Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно к кардиологии, и может быть использовано при лечении больных ишемической болезнью сердца (ИБС) с острым инфарктом миокарда (ИМ).
Уровень техники
В рандомизированных клинических исследованиях тромболитической терапии (ТЛТ) и других стратегий, в том числе немедленного, задержанного и отсроченного чрескожного коронарного вмешательства (ЧКВ), были определены несомненные достоинства ранней фармакологической и инвазивной реперфузии в лечении острого ИМ (1-8).
Острый ИМ развивается в результате внезапного нарушения кровоснабжения миокарда, обычно вследствие тромботической окклюзии крупной эпикардиальной коронарной артерии. ЧКВ является наиболее эффективным методом восстановления коронарного кровотока и применим у более чем 90% больных. Опубликованные данные свидетельствуют в пользу применения ЧКВ для лечения острого ИМ (9, 10). С помощью ангиопластики удается восстановить антеградный кровоток до градации 3 по TIMI в 90-95% случаях. Контрольная ангиография в отдаленные сроки свидетельствует, что 70-90% инфаркт-ответственных артерий (ИОА) сохраняют свою проходимость (10).
Однако само восстановление кровотока в инфаркт-ответственной артерии, т.е. реперфузия миокарда, может приводить к повреждению мышечной ткани вследствие недостатка эндогенных энергетических субстратов и вхождения ионов Са++, также как и продуктов гликолиза, в поврежденные и ишемизированные кардиомиоциты (11-13). Показано, что ведущую роль в реперфузионном повреждении миокарда играет выраженная активация свободнорадикальных процессов (окислительный стресс) как результат неконтролируемого накопления активных форм кислорода (15-17).
В результате уже с первых минут восстановления кровотока в ИОА может развиться стойкая контрактура мышечных волокон (14), ведущая к резкому снижению сократительной способности миокарда, отсутствие кровотока («no-reflow») в ИОА и формирование геморрагического инфаркта миокарда. Таким образом, восстановление кровотока в ИОА, по мнению большинства исследователей, с одной стороны, положительно влияет на клиническое течение и прогноз заболевания, но этот эффект во многом нивелируется благодаря запуску описанных выше нежелательных биохимических процессов, присущих реперфузии миокарда, так называемому «реперфузионному синдрому».
Одним из способов решения данной проблемы является использование в профилактике реперфузионного повреждения миокарда ингибиторов свободнорадикальных процессов - антиоксидантов, в частности производных 3-оксипиридинов (18).
Известен способ лечения ишемической болезни сердца и острого инфаркта миокарда (RU 2168993), включающий традиционную терапию пролонгированными нитратами, антагонистами кальция, бета-адреноблокаторами и 2-этил-6-метил-3-оксипиридинсукцинатом внутривенно в течение 5 дней, затем внутримышечно в течение 9 дней, причем доза препарата рассчитывается исходя из 6-9 мг/кг/сут.
Достижению требуемого технического результата в указанном решении препятствует высокий объем распределения действующего вещества из-за используемого способа введения препарата, при котором происходит распределение 2-этил-6-метил-3-оксипиридина по всему организму, что уменьшает время его воздействия и концентрацию непосредственно в области инфаркта миокарда.
Наиболее близким, принятым за прототип для настоящего изобретения, является способ лечения острого ИМ, заключающийся во внутрикоронарном введении кардио-цитопротектора фосфокреатина в ИОА в момент выполнения механической реканализации в ИОА и коронарной ангиопластики ИОА (см. российскую заявку 2004126985/14), позволяющий существенно повысить концентрацию лекарственного средства в зоне реперфузии.
Однако достижению требуемого технического результата в указанном способе препятствует наличие антеградного кровотока в момент проведения механической реканализации и последующей ангиопластики ИОА, выполняемой параллельно с введением лекарственного вещества. Учитывая, что реперфузионное повреждение возникает непосредственно после восстановления кровотока в ИОА [Marc J.Claeys, Johan Bosmans et al. Am. J. Cardiol. 2004; 94:9-13], это значительно снижает эффективность данного способа профилактики реперфузионного повреждения миокарда.
Раскрытие изобретения
Задачей, на решение которой направлено заявляемое изобретение, является создание нового способа лечения острого ИМ, предотвращающего реперфузионный некроз кардиомиоцитов и тем самым повышающего эффективность методов лечения, связанных с восстановлением коронарного кровотока в остром периоде инфаркта миокарда.
Технический результат, достигаемый при осуществлении изобретения, выражается в уменьшении проявлений окислительного стресса, улучшении клеточного энергообмена, стабилизации клеточных мембран, восстановлении функциональной активности клеток, сохранении их структурно-функциональной целостности, что в конечном итоге приводит к уменьшению размеров зоны некроза и повышению терапевтического эффекта методов восстановления коронарного кровотока. Принципиальной особенностью достижения данного технического результата является введение действующего вещества в зону ишемии до момента восстановления кровотока в ИОА, что позволяет значительно повысить устойчивость ишемизированного миокарда к повреждающему воздействию реперфузии.
Для достижения вышеуказанного технического результата в способе лечения острого ИМ, включающем внутрикоронарное введение лекарственного вещества в инфарцированную область (прототип изобретения) вносятся следующие изменения:
1) введение лекарственного средства, позволяющего уменьшить реперфузионное повреждение миокарда, производится до момента восстановления антеградного кровотока, дистальнее окклюзии коронарной артерии, по каналу баллона долгой замены, с помощью которого выполняется стандартная процедура предилятации ИОА, в течение 1-10 мин;
2) в качестве лекарственных средств могут использоваться любые препараты, разрешенные к медицинскому применению при остром ИМ и показавшие свою эффективность на экспериментальных моделях профилактики реперфузионного повреждения сердечной мышцы;
3) в качестве примера использовали раствор 2-этил-6-метил-3-оксипиридинсукцината в дозе 50-800 мг.
В частном случае выполнения изобретения растворы вводят с постоянной объемной скоростью 0,1-4 мл/с.
Выбор 2-этил-6-метил-3-оксипиридинсукцината, введение которого было выполнено по заявляемому способу, был сделан по следующим причинам. Известно, что:
- 2-этил-6-метил-3-оксипиридинсукцинат улучшает функциональное состояние ишемизированного миокарда, уменьшая проявления систолической и диастолической дисфункции левого желудочка, а также электрической нестабильности миокарда;
- в условиях критического снижения коронарного кровотока 2-этил-6-метил-3-оксипиридинсукцинат существенно активирует энергосинтезирующие процессы в зоне ишемии и снижает выраженность окислительного стресса, увеличивает коллатеральное кровоснабжение и кислород-транспортную способность эритроцитов, улучшает реологические свойства крови, что способствует ограничению величины очага некроза, поддержанию сократительной и пропульсивной функции сердца;
в экспериментальных условиях показано, что 2-этил-6-метил-3-оксипиридинсукцинат уменьшает неблагоприятные последствия реперфузионного синдрома;
- 2-этил-6-метил-3-оксипиридинсукцинат, в отличие от других препаратов фарм-группы антигипоксантов-антиоксидантов, стабилизирует мембранные структуры сосудистой стенки, ингибирует агрегацию тромбоцитов, что важно при восстановлении кровотока по ИОА во время проведения коронарной ангиопластики.
Предлагаемый способ лечения острого ИМ за счет суперселективного введения действующего вещества (раствора 2-этил-6-метил-3-оксипиридинсукцината) в ИОА позволяет осуществить доставку препарата дистальнее места оклюзии артерии, т.е. непосредственно к ишемизированному миокарду. Известно, что синдром реперфузии может существенно ухудшать состояние пациентов с развитием острого ИМ. Проявление этого синдрома максимально выражено в момент восстановления кровотока по ИОА. Насыщение препаратом инфарцированной области позволяет предупредить развитие реперфузионного повреждения кардиомиоцитов и уменьшить его клинические проявления, что способствует ограничению зоны некроза миокарда, предупреждению развития сердечной недостаточности и нарушений ритма сердца, сокращению сроков лечения.
Краткое описание чертежей
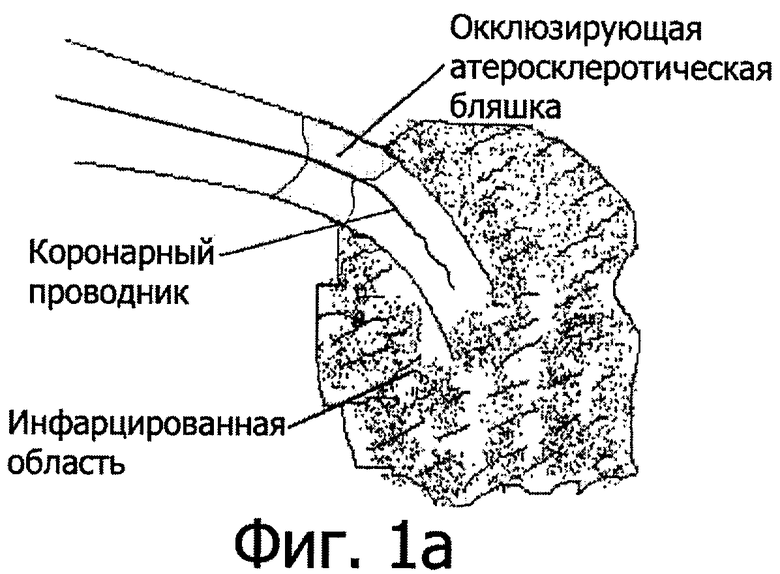
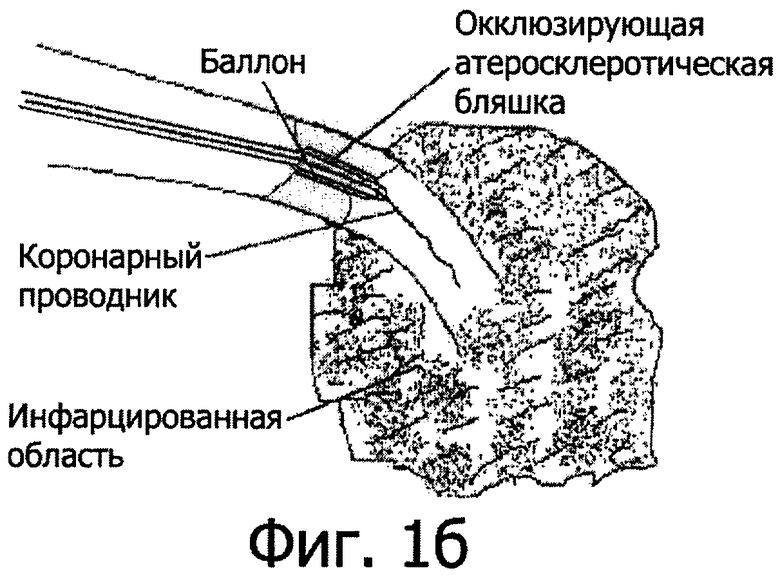
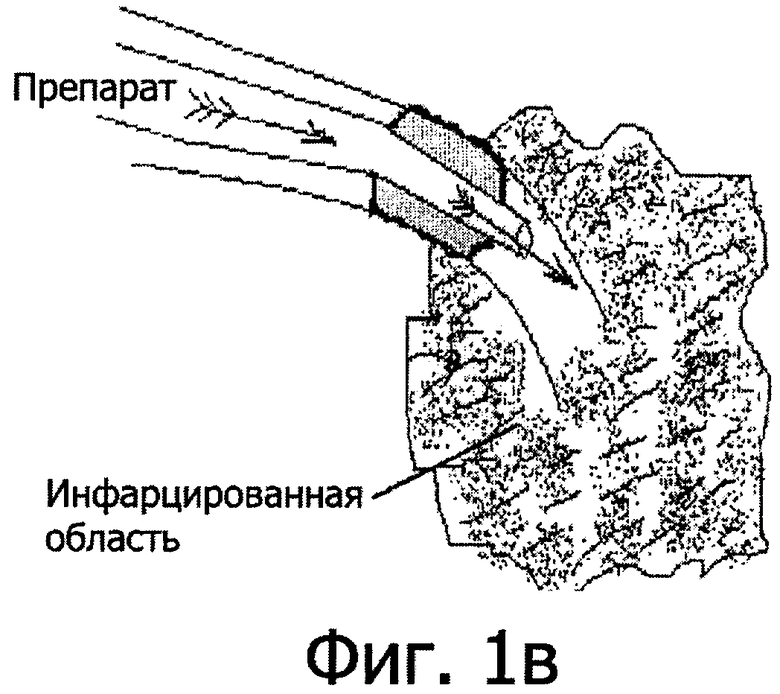
На фиг.1 представлены этапы достижения технического результата. Для достижения вышеуказанного технического результата осуществляют механическую реканализацию окклюзии ИОА коронарным проводником (фиг.1а) с последующим введением в место окклюзии баллона долгой замены таким образом, чтобы дистальный кончик баллона находился за окклюзией в дистальном просвете сосуда (фиг.1б). После этого осуществляют дилатацию коронарного баллона долгой замены и удаление коронарного проводника. Затем по центральному каналу осуществляют введение лекарственного вещества непосредственно в коронарную артерию за место окклюзии с объемной скоростью 0,1-4 мл/с (фиг.1в) и после терапевтического воздействия лекарства в течение 1-10 мин и в указанных выше дозировках снова проводят коронарный проводник по центральному каналу баллона с последующим рутинным выполнением ангиопластики ИОА.
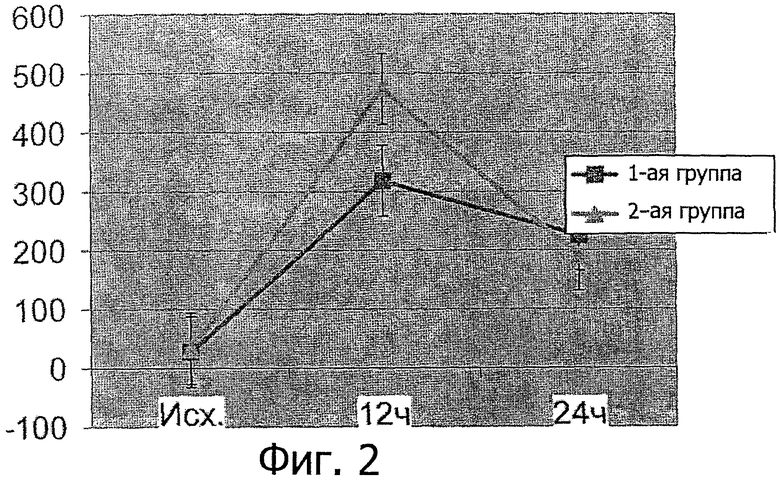
На фиг.2 показана динамика изменения абсолютной концентрации тропонина I в исследуемых группах.
На фиг.3 показана динамика ФВ ЛЖ в исследуемых группа (%).
Осуществление изобретения
Для оценки результатов применения внутрикоронарного введения растворов по предлагаемому способу проведено исследование, в котором принимали участие 16 пациентов различных возрастных групп (от 45 до 72 лет), которым выполняли ангиопластику инфаркт-ответственной коронарной артерии.
Были рандомизированы случайным образом две группы, по 8 человек в каждой. Всем пациентам была успешно выполнена механическая реканализация и ангиопластика проксимальной трети коронарной артерии в первые 4,5 часа от момента развития инфаркта миокарда. Первой группе пациентов во время проведения ангиопластики вводился раствор 2-этил-6-метил-3-оксипиридинсукцината (препарат «Мексикор» производства ООО «ЭкоФармИнвест», Россия) по указанной методике. Пациентам второй группы осуществляли введение раствора 2-этил-6-метил-3-оксипиридинсукцината в устье коронарной артерии во время проведения ангиопластики. Оценка размеров ишемического и реперфузионного повреждения кардиомиоцитов проводилась согласно принятым рекомендациям (19) с помощью анализа динамики концентраций специфического белка повреждения тропонина I через 12 часов и через 24 часа после выполнения ангиопластики (фиг.2).
Через 12 час после проведения ангиопластики концентрация тропонина I в контрольной первой группе составляла 318×10-9 г/мл ±31, а во второй группе - 460×10-9 г/мл ±17. В первой группе пациентов, прооперированных по заявленному способу, показания концентрации тропонина I через 12 часов были достоверно ниже (р<0,05) по сравнению со второй (контрольной) группой, что свидетельствует о меньшем объеме некроза кардиомиоцитов. Через 24 часа концентрация тропонина I в первой и контрольной группе была примерно одинакова, на уровне 210×10-9 г/мл ±10.
Для точной оценки сравнения глобальной и сегментарной сократимости ЛЖ в исследуемых группах проводили левую контрастную вентрикулографию исходно (до момента процедуры) и на 10-е сутки заболевания (фиг.3).
Как видно на представленной диаграмме (фиг.3), на 10-е сутки заболевания в первой группе отмечено более выраженное улучшение глобальной функции ЛЖ (р<0,05).
Таким образом, из данных, представленных на фиг.2-3, в группе с внутрикоронарным введением раствора 2-этил-6-метил-3-оксипиридинсукцината по заявленной методике выявлены более низкие цифры тропонина I и более выраженная положительная динамика ФВ ЛЖ (при исходно равных значениях), свидетельствующие о большей степени ограничения реперфузионного повреждения кардиомиоцитов по заявленному способу по сравнению с прототипом.
Заявленный способ лечения острого инфаркта миокарда далее подтверждается следующими примерами.
Пример 1.
Пациенту С., 46 лет, в остром периоде ИМ через 4,5 часа после начала приступа ангиозных болей при проведении процедуры коронарной баллонной ангиопластики передней межжелудочковой ветви левой коронарной артерии по центральному просвету баллона было введено 200 мг раствора 2-этил-6-метил-3-оксипиридинсукцината с постоянной объемной скоростью 4,0 мл/с. После перевода пациента в отделение интенсивной терапии послеоперационное течение шло гладко. На 10-е сутки пациент был выписан для амбулаторного лечения. При контрольном осмотре через 3 месяца пациент не предъявлял жалоб на ангинозные приступы или их эквиваленты, по данным лабораторных и инструментальных исследований признаков ишемии миокарда выявлено не было.
Пример 2.
Пациентке К., 69 лет, в остром периоде ИМ через 4 часа после начала приступа ангиозных болей при проведении процедуры коронарной баллонной ангиопластики проксимального сегмента огибающей ветви левой коронарной артерии по заявленной методике было введено 800 мг раствора 2-этил-6-метил-3-оксипиридинсукцината с постоянной объемной скоростью 1,0 мл/с. После перевода пациентки в отделение интенсивной терапии послеоперационное течение шло гладко. Больная на 11-е сутки была выписана для амбулаторного лечения. При контрольном осмотре через 6 месяцев пациентка не предъявляла жалоб на ангинозные приступы, по данным ЭХО-КГ отмечено улучшение сократимости миокарда ЛЖ на 19% по сравнению с исходным.
Пример 3.
Пациентке Р., 54 года, в остром периоде ИМ через 3 часа после начала приступа ангиозных болей при проведении процедуры коронарной баллонной ангиопластики передней межжелудочковой ветви левой коронарной артерии по заявленной методике было введено 50 мг 2-этил-6-метил-3-оксипиридинсукцината в физиологическом растворе с постоянной объемной скоростью 0,1 мл/с.
После перевода пациентки в отделение интенсивной терапии послеоперационное течение шло гладко. Больная выписана для амбулаторного лечения на 15-е сутки. При контрольном осмотре через 4 мес. пациентка не предъявляла жалоб на ангинозные приступы или их эквиваленты, по данным лабораторных и инструментальных исследований признаков ишемии миокарда выявлено не было.
Из приведенных примеров видно, что использование заявленного способа и эффективность применения 2-этил-6-метил-3-оксипиридинсукцината не зависят от возраста пациентов и являются эффективными для всех возрастных групп.
Таким образом, заявленный способ лечения острого ИМ и применение 2-этил-6-метил-3-оксипиридинсукцината с внутрикоронарным введением непосредственно в инфарцированную область через инфаркт-ответственную артерию до возникновения реперфузии позволяет обеспечить целевую доставку и поддержание высоких концентраций активного вещества в ишемизированном миокарде, что многократно усиливает терапевтический эффект лекарственного препарата в отношении реперфузионного повреждения. Из приведенных примеров видно, что заявленный способ лечения с использованием раствора 2-этил-6-метил-3-оксипиридинсукцината значительно снижает количество поврежденных кардимиоцитов, что отражается на достоверно более благоприятной динамике кардиоспецифичных ферментов и улучшает глобальную и сегментарную сократимость миокарда ЛЖ на госпитальном периоде течения заболевания. Все это позволяет говорить о предотвращении или уменьшении реперфузионного повреждения кардимиоцитов.
Заявленное изобретение позволяет значительно улучшить клиническое течение инфаркта миокарда, сократить срок госпитализации пациентов. Ни в одном случае после выполненных вмешательств не наблюдалось нарушений сердечного ритма или повторного инфаркта, а также летальных исходов.
Все пациенты после лечения вернулись к привычному для них ритму жизни без длительного реабилитационного периода, как правило, необходимому после операции хирургического вмешательства.


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА | 2005 |
|
RU2299730C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА | 2004 |
|
RU2267323C1 |
| Способ кардиопротекции ишемических и реперфузионных повреждений в остром периоде инфаркта миокарда | 2019 |
|
RU2712448C1 |
| СПОСОБ КОРРЕКЦИИ ПРОЦЕССОВ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ У БОЛЬНЫХ ОСТРЫМ ИНФАРКТОМ МИОКАРДА | 2016 |
|
RU2627458C1 |
| СПОСОБ РЕПЕРФУЗИОННОЙ ТЕРАПИИ БОЛЬНЫХ ОСТРЫМ ИНФАРКТОМ МИОКАРДА | 2002 |
|
RU2226097C2 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА | 2008 |
|
RU2365380C1 |
| СПОСОБ ЭНДОВАСКУЛЯРНОЙ КОРРЕКЦИИ ФЕНОМЕНА "NO-REFLOW" У ПАЦИЕНТОВ С ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ С ПОДЪЕМОМ СЕГМЕНТА ST ПРИ ПРОВЕДЕНИИ ПЕРВИЧНОГО ЧРЕСКОЖНОГО КОРОНАРНОГО ВМЕШАТЕЛЬСТВА ИНФАРКТ-ЗАВИСИМОЙ АРТЕРИИ | 2014 |
|
RU2574123C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА | 2018 |
|
RU2702146C1 |
| СПОСОБ КУПИРОВАНИЯ РЕПЕРФУЗИОННОГО СИНДРОМА У ПАЦИЕНТОВ С ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ И ПОДЪЕМОМ СЕГМЕНТА ST | 2018 |
|
RU2695341C1 |
| СПОСОБ ЗАЩИТЫ МИОКАРДА ОТ ИШЕМИЧЕСКОГО ПОВРЕЖДЕНИЯ У БОЛЬНЫХ СТАБИЛЬНОЙ ИБС ПРИ ПРОВЕДЕНИИ ЧРЕСКОЖНЫХ КОРОНАРНЫХ ВМЕШАТЕЛЬСТВ | 2018 |
|
RU2680385C1 |

Изобретение относится к медицине, а именно к кардиологии и касается лечения острого инфаркта миокарда. Для этого до момента восстановления антеградного кровотока дистальнее окклюзии коронарной артерии в течение 1-10 мин вводят лекарственное средство, позволяющее уменьшить реперфузионное повреждение миокарда, например раствор 2-этил-6-метил-3-оксипиридинсукцината. Способ обеспечивает эффективное лечение и сокращение сроков госпитализации за счет уменьшения реперфузионных нарушений и улучшения сократимости левого желудочка сердца. 4 з.п. ф-лы, 3 ил.
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА | 2004 |
|
RU2267323C1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| КОРОТКОВ А | |||
| О патогенетических механизмах реперфузионных повреждений в острейшей стадии инфаркта миокарда и способах их предотвращения | |||
| Medlinks.ru | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| БОКАРЕВ И | |||
| и др | |||
| Русский медицинский журнал, 1998, т.6, №3 | |||
| CLAEYS M | |||
| et al | |||
| Effect of intracoronary adenosine infusion | |||
Авторы
Даты
2009-01-20—Публикация
2006-12-01—Подача