Настоящее изобретение имеет отношение к биочипам, использующим нуклеиновые кислоты, и к использованию иммобилизованных антипроб нуклеиновых кислот для идентификации нуклеиновых кислот.
ДНК микрочип (биочип) представляет собой твердый носитель (платформу), на поверхности которого иммобилизованы короткие однонитчатые молекулы нуклеиновых кислот. Гибридизацию тестируемой однонитчатой нуклеиновой кислоты с короткими однонитчатыми нуклеиновыми кислотами, иммобилизованными на поверхности биочипа, используют для диагностики нуклеиновых кислот, для исследования экспрессии генов и определения первичной последовательности нуклеиновых кислот.
Другим определением ДНК чипа может быть такое: носитель, на котором иммобилизована ДНК-проба, представляющая собой половину молекулы ДНК, которая способна узнать свою другую половину, находящуюся в растворе, и образовать с ней полноценную двунитчатую молекулу ДНК.
В литературе существуют две номенклатуры, определяющие названия двух однонитчатых молекул НК, гибридизующихся друг с другом, причем обе используют названия "проба" и "мишень". В настоящем патенте мы следуем предложению, опубликованному в Nature Genetics, volume 21 supplement, pp.1-60, 1999, и называем «НК-пробой» однонитчатую молекулу НК, иммобилизованную на поверхности НК чипа, соответственно, вторая молекула это «НК-мишень».
Принципиальные трудности гибридизации связаны с фундаментальными особенностями взаимодействующих молекул и ДНК-чип технологий. Например, низкие эффективность и скорость гибридизации, требующие многочасовой экспозиции, обусловлены тем, что взаимодействие иммобилизованной НК-пробы и НК-мишени происходит только на поверхности чипа, в тонком слое, где иммобилизована НК. Объем этого слоя по сравнению с остальным объемом ячейки крайне мал. Поэтому лишь очень небольшая часть молекул НК-мишеней оказывается в ней в каждый момент времени. Среди указанных молекул доля НК-мишеней комплементарных НК-пробе может быть очень низка.
Крайне низкая скорость реакции обусловлена не только малым объемом поверхности гибридизации, но и очень малой скоростью диффузии молекул НК-мишеней. Молекулы НК, имеющие большое количество зарядов и поверхностных полярных групп в растворе, имеют обширную и плотную сольватную оболочку, которая резко замедляет скорость диффузии, и значительно затрудняют гибридизацию. С целью ускорить гибридизацию применяют разные способы, например, увеличивают поверхность взаимодействия иммобилизованной НК-пробы с НК-мишенью. Для этого НК-пробу иммобилизуют в трехмерном матриксе, например геле. Этот способ реализован в чипах с иммобилизованными химической модификацией в полиакриламидном геле предварительно синтезированными олигонуклеотидами. Такие чипы разрабатывают в Институте Молекулярной Биологии им. Энгельгардта в Москве. Существенным недостатком этого подхода является низкая скорость диффузии молекул НК-мишеней внутри объема геля, что снижает преимущество, полученное в результате увеличения объема, в котором находятся НК-пробы.
Близость иммобилизованных НК-проб к поверхности затрудняет диффузию вблизи поверхности объемных молекул НК-мишеней с обширной сольватной оболочкой, поскольку сама поверхность тоже имеет определенную структуру поверхностных сольватированных групп. Поэтому, например, использование для присоединения НК-пробы спейсера (удлинителя) длиной в десятки углеродных атомов увеличивает эффективность гибридизации.
Типичным для использования всех разновидностей ДНК микрочипов является то, что гибридизацию молекулы НК-мишени, находящейся в растворе с иммобилизованной молекулой НК-пробы, осуществляют непосредственно на поверхности ДНК чипа. В большинстве случаев молекула НК-мишени существенно длиннее молекулы НК-пробы. В то же время тем, кто практически применяет рассматриваемый метод, известно, что в идеале длины НК-проб и НК мишеней должны быть одинаковы. Например, такой вывод сделан в работе Nature Genetics 1999, 21, 5-9; Bio Techniques. 2005, 39, 89-96.
Настоящее изобретение предлагает такой вариант ДНК диагностики, при котором не происходит гибридизации длинных молекул НК-мишеней с короткими НК-пробами на поверхности НК-чипа.
Существующие ДНК чипы можно подразделить на три типа. Старейшими являются ДНК чипы для секвенирования, например, те, что производит Affymetrix или Hyseq. Вторая разновидность - экспрессионные ДНК-чипы, в которых используют иммобилизованную ДНК двух типов: во-первых, относительно короткие ген-специфичные фрагменты ДНК длиной 20-25 нуклеотидов, например олигонуклеотидные микрочипы фирмы Affymetrix; во-вторых, крупные фрагменты кодирующей ДНК длиной 300-500 нуклеотидов, получаемые в результате клонирования, ПЦР (полимеразная цепная реакция) амплификации и очистки ДНК. Третий тип ДНК чипов используют для экспериментов по сравнительной геномике. При использовании ДНК чипов можно одновременно следить за изменением десятков тысяч генов в процессе развития клеток и тканей, при различных физиологических и патологических ситуациях, при воздействии терапевтических средств и токсинов. Выявление четких маркеров патологии на уровне экспрессии генов и разработка диагностических ДНК чипов - одна из приоритетнейших задач медико-биологических исследований.
Контролируемое электрическое поле, как это было показано в работе (Proceedings of National Academy of Science USA. 1997, 94(4): 1119-1123), можно использовать для того, что обеспечить транспорт, концентрацию, гибридизацию, и денатурацию олигонуклеотидов на ДНК-чипах. Одним из преимуществ этого подхода является то, что электрическое поле заметно снижает температуру денатурации.
Наиболее распространенным методом работы с ДНК-чипами является флуоресцентная детекция. При этом в качестве генератора флуоресцентного сигнала могут использоваться красители, непосредственно присоединенные к изучаемой последовательности, например введение в ее состав с помощью флуоресцентно меченных праймеров. Но чаще используется непрямой метод, при котором последовательность содержит биотин, к которому присоединяются красители, соединенные со стрептавидином. Основным недостатком этого метода является невысокая чувствительность, порождаемая низким отношением сигнала к шуму, особенно при низких концентрациях НК мишени.
Существуют также методы, основанные на изменении электрохимического потенциала электрода, на поверхности которого иммобилизированы ДНК-пробы при гибридизации с ними исследуемой ДНК. Первый подход основан на мечении исследуемых молекул комплексами, содержащими атомы железа. Наличие этих проб на поверхности электрода изменяет его электрохимический потенциал. Метод разработан компанией Clinical Micro Sensors. Второй состоит в детекции интенсивности окислительно-восстановительного потенциала, возникающего при окислении гуаниновых оснований. При этом НК-мишень не нуждается в мечении. Детекция гибридизации основана на резком снижении уровня окисления гуаниновых оснований на аноде при формировании двухцепочной структуры. Этот эффект изменения уровня окисления при формировании дуплекса может быть получен путем применения окисляющих интеркалаторов, таких как Со (Phen)3, которые селективно связываются с двухцепочечными последовательностями и вызывают окисление расположенных в них гуаниновых оснований, что приводит к повышению уровня окислительного электропотенциала.
Электрохимические методы детекции гибридизации являются самым перспективным на сегодняшний день направлением развития технологий детекции сигналов на поверхности ДНК микрочипов, поскольку они позволяют использовать разработки в области электрохимии и микроэлектроники. Разрешающая способность этих методов зависит от возможного количества электродов. Технологии, разработанные для создания микроэлектронных устройств, позволяют сделать плотность этих электродов очень высокой. Использование электрохимических процессов позволяет проводить на одном чипе в одном реакционном объеме сразу все этапы анализа: иммобилизацию пробы, гибридизацию, детекцию. В то же время, исследования в области электрохимических методов детекции находятся пока на стадии модельных экспериментов и еще рано говорить о появлении технологий, которые могли бы быть использованы для практических целей.
К сожалению, дороговизна и сложность затрудняют использование как флуоресцентных, так и электрохимических методов детекции результатов гибридизации НК-мишеней и НК-проб, иммобилизованных на биочипах. Эти сложности приводят к тому, что эти методы в основном применяют только в больших и хорошо оснащенных исследовательских лабораториях.
Таким образом, существует необходимость разработки более эффективных и чувствительных и, в то же время, простых в эксплуатации методов и устройств для работы с ДНК микрочипами.
Сущность изобретения.
Изобретение предлагает следующую внутреннюю структуру биочипа, несущего нуклеиновые кислоты, - в каждом пятне (участке платформы, покрытом иммобилизованными НК) иммобилизованы однонитчатые НК антипробы, комплементарные к НК пробам. Указанные НК-пробы гибридизованы с антипробами, в результате чего биочип представляет собой платформу, несущую двунитчатые гибриды иммобилизованной НК-антипробы с НК-пробой. Такой биочип помещают в компартмент (отсек, камеру), заполненный раствором, и денатурируют комплекс антипробы с пробой. После этого с помощью электрического поля перемещают НК-пробу в другой компартмент, в котором находится НК-мишень и в котором обеспечивают условия гибридизации таким образом, что в случае взаимной комплементарности НК-мишень и НК-проба образуют двунитчатую молекулу НК. На следующем шаге некомплементарные НК-пробы возвращают либо обратно в компартмент с биочипом, где создают условия регибридизации проб с антипробами, либо в другой компартмент, в котором находится тот же набор антипроб, также для регибридизации. НК-пробы, комплементарные НК-мишени, останутся в компартменте для НК-мишени в составе двунитчатых НК молекул, поэтому соответствующие им пятна с антипробами будут содержать однонитчатые НК-молекулы. Таким образом, определение одно- или двунитчатые НК-молекулы содержит данное пятно на биочипе является методом идентификации НК-мишени. Изобретение учитывает возможность регенерации исходного биочипа путем возвращения всех НК-проб после окончания тестирования обратно на этот биочип и гибридизации этих проб с соответствующими им антипробами.
Предложено устройство, содержащее отдельные компартменты для помещения биочипа с антипробами и исследуемой НК-мишени и соединяющий эти компартменты канал, заполненный средой, проницаемой для НК-проб и непроницаемой для НК-мишеней и комплексов НК-мишеней с НК-пробами.
Предпочтительным является электрофоретическое перемещение НК-проб из одного компартмента в другой по соединяющему их каналу. Предусмотрена возможность наблюдения и оценки как факта прохождения НК-пробы по указанному каналу, так и времени, которое на это потребуется.
Краткое описание чертежей.
Следующие чертежи описывают только некоторые из процессов и аппаратов, предложенных в настоящем изобретении, и это описание выполнено с целью проиллюстрировать на отдельных примерах указанное изобретение.
Фиг.1А схематически показывает концепцию объединения НК-биочипа с внешней камерой, позволяющей осуществить гибридизацию НК-мишени с НК-пробой в растворе.
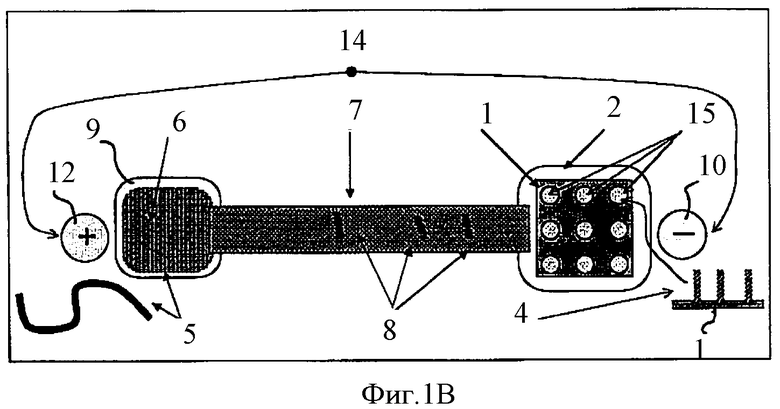
Фиг.1B схематически показывает денатурацию двунитчатых олигонуклеотидов, иммобилизованных на биочипе и электрофоретический транспорт однонитчатых НК-проб в камеру с НК-мишенями.
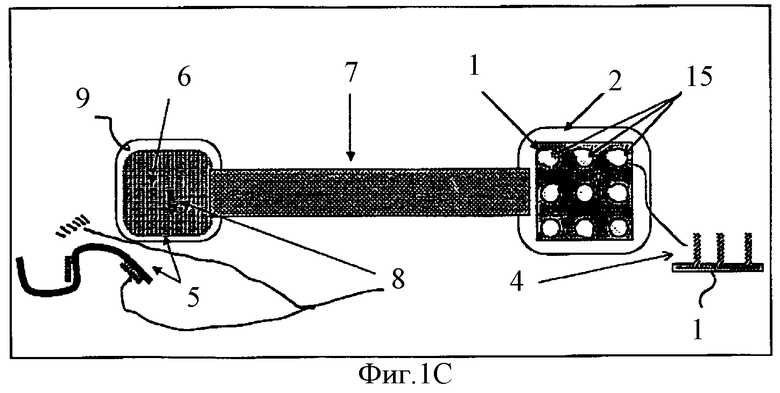
Фиг.1C схематически показывает гибридизацию НК-проб с НК-мишенями в растворе.
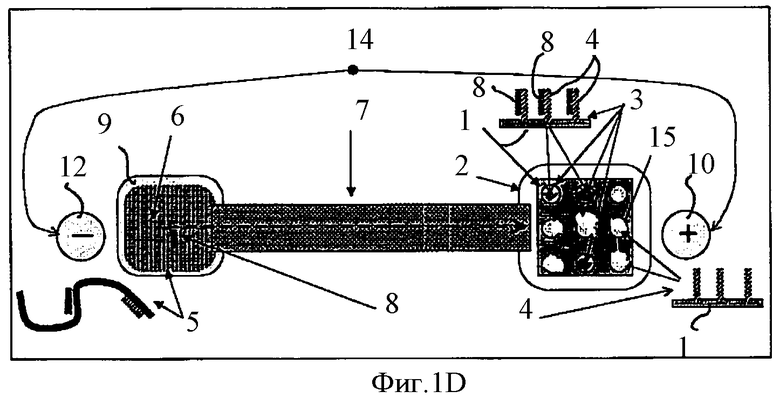
Фиг.1D схематически показывает электрофоретический транспорт однонитчатых НК-проб некомплементарных НК-мишеням обратно в камеру с биочипом.
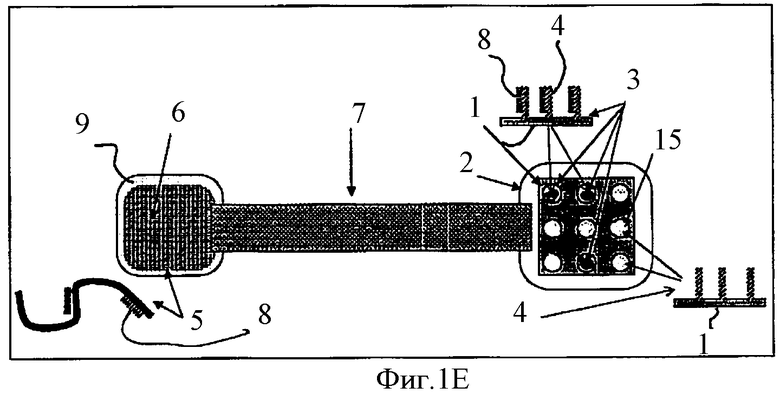
Фиг.1Е схематически показывает гибридизацию свободных НК-проб с комплементарными им НК-антипробами, иммобилизованными на биочипе.
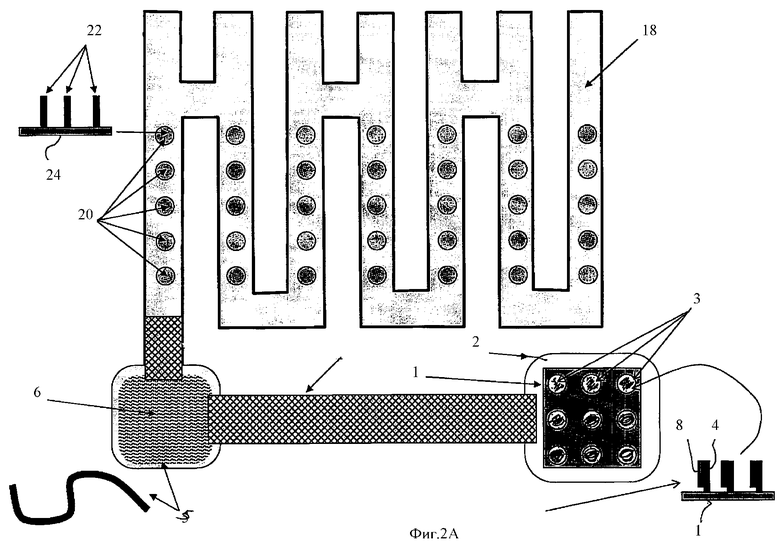
Фиг.2А схематически показывает концепцию объединения устройства, показанного на Фиг.1А, с лабиринтным каналом, на дне которого находятся пятна, в каждом из которых иммобилизованы НК-антипробы.
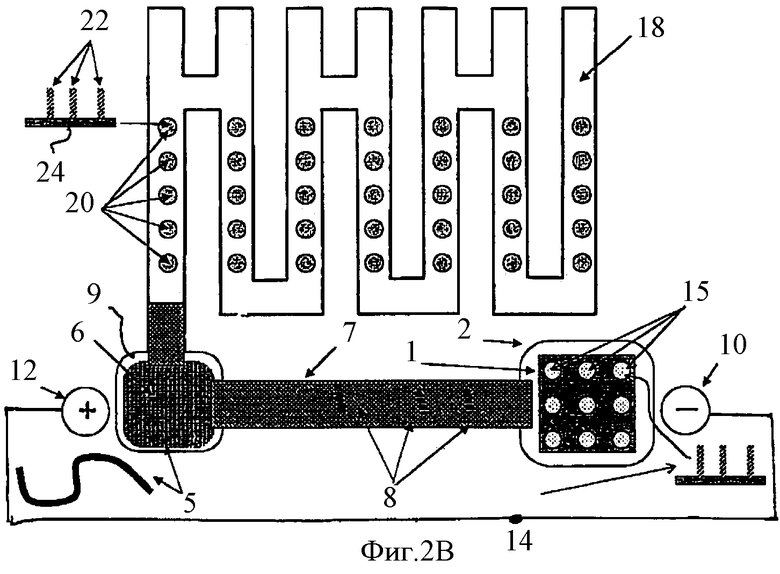
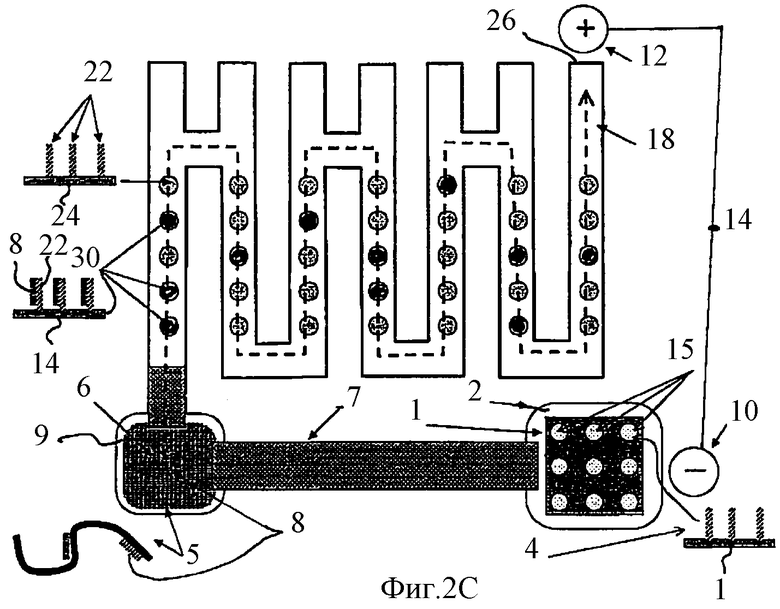
Фиг.2В-2Е схематически показывают последовательные шаги работы устройства, показанного на Фиг.2А, где указанные шаги подобны шагам, представленным на Фиг.1B-1Е соответственно.
Фиг.3 схематически показывает последовательные шаги работы устройства, показанного на Фиг.2А-2Е, когда устройство заряжают новым биочипом и новой камерой с новой НК-мишенью.
Фиг.4 схематически показывает последовательные шаги работы устройства, показанного на Фиг.2А-2Е, когда устройство заряжают новой камерой с новой НК-мишенью и загружают в использованный ранее биочип новые НК-пробы.
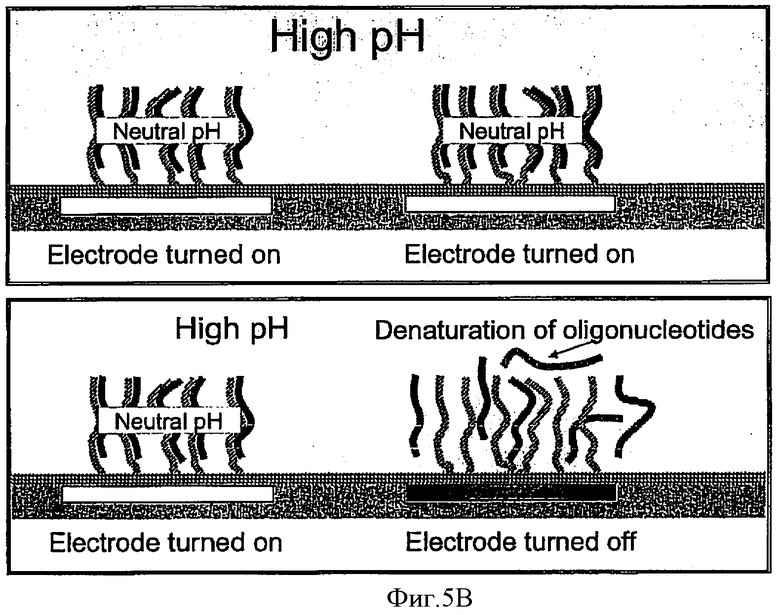
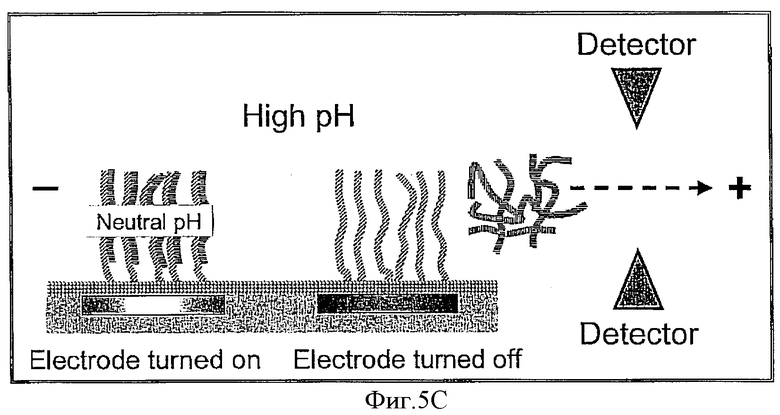
Фиг.5А-5С схематически показывают один из возможных вариантов процесса денатурации двунитчатой НК, используя изменение рН раствора и электрического потенциала электродов.
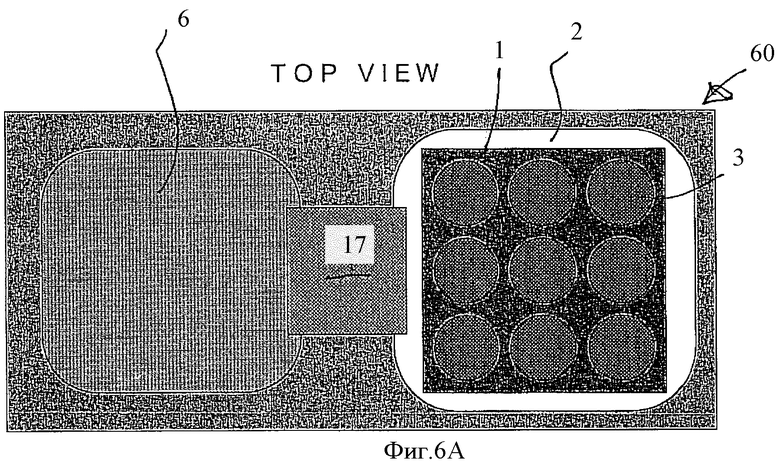
Фиг.6А представляет собой вид сверху модульного устройства, которое позволяет обеспечить процесс, показанный на Фиг.1А-1Е.
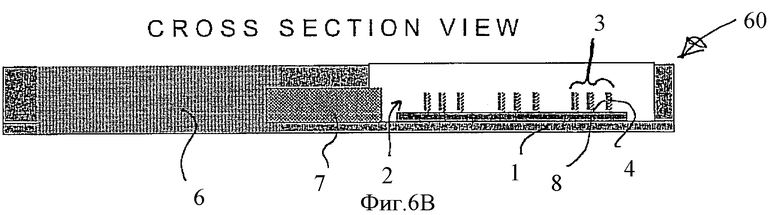
Фиг.6В показывает в поперечном сечении устройство, представленное на Фиг.6А.
Фиг.7А-7Е показывает в поперечном сечении последовательные шаги работы устройства, представленного на Фиг.6А.
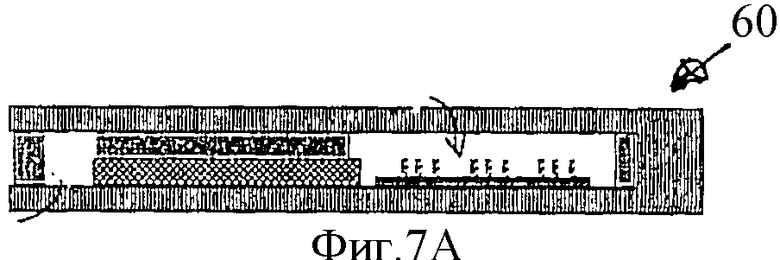
Фиг.7А - все камеры устройства заполняют соответствующими растворами в процессе изготовления.
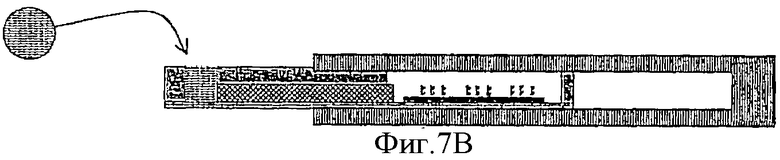
Фиг.7В - загрузка НК-мишени в соответствующую камеру.
Фиг.7С - электрофоретический перенос НК-проб и гибридзация с НК-мишенью.
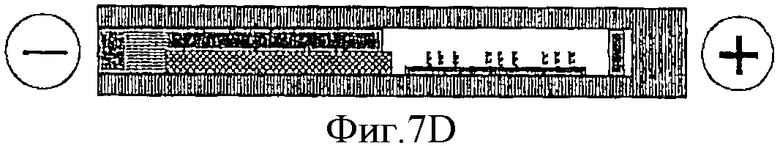
Фиг.7D - электрофоретический перенос НК-проб, некомплементарных НК-мишени, обратно в камеру с биочипом.
Фиг.7Е - гибридизация НК-проб, некомплементарных НК-мишени, с иммобилизованными на биочипе НК-антипробами.
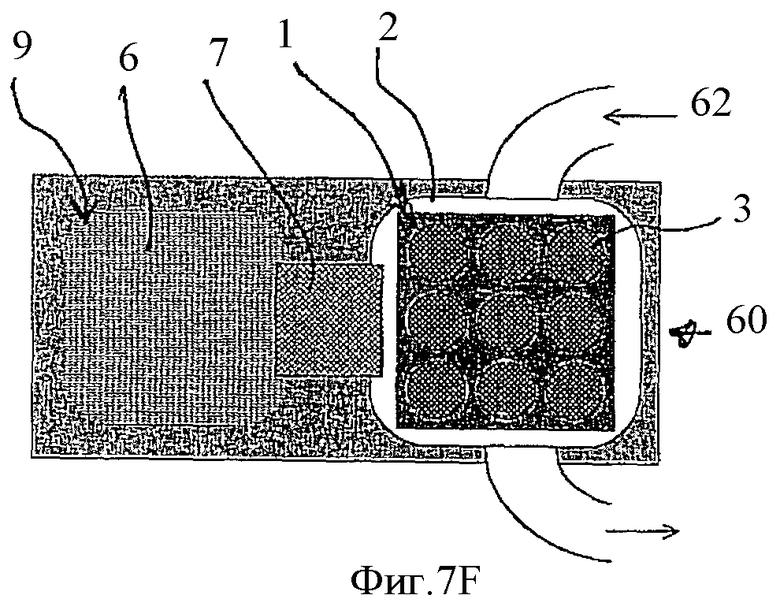
Фиг.7F - определение одно- или двунитчатые олигонуклеотиды содержит каждое пятно на биочипе с помощью отмывки и окраски флуоресцентными красителями.
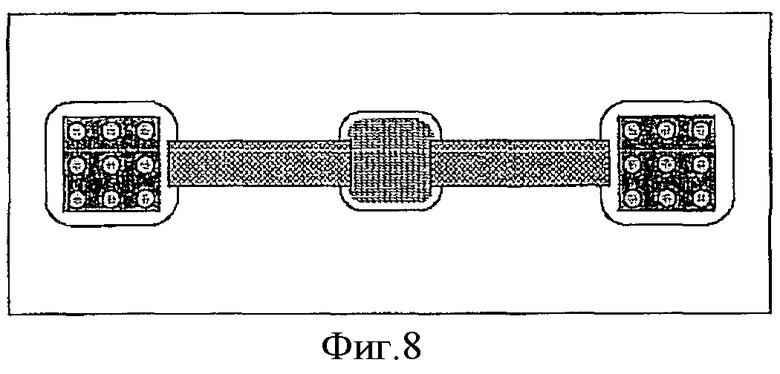
Фиг.8 схематически показывает альтернативный вариант соединения двух камер с биочипом и камеры, содержащей раствор с НК-мишенью.
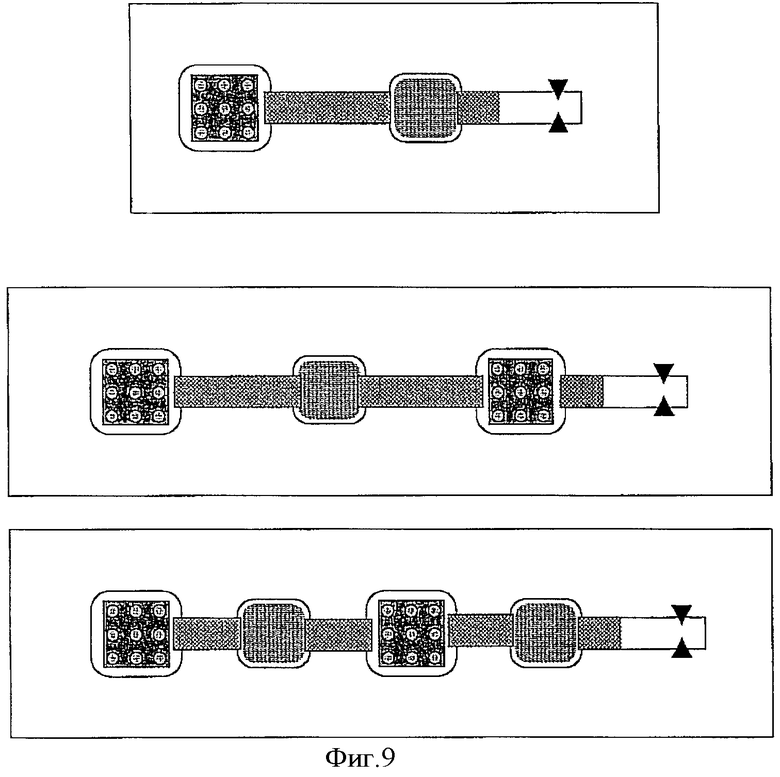
Фиг.9 схематически показывает несколько альтернативных вариантов соединения камер с биочипом и камер, содержащих раствор с НК-мишенью, и детекторов, обнаруживающих НК-пробу, движущуюся в электрическом поле.
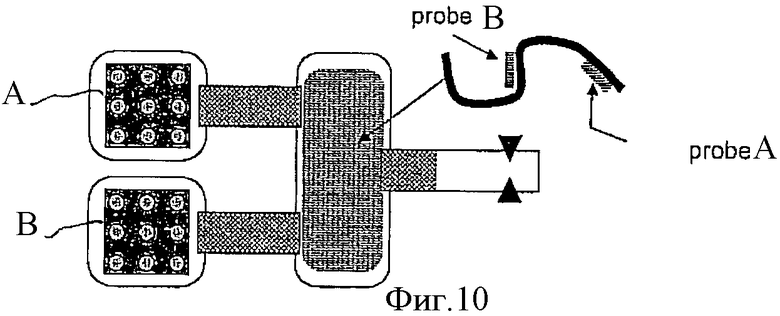
Фиг.10 схематически показывает вариант соединения двух камер с биочипом и одной камеры, содержащей раствор с НК-мишенью, и детекторов, обнаруживающих НК-пробу, движущуюся в электрическом поле.
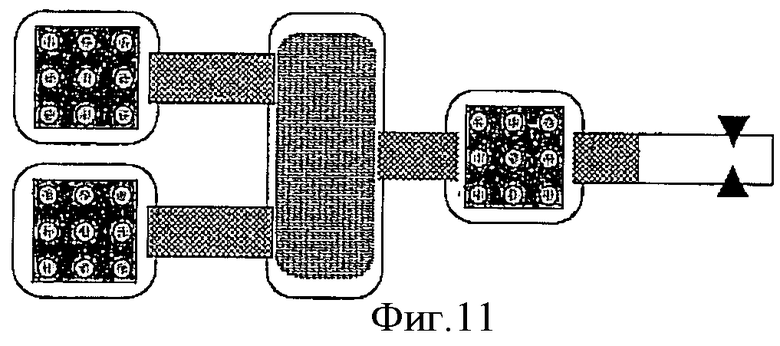
Фиг.11 схематически показывает вариант соединения трех камер с биочипом и одной камеры, содержащей раствор с НК-мишенью, и детекторов, обнаруживающих НК-пробу, движущуюся в электрическом поле.
Детальное описание предпочтительных вариантов изобретения.
Настоящее изобретение представляет собой методы и устройства, предназначенные для определения комплементарности НК-мишеней и НК-проб с использованием биочипов, на поверхности которых иммобилизованы НК-антипробы, комплементарные НК-пробам.
Изобретение предлагает новый метод детекции сигнала, в котором специальные детекторы обнаруживают в растворе поток НК-проб, которые освобождены из двунитчатого комплекса с НК-антипробами и движутся в электрическом поле по направлению к НК-мишеням или, аналогично этому, в обратном направлении. Указанные детекторы могут обнаруживать не только поток заряженных НК-молекул, но и фиксировать время прохождения этого потока с целью определения расстояния от указанного детектора до того места на биочипе, в котором НК-проба находилась в двунитчатом комплексе с иммобилизованной НК-антипробой.
Настоящее изобретение в отличие от существующих методов гибридизационной диагностики, которые используют два типа НК молекул - НК-пробы и НК-мишени, предлагает использовать три типа НК молекул, а именно: НК-антипробы, иммобиллизованные на поверхности биочипа, НК-пробы свободные в растворе и НК-мишени, которые могут быть как свободны в растворе, так и иммобилизованы либо на поверхности тела, либо внутри пористого тела, например геля.
НК-пробы можно селективно высвобождать из комплекса с НК-антипробами, иммобилизованными в одном пятне, и перемещать их в камеру с НК-мишенями, в которой созданы такие условия гибридизации, что в случае комплементарности пробы и мишени будут образовываться двунитчатые НК молекулы. После этого НК-пробы, некомплементарные НК-мишени, можно таким образом вернуть обратно и гибридизовать с иммобилизованными НК-антипробами для того, чтобы подходящими методами определить, какие из НК-антипроб превратились в двунитчатые НК, а какие остались однонитчатыми, потому что их половинки оказались комплементарны НК-мишени и остались в комплексе с указанными НК-мишенями.
Благодаря тому что однонитчатые НК-мишени согласно предлагаемому изобретению взаимодействуют не с иммобилизованными комплементарными им НК-пробами, а со свободными НК-пробами, появляется возможность упростить процедуру подготовки НК-мишени к процедуре гибридизации. Например, можно использовать для гибридизации НК-мишени, которые находятся внутри геля или иммобилизованы на поверхности частиц. Например, это могут быть парамагнитные, металлические, полупроводниковые и полимерные частицы.
Изобретение учитывает, что в таком режиме работы НК-мишени могут быть иммобилизованы на поверхности другого НК-чипа, например, изготовленного для работы с другими НК-пробами; на поверхности парамагнитных частиц, которые широко используют при сепарации и амплификации НК; а также внутри геля, как это бывает при электрофорезе нуклеиновых кислот.
Настоящее изобретение благодаря использованию концепции НК-антипроб позволяет осуществлять регенерацию и многократное использование одного НК биочипа за счет того, что после гибрдизации НК-пробы с НК-мишенью и детекции сигнала можно денатурировать комплекс НК-пробы с НК-мишенью и вернуть все НК-пробы обратно на НК биочип и гибридизовать их с НК-антипробами и, таким образом, регенерировать указанный биочип.
Настоящее изобретение позволяет использовать в качестве НК-антипроб повторяющуюся НК последовательность, в которой повторяющейся единицей является структура одной НК-антипробы. В результате этого не только увеличится расстояние от большинства НК-антипроб до поверхности, на которой они иммобилизованы, что улучшит эффективность гибридизации, но и увеличит количество мест гибридизации в данном пятне на биочипе и таким образом усилит сигнал.
Использование НК-антипроб, представляющих собой длинные однонитчатые молекулы НК, позволяет исключить проблемы, возникающие при попытках гибридизовать однонитчатые молекулы НК в непосредственной близости к той поверхности, к которой одна из этих молекул иммобилизована. В результате предлагаемые НК-антипробы должны быть полезны при использовании особенно длинных НК-проб, например, при длинах НК-проб более чем 60 оснований.
Предлагаемые НК-антипробы могут быть иммобилизованы на поверхности НК-чипа таким же образом, как на обычных ДНК чипах (в виде пятен). Использование предлагаемых НК-антипроб позволяет осуществить переход от двумерного расположения молекул НК-проб к расположению в пространстве. В настоящее время такой переход происходит при изготовлении гелевых чипов, существенным ограничением для которых является то, что молекулы ДНК мишеней должны диффундировать внутрь геля, для того чтобы гибридизоваться с ДНК пробами, иммобилизованными внутри этого геля. Настоящее изобретение учитывает возможность иммобилизации носителей не только на какой-либо поверхности, но и в объеме геля или пористого материала.
В соответствии с настоящим изобретением можно приготовить комплекс НК-антипробы с НК-пробой следующим образом. Вначале изготовить длинную двунитчатую молекулу НК, которая имеет повторенную первичную структуру. В этой структуре повторяющейся единицей одной нити является структура НК-антипробы, ограниченная последовательностями-сигналами, которые в комплементарной ей нити образуют сигналы, которые опознает какая-либо однонитчатая рестриктаза таким образом, что после обработки этой рестриктазой в этих местах появятся однонитчатые разрезы. В результате указанная двунитчатая молекула НК превратится в одну длинную однонитчатую НК, к которой последовательно присоединено множество НК-проб.
Структура предлагаемых НК-антипроб позволяет также использовать следующий метод получения НК-проб. Однонитчатая НК-проба способна присоединять к себе с образованием двунитчатой структуры только комплементарные последовательности НК. Поэтому в случае обработки такого НК-носителя раствором смеси статистически приготовленных олигонуклеотидов (например, имеющих длину от 5 до 50 оснований) только комплементарные последовательности гибридизуются с НК-носителем и образуют комплекс НК-носителя с НК-пробой.
Еще одним режимом работы может быть такой, при котором НК-антипробы иммобилизованы на биочипах нестандартных размеров и формы, например на открытой поверхности неплоского тела или внутри пор пористого тела и гибридизованы с НК-пробой, образуя двунитчатую НК. Предложено денатурировать такой комплекс НК-антипроб с НК-пробой и высвобождать НК-пробу для того, чтобы она в свободном состоянии обнаруживала НК-мишень и гибридизовалась с ней. Способами денатурации, например, могут быть нагрев, изменение рН среды и приложение электрического поля.
Работа предложенного устройства показана на Фиг.1A-1F. На всех рисунках серии, обозначенной как Фиг.1 для изображения и описания структуры и работы компонентов указанного устройства использована единая нумерация. Биочип содержит подложку 1, на которой в виде пятен иммобилизованы антипробы 4. Антипроба 4 представляет собой однонитчатую НК, последовательность которой комплементарна последовательности другой однонитчатой НК, которая обозначена здесь как НК-проба 8. Антипроба 4 иммобилизована на поверхности 1 биочипа одним из стандартных методов, например, с использованием биотинилирования.
Изобретение учитывает, что хотя изображенная на Фиг.1А НК-антипроба 4 содержит только одну последовательность, комплементарную НК-пробе 8, возможны варианты, в которых НК-антипроба содержит множество повторяющихся последовательностей, комплементарных соответствующей ей НК-пробы. В таких случаях становится возможным повышение эффективности гибридизации и усиление гибридизационного сигнала или снижение плотности посадки НК-антипроб в пятне при условии сохранения стандартной величины сигнала. Изобретение также учитывает, что длинная повторенная НК-антипроба 4 может иметь такую структуру, которая позволяет иммобилизовать на поверхности 1 оба конца указанной НК-антипробы.
После иммобилизации на поверхности 1 НК-антипробы 4 гибридизуют с НК-пробами 8. В предпочтительном варианте первичная последовательность НК-антипроб в указанном пятне 3 известна и отличается от последовательностей НК иммобилизованных в остальных пятнах биочипа 1. НК-пробы 8 могут быть выбраны из отдельно приготовленной библиотеки НК-проб или выловлены на НК-антипробы в условиях гибридизации их со смесью НК различных последовательностей. В результате гибридизации пятна 3 содержат двунитчатый комплекс НК-антипробы 4 с НК-пробой 8.
Изобретение учитывает, что НК-антипроба 4 может быть не только иммобилизована на поверхности биочипа, но, например, в случае, когда она имеет повторяющуюся последовательность и является НК молекулой большой длины, может быть не иммобилизована, но погружена в гель такой плотности, что будет в нем практически неподвижна, в то время как комплементарные ей НК-пробы будут способны под действием электрического поля двигаться в указанном геле. Аналогично НК-антипроба может быть обездвижена в пористых телах другой природы, сквозь которые НК-пробы, комплементарные указанной НК-антипробе, могут проникать.
Биочип 1, несущий двунитчатые комплексы НК-антипробы 4 с НК-пробой 8, помещают в специальный компартмент 2. Компартмент 2, предназначенный для биочипа 1, соединен каналом, содержащим жидкость, с другим компартментом 6, в котором находится НК-мишень 5.
В нижнем правом и левом углах каждого Фиг.1A-1F помещено не масштабное изображение в поперечном сечении НК-антипроб на поверхности биочипа 1 и НК-мишени соответственно.
Компартмент 2 для биочипа и компартмент 6 для НК-мишени заполнены электролитным раствором и соединены через содержащий тот же раствор канал 7, по которому в электрическом поле могут двигаться НК-пробы 8, в то время как НК-мишени 5 практически не могут пройти сквозь канал 7 из одного компартмента в другой.
В настоящем изобретении, как правило, рассматриваются однонитчатые НК-пробы длиной между 5 и 60 нуклеотидов и предпочтительно между 5 и 50. В противоположность коротким НК-пробам, НК-мишени имеют большую длину, как правило, больше чем 200 нуклеотидов. Изобретение учитывает, что НК-мишень может присутствовать в компартменте 6 в различных формах: свободная НК-молекула в растворе; иммобилизованная на поверхности 9 компартмента; иммобилизованная на частицах, которые могут быть металлические, полимерные, полупроводниковые, парамагнитные и др.; обездвиженная внутри геля, или пористой среды другой природы, в которых НК-пробы могут свободно двигаться. Изобретение учитывает также, что в компартмент 6 можно поместить обычный ДНК-чип, на котором иммобилизована НК-мишень.
В общем случае среда, заполняющая канал 7, сквозь которую проходят НК-пробы и не проходят НК-мишени, может быть пористой мембраной, средой, которой заполняют хроматографические колонки и различными видами гелей. В предпочтительном варианте указанная среда является гелем, в котором можно проводить электрофорез. Изобретение учитывает возможность использовать для таких целей гели различной природы и предпочтительно отмечает полиакриламидный и агарозный гель.
После того как устройство, схематически показанное на Фиг.1А, собрано, в компартмент 2 для НК-мишени и компартмент 6 для биочипа вставляют электроды 12 и 10 соответственно. После этого электроды 10 и 12 подключают к источнику тока 14. После денатурации комплекса иммобилизованной НК-антипробы 4 и НК-пробы 8, включение источника тока 14 приведет к миграции НК-проб 8 сквозь канал 7. Иммобилизованные НК-антипробы остаются на поверхности биочипа 1. Электрофорез проводят до тех пор, пока все НК-пробы 8 не переместятся в компартмент 6, где они смогут гибридизоваться с НК-мишенью 5.
На всех Фиг.1, показывающих разные стадии работы предложенного изобретения, использована одна и та же нумерация. После перемещения НК-проб 8 в компартмент 6 с НК-мишенями 5 пятна 3 на биочипе 1, которые исходно содержали двунитчатые НК, содержат только однонитчатые НК-антипробы 4 и показаны как 15 на Фиг.1B-1Е.
В условиях гибридизации в компартменте 6 часть НК-проб 8, комплементарных НК-мишени 5, гибридизуются с ней, образуя двунитчатые комплексы; некомплементарные НК-пробы остаются в виде свободных молекул в растворе. После этого между указанными компартментами вновь организуют электрическое поле с полярностью, обратной той, что указана на Фиг.1В. Те НК-пробы 8, которые оказались некомплементарны НК-мишени 5 и по этой причине находились в растворе в виде свободных молекул, в результате электрофореза в указанном электрическом поле вернутся в компартмент 2, содержащий биочип 1. В условиях гибридизации в компартменте 2 двунитчатые комплексы между НК-пробой 8 и НК-антипробой 4 образуются только в тех пятнах, которые содержат НК-пробы, некомплементарные исследуемой НК-мишени 5. После гибридизации биочип 1 в компартменте 2 будет содержать оба вида пятен - как пятна 15 с однонитчатыми НК, так и пятна 3 с двунитчатыми НК. Для того чтобы определить дву- или однонитчатая НК содержится в каждом пятне биочипа 1, можно использовать различные методы, среди которых есть окраска флуоресцентными красителями и другие спектроскопические методы.
Предпочтительным методом согласно настоящему изобретению является использование молекул, например, красителей, которые по-разному реагируют с одно- и двунитчатой НК и, в частности, ДНК.
Изобретение учитывает, что после идентификации пятен на биочипе 1 можно провести регенерацию биочипа 1 путем денатурации комплекса НК-мишени 5 с НК-пробой 8 в компартменте 6 и перемещения всех освободившихся из указанного комплекса НК-проб 8, используя электрофорез, как это показано на Фиг.1D, в компартмент 2 и гибридизации указанных НК-проб 8 с НК-антипробами 4 и последующего отмывания биочипа 1 от красителей или других молекул, использованных при предыдущей идентификации пятен.
Альтернативные методы идентификации НК-проб, комплементарных НК-мишени, могут быть использованы в результате введения в устройство дополнительного канала, как это показано на Фиг.2А-2Е, на которых использована та же нумерация, что и на всех Фиг.1. Дополнительный отводной канал из компартмента 6 показан на Фиг.2А-2Е в виде лабиринта. Изобретение учитывает, что такой канал может иметь различную форму, например линейный, дугообразный и другие формы.
На Фиг.2А показано изобретенное устройство 100, которое можно представить как устройство, показанное на Фиг.1А, с добавленным к нему отводным каналом 18. Отводной канал 18 заполнен электролитным буферным раствором и имеет серию пятен 20, в которых иммобилизованы НК-антипробы 22.
Изобретение учитывает, что НК-антипробы 22, аналогично НК-антипробам 4, могут быть не только иммобилизованы на поверхности канала 18, но, например, в случае, когда она имеет повторяющуюся последовательность и является НК молекулой большой длины, может быть не иммобилизована, но погружена в гель такой плотности, что будет в нем практически неподвижна, в то время как комплементарные ей НК-пробы будут способны под действием электрического поля двигаться в указанном геле. Аналогично НК-антипроба может быть обездвижена в пористых телах другой природы, сквозь которые НК-пробы, комплементарные указанной НК-антипробе, могут проникать.
Фиг.2В показывает денатурацию комплекса НК-пробы 8 с НК-антипробой 4 и миграцию НК-пробы 8 в электрическом поле, как это описано для Фиг.1В. После того как НК-пробы 8, комплементарные НК-мишеням 5, гибридизовались с ними в компартменте 6, образовав двунитчатые НК комплексы, оставшиеся свободными некомплементарные НК-мишени 5 НК-пробы 8 под действием электрического поля, сформированного между электродом 10, находящимся в компартменте 2, и электродом 12, находящимся на конце 26 канала 18, мигрируют из компартмента 6 в лабиринтный канал 18. Источник тока 14 подсоединен к электродам 10 и 12. Внутри канала 18 однонитчатые НК-пробы 8 гибридизуются с однонитчатыми НК-антипробами 22, иммобилизованными в пятнах 20, расположенных в канале 18, и, образуя двунитчатые комплексы, превращают пятна 20, содержавшие однонитчатые НК, в пятна, содержащие двунитчатые НК, и обозначенные как 30. Изобретение учитывает, что определение, какую НК одно- или двунитчатую содержит данное пятно, можно выполнить различными методами, хорошо известными тем, кто практикует методы гибридизации нуклеиновых кислот, например, с помощью красителей, которые окрашивают одно- и двунитчатые ДНК в разные цвета.
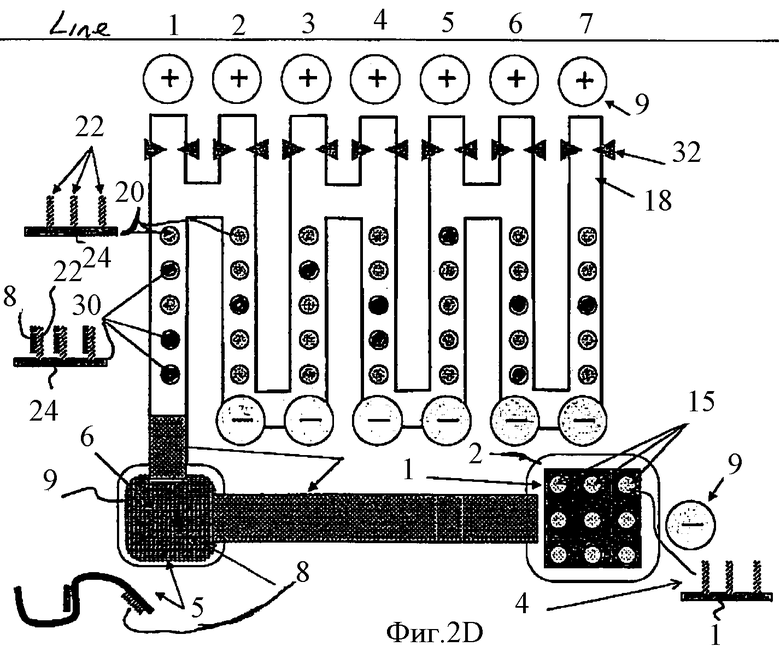
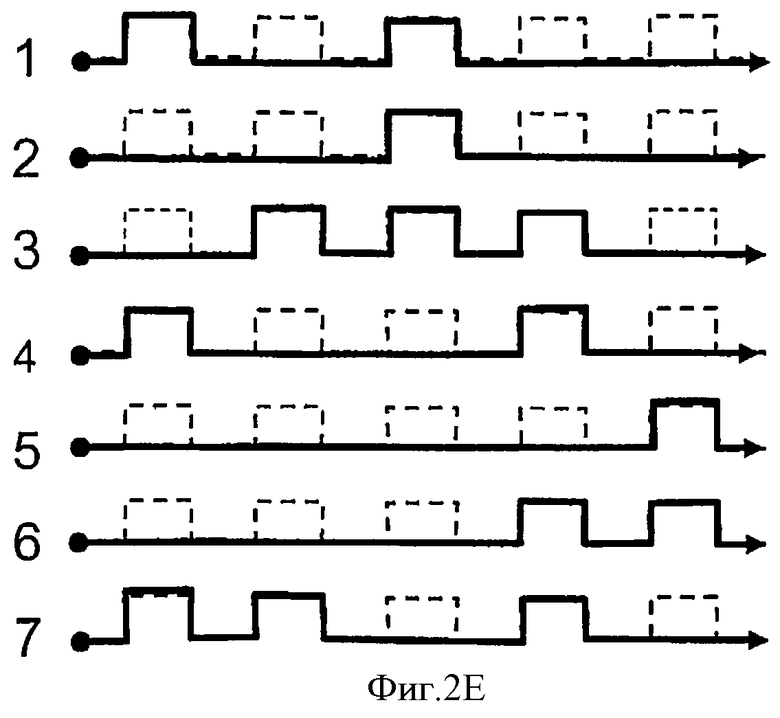
Согласно настоящему изобретению предпочтительным является такое определение одно- или двунитчатости НК, иммобилизованной в пятне, которое учитывает время прохождения НК-пробы в электрическом поле от рассматриваемого пятна до детектора 32. Поскольку расстояние от всех пятен, расположенных в канале 18, до детектора 32 известно, а скорость движения данной НК-пробы в данных условиях в данном электрическом поле можно определить экспериментально, постольку, измерив время от момента освобождения указанной НК-пробы из данного пятна и измерив промежуток времени, после которого эта проба была зафиксирована детектором 32, можно определить положение того пятна, из которого была освобождена указанная НК-проба.
В случае варианта, показанного на Фиг.2D, форма канала такова, что он содержит ответвления, в каждом из которых находится дополнительный электрод и детектор. Детектор 32 может, например, фиксировать прохождение НК-пробы мимо него, измеряя изменение электрических или спектрофотометрических характеристик в окрестности этого детектора.
На Фиг.2Е представлены, в качестве примера, показания семи детекторов, показанных на Фиг.2D, где сплошная линия означает, что в данный момент времени сквозь детектор не проходит НК-проба, тогда как пунктирные линии показывают прохождение сквозь детектор НК-пробы, которая до освобождения из соответствующего пятна была частью двунитчатого НК комплекса. Графики на Фиг.2Е выполнены для пятен, которые расположены в параллельных каналах на Фиг.2D.
Изобретение учитывает, что свободные НК-пробы, которые прошли сквозь детектор, могут быть по дополнительному обходному каналу направлены в компартмент 2 для гибридизации с соответствующими им НК-антипробами и, таким образом, для частичной регенерации биочипа 1. Для полной регенерации биочипа 1 необходимо и возможно денатурировать двунитчатый комплекс НК-мишени с НК-пробой в компартменте 6 и вернуть, например, электрофоретически освободившиеся НК-пробы в компартмент 2 для регибридзации с НК-антипробами.
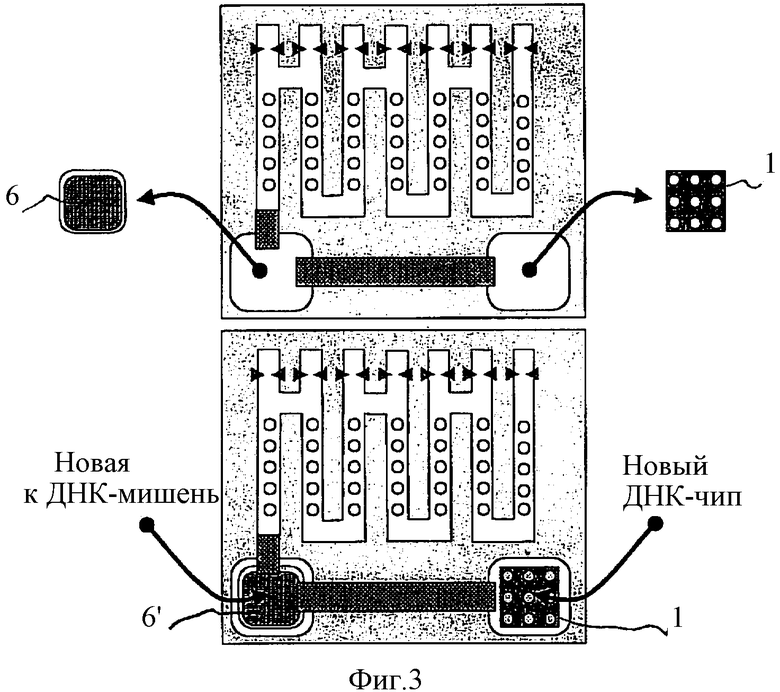
После окончания теста, в случае принятия решения не регенерировать использованный биочип 1, его можно заменить на новый биочип 1' и поменять НК-мишень в компартменте 6 на новую НК-мишень в компартменте 6', как это схематически показано на Фиг.3.
Изобретение учитывает, что в альтернативном варианте, после того как НК-мишени 5 образовали комплексы с комплементарными им НК-пробами 8, можно вернуть все некомплементарные НК-пробы 8 обратно в компартмент 2 и гибридизовать их там на биочип 1, лишив их таким образом электрофоретической подвижности. После этого можно денатурировать комплекс НК-мишени с НК-пробой и освободившиеся НК-пробы переместить в лабиринтный канал и проанализировать их аналогично тому, как это было объяснено на Фиг.2С-Е. В этом варианте также можно вернуть все НК-пробы, прошедшие сквозь детектор в компартмент 2 для полной регенерации биочипа 1.
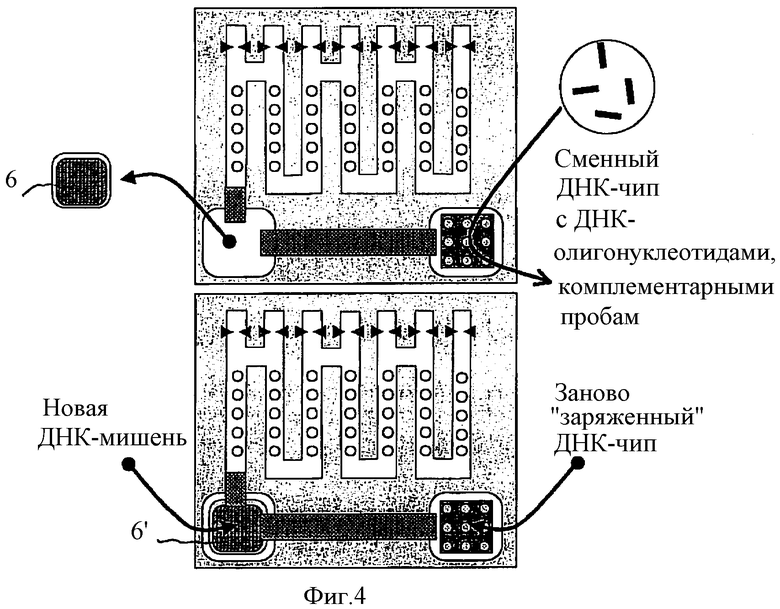
Изобретение также учитывает, что предложенная процедура регенерации биочипа может быть использована для разработки автоматического диагностического прибора высокой производительности. Эта концепция схематически представлена на Фиг.4, где показан этап работы устройства, на котором происходит замена старой НК-мишени на новую НК-мишень и регенерация биочипа с использованием НК-проб.
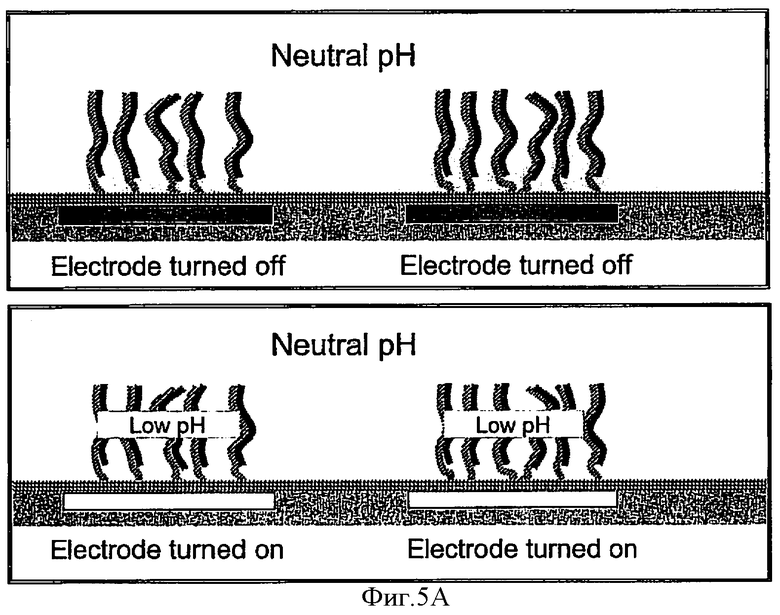
В дополнение к хорошо известным методам денатурации, таким как изменение температуры, рН и ионной силы, а также прямое воздействие электрическим полем, на Фиг.5А-5С показана еще одна возможность денатурировать двунитчатые НК, которая использует возможность изменения рН среды в окрестности электрода под воздействием электрического потенциала, приложенного к этому электроду. На Фиг.5А показано исходное состояние, при котором электроды выключены, что обозначено на Фиг.5 как "Electrod turned off". Включенное состояние указанных электродов на всех Фиг.5 обозначено как "Electrode turned on". При исходном выключенном состоянии электродов, как это показано на верхнем Фиг.5А, специально подобранная среда, прилегающая к поверхности электрода, имеет нейтральное значение рН. Указанная среда обладает такими свойствами, что включение электродов, как это показано на нижнем Фиг.5А, приводит к понижению рН и созданию кислотной среды только в ближайшей окрестности указанного электрода. Соответственно, если до включения электродов среда во всем объеме камеры была щелочной, то включение электродов сделает среду около поверхности электрода нейтральной, как показано на верхнем Фиг.5B. Таким образом, управляя включением и выключением электродов и подбором исходных значений рН в камере, можно контролируемо создавать в окрестности каждого электрода такие условия, которые денатурируют двунитчатые НК, находящиеся в этом месте, как это показано на нижнем Фиг.5B. Поместив дополнительный положительный электрод позади детектора, можно обеспечить такое электрическое поле, в котором НК-пробы, освобожденные из комплекса с НК-антипробами в пятне, находящемся над определенным электродом, будут двигаться в направлении детектора и пройдут мимо него, что позволит детектору обнаружить эти НК-пробы, как это показано на Фиг.5С. Время, которое пройдет от момента выключения данного электрода, обозначенного на Фиг.5С как «Electrode turned off», до момента, когда детектор обнаружит пробу, будет коррелировать с расстоянием от указанного электрода до детектора, что позволит идентифицировать НК-пробу.
На Фиг.6 показаны вид сверху (Фиг.6А) и поперечный разрез (Фиг.6B) устройства, обозначенного как 60, в котором можно проводить процесс, описанный на Фиг.1A-1С; на Фиг.6 и Фиг.1 обозначения одинаковы.
Фиг.7А-7Е представляют собой схематическое изображение в поперечном сечении устройства, показанного на Фиг.6, в процессе работы.
На Фиг.7А показано, что производитель в процессе изготовления заполняет компартменты устройства необходимыми растворами. На Фиг.7B показано, что специфическую НК-мишень загружают в соответствующий компартмент. После этого НК-пробы электрофоретически мигрируют в компартмент с НК-мишенью и гибридизуются с НК-мишенью, образуя двунитчатые комплексы, как показано на Фиг.7С. После этого некомплементарные НК-пробы электрофоретически возвращают в исходный компартмент, как показано на Фиг.7D и гибрдизуют с биочипом, как показано на Фиг.7Е. Определение, какая именно НК (дву- или однонитчатая) содержится в каждом пятне на биочипе, завершает процедуру тестирования НК-мишени. На Фиг.7F показано, что можно, используя дополнительный канал 62, осуществить промывание, окраску и микроскопическое наблюдение биочипа без открывания устройства, через прозрачную крышку компартмента, в который помещен биочип. После этого можно осуществить регенерацию биочипа, как это было описано ранее, и, удалив протестированную НК-мишень, подготовить устройство к тестированию следующей НК-мишени.
Изобретение учитывает, что в дополнение к вариантам, когда один биочип соединен с одной камерой для НК-мишени, как это было показано на Фиг.1 и 2, возможны варианты соединения множества биочипов и детекторов с одной или несколькими НК-мишенями в зависимости от характера проводимой диагностики, как это, например, показано на Фиг.8-11. Изобретение также учитывает, что хотя на Фиг.9-11 детектор помещен на выходе из устройства, возможны не только различные положения детектора в указанных схемах, но также возможно совместное использование вариантов, представленных на Фиг.2 и Фиг.8-11, при использовании различного количества каналов и детекторов.
Предшествующее описание иллюстрирует специфические варианты изобретения, но не предполагает, что практические воплощения изобретения будут ограничены только ими.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО МНОГОРАЗОВОГО ИСПОЛЬЗОВАНИЯ ДЛЯ ГИБРИДИЗАЦИИ НУКЛЕИНОВЫХ КИСЛОТ И ЕГО ПРИМЕНЕНИЕ | 2007 |
|
RU2366717C2 |
| СПОСОБ ГИБРИДИЗАЦИИ НК | 2009 |
|
RU2423522C2 |
| ДИАГНОСТИКА И ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2550925C2 |
| СПОСОБ АБЛЯЦИИ ЦЕЛЕВОЙ ДНК С ПОВЕРХНОСТИ ДНК-БИОЧИПОВ | 2009 |
|
RU2410439C1 |
| ОПРЕДЕЛЕНИЕ ЦЕЛЕВЫХ НУКЛЕИНОВОКИСЛОТНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ПУТЕМ РАСЩЕПЛЕНИЯ ЗОНДИРУЮЩЕГО ОЛИГОНУКЛЕОТИДА И ГИБРИДИЗАЦИИ | 2012 |
|
RU2588457C2 |
| СПОСОБ ОБНАРУЖЕНИЯ И ОПРЕДЕЛЕНИЯ ДНК С ЗАДАННОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ МЕТОДОМ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ | 2019 |
|
RU2723160C1 |
| ГЕНЕТИЧЕСКИЕ ПОЛИМОРФИЗМЫ ПРИ ВОЗРАСТНОЙ ДЕГЕНЕРАЦИИ ЖЕЛТОГО ПЯТНА | 2010 |
|
RU2577726C2 |
| НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ЗОНДОВ ДЛЯ ГЕНОТИПИРОВАНИЯ ПОЛИМОРФНЫХ ЛОКУСОВ ДНК, АССОЦИИРОВАННЫХ С РИСКОМ РАЗВИТИЯ СПОРАДИЧЕСКОЙ ФОРМЫ БОЛЕЗНИ АЛЬЦГЕЙМЕРА В РОССИЙСКИХ ПОПУЛЯЦИЯХ | 2014 |
|
RU2600874C2 |
| НАБОРЫ ОЛИГОНУКЛЕОТИДНЫХ ЗОНДОВ И СПОСОБЫ ПРОФИЛИРОВАНИЯ МИКРОБИОТЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2011 |
|
RU2605913C2 |
| ГЕНЕТИЧЕСКИЕ ПОЛИМОРФИЗМЫ ПРИ ВОЗРАСТНОЙ ДЕГЕНЕРАЦИИ ЖЕЛТОГО ПЯТНА | 2010 |
|
RU2546008C2 |


Изобретение относится к области молекулярной биологии и может быть использовано для анализа нуклеиновых кислот. В способе сравнения последовательностей двух нуклеиновых кислот, представляющих собой НК-пробу и НК-мишень, используют биочип, содержащий множество однонитчатых нуклеиновых кислот (НК-антипробы), которые гибридизованы с НК-пробами. Для этого данный биочип изготавливают и помещают в компартмент, в котором последовательно обеспечивают денатурирующие условия и условия перехода НК-проб в компартмент, содержащий НК-мишень. В компартменте с НК-мишенью последовательно обеспечивают условия гибридизации НК-пробы с комплементарной НК-мишенью и условия электрофоретического перехода НК-пробы в компартмент с биочипом. Комлементарность НК-пробы и НК-мишени устанавливают либо по образованию комплекса НК-мишени и НК-пробы, либо по образованию в другом компартменте для НК-антипроб комплекса НК-антипробы и НК-пробы, полученной денатурацией комплекса НК-пробы и НК-мишени. Устройство для работы с биочипом, содержащим НК-антипробы, которые гибридизованы с НК-пробами, включает компартмент для размещения указанного биочипа и компартмент для НК-мишени, соединенные каналом, который заполнен средством, непроницаемым для НК-мишеней, но проницаемым для НК-проб. Применение изобретения позволяет повысить чувствительность и эффективность анализа нуклеиновых кислот при использовании биочипов. 2 н. и 18 з.п. ф-лы, 25 ил.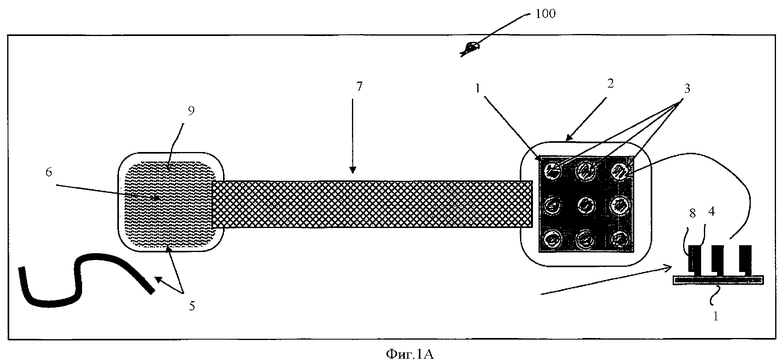
приготовление биочипа, содержащего на своей поверхности набор участков (пятен), внутри которых иммобилизовано множество однонитчатых молекул нуклеиновых кислот, называемых НК-антипроба, первичная последовательность которых комплементарна последовательности НК-пробы, так что в условиях гибридизации указанные НК-антипробы и НК-пробы гибридизуются таким образом, что образуют двунитчатую нуклеиновую кислоту, причем указанные однонитчатые молекулы нуклеиновых кислот гибридизованы с указанными НК-пробами;
помещение указанного биочипа в компартмент, содержащий жидкость;
денатурацию указанного комплекса НК-антипробы с НК-пробой;
обеспечение возможности электрофоретического перехода указанной НК-пробы в компартмент, содержащий НК-мишень;
обеспечение контакта НК-мишени, с указанной НК-пробой;
обеспечение таких условий гибридизации, при которых указанная НК-проба имеет возможность гибридизоваться с комплементарной НК-мишенью с образованием комплекса НК-пробы с НК-мишенью;
обеспечение условий для электрофоретического перемещения НК-пробы в компартмент с иммобилизованными НК-антипробами через среду, сквозь которую могут проходить НК-пробы, но не проходят НК-мишени;
обеспечение возможности гибридизации указанной НК-пробы с набором НК-антипроб;
детектирование комплементарности НК-пробы и НК-мишени либо путем определения, является ли НК-проба частью комплекса НК-пробы с НК-мишенью в указанном компартменте, либо путем создания вначале денатурирующих условий в компартменте для НК-мишени, затем условий для электрофоретического перемещения НК-пробы между компартментом для НК-мишени и другим компартментом для иммобилизованных НК-антипроб и в завершении условий для гибридизации НК-проб с НК-антипробами в указанном другом компартменте для иммобилизованных НК-антипроб с последующим определением, является ли НК-проба частью комплекса НК-пробы с иммобилизованными НК-антипробами в указанном другом компартменте для иммобилизованных НК-антипроб.
предназначенное для работы с биочипом, на котором иммобилизованы НК-антипробы, гибридизованные с комплементарными НК-пробами, включающее компартмент для размещения указанного биочипа, несущего НК-антипробы, гибридизованные с НК-пробами и образующие с ними двунитчатые нуклеиновые кислоты; компартмент для НК-мишени; канал, соединяющий компартмент для размещения указанного биочипа и компартмент для НК-мишени, заполненный средством, которое препятствует перемещению НК-мишени между указанными компартментами и является проницаемым для указанных НК-проб; приспособление, позволяющее подключить один электрод для электрофореза к указанному компартменту для НК-мишени, и другой электрод для электрофореза к компартменту с указанным комплексом НК-пробы с НК-антипробой.
| US 2004115709, 17.06.2004 | |||
| CN 1519329, 11.08.2004 | |||
| JP 2001149097, 05.06.2001 | |||
| DE 10353985, 23.06.2005 | |||
| DE 3917436 A1, 07.12.1989 | |||
| RU 2003108502 A, 20.01.2005. |
Авторы
Даты
2009-02-27—Публикация
2007-02-22—Подача