Область техники, к которой относится изобретение
Настоящее изобретение относится к области аналитических и биоорганических исследований, может быть использовано в гематологии и онкологической диагностике, в биохимических исследованиях для молекулярного узнавания, качественного и количественного обнаружения определенных последовательностей нуклеиновых кислот, например, для обнаружения ДНК с заданной последовательностью промотора гена каталитической субъединицы теломеразы человека с высокими чувствительностью, селективностью и экспрессностью.
Уровень техники
Из уровня техники известны решения, позволяющие осуществлять молекулярную диагностику онкологических заболеваний. Мутации в структуре дезоксирибонуклеиновых кислот (ДНК) являются причиной широкого спектра генетических заболевания, в том числе раковых. Обнаружение и определение поврежденных участков ДНК позволяет проводить прогнозирование и достоверную диагностику широкого класса заболеваний на ранних стадиях. На сегодняшний день для ранней диагностики заболеваний и своевременного лечения требуется определение ДНК с поврежденными фрагментами с высокой чувствительностью и точностью, поскольку даже небольшое изменение качественного и количественного состава биологических жидкостей могут быть вызваны началом широкого набора серьезных заболеваний. Однако современные методы не в полной мере удовлетворяют требованиям к чувствительности, экспрессности, доступности используемого оборудования и стоимости анализа, что приводит к необходимости пересмотра существующих и разработке новых, более чувствительных, селективных и менее ресурсозатратных экспресс-способов определения ДНК в таких биологических жидкостях, как кровь, моча, спинномозговая жидкость, слюна и др.
В настоящее время используемые методы основаны на идентификации последовательностей ДНК путем гибридизации комплементарных последовательностей с флуоресцентным методом обнаружения. В большинстве методов определения малых количеств нуклеиновых кислот, как правило, используется предварительная амплификация фрагментов ДНК в полимеразной цепной реакции (ПЦР). Одновременно по мере накопления в реакционной среде ПЦР амплифицированных фрагментов ДНК проводят их обнаружение. Известные из уровня техники решения, связанные с ПЦР-методами и описанные в работе [Fondevila М., Bcrsting С, Phillips С, de la Puente М., Consortium E.-N., Carracedo A., Morling L., Lareu M.V. Forensic SNP genotyping with SNaPshot: Technical considerations for the development and optimization of multiplexed SNP assays. Forensic Sci Rev. 2017. V. 29. P. 57-76] обладают высокой чувствительностью и возможностью одновременного определения 4-5 ДНК-мишеней.
Однако чувствительность ПЦР-методов зависит от эффективности амплификации ПЦР ДНК-фрагмента образца, которая, в свою очередь, снижается при наличии повреждений ДНК или ее фрагментации. Присутствие повреждений ДНК прежде всего обусловлено природой образцов. Более того, при мультиплексном определении нескольких молекул-мишеней на фоне большого количества ДНК, с последовательностью, отличающейся только на один нуклеотид, ошибки ПЦР начинают вносить существенный вклад в точность определения последовательности и резко падает чувствительность. Таким образом, возрастает предел обнаружения мутаций и возможность получения ложно-положительных результатов. Именно эти проблемы являются основными ограничениями при определении опухолевой ДНК в биологических жидкостях. Сильное фрагментирование ДНК, характерное для свободной ДНК во внеклеточных жидкостях, также зависит от природы и процедуры пробоотбора и служит препятствием достоверной и эффективной идентификации в диагностических системах на основе амплификации ДНК-мишени. При переходе к анализу фрагментов длиной менее 50 нуклеотидов, их выделение и последующая специфическая гибридизация праймеров для амплификации становятся практически невозможными. Кроме того, существует проблема блокирующих повреждений нуклеиновых кислот, наличие которых нарушает гибридизацию пробы и останавливает удлинение праймера в ПЦР, что препятствует обнаружению малых количеств ДНК. Это приводит к существенным ограничениям использования ДНК, выделенной из долго хранящихся биоматериалов. Образование неканонических структур ДНК-матрицей, например G(гуанин)-квадруплексов, также препятствует эффективной идентификации последовательности ДНК ПЦР-методами.
На данный момент широкий круг задач биомедицинской диагностики решается путем применения спектроскопии гигантского, или поверхностно усиленного, комбинационного рассеяния (ГКР, англ. SERS - surface enhanced Raman spectroscopy). Значительное усиление сигнала комбинационного рассеяния (КР) достигается за счет использования наночастиц благородных металлов в качестве основы сенсорной системы. Известно, что наночастицы благородных металлов и нанокомпозиционные материалы на их основе способны усиливать сигнал комбинационного рассеяния в 106-1014 раз за счет их способности генерировать локальное электромагнитное поле, взаимодействующее с колебательными состояниями анализируемых органических молекул. Спектроскопия ГКР активно изучается более 30 лет, а в последнее десятилетие зарекомендовала себя в качестве одного из наиболее эффективных и многообещающих методов обнаружения биологических структур. Явление ГКР открывает новые возможности в создании сверхчувствительных диагностических методов анализа и понижении предела обнаружения по сравнению с известными методами. Современные методы не в полной мере удовлетворяют требованиям к чувствительности, экспрессности, доступности используемого оборудования и стоимости анализа, что приводит к необходимости пересмотра существующих и разработке новых, более чувствительных, селективных и менее ресурсозатратных экспресс-способов определения ДНК в таких биологических жидкостях, как кровь, моча, спинномозговая жидкость, слюна и др. Сложность анализа ДНК методом спектроскопии ГКР заключается в низкой воспроизводимости коэффициентов усиления сигнала, вызванной различной ориентацией фрагментов ДНК и низкими концентрациями поврежденных участков. В связи с этим необходим поиск приемов для улучшения метрологических характеристик определения с использованием сенсора. Наибольшего усиления и воспроизводимости сигнала ГКР возможно достичь путем структурирования и упорядочивания поверхности, с которой происходит регистрация аналитического сигнала. Наночастицы серебра (НЧС) активно используются в качестве усилителя сигнала КР за счет возможности создания наноструктур со сложной иерархией путем агрегации и высокой концентрацией горячих точек (англ. hot spots), в которых и реализуется локальный поверхностный плазмонный резонанс.
Из уровня техники известно решение, представленное в работе [Graham D., Thompson D.G., Smith W.E., Faulds K. Control of enhanced Raman scattering using a DNA-based assembly process of dye-coded nanoparticles. Nat. Nanotechnol. 2008. V. 3. P. 548-551], описывающей селективное обнаружение ДНК методом спектроскопии ГКР с использованием модифицированных красителем НЧС, на поверхность которых иммобилизованы олигонуклеотиды. Предложенный подход позволяет обнаруживать ДНК по процессу агрегации наночастиц серебра (НЧС) посредством их модификации олигонуклеотидами и их направленного взаимодействия за счет комплементарности ДНК. В этом случае обнаружение основано на образовании димеров НЧС при гибридизации ДНК, которое происходит исключительно в присутствии мишени. При этом модифицированные красителем НЧС без гибридизации не давали усиления на спектрах ГКР. Предложенный подход демонстрирует высокую, сравнимую с ПЦР, чувствительность. Достижение повышенной чувствительности связано с наличием усиленных сигналов ГКР для димеров НЧС и отсутствием - в случае отдельных НЧС. ДНК сама по себе не дает сигнала ГКР, поскольку не имеет подходящего видимого хромофора и обладает низким адсорбционным сродством к поверхности ГКР-активных НЧС.
Однако известное решение детектирования последовательностей нуклеиновых кислот методом спектроскопии ГКР не является экспрессным. Предложенный подход требует предварительной агрегации НЧС посредством гибридизации с ДНК в течение 20-60 мин. При этом интенсивность аналитических сигналов существенно зависит от продолжительности и температурного режима агрегации, что приводит к дополнительным погрешностям в анализе. При этом отсутствие комплементарных взаимодействий приводит к получению сигналов на спектрах ГКР, что осложняет количественный анализ. Минимальная изученная концентрация фрагментов ДНК составляет 7.5⋅10-9 М, что может быть недостаточно для постановки диагноза на ранних стадиях рака.
Наиболее близким к заявляемому является способ измерения связанных с раком веществ, включая свободную ДНК, происходящую от раковых клеток, посредством спектроскопии КР (WO 2014181816 A1 (ЕА 201592123 А) «Raman quantification method of cancer-related substance» («Способ измерения связанных с раком веществ посредством спектроскопии комбинационного рассеяния света»)). Предложенный способ измерений включает этапы 1) приготовления биочипа с мезокристаллической областью из оксидов серебра, содержащей перекись серебра, 2) добавления по каплям сыворотки крови или раствора биологического образца к мезокристаллической области биочипа, избирательного захвата связанных с раком веществ, имеющих положительный заряд в образце, 3) облучения лазерным светом захваченных связанных с раком веществ и 4) последующего определения этих компонентов методом спектроскопии КР, при этом дают оценку раковым заболеваниям на основе интенсивности сигналов поверхностно-усиленного комбинационного рассеяния света (SERS, ГКР).
Однако в известном решении невозможно селективное количественное определение ДНК с поврежденными фрагментами. Вывод о содержании связанных с раком веществ делают по свойственным для углерода D- и G-полосам и характерному пику для метиловой группы вблизи 2900 см-1, которые присутствуют у любых как белковых соединений, так и молекул ДНК. Некоторая селективность обеспечивается исключительно разделением положительно и отрицательно заряженных аналитов. Предложенная методика требует синтеза и использования квантовых кристаллов (100-200 нм), состоящих из квантовых точек серебра (5-10 нм), которые только после приложения электрического потенциала способны реагировать с определяемыми соединениями: как ДНК, так и белками. Описанный биочип обладает достаточно сложной конструкцией, что отрицательно влияет на воспроизводимость методик его получения и определения целевых аналитов, сужает круг определяемых соединений. Производство данного сенсора сложно осуществлять в больших масштабах. Кроме того, продемонстрирована возможность обнаружения ракового заболевания и оценка прогрессирования заболевания на реальных образцах крови, но количественных зависимостей содержания ДНК в исследуемых образцах для диагностирования рака на ранних стадиях с использованием описанного подхода получить не удалось. Таким образом, известный метод не позволил проводить достоверную количественную оценку содержания ДНК со строго заданной последовательностью с необходимыми чувствительностью: низким ПО<1⋅10-12 М, широким диапазоном определяемых концентраций: ДОК 1⋅10-12-1⋅10-7 М, высокой воспроизводимостью: sr<0.10 и селективностью по отношению к наиболее близким по строению: ДНК с отличной от определяемой последовательностью).
Технической проблемой является отсутствие способа определения ДНК с поврежденными фрагментами, обладающего высокими чувствительностью, селективностью и экспрессностью для диагностики онкологических заболеваний на ранних стадиях.
Данная техническая проблема решается за счет идентификации последовательности ДНК, селективного определение поврежденных ДНК, что включает в себя приготовление планарной ГКР-активной поверхности из наночастиц благородных металлов; последующую гибридизацию поврежденного фрагмента ДНК с различными комплементарными олигонуклеотидами, ковалентно модифицированных коммерчески доступными ГКР-метками; добавления капли раствора биологического образца на поверхность наночастиц, направленное структурирование определяемых соединений на ГКР-сенсорной поверхности за счет нековалентных взаимодействий; облучения монохроматическим пучком лазера и определение фрагментов ДНК в изучаемом образце методом спектроскопии ГКР на основе интенсивности сигналов на регистрируемых спектрах.
Раскрытие изобретения
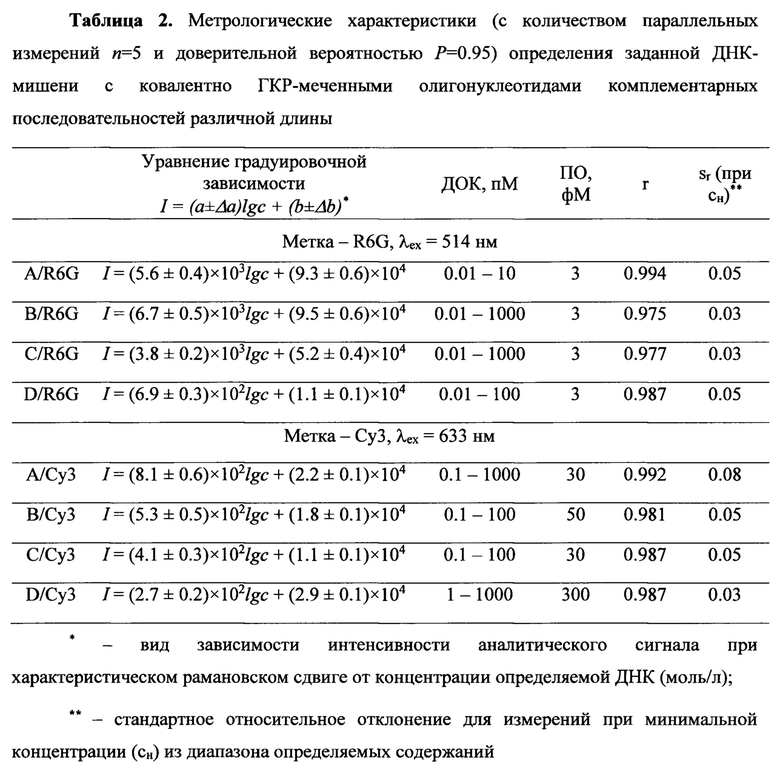
Техническим результатом изобретения является разработка способа для качественного и количественного определения ДНК в целях диагностики онкологических заболеваний, который позволяет использовать метод спектроскопии ГКР с высокими коэффициентами чувствительности (до 105 абс.ед.) и низким пределом обнаружения (ПО до 3 фМ), высокой селективностью (по отношению к молекулам ДНК с отличной последовательностью нуклеиновых кислот), широким диапазоном определяемых концентраций (ДОК от 1⋅10-14 до 1⋅10-7 М), высокими воспроизводимостью и прецизионностью (коэффициенты корреляции градуировочных зависимостей составляет не менее 0.97, относительное стандартное отклонение при нижней определяемой концентрации не более 0.08). Способ позволяет проводить узнавание фрагментов ДНК конъюгатами олигонуклеотидов с наночастицами для обнаружения и определения ДНК с определяемой последовательностью промотора гена каталитической субъединицы теломеразы человека с высокими чувствительностью, селективностью и экспрессностью для диагностики онкологических заболеваний на ранних стадиях, а именно на нулевой и первой стадиях, когда опухоль не вышла за пределы очага ее образования и не поразила соседние ткани либо успела врасти в окружающие ткани, но не распространилась в лимфатические узлы или другие части тела, при содержании молекул ДНК с повреждениями менее 1⋅10-11 М.
Технический результат достигается способом определения фрагментов поврежденной ДНК, заключающимся в том, что на планарную ГКР-активную поверхность, включающую наночастицы благородных металлов (оптический сенсор) наносят предварительно подготовленный раствор, образованный при гибридизации жидкой пробы с исследуемым фрагментом поврежденной ДНК с комплементарным олигонуклеотидом, ковалентно модифицированным ГКР-меткой, облучают монохроматическим пучком лазера и определение фрагментов ДНК в изучаемом образце методом спектроскопии ГКР проводят по интенсивности сигналов на регистрируемых спектрах. Оптический сенсор представляет собой нанесенные на материал-носитель наночастицы благородных металлов, в качестве которых используют серебро или золото, а в качестве материала-носителя используют диэлектрический химически инертный материал, выбранный из ряда, включающего оксид алюминия, оксид магния, диоксид кремния, диоксид циркония, силикатное стекло. При этом наночастицы имеют размеры 20-90 нм и характеризуются полосой плазмонного резонанса 420-650 нм, для нанесения используют 10-500 мкмоль благородного металла в расчете на 1 мм2 поверхности носителя с последующей сушкой. Для нанесения пробы (предварительно подготовленного раствора, образованног при гибридизации жидкой пробы с исследуемым фрагментом поврежденной ДНК с комплементарным олигонуклеотидом, ковалентно модифицированным ГКР-меткой) и однократного анализа используют поверхность площадью 4×4 мм2. Гибридизацию проводят путем нагрева и выдерживания раствора в течение 5-10 мин при температуре 90-100°С, с последующим охлаждением до комнатной температуры, при этом в качестве олигонуклеотидов для гибридизации использованы олигонуклеотиды, длина которых выбирается с учетом химической структуры ГКР-метки, из расчета конечного расстояния 1-5 нм между ГКР-индикатором и наночастицами металла для осуществления резонансного взаимодействия на поверхности наночастиц, а в качестве ГКР-индикаторов предпочтительно использовать вещества, дающие наибольшее разрешение и количество характеристичных полос на спектрах ГКР, например родаминовые и цианиновые красители, в частности R6G и Су3. Для проведения гибридизации предпочтительно использовать ГКР-меченный олигонуклеотид взятый в мольном соотношении от 1:10 до 10:1 к определяемой ДНК. Для качественного и количественного анализа жидкие пробы наносят путем их накалывания на поверхность наночастиц, предпочтительно наносить на поверхность жидкие пробы объемом 10-50 мкл для определения ДНК с концентрациями 10-15-10-2 М. Предпочтительно после нанесения жидкой пробы на ГКР-сенсорную поверхность выдержать образец при комнатной температуре в течение времени, необходимого для равномерного распределения пробы по поверхности сенсора и возможности фокусировки лазера. В среднем оптимальный промежуток времени между нанесением пробы на сенсор и регистрацией сигнала ГКР составляет от 5 до 60 мин. При проведении анализа предпочтительно использовать монохроматическое лазерное излучение с длиной волны наиболее близкой к максимуму поглощения раствора ГКР-индикатора из диапазона длин волн 450-1100 нм и мощностью, не превышающей 10% от номинальной величины, при облучении сенсора с нанесенной пробой не более 10 с, при этом о качественном и количественном содержании ДНК судят по положению и интенсивности полос при 1360, 1380, 1470, 1510, 1570, 1590 и 1650 см-1 с допустимой величиной погрешности не более 10 см-1.
Последовательность нуклеиновых кислот в структуре ГКР-меченного олигонуклеотида выбирается из соображений комплементарности нуклеиновых кислот: А (аденин) - Т (тимин), G (гуанин) - С (цитозин) к необходимой мишени.
Диагностика онкологических заболеваний осуществляется за счет идентификации последовательности ДНК, селективного определение поврежденных ДНК, что включает в себя приготовление планарной ГКР-активной поверхности из наночастиц благородных металлов; последующую гибридизацию поврежденного фрагмента ДНК с различными комплементарными олигонуклеотидами, ковалентно модифицированных коммерчески доступными ГКР-метками; добавления капли раствора биологического образца на поверхность наночастиц, направленное структурирование определяемых соединений на ГКР-сенсорной поверхности за счет нековалентных взаимодействий; облучения монохроматическим пучком лазера и определение фрагментов ДНК в изучаемом образце методом спектроскопии ГКР на основе интенсивности сигналов на регистрируемых спектрах.
Способность селективно связывать и равномерно структурировать анализируемое вещество по поверхности ГКР-сенсорного устройства подтверждается регистрацией идентичных по интенсивности аналитических сигналов по всей площади поверхности наноструктур (n=10; Р=0.95); способность контролировать расположение ГКР-метки относительно наноструктур благородного металла подтверждается регистрацией различных по усилению аналитических концентраций для идентичных концентраций ДНК с различным расположением ГКР-метки. Это позволяет детектировать ДНК с низкими пределами обнаружения методом спектроскопии ГКР, за счет образования квадруплексов ковалентно ГКР-меченных олигонуклеотидов с определяемой ДНК-мишенью на поверхности сенсорного устройства. Заявляемый оптический сенсор позволяет регистрировать усиленный и воспроизводимый сигнал комбинационного рассеяния, интенсивность которого зависит от концентрации определяемой ДНК-мишени в нанесенном образце за счет присутствия ГКР-меток в олигонуклетидном остатке.
Высокочувствительное обнаружение ДНК методом спектроскопии ГКР осуществляется за счет их селективной гибридизации с использованием олигонуклеотидов, ковалентно модифицированных ГКР-красителями (ГКР-метками, ГКР-индикаторами), которые встраиваются в состав дуплекса после гибридизации зонда с мишенью.
Представленный способ пригоден для работы с портативным, коммерчески доступным, серийным оборудованием вне лабораторных условий. Таким образом, с использованием заявляемого оптического планарного сенсора возможно высокочувствительное и селективное качественное и количественное определение присутствующих в образце молекул ДНК.
Заявляемый способ применим для определения малых количеств ДНК на фоне большого количества посторонних мешающих компонентов анализируемых реальных биологических жидкостей: крови, мочи, церебральной жидкости и др. Данный результат достигается за счет дополнительного селективного связывания фрагментов ДНК с направленно выбранными ковалентно ГКР-меченными олигонуклеотидами на поверхности наночастиц. Кроме того, за счет направленного структурирования и упорядочивания, а также контроля расстояния от ГКР-метки до поверхности наночастиц регистрируется воспроизводимый на всей сенсорной поверхности усиленный сигнал ГКР. Усиление сигнала комбинационного рассеяния в 103-1014 раз достигается за счет дополнительного оборачивания гибридизованного дуплекса ДНК вокруг металлических наночастиц, выступающих в качестве ГКР-усилителя благодаря нековалентным взаимодействиям. Предлагаемый способ определения ДНК демонстрирует отсутствие сигналов для произвольных ДНК на спектрах гигантского комбинационного рассеяния (фиг. 5, 6), что позволяет надежно количественно определять необходимые ДНК на уровне 10-14 М. Заявленный способ анализа позволяет эффективно предконцентрировать и селективно связывать анализируемое вещество, подбирать ковалентно ГКР-меченный олигонуклеотид для образования дуплекса из соображений комплементарности: А (аденин) - Т (тимин) и G (гуанин) - С (цитозин), и длины Якоря 15-25 нуклеиновых кислот и Промотора 10-50 нуклеиновых кислот, содержащего ГКР-метку, обнаруживать аналит с коэффициентом усиления до 1014, в том числе за счет сохранения структуры ДНК. При этом также стоит отметить потенциальное устранение мешающего влияния посторонних компонентов различных биологических жидкостей.
Таким образом, использование предлагаемого способа анализа позволяет детектировать сигнал ГКР с высоким коэффициентом чувствительности, высокой селективностью, широким диапазоном определяемых концентраций, высокой воспроизводимостью и прецизионностью.
Краткое описание чертежей
Изобретение поясняется чертежами.
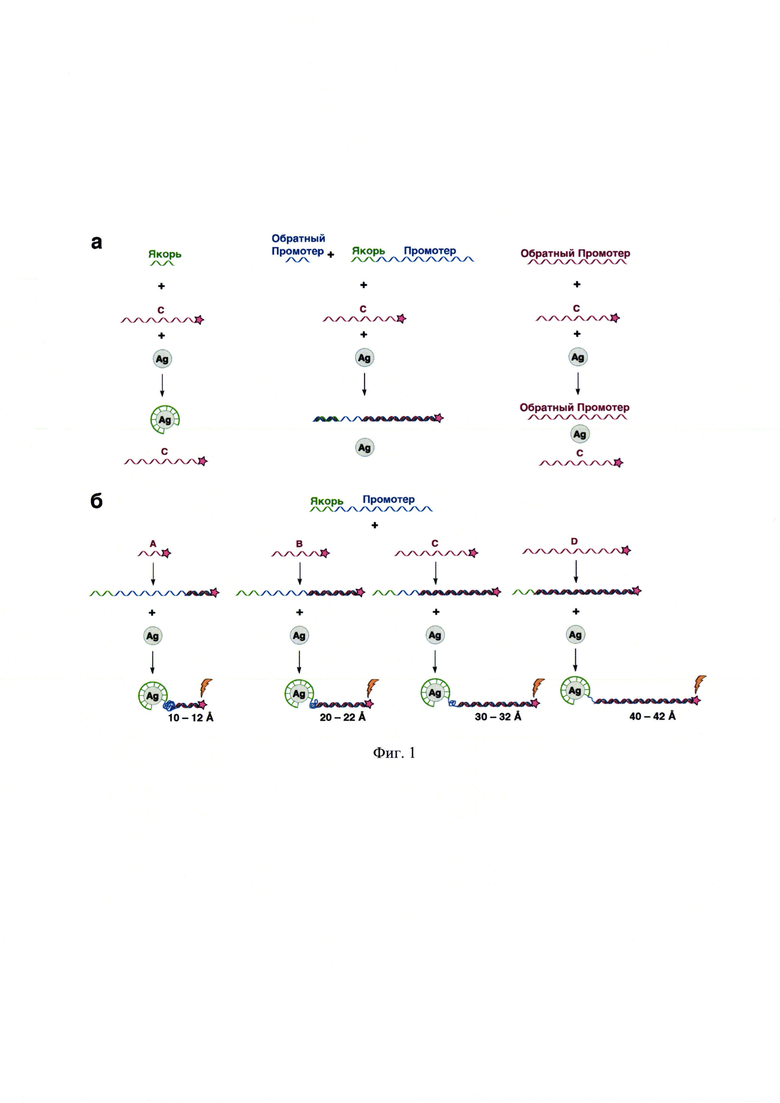
На фиг. 1 представлена схемы контрольных экспериментов (а) и образования квадруплекса ДНК (б) с ковалентно ГКР-меченными олигонуклеотидами, содержащими комплементарные последовательности, с различными длинами цепи в присутствии наночастиц благородных металлов. Знак «звездочка» обозначает ГКР-метку, знак «молния» указывает на появление усиленного специфического сигнала ГКР.
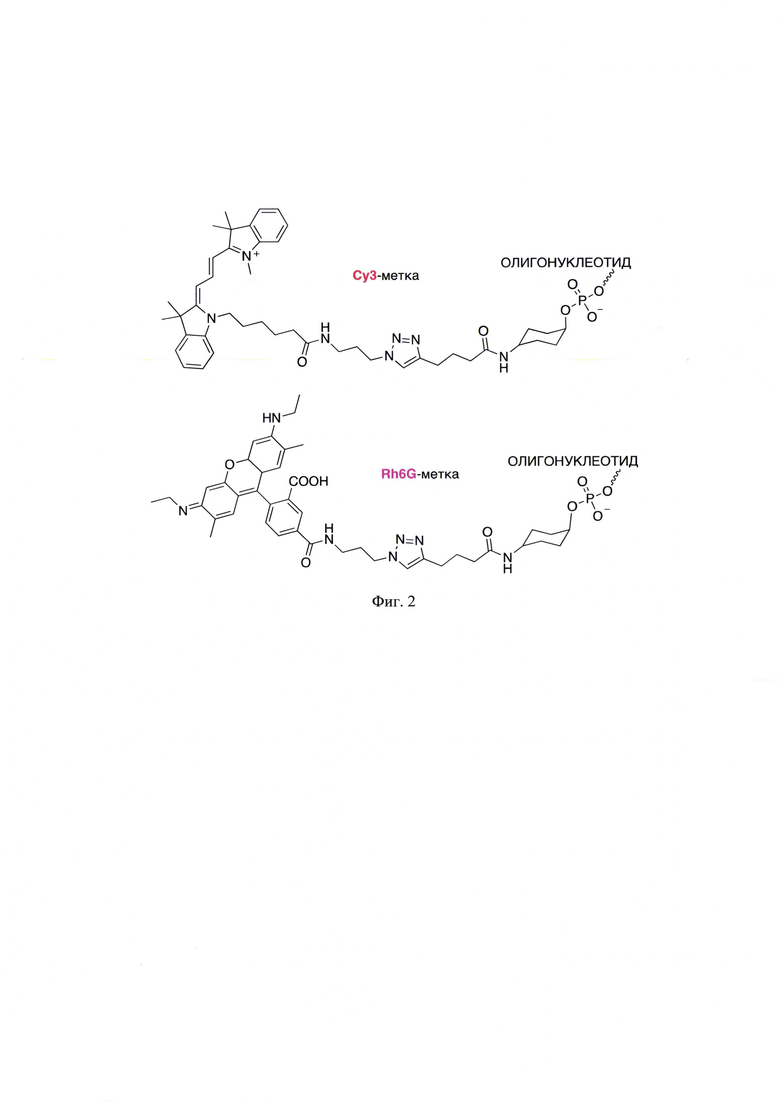
На фиг. 2 представлены структуры ковалентно меченных ГКР-индикаторами: R6G и Су3, олигонуклеотидов.
На фиг. 3 представлены типичные изображения, полученные методом сканирующей электронной микроскопии, иллюстрирующие морфологию наноструктурированных серебряных поверхностей, полученных пиролизом аэрозоля аммиачного комплекса серебра (а-е). Позициями на фигурах обозначены изображения с различными масштабами: а - 500 нм, б, г - 2 мкм, в - 50 мкм, д - 10 мкм, е - 20 мкм.
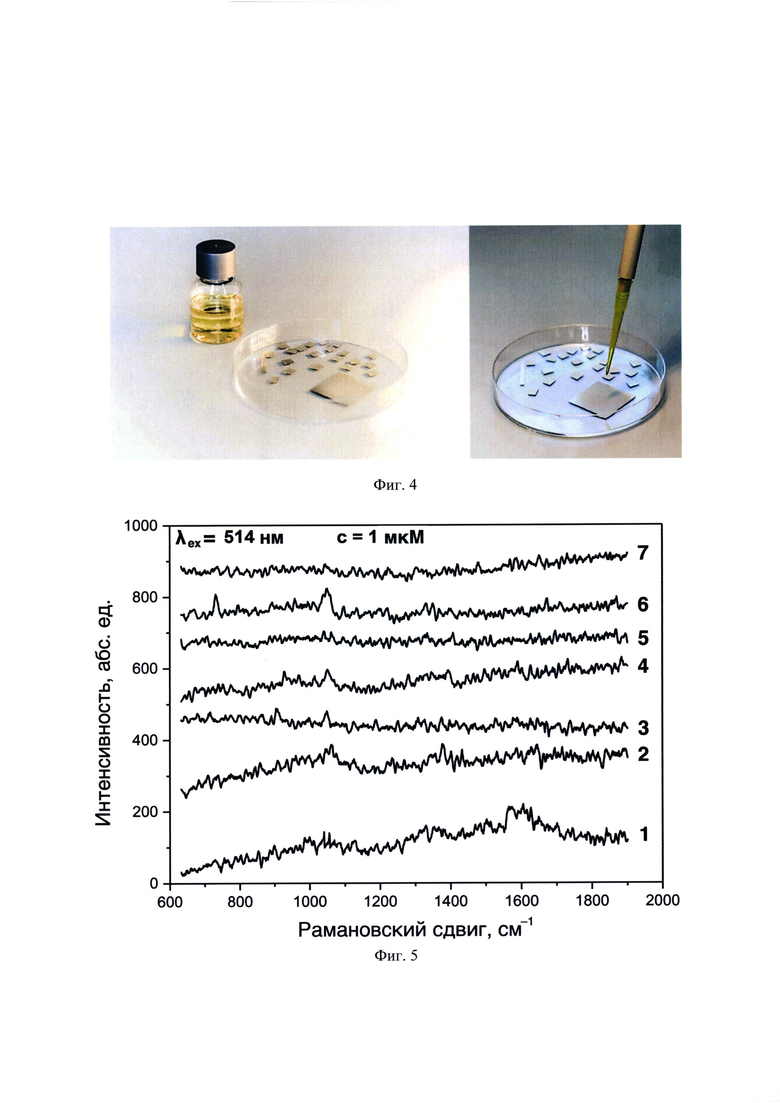
На фиг. 4 представлены фотографии подготовленных к анализу и исходных полученных пластинок, покрытых слоем наночастиц серебра.
На фиг. 5 представлены спектры ГКР фонового сигнала оптических планарных ГКР-сенсоров, полученные с использованием λех=514 нм. Позициями на фигурах обозначены спектры для образцов: 1 - ГКР-сенсорного покрытия без пробы и ГКР-сенсорного покрытия с нанесением гибридизованных с A/R6G проб: 2 - Якорь1, 3 - Якорь2, 4 - обратный комплементарный Якорь2, 5 - обратный комплементарный Промотор, и 6 - Якорь1-Промотор и 7 - Якорь2-Промотор, нанесенных в объеме 10 мкл и концентрации 1⋅10-6 М на планарную поверхность наночастиц серебра, полученных пиролизом аэрозоля аммиачного комплекса.
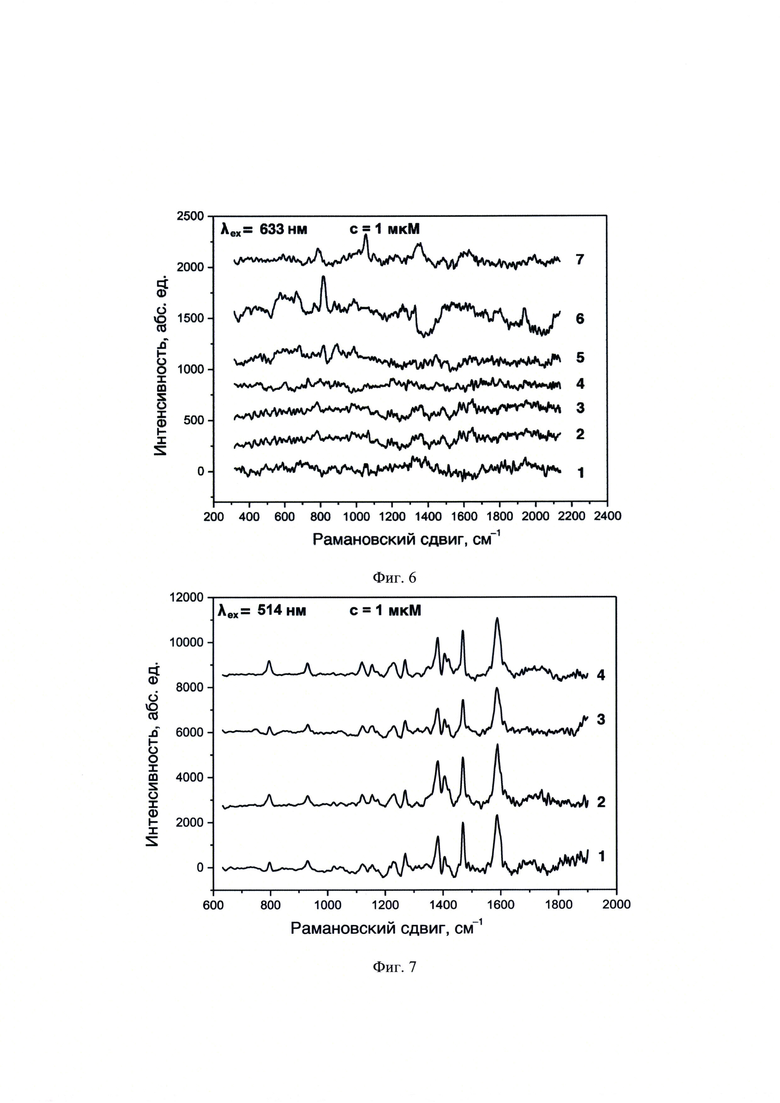
На фиг. 6 представлены спектры ГКР фонового сигнала оптических планарных ГКР-сенсоров, полученные с использованием λех=633 нм. Позициями на фигурах обозначены спектры для образцов: 1 - ГКР-сенсорного покрытия без пробы и ГКР-сенсорного покрытия с нанесением гибридизованных с A/R6G проб: 2 - Якорь1, 3 - Якорь2, 4 - обратный комплементарный Якорь2, 5 - обратный комплементарный Промотор, и 6 - Якорь1-Промотор и 7 - Якорь2-Промотор, нанесенных в объеме 10 мкл и концентрации 1⋅10-6 М на планарную поверхность наночастиц серебра, полученных пиролизом аэрозоля аммиачного комплекса.
На фиг. 7 представлены спектры ГКР, полученные с использованием λех=514 нм для образцов ГКР-меченных олигонуклеотидов, предварительно гибридизованных с Якорь1-Промотор. Позициями на фигурах обозначены спектры для образцов: 1 - А/Су3, 2 - В/Су3, 3 - С/Су3 и 4 - D/Су3, нанесенных в объеме 10 мкл и концентрации 1⋅10-6 М на планарную поверхность наночастиц серебра, полученных пиролизом аэрозоля аммиачного комплекса.
На фиг. 8 представлены зависимости интенсивностей при различных рамановских сдвигах ( 1382,
1382,  1469 и
1469 и  1590 см-1) для олигонуклеотидных остатков А/Су3, В/Су3, С/Су3 и D/Су3 концентрации 1⋅10-6 М (λех=514 нм).
1590 см-1) для олигонуклеотидных остатков А/Су3, В/Су3, С/Су3 и D/Су3 концентрации 1⋅10-6 М (λех=514 нм).
На фиг. 9 представлены спектры ГКР, полученные с использованием λех=633 нм для образцов ГКР-меченных олигонуклеотидов, предварительно гибридизованных с Якорь1-Промотор. Позициями на фигурах обозначены спектры для образцов: 1 - А/Су3, 2 - В/Су3, 3 - С/Су3 и 4 - D/Су3, нанесенных в объеме 10 мкл и концентрации 1⋅10-6 М на планарную поверхность наночастиц серебра, полученных пиролизом аэрозоля аммиачного комплекса.
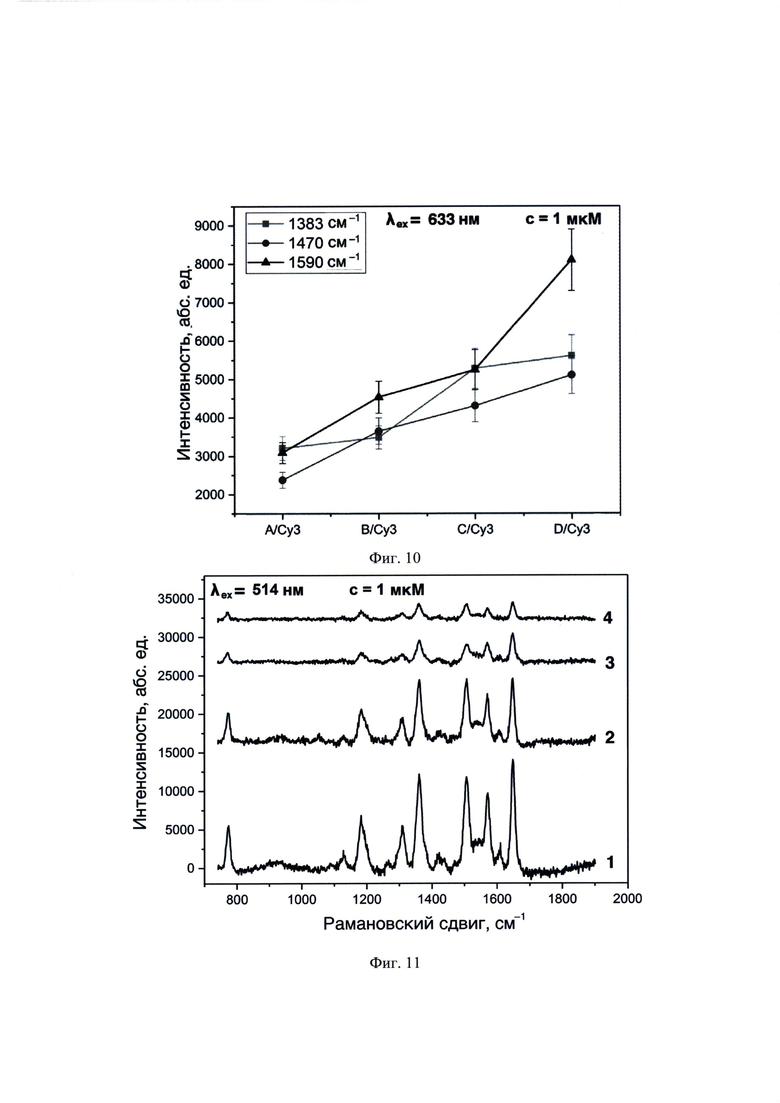
На фиг. 10 представлены зависимости интенсивностей при различных рамановских сдвигах ( 1383,
1383,  1470 и
1470 и  1590 см-1) для олигонуклеотидных остатков А/Су3, В/Су3, С/Су3 и D/Су3, гибридизованных с Якорь1-Промотором в концентрации 1⋅10-6 М (λех=633 нм).
1590 см-1) для олигонуклеотидных остатков А/Су3, В/Су3, С/Су3 и D/Су3, гибридизованных с Якорь1-Промотором в концентрации 1⋅10-6 М (λех=633 нм).
На фиг. 11 представлены спектры ГКР, полученные с использованием λех=514 нм для образцов ГКР-меченных олигонуклеотидов, предварительно гибридизованных с Якорь1 -Промотором. Позициями на фигурах обозначены спектры для образцов: 1 - A/R6G, 2 - B/R6G, 3 - C/R6G и 4 - D/R6G, нанесенных в объеме 10 мкл и концентрации 1⋅10-6 М на планарную поверхность наночастиц серебра, полученных пиролизом аэрозоля аммиачного комплекса.
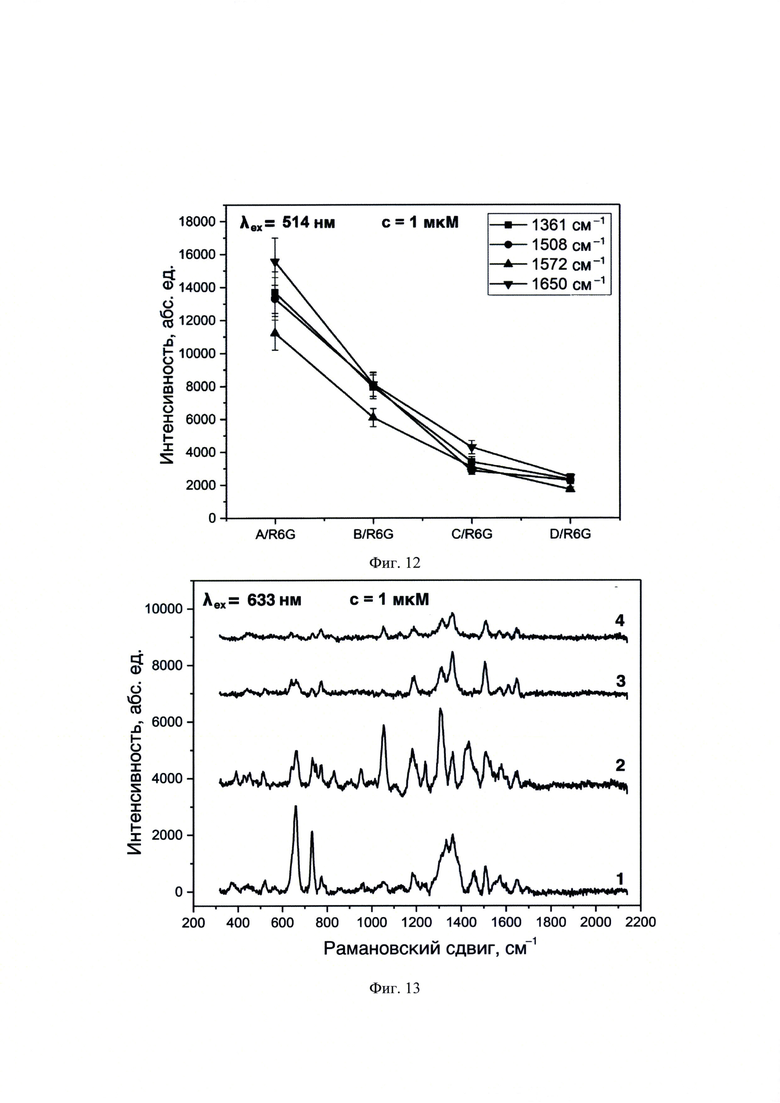
На фиг. 12 представлены зависимости интенсивностей при различных рамановских сдвигах ( 1361,
1361,  1508,
1508,  1572 и
1572 и  1650 см-1) для олигонуклеотидных остатков A/R6G, B/R6G, C/R6G и D/R6G, гибридизованных с Якорь1-Промотором в концентрации 1⋅10-6 М (λех=514 нм).
1650 см-1) для олигонуклеотидных остатков A/R6G, B/R6G, C/R6G и D/R6G, гибридизованных с Якорь1-Промотором в концентрации 1⋅10-6 М (λех=514 нм).
На фиг. 13 представлены спектры ГКР, полученные с использованием λex=633 нм для образцов ГКР-меченных олигонуклеотидов, предварительно гибридизованных с Якорь1-Промотором. Позициями на фигурах обозначены спектры для образцов: 1 - A/R6G, 2 - B/R6G, 3 - C/R6G и 4 - D/R6G, нанесенных в объеме 10 мкл и концентрации 1⋅10-6 М на планарную поверхность наночастиц серебра, полученных пиролизом аэрозоля аммиачного комплекса.
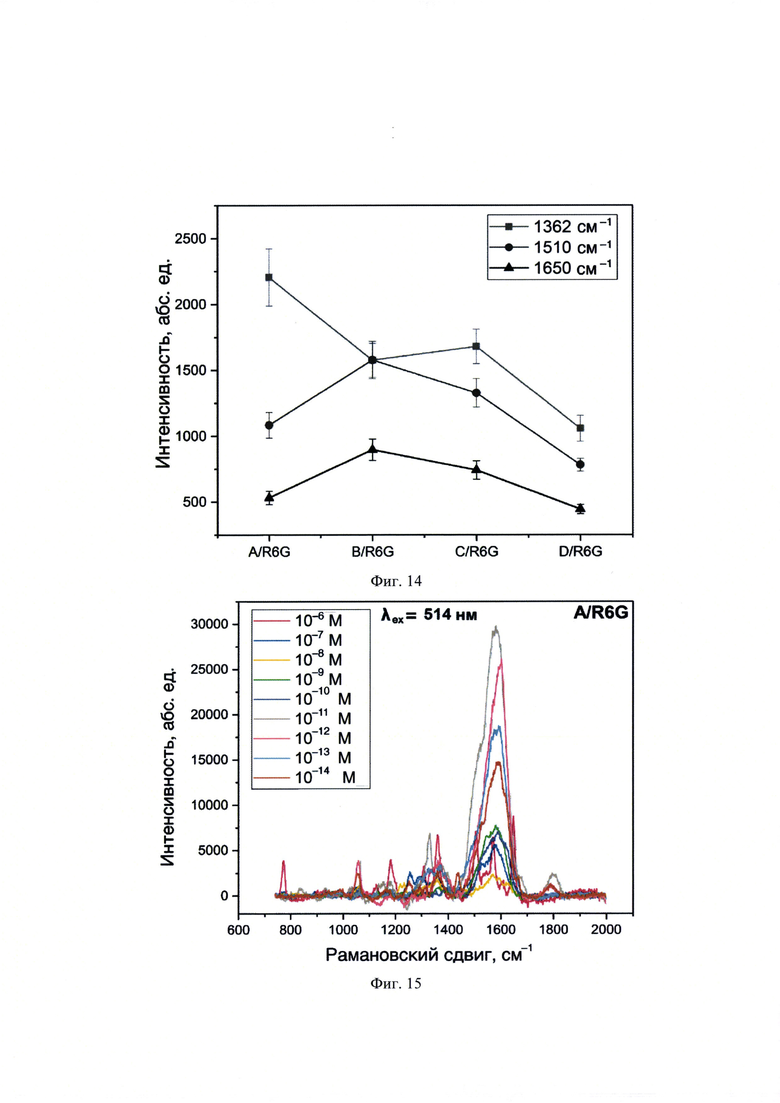
На фиг. 14 представлены зависимости интенсивностей при различных рамановских сдвигах ( 1362,
1362,  1510 и
1510 и  1650 см-1) для олигонуклеотидных остатков A/R6G, B/R6G, C/R6G и D/R6G концентрации 1⋅10-6 М (λех=633 нм).
1650 см-1) для олигонуклеотидных остатков A/R6G, B/R6G, C/R6G и D/R6G концентрации 1⋅10-6 М (λех=633 нм).
На фиг. 15 представлены спектры ГКР, полученные с использованием λех=514 нм для образца A/R6G, нанесенного в объеме 10 мкл и концентрациях 1⋅10-14-1⋅10-6 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
На фиг. 16 представлены спектры ГКР, полученные с использованием λех=514 нм для образца A/R6G, нанесенного в объеме 10 мкл и концентрациях 1⋅10-14-1⋅10-6 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
На фиг. 17 представлены спектры ГКР, полученные с использованием λех=514 нм для образца B/R6G, нанесенного в объеме 10 мкл и концентрацией 1⋅10-7 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
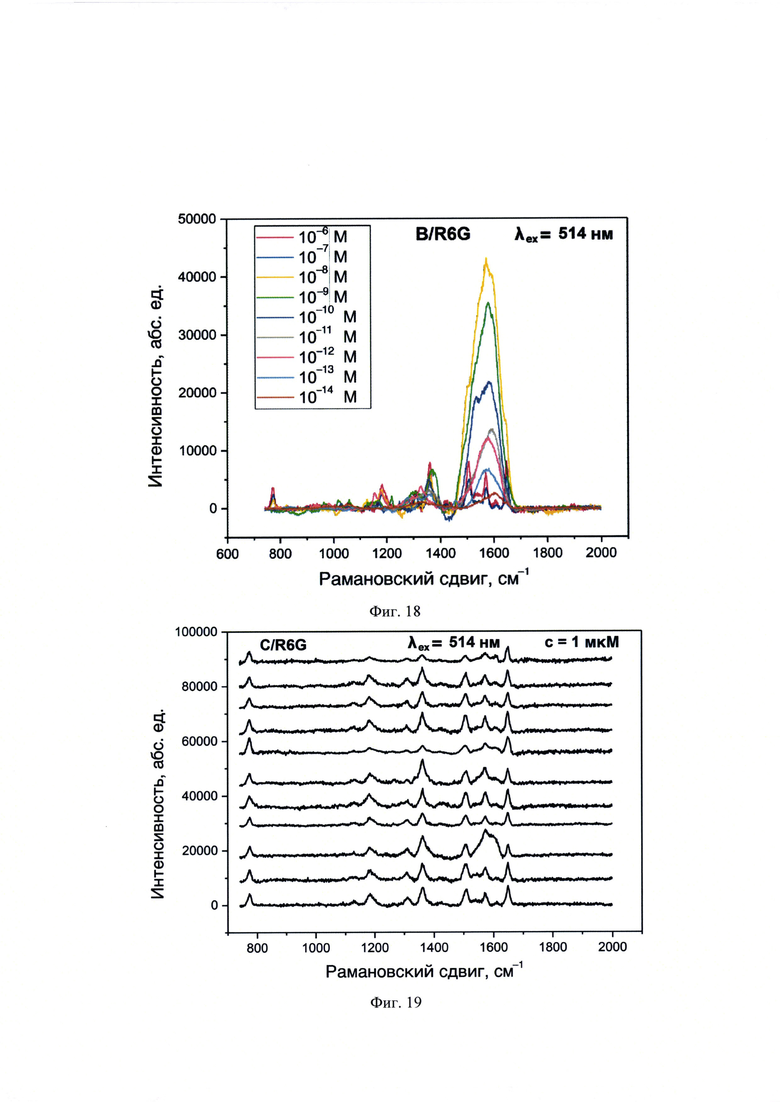
На фиг. 18 представлены спектры ГКР, полученные с использованием λех=514 нм для образца B/R6G, нанесенного в объеме 10 мкл и концентрациях 1⋅10-14-1⋅10-6 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
На фиг. 19 представлены спектры ГКР, полученные с использованием λех=514 нм для образца C/R6G, нанесенного в объеме 10 мкл и концентрацией 1⋅10-6 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
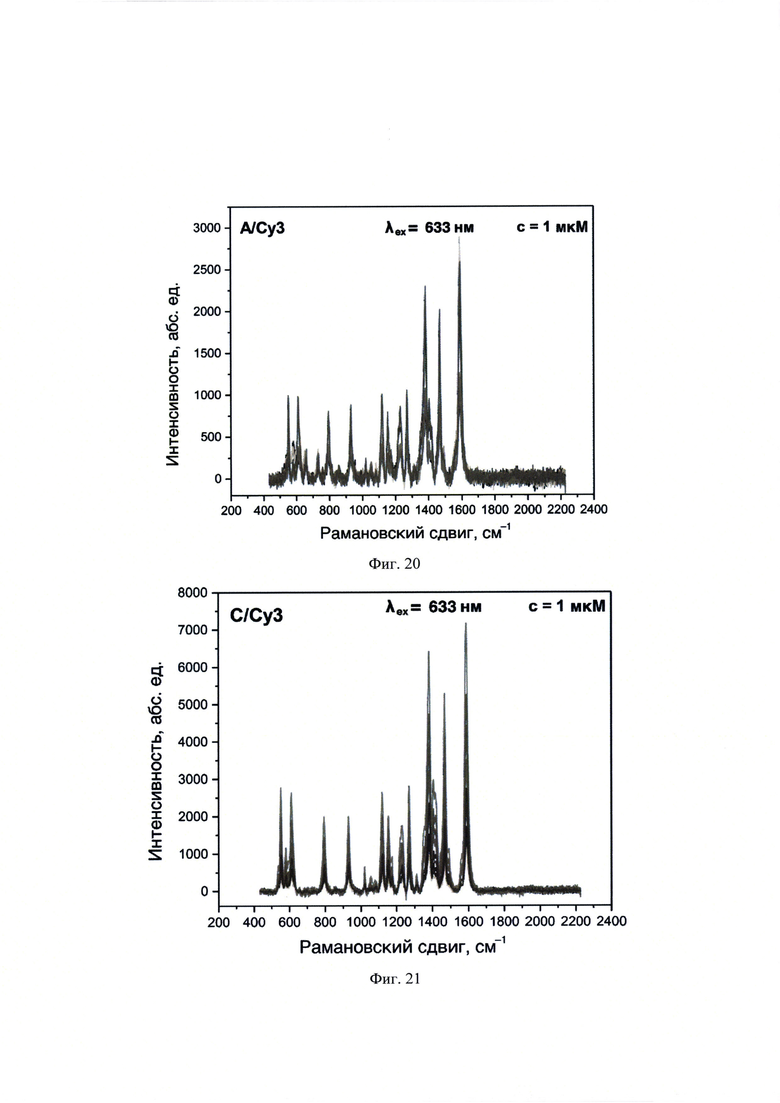
На фиг. 20 представлены спектры ГКР, полученные с использованием λех=633 нм для образца А/Су3, нанесенного в объеме 10 мкл и концентрацией 1⋅10-6 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
На фиг. 21 представлены спектры ГКР, полученные с использованием λех=633 нм для образца С/Су3, нанесенного в объеме 10 мкл и концентрацией 1⋅10-6 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
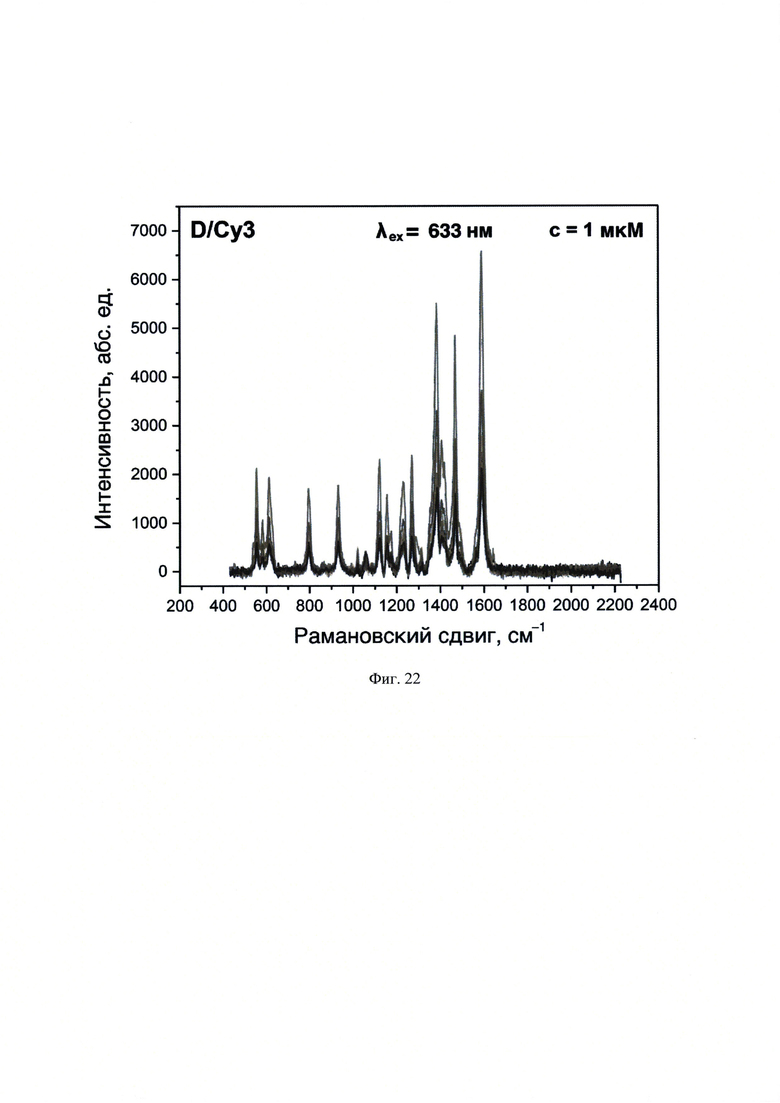
На фиг. 22 представлены спектры ГКР, полученные с использованием λех=633 нм для образца D/Су3, нанесенного в объеме 10 мкл и концентрацией 1⋅10-6 М на планарную поверхность НЧС, полученных пиролизом аэрозоля аммиачного комплекса.
Осуществление изобретения
В настоящем изобретении приняты следующие обозначения и термины:
ВЭЖХ - высокоэффективная жидкостная хроматография
ГКР - гигантское комбинационное рассеяние
ДМАА - диметиламиламин
ДМСО - диметилсульфоксид
ДМФА - диметилформамид
ДНК - дезоксирибонуклеиновая кислота
ДОК - диапазон определяемых концентраций
НЧС - наночастицы серебра
Обратный комплементарный Якорь/Промотор - олигонуклеотидная последовательность в обратном порядке нуклеотидов относительно последовательности, комплементарной последовательности Якорь/Промотор
ОФ-ВЭЖХ - обращенно-фазовая ВЭЖХ
ПО - предел обнаружения
Промотор - участок олигонуклеотидной последовательности, узнаваемый РНК-полимеразой как стартовая площадка для начала транскрипции (фиг. 1)
ПЦР - полимеразная цепная реакция
РЭМ - растровая электронная микроскопия
Спектр ГКР - спектр комбинационного рассеяния с сигналами, усиленными за счет эффекта поверхностного плазмонного резонанса на наноструктурах благородных металлов
Трис-HCl - раствор трисаминометана с соляной кислотой
ЭДТА - этилендиаминтетрацетат натрия
Якорь - участок олигонуклеотидной последовательности, взаимодействующий с наночастицами металла (фиг. 1)
А - аденин
С - цитозин
ESI-MS - масс-спектрометрия с ионизацией электрораспылением
G - гуанин
PAGE - денатурирующий полиакриловый гель
SERS - surface enhanced Raman spectroscopy
T - тимин
TAMRA - раствор трет-бутиламин/вода, 1:3 об./об.
ТВТА - трис(бензилтриазолил)амин
Химические символы / сокращения имеют свои обычные значения: °С (градус (градусы) Цельсия), нм (нанометр (нанометры)), мкм (микрометр (микрометры)), см (сантиметр (сантиметры)), мин (минута (минуты)), с (секунда (секунды)), мин (минута (минуты)), ч (час (часы)), мкл (микролитр (микролитры)), мкг (микрограмм (микрограммы)), М (моль (моли) в литре), мкМ (микромоль (микромоли) в литре), пМ (пикомоль (пикомоли) в литре), л (литр (литры)), мл (миллилитр (миллилитры)), мкл (микролитр (микролитры)), г (грамм (граммы)), мг (миллиграмм (миллиграммы)), моль (моли), ммоль (миллимоль (миллимоли)), масс. % (массовый процент (массовые проценты)), об. % (объемный процент (объемные проценты)), м.м. (молекулярная масса).
Заявляемый способ анализа состоит из трех ключевых этапов: подготовки наночастиц благородных металлов, выступающих в роли ГКР-усилителя; образования дуплекса ДНК-мишени с направленно выбранным ковалентно ГКР-меченным комплементарным олигонуклеотидом; нанесения пробы с исследуемым соединением на поверхность наночастиц жидкой пробы с исследуемым соединением с образованием направленно упорядоченной за счет нековалентных взаимодействий структуры (фиг. 1), включающей определяемую ДНК, ГКР-метку и олигонуклеотид; детектирование полученного гибридизированного ГКР-меченного дуплекса (фиг. 2), методом спектроскопии гигантского комбинационного рассеяния и о качественном и количественном содержании определяемой ДНК судят по положению и интенсивности полос на регистрируемых спектрах. При этом в качестве материала-носителя может быть выбран любой другой из диэлектрических химически инертных материалов, в частности наиболее распространенных для этой цели материалов, таких как оксид алюминия, оксид магния, диоксид кремния, целлюлоза, диоксид циркония, что существенно не изменит эффект, а в качестве ГКР-усилителя могут быть выбраны любые наночастицы благородных металлов, размерами 20-90 нм, имеющие полосу плазмонного резонанса в области 420-650 нм и способные усиливать сигнал комбинационного рассеяния модельных ГКР-индикаторов: R6G и Су3, в концентрации не более 1⋅10-8 М.
В качестве ГКР-меченного олигонуклеотида выбирают олигонуклеотид, комплементарный по последовательности нуклеиновых кислот к ДНК-мишени (по принципу комплементарного соответствия нуклеиновых кислот: А (аденин) - Т (тимин) и G (гуанин) - С (цитозин)), при этом предпочтительно использовать олигонуклеотид, состоящий из 25-75 нуклеиновых кислот (Якорь: 15-25 нуклеиновых кислот и Промотор: 10-50 нуклеиновых кислот), что обеспечивает длину олигонуклеотида 10-50 А и расстояние ГКР-метки 1-5 нм от поверхности наночастиц благородных металлов.
Детектирование полученного гибридизированного ГКР-меченного дуплекса, методом спектроскопии гигантского комбинационного рассеяния осуществляется на коммерчески доступных КР-спектрометрах с хотя бы одним источником монохроматического излучения в видимом диапазоне: 500-1100 нм. О качественном и количественном содержании ДНК судят по наличию и интенсивности характеристических полос на регистрируемых спектрах ГКР, а именно при характеристических рамановских сдвигах: ок. 1360, 1380,1470, 1510, 1570, 1590 и 1650 см-1.
Представленные ниже примеры конкретного осуществления изобретения приведены для предоставления специалистам в данной области техники полного описания проведения и применения анализа по изобретению, но не ограничивают предполагаемый авторами изобретения объем изобретения.
Все приведенные ниже реагенты являются коммерчески доступными. Все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С; в ходе всех экспериментов для приготовления водных растворов и промывки суспензий использовали деионизированную воду высокой чистоты, очищенную с использованием установки «Milli-Q», «МПИроге»; спектры ГКР зарегистрированы на КР-спектрометре «Renishaw inVia Reflex» с фокусным расстоянием 250 мм, размером пятна лазера 1-300 мкм, при этом все спектры ГКР сняты с использованием 50×-го объектива и с временем экстинкции 10 с, юстировку прибора проводили с использованием монокристаллических пластин кремния в качестве стандарта; оптические фотографии снимались на конфокальном микроскопе «Leica DMLM» с разрешением до 2.5 мкм; разделение неоднородных систем проводилось с помощью центрифуги «Centrifuge 5804», «Eppendorf»; для фильтрования использовали насосный фильтр «MillexLCR» («Millipore», с порами 450 мкм); взвешивание препаратов проводили с точностью ±0.02 мг на аналитических весах «Discovery», «OHAUS»; точные объемы жидкостей отбирали с использованием автоматических дозаторов «Eppendorf» с диапазонами объемов: 2-20, 10-100, 20-200, 100-1000 и 500-5000 мкл; гомогенизацию неоднородных систем ультразвуковым облучением проводили в УЗ-ванне «Elmasonic Р», «Elma», механическую гомогенизацию неоднородных систем проводили с использованием или мини-ротатора «Bio RS-24», «BioSan», или планетарной мельницы «PULVERISETTE», «FRITSCH», или магнитной мешалки «RCT basic», «IKA» с возможностью подогрева.
Пример 1. Способ селективного детектирования заданного фрагмента ДНК с олигонуклеотидом, меченным ГКР-индикатором Су3
В качестве ГКР-усилителя использовали планарный оптический ГКР-сенсор, представляющий собой нанесенные на поверхность тонкой стеклянной пластинки наночастицы серебра до толщины не более 10 мкм. Получение наночастиц осуществляли следующим образом: к 100 мл свежеприготовленного 0.17 М водного раствора нитрата серебра по каплям со стеклянной палочки при постоянном перемешивании добавляли ~ 30 мл 0.1 М водного раствора гидроксида натрия до полного выпадения черно-коричневого осадка оксида серебра(I):
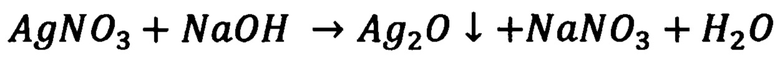
Затем осадок Ag2O тщательно промывали деионизованной водой (трижды порциями по 100 мл воды), далее добавляли 100 мл воды и по каплям 7 мл концентрированного раствора аммиака при постоянном перемешивании для образования водного раствора аммиачного комплекса серебра:
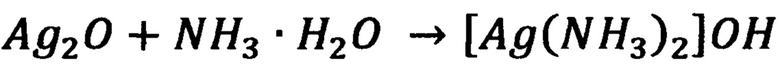
После полного растворения осадка дополнительно добавляли 25 мл концентрированного раствора аммиака для предотвращения выпадения оксида серебра(I) в процессе аэрозольного распыления аммиачного комплекса.  количества аммиака существенно ухудшали микроструктуру образующихся в процессе пиролиза серебряных колец. Полученный раствор разбавляли до 170 мл водой. Прозрачный 0.01 М раствор комплекса серебра фильтровали через мембранный фильтр, затем разбавляли в 8 раз водой до концентрации [Ag(NH3)2]OH 12.5 мМ. В контейнер установки ультразвукового аэрозольного ингалятора переносили 50 мл конечного раствора. Два покровных стекла предварительно отмывали в ацетонитриле и нагревали на дне химического стакана до 290-320°С. На неубалайзер устанавливали патрубок-переходник с диаметром ~1 см. Использовали параметры распыления: 7 на «УЗ» и 1 на «Воздух». Таким образом, серебро наносили на поверхность покровного стекла ультразвуковым серебряным дождем аммиачного комплекса серебра(I). Сначала серебро распылялось в виде тумана, затем в виде капель размером 1-5 мкм, которые при попадании на нагретую до 290-320°С поверхность стекла испарялись. При этом протекали следующие реакции:
количества аммиака существенно ухудшали микроструктуру образующихся в процессе пиролиза серебряных колец. Полученный раствор разбавляли до 170 мл водой. Прозрачный 0.01 М раствор комплекса серебра фильтровали через мембранный фильтр, затем разбавляли в 8 раз водой до концентрации [Ag(NH3)2]OH 12.5 мМ. В контейнер установки ультразвукового аэрозольного ингалятора переносили 50 мл конечного раствора. Два покровных стекла предварительно отмывали в ацетонитриле и нагревали на дне химического стакана до 290-320°С. На неубалайзер устанавливали патрубок-переходник с диаметром ~1 см. Использовали параметры распыления: 7 на «УЗ» и 1 на «Воздух». Таким образом, серебро наносили на поверхность покровного стекла ультразвуковым серебряным дождем аммиачного комплекса серебра(I). Сначала серебро распылялось в виде тумана, затем в виде капель размером 1-5 мкм, которые при попадании на нагретую до 290-320°С поверхность стекла испарялись. При этом протекали следующие реакции:
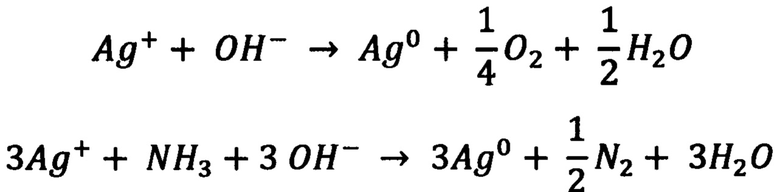
В процессе нанесения серебра сохраняли расстояние от сопла до пластинок 1.5-2 см. Сопло перемещали медленными, равномерными круговыми движениями по всей поверхности пластин. Распыление проводили по 5 мин с перерывом на 5 мин для полного прогрева поверхности покровного стекла. После расходования всего объема аммиачного комплекса серебра полученные пластинки дополнительно выдерживали при нагреве в течение 15 мин. Морфологию получаемых сенсорных наноструктурированных поверхностей контролировали методами сканирующей электронной микроскопии (СЭМ) и просвечивающей электронной микроскопии (ПЭМ) (фиг. 3). Затем полученные пластинки 24×24 мм2 нарезали алмазным надфилем на сенсорные поверхности размером 4×4 мм2 (фиг. 4).
На следующей стадии проводили процедуру гибридизации определяемой ДНК путем добавления олигонуклеотида, ковалентно меченного ГКР-индикатором с направленно подобранной последовательностью НК, что гарантирует селективность анализа, а интенсивность полос, свойственная для ГКР-индикаторов и контролируемое расстояние от ГКР-метки до поверхности наноструктур металла, обеспечивает высокую чувствительность анализа. Для получения меченных последовательностей олигонуклеотидов (фиг. 2) использовали автоматизированную методику синтеза, приведенную в работе авторов [V.М. Farzan, Е.A. Ulashchik, Y.V. Martynenko-Makaev, М.V. Kvach, I.О. Aparin, V.A. Brylev, Т.A. Prikazchikova, S.Y. Maklakova, A.G. Majouga, A.V. Ustinov, G.A. Shipulin, V.V. Shmanai, V.A. Korshun and T.S. Zatsepin. Automated solid-phase click synthesis of oligonucleotide conjugates: From small molecules to diverse n-acetylgalactosamine clusters. Bioconjug. Chem. 2017. V. 28. P. 2599-2607]. 5'-Алкин-модифицированные олигонуклеотиды получали в синтезаторах олигонуклеотидов ASM-2000 («Biosset») или ММ-12 («Bioautomation») с использованием амидофосфитного метода. Защищенные 2'-дезоксирибонуклеозид-3'-фосфорамидиты, Unylinker-CPG (500  ) и S-этилтио-1H-тетразол были приобретены у «ChemGenes». Раствор азида 6-R6G (100 мМ) и медного катализатора CuI⋅Р(OEt)3 (100 мМ) в апротонном биполярном растворителе (диметилсулфоксиде (ДМСО), диметилфорамиде (ДМФА) или диметиламиламине (ДМАА), 100 мкл) добавляли к 5'-алкин-модифицированным олигонуклеотидам, связанным с твердой фазой в колонке (1 мкмоль) 5 раз каждые 30 мин. Через 3 ч твердый носитель тщательно промывали (10×150 мкл ДМСО, затем 3×150 мкл ацетонитрила) с последующим снятием защиты у цианоэтильных групп (2×10% диэтиламина в ацетонитриле (10 мин) и полное снятие защиты с использованием смеси TAMRA (трет-бутиламин/вода, 1:3 об./об.) при 55°С в течение ночи. Раствор выпаривали и аликвоту анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) и масс-спектрометрии с электрораспылительной ионизацией (ESI-MS).
) и S-этилтио-1H-тетразол были приобретены у «ChemGenes». Раствор азида 6-R6G (100 мМ) и медного катализатора CuI⋅Р(OEt)3 (100 мМ) в апротонном биполярном растворителе (диметилсулфоксиде (ДМСО), диметилфорамиде (ДМФА) или диметиламиламине (ДМАА), 100 мкл) добавляли к 5'-алкин-модифицированным олигонуклеотидам, связанным с твердой фазой в колонке (1 мкмоль) 5 раз каждые 30 мин. Через 3 ч твердый носитель тщательно промывали (10×150 мкл ДМСО, затем 3×150 мкл ацетонитрила) с последующим снятием защиты у цианоэтильных групп (2×10% диэтиламина в ацетонитриле (10 мин) и полное снятие защиты с использованием смеси TAMRA (трет-бутиламин/вода, 1:3 об./об.) при 55°С в течение ночи. Раствор выпаривали и аликвоту анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) и масс-спектрометрии с электрораспылительной ионизацией (ESI-MS).
Полученные олигонуклеотиды дважды очищали денатурирующим полиакриловым гелем (PAGE), а затем методом обращенно-фазовой ВЭЖХ и (ОФ-ВЭЖХ). Гель-электрофорез денатурированных олигонуклеотидов проводили в 15% PAGE, содержащем 7 М мочевины в трис-боратном буфере (50 мМ Трис-HCl, 50 мМ борная кислота, 1 мМ этилендиаминтетрацетат натрия (ЭДТА), рН 8.3). Олигонуклеотиды извлекали из геля путем электроэлюции с помощью Elutrap (Whatman) в трис-боратном буфере (5 мМ Трис-HCl, 5 мМ борная кислота, 0.1 мМ ЭДТА, рН 8.3). Анализ методом ВЭЖХ и очистку олигонуклеотидов проводили с использованием хроматографической колонны 2.1×50 мм Jupiter С18 (5 мкм, «Phenomenex»), буфера А: 10 мМ диизопропиламин и 15 мМ 1,1,1,3,3,3-гексафторизопропанол и буфера Б: 10 мМ диизопропиламин, 15 мМ 1,1,1,3,3,3-гексафторизопропанол и 80% ацетонитрил. Соли промывали буфером А (4 цикла), а затем 100% буфера Б (2 цикла) при скорости потока 0.3 мл/мин и температуре 45°С. Структуру полученных олигонуклеотидов подтверждали методом ESI-MS с использованием системы Agilent 1260-Bruker Maxis Impact. Масс-спектрометрический анализ олигонуклеотидов проводился в отрицательном режиме (капиллярное напряжение 3500 В), и регистрируемые спектры пересчитывали методом максимальной энтропии.
Полученный 5'-алкин-модифицированных олигонуклеотид модифицировали малыми молекулами ГКР-индикаторов. Полученный олигонуклеотид готовили в твердой фазе и связывали с 5'-алкинфосфорамидитом. Клик-модификацию проводили на твердой фазе путем добавления 10 мМ раствора азида, 100 мМ CuI⋅Р(OEt)3 4×100 мкл (азида 2 экв.) в течение 4 ч с последующим промыванием. В большинстве случаев олигонуклеотиды отщепляли от носителя и снимали защиту в синтезаторе, используя 1,2-этилендиамин/толуол, 1:1 об./об., в течение 2 ч при комнатной температуре с последующим промыванием (4×150 мкл ацетонитрила) и элюирование 50% ацетонитрилом в воде или снятие защиты с использованием раствора АМА (концентрированный водный аммиак и 40% водный метиламин, 1:1 об./об.) в течение 30 мин при 65°С. В случае R6G снятие защиты проводили с использованием раствора TAMRA при 55°С в течение ночи. В случае Су5 использовали две схемы снятия защиты (концентрированный водный раствор аммиака при комнатной температуре в течение 2 и 18 ч). Для переключения фазы раствора 5'-алкин-модифицированный олигонуклеотид (2 нмоль) растворяли в 1 М ацетате триэтиламмония (30 мкл). Затем добавляли 20 мкл раствора медного катализатора в 60% ДМСО (15 мМ трис(бензилтриазолил)амин (ТВТА) и 13 мМ сульфата меди (II)), а затем 4 мкл 10 мМ азида Су5 в ДМСО и 140 мкл 80% ДМСО. Раствор дегазировали и дважды заполняли аргоном в вакуумном центрифужном концентраторе, а затем добавляли дегазированный раствор аскорбиновой кислоты (0.25 М, 6 мкл). Реакционную смесь оставляли на ночь при комнатной температуре, и олигонуклеотидный продукт осаждали 4% LiClO4 в ацетоне (1 мл). Очистку и анализ методом ВЭЖХ проводили, как описано выше.
При выборе последовательности НК в структуре ГКР-меченного олигонуклеотида руководствовались его комплементарностью определяемой ДНК: А (аденин) - Т (тимин), G (гуанин) - С (цитозин) для последующего образования водородных связей в парных комплексах (дуплексах) с длиной Якоря 15-25 нуклеиновых кислот и длиной Промотора 10-50 нуклеиновых кислот. В качестве модельной определяемой ДНК рассмотрена структура Якорь1-Промотор (табл. 1, фиг. 1), повреждение в которой обозначено «с» и встречается при раке мочевого пузыря [Avogbe Р.Н., Manel A., Vian Е., Durand G., Forey N., Voegele C, Zvereva M., Hosen I., Meziani S., De Tilly В., Polo G., Lole O., Francois P., Delhomme T.M., Carreira C, Monteiro-Reis S., Henrique R., Abedi-Ardekani В., Byrnes G., Foil M., Weiderpass E., McKay J., Jeronimo C, Scelo G., Le Calvez-Kelma F. Urinary TERT promoter mutations as non-invasive biomarkers for the comprehensive detection of urothelial cancer. EBioMedicine 2019. V. 44. P. 431-438]. Конкретные определяемые последовательности нуклеиновых кислот и поврежденных фрагментов задаются типом диагностируемого заболевания согласно ранее известным данным биохимических исследований [Descotes F., Kara N., Decaussin-Petrucci M., Piaton E., Geiguer F., Rodriguez-Lafrasse C, Terrier J.E., Lopez J., Ruffion A. Non-invasive prediction of recurrence in bladder cancer by detecting somatic TERT promoter mutations in urine Br. J. Cane. V. 117. P. 583-587].
К структуре выбранной ДНК комплементарны следующие олигонуклеотиды: A/R6G, А/Су3, B/R6G, В/Су3, C/R6G, С/Су3, D/R6G и D/Су3, которые отличаются либо природой ГКР-метки (R6G или Су3), либо длиной последовательности (А, В, С или D) (табл. 1). В качестве побочных присутствующих последовательностей ДНК рассмотрены обратный комплементарный Якорь1 (аналогичной длины, но отличной последовательности НК), обратный комплементарный Промотор (отличной длины и отличной последовательности НК) и Якорь1-Промотор (отличной длины, но с присутствием аналогичного по последовательности НК фрагмента) (табл. 1). Гибридизацию проводили путем нагревания эквимолярной смеси мишени и ГКР-меченного олигонуклеотида от 23 до 95°С, выдерживали при 95°С в течение 5 мин, затем охлаждали до 23°С. Гибридизированные обратный комплементарный Якорь1, обратный комплементарный Промотор и Якорь1 с комплементарными ГКР-меченными фрагментами олигонуклеотидов: A/R6G, А/Су3, B/R6G, В/Су3, C/R6G, С/Су3, D/R6G и D/Су3 на спектрах ГКР имеют только фоновые сигналы с использованием лазерного излучения λех=514 и 633 нм (фиг. 5 и 6). Наноструктуры серебра на спектрах ГКР также не обладают собственными интенсивными полосами с использованием лазерного излучения λех=514 и 633 нм (фиг. 5 и 6). Не гибридизированный с комплементарным ГКР-меченным олигонуклеотидом Якорь1 не имел характеристических полос аналитических сигналов с использованием лазерного излучения λех=514 и 633 нм (фиг. 5 и 6).

Спектры ГКР для образца ДНК Якорь1-Промотор, гибридизованного с олигонуклеотидами, ковалентно меченными Су3 при λех=514 нм имели одинаковое положение характеристических пиков: 1382, 1469 и 1590 см-1, вне зависимости от длины олигонуклеотида (фиг. 7). При изменении длины олигонуклеотида возникал различный коэффициент усиления сигналов ГКР (фиг. 8), что свидетельствовало о различных расстояниях между ГКР-меткой и поверхностью наноструктур, и, как следствие, подтверждало закрепление и гибридизацию ДНК и упорядоченное расположение аналита по поверхности наноструктур (фиг. 1).
Спектры ГКР для образца ДНК Якорь1-Промотор, гибридизованного с олигонуклеотидами, ковалентно меченными Су3 при λех=633 нм имели одинаковое положение характеристических пиков: 1383, 1470 и 1590 см-1, вне зависимости от длины олигонуклеотида (фиг. 9). При изменении длины олигонуклеотида возникал различный коэффициент усиления сигналов ГКР (фиг. 10), что свидетельствовало о различных расстояниях между ГКР-меткой и поверхностью наноструктур, и, как следствие, подтверждало закрепление и гибридизацию ДНК (фиг. 1). Вывод о присутствии ДНК с заданной последовательностью НК делали по присутствию на спектрах ГКР перечисленных характеристических сигналов.
Для детектирования анализируемых веществ с концентрациями 10-14-10-2 М используют жидкие пробы объемом 10-30 мкл путем их накалывания на поверхность сенсора. Для обеспечения высокой скорости анализа при большом отношении сигнал/шум и отсутствии появления ложной спектральной информации, мощность лазерного излучения не превышает 10% от номинальной величины при продолжительности набора спектров ДНК в составе ГКР-меченного дуплекса не более 10 с. Превышение указанных параметров может привести к фотоповреждению образца.
Пример 2. Способ селективного детектирования заданного фрагмента ДНК с олигонуклеотидом, меченным ГКР-индикатором R6G
Анализ проводился аналогично примеру 1 с отличием в том, что в качестве ГКР-индикатора, ковалентно закрепленного на олигонуклеотиде, использовали R6G.
Спектры ГКР для образца ДНК Якорь1-Промотор, гибридизованного с олигонуклеотидами, ковалентно меченными R6G при λех=514 нм имели одинаковое положение характеристических пиков: 1361, 1508, 1572 и 1650 см-1, вне зависимости от длины олигонуклеотида (фиг. 11). При изменении длины олигонуклеотида возникал различный коэффициент усиления сигналов ГКР (фиг. 12), что свидетельствовало о различии в расстояниях между ГКР-меткой и поверхностью наноструктур, и, как следствие, подтверждало закрепление и гибридизацию ДНК и упорядоченное расположение аналита по поверхности наноструктур (фиг. 1).
Спектры ГКР для образца ДНК Якорь1-Промотор, гибридизованного с олигонуклеотидами, ковалентно меченными R6G при λех=633 нм имели одинаковое положение характеристических пиков: 1362, 1510 и 1650 см-1, вне зависимости от длины олигонуклеотида (фиг. 13). При изменении длины олигонуклеотида возникал различный коэффициент усиления сигналов ГКР (фиг. 14), что свидетельствовало о различных расстояниях между ГКР-меткой и поверхностью наноструктур, и, как следствие, подтверждало закрепление и гибридизацию ДНК (фиг. 1). Вывод о присутствии ДНК с заданной последовательностью НК делали по присутствию на спектрах ГКР перечисленных характеристических сигналов.
Пример 3. Способ селективного определения заданного фрагмента ДНК с олигонуклеотидом, меченным ГКР-индикатором R6G с концентрацией в интервале 10-14-10-6 М
Анализ проводился аналогично примеру 1 с отличием в том, что в качестве металлических наночастиц использовали частицы серебра, полученные следующим образом: при непрерывном интенсивном перемешивании к 90 мл 1.11⋅10-3 М нитрата серебра быстро добавляли 10 мл раствора гидроксиламин гидрохлорида (1.5⋅10-2 М) с гидроксидом натрия (3⋅10-2 М). Получали НЧС с максимумом поглощения при 418 нм с шириной на полувысоте ~100 нм и достаточно монодисперсным распределением НЧС по размерам (d ≈ 34 нм). Спектры ГКР для образца ДНК Якорь1-Промотор, гибридизованного с олигонуклеотидами, ковалентно меченными R6G при λех=514 нм имели идентичное с примером 1 положение характеристических пиков. При этом изменяли содержание определяемого Якорь1 в интервале концентраций 10-14-10-6 М в присутствии ГКР-меченного олигонуклеотида A/R6G (фиг. 15 и 16), B/R6G (фиг. 17 и 18), C/R6G (фиг. 19) и D/R6G. Равномерность распределения целевого аналита продемонстрирована регистрацией 30 спектров ГКР в разных точках по поверхности ГКР-сенсорного элемента (диаметр пятна лазера составлял ок. 3 μм, площадь ГКР-сенсорного элемента во всех примерах ок. 16 см2) с воспроизведением интенсивностей сигналов при характеристических для ГКР-меченных олигонуклеотидов рамановских сдвигах на регистрируемых спектрах (фиг. 17 и 19). Воспроизводимость аналитических сигналов составляла менее 5% (фиг. 17 и 19). Вывод о качественном составе и количественном содержании осуществляли по наличию характеристических полос на спектрах ГКР и интенсивности полученных сигналов по градуировочным зависимостям (табл. 2) соответственно.
Пример 4. Способ селективного определения заданного фрагмента ДНК с олигонуклеотидом, меченным ГКР-индикатором Су3 с концентрацией в интервале 10-14-10-6 М
Анализ проводился аналогично примеру 1 с отличием в том, что в качестве металлических наночастиц использовали частицы серебра, полученные следующим образом: при непрерывном интенсивном перемешивании к 90 мл раствора гидроксиламин гидрохлорида (1.67⋅10-3 М) с гидроксидом натрия (3.33⋅10-3 М) добавляли 10 мл раствора 1⋅10-2 М нитрата серебра. Предполагалось получение НЧС с максимумом поглощения при 408 нм с шириной на полувысоте ~80 нм и достаточно монодисперсным распределением НЧС по размерам (d ≈ 23 нм). В получаемых золях серебра окончательная кислотность среды была нейтральная, рН 7. Реакция восстановления протекала моментально, в течение нескольких секунд. Коллоиды серебра проявляли ГКР-активность сразу после их синтеза. Спектры ГКР для образца ДНК Якорь1-Промотор, гибридизованного с олигонуклеотидами, ковалентно меченными Су3 при λex=633 нм имели идентичное с примером 1 положение характеристических пиков. В качестве модельной определяемой ДНК рассмотрена структура Якорь2-Промотор (табл. 1), которая имеет в своей структуре фрагмент Якорь1-Промотор. К структуре выбранной ДНК комплементарны следующие олигонуклеотиды: A/R6G, А/Су3, B/R6G, В/Су3, C/R6G, С/Су3, D/R6G и D/Су3, которые отличаются либо природой ГКР-метки (R6G или Су3), либо длиной последовательности (А, В, С или D) (табл. 1). В качестве побочной присутствующей последовательности ДНК рассмотрена обратный комплементарный Якорь2 (аналогичной длины, но отличной последовательности НК) (табл. 1). Гибридизацию проводили путем нагревания эквимолярной смеси мишени и ГКР-меченного олигонуклеотида от 23 до 95°С, выдерживали при 95°С в течение 5 мин, затем охлаждали до 23°С. Гибридизированная последовательность обратный комплементарный Якорь2 с комплементарными ГКР-меченными фрагментами олигонуклеотидов: A/R6G, А/Су3, B/R6G, В/Су3, C/R6G, С/Су3, D/R6G и D/Су3 на спектрах ГКР имеют только фоновые сигналы с использованием лазерного излучения λех=514 и 633 нм (фиг. 5 и 6). Не гибридизированный с комплементарным ГКР-меченным олигонуклеотидом Якорь2-Промотор не имел характеристических полос аналитических сигналов с использованием лазерного излучения λех=514 и 633 нм (фиг. 5 и 6). В идентичных условиях изменяли содержание определяемого Якорь2-Промотор в интервале концентраций 10-14-10-6 М в присутствии ГКР-меченного олигонуклеотида А/Су3 (фиг. 20), В/Су3, С/Су3 (фиг. 21) и D/Су3 (фиг. 22). Воспроизводимость аналитических сигналов составляла менее 5%. Вывод о качественном составе и количественном содержании осуществляли по наличию характеристических полос на спектрах ГКР и интенсивности полученных сигналов по градуировочным зависимостям соответственно (табл. 2).
Как видно из приведенных примеров, в то время как известные способы давали возможность невоспроизводимого определения лишь отдельных ДНК за достаточно продолжительное время анализа, составлявшее в ряде случаев до нескольких часов с использованием дорогостоящего и громоздкого оборудования, заявленный нами способ анализа позволяет предконцентрировать и селективно связывать анализируемое вещество, обнаруживать ДНК за счет оптических явлений, в том числе на поверхности наночастиц с использованием ковалентных и нековалентных взаимодействий.
Для детектирования ДНК, присутствующих в пробе на уровне концентраций 10-14-10-2 М, предпочтительно использовать жидкие пробы объемом 10-50 мкл путем их накалывания на поверхность наночастиц благородного металла.
Для обеспечения высокой экспрессности анализа при высоком отношении сигнал / шум и отсутствии появления ложной спектральной информации, мощность лазерного излучения не должна превышать 10% от номинальной величины при продолжительности набора спектров для ковалентно меченной молекулы ДНК не более 10 с. При этом для проведения анализа используют монохроматическое лазерное излучение с длиной волны наиболее близкой к максимуму поглощения раствора ГКР-индикатора из диапазона длин волн 450-1100 нм.
Для проведения анализа помимо стационарных КР-спектрометров возможно использование портативных приборов с вышеперечисленными длинами волн для регистрации спектров ГКР. Таким образом, предлагаемое техническое решение эффективно для использования в целях мобильного высокочувствительного и высокоточного входного контроля и идентификации молекул ДНК, ускоренного контроля образцов биологических жидкостей, для окончательного контроля и диагностики как в лабораторных, так и в «полевых» условиях.
Анализ общеизвестных источников информации показал, что способ определения ДНК, основанный на использовании наночастиц благородных металлов, гибридизации мишени с направленно выбранным ковалентно ГКР-меченным комплементарным олигонуклеотидом, позволяющим образовывать направленно упорядоченную за счет нековалентных взаимодействий структуры, включающей определяемую ДНК, ГКР-метку и олигонуклеотид, для детектирования и определения ДНК методом спектроскопии гигантского комбинационного рассеяния, не известен.



Способ определения ДНК в биологических жидкостях, который заключается в подготовке наночастиц благородных металлов, выступающих в роли ГКР-усилителя; гибридизации мишени с направленно выбранным ковалентно ГКР-меченным комплементарным олигонуклеотидом; нанесении пробы с исследуемым соединением на поверхность наночастиц жидкой пробы с исследуемым соединением с образованием направленно упорядоченной за счет нековалентных взаимодействий структуры, включающей определяемую ДНК, ГКР-метку и олигонуклеотид; детектировании полученного гибридизированного ГКР-меченного дуплекса методом спектроскопии гигантского комбинационного рассеяния. О качественном и количественном содержании ДНК судят по положению и интенсивности полос на регистрируемых спектрах. Способ применим для определения малых количеств ДНК на фоне большого количества посторонних компонентов анализируемых биологических жидкостей. Технический результат - повышение чувствительности, селективности и экспрессности. 13 з.п. ф-лы, 22 ил., 2 табл.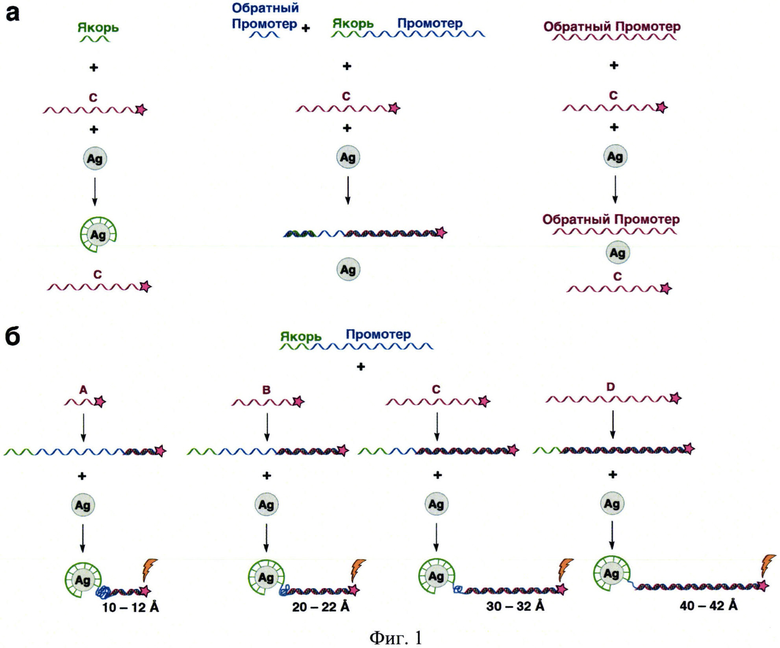
1. Способ определения фрагментов поврежденной ДНК, характеризующийся тем, что на планарную ГКР-активную поверхность, включающую наночастицы благородных металлов, наносят предварительно подготовленный раствор, образованный при гибридизации жидкой пробы с исследуемым фрагментом поврежденной ДНК с комплементарным олигонуклеотидом, ковалентно модифицированным ГКР-меткой, облучают монохроматическим пучком лазера и определение фрагментов ДНК в изучаемом образце методом спектроскопии ГКР проводят по интенсивности сигналов на регистрируемых спектрах.
2. Способ по п. 1, характеризующийся тем, что в качестве наночастиц благородных металлов используют серебро или золото.
3. Способ по п. 2, характеризующийся тем, что наночастицы имеют размеры 20-90 нм и характеризуются полосой плазмонного резонанса 420-650 нм.
4. Способ по п. 1, характеризующийся тем, что в качестве материала-носителя для наночастиц используют диэлектрический химически инертный материал, выбранный из ряда, включающего оксид алюминия, оксид магния, диоксид кремния, диоксид циркония, силикатное стекло.
5. Способ по п. 1, характеризующийся тем, что используют 10-500 мкмоль благородного металла в расчете на 1 мм2 поверхности носителя с последующей сушкой.
6. Способ по п. 1, характеризующийся тем, что для нанесения пробы и однократного анализа используют поверхность площадью 4×4 мм2.
7. Способ по п. 1, характеризующийся тем, что гибридизацию проводят путем нагрева и выдерживания раствора в течение 5-10 мин при температуре 90-100°С, с последующим охлаждением до комнатной температуры.
8. Способ по п. 1, характеризующийся тем, что в качестве ГКР-индикаторов используют родаминовые и цианиновые красители.
9. Способ по п. 1, характеризующийся тем, что в качестве олигонуклеотидов для гибридизации используют олигонуклеотиды, длина которых выбирается из расчета конечного расстояния 1-5 нм между ГКР-индикатором и наночастицами металла.
10. Способ по п. 1, характеризующийся тем, что количество ГКР-меченного олигонуклеотида используют в мольном соотношении от 1:10 до 10:1 к определяемой ДНК.
11. Способ по п. 1, характеризующийся тем, что используют жидкие пробы путем их накалывания на поверхность наночастиц.
12. Способ по п. 1, характеризующийся тем, что используют жидкие пробы объемом 10-50 мкл с концентрацией ДНК 10-15-10-2 М.
13. Способ по п. 1, характеризующийся тем, что при проведении анализа используют монохроматическое лазерное излучение с длиной волны наиболее близкой к максимуму поглощения раствора ГКР-индикатора из диапазона длин волн 450-1100 нм и мощностью, не превышающей 10% от номинальной величины, при облучении сенсора с нанесенной пробой не более 10 с.
14. Способ по п. 1, характеризующийся тем, что о качественном и количественном содержании ДНК судят по положению и интенсивности полос при 1360, 1380, 1470, 1510, 1570, 1590 и 1650 см-1 с допустимой величиной погрешности не более 10 см-1.
| WO 2016205971 A1, 29.12.2016 | |||
| JPWO 2014181816 A1, 23.02.2017 | |||
| DUNCAN GRAHAM et al | |||
| "Control of enhanced Raman scattering using a DNA-based assembly process of dye-coded nanoparticles", Nature Nanotechnology, vol 3, pages 548-551 (2008) | |||
| M | |||
| Fondevila et al | |||
| "Forensic SNP genotyping with SNaPshot: Technical considerations for the development and |
Авторы
Даты
2020-06-09—Публикация
2019-08-15—Подача