Область изобретения
Настоящее изобретение относится к химической модификации белков для продления времени их циркулирования и уменьшения их иммуногенности. Конкретнее, изобретение относится к конъюгации поли(этиленгликолей) или поли(этиленоксидов) с уратоксидазами, а также к процессу изолирования тетрамерной формы уриказы из раствора уриказы и изолированной тетрамерной уриказы, которая практически устраняет иммуногенность уратоксидазы без ухудшения ее активности в разложении мочевой кислоты.
Существующий уровень техники
Известные уратоксидазы (уриказы; Е.С. 1.7.3.3) являются ферментами, которые катализируют окисление мочевой кислоты в более растворимый продукт, аллантоин, пуриновый метаболит, который лучше выделяется. Люди не вырабатывают ферментно активной уриказы в результате нескольких мутаций в гене для уриказы, произошедших в ходе эволюции высших приматов. Wu, X, et al. (1992) J Mol Evol 34:78-84. Вследствие этого у восприимчивых индивидов избыточные концентрации мочевой кислоты в крови (гиперурикемия) и в моче (гиперуринурия) могут приводить к болезненным артритам (подагре), порче уратовых отложений (подагрическим узлам) и отказу почек. У некоторых больных доступные лекарства, такие как аллопуринол (ингибитор синтеза мочевой кислоты), дают ограничивающие лечение обратные эффекты либо не лечат данные состояния адекватно. Hande, KR, et al. (1984) Am J Med 76:47-56; Fam, AG (1990) Bailliere's Clin Rheumatol 4:177-192. Инъекции уриказы могут уменьшить гиперурикемию и гиперуринурию, по крайней мере временно. Поскольку уриказа является для человека чужеродным белком, даже первая инъекция немодифицированного белка из Aspergillus flavus вызвала анафилактические реакции у определенного процента пациентов (Pui, C-H, et al. (1997) Leukemia 11:1813-1816), а иммунологические реакции ограничивают ее полезность при хроническом или периодическом лечении. Don-adio, D, et al. (1981) Nouv Presse Med 10:711-712; Leaustic, M, et al. (1983) Rev Rhum Mal Osteoartic 50:553-554.
Частично оптимальное действие доступных лечений гиперурикемии известно уже несколько десятилетий. Kissel, P, et al. (1968) Nature 217:72-74. Аналогично, возможность того, что определенные группы пациентов с тяжелой подагрой могут извлекать пользу из безопасной и эффективной формы инъецируемой уриказы, известна много лет. Davis, FF, et al. (1978) в GB Broun et al. (ред) Enzyme Engineering, Vol.4 (стр.169-173) New York, Plenum Press; Nishimura, H, et al. (1979) Enzyme 24:261-264; Nishimura, H, et al. (1981) Enzyme 26:49-53; Davis, S, et al. (1981) Lancet 2(8241):281-283; Abuchowski, A, et al. (1981) J Pharmacol Exp Ther 219:352-354; Chen, RH-L, et al. (1981) Biochim Biophys Acta 660:293-298; Chua, CC, et al. (1988) Ann Int Med 109:114-117; Greenberg, ML, et al. (1989) Anal Biochem 176:290-293. Уриказы, производные от животных органов, почти нерастворимы в растворителях, которые совместимы с безопасным введением путем инъекции. Патент США №3616231. Определенные уриказы, производные от растений или от микроорганизмов, более растворимы в медицински приемлемых растворителях. Однако инъекция микробных ферментов быстро вызывает иммунологические реакции, которые могут привести к опасным для жизни аллергическим реакциям или к инактивации и/или ускоренному устранению уриказы из циркуляции. Donadio, et al. (1981); Leaustic, et al. (1983). Ферменты, основанные на выведенных аминокислотных последовательностях уриказ млекопитающих, в том числе свиньи и бабуина, или насекомых, таких, к примеру, как Drosophila melanogaster или Drosophila pseudoobscura (Wallrath, LL, et al. (1990) Moll Cell Biol 10:5114-5127), не стали пригодными кандидатами для клинического использования из-за проблем иммуногенности и растворимости при физиологическом рН.
Ковалентная модификация белков с поли(этиленгликолем) или поли(этиленоксидом) (оба обозначаются как PEG) была использована для увеличения полужизни белка и уменьшения иммуногенности. Патенты США №4179337, 4766106 и 4847325; Saifer, MGP, et al. (1994) Adv Exp Med Biol 366:377-387. Связывание PEG высокого молекулярного веса для получения конъюгатов с продленным временем циркуляции и/или уменьшенной иммуногенности при сохранении функциональной активности было ранее продемонстрировано для другого фермента супероксиддисмутазы (Somack, R, et al. (1991) Free Rad Res Commun 12-13:553-562; Патенты США №5283317 и 5468478) и для других типов белков, например цитокинов (Saifer, MGP, et al. (1997) Polym Preprints 38:576-577; Sherman, MR, et al. (1997) в JM Harris, et al. (ред), Poly(ethylene glicol) Chemistry and Biological Applications. ACS Symposium Series 680 (стр.155-169) Washington, DC: American Chemical Society). Конъюгаты уриказы с полимерами, отличными от PEG, также описаны. Патент США №4460683.
Почти во всех известных и упомянутых выше попытках PEG-илировать уриказу (т.е. ковалентно связать PEG с уриказой) PEG первично присоединялся к аминогруппам, содержащим аминотерминальный остаток и доступные лизиновые остатки. В общеиспользуемых уриказах общее количество лизинов в каждой из четырех идентичных подъединиц находится в пределах между 25 (Aspergillus flavus (Патент США №5382518)) и 29 (свинья (Wu, X, et al. (1989) Proc Nati Acad Sci USA 86:9412-9416)). Некоторые из лизинов недоступны для PEG-илирования в присущей ферменту конформации. Наиболее общим подходом к уменьшению иммуногенности уриказы было связывание большого количества нитей PEG с низким молекулярным весом. Это стабильно приводило к большим уменьшениям ферментной активности получаемых конъюгатов.
Прежние исследователи использовали инъецированную уриказу для катализации перехода мочевой кислоты в аллантоин in vivo. См. Pui, et al. (1997). Это - основа для использования во Франции и Италии уриказы из гриба Aspergillus flavus (Uricozyme®), чтобы предотвратить или временно скорректировать гиперурикемию, связанную с цитотоксической терапией гематологических нарушений, и чтобы временно уменьшить тяжелую гиперурикемию у пациентов с подагрой. Potaux, L, et al. (1975) Nouv Presse Med 4: 1109-1112; Legoux, R, et al. (1992) J Biol Chem 267:8565-8570; Патенты США №5382518 и 5541098. Из-за своего короткого жизненного цикла циркуляции Uricozyme® требует ежедневных инъекций. Более того, он не очень хорошо подходит для долговременной терапии из-за своей иммуногенности.
Одна внутривенная инъекция препарата уриказы из Candida utilis, связанной с 5 кДа PEG, снижала урат сыворотки до нефиксируемых уровней у пяти человек, у которых средняя концентрация урата сыворотки до инъекции составляла 6,2 мг/дл, что в пределах нормы. Davis, et al. (1981). Субъектам давали дополнительную инъекцию четыре недели спустя, но их реакция не была засвидетельствована. После второй (и последней) инъекции не было обнаружено антител к уриказе при использовании относительно нечувствительного теста гелевой диффузии. Этот источник не содержит сведений о хроническом или субхроническом лечении пациентов-людей или экспериментальных животных.
Препарат уриказы из Arthrobacter protoformiae, связанной с 5 кДа PEG, использовался для временного управления гиперурикемией у одного пациента с лимфомой, у которого концентрация урата сыворотки до инъекции составляла 15 мг/дл. Chua, et al. (1988). Из-за критического состояния пациента и короткой продолжительности лечения (четыре инъекции за 14 дней) было невозможно оценить долговременную эффективность или безопасность этого конъюгата.
В данной заявке термин "иммуногенность" означает возбуждение иммунной реакции инъецированным препаратом PEG-модифицированной или немодифицированной уриказы (антигеном), а "антигенность" означает реакцию антигена с ранее существовавшими антителами. Антигенность и иммуногенность совместно обозначаются как "иммунореактивность". В предшествующих исследованиях PEG-уриказы иммунореактивность определялась различными способами, в том числе: 1) реакцией in vitro PEG-уриказы с ранее сформированными антителами; 2) измерением вызванного синтеза антител и 3) повышенными скоростями очистки крови после повторных инъекций.
Предшествующие попытки устранения иммуногенности уриказ по разным источникам путем связывания различных количеств нитей PEG через различные линкеры имели ограниченный успех. PEG-уриказы впервые рассмотрели FF Davis и Y Inada и их коллеги. Davis, et al. (1978); Патент США №4179337; Nishimura, et al. (1979); Патенты Японии №55-99189 и 62-55079. Конъюгат, раскрытый в патенте '337, был синтезирован путем реагирования уриказы из неспецифицированного источника с 2000-кратным молярным избытком PEG весом 750 дальтонов, что показывает, что большое количество молекул полимера с большей вероятностью соединялось с каждой подъединицей уриказы. Патент '337 раскрывает связывание либо PEG, либо поли(пропиленгликоля) с молекулярными весами от 500 до 20000 дальтонов, предпочтительно от 500 до 5000 дальтонов, для получения активных, водорастворимых, неиммуногенных конъюгатов различных полипептидных гормонов и ферментов, содержащих оксидоредуктазы, одним из трех примеров которых является уриказа. В дополнение к этому патент '337 подчеркивает связывание от 10 до 100 нитей полимера с каждой молекулой фермента и сохранение по меньшей мере 40% ферментной активности. Однако при этом не сообщалось тестовых результатов по объему связывания PEG с доступными аминогруппами уриказы, остаточной специфической уриколитической активности или иммунореактивности конъюгата.
Данные из 13 процитированных источников относительно PEG-илирования уриказы собраны в Таблице 1. Некоторые из этих результатов также представлены графически на фиг.1А-2Б. Семь из этих публикаций описывают значительные уменьшения уриколитической активности, измеренной in vitro, вызванной связыванием различного количества нитей PEG с уриказой из Candida utilis. Связывание большого количества нитей PEG весом 5 кДа с уриказой свиной печени дало подобные результаты, как описано и в публикации Chen, и в сделанном той же группой авторов докладе на симпозиуме. Chen, et al. (1981); Davis, et al. (1978).
Среди исследований, собранных в Таблице 1, уменьшение иммунореактивности уриказы отмечено в семи из них, а устранение иммунореактивности - в пяти. В трех из последних пяти исследований устранение иммунореактивности было связано с серьезным уменьшением уриколитической активности - до самое большее 15, 28 или 45% от начальной активности. Nishimura, et al. (1979) (15% активности); Chen, et al., (1981) (28% активности); Nishimura et al. (1981) (45% активности). В четвертом докладе сообщалось, что PEG связывался с 61% доступных лизиновых остатков, но не была установлена остаточная специфическая активность. Abuchowski et al. (1981). Однако команда исследователей, содержавшая двух из этих же ученых и использовавшая те же способы, в другом источнике сообщила о том, что этот объем связывания оставлял лишь 23-28% остаточной активности. Chen et al. (1981). Публикации 1981 года Abuchowski et al. и Chen et al. показывают, что для значительного уменьшения иммуногенности уриказы PEG должен связываться приблизительно с 60% доступных лизиновых остатков (Таблица 1). Пятая публикация, в которой сообщается об устранении иммунореактивности уриказы, не раскрывает объема связывания PEG, остаточной уриколитической активности или природы связи PEG-белок. Veronese, FM, et al. (1997) в JM Harris, et al. (ред), Poly(ethylene glycol) Chemistry and Biological Applications. ACS Symposium Series 680 (стр.182-192) Washington, DC: American Chemical Society.
Конъюгация PEG к меньшей части лизиновых остатков в уриказе уменьшает, но не устраняет ее иммунореактивность у экспериментальных животных. Tsuji, J, et al. (1985) Int J Immunopharmacol 7:725-730 (28-45% связанных аминогрупп); Yasuda, Y, et al. (1990) Chem Pharm Bull 38:2053-2056 (38% связанных аминогрупп). Остаточные уриколитические активности соответствующих добавок находятся в диапазоне от <33% (Tsuji, et al.) до 60% (Yasuda, et al.) от их начальных значений. Tsuji, et al. синтезировали конъюгаты PEG-уриказы с PEG весом 7,5-10 кДа в дополнение к PEG с весом 5 кДа. Все результирующие конъюгаты были несколько иммуногенны и антигенны, в то же время проявляя заметно уменьшенные ферментные активности (Таблица 1; фиг.1А-1Б).
Сообщалось, что PEG-илированный препарат уриказы из Candida utilis, который безопасно дважды вводился каждому из пяти людей, сохранял только 11% своей начальной активности. Davis, et al., (1981). Несколькими годами позже PEG-модифицированная уриказа из Arthrobacter protoformiae четырежды вводился одному пациенту с лимфомой и тяжелой гиперурикемией. Chua, et al. (1988). Хотя остаточная активность этого ферментного препарата не была измерена, Chua, et al. продемонстрировали отсутствие антиуриказных антител в сыворотке пациента 26 дней спустя после первой инъекции PEG-уриказы при помощи ферментно-связанного иммуносорбентного теста (ELISA).
Как показано в Таблице 1, предыдущие исследования PEG-илированной уриказы показывают, что каталитическая активность заметно подавляется путем связывания значительного количества нитей PEG для значительного уменьшения ее иммунореактивности. Более того, наиболее ранние препараты PEG-уриказы синтезировались с помощью PEG, активированного с помощью циануринового хлорида, производного триазина (2,4,6-трихлор-1,3,5-триазина), который, как было показано, вводит новые антигенные детерминанты и вызывает формирование антител у кроликов. Tsuji, et al. (1985).
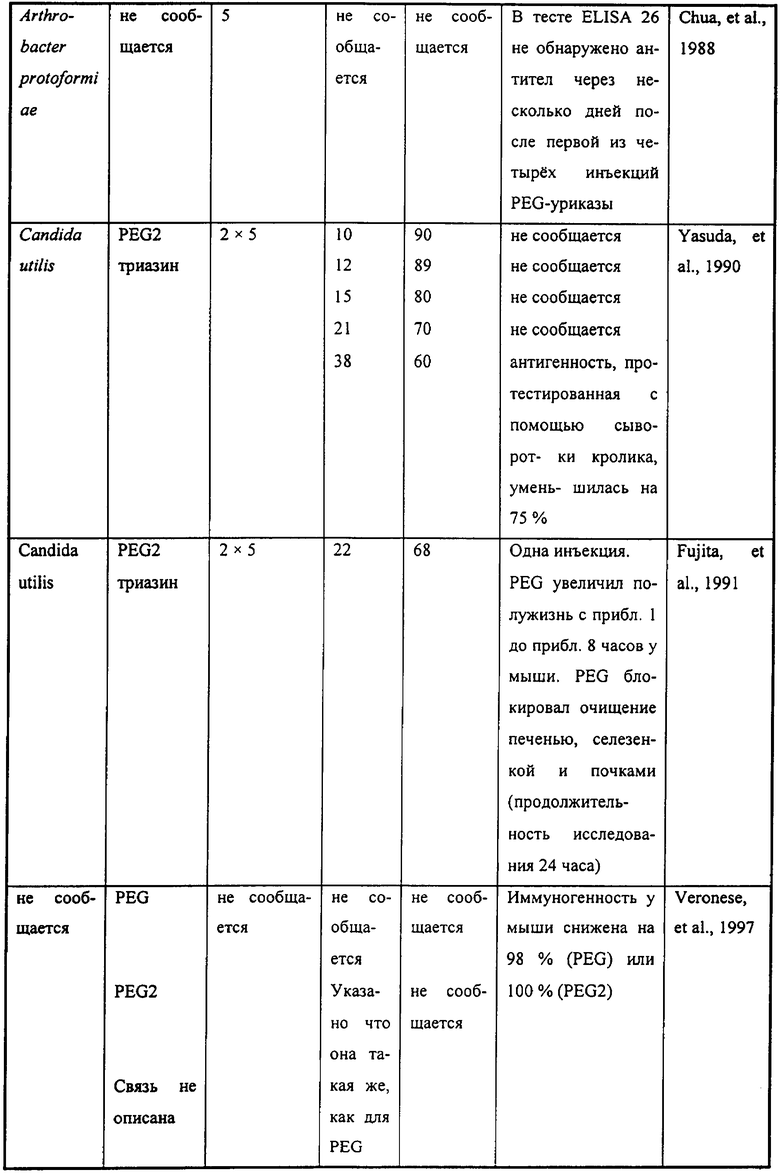
Японский патент №3-148298, выданный A Sano et al., раскрывает модифицированные белки, в том числе уриказу, дериватизированные с PEG, имеющим молекулярный вес 1-12 кДа, которые проявляют уменьшенную антигенность и "улучшенное продленное" действие, и способы получения таких дериватизированных пептидов. Однако не раскрываются количество нитей, ферментные тесты, биологические тесты и значение выражения "улучшенное продленное". Японские патенты №№55-99189 и 62-55079, оба выданы Y Inada, раскрывают конъюгаты уриказы, полученные с помощью PEG-триазина или бис-РЕО-триазина (обозначенного PEG2 в Таблице 1) соответственно. См. Nishimura et al. (1979 и 1981). В конъюгате первого типа молекулярные веса PEG составляли 2 и 5 кДа, в то время как в конъюгате второго типа использовался только PEG с весом 5 кДа. Nishimura et al. (1979) сообщает о восстановлении 15% уриколитической активности после модификации 43% доступных лизинов с помощью линейного PEG с весом 5 кДа, в то время как Nishimura et al. (1981) сообщает о восстановлении 31 или 45% уриколитической активности после модификации 46 или 36% лизинов с помощью соответственно PEG2.
Сущность изобретения
Анализ предшествующего уровня техники показывает, что когда достигается значительное снижение иммуногенности и/или антигенности уриказы путем PEG-илирования, это обязательно связано со значительной потерей уриколитической активности. Безопасность, удобство и стоимостная эффективность биомедикаментов испытывают обратное воздействие за счет уменьшения потенциала биомедикаментов и возникающей из-за этого потребности в увеличении вводимой дозы. Таким образом существует необходимость в безопасном и эффективном альтернативном средстве для снижения повышенных уровней мочевой кислоты в жидкостях тела, в том числе в крови и моче. Одним из таких средств в соответствии с настоящим изобретением может быть практически неиммуногенная PEG-уриказа, которая сохраняет всю или почти всю уриколитическую активность немодифицированного фермента.
Конъюгат уратоксидазы (уриказы) сохраняет по меньшей мере 75% уриколитической активности неконъюгированной уриказы и имеет значительно сниженную иммуногенность. В соответствии с изобретением обеспечивается очищенная уриказа, в которой каждая подъединица может ковалентно связываться со в среднем от 2 до 10 нитей PEG, которые могут быть линейными или разветвленными, причем каждая молекула PEG может иметь молекулярный вес между приблизительно 5 и 100 кДа. Уриказа также может быть рекомбинантной. Независимо от рекомбинантности уриказа может иметь млекопитающее происхождение. Т.е. уриказа может быть уриказой свиной, бычьей или овечьей печени. Уриказа может быть химерической. Химерическая уриказа может содержать части уриказы свиной печени и/или печени бабуина. Например, химерическая уриказа может быть свино-бабуиновой химерической уриказой (СБХ-уриказой) или свиной уриказой, содержащей мутации R291K и T301S (C-KS-уриказой) (см. последовательности на фиг.6 и результаты физиологических и иммунологических исследований на фиг.7-12). Альтернативно уриказа может быть уриказой печени бабуина, в которой тирозин 97 замещен гистидином, за счет чего специфическая активность уриказы может быть увеличена по меньшей мере на приблизительно 60%. Уриказа, независимо от происхождения, может также иметь усеченную форму либо со стороны аминного терминала, либо со стороны карбоксилового терминала, либо на обоих терминалах. Подобным же образом уриказа может быть грибной или микробной уриказой. Грибная или микробная уриказа может быть встречающейся в природе или рекомбинантной формой уриказы из Aspergillus flavus, Arthrobacter globiformis или Candida utilis. Альтернативно, уриказа может быть уриказой беспозвоночного, такой как, к примеру, встречающаяся в природе или рекомбинантная форма уриказы из Drosophila melanogaster или Drosophila pseudoobscura. Уриказа может быть также растительной уриказой, например встречающейся в природе, или рекомбинантной формой уриказы из узелка корня сои (Glycine max). PEG может иметь средний молекулярный вес между приблизительно 5 и 100 кДа; предпочтительно PEG может иметь средний молекулярный вес между приблизительно 10 и 60 кДа; более предпочтительно PEG может иметь средний молекулярный вес между приблизительно 20 и 40 кДа, например 30 кДа. Среднее количество ковалентно связанных нитей PEG может составлять от 2 до 10 нитей на одну подъединицу уриказы; предпочтительно среднее количество ковалентно связанных нитей может составлять от 3 до 8 на подъединицу; более предпочтительно среднее количество нитей PEG может быть от 4 до 6 на подъединицу. Уриказа может быть тетрамерной. Нити PEG могут быть ковалентно связаны с уриказой через уретановые (карбаматные) связи, вторично-аминные связи и/или амидные связи. Если уриказа является рекомбинантной формой любой подразумеваемой здесь уриказы, то эта рекомбинантная форма может иметь в значительной мере ту же последовательность, что и встречающаяся в природе форма.
PEG-уриказа может быть очищенной уриказой из двух или более подъединиц, в которой каждая подъединица может быть ковалентно связана со в среднем от 2 до 10 нитей линейного или разветвленного PEG, причем каждая молекула PEG может иметь молекулярный вес между приблизительно 5 и 100 кДа в фармацевтически приемлемом носителе. Млекопитающим может быть человек. Шаг введения может быть, к примеру, внутривенной, внутрикожной, подкожной, внутримышечной или внутрибрюшинной инъекцией или ингаляцией препарата в виде аэрозоля. Повышенные уровни мочевой кислоты могут существовать в крови, моче и/или прочих жидкостях и тканях тела и могут быть связаны с подагрой, подагрическими узлами, почечной недостаточностью, трансплантацией органа или злокачественным заболеванием.
Существом настоящего изобретения является получение перечисленных выше биомедикаметов, а также способ выделения тетрамерной формы уриказы из раствора, содержащего несколько форм уриказы. Изначально раствор может содержать тетрамерную уриказу и совокупности уриказы. Способ может содержать следующие шаги: подача раствора в по меньшей мере одну сепарационную колонну при рН между приблизительно 9 и 10,5, например 10,2; восстановление фракций элюата и идентификации тех из них, которые могут содержать изолированную тетрамерную уриказу, причем фракции практически свободны от совокупностей уриказы; и объединение фракций изолированной тетрамерной уриказы. Сепарационная колонна может быть основана на ионном обмене, исключении по размеру или любом другом эффективном сепарационном свойстве. Способ может также содержать анализ фракций для определения наличия тетрамерной уриказы и/или отсутствия совокупностей уриказы. Например, такой анализ может содержать высокоточную жидкостную хроматографию (ВТЖХ), прочие хроматографические способы, рассеивание света, центрифугирование и/или электрофорез. В одном из аспектов данного выполнения очищенная тетрамерная уриказа может содержать менее 10% совокупностей уриказы.
Краткое описание чертежей
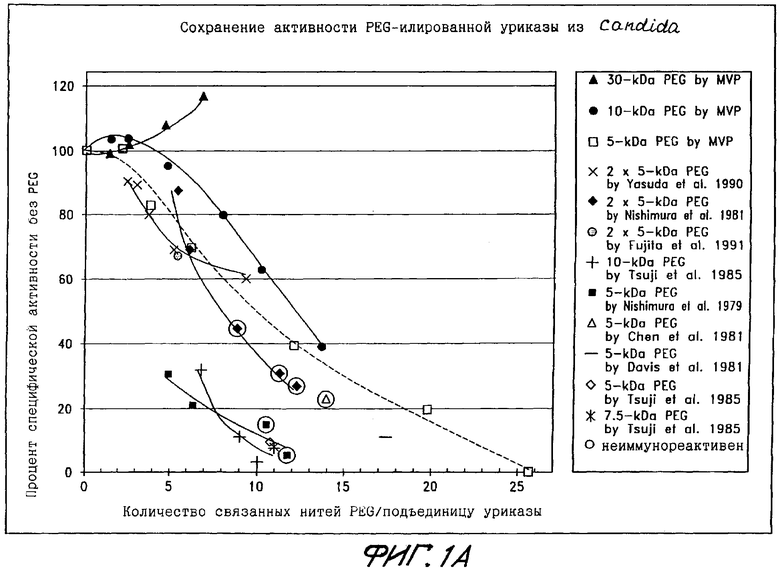
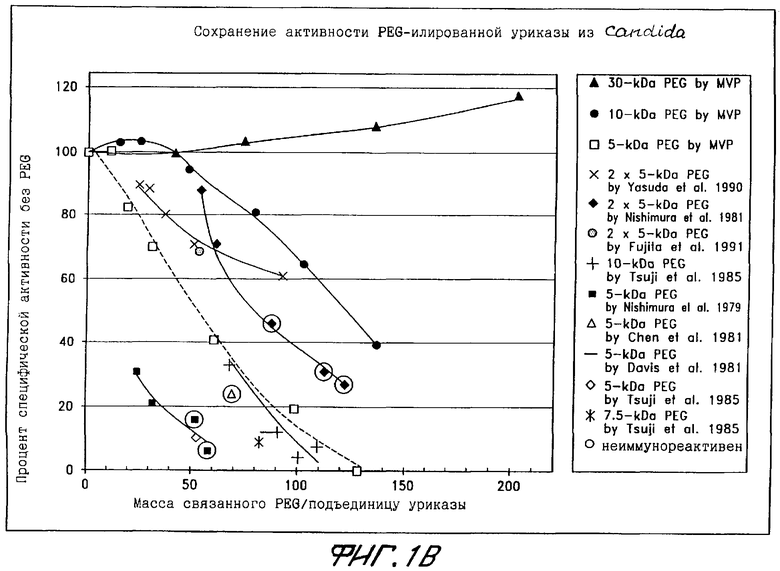
Фиг.1А показывает сохранение активности PEG-илированной уриказы из Candida utilis в виде функции количества нитей PEG, связанных с подъединицей.
Фиг.1Б показывает сохранение активности PEG-илированной уриказы из Candida utilis в виде функции общей массы PEG, связанного с подъединицей.
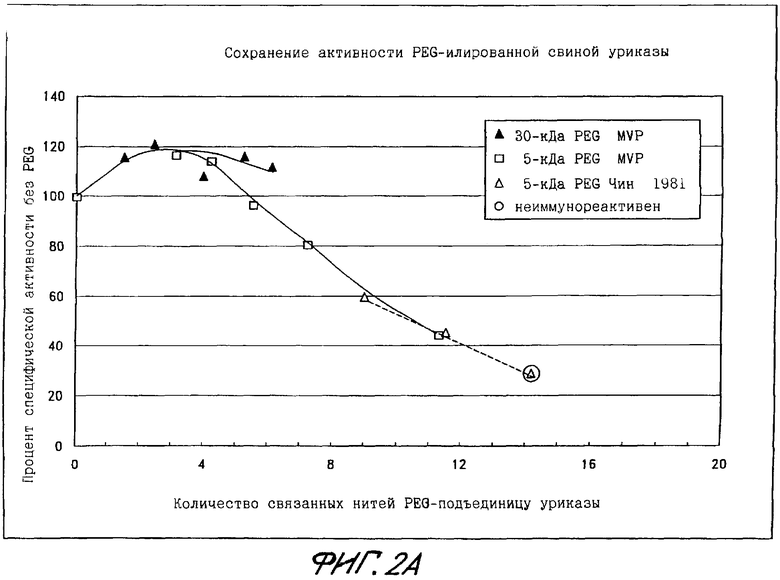
Фиг.2А показывает сохранение активности PEG-илированной уриказы из свиной печени в виде функции количества нитей PEG, связанных с подъединицей.
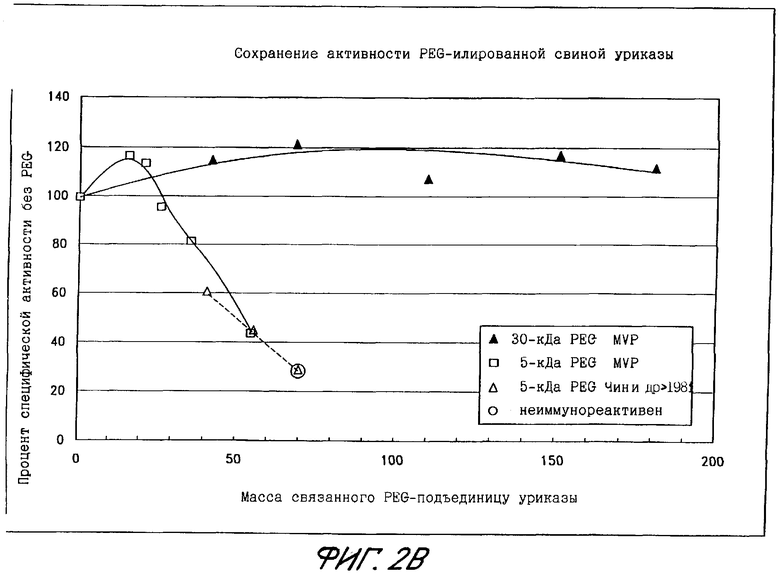
Фиг.2Б показывает сохранение активности PEG-илированной уриказы из свиной печени в виде функции общей массы PEG, связанного с подъединицей.
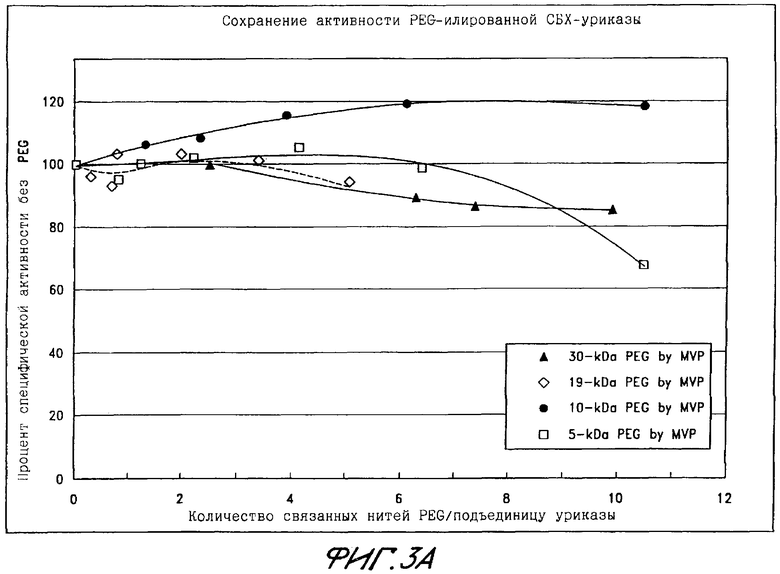
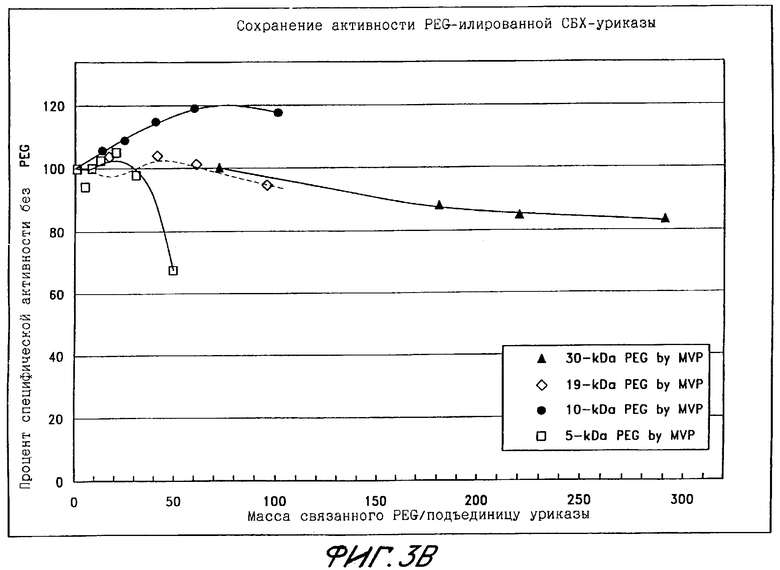
Фиг.3А показывает сохранение активности PEG-илированной свино-бабуиновой химерической (СБХ) уриказы в виде функции количества нитей, связанных с подъединицей.
Фиг.3Б показывает сохранение активности PEG-илированной СБХ-уриказы в виде функции общей массы PEG, связанного с подъединицей.
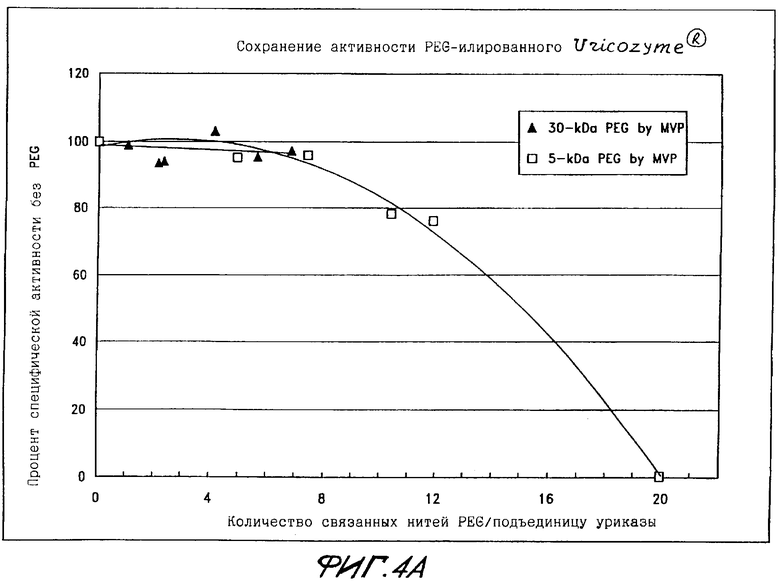
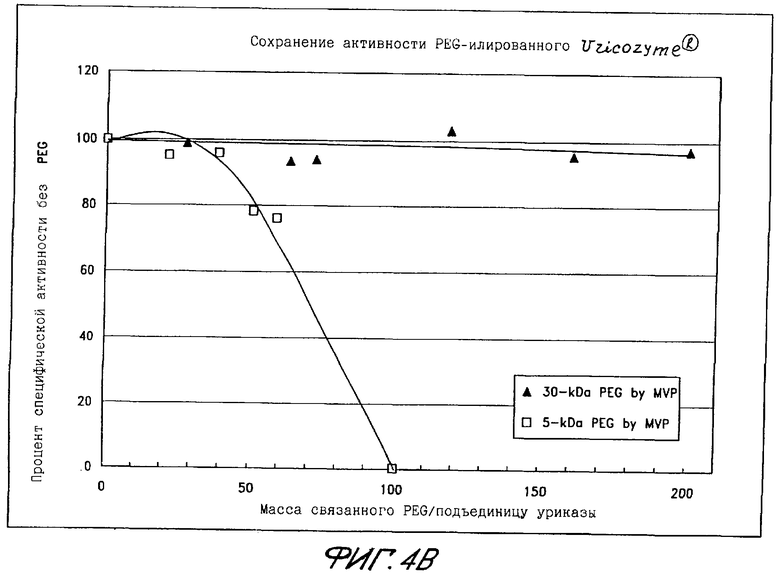
Фиг.4А показывает сохранение активности PEG-илированной уриказы из Aspergillus flavus в виде функции количества нитей PEG, связанных с подъединицей.
Фиг.4Б показывает сохранение активности PEG-илированной уриказы из Aspergillus flavus в виде функции общей массы PEG, связанного с подъединицей.
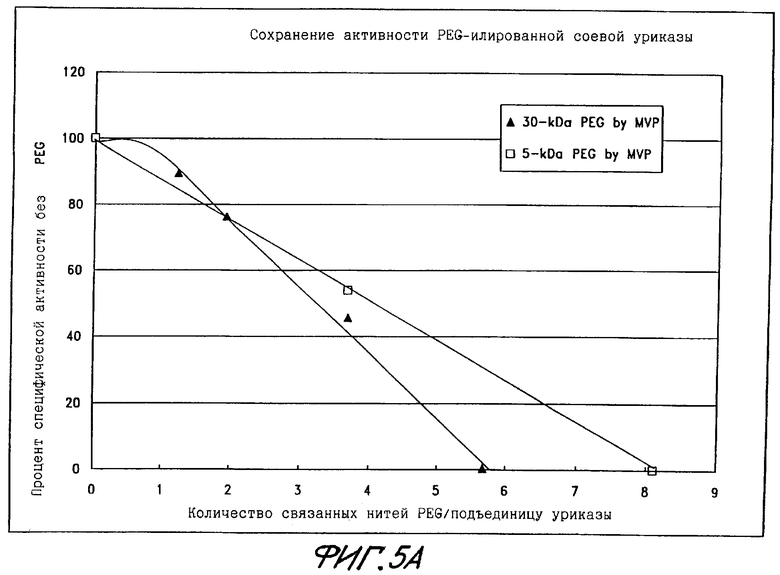
Фиг.5А показывает сохранение активности PEG-илированной рекомбинантной уриказы узелка соевого корня в виде функции количества нитей PEG, связанных с подъединицей.
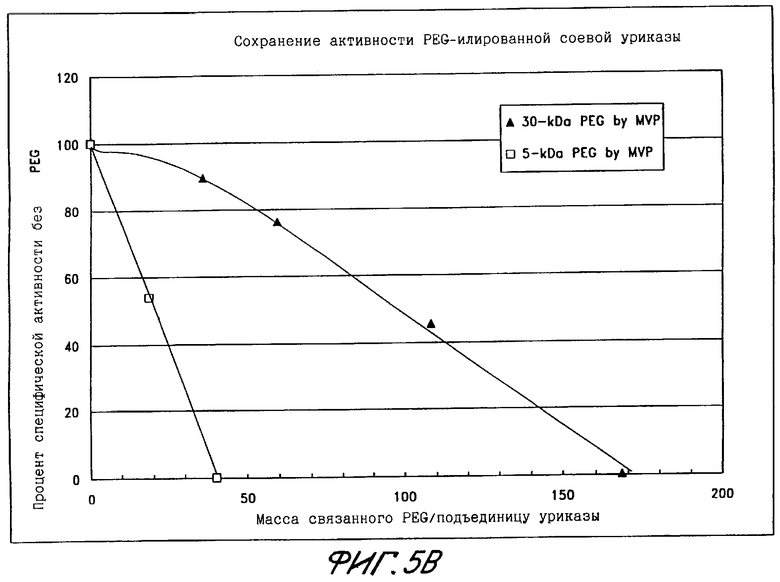
Фиг.5Б показывает сохранение активности PEG-илированной рекомбинантной уриказы узелка соевого корня в виде функции общей массы PEG, связанного с подъединицей.
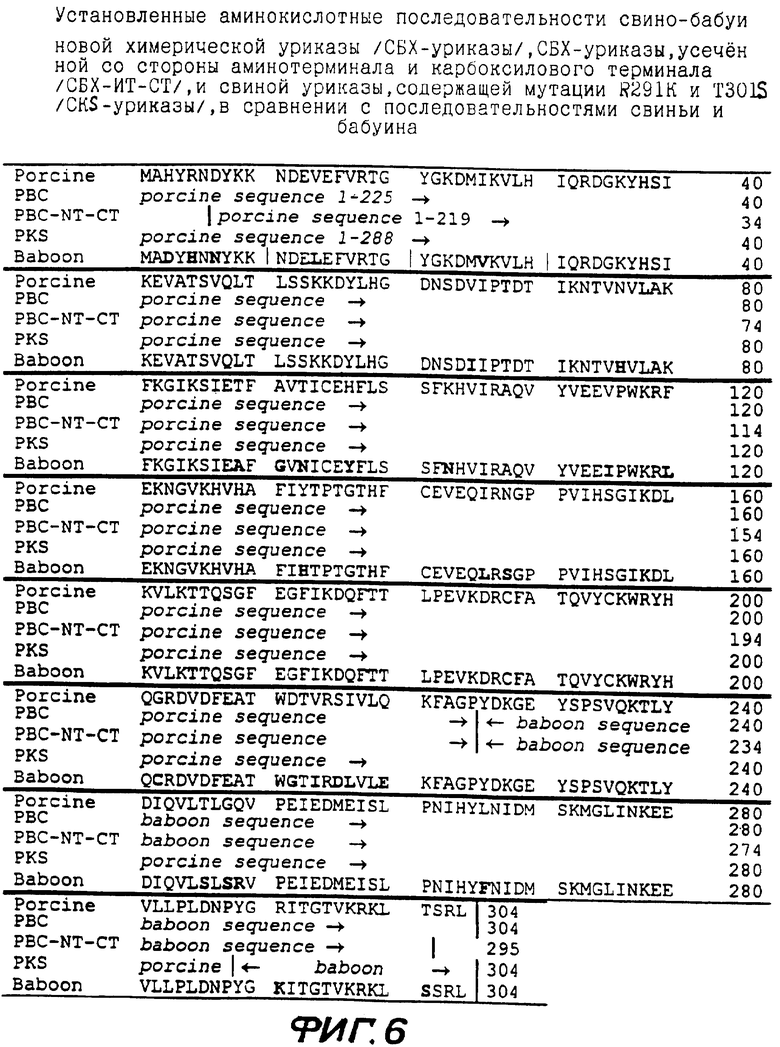
Фиг.6 показывает выведенные аминокислотные последовательности свино-бабуиновой химерической уриказы (СБХ-уриказы), СБХ-уриказы, которая усечена как со стороны аминотерминала, так и со стороны карбоксилового терминала (СБХ-NT-CT), и свиной уриказы, содержащей мутации R291K и T301S (CKS-уриказы), в сравнении с последовательностями свиньи и бабуина.
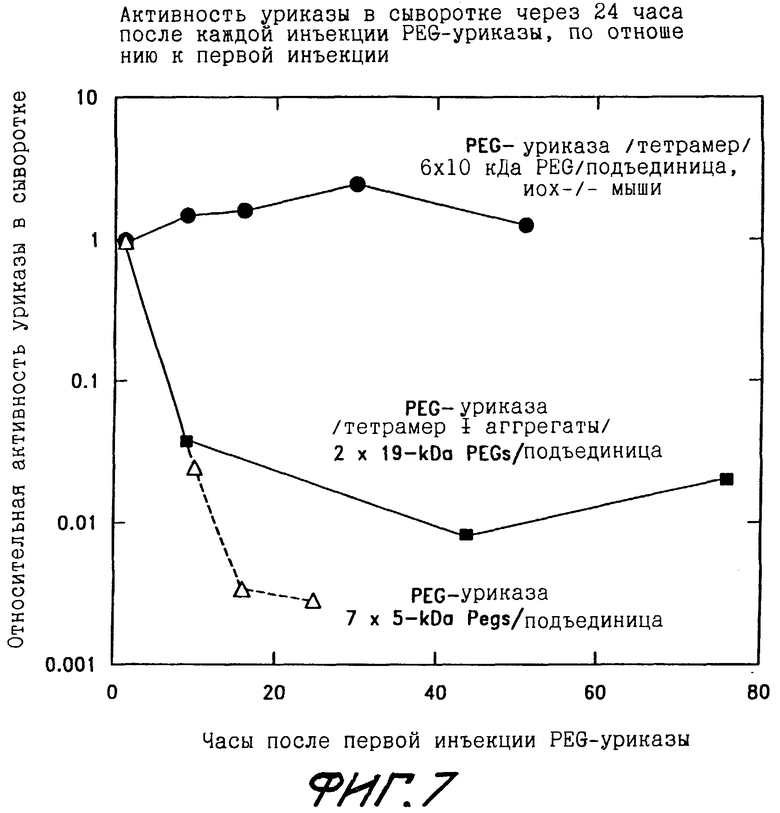
Фиг.7 показывает активность уриказы в сыворотке мыши через 24 часа после каждой из четырех или пяти внутрибрюшинных инъекций PEG-модифицированной СБХ-уриказы по сравнению со значением, полученным через 24 часа после первой инъекции.
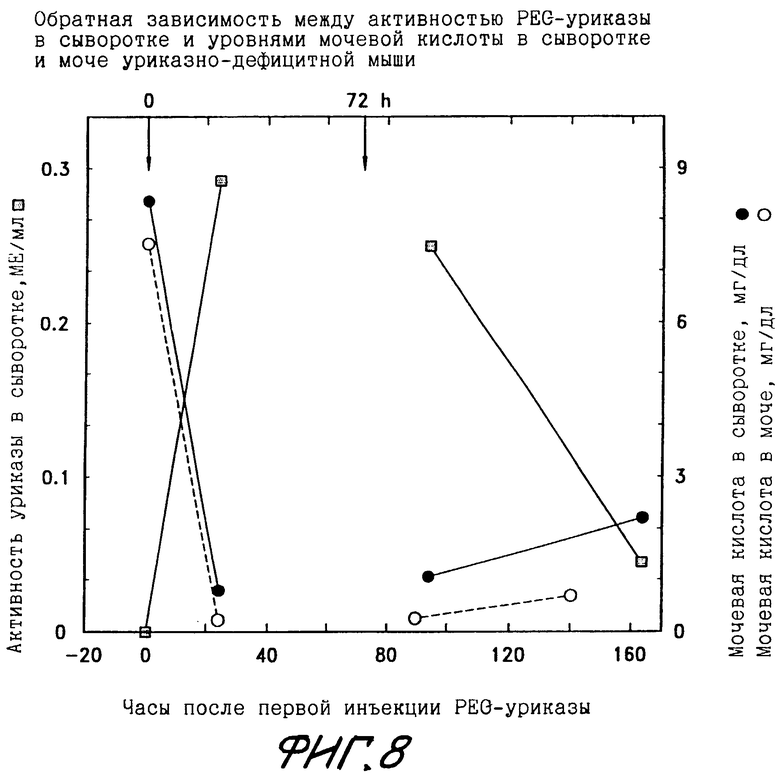
Фиг.8 показывает обратную зависимость между активностью инъецированной PEG-модифицированной СБХ-уриказы в сыворотке уриказодефицитной мыши и концентрациями мочевой кислоты в сыворотке и моче.
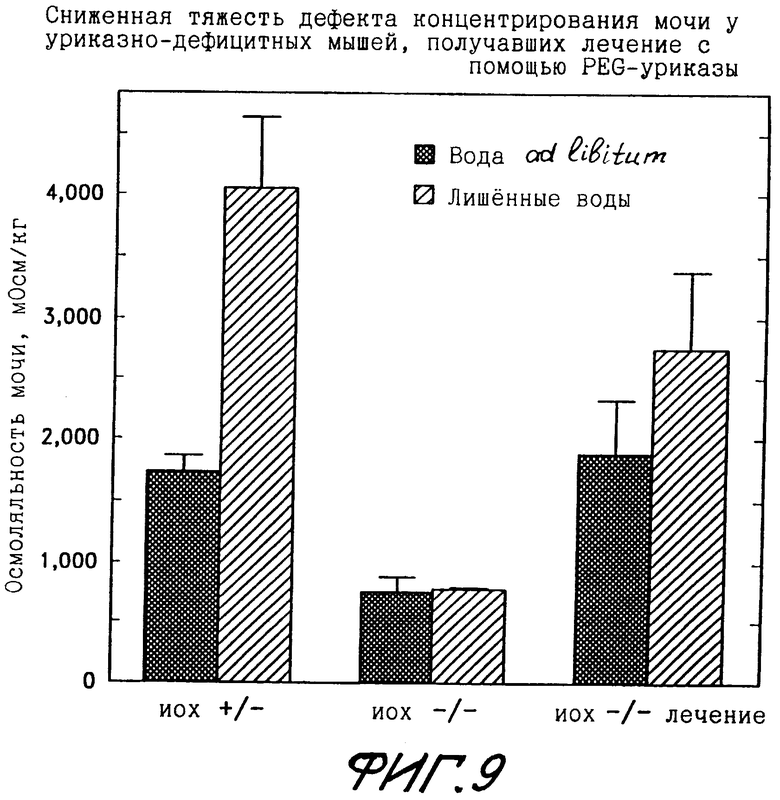
Фиг.9 показывает уменьшение тяжести дефекта концентрации мочи у уриказодефицитных (uox-/-) мышей, которые лечились с помощью PEG-модифицированной СБХ-уриказы.
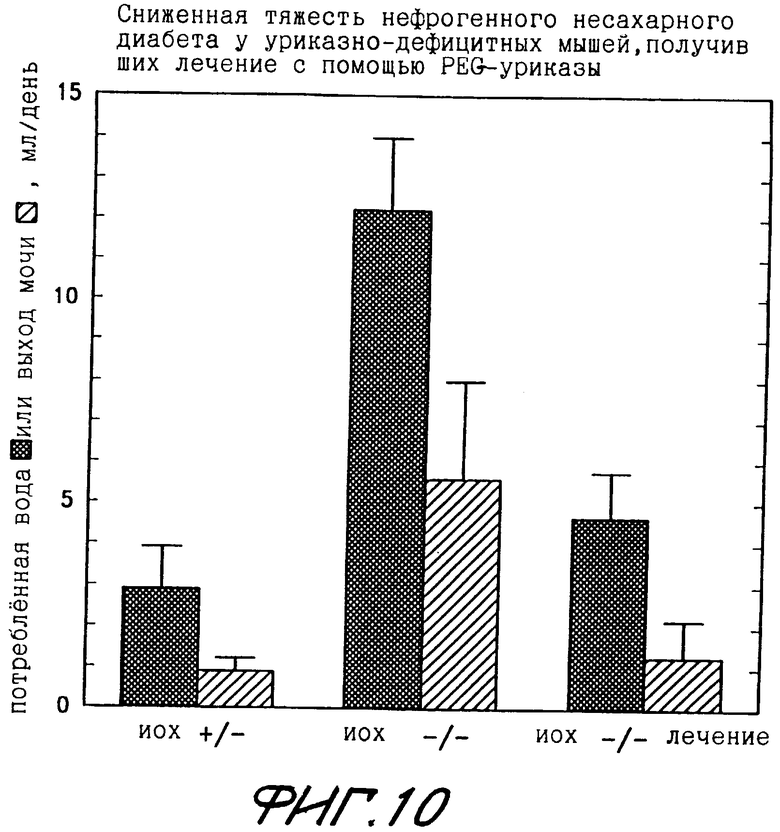
Фиг.10 показывает уменьшение тяжести нефрогенного несахарного диабета у уриказодефицитных (uox-/-) мышей, которые лечились с помощью PEG-модифицированной СБХ-уриказы.
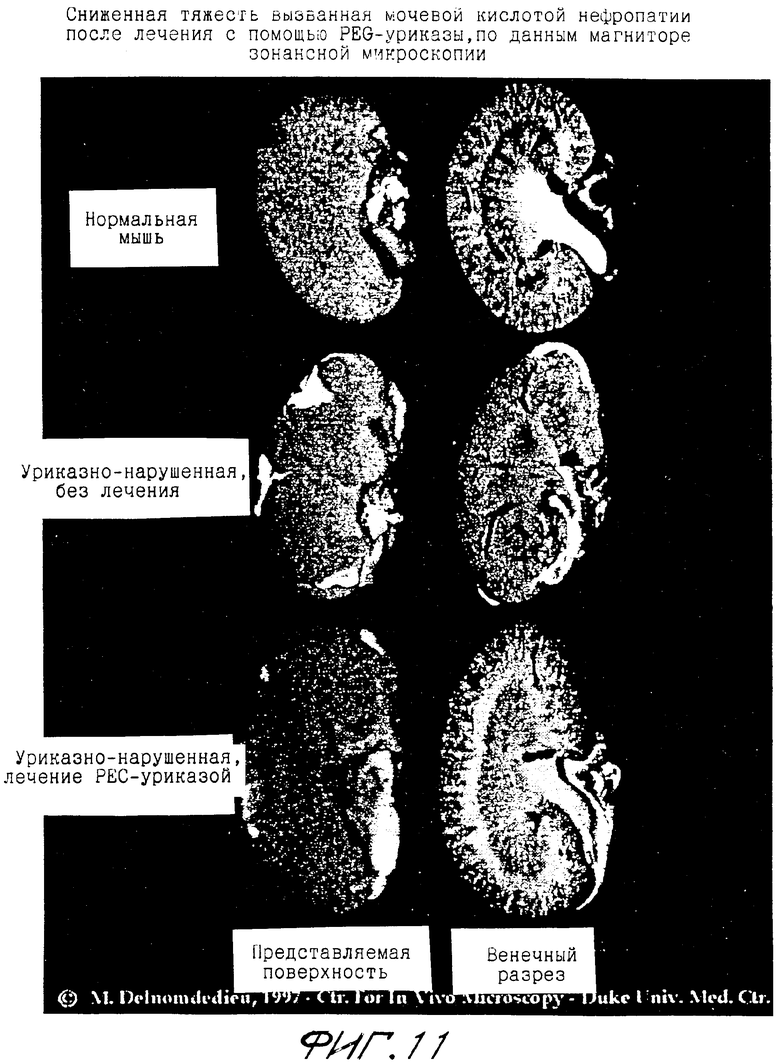
Фиг.11 показывает уменьшение тяжести вызванной мочевой кислотой нефропатии, по показаниям магнитно-резонансной микроскопии, у уриказодефицитных (uox-/-) мышей, которые лечились с помощью PEG-модифицированной СБХ-уриказы.
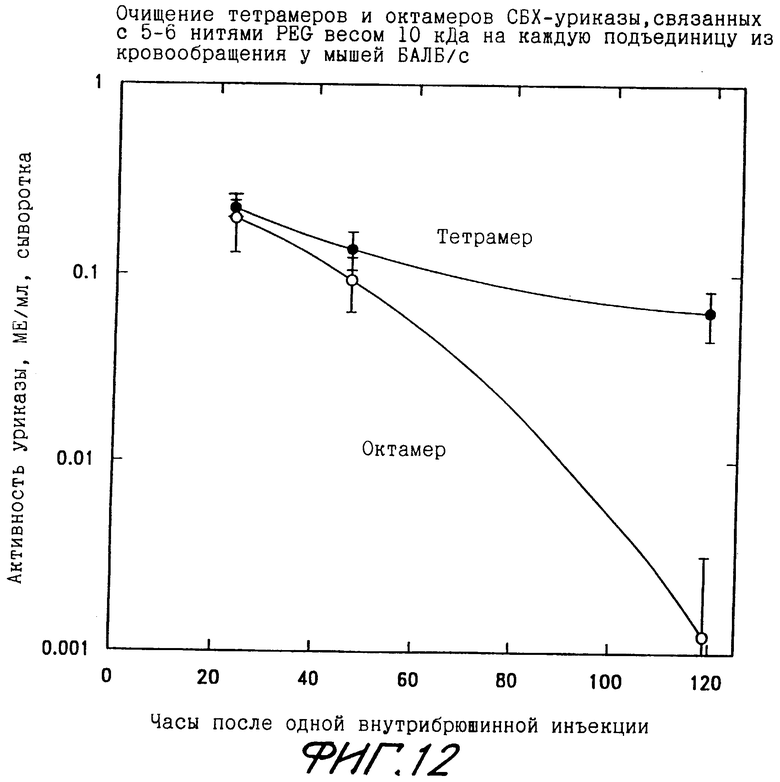
Фиг.12 показывает ускоренное очищение из кровообращения мыши BALB/c инъецированного октамера СБХ-уриказы по сравнению с тертамером, причем оба они были связаны с 5-6 нитями PEG весом 10 кДа на подъединицу.
Подробное описание предпочтительных выполнений
Настоящее изобретение обеспечивает улучшенные конъюгаты водорастворимых полимеров, предпочтительно поли(этиленгликолей) или поли(этиленоксидов), с уриказами. Эти конъюгаты практически неиммуногенны и сохраняют по меньшей мере 75%, предпочтительно 85% и более, предпочтительно 95% и более уриколитической активности немодифицированного фермента. Уриказы, пригодные для конъюгации с водорастворимыми полимерами, включают в себя встречающиеся в природе уратоксидазы, выделяемые из бактерий, грибов и тканей растений и животных, как позвоночных, так и беспозвоночных, а также рекомбинантные формы уриказы, в том числе мутированные, гибридные и/или усеченные ферментно-активные варианты уриказы. Водорастворимые полимеры, пригодные для использования в настоящем изобретении, включают в себя линейные или разветвленные поли(этиленгликоли) или поли(этиленоксиды), общеизвестные как PEG. Примером разветвленного PEG является объект патента США №5643575. Одним из предпочтительных примеров линейного PEG является монометокси PEG с общей структурой СН3О-(СН2СН2O)nH, где n варьируется от 100 до 2300.
Одной из предпочтительных уриказ млекопитающих является рекомбинантная свино-бабуиновая химерическая уриказа, составленная из частей последовательностей уриказы свиной печени и печени бабуина, обе из которых были впервые определены Wu et al. (1989). Один из примеров такой химерической уриказы содержит первые 225 аминокислот из последовательности свиной уриказы (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №1), а последние 79 аминокислот - из последовательности уриказы бабуина (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №2) (свино-бабуиновая уриказы, или СБХ-уриказа; см. фиг.6). Еще один пример такой химерической уриказы содержит остатки 7-225 свиной последовательности (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №1) и остатки 226-301 последовательности бабуина (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №2); это эквивалентно СБХ-уриказе, усеченной как со стороны аминотерминала, так и со стороны карбоксилового терминала (СБХ-NT-CT; см. фиг.6). Еще один пример такой химерической уриказы содержит первые 288 аминокислот из свиной последовательности (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №1) и последние 16 аминокислот из последовательности бабуина (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №2). Поскольку последняя последовательность отличается от последовательности свиньи только в двух позициях, содержа лизин (К) вместо аргинина в остатке 291 и серии (S) вместо треонина в остатке 301, мутант обозначается как свиная-K-S или CKS-уриказа. Каждая из CKS-, СБХ- и СБХ-NT-CT-уриказ содержит на один лизиновый остаток больше, и, следовательно, на одно потенциальное место для PEG-илирования больше чем последовательность свиньи или бабуина.
сДНК для различных уриказ млекопитающих, в том числе СБХ-уриказы, CKS-уриказы и рекомбинантной бабуино-подобной уриказы, были частично клонированы и были определены оптимальные условия для экспрессии в Е. coli с помощью стандартных способов. См. Erlich, НА, (ред.) (1989) PCR Technology. Principles and Applications for DNA Amplification. New York: Stockton Press; Sambrook, J et al. (1989) Molecular Cloning. A Laboratory Manual, Second Edition. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. Рекомбинантные уриказы экстрагировались, очищались и их стабильность и активность тестировались с помощью модификации стандартных тестов. См. Fridovich, I, (1965) J Biol Chem 240:2491-2494; Nishimura et al. (1979) и Пример 1.
Уриказа может конъюгироваться через биологически стабильные, нетоксичные, ковалентные связки относительно небольшого количества нитей PEG. Такие связки могут содержать уретановые (карбаматные) связки, вторично-аминные связки и амидные связки. Различные активированные PEG, пригодные для такой конъюгации, коммерчески доступны у фирмы Shearwater Polymers, Huntsville, AL.
Например, уретановые связки с уриказой могут формироваться путем инкубирования уриказы в присутствии сукцинимидилкарбоната (СК) или 4-нитрофенилкарбоната (НФК), производного от PEG. СК-PEG может синтезироваться с помощью процедуры, описанной в патенте США №5612460, включенном сюда посредством ссылки. НФК-PEG может синтезироваться путем реагирования PEG с 4-нитрофенилхлорформатом в соответствии со способами, описанными у Veronese, FM. et al. (1985) Appl Biochem Biotechnol 11:141-152 и в патенте США №5286637, включенном сюда посредством ссылки. Способы, описанные в патенте '637, адаптируются для PEG с высоким молекулярным весом путем регулирования концентраций реагентов для поддержания подобной стехиометрии. Альтернативный способ синтеза НФК-PEG описан в Buttner, W. et al., описание патента ГДР № DD 279486 A1.
Амидные связки с уриказой могут быть получены с помощью N-гидроксисукцинимидного сложного эфира карбоксиловой кислоты, производного от PEG (Shearwater Polymers). Вторичные аминовые связки могут формироваться с помощью 2,2,2-трифторэтансульфонилового PEG (тресил PEG; Shearwater Polymers) или путем восстановительного алкилирования с помощью PEG-альдегида (Shearwater Polymers) и цианборгидрида натрия.
В конъюгатах, содержащих PEG с молекулярными весами между 5 и 30 кДа, максимальное количество нитей PEG, связанных с одной подъединицей при сохранении по меньшей мере 75% уриколитической активности немодифицированного фермента, находится в диапазоне от 2 нитей для уриказы соевых бобов до более 10 нитей для СБХ-уриказы (см. условия теста в Примере 1 и результаты на фиг.1А-5Б). Последняя степень PEG-илирования соответствует приблизительно одной трети всех аминогрупп. В одном из вариантов выполнении среднее количество нитей PEG, связанных с каждой подъединицей уриказы, находится в пределах от 2 до 10. В предпочтительном выполнении среднее количество нитей PEG, связанных с каждой подъединицей уриказы, находится в пределах от 3 до 8. В еще более предпочтительном выполнении среднее количество нитей PEG, ковалентно связанных с каждой подъединицей уриказы, находится в пределах от 4 до 6. В еще одном выполнении молекулярный вес PEG, используемого для реакции связывания, находится в пределах от 5 до 100 кДа, предпочтительно от 10 до 60 кДа и более предпочтительно от 20 до 40 кДа, например равен 30 кДа.
Как известно, существует несколько факторов, которые могут влиять на выбор оптимального молекулярного веса и количества нитей PEG для связывания с данной формой уриказы. В общем, уменьшение или устранение иммуногенности без значительной потери уриколитической активности может требовать связывания относительно большего количества нитей PEG более низкого молекулярного веса по сравнению с меньшим количеством нитей PEG большего молекулярного веса. Например, оптимально эффективными могут быть либо 6 нитей PEG с весом 20 кДа на подъединицу, либо 4 нити PEG с весом 30 кДа на подъединицу. Подобным же образом каждая отличная форма уриказы может иметь другие оптимальные значения в отношении и к размеру, и к количеству нитей. См. фиг.1А-5Б.
Конъюгирование с PEG делает все протестированые уриказы растворимыми и стабильными в буферах при физиологическом рН без добавления аналога субстрата или ингибитора, такого как 8-азаксантин, который используется в качестве стабилизатора в грибной уриказе (Uricozyme®). Два различных конъюгата СБХ-уриказы - один, содержащий 6 нитей PEG весом 10 кДа на подъединицу, и другой, содержащий 2 нити PEG весом 19 кДа на подъединицу, сохраняли значительную активность после инкубации в сыворотке мыши в течение более чем один месяц при 37°С. Вдобавок несколько конъюгатов имели в мышах циркуляционную полужизнь продолжительнее двух дней в противоположность полужизням продолжительностью 8 часов или 24 часа, о которых сообщалось ранее в отношении PEG-модифицированных уриказ млекопитающего и микробного происхождения. Chen et al. (1981); Fuertges, F. et al. (1990) J Contr Release 11:139-148; Fujita, T, et al., (1991) J Pharmacobiodyn 14:623-629. Более длительные полужизни инъецируемых белковых лекарств делают их более экономичными и могут привести к улучшенному восприятию пациентом. Более продолжительная полужизнь показывает также, что эти продукты лучше переносятся организмом.
Когда PEG-конъюгаты СБХ-уриказы были приготовлены из очищенной тетрамерной формы белка (четыре подъединицы по 35 кДа), они проявляли сильно уменьшенную иммуногенность у мышей (фиг.7) в противоположность умеренной иммуногенности PEG-конъюгатов с большими формами фермента (например, с октамерами по 35 кДа на подъединицу; см. фиг.12) и очень высокой иммуногенности немодифицированного фермента. Повторные инъекции PEG-уриказы по настоящему изобретению уриказодефицитным мышам устраняли у них гиперурикемию более чем на 2 месяца и защищали структуру и функцию их почек от разрушения, связанного с мочевой кислотой (фиг.8-11).
Инъекции полностью активных конъюгатов СБХ-уриказы с PEG весом 10 кДа (фиг.3А-3Б) сильно уменьшали гиперурикемию у гомозиготных уриказодефицитных мышей (фиг.8). Уровни мочевой кислоты в моче были также сильно снижены у всех уриказодефицитных мышей, которые лечились с помощью PEG-модифицированной СБХ-уриказы. Уриказодефицитные мыши получали ряд инъекций с препаратом PEG-уриказы, подобным использованному для получения данных фиг.8. Это лечение снижало тяжесть дефекта концентрирования мочи, как показано измерениями осмоляльности мочи при нормальных условиях и после 12-часового периода водной депривации (фиг.9) и потреблением ими воды и выходом мочи (фиг.10) по сравнению с соответствующими измерениями для генетически подобных мышей, не получавших лечения. Также было продемонстрировано, что десять недель лечения, начатого в первые десять дней жизни, гомозиготных уриказодефицитных (uox-/-) "нокаутированных" мышей с помощью PEG-уриказы по настоящему изобретению уменьшило тяжесть вызванного уратом нарушения почечной архитектуры, как показано с помощью магниторезонансной микроскопии (фиг.11). См. способы микроскопии в Hedlund, LW, et al. (1991) FundAppl Toxicol 16:787-797; Johnson, GA. et al. (1992) в JC Gore (ред.), Reviews of Magnetic Resonance in Medicine, Vol.4 (стр.187-219) New York: Pergamon Press.
Очищенные препараты встречающихся в природе и рекомбинантных уриказ обычно содержат смесь совокупностей фермента в дополнение к тетрамерной (140 кДа) форме. Процент тетрамерной формы в каждом уриказном препарате обычно варьируется от 20 до 90%. Несмотря на очевидность того, что не PEG-илированные совокупности нескольких других белков в высокой степени иммуногенны (см., например, Moore, WV. et al. (1980) J Clin Endocrinol Metab 51:691-697), предыдущие исследования PEG-уриказы не описывают никаких усилий по ограничению содержания совокупностей, предполагая, что потенциальная иммуногенность PEG-модифицированных совокупностей не учитывалась. На основании наблюдений представляется вероятным, что такие совокупности присутствовали в ферментных препаратах, использовавшихся для предшествующих синтезов PEG-уриказы. Их присутствие могло сделать задачу приготовления неиммуногенных конъюгатов более сложной. Также представляется, что большие потери уриколитической активности, наблюдавшиеся в предшествующих исследованиях по PEG-илированию уриказы, были связаны с большим количеством связываемых нитей PEG низкого молекулярного веса. С другой стороны, способы очищения и PEG-илирования уриказы, описанные здесь, обеспечивают ковалентное присоединение 10 нитей PEG на подъединицу при сохранении более 75% уриколитической активности, по меньшей мере для определенных уриказ, например свино-бабуиновой химерической уриказы и фермента из A. flavus (см. фиг.3А и 4А).
В еще одном предпочтительном выполнении практически все совокупности тетрамерной формы фермента могут быть удалены путем ионообменной или размероисключающей хроматографии при рН в пределах от 9 до 10,5, предпочтительно 10,2, до конъюгации с PEG результирующего практически полностью тетрамерного препарата уриказы. Молекулярный вес уриказы в каждой фракции, выходящей из препарационной колонны, может контролироваться посредством любой аналитической технологии зависимости от размера, в том числе, к примеру, ВПЖХ (высокопроизводительной жидкостной хроматографии), традиционной размероисключающей хроматографии, центрифугирования, светорассеивания, капиллярного электрофореза или гелевого электрофореза в неденатурирующем буфере. Для тетрамерной уриказы, выделенной с помощью размероисключающей хроматографии, фракции, содержащие только форму фермента с весом 140 кДа, могут объединяться и использоваться для конъюгации с PEG. Для тетрамерной уриказы, выделенной с помощью ионообменной хроматографии, фракции, выходящие из ионообменной колонны, могут анализироваться по отношению к размеру для определения, какие фракции содержат значительные количества тетрамерной формы без обнаруживаемых совокупностей. Из объединенной таким образом уриказы по меньшей мере 90% может находиться в тетрамерной форме; нежелательные совокупности, таким образом, составляют приблизительно 10%, 5%, 2% или менее от всей выделенной уриказы.
Представленные здесь результаты показывают, что даже при сильном PEG-илировании формы СБХ, бóльшие, чем тетрамер, являются сильно иммуногенными для мышей (фиг.12). Более того, у мышей, которые один раз были инъецированы с помощью PEG-конъюгатов совокупностей уриказы, уриколитическая активность при последующих инъекциях либо PEG-илированных тетрамеров, либо PEG-илированных совокупностей быстро устранялась из кровообращения. В противоположность этому конъюгаты, приготовленные из уриказы, содержащей менее 5% совокупностей, могли многократно повторно инъецироваться без какого-либо ускорения их очищения (фиг.7) и без обнаруживаемого образования антител, что показал чувствительный ферментно-связанный иммунный тест. Использование сильно очищенной тетрамерной уриказы дополнительно отличает улучшенные конъюгаты по настоящему изобретению от ранее описанных препаратов PEG-уриказы. Напротив, присутствие значительной доли (например, >10%) совокупностей в уриказных препаратах, использовавшихся некоторыми предшествующими исследователями, приводило их к связыванию большого количества нитей PEG в попытке подавить иммуногенность. Следовательно, ферментная активность полученных конъюгатов была значительно снижена. Изобретение предполагает PEG-илированную уриказу в нететрамерной форме, такую как, к примеру, димеры уриказы, в тех пределах, пока такая конъюгированная уриказа сохраняла по меньшей мере 75% своей уриколитической активности и являлась практически неиммуногенной.
Следующие примеры, которые никоим образом не должны рассматриваться как ограничение изобретения, иллюстрируют различные раскрытые выше аспекты. Эти примеры описывают PEG-уриказы, приготовленные путем связывания активированных (т.е. электрофильных) производных PEG различных размеров и составов с встречающимися в природе свиной, грибной или бактериальной уриказами, либо с рекомбинантными соевой, свиной или свино-бабуиновой химерической уриказами. Результаты исследований активности, растворимости, стабильности, фармакокинетики, фармакодинамики и иммунологических исследований содержатся в примерах. Данные на фиг.8-11 делают очевидной способность PEG-модифицированной СБХ-уриказы по настоящему изобретению корректировать гиперурикемию и гиперуринурию и предохранять структуру и функцию почек в животной модели, имеющей гиперурикемию и гиперуринурию, вызывающие серьезное разрушение почек. Wu, X. et al. (1994) Proc Natl Acad Sci USA 91:742-746. Эти примеры обеспечивают специалистам руководство по приготовлению практически неиммуногенных конъюгатов уриказы, сохраняющих по меньшей мере 75% уриколитической активности немодифицированного фермента.
ПРИМЕР 1
Очистка тетрамерной формы уриказы
Тетрамерная форма уриказы (молекулярный вес ок. 140 кДа) был получен в чистом виде из раствора уриказы свиной печени путем препаративной размероисключающей или ионообменной хроматографии с последующей аналитической размероисключающей хроматографией. Уриказа свиной печени была приобретена у компании Sigms-Aldrich, St. Louis, МО, номер по каталогу U2350 или U3377 либо у компании Boehringer Mannheim, Indianapolis, IN.
Препаративная и аналитическая размероисключающая хроматография выполнялась при рН 10-10,5, предпочтительно 10,2 в 10 ммоль-натриевом буфере, содержащем 0,1 моль NaCl, в колоннах Superdex 200, предварительно откалиброванных с помощью белков известного молекулярного веса. Superdex были приобретены у Amersham Pharmacia, Piscataway, NJ. Может использоваться любой буфер, способный поддерживать желательный уровень рН и совместимый с химией, которая предназначена для последующего связывания с PEG. Такие буферы хорошо известны из уровня техники. Ультрафиолетовое поглощение элюата из препаративной колонны наблюдалось при 280 нм, и содержащие уриказу части элюата, соответствующие молекулярному весу желательной тетрамерной формы, но свободные от соединений с большим молекулярным весом, собирались для использования при синтезе практически неиммуногенной PEG-уриказы, как описано в Примере 2. Альтернативно тетрамерные формы уриказы могут быть выделены с помощью другого размероисключающего средства, такого как Superose 12 (Amersham Pharmacia) или любого другого средства, совместимого с мягкими алкалиновыми растворами и имеющего диапазон фракционирования подходящего размера. Такие средства доступны и хорошо известны из уровня техники.
Ионообменная хроматография выполнялась при рН 10-10,5, предпочтительно 10,2, в колоннах Mono Q (Amersham Pharmacia, Piscataway, NJ), которые были сбалансированы с помощью 0,1 молярного натриево-карбонатного буфера. Любой буфер, совместимый с химией связывания с PEG и способный поддерживать желательный уровень рН, может быть использован при достаточно низкой ионной концентрации, обеспечивающей адсорбцию уриказы к колонне. Такие буферы хорошо известны из уровня техники. Ультрафиолетовое поглощение элюата наблюдалось на 280 нм в ходе элюирования уриказы из ионообменной смолы путем увеличения ионной концентрации подаваемого буферного раствора, например, посредством линейного градиента от 0 до 0,5 моль NaCl в натриево-карбонатном буфере. Затем использовалась размероисключающая ВПЖХ для идентификации фракций элюата, содержащих желательную тетрамерную форму уриказы без обнаруживаемых совокупностей, для синтеза практически неиммуногенной уриказы. Альтернативно тетрамерная форма уриказы может быть изолирована с помощью других ионообменных средств, таких как Q-Sepharose (Amersham Pharmacia) или любого другого средства, которое совместимо с мягкими алкалиновыми растворами. Такие средства доступны и хорошо известны из уровня техники.
Активность уриказы была исследована с помощью модификации стандартных способов. См., например, Fridovich (1965); Nishimura et al. (1979). Растворы мочевой кислоты приготавливались ежедневно в 50-ммольном натриево-боратном буфере, рН 9,2 для обеспечения конечных концентраций в тесте от 6 до 150 мкмоль. Препараты уриказы растворялись в этом боратном буфере, содержащем альбумин бычьей сыворотки (Sigma-Aldrich, St. Louis, МО, номер по каталогу А-7030), так что окончательная концентрация альбумина в данном тесте составляла 0,1 мг/мл. После смешивания различных растворов фермента с субстратом в ячейках пластинки микротитра в микропластиночном считывателе скорость исчезновения мочевой кислоты при 25°С отслеживалась при 292 нм каждые 4 секунды в течение 3 минут. Из образцов, в которых от 10 до 40% субстрата было потреблено в течение 3 минут, по меньшей мере 20 точек данных использовались для расчета максимальной скорости уменьшения поглощения в минуту. Одна международная единица (ME) активности уриказы определяется как количество фермента, которое потребляет один микромоль мочевой кислоты в минуту; конкретные активности выражаются в МЕ/мг белка. Некоторые данные для относительных активностей уриказы на фиг.1А-5Б были получены с помощью 100 мкмоль мочевой кислоты в тесте. Прочие результаты для скорости при 100 мкмоль мочевой кислоты (V100) были рассчитаны из значений константы Михаэлиса (Км) и максимальной скорости (Vmax) для соответствующих ферментных препаратов с помощью формулы:
V100=100×Vmax/(Km+100),
где Км выражается в микромолях.
ПРИМЕР 2
Связывание PEG с тетрамерной свиной уриказой
К раствору тетрамерной уриказы в 0,1-молярном натриево-карбонатном буфере, рН 10,2, к каждому молю подъединицы уриказы (молекулярный вес 35 кДа) добавлялось 10-200 моль активированного производного монометокси PEG, например 4-нитрофенил карбонат (НФК-PEG), различных размеров. Эти и прочие подходящие активированные PEG и поставляются компанией Shearwater Polymers. Инструкции по связыванию этих PEG с белками даны в каталоге Shearwater Polymers в Интернете на www.swpolymers.com и в JM Harris et al. (ред.) (1997) Poly(ethylene glycol) Chemistry and Biological Applications. ACS Symposium Series 680, Washington, DC: American Chemical Society. Реакция связывания протекает при 0-8°С до тех пор, пока объем связывания PEG не перестает существенно меняться со временем. Непрореагировавший PEG затем удалялся из продукта реакции путем хроматографии и/или ультрафильтрации.
Количество нитей PEG, связанных с каждой подъединицей уриказы, определялось посредством адаптации способов, описанных в Kunitani, М. et al. (1991) J Chromatogr 588:125-137; Saifer et al. (1997) и Sherman et al. (1997). Аликвотные количества смесей или фракций реакции PEG-илирования из препаративных ионообменных или размероисключающих колонн определялись посредством аналитической размероисключающей ВПЖХ на TSK 5000PWXL при комнатной температуре в 10-ммольном натриево-карбонатном буфере, рН 10,2, содержащем 0,1 моль NaCl. В качестве колонны ВПЖХ использовалась колонна, выпускаемая фирмой TosoHaas, Montgomeryville, PA. Белки и PEG отслеживались детекторами ультрафиолетового поглощения и индекса рефракции. Количество белка в конъюгате рассчитывалось по площади пика индекса рефракции, скорректированного с учетом вклада белка в индекс рефракции, по отношению к площади пика индекса рефракции подходящего стандарта PEG.
Фиг.2А показывает сохранение активности PEG-илированной уриказы свиной печени в виде функции количества нитей PEG, связанных с каждой подъединицей. Данные, полученные в соответствии с настоящим изобретением (▴, □) сравниваются с данными, полученными Chen et al. (1981). Точка данных в большом круге обозначает конъюгат, который неиммунореактивен по данным Chen et al. (1981). Как показано на фиг.2А, конъюгаты тетрамерной свиной уриказы, содержащие до 6 нитей PEG весом 30 кДа на каждую подъединицу или содержащие до 7 нитей PEG весом 5 кДа на каждую подъединицу, сохраняли по меньшей мере 75% активности немодифицированного фермента. Очевидное увеличение специфической активности при увеличении количества нитей PEG весом 5 или 30 кДа (до 4 нитей на каждую подъединицу) может отразиться на относительной нерастворимости или нестабильности немодифицированного фермента по сравнению с конъюгатами. Как показано на фиг.2Б, конъюгаты свиной уриказы со в среднем более чем 3 нитями PEG весом 30 кДа на каждую подъединицу содержат большую массу PEG, чем было найдено достаточным для устранения иммунореактивности у Chen et al. (1981).
ПРИМЕР 3
Свойства PEG-конъюгатов тетрамерной рекомбинантной СБХ-уриказы
Рекомбинантная свино-бабуиновая химерическая (СБХ) уриказа была субклонирована в вектор экспресии pET3d (Novagen, Madison, WI), и результирующий плазмидный конструкт был преобразован в культуру Escherichia coli BL21(DE3)pLysS (Novagen) и экспрессирован в ней. Эти процедуры проводились с помощью способов, хорошо известных из уровня техники в молекулярной биологии. См. Erlich (1989); Sambrook et al. (1989); Ausubel, F. et al. (ред.) (1997) Short Protocols in Molecular Biology. New York: John Wiley & Sons.
Фиг.6 показывает установленную аминокислотную последовательность СБХ-уриказы (аминокислоты 1-225 ИДЕНТИФИКАТОРА ПОСЛЕДОВАТЕЛЬНОСТИ №1 и аминокислоты 226-304 ИДЕНТИФИКАТОРА ПОСЛЕДОВАТЕЛЬНОСТИ №2) в сравнении с последовательностями свиньи (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №1) и бабуина (ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №2). Остатки в последовательности бабуина, отличные от остатков в последовательности свиньи, выделены жирным шрифтом. Впервые последовательности свиньи и бабуина были определены Wu et al. (1989) и подтверждены настоящими изобретателями. ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №1 идентичен Номеру Доступа р16164 GenBank за исключением отсутствия начального метионилового остатка в последовательности GenBank. ИДЕНТИФИКАТОР ПОСЛЕДОВАТЕЛЬНОСТИ №2 идентичен Номеру Доступа р25689 GenBank за исключением отсутствия начального метионилового остатка и замены гистидина треонином в остатке 153 в последовательности GenBank (остаток 154 на фиг.6).
Тетрамерная форма СБХ-уриказы изолировалась и связывалась с PEG различного молекулярного веса, как описано в Примерах 1 и 2. Конъюгаты, приготовленные с PEG весом 5, 10, 19 или 30 кДа, содержали до 10 нитей PEG на каждую подъединицу. Те из них, которые были приготовлены с помощью PEG весом по меньшей мере 10 кДа, сохраняли более 95% начальной специфической активности рекомбинантной уриказы (фиг.3А-3Б).
Следующие свойства конъюгата тетрамерной СБХ-уриказы с приблизительно 6 нитями PEG весом 10 кДа на каждую подъединицу проиллюстрированы на следующих чертежах: отсутствие иммуногенности (фиг.7) и эффективность на уриказно-дефицитных мышах при 1) корректировании гиперурикемии и гиперуринурии (фиг.8); 2) снижении тяжести дефекта концентрирования мочи (фиг.9) и 3) снижении тяжести нефрогенного несахарного диабета (фиг.10). В дополнение к этому данная PEG-уриказа снижала тяжесть связанного с мочевой кислотой поражения почек, как видно по данным магнитно-резонансной микроскопии (фиг.11).
Фиг.7 показывает активность СБХ-уриказы в сыворотке мыши 24 часа спустя после каждой из четырех или пяти внутрибрюшинных инъекций PEG-уриказы по отношению к значению 24 часа спустя после первой инъекции. PEG-конъюгаты приготовлялись из трех различных препаратов СБХ-уриказы с помощью двух различных технологий активации PEG. Один препарат (●) тестировался на уриказно-дефицитных (uox-/-) мышах; другие два (Δ, ▪) тестировались на нормальных BALB/c мышах. Наиболее иммунореактивный препарат (Δ) был приготовлен из очищенной СБХ-уриказы, содержащей неизвестное количество совокупностей уриказы, связанной со в среднем 7 нитями PEG весом 5 кДа на каждую подъединицу, с помощью сукцинимидилово-карбонатного производного PEG (CK-PEG). Zalipsky, патент США №5612460, включенный сюда посредством ссылки. Умеренно-иммунореактивный препарат (▪) был приготовлен путем связывания препарата СБХ-уриказы, содержащего 11% совокупностей со в среднем 2 нитями PEG весом 19 кДа на каждую подъединицу, с помощью 4-нитрофенилкарбонатного производного PEG (НФК-PEG). Sherman et al. (1997). Наименее иммунореактивный препарат (●) был приготовлен путем связывания в среднем 6 нитей НФК-PEG весом 10 кДа на каждую подъединицу с препаратом СБХ-уриказы, содержащим <5% аггрегированной уриказы.
Фиг.8 показывает обратную зависимость между концентрациями мочевой кислоты в сыворотке и моче и активностью инъецированной PEG-уриказы в сыворотке уриказно-дефицитной (uox-/-) мыши. Инъекции в момент времени 0 и спустя 72 часа содержали 0,43 МЕ СБХ-уриказы, конъюгированной со в среднем 6 нитями PEG весом 10 кДа на каждую подъединицу фермента.
Фиг.9 показывает, что лечение уриказно-дефицитных мышей с помощью PEG-модифицированной СБХ-уриказы снизило тяжесть дефекта концентрирования мочи. Среднее и среднеквадратичное отклонение данных для осмоляльности мочи показаны для двух мышей, содержащих одну копию нормального мышиного гена уриказы (uox+/-), шести не подвергнутых лечению гомозиготных уриказно-дефицитных мышей (uox-/-) и шести гомозиготных уриказно-дефицитных мышей, которые были десять раз инъецированы между третьим и семьдесят вторым днем жизни с помощью либо 95, либо 190 мМЕ PEG-уриказы. Мыши каждой генетической группы либо получали воду ad libitum (закрашенные прямоугольники), либо были лишены воды в течение 12 часов (штрихованные прямоугольники) до сбора их мочи.
Фиг.10 показывает, что лечение уриказно-дефицитных мышей с помощью PEG-модифицированной СБХ-уриказы снизило тяжесть нефрогенного несахарного диабета, характеризующегося ненормально высоким потреблением воды и ненормально высоким выходом мочи. Генетические основы мышей и протокол лечения были теми же, что и на фиг.9. Среднее и среднеквадратичное отклонение дневного потребления воды (сплошные прямоугольники) и выход мочи (штрихованные прямоугольники) показаны для трех групп по шесть мышей.
Фиг.11 показывает, что лечение уриказно-дефицитных мышей с помощью PEG-модифицированной СБХ-уриказы снизило тяжесть вызванной мочевой кислотой нефропатии, как показано магнитно-резонансной микроскопией. Генетические основы трех групп мышей и протокол лечения были такими же, что и на фиг.9 и 10.
В дополнение к результатам, приведенным на фиг.8-11, было продемонстрировано, что уровни мочевой кислоты в моче всех уриказно-дефицитных мышей сильно снижались после лечения с помощью PEG-модифицированной уриказы. Наконец, фиг.12 показывает, что в отличие от PEG-модифицированной тетрамерной формы СБХ-уриказы октамерная форма (молекулярный вес =280 кДа) даже при сильном PEG-илировании является иммуногенной для мышей. Это свойство отражается в ускоренном очищении PEG-модифицированного октамера в течение 5 дней после одной внутрибрюшинной инъекции. Те же мыши повторно инъецировались той же дозой тех же препаратов PEG-уриказы на 8 и 15 дни. Двадцать четыре часа после второй и третьей инъекций уриколитическая активность была необнаруживаема в сыворотках мышей, инъецированных с помощью PEG-илированного октамера, но обнаруживаема в сыворотках тех мышей, которые были инъецированы с помощью PEG-илированного тетрамера. Эти результаты в комбинации с ускоренным очищением PEG-илированного октамера, наблюдавшимся после первой инъекции (фиг.12), поддерживают полезность устранения всех форм уриказы больших, чем тетрамер, до PEG-илирования фермента.
ПРИМЕР 4
PEG-конъюгация уриказы из Candida utilis
Уриказа из Candida utilis приобреталась либо у компании Sigma-Aldrich (St. Louis, МО; номер по каталогу U1878), либо у компании Worthington Biochemical Corporation (Freehold, NJ; номер по каталогу URYW). Действуя по описаниям Примеров 1 и 2, тетрамерную форму изолировали и синтезировали PEG-конъюгаты с помощью PEG весом 5, 10 или 30 кДа (фиг.1А-1Б). Фиг.1А показывает сохранение активности PEG-илированной уриказы из Candida utilis в виде функции количества нитей PEG, связанных с каждой подъединицей. Данные, полученные в соответствии с настоящим изобретением (▴, ●, □) сравниваются с данными Nishimura et al. (1979); Nishimura et al. (1981); Chen et al. (1981); Davis et al. (1981); Tsuji et al. (1985); Yasuda et al. (1990) и Fujita et al. (1991). Точки данных в больших кругах обозначают конъюгаты, которые описываются как неантигенные в Nishimura et al. (1979 или 1981) или неиммунореактивные в Chen et al. (1981).
Фиг.1Б показывает сохранение активности PEG-илированной уриказой из Candida utilis в виде функции общей массы PEG, связанной с каждой подъединицей. Данные, полученные в соответствии с настоящим изобретением (▴, ●, □) сравниваются с данными тех же трудов, что и на фиг.1А. Точки данных в больших кружках имеют то же значение, что и на фиг.1А.
Как показано на фиг.1А и 1Б, конъюгаты со в среднем до 6 нитей PEG весом 5 или 30 кДа либо 9 нитей PEG весом 10 кДа на каждую подъединицу сохраняют по меньшей мере 75% активности немодифицированного фермента. Очевидное увеличение специфической активности при прикреплении увеличенного количества нитей PEG весом 30 кДа (до 5 или 6 нитей на каждую подъединицу) может отражать относительную нерастворимость или нестабильность немодифицированного фермента по сравнению с конъюгатами.
ПРИМЕР 5
PEG-конъюгация уриказы из Aspergillus flavus
Уриказа из Aspergillus flavus приобреталась у компании Sanofi Whinthrop (Gentilly Cedex, France). Действуя, как описано в Примере 2, синтезировали конъюгаты с помощью PEG различного молекулярного веса (фиг.4А-4Б). Конъюгаты, приготовленные путем связывания фермента из A. flavus со в среднем до 12 нитей PEG весом 5 кДа или до 7 нитей PEG весом 30 кДа на каждую подъединицу, сохраняли 75% начальной специфической активности этой грибной уриказы.
ПРИМЕР 6
PEG-конъюгация уриказы сои
Рекомбинантная уриказа из узелка соевого корня (называемая также нодулин 35) приготовлялась и очищалась, как описывали Kahn и Tipton (Kahn, К. et al. (1997) Biochemistry 36:4731-4738), и была предоставлена доктором Типтоном (University of Missouri, Columbia, МО). Действуя по описаниям, данным в Примерах 1 и 2, изолировали тетрамерную форму и приготавливали конъюгаты с помощью PEG различного молекулярного веса (фиг.5А-5Б). В противоположность уриказе из Candida utilis (фиг.1А), свиной уриказы (фиг.2А), свино-бабуиновой химерической уриказы (фиг.3А) и уриказы из Aspergillus flavus (фиг.4А) соевый фермент переносил связывание только приблизительно 2 нитей PEG весом 5 или 30 кДа на каждую подъединицу с сохранением по меньшей мере 75% начальной уриколитической активности.
ПРИМЕР 7
PEG-конъюгация уриказы из Arthrobacter slobiformis
Уриказа из Arthrobacter globiformis приобреталась у компании Sigma-Aldrich (номер по каталогу U7128). См. патент Японии №9-154581. Действуя по описаниям, данным в Примерах 1 и 2, изолировали тетрамерную форму и приготавливали конъюгаты с PEG весом 5 и 30 кДа. Хотя конъюгаты со в среднем более 3 нитей PEG весом 5 кДа на каждую подъединицу сохраняли менее 60% начальной специфической активности, конъюгаты со в среднем приблизительно 2 нитями PEG весом 30 кДа на каждую подъединицу сохраняли по меньшей мере 85% начальной специфической активности.
ПРИМЕР 8
PEG-конъюгация аминоусеченной свиной и СБХ-уриказ
Рекомбинантные свиная и СБХ-уриказы, в которых уничтожены первые шесть аминокислот со стороны аминотерминала, экспрессируются в Е. coli и очищаются от нее посредством стандартных методов, как описано в Примере 3. Действуя по описаниям, данным в Примерах 1 и 2, синтезировали PEG-конъюгаты аминоусеченных уриказ для получения неиммуногенных конъюгатов, сохраняющих по меньшей мере 75% начальной специфической активности.
ПРИМЕР 9
PEG-конъюгация свиной и СБХ-уриказ, усеченных со стороны карбоксилового терминала либо как со стороны аминотерминала, так и со стороны карбоксилового терминала
Рекомбинантные свиная и СБХ-уриказы, в которых уничтожены последние три аминокислоты со стороны карбоксилового терминала, экспрессируются в Е. coli и очищаются от нее посредством стандартных методов, как описано в Примере 3. Это карбоксилово-терминальное уничтожение может улучшить растворимость немодифицированных ферментов, поскольку оно удаляет пероксисомно-целевой сигнал. См. Miura et al. (1994). Действуя по описанию, данному в Примерах 1 и 2, синтезировали PEG-конъюгаты карбоксил-усеченных уриказ для получения практически неиммуногенных конъюгатов, сохраняющих по меньшей мере 75% начальной специфической активности. Последовательность рекомбинантной СБХ-уриказы, усеченная на шесть остатков со стороны аминотерминала и на три остатка со стороны карбоксилового терминала (СБХ-NT-CT), показана на фиг.6. Эта уриказа экспрессируется, очищается и PEG-илируется, как описано в Примерах 1, 2 и 3, для получения практически неиммуногенных конъюгатов, сохраняющих по меньшей мере 75% начальной специфической активности.
ПРИМЕР 10
PEG-конъюгация мутантов свиной уриказы, содержащих увеличенное количество мест присоединения PEG
Рекомбинантные свиные уриказы, в которых потенциальное количество мест присоединения PEG увеличено путем замены одного или более аргининовых остатков лизином, приготовлены, как описано в Примере 3. См. Hershfield, MS, et al. (1991) Proc Natl Acad Sci USA 88:7185-7189. Аминокислотная последовательность одного из примеров такого мутанта (CKS-уриказа), в которой аргинин в остатке 291 заменен лизином, а треонин в остатке 301 заменен серином, показана на фиг.6. Действуя по описаниям, данным в Примерах 1 и 2, PEG конъюгировали с этой уриказой для получения практически неиммуногенных конъюгатов, сохраняющих по меньшей мере 75% начальной специфической активности рекомбинантной уриказы.
ПРИМЕР 11
PEG-конъюгация мутанта рекомбинантной уриказы бабуина
С помощью стандартных способов молекулярной биологии, как и в Примере 3, конструируется уриказа бабуина, имеющая аминокислотное замещение (гистидин вместо тирозина) в позиции 97 (см. последовательность бабуина на фиг.6). Действуя по описаниям, данным в Примерах 1 и 2, синтезировали PEG-конъюгаты тетрамерной формы мутанта рекомбинантной уриказы бабуина для получения конъюгатов со значительно сниженной иммуногенностью, сохраняющих по меньшей мере 75% начальной специфической активности рекомбинантной уриказы.
ПРИМЕР 12
Иммуногенность PEG-конъюгатов из Candida utilis, Aspergillus flavus и Arthrobacter globiformis
Уриказы из Candida utilis, Aspergillus flavus и Arthrobacter globiformis получены, как описано в Примерах 4, 5 и 7 соответственно. Действуя по описаниям, данным в Примерах 1 и 2, синтезировали PEG-конъюгаты с PEG весом 5, 10, 20 или 30 кДа. Иммуногенность этих конъюгатов сильно снижена или устранена.


Изобретение относится к биофармакологии и касается PEG-конъюгатов встречающейся в природе или рекомбинантной уратоксидазы (уриказы). Уриказа ковалентно связывается с поли(этиленгликолем) или поли(этиленоксидом) (оба обозначаются PEG), причем в среднем от 2 до 10 нитей PEG конъюгируют с каждой подъединицей уриказы, и PEG имеет средний молекулярный вес между примерно 5 и 100 кДа. Полученные PEG-уриказные конъюгаты являются практически неиммуногенными и сохраняют по меньшей мере 75% уриколитической активности немодифицированного фермента. 3 н. и 41 з.п. ф-лы, 17 ил.
| US 4179337 А, 18.12.1997 | |||
| RU 94006023 А1, 20.04.1996 | |||
| ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ УРАТОКСИДАЗНОЙ АКТИВНОСТЬЮ, ФРАГМЕНТ ДНК, ОБЕСПЕЧИВАЮЩИЙ ЭКСПРЕССИЮ ПОЛИПЕПТИДА С УРАТОКСИДАЗНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ), ВЕКТОР ЭКСПРЕССИИ, СОДЕРЖАЩИЙ ФРАГМЕНТ ДНК, ОБЕСПЕЧИВАЮЩИЙ ЭКСПРЕССИЮ ПОЛИПЕПТИДА С УРАТОКСИДАЗНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ), ШТАММ, ЭКСПРЕССИРУЮЩИЙ ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ УРАТОКСИДАЗНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА, ОБЛАДАЮЩЕГО УРАТОКСИДАЗНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2105812C1 |
Авторы
Даты
2009-03-20—Публикация
2006-03-09—Подача