Изобретение относится к молекулярной биологии, микробиологии и гистологии и может использоваться как в медицинской диагностике, так и для научных исследований.
В современной практике широко применяются иммунофлуоресцентные гистохимические методы анализа (Shi S.R., Cote R.J., Taylor C.R. Antigen retrieval immunohistochemistry: past, present, and future. Histochem. Cytochem. 1997; 45(3):327-343; Shi S.R., Cote R.J., Taylor C.R. Antigen retrieval techniques: current perspectives. J. Histochem. Cytochem. 2001; 49(8):931-937), характеризующиеся сочетанием специфичности (благодаря использованию высокоселективных антител) и чувствительности определения (обусловленную возможностями флуоресцентных маркеров). При этом иммуногистохимический подход позволяет проводить структурную характеристику образцов - анализ пространственного распределения специфических антигенов (окрашивание мембран, цитоплазмы, ядра и других элементов клеток). Иммунохимические методы окрашивания гистологических препаратов подразделяются на прямые, в которых метка непосредственно присоединена к иммунореагенту (специфическому антителу), и непрямые, в которых введение метки в иммунный комплекс является дополнительной стадией (Михайлов А.Т., Симирский В.Н. Методы иммунологического анализа в биологии развития. // СПб.: Наука. 1991). Несмотря на большую продолжительность непрямого окрашивания, в значительной части случаев оно является предпочтительным. Непрямое мечение позволяет провести эффективное блокирование сайтов неспецифической сорбции маркера, тем самым повышая чувствительность и достоверность детекции. Кроме того, в непрямом анализе конъюгат маркера является универсальным реагентом, пригодным для определения самых разных антигенов. Непрямое мечение исключает необходимость для каждой новой задачи синтезировать специфические конъюгаты и контролировать свойства полученных при синтезе продуктов.
При реализации непрямого иммуногистохимического окрашивания в современной практике используются два основных способа введения метки:
- взаимодействие специфических антител и меченых антивидовых антител;
- модификация специфических антител биотином и их последующее выявление с помощью конъюгата (стрепт)авидин-маркер.
Хотя первый способ позволяет работать с нативными специфическими антителами, не прибегая к какой бы то ни было их обработке, взаимодействие с антивидовыми антителами вносит существенный элемент неопределенности, поскольку в зависимости от свойств антивидовых и специфических антител эффективность взаимодействия между ними может значительно варьировать. В этом отношении реакция биотин-(стрепт)авидин более перспективна, поскольку она характеризуется высокой константой связывания - около 1015 М-1 (на 6-7 порядков превосходя реакцию с антивидовыми антителами), неизменной для всех взаимодействующих молекул и не зависящей от индивидуальных свойств используемых препаратов (Muus C.J., Azar H.A. Application of immunochemistry to the diagnosis of human neoplasms in routine histologic sections. Diagn. Immunol. 1986; 4(3):125-139; Wilchek M., Bayer E.A. Applications of avidin-biotin technology: literature survey. Methods Enzymol. 1990; 184: 14-45; Diamandis E.P., Christopoulos Т.К. The biotin-(strept)avidin system: principles and applications in biotechnology. Clin. Chem. 1991; 37(5):625-636; Lindqvist Y., Schneider G. Protein-biotin interactions. Curr. Opin. Struct. Biol. 1996; 6(6):798-803; Kim S.H., Jung K.C., Shin Y.K., Lee K.M., Park Y.S., Choi Y.L., Oh K.I., Kim M.K,, Chung D.H., Son H.G., Park S.H. The enhanced reactivity of endogenous biotin-like molecules by antigen retrieval procedures and signal amplification with tyramine. Histochem. J. 2002; 34(3-4):97-103). В настоящее время коммерчески доступны как производные биотина (активированные эфиры, позволяющие быстро и в щадящих условиях биотинилировать специфические антитела или другие необходимые белки), так и конъюгаты стрептавидина с флуоресцентными метками. (Evensen О, Dale OB, Nilsen A. Immunohistochemical identification of Renibacterium salmoninarum by monoclonal antibodies in paraffin-embedded tissues of Atlantic salmon (Saimo salar L.), using paired immunoenzyme and paired immunofluorescence techniques. J. Vet. Diagn. Invest. 1994; 6(1):48-55; Selvanayagam Z.E., Gopalakrishnakone P. Tests for detection of snake venoms, toxins and venom antibodies: review on recent trends (1987-1997). Toxicon. 1999; 37(4):565-586; Wilbur D.S., Pathare P.M., Hamlin D.K., Stayton P.S., To R., Klumb L.A., Buhler K.R., Vessella R.L. Development of new biotin/streptavidin reagents for pretargeting. Biomol. Eng. 1999; 16 (1-4): 113-118; Sugiyama К., Hoshino N., Tatsumi H., Fukuda S. Complexes containing crosslinked avidin, analytical method with the use of crosslinked avidin and analytical reagents and kits. US Patent 6787325. September 7, 2004).
Непрямой иммуногистохимический анализ с использованием системы биотин-(стрепт)авидин в наиболее распространенных вариантах включает следующие этапы (Avidin-Biotin Technology. Methods in Enzymology: Vol.184. John N. Abelson, Melvin I. Simon, Meir Wilchek, Edward A. Bayer, eds. San Diego, CA, USA. Academic Press, 1990):
А) Предварительно проводится биотинилирование специфических антител с отделением продукта синтеза - конъюгата, содержащего одну молекулу антитела и неопределенное (варьирующее в пределах синтеза для разных молекул конъюгата) количество молекул биотина - от непрореагировавшего активированного биотина и других низкомолекулярных компонентов реакционной среды.
Б) В результате взаимодействия биотинилированных антител с препаратом происходит их связывание с пространственно доступными антигенными детерминантами на поверхности клеток или иных анализируемых структур.
В) Не связавшиеся с препаратом молекулы биотинилированных антител удаляются посредством промывки препарата.
Г) Препарат инкубируется в растворе конъюгата стрептавидин - флуоресцентный маркер, после чего непрореагировавшие молекулы конъюгата отмываются. Содержащие маркер иммобилизованные комплексы детектируются с помощью проточного цитометра или микроскопа с флуоресцентной детекцией.
Е) На основании зарегистрированного сигнала делается вывод о наличии и распределении антигена в пробе.
Один из вариантов реализации данного подхода описан в статье A.Scorilas, A.Bjartell, H.Lilja, С.Moller, E.P.Diamandis. Streptavidin-polyvinylamine conjugates labeled with a europium chelate: Applications in immunoassay, immunohistochemistry, and microarrays. Clin. Chem., 2000; 46 (9), 1450-1455. Ниже представлено изложение предлагаемой авторами методики проведения анализа, рассматриваемой в настоящей заявке в качестве прототипной:
Анализируемые срезы предварительно обрабатывают универсальным тканевым восстановителем в течение 10 мин для предотвращения неспецифического связывания. Затем на препарат наносят раствор биотинилированных антител в рабочем разведении и инкубируют в течение 1 часа при 37°С. После этого проводят взаимодействие со стрептавидином, меченным флуоресцентной европиевой меткой, и инкубируют еще 25 мин. Непрореагировавшие антитела удаляют отмывкой раствором детергента Tween-20 (0,5 мл/л). Детекцию подготовленных и высушенных срезов проводят методом флуоресцентной микроскопии.
Отметим, что введение флуоресцентной метки посредством взаимодействия биотин-(степт)авидин имеет существенные недостатки, не преодоленные в известных на сегодняшний день работах.
1. При химическом конъюгировании антител с биотином образуется смесь продуктов разной стехиометрии и, соответственно, разных свойств. Соотношение продуктов зависит как от контролируемых (исходные концентрации реагентов, продолжительность взаимодействия, температурный режим, состав реакционной среды), так и от неконтролируемых факторов (наличие примесей, степень сохранения модифицированным биотином реакционной способности, конформационное состояние антител, число и степень доступности реакционно-способных групп на их поверхности).
2. При необходимости контакта конъюгата (стрепт)авидин-маркер с пробой результаты анализа искажаются в тех случаях, когда матрикс пробы содержит биотин, что свойственно, в частности, пробам мяса (Kopinski J.S., Leibholz J., Bryden W.L. Biotin studies in pigs. 4. Biotin availability in feedstuffs for pigs and chickens. Br. J. Nutr. 1989; 62(3):773-780). Аналогичные проблемы описаны также для иммунодетекции гельминтов (Romaris F., Iglesias R., Garcia L.O., Leiro J., Santamarina M.T., Paniagua E., Ubeira F.M. Free and bound biotin molecules in helminths: a source of artifacts for avidin biotin-based immunoassays. Parasitol. Res. 1996; 82(7):617-622). При анализе яиц имеющийся в пробе авидин (White Н.В. 3rd. Vitamin-binding proteins in the nutrition of the avian embryo. J. Exp.Zool. Suppl. 1987; 1:53-63) связывается с биотинилированными антителами, препятствуя локализации с их помощью специфических антигенных детерминант.
Возможность работы с межмолекулярными конъюгатами стандартного состава и тем самым унифицированных свойств возникает при переходе от химического конъюгирования к генно-инженерному (Witkowski A., Daunert S., Kindy M.S., Bachas L.G. Enzyme-linked immunosorbent assay for an octapeptide based on a genetically engineered fusion protein. Anal. Chem. 1993; 65(9):1147-1151; Grigorenko V., Andreeva I., Borchers Т., Spener F., Egorov A. A genetically engineered fusion protein with horseradish peroxidase as a marker enzyme for use in competitive immunoassays. Anal. Chem. 2001; 73(6):1134-1139; Rau D., Kramer К., Hock В. Single-chain Fv antibody-alkaline phosphatase fusion proteins produced by one-step cloning as rapid detection tools for ELISA. J. Immunoassay Immunochem. 2002; 23(2):129-143). Однако из-за небелковой природы биотина данный подход для него неприменим.
Задачей изобретения является разработка способа иммуногистохимического определения антигенов, в котором непрямое введение метки в детектируемые иммунные комплексы осуществляется посредством белок-белкового взаимодействия с высокой константой связывания, существенно превосходящей иммунохимические реакции, а взаимодействующие белки пригодны для генно-инженерного получения межмолекулярных конъюгатов стандартного состава.
Заявителями предлагается для введения метки использовать реакцию между бактериальным ферментом рибонуклеазой (барназой) и ее ингибитором барстаром. Данное взаимодействие характеризуется высокой аффинностью и специфичностью (константа связывания комплекса 1014 М-1), протекает в широком диапазоне параметров реакционной среды и нечувствительно к ее составу (Hartley R.W. Barnase-barstar interaction. Methods Enzymol. 2001; 341:599-611). И барназа, и барстар представляют собой небольшие белки (массой 12 и 10 кДа соответственно) без кофакторов, углеводов и иных структурных элементов небелковой природы, что делает методически простым их генно-инженерное конъюгирование. Концевые участки аминокислотных цепей барназы и барстара не участвуют в формировании специфического комплекса, что позволяет использовать их для конъюгирования с маркерами и иммунореагентами без потери активности (Deyev S.M., Yazynin S.A., Kuznetsov D.A., Jukovich M., Hartley R.W. Ribonuclease-charged vector for facile direct cloning with positive selection. Mol. Gen. Genet. 1998; 259(4):379-382). Более того, показано, что генно-инженерное присоединение барназы к антителам повышает их стабильность и благодаря этому воспроизводимость результатов анализа (Martsev S.P., Tsybovsky Y.I., Stremovskiy O.A., Odintsov S.G., Balandin T.G., Arosio P., Kravchuk Z.I., Deyev S.M. Fusion of the antiferritin antibody VL domain to barnase results in enhanced solubility and altered pH stability. Protein Eng. Des. Sel. 2004; 17 (1): 85-93). Константа связывания 1014 M-1 обеспечивает количественное формирование комплексов и отсутствие их сколько-либо существенной диссоциации за время анализа. Преимуществом системы является возможность получения конъюгатов стандартной стехиометрии также и при химическом синтезе, поскольку молекула барназы не содержит цистеиновых групп, а введенный путем сайт-специфического мутагенеза в концевой участок молекулы цистеин позволяет синтезировать конъюгаты состава 1:1.
Таким образом, отличие предлагаемого подхода от прототипного состоит в том, что присоединение метки к детектируемому иммунному комплексу осуществляют не посредством взаимодействия биотин-(стрепт)авидин, а посредством взаимодействия барназа-барстар, что позволяет получать межмолекулярные конъюгаты генно-инженерными методами и унифицировать состав конъюгатов, тем самым обеспечивая воспроизводимость результатов анализа.
Возможность реализации и эффективность предлагаемого подхода подтверждают представленные ниже примеры анализа с использованием системы барназа-барстар, вводимой в состав детектируемых иммунных комплексов посредством химического или генно-инженерного конъюгирования:
Пример 1. Цитометрическая детекция белка-онкомаркера р185HER2 на поверхности клеток аденокарциномы яичника с помощью химического конъюгата барстар - флуоресцеинизотиоцианат (ФИТЦ) и рекомбинантного конъюгата мини-антитело-барназа.
Синтез конъюгата барстар-ФИТЦ
Барстар переводили в реакционный буфер, содержащий 0,1 М тетраборат натрия, 0,1 М хлорид натрия, рН 8,8. К 50 мкл раствора барстара с концентрацией 5,7 мг/мл (0,55 мМ; количество белка 27,5 нмоль) добавляли 0,5 мг (1,3 мкмоль) сухого ФИТЦ (Sigma), растворяли при интенсивном перемешивании и комнатной температуре в течение 30 мин и инкубировали при 4°С в течение ночи. Непрореагировавший ФИТЦ удаляли двукратной гель-фильтрацией на колонке ⊘ 6 мм × 14 мм с Sephadex G-25M (Pharmacia, Швеция), уравновешенной фосфатно-солевым буфером (ФСБ) - 1,7 мМ КН2PO4, 5,2 мМ Na2HPO4, 137 мМ NaCl, 2,68 мМ KCl, рН 7,4.
Получение рекомбинантного конъюгата анти-p185HER2 мини-антитело-барназа.
Ген белка слияния анти-р185HER2 мини-антитела с барназой получали клонированием гена барназы из плазмиды рМТ413 в экспрессионную плазмиду pIG6, содержащую ген анти-р185HER2 мини-антитела и пентагистидиновую последовательность на С-конце как описано в (Deyev S.M., Waibel R., Lebedenko E.N., Schubiger A.P., Pluckthun A. Design of multivalent complexes using the barnase*barstar module. Nat. Biotechnol. 2003; 21, 1486-1492). Белок нарабатывали в клетках Е.coli штамма SB536 и очищали на Ni-NTA сефарозе.
Цитометрический анализ.
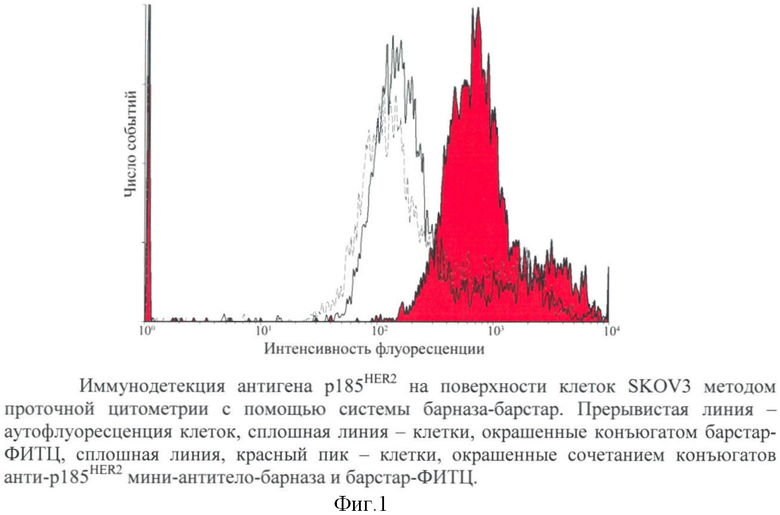
Клетки человеческой аденокарциномы яичника SKOV3, на поверхности которых экспонирован рецепторный белок р185HER2, снимали с подложки ФСБ с 5 мМ ЭДТА. Затем клетки после однократной отмывки ФСБ с 1% БСА (Sigma) помещали в круглодонные 96-луночные планшеты (Nunc, Дания). Объединяли равные объемы 100 нМ растворов рекомбинантного конъюгата анти-р185HER2 мини-антитело-барназа и конъюгата барстар-ФИТЦ в ФСБ, содержащем 1% БСА и 0,01% NaN3, и добавляли их к клеткам SKOV3. После 1 часа инкубации при +4°С клетки дважды отмывали ФСБ с 1% БСА от непрореагировавших молекул. (В контрольном опыте вместо рекомбинантного конъюгата анти-р185HER2 мини-антитело-барназа использовали ФСБ, содержащий 1% БСА и 0,01% NaN3). Взаимодействие антител с антигеном р185HER2 на поверхности клеток регистрировали с помощью проточного цитофлуориметра ELIPS XL (Coulter Corporation, США) при длине волны возбуждения 488 нм. Данные обрабатывали с помощью программного обеспечения WinMDI 2.8.
Из представленных на фиг.1 результатов следует, что средняя интенсивность флуоресценции клеток SKOV3, окрашенных с анти-р185HER2 мини-антитело-барназой и барстар-ФИТЦ, в 4.10±0.04 раза выше, чем клеток SKOV3, окрашенных только барстар-ФИТЦ. Такое различие значений интенсивности флуоресценции достоверно свидетельствует о специфическом связывании рекомбинантного конъюгата анти-р185HER2 мини-антитело-барназа с рецептором р185HER2. Интенсивность флуоресценции клеток, окрашенных конъюгатом барстар-ФИТЦ, достоверно не отличается от аутофлуоресценции клеток. Использование пары барназа-барстар позволяет идентифицировать прогностически значимый рецептор p185HER2 на поверхности человеческих раковых клеток.
Пример 2. Флуоресцентно-микроскопическая детекция белка-онкомаркера p185HER2 на поверхности клеток аденокарциномы яичника с помощью рекомбинантных конъюгатов барстара с «улучшенным» зеленым флуоресцентным белком (EGFP) и барназы с мини-антителами.
Получение рекомбинантного конъюгата барстар-EGFP.
Ген белка слияния барстара с «улучшенным» зеленым флуоресцентным белком, содержащий на N-конце гексагистидиновую последовательность, получали клонированием гена барстара из плазмиды рМТ643, кодирующей двойной мутант барстара С40/82А, в плазмиду pQE30, содержащую ген EGFP и гексагистидиновую последовательность, с использованием стандартных генно-инженерных методов (Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. Москва, Мир, 1984). Белок нарабатывали в клетках Е.coli штамма BL21(DE3) и очищали на Ni-NTA сефарозе.
Рекомбинантный конъюгат барназы с мини-антителами получали, как описано в Примере 1.
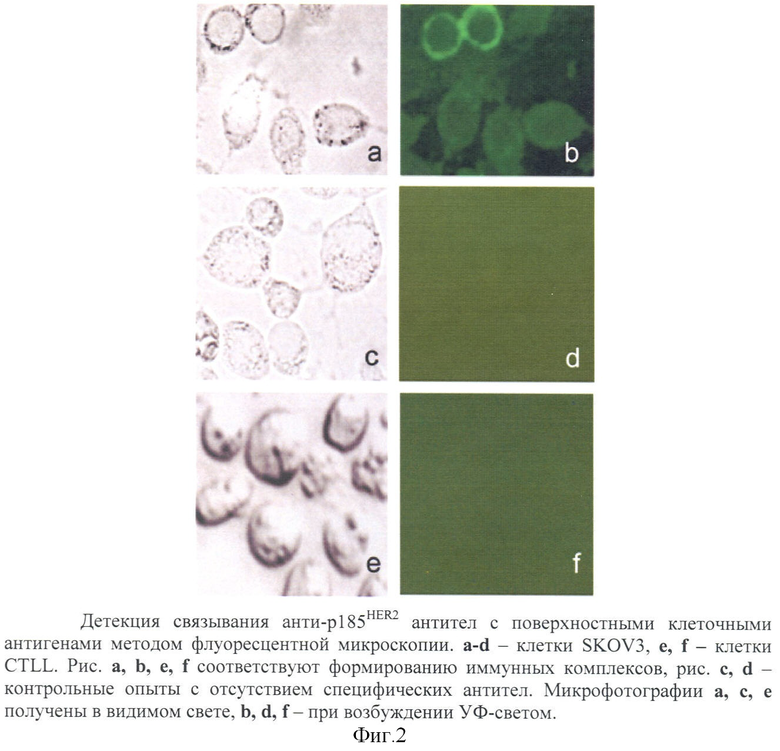
Флуоресцентно-микроскопический анализ (см. фиг.2).
Клетки SKOV3 (экспонирующие на поверхности белок p185HER2) и CTLL (лишенные p185HER2 - отрицательный контроль) культивировали в 24-луночных планшетах (Flow) при 37°С в атмосфере с 5% СО2 до плотности 2×105 клеток на лунку. Конъюгаты - рекомбинантное анти-р185HER2 мини-антитело-барназа и барстар-EGFP - смешивали в эквимолярных количествах в ФСБ, содержащем 2,5 мМ CaCl2, 2,5 мМ MgCl2, 1% БСА (Sigma) и 0,01% NaN3, добавляли к клеткам до конечной концентрации 200 нМ, инкубировали 1 ч при +4°С и затем отмывали ФСБ. (В контрольных опытах препарат рекомбинантное анти-р185HER2 мини-антитело-барназа заменяли на ФСБ, содержащий 2,5 мМ CaCl2, 2,5 мМ MgCl2, 1% БСА (Sigma) и 0,01% NaN3). Клетки анализировали с помощью инвертированного флуоресцентного микроскопа OLIMPUS CK40.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ АНТИГЕНОВ | 2005 |
|
RU2303783C1 |
| КОНСТРУКЦИЯ НА ОСНОВЕ БЕЛКОВОЙ ПАРЫ БАРНАЗА-БАРСТАР И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2480524C2 |
| Конъюгат люминесцентных наночастиц диоксида кремния с рекомбинантными однодоменными нано - моноантителами C7b ламы, способными специфически взаимодействовать с рекомбинантным белком HER2/neu - аналогом природного рецептора эпидермального фактора роста EGFR/ERBB клеток человека | 2017 |
|
RU2679075C1 |
| Способ получения рекомбинантного противоопухолевого токсина на основе белков барназа-барстар и адресного полипептида дарпина с эффектом моментальной отмены цитотоксического действия | 2015 |
|
RU2610179C1 |
| ЭКСПРЕССИОННЫЙ ПЛАЗМИДНЫЙ ДНК ВЕКТОР pETl5b-p26AEI РАЗМЕРОМ 6350 П.О. ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА P26, АУТЕНТИЧНОГО ОСНОВНОМУ КАПСИДНОМУ БЕЛКУ P26 ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ ЛОШАДЕЙ В ПРОКАРИОТИЧЕСКОЙ СИСТЕМЕ | 2024 |
|
RU2832869C1 |
| МЫШИНЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С АНТИГЕНОМ F1 ИЗ Yersinia pestis, СПОСОБ ИХ ПОЛУЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ, СПОСОБ И НАБОР ДЛЯ ДЕТЕКЦИИ Yersinia pestis | 2009 |
|
RU2420588C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОБНАРУЖЕНИЯ БИОЛОГИЧЕСКИХ ТОКСИНОВ | 2004 |
|
RU2320994C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401299C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401300C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401301C1 |
Изобретение относится к области молекулярной биологии и гистологии и касается способа иммунофлуоресцентного определения локализации антигенов. Способ основан на взаимодействии двух белков - бактериальной рибонуклеазы барназы и ее ингибитора барстара, один из которых присоединен к иммунореагенту, а другой - к флуоресцентному маркеру. Данное взаимодействие характеризуется высокой аффинностью и специфичностью (константа связывания комплекса 1014 М-1), идет в широком диапазоне параметров реакционной среды и не зависит от наличия в ней каких-либо конкурирующих или ингибирующих факторов. Использование способа позволяет получать межмолекулярные конъюгаты для иммуноанализа генно-инженерными методами и унифицировать состав конъюгатов, тем самым обеспечивая воспроизводимость результатов анализа. 2 ил.
Способ иммунофлуоресцентного определения локализации антигенов во вне- и внутриклеточных структурах, включающий формирование на поверхности биологического препарата комплексов между молекулами антигена и специфическими антителами, присоединение к комплексам флуоресцентной метки и ее детекцию, отличающийся тем, что присоединение флуоресцентной метки осуществляется посредством взаимодействия двух белков - бактериальной рибонуклеазы барназы и ее ингибитора барстара, при этом один из взаимодействующих белков генно-инженерно присоединен к иммунореагенту, а другой присоединен к флуоресцентной метке.
| SCORILAS A et al., Streptavidin-polyvinylamine conjugates labeled with a europium chelate: Applications in immunoassay, immunohistochemistry, and microarrays | |||
| Clin | |||
| Chem., 2000; 46 (9), 1450-1455, найдено в PubMed, PMID: 10973889 | |||
| Deyev S.M | |||
| et al | |||
| Ribonuclease-charged vector for facile direct cloning with positive selection, Mol Gen Genet | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
Авторы
Даты
2009-03-27—Публикация
2006-08-15—Подача