Область техники
Настоящее изобретение относится к способам, позволяющим облегчить получение диариламинов и их аналогов. Способы настоящего изобретения позволяют получать диариламины с высоким выходом и с высокой степенью чистоты. Настоящее изобретение относится также к промежуточным соединениям, пригодным для использования в способе настоящего изобретения. Настоящее изобретение относится также к диариламинам, полученным способами настоящего изобретения.
Уровень техники
Протеинкиназы участвуют в различных клеточных реакциях на внеклеточные сигналы. Недавно было обнаружено семейство активируемых митогеном протеинкиназ (MAPK). Членами этого семейства являются Ser/Thr киназы, которые активируют свои субстраты путем фосфорилирования [B. Stein et al., Ann. Rep. Med. Chem., 31, pp. 289-98 (1996)]. Сами MAPKs активируются различными сигналами, включая факторы роста, цитокины, УФ-излучение и вызывающие стресс агенты.
Одной из MAPK, представляющей особый интерес, является p38; p38, известную так же как подавляющий цитокины белок, связывающийся с противовоспалительными средствами, (CSBP) и RK, выделили из мышиных pre-B клеток, которые были трансфицированы липополисахаридным (LPS) рецептором, CD14, и индуцированы LPS. Позднее p38 была выделена и секвенирована, как и кодирующая ее кДНК в организмах людей и мышей. Активацию p38 наблюдали в клетках, стимулированных стрессами, такими как обработка липополисахаридами (LPS), УФ, анизомицином или осмотическим шоком, а также цитокинами, такими как IL-1 и TNF.
Ингибирование p38 киназы приводит к блокаде продуцирования как IL-1, так и TNF. IL-1 и TNF стимулируют продукцию других провоспалительных цитокинов, таких как IL-6 и IL-8, и вовлечены в развитие острых и хронических воспалительных заболеваний, а также постклимактерического остеопороза [R. B. Kimble et al., Endocrinol., 136, pp. 3054-61 (1995)].
На основании этих фактов считают, что p38, наряду с другими MAPKs, играет роль в опосредовании клеточной реакции на воспалительные сигналы, такие как накопление лейкоцитов, активация макрофагов/моноцитов, ресорбция тканей, лихорадка, реакции в острой фазе и нейтрофилия. Кроме того, MAPKs, такие как p38, вовлечены в раковые заболевания, в индуцируемую тромбином агрегацию тромбоцитов, иммунодефицитные состояния, аутоиммунные заболевания, гибель клеток, аллергии, остеопороз и нейродегенеративные заболевания. Ингибиторы p38 также вовлечены в сферу управления болью за счет ингибрования индуцирования эндопероксидсинтазы-2 простагландинов. Другие заболевания, связанные со сверхпродуцированием IL-1, IL-6, IL-8 или TNF, представлены в WO 96/21654.
Многие молекулы, обладающие важными с точки зрения медицины свойствами против различных мишеней, включая MAPKs, включают диариламины. Одним из примеров этого является класс молекул, идентифицированный как эффективные ингибиторы p38 MAP киназ (см., например, WO 99/58502 и WO 00/17175). Однако, хотя они и являются эффективными в качестве лекарств, существует мало способов получения ариламинсодержащих молекул без значительного количества побочных продуктов. Традиционной схемой получения молекул, включающих диариламин, является реакция присоединения ариламинов к арилгалогенидам, катализируемая палладием. Однако проблемы с избыточным присоединением арилгалогенидного компонента к амину традиционно приводили к низким выходам и к низкой степени чистоты, если при этом использовать первичный ариламин. По этой причине первичные амины обычно не используют в качестве субстратов для таких превращений, что ограничивает возможности применения реакций присоединения с использованием палладиевого катализатора.
Соответственно, существует необходимость в способе, который позволил бы облегчить синтез диариламинов и их аналогов, который позволил бы избежать проблемы избыточного арилирования и который обеспечил бы получение диариламинов с высоким выходом и с высокой степенью чистоты. Существует также необходимость в промежуточных соединениях, которые можно получать таким способом.
Сущность изобретения
В соответствии с одним из вариантов, в настоящем изобретении предложены способы облегчения синтеза диариламинов, которые позволяют избежать проблемы избыточного арилирования, применимы для крупномасштабного производства и обеспечивают высокие выходы. Настоящее изобретение позволяет также избежать использования вредных реагентов, таких как соединения олова.
Более конкретно в настоящем изобретении предложен способ, в котором первичный ариламин временно переводят во "вторичный", присоединяя к азоту подходящую защитную группу. После такого преобразования защищенное производное анилина подвергают реакции перекрестного сочетания, промотируемой солью щелочного металла или катализируемой переходным металлом, с арильной уходящей группой с получением промежуточного соединения, которое после удаления защитной группы приводит к получению диариламинового субстрата. Продукт можно получить с небольшим количеством побочных продуктов и с высоким выходом.
В настоящем изобретении предложены способы получения соединения формулы (I):

или его соли,
где Ar1 и Ar2 имеют указанные далее значения.
Способы настоящего изобретения включают стадию присоединения соединения формулы (II) к амину формулы (III) с получением диариламина формулы (I) в присутствии соли щелочного металла или катализатора на основе переходного металла:

где Ar1, Ar2, X и Y имеют указанные далее значения.
Способы настоящего изобретения обладают тем преимуществом, что позволяют получать соединение формулы (I) из производного первичного ариламина без проблемы избыточного арилирования. Способы настоящего изобретения обладают далее тем преимуществом, что позволяют получать соединение формулы (I) с высоким выходом и высокой степенью чистоты, и, кроме того, смягчают условия реакции, которую поэтому легко использовать для крупномасштабного производства.
Подробное описание изобретения
Настоящее изобретение позволяет преодолеть трудности и недостатки известных ранее способов и предоставляет способы получения соединения формулы (I):

или его соли,
где Ar1 и Ar2 независимо представляют Q;
где каждый Q представляет арильную или гетероарильную кольцевую систему, необязательно конденсированную с насыщенным или ненасыщенным 5-8-членным кольцом, содержащим 0-4 гетероатома;
где Q необязательно замещен у одного или более из кольцевых атомов одним или более заместителями, независимо выбранными из галогена; С1-С6алифатической группы, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, NR'CO2R', NR'C(O)R', SO2N(R')2, N=CH-N(R')2 или OPO3H2; С1-С6алкокси, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, SO2N(R')2, NR'CO2R', NR'C(O)R', N=CH-N(R')2 или OPO3H2; Ar3; CF3; OCF3; OR'; SR'; SO2N(R')2; OSO2R'; SCF3; NO2; CN; N(R')2; CO2R'; CO2N(R')2; C(O)N(R')2; NR'C(O)R'; NR'CO2R'; NR'C(O)C(O)R'; NR'SO2R'; OC(O)R'; NR'C(O)R2; NR'CO2R2; NR'C(O)C(O)R2; NR'C(O)N(R')2; OC(O)N(R')2; NR'SO2R2; NR'R2; N(R2)2; OC(O)R2; OPO3H2; и N=CH-N(R')2;
R' выбирают из водорода; С1-С6алифатической группы; или 5-6-членной карбоциклической или гетероциклической кольцевой системы, необязательно замещенной 1-3 заместителями, независимо выбранным из галогена, С1-С6алкокси, циано, нитро, амино, гидрокси, и С1-С6алифатической группы;
R2 представляет С1-С6алифатическую группу, необязательно замещенную N(R')2, OR', CO2R', C(O)N(R')2 или SO2N(R')2; или карбоциклическую или гетероциклическую кольцевую систему, необязательно замещенную N(R')2, OR', CO2R', C(O)N(R')2 или SO2N(R')2,
где Ar3 представляет арильную или гетероарильную кольцевую систему, необязательно конденсированную с насыщенным или ненасыщенным 5-8-членным кольцом, содержащим 0-4 гетероатома,
где Ar3 необязательно замещен у одного или более из кольцевых атомов одним или более заместителями, независимо выбранными из галогена; С1-С6 алифатической группы, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, NR'CO2R', NR'C(O)R', SO2N(R')2, N=CH-N(R')2, или OPO3H2; С1-С6алкокси, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, SO2N(R')2, NR'CO2R', NR'C(O)R', N=CH-N(R')2 или OPO3H2; CF3; OCF3; OR'; SR'; SO2N(R')2; OSO2R'; SCF3; NO2; CN; N(R')2; CO2R'; CO2N(R')2; C(O)N(R')2; NR'C(O)R'; NR'CO2R'; NR'C(O)C(O)R'; NR'SO2R'; OC(O)R'; NR'C(O)R2; NR'CO2R2; NR'C(O)C(O)R2; NR'C(O)N(R')2; OC(O)N(R')2; NR'SO2R2; NR'R2; N(R2)2; OC(O)R2; OPO3H2; и N=CH-N(R')2.
В предпочтительном варианте Ar1 и Ar2 независимо выбирают из необязательно замещенного фенила, нафтила, бензимидазолила, бензотиенила, бензофуранила, индолила, хинолинила, бензотиазолила, бензооксазолила, бензимидазолила, изохинолинила, изоиндолила, акридинила, бензоизоксазолила, пиридила, пиримидила, пиридазинила, тетразолила, фуранила, имидиазолила, изоксазолила, оксадиазолила, оксазолила, пирролила, тиазолила, триазолила и тиенила. В более предпочтительном варианте, Ar1 и Ar2 независимо выбирают из необязательно замещенного фенила и пиридила. В еще более предпочтительном варианте, Ar1 необязательно замещен пиридилом и Ar2 необязательно замещен фенилом.
Способы настоящего изобретения включают стадию присоединения соединения формулы (II) к амину формулы (III) с получением диариламина формулы (I) в присутствии соли щелочного металла или катализатора на основе переходного металла:

где X представляет уходящую группу; и
Y представляет -C(O)-O-Z; и
Z выбирают из С1-С6алифатической группы, бензила, Fmoc, -SO2R' и Q, при условии, что Q не замещен X или алкином, где Ar1, Ar2, Q и R' имеют указанные выше значения.
На приведенной далее схеме 1 представлен предпочтительный способ осуществления настоящего изобретения:
Схема 1
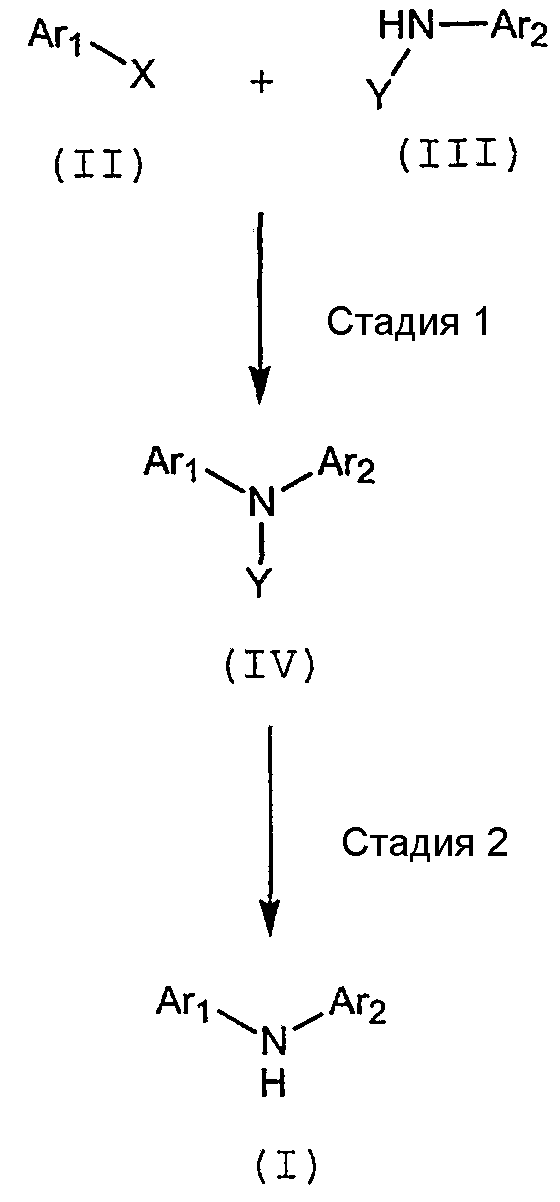
где Ar1, Ar2, X и Y имеют указанные выше значения. Проиллюстрированные выше стадии можно представить следующим образом:
Стадия 1:
Соединение формулы (II), содержащее подходящую уходящую группу X, подвергают взаимодействию с соединением формулы (III), которое содержит Y-NH-фрагмент. Реакцию осуществляют в присутствии соли щелочного металла, такого как карбонат цезия; или в другом варианте в присутствии катализатора на основе переходного металла и, необязательно, основания и, необязательно, одного или более из лигандов.
В одном из вариантов используют катализатор на основе переходного металла. Примеры катализаторов на основе переходного металла, которые можно использовать, включают ион или атом переходного металла и один или более из подходящих лигандов. Предпочтительно, чтобы катализатор на основе переходного металла включал металл 8 группы. Более предпочтительно, чтобы катализатор на основе переходного металла включал палладий. В соответствии с предпочтительным вариантом изобретения на стадии 1 одновременно используют два различных лиганда.
В соответствии с предпочтительным вариантом изобретения на стадии 1 используют основание вместе с катализатором на основе переходного металла. Подходящие основания включают KOtBu, NaOtBu, K3PO4, Na2CO3 и Cs2CO3. Более предпочтительно, чтобы основанием служил K3PO4.
Предпочтительные растворители для стадии 1 при использовании катализатора на основе переходного металла включают толуол и неполярные апротонные растворители, такие как MTBE, DME и гексан.
В другом варианте изобретения на стадии 1 используют соль щелочного металла. Предпочтительно, чтобы солью щелочного металла была соль цезия.
Предпочтительные растворители для стадии 1 при использовании солей щелочных металлов включают полярные апротонные растворители, такие как NMP.
Стадия 2:
На стадии 2 радикал Y соединения (IV) удаляют с получением диариламина формулы (I).
В соответствии с предпочтительным вариантом изобретения на стадии 2 используют кислоту, такую как TFA, HCl, HBr или HI. Более предпочтительно, если в качестве кислоты используют HCl.
Предпочтительные растворители для стадии 2 включают хлорированные растворители, такие как CH2Cl2, 1,2-дихлорэтан и хлорбензол.
Способы настоящего изобретения обладают тем преимуществом, что позволяют получать соединение формулы (I) из производного первичного ариламина, исключая проблему избыточного арилирования. Способы настоящего изобретения обладают дополнительным преимуществом, так как обеспечивают возможность получения соединения формулы (I) с высоким выходом и с высокой степенью чистоты, и в большом масштабе.
Стадия 1 Реагенты:
Катализаторы на основе переходных металлов, пригодные для целей настоящего изобретения, включают ион или атом переходного металла и один или более из лигандов. Переходный металл может находиться в любой подходящей степени окисления, причем валентность может быть в интервале от нулевой валентности до любой более высокой валентности, допустимой для этого переходного металла. В соответствии с предпочтительным вариантом изобретения катализаторы на основе переходных металлов включают металлы 8 группы. Более предпочтительно, чтобы катализаторы на основе переходного металла включали палладий. Комплексные катализаторы могут включать хелатирующие лиганды, включая, без ограничений, алкил и арилпроизводные фосфинов и бифосфинов, иминов, арсинов и их сочетания.
Более предпочтительно, чтобы катализатором на основе переходного металла был палладиевый катализатор формулы PdLn, где каждый L независимо выбирают из Cl, -OAc, -O-толила, галогена, PPh3, dppe, dppf, и BINAP; и n представляет целое число от 1 до 4. Вышеуказанные катализаторы на основе переходных металлов можно получить, используя известные специалистам способы.
При осуществлении способов настоящего изобретения могут происходить различные превращения лигандов. Лиганд может быть связан с переходным металлом в процессе осуществления способов настоящего изобретения, или лиганд может находиться в лабильной конфигурации по отношению к переходному металлу во время осуществления всего или части способа настоящего изобретения. Соответственно, термин "катализатор на основе переходного металла" в том смысле, как здесь использован, включает любой катализатор на основе переходного металла и/или предшественник катализатора в том виде, как его вводят в реактор, и который, при необходимости, превращают in situ в активную форму катализатора, которая принимает участие в реакции.
Количество катализатора на основе переходного металла, которое следует использовать в способе настоящего изобретения, представляет собой любое количество, которое промотирует образование продукта - диариламина.
В соответствии с предпочтительным вариантом изобретения, количество катализатора является каталитическим количеством, если катализатор используют в таком количестве, которое меньше, чем стехиометрическое относительно арильных компонент. В другом предпочтительном варианте катализатор присутствует в интервале от около 0,01 до около 20 мольных процентов относительно не аминарильного компонента, более предпочтительно от около 1 до около 10 мольных процентов и еще более предпочтительно от около 1 до около 5 мольных процентов.
Специалист может легко выбрать подходящий растворитель для использования в способе настоящего изобретения. Растворитель может присутствовать в любом количестве, необходимом для облегчения осуществления необходимого процесса, и совсем не обязательно, чтобы это количество было таким, чтобы растворить субстраты и/или реагенты указанного процесса. В соответствии с настоящим изобретением растворитель не должен мешать образованию продукта - диариламина. Примеры подходящих растворителей включают, без ограничений, галогенированные растворители, углеводородные растворители, эфирные растворители, протонные растворители и апротонные растворители. Смеси растворителей также включены в объем настоящего изобретения. Предпочтительные растворители, пригодные для осуществления стадии 1 способа настоящего изобретения, в котором используют катализатор на основе переходного металла, включают толуол, бензол или неполярные апротонные растворители, такие как MTBE, DME или гексан.
В соответствии с одним из вариантов стадию присоединения с использованием катализатора на основе переходного металла (Стадия 1) осуществляют в присутствии основания. Примеры подходящих оснований включают, без ограничений, гидроксиды щелочных металлов, алкоксиды щелочных металлов, карбонаты металлов, фосфаты, арилоксиды щелочных металлов, амиды щелочных металлов, третичные амины, гидроксиды (гидрокарбил)аммония и органические диазаоснования. Используемым количеством основания может быть любое количество, которое обеспечит образование продукта - диариламина. Предпочтительные основания настоящего изобретения включают KOtBu, NaOtBu, K3PO4, Na2CO3, и Cs2CO3.
Соли щелочных металлов, пригодные для целей настоящего изобретения, включают соли с ионами натрия, калия, рубидия или цезия. Предпочтительно, соли щелочных металлов, пригодные для целей настоящего изобретения, включают соли с ионами калия или цезия. Предпочтительные соли щелочных металлов включают карбонаты, фосфаты и соли алкоксидов. Более предпочтительные соли щелочных металлов, пригодные для целей настоящего изобретения, включают карбонат калия и карбонат цезия. Наиболее предпочтительно, чтобы солью щелочного металла был карбонат цезия.
Количество катализатора на основе переходного металла, которое следует использовать в рассматриваемом способе, является любым количеством, которое промотирует образование продукта - диариламина.
Предпочтительные растворители, пригодные для стадии 1 способа настоящего изобретения, в котором используют соли щелочных металлов, включают полярные апротонные растворители, такие как NMP.
Стадия 2 Реагенты:
В соответствии с предпочтительным вариантом настоящего изобретения стадию удаления защитных групп (стадия 2) осуществляют в присутствии кислоты. Примеры подходящих кислот включают, без ограничений, HCl, HBr, HI и органические кислоты, включая муравьиную кислоту, уксусную кислоту, пропионовую кислоту, бутановую кислоту, метансульфоновую кислоту, п-толуолсульфоновую кислоту, бензолсульфоновую кислоту и трифторуксусную кислоту. Предпочтительные кислоты настоящего изобретения включают HCl, HBr, HI, и TFA.
Предпочтительные растворители для осуществления стадии 2 способа настоящего изобретения включают хлорированные растворители, такие как CH2Cl2, 1,2-дихлорэтан и хлорбензол.
В одном их вариантов настоящего изобретения X представляет уходящую группу. В соответствии с предпочтительным вариантом настоящего изобретения X выбирают из группы, состоящей из Cl, Br, I, F, OTf, OTs, иодония и диазо.
В одном их вариантов настоящего изобретения Y представляет карбаматную аминозащитную группу. В соответствии с предпочтительным вариантом изобретения Y представляет Boc.
В том смысле, как здесь использованы, приводятся следующие определения, если нет других указаний. Кроме того, комбинации заместителей допустимы только в таком случае, если приводят к получению стабильных соединений. Далее приводятся некоторые сокращения, используемые в описании (включая химические формулы):
Boc = трет-бутоксикарбонил
Fmoc = флуоренилметоксикарбонил
Tf = трифторметансульфонат
Ts = п-толуолсульфонил
Ms = метансульфонил
TFA = трифторуксусная кислота
Ac = ацетил
dba = транс,транс-дибензилиденацетон
dppe = 1,2-бис-(дифенилфосфино)этан
dppf = 1,1'-бис-(дифенилфосфанил)ферроцен
dppp = пропан-1,3-диилбис(дифенилфосфан)
BINAP =2,2'-бис(дифенилфосфанил)-1,1'-бинафтил
MTBE = метил-трет-бутиловый эфир
DME = диметоксиэтан
CDI = 1,1'-карбонилдиимидазол
DCC = N,N'-дициклогексилкарбодиимид
EDC = гидрохлорид l-этил-3-(3-диметиламинопропил)карбодиимида
HOBt = N-гидроксибензотриазол
NMP = N-метилпирролидинон
ДМФА = диметилформамид (ДМФА)
MCPBA = м-хлорпербензойная кислота
MMPP = гексагидрат монопероксифталата магния
DIBAL-H = диизобутилалюминийгидрид
LAH = литийалюминийгидрид
super гидрид = литийтриэтилборгидрид
L-селектид = литий три-втор-бутилборгидрид
Red-Al = натрий-бис-(метоксиэтокси)алюминийгидрид
IPA = изопропанол
glyme = диметоксиэтан (глим)
diglyme = бис(2-метоксэтил)эфир (диглим)
В том смысле, как здесь использованы, приводятся следующие определения, если нет других указаний. Фразу "необязательно замещенный" используют взаимозаменяемо с фразой "замещенный или незамещенный." Далее, комбинации заместителей допустимы только в тех случаях, когда такие комбинации приводят к получению стабильных соединений. Кроме того, если нет других указаний, функциональные группы радикалов выбирают независимо.
Термин "уходящая группа", в том смысле, как здесь использован, имеет известные специалистам в этой области значения (см. March, Advanced Organic Chemistry, 4th 30 Edition, John Wiley & Sons, pp. 352-357, 1992, включено сюда для ссылки). Примеры уходящих групп включают, без ограничений, галогены, такие как F, Cl, Br и I, диазо, арил- и алкилсульфонилоксигруппы и трифторметансульфонилокси.
Термин "алифатический" (алифатическая группа) в том смысле, как здесь использован, означает неразветвленную или разветвленную C1-C12углеводородную цепь, которая полностью насыщена или которая содержит одно или более из звеньев ненасыщенности. Термин "алифатический" включают также моноциклический C3-C8углеводород или бициклический C8-C12углеводород, который полностью насыщен или который содержит одно или более из звеньев ненасыщенности, но который не является ароматическим (указанные циклические углеводородные цепи называют здесь также "карбоциклом" или "циклоалкилом") и который имеет одну точку присоединения к остальной части молекулы, и где любое индивидуальное кольцо указанной бициклической кольцевой системы содержит 3-7 членов. Например, подходящие алифатические группы включают, но ими не ограничиваются, линейные или разветвленные алкильные, алкенильные, алкинильные группы, или их комбинации, такие как (циклоалкил)алкил, (циклоалкенил)алкил) или (циклоалкил)алкенил.
Термины "алкил", "алкокси", "гидроксиалкил", "алкоксиалкил" и "алкоксикарбонил", используемые отдельно или как часть более крупного фрагмента, включают как разветвленные, так и неразветвленные цепи, содержащие от одного до двенадцати атомов углерода. Термины "алкенил" и "алкинил", используемые отдельно или как часть более крупного фрагмента, включают как разветвленные, так и неразветвленные цепи, содержащие от двух до двенадцати атомов углерода, где алкенил включает, по меньшей мере, одну двойную связь, и алкинил включает, по меньшей мере, одну тройную связь.
Термин "химически стабильный" или "химически возможный и стабильный", в том смысле, как здесь использован, относится к соединению, строение которого обеспечивает соединению достаточную стабильность для того, чтобы можно было его получить и ввести млекопитающему известными специалистам способами. Обычно такие соединения являются стабильными при температуре 40ºC или меньше, в отсутствии влаги или других химически реакционных условий, по меньшей мере, в течение недели.
Термины "галогеноалкил", "галогеноалкенил" и "галогеноалкокси" означают алкил, алкенил или алкокси соответственно, замещенные одним или более из атомов галогенов. Термин "галоген" означает F, Cl, Br или I.
Термин "гетероатом" означает N, О или S и включает любую окисленную форму азота и серы и кватернизованную форму любого основного азота.
Термины "амин" или "амино", используемые отдельно или как часть более крупного фрагмента, относятся к трехвалентному азоту, который может быть первичным или который может быть замещен 1-2 алифатическими группами.
Термин "арил", используемый отдельно или как часть более крупного фрагмента, такого как "аралкил", "аралкокси" или "арилоксиалкил", относится к моноциклическим, бициклическим и трициклическим карбоциклическим кольцевым системам, содержащим в целом от пяти до четырнадцати членов, где, по меньшей мере, одно кольцо в системе является ароматическим, и где каждое кольцо в системе содержит от 3 до 8 кольцевых членов. Термин "арил" может быть использован взаимозаменяемо с термином "арильное кольцо".
Термин "гетероцикл", "гетероциклил" или "гетероциклической" в том смысле, как здесь использован, означает не ароматические, моноциклические, бициклические или трициклические кольцевые системы, содержащие от пяти до четырнадцати кольцевых членов, в которых один или более из кольцевых членов представляет гетероатом, где каждое кольцо в системе содержит от 3 до 7 кольцевых членов.
Специалисту в этой области должно быть понятно, что максимальное число гетероатомов в стабильном, химически допустимом гетероциклическом или гетероароматическом кольце определяется размером кольца, степенью ненасыщенности и валентностью гетероатома. Обычно гетероциклическое или гетероароматическое кольцо может содержать от одного до четырех гетероатомов, до тех пор, пока гетероциклическое или гетероароматическое кольцо является химически допустимым и стабильным.
Термин "гетероарил", используемый отдельно или как часть более крупного фрагмента, такого как "гетероаралкил" или "гетероарилалкокси”, относится к моноциклическим, бициклическим или трициклическим кольцевым системам, содержащим в целом от пяти до четырнадцати кольцевых членов, и где, по меньшей мере, одно кольцо в системе является ароматическим, по меньшей мере, одно кольцо в системе содержит один или более из гетероатомов, и каждое кольцо в системе содержит от 3 до 7 кольцевых членов. Термин "гетероарил" может быть использован взаимозаменяемо с термином "гетероарильное кольцо" или термином "гетероароматический".
Арильная группа (включая аралкил, аралкокси, арилоксиалкил и т.п.) или гетероарил (включая гетероарилалкил и гетероарилалкокси и т.п.) может содержать один или более из заместителей. Подходящими заместителями у ненасыщенного атома углерода арильной, гетероарильной, аралкильной или гетероаралкильной группы являются заместители, выбранные из галогена; галогеноалкила; -CF3; -R4; -OR4; -SR4; 1,2-метилендиокси; 1,2-этилендиокси; защищенного OH (такого как ацилокси); фенила (Ph); Ph замещенного R4; -OPh; -OPh замещенного R4; -CH2Ph; -CH2Ph замещенного R4; -CH2CH2(Ph); -CH2CH2(Ph) замещенного R4; -NO2; CN; N(R4)2; -NR4C(O)R4; -NR4C (O)N(R4)2; -NR4CO2R4; -NR4NRC(O)R4; -NR4C(O)N(R4)2; -NR4NR4C(О)R4; -NR4NR4C(O)N(R4)2; -NR4NR4CO2R4; -C(О)C(О)R4; -C(O)CH2C(O)R4; -CO2R4; -C(O)R4; -C(O)N(R4)2; -OC(O)N(R4)2; -SO2R4; -SO2N(R4)2; -S(O)R4; -NR4SO2N(R4)2; -NR4SO2R4; -C(=S)N(R4)2; -C(=NH)-N(R4)2; -(CH2)yNHC(О)R4; -(CH2)yR4; -(CH2)yNHC(O)NHR4; -(CH2)yNHC(О)OR4; -(CH2)yNHS(O)R4; -(CH2)yNHSO2R4; или -(CH2)yNHC(О)CH(V-R4)R4; где каждый R4 независимо выбирают из водорода, необязательно замещенного С1-6алифатической группой, незамещенного 5-6-членного гетероарильного или гетероциклического кольца, фенила(Ph), -O-Ph, -CH2(Ph); где y представляет 0-6; и V является мостиковой группой. Если R4 представляет С1-6 алифатическое кольцо, оно может быть замещено одним или более из заместителей, выбранных из -NH2, -NH(C1-C4алифатической группы), -N(C1-C4алифатической группы)2, -S(O)(C1-C4алифатической группы), -SO2(C1-C4алифатической группы), галогена, -(C1-С4алифатической группы), -OH, -О-(C1-C4алифатической группы), -NO2, -CN, -CO2H, -CO2(C1-C4алифатической группы), -О-(галогенC1-C4алифатической группы), или -галоген(C1-C4алифатической группы); где каждая C1-4алифатическая группа является незамещенной.
Термин "мостиковая группа" или "мостик" означает органический фрагмент, который соединяет две части соединения. Мостики состоят из -О-, -S-, -NR*-, -C(R*)2-, -C(О) или алкилиденовой цепи. Алкилиденовая цепь является насыщенной или ненасыщенной, неразветвленной или разветвленной, С1-С6углеродной цепью, которая необязательно замещена, и где вплоть до двух не смежных насыщенных атомов углерода цепи необязательно заменены -C(О)-, -C(O)C(O)-, -C(O)NR*-, -C(O)NR*NR*-, NR*NR*-, -NR*C(O)-, -S-, -SO-, -SO2-, -NR*-, -SO2NR*-, или -NR*SO2-; где R* выбирают из водорода или алифатической группы. Необязательными заместителями у алкилиденовой цепи являются заместители, раскрытые далее для алифатической группы.
Алифатическая группа или неароматическое гетероциклическое кольцо может содержать один или более из заместителей. Подходящими заместителями у насыщенного углерода алифатической группы или неароматического гетероциклического кольца являются заместители, выбранные из перечисленных выше для ненасыщенного углерода арильной или гетероарильной группы, и следующие: =О, =S, =NNHR5, =NN(R5)2, =NR5, -OR5, =NNHC(O)R5, =NNHCO2R5, =NNHSO2R5 или =NR5, где каждый R5 независимо выбирают из водорода или необязательно замещенной С1-6алифатической группы. Если R5 представляет С1-6алифатическую группу, она может быть замещена одним или более заместителями, выбранными из -NH2, -NH(C1-4алифатическая группа), -N(C1-4алифатическая группа)2, галогена, -OH, -О-(C1-4алифатическая группа), -NO2, -CN, -CO2H, -CO2(C1-4алифатическая группа), -О-(галгеноC1-4алифатическая группа) или (галогеноC1-4алифатическая группа); где каждая C1-4алифатическая группа является незамещенной.
Заместителями у азота неароматического гетероциклического кольца являются заместители, выбранные из -R6, -N(R6)2, -C(O)R6, -CO2R6, -C(O)C(O)R6, -C(О)CH2C(O)R6, -SO2R6, -SO2N(R6)2, -C(=S)N(R6)2, -C(=NH)-N(R6)2 или -NRSO2R, где каждый R6 независимо выбирают из водорода, необязательно замещенной С1-6алифатической группы, необязательно замещенного фенила (Ph), необязательно замещенного -O-Ph, необязательно замещенного -CH2(Ph) или незамещенного 5-6-членного гетероарильного или гетероциклического кольца. Если R6 представляет С1-6алифатическую группу или фенильное кольцо, он может быть замещен одним или более из заместителей, выбранных из -NH2, -NH(C1-4алифатическая группа), -N(C1-4алифатическая группа)2, галогена, -(C1-4алифатическая группа), -OH, -O-(C1-4алифатическая группа), -NO2, -CN, -CO2H, -CO2(C1-4алифатическая группа), -О-галогено(C1-4алифатическая группа), или (галогеноC1-4алифатическая группа), где каждая C1-4алифатическая группа является незамещенной.
Схемы 2-8 иллюстрируют применение способа, представленного на схеме 1, для синтеза производных пиридинилариламина. Указанные пиридинилдиариламины, синтезированные в соответствии со способом настоящего изобретения, можно далее функционализировать в соответствии со способами, известными специалистам в данной области, чтобы получить соединения, которые являются эффективными ингибиторами p38 киназы.
Схема 2


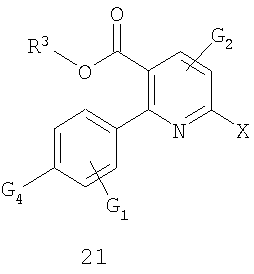
где R3 выбирают из С1-С6алифатической группы; арила; и арила, замещенного С1-С6алифатической группой, арила, нитро, CN, CO2R', CO2N(R')2, OR', NCO2R', NR'C(O)N(R')2 или OC(O)N(R')2; при условии, что R3 не является трет-бутилом;
G1, G2, G3, G4 и G5 независимо выбирают из водорода, алифатической группы, арила, замещенного арила, нитро, CN, OR', CO2R', CO2N(R')2, NR'CO2R', NR'C(O)N(R')2, OC(O)N(R')2, F, Cl, Br, I, O-Ts, O-Ms, -OSO2R' и OC(O)R';
X представляет уходящую группу;
Y представляет -C(O)-O-Z;
Z выбирают из С1-С6алифатической группы, бензила, Fmoc, SO2R' или Q при условии, что Q не замещен X или алкином;
где Q и R' имеют указанные выше значения.
Различные стадии, проиллюстрированные на схеме 2, можно представить следующим образом.
Стадия 1: Исходное вещество 21 можно получить путем синтеза из 2-хлорникотиновой кислоты в соответствии с известными специалистам способами (см., например схему 3). Осуществляют присоединение исходного материала 21 к защищенному ариламину 22 (см., например схему 3) в присутствии соли щелочного металла, такой как карбонат цезия, в растворителе, таком как NMP; или в другом варианте в присутствии катализатора, такого как ацетат палладия, необязательно лиганда, такого как BINAP или dppe, и необязательно основания, такого как фосфат калия, в подходящем растворителе, таком как толуол, MTBE, DME или гексан, получая защищенный продукт присоединения формулы 23.
Стадия 2: Защищенный продукт присоединения 23 подвергают взаимодействию с кислотой, такой как TFA, в подходящем растворителе, таком как метиленхлорид, 1,2-дихлорэтан или хлорбензол, получая соединение формулы 24.
Схема 3a иллюстрирует синтез исходного вещества 21, и на схеме 3b приведены примеры дальнейшего получения производных продукта присоединения 24 схемы 2 с удаленными защитными группами.
Схема 3а
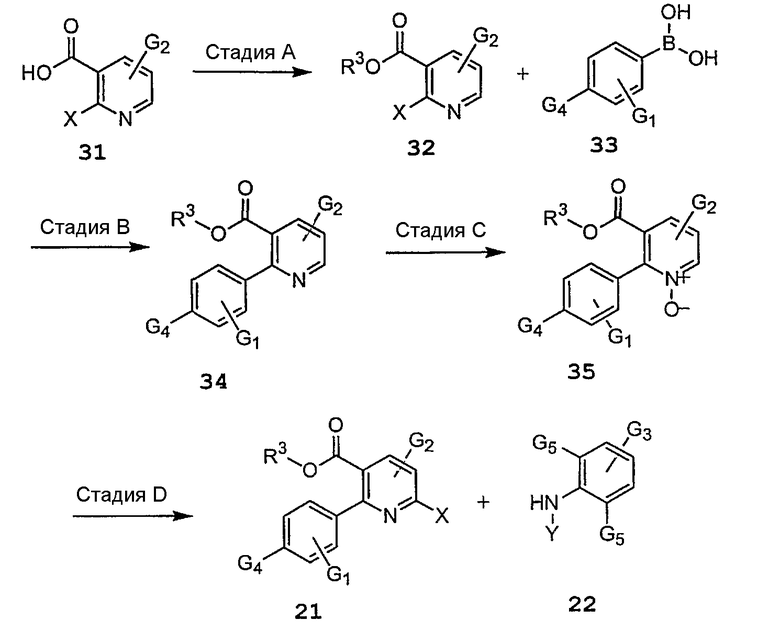
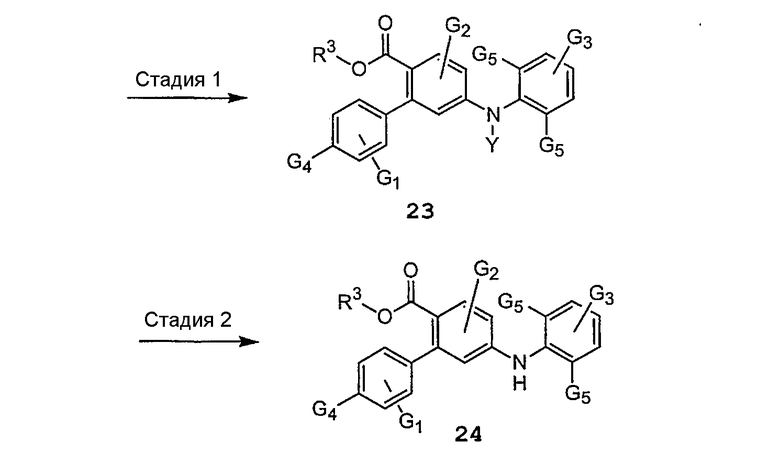
Схема 3b

где R3, G1, G2, G3, G4 и G5 имеют значения, указанные выше для схемы 2.
Различные стадии, проиллюстрированные на схемах 3a и 3b, можно представить следующим образом:
Стадия A: Производное никотиновой кислоты 31 можно активировать, осуществляя его взаимодействие с хлорформиатным активирующим агентом, таким как SOCl2, фенилхлорформиат или п-нитрофенилхлорформиат, или с карбодиимидным активирующим агентом, таким как CDI, DCC, или EDC в присутствии HOBt и N-гидроксисукцинимида в полярном апротонном растворителе, таком как CH2Cl2, 1,2-дихлорэтан, ДМФА или NMP, и при нагревании. Затем для получения соединения 32 добавляют спирт формулы R3OH.
Стадия B: Осуществляют присоединение соединения 32 к бороновой кислоте, такой как 33, в присутствии катализатора, такого как ацетат палладия, основания, такого как карбонат натрия, карбонат калия, карбонат лития, карбонат цезия, трет-бутоксид калия, трет-бутоксид натрия или трет-бутоксид лития, в растворителе, таком как толуол, MTBE, DME или гексан, получая соединение 34.
Стадия C: Затем осуществляют N-окисление продукта присоединения 34 в присутствии реагента, такого как MCPBA, надуксусная кислота или MMPP, в хлорированном растворителе, таком как CH2Cl2 или 1,2-дихлорэтан, получая соединение 35.
Стадия D: N-оксид 35 активируют в присутствии реагента, такого как POCl3, POBr3, SOCl2, SO2C12 или SOBr2, получая соединение 21.
Стадии 1 и 2 такие же, как на вышеприведенной схеме 2.
Стадия E: Получают производные свободного амина 24 с получением соответствующей мочевины в результате реакции с активированным карбонилом, таким как X4C(O)X5, где X4 и X5 каждый независимо выбирают из Cl, Br, I, имидазола, О-Ph, п-нитрофенилокси, замещенного О-арила или отщепляемой группы, и затем осуществляют взаимодействие карбонила с гидроксидом аммония в растворителе, таком как толуол, DME или MTBE, получая соединение 36.
Стадия F: Сложноэфирную функциональную группу соединения 36 восстанавливают до соответствующего спирта в присутствии восстанавливающего агента, такого как DIBAL, LAH, супер гидрид, L-селектид, LiBH4, NaBH3(анилид), Red-Al или NaBH4 в растворителе, таком как ТГФ, DME, MTBE, MeOH, EtOH, IPA, t-BuOH, глим или диглим, получая соединение 37.
Стадия G: Спирт 37 можно далее функционализировать, например путем активирования с использованием Х4С(О)Х5, где X4 и X5 имеют указанные выше на стадии E значения, осуществляя затем взаимодействие карбонила с OH(CH2)2NH2, получая соединение 38.
Хотя способы схем 4-7 проиллюстрированы с использованием конкретных реагентов и исходных материалов, специалистам в этой области должно быть понятно, что подходящие аналогичные реагенты и исходные материалы можно использовать для получения аналогичных соединений.
На схеме 4 представлен пример использования способа настоящего изобретения для получения диариламина.
Схема 4


Различные стадии, проиллюстрированные на схеме 4, можно кратко представить следующим образом.
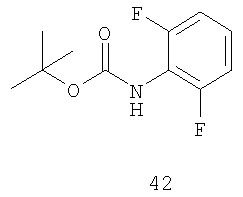
Стадия 1: Метиловый эфир 6-хлор-2-(4-фторфенил)никотиновой кислоты 41 можно получить путем синтеза из 2-хлорникотиновой кислоты (см., например, схему 5). Осуществляют реакцию присоединения соединения 41 к защищенному ариламину, такому как Boc-2,6-дифторанилин 42 (см., например, схему 5) в присутствии соли щелочного металла, такой как карбонат цезия, и растворителя, такого как NMP; или в другом варианте в присутствии катализатора, такого как ацетат палладия, необязательно лиганда, такого как BINAP, и необязательно основания, такого как фосфат калия, в подходящем растворителе, таком как толуол, получая защищенный продукт присоединения формулы 43.
Стадия 2: Защищенный продукт присоединения 43 подвергают взаимодействию с кислотой, такой как TFA, в подходящем растворителе, таком как метиленхлорид, получая соединение формулы 44.
Вообще говоря, специалист в рассматриваемой области должен понимать, что соединение формулы 44 можно получить в результате реакции соединения 41a с соединением 42a:
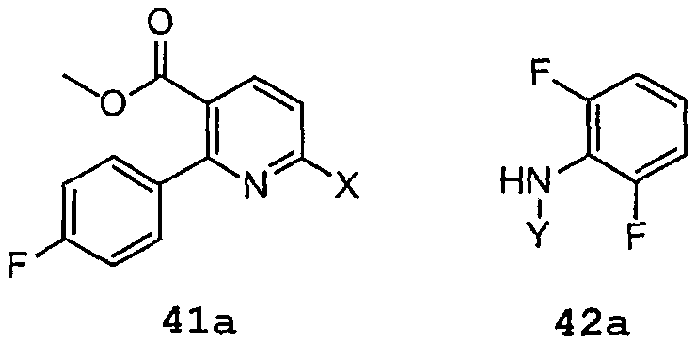
где X и Y имеют указанные выше значения.
Схема 5a иллюстрирует синтез исходного вещества 41 и схема 5b иллюстрирует получение последующих производных продукта присоединения 44 со схемы 4 с удаленными защитными группами.
Схема 5а
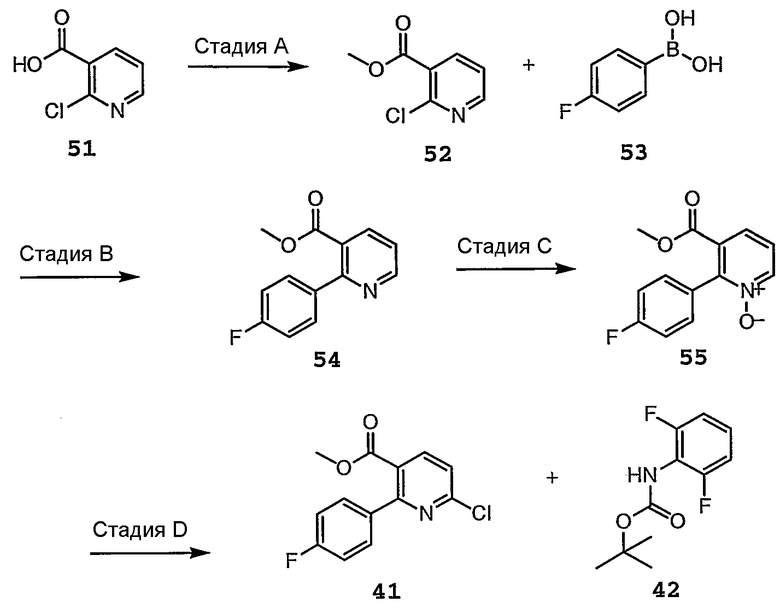
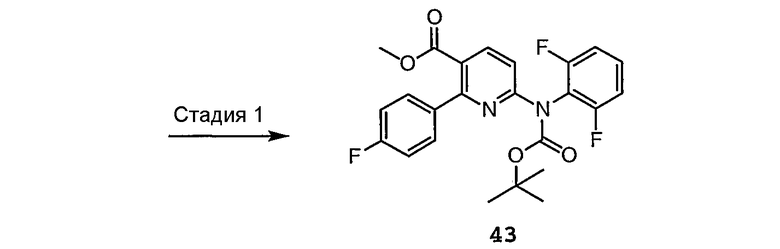

Схема 5b
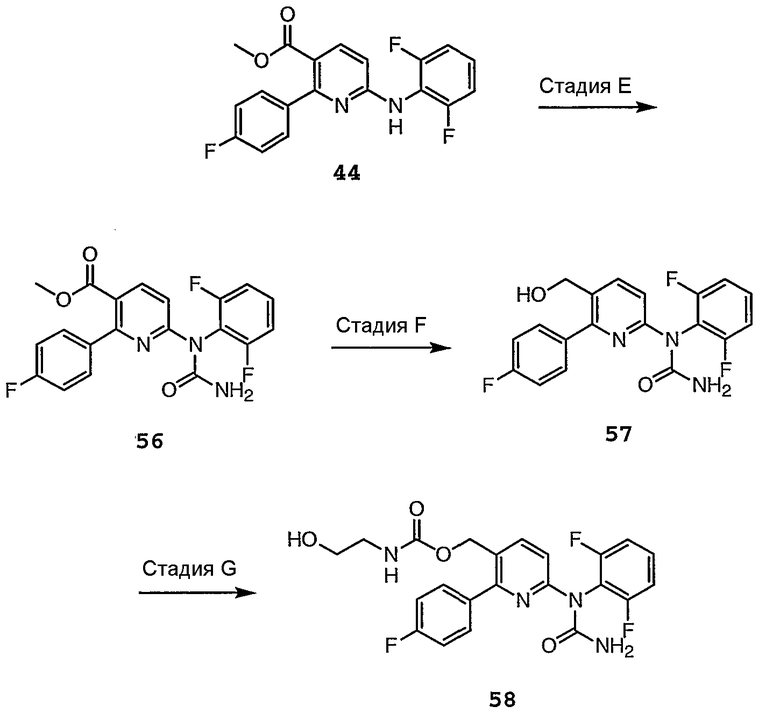
Различные стадии, проиллюстрированные на схемах 5a и 5b, можно кратко представить следующим образом.
Стадия A: 6-хлорникотиновую кислоту 51 активируют, осуществляя взаимодействие с хлорформиатным активирующим агентом, таким как SOCl2, фенилхлорформиат или п-нитрофенилхлорформиат, или карбодиимидным активирующим агентом, таким как CDI, DCC, или EDC в присутствии HOBt и N-гидроксисукцинимида в полярном апротонном растворителе, таком как CH2Cl2, 1,2-дихлорэтан, ДМФА или NMP, и при нагревании. Затем для получения метилового эфира 6-хлорникотиновой кислоты 52 добавляют спирт, такой как метанол.
Стадия B: Осуществляют реакцию присоединения соединения 52 к бороновой кислоте, такой как соединение 53, в присутствии катализатора, такого как ацетат палладия, основания, такого как карбонат натрия, карбонат калия, карбонат лития, карбонат цезия, трет-бутоксид калия, трет-бутоксид натрия, или трет-бутоксид лития, в растворителе, таком как толуол, MTBE, DME или гексан, получая соединение 54.
Стадия C: Затем осуществляют N-окисление продукта присоединения 54 в присутствии реагента, такого как MCPBA, надуксусная кислота, или MMPP, в хлорированном растворителе, таком как CH2Cl2 или 1,2-дихлорэтан, получая соединение 55.
Стадия D: Активированный N-оксид 55 галогенируют в присутствии реагента, такого как POCl3, POBr3, SOC12, SO2C12 или SOBr2, получая соединение 41.
Стадии 1 и 2 осуществляют, как представлено ранее на схеме 4.
Стадия E: Получают производное свободного амина соединения 44 для получения соответствующей мочевины путем реакции с активированным карбонилом, таким как X4C(O)X5, где X4 и X5 каждый независимо выбирают из Cl, Br, I, имидазола, O-Ph, п-нитрофенилокси, замещенного О-арила, или отщепляемой группы, и затем, осуществляя взаимодействие карбонила с гидроксидом аммония в растворителе, таком как толуол, DME, или MTBE, получают соединение 56.
Стадия F: Сложноэфирную функциональную группу соединения 56 восстанавливают до соответствующего спирта в присутствии восстанавливающего агента, такого как DIBAL, LAH, супер гидрид, L-селектид, LiBH4, NaBH3(анилид), Red-Al или NaBH4, в растворителе, таком как ТГФ, DME, MTBE, MeOH, EtOH, IPA, t-BuOH, глим или диглим, получая соединение 57.
Стадия G: Спирт 57 можно далее функционализировать, например, осуществляя взаимодействие с X4C(O)X5, где X4 и X5 имеют указанные выше на стадии E значения, и затем осуществляя взаимодействие карбонила с OH(CH2)2NH2, получая соединение 58.
На схеме 6 представлен пример использования способа настоящего изобретения для получения диариламина.
Схема 6

Различные стадии, проиллюстрированные на схеме 6, можно кратко представить следующим образом.
Стадия 1: Этиловый эфир 6-хлор-2-(2,4-дифторфенил)никотиновой кислоты 61 можно получить путем синтеза из 2-хлорникотиновой кислоты (см., например, схему 7). Осуществляют реакцию присоединения соединения 61 к защищенному ариламину, такому как Boc-2,6-дифторанилин 42 (см., например, схему 7) в присутствии соли щелочного металла, такой как карбонат цезия, и растворителя, такого как NMP; или в другом варианте в присутствии катализатора, такого как ацетат палладия, необязательно лиганда, такого как BINAP, и необязательно основания, такого как фосфат калия, в совместимом растворителе, таком как толуол, получая защищенный продукт присоединения формулы 62.
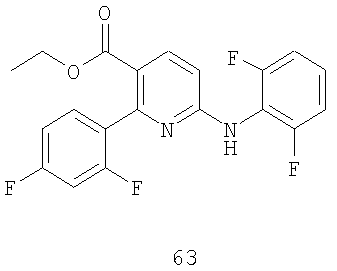
Стадия 2: Защищенный продукт присоединения 62 подвергают взаимодействию с кислотой, такой как TFA, в подходящем растворителе, таком как метиленхлорид, получая соединение формулы 63.
Более обычно, специалисту в указанной области должно быть понятно, что соединение формулы 63 можно получить, осуществляя взаимодействие соединения 61a с соединением 42a:

где X и Y имеют указанные выше значения.
Схема 7a иллюстрирует синтез исходного вещества 61 и Схема 7b иллюстрирует далее получение производного продукта присоединения 63 на схеме 6 после удаления защитных групп.
Схема 7а

Схема 7b

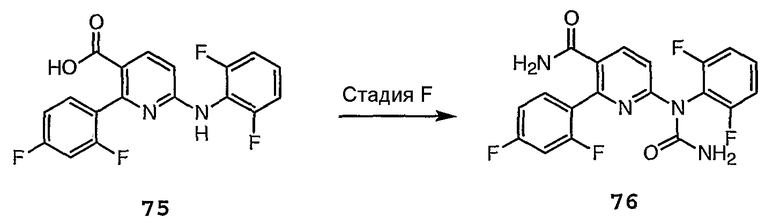
Различные стадии на схемах 7a и 7b можно кратко представить следующим образом.
Стадия A: 6-хлорникотиновую кислоту 51 активируют, осуществляя взаимодействие с хлорформиатным активирующим агентом, таким как SOCl2, фенилхлорформиат или п-нитрофенилхлорформиат, или карбодиимидным активирующим агентом, таким как CDI, DCC или EDC в присутствии HOBt и N-гидроксисукцинимида в полярном апротонном растворителе, таком как CH2Cl2, 1,2-дихлорэтан, ДМФА, или NMP, и при нагревании. Затем добавляют спирт, такой как этанол, для получения этилового эфира 6-хлорникотиновой кислоты 71.
Стадия B: Осуществляют взаимодействие соединения 71 с бороновой кислотой, такой как соединение 72, в присутствии катализатора, такого как ацетат палладия, основания, такого как карбонат натрия, карбонат калия, карбонат лития, карбонат цезия, трет-бутоксид калия, трет-бутоксид натрия или трет-бутоксид лития, в растворителе, таком как толуол, MTBE, DME или гексан, получая соединение 73.
Стадия C: Затем продукт присоединения 73 подвергают N-окислению в присутствии реагента, такого как MCPBA, надуксусная кислота или MMPP, в хлорированном растворителе, таком как CH2Cl2 или 1,2-дихлорэтан, получая соединение 74.
Стадия D: Активированный N-оксид 74 галогенируют в присутствии реагента, такого как POC13, POBr3, SOC12, SO2C12 или SOBr2, получая соединение 61.
Стадии 1 и 2 осуществляют в соответствии с представленной выше схемой 6.
Стадия E: Сложноэфирную функциональную группу соединения 63 омыляют в присутствии основания, такого как NaOH, в растворителе, таком как ТГФ, и затем подкисляют кислотой, такой как HCl, получая соединение 75.
Стадия F: Затем осуществляют взаимодействие соединения 75 с дифосгеном, а затем с NH4OH, получая соединение амидмочевины 76.
Схема 8
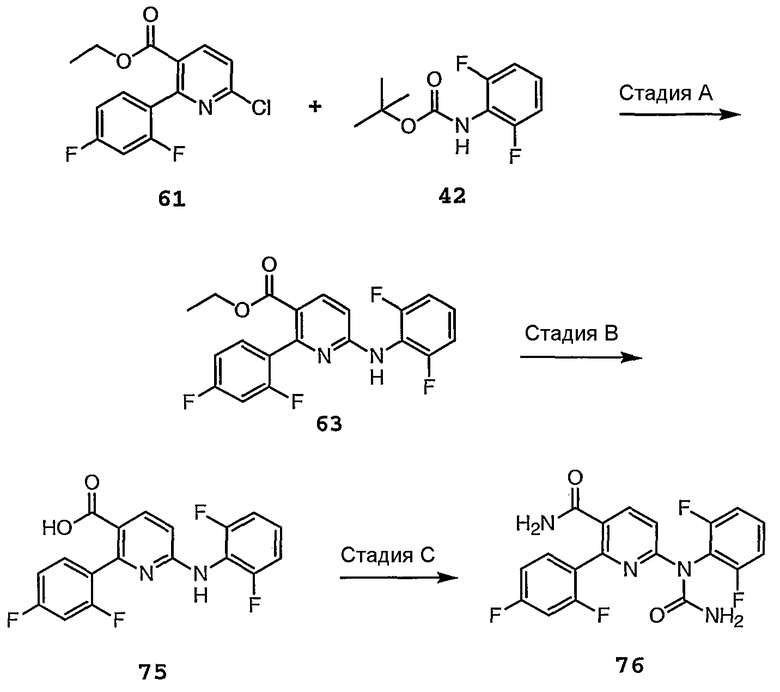
Различные стадии, проиллюстрированные на схеме 8, можно кратко представить следующим образом.
Стадия A: Этиловый эфир 6-хлор-2-(2,4-дифторфенил)никотиновой кислоты 61 можно получить путем синтеза из 2-хлорникотиновой кислоты. Осуществляют реакцию присоединения исходного материала 61 к защищенному ариламину, такому как Boc-2,6-дифторанилин 42, в присутствии соли щелочного металла, такой как карбонат цезия, в приемлемом растворителе, таком как MMP, получая защищенный продукт присоединения. Затем осуществляют взаимодействие защищенного продукта присоединения с кислотой, такой как TFA, в подходящем растворителе, таком как метиленхлорид, получая соединение формулы 63.
Стадия B: Сложноэфирную функциональную группу соединения 63 омыляют в присутствии основания, такого как NaOH, в растворителе, таком как ТГФ, и затем подкисляют кислотой, такой как HCl, получая соединение 75.
Стадия C: Затем осуществляют взаимодействие соединения 75 с дифосгеном, а затем с NH4OH , получая соединение амидмочевины 76.
Приведенные далее примеры иллюстрируют настоящее изобретение способами, которые можно использовать на практике, но их не следует рассматривать как ограничения всего объема способов настоящего изобретения.
Там, где это применимо, используют следующий способ ВЭЖХ, если нет других указаний: градиентное элюирование смесью вода:ацетонитрил, 0,1% TFA (90:10→10:90→90:10) осуществляют в течение 26 минут со скоростью 1 мл/мин при 254 нм. Используют колонку Zorbax SB Phenyl 4,6×25 см, 5 мкм. Термин "Tret" относится к временам удерживания, выраженным в минутах, для соединения.
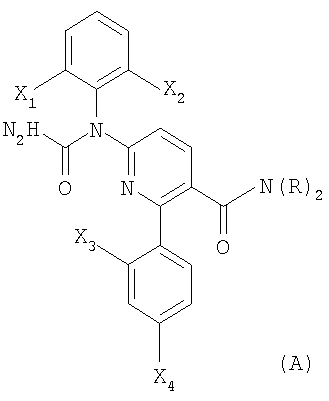
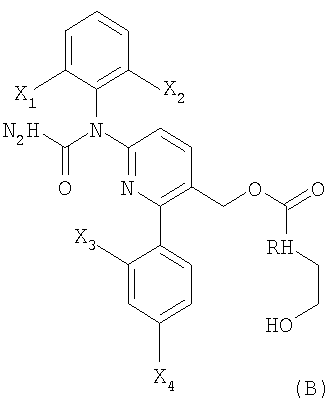
В соответствии с другим вариантом способы настоящего изобретения позволяют получать соединения формулы (A) или формулы (B):


где каждый из X1, Х2, Х3 и Х4 независимо выбирают из фтора или хлора;
и
R представляет Н или метил.
Соединения формулы (А) и формулы (В) можно использовать в качестве ингибиторов р38. В международной публикации РСТ WO 99/58502 (здесь и далее "'502 публикация"), содержание которой включено сюда для ссылки, раскрыт класс соединений, который охватывает соединения формулы (А) и формулы (В). Способы настоящего изобретения можно легко использовать для получения соединений публикации '502.
В соответствии с предпочтительным вариантом формулы (А) каждый из X1, Х2, Х3 и Х4 представляет фтор. В соответствии с другим предпочтительным вариантом формулы (А) R представляет Н.
В соответствии с предпочтительным вариантом формулы (В) каждый из X1, X2, Х3 и Х4 представляет фтор. В соответствии с другим предпочтительным вариантом формулы (В) R представляет Н.
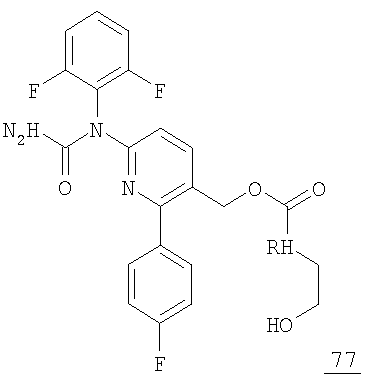
В соответствии с наиболее предпочтительным вариантом формулы (В) способы настоящего изобретения обеспечивают получение соединения 77, представленного далее:
Примеры
Пример 1
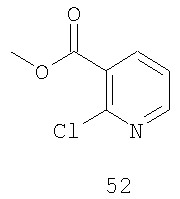
Метиловый эфир 2-хлорникотиновой кислоты (52):
Соединение 52 получают в соответствии со способом Synth. Comm. 26(12), 2257-2272 (1996). В продуваемую потоком азота колбу загружают 2-хлорникотиновую кислоту (1000,0 г, 6,0 моль, 1,0 экв.) с последующим введением 9 л метиленхлорида. К смеси добавляют тионилхлорид (1,4 л, 19,7 моль, 3/2 экв.) и реакционную смесь нагревают при 40°С при интенсивном перемешивании в атмосфере азота в течение ночи. Раствор хлорангидрида охлаждают на бане со льдом и медленно добавляют метанол (3 л, 74 моль, 12 экв.), поддерживая при этом температуру при 20°С. Параметром, ограничивающим скорость, является интенсивное выделение больших количеств газообразного HCl. После окончания добавления по данным ВЭЖХ-анализа [Tret исходного материала=7,5 мин, Tret соединения 52=11 мин] продукт образуется мгновенно. Летучие продукты удаляют в вакууме, и полученный остаток экстрагируют из 10% Na2СО3, используя EtOAc. Объединенные органические фракции сушат (MgSO4), фильтруют и концентрируют, получая масло бледно-желтого цвета.
Пример 2

Метиловый эфир 2-(4-фторфенил)никотиновой кислоты (54):
В продуваемую потоком азота колбу загружают Pd(Ph3)4 (1,84 г, 1,6 ммоль, 0,005 экв.), карбонат натрия (42,8 г, 404 моль, 1,3 экв.), соединение 52 (55,5 г, 320,6 ммоль, 1,0 экв.), п-фторфенилбороновую кислоту (53,8 г, 384,7 ммоль, 1,2 экв.), затем загружают 1,3 л денатурированного EtOH. Реакционную смесь нагревают при 78ºC при интенсивном перемешивании в атмосфере N2 в течение ночи. По данным ВЭЖХ-анализа [Tret 52=10 мин, Tret 54=12 мин] реакционной смеси исходный материал полностью израсходован и появился пик, который элюируется позднее. Реакционную смесь охлаждают при комнатной температуре, и растворители удаляют в вакууме. Остаток растворяют в EtOAc, промывают, сушат (MgSO4), фильтруют через целит и концентрируют, получая соединение 54 в виде твердого вещества бледно-желтого цвета.
Пример 3

Метиловый эфир 2-(4-фторфенил)-1-оксиникотиновой кислоты (55):
В продуваемую потоком азота колбу загружают гидроперекись мочевины (86,9 г, 924 ммоль, 4,0 экв.), диарилпиридин 54 (53,4 г, 231 ммоль, 1,0 экв.) и 530 мл уксусной кислоты. Ярко-желтый гомогенный раствор нагревают при 70-75ºC при интенсивном перемешивании в атмосфере азота до тех пор, пока по данным ВЭЖХ-анализа [Tret 54=12 мин, Tret 55=10 мин] не окажутся израсходованными более 97% исходных материалов. Реакционную смесь охлаждают до комнатной температуры и содержимое медленно выливают на 500 г льда. К интенсивно перемешиваемой ледяной смеси медленно добавляют 6 н. NaOH до достижения значения pH7, поддерживая при этом температуру 30ºC. Добавляют EtOAc и NaHCO3 (твердый) до тех пор, пока pH водной смеси не достигает значения 8-9 и твердая часть растворяется. Слои разделяются и осуществляют обратную экстракцию водного слоя, используя EtOAc. Объединенные органические слои промывают 5% NaHCO3 и затем тестируют, используя перекисные тестовые полоски в отношении присутствия окислителя. Если органический слой оказывается позитивным в отношении перкислоты, промывки бикарбонатом повторяют до тех пор, пока результаты теста не оказываются негативными. После того, как объединенные органические слои оказываются негативными в отношении перкислоты, их сушат (MgSO4), фильтруют и концентрируют, получая соединение 55 в виде твердого вещества бледно-желтого цвета.
Пример 4
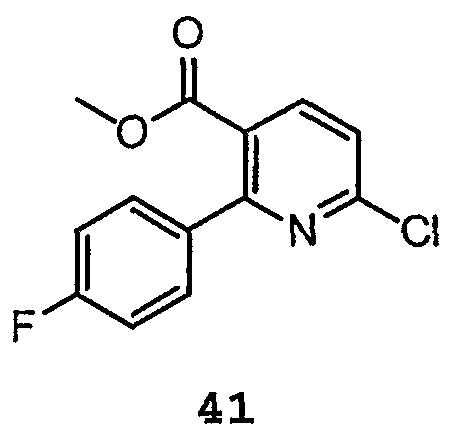
Метиловый эфир 6-хлор-2-(4-фторфенил)никотиновой кислоты (41):
В продуваемую потоком азота колбу загружают N-оксид 55 (45 г, 182 моль, 1,0 экв.), затем 300 мл дихлорэтана. Добавляют сразу всю хлорокись фосфора (101 мл, 1080 ммоль, 6 экв.), что вызывает немедленное повышение температуры с 17 до 19ºC, с последующим постепенным повышением температуры. Полученный раствор нагревают в атмосфере азота при 70-75ºC до тех пор, пока по данным ВЭЖХ-анализа [Tret 55=10 мин, Tret 41=17 мин] не оказываются израсходованными более 94% исходных материалов. Реакционную смесь охлаждают до комнатной температуры и содержимое концентрируют в вакууме, удаляя большую часть POCl3. Остаток гасят, медленно выливая на 450 г льда. После того, как лед расплавился, продукт экстрагируют метиленхлоридом. Объединенные органические части сушат (MgSO4), фильтруют через двуокись кремния, элюируют метиленхлоридом и концентрируют, получая соединение 41 в виде твердого вещества.
Пример 5

Метиловый эфир 6-(2,6-дифторфениламино)-2-(4-фторфенил)никотиновой кислоты (44):
В продуваемую потоком азота колбу загружают ацетат палладия (13,2 г, 59 ммоль, 0,04 экв.), рацемический BINAP (36,6 г, 59 ммоль, 0,04 экв.), а затем 1,9 л толуола. Гетерогенную суспензию нагревают при 50ºC в атмосфере азота в течение 2 часов, охлаждают до 30ºC, затем добавляют пиридилхлорид 41 (386,4 г, 1,45 моль, 1,0 экв.) и Boc-2,6-дифторанилин 42 (386,4 г, 1,69 моль, 1,2 экв.) и затем сразу весь K3PO4 (872 г, 4,1 моль, 2,8 экв.), после чего промывают 1,9 л толуола. Гетерогенную реакционную смесь нагревают при 100ºC в течение ночи и за ходом реакции следят с помощью ВЭЖХ. После того, как по данным ВЭЖХ происходит превращение реакционной смеси в соединение 43 [Tret 41=17 мин, Tret 43=20,5 мин, Tret 44=17,6 мин, контроль на длине волны 229 нм] (обычно за 18-20 часов), реакционную смесь охлаждают до комнатной температуры, и содержимое разбавляют, используя 1,94 л EtOAc. К раствору добавляют 1×1,94 л 6н HCl и оба слоя фильтруют через целит. Влажную лепешку целита промывают 2×1,9 л EtOAc. Слои разделяют и органический слой промывают 1×1,9 л солевого раствора, сушат (MgSO4), фильтруют и концентрируют, получая вязкое масло коричневого цвета. Для удаления Boc-защитной группы полученное масло растворяют в 1,94 л метиленхлорида и добавляют 388 мл TFA. Реакционную смесь перемешивают в течение ночи для облегчения удаления Boc. Летучие удаляют в вакууме, EtOAc (1,9 л) и добавляют достаточное количество 1н. или 6 н. NaOH до тех пор, пока pH не достигает значения 2-7. Затем добавляют достаточное количество 5% NaHCO3, чтобы довести значение pH до 8-9. Органические слои разделяют и промывают 1×5% NaHCO3, сушат (MgSO4), фильтруют и концентрируют до смеси масло/жидкость коричневого цвета. Сырую смесь масло/жидкость дважды подвергают азеотропной сушке, используя достаточное количество толуола. В это время свободное основание выпадает в осадок и происходит образование суспензии. Остаток растворяют в 500 мл толуола и добавляют 1,6 л раствора смеси 1н. HCl/эфир, что приводит к выпадению твердого вещества. Осуществляют нагревание до тех пор, пока не происходит разрушение гомогенизированной твердой части. При необходимости можно добавить 200 мл EtOAc, чтобы облегчить разрушение. После охлаждения выделяют твердый продукт 44, используя вакуумное фильтрование.
Пример 6
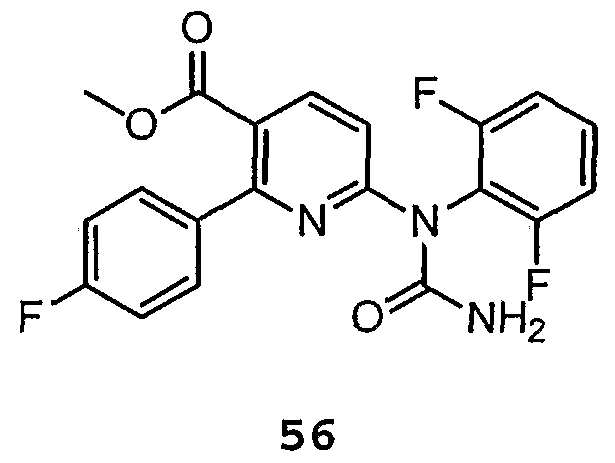
Метиловый эфир 6-1-(2,6-дифторфенил)уреидо]-2-(4-фторфенил)никотиновой кислоты (56):
В продуваемую потоком азота колбу загружают HCl соль амино(сложного)эфира соединения 44 (262 г, 0,67 моль, 1,0 кв.), затем 1,2 л толуола. К гетерогенной смеси добавляют фосген (1,4 л, 1,3M толуольный раствор, 2,7 моль, 4,0 экв.), и реакционную смесь нагревают при 50ºC в атмосфере азота в течение ночи. За ходом реакции с образованием -NC(O)C1 фрагмента следят с помощью ВЭЖХ [Tret 44=17,6 мин, Tret промежуточный карбамоил=19,7 мин, Tret 56=16,4 мин, контроль на длине волны 229 нм]. После того, как азот полностью прореагировал, раствор коричневого цвета охлаждают до примерно -5ºC и по каплям медленно добавляют NH4OH (0,84 л, 12,4 моль, 18,5 экв.). По мере того, как добавление приближается к завершению, происходит образование твердого продукта. Суспензию перемешивают с 1 л воды и собирают, используя вакуумное фильтрование. Влажный осадок на фильтре промывают 1×390 мл толуола для удаления примесей, которые выходят позже.
Пример 7

1-(2,6-Дифторфенил)-1-[6-(4-фторфенил)-5-гидроксиметилпиридин-2-ил]мочевина (57):
В продуваемую потоком азота колбу загружают мочевину-эфир соединения 56 (10,0 г, 24,92 ммоль, 1,0 экв.), а затем 10 мл ТГФ. Смесь охлаждают до 0-5ºC. К охлажденному раствору по каплям добавляют раствор смеси DIBAL-H/ТГФ (149,5 мл, 149,5 ммоль, 6,0 экв.) в течение 20-30 минут. Реакционную смесь перемешивают при 15-20ºC, при этом за ходом реакции следят с помощью ВЭЖХ [Tret 56=16,4 мин, Tret 57=14,0 мин, контроль на длине волны 229 нм]. Реакционную смесь гасят в холодной (5-10ºC) 15% водной H2SO4 (150 мл). После того, как процесс гашения завершается, смесь перемешивают в течение 10-15 минут. К смеси добавляют TBME (150 мл). Смесь нагревают при 50ºC в течение 60 минут. Смесь охлаждают до комнатной температуры и водный слой удаляют. Органический слой концентрируют до около 35 мл остаточного объема. Затем процессы разбавления и концентрирования повторяют. Оставшуюся смесь охлаждают до 0-2ºC и выдерживают при этой температуре в течение 45 минут. Не совсем белое твердое вещество 57 собирают, используя фильтрование с подсосом, используя холодный толуол (25 мл) в качестве промывочного растворителя. Твердый продукт сушат в вакууме при комнатной температуре в течение 3-5 часов, достигая скорректированного выхода 80%.
Пример 8

6-[1-(2,6-Дифторфенил)уреидо]-2-(4-фторфенил)пиридин-3-илметиловый эфир (2-гидроксиэтил)карбаминовой кислоты (58):
В продуваемую потоком азота колбу загружают бензиловый спирт 57 (7,1 г, 19,0 ммоль, 1,0 экв.) и CDI (6,2 г, 38,0 ммоль, 2,0 экв.), а затем 71 мл ТГФ. Полученный раствор перемешивают при комнатной температуре в течение 1-2 часов и затем осуществляют тестовое гашение в сухой смеси ацетонитрил/избыток этаноламина. Если активация не оказывается полной, можно добавить дополнительное количество CDI до тех пор, пока тестовое гашение не свидетельствует о полном превращении. После того, как тестовое гашение свидетельствует о полном превращении в соединение 58, реакционную смесь гасят, медленно добавляя 2,0 экв. этаноламина (0,64 мл, 38 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, после чего результаты ВЭЖХ-анализа [Tret 57=14,2 мин, Tret 58=13,6 мин, контроль на длине волны 229 нм] свидетельствуют о полном превращении в соединение 58. ТГФ удаляют в вакууме, остаток растворяют в 71 мл этилацетата и промывают водным раствором NH4C1 (2×71 мл), а затем солевым раствором (1×71 мл). Органический слой азеотропно сушат, используя EtOAc (2×71 мл). Остаток снова смешивают с 71 мл EtOAc, фильтруют и снова концентрируют. К конечному остатку добавляют 7,1 мл EtOAc и 63 мл толуола и осторожно нагревают до 35-40ºC. После охлаждения образуется твердое вещество белого цвета, которое выделяют, используя вакуумное фильтрование, и промывают холодным толуолом.
Пример 9

Этиловый эфир 2-(2,4-дифторфенил)-6-(2,6-дифторфениламино)никотиновой кислоты (63):
В однолитровую четырехгорлую, круглодонную колбу, снабженную верхней механической мешалкой, рубашкой для обогрева, дефлегматором и термопарой, загружают соединение 61 (50 г), Cs2CO3 (150 г) и 0,15 л NMP. Полученный раствор интенсивно перемешивают и нагревают до 65ºC, и в это время к суспензии добавляют раствор соединения 42 (60 г) в 0,10 л NMP в течение 10 минут. После нагревания при 65ºC в течение 18 часов по данным ВЭЖХ-анализа происходит примерно 85% превращение соединения 61 в нужный Boc-аддукт. В это время температуру повышают до 75ºC, после нагревания в течение еще 18 часов по данным ВЭЖХ-анализа происходит примерно 97% превращение соединения 61 в нужный Boc-аддукт 62 (не показан). Затем смесь охлаждают до 20ºC и выливают одной порцией в 2,0 л перемешиваемой воды в четырехгорлую, трехлитровую, круглодонную колбу с верхней механической мешалкой и термопарой. Температура воды повышается с 22ºC до 27ºC в результате добавления раствора NMP. Затем суспензию охлаждают до 15ºC и фильтрованием собирают твердое вещество желто-коричневого цвета, промывают водой и оставляют сохнуть на фильтре в течение 2 часов.
В двухлитровую четырехгорлую, круглодонную колбу, снабженную верхней механической мешалкой и термопарой, загружают твердое вещество желто-коричневого цвета и 0,8 л CH2Cl2. К перемешиваемому раствору добавляют одной порцией 70 мл TFA. После двух часов перемешивания при комнатной температуре по данным ВЭЖХ-анализа не детектируется ни одного Boc-защищенного материала, и смесь концентрируют, используя роторный испаритель. Маслянистый остаток помещают в 0,7 л EtOAc, и обрабатывают 0,7 л насыщенного NaHCO3, причем в это время происходит выделение газа. Слой EtOAc промывают 0,25 л насыщенного раствора NaCl и концентрируют, используя роторный испаритель. К полученному маслу коричневого цвета добавляют 0,2 л EtOAc и раствор обрабатывают HCl в Et2O (0,4 л 2,0M раствора) и перемешивают в течение 60 минут. Продукт 63, порошок желтого цвета собирают фильтрованием (70,5% выход).
Продукт можно перекристаллизовать, нагревая до кипения с обратным холодильником сырую соль в смеси 4 мл EtOH/г сырого продукта и затем охлаждая до комнатной температуры.
Хотя здесь был представлен ряд вариантов осуществления настоящего изобретения, очевидно, что основную схему можно изменить, получая в результате другие варианты, которые можно использовать в способах настоящего изобретения. Поэтому должно быть ясно, что объем настоящего изобретения должен быть определен прилагаемой далее формулой изобретения, а не конкретными вариантами его воплощения, которые были представлены выше в качестве примеров.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СИНТЕЗА ИНГИБИТОРОВ Е1-АКТИВИРУЮЩЕГО ФЕРМЕНТА | 2008 |
|
RU2553476C2 |
| 4-АМИНОХИНАЗОЛИНОВЫЕ АНТАГОНИСТЫ СЕЛЕКТИВНЫХ НАТРИЕВЫХ И КАЛЬЦИЕВЫХ ИОННЫХ КАНАЛОВ | 2004 |
|
RU2378260C2 |
| АЗАИНДОЛЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ JAK И ДРУГИХ ПРОТЕИНКИНАЗ | 2005 |
|
RU2403252C2 |
| ПРОИЗВОДНЫЕ 2-УРЕИДО-6-ГЕТЕРОАРИЛ-3Н-БЕНЗИМИДАЗОЛ-6-КАРБОНОВОЙ КИСЛОТЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ГИРАЗЫ И/ИЛИ ТОПОИЗОМЕРАЗЫ IV ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2003 |
|
RU2333208C2 |
| КОМПОЗИЦИИ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПОТЕНЦИАЛЗАВИСИМЫХ НАТРИЕВЫХ КАНАЛОВ | 2007 |
|
RU2470012C2 |
| БЕНЗИМИДАЗОЛЫ, ПРИМЕНИМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2006 |
|
RU2415853C2 |
| ПИРРОЛОПИРИМИДИНЫ, ПРИМЕНИМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2006 |
|
RU2434871C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ERK2 И ИХ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2300377C2 |
| ПИРРОЛОПИРАЗИНЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ АВРОРА А | 2005 |
|
RU2394825C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
Настоящее изобретение относится к способу получения соединения диариламина формулы

включающий стадию (1) присоединения соединения формулы (21) к амину формулы (22) в присутствии соли щелочного металла или катализатора на основе переходного металла и (2) удаления группы Y из полученного соединения в присутствии кислоты:

где значения радикалов такие, как указано в п.1 формулы изобретения; а также к соединению формулы (А) или (В)
где X1, X2, X3 и X4 независимо выбирают из фтора и хлора; и R представляет Н или метил. Технический результат: получение диариламинов с более высоким выходом а также с высокой степенью чистоты. 2 н. и 47 з.п. ф-лы.
1. Способ получения соединения диариламина формулы

включающий стадию (1) присоединения соединения формулы 21 к амину формулы 22 в присутствии соли щелочного металла или катализатора на основе переходного металла и (2) удаления группы Y из полученного соединения в присутствии кислоты:


где R3 выбирают из алифатической группы, арила или арила, замещенного алифатической группой, арилом, нитро, CN, CO2R', CO2N(R')2, OR', NCO2R', NR'C(O)N(R')2 и ОС(O)N(R')2;
при условии, что R3 не представляет трет-бутил; и
G1, G2, G3, G4 и G5 независимо выбирают из водорода, алифатической группы, арила, замещенного арила, нитро, CN, OR', CO2R', CO2N(R')2, NR'CO2R', NR'C(O)N(R')2, OC(O)N(R')2, F, Cl, Br, I, O-Tos, O-Ms, OSO2R' и ОС(O)R'; и
X представляет уходящую группу;
Y представляет -C(O)-O-Z;
Z представляет C1-С6алифатическую группу, бензил, Fmoc, -SO2R' или Q, при условии, что Q не замещен Х или алкином;
Q представляет арильную или гетероарильную кольцевую систему, необязательно конденсированную с насыщенным или ненасыщенным 5-8-членным кольцом, содержащим 0-4 гетероатома;
где Q необязательно замещен у одного или более из кольцевых атомов одним или более заместителями, независимо выбранными из галогена; C1-С6алифатической группы, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, NR'CO2R', NR'C(O)R', SO2N(R')2, N=CH-N(R')2 или ОРО3Н2; C1-С6алкокси, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, NR'CO2R', NR'C(O)R', SO2N(R')2, N=CH-N(R')2 или ОРО3Н2; Ar3; CF3; OCF3; OR'; SR'; SO2N(R')2; OSO2R'; SCF3; NO2; CN; N(R')2; CO2R'; CO2N(R')2; C(O)N(R')2; NR'C(O)R'; NR'CO2R'; NR'C(O)C(O)R'; NR'SO2R'; OC(O)R'; NR'C(O)R2; NR'CO2R2; NR'C(O)C(O)R2; NR'C(O)N(R')2; OC(O)N(R')2; NR'SO2R2; NR'R2; N(R2)2; OC(O)R2; ОРО3Н2 и N=CH-N(R')2;
R' выбирают из водорода; C1-С6алифатической группы или 5-6-членной карбоциклической или гетероциклической кольцевой системы, необязательно замещенной 1-3 заместителями, независимо выбранным из галогена, C1-С6алкокси, циано, нитро, амино, гидрокси, и C1-С6алифатической группы;
где Ar3 представляет арильную или гетероарильную кольцевую систему, необязательно конденсированную с насыщенным или ненасыщенным 5-8-членным кольцом, содержащим 0-4 гетероатома;
где Ar3 необязательно замещен у одного или более из кольцевых атомов одним или более заместителями, независимо выбранными из галогена; С1-С6алифатической группы, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, NR'CO2R', NR'C(O)R', SO2N(R')2, N=CH-N(R')2, или ОРО3Н2; C1-С6алкокси, необязательно замещенной N(R')2, OR', CO2R', C(O)N(R')2, OC(O)N(R')2, SO2N(R')2, NR'CO2R', NR'C(O)R', N=CH-N(R')2 или ОРО3Н2; CF3; OCF3; OR'; SR'; SO2N(R')2; OSO2R'; SCF3; NO2; CN; N(R')2; CO2R'; CO2N(R')2; C(O)N(R')2; NR'C(O)R'; NR'CO2R'; NR'C(O)C(O)R'; NR'SO2R'; OC(O)R'; NR'C(O)R2; NR'CO2R2; NR'C(O)C(O)R2; NR'C(O)N(R')2; OC(O)N(R')2; NR'SO2R2; NR'R2; N(R2)2; OC(O)R2; ОРО3Н2 и N=CH-N(R')2;
R2 представляет C1-С6алифатическую группу, необязательно замещенную N(R')2, OR', CO2R', C(O)N(R')2 или SO2N(R')2; или карбоциклическую или гетероциклическую кольцевую систему, необязательно замещенную N(R')2, OR', CO2R', C(O)N(R')2 или SO2N(R')2.
2. Способ по п.1, который осуществляют с использованием катализатора на основе переходного металла.
3. Способ по п.2, где катализатор на основе переходного металла включает палладий.
4. Способ по п.3, где катализатором является PdLn, где каждый L независимо выбирают из -ОАс, -O-толила, галогена, PPh3, dppe, dppf, dba и BINAP; и n представляет целое число от 0 до 4.
5. Способ по п.2, где стадию присоединения соединения формулы 21 к амину формулы 22 осуществляют в присутствии основания.
6. Способ по п.5, где основание выбирают из KOtBu, NaOtBu, K3PO4, Na2CO3 и Cs2СО3.
7. Способ по п.1, который осуществляют с использованием соли щелочного металла.
8. Способ по п.7, где соль щелочного металла выбирают из солей с ионами калия, рубидия или цезия.
9. Способ по п.8, где соль щелочного металла выбирают из карбоната калия или карбоната цезия.
10. Способ по п.9, где солью щелочного металла является карбонат цезия.
11. Способ по п.1, где Х выбирают из группы, состоящей из -С1, -Br, -I, -F, -OTf, -OTs, иодония и диазо.
12. Способ по п.1, где Y представляет Boc.
13. Способ по п.1 получения диариламина формулы:
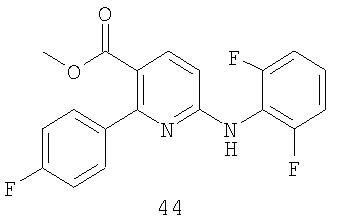
включающий стадии (1) присоединения соединения формулы 41а к амину формулы 42а в присутствии соли щелочного металла или катализатора на основе переходного металла и (2) удаления группы Y из полученного соединения в присутствии кислоты:
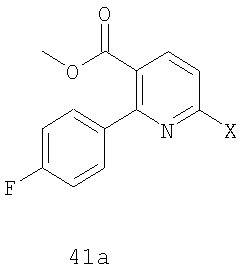
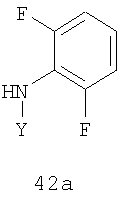
где Х и Y имеют указанные в п.1 значения.
14. Способ по п.13, который осуществляют с использованием катализатора на основе переходного металла.
15. Способ по п.14, где катализатор на основе переходного металла включает палладий.
16. Способ по п.15, где катализатором является PdLn, где каждый L независимо выбирают из -ОАс, -O-толила, галогена, PPh3, dppe, dppf, dba и BINAP; и n представляет целое число от 0 до 4.
17. Способ по п.13, где стадию присоединения соединения формулы 41а к амину формулы 42а осуществляют в присутствии основания.
18. Способ по п.17, где основание выбирают из KOtBu, NaOtBu, K3PO4, Na2CO3 и Cs2СО3.
19. Способ по п.14, который осуществляют с использованием соли щелочного металла.
20. Способ по п.19, где соль щелочного металла выбирают из солей с ионами калия, рубидия или цезия.
21. Способ по п.20, где соль щелочного металла выбирают из карбоната калия или карбоната цезия.
22. Способ по п.21, где солью щелочного металла является карбонат цезия.
23. Способ по п.13, где Х выбирают из группы, состоящей из -С1, -Br, -I, -F, -OTf, -OTs, иодония и диазо.
24. Способ по п.13, где Y представляет Boc.
25. Способ по п.1 получения диариламина формулы:
включающий стадии (1) присоединения соединения формулы 61а к амину формулы 42а в присутствии соли щелочного металла или катализатора на основе переходного металла и (2) удаления группы Y из полученного соединения в присутствии кислоты:
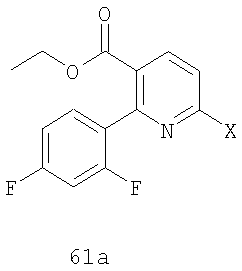

где X и Y имеют указанные в п.1 значения.
26. Способ по п.25, который осуществляют с использованием катализатора на основе переходного металла.
27. Способ по п.26, где катализатор на основе переходного металла включает палладий.
28. Способ по п.27, где катализатором является PdLn, где каждый L независимо выбирают из -ОАс, -O-толила, галогена, PPh3, dppe, dppf, dba, и BINAP; и n представляет целое число от 0 до 4.
29. Способ по п.25, где стадию присоединения соединения формулы 61а к амину формулы 42а осуществляют в присутствии основания.
30. Способ по п.29, где основание выбирают из KOtBu, NaOtBu, K3PO4, Na2CO3 и Cs2СО3.
31. Способ по п.25, который осуществляют с использованием соли щелочного металла.
32. Способ по п.31, где соль щелочного металла выбирают из солей с ионами калия, рубидия или цезия.
33. Способ по п.32, где соль щелочного металла выбирают из карбоната калия или карбоната цезия.
34. Способ по п.33, где солью щелочного металла является карбонат цезия.
35. Способ по п.25, где Х выбирают из группы, состоящей из -С1, -Br, -I, -F, -OTf, -OTs, иодония и диазо.
36. Способ по п.25, где Y представляет Boc.
37. Способ по п.25 получения диариламина формулы:
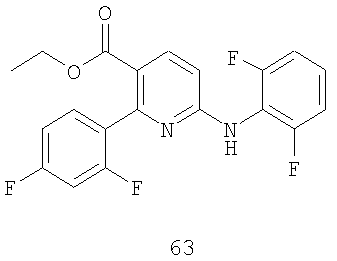
включающий стадии (1) присоединения соединения формулы 61 к амину формулы 42 в присутствии подходящей соли щелочного металла или катализатора на основе переходного металла и (2) удаления Вос-группы из продукта присоединения в присутствии кислоты:

38. Способ по п.37, который осуществляют с использованием карбоната цезия.
39. Способ по п.38, который далее включает стадии:
(a) взаимодействия соединения формулы 63 с основанием и
(b) подкисления реакционной смеси, образовавшейся на стадии (а) с получением соединения формулы 75:
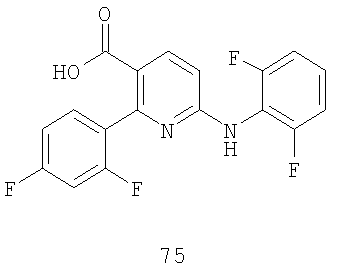 .
.
40. Способ по п.39, где основанием на стадии (а) является NaOH.
41. Способ по п.39, где кислотой на стадии (b) является HCl.
42. Способ по п.39, который далее включает стадии:
c) взаимодействия соединения формулы 75 с дифосгеном и
d) обработки реакционной смеси, полученной на стадии с), NH4OH с получением соединения формулы 76.

43. Способ по п.1, где кислоту выбирают из группы, состоящей из HCl, HBr, HI и органической кислоты.
44. Способ по п.13, где кислоту выбирают из группы, состоящей из HCl, HBr, HI и органической кислоты.
45. Способ по п.25, где кислоту выбирают из группы, состоящей из HCl, HBr, HI и органической кислоты.
46. Способ по п.37, где кислоту выбирают из группы, состоящей из HCl, HBr, HI и органической кислоты.
47. Соединение формулы (А) или (В):
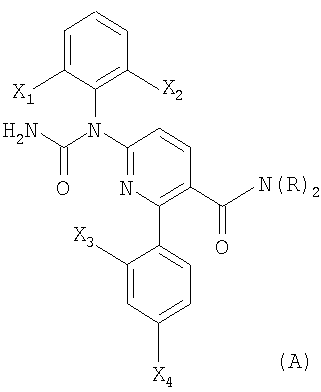

где X1, Х2, Х3 и Х4 независимо выбирают из фтора и хлора;
и
R представляет Н или метил.
48. Соединение по п.47, где соединение имеет формулу (А), каждый X1, Х2, Х3 и Х4 представляет фтор и R представляет водород.
49. Соединение по п.47, где соединение имеет формулу (В), каждый X1, X2, Х3 и Х4 представляет фтор и R представляет водород.
| J | |||
| Cao et al, Bioorg | |||
| Med | |||
| Chem | |||
| Lett., vol.11 no.24 (2001), 3169-3173 | |||
| Murakami et al, Chem | |||
| Pharm | |||
| Bull., vol.43, no.8 (1995), 1287-1293 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| SUCHOLEIKI ET AL, TETRAHEDRON LETTERS, vol.42, no.19 (2001), 3279-3282 | |||
| SETO ETAL, J | |||
| MED | |||
| CHEM., vol.115, no.4 (1993), 1321-1329 | |||
| REWCASTLE ET AL., vol.30, no.9, 1576-1581 | |||
| Способ очистки диариламинов | 1972 |
|
SU517247A3 |
Авторы
Даты
2009-04-10—Публикация
2004-02-10—Подача