Область техники, к которой относится изобретение
Изобретение относится к синтетическим пептидам, пригодным для применения в иммунологических анализах для обнаружения инфекций, вызываемых вирусами ВИЧ-1, к способу их получения, композициям и наборам с содержанием таких пептидов, применению этих пептидов в диагностике и способам проведения иммунологического анализа с их применением для обнаружения антител против ВИЧ.
Уровень техники
Ретровирус типа ВИЧ-1 (вирус иммунодефицита человека, тип 1) исторически известен как первый возбудитель СПИДа у человека. Сегодня различаются вирусы типа ВИЧ-1, вирусы ВИЧ-1 группы М (наибольшая группа) и вирусы ВИЧ-1 группы О (наименьшая группа, названная первоначально подтипом О), которые отличаются от первых, в числе прочего, геномом и иммунологией. С 1986 года (Clavel и др., Science, т.233, стр.343-346, 18 июля 1986 г.) известен второй тип вируса, ответственного за СПИД человека, названный ВИЧ-2.
В целях удобства изложения вирус ВИЧ-1 группы М будет называться далее ВИЧ-1 М, а вирус ВИЧ-1 группы О - ВИЧ-1 О.
Первоначально ретровирус типа ВИЧ-1 был открыт в виде 3 разных изолятов. Эти изоляты обозначили как LAV, HTLV-III и ARV, иногда изолят обозначается также как ARV-2. Здесь можно отослать к статьям: Barre-Sinoussi и др. (Science, 20 мая 1983 г., 220, стр.868-871); Popovic и др. (Science, 4 мая 1984 г., 224, стр.497-500); Gallo и др., (Science, 4 мая 1984 г., 224, стр.500-503) и Levy и др., (Science, 24 августа 1984 г., 225, стр.840-842), в которых делается ссылка на открытие упомянутых изолятов. Все эти три изолята входят сегодня в категорию вирусов ВИЧ-1 М. Вирусы ВИЧ-1 О были описаны значительно позже, в 1990 году, и их изоляты имели разные обозначения, такие как ВИЧ-3 или ANT 70 (заявка на европейский патент ЕР 345 375, а также De Leys и др., Journal of Virology, март 1990 г., т.64, №3, стр.1207-1216) или же позже MVP5180/91 (Gurtler и др., Journal of Virology, март 1994 г., т.68, №3, стр.1581-1585; заявка на патент ЕР 0591914) и пр. С тех пор были описаны и другие изоляты группы О, такие как HIV-1vAu; hiv-1dur, MVP2901/94 и пр.
Последовательность первых изолятов ретровируса ВИЧ-1 М была объяснена и опубликована в начале 1985 года; здесь можно сослаться на статьи: Wain-Hobson и др. (Cell, январь 1985 г., 40, стр.9-17), Ratner и др. (Nature, 24 января 1985 г., 313, стр.277-284) и Sanchez-Pescador и др. (Science, 1 февраля 1985 г., 227, стр.484-492). С тех пор вирусы LAV, HTLV-III ARV/ARV-2 признаны в качестве вариантов одного и того же вируса СПИДа, известного в настоящее время под названием ВИЧ-1 (Ratner и др., Nature, т.313, 21 февраля 1985 г., стр.636-637).
Первые диагностические исследования инфекции in vitro, вызванной ВИЧ-1 М, которые были осуществлены в 1984-1985 гг., проводились посредством иммунологического анализа и ставили своей целью обнаружение присутствия антител против ВИЧ-1 М в биологических пробах человека, таких как сыворотка или плазма. В этих первых иммунологических анализах для обнаружения антител против ВИЧ-1 М использовали вирусный лизат в качестве антигенной мишени для захвата искомых антител (так называемые иммунологические анализы первого поколения). Поскольку иногда такие иммунологические анализы давали ложно отрицательные и/или ложно положительные результаты вследствие недостаточной степени чистоты используемого антигенного препарата, то прибегли к генной инженерии для получения более контролируемых и более однородных антигенов, которые оказались более чувствительными и более специфичными. Можно сослаться, в частности, на работы, проведенные несколькими коллективами на разных формах антигена гликопротеина трансмембранной оболочки, gp41, вируса ВИЧ 1 М, и на иммунологические анализы по их применению, работы, описанные в статьях: Chang и др. (Science, 228, 5 апреля 1985 г., стр.93-96); Crowl и др. (Cell, 41, июль 1985 г., стр.979-986); Chang и др. (BioTechnology, 3, октябрь 1985 г., стр.905-909); Cabradilla и др. (BioTechnology, 4, февраль 1986 г., стр.128-133) и пр. Таким образом, эти иммунологические анализы на основе рекомбинантного антигена знаменовали собой иммунологические анализы второго поколения. И хотя эти новые иммунологические анализы означали значительный прогресс, однако они по-прежнему не позволяли обнаруживать все виды сыворотки у лиц, инфицированных вирусом ВИЧ-1 М.
В поисках повышенной чувствительности и специфичности некоторые коллективы исследователей обратились к синтетическим коротким (состоящим, как правило, из менее чем 50 аминокислот) пептидам, которые легко произвести и контролировать и которые способны использоваться в качестве мишеней-антигенов для обнаружения антител против ВИЧ-1 М. Таким образом Wang и др. (PNAS, август 1986 г., т.83, стр.6259-6163) описали применение пептида гликопротеина gp41 вируса ВИЧ-1 М с последовательностью RILAVERYLKDQQLLGIWGC603S (SEQ ID N0 8) в качестве антигена для захвата антител.
Таким же образом в заявке на патент WO 86/06414, поданной на имя фирмы «Genetic Systems Corparation», описан ряд коротких пептидов, в том числе некоторые производные от gp41 вируса ВИЧ-1 MBRU, в качестве пептида (X) (39), соответствующего очень близкой последовательности RILAVERYLKDQQLLGIWGC603SGKLIC609 (SEQ ID №9).
В патенте США №4,879,212 (Wang и др.) раскрыт пептид гликопротеина gp41 вируса ВИЧ-1 М с несколько большей длиной (35 аминокислот) со следующей последовательностью:
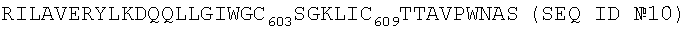
Пептиды Wang и др. и пептиды из заявки на патент WO 86/06414 придают очень высокую чувствительность и очень высокую специфичность новым иммунологическим анализам на основе пептидов, которые названы иммунологическими анализами третьего поколения. Многочисленные авторы последовали по пути применения коротких пептидов при создании новых реактивов, и с этих пор они содержатся в многочисленных коммерческих наборах (комплектах) для обнаружения антител против ВИЧ.
Коллективу John W. Gnann в клинике Scripps de La Jolla в Калифорнии удалось даже идентифицировать в указанном выше пептиде (X) (39) эпитоп, являющийся очень важным в диагностике вследствие того, что одновременно он обладает очень высокой иммунологической реакционной способностью и очень высокой специфичностью по отношению к ВИЧ-1 М, он представляет собой иммунодоминантный эпитоп с последовательностью WGC603SGKLIC609 гликопротеина gp41 вируса ВИЧ-1 М (Gnann и др., Journal of Virology, август 1987 г., стр.2639-2641; Gnann и др., Science, т.237, 11 сентября 1987 г., стр.1346-1349). Gnann и др. высказали идею относительно того, что в упомянутом иммунодоминантном эпитопе образование дисульфидного мостика между цистеинами С603 и С609 могло бы играть ключевую роль в антигенной конформации эпитопа, потенциально содействуя созданию циклической структуры.
Через короткое время в заявках на патенты WO 89/03844 на имя фирмы «Ferring АВ» и ЕР 0326490 А2 на имя фирмы «IAF Biochem International» были описаны пептиды гликопротеина gp41 вируса ВИЧ-1 М, содержавшие «эпитоп Gnann и др.» в виде произвольной циклизации дисульфидным мостиком между двумя цистеинами С603 и
С609, что можно представить в обобщенном, упрощенном и символическом виде посредством следующей произвольной формулы:
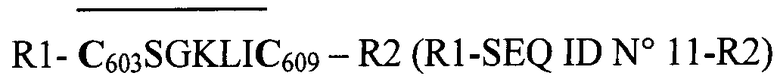
Они подтвердили новаторскую интуицию Gnann и др.
В заявке на патент ЕР 0326490 А2, в числе прочего, был описан пептид 35mer гликопротеина gp41 вируса ВИЧ-1 М из патента США 4,879,212 (Wang и др.), но в циклизованном виде с последовательностью (I):
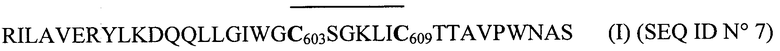
Однако усовершенствование за счет таких циклизованных пептидов остается предметом споров, при этом указанные пептиды не позволяют достаточно рано обнаружить в некоторых образцах сероконверсию вируса ВИЧ-1 М. Следовательно, параметры, в частности, циклического пептида с приведенной выше последовательностью (I) еще не являются удовлетворительными в отношении чувствительности, учитывая при этом, что данный пептид не позволяет обнаруживать все положительные образцы сероконверсии в антителе против ВИЧ-1 М и что, кроме того, он создает трудности в отношении кпд синтеза и растворимости.
Следовательно, каким бы не был пептид гликопротеина gp41, используемый в качестве мишени-антигена для обнаружения сероконверсий против ВИЧ-1 М, все же остаются некоторые, слабо положительные образцы, не обнаруживаемые при иммунологических анализах третьего поколения. Таким образом, в уровне техники присутствует необходимость в реактивах, которые были бы улучшенными, растворимыми и пригодными для применения в целях обнаружения в положительных пробах антител против ВИЧ-1 М. В частности, присутствует необходимость в реактивах с повышенной чувствительностью, позволяющих обнаруживать сероконверсии в еще более ранние сроки. Действительно, решающее значение при переливании крови имеет наиболее раннее обнаружение любого образца, инфицированного вирусом ВИЧ-1 М. Выигрыш хотя бы одной недели в опережении срока обнаружения является очень важным фактором для исключения, например, передачи вируса лицу после переливания крови.
Раскрытие изобретения
Авторы настоящего изобретения начали с попытки получения пептида, близкого к циклическому пептиду с последовательностью (I), т.е. с более высоким кпд. Из разных возможных подходов был выбран один, который состоял всего лишь в уменьшении размера пептида, другой подход заключался в замене остатков аминокислот, способных вызывать снижение кпд синтеза (проблемы, связанные с растворимостью, конъюгацией, вторичными реакциями …). Еще один возможный подход состоял в удлинении пептида посредством гидрофильных аминокислот для обеспечения большей растворимости и пр.
Авторы изобретения заменяли остаток триптофана в позиции 615 разными другими остатками для получения линейного пептида (не циклизованного между двумя остатками цистеина) со следующей последовательностью (II):
RILAVERYLKDQQLLGIWGC603SGKLIC609TTAVPX615Naa1aa2 (II) (SEQ ID N0 6),
где X - аминокислота, выбранная из группы, состоящей из F и G и обе аминокислоты aa1 и аа2 либо отсутствуют, либо означают:
aa1: аланин,
аа2: серин.
Как известно среднему специалисту, буквами F и G обозначаются аминокислоты: фенилаланин (F) и глицин (G).
Посредством прямого окисления обоих цистеинов на пептидах с последовательностью (II) авторы изобретения приготовили затем циклизованные пептиды следующей формулы (III):
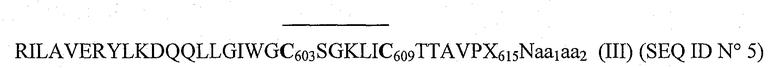
где Х означает аминокислоту, выбранную из группы, состоящей из F и G, и обе аминокислоты aa1 и аа2 либо отсутствуют, либо означают:
aa1: аланин,
аа2: серин.
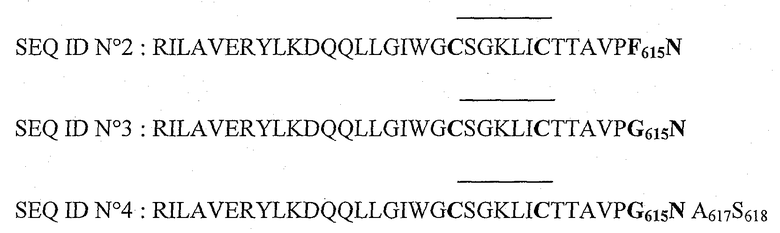
Авторы синтезировали, в частности, циклизованные, приводимые ниже пептиды, которые обозначены соответственно SEQ ID N0 1, N0 2, N0 3 и N0 4:

Совершенно неожиданно, учитывая тот факт, что, с одной стороны, для некоторых пептидов первоначально длинная последовательность из 35 аминокислот была укорочена с риском потери функционального эпитопа и, с другой стороны, были получены частично искусственные последовательности, которые не встречались в природных вирусных штаммах, авторы сделали вывод, что модифицируя таким образом цикличный, известный из уровня техники пептид формулы (I), который не обеспечивал обнаружения всех образцов сероконверсии, положительных по содержанию антител против вируса ВИЧ-1 М, можно получить новые пептиды, т.е. пептиды с последовательностью (III), способные обнаруживать все образцы.
Следовательно, целью настоящего изобретения является циклический пептид гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III):
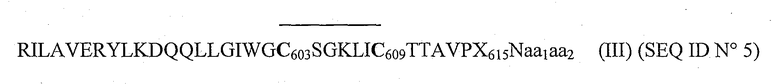
где Х означает аминокислоту, выбранную из группы, состоящей из F и G, и обе аминокислоты aa1 и аа2 либо отсутствуют, либо означают:
aa1: аланин,
аа2: серин.
Также объектом настоящего изобретения является композиция, в частности антигенная, содержащая пептид с последовательностью (III).
Еще одним объектом настоящего изобретения служит пептид гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III), выбранный из группы следующих пептидов:

Объектом настоящего изобретения является, кроме того, композиция, в частности антигенная, содержащая пептид с последовательностью (III), выбранный из группы, состоящей из пептидов SEQ ID N0 1-4, приведенных выше.
В рамках настоящего изобретения под понятием «композиция» следует понимать любой жидкий или твердый ассоциат из нескольких молекулярных компонентов. Некоторые композиции или смеси состоят из водных, жидких или твердых растворов с содержанием одного или нескольких целевых химических компонентов. Таким водным раствором может служить буферный раствор, показатель рН которого является, как правило, близким к нейтральному (составляет предпочтительно от 5 до 9), который образует предпочтительно ассоциат с одним или несколькими протеидами (т.е. протеинами, полипептидами, олигопептидами и/или аминокислотами), являющимися эффективными при достижении поставленной цели. Из буферных растворов, хорошо известных среднему специалисту, можно указать в качестве не ограничивающего примера на фосфатные, карбонатные, боратные буферы, Tris и пр. Из протеинов, пригодных для применения в составе буферных растворов, можно указать, в числе прочего, на альбумин бычьей сыворотки и пр. Часто в такие композиции вводят консервант, например, азид натрия, а также при необходимости ПАВ.
В рамках настоящего изобретения под понятием «антигенная композиция» следует понимать любую из указанных выше композиций с содержанием, по меньшей мере, одного пептида согласно изобретению (с последовательностью (III)), имеющего вид, при котором он существенно сохраняет ее первоначальную антигенную реакционную способность, т.е. ее способность быть распознанным антителами против ВИЧ. Такие антигенные композиции могут содержать в себе также антиген ВИЧ-2 и/или антиген ВИЧ-1 О, поддерживаемые в состоянии иммунологической реакционной способности.
Эти антигенные композиции могут применяться в образце биологической жидкости человека при диагностике in vitro инфекции ВИЧ и, в частности, но не исключительно, для обнаружения антител против ВИЧ согласно любой форме протокола проведения иммунологического анализа, известного самого по себе среднему специалисту (см. ниже в числе прочего раздел «Осуществление изобретения», п.4).
Такие антигенные композиции могут вводиться в жидком или сухом виде в наборы для диагностики in vitro вызванной ВИЧ инфекции, в частности в наборы для обнаружения антител против ВИЧ. Эти антигенные композиции могут быть иммобилизованы на твердой фазе или вводиться в антиген для обнаружения, например в меченый антиген в частности меченый ферментом и пр., с применением методов, известных сами по себе среднему специалисту.
Также объектом настоящего изобретения является способ получения пептида с последовательностью (III), в частности пептида, выбранного из группы пептидов SEQ ID N0 1, SEQ ID N0 2, SEQ ID N0 3 и SEQ ID N0 4.
Кроме того, объектом изобретения служит способ получения композиции, содержащей пептид с последовательностью (III), в частности пептид, выбранный из группы, состоящей из пептидов SEQ ID N0 1, SEQ ID N0 2, SEQ ID N0 3 SEQ и ID N0 4.
Объектом настоящего изобретения является также способ обнаружения антител против ВИЧ в биологическом образце, включающий в себя:
а) приведение в контакт биологического образца либо с пептидом гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III), в частности с пептидом, выбранным из группы пептидов SEQ ID N0 1, SEQ ID N0 2, SEQ ID N0 3 SEQ и ID N0 4 и/или композиции с содержанием такого пептида, либо с комбинацией пептидов с последовательностью (III);
b) инкубацию смеси в условиях, обеспечивающих формирование комплексов «антиген - антитело» и
c) проявление и обнаружение образовавшихся комплексов «антигены - антитела» средством для обнаружения, состоящим при необходимости из антигена ВИЧ-1, способного в случае необходимости содержать в себе пептид с последовательностью (III) согласно изобретению, являющийся меченым и способным связываться с захваченным антителом ВИЧ-1.
Объектом настоящего изобретения является также упомянутый ранее способ обнаружения антител против ВИЧ, этап а) которого включает в себя приведение в контакт биологического образца со смесью, состоящей, по меньше мере, из одного пептида гликопротеина gp41 с последовательностью (III) согласно изобретению и антигена ВИЧ-2 и/или ВИЧ-1 О.
Также объектом настоящего изобретения является набор для обнаружения антител против ВИЧ в биологическом образце, содержащий пептид гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III), в частности пептид, выбранный из группы пептидов SEQ ID N0 1, SEQ ID N0 2, SEQ ID N0 3 и SEQ ID N0 4, и/или композицию с содержанием такого пептида, при необходимости в сочетании с антигеном ВИЧ-2 и/или антигеном ВИЧ-1 О.
Кроме того, объектом настоящего изобретения является применение, по меньшей мере, одного пептида гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III), в частности пептида, выбранного из группы пептидов SEQ ID N0 1, SEQ ID N0 2, SEQ ID N0 3 SEQ и ID N0 4, при необходимости в сочетании с антигеном ВИЧ-2 и/или антигеном ВИЧ-1 О, для обнаружения антител против ВИЧ.
Осуществление изобретения
1. Биологические образцы.
Под выражением «биологический образец» в рамках настоящего изобретения понимается образец любой жидкости человеческого организма, такой как кровь, сыворотка, плазма, слюна, слезы, сперма, спинномозговая жидкость, а также любая другая жидкость организма, способная содержать в себе антитела против ВИЧ.
2. Приготовление пептидов согласно изобретению.
Предпочтительно, поскольку это более практично, но не является исключительным, продуцировать пептиды с последовательностью (III) согласно изобретению с помощью традиционных методов, хорошо известных среднему специалисту. В качестве примера можно указать на синтез типа Marrifield (Marrifield, J. Am. Chem. Soc. 85, стр.2149-2154, 1963 г.). Также можно применять синтез типа "Fmoc" (9-флуоренилметилоксикарбонил), являющийся оптимальным благодаря чистоте, антигенной специфичности, отсутствию вторичных, не желаемых продуктов и своей простоте применения.
Синтез пептидов может быть автоматизирован с помощью синтезаторов, например синтезатора "Pioneer" фирмы "Perspective", синтезатора «433А» фирмы ABI (Applied Biosystems Inc.) или синтезатора "Symphony" фирмы "Rainin".
Также пептиды могут быть продуцированы посредством синтеза в однородной фазе с применением приемов, известных сами по себе среднему специалисту.
Циклизация линейных пептидов с целью получения циклизованных пептидов формулы (III) согласно изобретению может проводиться разными способами, которые известны среднему специалисту, в частности одним из способов, раскрытых в заявках на патент WO 89/03844 (этап химического окисления йодом в метанольном растворе) и ЕР 0326490 А2 (метод с применением феррицианида калия).
С помощью методов, известных сами по себе специалисту, пептиды согласно изобретению могут быть, при необходимости, введены в буферные растворы в присутствии протеинов, полипептидов, олигопептидов или аминокислот и других эффективных химических компонентов для приготовления антигенных композиций согласно изобретению.
3. Другие антигены ВИЧ, пригодные для применения в способе обнаружения антител против ВИЧ и в наборе для обнаружения антител против ВИЧ согласно изобретению.
В качестве антигена ВИЧ-2 может применяться разновидность антигенов, предпочтительно gp140 или трансмембранный гликопротеин gp36 вируса ВИЧ-2, более предпочтительно пептид с содержанием, по меньшей мере, иммунодоминантного эпитопа (трансмембранного гликопротеина gp36) Гнанна (Gnann) и др., т.е. с содержанием, по меньшей мере, аминокислот WGCAFRQVC (см., например, статью Gnann и др., Science, т.237, 11 сентября 1987 г., стр.1346-1349; статью Guyader и др., Nature, 16 апреля 1987 г. 326, стр.662-669, в которых описывается полная последовательность вируса ВИЧ-2ROD или последовательность env, приведенная в патенте ЕР 0239425), еще более предпочтительно пептид, содержащий, по меньшей мере, аминокислоты WGCAFRQVC в циклизованном виде, приданном дисульфидным мостиком между двумя цистеинами.
В качестве антигена ВИЧ-1 О может использоваться разновидность антигенов, предпочтительно gp160 или gp41 вируса ВИЧ-1 О. Более предпочтительно применять пептид, содержащий иммунодоминантный эпитоп (gp41) Гнанна (Gnann) и др., содержащий, например, по меньшей мере, аминокислоты WGCKGKLIC (MVP 5180/91, описанные в последовательности env в заявке на патент ЕР 0591914, или последовательность, получаемую на основе банка данных GenBank под номером доступа L20571, см. Gurtler и др., Journal of Virology, март 1994 г., т.68, №3, стр.1581-1585). Еще более предпочтительно применять пептид, содержащий, по меньшей мере, аминокислоты WGCKGKLIC в циклизованном виде, приданном дисульфидным мостиком между обоими цистеинами.
Альтернативно в качестве антигена ВИЧ-1 О могут применяться, например, аминокислоты WGCKGKLVC (вируса ВИЧ-3/ANT70, последовательность, получаемая на основе банка данных GenBank под номером доступа L20587, см. Gurtler и др., Journal of Virology, март 1994 г., т.68, №3, стр.1581-1585). Еще более предпочтительно применять пептид, содержащий, по меньшей мере, аминокислоты WGCKGKLVC в циклизованном виде, приданном дисульфидным мостиком между обоими цистеинами.
4. Варианты осуществления способа обнаружения антител против ВИЧ согласно изобретению.
В отношении возможных вариантов осуществления способа обнаружения антител против ВИЧ согласно изобретению можно с уверенностью отослать, например, к обзору "A Decade of Development In Immunoassay Methodology", James P. Gosling, Clinical Chemistry, 36/8, стр.1408-1427, 1990 г., в котором приводится обширный перечень имеющихся известных технологий и вариантов проведения иммунологических анализов.
Способ обнаружения антител против ВИЧ в биологическом образце может проводиться, в широком смысле слова, посредством любого иммунологического анализа, т.е. такого иммунологического анализа, при котором образуется иммунный комплекс между, по меньшей мере, одним пептидом согласно изобретению и, по меньшей мере, одним антителом против ВИЧ. Методы проведения иммунологического анализа (immunoassay) хорошо известны среднему специалисту и ими могут быть EIA (Enzyme Immuno Assay), ELISA (Enzyme Linked Immuno Sorbent Assay), RIA (Radio Immuno Assay), FIA (Fluoro Immuno Assay) и др., что определяется выбранными маркером и меченым реактивом.
Термин «меченый» относится как к непосредственному мечению (посредством ферментов, радиоизотопов, флуорохромов, люминесцирующих соединений и пр.), так и к непрямому мечению (например, посредством антител, которые сами являются непосредственно мечеными, или с помощью реактивов меченой «пары сродства», такой как не являющаяся исключительной пара «меченый авидин - биотин» и пр.). Средство для обнаружения в способе обнаружения антител против ВИЧ согласно изобретению может состоять, например, но не исключительно, из меченого антигена ВИЧ, меченого антитела к иммуноглобулину человека или любой другой молекулы, имеющей сродство с иммуноглобулином, таким как протеин А или протеин G, в меченом виде и пр. В качестве маркера может применяться фермент, радиоизотоп, флуорохром, люминесцирующее соединение и пр., который присоединяют известным способом к пептиду согласно изобретению или к антителу против иммуноглобулина или к любой другой молекуле, выбранной в качестве средства для обнаружения (например, протеин А или протеин G).
В рамках настоящего изобретения пептиды можно метить пероксидазой хрена в соответствии с известным протоколом, например, способом Nakane и Kawaoki (J. Histochem. Cytochem., 22, стр.1984, 1974 г.) или любым другим известным специалисту способом связывания. Могут применяться и другие ферменты, такие как щелочная фосфатаза и пр.
Способ обнаружения антител против ВИЧ согласно изобретению может осуществляться в твердой фазе (гетерогенный анализ) или жидкой фазе (гомогенный анализ).
Для обнаружения антител против ВИЧ согласно изобретению могут применяться разные, известные специалисту протоколы: протоколы конкурентного и непрямого типа или же традиционного типа сэндвича «антиген - антитело - антиген», обозначаемого также как метод «сэндвича с двойным антигеном» (Maioloni и др., Journal of Immunological Methods, 20, 1978 г., стр.25-34), в один или два приема.
В предпочтительном варианте выполнения изобретения с применением гетерогенной фазы и с использованием протокола непрямого типа или же метода «сэндвича с двойным антигеном» антиген оболочки вируса ВИЧ-1 М, соответствующий gp160, gp41 или пептиду согласно изобретению, применяемому в ассоциации или нет с антигеном ВИЧ-2 и/или антигеном ВИЧ-1 О в качестве антигена для захвата антител, иммобилизуется на твердой фазе. В качестве не ограничивающих примеров твердой фазы можно указать на применение микропланшетов, выполненных, в частности, из полистирола, таких как выпущенные в продажу фирмой Nunc, Дания. Также можно применять частицы или твердые шарики, парамагнитные шарики, такие как поставляемые фирмой Dynal или Merck-Eurolab (Франция) (товарный знак Estapor™) или же испытательные трубки из полистирола или полипропилена, полоски из нитроцеллюлозы и пр.
В предпочтительном варианте выполнения при использовании метода «сэндвич с двойным антигеном» (Maiolini и др., 1978 г.) пептид согласно изобретению применяется меченым в качестве средства для обнаружения, т.е. в качестве антигена для обнаружения комплексов, образовавшихся и иммобилизованных на твердой фазе.
Согласно другому предпочтительному варианту выполнения в рамках протокола непрямого типа антитело к иммуноглобулину человека или фрагмент с иммунологической реакционной способностью (Fab, Fab' и пр.) этого антитела может применяться меченым в качестве средства для обнаружения, т.е. в качестве антитела для обнаружения комплексов, образовавшихся и иммобилизованных на твердой фазе.
5. Наборы для обнаружения антител против ВИЧ.
Для осуществления изобретения, являющегося простым и пригодным для использования в многочисленных биологических образцах, могут применяться наборы и реактивы для обнаружения антител против ВИЧ в биологическом образце способом согласно изобретению.
Следовательно, объектом изобретения является набор для обнаружения антител против ВИЧ в биологическом образце, содержащий:
- по меньшей мере, один антиген для захвата и/или обнаружения, которым является пептид, причем этим пептидом может служить пептид с последовательностью (III) согласно изобретению или антигенная композиция, содержащая указанный пептид;
- по меньшей мере, одно средство для обнаружения образовавшихся комплексов «антиген - антитело».
Предпочтительно, чтобы указанный набор содержал в себе несколько антигенов для захвата и/или обнаружения.
Как описано выше, предпочтительно выполнить захватывающий антиген в виде антигена, иммобилизованного на твердой фазе, такой как микропланшет.
Предпочтительный набор для обнаружения антител против ВИЧ в биологическом образце включает в себя:
a) захватывающий антиген, которым является пептид с последовательностью (III) согласно изобретению или антигенная композиция с содержанием такого пептида, причем этот захватывающий антиген иммобилизован на микропланшете;
b) антиген для обнаружения, меченый энзимом.
Другой предпочтительный набор для обнаружения антител против ВИЧ в биологическом образце содержит:
а) захватывающий антиген, причем этот антиген иммобилизован на микропланшете;
b) антиген для обнаружения, меченый энзимом и являющийся пептидом последовательностью (III) согласно изобретению или композицией с содержанием такого пептида.
Еще один предпочтительный набор для обнаружения антител против ВИЧ в биологическом образце содержит:
a) захватывающий антиген, которым является пептид с последовательностью (III) согласно изобретению, причем захватывающий антиген иммобилизован на микропланшете;
b) антитело к иммуноглобулину, меченое, в частности, энзимом.
Ниже приводятся примеры, иллюстрирующие изобретение без ограничения его объема.
Пример 1. Синтез пептидов
Описываемые ниже операции по синтезу осуществлялись на синтезаторе Pioneer с применением химического соединения "Fmoc" (9-флуоренилметилокси): на каждом этапе реактивы (т.е. защищенная аминокислота и активаторы связывания (TBTU (2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурон-тетрафторборат)/HOBt(N-гидроксибензотриазол)) добавлялись в избытке (в соотношении: «моли реактивов/моли замещаемых групп на смоле»=5). В конце синтеза пептид отделили от смолы раствором на основе трифторуксусной кислоты (реактив К). Затем пептид перевели в осадок в охлажденном растворе простого эфира и очистили посредством жидкостной хроматографии высокого разрешения (ВЭЖХ). По каждому синтезированному линейному пептиду проводился этап химического окисления, позволивший циклизировать пептид на уровне двух цистеинов.
Таким образом авторы изобретения синтезировали следующие цикличные пептиды:
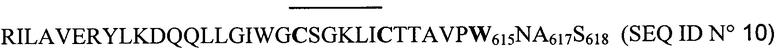
Данный пептид с последовательностью SEQ ID №10 был синтезирован и применен в описанных ниже экспериментах, так как, по мнению авторов изобретения, он является наиболее близким прототипом. Именно в этом значении он применялся в сравнениях, приводимых ниже.
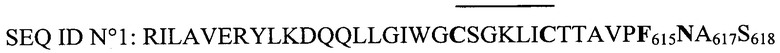
Каждый из этих пептидов конъюгировал с пероксидазой хрена (конъюгированный и меченый) хорошо известным методом Nakane и Kawaoi (J. Histochem. Cytochem. 22, стр.1984, 1974 г.).
Пример 2. Применявшиеся сывороточные образцы
Для обнаружения антител против ВИЧ применялись следующие виды сыворотки:
- образцы панелей для сероконверсии, поставленные фирмой Boston Biomedica Inc. (7 панелей, 17 образцов), фирмой Nabi (5 панелей, 14 образцов) и фирмой Impath Bioclinical Partners (4 панели ВСР, 10 образцов);
- 4 положительных образца сыворотки с содержанием антител против ВИЧ-1 (С4, С5, С9 и С 10) внутренней панели фирмы Bio-Rad, г.Марн Ля Кокет, 92430, Франция;
- 13 видов сыворотки от здоровых доноров и больных лиц дополнительно подверглись тесту для определения пороговой величины, возможной при исследованиях.
Пример 3. Иммуноэнзиматическое исследование с применением конъюгатов пероксидаза - пептиды ВИЧ-1
В приводимом ниже примере обнаружение антител против ВИЧ было основано на принципе иммуноэнзиматического метода типа «сэндвич с двойным антигеном». Тест основан на использовании, с одной стороны, микропланшета (твердая фаза), сенсибилизированного очищенными антигенами, в том числе гликопротеином оболочки (gp160) вируса ВИЧ-1 М, и, с другой стороны, конъюгата, состоящего из пептида согласно изобретению, меченого пероксидазой, которые захватывались в сэндвич подлежащим обнаружению антителом против ВИЧ.
Применявшийся при исследовании протокол был следующим: 100 мкл каждого образца исследуемой, разбавленной на % сыворотки поместили в чашечку сенсибилизированного микропланшета и произвели гомогенизирование смеси. После инкубации смеси под клейкой пленкой в течение 60 минут при 37°С и последующей промывки микропланшета буфером Tris NaCl в каждую лунку добавили по 100 мкл меченого конъюгата (пептид ВИЧ-1 согласно изобретению, меченый пероксидазой). Смесь подвергли инкубации под клейкой пленкой в течение 30 минут при 18-30°С.
После удаления свободной фракции конъюгата промывкой указанным выше буфером Tris NaCl выявляли присутствие иммобилизованного в комплексах фермента. Для этого в каждую лунку добавили 80 мкл проявляющего раствора (содержавшего субстрат H2O2 в растворе лимонной кислоты и ацетата натрия и хромоген, тетраметилбензидин). После инкубации новой смеси в темном месте в течение 30 минут при 18-30°С проявление прекратили добавкой 100 мкл серной кислоты 1N. Оптическую плотность определили спектрофотометром при 450/620 нм.
Присутствие или отсутствие антител против ВИЧ определяли сравнением полученной оптической плотности (OD) по каждому тестированному образцу с расчетной пороговой величиной (пороговая величина = средней величине OD отрицательных образцов + 0,100 единицы OD).
Образец считался положительным (носитель антител против ВИЧ) в том случае, когда полученное значение OD превышало значение OD пороговой величины, и отрицательным, когда значение OD было меньше OD пороговой величины.
В таблице 1 приведены результаты сравнения, проведенного с использованием 5 конъюгатов, приготовленных в одних и тех же условиях (связывание каждого пептида, синтезированного, как описано выше, с пероксидазой). Ниже описываются разные приготовленные конъюгаты:
- конъюгат А: пептид с последовательностью SEQ ID N0 10, связанный с пероксидазой,
- конъюгат В: пептид с последовательностью SEQ ID N0 1, связанный с пероксидазой,
- конъюгат С: пептид с последовательностью SEQ ID N0 2, связанный с пероксидазой,
- конъюгат D: пептид с последовательностью SEQ ID N0 3, связанный с пероксидазой,
- конъюгат Е: пептид с последовательностью SEQ ID N0 4, связанный с пероксидазой.
В нижеследующей таблице 1 приведены результаты, являющиеся значениями OD, полученными после иммуноэнзимических исследований по описанному выше протоколу с применением указанных конъюгатов А, В, С, D и Е.
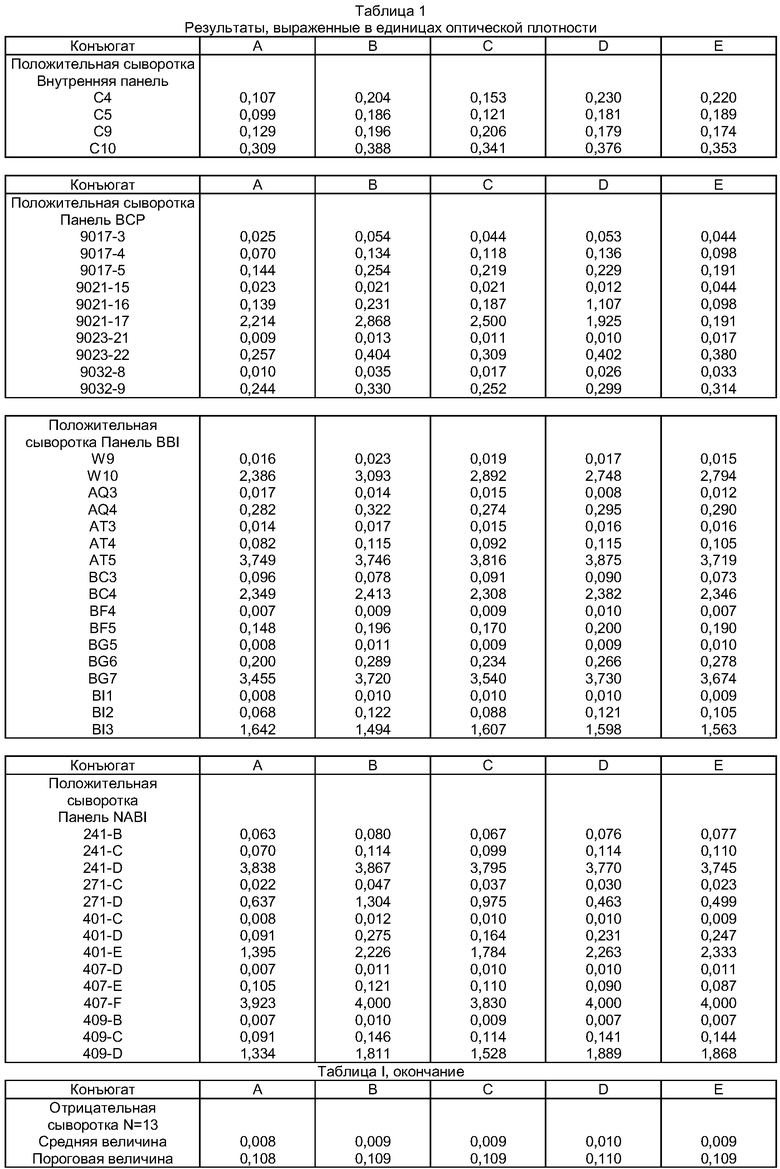
Конъюгаты В, С, D и Е, полученные с помощью пептидов согласно изобретению, дают для тестированных положительных образцов при квазиидентичном пороговом значении величину OD, которая существенно превышает величину OD, полученную посредством конъюгата А 35-мерного пептида, известного из уровня техники (пептид с последовательностью SEQ ID N0 10).
В приводимой ниже таблице II те же результаты выражены через соотношение
OD образца/пороговая величина (OD/VS).
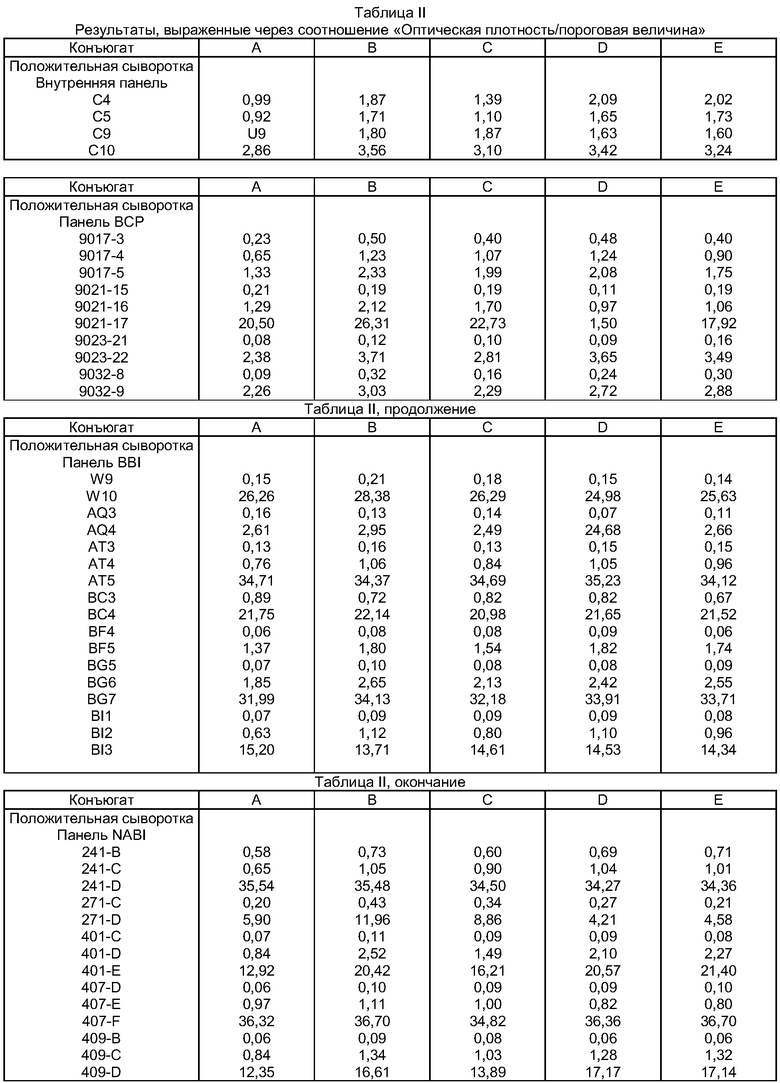
При квазиидентичной пороговой величине конъюгаты В, С, D и Е, полученные с помощью пептидов согласно изобретению, дают для тестированных образцов соотношения OD/VS, которые существенно превышают те же соотношения, полученные с помощью конъюгата А 35-мерного пептида, известного из уровня техники (пептид с последовательностью SEQ ID N0 10). Также некоторые отрицательные образцы с содержанием конъюгата А известного из уровня техники пептида были обнаружены положительными с помощью пептидов согласно изобретению.
В таблице III с результатами, выраженными в виде соотношения OD/VS, показано распределение образцов в зависимости от полученных соотношений OD/VS:
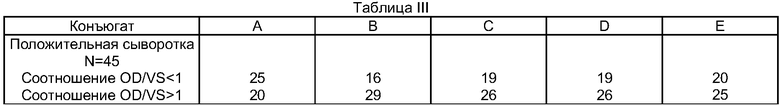
Из таблицы III четко следует, что подвергнутая тесту положительная сыворотка исследуется более эффективно с помощью пептидов согласно изобретению, чем с помощью известных из уровня техники пептидов с последовательностью SEQ ID N0 10 (конъюгат А), так как количество образцов, характеризующихся соотношением OD/VS более 1, является существенно большим.
Как следует в целом из таблиц I, II и III, пептиды согласно изобретению (конъюгаты В, С, D и Е с последовательностью (III)) позволяют эффективно обнаруживать сероконверсии в более ранние сроки, чем известный из уровня техники пептид с последовательностью SEQ ID N0 10 (конъюгат А).
В приводимой ниже таблице IV иммунологическая реакционная способность конъюгатов В, С, D и Е приведена в процентах от иммунологической реакционной способности конъюгата А, который служит эталонным.
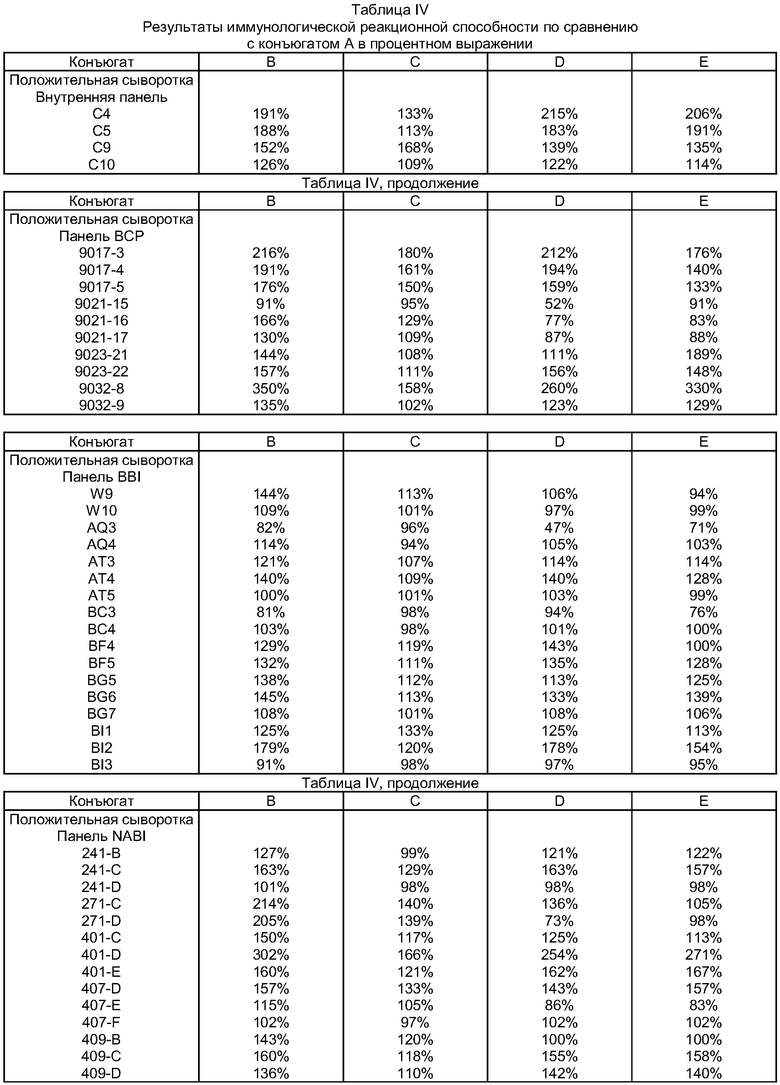
Из таблицы IV хорошо видно, что пептиды согласно изобретению (конъюгаты В, С, D и Е с последовательностью (III)) обладают иммунологической реакционной способностью, которая, как правило, значительно превышает ту же способность известного из уровня техники пептида с последовательностью SEQ ID N0 10, и характеризуются, как правило, более высокой чувствительностью при обнаружении.
Следовательно, приведенные выше результаты показывают, что тестированная сыворотка, положительная по содержанию антител против ВИЧ-1, обнаруживается пептидами согласно изобретению (конъюгаты В, С, D и Е с последовательностью (III)) значительно эффективнее, чем при использовании известного из уровня техники пептида (конъюгата А с последовательностью SEQ ID N0 10), являющегося наиболее близким прототипом. Кроме того, пептиды согласно изобретению (конъюгаты В, С, D и Е с последовательностью (III)) позволяют обнаруживать сероконверсии в более ранние сроки.
Таким образом, стоящая проблема положительно решается посредством пептидов согласно изобретению.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОДНОВРЕМЕННОГО ОБНАРУЖЕНИЯ АНТИГЕНОВ И АНТИТЕЛ ПРОТИВ ИНФЕКЦИОННОГО МИКРООРГАНИЗМА | 2003 |
|
RU2300769C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ХИМЕРНЫЙ ПОЛИПЕПТИД ВИЧ, ПОЛИПЕПТИДЫ И ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К ВИЧ | 2001 |
|
RU2214274C2 |
| КОМПОЗИЦИИ ДЛЯ ПРЕДУПРЕЖДЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ ВИРУСОМ ВИЧ-1 | 2012 |
|
RU2603262C2 |
| СПОСОБ БЫСТРОГО ОТБОРА ВАРИАНТОВ GP-120 ВИЧ | 2012 |
|
RU2603732C2 |
| ВАКЦИНА ПРОТИВ ВИЧ/СПИД | 2010 |
|
RU2475264C2 |
| АНТИТЕЛО ИЛИ ЕГО ФРАГМЕНТ, ИМЕЮЩИЕ НЕЙТРАЛИЗУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИЧ, НО НЕ В ОТНОШЕНИИ IL2 | 2005 |
|
RU2393873C2 |
| АНТИТЕЛО ИЛИ ЕГО ФРАГМЕНТ, ИМЕЮЩИЕ НЕЙТРАЛИЗУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИЧ | 2005 |
|
RU2380378C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ РАЗМНОЖЕНИЯ ВИЧ-1 | 2001 |
|
RU2275379C2 |
| КОМПОЗИЦИИ АНТИТЕЛ К ВИЧ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2757135C2 |
| GP41-НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624046C2 |
Изобретение относится к области вирусологии и генетической инженерии. Синтетический пептид с последовательностью (III) является производным гликопротеина gp41 вируса ВИЧ-1 и пригоден для применения в иммунологических анализах для обнаружения инфекций, вызываемых вирусом ВИЧ-1. Кроме того, предложены антигенная композиция, способ получения пептида, способ обнаружения in vitro антител против ВИЧ-1 и набор для его осуществления. Изобретение может быть использовано в медицине. 7 н. и 2 з.п. ф-лы, 4 табл.
1. Циклический пептид гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III)
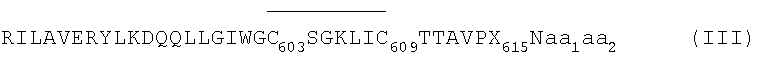
где: X - аминокислота, выбранная из группы, состоящей из F и G, и обе аминокислоты aa1 и аа2 либо отсутствуют, либо представляют собой:
aa1: аланин,
аа2: серии,
предназначенный для обнаружения антител против ВИЧ-1.
2. Пептид по п.1, выбранный из группы, состоящей из следующих пептидов:
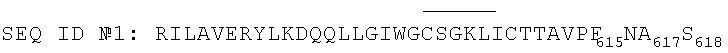
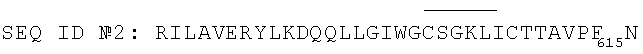
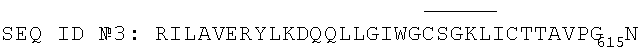
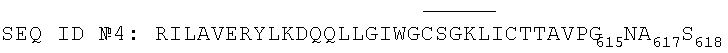
3. Антигенная композиция, предназначенная для обнаружения антител против ВИЧ-1, содержащая пептид по п.1 или 2.
4. Способ получения пептида с последовательностью (III), охарактеризованного в п.1 или 2, причем этот способ состоит в химическом синтезе такого пептида.
5. Способ обнаружения in vitro антител против ВИЧ в биологическом образце, включающий в себя следующие этапы:
a) приведение в контакт биологического образца, по меньшей мере, с одним пептидом гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III), таким как охарактеризованный в п.1 или 2, и/или с композицией по п.3;
b) инкубация смеси в условиях, обеспечивающих образование комплексов «антиген - антитело» между пептидом или пептидами с последовательностью (III) и антителами против ВИЧ-1, присутствующими в биологическом образце, и
c) проявление и обнаружение образовавшихся комплексов «антигены- антитела».
6. Способ обнаружения по п.5, в котором на этапе а) предусматривается приведение в контакт биологического образца с антигенной композицией, состоящей, по меньшей мере, из одного пептида гликопротеина gp41 с последовательностью (III) и одного антигена вируса ВИЧ-2 и/или одного антигена вируса ВИЧ-1 О.
7. Набор для обнаружения антител против ВИЧ в биологическом образце, при этом набор содержит пептид гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III), такой как охарактеризованный в п.1 или 2, или композицию по п.3 при необходимости в сочетании с антигеном ВИЧ-2 и/или ВИЧ-1 О.
8. Применение пептида гликопротеина gp41 вируса ВИЧ-1 с последовательностью (III), охарактеризованного в п.1 или 2 для обнаружения антител против ВИЧ в биологическом образце.
9. Применение композиции по п.3 для обнаружения антител против ВИЧ в биологическом образце.
| В. В. Куйбышева | 0 |
|
SU326490A1 |
| US 2004072267, 15.04.2004 | |||
| WO 9845323, 15.10.1998. | |||
Авторы
Даты
2009-04-20—Публикация
2005-07-27—Подача