Настоящее изобретение относится к антителу или фрагменту антитела, обладающим нейтрализующей активностью в отношении вируса иммунодефицита человека, и пригодным для лечения и/или профилактики ВИЧ-инфекции. Изобретение также относится к фармацевтической композиции, содержащей вышеуказанные антитела, диагностической композиции и к способу проведения пассивной иммунотерапии.
Вирус иммунодефицита человека (ВИЧ) относится к семейству Lentivirus ретровирусов животных и является возбудителем болезни Синдром Приобретенного Иммунодефицита (СПИД). До настоящего времени были идентифицированы и изучены на молекулярном уровне два близкородственных типа ВИЧ - тип 1 (ВИЧ-1) и тип 2 (ВИЧ-2).
Введение противовирусных агентов против ВИЧ, таких как ингибиторы обратной транскриптазы, позволяет во многом улучшить состояние пациента, зараженного ВИЧ. Однако, в большинстве случаев, терапевтическая эффективность лечения СПИДа такими лекарственными средствами является частичной или временной, и, кроме того, эти лекарственные средства подавляют рост кроветворных клеток или проявляют токсичность в их отношении, и таким образом подавляют восстановление иммунной системы, ставшей недостаточной.
Таким образом, общепризнанно, что программы профилактики СПИДа и терапия антиретровирусными лекарственными средствами (VALDISERRI, 2003, Nat. Med, 9:881) должны сочетаться с эффективными бактерицидными веществами и вакцинами. Но создание и испытание таких вакцин оказалось сложным (LETVIN и др. 2002, Annu. Rev. Immunol., 20:73; McMICHAEL & HANKE, 2003, Nat. Med., 9:874).
Поверхности слизистых оболочек являются основным местом проникновения ВИЧ-1 (NICOLSI и др. 1994, J. Acquir. Immun. Defic. Syndr., 7:296). Передача ВИЧ-1 через слизистые оболочки может происходить при попадании на них зараженных ВИЧ-1 жидкостей, таких как сперма, молозиво, грудное молоко и цервикально-вагинальная жидкость (CHERMANN, 1998, Am. J. Reprod. Immunol., 40:183; MILMAN & SCHARMA, 1994, AIDS, 10:1305).
Из-за взаимодействия ВИЧ с поверхностью слизистых оболочек компонент вакцины, разработанной против ВИЧ, должен заставлять иммунную систему слизистой оболочки препятствовать ранним стадиям передачи вируса через слизистую оболочку и потенциальным рецепторам.
Было установлено, что антитела, нейтрализующие вирус СПИДа, могут, очевидно, играть важную роль в защите.
Однако хотя было возможно получить нейтрализующие антитела против роста конкретных штаммов вируса в лаборатории, в получении антител, которые могли бы нейтрализовать широкий ряд штаммов с достаточной эффективностью in vivo, пока не удалось достичь такого же успеха.
Поэтому существует необходимость создания антител, которые способны нейтрализовать инфекцию ВИЧ и, в частности, инфекцию ВИЧ-1.
Существует необходимость создания антител, которые позволяют предотвратить и/или уменьшить инфицирование ВИЧ через поверхность слизистых оболочек.
Также существует необходимость создания антител для изготовления лекарственных препаратов, предназначенных для применения при пассивной иммунотерапии.
Существует необходимость создания антител, которые могут использоваться для диагностических целей.
Целью настоящего изобретения является удовлетворение вышеупомянутых потребностей полностью или частично.
Изобретатели получили эффективное моноклональное антитело, которое позволяет удовлетворить вышеупомянутые неудовлетворенные потребности. В частности, изобретатели идентифицировали Fab (Fragment antigen binding - антигенсвязывающий фрагмент) нового секреторного IgA (S-IgA) антитела, имеющий конкретную область, определяющую комплементарность, 3 (CDR3 - complementarity determining region) вариабельной области его Н-цепи, причем указанное антитело распознает конкретный пептид из белка gp41 вируса ВИЧ-1. Новое идентифицированное антитело также обладает способностью подавлять трансцитоз ВИЧ-1 и блокировать инфицирование CD4+ Т клеток.
Поэтому, согласно одному из его первых аспектов, настоящее изобретение относится к моноклональному антителу или фрагменту антитела, распознающему пептид, имеющий последовательность, представленную на SEQ ID NO 7, или его аналог, причем область, определяющая комплементарность, 3 (CDR3) вариабельной области его Н-цепи содержит пептидную последовательность, представленную на SEQ ID NO 1, или ее функциональный аналог.
Термин «фрагмент антитела», как его используют здесь, обозначает антитело, которое имеет N-концевую и/или С-концевую делецию, но где оставшаяся последовательность остатков аминокислот идентична соответствующим позициям встречающейся в природе последовательности, и биологические свойства которой сохраняются или не подвергаются отрицательному влиянию. Этот фрагмент антитела может включать дополнительные модификации, такие как инсерция, делеция и/или замена остатков аминокислот и/или слияние с другими пептидами или белками с образованием химерного белка. Термин «фрагмент антитела» также может означать различные части антитела, то есть константные, вариабельные, тяжелые и легкие цепи.
В том значении, с которым оно употребляется в настоящем изобретении, выражение «функциональный аналог» в отношении пептида следует понимать как обозначающее пептид, который имеет гомологию или идентичность аминокислотной последовательности с другой аминокислотной последовательностью и который имеет подобные или сохраняющиеся биологические свойства по сравнению с указанной другой пептидной последовательностью. Как правило, пептиды-аналоги содержат консервативные замены (и/или инсерции и/или делеции) аминокислот по сравнению с последовательностью, встречающейся в природе.
Согласно другому аспекту, настоящее изобретение относится к вариабельной области Н-цепи, распознающей пептидную последовательность, представленную на SEQ ID NO 7, или ее аналог, где CDR3 указанной вариабельной области Н-цепи содержит пептидную последовательность, представленную на SEQ ID NO 1, или ее функциональный аналог.
Согласно другому аспекту, антитела по настоящему изобретению или их фрагменты способны нейтрализовать ВИЧ.
Согласно другому аспекту, настоящее изобретение также относится к последовательности нуклеиновых кислот, кодирующей антитело по настоящему изобретению или его фрагмент, а также к вектору и клетке-хозяину, содержащему указанную последовательность нуклеиновых кислот.
Согласно другому аспекту, настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного агента эффективное количество агента, выбранного из антитела по изобретению или его фрагмента, последовательности нуклеиновых кислот по изобретению, вектора по изобретению или клетки-хозяина по изобретению, и содержащей подходящий носитель.
Согласно другому аспекту настоящее изобретение относится к диагностической композиции и способу определения in vitro штамма ВИЧ в образце.
Согласно другому аспекту настоящее изобретение также относится к способу осуществления пассивной иммунотерапии пациента, подверженного инфекции ВИЧ, предусматривающему прием терапевтически эффективного количества по меньшей мере антитела по настоящему изобретению или его фрагмента.
АНТИТЕЛА
Антитело согласно настоящему изобретению обозначает целый иммуноглобулин или его фрагмент, и в частности, его антиген-связывающий участок.
Иммуноглобулин - это тетрамерная молекула, состоящая из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну «легкую» (L - light) (около 25 кДа) и одну «тяжелую» (Н - heavy) цепь (около 50-70 кДа). Амино-концевой участок каждой цепи содержит вариабельную область (V - variable), содержащую примерно от 100 до 110 и более остатков аминокислот, в первую очередь ответственную за распознавание антигена. Карбокси-концевой участок каждой цепи определяет константную область (С - constant), ответственную за эффекторную функцию. Легкие цепи человека классифицируют как λ и к легкие цепи. Константные области тяжелых цепей классифицируют как µ, δ, γ, α и ε, и они определяют изотипы антител, такие как IgM, IgD, IgG, IgA и IgE соответственно. Вариабельные области каждой легкой/тяжелой пары цепей образуют сайт связывания антитела, таким образом, интактный иммуноглобулин обычно имеет по меньшей мере два сайга связывания.
В конкретном воплощении изобретения моноклональное антитело по изобретению или его фрагмент может представлять собой IgA, в частности, секреторный IgA (S-IgA).
Согласно другому воплощению моноклональное антитело по изобретению или его фрагмент может представлять собой антитело человека.
Цепи иммуноглобулина демонстрируют одинаковую общую структуру сравнительно консервативных каркасных областей (FR - framework region), соединенных свободными гипервариабельными областями, также называемыми областями, определяющими комплементарность, или CDR. Области CDR двух цепей каждой пары выровнены при помощи каркасных областей, что делает возможным связывание специфического эпитопа (антиген-связывающая область антитела). Как легкая, так и тяжелая цепи содержат, от N-конца к С-концу, домены FR1, CDR1, FR2, CRD2, FR3, CDR3 и HFR4.
Антитело по изобретению, в частности, содержит в качестве CDR3 вариабельной области Н-цепи пептидную последовательность, представленную на SEQ ID NO 1, или ее функциональный аналог. Эта последовательность состоит из остатков 21 аминокислоты и содержит в середине остаток ароматической гидрофобной кислоты, такой как триптофан или фенилаланин (W или F) (10-ый аминокислотный остаток, начиная с N-конца, обозначенный как W в однобуквенном аминокислотном коде в SEQ ID NO 1).
Не связываясь какой-либо конкретной теорией, исследователи предполагают, что этот остаток ароматической аминокислоты может играть решающую роль в узнавании антигена, то есть пептида Р1, идентифицируемого по пептидной последовательности, представленной на SEQ ID NO 7. Поэтому предполагают, что функциональный аналог последовательности CDR3 по изобретению должен иметь длину последовательности, составляющую по меньшей мере около 15 аминокислот, предпочтительно по меньшей мере около 18 аминокислот, и более предпочтительно около 20-21 аминокислот, и должен содержать в середине последовательности остаток ароматической аминокислоты, такой как триптофан или фенилаланин или их аналоги.
Согласно другому воплощению изобретения вариабельная область Н-цепи моноклонального антитела по настоящему изобретению или его фрагмента, кроме того, содержит по меньшей мере одну CDR, выбранную из CDR1 и CDR2, имеющих соответственно пептидную последовательность, представленную на SEQ ID NO 2 или SEQ ID NO 3, или их функциональных аналогов.
Согласно конкретному воплощению изобретения вариабельная область Н-цепи моноклонального антитела по настоящему изобретению или его фрагмента, кроме того, содержит в качестве CDR областей CDR1, CDR2 и CDR3, имеющие соответственно пептидную последовательность, представленную на SEQ ID NO 2 и SEQ ID NO 3 и SEQ ID NO 1.
В другом воплощении изобретение относится к вариабельной области Н-цепи, как определено выше.
Вариабельная область Н-цепи по настоящему изобретению может распоззнавать пептид, называемый Р1 и имеющий пептидную последовательность, представленную на SEQ ID NO 7, или ее аналог.
Пептид Р1 соответствует аминокислотной последовательности, присутствующей в белке gp41 оболочки вируса ВИЧ, который выставлен на поверхности вирусной частицы до ее взаимодействия с клеткой-мишенью. У штамма ВИЧ-1 эта последовательность простирается от аминокислоты 650 до аминокислоты 685 белка gp41.
В растворе этот пептид может переходить структурированное олигомерное состояние, зависящее от концентрации, а именно, димерное или тетрамерное состояние (ALFSEN & BOMSEL, 2002, J. Biol. Chem., 277: 25649).
Следовательно, антитело или вариабельная область Н-цепи по настоящему изобретению или их фрагмент могут распознавать пептид Р1 в мономерной или олигомерной форме.
Пептидная последовательность Р1 (последовательность SEQ ID NO 7) содержит различные последовательности эпитопов, распознаваемые различными антителами, известными в предшествующем уровне техники. Такими эпитопами являются эпитоп ELDKWA, распознаваемый моноклональным антителом IgG 2F5 и эпитоп NWFDIT, распознаваемый моноклональным антителом IgG 4E10.
В воплощении настоящего изобретения антитело по настоящему изобретению или фрагмент антитела не распознают эпитопы, известные как 2F5 и 4E10.
В другом воплощении настоящего изобретения антитело по настоящему изобретению или его фрагмент могут также содержать вариабельную область L-цепи, содержащую по меньшей мере одну область, определяющую комплементарность, выбранную из CDR1, CDR2 и CDR3, имеющих пептидную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6 соответственно, или их функциональных аналогов.
Таким образом, согласно другому воплощению настоящее изобретение относится к вариабельной области L-цепи, содержащей по меньшей мере один участок CDR, выбранный из CDR1, CDR2 и CDR3, имеющих соответственно пептидную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6, или их функциональных аналогов.
Согласно другому воплощению вариабельная область L-цепи по изобретению включает в качестве CDR областей CDR1, CDR2 и CDR3, имеющие соответственно пептидную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и/или SEQ ID NO 6.
Согласно другому воплощению моноклональное антитело по настоящему изобретению или его фрагмент содержат вариабельную область Н-цепи и вариабельную область L-цепи, имеющие соответственно аминокислотную последовательность, представленную на SEQ ID NO 8 и SEQ ID NO 9.
Согласно одному воплощению антитело по настоящему изобретению представляет собой Fab-фрагмент, идентифицированный как клон 43 в экспериментальной части и содержащий вариабельную область Н-цепи и вариабельную область L-цепи, имеющие соответственно последовательности аминокислот, представленные на SEQ ID NO 8 и SEQ ID NO 9.
Согласно другому воплощению антитело по настоящему изобретению может быть рекомбинантным анти-ВИЧ антителом или его фрагментом, содержащим вариабельную область Н-цепи по настоящему изобретению.
Согласно другому воплощению изобретения рекомбинантное антитело по настоящему изобретению может дополнительно содержать вариабельную область L-цепи по настоящему изобретению.
Следовательно, CDR3 вариабельной области Н-цепи по настоящему изобретению или целиком вариабельная область Н-цепи могут использоваться для создания химерного или рекомбинантного антитела, имеющего каркасную область, отличную от изотипа IgA, такую как, например, каркасная область изотипа IgG. Такая конструкция может быть получена с помощью любых инструментов молекулярной биологии, известных в предшествующем уровне техники, например, как описано в издании «Молекулярное клонирование - Лабораторный справочник» (второе издание), Sambrook и др., 1989, Coldspring Harbor Laborotory, Coldspring Harbor Press, N.Y. (Sambrook). Химерное или рекомбинантное антитело может быть целым антителом или его фрагментом.
Соответственно функциональный аналог CDR по настоящему изобретению вариабельной области Н-цепи или вариабельной области L-цепи, будучи вставленным вместо оригинальной последовательности в антитело по настоящему изобретению, приводит к сохранению его способности или не оказывает отрицательного влияния на его способность распознавать пептид с последовательностью согласно SEQ ID NO 7 или его функциональные аналоги, и сохраняет способность нейтрализовать ВИЧ и/или ингибировать инфицирование ВИЧ.
Настоящее изобретение также относится к антителам, содержащим Fab-фрагмент, являющийся производным человеческого антитела согласно данному изобретению, и Fc-домен, выделенный из другого субтипа Ig, такого как IgG, или подобного ему.
Следовательно, согласно одному из воплощений настоящее изобретение также относится к антигенсвязывающему элементу антитела согласно настоящему изобретению или к его фрагменту, содержащему вариабельную область Н-цепи, как определено выше. Этот антигенсвязывающий участок может необязательно содержать вариабельную область L-цепи, как определено выше.
Антигенсвязывающие участки могут быть получены с помощью любой известной техники рекомбинирования ДНК или путем ферментативного или химического расщепления интактных антител. Антигенсвязывающие участки могут включать в частности. Fab (моновалентный фрагмент, состоящий из VL, VH, CL и СН1 доменов), F(ab')2 (бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидными мостиками в шарнирной области), Fv-домен (фрагмент, состоящий из VL и VH-доменов одного плеча антитела), Fd (фрагмент, состоящий из VH и СН1-доменов), dAb-домен (состоящий из VH-домена), scFv (участок, состоящий из антитела, в котором VL и VH-домены спарены с образованием моновалентной молекулы посредством синтетического линкера), химерное антитело, димеры фрагментов антител, и фрагменты областей, определяющих комплементарность, (CDR).
Способность антитела по настоящему изобретению или его фрагмента нейтрализовать ВИЧ можно оценить с помощью анализа ингибирования трансцитоза и с помощью анализа блокирования инфицирования CD4+T клеток, как будет описано ниже и проиллюстрировано примерами.
НЕЙТРАЛИЗУЮЩАЯ АКТИВНОСТЬ АНТИТЕЛ
Нейтрализующая активность антител по настоящему изобретению или их фрагментов против ВИЧ может быть оценена по игибированию трансцитоза ВИЧ через эпителиальные клетки и/или ингибированию инфицирования клеток CD4+T ВИЧ.
Согласно изобретению нейтрализуемый ВИЧ представляет собой, в частности, штамм ВИЧ-1.
Оценка способности моноклонального антитела по настоящему изобретению ингибировать трансцитоз ВИЧ через клетки может быть проведена на любой поляризованной клетке. В одном воплощении изобретения поляризованная клетка может быть эпителиальной клеткой, такой как, например, линия интестинальных клеток НТ-29 или линия эндометриальных клеток НЕС-1 или клетки из биопсии слизистой оболочки человека (Bomsel и др.. Immunity, 1998, 3:277). Как правило, клеточные линии выращивают в виде плотного поляризованного монослоя на проницаемой фильтровальной подложке (имеющей, например, размер пор 0,45 мкм), образующей границу между двумя независимыми камерами, верхняя из которых омывает верхнюю поверхность эпителиального монослоя, а нижняя омывает базолатеральную поверхность, или биопсии устанавливают с использованием камер.
Трансцитоз может быть инициирован при контакте с инфицированными ВИЧ-клетками, например, инфицированными ВИЧ-мононуклеарами периферической крови (РВМС - peripheral blood mononuclearcells) в апикальной камере.
Тестируемые антитела могут помещать в апикальную камеру до или после введения инфицированных ВИЧ клеток или их могут проинкубировать с вирусом ВИЧ-1 или с ВИЧ-1 инфицированными клетками.
Тестируемые антитела по изобретению могут использовать в различной концентрации, например, от примерно 0,01 нг/мл до примерно 10 нг/мл, в частности от примерно 0,1 и до примерно 5 нг/мл или более предпочтительно от примерно 0,5 до 1 нг/мл.
Оценку трансцитоза вируса и возможности его ингибирования могут осуществлять, определяя нуклеиновую кислоту или белок вируса ВИЧ в базолатеральной среде любыми известными способами, такими как PCR (Polymerase Chain Reaction - полимеразная цепная реакция), RT-PCR (Reverse Transcriptase Polymerase Chain Reaction - полимеразная цепная реакция с обратной транскриптазой) или ELISA (enzyme-linked immunosorbent assay - твердофазный иммуноферментный анализ).
В одном воплощении для оценки трансцитоза вируса ВИЧ могут использовать пептид р24, который могут определять с помощью анализа ELISA с использованием, например, набора, поставляемого PASTEUR-SANOFI (FRANCE).
В конкретном воплощении при добавлении к примерно 106 инфицированных ВИЧ-1 мононуклеаров периферической крови в концентрации от около 0,5 нг/мл до около 5 нг/мл и инкубации в течение около 1 ч при температуре около 17°С или около 4°С перед добавлением инфицированных клеток в апикальную камеру, моноклональные антитела или их фрагменты по настоящему изобретению могут ингибировать трансцитоз вируса, инициированный внесением 106 ВИЧ-1 позитивных мононуклеаров периферической крови в апикальную камеру по меньшей мере примерно на 50%, в частности по меньшей мере примерно на 75% и в более частном случае по меньшей мере примерно на 95% по сравнению с трансцитозом вируса, происходящим в отсутствие антител.
В другом воплощении антитела по настоящему изобретению или их фрагменты могут добавлять в апикальную камеру до введения инфицированных ВИЧ-1 мононуклеаров периферической крови. В этом воплощении происходит ингибирование трансцитоза вируса по меньшей мере примерно на 50% по сравнению с трансцитозом вируса, происходящим в отсутствие антител.
В качестве примера. Fab и Fd-фрагменты клона 43, которые также являются объектом настоящего изобретения, могут ингибировать трансцитоз ВИЧ соответственно примерно по меньшей мере на 70% и примерно на 80%.
В частном воплощении изобретения Fab и Fd-фрагменты клона 43, которые также являются объектами настоящего изобретения, также способны специфически связываться с белком gp41, экспрессированным на поверхности инфицированных ВИЧ-1 (JRCSF клон R5) мононуклеаров периферической крови, как показывает анализ с помощью проточной цитометрии, проведенный традиционным способом, известным из предшествующего уровня техники.
В другом воплощении изобретения моноклональные антитела по настоящему изобретению или их фрагменты могут проявлять способность ингибировать инфицирование CD4+T клеток ВИЧ-1.
В частном воплощении после инкубации вируса в концентрации 1 нг/мл в течение около 30 мин при температуре около 37°С с антителом по настоящему изобретению или его фрагментом, инфицирование CD4+T клеток может быть ингибировано по меньшей мере примерно на 75% и, в частности, по меньшей мере примерно на 95% по сравнению с инфекцией ВИЧ CD4+T клеток, происходящей без антител или в присутствии неспецифического антитела, не распознающего вирус.
В качестве примера, Fab-фрагмент клона 43, который также является объектом настоящего изобретения, может ингибировать инфицирование CD4+T клеток ВИЧ по меньшей мере на 95%.
НУКЛЕИНОВЫЕ КИСЛОТЫ. ВЕКТОРЫ И КЛЕТКИ-ХОЗЯЕВА
Антитело по настоящему изобретению идентифицируют путем скрининга фаг-дисплейной библиотеки Fab-фрагмента IgA, полученной как описано в экспериментальной части.
Способы получения и работы с комбинаторной библиотекой подробно описаны в литературе и входят в общие знания специалиста в данной области.
Комбинаторную фаг-дисплейную библиотеку Fab подвергали скринингу на пептид Р1, имеющий последовательность, представленную на SEQ ID NO 7 с помощью итерактивного пэннинга на антиген, фиксированный на твердой подложке (такой как пластины для твердофазного иммуноферментного анализа (ELISA)), способом, известным как микропэннинг, описанным у Azzay & Highsmith (Clinical Biochemistry, 2002, 35: 425-445).
Начальная концентрация может составлять, например, около 125 микромоль, при которой пептид Р1 переходит в димерное/тетрамерное олигомерное состояние.
Определение взаимодействия между антигеном, а именно Р1 и антигенсвязывающим доменом, находящимся на внешней стороне бактериофага могут проводить любым способом, используемым в данной области. Например, может быть использован способ ELISA, где пептид Р1 наносят на гнезда пластины и затем вносят фаги из библиотеки.
Гены, кодирующие участок связывания антигена, которые являются уникальными для каждого фага, могут выделять из нуклеиновой кислоты выбранного фага, секвенировать и использовать для конструирования генов полной молекулы антитела или его аналога, такого как Fab, F(ab')2 или scFv-фрагменты, как описано выше.
Последовательность генов, кодирующих участок связывания антигена, выделенную из выбранного фага, могут секвенировать любым способом, известным специалисту в данной области техники.
Например, секвенирование могут осуществлять с использованием автоматического секвенатора ДНК с набором реактивов (Applied Biosystems), содержащим флуоресцентно меченные дидезоксинуклеотиды, выступающие в качестве терминаторов, для циклической реакции Taq секвенирования. Могут получать препарат двуцепочечной ДНК, например, из бактерии, и секвенирование могут выполнять с использованием набора праймеров, которые специфически гибридизуются с вектором, используемым для клонирования цепей Н и L фрагмента Fab, в направлении 3'-5' и 5'-3' каждой цепи Fab-фрагмента. Например, при использовании вектора pComb3X, могут использовать праймеры, имеющие последовательности, представленные в Таблице II.
Таким образом, согласно другому воплощению настоящее изобретение также относится к молекулам нуклеиновых кислот, таким как ДНК и РНК, и подобным им, которые кодируют последовательности аминокислот вариабельных областей тяжелых и легких цепей по настоящему изобретению, где эти последовательности представлены соответственно на SEQ ID NO 8 и SEQ ID NO 9.
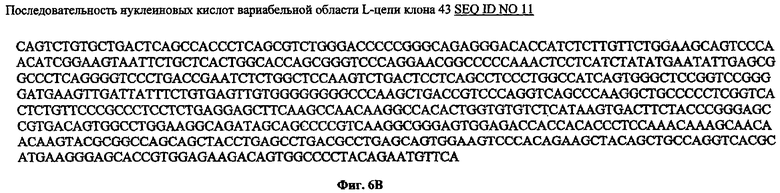
В частности, последовательности аминокислот по настоящему изобретению для вариабельной области Н-цепи могут представлять собой последовательность, представленную на SEQ ID NO 10, а для вариабельной области L-цепи могут представлять собой последовательность, представленную на SEQ ID NO 11.
Конечно, вследствие вырожденности генетического кода, предусматриваются также вариации в последовательности нуклеиновых кислот вариабельных областей тяжелых и легких цепей, соответственно, показанных на SEQ ID NO 10 и SEQ ID NO 11, которые в результате будут давать последовательности нуклеиновых кислот, способные обеспечивать продукцию антител или их функциональных аналогов, содержащих последовательность нуклеиновых кислот вариабельной области тяжелой цепи, представленную на SEQ ID NO 8, и последовательность нуклеиновых кислот вариабельной области легкой цепи, представленную на SEQ ID NO 9.
Согласно одному воплощению настоящее изобретение также относится к последовательности нуклеиновой кислоты, кодирующей антитело по настоящему изобретению или его фрагмент. Этой нуклеиновой кислотой может быть РНК, кДНК или тому подобное. Последовательность нуклеиновой кислоты по настоящему изобретению может быть слитой с другими последовательностями нуклеиновых кислот с получением химерного белка с помощью любой методики, известной в молекулярной биологии. Например, последовательность нуклеиновой кислоты по настоящему изобретению может быть слитой с нуклеиновой кислотой, кодирующей His-Tag HA-Tag участка, которая может использоваться впоследствии, например, для того, чтобы способствовать очистке антител по настоящему изобретению.
Согласно другому воплощению настоящее изобретение также относится к экспрессионному вектору, содержащему последовательность нуклеиновых кислот, кодирующую моноклональное антитело в соответствии с изобретением, или его фрагмент.
Такой экспрессионный вектор может использоваться для экспрессии моноклонального антитела по настоящему изобретению или его фрагмента в различных типах клеток. Такой вектор может представлять собой плазмидный или вирусный вектор. Такой вектор может иметь способность к автономной репликации в клетке-хозяине, или может быть интегрирован в геном клетки-хозяина.
В качестве примера экспрессионных векторов, которые могут являться подходящими для осуществления изобретения, можно упомянуть векторы pComb3X и рА8К88.
Настоящее изобретение также предусматривает экспрессию антитела по настоящему изобретению или его фрагмента с помощью различных клеток-хозяев, таких как бактерии, клетки млекопитающих (СНО или HEK293), клетки насекомых (такие как Sf9-клетки), или клетки растений (табак, томаты).
После экспрессии антитело по настоящему изобретению могут выделять и очищать с помощью любой известной в данной области методики. Например, антитело может экспрессироваться с His-Tag или HA-Tag, и впоследствии его могут очищать на никелевой колонке или с использованием специфического антитела, как это обычно выполняют в уровне техники.
Таким образом, настоящее изобретение также относится к клетке-хозяину, трансформированной последовательностью нуклеиновых кислот, кодирующей моноклональное антитело в соответствии с изобретением или его фрагмент. Клетка-хозяин может быть получена согласно любой известной технике трансформации, например электропорацией, с помощью кальциево-фосфатной техники, липофекцией, инфицированием, например, рекомбинантным вирусом. Настоящее изобретение также относится к клетке-хозяину, трансформированной последовательностью нуклеиновых кислот, кодирующей моноклональное антитело в соответствии с изобретением или его фрагмент, с помощью электропорации в случае бактерий или с помощью липофекции в случае клеток млекопитающего (СНО - Chinese hamster ovary - (клетки) яичника китайского хомячка).
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
Согласно одному воплощению настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного агента эффективное количество по меньшей мере одного агента, выбранного из антитела по изобретению или его фрагмента, в частности клона 43, вариабельной области Н-цепи по изобретению, рекомбинантного анти-ВИЧ антитела по изобретению или его фрагмента, нуклеиновой кислоты согласно изобретению, экспрессионного вектора по изобретению или клетки-хозяина по изобретению, и содержащей подходящий носитель.
Согласно другому воплощению вышеописанный активный агент может использоваться для изготовления лекарственного средства, предназначенного для применения при профилактике и/или лечении ВИЧ-инфекции, и, в частности, ВИЧ-1 инфекции.
Термин «эффективное количество» означает минимальное количество, необходимое для наблюдения ожидаемого эффекта, то есть нейтрализации ВИЧ и/или профилактики инфицирования ВИЧ. Терапевтически или профилактически эффективное количество антитела по изобретению или его фрагмента может быть определено для конкретного пациента как количество антител, необходимое пациенту для достижения терапевтического или профилактического эффекта (то есть уменьшения или предотвращения инфицирования), при снижении до минимума побочных эффектов. Эффективное количество могут измерять по уменьшению количества антигенов ВИЧ в сыворотке у индивидуума.
Служащий в качестве примера и неограничивающий диапазон терапевтически или профилактически эффективного количества антитела по изобретению или его фрагмента находится в пределах примерно от 0,1 до 100 мг/кг, более предпочтительно от 0,5 до 50 мг/кг, еще более предпочтительно от 1 до 20 мг/кг и еще более предпочтительно от 1 до 10 мг/кг.
Согласно другому воплощению моноклональное антитело по изобретению или его фрагмент, или фармацевтическую композицию по изобретению могут применять для пассивной иммунотерапии, путем введения индивидууму, восприимчивому к инфицированию или имеющему предполагаемый контакт с ВИЧ, терапевтически эффективного количества по меньшей мере антитела по изобретению или его фрагментов, или фармацевтической композиции по изобретению. Пассивную иммунотерапию по изобретению могут проводить у пациентов, демонстрирующих СПИД или другие вызванные ВИЧ-инфекцией состояния, или индивидуумов, имеющих риск ВИЧ-инфекции.
Согласно одному воплощению пассивную иммунотерапию по изобретению могут также проводить в профилактических целях, то есть до предполагаемого контакта с ВИЧ.
Фармацевтическую композицию по изобретению могут вводить перорально, парентерально (внутривенно или интранозально или подобным образом), локально, ректально, вагинально или подобными способами.
Таким образом, фармацевтическая композиция по изобретению может быть приготовлена в разных галеновых формах, таких как стерильные растворы для инъекций и впрыскиваний, дисперсии и суспензии, таблетки, пилюли, порошки, липосомы, суппозитории или крема.
Подходящий носитель, используемый при изготовлении фармацевтической композиции по настоящему изобретению, следует подбирать в соответствии с тем, какую галенову форму требуется изготовить. Такие подходящие носители включают, но не ограничиваются, следующие вещества: воду, физиологический раствор, забуференный фосфатом физиологический раствор, декстрозу, глицерин или подобные вещества, а также комбинации указанных веществ. В фармацевтическую композицию по изобретению могут также входить фармацевтически приемлемые соединения, такие как смачивающие и эмульгирующие агенты, предохранители и буферы.
Фармацевтическая композиция по изобретению может также содержать, в дополнение к активным агентам по изобретению, по меньшей мере один другой анти-ВИЧ агент, такой как антиретровирусные лекарства. Согласно другому воплощению такие дополнительные антиретровирусные лекарства могут вводить в комбинации с фармацевтической композицией по настоящему изобретению одновременно, раздельно или последовательно во времени.
В другом воплощении антитело по изобретению или его фрагмент могут быть меченными с терапевтической целью, в этом случае метящий агент может быть конъюгированным лекарственным средством или токсином, таким как радиоизотоп или радионуклид (131I, 99Tc, 111In и подобные), коклюшный токсин, таксол, цитохалазин В, доксорубикон и тому подобное.
ДИАГНОСТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ
Моноклональное антитело по изобретению или его фрагмент могут также использоваться в качестве диагностического агента в способе определения in vitro штаммов ВИЧ, в частности штаммов ВИЧ-1 в образце.
В одном воплощении способ по изобретению включает по меньшей мере следующие стадии:
a) приведения образца в контакт по меньшей мере с антителом по изобретению или его фрагментом в условиях, подходящих для образования комплекса между указанным антителом или его фрагментом с белком ВИЧ, содержащим пептид, имеющий последовательность, представленную на SEQ ID NO 3, или его функциональный аналог, и
b) детекции наличия указанного комплекса.
Детекцию комплекса могут осуществлять с помощью любого иммунологического анализа, известного в области техники.
Такие анализы включают, но не ограничиваются указанным, радиоиммунологический анализ, вестерн-блоттинг, иммунофлюоресцентный анализ, иммуноферментный анализ (такой как ELISA), хемилюминесцентный анализ, иммуногистохимический анализ и подобные методы.
Дополнительно, для того чтобы облегчить детекцию, антитело по изобретению или его фрагмент могут быть маркированы с помощью детектируемого маркера. В качестве примера маркирующих агентов можно упомянуть флуоресцентные соединения, такие как флуоресцеин или родамин; ферменты, такие как пероксидаза хрена, бета-галактозидаза или люцифераза; биотин, позволяющий проводить определение посредством непрямого измерения связывания авидина или стрептавидина; или радиоактивно меченные аминокислоты, содержащие, например, радиоизотоп или радионуклид 3H, 14C или 125I.
Согласно другому воплощению настоящее изобретение также относится к диагностической композиции, содержащей антитело по изобретению или его фрагмент.
Для лучшего понимания изобретения далее приведены следующие примеры.
Представленные примеры служат для иллюстрации изобретения и не призваны ограничивать объем изобретения никаким образом.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
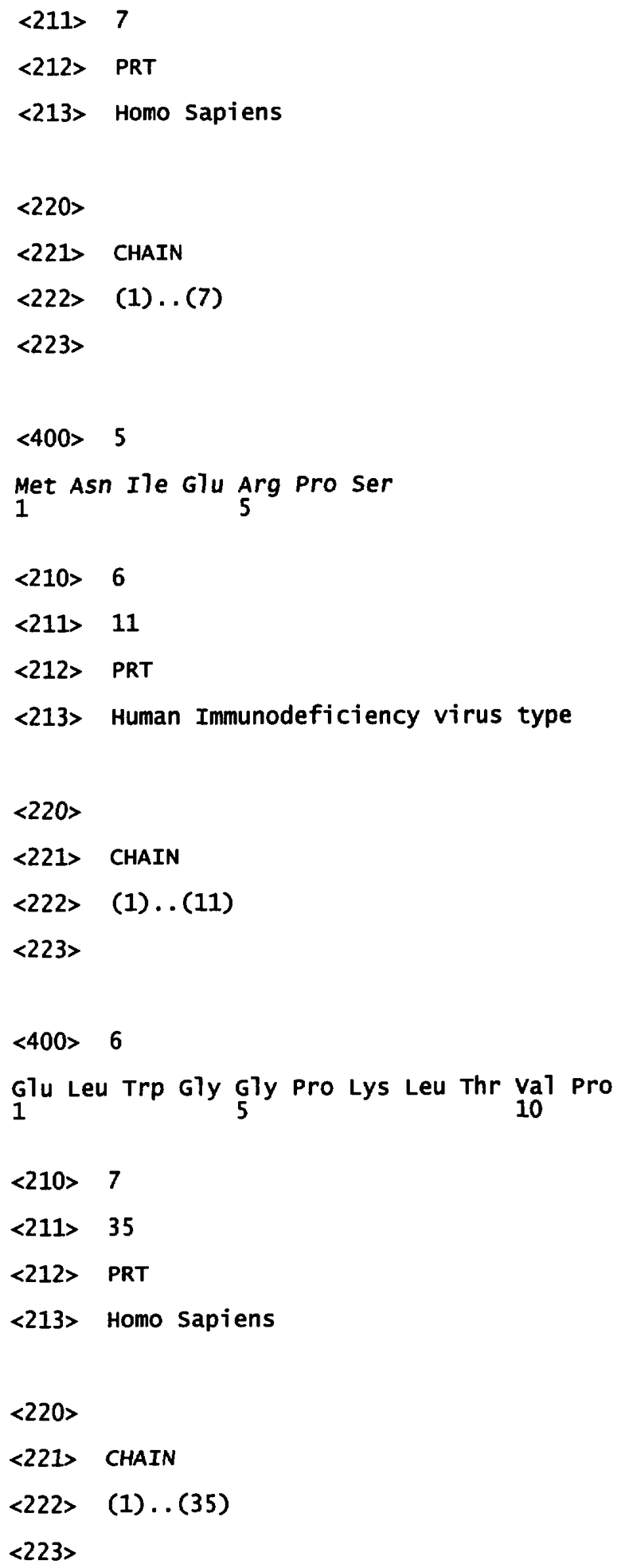
Фиг.1: Показан иммуноблот производного белка gp41 вируса ВИЧ-1, приведенный в контакт с содержащими анти-ВИЧ-1 IgA цервикально-вагинальными выделениями устойчиво серонегативных в отношении IgG индивидуумов группы высокого риска (Highly Exposed Persistently IgG Seronegative - HEPS). В качестве позитивного контроля выполнили иммуноблот gp41-пептида с сывороткой, полученной от ВИЧ серопозитивных индивидуумов. В качестве негативного контроля осуществили тот же самый эксперимент с сывороткой, полученной от ВИЧ серонегативных индивидуумов.
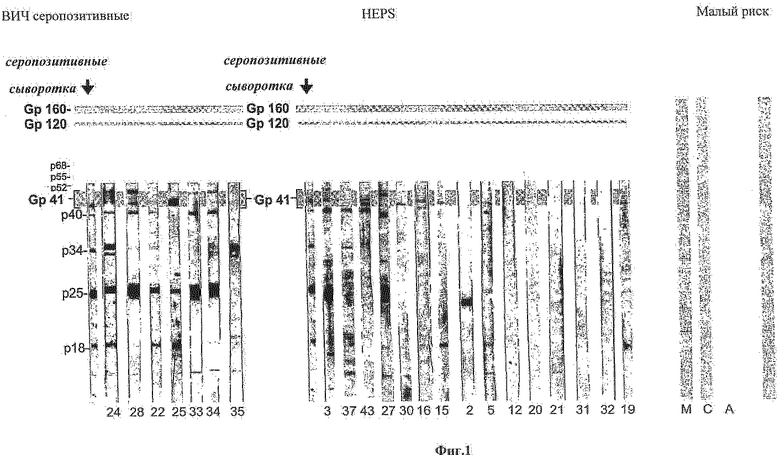
Фиг.2: Представлено схематичное изображение плазмиды pComb3X, где вариабельная и константная области тяжелой и легкой цепей фрагмента Fab IgA фаговой библиотеки вставлены соответственно между сайтами рестрикции ферментов Sac 1 и Xba, и между Xho 1 и Spe 1.
Фиг.3: Показано ингибирование трансцитоза ВИЧ-1 через эндометриальные НЕС-1-клетки клеточных линий выбранными клонами Fab IgA. Негативный контроль получен в результате эксперимента с неспецифичными Fab клонами, которые не распознают Р1 в анализе ELISA. Позитивный контроль выполняют при помощи 2F5 антитела IgA.
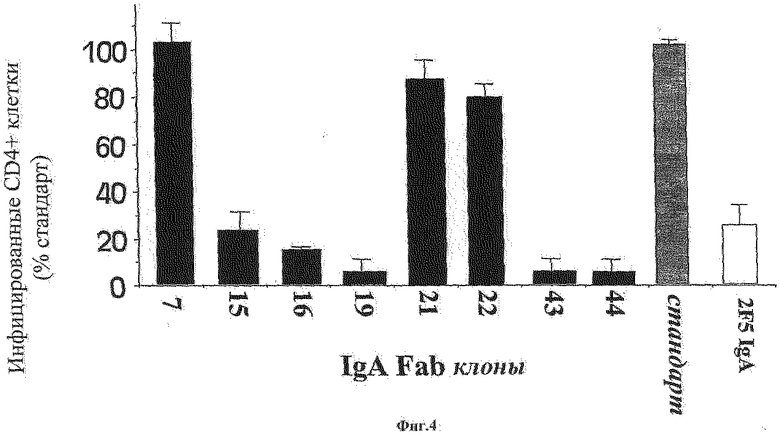
Фиг.4: Показано ингибирование инфицирования вирусом ВИЧ-1 Lai2 клеток HeLa CD4+CXCR4+LTR LacZ, преинкубированных с выбранными Fab-фрагментами с концентрацией 1 нг/мл в течение 30 мин при температуре 37°С перед инкубацией с клетками в течение 1 часа при температуре 37°С. Негативный контроль (стандарт) получали без использования Fab-фрагментов или с использованием неспецифичных Fab клонов, которые не распознают Р1 в анализе ELISA. Позитивный контроль выполняют при помощи 2F5 антитела IgA.
Фиг.5: Показана аминокислотная последовательность области, определяющей комплементарность, 3 (CDR3) (SEQ ID NO 1), а также CDR1 и CDR2 (SEQ ID NO 2 и SEQ ID NO 3) вариабельной области Н-цепи антитела по изобретению. Также показаны аминокислотные последовательности областей, определяющих комплементарность, CDR1, CDR2 и CDR3, вариабельной области L-цепи антитела по настоящему изобретению, представленные на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6. Также показана аминокислотная последовательность SEQ ID NO 7 пептида PI, соответствующая аминокислотной последовательности между положениями 649 и 684 в белке gp41 вируса ВИЧ-1.
Фиг.6А и 6В: Показана аминокислотная последовательность и последовательность нуклеиновых кислот вариабельной области тяжелой цепи (SEQ ID NO 8 и SEQ ID NO 10) и вариабельной области легкой цепи (SEQ ID NO 9 и SEQ ID NO 11) клона Fab 43.
Фиг.7: Представлены аминокислотные последовательности участка FR и области, определяющей комплементарность, (CDR) легкой и тяжелой цепей Fab IgA клона 43, полученные при использовании программы IMGT, доступной в сети Интернет (и разработанной M.P.Lefranc, France). IMGT/V-QUEST software (http://imgt.cines.fr).
Таблица I: Представлены последовательности праймеров, используемых для синтеза ДНК, полученной от HEPS индивидуумов.
Таблица II: Представлены последовательности праймеров, используемых для идентификации и секвенирования Fab IgA из фаг-дисплейной библиотеки.
Пример 1
Идентификация анти-ВИЧ-1 IgA в цервикально-вагинальных выделениях устойчиво серонегативных в отношении IgG индивидуумов группы высокого риска (Highly Exposed Persistently IgG Seronegative - HEPS).
Цервикальные выделения, взятые у 56 HEPS индивидуумов из Камбоджи, тестировали на наличие секреторного IgA к гликопротеину оболочки ВИЧ. Выделения собирали после двухдневного полового воздержания с использованием 3 мл стерильного забуференного физиологического раствора с фосфатом. Образцы центрифугировали, замораживали и хранили при температуре -80°С. Загрязнение образцов спермой измеряли при помощи анализа для определения семенной жидкости (SENA; HUMANGEN FERTILITY DIAGNOSTICS, Charlottesville, VA), согласно инструкции производителя, но оптимизировав процесс увеличением времени инкубации и использованием O-фенилендиамин дигидрохлорида в качестве субстрата. Загрязненные образцы отбраковывали.
Присутствие IgA антител, специфичных к ВИЧ, определяли при помощи вестерн-блоттинга с использованием коммерчески доступного набора (New Lav Blotl, Sanofi-Pasteur, France) и с последовательностью действий согласно инструкции производителя. Среди тестируемых образцов, 22 имели высокий уровень содержания секреторного IgA (S-IgA) против белка оболочки ВИЧ gp41 (Фиг.1).
Пример 2
Составление комбинаторной фаг-дисплейной библиотеки, выражающей Fob-фрагмент IgA.
Для конструирования комбинаторной фаг-дисплейной библиотеки, экспрессирующей Fab-фрагмент IgA использовали В клетки слизистой оболочки, взятые у 22 HEPS индивидуумов из примера 1.
Тотальную РНК получали из обогащенной популяции В-клеток цервикально-вагинальных выделений 22 HEPS пациентов с использованием стандартных методик. Тотальную РНК (60 мкг) очищали от цервикальных В-клеток на единственной быстрой стадии выделения РНК с помощью гуанидин изотиацианата/фенолхлороформа (Chomczynski & Sacchi, Anal. Biochem., 1987, 162: 156-9). Эту тотальную РНК трансформировали в комплементарную ДНК (кДНК) с использованием полимеразной цепной реакции с обратной транскриптазой (RT-PCR). Полученную библиотеку ДНК амплифицировали с использованием специфических праймеров к Fab-фрагменту IgA слизистой оболочки, представленных в таблице I.
Легкую цепь (L) амплифицированной ДНК затем подвергали рестрикции Sac I и Xba 1, а тяжелую цепь (Н) - Xho 1 и Spe 1 и продукты рестрикции вставляли в вектор pComb3X (Barbas и др., Proc Natl Acad Sci USA, 1991, 88:7978-82), подвергнутый рестрикции тем же ферментом. Подвергнутый рестрикции вектор и подвергнутый рестрикции продукт RT-PCR лигировали с помощью ДНК-лигазы фага Т4 (4 вставки плюс 1 вектор плюс Т4ДНК-лигаза, в течение ночи при температуре 14°С) (Фиг.2). Полученные рекомбинантные плазмиды затем использовали для трансформации бактерии E.coli (pilus+, муж) TG1 посредством электропорации.
Библиотеку антитела кДНК в культуре после трансформации бактерии затем экспрессировали в бактериофаге путем суперинфекции при помощи фага-помощника VCS-M13 (1012 бляшкообразующих единиц) (Stratagen, La Jolla, CA).
Препарат фага затем собирали. Фаги осаждали, добавляя 20% (мас./объем) полиэтиленгликоля 8000 и 2,5 М р-ра NaCl с последующей инкубацией на льду в течение одного часа. После центрифугирования бляшки фагов ресуспендировали в забуференном физиологическом растворе с фосфатом и микроцентрифугировали в течение нескольких минут с получением дербиса бляшек.
Рестрикционный анализ отдельных клонов показал, что приблизительно 35% фагов содержали Fab-фрагмент IgA и что титр библиотеки, как правило, был близок к 107 бляшкообразующих единиц/мл и она содержала 107 различных клонов.
Пример 3
Скрининг библиотеки фага Fab-фрагмента белка IgA на пептид Р1 (последовательность №7)
Фаг-дисплейную библиотеку Fab-фрагмента IgA подвергают скринингу посредством микропэннинга, при котором концентрация антигена была варьирующим условием в каждом цикле. Антиген, используемый для скрининга, представлял собой пептид P1 (Alfsen & Bomsel, 2002, J. Biol. Chem., 277: 25649-59; получен от Eurogentec, Бельгия). Начальное количество пептида Р1 составляло 20 мкг, количество делили на 2 в каждом цикле и в конечном итоге количество составляло 2,5 мкг в четвертом цикле.
Гнезда пластин 96 (Exiqon peptide Immobilirez, 10202-111-10) покрывали 125 микромоль пептида Р1, что представляет собой концентрацию, при которой он находится в димерной форме, после чего блокировали бычьим сывороточным альбумином (BSA - bovine serum albumin) в течение 2 часов при температуре 37°С. Концентрированные фаги, полученные из библиотеки, затем наносили на лунки в количестве 1012-1013 бляшкообразующих единиц в течение 2 часов при температуре 37°С. Несвязанные фаги удаляли интенсивным промыванием: на первом и втором цикле селекции промывали 10 раз забуференным физиологическим раствором с фосфатом, содержащим 0,1% Tween-20, затем в течение 10 мин забуференным физиологическим раствором с фосфатом для удаления детергента. На последующих циклах селекции промывание проводили 20 раз забуференным физиологическим раствором с фосфатом, содержащим 0,1% Tween-20, затем 20 раз забуференным физиологическим раствором с фосфатом. Специфическое элюирование фагов, несущих эпитопы поверхностного Fab-фрагмента, связывающего Р1, проводили путем обработки 0,1 М раствора глицин-HCl, с рН, поддерживаемым на уровне 2,2, в течение 10 мин. Элюат немедленно нейтрализовали и использовали для инфицирования 2 мл свежих бактериальных культур Е. coli TG1 (OD600=1). Бактерии инкубировали при 30°С в течение 30 минут, объем культуры увеличивали и культуру инкубировали при 37°С в шейкере в течение 1 часа и после этого добавляли 1012 бляшкообразующих единиц/мл VCS-M13 фага-помощника для получения рекомбинантного фага. Элюированные фаги амплифицировались между каждым циклом пэннинга.
После пэннинга отдельные клоны из четырех циклов выращивали и присутствие Fab-фрагмента определяли с помощью полимеразной цепной реакции с использованием специфических праймеров, представленных в таблице II, которые гибридизуются с вектором в 3'-5' направлении и 5'-3' направлении тяжелой и легкой цепи Fab-фрагмента. Клоны, содержащие Fab-фрагмент белка IgA, переводили в растворимый Fab-фрагмент путем трансформации ими штамма Е. coli, не несущего амбер-супрессор, и определяли последовательность вариабельных областей тяжелой (Н) и легкой (L) цепи с использованием программного обеспечения IMGT/V-Quest (Фиг.7).
Секвенирование генов иммуноглобулина.
Секвенирование проводили с использованием автоматического секвенатора ДНК с набором реактивов, содержащих флуоресцентно меченные дидезоксинуклеотиды, выступающие в качестве терминаторов, для циклической реакции Taq секвенирования (Applied Biosystems). Двунитевую ДНК получали из бактерий и проводили секвенирование с использованием набора праймеров (см. таблица II), которые специфически связываются с вектором pComb3X в направлениях 3'-5' и 5'-3' каждой цепи Fab-фрагменга.
На фиг.6 показаны результаты секвенирования вариабельных областей Н и L цепей клона 43 (SEQ ID NO 10 и SEQ ID NO 11).
На фиг.7 показана идентификация последовательностей соответствующих аминокислот областей, определяющих комплементарность, с использованием программного обеспечения IMGT.
Вектор, используемый для клонирования, несет амбер-кодон между теговыми последовательностями (His-tag и HA-tag), а фаговый белок pIII обеспечивает возможность как получения антитела, слитого с белком оболочки фага, с использованием супрессорного штамма Е. coli, например TG1, так и получения растворимых антител при экспрессии вектора в несупрессорных штаммах, таких как ТОР10. Принимая во внимание это преимущество, ДНК фага использовали для трансформации ТОР-10 Е. coli (штамм, не имеющий суппрессорного амбер-кодона) для экспрессии растворимого Fab-фрагмента без слитого белка pIII. Экспрессию Fab-фрагмента индуцировали с помощью 1 мМ раствора изопропил b-D-тиогалактопиранозида (IPTG).
Для крупномасштабной экспрессии моноклонального антитела по настоящему изобретению весь оперон переносили из pComb3X на вектор pASK88 (SkereA., Gene, 1994, 151(1-2): p.131-5; Skerra A., Gene, 1994, 141(1): p.79-84; Skerra А., и др., Biotechnology (NY), 1991. 9(3), р.273-8; Skerra A. & A. Pluckthun, Protein Eng, 1991, 4(8): p.971-9). Fab-фрагмент ДНК моноклонального антитела по настоящему изобретению амплифициовали с помощью специфических праймеров, вносящих сайты рестрищии, необходимые для субклонирования в pASK88 вектор. Продукты амплификации очищали электрофорезом в агарозном геле и разрезали рестрикционными ферментами PstI и NcoI в случае тяжелой цепи и SacI и HihdIII в случае легкой цепи. Фрагмент Fd (VH-CH1) и гены легкой цепи (VL-С1) отдельно друг от друга вставляли и лигировали в pASK88, расщепленный теми же рестрикционными ферментами по стандартным протоколам. Концевые молекулы трансформировали в термокомпетентные бактериальные клетки JM83 (предоставлены Dr. Skerra) и высевали для разделения индивидуальных клонов. Плазмидную ДНК нескольких клонов анализировали с помощью рестрикционного анализа и, в некоторых случаях, с помощью секвенирования двунитевой ДНК с использованием специфических праймеров.
Экспрессионный вектор pASK88 разработали для удобного клонирования вариабельного домена генов иммуноглобулина и для периплазматической серкеции соответствующих Fab-фрагментов бактерией Escherichia coli. Экспрессию в данной плазмиде контролировал тетрациклиновый промотор.
С использованием этого вектора получили большое количество антител по настоящему изобретению. Препаративную экспрессию проводили в масштабе одного литра с использованием Е. coli (К-12 JM83) в качестве хозяйской клетки для экспрессии. Клетки выращивали до середины логарифмического роста и экспрессию Fab-фрагмента стимулировали 0,2 мг/л ангидротетрациклина в течение 4 час.
Очистку моноклональных антител по настоящему изобретению проводили путем взаимодействия с His-tag на вращающихся колонках Ni-NTA (Qiagen). Стерильно фильтрованную периплазматическую фракцию наносили на колонки и для сбора образцов использовали градиент 250-500 мМ имидазола в хроматографическом буфере.
Пример 4
Твердофазный иммуноферментный анализ, проведенный на растворимых клонах Fab-фрагментов IgA из фаг-дисплейной библиотеки.
Твердофазный иммуноферментный анализ осуществляли на растворимых Fab-фрагментах IgA, полученных из TOP10F' бактерий (система pComb3x) и с растворимыми IgA Fab, полученными из К-12 JM83 бактерий (система pASK88).
Гнезда пластинок (Exiqon peptide Immobilized, 10202-111-10 или NUNC, 439454) покрывали пептидом Р1 (последовательность аминокислот 649-684 белка gp41 вируса ВИЧ-1) и блокировали BSA в течение 2 часов при температуре 37°С. Затем добавляли очищенный IgA в количестве 2 нг/мл и инкубировали 2 часа при температуре 37°С. Детекцию проводили с помощью мышиного анти-На (клон 12СА5, Roche) или анти-His антитела (PentaHis, Qiagen 34660) с последующей обработкой антимышным антителом козы, конъюгированным с пероксидазой хрена (Caltag Laboratories, H1003). Ферментативную реакцию осуществляли при добавлении триметилбензола (3,3',5,5'-тетраметил-бензидин, Kikergaad & Perry Laboratories Inc.) в качестве субстрата и абсорбцию измеряли при 450 нм после добавления 1 М раствора фосфорной кислоты с использованием ELISA ридера. Позитивный контроль представлял собой 2F5 антитела, а негативный контроль представлял собой клон, полученный после пэннинга, который не распознает Р1 в анализе ELISA.
Пример 5
Подавление трансцитоза
Трансцитоз ВИЧ-1 через эпителиальные клетки и нейтрализацию трансцитоза антителами выполняли на линии интестинальных клеток НЕС-1, которые выращивали в виде плотного, поляризованного монослоя в течение 7 дней на проницаемой фильтровальной подложке (размер пор 0,45 мкм), образующей границу между двумя независимыми камерами, верхняя из которых омывала апискальную (люминальную) поверхность эпителиального монослоя, а нижняя омывала базолатеральную (серозную) поверхность. Мононуклеары периферической крови получали и обрабатывали как описано у Lagaye и др. (J. Virol, 2001, 75:4780). После этого мононуклеары периферической крови активировали фитогемагглютинином (фГа) в течение 48 часов и инокулировали ВИЧ-1 JRCSF клоном R5 или YU2 и использовали на 7-ой день после инфекции. Очищенный S-IgA (5 нг/мл) добавляли в апикальную камеру и инкубировали в течение 10 мин при температуре 37°С. Для инициирования трансцитоза вируса в апикальную камеру добавляли 2,166 ВИЧ-1 позитивных мононуклеаров периферической крови. Контакт между ВИЧ-1 позитивными мононуклеарами периферической крови и монослоем эпителиальных клеток приводит к быстрому прорастанию ВИЧ-1 вирионов, с их последующим трансцитозом из апикального в базолатеральный полюс эпителиальных клеток. Спустя 2 часа ингибирование трансцитоза антителами определяли путем детекции белка р24 вируса ВИЧ в базолатеральной среде способом твердофазного иммуноферментного анализа (Coulter, France или PASTEUR SANOFI, FRANCE). Уровень белка р24 в отсутствии антитела или в присутствии неспецифичного к Р1 Fab-фрагмента или в присутствии контрольного IgA 2F5 измеряли как негативный и позитивный контроль со значениями в 100, 98 и 35% соответственно. Значение негативного контроля принимали за 100% трансцитоз и использовали для представления результатов.
Эксперименты проводили в виде в трех независимых экспериментов. Результаты позволили идентифицировать 3 клона, которые были способны ингибировать трансцитоз вируса ВИЧ более чем на 50%, в том числе, клоны 43 и 44 (Фиг.3).
Пример 6
Подавление инфицирования ВИЧ
ВИЧ-1 Lai2 проинкубировали с выбранными Fab-фрагментами в концентрации 1 нг/мл в течение 30 мин при температуре 37°С перед инкубацией с клетками HeLa CD4+CXCR4+LTR LacZ (Dragic и др., 1992, J. Virol., 66:4794-4802) в течение 1 часа при температуре 37°С. Несвязавшийся вирус удаляли промыванием клеток два раза перед инкубацией в течение 36 часов при температуре 37°С. Клетки анализировали на содержание ВИЧ путем измерения бета-галактозидазной активности в выделенных клетках при помощи CPRG субстрата и колориметрических измерений. Негативный контроль осуществляли без использования Fab-фрагментов или с использованием неспецифичных Fab клонов, которые не распознают Р1 в анализе ELISA.
Результаты, представленные на Фиг.3, представляют собой среднее по меньшей мере двух независимых экспериментов, каждый из которых был выполнен дважды.
Результаты позволили идентифицировать 5 клонов, способных ингибировать инфицирование CD4+ клеток ВИЧ-1 более чем на 75% или более чем на 95% (Фиг.4). Среди этих клонов два клона были также способны подавлять трансцитоз ВИЧ - это были клоны 43 и 44 (см. пример 4).








| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ИЛИ ЕГО ФРАГМЕНТ, ИМЕЮЩИЕ НЕЙТРАЛИЗУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИЧ, НО НЕ В ОТНОШЕНИИ IL2 | 2005 |
|
RU2393873C2 |
| АНТИТЕЛА, ОБЛАДАЮЩИЕ СПЕЦИФИЧНОСТЬЮ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2794996C2 |
| НЕКОНКУРЕНТНЫЕ В ОТНОШЕНИИ НЕЙРЕГУЛИНА АЛЛОСТЕРИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО HER3 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704228C2 |
| GP41-НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624046C2 |
| АНТИТЕЛА ПРОТИВ ПРЕДСТАВИТЕЛЯ А5 СЕМЕЙСТВА 19 СО СХОДСТВОМ ПОСЛЕДОВАТЕЛЬНОСТЕЙ И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2785436C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2821703C2 |
| АНТИТЕЛА К Aβ-ПЕПТИДУ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2341533C2 |
| РЕКОМБИНАНТНЫЕ АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF), ПОЛУЧЕННЫЕ ПОСРЕДСТВОМ МУТАГЕНЕЗА ВАРИАБЕЛЬНОЙ ОБЛАСТИ | 2011 |
|
RU2557309C2 |
| Молекулы, связывающиеся с 4-1ВВ | 2011 |
|
RU2710717C2 |
| Антитела против TIGIT и их применение | 2019 |
|
RU2750705C1 |



Изобретение относится к биотехнологии. Описано анти-ВИЧ моноклональное антитело, распознающее пептид, имеющий последовательность SEQ ID NO 7, или его аналог, где область, определяющая комплементарность 3 (CDR3) вариабельной области его Н-(тяжелой) цепи, содержит SEQ ID NO 1, или ее функциональный аналог. Описана вариабельная область Н-цепи, распознающая SEQ ID NO 7, или ее аналог, где CDR 3 содержит SEQ ID NO 1, или ее функциональный аналог. Представлена молекула нуклеиновой кислоты, кодирующая описанное антитело. Предложен экспрессионный вектор, содержащий указанную нуклеиновую кислоту. Предложена клетка-хозяин, трансформированная указанной молекулой нуклеиновой кислоты или предложенным вектором. Раскрыта анти-ВИЧ фармацевтическая композиция, содержащая эффективное количество описанного антитела или указанной молекулы нуклеиновой кислоты, предложенных вектора или клетки-хозяина. Предложен способ проведения пассивной иммунотерапии индивидуума, восприимчивого к инфицированию ВИЧ, включающий введение указанному индивидууму терапевтически эффективного количества описанного антитела или его функционального фрагмента. Также преложен способ определения in vitro штаммов ВИЧ в образце, включающий стадию приведения образца в контакт с описанным антителом или его функциональным фрагментом. Изобретение позволяет нейтрализовать инфекцию ВИЧ, уменьшить инфицирование через слизистые оболочки и проводить пассивную иммунотерапию. 10 н. и 8 з.п. ф-лы, 8 ил., 2 табл.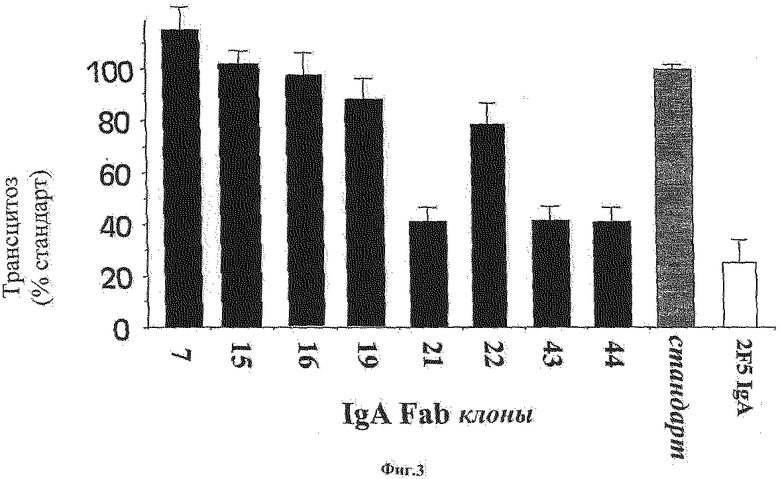
1. Анти-ВИЧ моноклональное антитело или его функциональный фрагмент, распознающее пептид, имеющий последовательность, представленную на SEQ ID NO 7, или его аналог, где область, определяющая комплементарность 3 (CDR3) вариабельной области его Н-(тяжелой) цепи содержит аминокислотную последовательность, представленную на SEQ ID NO 1, или ее функциональный аналог.
2. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что вариабельная область его Н-цепи содержит по меньшей мере одну CDR, выбранную из CDR1 и CDR2, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 2 и SEQ ID NO 3, или их функциональных аналогов.
3. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что оно содержит вариабельную область L-(легкой) цепи, содержащую по меньшей мере одну CDR, выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6, или их функциональных аналогов.
4. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что оно представляет собой IgA.
5. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что оно представляет собой человеческое антитело.
6. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что вариабельная область тяжелой цепи имеет аминокислотную последовательность, представленную на SEQ ID NO 8, а вариабельная область легкой цепи имеет аминокислотную последовательность, представленную на SEQ ID NO 9.
7. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что нейтрализуемый ВИЧ представляет собой штамм ВИЧ-1.
8. Вариабельная область Н-цепи, распознающая аминокислотную последовательность, представленную на SEQ ID NO 7, или ее аналог, где CDR 3 указанной вариабельной области Н-цепи содержит аминокислотную последовательность, представленную на SEQ ID NO 1, или ее функциональный аналог.
9. Вариабельная область Н-цепи по п.8, отличающаяся тем, что она содержит по меньшей мере одну CDR, выбранную из CDR1 и CDR2, имеющих, соответственно, аминокислотные последовательности, представленные на SEQ ID NO 2 и SEQ ID NO 3, или их функциональных аналогов.
10. Рекомбинантное анти-ВИЧ антитело или его функциональный фрагмент, где оно содержит вариабельную область Н-цепи по п.8.
11. Молекула нуклеиновой кислоты, кодирующая моноклональное антитело или его функциональный фрагмент по п.1.
12. Молекула нуклеиновой кислоты по п.11, отличающаяся тем, что последовательность вариабельной области тяжелой цепи представлена на SEQ ID NO 10, а последовательность вариабельной области легкой цепи представлена на SEQ ID NO 11.
13. Экспрессионный вектор, содержащий последовательность нуклеиновых кислот по п.12.
14. Клетка-хозяин, трансформированная молекулой нуклеиновой кислоты по п.11 или 12 или вектором по п.13 и предназначенная для экспрессии антитела или его функционального фрагмента по п.1.
15. Анти-ВИЧ фармацевтическая композиция, содержащая в качестве активного агента эффективное количество агента, выбранного из антитела или его функционального фрагмента по п.1, молекулы нуклеиновой кислоты по п.11, вектора по п.13 или клетки-хозяина по п.14, и подходящий носитель.
16. Применение антитела или его функционального фрагмента по п.1, или молекулы нуклеиновой кислоты по п.11, или вектора по п.13, или клетки-хозяина по п.14 для изготовления лекарственного средства, предназначенного для применения при профилактике и/или лечении ВИЧ-инфекции.
17. Способ определения in vitro штаммов ВИЧ в образце, включающий, по меньшей мере, стадию:
а) приведения образца в контакт, по меньшей мере, с антителом или его функциональным фрагментом по п.1 в условиях, подходящих для образования комплекса между указанным антителом или его функциональным фрагментом с белком ВИЧ, содержащим пептид, имеющий аминокислотную последовательность, представленную на SEQ ID NO 7, или его аналогом, и
б) детекции наличия указанного комплекса.
18. Способ проведения пассивной иммунотерапии индивидуума, восприимчивого к инфицированию ВИЧ, включающий введение указанному индивидууму терапевтически эффективного количества, по меньшей мере, антитела или его функционального фрагмента по п.1.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| RU 2003125554, 10.02.2005. | |||
Авторы
Даты
2010-01-27—Публикация
2005-05-02—Подача