Изобретение относится к антителу или его фрагменту, имеющему нейтрализующую активность против ВИЧ и пригодному для лечения и/или профилактики ВИЧ-инфекции. Изобретение также относится к фармацевтической композиции, содержащей указанное антитело, к диагностической композиции и способу осуществления пассивной иммунотерапии.
Вирус иммунодефицита человека (ВИЧ) является членом семейства лентивирусов, относящегося к ретровирусам животных, и является возбудителем Синдрома Приобретенного Иммунодефицита (СПИД). К настоящему времени были идентифицированы и охарактеризованы на молекулярном уровне два близкородственных типа ВИЧ - тип 1 (ВИЧ-1) и тип 2 (ВИЧ-2).
Применение противовирусных агентов против ВИЧ, таких как ингибиторы РНК-зависимой ДНК-полимеразы (обратной транскриптазы), позволило значительно улучшить состояние пациентов, страдающих от СПИД. Однако, в большинстве случаев, терапевтическая эффективность данных лекарственных средств в отношении СПИД является частичной или временной, и, кроме того, указанные лекарственные средства проявляют токсичность или ингибируют рост кроветворных клеток и, вследствие этого, ингибируют восстановление иммунной системы, которая приобрела недостаточность.
В связи с этим, повсеместно принято, что программы профилактики СПИД и антивирусную терапию с помощью лекарственных средств (VALDISSERI, 2003, Nat. Med, 9:881) следует объединять с эффективными противомикробными агентами и вакцинами. Но, как было доказано, разработка и испытание таких вакцин связаны со сложностями (LETVIN, et al. 2002, Annu. Rev. Immunol, 20:73; McMICHAEL & HANKE, 2003, Nat. Med., 9:874).
Слизистые поверхности являются основным участком проникновения ВИЧ-1 (NICOLOSI, et al. 1994, J. Acquir. Immun. Defic. Syndr., 7:296). Передача ВИЧ-1 может происходить через контакт слизистых поверхностей с инфицированными ВИЧ-1 жидкостями, такими как сперма, молозиво, грудное молоко и цервикально-вагинальные выделения (CHERMANN, 1998, Am. J. Reprod. Immunol., 40:183; MILMAN & SCHARMA, 1994, AIDS, 10:1305).
Ввиду взаимодействия ВИЧ со слизистой поверхностью, компонент вакцины, разработанной против ВИЧ, должен заставлять иммунную систему слизистой оболочки вмешиваться в ранние стадии передачи вируса через слизистую поверхность и взаимодействовать с потенциальными рецепторами.
Признано, что антитела, нейтрализующие вирусы СПИД, могут, безусловно, играть важную роль в противовирусной защите.
Однако, хотя оказалось возможным получить нейтрализующие антитела против конкретного штамма вируса, выращенного в лаборатории, не удалось до сих пор достичь подобного успеха в создании антител, которые могли бы нейтрализовать широкий спектр вирусных штаммов и которые могли бы проявлять эффективную активность in vivo.
Эктодомен белка gp41 ВИЧ, будучи наиболее консервативной областью в оболочке вируса, является чрезвычайно иммуногенным гликопротеином.
Из US 6 455 265 известно, что консервативная область и область антигенной детерминанты из ретровирусного белка оболочки gp41 ВИЧ могут быть причиной вредоносных аутоиммунных явлений благодаря аналогиям трехмерной структуры и/или перекрестной реактивности по отношению к определенным участкам белка человеческой иммунной системы, и, в частности, IL-2 (интерлейкин-2).
Из WO 2005/010033 известны рекомбинантные петлевые белки gp41, содержащие линкерный фрагмент в соединительной петле между N- и С-спиралями gp41 и лишенные или проявляющие сниженные аутоиммунные побочные эффекты. Вследствие этого, существует потребность в антителе, которое позволяет нейтрализовать ВИЧ-инфекцию, и, в частности, ВИЧ-1 инфекцию, без аутоиммунного побочного эффекта.
Существует потребность в антителе, которое позволяет предотвратить и/или уменьшить ВИЧ-инфицирование через слизистую поверхность.
Также существует необходимость в создании антитела для изготовления лекарственного средства, предназначенного для применения при пассивной иммунотерапии.
Существует потребность в антителе, которое можно применять для диагностических целей.
Изобретение имеет своей целью удовлетворение вышеупомянутых потребностей полностью или отчасти.
Изобретателями получено эффективное моноклональное антитело, которое позволяет удовлетворить вышеупомянутые насущные потребности.
В частности, изобретателями идентифицирован новый Fab (fragment antigen binding - антигенсвязывающий фрагмент) IgA антитела, содержащий в вариабельной области Н-цепи по меньшей мере одну область, определяющую комплементарность, (CDR - complementary determining region), выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 1, SEQ ID NO 2 и SEQ ID NO 3, или их функциональных аналогов.
В частности, новый идентифицированный Fab IgA антитела может распознавать рекомбинантный петлевой белок gp41 или белок gp41 дикого типа, но может не распознавать пептид, называемый Р1, который находится в рекомбинантном петлевом белке gp41 или белке gp41 дикого типа.
Пептид PI (SEQ ID NO 12) соответствует, например, аминокислотной последовательности с 649 по 683 из аминокислотной последовательности дикого типа белка gp41, представленной на SEQ ID N0 11 и полученной от ВИЧ-1 штамма НхВ2.
Впервые идентифицированное антитело также обладает способностью ингибировать трансцитоз ВИЧ-1 и блокировать инфицирование CD4+Т-клеток.
Таким образом, согласно одному аспекту, настоящее изобретение относится к моноклональному антителу или его фрагменту, содержащему в вариабельной области Н-цепи по меньшей мере одну область, определяющую комплементарность, (CDR), выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO I, SEQ ID NO 2 и SEQ ID NO 3, или их функциональных аналогов.
Согласно другому аспекту, настоящее изобретение относится к моноклональному антителу или его фрагменту, распознающему рекомбинантный петлевой белок gp41, как определено ниже, и не распознающему пептид, имеющий аминокислотную последовательность, представленную на SEQ ID NO 12. В качестве примера рекомбинантного петлевого белка gp41, который может распознаваться антителом по изобретению, можно привести рекомбинантный петлевой белок gp41, имеющий аминокислотную последовательность, представленную на SEQ ID NO 13.
Соответственно, антитело по изобретению может также распознавать последовательность дикого типа белка gp41, который может существовать в природе в различных штаммах ВИЧ.
Согласно другому аспекту, настоящее изобретение относится к моноклональному антителу или его фрагменту, содержащему вариабельную область L-цепи (легкой (light) цепи), содержащую по меньшей мере одну область, определяющую комплементарность (CDR), выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6, или их функциональных аналогов.
Термин «фрагмент антитела», при использовании в настоящем описании, относится к антителу, которое имеет амино-концевую и/или карбокси-концевую делецию, но в котором оставшаяся аминокислотная последовательность идентична соответствующим положениям в природной последовательности, и его биологические свойства сохраняются или не ухудшаются. Этот фрагмент антитела может содержать дополнительные модификации, такие как вставка, делеция и/или замещение остатков аминокислот и/или слияние с другими пептидами или белками для получения химерных белков. Термин «фрагмент антитела» может также охватывать различные части антитела, т.е. постоянную, вариабельную, тяжелую и легкую цепи.
По смыслу изобретения, выражение «функциональный аналог» в отношении пептида предназначено для обозначения пептида, который имеет аминокислотную последовательность, гомологичную или идентичную другой аминокислотной последовательности, и который имеет и сохраняет или имеет похожие биологические свойства в сравнении с указанной другой пептидной последовательностью. Как правило, пептидные аналоги содержат консервативные аминокислотные замены (и/или вставки и/или делеции) по сравнению с природной последовательностью.
Согласно другому аспекту, настоящее изобретение также относится к вариабельной области Н-цепи, содержащей по меньшей мере одну CDR, выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 1, SEQ ID NO 2, SEQ ID NO 3, или их функциональных аналогов.
Согласно другому аспекту, настоящее изобретение относится к вариабельной области Н-цепи, распознающей рекомбинантный петлевой белок gp41, как определено ниже, например, имеющий аминокислотную последовательность, представленную на SEQ ID NO 13, и не распознающей пептид с аминокислотной последовательностью, представленной на SEQ ID NO 12.
Согласно другому аспекту, антитела по изобретению или их фрагменты обладают способностью нейтрализовать ВИЧ.
Согласно другому аспекту настоящее изобретение также относится к последовательности нуклеиновых кислот, кодирующей антитело по изобретению или его фрагмент, а также к экспрессионному вектору и клетке-хозяину, содержащим указанную последовательность нуклеиновых кислот.
Согласно другому аспекту, настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного агента эффективное количество агента, выбранного из антитела по изобретению или его фрагмента, последовательности нуклеиновых кислот по изобретению, вектора по изобретению или клетки-хозяина по изобретению и подходящий носитель.
Согласно другому аспекту, настоящее изобретение также относится к диагностической композиции и способу детекции in vitro штамма ВИЧ в образце.
Согласно другому аспекту, настоящее изобретение также относится к способу проведения пассивной иммунотерапии индивидуума, восприимчивого к инфицированию ВИЧ, включающему введение терапевтически эффективного количества по меньшей мере антитела по изобретению или его фрагмента.
АНТИТЕЛА
Антитело по изобретению относится к интактному иммуноглобулину или его фрагменту и, в частности, к его антигенсвязывающему участку.
Иммуноглобулин (Ig) представляет собой тетрамерную молекулу, состоящую из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну «легкую» (L) (примерно 25 кДа) и одну «тяжелую» (Н) цепь (примерно 50-70 кДа). Амино-концевой участок каждой цепи включает вариабельную область (V) из примерно от 100 до 110 или более аминокислот, в первую очередь, ответственную за распознавание антигена. Карбокси-концевой участок каждой цепи определяет постоянную область (С), в первую очередь, ответственную за эффекторную функцию. Человеческие легкие цепи классифицируют, как κ и λ легкие цепи. Постоянные области тяжелой цепи классифицируют, как µ, δ, γ, α или ε, и определяют тип антител, как IgM, IgD, IgG, IgA и IgE, соответственно. Вариабельные области каждой пары легкая/тяжелая цепь образуют связывающий сайт антитела, так что интактный иммуноглобулин, как правило, имеет по меньшей мере два связывающих сайта.
В конкретном воплощении изобретения, моноклональное антитело по изобретению или его фрагмент может представлять собой IgA, и более конкретно, секреторный IgA (S-IgA).
Согласно другому воплощению, моноклональное антитело по изобретению или его фрагмент может представлять собой человеческое антитело.
Иммуноглобулиновые цепи характеризуются одинаковой общей структурой из сравнительно консервативных каркасных областей (FR - framework regions), соединенных при помощи свободных гипервариабельных областей, также называемых областями, определяющими комплементарность, или CDR. CDR двух цепей каждой пары выровнены при помощи каркасных областей, что позволяет связывать специфический эпитоп (антигенсвязывающий участок антитела). Как легкие, так и тяжелые цепи содержат, от N-конца к С-концу, домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
Согласно одному воплощению, антитело по изобретению может содержать в вариабельной области Н-цепи по меньшей мере одну область, определяющую комплементарность, (CDR), выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO I, SEQ ID NO 2 и SEQ ID NO 3, или их функциональных аналогов.
Согласно конкретному воплощению, вариабельная область Н-цепи антитела по изобретению или его фрагмента может содержать в качестве CDR областей области, определяющие комплементарность, CDR1, CDR2 и CDR3, имеющие, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 1, SEQ ID NO 2 и SEQ ID NO 3, или их функциональные аналоги.
В другом воплощении, антитело по изобретению представляет собой также вариабельную область Н-цепи, как ранее определено. В частности, вариабельная область Н-цепи по изобретению может содержать по меньшей мере одну CDR, выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 1, SEQ ID NO 2, SEQ ID NO 3, или их функциональных аналогов.
Согласно другому воплощению, вариабельная область Н-цепи по изобретению может содержать в качестве CDR областей CDR1, CDR2 и CDR3, имеющие, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 1 и SEQ ID NO 2 и SEQ ID NO 3, или их функциональные аналоги.
Антитело по изобретению или вариабельная область Н-цепи по изобретению могут не распознавать пептид, называемый Р1 и имеющий аминокислотную последовательность, представленную на SEQ ID NO 12.
В другом воплощении настоящего изобретения, антитело по изобретению или его фрагмент могут также содержать вариабельную область L-цепи, содержащую по меньшей мере одну область, определяющую комплементарность, выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6, или их функциональных аналогов.
Таким образом, согласно другому воплощению, настоящее изобретение также относится к вариабельной области L-цепи, содержащей по меньшей мере одну CDR, выбранную из CDR1, CDR2 и CDR3, имеющих, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6, или их функциональных аналогов.
Согласно другому воплощению, вариабельная область L-цепи по изобретению содержит в качестве CDR областей CDR1, CDR2 и CDR3, имеющие, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6, или их функциональные аналоги.
Согласно одному воплощению, антитело по изобретению содержит вариабельную область Н-цепи по изобретению и вариабельную область L-цепи по изобретению, имеющие, соответственно, аминокислотную последовательность, представленную на SEQ ID NO 7 и SEQ ID NO 8, или ее функциональные аналоги. В конкретном воплощении, антитело по изобретению представляет собой Fab, указанный как клон 69 в экспериментальной части и содержащий указанные вариабельные области Н-(тяжелой(heavy)) и L-цепей.
Согласно другому воплощению, антитело по изобретению может представлять собой рекомбинантное анти-ВИЧ антитело или его фрагмент. Рекомбинантное антитело может содержать вариабельную область Н-цепи по изобретению.
Согласно другому воплощению, рекомбинантное антитело по изобретению может дополнительно содержать вариабельную область L-цепи по изобретению.
Таким образом, области, определяющие комплементарность, вариабельной области Н-цепи по изобретению, или вариабельную область Н-цепи целиком, можно использовать для конструирования химерного, или рекомбинантного, антитела, имеющего каркас, отличающийся от IgA изотипа, такой как, например, каркас IgG изотипа. Такую конструкцию можно получить при помощи любых средств молекулярной биологии, известных в данной области, таких, как описанные в "Molecular Cloning - A Laboratory Manual" (2nd ed.), Sambrook et al., 1989, Coldspring Harbor Laboratory, Coldspring Harbor Press, N.Y. (Sambrook). Химерное, или рекомбинантное, антитело может представлять собой целое антитело или его фрагмент.
Соответственно, функциональный аналог области, определяющей комплементарность, вариабельной области Н-цепи или вариабельной области L-цепи по изобретению, будучи вставленным вместо оригинальной последовательности в антителе по изобретению, сохраняет способность указанного антитела или не ухудшает его способность распознавать рекомбинантный петлевой белок gp41, как определено ниже, или белок gp41 дикого типа. В качестве примера, рекомбинантный петлевой белок gp41 может иметь аминокислотную последовательность, представленную на SEQ ID NO 13, а последовательность дикого типа белка gp41 может иметь, например, аминокислотную последовательность, представленную на SEQ ID NO 11, или ее функциональные аналоги. Дополнительно, также сохраняются его способность не распознавать пептид с последовательностью, представленной как SEQ ID NO 12, и его способность нейтрализовать ВИЧ и/или ингибировать ВИЧ-инфекцию.
Настоящее изобретение также относится к антителам, содержащим Fab-фрагмент, происходящий от человеческого антитела по данному изобретению, и человеческую область Fc, происходящую от другого подтипа Ig, такого как IgG и тому подобное.
Таким образом, согласно одному воплощению, изобретение также относится к антигенсвязывающему участку антитела по изобретению или его фрагменту, содержащему вариабельную область Н-цепи, как описано ранее. Этот антигенсвязывающий участок может, возможно, содержать вариабельную область L-цепи, как описано ранее.
Антигенсвязывающие участки можно получить при помощи любой известной методики рекомбинации ДНК или путем ферментативного или химического расщепления интактных антител. Антигенсвязывающие участки могут включать, помимо всего прочего, Fab (моновалентный фрагмент, состоящий из VL, VH, CL и СН1 доменов), F(ab')2 (бивалентный фрагмент, содержащий два Fab фрагмента, соединенных дисульфидным мостиком в шарнирной области), Fv (фрагмент, состоящий из VL и VH доменов из одного плеча антитела), Fd (фрагмент, состоящий из VH и СН1 доменов), dAb фрагмент (состоящий из VH домена), scFv (состоящий из антитела, в котором VL и VH участки сгруппированы в пары для образования моновалентных молекул через синтетический линкер), химерное антитело, димеры фрагментов антител и фрагменты областей, определяющих комплементарность, (CDR).
Способность антитела по изобретению или его фрагмента нейтрализовать ВИЧ можно оценить посредством анализа ингибирования трансцитоза и анализа блокирования инфицирования CD4+ Т клеток, как описано ниже и проиллюстрировано примерами.
Рекомбинантный петлевой белок GP41
Антитело по изобретению может распознавать рекомбинантные петлевые белки gp41, являющиеся производными аминокислотных последовательностей гликопротеинов ВИЧ gp41 дикого типа. В качестве примера аминокислотной последовательности дикого типа белка gp41, который можно использовать при осуществлении настоящего изобретения, можно упомянуть аминокислотную последовательность, представленную как SEQ ID NO 11, полученную от ВИЧ-1 штамма НхВ2.
Рекомбинантные петлевые белки gp41, которые могут быть пригодны для осуществления настоящего изобретения, можно получить путем введения в области антигенной детерминанты некоторых мутаций (делеция, замещение и/или вставка), для того чтобы уменьшить гомологию с человеческим интерлейкином-2 (IL-2), чтобы исключить или уменьшить риск запуска аутоиммунной реакции. Такие рекомбинантные петлевые белки gp41, в частности, описаны в заявке WO 2005/010033, которая включена в настоящее описание посредством ссылки.
В настоящем описании, «мутация» обозначает любую модификацию участка (возможно, уменьшенного до единичного аминокислотного остатка) полипептида, выполненную физическими средствами, химическими средствами (ковалентная или нековалентная модификация) и/или биологическими средствами (мутации путем замещения, делеции и/или вставки одной или более аминокислот), приводящую к модификации функционального потенциала аминокислоты (аминокислот), входящей(их) в указанную область, называемую «мутированная область». В качестве примера возможно осуществить мутации, приводящие к потере, приобретению и/или модулированию свойств дисульфидных мостиков, водородных связей, электростатических взаимодействий и/или гидрофобных взаимодействий, к модификации способности белка образовывать гетерокомплекс, или, альтернативно, в случае олигомерных белков, к модификации состояния олигомеризации или стабильности олигомера.
Модификация областей антигенной детерминанты приводит к введению в или замещению части петли гидрофильным и не иммуногенным или слабо иммуногенным гибким линкером, и, возможно, с введением мутации(ий).
Рекомбинантный петлевой белок gp41 может включать, кроме того, по меньшей мере одну мутацию в своей области антигенной детерминанты, которая приводит к перекрестной реакции in vitro, В типа и/или Т типа, с хозяйским белком и, в частности, с IL-2.
Некоторые из мутаций, имеющих решающее значение для проявления этого изменения в антигенности, раскрыты в публикациях US 6,455,265 и WO 2005/010033, содержание которых полностью включено в настоящее описание посредством ссылки.
Рекомбинантные петлевые белки gp41, пригодные по изобретению, могут также включать модификации, такие как укорачивание части аминокислотной последовательности на N- или С-концевых областях или добавление пептидной последовательности для получения химерного белка, такой как His-метка (гистидиновая метка) или НА-метка (гемагглютининовая метка), как описано в публикации WO 2005/010033.
Для получения рекомбинантных петлевых белков gp41 для использования в настоящем изобретении можно применять любые известные способы пептидного синтеза или генно-инженерные методики, такие как описаны в "Molecular Cloning - A Laboratory Manual (молекулярное клонирование - лабораторное руководство)" (2nd ed.), Sambrook et al., 1989, Coldspring Harbor Laboratory, Coldspring Harbor Press, N.Y. (Sambrook).
Согласно конкретному воплощению, антитела по изобретению могут распознавать рекомбинантный петлевой белок gp41, имеющий аминокислотную последовательность, представленную на SEQ ID NO 13, или ее аналоги.
Дополнительно, антитело по изобретению или его фрагмент не только распознают рекомбинантный петлевой белок gp41, имеющий, например, аминокислотную последовательность, представленную на SEQ ID NO 13, но также распознает белки gp41 дикого типа, тем не менее, не распознавая при этом пептид, имеющий последовательность, представленную на SEQ ID NO 12.
В качестве примера белка gp41 дикого типа, который может распознаваться антителом по изобретению, можно упомянуть белок gp41, имеющий аминокислотную последовательность, представленную на SEQ ID NO 11, которая происходит от ВИЧ штамма НхВ2 и которая соответствует аминокислотной последовательности с 540 по 683.
ПЕПТИД Р1
Антитело по изобретению не распознает пептид, называемый Р1 и имеющий пептидную последовательность, представленную на SEQ ID NO 12, или ее аналог.
Пептид Р1 соответствует аминокислотной последовательности, присутствующей в gp41, белке оболочки ВИЧ, которая выставляется на поверхности вирусных частиц перед тем, как вирусы взаимодействуют с клетками-мишенями. В качестве примера, у штамма ВИЧ-1НхВ2 в этой последовательности содержатся аминокислоты с 649 по 683 из белка gp41 дикого типа.
В водном растворе этот пептид может принять зависящее от концентрации структурированное олигомерное состояние, а именно, димерное или тетрамерное состояние (ALFSEN & BOMSEL, 2002, J. Biol. Chem., 277:25649).
Таким образом, антитело или вариабельная область Н-цепи по изобретению, или его фрагмент, не распознают пептид Р1 в мономерной или олигомерной форме.
НЕЙТРАЛИЗУЮЩАЯ АКТИВНОСТЬ АНТИТЕЛА
Нейтрализующую активность антитела по изобретению, или его фрагмента, в отношении ВИЧ можно оценить посредством ингибирования трансцитоза ВИЧ через эпителиальные клетки и/или ингибирования инфицирования ВИЧ CD4+ Т клеток.
Согласно одному воплощению, нейтрализуемый ВИЧ представляет собой, в частности, ВИЧ-1 штамм.
Оценку способности моноклонального антитела по изобретению ингибировать трансцитоз ВИЧ через эпителиальные клетки можно выполнить на любых поляризованных клетках. В одном воплощении, поляризованные клетки могут представлять собой эпителиальные клетки, такие как, например, клеточная линия НТ-29 клеток кишечника или эндометриальная клеточная линия НЕС-1, или клетки из биопсии слизистой человека (BOMSEL et al., Immunity, 1998, 3:277). Как правило, клеточные линии выращивают в виде плотного поляризованного монослоя на проницаемой фильтровальной подложке (имеющей, например, размер пор 0,45 мкм), образующей контактную поверхность между двумя раздельными камерами, из которых верхняя омывает апикальную поверхность эпителиального монослоя, а нижняя омывает базолатеральную поверхность, или образцы биопсии размещены внутри с использованием камер.
Трансцитоз можно инициировать взаимодействием с ВИЧ-инфицированными клетками, такими как, например, ВИЧ-1 инфицированные мононуклеары периферической крови (РВМС peripheral blood mononuclear cells), в апикальной камере.
Антитело, подвергаемое тестированию, можно поместить в апикальную камеру до или после внесения ВИЧ-инфицированных клеток, или его можно предварительно инкубировать с клетками, инфицированными вирусом ВИЧ-1 или ВИЧ-1.
Антитело по изобретению, которое необходимо тестировать, можно наносить в различных концентрациях, например, от примерно 0,01 до примерно 10 нг/мл, в частности, от примерно 0,1 до примерно 5 нг/мл или, наиболее предпочтительно, от примерно 0,5 до примерно 1 нг/мл.
Оценку трансцитоза вируса и, возможно, его ингибирования можно выполнять, выявляя нуклеиновую кислоту или белок вируса ВИЧ в базолатеральной среде при помощи любой методики, известной в данной области, такой как PCR (полимеразная цепная реакция - polymerase chain reaction), RT-PCR (полимеразная цепная реакция с обратной транскрипцией - reverse transcriptase polymerase chain reaction) или ELISA (твердофазный иммуноферментный анализ - enzyme linked immunosorbent assay).
В одном воплощении, ВИЧ-пептид, который можно применять для оценки вирусного трансцитоза, может представлять собой пептид р24, который можно детектировать при помощи метода анализа ELISA, используя, например, набор реактивов, поставляемый PASTEUR-SANOFI (FRANCE).
В конкретном воплощении при добавлении к примерно 106 ВИЧ-1 инфицированных РВМС клеток в концентрации от примерно 0,5 нг/мл до примерно 5 нг/мл и инкубировании в течение примерно 1 часа при примерно 17°С или при примерно 4°С перед внесением инфицированных клеток в апикальную камеру, моноклональное антитело по изобретению или его фрагмент может ингибировать трансцитоз вируса, инициированный добавлением 106 ВИЧ-1 инфицированных РВМС клеток в апикальную камеру, по меньшей мере примерно на 50%, в частности, по меньшей мере примерно на 75% и, более конкретно, по меньшей мере примерно на 95%
по сравнению с трансцитозом вируса, выполненным без антитела.
В другом воплощении, антитело по изобретению или его фрагмент можно внести в апикальную камеру перед добавлением ВИЧ-инфицированных РВМС клеток. В таком воплощении, ингибирование трансцитоза может составлять по меньшей мере примерно 50% по сравнению с трансцитозом вируса, выполненным без антитела.
В качестве примера, Fab и Fd клона 69, которые также являются объектами настоящего изобретения, могут ингибировать ВИЧ трансцитоз, соответственно, по меньшей мере примерно на 70% и примерно на 80%.
В конкретном воплощении, Fab и Fd клона 69, которые также являются объектами настоящего изобретения, способны специфически связывать и gp41, экспрессированный на поверхности ВИЧ-1 (JRCSF клон R5) инфицированных РВМС клеток, согласно измерению с помощью проточной цитометрии в соответствии с общеупотребительным способом, известным в данной области.
В другом воплощении, моноклональные антитела по изобретению или их фрагменты могут проявлять способность ингибировать ВИЧ-инфицирование CD44+ Т клеток.
В конкретном воплощении, после инкубирования вируса в концентрации примерно 1 нг/мл в течение примерно 30 мин при температуре примерно 37°С с антителом по изобретению или его фрагментом инфицирование CD4+ Т клеток вирусом ВИЧ может быть ингибировано по меньшей мере примерно на 75%, и более конкретно, по меньшей мере примерно на 95%, по сравнению с ВИЧ-инфицированием CD4+ Т клеток, выполненным без антитела или с неспецифическим антителом, которое не распознает вирус.
В качестве примера, Fab клона 69, который является объектом настоящего изобретения, может ингибировать ВИЧ-инфицирование CD4+ Т клеток по меньшей мере на 95%.
НУКЛЕИНОВЫЕ КИСЛОТЫ, ВЕКТОРЫ И КЛЕТКИ-ХОЗЯЕВА
Антитело по изобретению было идентифицировано скринингом фаг-дисплейной библиотеки Fab IgA, полученной, как описано в экспериментальной части.
Способы получения и работы с комбинаторной дисплейной библиотекой были исчерпывающе описаны в литературе и входят в общие знания специалиста в данной области.
Комбинаторную фаг-дисплейную библиотеку Fab подвергли скринингу двухступенчатым способом.
На первой стадии, фаг-дисплейную библиотеку Fab подвергли скринингу на пептиде Р1, имеющем последовательность, представленную как SEQ ID NO 12, иммобилизованном на твердом носителе (таком как планшеты, используемые в методе твердофазного иммуноферментного анализа (ELISA)), для того чтобы истощить библиотеку антител, распознающих данный пептид.
Эту первую стадию могут осуществлять с концентрацией антигена, составляющей примерно 100 мкМ, при которой пептид Р1 приобретает димерно/тетрамерное олигомеризованное состояние.
На второй стадии, фаг-дисплейную библиотеку Fab подвергли скринингу с рекомбинантным петлевым белком gp41 путем многократного пэннинга на антигене, иммобилизованном на твердом носителе; данный способ известен как микропэннинг и описан у AZZAY & HIGHSMITH (Clinical Biochemistry, 2002, 35:425-445).
Рекомбинантный петлевой белок gp41, который можно использовать для скрининга фаг-дисплейной библиотеки Fab по изобретению, может иметь, например, аминокислотную последовательность, представленную на SEQ ID NO 13, или ее функциональный аналог.
Исходное количество может составлять, например, от примерно 2 до примерно 1 мкг, затем количество можно разделить на два в каждом цикле пэннинга.
Определение взаимодействия между антигеном, а именно, рекомбинантным петлевым белком gp41, и антигенсвязывающим доменом, выставленным на внешней стороне бактериофагов, можно оценивать при помощи любых методик, известных в данной области. Например, можно использовать метод ELISA, где рекомбинантным петлевым белком gp41 покрывают лунки планшета, а затем вносят фаговую библиотеку.
Гены, кодирующие антигенсвязывающий сайт, которые являются уникальными для каждого фага, можно затем выделить из фаговой нуклеиновой кислоты отобранного фага, секвенировать и применить для конструирования генов целой молекулы антитела или ее аналога, такого как Fab фрагмент, F(ab')2 или scFv, как описано выше.
Последовательность генов, кодирующих антигенсвязывающий сайт, выделенных из отобранного фага, можно секвенировать согласно любой методике, известной специалисту в данной области.
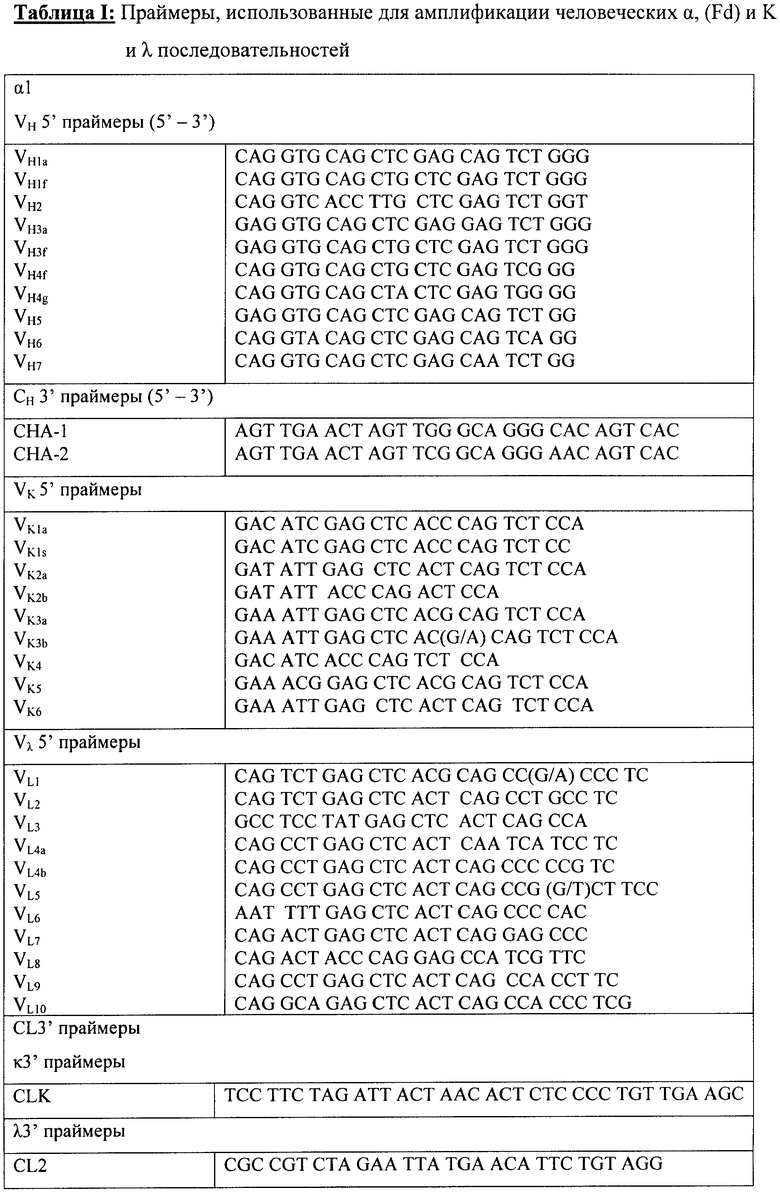
Например, секвенирование можно выполнить, применяя автоматический секвенатор ДНК с набором реактивов (Applied Biosystems), содержащих флуоресцентно меченные дидезоксинуклеотиды, выступающие в качестве терминаторов, для циклической реакции Taq секвенирования. Двухцепочечную ДНК можно получить, например, из бактерий, и секвенирование можно выполнить, используя набор праймеров, которые специфически связываются с вектором, используемым для клонирования Н- и L-цепей Fab, до и после каждой Fab-цепи. Например, применяя рComb3Х вектор, можно использовать праймеры, имеющие последовательности, приведенные в Таблице II.
Таким образом, согласно другому воплощению, настоящее изобретение также относится к молекулам нуклеиновых кислот, таких как кДНК (комплементарная ДНК), РНК и тому подобное, кодирующим аминокислотные последовательности вариабельных областей тяжелых и легких цепей по изобретению, где указанные последовательности представлены, соответственно, на SEQ ID NO 7 и SEQ ID NO 8.
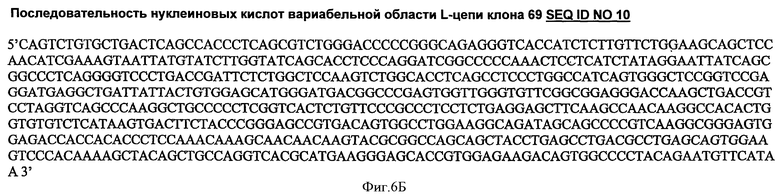
В частности, последовательности нуклеиновых кислот по изобретению могут представлять собой последовательность вариабельной области Н-цепи, представленную на SEQ ID NO 9, и последовательность вариабельной области L-цепи, представленную на SEQ ID NO 10.
Безусловно, вследствие вырожденности генетического кода, можно предположить вариации в последовательности нуклеиновых кислот вариабельных областей тяжелых и легких цепей, показанных, соответственно, на SEQ ID NO 9 и SEQ ID NO 10, которые будут, в результате, давать последовательности нуклеиновых кислот, которые могут быть способны обеспечивать выработку антител или их функциональных аналогов, содержащих аминокислотную последовательность вариабельной области тяжелой цепи, показанную на SEQ ID NO 7, и аминокислотную последовательность вариабельной области легкой цепи, показанную на SEQ ID NO 8.
Согласно одному воплощению, изобретение также относится к последовательности нуклеиновых кислот, кодирующей антитело по изобретению или его фрагмент. Эта нуклеиновая кислота может представлять собой РНК, кДНК и тому подобное. Последовательность нуклеиновых кислот по изобретению можно слить с другими последовательностями нуклеиновых кислот для конструирования рекомбинантных белков при помощи любых методик молекулярной биологии, известных в данной области. Например, последовательность нуклеиновых кислот по изобретению можно слить с нуклеиновой кислотой, кодирующей His-метку или НА-метку, которые можно использовать впоследствии, например, для очистки антител по изобретению.
Согласно другому воплощению, настоящее изобретение также относится к экспрессионному вектору, содержащему последовательность нуклеиновой кислоты, кодирующей моноклональное антитело в соответствии с изобретением или его фрагмент.
Такой экспрессионный вектор можно применять для экспрессии моноклонального антитела в соответствии с изобретением, или его фрагмента, в клетках различных типов. Такой вектор может представлять собой плазмиду или вирусный вектор. Такой вектор может обладать способностью к автономной репликации в клетке-хозяине, или его можно интегрировать в геном клетки-хозяина.
В качестве примера векторов, которые могут служить для осуществления изобретения, можно упомянуть pComb3Х или pASK88.
В настоящем изобретении также предусматривается экспрессия антитела по изобретению, или его фрагмента, при помощи различных клеток-хозяев, таких как бактерии, клетки млекопитающих (СНО или НЕК293), клетки насекомых (такие как Sf9 клетки) или клетки растений (табак, томаты).
После экспрессии антитело по изобретению можно выделить и очистить при помощи любых методик, известных в данной области. Например, антитело можно экспрессировать с His-меткой или НА-меткой и можно впоследствии очистить на никелевой колонке или с использованием специфического антитела, как это обычно выполняют в данной области.
Таким образом, настоящее изобретение также относится к клетке-хозяину, трансформированной при помощи последовательности нуклеиновой кислоты, кодирующей моноклональное антитело в соответствии с изобретением или его фрагмент. Клетку-хозяин можно получить в соответствии с любой методикой трансформации, известной в данной области, такой как электропорация, методики обработки фосфатом кальция, липофекция, инфицирование при помощи, например, рекомбинантного вируса. Настоящее изобретение относится к клетке-хозяину, трансформированной последовательностью нуклеиновой кислоты, кодирующей моноклональное антитело в соответствии с изобретением или его фрагмент, например, с помощью электропорации в случае бактерий или липофекции в случае клеток млекопитающих (СНО - Chinese hamster ovary - (клетки) яичника Китайского хомячка).
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
Согласно одному воплощению, изобретение относится к фармацевтической композиции, содержащей в качестве активного агента эффективное количество по меньшей мере одного агента, выбранного из антитела по изобретению или его фрагмента, в частности клона 69, вариабельной области Н-цепи по изобретению, рекомбинантного анти-ВИЧ антитела по изобретению или его фрагмента, нуклеиновой кислоты согласно изобретению, экспрессионного вектора согласно изобретению или клетки-хозяина согласно изобретению, и подходящий носитель.
Согласно другому воплощению, вышеописанный активный агент можно использовать для производства медицинского препарата, предназначенного для применения при профилактике и/или лечении ВИЧ-инфекции, и в частности, ВИЧ-1 инфекции.
Термин «эффективное количество» означает минимальное количество, необходимое для проявления ожидаемого эффекта, т.е. нейтрализации ВИЧ и/или предотвращения инфицирования вирусом ВИЧ. Терапевтически или профилактически эффективное количество антитела согласно изобретению или его фрагмента для конкретного пациента можно определить, как количество антитела, вводимого индивидууму для оказания терапевтического или профилактического эффекта (т.е. уменьшение или профилактика инфицирования) при минимизации побочных эффектов. Эффективное количество можно измерить по уменьшению количества ВИЧ антигенов в сыворотке у индивидуума.
В качестве примера, не ограничивающий диапазон терапевтически или профилактически эффективного количества антитела по изобретению или его фрагмента составляет примерно 0,1-100 мг/кг, более конкретно, примерно 0,5-50 мг/кг, более конкретно, примерно 1-20 мг/кг и, еще более конкретно, примерно 1-10 мг/кг.
Согласно другому воплощению, моноклональное антитело по изобретению, или его фрагменты, или фармацевтическую композицию по изобретению можно применять при пассивной иммунотерапии путем введения индивидууму, имеющему риск быть инфицированным или имеющему предполагаемый контакт с ВИЧ, или находившемуся в контакте с ВИЧ, терапевтически эффективного количества по меньшей мере антитела согласно изобретению, или его фрагмента, или фармацевтической композиции по изобретению. Пассивную иммунотерапию по изобретению можно практиковать в отношении индивидуумов, проявляющих симптомы СПИД или родственные болезненные состояния, вызванные ВИЧ инфекциями, или индивидуумов, находящихся в группе риска ВИЧ инфекций.
Согласно одному воплощению, пассивную иммунотерапию по изобретению можно также применять профилактически, т.е. до предполагаемого контакта с ВИЧ.
Фармацевтическую композицию по изобретению можно вводить перорально, парентерально (внутривенно или интраназально, или тому подобное), местно, ректально, вагинально или тому подобное.
Таким образом, фармацевтическую композицию по изобретению можно изготавливать в виде различных готовых лекарственных форм, таких как инъекционные или инфузионные стерильные растворы, дисперсии или суспензии, таблетки, пилюли, порошки, липосомы, суппозитории и кремы.
Подходящий носитель для использования в изготовлении фармацевтической композиции по изобретению необходимо адаптировать в соответствии с лекарственной формой, которую предполагается изготовить. Такие подходящие носители включают, но не ограничиваются указанным, воду, физиологический раствор, забуференный фосфатом физиологический раствор, декстрозу, глицерин и тому подобное, а также их комбинации. Фармацевтически приемлемые соединения, такие как увлажняющие или эмульгирующие агенты, консерванты или буферы, можно также включать в фармацевтические композиции по изобретению.
Фармацевтическая композиция по изобретению может также включать, в дополнение к активным агентам по изобретению, другие активные агенты против ВИЧ, такие как антиретровирусные лекарственные средства. Согласно другому воплощению, такие дополнительные антиретровирусные лекарственные средства можно вводить в комбинации с фармацевтической композицией по изобретению одновременно, раздельно или последовательно во времени.
В другом воплощении, антитело по изобретению или его фрагмент может также быть помечено для терапевтических целей, причем в этом случае метка может представлять собой конъюгат лекарственного средства или токсин, например, радиоизотоп или радионуклид (131I, 99Тc, 111In или тому подобное), коклюшный токсин, таксол, цитокалазин В, доксорубицин и тому подобное.
ДИАГНОСТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ
Моноклональное антитело по изобретению или его фрагмент можно также применять в качестве диагностического агента в способе детекции in vitro ВИЧ-штамма, и в частности, ВИЧ-1 штамма, в образце.
В одном из его вариантов воплощения, способ по изобретению включает по меньшей мере стадии:
А. Приведение образца в контакт по меньшей мере с антителом по изобретению или с его фрагментом при условиях, пригодных для образования комплекса между указанным антителом, или его фрагментом, и белком gp41 или его функциональным аналогом.
Б. Детекция наличия указанного комплекса.
В качестве примера белка gp41, который может образовать комплекс с антителом согласно изобретению, можно упомянуть белки gp41 дикого типа, такие как, например, белок gp41, имеющий аминокислотную последовательность, представленную на SEQ ID NO 11 или его функциональный аналог, или модифицированные gp41 белки, такие как рекомбинантный петлевой белок gp41, имеющий, например, аминокислотную последовательность, представленную на SEQ ID NO 13, или его функциональный аналог.
Детекцию комплекса можно осуществлять при помощи любого метода иммунного анализа, известного в данной области.
Такие методы анализа включают, но не ограничены, радиоиммунный анализ, анализ с помощью Вестерн-блота, иммунофлуоресцентный анализ, ферментный иммуноанализ (такой как ELISA), хемолюминесцентный анализ, иммуногистохимический анализ и тому подобное.
Дополнительно, для облегчения детекции, моноклональное антитело по изобретению, или его фрагмент, можно пометить при помощи детектируемого маркера. В качестве примера агента для мечения можно упомянуть флуоресцирующие соединения, такие как флуоресцеин или родамин; ферменты, такие как пероксидаза хрена, бета-галактозидаза или люцифераза; биотин, позволяющий выполнять детекцию посредством непрямого измерения связывания авидина или стрептавидина; или радионуклиды 3H,14С или 125I.
Согласно другому варианту воплощения, настоящее изобретение также относится к диагностической композиции, содержащей антитело в соответствии с изобретением или его фрагмент.
Чтобы сделать данное изобретение более понятным, предоставлены следующие примеры.
Указанные примеры предназначены только для иллюстрации и не должны истолковываться как ограничивающие каким-либо образом область изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 представлен иммуноблот производного белка gp41 ВИЧ-1, приведенного в контакт с цервикально-вагинальным выделением устойчиво серонегативных в отношении IgG индивидуумов группы высокого риска (Highly Exposed Persistently IgG Seronegative - HEPS), содержащим анти-ВИЧ-1 IgA. В качестве позитивного контроля выполнили иммуноблот gp41-пeптидa с сывороткой, полученной от ВИЧ серопозитивных индивидуумов. В качестве негативного контроля осуществили тот же самый эксперимент с сывороткой, полученной от ВИЧ серонегативных индивидуумов.
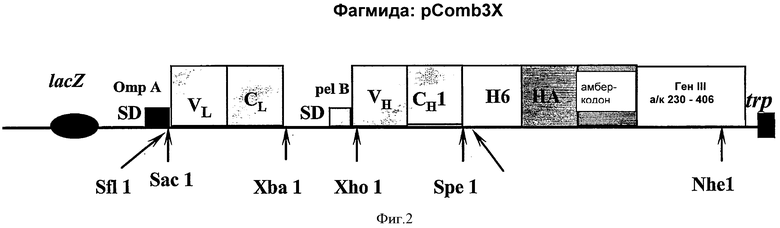
На Фиг.2 схематично представлено изображение плазмиды pComb3Х, где вариабельные и константные области тяжелой и легкой цепей от фаговой библиотеки Fab IgA были вставлены, соответственно, между сайтами рестрикции ферментами Sac 1 и Xba I, и между Xho 1 и Spe 1.
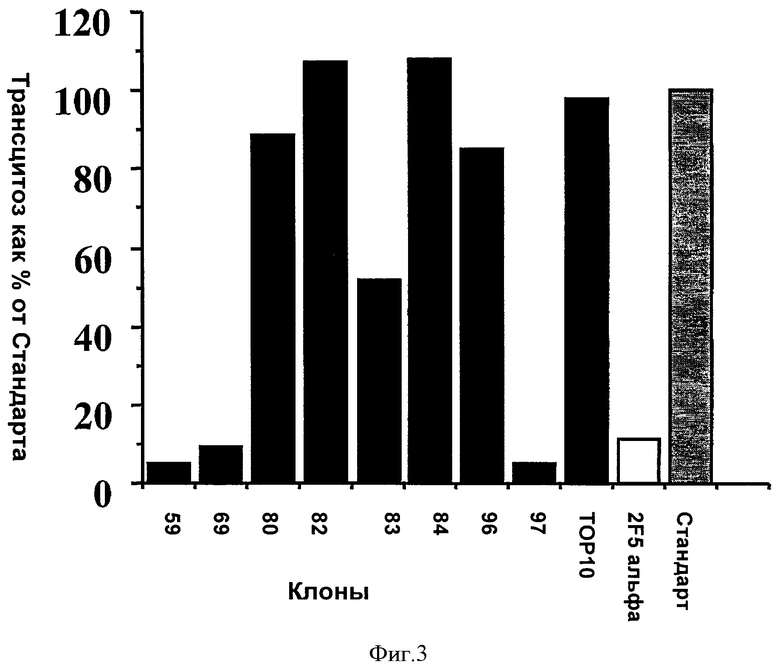
На Фиг.3 представлено ингибирование трансцитоза ВИЧ-1 через эндометриальные клетки линии НЕС-1 отобранными клонами IgA Fab. Негативный контроль получили, выполнив эксперимент без антитела (стандарт) или с продуктом, полученным в результате скрининга фаговой библиотеки, полученной при помощи пустой плазмиды ТОР10. Позитивный контроль выполняли с использованием 2F5 антитела IgA.
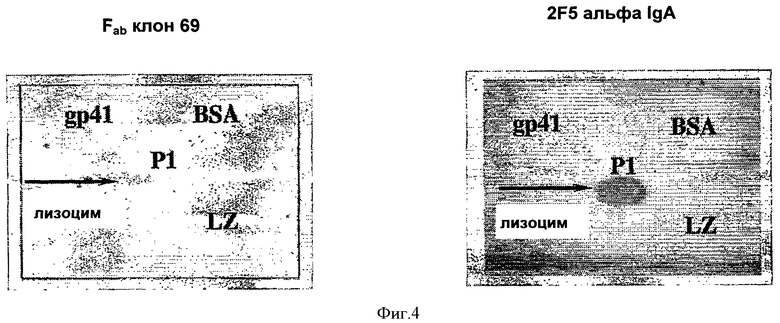
На Фиг.4 представлены результаты дот-блот анализа, выполненного с клоном Fab 69 и антителом альфа 2F5 IgA на белке gp41 дикого типа из штамма ВИЧ НхВ2 (аминокислоты с 546 по 682) с использованием пептида с лейциновой застежкой, BSA (bovine serum albumin - бычий сывороточный альбумин) и лизоцима. После промывания нитроцеллюлозных мембран, антитело/белковые комплексы инкубировали с мышиным анти-His антителом для Fab клона 69 и мышиным анти-человеческим антителом для 2F5 антитела. Оба комплекса детектировали при помощи анти-мышиного антитела козы, конъюгированного с пероксидазой хрена, с последующим использованием электрогенерированной хемолюминисценции и ауторадиографии.
На Фиг.5 представлены аминокислотные последовательности, соответствующие определяющим комплементарность последовательностям вариабельной области Н-цепи антитела согласно изобретению (CDR1 как SEQ ID NO 1, CDR2 как SEQ ID NO 2, CDR3 как SEQ ID NO 3), и области, определяющие комплементарность, вариабельной области L-цепи антитела согласно изобретению, причем CDR1, CDR2 и CDR3 представлены на SEQ ID NO 4, SEQ ID NO 5 и SEQ ID NO 6.
На Фиг.6А и 6Б представлены аминокислотные последовательности и последовательности нуклеиновых кислот вариабельной области тяжелой цепи (SEQ ID NO 7 и SEQ ID NO 9) и вариабельной области легкой цепи (SEQ ID NO 8 и SEQ ID NO 10) клона Fab 69.
На Фиг.7 представлены аминокислотные последовательности каркасной области (FR) и области, определяющей комплементарность (CDR) легкой и тяжелой цепей Fab IgA клона 69, полученного с использованием IMGT программы, бесплатно доступной из Интернета (созданной M.P.LEFRANC, France). IMGT/V-QUEST программа (http://imtg.cines.fr).
На Фиг.8 представлены аминокислотные последовательности, соответствующие белку gp41 дикого типа, SEQ ID NO 11 (ВИЧ-1 штамм НхВ2), пептиду PI SEQ ID NO 12.
На Фиг.9 представлены аминокислотные последовательности рекомбинантного петлевого белка gp41, SEQ ID NO 13.
В Таблице I представлены последовательности праймеров, использованных для амплификации ДНК, полученной от HEPS индивидуумов.
В Таблице II представлены последовательности праймеров, использованных для идентификации и секвенирования последовательностей нуклеиновых кислот Fab IgA из фаг-дисплейной библиотеки.
Пример 1
Идентификация анти-ВИЧ-1 IgA в цервикально-вагинальных выделениях устойчиво IgG серонегативных индивидуумов группы высокого риска (HEPS индивидуумов).
Цервикальные выделения 56 HEPS индивидуумов из Камбоджи исследовали на наличие гликопротеина оболочки ВИЧ S-IgA. Выделения собирали после двух дней полового воздержания, используя 3 мл стерильного PBS (phosphate buffered saline - забуференного фосфатом физиологического раствора). Образцы центрифугировали и замораживали и хранили при -80°С. Контаминацию образца спермой измеряли с использованием метода анализа детекции семенной жидкости (SEMA; HUMANGEN FERTILITY DIAGNOSTICS, Charlottesville, VA) согласно инструкциям производителя, но оптимизированного в отношении увеличения времени инкубирования и использования O-фенилендиамин дигидрохлорида в качестве субстрата. Контаминированные образцы изымали из исследования.
Наличие специфических IgA антител к ВИЧ тестировали при помощи Вестерн-блота с применением коммерчески доступного набора реактивов (New Lav Blot1, Sanofi-Pasteur, France) в соответствии с инструкциями производителя.
В 22 из протестированных образцов содержалась в большом количестве анти-ВИЧ секреторная форма IgA (S-IgA) против оболочечного gp41 (Фиг.1).
Пример 2
Конструирование комбинаторной фаг-дисплейной библиотеки, экспрессирующей Fab от IgA
В-клетки слизистой оболочки от 22 идентифицированных HEPS индивидуумов из Примера 1 использовали для конструирования комбинаторной фаговой дисплейной библиотеки, экспрессирующей Fab от IgA.
Целую РНК получали из обогащенной популяции В-клеток из цервикально-вагинальных выделений от 22 HEPS индивидуумов с применением стандартных методик. Целую РНК (60 мкг) очищали из цервикальных В-клеток путем быстрой одностадийной методики выделения РНК на основе гуанидина изотиоцианата/фенолхлороформа (CHOMCZYNSKI & SACCHI, Anal. Biochem., 1987, 162:156-9). Данную РНК целиком трансформировали в комплементарную ДНК (кДНК) с использованием полимеразной цепной реакции с обратной транскрипцией (RT-PCR). Полученную кДНК библиотеку амплифицировали с использованием специфических праймеров Fab IgA слизистой оболочки, приведенных в Таблице I.
Затем амплифицированную ДНК расщепляли при помощи Sac I и Хbа 1 для легкой цепи (L) и Xho 1 и Spe 1 для тяжелой цепи (Н), и полученные в результате расщепления продукты вставляли в вектор pComb3Х (BARBAS et al., Proc Natl Acad Sci USA, 1991, 88:7978-82), расщепленный при помощи тех же самых ферментов. Расщепленный вектор и расщепленный PCR-продукт лигировали с использованием ДНК-лигазы от фага Т4 (4 вставки плюс 1 вектор плюс Т4ДНК лигаза, в течение ночи при 14°С) (Фиг.2). Полученные рекомбинантные плазмиды затем использовали для трансформации бактерий Е. coli (pilus+, мужские) TG1 посредством электропорации.
Библиотеку комплементарных ДНК антител в культуре после трансформации бактерий затем экспрессировали на бактериофаге путем суперинфицирования при помощи хелперного фага VCS-M13 (1012 pfu - (plague forming units - бляшкообразующих единиц)) (Stratagene, La Jolla, CA).
Собирали препараты фага. Фаги осаждали добавлением 20% (масс./об.) полиэтиленгликоля 8000 и 2,5 М NaCl с последующим инкубированием на льду в течение одного часа. После центрифугирования осадок фага ресуспендировали в забуференном фосфатом физиологическом растворе (PBS) и микроцентрифугировали в течение нескольких минут для отделения клеточного дебриса.
Рестрикционный анализ колоний из титровальных планшетов показал, что приблизительно 35% фагов содержат Fab IgA и что содержащие библиотеку титры, как правило, были близки к содержанию 107 КОЕ/мл (колониесодержащих единиц в мл) и 107 различных клонов.
Пример 3
Скрининг Fab IgA фаговой библиотеки на рекомбинантном петлевом белке gp41 (SEQ ID NO 13)
Fab IgA фаговую дисплейную библиотеку подвергали скринингу путем микропэннинга, в котором концентрация антигена представляла собой параметр, варьируемый в каждом цикле. Антиген, использованный для скрининга, представлял собой рекомбинантный петлевой белок gp41 (SEQ ID NO 13).
Перед скринингом Fab IgA фаговой дисплейной библиотеки с рекомбинантным петлевым белком gp41 (SEQ ID NO 13) первый цикл пэннинга выполнили с пептидом PI (SEQ ID NO 12) (ALFSEN & BOMSEL, 2002, J. Biol. Chem., 277:25649-59; получен из Eurogentec, Belgium) в количестве 20 мкг (100 мкМ), в котором данный пептид находится в олигомерном состоянии. Такой протокол позволяет отделить любой Fab IgA, способный связывать пептид Р1 в олигомерном состоянии.
Исходное количество использованного рекомбинантного петлевого белка gp41 составляло 1 мкг, и количество делили на два в каждом цикле так, что в конечном итоге количество в четвертом цикле составляло 125 нг.
Лунки 96-луночных планшетов (Exiqon peptide Immobilirez, 10202-111-10) покрывали 1 мкг рекомбинантного петлевого белка gp41, затем блокировали при помощи BSA в течение 2 часов при 37°С. Концентрированные фаги, полученные из библиотеки, затем добавляли в лунки в количестве 1012-1013 бляшкообразующих единиц и оставляли на 2 часа при 37°С. Несвязанные фаги затем удаляли интенсивным промыванием, для первого и второго циклов селекции, 10 раз при помощи PBS, содержащего 0,1% Твин-20, затем 10 раз при помощи PBS для удаления детергента. Для последующих циклов селекции промывание вели 20 раз при помощи PBS, содержащего 0,1% Твин-20, затем 20 раз при помощи PBS. Специфическое элюирование фагов, несущих эпитопы поверхностных Fabs, связывающих рекомбинантный петлевой белок gp41, осуществляли путем обработки при помощи 0,1 М глицин-HCl, с рН, отрегулированным до 2,2, в течение 10 мин. Элюированную фракцию немедленно нейтрализовали и использовали для инфицирования 2 мл свежей Е. coli TG1 бактериальной культуры (OD600 (оптическая плотность при 600 нм) =1). Бактерии инкубировали при 30°С в течение 30 минут, культуральный объем увеличивали, и культуру инкубировали в шейкере при 37°С в течение 1 часа, а затем добавляли 1012 бляшкообразующих единиц/мл VCS-M13 хелперного фага для производства рекомбинантных фагов в течение ночи. Элюированные фаги амплифицировали между каждым циклом пэннинга.
После пэннинга индивидуальные клоны из четырех раундов выращивали и контролировали наличие Fab при помощи PCR с использованием специфических праймеров, приведенных в Таблице II, которые гибридизируются с вектором до и после Fab легких и тяжелых цепей. Клоны, содержащие Fab IgA, переводили в растворимую форму Fab путем трансформирования ими клеток Е. coli несупрессорного штамма, несущих амбер-кодон, и секвенировали для определения последовательностей вариабельных областей тяжелых (Н) и легких (L) цепей, используя программу IMGT/V-QUEST (Фиг.7).
Секвенирование иммуноглобулиновых генов
Секвенирование выполняли с использованием автоматического ДНК-секвенатора с набором реактивов (Applied Biosystems), содержащих флуоресцентно меченные дидезоксинуклеотиды, выступающие в качестве терминаторов, для циклической реакции Taq секвенирования. Двухцепочечную ДНК получали из бактерий и секвенирование выполняли, используя набор праймеров (см. Таблицу II), которые связываются специфически с pComb3Х вектором до и после каждой Fab-цепи.
На Фиг.6А и 6Б показан результат секвенирования вариабельных областей Н- и L-цепи клона 69 (SEQ ID NO 9 и SEQ ID NO 10).
На Фиг.7 представлены результаты идентификации аминокислотных последовательностей, соответствующих областям, определяющим комплементарность, с использованием IMGT программы.
Вектор, использованный для клонирования, несет амбер-кодон между последовательностями метки (His-метка и НА-метка) и фагового белка pIII, что предоставляет возможность либо получить антитело, слитое с фаговым белком оболочки, используя Е. coli супрессорный штамм, такой как TG1, или получить растворимые антитела экспрессией вектора в несупрессорном штамме, таком как ТОР-10. Принимая во внимание это преимущество, фаговые ДНК использовали для трансформации ТОР-10 Е. coli (не-супрессорный штамм, несущий амбер-кодон), чтобы экспрессировать растворимые Fab-фрагменты без рIII слитого белка. Экспрессию Fab индуцировали, используя 1 мМ изопропил-β-D-тиогалактопиранозида (IPTG).
Для крупномасштабной экспрессии моноклонального антитела по изобретению интактный оперон перенесли из рComb3Х в вектор pASK.88 (SKERRA A., Gene, 1994, 151(1-2): р. 131-5; SKERRA A., Gene, 1994, 141(1): p. 79-84; SKERRA A., et al., Biotechnology (NY), 1991. 9(3), p.273-8; SKERRA A. & A. PLUCKTHUN, Protein Eng, 1991,4(8): p.971-9).
Fab ДНК моноклонального антитела по изобретению амплифицировали при помощи специфических праймеров, вносящих сайты рестрикции, необходимые для суб-клонирования в pASK88 вектор. Продукты амплификации очищали агарозным гель-электрофорезом и расщепляли при помощи рестриктаз PstI и NcoI, в случае тяжелой цепи, и SacI и HindIII, в случае легкой цепи. Гены Fd (VH-CH1) и гены легкой цепи (VL-CL) вставили отдельно и лигировали в pASK88, расщепленный при помощи тех же самых рестриктаз, используя стандартный протокол. Продукты лигирования трансформировали в термокомпетентные бактериальные клетки JM83 (предоставлены Dr. Skerra) и высевали на чашки Петри для разделения на индивидуальные клоны. Плазмидную ДНК для нескольких клонов анализировали рестрикционным анализом и, для некоторых из них, секвенированием двухцепочечной ДНК с использованием специфических праймеров (SKERRA А., Gene, 1994, 151(1-2): р.131-5; SKERRA A., Gene, 1994, 141(1): p.79-84; SKERRA A., et al., Biotechnology (NY), 1991. 9(3), p.273-8; SKERRA A. & A. PLUCKTHUN, Protein Eng, 1991,4(8): p.971-9).
Экспрессионный вектор pASK88 разработали для удобного клонирования генов иммуноглобулиновых вариабельных областей, а также для периплазмической секреции соответствующих Fabs фрагментов в Escherichia coli. При использовании данной плазмиды экспрессию контролировали с помощью тетрациклинового промотора.
Большие количества моноклонального антитела по изобретению получали с использованием данного вектора. Препаративную экспрессию выполняли в масштабе 1 л, применяя Е. coli К-12 JM83 в качестве экспрессирующих клеток-хозяев. Клетки выращивали до середины логарифмической фазы и затем индуцировали Fab экспрессию при помощи 0,2 мг/л безводного тетрациклина в течение 4 ч или в течение ночи.
Очистку моноклонального антитела по изобретению осуществляли на колонках Ni-NTA Spin Columns (Qiagen) взаимодействием с His-меткой. Периплазмическую фракцию, стерилизованную фильтрацией, наносили на колонку и применяли градиент из 250-500 мМ имидазола в буфере для хроматографии для сбора образцов.
Пример 4
ELISA анализ, выполненный с растворимыми IgA Fab клонами из фаговой дисплейной библиотеки.
Выполняли ELISA анализ с растворимыми IgA Fab, полученными из ТОР-10F' бактерий (pComb3х система), и с растворимыми IgA Fab, полученными из К-12 JM83 бактерий (pASK88 система).
Лунки планшетов (Exiqon peptide Immobilirez, 10202-111-10 или NUNC, 439454) покрывали 100 нг рекомбинантного петлевого белка gp41 (SEQ ID NO 13) и блокировали BSA в течение 2 часов при 37°С. Затем добавляли очищенные IgA в концентрации 2 нг/мл и инкубировали в течение 2 часов при 37°С. Детекцию проводили при помощи мышиного анти-НА антитела (клон 12СА5, Roche) или анти-His (PentaHis, Qiagen 34660) антитела с последующим применением анти-мышиного антитела козы (Caltag Laboratories, H1003), меченного пероксидазой хрена. Ферментативную реакцию проявляли добавлением ТМВ (3,3',5,5'-тетраметилбензидин, Kikergaard & Perry Laboratories Inc.) в качестве субстрата, и поглощение измеряли при 450 нм после добавления 1М фосфорной кислоты с использованием спектрофотометра для прочтения планшетов ELISA. Позитивный контроль представлял собой 2F5 антитело, а негативный контроль представлял собой полученный после пэннинга клон, который не распознает рекомбинантный петлевой белок gp41 в ходе ELISA.
Пример 5
Ингибирование трансцитоза
ВИЧ-1 трансцитоз через эпителиальные клетки и нейтрализацию трансцитоза антителами выполняли на клеточной линии НЕС-1 клеток кишечника, выращенных в виде плотного поляризованного монослоя в течение 7 дней на проницаемой фильтровальной подложке (размер пор 0,45 мкм), образующей контактную поверхность между двумя раздельными камерами, из которых верхняя омывает апикальную (люминальную) поверхность эпителиального монослоя, а нижняя омывает базолатеральную (серозную) поверхность.
РВМС получали и подготавливали, как описано у LAGAYE et al. (J. Virol, 2001, 75:4780). Затем РВМС-клетки активировали фитогемагглютинином (PhA) в течение 48 ч и инокулировали ВИЧ-1 JRCSF клоном R5 или YU2 и использовали на 7 день после инфицирования. Очищенные S-IgA (5 нг/мл) добавляли в апикальную камеру и инкубировали в течение 10 мин при 37°С.
Чтобы инициировать трансцитоз вируса, 2·106 ВИЧ-1+ РВМС добавляли в апикальную камеру. Контакт между ВИЧ-1+ РВМС и монослоем эпителиальных клеток приводил к быстрому отпочкованию ВИЧ-1 вирионов с последующим их трансцитозом от апикального к базолатеральному полюсу эпителиальных клеток. Спустя 2 часа ингибирование трансцитоза антителом определяли путем детекции ВИЧ белка р24 в базолатеральной среде при помощи ELISA (Coulter, France или PASTEUR SANOFI, FRANCE). Уровень р24 в отсутствие антитела или в присутствии неспецифического Fab к рекомбинантному петлевому белку gp41 или в присутствии контрольного IgA 2F5 измеряли, соответственно, в качестве негативного и позитивного контроля со значением, соответственно, равным 100, 98 и 35%. Значение для негативного контроля приняли за 100% трансцитоза и использовали для представления результатов.
Эксперименты выполняли в трехкратной независимой повторности.
Результаты позволяют идентифицировать 3 клона, которые были способны ингибировать ВИЧ трансцитоз более чем на 50%, среди которых находился клон 69 (Фиг.3).
Пример 6
Дот-блоттинг
BSA, пептид с лейциновой застежкой, лизоцим и gp41 белок дикого типа от ВИЧ штамма НхВ2 (аминокислоты с 546 по 682, получен от ABI) были точечно нанесены на нитроцеллюлозные мембраны, соответственно, каждый образец в концентрации 100 нг/мл. После этого, Fab клона 69, в концентрации 5 нг/мл, или антитело 2F5 альфа-IgA, в концентрации 2 мкг/мл, с разведением 1:2500, инкубировали на нитроцеллюлозных мембранах.
После промывания нитроцеллюлозных мембран (блокирующий реактив для Вестерн-блоттинга, Roche: 1% для блокирования и промывания, 0,1% для связывания антитела, согласно инструкциям производителя), иммунные комплексы инкубировали с мышиным анти-His антителом (Qiagen, 0,2 мг/мл, 1:5000 разведение) для Fab клона 69 и с мышиным анти-человеческим антителом для 2F5 альфа-IgA. Оба комплекса детектировали при помощи анти-мышиного антитела козы, меченного пероксидазой хрена (Caltag Laboratories, H1003,1:4000 разведение) с последующим переносом на рентгеновскую пленку ECL и ауторадиографией (ECL, Amersham, согласно инструкциям производителя).
На Фиг.4 представлен результат эксперимента, повторенного дважды.

| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ИЛИ ЕГО ФРАГМЕНТ, ИМЕЮЩИЕ НЕЙТРАЛИЗУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИЧ | 2005 |
|
RU2380378C2 |
| КОМПОЗИЦИИ ДЛЯ ПРЕДУПРЕЖДЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ ВИРУСОМ ВИЧ-1 | 2012 |
|
RU2603262C2 |
| GP41-НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624046C2 |
| НЕКОНКУРЕНТНЫЕ В ОТНОШЕНИИ НЕЙРЕГУЛИНА АЛЛОСТЕРИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО HER3 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704228C2 |
| АНТИТЕЛА, ОБЛАДАЮЩИЕ СПЕЦИФИЧНОСТЬЮ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2794996C2 |
| УЛУЧШЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА | 2014 |
|
RU2711322C1 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2821703C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-R[альфа] ДОМЕНА SUSHI | 2012 |
|
RU2644671C2 |





Изобретение относится к биотехнологии. Описано анти-ВИЧ моноклональное антитело или его функциональный фрагмент, содержащее в вариабельной области тяжелой Н-(тяжелой) цепи области, определяющие комплементарность, CDR1, CDR2 и CDR3, имеющие последовательности, представленные в описании, и в вариабельной области L-(легкой) цепи CDR1, CDR2 и CDR3, имеющие последовательности, представленные в описании. Предложены экспрессионные векторы, кодирующие фрагменты тяжелой и легкой цепей описанного антитела и клетки-хозяева, трансформированные указанными векторами. Описаны способ детекции штамма ВИЧ и способ проведения пассивной иммунотерапии индивидуума. Изобретение позволяет получать антитело, которое позволяет нейтрализовать ВИЧ-инфекцию, без аутоиммунного побочного эффекта. 10 н. и 7 з.п. ф-лы, 9 ил., 2 табл.
1. Анти-ВИЧ моноклональное антитело или его функциональный фрагмент, содержащее в вариабельной области тяжелой Н-(тяжелой) цепи области, определяющие комплементарность, CDR1, CDR2 и CDR3, имеющие соответственно аминокислотную последовательность, представленную на SEQ ID NO I, SEQ ID NO 2, SEQ ID NO 3, и в вариабельной области L-(легкой) цепи CDR1, CDR2 и CDR3, имеющие соответственно аминокислотную последовательность, представленную на SEQ ID NO 4, SEQ ID NO 5, SEQ ID NO 6.
2. Моноклональное антитело по п.1, отличающееся тем, что оно не распознает пептид аминокислотной последовательности, представленной на SEQ ID NO 12.
3. Моноклональное антитело или его функциональный фрагмент по п.1, распознающее рекомбинантный петлевой белок gp41, имеющий аминокислотную последовательность, представленную на SEQ ID NO 13, и не распознающее пептид аминокислотной последовательности, представленной на SEQ ID NO 12.
4. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что оно представляет собой IgA.
5. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что оно представляет собой человеческое антитело.
6. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что вариабельная область тяжелой цепи имеет аминокислотную последовательность, представленную на SEQ ID NO 7, а вариабельная область легкой цепи имеет аминокислотную последовательность, представленную на SEQ ID NO 8.
7. Моноклональное антитело или его функциональный фрагмент по п.1, отличающееся тем, что оно имеет способность нейтрализовать вирус иммунодефицита человека (ВИЧ).
8. Моноклональное антитело или его функциональный фрагмент по п.7, отличающееся тем, что нейтрализуемый ВИЧ представляет собой штамм ВИЧ-1.
9. Фрагмент тяжелой цепи антитела по п.1, представляющий собой ее вариабельную область, кодируемый молекулой нуклеиновой кислоты, имеющей последовательность SEQ ID NO 9.
10. Фрагмент легкой цепи антитела по п.1, представляющий собой ее вариабельную область, кодируемый молекулой нуклеиновой кислоты, имеющей последовательность SEQ ID NO 10.
11. Экспрессионный вектор, кодирующий фрагмент тяжелой цепи антитела по п.9.
12. Экспрессионный вектор, кодирующий фрагмент легкой цепи антитела по п.10.
13. Клетка-хозяин, трансформированная экспрессионным вектором по п.11 и продуцирующая фрагмент тяжелой цепи антитела, представляющий собой ее вариабельную область, по п.9.
14. Клетка-хозяин, трансформированная экспрессионным вектором по п.12 и продуцирующая фрагмент легкой цепи антитела, представляющий собой ее вариабельную область, по п.10.
15. Применение антитела, или его функционального фрагмента по п.1, или фрагмента тяжелой цепи антитела по п.9, или фрагмента легкой цепи антитела по п.10, экспрессионного вектора по п.11 или 12, или клетки-хозяина по п.13 или 14 для изготовления лекарственного средства, предназначенного для применения при профилактике и/или лечении ВИЧ-инфекции.
16. Способ детекции штамма ВИЧ в образце in vitro, включающий по меньшей мере стадию:
А) приведения образца в контакт по меньшей мере с антителом или его функциональным фрагментом по п.1 при условиях, подходящих для образования комплекса между указанным антителом или его функциональным фрагментом и белком gp41 или его функциональным аналогом, и Б) детекции наличия указанного комплекса.
17. Способ проведения пассивной иммунотерапии индивидуума, восприимчивого к инфицированию ВИЧ, включающий введение указанному индивидууму терапевтически эффективного количества по меньшей мере антитела или его функционального фрагмента по п.1.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| РЫБАЛЬСКИЙ Н.Г., СЕРОВА М.А., ИГНАТЬЕВА Г.А., СТАРЧЕУС А.П | |||
| Моноклинальные антитела и гибридомы | |||
| - М.: ВАСХНИЛ, 1989. | |||
Авторы
Даты
2010-07-10—Публикация
2005-05-02—Подача