Изобретение относится к медицине и биотехнологии и может быть использовано при создании кандидатных вакцинных препаратов против ВИЧ/СПИД.
Основными требованиями к кандидатным вакцинам против ВИЧ/СПИД являются безопасность, индукция мультипотентного иммунного ответа против ВИЧ, включая клеточный иммунитет, мукозный иммунитет и нейтрализующие антитела, а также применение вирусного или бактериального вектора, способного генерировать персистентный и длительно функционирующий иммунный ответ.
Известные стандартные подходы в создании вакцин из живого аттенуированного вируса [Hofmann-Lehmann R., Vlasak J., Williams A.L., Chenine A.L., McClure H.M., Anderson D.C., O'Neil S., Ruprecht R.M. Live attenuated, nef-deleted SIV is pathogenic in most adult macaques after prolonged observation. AIDS. - 2003. - Vol.17. - P.157-166. (524)], а также инактивированных (убитых) вакцин, на основе рекомбинантных белков или на основе антитоксина [Learmont J.C., Geezy A.F., Mills J., Ashton L.J., Raynes-Greenow C.H., Garsia R.J., Dyer W.B., Mclntyre L., Oelrichs R.B., Rhodes D.I., Deacon N.J., Sullivan J.S. Immunologic and virologic status after 14 to 18 years of infection with an attenuated strain of HIV-1. A report from the Sydney Blood Bank Cohort. // N. Engl. J. Med. - 1999. - Vol.340. - P.1715-1722], оказываются неэффективными при разработке вакцин против ВИЧ-инфекции/СПИДа. Главная причина заключается в необычной биологии вируса. Аттенуированные вакцинные штаммы не гарантируют безопасность вакцины, инактивированные вакцины не индуцируют формирования широкого и сильного протективного ответа [Murphey-Corb М., Martin L.N., Davison-Fairburn В., Montelaro R.C., Miller М., West М., Ohkawa S., Baskin G.B., Zhang J.Y., Putney S.D. et al. A formalin-inactivated whole SIV vaccine confers protection in macaques. // Science. - 1989. - Vol.246. - Р.1293-1297]. Вакцинные препараты на основе рекомбинантного оболочечного гликопротеина ВИЧ индуцируют умеренный титр антител, способный нейтрализовать ограниченный круг изолятов ВИЧ, и не индуцируют образование цитотоксических антител [Johnston R. AIDSVAX results: an answer, or just more questions? // AIDS Patient Care STDS. - 2003. - Vol.17. - P.47-51; Watanabe M.E. Skeptical scientists skewer VaxGen statistics. // Nat. Med. - 2003. - Vol.9. - Р.376].
Известно около 40 кандидатных вакцин против ВИЧ/СПИД, эффективность ни одной из которых к настоящему времени не доказана. Значительная часть разработок посвящена созданию препаратов на основе рекомбинантных технологий.
Известна кандидатная вакцина AIDSVAX В/В (AIDSVAX В/Е) (VaxGen) [Watanabe M.E. Skeptical scientists skewer VaxGen statistics. //Nat. Med. - 2003. - Vol.9. - P.376], включающая полноразмерный рекомбинантный белок gp120. Однако завершение испытаний кандидатной вакцины gp120 (VaxGen) показало ее неспособность защищать от ВИЧ-инфекции и снижать вирусную нагрузку у ВИЧ-инфицированных больных. Возможно, эта неспособность к защите от инфекции связана с отсутствием образования антител, способных нейтрализовать генетически разнообразные первичные изоляты ВИЧ1.
Известна кандидатная вакцина на основе живого рекомбинантного вируса оспы ALVAC-HIV (AVENTIS-PASTEUR) и вакцины AIDSVAX В/Е на основе рекомбинантного gp120B, (VaxGen), используемая по системе прайм-буст [Belshe R.B., Gorse G.J., Mulligan M.J., Evans T.G., Keefer M.C., Excler J.-L., Duliege A.-M., Tartaglia J., Cox W.I., McNamara J., Hwang K.-L., Bradney A., Montefiori D., Weinhold K.J. Induction of immune responses to HIV-1 canarypox virus (ALVAC) HIV-1 and gp120 SF-2 recombinant vaccines in uninfected volunteers. // AIDS. - 1998. - Vol.12. - P.2407-2415], для которой в настоящее время проводится III фаза клинических испытаний сочетанного действия двух вышеназванных препаратов. Предполагается, что не очень эффективные в отдельности, при сочетанном воздействии эти препараты смогут индуцировать у добровольцев два типа иммунного ответа: индукцию эффекторных клеток, уничтожающих ВИЧ, и образование антител, нейтрализующих вирус. Исследователи ожидают, что двойное воздействие приведет к результату, который будет выше, чем сумма ответов на отдельные вакцины.
Испытания кандидатной вакцины фирмы Merck на основе аденовируса 5 были досрочно приостановлены, так как в группе вакцинированных наблюдалось больше случаев новой инфекции, чем в группе лиц, получивших плацебо [Michael Robertson, D Casimiro, S De Rosa, S Dubey, L Kierstead, and J McElrath. Immunological Characterization of Subjects from the STEP Study: A Phase IIB Test-of-Concept Trial of the MRKAd5 HIV-1 Gag/Pol/Nef Trivalent Vaccine // CROI 2008, http://www.hvtn.org/science/step_roberts.html].
Известен вакцинный препарат [патент РФ №2179980, МПК С07К 7/00, опубл. 27.02.2002], предлагающий в качестве активного вакцинирующего компонента антигены-миметики, имитирующие консервативные фрагменты эпитопа белка gp41 ВИЧ1. Применение известного препарата предполагает сильный иммунный ответ организма на введение этого белка с образованием вирус-нейтрализующих антител. Использование пептидов консервативного эпитопа белка gp41 предполагает обеспечить защиту от множества новых постоянно образующихся субтипов ВИЧ, однако известный вакцинный препарат обеспечивает образование только антител.
Известна также вакцина против СПИДа [патент РФ 2014845, МПК А61K 39/12, опубл. 30.06.1994], обладающая способностью вызывать образование антител только против ключевого эпитопа белка gp41.
Описанные в указанных выше патентах вакцины могут вызывать либо индукцию только вируснейтрализующих антител, либо только лимфопролиферативный ответ, в то время как для профилактики и терапии ВИЧ-инфекции важен полифункциональный иммунный ответ, включающий как гуморальную, так и клеточную составляющие.
Описан рекомбинантный белок [патент РФ 2214274, МПК А61K 39/21, опубл. 2003 г.], состоящий из внутреннего белка р24 и иммуногенного фрагмента gp41. Заявлено, что этот рекомбинантный полипептид способен индуцировать сильный иммунный ответ у млекопитающих, однако в составе вакцины он до настоящего времени использован не был.
Известна вакцинная композиция против вируса иммунодефицита человека [патент РФ №2223784, МПК С12N 15/09, оп. 2004 г.], включающая две рекомбинантные плазмиды, содержащие необходимые для поверхностного экспонирования гены Lpp-OmpA, расположенные за ними гены, кодирующие белки ВИЧ-1, а именно белок обратной транскриптазы или трансактивирующий белок (Tat). Известная вакцина создана с использованием аттенуированного штамма Salmonella, сконструированного для экспрессии на его поверхности специфических белков ВИЧ. Вакцину предлагают вводить перорально. Описанная вакцина также не может вызывать мультипотентный иммунный ответ организма на внедрение вируса иммунодефицита человека. Кроме того, представляется, что эта вакцина не может обладать хорошим протективным действием, т.к. трансактивирующий белок Tat и обратная транскриптаза образуются в клетках уже после внедрения вируса, т.е. в начале репликации вируса. Ядерная локализация трансактивирующего белка Tat вообще делает его недоступным для антител, образовавшихся вследствие вакцинации.
Наиболее близкой к настоящему изобретению является вакцина против ВИЧ-инфекции и СПИД [патент РФ 2306950, МПК А61K 39/21, опубл. 10.04.2007], включающая пептид, представляющий собой пептидный фрагмент структурного белка р17/18/55 ВИЧ-1/2 (продукты гена gag), связанный с клеточным рецептором CD4. Наличие в вакцине клеточного рецептора CD4, представляющего собой мономерный гликопротеид массой 58 кДа, который обнаруживается на поверхности примерно 60% Т-лимфоцитов, предшественников Т-лимфоцитов в костном мозге и тимусе, а также моноцитов, макрофагов, эозинофилов, дендритных клеток и клеток микроглии ЦНС, позволяет предположить основное назначение известной вакцины - терапевтическое, т.к. образование антител к CD4 у здорового человека при введении ему вакцины может вызвать нежелательные последствия. Кроме того, доказано, что есть СD4-независимые штаммы ВИЧ, которым связывание с CD4 не требуется для проникновения в клетку.
Таким образом, технический результат, получаемый при реализации описываемого изобретения, состоит в создании безопасной вакцины против ВИЧ/СПИД, обладающей мультипотентным иммунным ответом, в повышении ее профилактической эффективности за счет использования для получения химерного рекомбинантного белка ВИЧ уникальных генов/фрагментов генов, кодирующих оптимальные антигенные детерминанты, способные индуцировать образование вирус-нейтрализующих антител, клеточный и лимфопролиферативный ответ при значительном снижении вакцинирующей дозы препарата.
Указанный технический результат достигается тем, что вакцина против ВИЧ/СПИД, включающая соединение вакцинных антигенов вируса ВИЧ/СПИД и фармакологически приемлемого носителя, содержит в качестве вакцинных антигенов вируса ВИЧ/СПИДа химерный рекомбинантный полипептид (состоящий из последовательно расположенных фрагмента р17 и полноразмерного белка р24, кодируемых геном gag, и фрагмента белка gp41, кодируемого участком гена env), экспрессируемый в клетках Е.coli на основе плазмидного вектора рЕТ15b, в который по сайту рестрикции Bam H1 вставлен фрагмент ДНК, кодирующий химерный рекомбинантный полипептид и по сайтам рестрикции Hind III - Eco R1 вставлен par-локус, а в качестве полимерного носителя используют производное гетероцепных полиаминов с молекулярной массой 50000-150000 Да (Полиоксидоний) в соотношении белок:Полиоксидоний 1:10.
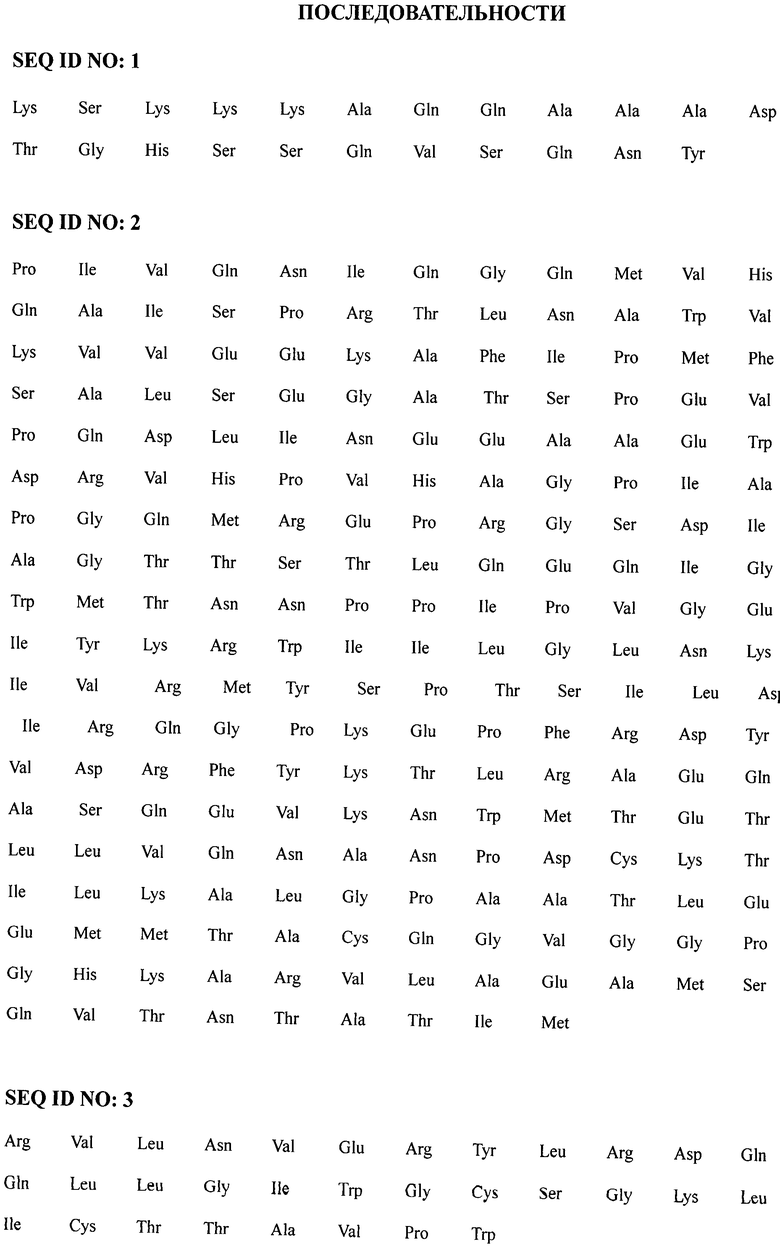
При этом химерный рекомбинантный полипептид ВИЧ1 представляет собой стерильный очищенный белок, копирующий аминокислотные последовательности фрагмента р17, полноразмерного белка р24 и фрагмента белка gp41, в котором фрагмент р17 имеет следующую аминокислотную последовательность:
SEQ ID NO:1

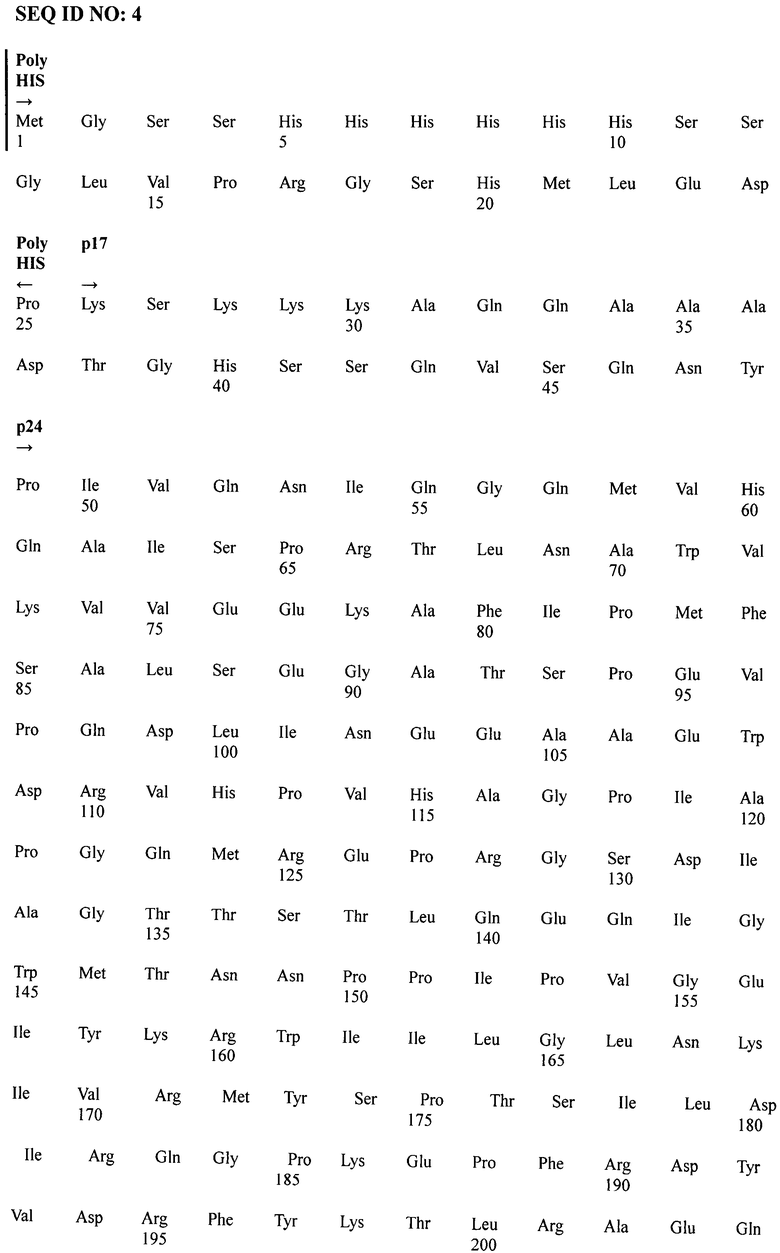
полноразмерный белок р24 имеет следующую аминокислотную последовательность
SEQ ID NO:2
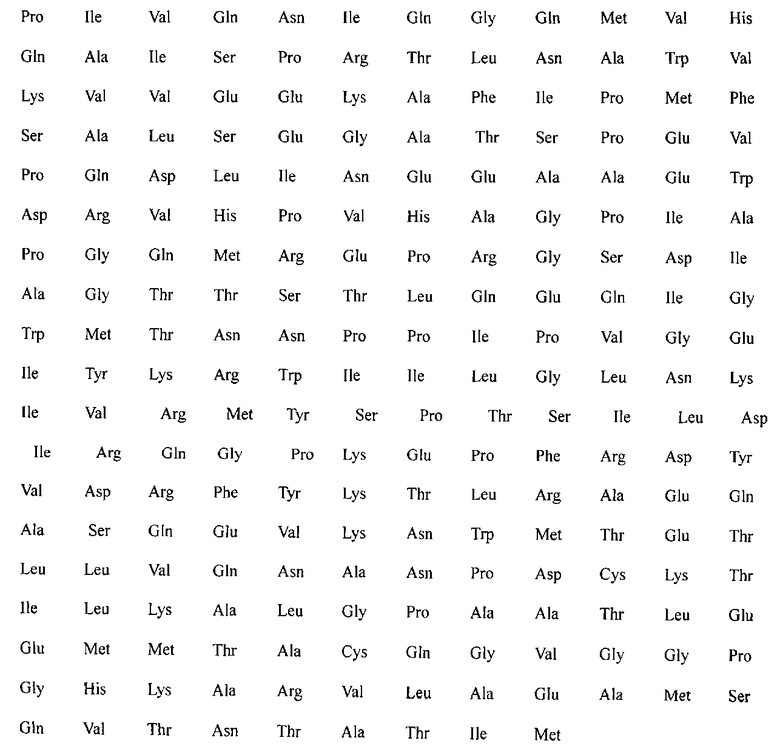
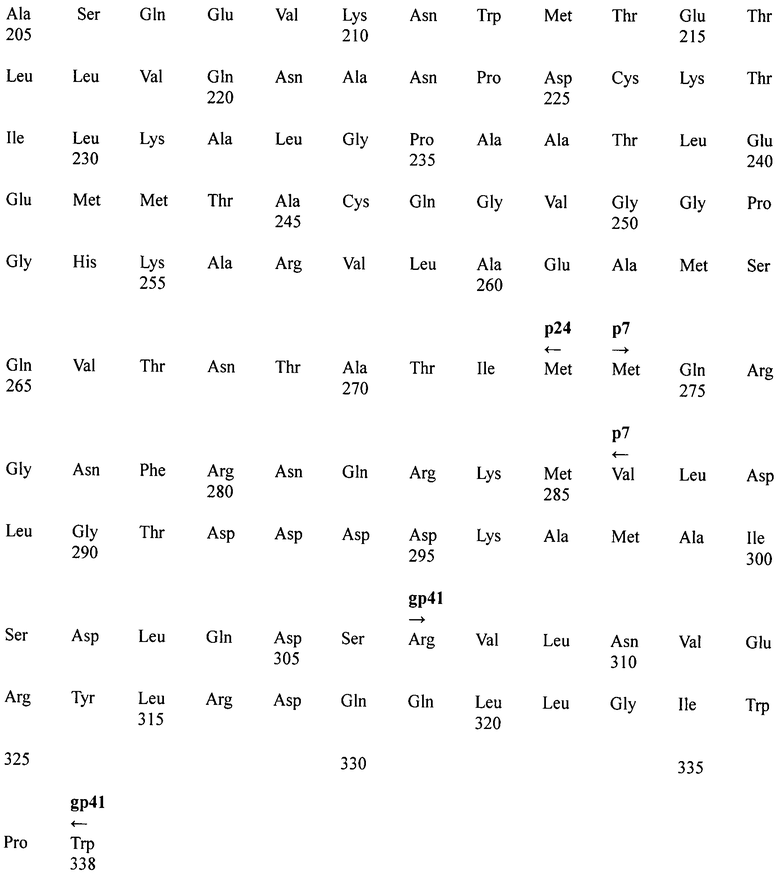
Фрагмент gp41 имеет следующую аминокислотную последовательность
SEQ ID NO:3

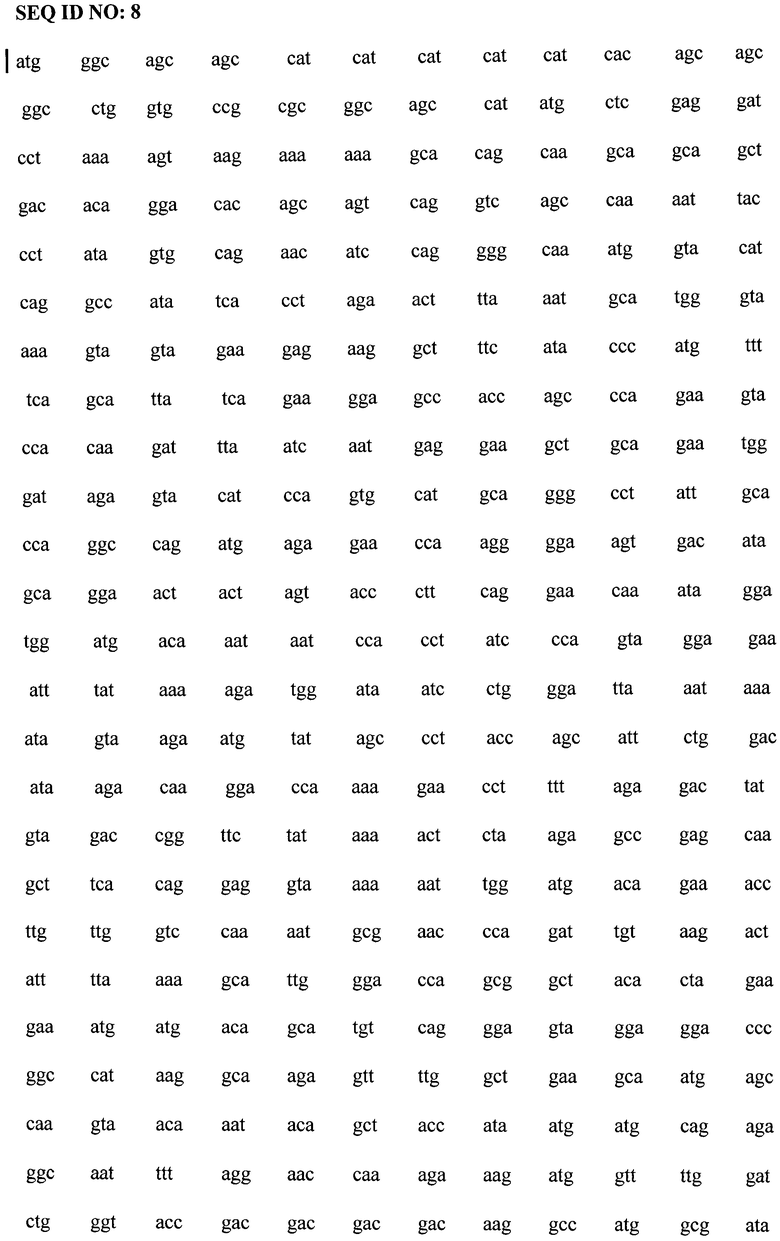
SEQ ID NO:4 представляет собой последовательно соединенные SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3.
В результате анализа баз данных последовательностей ВИЧ выбраны гены/фрагменты генов, кодирующие оптимальные антигенные детерминанты для включения в состав кандидатной вакцины.
Выбор полноразмерного белка р24, а также фрагментов белков из антигенных детерминант gp41 и р17 осуществляют из следующих предпосылок.
Индукцию нейтрализующих антител обеспечивают поверхностными белками ВИЧ1, кодируемыми геном env, поэтому в состав рекомбинантной вакцины введен фрагмент гена, кодирующего трансмембранный белок ВИЧ1 - gp41. Для индукции клеточного и лимфопролиферативного ответа в состав плазмиды введен ген, кодирующий фрагмент белка р17 и полноразмерный внутренний белок ВИЧ1 - р24, на которых расположены многочисленные эпитопы для Т-хелперов и цитотоксических лимфоцитов. Поскольку ВИЧ отличается высокой вариабельностью, введенный в состав экспрессирующего вектора участок гена gag, кодирующий фрагмент матриксного белка р17 и внутренний белок р24, совместно с фрагментом гена env, кодирующим участок 578-609 gp41 (SEQ ID NO:4), обеспечивают широкий спектр действия иммунного ответа описываемой кандидатной вакцины. В связи с консервативностью выбранных для вакцины фрагмента белка р17, белка р24 и фрагмента gp41, входящих в состав химерного рекомбинантного полипептида, последний приобретает способность индуцировать образование антител к ВИЧ1 широкого спектра действия. Матриксный белок р17, помимо участия в репликации вируса и формирования вириона, действует вне зараженных клеток, где нарушает регуляцию биологической активности клеток иммунной системы, вовлеченных в патогенез ВИЧ-инфекции. В связи с этим ожидается, что специфические антитела, индуцированные вакциной, смогут распознать белок р17, нарушить жизненный цикл ВИЧ и предотвратить распространение инфекции в организме человека [Fiorentini S., Giaquilli С., Caccuri F., Magiera AK, Caruso A. HIV Matrix protein p17: a candidate antigen for therapeutic vaccines against AIDS. Pharmacol. Ther, 2010, Dec; 128(3):433-444. Epub 2010 Sep 8]. Ожидается, что включение белка p17 в вакцинирующий препарат значительно повышает его иммуногенные и протективные свойства.
Полимерный носитель Полиоксидоний (ПО), относящийся к классу высокомолекулярных водорастворимых производных гетероцепных полиаминов, обладает выраженной собственной иммуностимулирующей активностью, благодаря чему достигается значительное повышение иммуногенности и профилактической эффективности вакцины.
Вакцину против ВИЧ/СПИД в соответствии с изобретением получают следующим образом.
Первоначально осуществляют выбор ВИЧ-специфической нуклеотидной последовательности для включения в состав рекомбинантных пазмид. Для этого химерную генно-инженерную конструкцию, состоящую генов и фрагментов генов, соответствующих фрагменту белка р17, полноразмерному белку р24 и фрагменту белка gp41, собирают в промежуточной плазмиде pBS. Синтезируют праймеры, соответствующие 131-136 и 365-370 аминокислотной последовательности полноразмерной кДНК плазмиды рВН10 для фрагмента белка р17, полноразмерного белка р24 и 578-609 для фрагмента белка gp41. PCR-фрагменты поочередно клонируют в pBS. В качестве экспрессирующего вектора используют рЕТ15, способный экспрессироваться в Е.coli. Результатом экспрессии является химерный рекомбинантный полипептид rec(17-24-41). Клетки обрабатывают 8М мочевиной и ультразвуком. Осветленный лизат сульфитируют и чистят на аффинной колонке с Ni2+ - агарозой, а затем на колонке с Q-сефарозой (Pharmacia). Чистоту продукта проверяют электрофорезом в PAAG. Полученный таким образом химерный рекомбинантный полипептид используют в качестве антигена для получения вакцины против ВИЧ/СПИД.
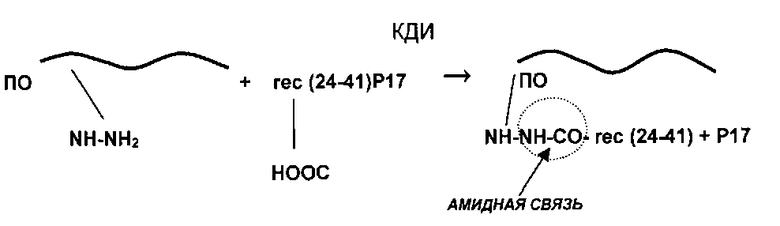
Полученный антиген вируса ВИЧ/СПИД соединяют при помощи реакции конъюгации с полимерным носителем - Полиоксидонием (сополимер N-оксида поли-1,4-этиленпиперазина и N-карбоксиэтил)-1,4-этиленпиперазиний бромида с молекулярной массой 50000-150000 Да) согласно схеме:
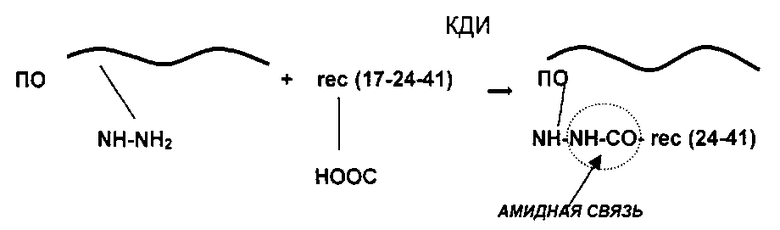
где ПО - сополимер N-оксида поли-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида (Полиоксидоний),
КДИ - карбодиимид,
rec(17-24-41) - химерный рекомбинантный полипептид.
В полученном соединении рекомбинантный вакцинирующий полипептид и ПО в вакцине связаны между собой прочными ковалентными амидными связями (помимо возникающих водородных, ионных, Вандер-Ваальсовых связей и комплексных связей за счет NO групп).
Поэтому соединение ПО с вакцинным антигеном ВИЧ обеспечивает высокую стабильность антигена и усиление его иммуногенности, что позволяет снизить прививочную дозу антигена. Эффект усиления иммунного ответа на рекомбинантный белок ВИЧ1 с помощью Полиоксидония позволил уменьшить дозу антигена rec(17-24-41).
Анализ состава полученных соединений и их специфических свойств осуществляют с использованием следующих методик: SDS-электрофорез в полиакриламидном геле (ПААГ), иммуноферментный анализ (ИФА), иммуноблот, MALDI-TOF, метод молекулярной гибридизации, оценка лимфопролиферативного ответа.
Оценку иммуногенных свойств полученных соединений проводят путем исследования реакции иммунной системы и организма в целом на экспериментальных животных, а также путем клинических испытаний вакцины с привлечением добровольцев.
Изобретение проиллюстрировано последовательностями, таблицами 1-4 и чертежами (фиг.1-4), где
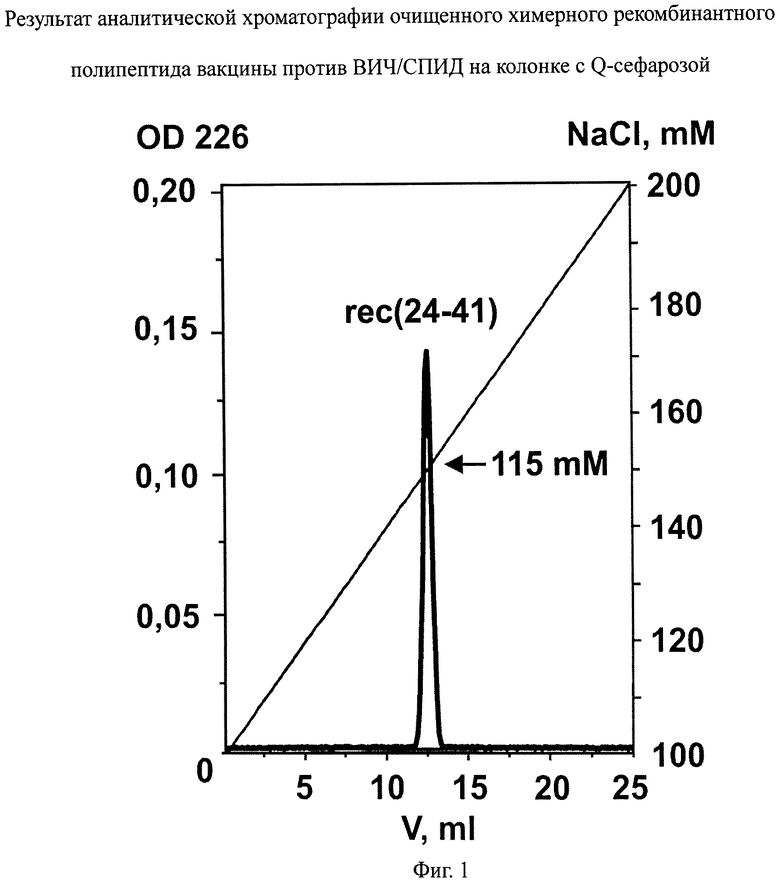
фиг.1 - результат аналитической хроматографии очищенного химерного рекомбинантного полипептида вакцины против ВИЧ/СПИД на колонке с Q-сефарозой;
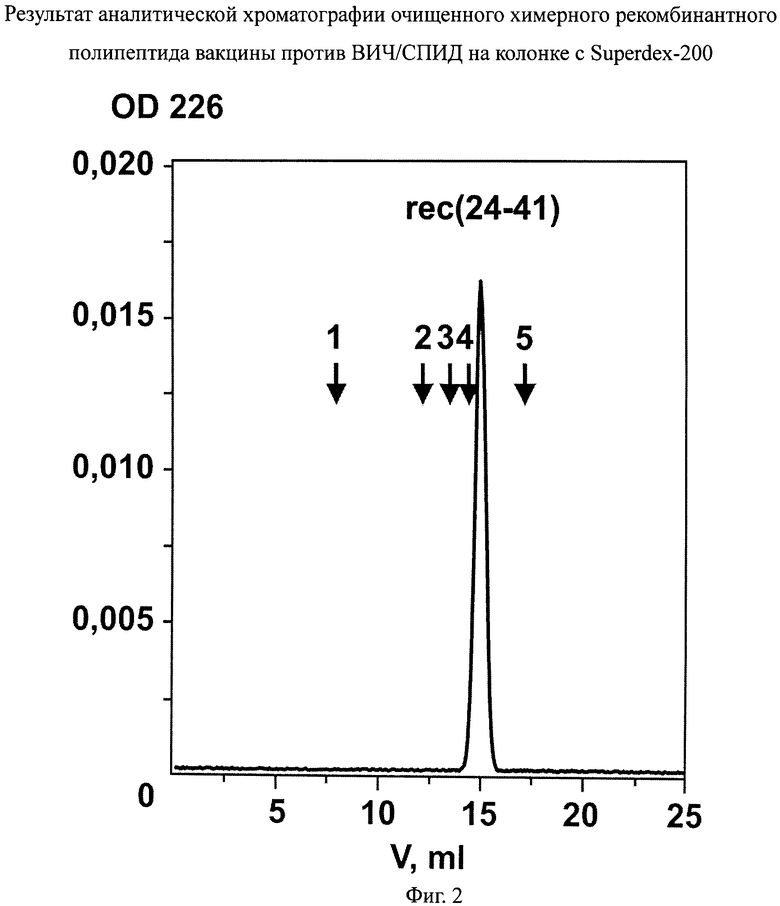
фиг.2 - результат аналитической хроматографии очищенного химерного рекомбинантного полипептида вакцины против ВИЧ/СПИД на колонке с Superdex-200;
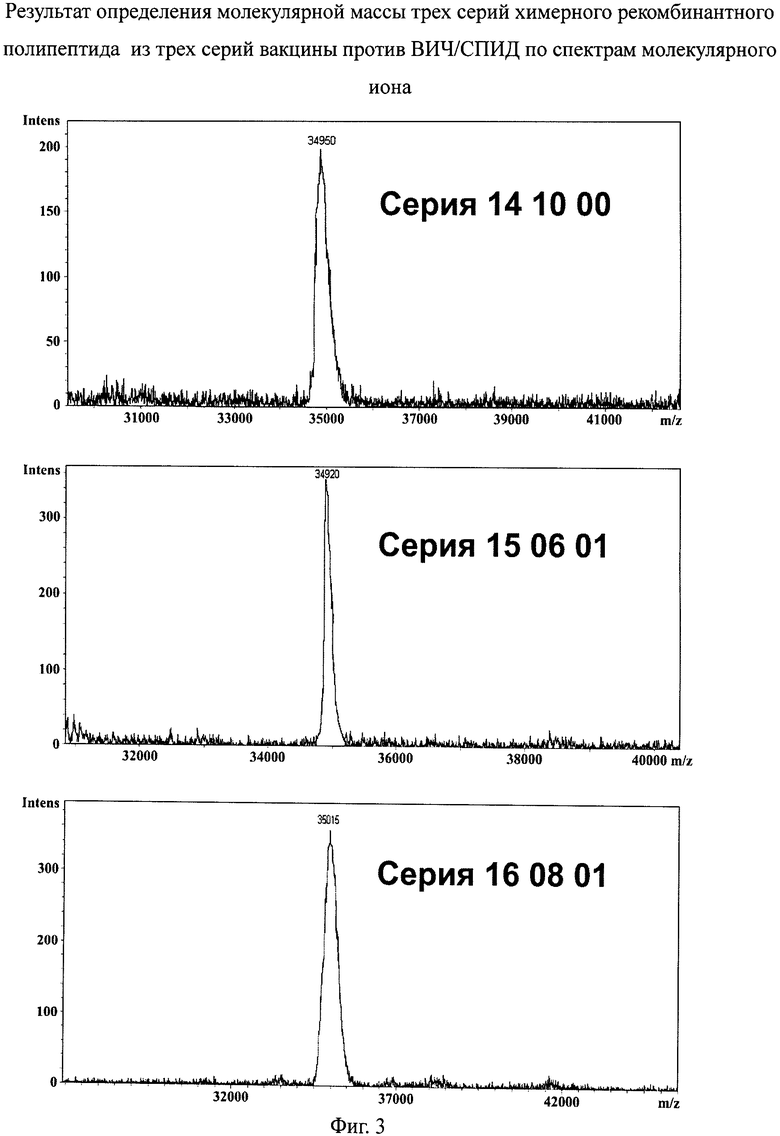
фиг.3 - результат определения молекулярной массы трех серий химерного рекомбинантного полипептида из трех серий вакцины против ВИЧ/СПИД по спектрам молекулярного иона;
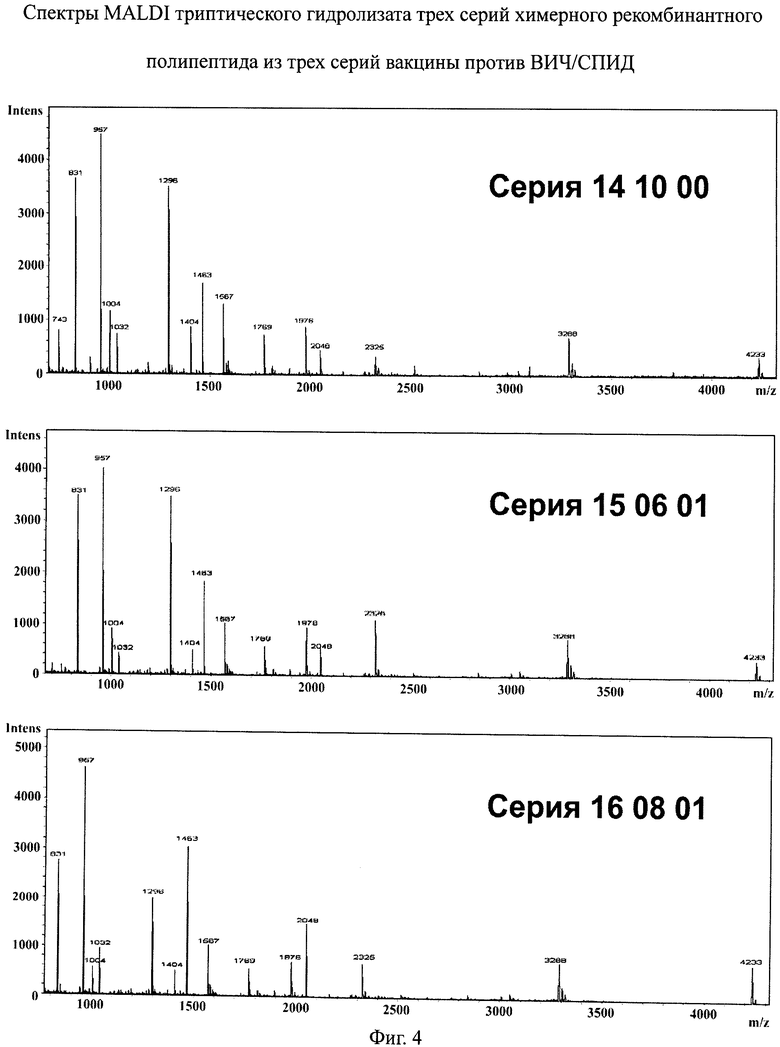
фиг.4 - спектры MALDI триптического гидролизата трех серий химерного рекомбинантного полипептида из трех серий вакцины против ВИЧ/СПИД.
Ниже представлены примеры реализации описываемого изобретения, где в примерах 1-10 показаны этапы осуществления способа получения вакцины против ВИЧ/СПИД, а в примерах 11-18 приведена экспериментальная оценка эффективности полученных препаратов.
Предварительно производят выбор ВИЧ-специфических нуклеотидных последовательностей для включения в состав плазмидного вектора с целью получения ВИЧ специфических белков вакцины против ВИЧ/СПИД.
Выбор осуществляют по результатам анализа международной базы данных (Kuiken С, Foley В., Hahn В. et al. HIV Sequence Compendum 2001. // Los Alamos Nat. Lab., Los Alamos, New Mexico 87545, USA), ориентируясь на наиболее актуальные (иммуногенные) области генома ВИЧ. Ниже приведены нуклеотидные последовательности, кодирующие выбранные для вакцины в соответствии с изобретением фрагмент белка р17, белок р24 и фрагмент белка gp41.
Нуклеотидная последовательность, кодирующая фрагмент белка р17
SEQ ID NO:5
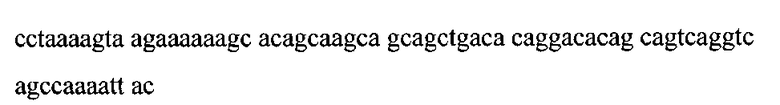
Нуклеотидная последовательность, кодирующая белок р24
SEQ ID NO:6

Нуклеотидная последовательность, кодирующая фрагмент белка gp41
SEQ ID NO:7
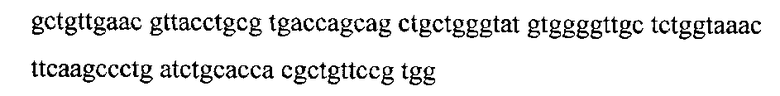
SEQ ID NO:8 представляет собой последовательно соединенные SEQ ID NO:5, SEQ ID NO:6 и SEQ ID NO:7.
После выбора нуклеотидных последовательностей поэтапно проводят соответствующие действия для получения плазмиды с выбранными фрагментами генома ВИЧ, экспрессии плазмиды в E.coli, выделения и очистки продуктов экспрессии.
Пример 1. Получение плазмиды рЕТ15par
Плазмиду рЕТ15b гидролизуют рестриктазой Hind III, достраивают липкие концы ДНК-полимеразой Т4, затем плазмиду выделяют набором Quiagen, и лигируют с раr-локусом, полученным по известной методике [Meacock Р.А., Cohen, S.N., Cell, 1980, v.20, pp.529-542]. Полученной лигазной смесью трансформируют клетки Е.coli штамм Nova-Blue (Novagen) по обычной методике [Маниатис Т., Фриг Э., Сэмбрук Дж. Молекулярное клонирование. Москва, Мир, 1984]. Трансформированные клетки высевают на чашки с LB агаром, содержащим 25 мкг/мл канамицина. Выросшие колонии проверяют на наличие рекомбинантных плазмид. Для этого бактериальные клетки лизируют и выделяют плазмидную ДНК. Выделенную плазмидную ДНК обрабатывают рестриктазами Pst I и Hind III и гидролизат исследуют электорофорезом в 1%-ной агарозе.
Гидролизат плазмидной ДНК рЕТ15-par имеет на электрофореграмме полосу ДНК размером 2270 пар оснований.
Пример 2. Получение плазмиды рЕТ15par(17-24-41) (со вставкой ДНК, кодирующей химерный полипепдид)
Олигонуклеотиды для получения gp41 кинируют с помощью ДНК-киназы обычным способом [Маниатис Т., Фриг Э., Сэмбрук Дж. Молекулярное клонирование. Москва, Мир, 1984], смешивают в эквимолярном соотношении, инкубируют при температуре 95°С в течение 30 мин, и отжигают при температуре 15°С в течение 2 часов в термостате, затем добавляют ДНК-лигазу и инкубируют 8-10 часов при 15°С. Целевой фрагмент ДНК gp41 выделяют с помощью набора для выделения ДНК фирмы Qiagen.
Структура олигонуклеотидов для получения копии фрагмента gp41

Участки ДНК, кодирующие фрагмент белка р17 и полноразмерный р24, получают одномоментно в составе одной цепи ДНК. Для этого плазмиду рВН-10, содержащую полноразмерный геном ВИЧ1 [Kuiken С., Foley В., Hahn В. et al. HIV Sequence Compendum 2001. // Los Alamos Nat. Lab., Los Alamos, New Mexico 87545, USA], амплифицируют с помощью праймеров N1 и N2. Выбранный фрагмент ДНК выделяют с помощью набора реагентов для выделения ДНК фирмы Qiagen, гидролизуют рестриктазой BamHl и очищают электрофорезом в 1% агарозе.
Структура олигонуклеотидов для получения ПЦР-фрагмента 17-24 и ПЦР-фрагмента 17-24-41

Для получения полноразмерного фрагмента ДНК, кодирующего химерный рекомбинантнантный полипептид rec(17-24-41), в пробирке 0,5 мл смешивают фрагмент ДНК gp41 с объединенным фрагментом ДНК, кодирующим фрагмент р17 и полноразмерный р24, и проводят ПЦР с использованием праймеров N1 и N3. Целевой фрагмент выделяют аналогично описанному выше, гидролизуют рестриктазой BamHl и лигируют с вектором рЕТ15-par, гидролизованным той же рестриктазой.
Пример 3. Трансформация Е.coli
Полученной лигазной смесью трансформируют клетки Е.coli штамм Nova-Blue (Novagen) по общепринятой методике [Маниатис Т., Фриг Э., Сэмбрук Дж. Молекулярное клонирование. Москва, Мир, 1984]. Трансформированные клетки высевают на чашки с LB агаром, содержащим 25 мкг/мл канамицина. Выросшие колонии проверяют на наличие рекомбинантных плазмид. Для этого бактериальные клоны выращивают и выделяют плазмидную ДНК. Выделенную плазмидную ДНК анализируют ПЦР с использованием праймеров N3 и Т7. Структуру ДНК фрагмента подтверждают секвенированием по методу Сэнгера с использованием праймеров Т7 и N3 [Маниатис Т., Фриг Э., Сэмбрук Дж. Молекулярное клонирование. Москва, Мир, 1984].
Пример 4. Определение экспрессии ВИЧ-специфического белка с помощью иммуноблота и селекция колоний, содержащих требуемую вставку
Готовят два идентичных отпечатка на нитроцеллюлозных фильтрах с использованием чашек Петри с выросшими бактериальными клонами. Затем один фильтр выдерживают с разведенной сывороткой крови ВИЧ-инфицированного пациента, а другой - с разведенной сывороткой крови ВИЧ-негативного донора. Далее фильтры отмывают отмывающим буфером и выдерживают с конъюгатом пероксидазы с кроличьими антителами против IgG человека. Фильтры вновь отмывают и обрабатывают буферным раствором, содержащим субстрат пероксидазы - перекись водорода и хромоген 4-хлор-1-нафтол. Колонии бактерий, содержащие ВИЧ-специфическую вставку, экспрессируют ВИЧ-специфический белок rec(17-24-41) и взаимодействуют с антителами против ВИЧ, содержащимися в сыворотке инфицированного человека, давая окрашенное пятно на отпечатке. На контрольном фильтре, обработанном негативной сывороткой, окрашенные пятна отсутствуют.
Пример 5. Экспрессия, выделение и очистка химерного рекомбинантного полипептида ВИЧ
Штамм Е.coli BL21 (DE3), содержащий плазмиду рЕТ15 par(17-24-41), выращивают в 1 литре среды LB (лактобульона), содержащей 25 мг/л канамицина, при 37°С до плотности 0,5 ОЕ (при 600 им), добавляют изопропилтиоглюкопиранозид (ИПТГ) до концентрации 1 мМ инкубируют еще в течение 4 часов и собирают клетки центрифугированием при 4000 g. Клетки суспендируют в 50 мл 6М мочевины и обрабатывают ультразвуком, к осветленному лизату добавляют тетратионат калия и сульфит натрия до концентрации 25 мМ и 100 мМ соответственно, инкубируют 16 часов, после чего проводят хроматографию смеси на аффинной колонке с Ni2+ - агарозой (Qiagen) по прописи фирмы-производителя. Рехроматографию проводят на колонке с Q-сефарозой в 6М мочевине и линейном градиенте NaCl (0-0,2 М). Чистоту продукта оценивают по электрофорезу в PAAG.
Описанным выше способом получены и проанализированы три экспериментальные серии химерного рекомбинантного белка для дальнейшего соединения с полимерным носителем для получения вакцины против ВИЧ/СПИД с целью проведения исследований на лабораторных животных и для проведения I фазы клинических испытаний с тем, чтобы определить способность полученной вакцины индуцировать иммунный ответ.
Пример 6. Анализ чистоты химерного рекомбинантного полипептида ВИЧ1 (чистота, гомогенность, молекулярная масса)
Чистоту полученного химерного рекомбинантного полипептида ВИЧ1 оценивают по результатам аналитической хроматографии на колонках по профилю элюции с колонок с Q-сефарозой и Superdex-200 (фиг.1-2) и по электрофорезу в ПААГ. При аналитической хроматографии профиль элюции очищенного продукта с обеих колонок должен представлять собой острый равноплечий пик. Как видно из чертежей (фиг.1 и 2), профили элюции очищенного продукта с колонок с Q-сефарозой и Superdex-200 соответственно представляют собой острые равноплечие пики, что свидетельствует о чистоте продукта.
Пример 7. Анализ химерного рекомбинантного полипептида ВИЧ с помощью MALDI-TOF (подтверждение молекулярной массы и определение N-концевых пептидов)
Целью испытаний химерного рекомбинантного вакцинирующего полипептида ВИЧ1 методом масс-спектрометрии является подтверждение первичной структуры белка, что включает в себя подтверждение молекулярной массы и определение N-концевых пептидов. Кроме того, методом молекулярного иона определяют молекулярную массу белка. Теоретическая масса белка, рассчитанная по аминокислотной последовательности, составляет 34,950 кДа (килодальтон). Молекулярная масса образцов полученного по описанному выше способу химерного рекомбинантного белка rec(17-24-41), определенная на основании спектров молекулярного иона, представленных на фиг.3, составляет значения в пределах 34,800-35,200 для всех трех серий вакцины.
Определение молекулярной массы трех экспериментальных серий белка дало следующие результаты. Для серии 16 08 01 - 35,015 кДа, для серии 14 10 00 - 34,950 кДа и для серии 15 06 01 - 34,920 кДа. Таким образом, молекулярная масса полученных белков, определенная на основании спектров молекулярного иона, соответствует расчетной.
Для подтверждения аминокислотного состава рекомбинантный белок гидролизуют трипсином и полученный гидролизат анализируют с помощью масс-спектроскопии.
На фиг.4 приведены спектры MALDI трех экспериментальных серий белка, входящего в состав вакцины, а в табл.1 - структура ожидаемых пептидов, получаемых в результате исчерпывающего триптического гидролиза, и их молекулярная масса (МН+). Как видно из фиг.4 и табл.1, на спектрах присутствуют ионы всех ожидаемых пептидов с молекулярной массой выше 800, уровень шума на спектрах минимален, что свидетельствует о гомогенности и чистоте препарата. Исходя из этих спектров, установлено, что структура белка соответствует теоретически заявленной и полностью подтверждена, что доказывает подлинность химерного рекомбинантного белка rec(17-24-41), входящего в состав вакцины против ВИЧ/СПИД, т.е. структура белка полностью доказана. Сравнение масс-спектров показывает хорошую воспроизводимость белка от серии к серии.
Пример 8. Контроль очищенного препарата белка rec(17-24-41) на содержание примесей бактериальной ДНК
Использование химерного рекомбинантного полипептида rec(17-24-41) в качестве субстанции кандидатной анти-ВИЧ/СПИД-вакцины требует проведения контроля на содержание бактериальной ДНК. Контроль проводят методом молекулярной гибридизации с радиоактивной пробой. Удельная радиоактивность ДНК-зонда составляет 4×108 срm/мкг ДНК. Разведения стандартов очищенной бактериальной ДНК наносят на нитроцеллюлозный фильтр в концентрациях от 31,25 нг до 2 нг в точку. Содержание белка в дозе вакцины составляет 50 мкг. В связи с этим ДНК выделяют из 50 мкг белка, что соответствует дозе вакцины, и из 500 мкг белка, что в 10 раз превышает содержание белка в дозе вакцины. Установлено, что бактериальная ДНК не определяется как в препаратах, соответствующих одной дозе вакцины, так и в препаратах, соответствующих десятикратной дозе вакцины, т.е. содержание бактериальной ДНК во всех сериях рекомбинантного белка rec(17-24-41) меньше 2 пг (пикограмм) на десятикратную дозу препарата (500 мкг), что соответствует требованиям ВОЗ.
Пример 9. Рефолдинг химерного рекомбинантного полипептида reс(17-24-41)
Белки, продуцируемые в Е.coli, не подвергаются посттрансляционным изменениям, которые характерны для белков ВИЧ, образующихся в ходе естественной инфекции, и, таким образом, иммунологические характеристики рекомбинантных белков могут несколько отличаться от свойств вирусных белков. В связи с этим производят получение экспрессируемых в Е.coli рекомбинантных антигенов (особенно кодируемых геном gag), растворимых в физиологических условиях в водных растворах. Для этого очищенный белок подвергают рефолдингу. Для проведения рефолдинга к раствору белка добавляют цистеин до конечной концентрации 10 мМ, инкубируют 72 ч при 4°С и диализуют ступенчато против 6 М - 1 М мочевины, а затем против 10 мМ NaHCO3.
Пример 10. Получение конъюгата полученного рекомбинантного белка ВИЧ1 с носителем - производным гетероцепных полиаминов - Полиоксидонием
Конъюгация рефолдиированного белка rec(17-24-41) с Полиоксидонием происходит при рН 7,4 в присутствии карбодиимида (КДИ) согласно схеме:
Пример 11. Исследование иммуногенных свойств вакцины против ВИЧ/СПИД на лабораторных животных с помощью иммуноферментного анализа (ИФА)
Иммуногенность препарата проверяют на лабораторных животных. Составляют 4 группы по 20 мышей-гибридов (CBAxC57BL/6)F1 массой 16-18 г. Три группы иммунизируют соответствующими сериями вакцины, четвертую, контрольную группу составляют 20 неиммунизированных мышей. Вакцину животным вводят дважды внутрибрюшинно с интервалом в 28 дней. Иммунизирующая доза составляет 50 мкг антигена в составе 0,5 мл вакцины на животное. Кровь собирают через 7 дней после второй иммунизации и получают сыворотки обычным способом.
Иммунный ответ определяют с помощью ИФА. Сыворотки крови от мышей каждой группы объединяют и определяют в них титр антител с помощью ИФА в непрямом варианте. При этом на твердую фазу сорбируют химерный рекомбинантный полипептид rec(17-24-41) в концентрации 10 мкг/мл, используемый для вакцины против ВИЧ/СПИД или используют планшеты-иммуносорбенты коммерческих систем ИФА для определения антител к ВИЧ. Проявляющим реагентом для выявления специфических мышиных антител служит конъюгат пероксидазы с антителами против IgG мыши. Результаты, представленные в таблице 2, показывают, что вакцина индуцирует у иммунизированных животных образование высоких титров антител против белков ВИЧ1. Эти результаты указывают также на стандартность вакцинных препаратов.
Введение лабораторным животным (мышам) чистого рекомбинантного белка ВИЧ1 rec(17-24-41) вызывает более слабый иммунный ответ, что свидетельствует об усиливающем иммуногенном свойстве Полиоксидония, входящего в состав вакцины.
Пример 12. Анализ иммуногенности вакцины против ВИЧ/СПИД на лабораторных животных с помощью иммуноблота
Сыворотки иммунизированных животных готовят так же, как указано в примере 11. Специфическую активность сывороток мышей, иммунизированных вакциной против ВИЧ/СПИД, изучают в иммуноблоте. Для этого используют нитроцеллюлозные стрипы из коммерческого набора "New Lav Blot" ("BIO-RAD"), на которые нанесены индивидуальные белки культурального ВИЧ-1. Для детекции мышиных антител используют конъюгат пероксидазы с антителами против IgG мыши. Для идентификации специфических полос, соответствующих белкам ВИЧ, используют положительный контроль из набора "New Lav Blot", в качестве отрицательного контроля используют ВИЧ-негативную сыворотку из набора "New Lav Blot" (в обоих этих случаях для детекции используют конъюгат пероксидазы с антителами против IgG человека). Для постановки еще одного негативного контроля стрип из набора "New Lav Blot" обрабатывают сывороткой неиммунизированной мыши с использованием в качестве детектирующего реагента конъюгата пероксидазы с антителами против IgG мыши. Сыворотки мышей, иммунизированных вакциной против ВИЧ/СПИД, распознают белки культурального ВИЧ-1: gp41, р24, р55 (предшественника р24) в иммуноблоте, что указывает на сходство антигенных детерминант входящего в вакцину химерного рекомбинантного полипептида rec(17-24-41) с детерминантами соответствующих вирусных белков. Таким образом, использованный для иммунизации химерный рекомбинантный полипептид ВИЧ1, входящий в состав вакцины против ВИЧ/СПИД, обладает той же специфичностью, что и нативные вирусные белки ВИЧ1.
Пример 13. Исследование нейтрализующей активности антител, индуцированных вакциной против ВИЧ/СПИД.
Мышей линии (СВА × С57 В1/6) F1, самок, весом 16-18 г иммунизируют четыре раза вакциной против вируса ВИЧ/СПИД. Доза при каждой иммунизации составляет 10 мкг в расчете на рекомбинантный белок в составе вакцины на животное. При первой и второй иммунизации вакцину в соответствии с изобретением вводят животным подкожно. Третий и четвертый раз препарат вводят внутрибрюшинно. Интервал между первой, второй и третьей иммунизациями составляет 1 месяц, между третьей и четвертой - два месяца. Кровь собирают в стерильных условиях из шейной артерии через 7 дней и получают сыворотку как традиционным способом. Контрольную сыворотку получают от неиммунизированных животных.
Нейтрализующую активность сыворотки определяют в тесте нейтрализации на модели острой инфекции МТ4/ВИЧ1, при этом используется референс-штамм HIV-1 IIIВ, активно реплицирующийся в Т-лимфобластоидных клеточных линиях. Индекс нейтрализации составляет в среднем (для трех серий вакцины) - 54,9% при разведении иммунной сыворотки 1:50. Таким образом, антитела, полученные у животных в ответ на иммунизацию, обладают вирус-нейтрализующими свойствами.
Пример 14. Оценка лимфопролиферативного ответа на вакцину против ВИЧ/СПИД
Мышей-гибридов (СВА × C57BL/6)F1 массой 16-18 г иммунизируют вакциной против ВИЧ/СПИД подкожно дозой, соответствующей 50 мкг антигена (химерного рекомбинантного полипептида ВИЧ1) на животное. Через 30 дней мышам вводят внутрибрюшинно из расчета 500 мкг рекомбинантного белка в составе вакцины в физиологическом растворе. Через 48 и 72 ч после второй иммунизации из животных выделяют клетки селезенки и лимфатических узлов. Определяют пролиферативную активность клеток лимфатических узлов и отдельно клеток селезенки по включению 3Н-тимидина и визуально, с помощью инвертируемого микроскопа, по образованию бластов в культуре клеток. Негативным контролем служат неиммунизированные мыши. Клетки культивируют 12 ч при 37°С в 5% СO2 в трех параллелях в 24-луночных планшетах с плотностью 5×106 клеток на лунку в ростовой среде (DMEM с 20% FCS) и 3Н-тимидином. По завершении инкубации по 1×106 клеток переносят в U-образные лунки 96-луночного планшета, а оттуда на харвестер. Включение 3Н-тимидина оценивают путем просчета радиоактивности на бета-счетчике в толуоловом сцинтилляторе. Индекс антиген-специфический пролиферации (ИП) составляет в среднем для всех трех серий вакцины ИП=10 для клеток селезенки и ИП>8 для клеток лимфатических узлов. Это свидетельствует о том, что иммунизированные животные в ответ на введение вакцины развивали сильный лимфопролиферативный ответ.
Пример 15. Специфическое взаимодействие химерного рекомбинантного полипептида rec(17-24-41), входящего в состав вакцины против ВИЧ/СПИД, с антителами к ВИЧ, содержащимися в сыворотках крови инфицированных ВИЧ1 людей (исследование специфичности вакцины)
Определение проводят с помощью непрямого ИФА. Вакцину сорбируют на твердую фазу (полистироловые планшеты Greiner, Германия) в концентрации 10 мкг/мл в расчете на антиген. В качестве ВИЧ-позитивных образцов применяют стандартную панель сывороток крови человека ОСО 42-28-212-02 П (образцы, содержащие антитела к ВИЧ1). В качестве ВИЧ-негативных образцов используют стандартную панель сывороток крови человека, не содержащих антител к ВИЧ1 (ОСО 42-28-214-02 П). Проявляющим реагентом служит конъюгат пероксидазы хрена с антителами против IgG человека. Результаты, представленные в таблице 3, показывают, что при использовании экспериментальных серий вакцины позитивные образцы определены как позитивные, а негативные - как негативные, что свидетельствует об антигенной активности вакцины. Для всех серий получены близкие результаты, что свидетельствует о стандартности препарата вакцины. Таким образом, показано, что химерный рекомбинантный полипептид rec(17-24-41) в составе вакцины против вируса ВИЧ/СПИД специфически взаимодействует с антителами к ВИЧ1, содержащимися в сыворотках крови ВИЧ-инфицированных людей. Сравнение этих результатов с данными, полученными при анализе контрольных коллекций ВИЧ-позитивных и ВИЧ-негативных образцов с помощью коммерческой тест-системы для определения антител к ВИЧ «Пептоскрин-2», также свидетельствует о специфичности и чувствительности рекомбинантного антигена, входящего в состав предлагаемой вакцины против ВИЧ/СПИД.
Пример 16. Оценка безопасности вакцины
Доклинические испытания показали, что вакцина в соответствии с изобретением является апирогенным препаратом, не вызывающим у животных воспалительных реакций на месте введения и морфологических изменений внутренних органов. Определение пирогенности проводили по МУК4.1./4.2.588-96 с.52-53 [Методы контроля медицинских иммунобиологических препаратов, вводимых людям, Минздрав России, М. - 1998, с.15-25]. Согласно этим требованиям, препарат должен быть апирогенным в тест-дозе 10 мкг белка на 1 кг массы кролика. Проведенные испытания показали апирогенность препарата. Вакцина не оказывает влияния на состояние центральной нервной системы (ЦНС), на клеточные элементы крови, на обезвреживающую функцию печени, на биохимические показатели крови, отражающие состояние белкового, углеводного, жирового обменов, ферментов печени и уровень кальция в крови. Определение стерильности проводили методом прямого посева вакцины в сахарный бульон с пересевом на 5-е сутки. Контроль стерильности, токсичности и пирогенности серий вакцины против ВИЧ/СПИД проводили согласно методикам, изложенным в проекте ФСП (фармакопейной статьи предприятия) на препарат. Было показано, что все три серии вакцины стерильны, нетоксичны и апирогенны.
Пример 17. Исследование иммуногенных свойств вакцины в клинических испытаниях с привлечением здоровых неинфицированных ВИЧ добровольцев
К исследованию привлекают здоровых неинфицированных ВИЧ добровольцев, давших письменное информированное согласие на участие в клинических испытаниях и отвечающих критериям включения/исключения. Вакцину в дозе 50 мкг антигена и 500 мкг полиоксидония вводят внутримышечно 4 раза. Участников (3 человека в группе) вакцинируют по следующей схеме: вторую иммунизацию проводят через 1 месяц после первой, третью иммунизацию через 2 месяца после второй и четвертую через 3 месяца после третьей иммунизации. Кровь собирают в пробирки. Выдерживают 1 час при 37°С, затем переносят в холодильник на 4°С на 30 мин, центрифугируют в течение 10 мин (1000-1500 об/мин), отбирают сыворотку.
В индивидуальных сыворотках определяют антитела к вакцинному антигену. Определение проводят с помощью непрямого твердофазного иммуноферментного анализа. В качестве твердофазного иммуносорбента используют антиген rec(17-24-41), представляющий собой активную субстанцию вакцины.
Антиген rec(17-24-41) в концентрации 8 мкг/мл сорбируют на полистироловых планшетах фирмы «Greiner» (Германия) в 0,05 М растворе карбонантно-бикарбонантного буфера рН 9,5, внося по 100 мкл раствора антигена в лунку. Выдерживают 24 часов при комнатной температуре во влажной камере. После окончания инкубации содержимое лунок стряхивают. Готовят ряд последовательных двоичных разведений сывороток на 0,01 М фосфатно-солевом буфере, содержащем 0,05% раствора Твин-20 (ФСБ-Т) и 0,02% бычьего сывороточного альбумина (ФСБ-АТ). Образцы вносят в лунку в трех параллелях для каждого разведения, и выдерживают 60 мин при 37°С. По окончании инкубации лунки пятикратно отмывают ФСБ-Т для удаления несвязавшихся антител. В качестве детектирующего реагента используют конъюгат пероксидазы хрена с моноклональными антителами мыши против IgG человека. Конъюгат в рабочем разведении на ФСБ-АТ вносят в лунку. Инкубируют 60 мин при 37°С. После этого лунки вновь промывают пятикратно ФСБ-Т. Реакцию проявляют внесением в каждую лунку 0,2% раствора ортофенилендиамина в субстратном буфере. Развитие цветной ферментативной реакции останавливают после 15-минутной инкубации в темноте, внося в каждую лунку 50 мкл 10% раствора серной кислоты. Учет реакции производят с помощью спектрофотометра-ридера при длине волны 492 нм.
Результат считают положительным, если ОП (оптическая плотность) в анализируемой лунке превышает ОП крит., рассчитанную по формуле:
ОП крит. = ср. знач. ОП К(-)+0,2,
где 0,2 - коэффициент, определяемый методом статистической обработки результатов постановки ИФА, ОП К(-) - оптическая плотность ВИЧ-негативного образца из коммерческого набора New LAV Blot I фирмы «Bio-Rad» (США) в разведении 1:10.
Иммунизация вакциной вызывает образование антител у всех испытумых (таблица 4). Специфические антитела определяются у всех добровольцев после третьего введения антигена. Максимальный титр антител достигается после четвертого введения антигена. Т.е. вакцина является хорошим иммуногеном, способным индуцировать антитела у вакцинированных людей.
Пример 18. Определение антител против антигенов ВИЧ1 в сыворотках крови иммунизированных добровольцев с помощью иммуноблота
Исследование проводят с применением коммерческой тест-системы New LAV Blot I Assay (HIV-1 Ab confirmation, Western Blot) («Bio-Rad», США) согласно инструкции предприятия-изготовителя, приложенной к набору. Антигенной основой тест-системы являются белки культурального вируса ВИЧ-1, сорбированные на нитроцеллюлозе.
Перед проведением реакции полоски нитроцеллюлозы с сорбированными на них индивидуальными белками ВИЧ-1 (стрипы) выдерживают 5 мин в растворе для разведения образцов при комнатной температуре. Далее добавляют исследуемые сыворотки добровольцев, иммунизированных вакциной против ВИЧ/СПИД (конечное разведение сывороток 1:100). В контрольные лунки добавляют отрицательный контрольный образец (сыворотку крови ВИЧ-негативного человека) и положительный контрольный образец (сыворотку крови ВИЧ-позитивного человека) в разведении 1:100. Стрипы выдерживают с сыворотками 2 часа при комнатной температуре. По окончании инкубации стрипы отмывают 3 раза раствором для разведения образцов, выдерживая интервал между каждой отмывкой 5 минут. После этого вносят раствор конъюгата и оставляют на 1 час при комнатной температуре. Повторяют отмывку, добавляют субстратный раствор, выдерживают 15 мин при комнатной температуре. Реакцию останавливают, отмывая стрипы дистиллированной водой.
Реакцию учитывают, сравнивая расположение полосок на стрипе, инкубированном с исследуемым образцом, со стрипом, инкубированным с положительным образцом, приложенным к набору.
Исследования показали, что уже после второй иммунизации в образцах сывороток выявляются антитела, специфически распознающие антигены культурального ВИЧ. Количество антител нарастает после третьей и четвертой иммунизации.
Проведенные исследования показывают, что полученная в соответствии с описываемым изобретением вакцина против ВИЧ/СПИД в виде комплексного препарата обладает следующими преимуществами:
- препарат полностью безопасен в применении, поскольку в нем используется только высокоочищенный рекомбинантный полипептид rес(17-24-41);
- в экспериментах на животных вакцина против ВИЧ/СПИД показала способность индуцировать высокие титры специфических антител к антигенам ВИЧ1;
- антитела к вакцине способны нейтрализовать ВИЧ в культуре клеток;
- доклинические испытания показали иммуногенность, безопасность и стандартность препарата;
- полимерные носители на основе высокомолекулярных водорастворимых производных гетероцепных полиаминов обладают выраженной собственной иммуностимулирующей активностью, благодаря чему достигается повышение иммуногенности вакцины;
- первая фаза клинических испытаний показала безопасность, иммуногенность и антигенную активность представленной вакцины.
Изобретение представляет собой первую отечественную кандидатную вакцину против ВИЧ/СПИД, которая включена в клинические испытания. Клинические испытания вакцины зарегистрированы в реестре клинических испытаний анти/ВИЧ/СПИД-вакцин International AIDS Vaccine Initiative (IAVI), а сама вакцина была включена в рейтинг-лист перспективных кандидатных вакцин Global HIV Vaccine Enterprise. К настоящему времени вакцина прошла I фазу клинических испытаний, целью которой было изучение безопасности и реактогенности и в результате которых доказана ее безопасность, иммуногенность и антигенная специфичность.
Предыдущие описания и примеры приведены в качестве иллюстрации и не исчерпывают возможностей данного изобретения.
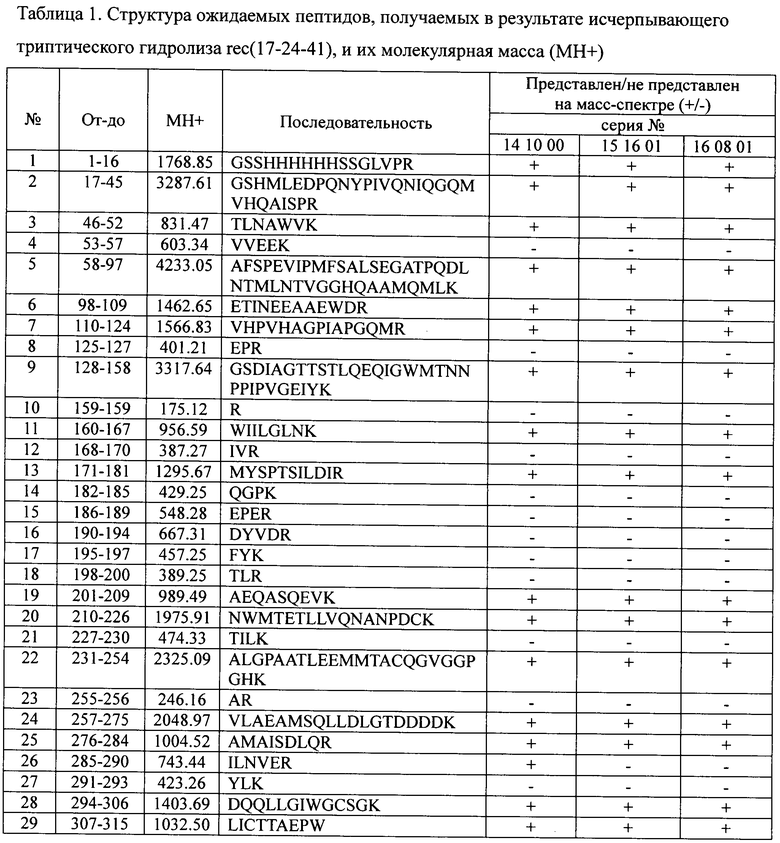

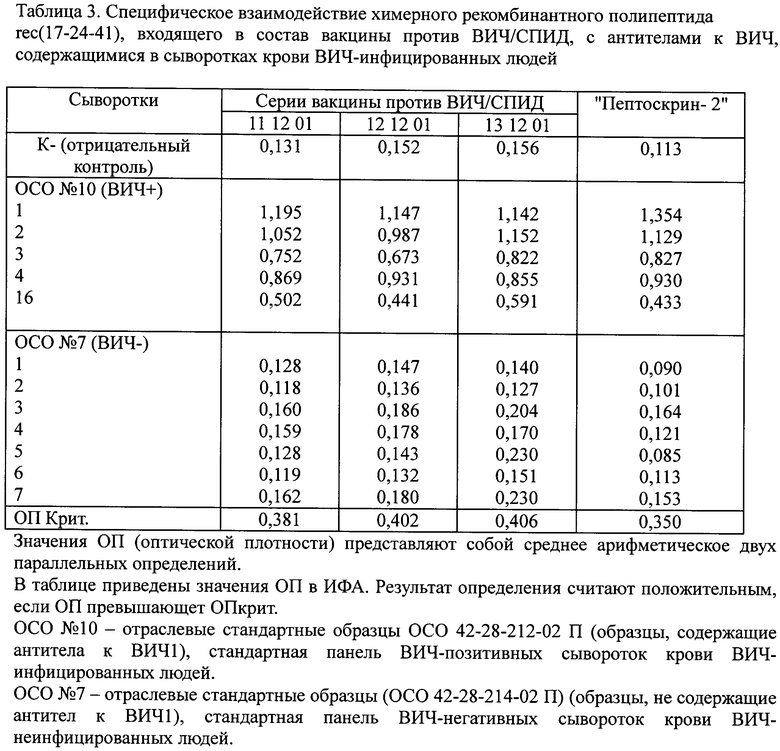
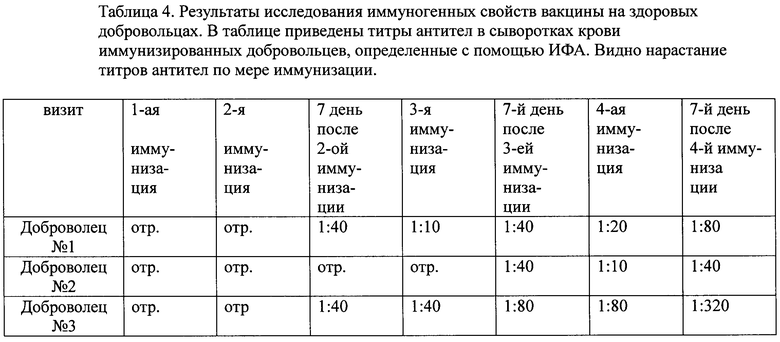


Изобретение относится к области биотехнологии, вирусологии и медицины. Вакцина против ВИЧ/СПИД включает соединение вакцинных антигенов вируса ВИЧ/СПИДа и фармакологически приемлемого носителя. В качестве вакцинных антигенов вируса ВИЧ/СПИДа используют химерный рекомбинантный полипептид, копирующий иммунореактивные участки трех белков ВИЧ1 - фрагмент трансмембранного белка gp41, кодируемого геном env, полноразмерный рекомбинантный белок р24, кодируемый геном gag, и фрагмент внутреннего белка р17, кодируемого геном gag. В качестве полимерного носителя используют производное гетероцепных полиаминов с молекулярной массой 50000-150000 Да в соотношении 1:10. Изобретение представляет собой безопасную вакцину против ВИЧ/СПИД, обладающую высокой иммуногенной активностью и антигенной специфичностью. 4 ил, 4 табл., 18 пр.
Вакцина против ВИЧ/СПИД, включающая соединение вакцинных антигенов вируса ВИЧ/СПИДа и фармакологически приемлемого носителя, характеризующаяся тем, что она содержит в качестве вакцинного антигена вируса ВИЧ/СПИД химерный рекомбинантный полипептид, состоящий из последовательно расположенных фрагмента р17 и полноразмерного белка р24, кодируемых геном gag, и фрагмента белка gp41, кодируемого геном env, экспрессируемый в клетках Е.coli на основе плазмидного вектора рЕТ15b, в который по сайту рестрикции Bam Hl вставлен фрагмент ДНК, кодирующий химерный рекомбинантный полипептид и по сайтам рестрикции Hind III - Eco R1 вставлен par-локус, a в качестве полимерного носителя используют производное гетероцепных полиаминов с молекулярной массой 50000-150000Д (Полиоксидоний) в соотношении 1:10, при этом химерный рекомбинантный полипептид имеет последовательность SEQ ID NO:4 и представляет собой очищенный белок, копирующий аминокислотные последовательности белков ВИЧ1: фрагмента р17, полноразмерного белка р24 и фрагмента белка gp41.
| КОМПЛЕКСНАЯ АУТОЛОГИЧНАЯ ВАКЦИНА ПРОТИВ ВИЧ-ИНФЕКЦИИ И СПИД | 2005 |
|
RU2306950C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ХИМЕРНЫЙ ПОЛИПЕПТИД ВИЧ, ПОЛИПЕПТИДЫ И ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К ВИЧ | 2001 |
|
RU2214274C2 |
| WO 03016337 А1, 27.02.2003. | |||
Авторы
Даты
2013-02-20—Публикация
2010-12-29—Подача