Перекрестная ссылка на родственные заявки
Данная заявка притязает на преимущества под § 119 (е) 35 U.S.C., раскрытые в серии заявок США № 60/492108, проходящих предварительную экспертизу и полностью включенных в данное описание.
Уровень техники
Область техники, к которой относится изобретение
Изобретение относится к области фармацевтической химии, в особенности к соединениям, композициям и способам лечения вирусных инфекций у млекопитающих, опосредованных, по меньшей мере частично, вирусом из вирусов семейства Flaviviridae.
Ссылки
В данной заявке цитированы следующие публикации в виде указанных сверху номеров:
1. Giangaspero, et al, Arch. Virol. Suppl., 7: 53-62 (1993);
2. Giangaspero, et al, Int. J. STD. AIDS, 4(5): 300-302 (1993);
3. Yolken, et al., Lancet, 1(8637): 517-20 (1989);
4. Wilks, et al., Lancet, 1(8629): 107 (1989);
5. Giangaspero, et al., Lancet, 2: 110 (1988);
6. Potts, et al., Lancet, 1(8539): 972-973 (1987);
7. Cornberg, et al., "Hepatitis C: therapeutic perspectives." Forum (Genova), 11(2): 154-62 (2001);
8. Dymock, et al., Antivir. Chem. Chemother. 11(2):79-96 (2000);
9. Devos, et al., International Patent Application Publication No. WO 02/18404 A2, published 7 March, 2002;
10. Sommadossi, et al., International Patent Application Publication No. WO 01/90121, published 23 May, 2001;
11. Carroll, S.S., et al., International Patent Application Publication No. WO 02057287, published 25 July, 2002;
12. Carroll, S.S., et al., International Patent Application Publication No. WO 02057425, published 25 July, 2002;
13. Herr, J.R., Bioorg. Med. Chem., 10: 3379-3393 (2002);
14. Andersen, K.E. et al., Eur. J. Med. Chem, 31: 417-425 (1996);
15. Thornber, C.W. Chem. Soc. Rev. 8: 563-580 (1979);
16. Lipinski, C.A. Annual Reports in Med. Chem. 21: 283-297 (1986);
17. Wissner, A. et al., J. Med. Chem. 23: 715-717 (1980);
18. Patani, G.A. et al., Chem. Rev. 96: 3147-3176 (1996).
Все из вышеуказанных опубликованных заявок полностью включены в данное описание в качестве ссылок, как если бы каждая отдельная публикация была специально и отдельно указана для включения в качестве ссылки во всей ее полноте.
Описание предшествующего уровня
Семейство вирусов flaviviridae состоит из трех видов: пестивирусы, флавивирусы и гепасивирусы (вирус гепатита С). Из указанных видов флавивирусы и гепасивирусы представляют собой важные патогены человека, широко распространенные во всем мире. Существуют 38 флавивирусов, связанных с заболеваниями человека, включающих вирусы лихорадки, вирус желтой лихорадки и вирус японского энцефалита. Флавивирусы вызывают ряд острых лихорадочных болезней и энцефалитных и геморрагических заболеваний. Вирусами гепатита С в настоящее время заражено примерно от 2 до 3% населения мира, при этом они вызывают хронические инфекции, приводящие к хроническому заболеванию печени, циррозу, печеночно-клеточному раку и печеночной недостаточности. Пестивирусы человека не охарактеризованы так обширно, как пестивирусы животных. Однако серологические исследования указывают на заметное воздействие пестивирусов на людей. Пестивирусные инфекции у людей причастны к ряду заболеваний, включающих, но, по всей вероятности, без ограничения, врожденную черепно-мозговую травму, инфантильный гастроэнтерит и хроническую диарею у больных, зараженных вирусом иммунодефицита человека (HIV) [1-6].
В текущей практике отсутствуют противовирусные лекарственные средства для профилактики или лечения пестивирусных или флавивирусных инфекций. Для лечения инфекций, вызванных гепасивирусом, то есть вирусом гепатита С (HCV), единственным получившим одобрение лекарственным средством в США в настоящее время является интерферон-альфа (IFN). HCV является главной причиной посттрансфузионного и спорадического «не-А, не-В» гепатита. Инфекция, вызванная HCV, является незаметной и неощутимой у значительной части хронически инфицированных (и инфекционных) ее носителей, которые могут не проявлять клинические симптомы в течение многих лет.
В настоящее время единственным приемлемым лечением хронического HCV является интерферон (IFN-альфа), которым необходимо проводить лечение в течение, по меньшей мере, шести (6) месяцев, и/или рибавирин, который может угнетать репликацию вируса в инфицированных клетках, а также улучшать функцию печени у некоторых людей.
IFN-альфа принадлежит к семейству встречающихся в природе маленьких белков с характерными биологическими действиями, такими как противовирусная, иммунорегуляторная и противоопухолевая активности, которые продуцируются и секретируются большинством ядросодержащих клеток животных в ответ на некоторые заболевания, в особенности вирусные инфекции. IFN-альфа является важным регулятором роста и дифференциации, влияющим на клеточную коммуникацию и иммунологический контроль. Однако лечение HCV интерфероном ограничивает долгосрочную эффективность скоростью реакции около 25%. Кроме того, лечение HCV интерфероном часто связано с нежелательными побочными действиями, такими как усталость, нервное возбуждение, озноб, головная боль, миалгия, артралгия, слабая алопеция, психиатрические симптомы и сопутствующие расстройства, аутоиммунные симптомы и сопутствующие расстройства и дисфункция щитовидной железы.
Рибавирин (1-β-D-рибофуранозил-1Н-1,2,-4-триазол-3-карбоксамид)-ингибитор инозин-5'-монофосфатдегидрогеназы (IMPDH) усиливает эффективность IFN-альфа при лечении HCV. Несмотря на введение рибавирина при использовании общепринятой стандартной терапии интерфероном-альфа (IFN) и рибавирином у более чем 50% больных вирус не устраняется. К настоящему времени стандартная терапия хронического гепатита С заменена на комбинацию PEG-IFN плюс рибавирин. Однако у ряда больных все еще наблюдаются значительные побочные действия, связанные, главным образом, с рибавирином. Рибавирин вызывает значительный гемолиз у 10-20% больных, подвергнутых лечению в общепринято рекомендуемых дозах, и данное лекарство является как тератогенным, так и эмбриотоксическим.
Для борьбы с вирусом предпринимаются другие попытки. Они включают, например, употребление нечувствительных олигонуклеотидов или рибозимов для ингибирования репликации HCV. Кроме этого, в качестве привлекательных стратегических средств для борьбы с инфекцией, вызванной HCV, рассматриваются низкомолекулярные соединения, которые непосредственно ингибируют белки HCV и препятствуют вирусной репликации. В качестве потенциальных мишеней для новых лекарственных средств рассматриваются NS3/4A серинпротеаза, геликаза рибонуклеиновой кислоты (PHK), PHK-зависимая РНК-полимераза.
Devos, et al. [9] описывают пурин и производные пиримидиннуклеозида и их применение в качестве ингибиторов репликации PHK-HCV. Sommadossi, et al. [10] описывает 1', 2' или 3'-модифицированные нуклеозиды и их применение для лечения хозяина, инфицированного HCV. Carroll, et al. [11,12] описывает нуклеозиды в качестве ингибиторов PHK-зависимой PHK вирусной полимеразы. Из сведений относительно мирового эпидемического уровня HCV и других членов семейства вирусов Flaviviridae следует, что имеется большая потребность в новых эффективных лекарственных средствах для лечения инфекций, вызванных вирусами семейства Flaviviridae. В настоящем изобретении предложены соединения для лечения таких инфекций.
Сущность изобретения
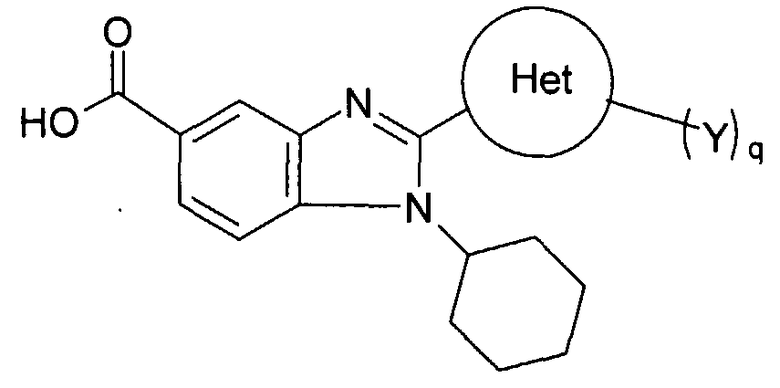
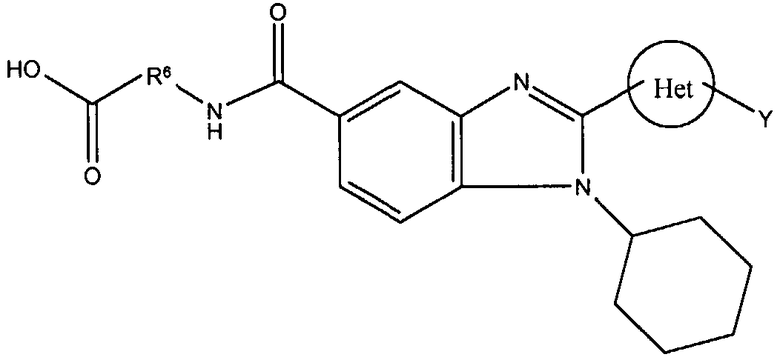
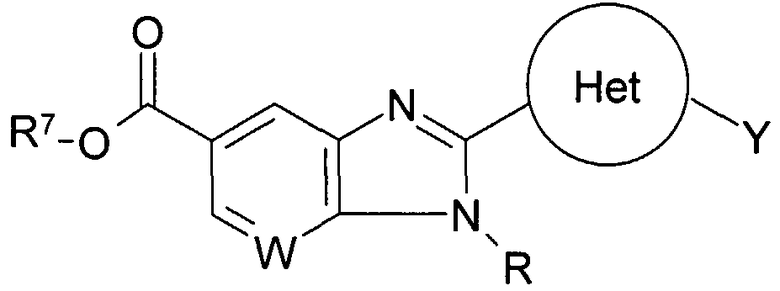
Данное изобретение относится к новым соединениям, применимым при лечении вирусных инфекций у млекопитающих, опосредованных, по меньшей мере частично, таким вирусом семейства Flaviviridae, как HCV. Соединения данного изобретения представлены формулой I:
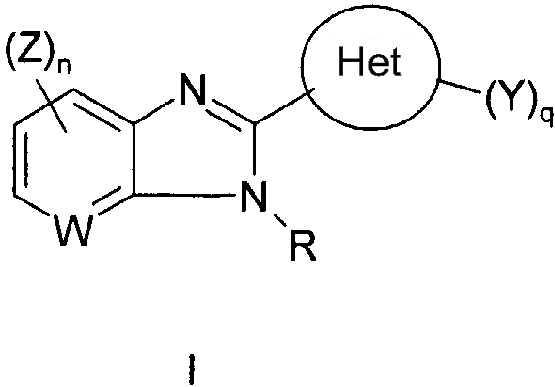
в которой:
W является СН или N;
R выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила и -NR12R13,
где каждый из R12 и R13 независимо выбран из группы, состоящей из (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила; или R12 и R13 вместе с атомом азота, к которому они присоединены, могут быть необязательно объединены с образованием гетероциклической группы, замещенной гетероциклической группы, гетероарила или замещенного гетероарила;
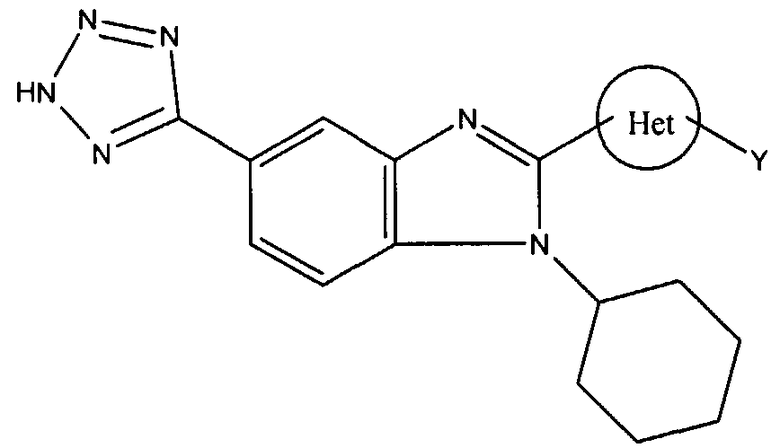
Z выбран из группы, состоящей из
а) -С(=О)OR7, где R7 выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы;
в) -С(=О)NR8R9, где R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы или, альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую группу, замещенную гетероциклическую группу, гетероарильную или замещенную гетероарильную циклическую группу;
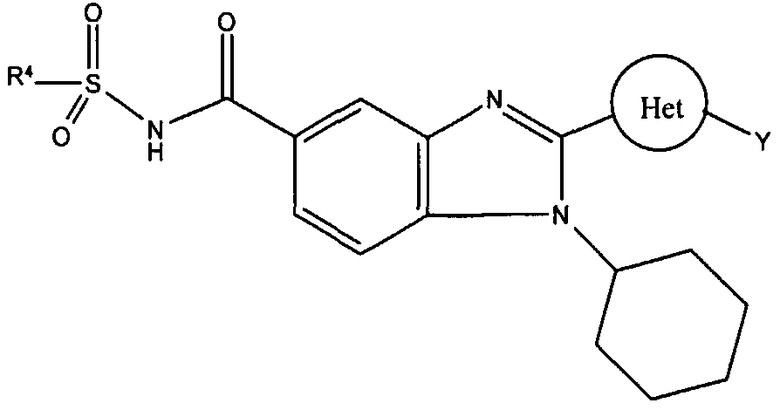
с) тетразолила или -С(О)NHS(O)2R4, где R4 выбран из группы, состоящей из алкила, замещенного алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы;
d) -С(X)-N(R3)CR2R2'C(=O)R1, где Х выбран из группы, состоящей из =О, =S и =NR11, где R11 представляет собой водород или алкил, R1 выбран из группы, состоящей из -OR7 и -NR8R9;
где R7, R8 и R9 являются такими, как они определены выше;
каждый R2 и R2' независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы;
или, альтернативно, R2 и R2', определенные выше и взятые вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную, замещенную циклоалкильную, гетероциклическую или замещенную гетероциклическую группу,
или, дополнительно альтернативно, один или R2 или R2' представляет собой водород, алкил или замещенный алкил и другой вместе с атомом углерода, к которому он присоединен, объединен или с R7 и атомом кислорода, к которому он присоединен, или с R8 и атомом азота, к которому он присоединен, с образованием гетероциклической или замещенной гетероциклической группы;
R3 выбран из группы, состоящей из водорода и алкила, или когда R2 и R2' не взяты вместе с образованием цикла и когда R2/R2' и R7 или R8 не объединены с образованием гетероциклической или замещенной гетероциклической группы, тогда R3 вместе с атомом азота, к которому он присоединен, может быть взят вместе с одним из R2 или
R2' с образованием гетероциклической или замещенной гетероциклической группы;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного гетероциклического или гетероарильного циклов, которые необязательно замещены (Y)q; при условии что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным или бицикл представляет собой нафтил;
каждый Y независимо выбран из группы, состоящей из галогена, циано, нитро,
(С1-C10)алкила, замещенного (С1-C10)алкила, ацила, ацилокси, гуанидино, замещенного гуанидино, оксикарбониламино, аминокарбонилокси, аминокарбониламино, оксикарбонилокси, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -CO2R7, -NR14R15, -NHNR14R15, -C(X)NR14R15, -OR14, -SR14, -S(O)R14, -S(O)2R14 и -S(O)2NR14R15, где Х является таким, как он определен выше.
где R7 является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила; или R14 и R15 вместе с атомом азота, к которому они присоединены, необязательно могут быть объединены с образованием гетероциклической группы, замещенной гетероциклической группы, гетероарила или замещенного гетероарила;
n представляет собой целое число, равное 0, 1 или 2;
q представляет собой целое число, равное 1, 2 или 3;
и его фармацевтически приемлемые соли или таутомеры.
В одном предпочтительном варианте n равно 0 (то есть Z=водород).
В другом предпочтительном варианте n равно единице или двум; более предпочтительно n равно единице.
Когда n не равно 0, предпочтительные группы Z относятся к нескольким вариантам. В одном предпочтительном варианте Z представляет собой, например, 1Н-тетразол-5-ил или -COOR7, где R7 является таким, как он определен выше. В особенно предпочтительном аспекте данного варианта Z выбран из группы, состоящей из 1Н-тетразол-5-ила, -С(=О)ОН и -С(=О)OR”, где R” является (С1-С6)алкилом и в особенности (С1-С2)алкилом. Кроме этого, в данном варианте Z наиболее предпочтительно представляет собой -С(=О)ОН.
В другом предпочтительном варианте Z представляет собой -С(=О)NR8R9, где R8 и
R9 являются, такими, как они определены выше. В одном в особенности предпочтительном аспекте данного варианта R8 является водородом и R9 является таким, как он определен выше. В данном аспекте R9 еще более предпочтительно выбран из группы, состоящей из алкила, замещенного алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Предпочтительно R9 - замещенные алкильные группы содержащие от 1 до 2 заместителей, выбранных из группы, состоящей из сульфоновой кислоты, карбокси и группы сложного эфира карбоновой кислоты. В особенности предпочтительные R9 замещенные алкильные группы включают, например, -CH2CH2SO3H и -CH2CH2COOH.
Предпочтительные R9 арильные и замещенные арильные группы включают, например, 7-гидроксинафт-1-ил, 6-гидроксинафт-1-ил, 5-гидроксинафт-1-ил, 4-метил-2-оксо-2Н-хромен-7-ил, 6-карбоксинафт-2-ил, (4-НООССН2-)фенил, (3,4-дикарбокси)фенил, 3-карбоксифенил, 3-карбокси-4-гидроксифенил, 2-карбоксинафтен-6-ил, (4-карбоксиметил)фенил, (3,4-дикарбокси)фенил, 4-гидрокси-3-карбоксифенил и 3-карбоксифенил.
Предпочтительные R9 гетероарильные и замещенные гетероарильные группы включают, например, 1-фенил-4-карбокси-1Н-пиразол-5-ил, 5-карбоксипирид-2-ил, 2-карбоксипиразин-3-ил и 3-карбокситиен-2-ил.
В другом предпочтительном варианте R9 представляет собой гетероциклическую группу, более предпочтительно N-морфолино.
В другом в особенности предпочтительном аспекте данного варианта R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое или замещенное гетероциклическое кольцо. Предпочтительные гетероциклические и замещенные гетероциклические кольца включают 4-8-членные кольца, содержащие от 1 до 3-х гетероатомов и в особенности от 1 до 2-х атомов азота, включающие, например, пиперидин, замещенный пиперидин, пиперазин, замещенный пиперазин, морфолино, замещенный морфолино, тиоморфолино и замещенный тиоморфолино, где атом серы тиоморфолинового или замещенного тиоморфолинового цикла необязательно окислен с получением сульфоксида и сульфонов. В особенности предпочтительные гетероциклические и замещенные гетероциклические группы включают, например, 4-гидроксипиперидин-1-ил, 1,2,3,4-тетрагидро-3-карбоксиизохинолин-2-ил, 4-метилпиперизин-1-ил, морфолин-4-ил и тиоморфолин-4-ил.
В еще одном предпочтительном варианте Z представляет собой -С(X)-N(R3)-CR2R2'-C(=O)R1.
В одном аспекте данного варианта Z представляет собой -C(O)NHCHR2C(=O)R1. В данном аспекте предпочтительные R2 группы включают водород, алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, арил, замещенный арил, гетероарил и замещенный гетероарил. В особенности предпочтительные R2 группы включают водород, алкил, замещенный алкил и циклоалкил, включающие, например, водород, метил, 1-метилпроп-1-ил, втор-бутил, гидроксиметил, 1-гидроксиэт-1-ил, 4-амино-н-бутил, 2-карбоксиэт-1-ил, карбоксиметил, бензил, (1Н-имидазол-4-ил)метил, (4-фенил)бензил, (4-фенилкарбонил)бензил, циклогексилметил, циклогексил, 5-гидрокси-1Н-индол-3-ил, 2-метилтиоэт-1-ил, изопропил, карбамоилметил, 2-карбамоилэт-1-ил, (4-гидрокси)бензил и 3-гуанидино-н-пропил.
В данном аспекте предпочтительные R1 группы, включают, например, гидрокси, амино и амино (N-морфолино).
В другом аспекте вышеуказанного варианта Z представляет собой -C(O)N(R3)CHR2C(=O)R1, где R2 и R3 вместе с атомом углерода и атомом азота, к которым они соответственно присоединены, объединены с образованием гетероциклической или замещенной гетероциклической группы. В данном аспекте предпочтительные гетероциклические и замещенные гетероциклические группы включают, например, пирролидинил, 2-карбоксипирролидинил, 2-карбокси-4-гидроксипирролидинил и 3-карбокси-1,2,3,4-тетрагидроизохинолин-3-ил.
В еще одном другом предпочтительном варианте Z представляет собой
-C(O)NHS(O)2R4. В данном предпочтительном аспекте R4 предпочтительно представляет собой алкил, замещенный алкил, арил и замещенный арил. Более предпочтительно, R4 представляет собой, например, биметил, трифторметил, фенил, 4-бромфенил, 4-нитрофенил или 4-метилфенил.
В другом предпочтительном варианте Z представляет собой изостерную карбоновую кислоту, такую как те, которые цитированы в перечисленных ссылках 13-18: Herr, J.R., Bioorg. Med. Chem., 10: 3379-3393 (2002) [13]; Andersen, K.E. et al., Eur. J. Med. Chem, 31: 417-425 (1996) [14]; Thornber, C.W. Chem. Soc. Rev. 8: 563-580 (1979) [15]; Lipinski, C.A. Annual Reports in Med. Chem. 21: 283-297 (1986) [16]; Wissner, A. et al., J. Med. Chem. 23: 715-717 (1980) [17]; and, Patani, G.A. et al., Chem. Rev. 96: 3147-3176 (1996) [18].
В другом предпочтительном варианте R выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила.
В особенности предпочтительные R группы включают водород, алкил, замещенный алкил, циклоалкил и замещенный циклоалкил, пояснительными примерами которых являются, например, водород, этил, изопропил, втор-бутил, 3-метил-н-бутил, циклопропил, циклопентил, циклогексил, циклопропилметил, 2-(N,N-диметиламино)эт-1-ил. Наиболее предпочтительно R представляет собой циклогексил.
В одном варианте W является N. Однако предпочтительно W является СН.
В одном предпочтительном варианте Het группа представляет собой конденсированное бициклическое азотсодержащее гетероциклическое или гетероарильное кольцо. Наиболее предпочтительно Het группа содержит в целом от 1 до 4-х циклических атомов азота в одной или обеих циклических группах и не обязательно 1-2 циклических гетероатома, выбранных из группы, состоящей из -O-, -S-, -S(O)- и -S(O)2-, опять же в одной или обеих циклических группах. В любом одном из конденсированных циклов предпочтительно имеется не более 3-х циклических атомов азота и еще более предпочтительно в любом одном из конденсированных циклов имеется не более 2-х циклических атомов азота.
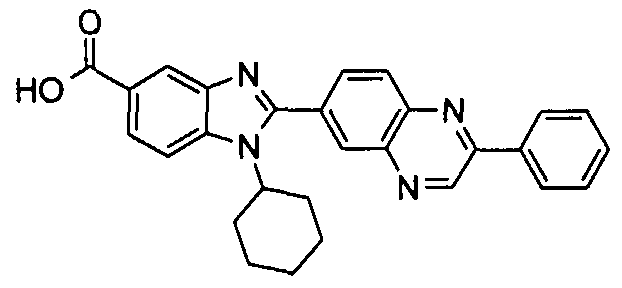
В особенно предпочтительном аспекте данного варианта Het группа выбрана из группы, состоящей из хинолинила, изохинолинила, хиноксалинила, хиназолинила, птеридинила, циннолинила, [1,8]нафтиридинила, [1,5]нафтиридинила, 1,2,3,4-тетрагидрохинолинила, 1,2,3,4-тетрагидроизохинолинила, 1,4-диоксо-1,4-дигидрофталазинила, 4-оксо-1,4-дигидрохинолинила, 4-оксо-1,4-дигидрохиназолинила, 1,1-диоксо-1,4-дигидро-1λ6-бензо[1,2,4]тиадиазинила и 1,4-дигидроизохинолинила, пояснительными примерами которых являются, например, хинолин-6-ил, изохинолин-6-ил, хинолин-7-ил, хиноксалин-6-ил, хиназолин-7-ил, птеридин-6-ил, циннолин-3-ил, [1,8]нафтиридин-3-ил, [1,5]нафтиридин-2-ил, 1,2,3,4-тетрагидрохинолин-6-ил, 1,4-диоксо-1,4-дигидрофталазин-6-ил, 4-оксо-1,4-дигидрохинолин-6-ил, 4-оксо-1,4-дигидрохиназолин-6-ил, 1,1-диоксо-1,4-дигидро-1λ6-бензо [1,2,4]тиадиазин-7-ил и 1,4-дигидроизохинолин-6-ил.
В другом предпочтительном варианте гетероциклическое или гетероарильное кольцо Het группы представляет собой кислородсодержащее гетероциклическое или гетероарильное кольцо. Het группа предпочтительно содержит 1-2 циклических атома кислорода и необязательно 1-2 циклических гетероатома, выбранных из группы, состоящей из -S-, -S(O)- и -S(O)2-.
В особенно предпочтительном аспекте данного варианта Het группа выбрана из группы, состоящей из 2-оксо-2Н-хроменила, 4-оксо-2Н-хроменила и 4-оксо-4Н-хромен-6-ила, пояснительными примерами которых являются, например, 2-оксо-2Н-хромен-7-ил, 4-оксо-2Н-хромен-6-ил, 4-оксо-2Н-хромен-7-ил и 4-оксо-4Н-хромен-6-ил.
В другом особенно предпочтительном варианте Het группа представляет собой нафтил.
Y предпочтительно выбран из группы, состоящей из (С1-C10)алкила, замещенного (С1-C10)алкила, амино, замещенного амино, арила, замещенного арила, циклоалкила, замещенного циклоалкила, галогена, гетероарила, замещенного гетероарила, замещенной гетероциклической группы, -C(O)NR14R15, -OR14 и -SR14.
Один ряд предпочтительных Y групп включает, например, аминозамещенный амино(гидразин) и моно- и дизамещенные аминогруппы. Монозамещенные аминогруппы включают алкиламино, замещенный алкиламино, ариламино, замещенный ариламино. Дизамещенные аминогруппы включают заместители, независимо выбранные из алкильных, замещенных алкильных, арильных и замещенных арильных групп. Примеры предпочтительных амино Y групп включают, например, амино, фениламино, [2-(трет-бутоксикарбониламиноэтил]амино, N-(4-хлорфенил)амино, N,N-диметиламино, 4-гидроксибутиламино, 3-имидазол-1-ил-пропиламино и гидразино.
Другой ряд предпочтительных Y групп включает (С1-C10)алкил, замещенный (С1-C10)алкил, циклоалкил и замещенный циклоалкил. Предпочтительные заместители для замещенных (С1-C10)алкильных Y групп включают, например, гидрокси, амино, замещенный амино, арил, замещенный арил, гетероарил и замещенный гетероарил. Предпочтительные заместители для замещенного циклоалкила включают, например, карбоксиметил и метил. Примеры предпочтительных алкильных, замещенных алкильных и замещенных циклоалкильных Y групп включают, например, метил, 3-гидроксипропил, (N,N-ди-н-пропил)аминометил, дифенилметил(бензгидрил) и 2-(пиразол-1-ил)эт-1-ил и 3-карбоксиметил-2,2-диметилциклобутил.
Другой ряд предпочтительных Y групп включает карбокси, группу сложных эфиров карбоновых кислот, галоген (в особенности фтор), циано и нитро.
Другой ряд предпочтительных Y групп включает -C(O)NR14R15, где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, арила и замещенного арила, или, где R14 и R15 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую и замещенную гетероциклическую группу. Предпочтительные заместители в замещенном алкиле и замещенном ариле включают, например, галоген гидрокси, карбамоил и подобные. Предпочтительные Y группы включают, например, 1-карбамоилэтилкарбамоил, 1-карбамоил-2-(1Н-имидазол-2-ил)этилкарбамоил, 1-карбамоил-2-гидроксиэтилкарбамоил, 1-карбамоил-2-метилпропилкарбамоил, 4-хлорфенилкарбамоил и пирролидин-1-илкарбонил.
Другой ряд предпочтительных Y групп включает арильные группы, примерами которых являются, например, фенил, нафталин-1-ил и 5,6,7,8-тетрагидронафталин-2-ил.
Другой ряд предпочтительных Y групп включает замещенный арил. В одном варианте замещенные арилы замещены неарильными группами. В другом варианте замещенный арил замещен арилом или замещенным арилом с образованием, например, бифенильной группы.
Предпочтительные заместители для замещенных арильных Y групп включают, например, ациламино, амино, замещенный амино, алкил, замещенный алкил, алкокси, замещенный алкокси, арил, замещенный арил, арилокси, замещенный арилокси, циклоалкил, замещенный циклоалкил, галоген, гетероциклическую группу, замещенную гетероциклическую группу, гетероарил, замещенный гетероарил, гидрокси, нитро и -C(O)NR14R15, где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, арила и замещенного арила или, где R14 и R15 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую и замещенную гетероциклическую группу.
Замещенные арильные Y группы, которые не замещены арильной или замещенной арильной группой, представляют собой, например, 4-ацетиламинофенил, 4-аминофенил, 4-амино-3-бромфенил, 4-амино-3,5-дихлорфенил, 4-бензилокси-2-гидрокси-3-метилфенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 5-бром-2-гидроксифенил, 3-карбамоил-4-гидроксифенил, 3-карбоксиметоксифенил, 2-циклогексил-5-метоксифенил, 3,4-дихлорфенил, 2,4-дигидроксифенил, 3,5-дигидроксифенил, 4-(N,N-диметиламино)фенил, 4-фторфенил, 2-фуран-2-ил-5-метоксифенил, 3-гидроксифенил, 2-гидрокси-4,6-диметоксифенил, 2-гидроксинафталин-1-ил, 2-гидрокси-6-метоксифенил, 2-гидрокси-5-метил-3-нитрофенил, 4-(имидазол-1-ил)фенил, 3-(2-метоксиэтокси)фенил, 2-метокси-5-нитрофенил, 3-метоксифенил, 4-метоксифенил, 5-метокси-2-тиофен-2-илфенил, 4-метилфенил, 4-морфолинофенил, 6-метилнафталин-2-ил, 2-нитрофенил, 3-(2-оксо-2-пирролидин-1-илэтокси)фенил, 4-феноксифенил, (4-пиперазин-1-ил)фенил, 3-[пирролидин-1-илкарбонил]фенил, 3-[3-пирролидин-1-илпропокси]фенил, 2-(2,4-диметоксипиримидин-5-ил)-4-метоксифенил и 2-(пирид-4-ил)фенил.
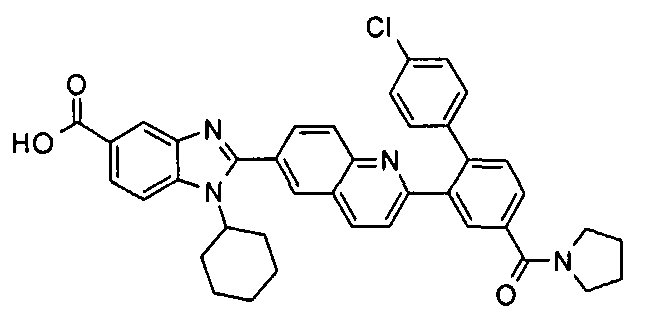
Замещенные арильные Y группы, которые замещены арильной или замещенной арильной группой, включают, например, бифен-2-ил, бифен-4-ил, 4-амино-4'-хлорбифен-2-ил, 4'-аминометил-4-метоксибифен-2-ил, 4-карбамоил-4'-метоксибифен-2-ил, 4-карбамоил-4'-фторбифен-2-ил, 4-карбамоил-4'-метоксибифен-2-ил, 4-карбамоил-4'-нитробифен-2-ил, 4-(карбамоилметилкарбамоил)бифен-2-ил, 4-(карбамоилметилкарбамоил)-4'-хлорбифен-2-ил, 4-карбокси-4'-хлорбифен-2-ил, 3-карбокси-4'-метоксибифен-2-ил, 4-карбокси-4'-метоксибифен-2-ил, 4'-карбокси-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4-карбоксиметоксибифен-2-ил, 4-карбоксиметокси-4'-хлорбифен-2-ил, 4'-хлорбифен-2-ил, 4'-хлор-4-хлорбифен-2-ил, 4'-хлор-4-(диметиламиноэтилкарбамоил)бифен-2-ил, 4'-хлор-4-(2-этоксиэтокси)бифен-2-ил, 3'-хлор-4'-фтор-4-метоксибифен-2-ил, 4'-хлор-4-фторбифен-2-ил, 4'-хлор-4-гидроксибифен-2-ил, 3'-хлор-4-метоксибифен-2-ил, 4'-хлор-4-метилкарбамоилбифен-2-ил, 4'-хлор-4-метоксибифен-2-ил, 4'-хлор-4-(2-метоксиэтокси)бифен-2-ил, 4'-хлор-4-нитробифен-2-ил, 4'-хлор-4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ил, 4'-хлор-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4'-хлор-4-(3-пирролидин-1-илпропокси)бифен-2-ил, 4'-циано-4-метоксибифен-2-ил, 3',4'-дихлор-4-метоксибифен-2-ил, 4,4'-диметоксибифен-2-ил, 3',4'-диметокси-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4'-диметиламино-4-метоксибифен-2-ил, 4-(2-диметиламиноэтилкарбамоил)бифен-2-ил, 4'-этокси-4-метоксибифен-2-ил, 4'-фтор-4-метоксибифен-2-ил, 4-гидроксибифенил, 4-метоксибифенил, 4-метокси-4'-гидроксибифен-2-ил, 4-(2-метоксиэтокси)бифен-2-ил, 4-метокси-4'-метилбифен-2-ил, 4-метокси-3'-нитробифен-2-ил, 4-метокси-4'-нитробифен-2-ил, 4-метилкарбамоилбифен-2-ил, 3'-метил-4-метоксибифен-2-ил, 4'-нитро-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ил, 4-(3-пирролидин-1-илпропокси)бифен-2-ил и 4'-трифторметил-4-метоксибифен-2-ил.
Другой ряд предпочтительных Y групп включает гетероарильные группы, примерами которых являются, например, бензо[1,3]диоксол-5-ил, бензофуран-2-ил, 2,3-дигидробензофуран-5-ил, пиразин-2-ил, пирид-2-ил, пирид-3-ил, пирид-4-ил, 1Н-пиррол-2-ил, 1Н-пиррол-3-ил, хинолин-4-ил, 3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил и тиен-2-ил.
Другой ряд предпочтительных Y групп включает замещенный гетероарил. Предпочтительные заместители в замещенных гетероарильных Y группах включают амино, замещенный амино, алкил, замещенный алкил, арил, замещенный арил, алкокси, замещенный алкокси, галоген, гетероарил, замещенный гетероарил, гидрокси, нитро и циано. Такие группы включают, например, 2-амино-4-метилтиазол-5-ил, 3-амино-5-фенилтиофен-2-ил, 5-бензилокси-2-метилбензофуран-3-ил, 7-бром-5-метоксибензофуран-2-ил, 6-хлор-9-метил-9Н-карбазол-3-ил, 5-(4-хлорфенил)-2-метилфуран-4-ил, 3-(4-хлорфенил)-5-метилизоксазол-4-ил, 2-(4-хлорфенил)-4-метилтиазол-5-ил, 1-(2-хлорпирид-3-ил)-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил, 3-(3,4-дихлорфенил)изоксазол-5-ил, 7-гидроксибензофуран-2-ил, 5-метоксибензофуран-3-ил, 3,5-диметил-1-фенил-1Н-пиразол-4-ил, 2,4-диметилтиазол-5-ил, 5-метил-2-фенилтиофен-3-ил и 1-фенил-1Н-пиразол-4-ил.
Другой ряд предпочтительных Y групп включает алкокси, тиоалкил, замещенный алкокси, замещенный тиоалкил, арилокси и замещенную арилоксигруппу. Примерами таких групп являются, например, 2-хлор-4-(4-хлорфенил)фенокси, этокси, 7-гидроксинафталин-2-окси, фенокси и фенилсульфанил.
В особенности предпочтительный класс соединений данного изобретения и их фармацевтически приемлемых солей представлен нижеуказанной формулой II:
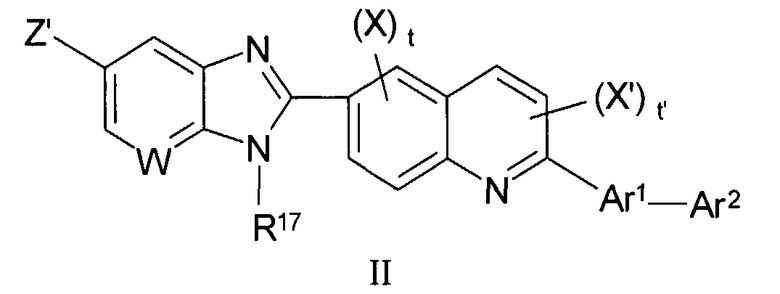
в которой:
W является СН или N;
Z' выбран из группы, состоящей из карбокси, группы сложного эфира карбоновой кислоты и тетразолила,
R17 выбран из группы, состоящей из циклоалкила, циклоалкила, замещенного 1-3 алкильными группами, гетероциклической группы и гетероциклической группы, замещенной 1-3 алкильными группами;
Х и Х' независимо выбраны из группы, состоящей из алкила, замещенного алкила, алкокси, замещенного алкокси, галогена, гидрокси и нитро;
Ar1 и Ar2 независимо выбраны из группы, состоящей из арила, замещенного арила, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы;
t представляет собой целое число, равное 0,1 или 2;
t' представляет собой целое число, равное 0 или 1 и
фармацевтически приемлемые соли.
W предпочтительно является СН.
R17 предпочтительно представляет собой циклоалкил и более предпочтительно циклогексил.
В одном предпочтительном варианте -Ar1-Ar2- выбраны из группы, состоящей из -арил-арила, -арил-замещенного арила, -замещенный арил-арила и -замещенный арил-замещенного арила. Примеры таких предпочтительных вариантов включают, например, бифен-2-ил, бифен-4-ил, 4-амино-4'-хлорбифен-2-ил, 4'-аминометил-4-метоксибифен-2-ил, 4-карбамоил-4'-метоксибифен-2-ил, 4-карбамоил-4'-фторбифен-2-ил, 4-карбамоил-4'-метоксибифен-2-ил, 4-карбамоил-4'-нитробифен-2-ил, 4-(карбамоилметилкарбамоил)бифен-2ил, 4-(карбамоилметилкарбамоил)-4'-хлорбифен-2-ил, 4-карбокси-4'-хлорбифен-2-ил, 3-карбокси-4'-метоксибифен-2-ил, 4-карбокси-4'-метоксибифен-2-ил, 4'-карбокси-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4-карбокиметоксибифен-2-ил, 4-карбоксиметокси-4'-хлорбифен-2-ил, 4'-хлорбифен-2-ил, 4'-хлор-4-хлорбифен-2-ил, 4'-хлор-4-(диметиламиноэтилкарбамоил)бифен-2-ил, 4'-хлор-4-(2-этоксиэтокси)бифен-2-ил, 3'-хлор-4'-фтор-4-метоксибифен-2-ил, 4'-хлор-4-фторбифен-2-ил, 4'-хлор-4-гидроксибифен-2-ил, 3'-хлор-4-метоксибифен-2-ил, 4'-хлор-4-метилкарбамоилбифен-2-ил, 4'-хлор-4-метоксибифен-2-ил, 4'-хлор-4-(2-метоксиэтокси)бифен-2-ил, 4'-хлор-4-нитробифен-2-ил, 4'-хлор-4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ил, 4'-хлор-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4'-хлор-4-(3-пирролидин-1-илпропокси)бифен-2-ил, 4'-циано-4-метоксибифен-2-ил, 3',4'-дихлор-4-метоксибифен-2-ил, 4,4'-диметоксибифен-2-ил, 3',4'-диметокси-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4'-диметиламино-4-метоксибифен-2-ил, 4-(2-диметиламиноэтилкарбамоил)бифен-2-ил, 4'-этокси-4-метоксибифен-2-ил, 4'-фтор-4-метоксибифен-2-ил, 4-гидроксибифенил, 4-метоксибифенил, 4-метокси-4'-гидроксибифен-2-ил, 4-(2-метоксиэтокси)бифен-2-ил, 4-метокси-4'-метилбифен-2-ил, 4-метокси-3'-нитробифен-2-ил, 4-метокси-4'-нитробифен-2-ил, 4-метилкарбамоилбифен-2-ил, 3'-метил-4-метоксибифен-2-ил, 4'-нитро-4-(пирролидин-1-илкарбонил)бифен-2-ил, 4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ил, 4-(3-пирролидин-1-илпропокси)бифен-2-ил и 4'-трифторметил-4-метоксибифен-2-ил.
В другом предпочтительном варианте -Ar1-Ar2- выбраны из группы, состоящей из -арил-гетероарила, -арил-замещенного гетероарила, -замещенный арил-гетероарила, -замещенный арил-замещенного гетероарила, гетероарил-арила, гетероарил-замещенного арила, замещенный гетероарил-арила и замещенный гетероарил-замещенного арила. Примеры таких предпочтительных вариантов включают, например, 2-фуран-2-ил-5-метоксифенил, 4-(имидазол-1-ил)фенил, 5-метокси-2-тиофен-2-илфенил, 2-(2,4-диметоксипиримидин-5-ил)-4-метоксифенил, 2-(пирид-4-ил)фенил, 3-амино-5-фенилтиофен-2-ил, 5-(4-хлорфенил)-2-метилфуран-2-ил, 3-(4-хлорфенил)-5-метилизоксазол-4-ил, 2-(4-хлорфенил)-4-метилтиазол-5-ил, 3-(3,4-дихлорфенил)изоксазол-5-ил, 3,5-диметил-1-фенил-1Н-пиразол-4-ил, 5-метил-2-фенилтиофен-3-ил и 1-фенил-1Н-пиразол-4-ил.
В другом предпочтительном варианте -Ar1-Ar2- выбраны из группы, состоящей из -арил-циклоалкила, -арил-замещенного циклоалкила, -замещенный арил-циклоалкила, -замещенный арил-замещенного циклоалкила, -арил-гетероциклической группы, арил-замещенной гетероциклической группы, замещенный арил-гетероциклической группы и замещенный арил-замещенной гетероциклической группы. Примеры таких предпочтительных вариантов включают (4-пиперазин-1-ил)фенил, 2-циклогексил-5-метоксифенил и 4-морфолинофенил.
В другом варианте изобретения представлены соединения, имеющие формулу III.
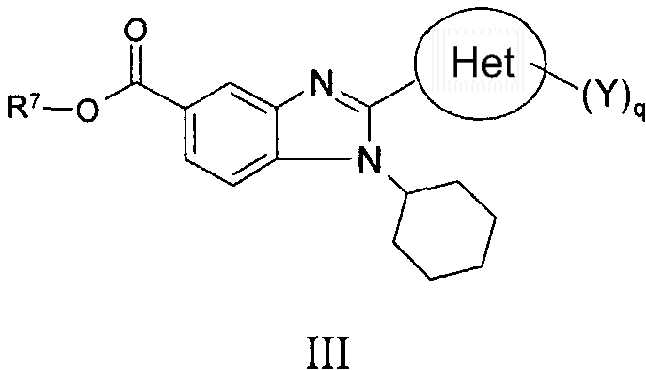
в которой:
q представляет собой целое число, равное 1, 2 или 3;
R7 выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии что по меньшей мере один 6-членный цикл в бицикле является гетероциклическим или гетероарильным или бицикл представляет собой нафтил;
каждый Y независимо выбран из группы, состоящей из галогена, циано, нитро,
(С1-C10)алкила, замещенного (С1-C10)алкила, ацила, ацилокси, гуанидино, замещенного гуанидино, оксикарбониламино, аминокарбонилокси, аминокарбониламино, оксикарбонилокси, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -CO2R7, -NR14R15, -NHNR14R15, -C(X)NR14R15, -OR14, -SR14, -S(O)R14, -S(O)2R14 и -S(O)2NR14R15; где Х является таким, как он определен выше;
где R7 является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила; или R14 и R15 вместе с атомом азота, к которому они присоединены, могут быть необязательно объединены с образованием гетероциклической группы, замещенной гетероциклической группы, гетероарила или замещенного гетероарила;
и их фармацевтически приемлемые соли и/или таутомеры.
Предпочтительные R7, Het и Y группы являются такими, как они определены выше.
В другом варианте изобретения представлены соединения, имеющие формулу IV:
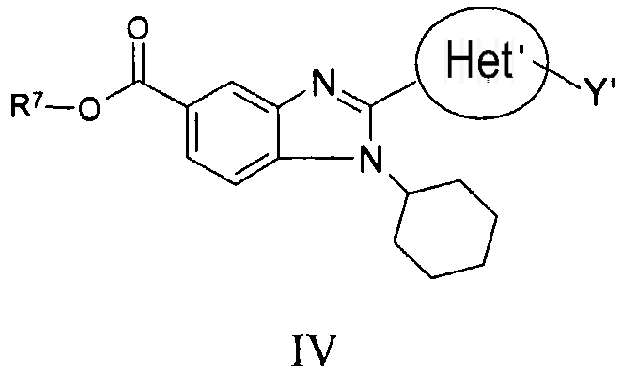
в которой:
R7 выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы;
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов, необязательно замещенных Y; при условии что, по меньшей мере, один 6-членный цикл в бицикле является ароматическим;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила;
и их фармацевтически приемлемые соли и/или таутомеры.
В другом варианте изобретения представлены соединения, имеющие формулу V:
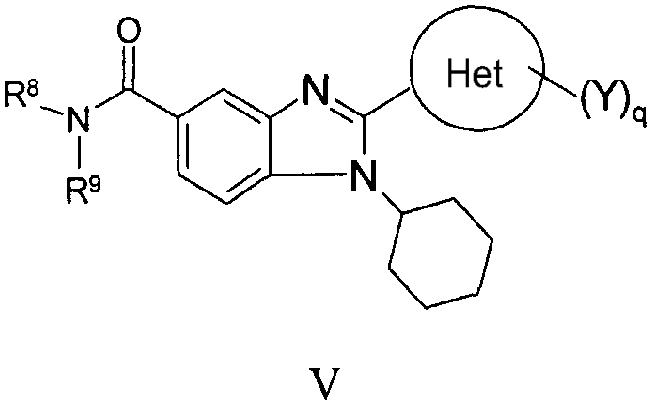
в которой:
R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы или, альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую, замещенную гетероциклическую, гетероарильную или замещенную гетероарильную циклическую группу;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным или бицикл представляет собой нафтил;
каждый Y независимо выбран из группы, состоящей из галогена, циано, нитро, (С1-C10)алкила, замещенного (С1-C10)алкила, ацила, ацилокси, гуанидино, оксикарбониламино, аминокарбонилокси, аминокарбониламино, оксикарбонилокси, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила, -CO2R7, -NR14R15, -NHNR14R15, -C(X)NR14R15, -OR14, -SR14, -S(O)R14, -S(O)2R14 и -S(O)2NR14R15; где Х является таким, как он определен выше;
где R7 является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила; или R14 и R15 вместе с атомом азота, к которому они присоединены, могут быть необязательно объединены с образованием гетероциклической группы, замещенной гетероциклической группы, гетероарила или замещенного гетероарила;
q представляет собой целое число, равное 1, 2 или 3; и
их фармацевтически приемлемые соли или таутомеры.
В еще одном другом варианте представлены соединения, имеющие формулу VI:
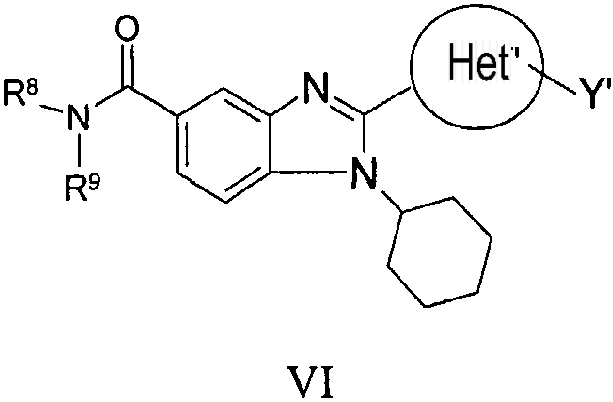
в которой:
R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы или, альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую, замещенную гетероциклическую, гетероарильную или замещенную гетероарильную циклическую группу;
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов, необязательно замещенных Y; при условии что, по меньшей мере, один 6-членный цикл в бицикле является ароматическим;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила; и
их фармацевтически приемлемые соли и/или таутомеры.
В еще одном другом варианте представлены соединения, имеющие формулу VII:
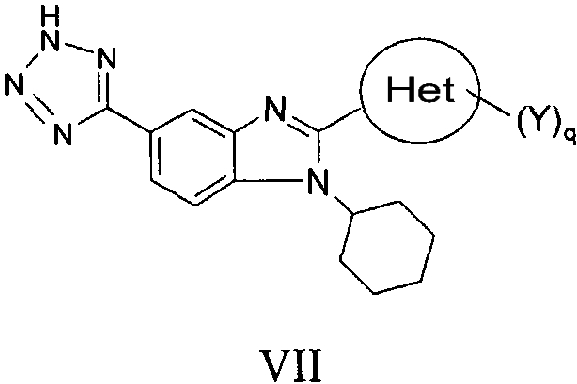
в которой:
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным или бицикл представляет собой нафтил;
каждый Y независимо выбран из группы, состоящей из галогена, циано, нитро,
(С1-C10)алкила, замещенного (С1-C10)алкила, ацила, ацилокси, гуанидино, замещенного гуанидино, оксикарбониламино, аминокарбонилокси, аминокарбониламино, оксикарбонилокси, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -CO2R7, -NR14R15, -NHNR14R15, -C(X)NR14R15, -OR14, -SR14, -S(O)R14, -S(O)2R14 и -S(O)2NR14R15; где Х является таким, как он определен выше;
где R7 является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила; или R14 и R15 вместе с атомом азота, к которому они присоединены, могут быть необязательно объединены с образованием гетероциклической группы, замещенной гетероциклической группы, гетероарила или замещенного гетероарила;
q представляет собой целое число, равное 1, 2 или 3; и
их фармацевтически приемлемые соли или таутомеры.
В еще одном варианте представлены соединения, имеющие формулу VIII:
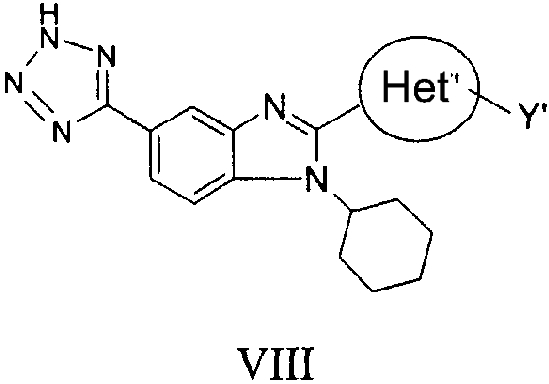
в которой:
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов, необязательно замещенных Y; при условии что, по меньшей мере, один 6-членный цикл в бицикле является ароматическим;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила; и
их фармацевтически приемлемые соли и/или таутомеры.
В еще одном другом варианте представлены соединения, имеющие формулу IX:
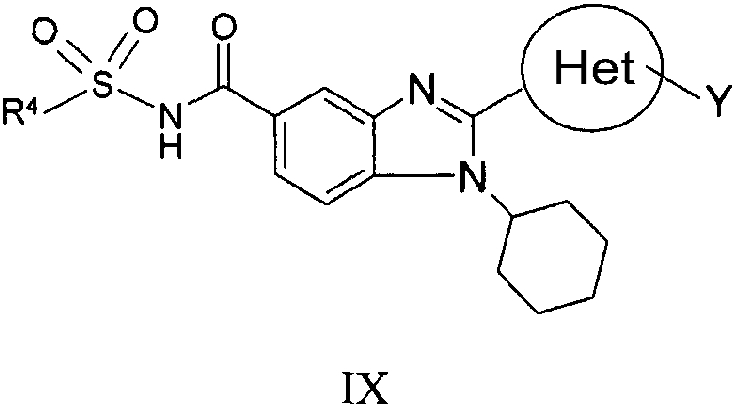
в которой:
R4 выбран из группы, состоящей из алкила, замещенного алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным или бицикл представляет собой нафтил;
каждый Y независимо выбран из группы, состоящей из галогена, циано, нитро, (С1-C10)алкила, замещенного (С1-C10)алкила, ацила, ацилокси, гуанидино, замещенного гуанидино, оксикарбониламино, аминокарбонилокси, аминокарбониламино, оксикарбонилокси, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -CO2R7, -NR14R15, -NHNR14R15, -C(X)NR14R15, -OR14, -SR14, -S(O)R14, -S(O)2R14 и -S(O)2NR14R15; где Х является таким, как он определен выше;
где R7 является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила; или R14 и R15 вместе с атомом азота, к которому они присоединены, могут быть необязательно объединены с образованием гетероциклической группы, замещенной гетероциклической группы, гетероарила или замещенного гетероарила;
q представляет собой целое число, равное 1, 2 или 3; и
их фармацевтически приемлемые соли или таутомеры.
В еще одном другом варианте представлены соединения, имеющие формулу X:
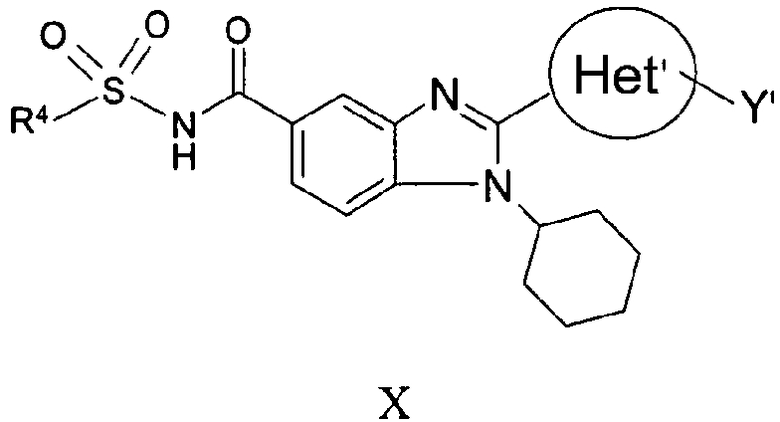
в которой:
R4 выбран из группы, состоящей из алкила, замещенного алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы;
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов, необязательно замещенных Y; при условии что, по меньшей мере, один 6-членный цикл в бицикле является ароматическим;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила; и
их фармацевтически приемлемые соли и/или таутомеры.
В еще одном другом варианте представлены соединения, имеющие формулу XI:
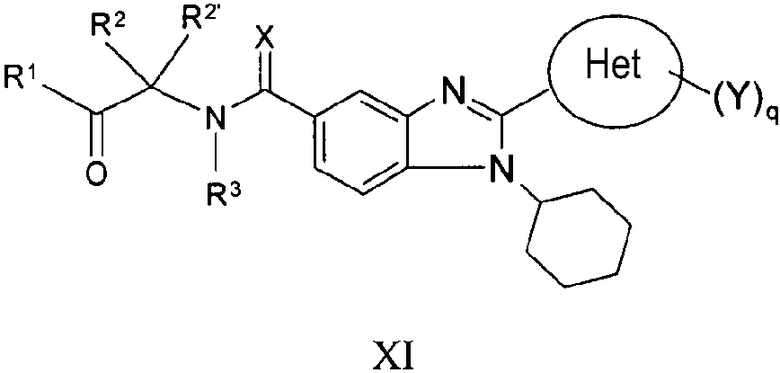
в которой Х выбран из группы, состоящей из =О, =S и =NR11, где R11 представляет собой водород или алкил, R1 выбран из группы, состоящей из -OR7 и -NR8R9, где R7 выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы; R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы, или, альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую, замещенную гетероциклическую, гетероарильную или замещенную гетероарильную циклическую группу;
каждый R2 и R2' независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы,
или альтернативно определенные выше R2 и R2', взятые вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную, замещенную циклоалкильную, гетероциклическую или замещенную гетероциклическую группу,
или дополнительно альтернативно один или R2 или R2' представляет собой водород, алкил или замещенный алкил и другой вместе с атомом углерода, к которому он присоединен, объединен или с R7 и атомом кислорода, к которому он присоединен, или с R8 и атомом азота, к которому он присоединен, с образованием гетероциклической или замещенной гетероциклической группы;
R3 выбран из группы, состоящей из водорода и алкила, или, когда R2 и R2' не взяты вместе с образованием кольца и когда R2,R2' и R7 или R8 не объединены с образованием гетероциклической или замещенной гетероциклической группы, тогда R3 вместе с атомом азота, к которому он присоединен, может быть взят вместе с одним из R2 и R2' с образованием гетероциклической или замещенной гетероциклической группы;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным или бицикл представляет собой нафтил;
каждый Y независимо выбран из группы, состоящей из галогена, циано, нитро, (С1-C10)алкила, замещенного (С1-C10)алкила, ацила, ацилокси, гуанидино, замещенного гуанидино, оксикарбониламино, аминокарбонилокси, аминокарбониламино, оксикарбонилокси, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -CO2R7, -NR14R15, -NHNR14R15, -C(X)NR14R15, -OR14, -SR14, -S(O)R14, -S(O)2R14 и -S(O)2NR14R15; где Х является таким, как он определен выше;
где R7 выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы; s является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-C10)алкила, замещенного (С1-C10)алкила, (С3-C10)циклоалкила, замещенного (С3-C10)циклоалкила, (С2-C10)алкенила, замещенного (С2-C10)алкенила, (С2-C10)алкинила, замещенного (С2-C10)алкинила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила; или R14 и R15 вместе с атомом азота, к которому они присоединены, могут быть необязательно объединены с образованием гетероциклической группы, замещенной гетероциклической группы, гетероарила или замещенного гетероарила;
q представляет собой целое число, равное 1, 2 или 3; и
их фармацевтически приемлемые соли или таутомеры.
В еще одном другом варианте представлены соединения, имеющие формулу XII:
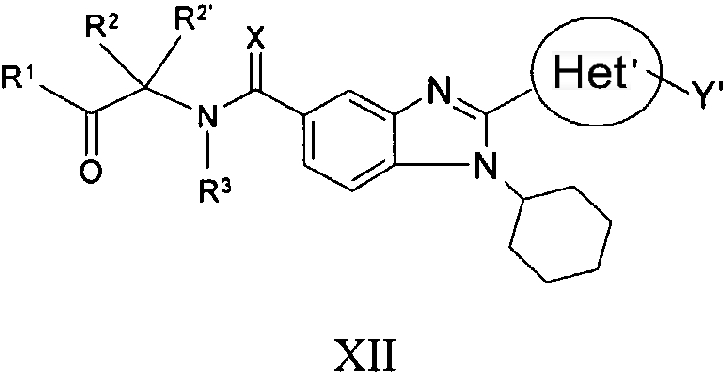
в которой Х выбран из группы, состоящей из =О, =S и =NR11, где R11 представляет собой водород или алкил, R1 выбран из группы, состоящей из -OR7 и -NR8R9, где R7 выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы; R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы, или, альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую, замещенную гетероциклическую, гетероарильную или замещенную гетероарильную циклическую группу;
каждый R2 и R2' независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы,
или альтернативно, определенные выше R2 и R2', взятые вместе с атомом углерода, к которому они присоединены, образуют циклическую группу,
R3 выбран из группы, состоящей из водорода и алкила, или, когда R2 и R2' не взяты вместе с образованием цикла, тогда R3 может быть взят вместе с одним из R2 и R2' с образованием гетероциклической или замещенной гетероциклической группы;
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов, необязательно замещенных Y; при условии что, по меньшей мере, один 6-членный цикл в бицикле является ароматическим;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила; и
их фармацевтически приемлемые соли и/или таутомеры.
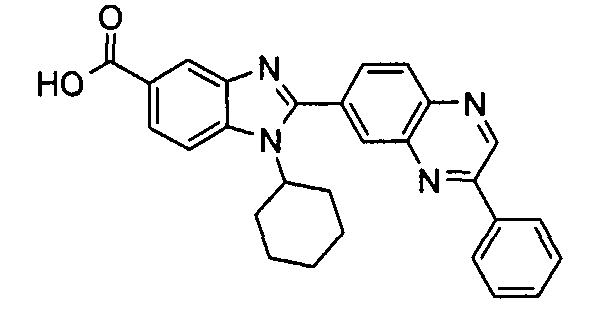
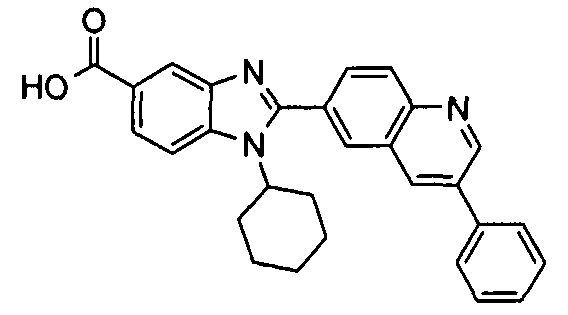
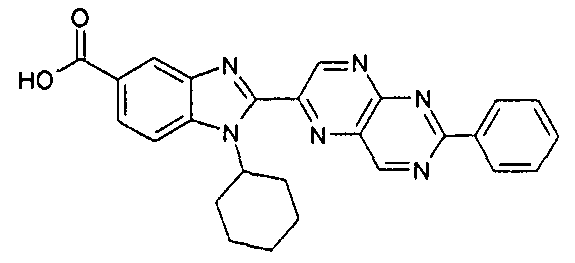
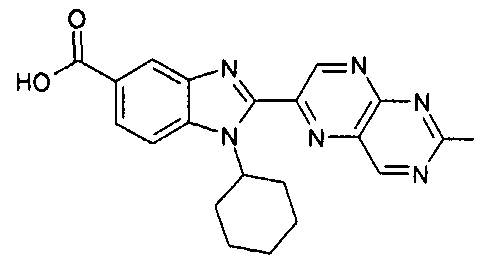
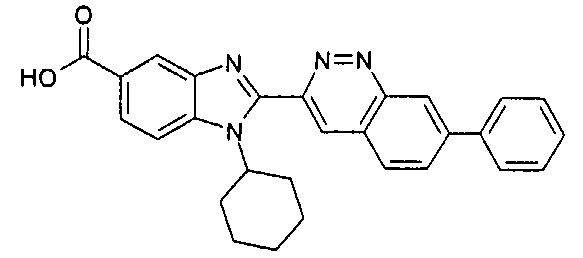
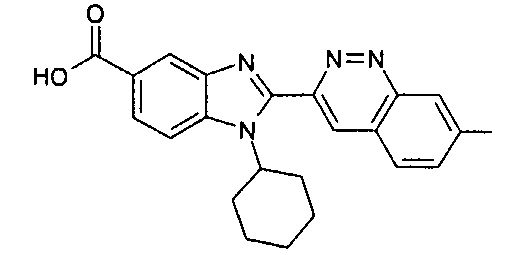
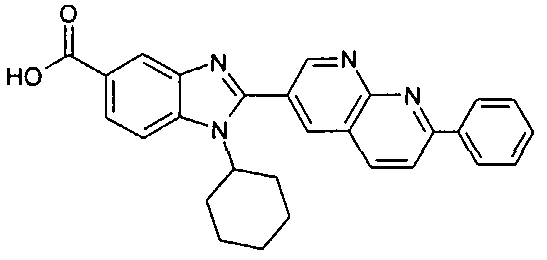
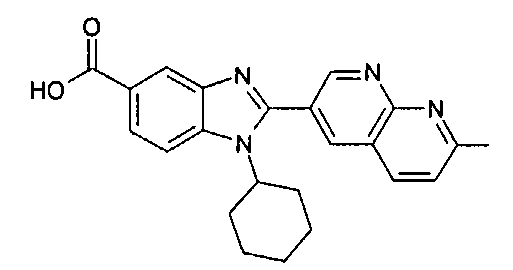
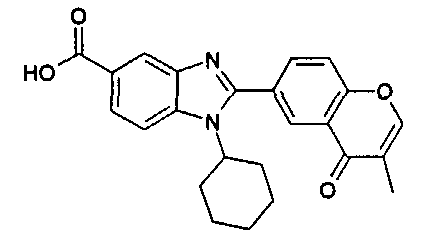
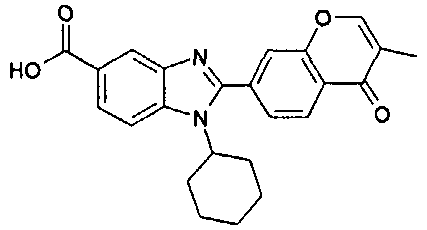
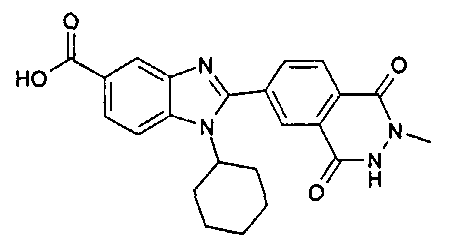
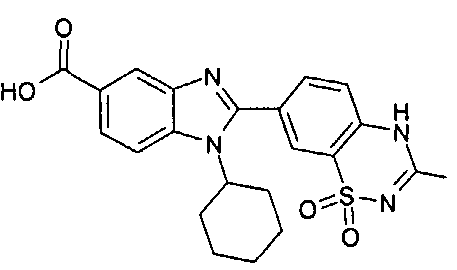
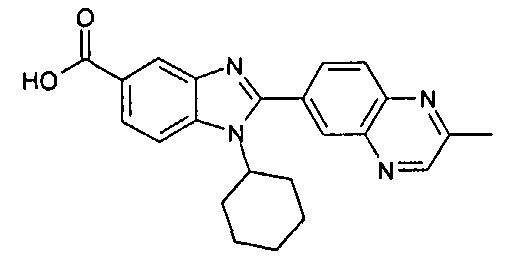
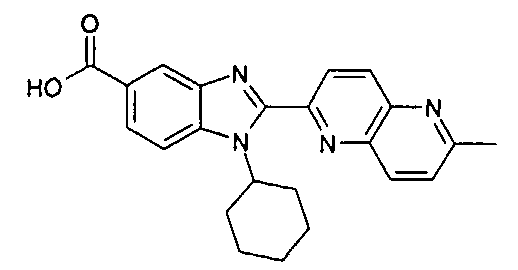
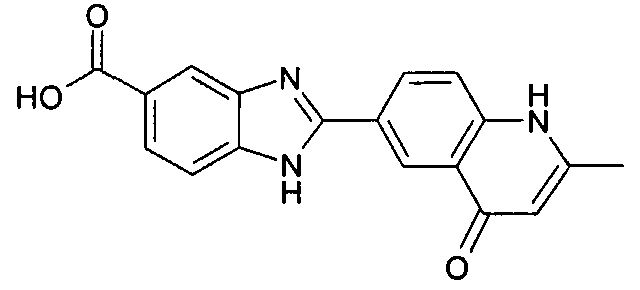
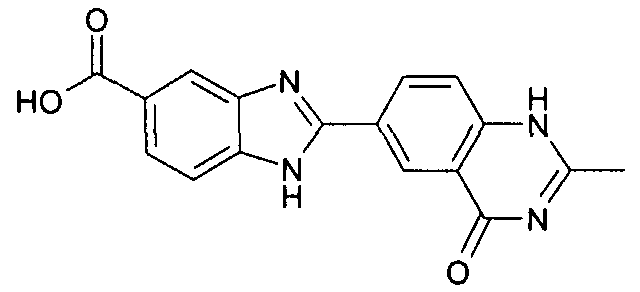
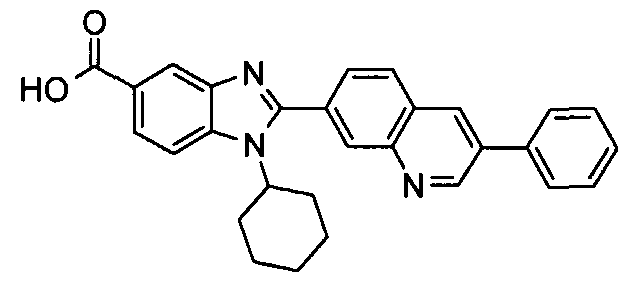
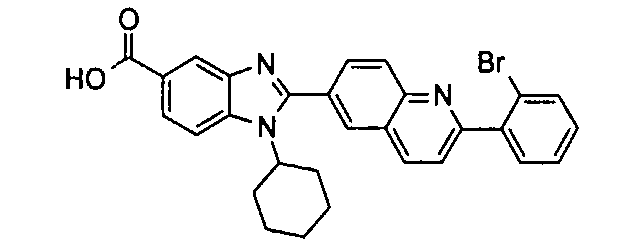
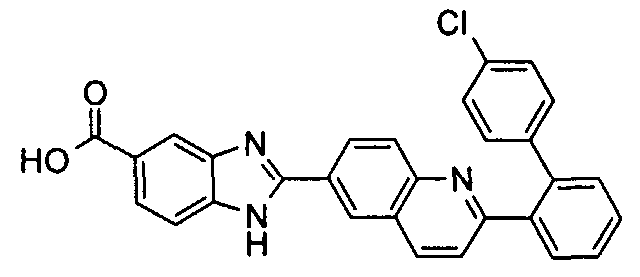
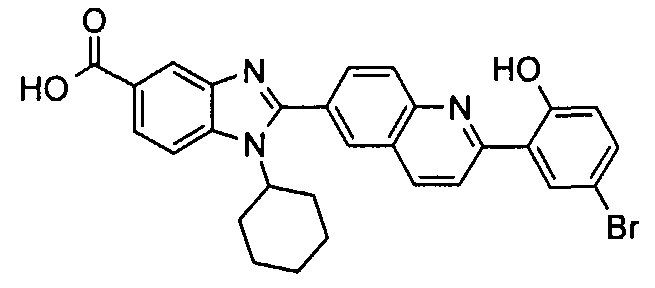
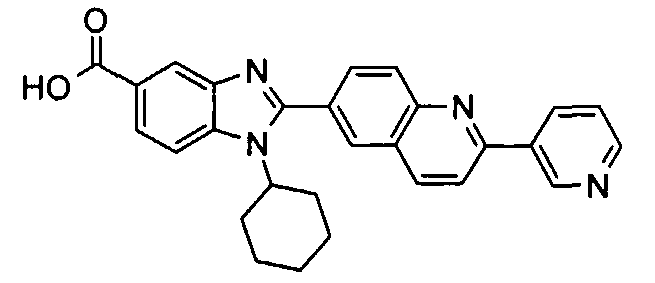
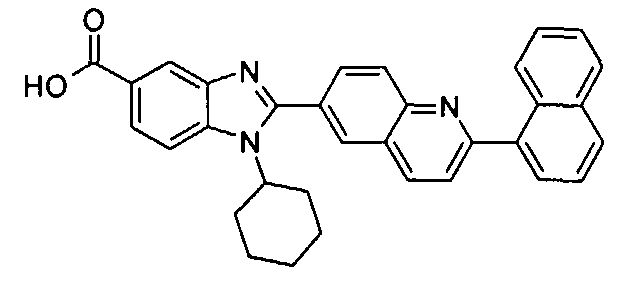
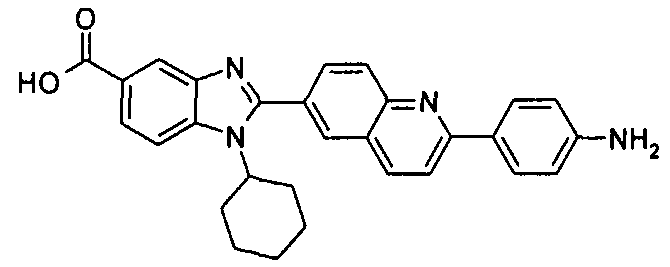
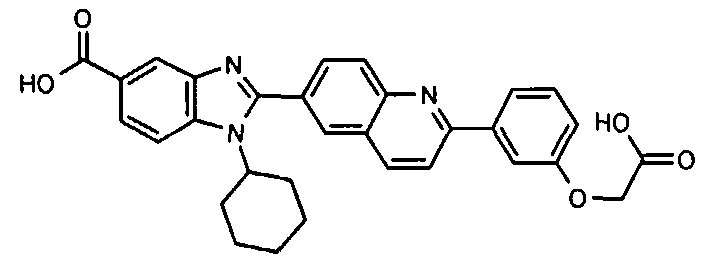
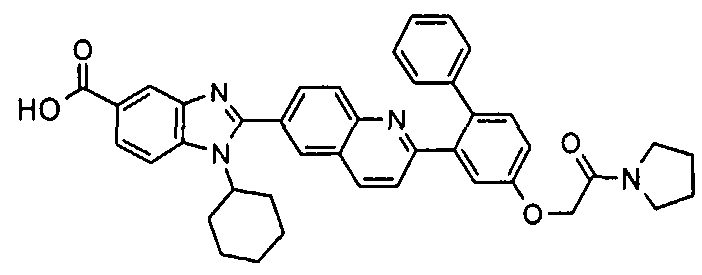
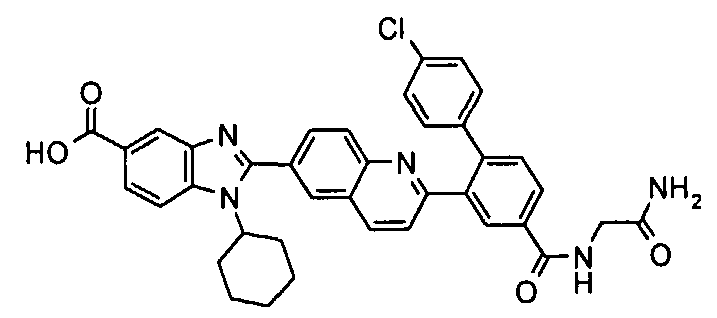
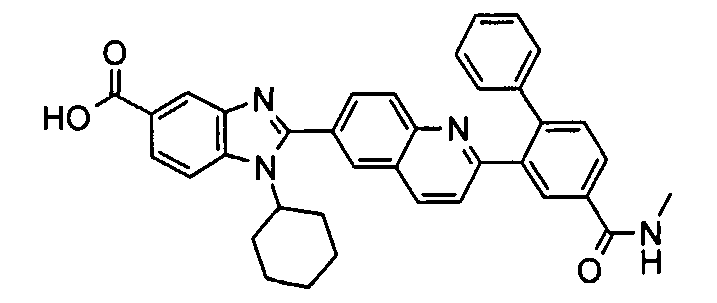
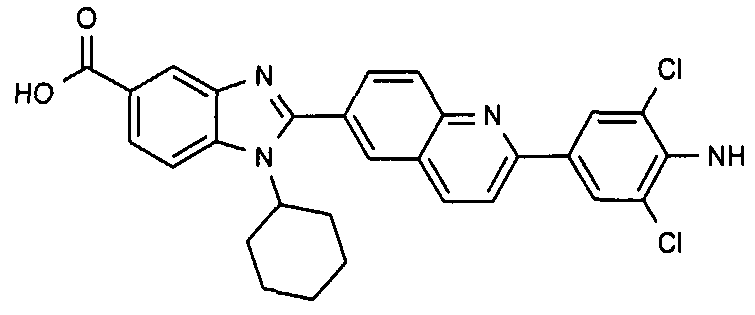
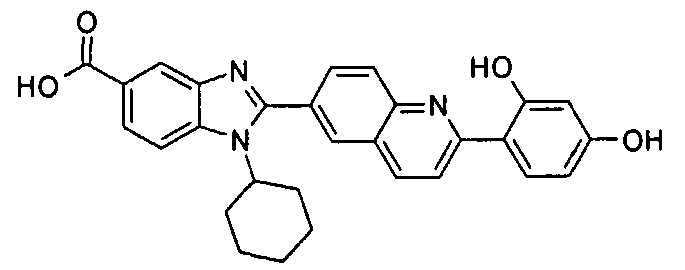
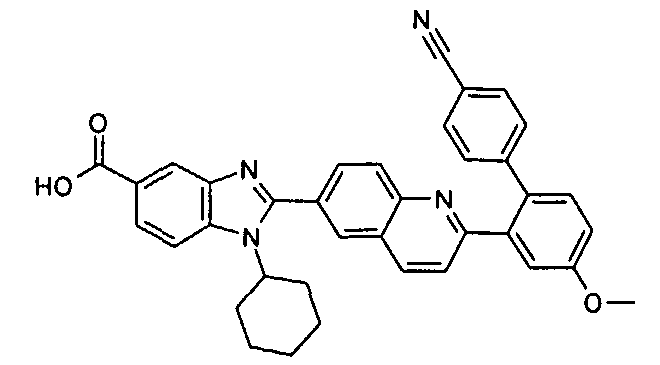
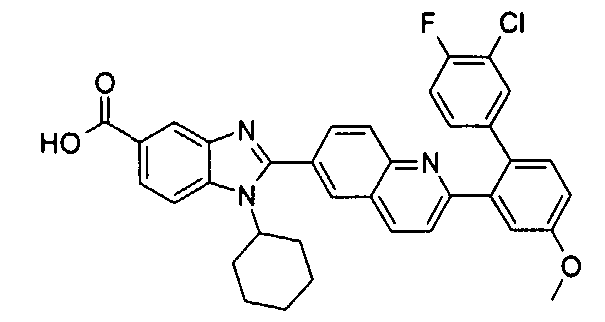
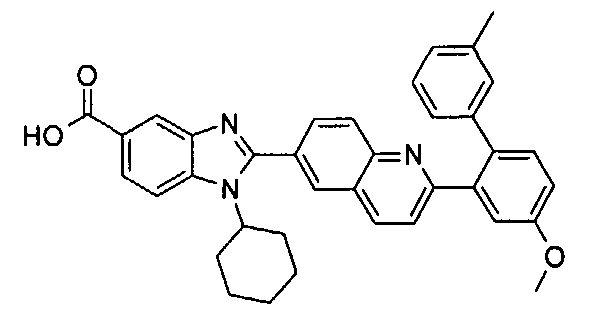
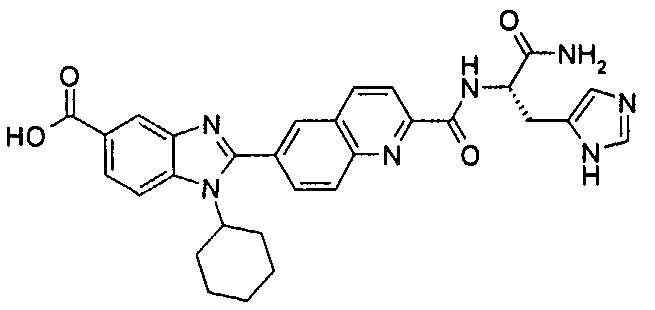
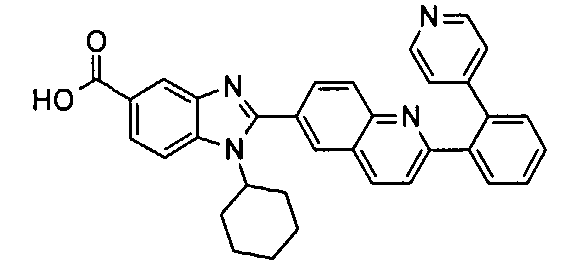
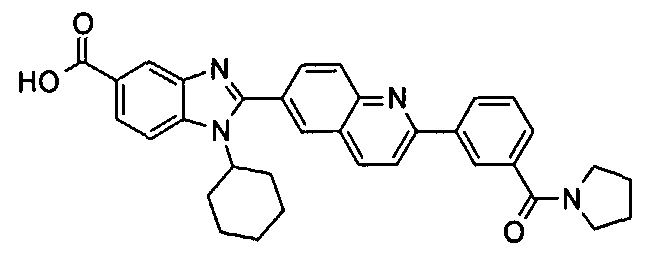
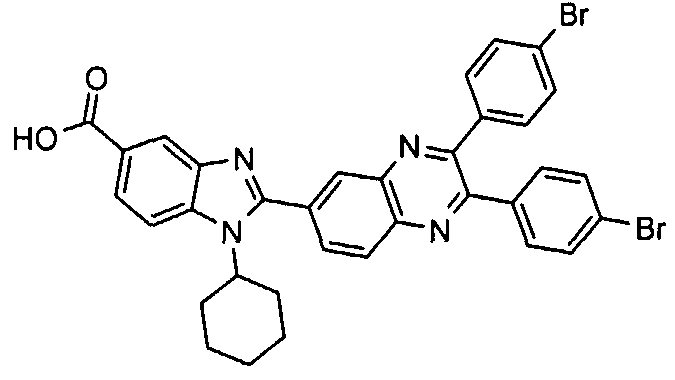
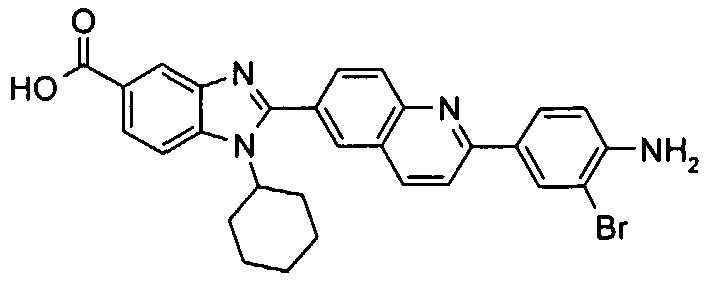
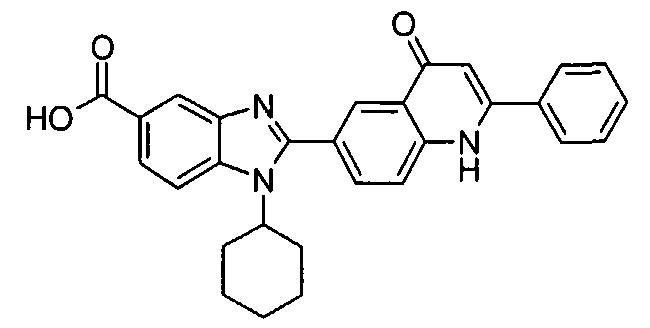
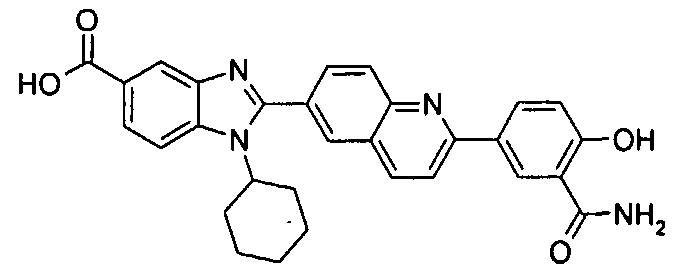
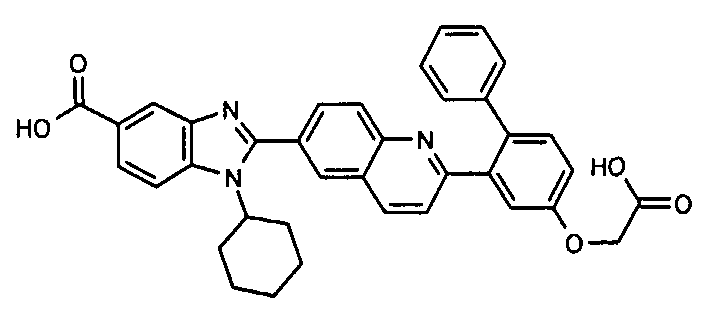
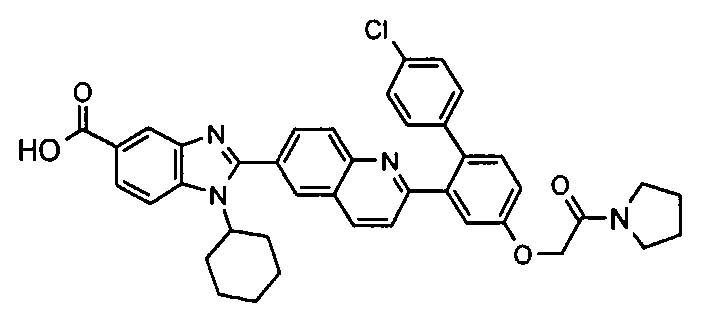
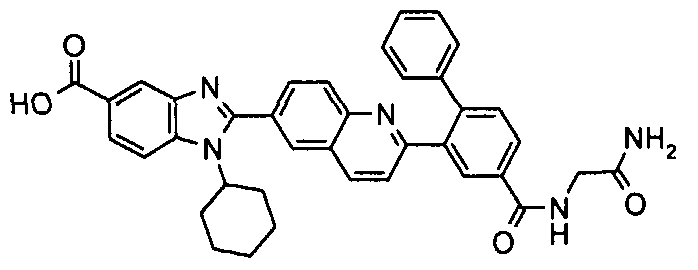
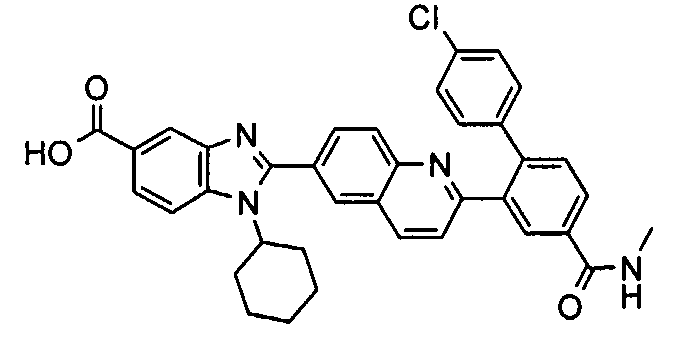
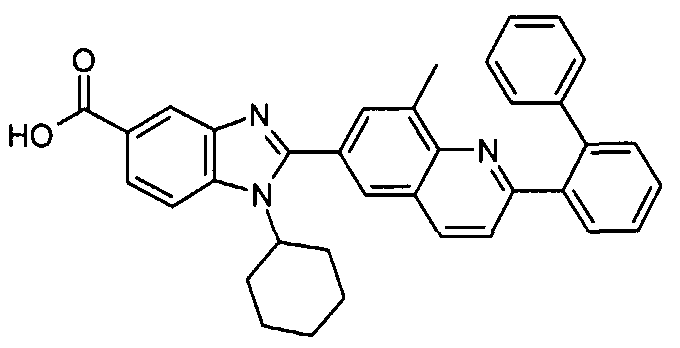
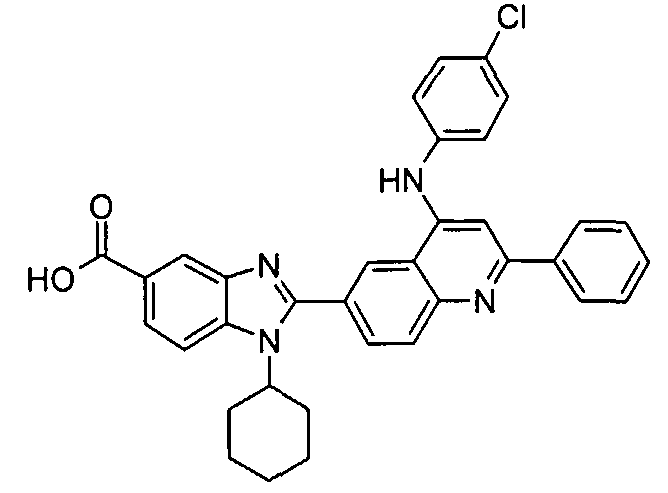
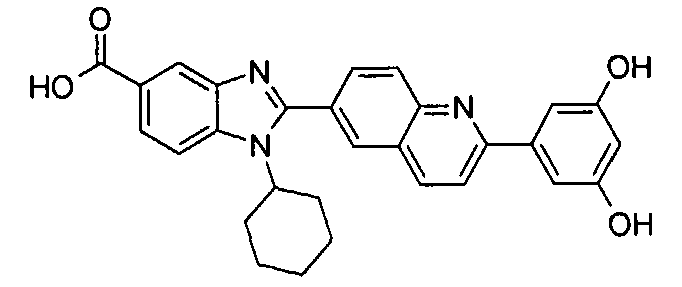
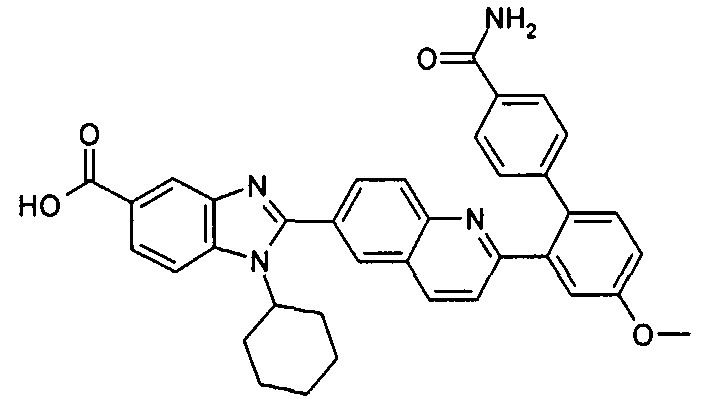
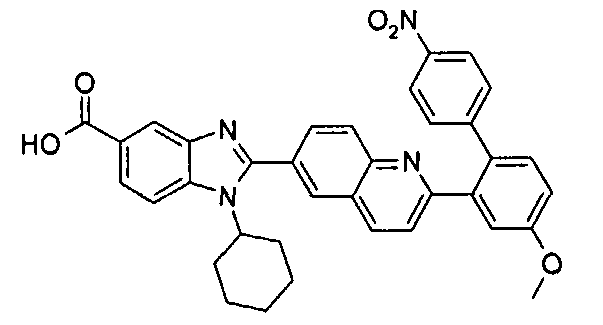
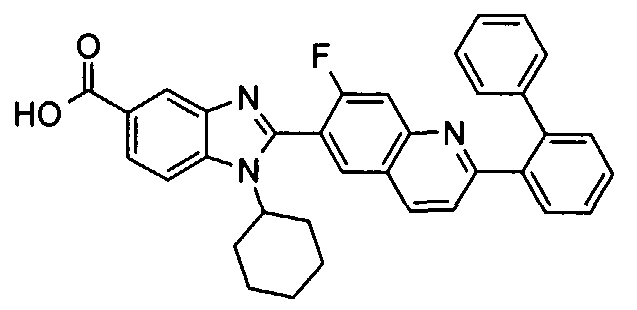
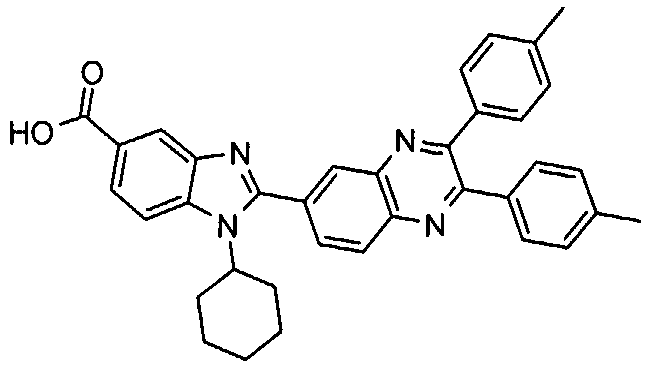
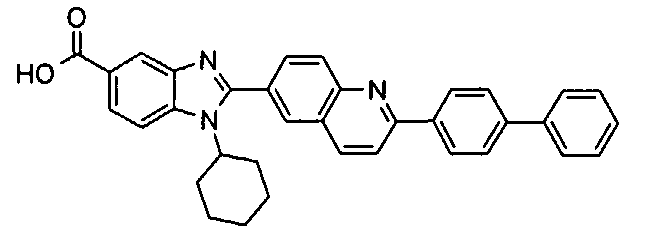
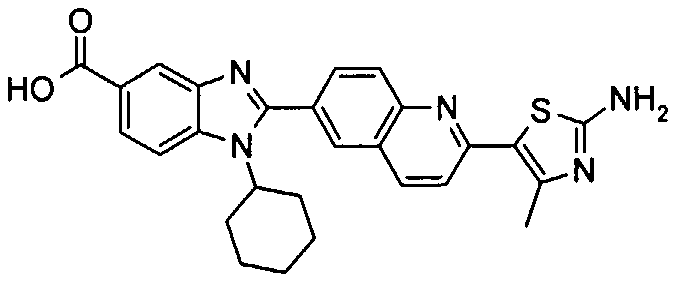
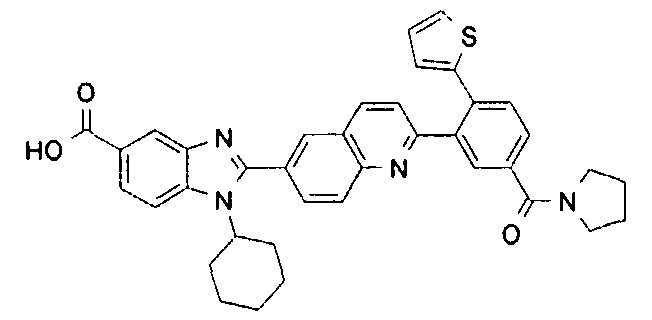
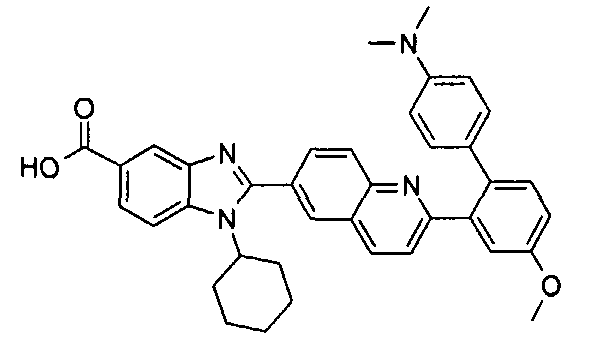
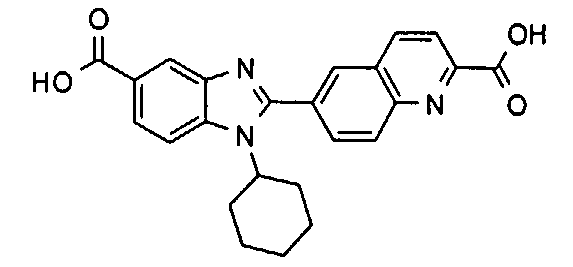
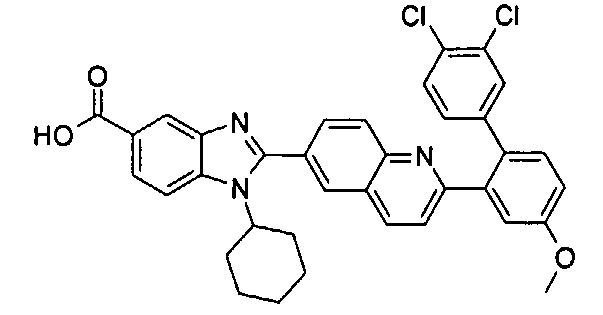
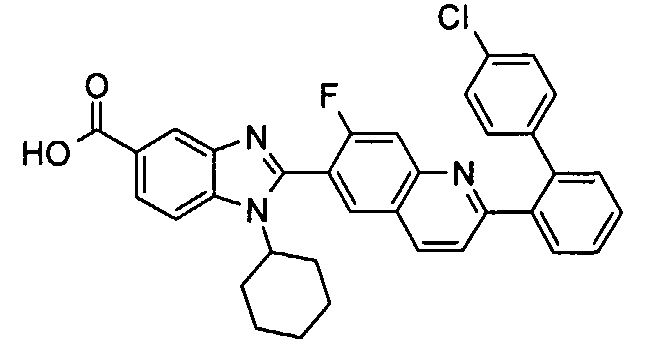
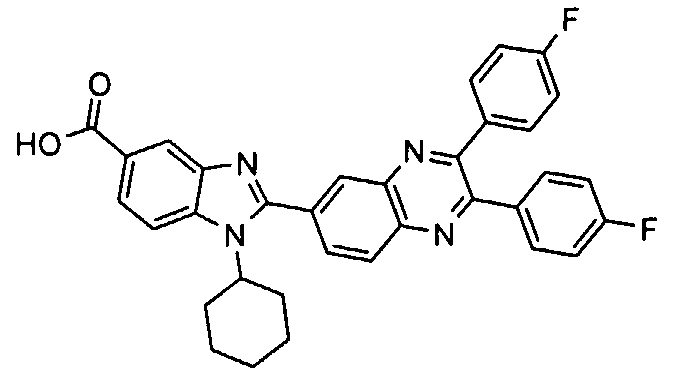
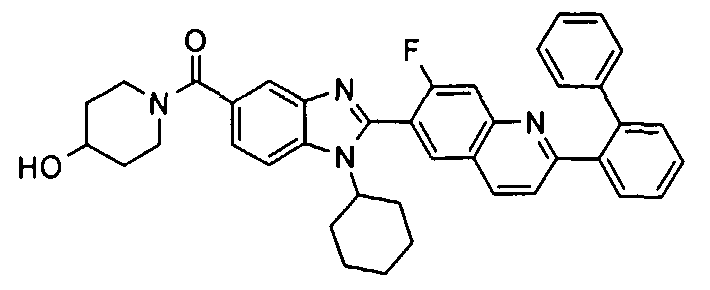
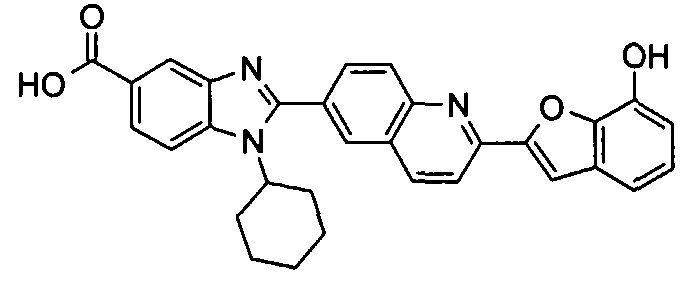
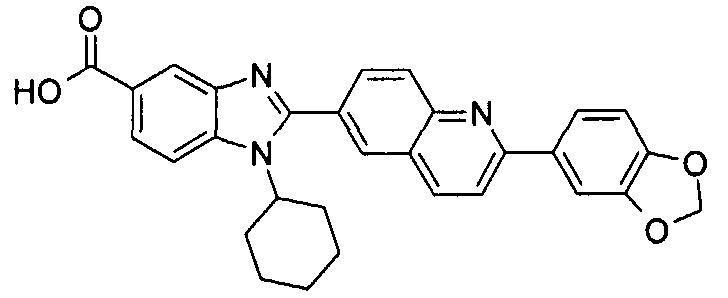
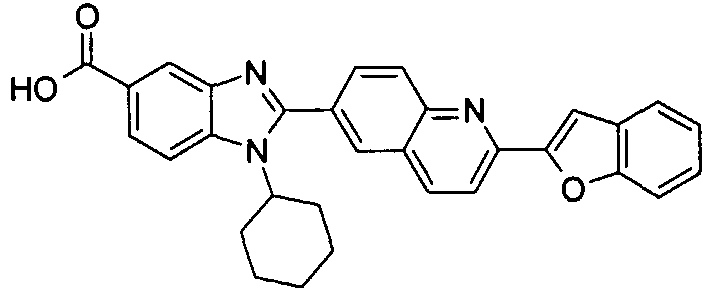
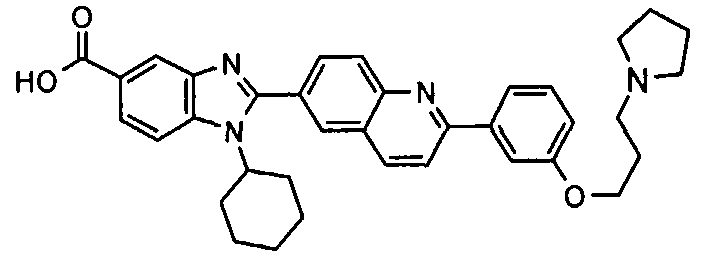
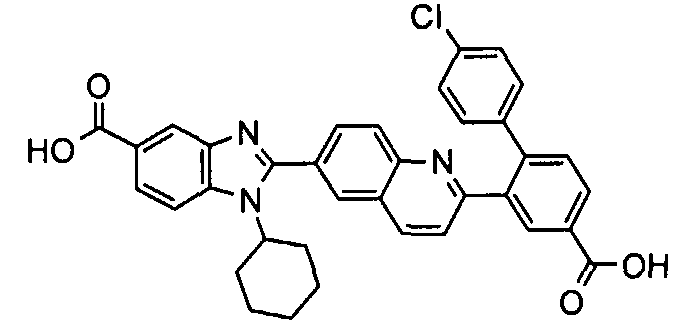
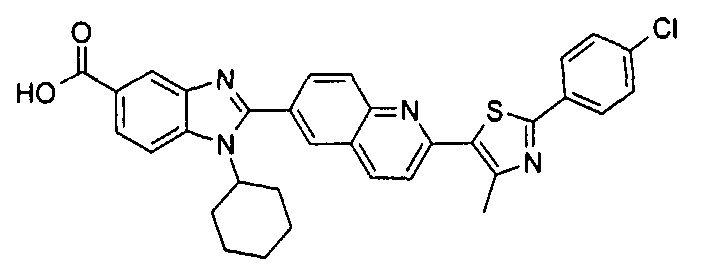
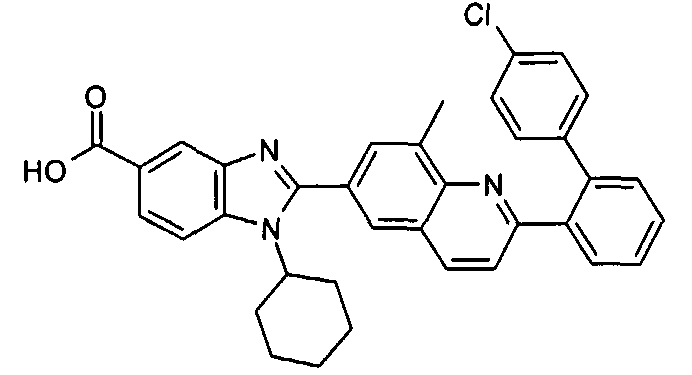
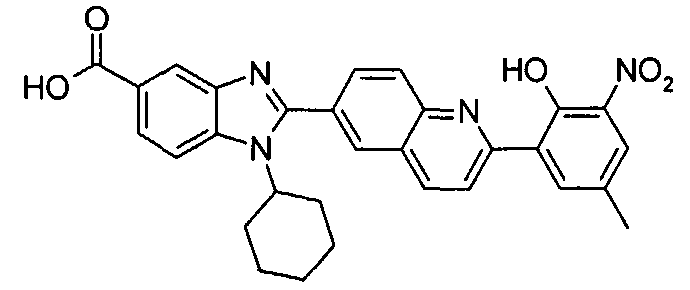
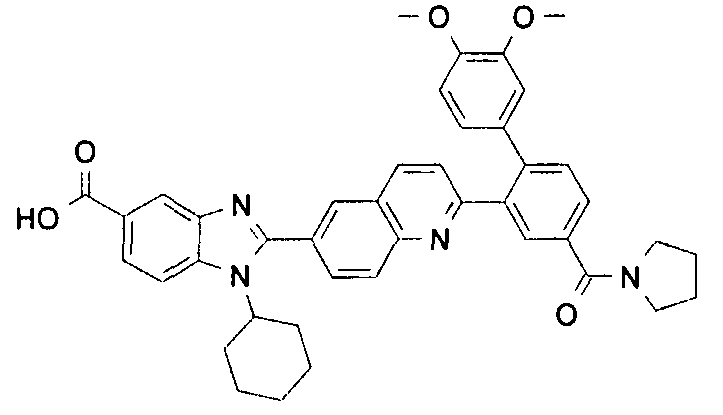
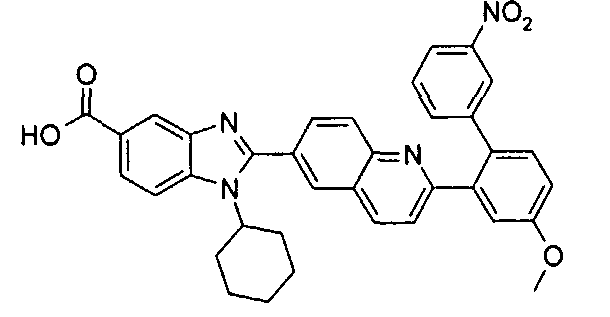
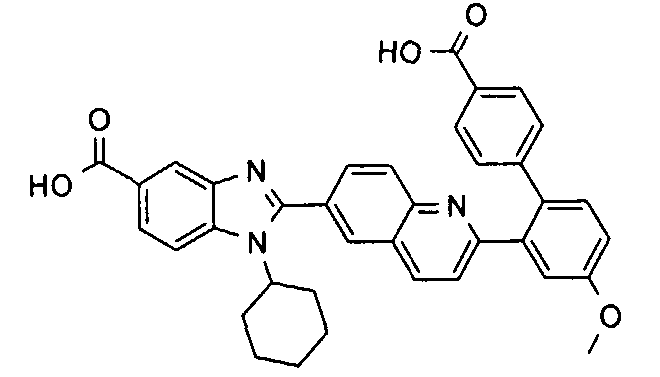
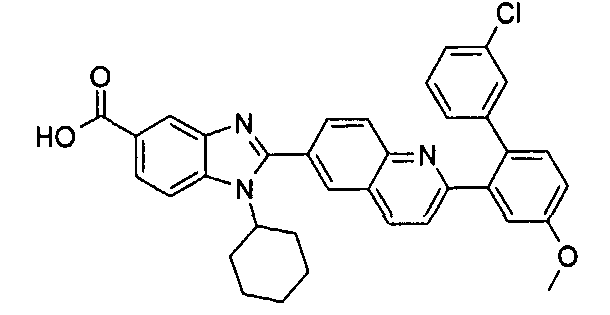
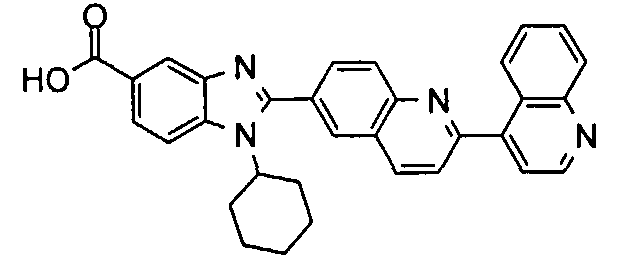
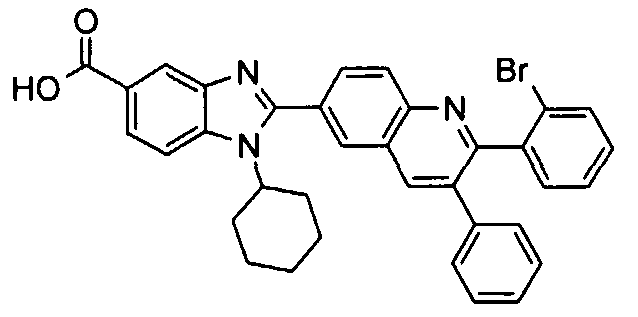
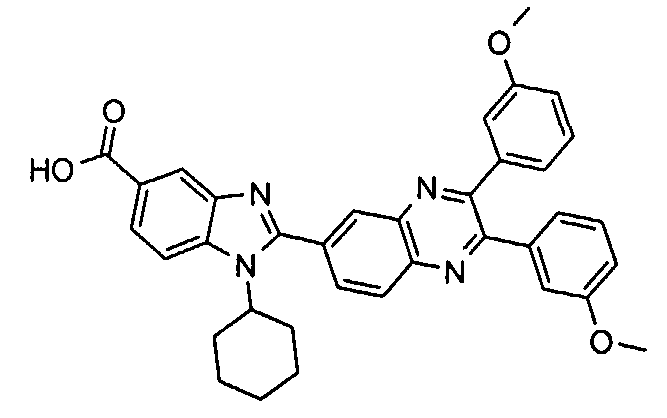
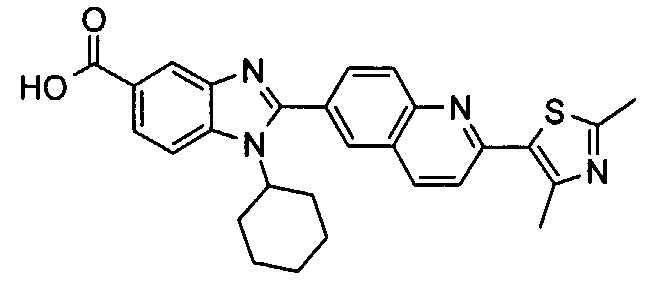
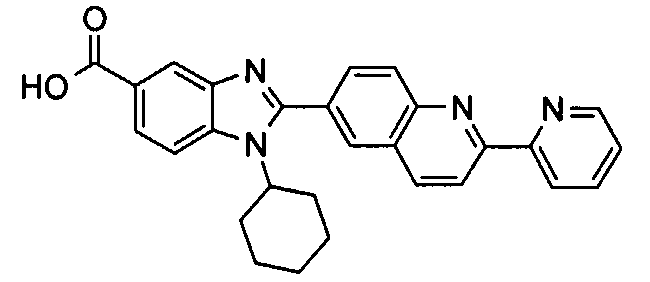
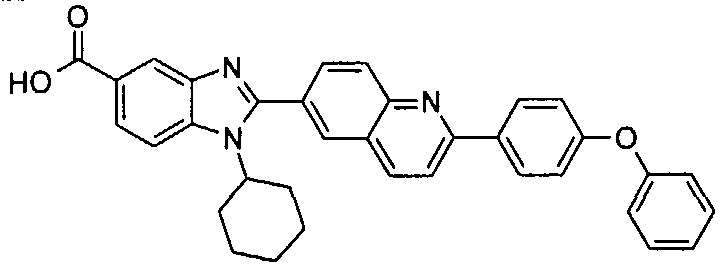
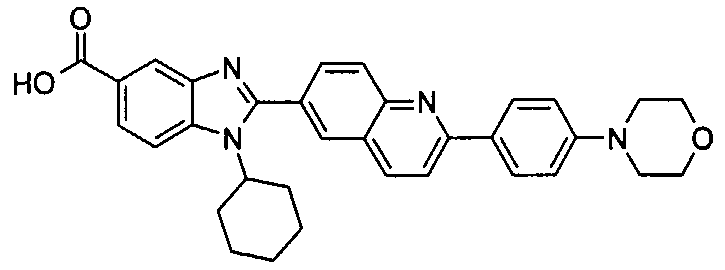
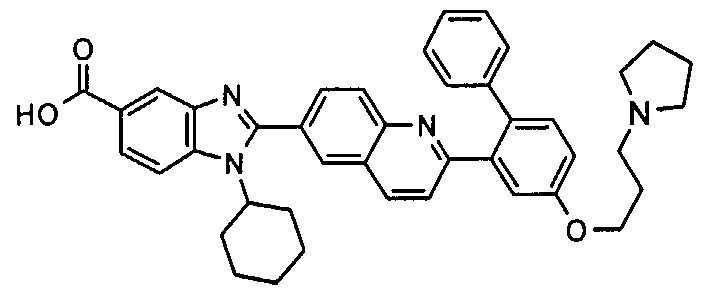
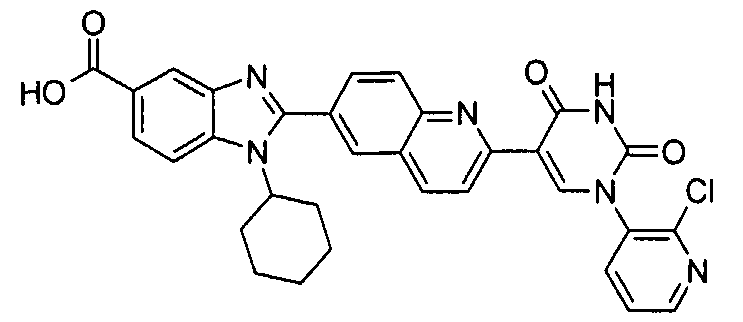
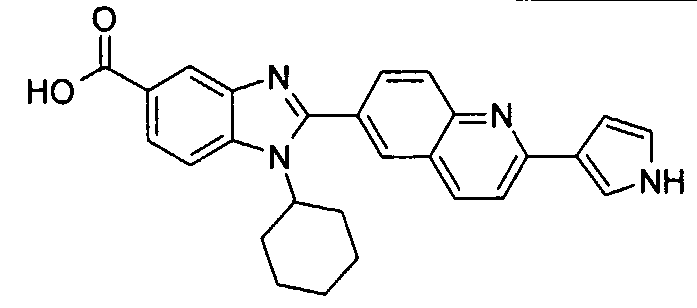
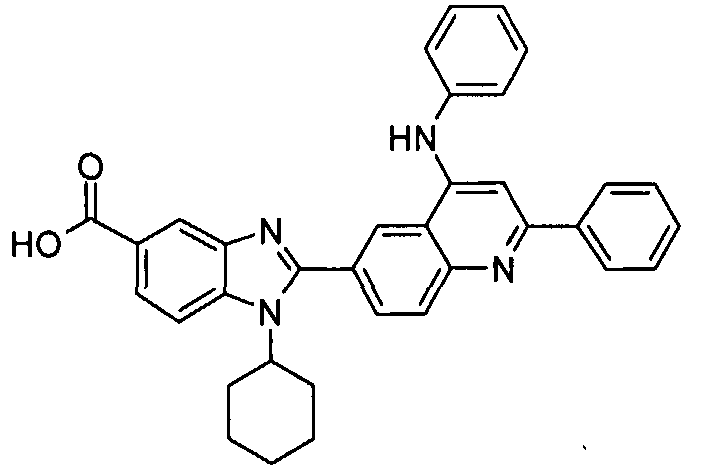
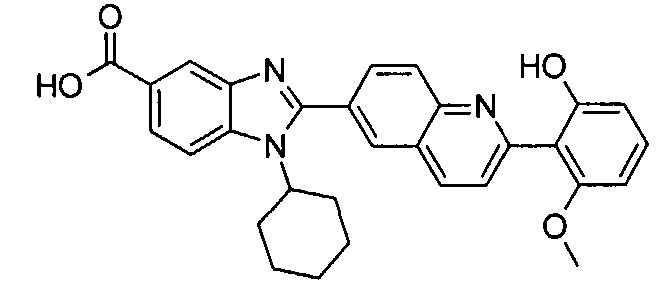
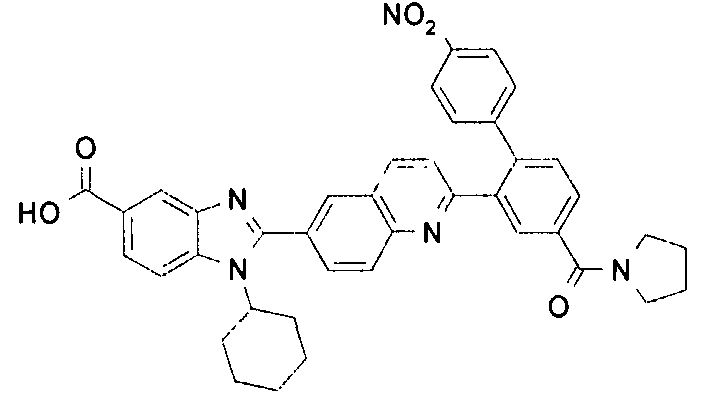
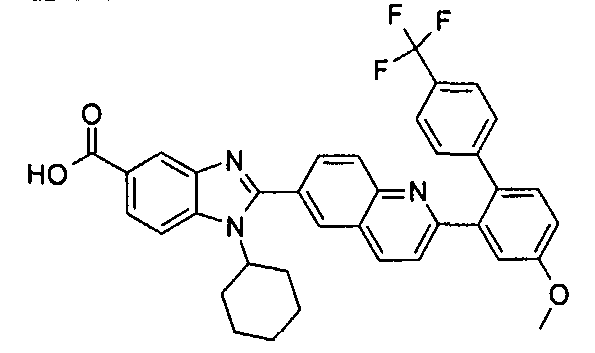
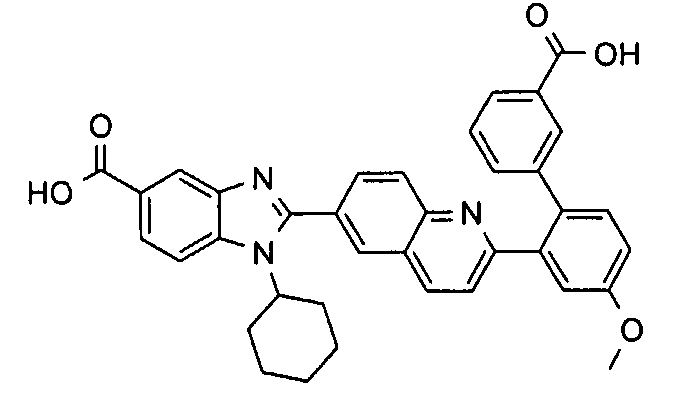
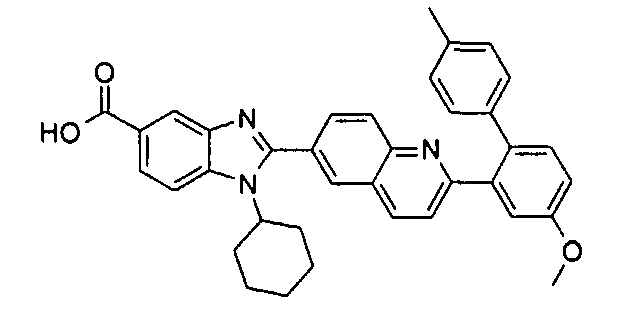
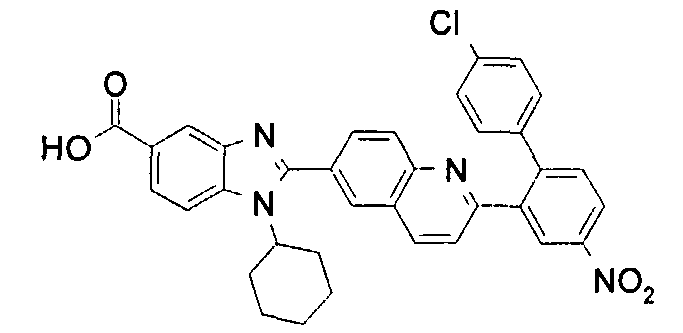
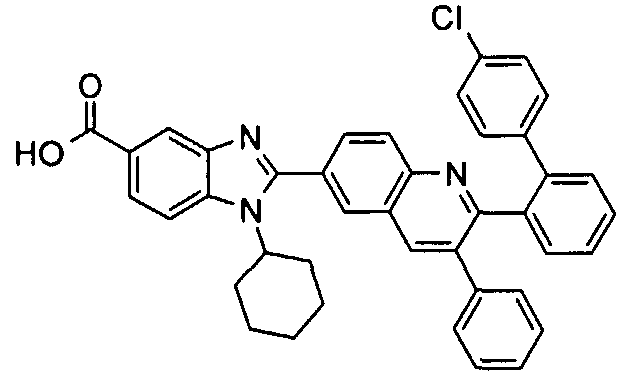
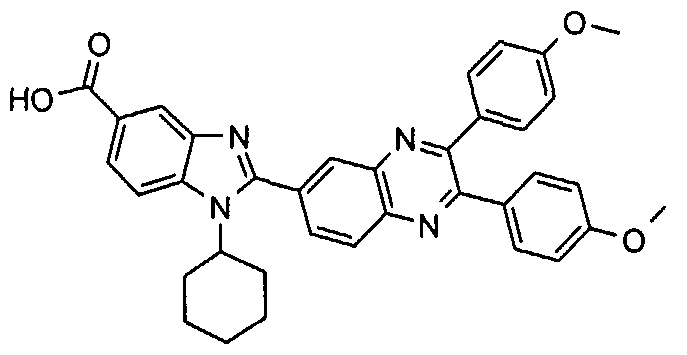
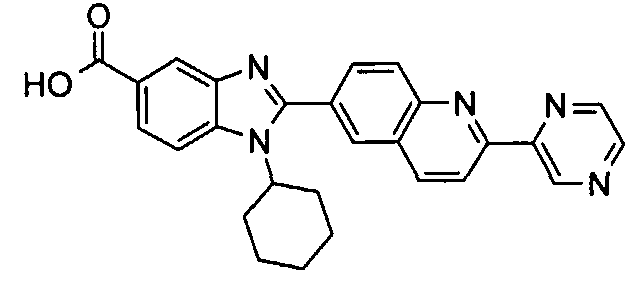
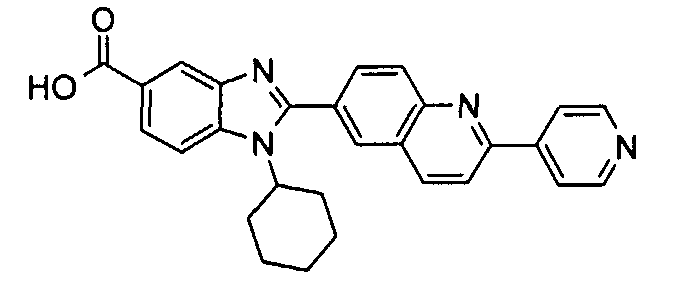
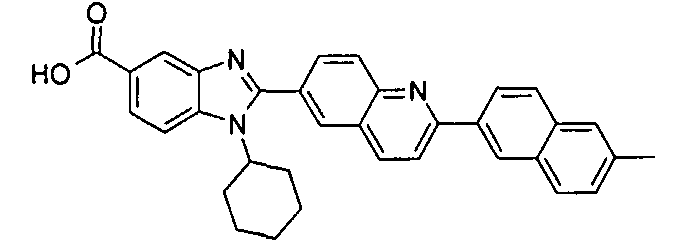
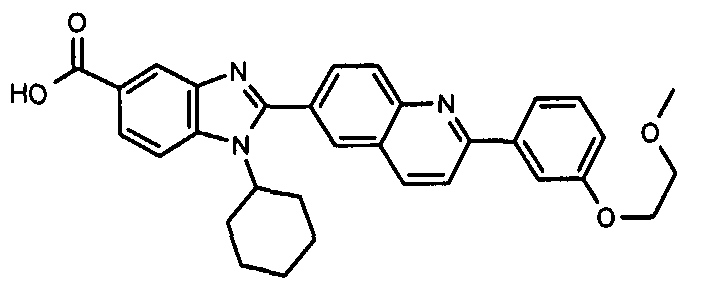
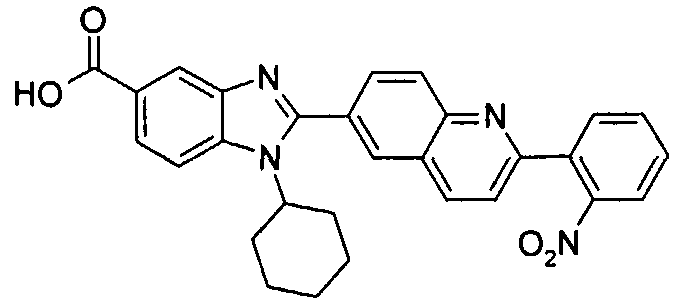
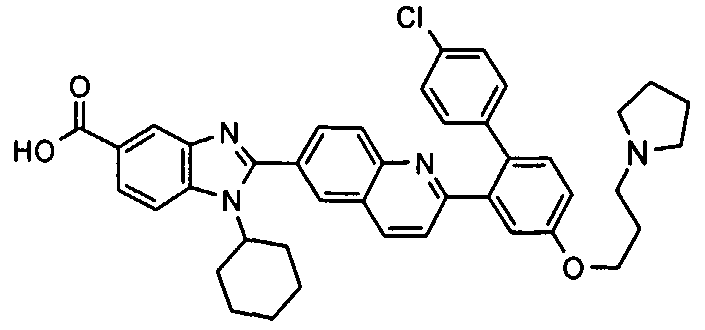
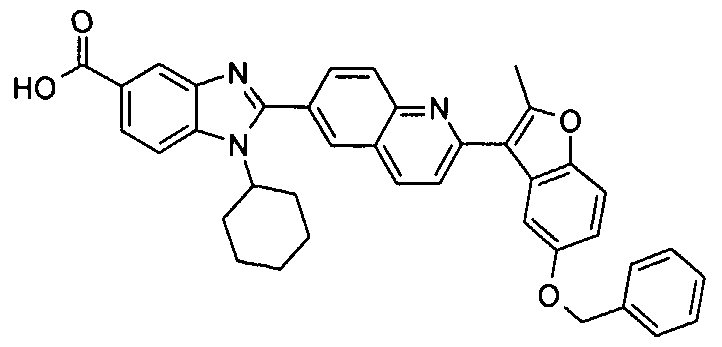
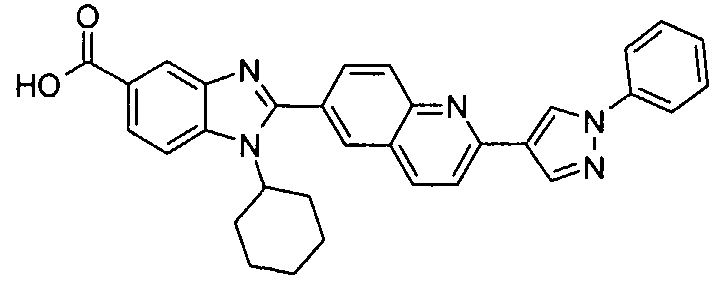
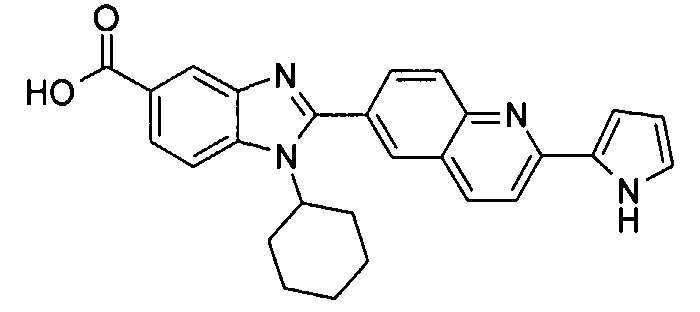
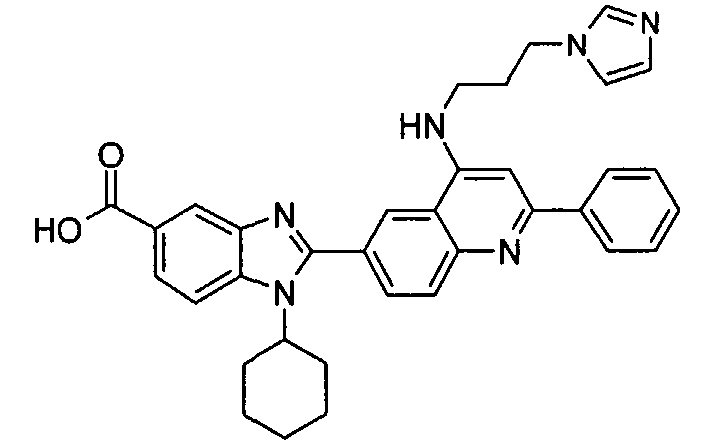
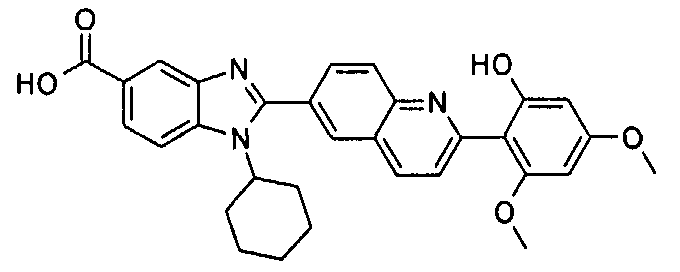
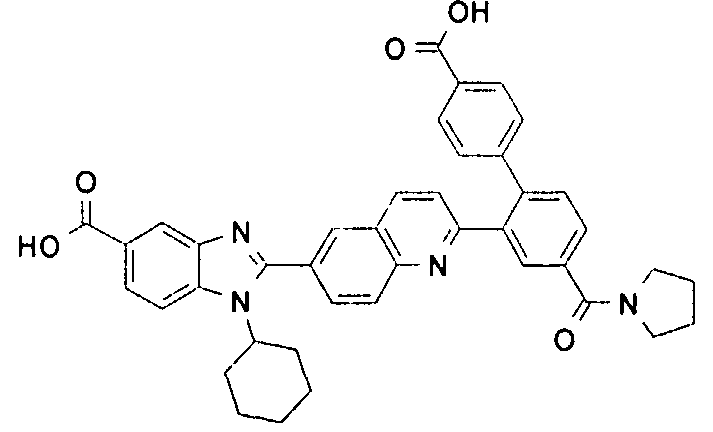
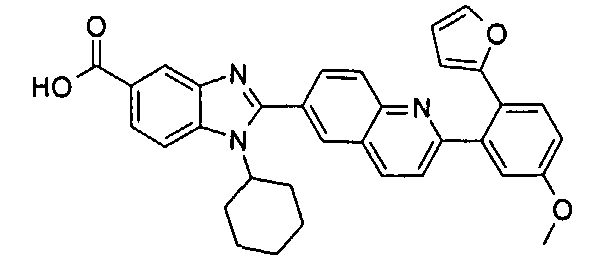
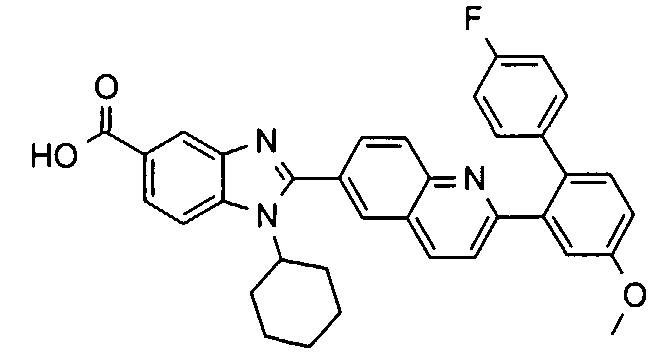
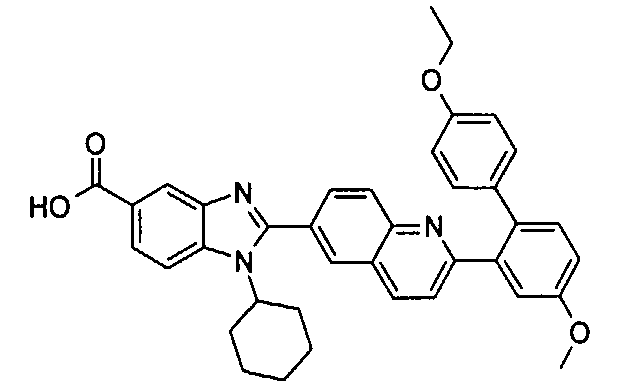
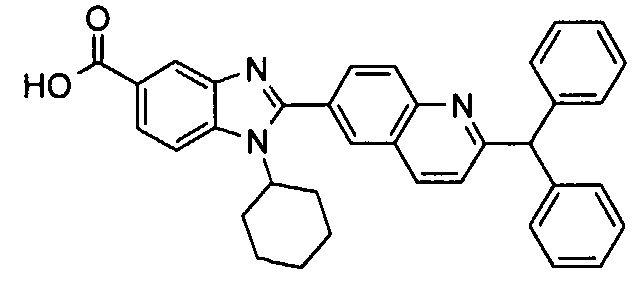
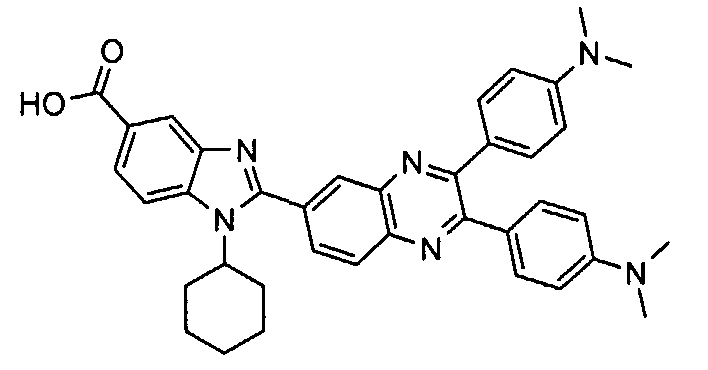
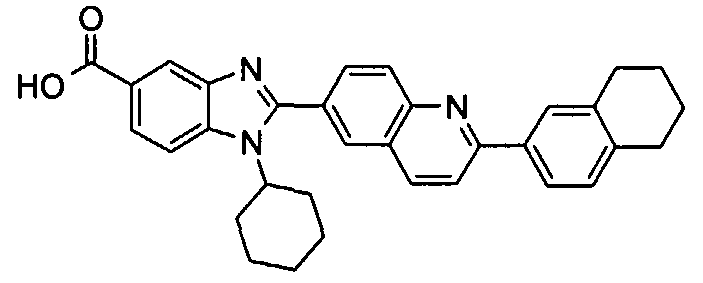
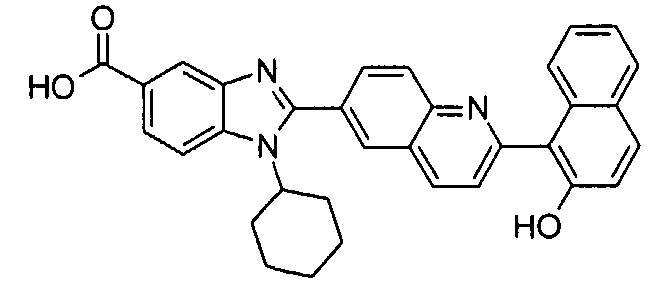
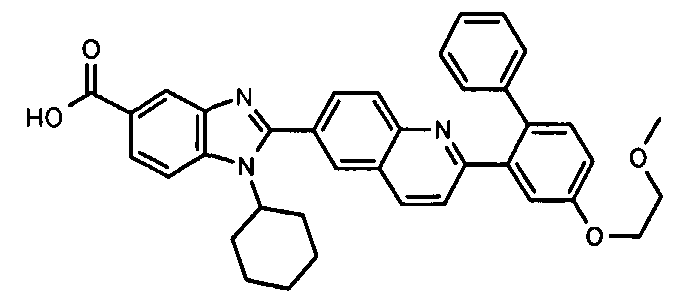
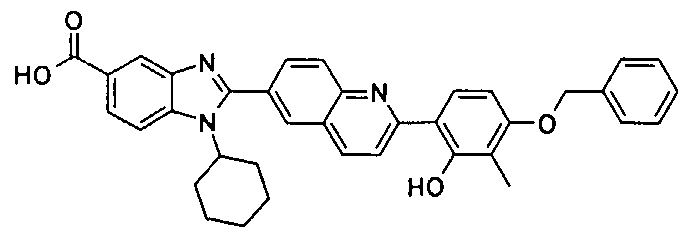
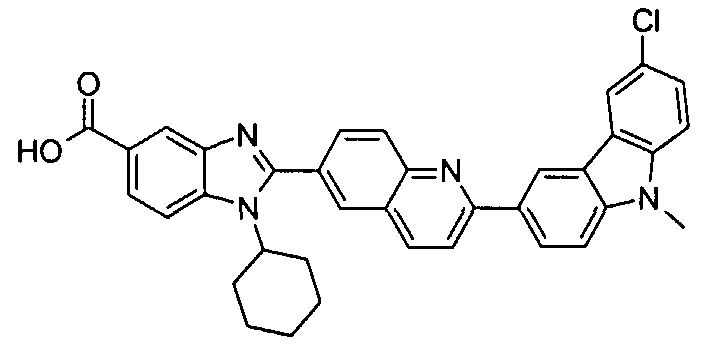
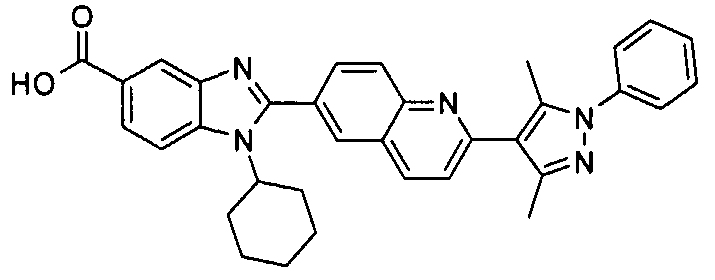
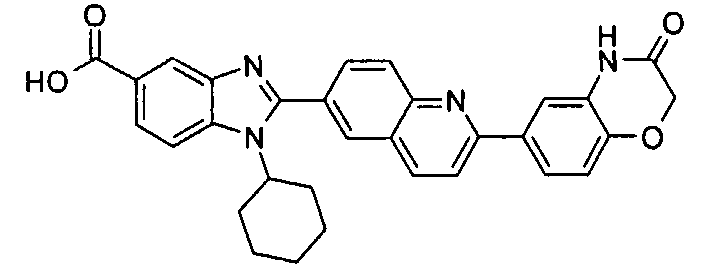
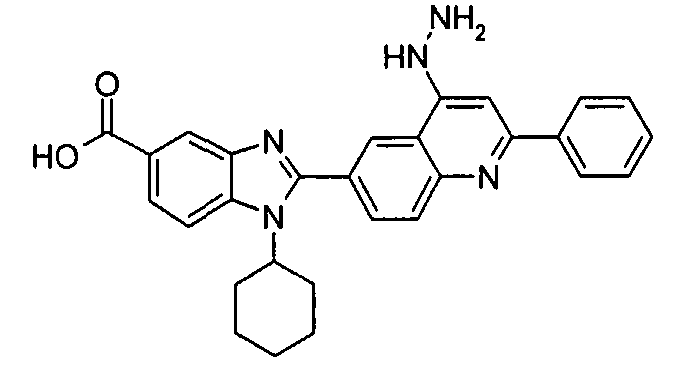
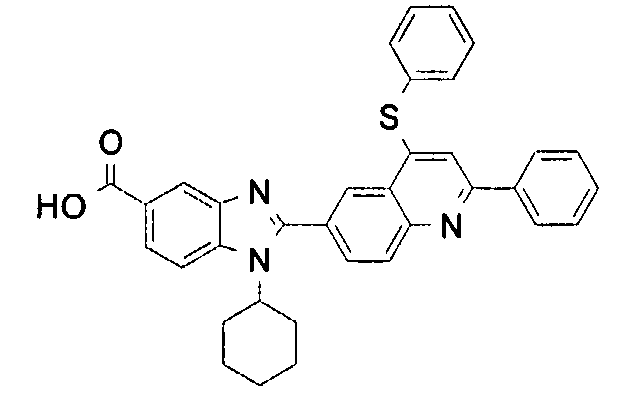
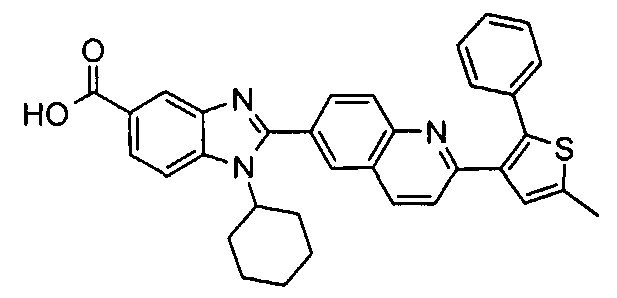
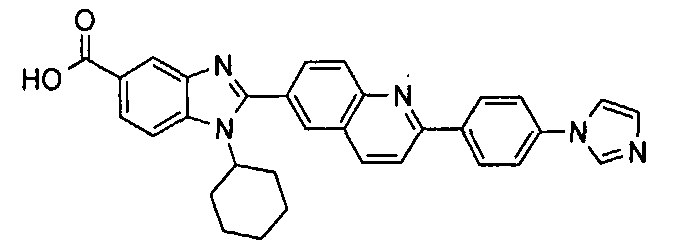
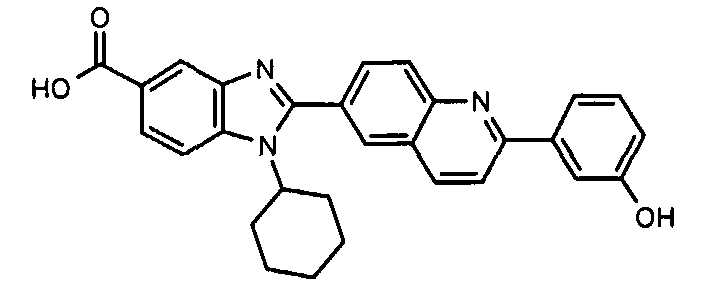
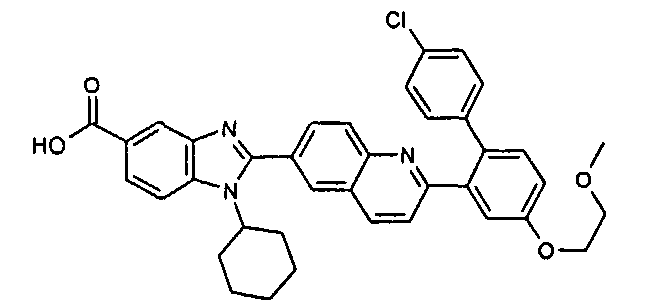
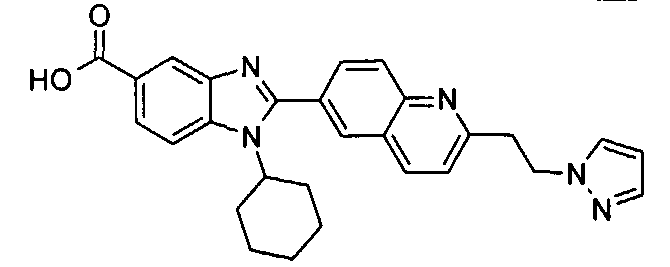
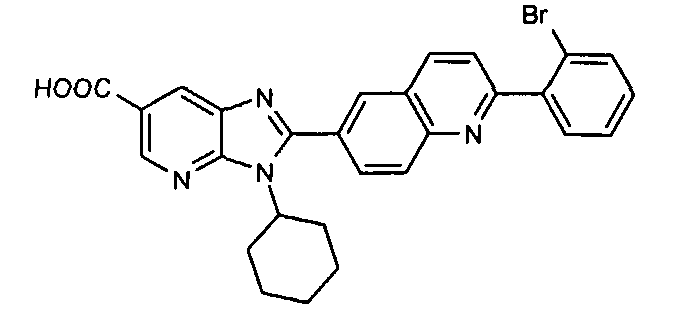
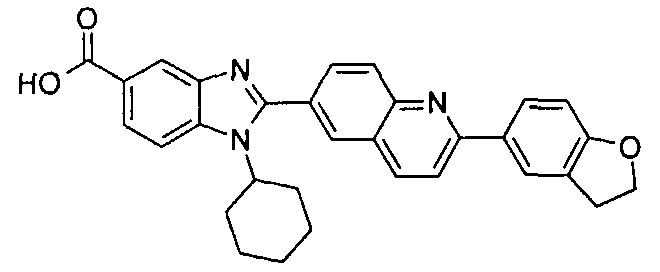
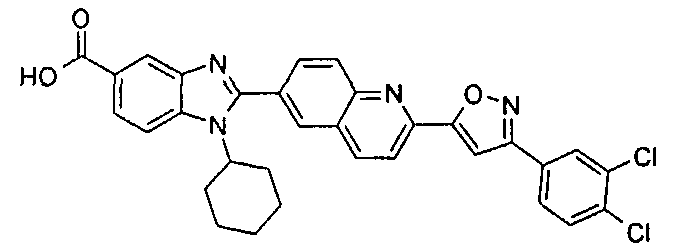
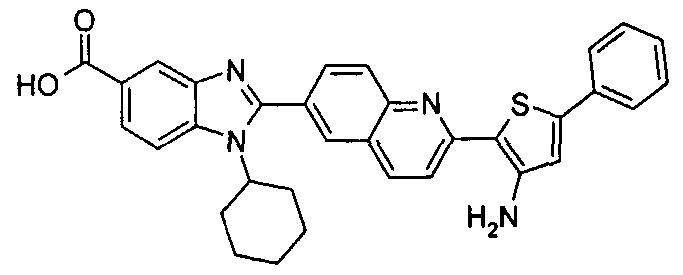
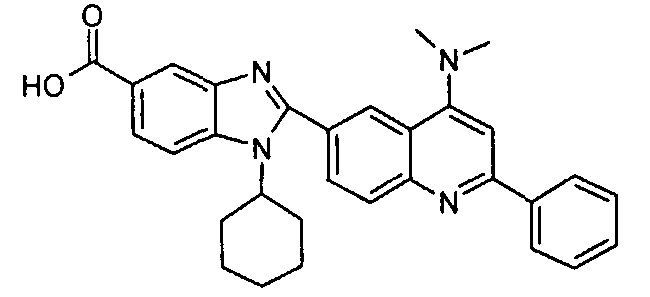
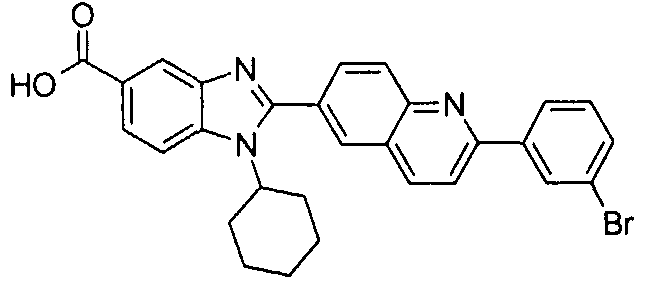
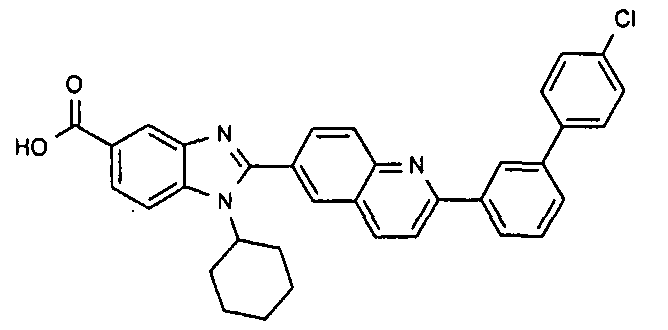
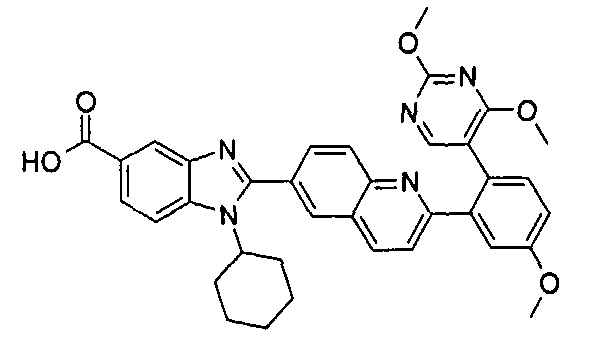
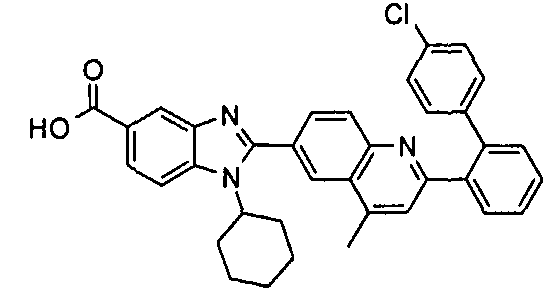
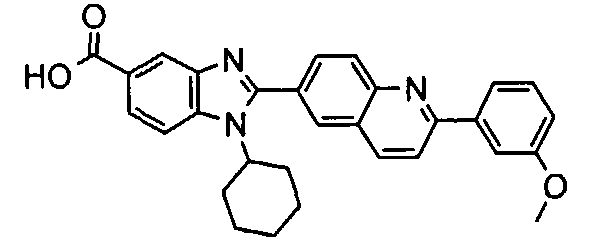
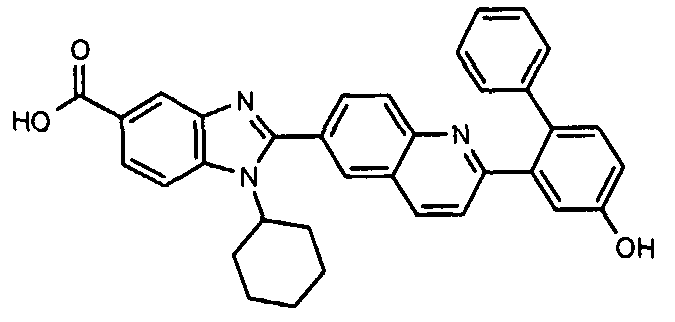
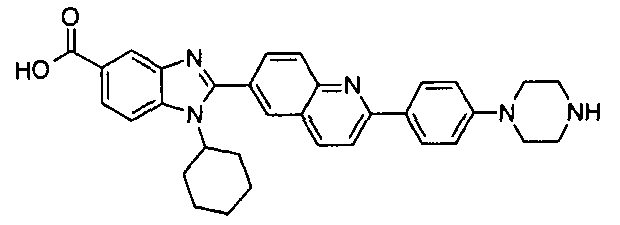
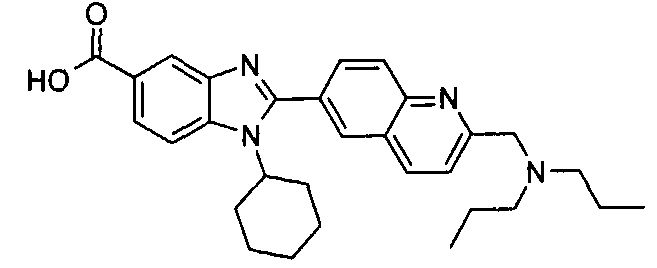
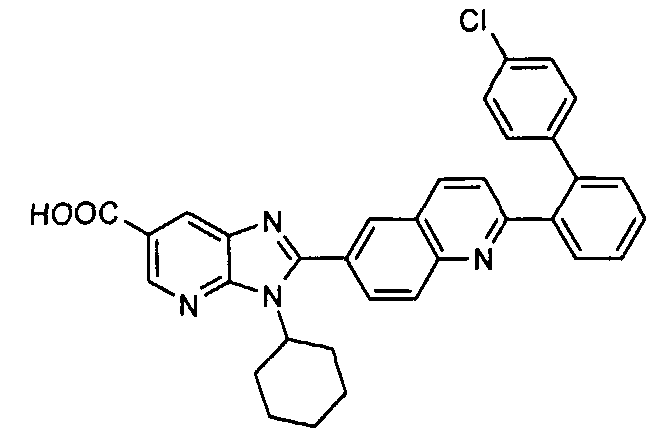
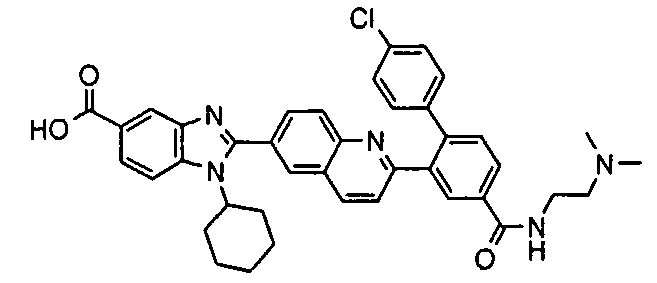
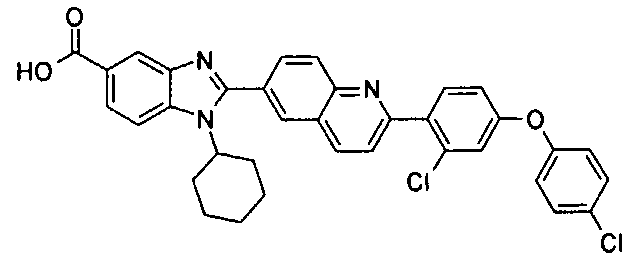
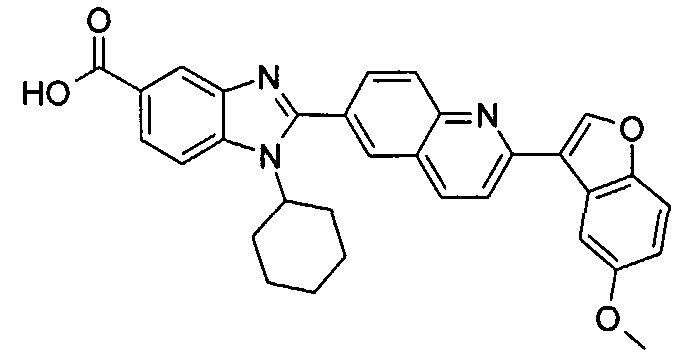
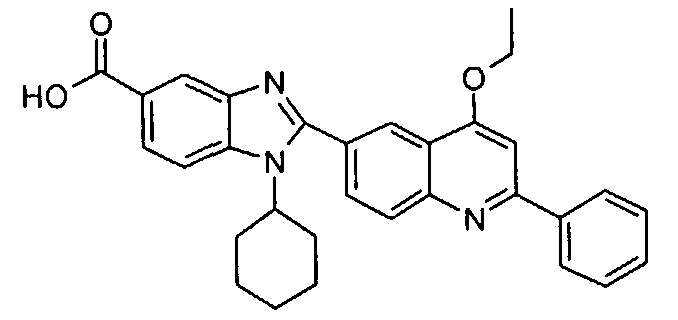
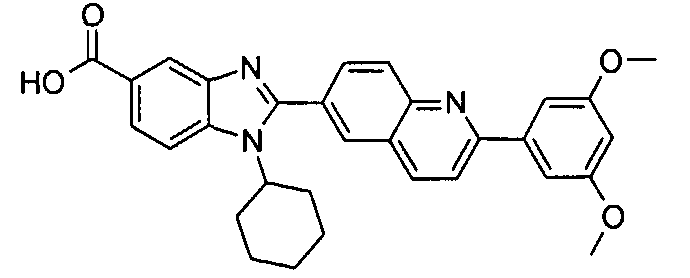
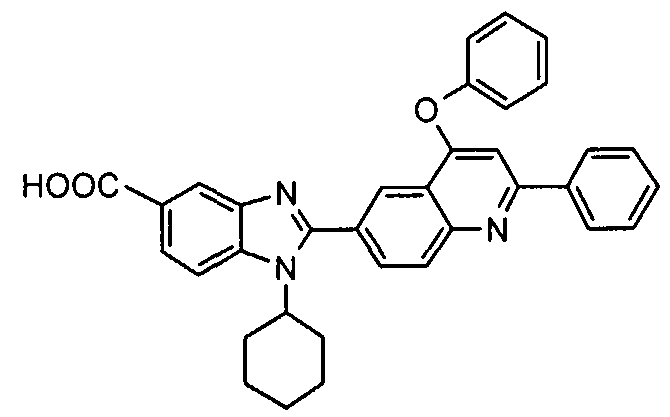
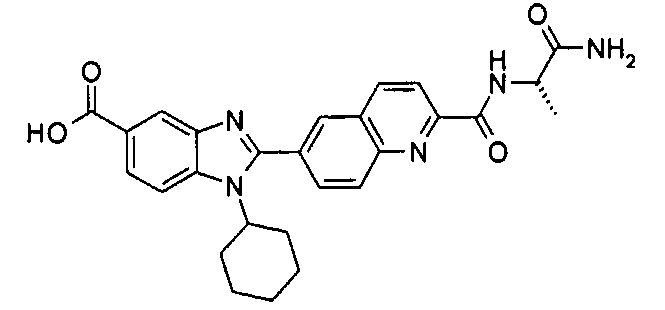
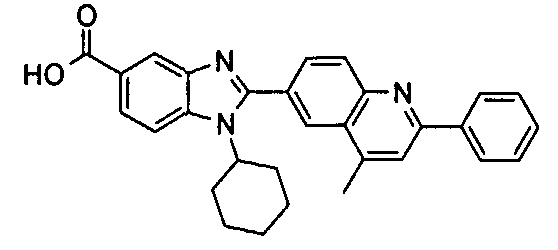
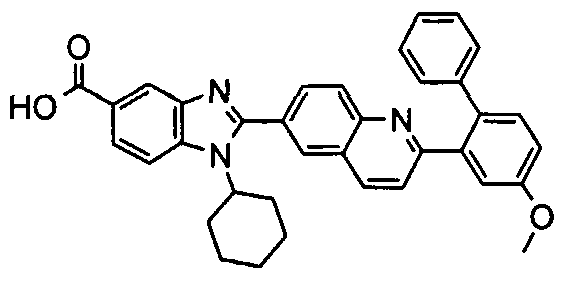
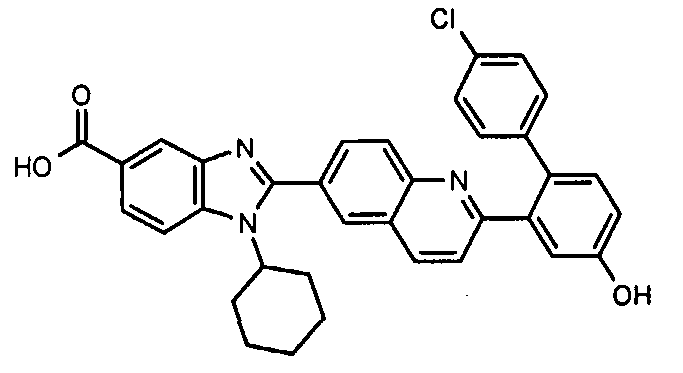
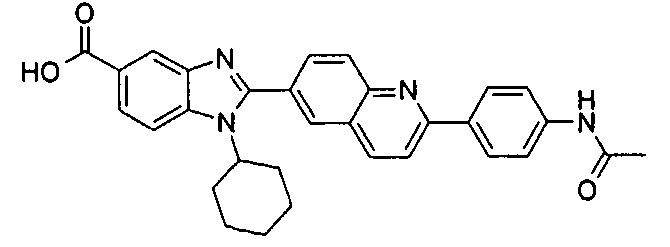
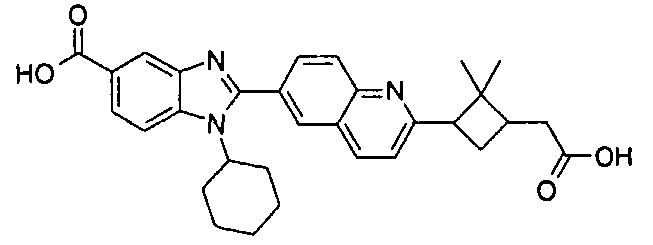
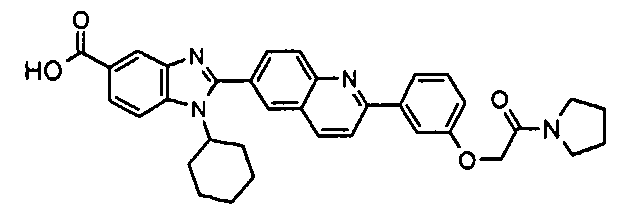
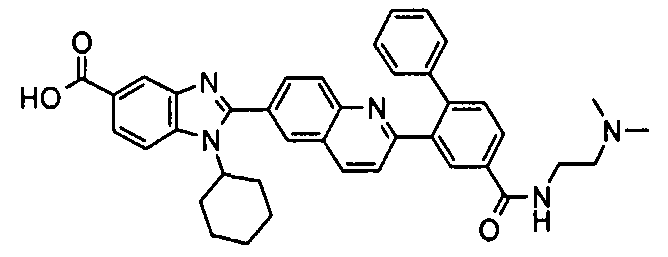
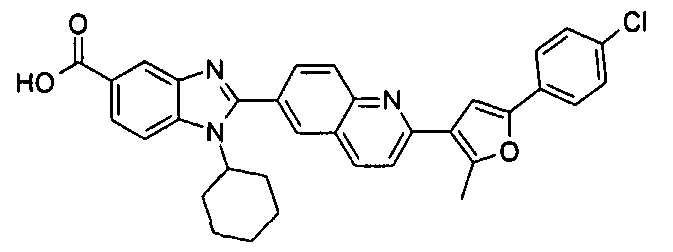
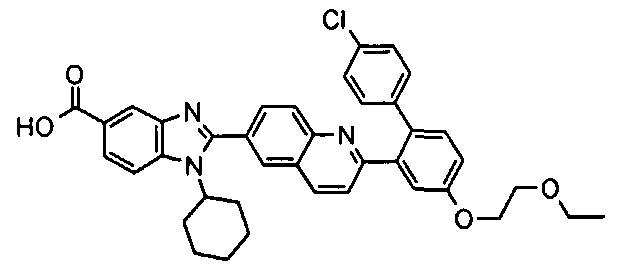
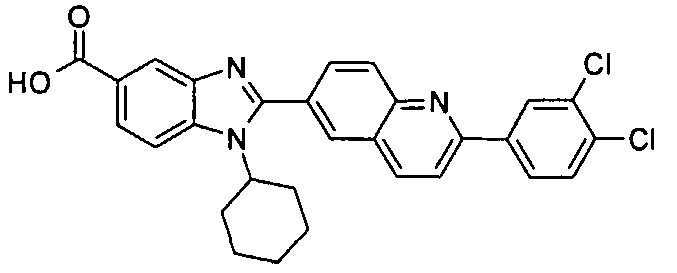
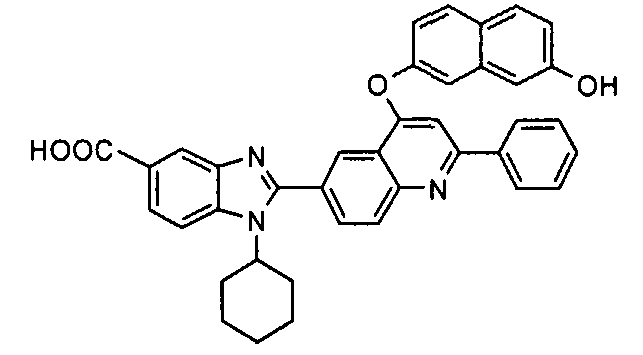
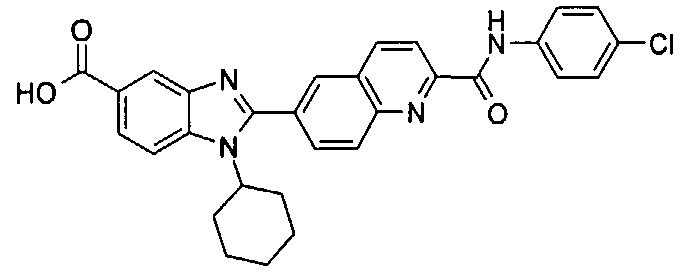
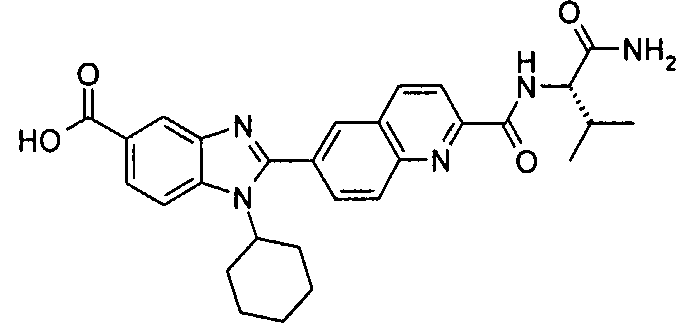
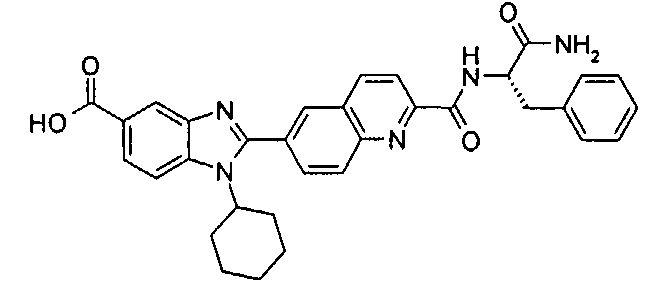
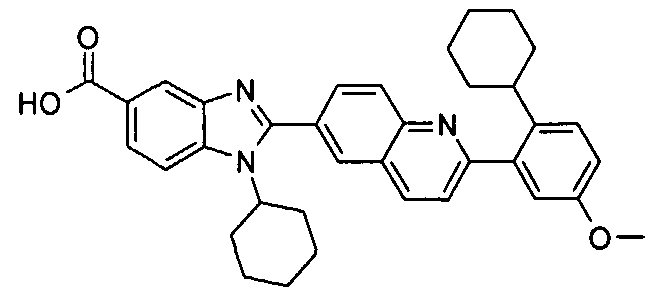
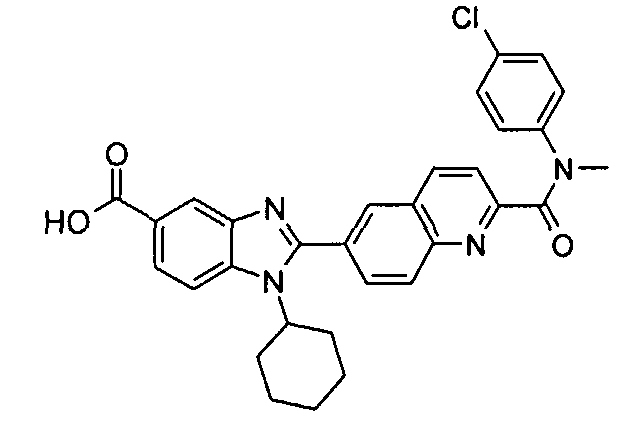
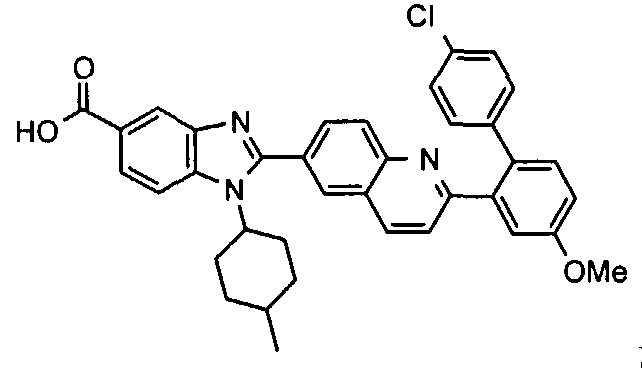
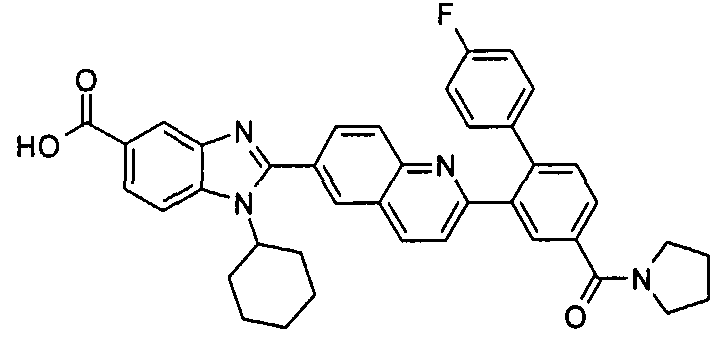
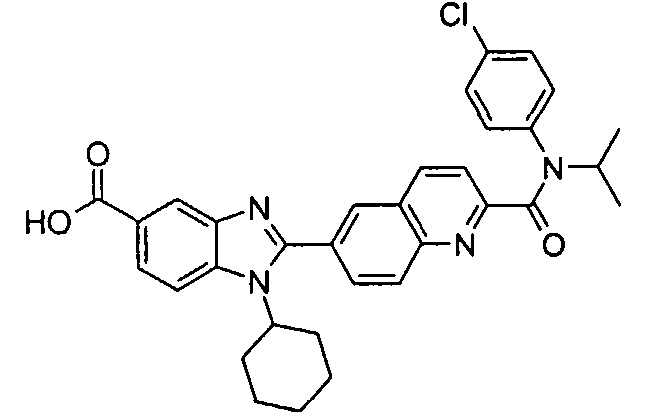
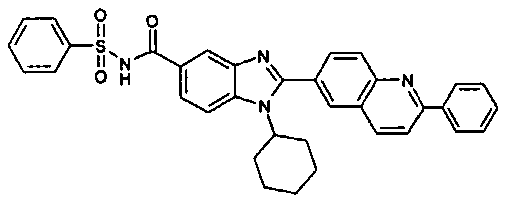
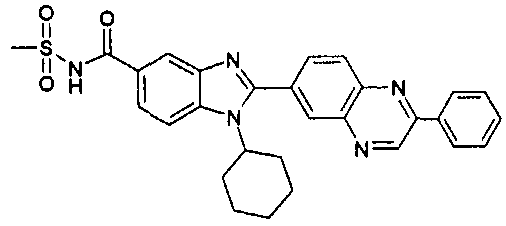
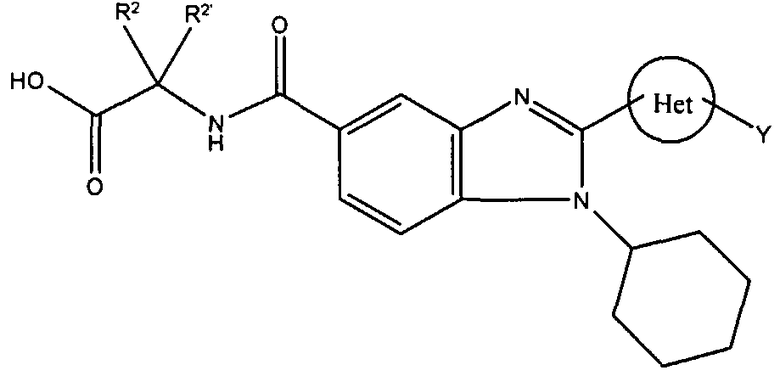
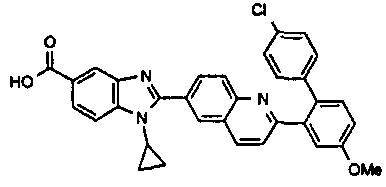
Соединения, входящие в область данного изобретения, включают соединения формулы I, представленные в следующих таблицах I-VIII:
нение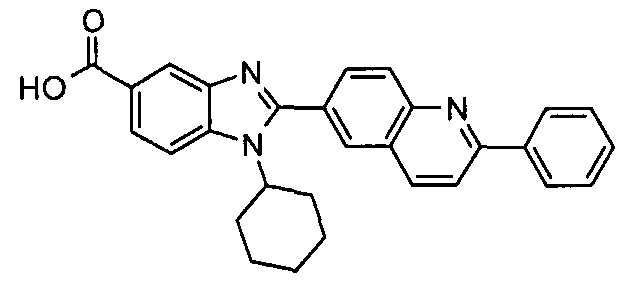
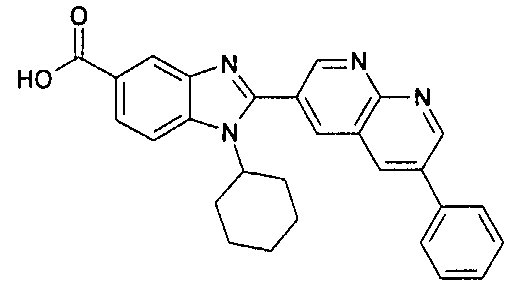
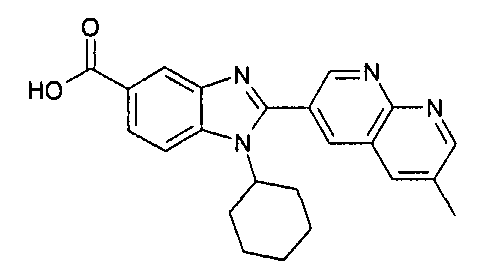
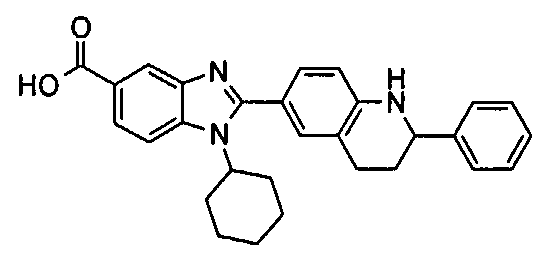
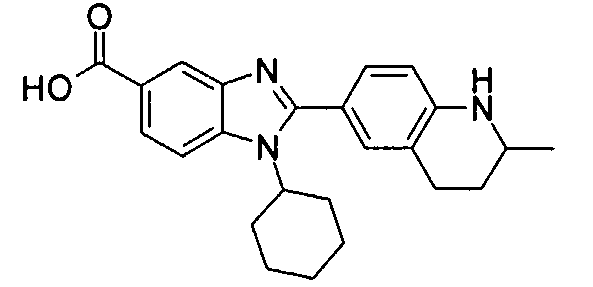
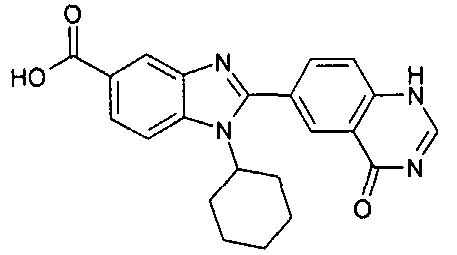
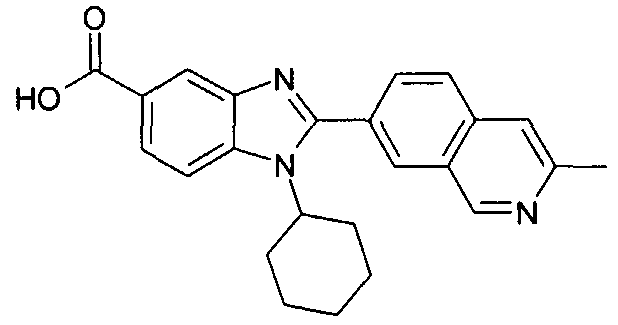
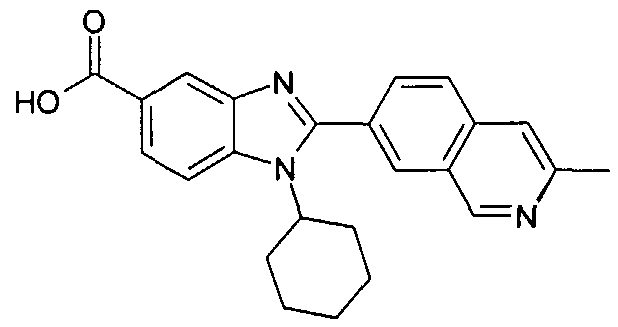
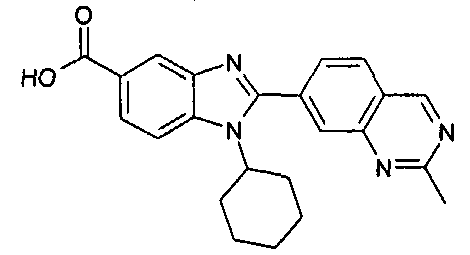

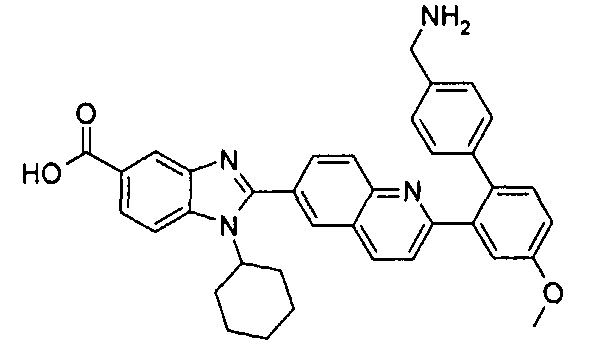
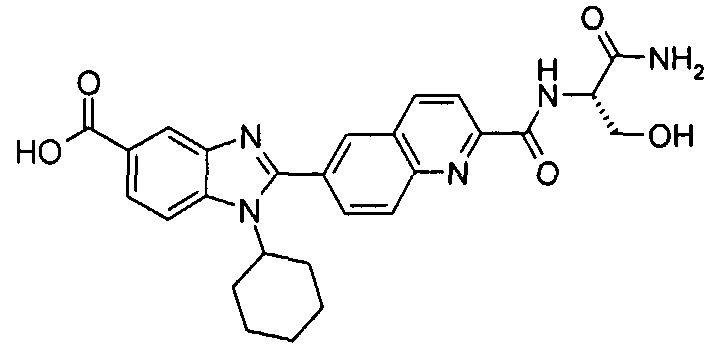
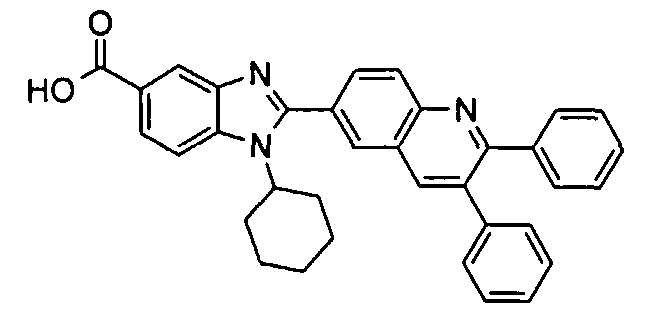
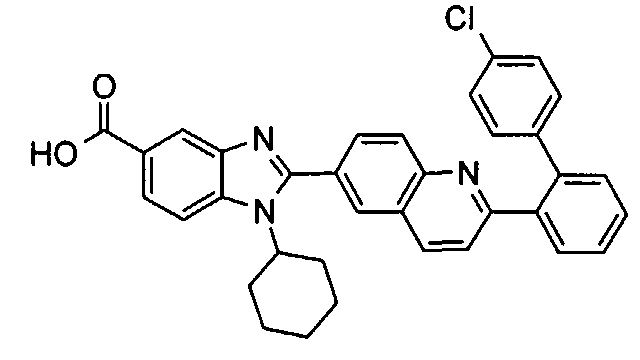
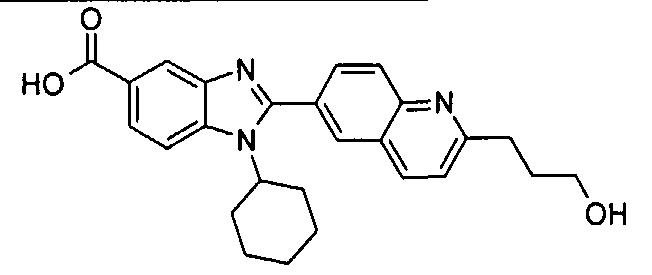
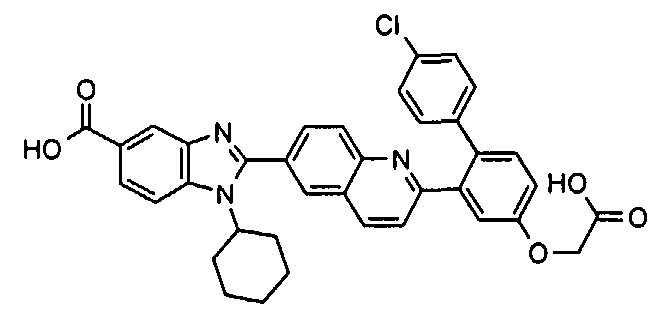
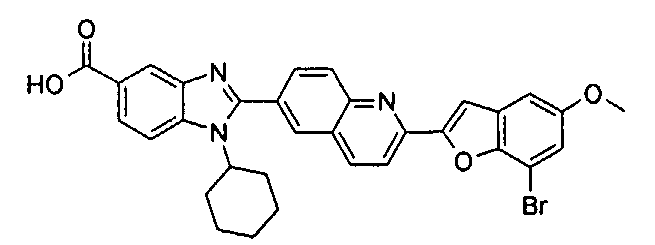
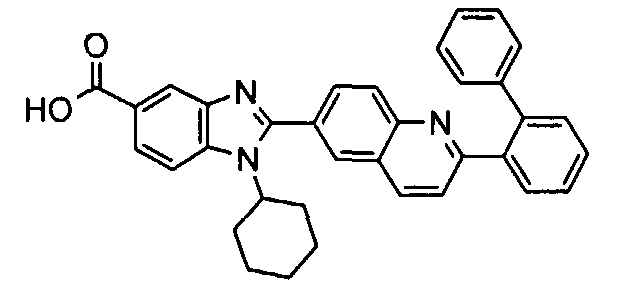
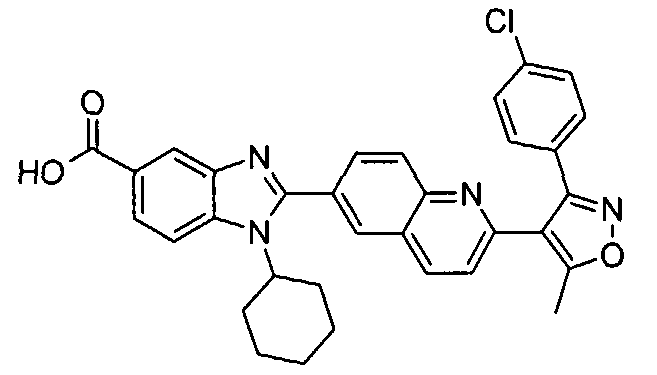
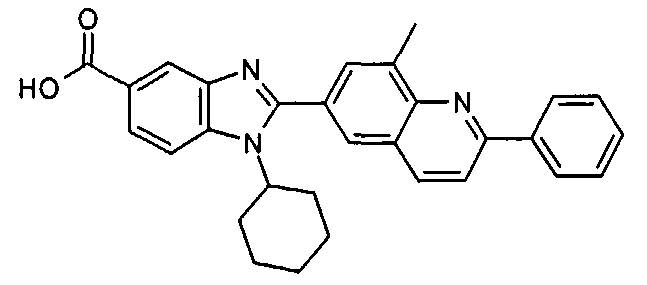
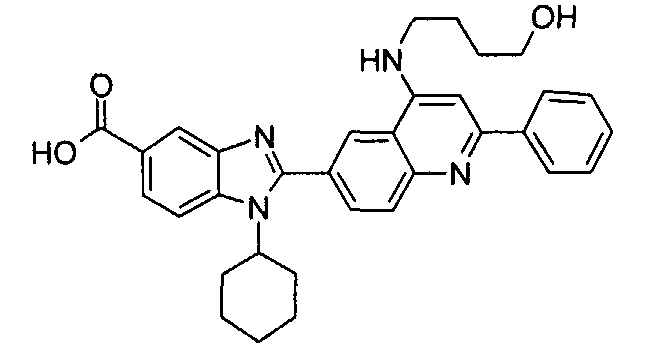
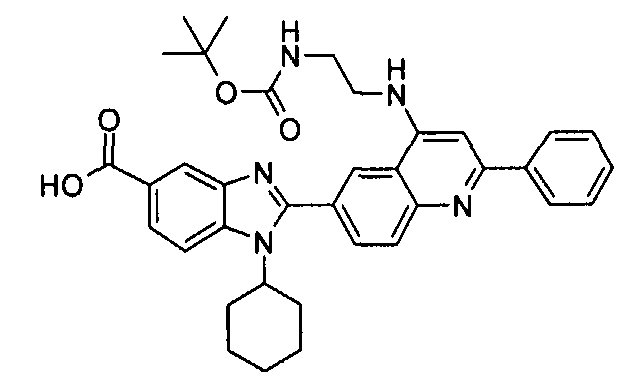
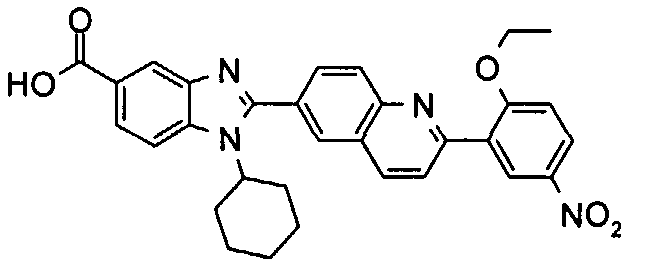
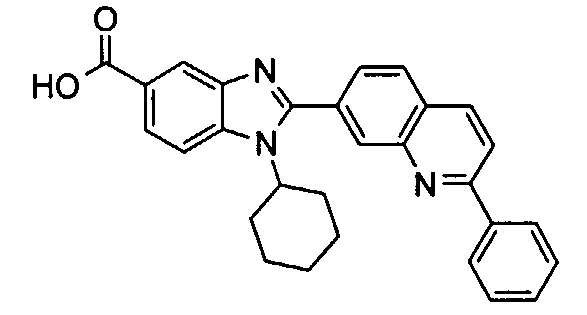
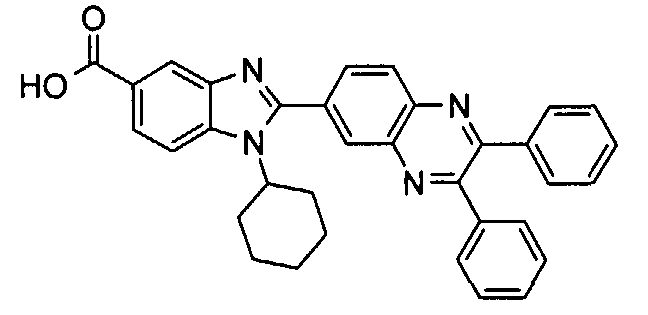
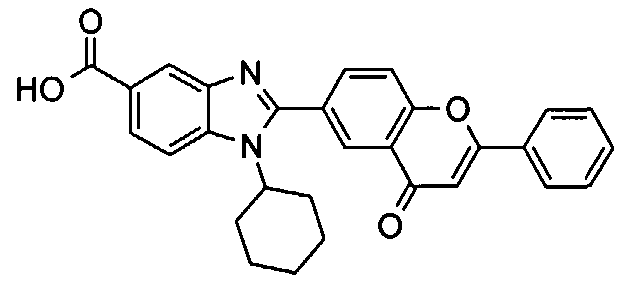
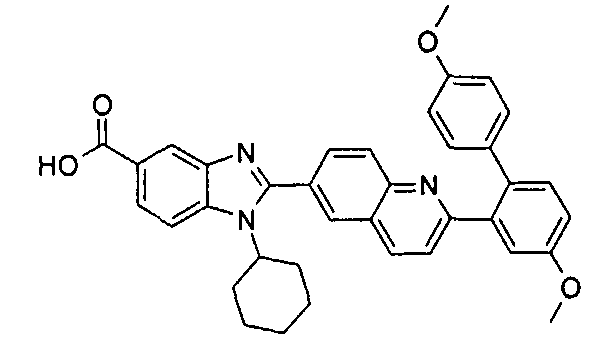
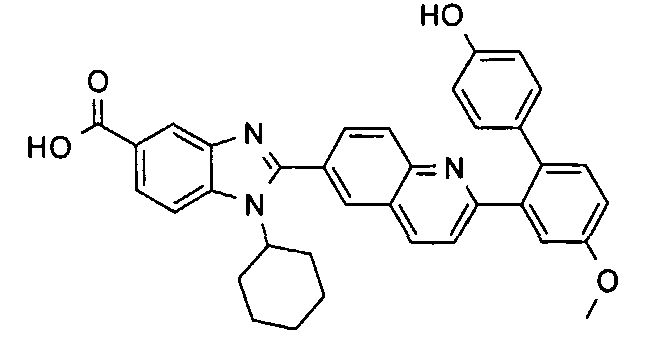
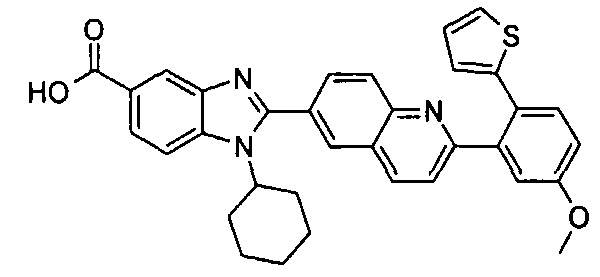
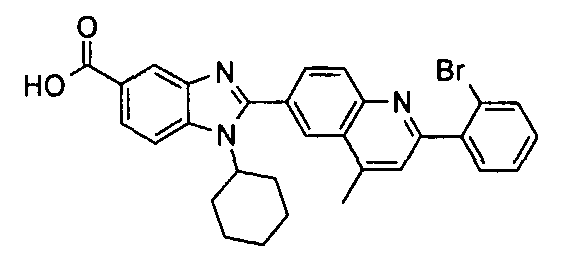
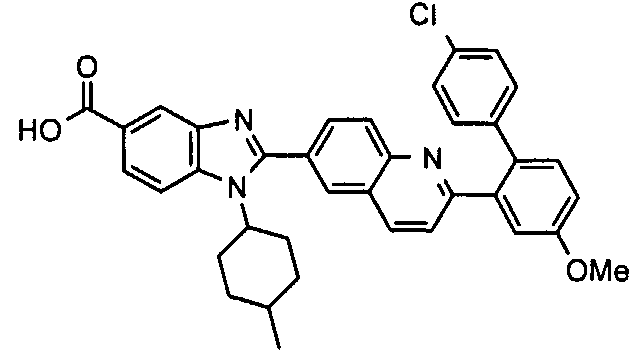
Изомер А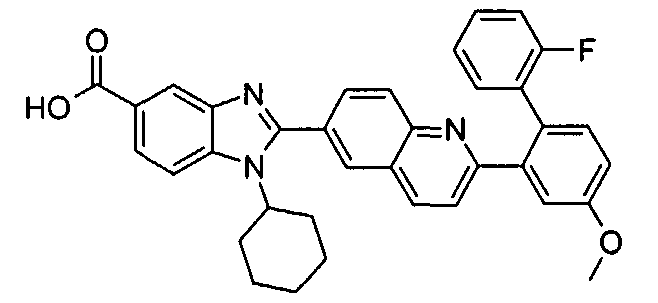
Изомер В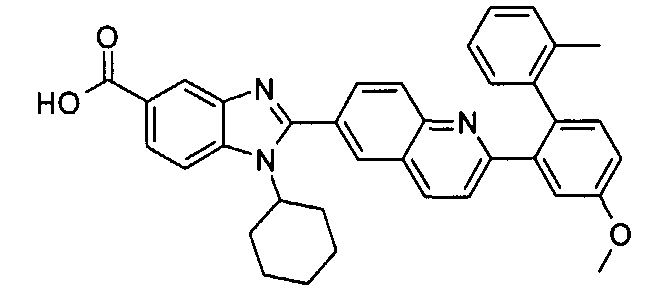
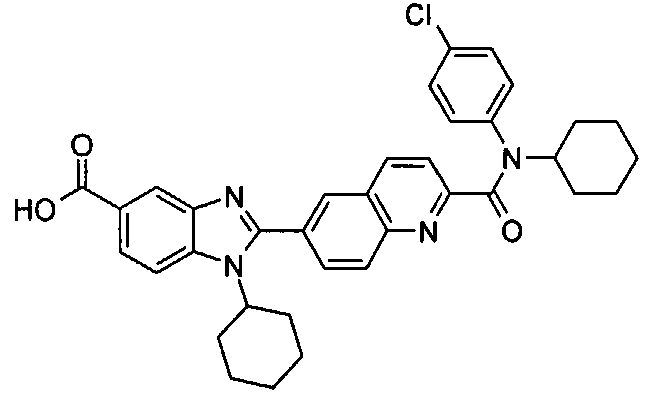
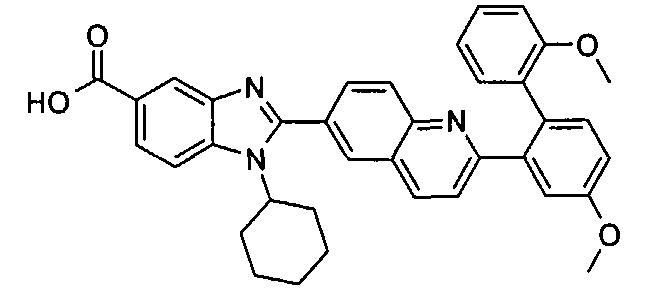
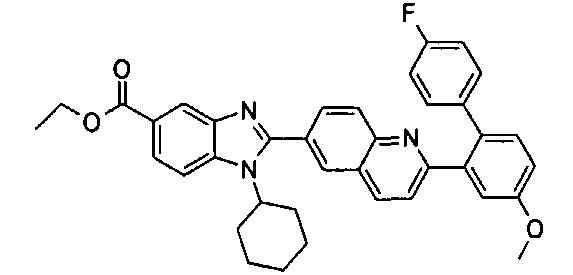
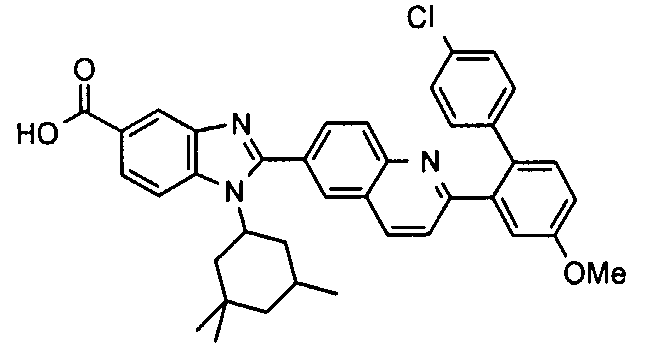
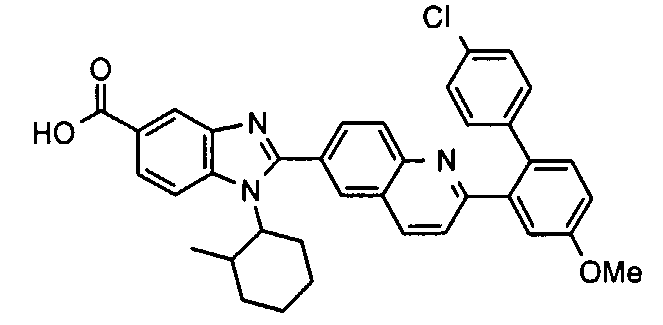
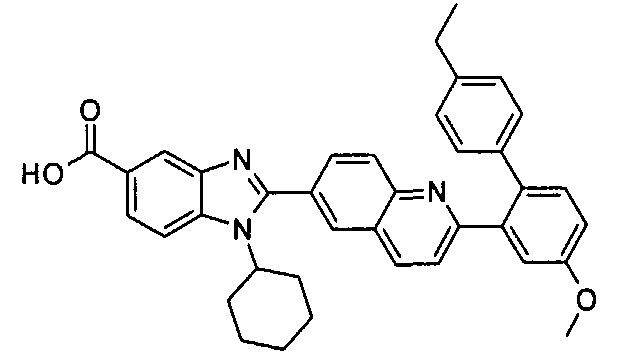
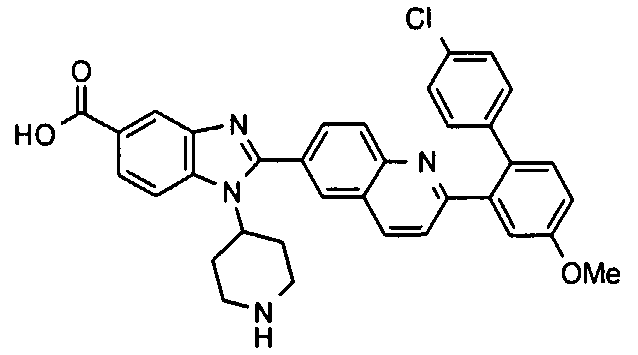
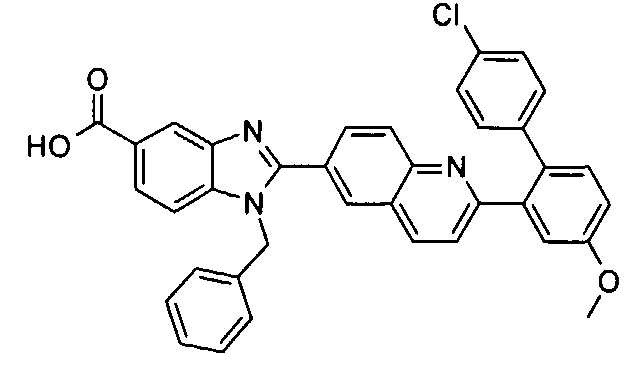
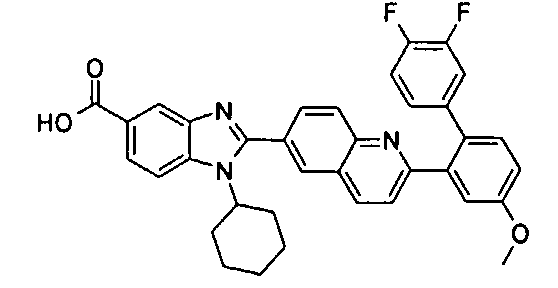
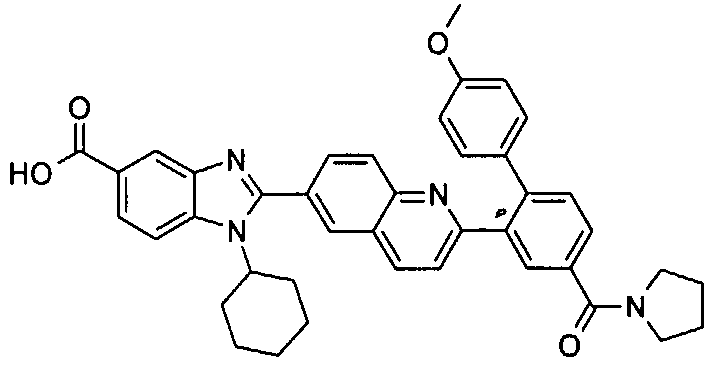
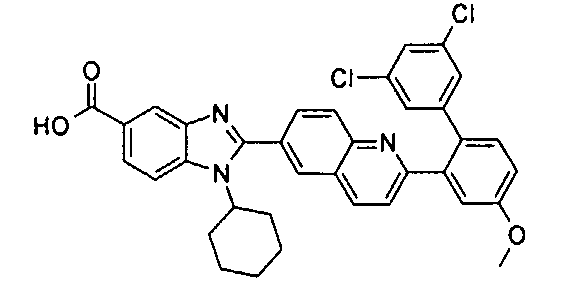
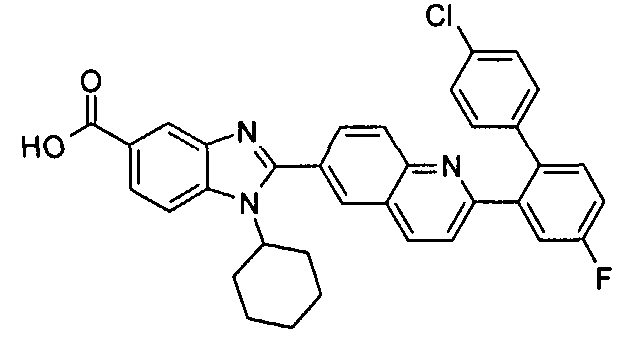
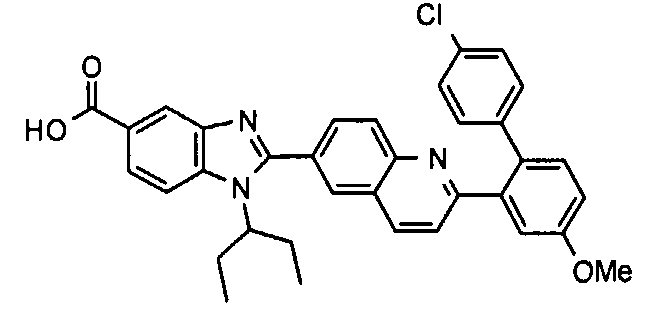
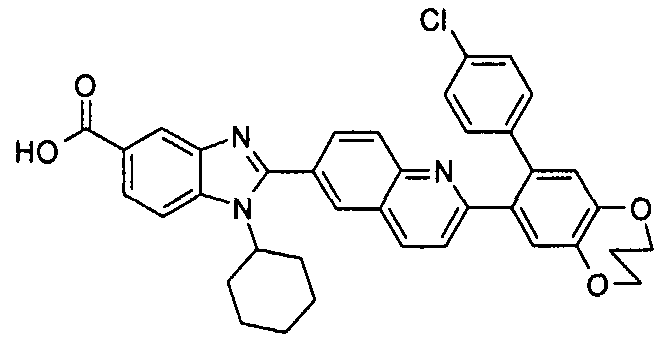
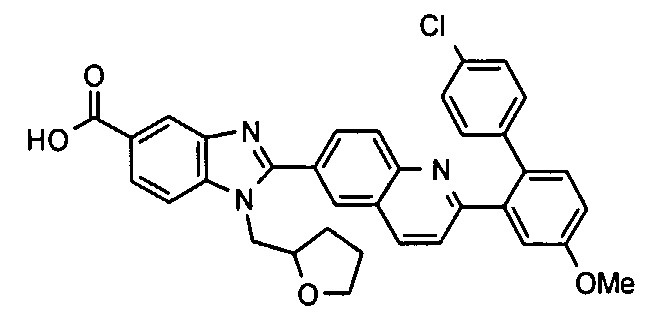
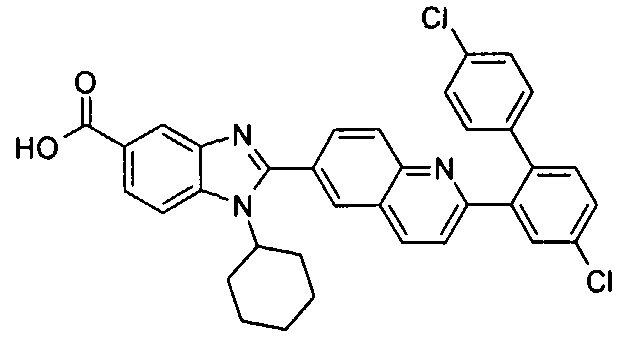
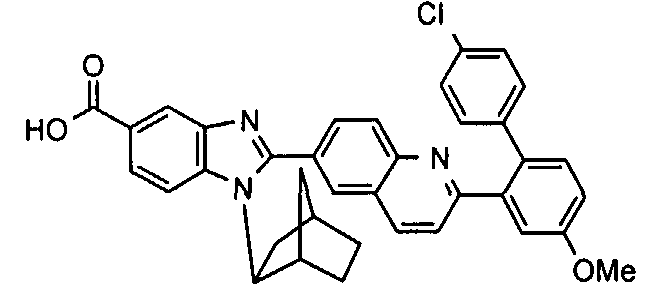
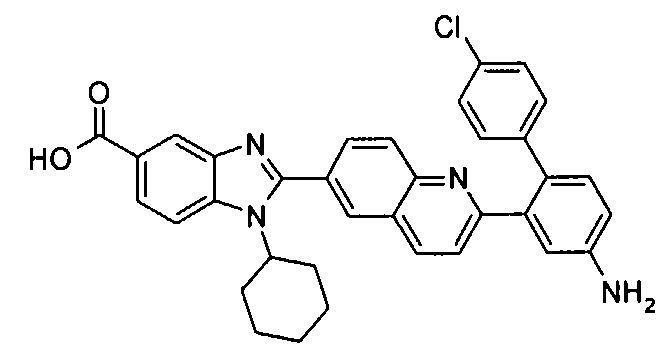
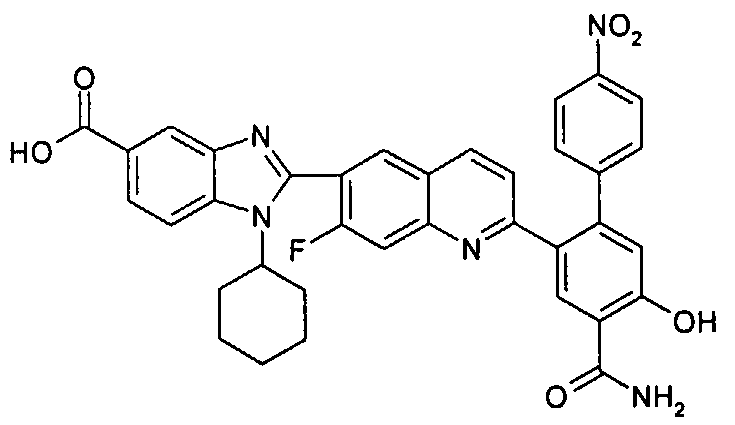
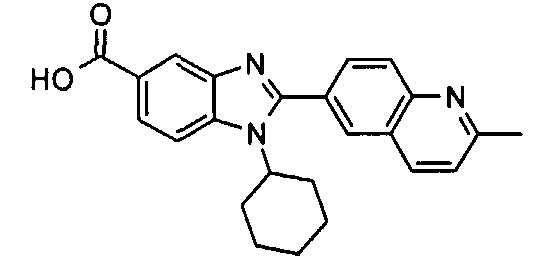
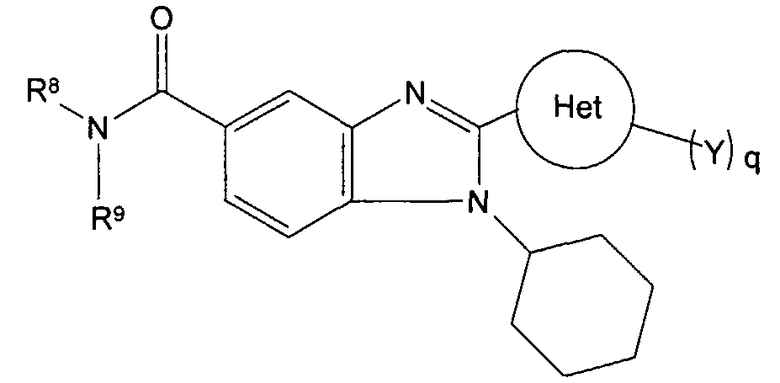
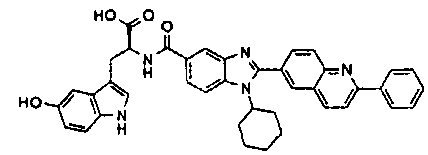
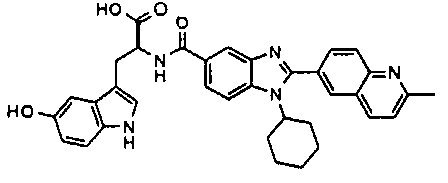
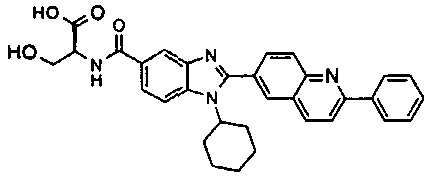
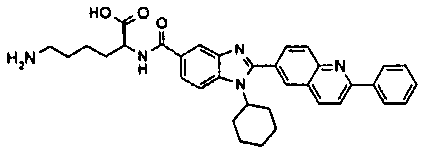
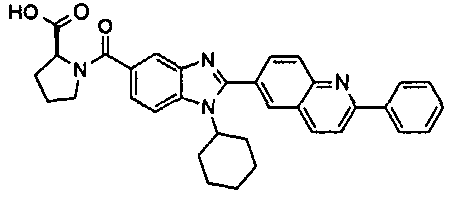
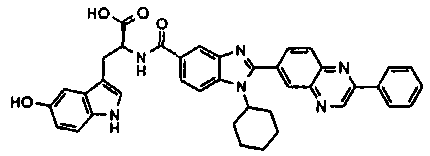
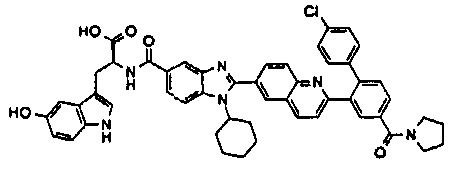
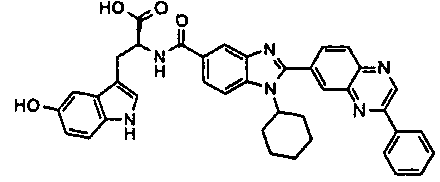
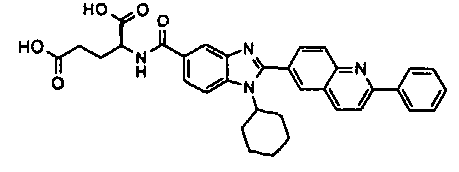
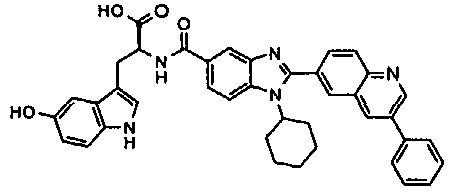
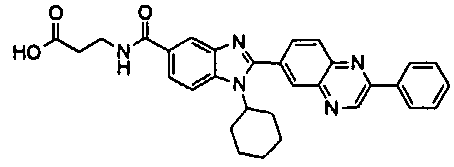
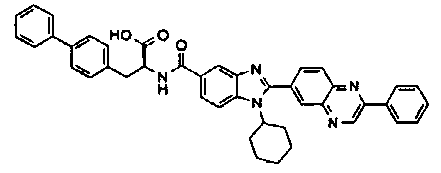
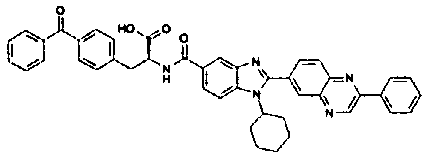
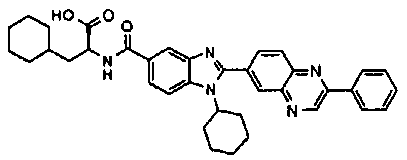
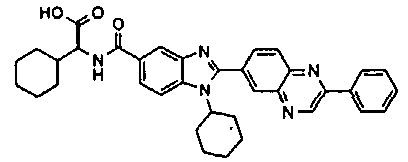
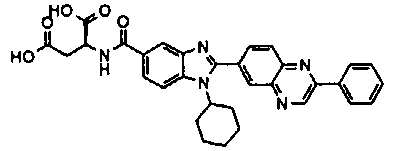
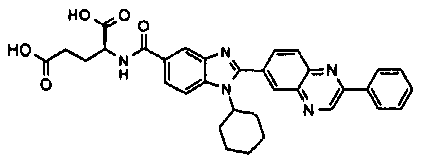
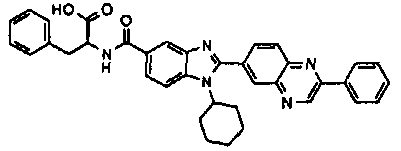
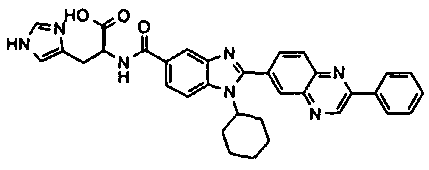
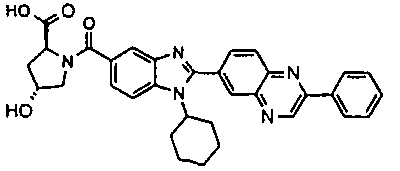
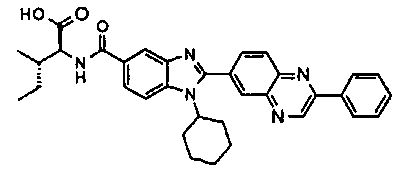
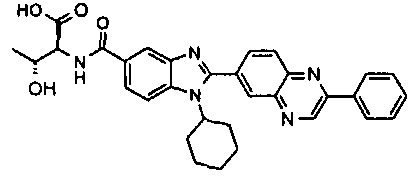
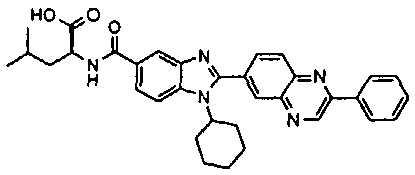
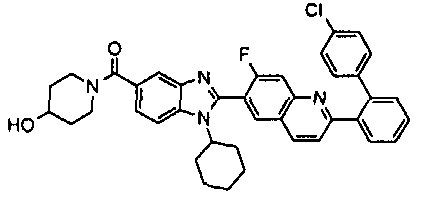
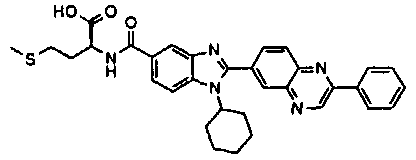
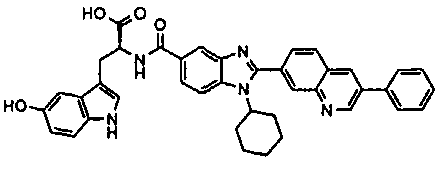
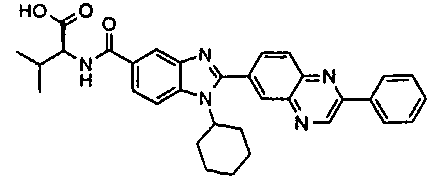
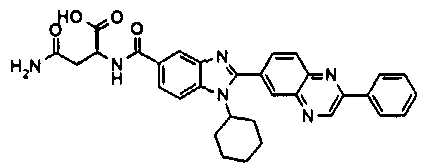
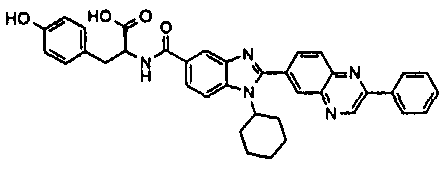
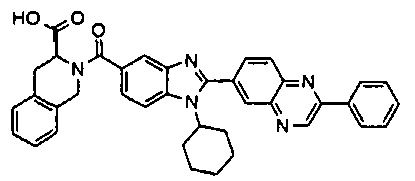
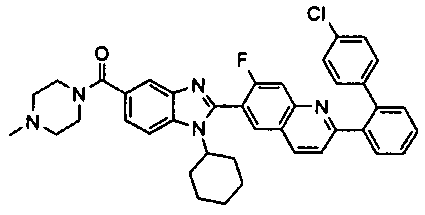
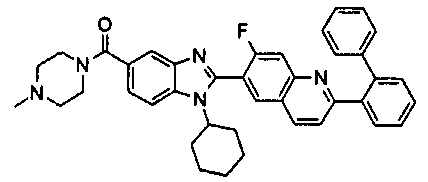
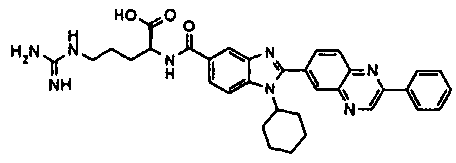
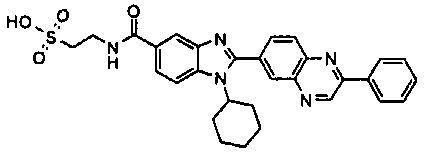
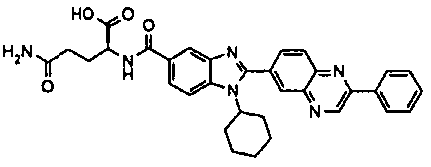
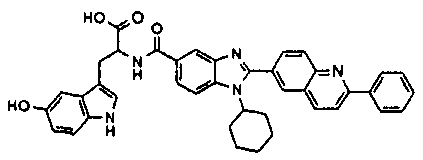
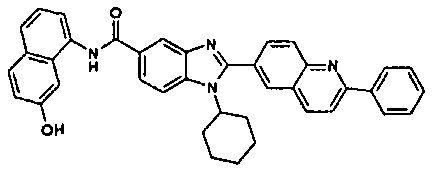
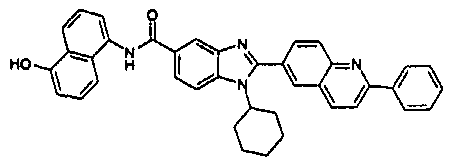
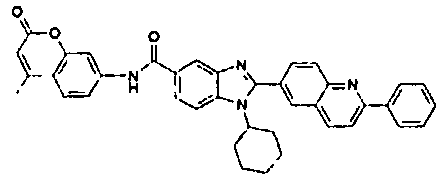
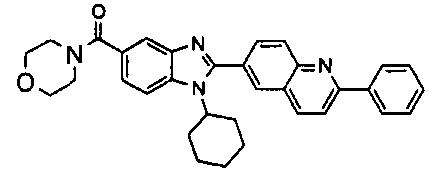
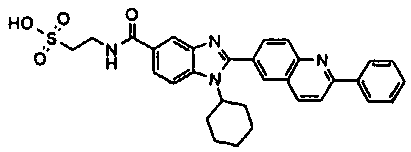
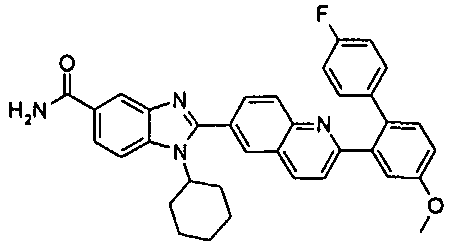
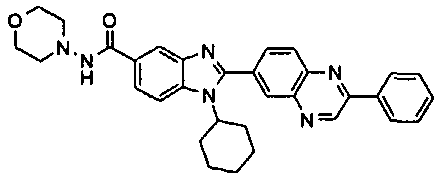
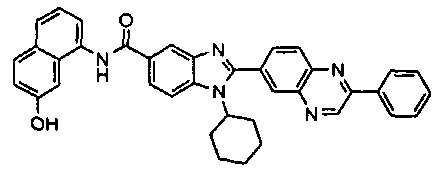
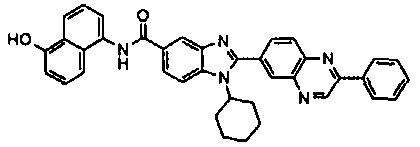
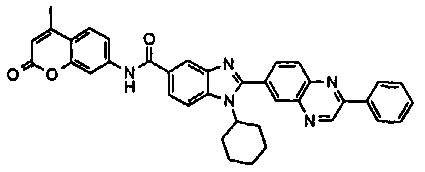
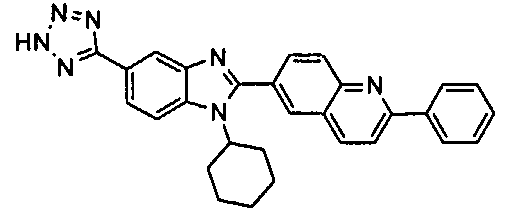
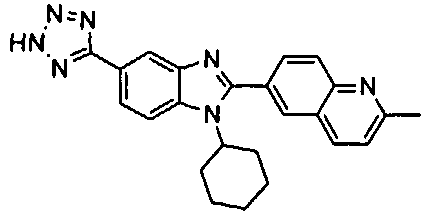
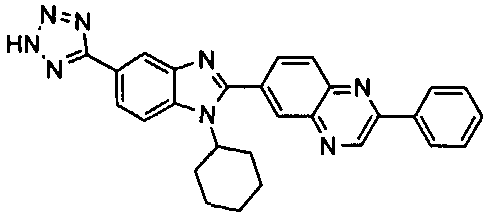
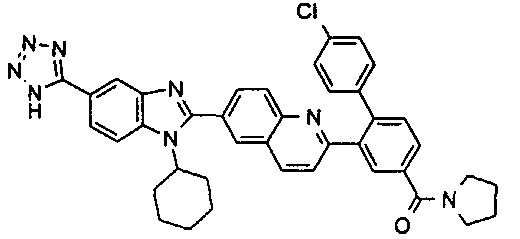
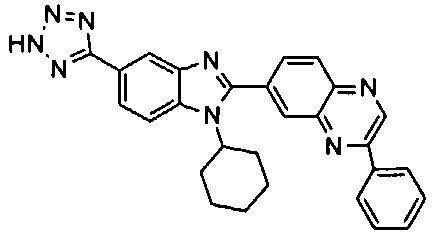
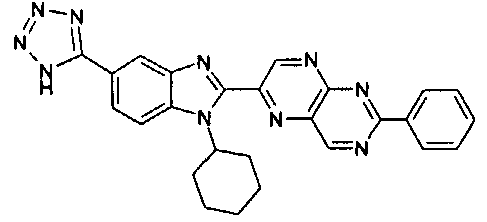
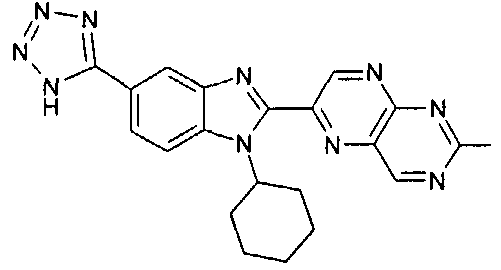
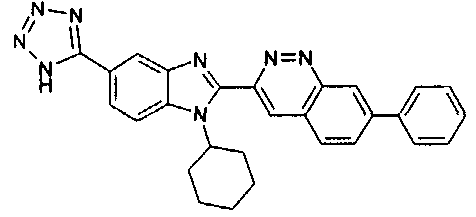
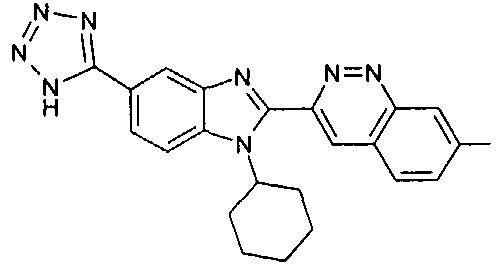
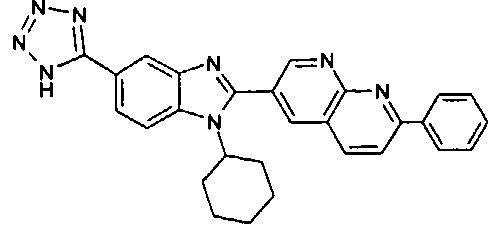
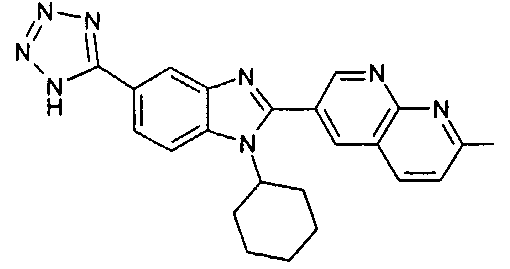
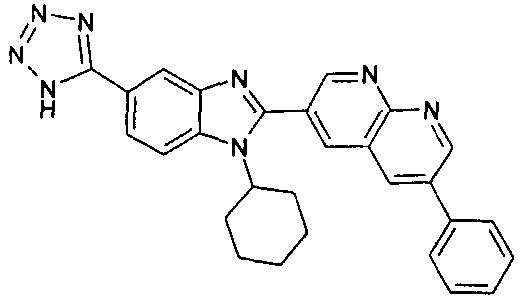
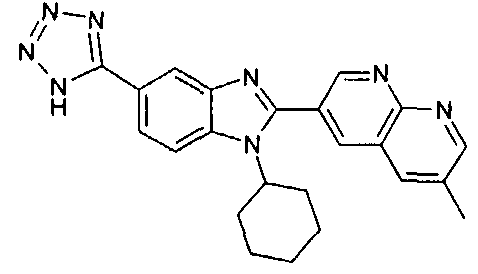
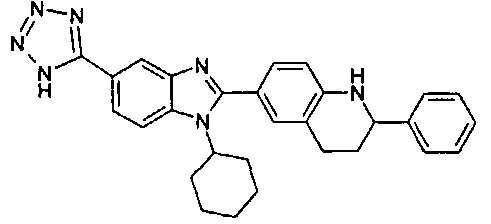
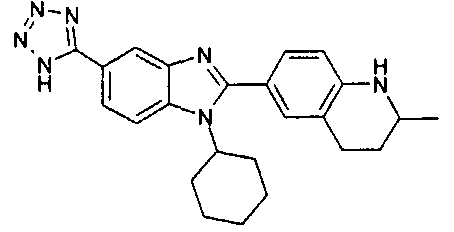
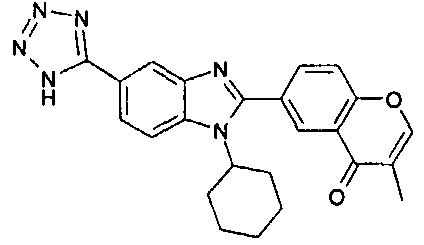
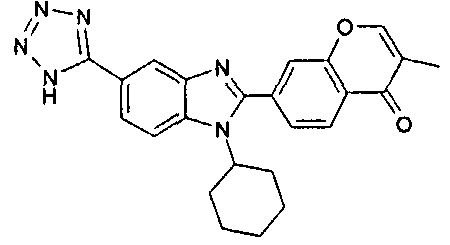
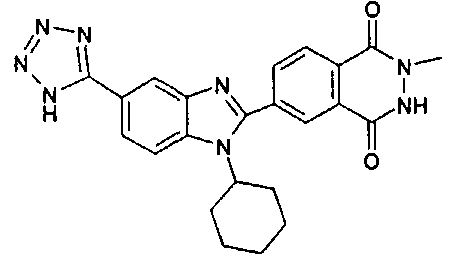
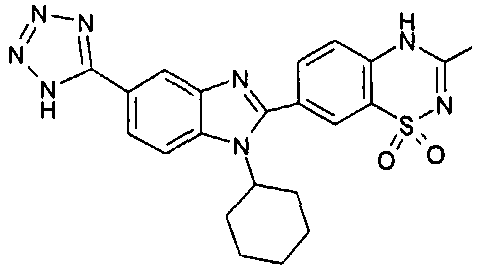
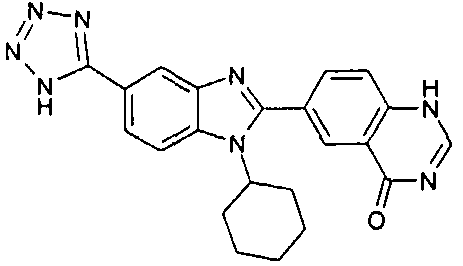
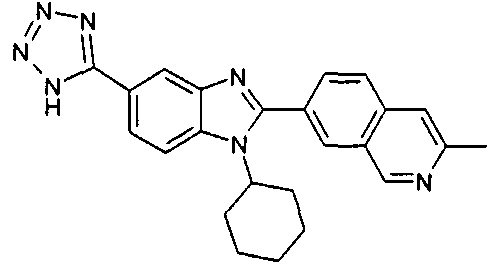
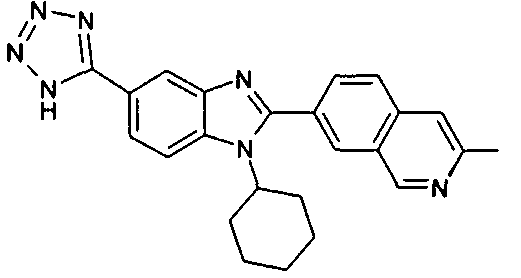
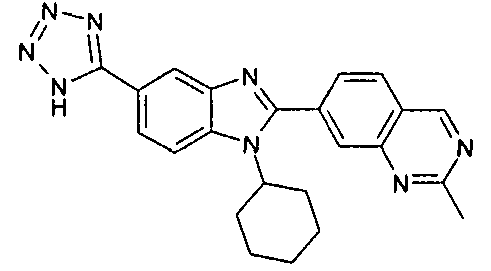
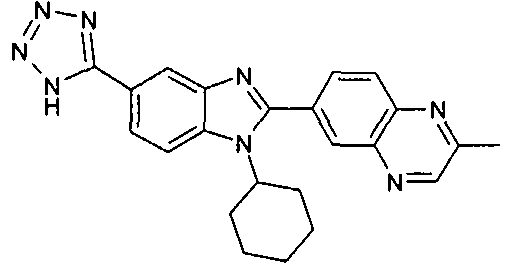
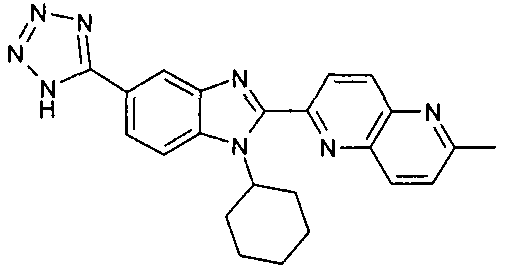
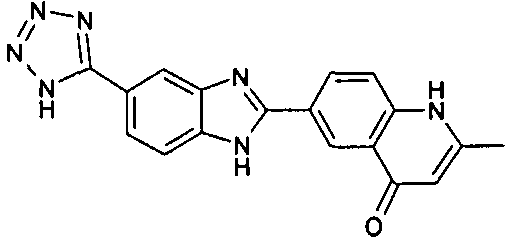
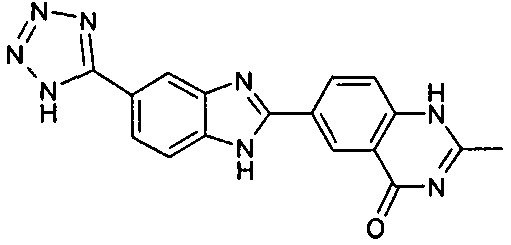
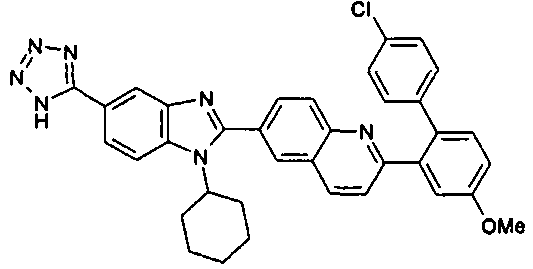
нение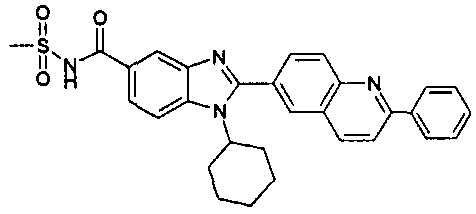
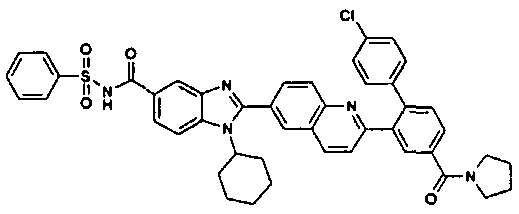
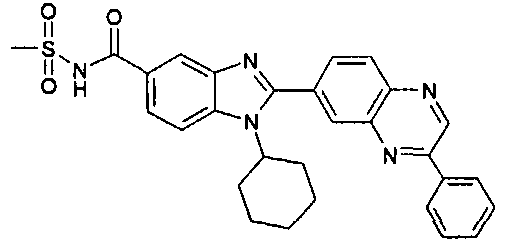
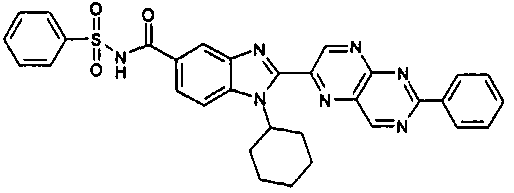
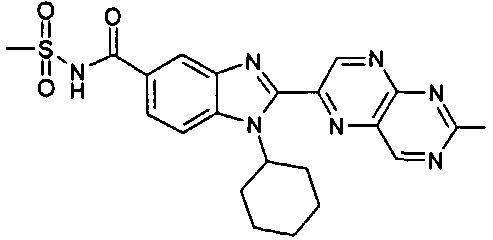
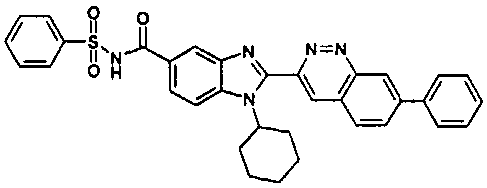
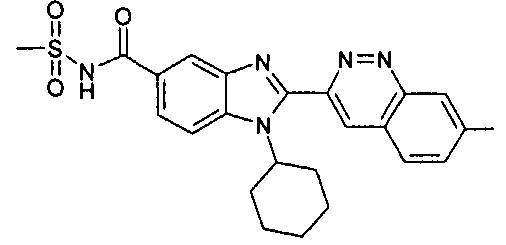
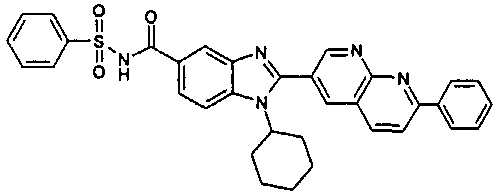
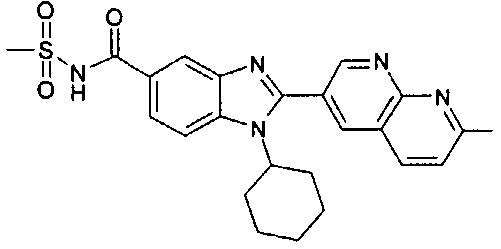
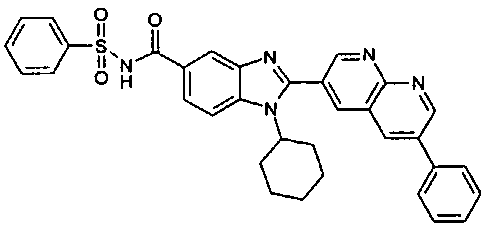

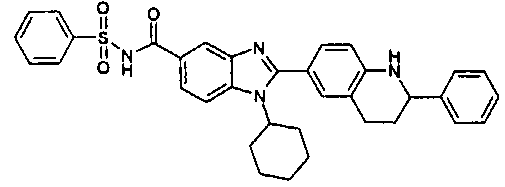
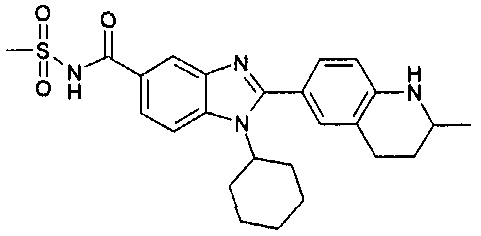
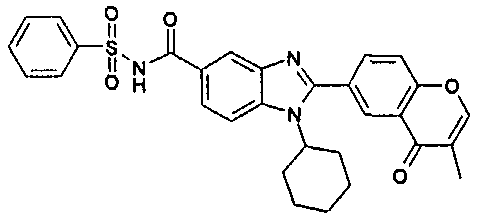
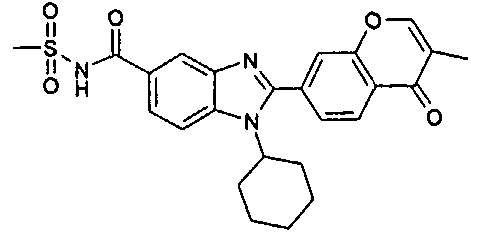
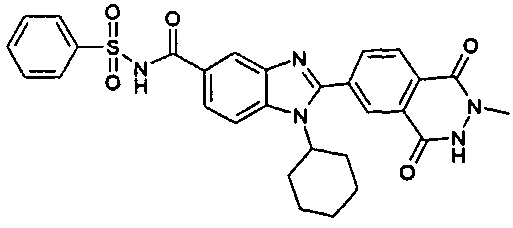
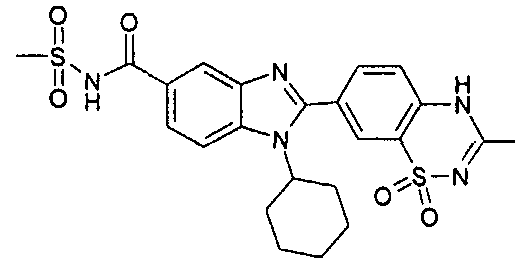
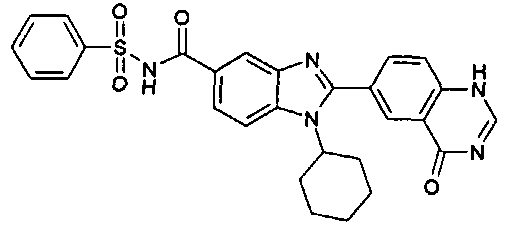
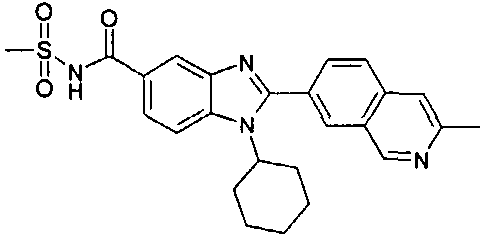
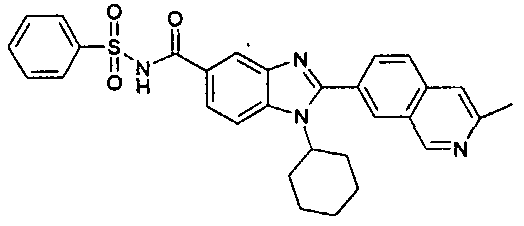
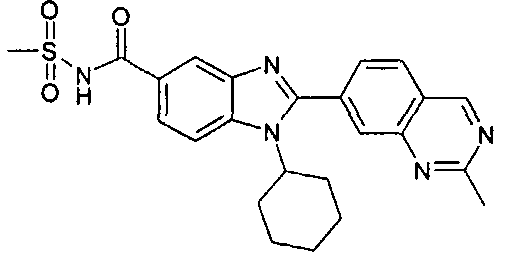
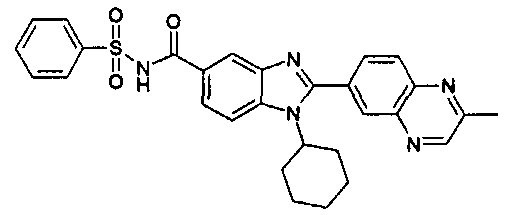
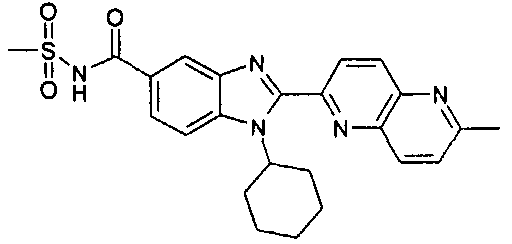
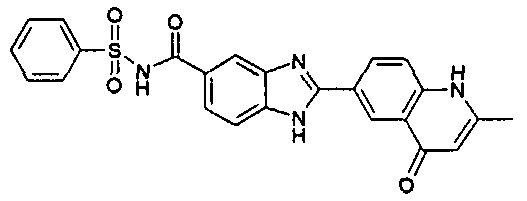
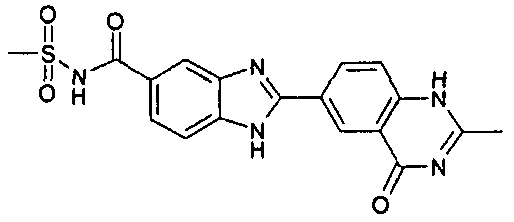
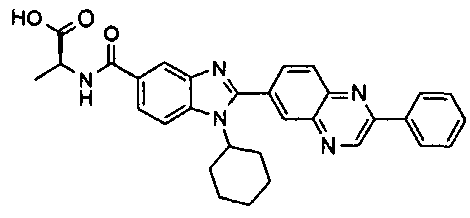
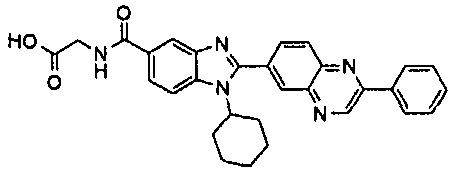
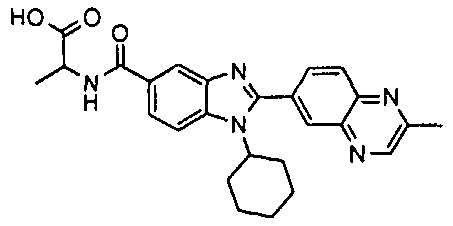
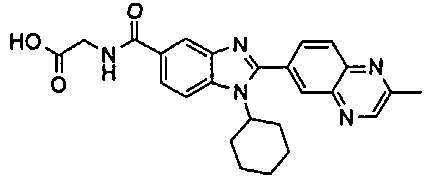
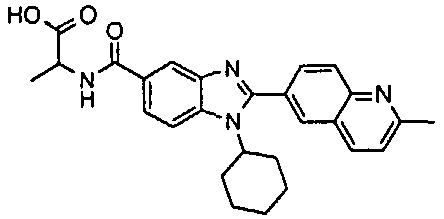
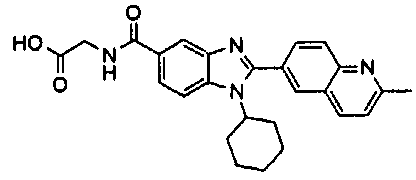
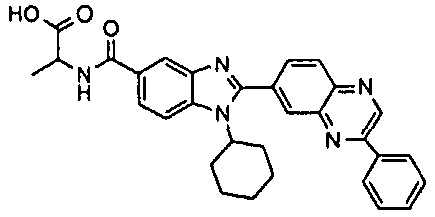
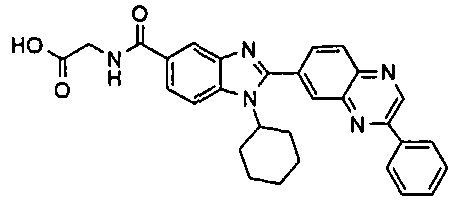
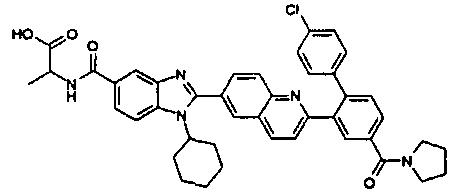
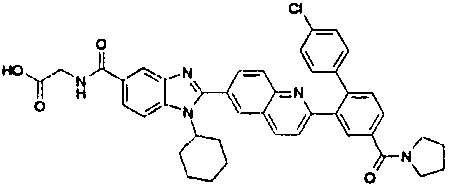
нение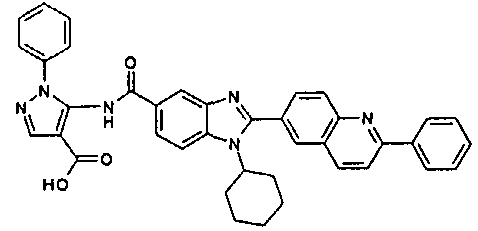
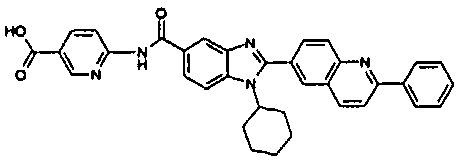
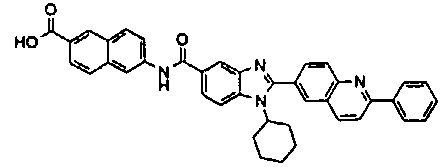
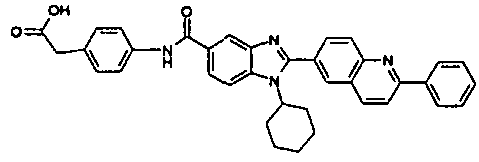
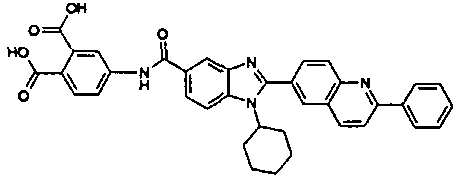
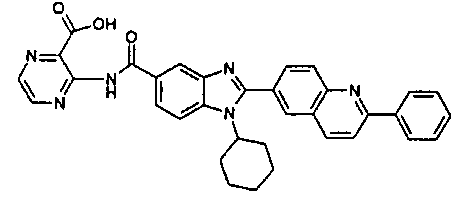
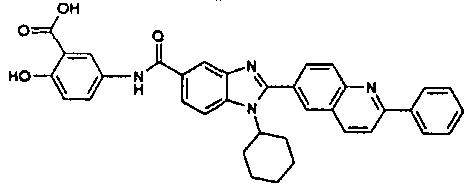
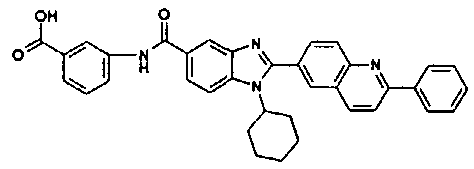
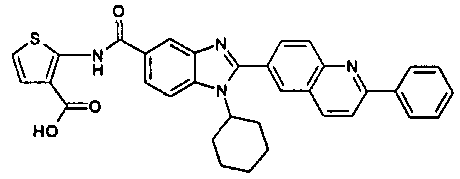
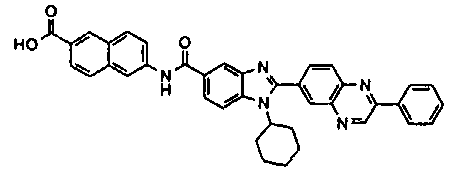
нение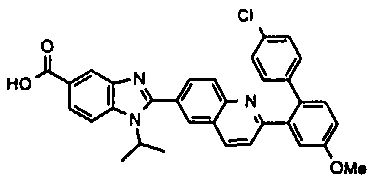
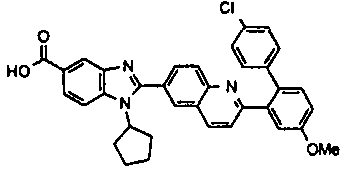
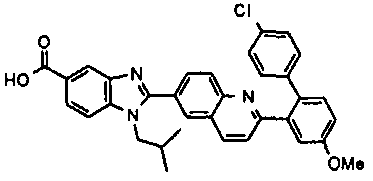
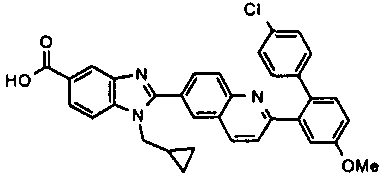
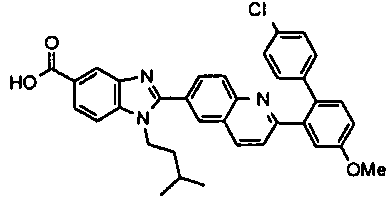
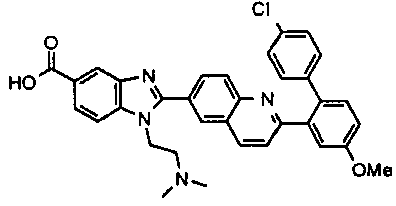
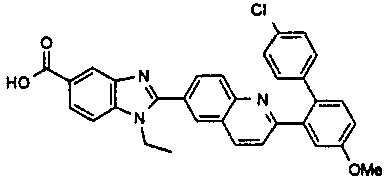
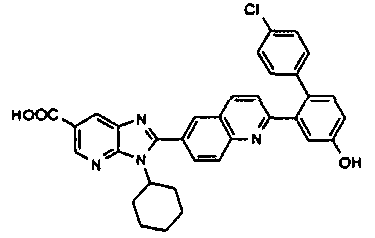
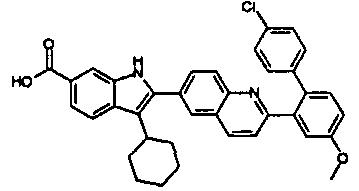
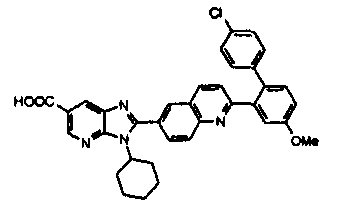
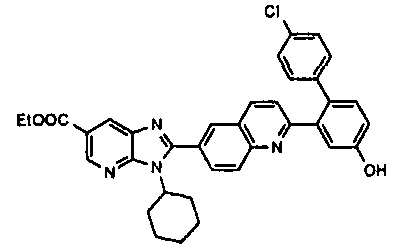
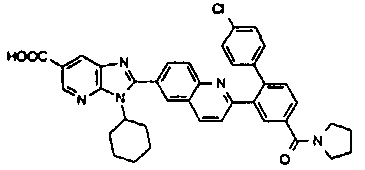
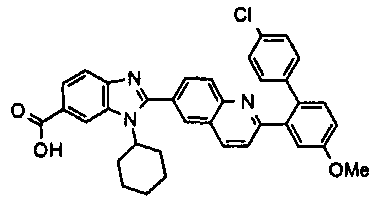
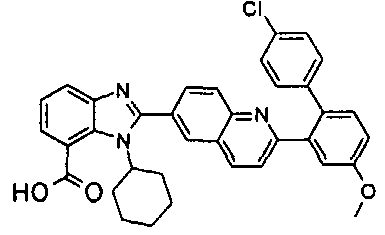
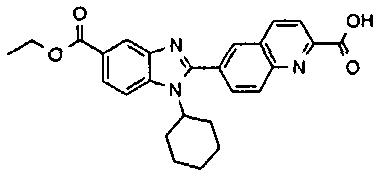
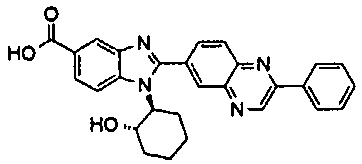
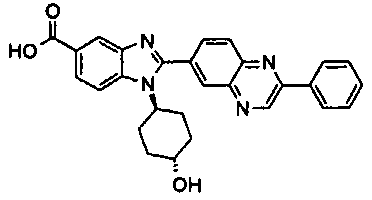
нение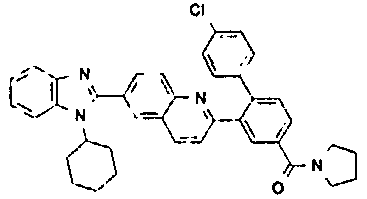
В еще одном другом варианте в настоящем изобретении предполагается включение следующих соединений:
N-[1-циклогексил-2-(4-оксо-1,4-дигидрохиназолин-6-ил)-1Н-бензоимидазол-5-илкарбонил]-N-(фенилсульфонил)амин;
6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]-4-оксо-1,4-дигидрохиназолин;
1-циклогексил-2-(4-оксо-1,4-дигидрохиназолин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота; и
их фармацевтически приемлемых таутомеров и солей.
Данное изобретение относится также к фармацевтическим композициям, содержащим фармацевтически приемлемый разбавитель и терапевтически эффективное количество одного из представленных в данном описании соединений или смесей одного или более таких соединений.
В данном изобретении также дополнительно предлагаются способы лечения вирусной инфекции у млекопитающих, опосредованной, по меньшей мере частично, вирусом из вирусов семейства flaviviridae, таким как HCV, включающие введение млекопитающему, у которого была выявлена вирусная инфекция или который обладает повышенным риском к развитию вирусной инфекции, фармацевтической композиции, содержащей фармацевтически приемлемый разбавитель и терапевтически эффективное количество одного из представленных в данном описании соединений или смесей одного или более таких соединений.
В еще одном другом варианте изобретения предлагаются способы лечения или профилактики вирусных инфекций у млекопитающих, в которых соединения данного изобретения вводят в комбинации с введением терапевтически эффективного количества одного или более средств против HCV. Средства, обладающие активностью против HCV, включают рибавирин, левовирин, тимозин-альфа-1, ингибитор NS3 серинпротеазы и ингибитор инозинмонофосфатдегидрогеназы, интероферон-альфа, пегилированный интерферон-альфа, взятый отдельно или в комбинации с рибавирином или левовиринном. Дополнительное средство, обладающее активностью против HCV, предпочтительно представляет собой интерферон-альфа или пегилированный интерферон-альфа, взятый отдельно или в комбинации с рибавирином или левовирином.
Подробное описание изобретения
Изобретение относится к соединениям, композициям и способам лечения вирусных инфекций, вызванных вирусами семейства Flaviviridae. Однако перед подробным описанием данного изобретения сначала будут определены следующие термины.
Определения
Перед подробным описанием настоящего изобретения следует учитывать, что в том случае, если не оговорено специально, данное изобретение не ограничено конкретной композицией или фармацевтическим носителем, которые могут меняться как таковые. Следует также иметь в виду, что использованная в данном описании терминология приведена только с целью описания отдельных вариантов и не предназначена для ограничения объема настоящего изобретения.
Следует отметить, что использованные в данном описании и формуле изобретения формы «а», «и» и «the» для указания единственного числа включают ссылки для указания во множественном числе, если в контексте ясно не указано иначе. Так например, ссылка на «фармацевтически приемлемый разбавитель» в композиции включает два или более фармацевтически приемлемых разбавителей и т.д.
В последующем данном описании и формуле изобретения будут представлены ссылки на ряд терминов, которые будут определены как имеющие следующие значения.
Использованный в данном описании термин «алкил» относится к одновалентным алкильным группам, имеющим от 1 до 10 атомов углерода, предпочтительно от 1 до 5 атомов углерода и более предпочтительно от 1 до 3 атомов углерода. Пояснительные примеры данного термина включают группы, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и подобные группы.
Термин «замещенный алкил» относится к алкильной группе, имеющей от 1 до 3 и предпочтительно от 1 до 2 заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циано, галогена, гидрокси, нитро, карбокси, группы сложного эфира карбоновой кислоты, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Использованный в данном описании термин «алкилен» относится к дивалентным алкильным группам с прямой и разветвленной цепью, имеющим от 1 до 10 атомов углерода, предпочтительно от 1 до 5 атомов углерода и более предпочтительно от 1 до 3 атомов углерода. Пояснительные примеры данного термина включают группы, такие как метилен, этилен, пропилен, бутилен и подобные.
Термин «замещенный алкилен» относится к алкиленовой группе, имеющей от 1 до 3 и предпочтительно от 1 до 2-х заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циано, галогена, гидрокси, нитро, карбокси, группы сложного эфира карбоновой кислоты, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Термин «алкокси» относится к группе «алкил-О-», включающей, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, и подобные группы.
Термин «замещенный алкокси» относится к группе «замещенный алкил-О-».
Термин «ацил» относится к группам: Н-С(О)-, алкил-С(О)-, замещенный алкил-С(О)-, алкенил-С(О)-, замещенный алкенил-С(О)-, алкинил-С(О)-, замещенный алкинил-С(О)-циклоалкил-С(О)-, замещенный циклоалкил-С(О)-, арил-(О)-, замещенный арил-С(О)-, гетероарил-С(О)-, замещенный гетероарил-С(О)-, гетероциклическая группа-С(О)- и замещенная гетероциклическая группа-(С(О)-.
Термин «ациламино» относится к группе -С(О)NR20R21, где R20 и R21 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы, замещенной гетероциклической группы, и где R20 и R21 объединены вместе с атомом азота с образованием гетероциклического или замещенного гетероциклического кольца.
Термин «ацилокси» относится к группам: алкил-С(О)О-, замещенный алкил-С(О)О-, алкенил-С(О)О-, замещенный алкенил-С(О)О-, алкинил-С(О)О-, замещенный алкинил-С(О)О-, арил-С(О)О-, замещенный арил-С(О)О-, циклоалкил-С(О)О-, замещенный циклоалкил-С(О)О-, гетероарил-С(О)О-, замещенный гетероарил-С(О)О-, гетероциклическая группа-С(О)О- и замещенная гетероциклическая группа-С(О)О-.
Термин «алкенил» относится к алкенильной группе, имеющей от 2 до 10 атомов углерода, предпочтительно имеющей от 2 до 6 атомов углерода и более предпочтительно от 2 до 4 атомов углерода, и имеющей, по меньшей мере, 1 и предпочтительно 1-2 участка алкенильной ненасыщенности.
Термин «замещенный алкенил» относится к алкенильным группам, имеющим от 1 до 3 заместителей и предпочтительно от 1 до 2 заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циано, галогена, гидрокси, нитро, карбокси, сложного эфира карбоновой кислоты, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Термин «алкинил» относится к алкинильной группе, имеющей от 2 до 10 атомов углерода, предпочтительно имеющей от 2 до 6 атомов углерода и более предпочтительно от 2 до 3 атомов углерода, и имеющей, по меньшей мере, 1 и предпочтительно 1-2 участка алкинильной ненасыщенности.
Термин «замещенный алкинил» относится к алкинильным группам, имеющим от 1 до 3 заместителей и предпочтительно от 1 до 2 заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циано, галогена, гидрокси, нитро, карбокси, сложного эфира карбоновой кислоты, циклоалкила, замещенного циклоакила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Термин «амино» относится к группе -NH2.
Термин «замещенный амино» относится к группе -NR22R23, где R22 и R23 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы, замещенной гетероциклической группы, и где R22 и R23 вместе с атомом азота, к которому они присоединены, объединены с образованием гетероциклической или замещенной гетероциклической группы, при условии что оба из R22 и R23 не являются водородом. Когда R22 является водородом и R23 является алкилом, замещенная аминогруппа в данном описании иногда отнесена к алкиламино. Когда R22 и R23 являются алкилом, замещенная аминогруппа в данном описании иногда отнесена к диалкиламино.
Термин «аминоацил» относится к группам -NR24C(O)алкил, -NR24C(O)замещенный алкил, -NR24C(O)-циклоалкил, -NR24C(O)замещенный циклоалкил, -NR24C(O)алкенил, -NR24C(O)замещенный алкенил, -NR24C(O)алкинил, -NR24C(O)замещенный алкинил, -NR24C(O)арил, -NR24C(O)замещенный арил, -NR24C(O) гетероарил, -NR24C(O)замещенный гетероарил, -NR24C(O) гетероциклическая группа и -NR24C(O)замещенная гетероциклическая группа, где R24 представляет собой водород или алкил.
Термин «аминокарбониламино» относится к группе -NR25C(O)NR26R27, где R25 является водородом или алкилом, и R26 и R27 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы, замещенной гетероциклической группы, и где R26 и R27 вместе с атомом азота, к которому они присоединены, объединены с образованием гетероциклической или замещенной гетероциклической группы.
Термин «аминокарбонилокси» относится к группе -NR28C(O)OR29, где R28 является водородом или алкилом и R29 выбран из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Термин «арил» или «Ar» относится к одновалентной ароматической карбоциклической группе, содержащей от 6 до 14 атомов углерода и имеющей один цикл (например, фенил) или множество конденсированных циклов (например, нафтил или антрил), причем конденсированные циклы могут быть ароматическими или могут быть неароматическими (например, 2-бензоксазолинон, 2Н-1,4-бензоксазин-3(4Н)-он-7-ил и подобные), при условии что точкой присоединения является атом в ароматическом кольце. Предпочтительные арилы включают фенил и нафтил.
Термин «замещенный арил» относится к арильным группам, замещенным 1-3 заместителями и предпочтительно 1-2 заместителями, выбранными из группы, состоящей из гидрокси, ацила, ациламино, ацилокси, алкила, замещенного алкила, алкокси, замещенного алкокси, алкенила, замещенного алкенила, алкинила, замещенного алкинила, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циклоалкокси, замещенного циклоалкокси, карбокси, группы сложного эфира карбоновой кислоты, циано, тиола, циклоалкила, замещенного циклоалкила, галогена, нитро, гетероарила, замещенного гетероарила, гетероциклической группы, замещенной гетероциклической группы, гетероарилокси, замещенного гетероарилокси, гетероциклилокси и замещенного гетероциклилокси.
Термин «арилокси» относится к группе арил-О-, включающей, например, фенокси, нафтокси и подобные группы.
Термин «замещенный арилокси» относится к замещенным арил-О-группам.
Термин «карбокси» относится к -СООН или ее солям.
Термин «группа сложного эфира карбоновой кислоты» относится к группам: -С(О)О-алкил, -С(О)О-замещенный алкил, -С(О)О-алкенил, -С(О)О-замещенный алкенил, -С(О)О-алкинил, -С(О)О-замещенный алкинил, -С(О)О-арил, -С(О)О-замещенный арил, -С(О)О-гетероарил, -С(О)О-замещенный гетероарил, -С(О)О-гетероциклическая группа и -С(О)О-замещенная гетероциклическая группа. Предпочтительные группы сложных эфиров карбоновых кислот представляют собой -С(О)О-алкил, -С(О)О-замещенный алкил, -С(О)О-арил и -С(О)О-замещенный арил.
Термин «циклоалкил» относится к циклическим алкильным группам, содержащим от 3 до 10 атомов углерода, имеющим одно или множество циклических колец, необязательно содержащих от 1 до 3 экзокарбонильных или тиокарбонильных групп. Подходящие циклоалкильные группы включают, например, адамантил, циклопропил, циклобутил, циклопентил, циклогексил, циклооктил, 3-оксоциклогексил и подобные группы. Во множестве конденсированных циклов один или более из циклов может быть другим, чем циклоалкил (например, арил, гетероарил или гетероциклическое кольцо), при условии что точкой присоединения является циклический атом углерода циклоалкильной группы. В одном варианте циклоалкильная группа не содержит от 1 до 3 экзокарбонильных или тиокарбонильных групп. В другом варианте циклоалкильная группа содержит от 1 до 3 экзокарбонильных или тиокарбонильных групп. Понятно, что термин «экзо» относится к присоединению карбонила или тиокарбонила к циклическому атому углерода циклоалкильной группы.
В предпочтительном варианте циклоалкил включает алкильные группы, содержащие от 3 до 10 атомов углерода, имеющие одно или множество циклических колец, включающие, например, адамантил, циклопропил, циклобутил, циклопентил, циклооктил и подобные группы.
Термин «циклоалкенил» относится к циклическим алкенильным группам, содержащим от 4 до 10 атомов углерода, имеющим одно или множество циклических колец и дополнительно имеющим, по меньшей мере, 1 и предпочтительно от 1 до 2 внутренних участков этиленовой (>C=C<) ненасыщенности, необязательно содержащим от 1 до 3 экзокарбонильных или тиокарбонильных групп. Подходящие циклоалкенильные группы включают, например, циклопентенил, циклогексенил, циклооктенил, 3-оксоциклогекс-1,2-енил и подобные группы. В одном варианте циклоалкенильная группа не содержит от 1 до 3 экзокарбонильных или тиокарбонильных групп. В предпочтительном варианте циклоалкенильная группа содержит от 1 до 3 экзокарбонильных или тиокарбонильных групп. Понятно, что термин «экзо» относится к присоединению карбонила или тиокарбонила к циклическому атому углерода циклоалкенильной группы.
Термин «замещенный циклоалкил» и «замещенный циклоалкенил» относится к циклоалкильной или циклоалкенильной группе, имеющей от 1 до 5 заместителей, выбранных из группы, состоящей из алкила, замещенного алкила, алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циано, галогена, гидрокси, нитро, карбокси, группы сложного эфира карбоновой кислоты, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы. Предпочтительный замещенный циклоалкил и замещенный циклоалкенил включает циклоалкильную или циклоалкенильную группу, имеющую от 1 до 5 заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циано, галогена, гидрокси, нитро, карбокси, группы сложного эфира карбоновой кислоты, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Термин «циклоалкокси» относится -О-циклоалкильным группам.
Термин «замещенный циклоалкокси» относится к -О-замещенным циклоалкильным группам.
Термин «гуанидино» относится к группе -NHC(=NH)NH2 и термин замещенный «гуанидино» относится к -NR30C(=NR30)N(R30)2, где каждый R30 независимо представляет собой водород или алкил.
Термин «гало» или «галоген» относится к фтору, хлору, брому и иоду и предпочтительно включает в себя фтор или хлор.
Термин «галогеналкил» относится к алкильной группе, замещенной, по меньшей мере, одним галогеном, и включает в себя моногалогеналкил, полигалогеналкил или пергалогеналкил.
Термин «гетероарил» относится к ароматической группе, содержащей в цикле от 1 до 15 атомов углерода, предпочтительно от 1 до 10 атомов углерода, и от 1 до 4 гетероатомов, выбранных из группы, состоящей из кислорода, азота, серы, -S(O)- и -S(O)2-. Такие гетероарильные группы предпочтительно представляют собой ароматические группы, содержащие в цикле от 1 до 15 атомов углерода, предпочтительно от 1 до 10 атомов углерода, и от 1 до 4 гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы. Такие гетероарильные группы могут иметь один цикл (например, пиридил или фурил) или множество конденсированных циклов (например, индолизинил или бензотиенил).
Термин «замещенный гетероарил» относится к гетероарильным группам, замещенным 1-3 заместителями, выбранными из такой же группы заместителей, определенных для замещенного арила.
Термин «гетероарилокси» относится к группе -О-гетероарил и термин «замещенный гетероарилокси» относится к группе -О-замещенный гетероарил.
Термин «гетероцикл» или «гетероциклический» относится к насыщенной или ненасыщенной группе, имеющей один цикл или множество конденсированных циклов, содержащей в цикле от 1 до 10 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, состоящей из азота, серы, -S(O)-, -S(O)2- или кислорода, причем цикл может необязательно содержать от 1 до 3 экзокарбонильных или тиокарбонильных групп. Такие гетероциклические группы предпочтительно представляют собой насыщенную или ненасыщенную группу, имеющую один цикл или множество конденсированных циклов, содержащую в цикле от 1 до 10 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, состоящей из азота, серы или кислорода.
Во множестве конденсированных циклов один или более из циклов может быть другим, чем гетероциклический (например, арил, гетероарил или циклоалкил), при условии что точкой присоединения является атом гетероциклического кольца. В одном варианте гетероциклическая группа не содержит от 1 до 3 экзокарбонильных или тиокарбонильных групп. В предпочтительном варианте гетероциклическая группа содержит от 1 до 3 экзокарбонильных или тиокарбонильных групп. Понятно, что термин «экзо» относится к присоединению карбонила или тиокарбонила к циклическому атому углерода гетероциклической группы.
Термин «замещенный гетероциклический» относится к гетероциклическим группам, замещенным 1-3 такими же заместителями, которые были определены для замещенного циклоалкила. Предпочтительные заместители для замещенных гетероциклических групп включает гетероциклические группы, имеющие от 1 до 5 заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, арила, замещенного арила, арилокси, замещенного арилокси, циано, галогена, гидрокси, нитро, карбокси, группы сложного эфира карбоновой кислоты, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Примеры гетероциклов и гетероарилов включают, но без ограничения, азетидин, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, дигидроиндол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтилпиридин, хиноксалин, хиназолин, циннолин, карбазол, карболин, фенантридин, акридин, фенантролин, изотиазол, феназин, изоксазол, феноксазин, фенотиазин, имидазолидин, имидазолин, пиперидин, пиперазин, индолин, фталимид, 1,2,3,4,-тетрагидроизохинолин, 4,5,6,7-тетрагидробензо[b]тиофен, тиазол, тиазолидин, тиофен, бензо[b]тиофен, морфолинил, тиоморфолинил (отнесенный также к тиаморфолинилу), пиперидинил, пирролидин, тетрагидрофуранил и подобные группы.
Термин «гетероциклилокси» относится к группе -О-гетероцикл, и термин «замещенный гетероциклилокси» относится к группе -О-замещенный гетероцикл.
Термин «оксикарбониламино» относится к группе -О(СО)NR31R32, где R31 и R32 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, гетероарила, замещенного гетероарила, гетероциклической группы, замещенной гетероциклической группы, и где R31 и R32 вместе с атомом азота, к которому они присоединены, объединены с образованием гетероциклической или замещенной гетероциклической группы.
Термин «оксикарбонилокси» относится к группе -ОС(О)OR33, где R33 выбран из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы.
Термин «тиол» относится к группе -SH.
Термин «тиоалкил» относится к группе -S-алкил, и термин «замещенный тиоалкил» относится к группе -S-замещенный алкил.
Термин «аминокислота» относится к β-аминокислотам или к α-аминокислотам формулы HR34NCH(R2)COOH, где R2 является таким, как он определен выше и R34 представляет собой водород, алкил, замещенный алкил или арил. α-Аминокислота предпочтительно является одной из двадцати встречающихся в природе L-аминокислот.
Термин «фармацевтически приемлемая соль» относится к фармацевтически приемлемым солям соединения, полученным из множества органических и неорганических противоионов, хорошо известных в данной области и включающих, например, но без ограничения, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и подобные; и когда молекула содержит основную функциональную группу, - солям органических или неорганических кислот, таким как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и подобные соли.
Понятно, что во всех вышеопределенных замещенных группах полимеры, достигаемые установлением заместителей с дополнительными заместителями для них самих (например, замещенный арил, имеющий в качестве заместителя замещенную арильную группу, которая сама замещена замещенной арильной группой и т.д.), не предназначены для включения в данное изобретение. В таких случаях максимальное число таких заместителей равно трем. То есть для каждого из вышеуказанных определений имеется ограничение, например замещенные арильные группы ограничены до: -замещенный арил-(замещенный арил)-замещенный арил.
Понятно, что вышепредставленные определения не предназначены для включения недопустимых видов замещения (например, метил, замещенный 5 фторсодержащими группами или гидроксильной группой в альфа-положении к этенильной или ацетиленовой ненасыщенности). Такие недопустимые виды замещения хорошо известны специалистам в данной области.
Общие методы синтеза
Соединения данного изобретения могут быть получены из легкодоступных исходных веществ с использованием следующих общих методов и методик. Понятно, что если даны типичные или предпочтительные условия процесса (то есть температуры реакции, время, мольные соотношения реагентов, растворители, давления и т.д.), в том случае если не указано иначе, могут быть также использованы другие условия процесса. Оптимальные условия реакций могут изменяться в зависимости от конкретно используемых реагентов или растворителя, но такие условия могут быть определены специалистом в данной области с помощью общеизвестных методов оптимизации.
Для специалистов в данной области очевидно, что дополнительно могут быть необходимы защитные группы, способные препятствовать протеканию нежелательных реакций некоторых функциональных групп. Подходящие защитные группы для различных функциональных групп, а также подходящие условия для их защиты и снятия хорошо известны специалистам в данной области. Так например, многочисленные защитные группы раскрыты в: T.W. Greene and P.G.M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999 и в цитированных в данном литературном источнике ссылках.
Если соединения данного изобретения содержат один или более хиральных центров, такие соединения могут быть получены или выделены в виде чистых стереоизомеров, то есть в виде отдельных энантиомеров или диастереомеров или в виде смесей, обогащенных стереоизомерами. Все такие стереоизомеры (и обогащенные смеси) включены в область данного изобретения, если не указано иначе. Чистые стереоизомеры (или обогащенные смеси) могут быть получены, например, с использованием оптически активных исходных веществ или стереоселективных реагентов, хорошо известных специалистам в данной области. Альтернативно, рацемические смеси таких соединений могут быть разделены с использованием, например, хиральной колоночной хроматографии, хиральных разделяющих агентов и подобных средств.
Общий метод получения представленных в данном описании соединений иллюстрируют следующие протоколы синтеза.
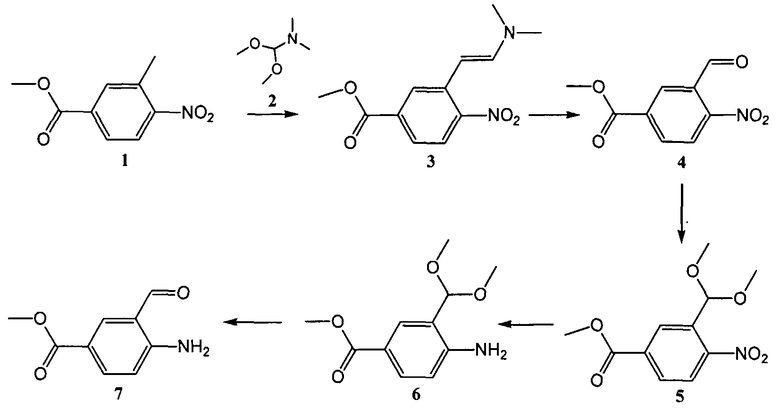
Схема I
Общая схема синтеза сложного метилового эфира 4-амино-3-формилбензойной кислоты 7
Схема I иллюстрирует традиционное получение соединения 7, представляющего собой сложный метиловый эфир 4-амино-3-формилбензойной кислоты, которое является исходным продуктом для получения хинолиновых или замещенных хинолиновых групп, то есть Het-Y. Как показано на схеме I, соединение 1, представляющее собой коммерчески доступный сложный метиловый эфир 3-метил-4-нитробензойной кислоты, контактируют, по меньшей мере, со стехиометрическим эквивалентом соединения 2, являющегося коммерчески доступным диметоксиметилдиметиламином, известным также как N,N-диметилформамиддиметилацеталь, при условиях, обеспечивающих образование соединения 3, представляющего собой сложный метиловый эфир 3-(2-диметиламиновинил)-4-нитробензойной кислоты. Реакцию предпочтительно проводят в инертном разбавителе, таком как N,N-диметилформамид, при повышенной температуре от около 100 до 160ºС в течение времени, достаточного для значительного завершения реакции, обычно от 12 до 48 часов. После завершения реакции образовавшийся продукт - соединение 3, может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные, или, альтернативно, он может быть использован на следующей стадии без очистки и/или выделения.
Соединение 3, представляющее собой сложный метиловый эфир 3-(2-диметиламиновинил)-4-нитробензойной кислоты, затем превращают в формальдегид контактированием, по меньшей мере, со стехиометрическим количеством окислителя при соответствующих условиях, вследствие чего образуется соединение 4, являющееся сложным метиловым эфиром 3-формил-4-нитробензойной кислоты. Реакцию проводят в подходящем растворителе, таком как ТГФ, в присутствии воды. Реакцию предпочтительно проводят при температуре от комнатной температуры до 50ºС. Реакция продолжается до ее значительного завершения от 0,5 до 2 часов. Подходящие окислители хорошо известны в данной области и включают, например, периодат натрия - NaIO4. Хотя соединение 4 может быть получено таким способом, данное соединение является также коммерчески доступным.
Формильную группу сложного метилового эфира 3-формил-4-нитробензойной кислоты 4 защищают подходящей защитной группой, например такой как ацетальная, с образованием сложного метилового эфира 3-диметоксиметил-4-нитробензойной кислоты 5. Могут быть также использованы другие защитные группы, хорошо известные в данной области. В реакции ацетализации соединение 4 контактирует с кислым раствором в метаноле при условиях, подходящих для образования соединения 5. Реакцию предпочтительно проводят при повышенной температуре от 80 до 100ºС. Реакция продолжается до ее значительного завершения от около 10 до 30 минут. После завершения реакции соединение 5, представляющее собой сложный метиловый эфир 3-диметоксиметил-4-нитробензойной кислоты, может быть выделено традиционными методами, такими как экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки и/или выделения.
Нитрогруппу соединения 5, являющегося сложным метиловым эфиром 3-диметоксиметил-4-нитробензойной кислоты, затем превращают в первичный амин традиционными методами восстановления с получением соединения 6, представляющего собой сложный метиловый эфир 4-амино-3-диметоксиметилбензойной кислоты. Традиционные методы восстановления включают, но без ограничения, гидрирование с использованием Pd/C. Реакцию предпочтительно проводят в подходящем реакторе, таком как реактор Парра, при комнатной температуре в течение времени, достаточного для обеспечения значительного завершения реакции, от 15 минут до 1,5 часов. Соединение 6 может быть выделено традиционными методами, такими как экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки и/или выделения.
Соединение 7, представляющее собой сложный метиловый эфир 4-амино-3-формилбензойной кислоты, получают традиционным удалением защитной группы. Ацеталь соединения 6 предпочтительно гидролизуют в стандартных условиях реакции. Условия гидролиза ацеталя хорошо известны в данной области и могут быть достигнуты, например, обработкой соединения 6 кислым водным раствором. Реакцию предпочтительно проводят при комнатной температуре и продолжают до ее значительного завершения от около 15 до 30 минут. После завершения реакции полученное соединение 7, представляющее собой сложный метиловый эфир 4-амино-3-формилбензойной кислоты, может быть выделено традиционными методами, такими как экстракция, осаждение, хроматография, фильтрация и подобные методы.
Альтернативно соединение 7 может быть получено непосредственно из соединения 4 восстановлением сульфатом железа и гидроксидом аммония.
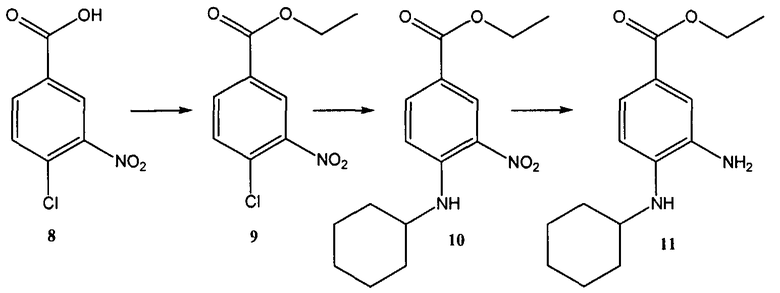
Схема II
Общая схема синтеза сложного этилового эфира 3-амино-4-циклогексиламинобензойной кислоты 11
Схема II иллюстрирует общий синтез соединения 11, представляющего собой сложный этиловый эфир 3-амино-4-циклогексиламинобензойной кислоты, который используют в качестве исходного продукта при получении 2-Het-Y замещенных 1-циклогексил-1Н-бензоимидазол-5-карбоновых кислот. Понятно, что циклогексильная группа на схеме II служит только для иллюстративных целей и что с использованием протоколов, представленных в данном описании, могут быть получены другие R-группы только лишь заменой циклогексиламина другими подходящими аминами.
Как показано на схеме II, соединение 8, представляющее собой коммерчески доступную 4-хлор-3-нитробензойную кислоту, превращают в соответствующий сложный этиловый эфир с использованием традиционных протоколов алкилирования. В одном предпочтительном методе соединения 8 контактируют с молярным избытком соответствующего спирта (этанола) в присутствии кислоты при повышенной температуре. Реакционную смесь выдерживают при повышенной температуре, предпочтительно при температуре кипения смеси спиртовой растворитель/реагент, до завершения реакции, от около 10 до 24-х часов. После завершения реакции образовавшееся соединение 9, представляющее собой сложный этиловый эфир 4-хлор-3-нитробензойной кислоты, может быть выделено традиционными методами, такими как экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, может быть использовано на следующей стадии без очистки и/или выделения.
Затем соединение 9, являющееся сложным этиловым эфиром 4-хлор-3-нитробензойной кислоты, аминируют с получением соединения 10, представляющего собой сложный этиловый эфир 4-циклогексиламино-3-нитробензойной кислоты. В данной реакции соединение 9 обрабатывают циклогексиламином в присутствии ТЭА. Реакцию предпочтительно проводят в инертном разбавителе, таком как ацетонитрил, при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение времени, достаточного для осуществления значительного завершения реакции, от 10 до 48 часов. После завершения реакции образовавшийся продукт, являющийся соединением 10, может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или, альтернативно, он может быть использован на следующей стадии без очистки и/или выделения.
Соединение 11, представляющее собой сложный этиловый эфир 3-амино-4-циклогексиламинобензойной кислоты, получают восстановлением функциональной нитрогруппы соединения 10. Протоколы восстановления хорошо известны в данной области и включают, например, гидрирование с использованием Pd/C. Реакцию предпочтительно проводят при комнатной температуре в подходящем инертном растворителе, таком как этилацетат, и продолжают до образования существенного количества продукта, которое обычно достигается от 2 до 8 часов. Образовавшееся соединение 11 представляет собой сложный этиловый эфир 3-амино-4-циклогексаламинобензойной кислоты, может быть выделено традиционными методами, такими как экстракция, осаждение, хроматография, фильтрация и подобные.
Тетразолил-замещенные соединения получают подобно с использованием 4-хлор-3-нитробензонитрила, как показано ниже на схеме II а.
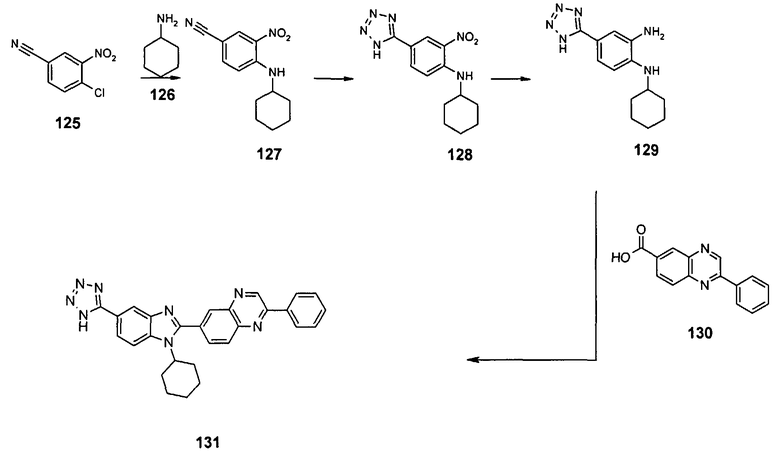
Схема IIa
Общая схема синтеза 1-циклогексил-5-(тетразол-2-ил)-2-(3-фенилхиноксалин-6-ил)бензоимидазола 131
Сначала соединение 125, представляющее собой коммерчески доступный 2-хлор-5-цианонитробензол, аминируют, как указано выше, соединением 126, являющимся циклогексиламином, с получением соединения 127. Как и прежде, циклогексиламин является типичным представителем подходящих аминов, которые могут быть использованы в данном протоколе. Превращение цианогруппы соединения 127, являющегося 2-циклогексиламино-5-цианонитробензолом, в соответствующее производное тетразолила, представляющее собой соединение 128, происходит при традиционных условиях, таких как контактирование соединения 127 с азидом триметилолова в присутствии кипящего толуола. Затем добавляют водный раствор кислоты и в течение нескольких часов при комнатной температуре происходит кислотный гидролиз, вследствие которого образуется соединение 128, которое может быть выделено традиционными методами, такими как экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки и/или выделения.
Затем нитрогруппу соединения 128 превращают в первичный амин традиционными методами восстановления с получением соединения 129. Традиционные методы восстановления включают, но без ограничения, гидрирование с использованием Pd/C. Реакцию предпочтительно проводят в подходящем реакторе, таком как реактор Парра, при комнатной температуре в течение времени, достаточного для обеспечения значительного завершения реакции, от 15 минут до 1,5 часов. Соединение 129 может быть выделено традиционными методами, такими как экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки и/или выделения.
Последующее обычное сочетание соединения 129 с соединением 130, представляющим собой 2-фенил-6-карбоксихиноксалин, обеспечивает получение соединения 131.
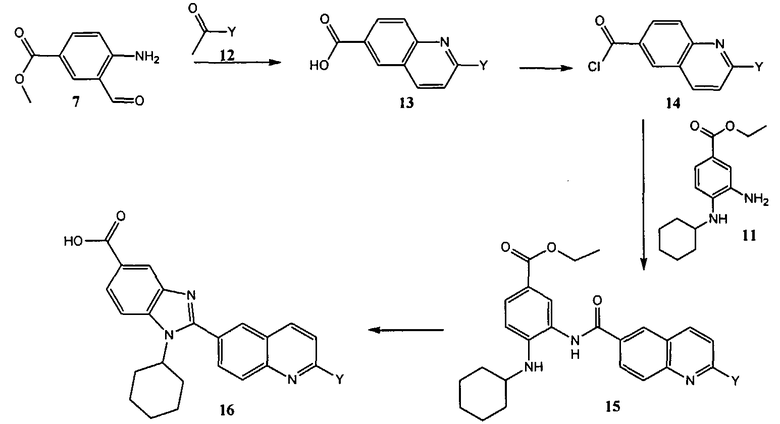
Схема III
Общая схема синтеза 1-циклогексил-2-(2-“Y”-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты
Полученное, как указывалось выше, соединение 7 объединяют с подходящим кетоном, таким как ацетофенон (где Y=фенил или замещенный фенил), в смеси основной/спиртовый растворитель, такой как КОН/EtOH, с получением ароматизированного продукта, являющегося соединением 13, представляющим собой 2-Y-хинолин-6-карбоновую кислоту. Y может быть арильной группой, такой как фенильная, замещенная фенильная, или алкильной группой, такой как метильная, или другой подходящей функциональной группой, в особенности такой как те, которые раскрыты в данном описании. Реакции предпочтительно происходят при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение времени, достаточного для осуществления значительного завершения реакции, от 10 до 48 часов. После завершения реакции образовавшееся соединение 13, представляющее собой 2-Y-хинолин-6-карбоновую кислоту, может быть выделено традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки и/или выделения.
Карбоксильную группу соединения 13 затем превращают в ацилхлорид обработкой соединения 13 подходящими хлорирующим реагентом. Хлорирующие реагенты хорошо известны в данной области, и предпочтительные хлорирующие реагенты включают тионилхлорид, оксалилхлорид, трихлорид фосфора и подобные. Реакционную смесь подвергают традиционным условиям реакции. Соединение 13 предпочтительно обрабатывают тионилхоридом, и реакция протекает в отсутствии других растворителей до ее значительного завершения. Обычно реакция происходит при повышенных температурах, таких как температура кипения тионилхлорида, в течение времени, достаточного для образования существенного количества продукта, от около 1 до 2 часов. После завершения реакции образовавшийся продукт ацил хлорид, которым является соединение 14, может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или, альтернативно, он может быть использован на следующей стадии без очистки и/или выделения.
Соединение 14, представляющее собой 2-Y-хинолин-6-карбонилхлорид, подвергается аминолизу соединением 11, полученным, как указывалось выше, с получением промежуточного продукта, которым является соединение 15, представляющее собой сложный этиловый эфир 4-циклогексиламино -3-[(2-Y-хиноин-6-карбонил)амино]бензойной кислоты. Реакцию аминолиза предпочтительно проводят в присутствии инертного растворителя, такого как ДМФА, с использованием, по меньшей мере, стехиометрического количества соединения 11. Реакцию предпочтительно проводят в течение времени, достаточного для значительного завершения реакции. Соединение 15 может быть выделено традиционными методами, такими как экстракция, фильтрация, хроматография и подобные, и использовано на следующей стадии без дополнительной очистки.
Затем соединение 15 обрабатывают уксусной кислотой для осуществления циклизации и получения сложного этилового эфира 1-циклогексил-2-(2-Y-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (не показано). Циклизацию предпочтительно осуществляют при повышенных температурах, обычно при температурах кипения растворителя, обычно при температурах от 130 до 145ºС в течение времени, достаточного для значительного завершения реакции, от 2 до 5 часов. После завершения реакции образовавшееся соединение может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки и/или выделения. Альтернативный вариант протокола циклизации включает обработку соединения 15 10% ТФУ в 1,2-дихлорэтане при температуре кипения раствора в течение времени, достаточного для осуществления значительного завершения реакции, от 3 до 10 часов. После завершения реакции образовавшееся соединение может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки/или выделения. Затем сложный этиловый эфир удаляют в щелочной среде в подходящем водно-спиртовом растворителе, таком как этанол. Этиловый эфир предпочтительно обрабатывают основанием, таким как водный раствор NaOH, при повышенной температуре, такой как температура кипения растворителя. Реакции дают возможность продолжаться в течение времени, достаточного для осуществления значительного завершения реакции, обычно от 1 до 3 часов, с получением соединения 16. После завершения реакции образовавшееся соединение может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, кроме того, очищенное соединение 16 может быть превращено в кислую соль обработкой HCl или другую кислую соль в подходящем растворителе, таком как диоксан и простой эфир, в течение времени, достаточного для обеспечения существенного образования соли, и затем выделено традиционными методами извлечения.
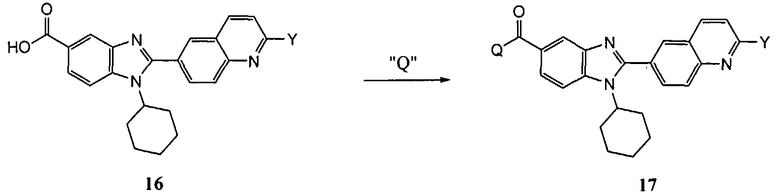
Схема IV
Общая схема синтеза соединения 17, представляющего собой 5-“Q”-1-циклогексил-2-(2-“Y”-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновую кислоту
Затем соединение 16 дериватизируют подходящей группой Q. Предпочтительные Q группы включают такие, которые вызывают образование Z групп, которые перечислены для соединений формулы I, когда Z является таким, как он определен в формуле I, подгруппа (b), (с-С(O)NHSO2R4) или (d). Соединение 16 предпочтительно сочетают с Q, где Q представляет собой группу, содержащую гетероатом, предпочтительно амино или замещенную аминогруппу, включающую, например, замещенные аминокислоты, такие как L-5-гидрокситриптофан. Подходящие аминогруппы хорошо известны в данной области и включают множество коммерчески доступных первичных или вторичных аминов и предпочтительно аминокислоту или замещенную аминокислоту, произведенную от L-изомера аминокислоты. Соединение 16 активируют традиционными средствами, такими как обработка HBTU и DIEA, при комнатной температуре в течение времени, достаточного для ускорения активации, от 5 до 20 минут. Затем активированное соединение 16 обрабатывают Q, например азотсодержащей группой, в инертном разбавителе, таком как N,N-диметилформамид, при комнатной температуре в течение периода времени, достаточного для осуществления значительного завершения реакции, от 30 минут до 1 часа. После завершения реакции образовавшийся продукт, который является соединением 17, может быть выделено традиционными методами, такими как экстракция, фильтрация, хроматография и подобные. Очищенный продукт может быть также превращен в кислую соль обработкой соединения 17 соответствующей кислой солью, такой как ТФУ, в течение времени, достаточного для существенного завершения реакции.
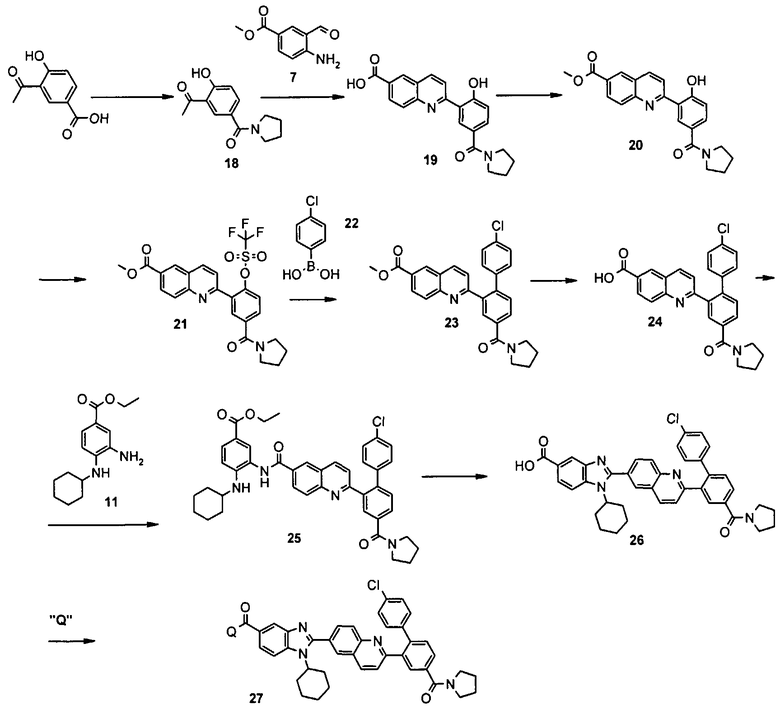
Схема V
Общая схема синтеза для синтеза производных 2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ила
Схема V иллюстрирует общую схему синтеза, предназначенную для синтеза 2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ильных производных указанных в заголовке соединений. Карбоксильную группу коммерчески доступной 3-ацетил-4-гидроксибензойной кислоты превращают в амид сочетанием с пирролидином. Если требуются другие первичные или вторичные амидные группы, в данной реакции могут быть использованы другие азотсодержащие основания. Реакцию предпочтительно проводят в присутствии инертного растворителя, такого как ДМФА, и осуществляют при комнатной температуре в течение времени, достаточного для обеспечения существенного превращения в продукт, которым является 1-[2-гидрокси-5-(пирролидин-1-карбонил)фенил]этанон 18, от 30 минут до 2 часов. После завершения реакции образовавшийся продукт может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или, альтернативно, он может быть использован в последующей реакции без дополнительной очистки.
Соединение 18 обрабатывают полученным, как указывалось выше, соединением 7 в спиртовом растворителе. Обработка смеси основанием в инертной атмосфере обеспечивает условия, подходящие для циклизации и получения соединения 19. Циклизацию предпочтительно осуществляют при повышенных температурах в течение времени, достаточного для обеспечения значительного завершения реакции, от 10 до 48 часов. Подходящее основание/растворитель может представлять собой, например, КОН/этанол, хотя могут быть также использованы другие основания и растворители. После завершения реакции образовавшееся соединение 19 может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующих стадиях синтеза без очистки и/или выделения.
Карбоновую кислоту соединения 19 защищают в виде сложного метилового эфира обработкой соединения 19 метанолом в кислой среде при обычных условиях реакции. Реакцию предпочтительно осуществляют при повышенной температуре от 50 до 80ºС в течение такого времени, чтобы происходило существенное превращение исходного продукта в сложный метиловый эфир, от 12 до 24 часов. Соответствующий сложный метиловый эфир 20 сразу после получения может быть выделен традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно он может быть использован на следующих стадиях синтеза без очистки и/или выделения.
Затем фенол 20 превращают в соответствующий трифлат или другую подходящую удаляемую группу обработкой соединения 20, например ангидридом трифторуксусной кислоты. Реакцию предпочтительно проводят в инертном растворителе, таком как ДХМ (DCM), в присутствии такого основания, как ДМАП (DMAP) или пиридин. Реакцию обычно проводят при комнатной температуре в течение времени, достаточного для обеспечения значительного завершения реакции, от около 10 до 48 часов. Соединение 21 может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующих стадиях синтеза без очистки и/или выделения.
Соединение 21 сочетают с подходящей бороновой кислотой, такой как пара-хлорфенилбороновая кислота 22, с получением бифенильного производного 23. Если требуются другие заместители или типы замещения, могут быть использованы другие бороновые кислоты. Реакцию проводят при традиционных условиях реакции сочетания в присутствии литиевой соли и палладиевого катализатора в диоксане и инертной атмосфере. Реакцию предпочтительно проводят при повышенных температурах, таких как температура кипения растворителя, в течение времени, достаточного для предоставления возможности существенному завершению реакции, от 10 до 48 часов. Соединение 23 может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующих стадиях синтеза без очистки и/или выделения.
Затем сложный метиловый эфир соединения 23 удаляют в щелочной среде с получением соединения 24, которое может быть использовано на следующих стадиях синтеза без очистки и/или выделения. Протоколы удаления защиты хорошо известны специалистам в данной области, и предпочтительно реакция включает обработку соединения 23 подходящим основанием, таким как водный раствор гидроксида натрия, в спиртовом растворителе при температуре перегонки в течение времени от 1 до 3 часов с получением хинолинкарбоновой кислоты 24.
Карбоновую кислоту 24 затем обрабатывают полученным, как указывалось выше, соединением 11 при условиях, походящих для получения амидной связи. Соединение 24 предпочтительно активируют, например, HATU и DIEA, при комнатной температуре в течение времени от 10 до 30 минут и затем обрабатывают соединением 11 при комнатной температуре в течение времени, достаточного для осуществления значительного завершения реакции, от 10 до 48 часов. Образовавшийся амид 25 может быть выделен такими традиционными методами, как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, он может быть использован на последующих стадиях синтеза без очистки и/или выделения.
Соединение 25 затем обрабатывают уксусной кислотой для осуществления циклизации и получения сложного этилового эфира бензоимидазол-5-карбоновой кислоты (не показано). Циклизацию предпочтительно осуществляют при повышенных температурах, обычно при температуре кипения раствора, которая обычно составляет от 130 до 145ºС, в течение времени, достаточного для обеспечения значительного завершения реакции, от 2 до 5 часов. После завершения реакции образовавшееся соединение может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, альтернативно, оно может быть использовано на следующей стадии без очистки и/или выделения. Затем сложный этиловый эфир удаляют в щелочной среде в соответствующем спиртовом растворителе, таком как этанол. Сложный этиловый эфир предпочтительно обрабатывают основанием, таким как водный раствор NaOH, при повышенной температуре, такой как температура кипения растворителя. Реакции дают возможность продолжаться в течение времени, достаточного для ее существенного завершения, с получением соединения 26, от 1 до 3 часов. После завершения реакции образовавшееся соединение может быть выделено традиционными методами, такими как нейтрализация, экстракция, осаждение, хроматография, фильтрация и подобные; или, кроме того, очищенное соединение 26 может быть превращено в кислую соль обработкой HCl или другой кислой солью в соответствующем растворителе, таком как диоксан и простой эфир, в течение времени, достаточного для обеспечения существенного образования соли, которая затем может быть выделена традиционными методами извлечения.
Соединение 26 затем дериватизируют с подходящей Q группой, перечисленной выше. Соединение 26 предпочтительно сочетают с замещенной аминогруппой, предпочтительно замещенной аминокислотой, такой как L-5-гидрокситриптофан. Подходящие аминогруппы хорошо известны в данной области и включают множество коммерчески доступных первичных или вторичных аминов и предпочтительно аминокислоту или замещенную аминокислоту, произведенную от L-изомера аминокислоты. Соединение 26 активируют традиционными средствами, такими как обработка HBTU и DIEA, при комнатной температуре в течение времени, достаточного для ускорения активации, обычно от 5 до 20 минут. Активированное соединение 26 затем сочетают с Q, такой, как, например, аминогруппа, в инертном разбавителе, таком как N,N-диметилформамид, при комнатной температуре в течение времени, достаточного для осуществления значительного завершения реакции, от 30 минут до 1 часа. После завершения реакции образовавшийся продукт, которым является соединение 27, может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные. Очищенный продукт может быть также превращен в кислую соль обработкой соединения 27 соответствующей кислотой, такой как HCl, в течение времени, достаточного для значительного завершения реакции.
Соединение 26 показано в таблицах в виде соединения 204.
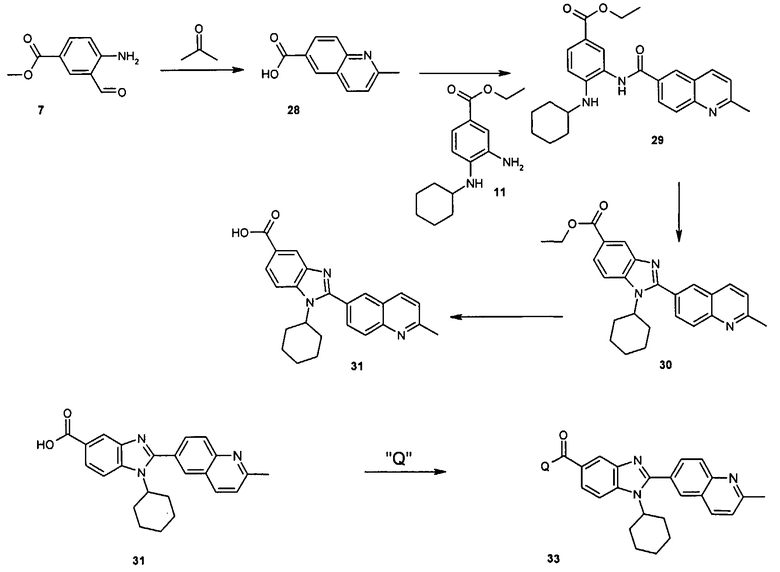
Схема VI
Общая схема синтеза метилзамещенных хинолиновых производных
Схема VI иллюстрирует схему синтеза для получения метилзамещенных хинолиновых производных указанных в заголовке соединений с использованием протоколов, раскрытых выше на схемах III и IV.
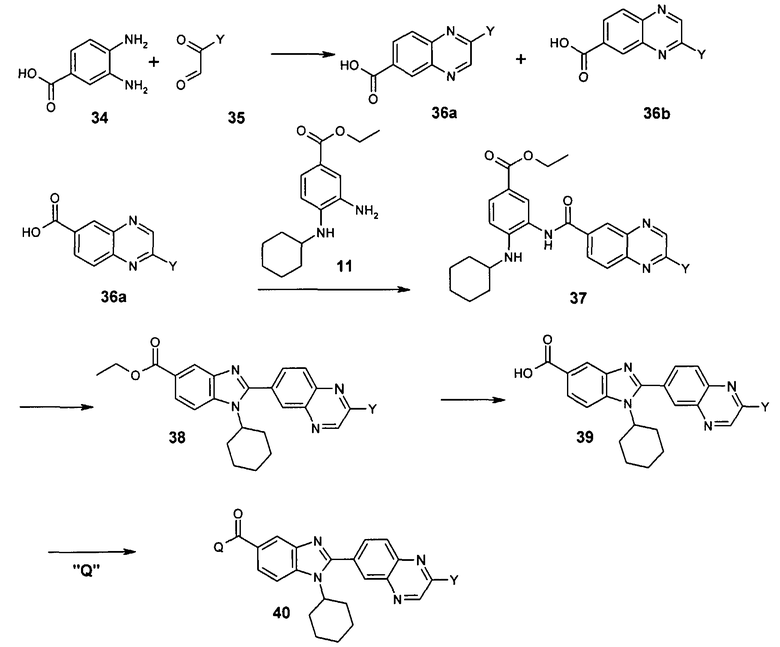
Схема VII
Общая схема синтеза 2-“Y”-замещенных хиноксалиновых производных
Схема VII иллюстрирует традиционное получение замещенных хиноксалиновых производных указанных в заголовке соединений. Как показано на схеме VII, коммерчески доступную 3,4-диаминобензойную кислоту обрабатывают легкодоступным дионом, таким как фенилглиоксаль (где Y=фенил), в условиях реакции, подходящих для осуществления циклизации в хиноксалин. Реакцию предпочтительно проводят в инертной атмосфере в кислой среде, такой как уксусная кислота. Реакции дают возможность протекать при повышенной температуре, обычно при температуре кипения раствора, в течение времени, достаточного для осуществления значительной циклизации, от около 1 до 4 часов. Полученные изомеры хиноксалина 36а и 36b могут быть разделены традиционными методами, такими как хроматография. Альтернативно, основной изомер, которым является соединение 36а, может быть получен с использованием спиртового растворителя, такого как этанол, при пониженных температурах, таких как 0ºС, в течение времени, достаточного для осуществления существенной циклизации, обычно от 10 до 48 часов. Затем выделяют основной изомер традиционными методиками разделения, такими как, например, фильтрация.
Затем соединение 36а сочетают с полученным, как указывалось выше, соединением 11 с получением промежуточного амидного продукта, которым является соединение 37. Реакцию предпочтительно осуществляют в инертном растворителе, таком как ДМФА, и соединение 36а активируют, например, обработкой HATU и DIEA, обычно от 5 до 30 минут. Соединение 11 предпочтительно добавляют к реакционной смеси при условиях, подходящих для получения амидного продукта. Реакцию предпочтительно проводят при температуре, близкой к комнатной, в течение времени, достаточного для получения существенного выхода продукта, которым является соединение 37, от около 10 до 24 часов. После завершения реакции образовавшийся амид может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или альтернативно, он может быть использован на следующей стадии без очистки и/или выделения.
Затем являющееся амидом соединение 37 циклизуют обработкой кислотой при повышенных температурах реакции. Реакцию предпочтительно проводят, например, при температуре кипения раствора в течение времени, достаточного для ускорения существенной циклизации, которое обычно составляет от 2 до 6 часов. Реакцию предпочтительно проводят в ледяной уксусной кислоте. Образовавшийся продукт, которым является соединение 38, может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или, альтернативно, он может быть использован на следующей стадии без очистки и/или выделения.
Сложный этиловый эфир соединения 38 затем удаляют обработкой водным раствором основания в подходящем спиртовом растворителе. Реакцию предпочтительно проводят при повышенных температурах в присутствии основания, такого как NaOH, в течение времени, достаточного для проведения существенного удаления защиты и получения соответствующей карбоновой кислоты - соединения 39. Образовавшийся продукт, которым является соединение 39, может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или альтернативно он может быть использован на следующей стадии без очистки и/или выделения.
Соединение 39 необязательно дериватизируют с подходящей амино- или замещенной аминогруппой, показанной как «Q». Аминогруппы хорошо известны в данной области, и очевидно, что в данной реакции могут быть использованы легкодоступные амины. Соединение 39 предпочтительно обрабатывают замещенной аминокислотой, такой как L-5-гидрокситриптофан. Реакцию предпочтительно проводят в инертном разбавителе, таком как ДМФА, при комнатной температуре в течение периода времени, достаточного для осуществления значительного завершения реакции, от 30 минут до 1 часа. После завершения реакции образовавшийся продукт 40 может быть выделен традиционными методами, такими как экстракция, фильтрация, хроматография и подобные; или, альтернативно, использован на следующей стадии без очистки и/или выделения.
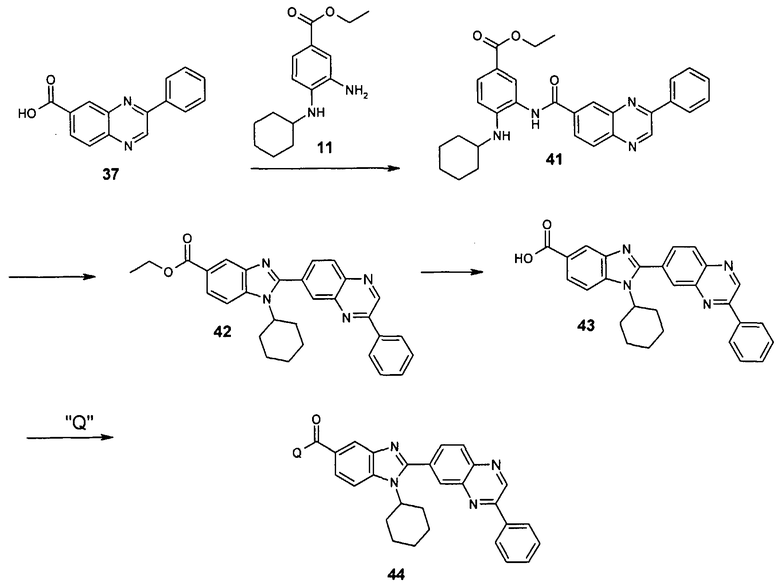
Схема VIIa
Общая схема синтеза 3-фенилзамещенных хиноксалиновых производных
Схема VIIa иллюстрирует традиционное получение 3-замещенных хиноксалиновых производных указанных в заголовке соединений. Более конкретно, в качестве примера выше приведено фенилзамещенное производное, хотя данная группа легко замещается, например, метильной группой, как показано в предыдущих примерах. Полученное, как указано выше, соединение 37 аминируют соединением 11 при традиционных условиях, таких как те, которые указаны выше, с получением хиноксалинового производного 41. Как и на вышеприведенных схемах синтеза, соединение 41 может подвергаться циклизации в кислой среде с получением циклизованного продукта 42. Гидролиз защитной группы - сложного этилового эфира, как и на вышеприведенных схемах, обеспечивает получение соединения 43. Необязательная дериватизация с аминогруппой, представленной «Q», дает продукт 44. Протоколы синтеза на данной схеме могут быть выведены из примеров, изображенных на вышеуказанных схемах.
В дополнение к вышеуказанным схемам следующие примеры иллюстрируют Het-Y-группы, которые входят в объем настоящего изобретения. Представленные ниже пояснительные соединения от I-A до I-W необязательно могут быть дополнительно дериватизованы с функциональными группами, например с амино, замещенным алкилом, гетероарилом, сульфонамидо или другими подходящими функциональными группами. Повсюду признается, что дополнительная дериватизация может потребовать использования защитных групп и стратегий для защитных групп с тем, чтобы могли следовать избирательные реакции. Представленные ниже сопроводительные иллюстративные примеры представляют собой предпочтительные протоколы синтеза, которые применимы при получении соединений формулы от I-A до I-W. На представленных ниже схемах R50, который выбран из водорода, Y или X', означает необязательный заместитель в Het (когда R50 не является водородом), где X' и Y являются такими, как они определены выше.
3-Замещенный хинолин Het-Y
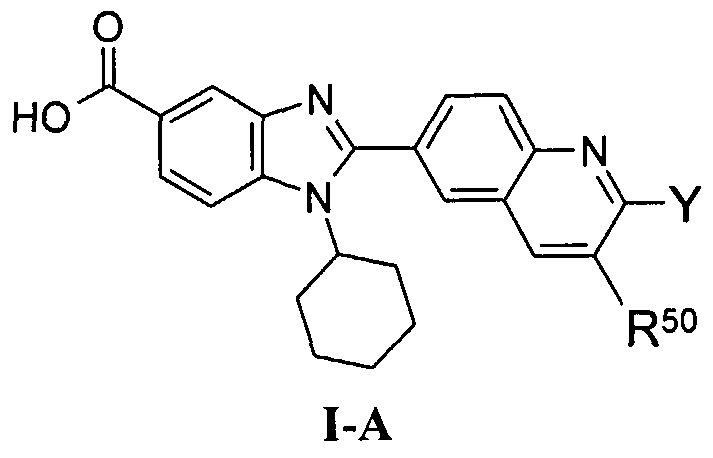
I-A может быть получено вышеуказанными протоколами с использованием промежуточного продукта 46, синтез которого является таким, как он описан ниже. Подлежащий синтезу предпочтительный промежуточный продукт 46 синтезируют по методике получения соединения 19, кроме того, что соединение 18 заменяют алкиларилкетоновыми аналогами 45, синтез которых раскрыт в: R.P. Thummel, S. Chirayl, C. Hery, J-L. Lim, T-L Wang, J. Org. Chem., 1993, 58, 1666-1671.
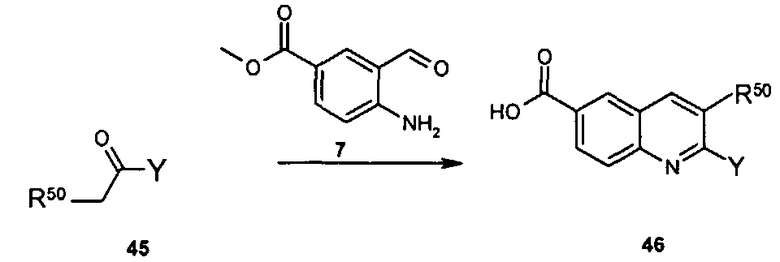
4-Замещенный хинолин Het-Y
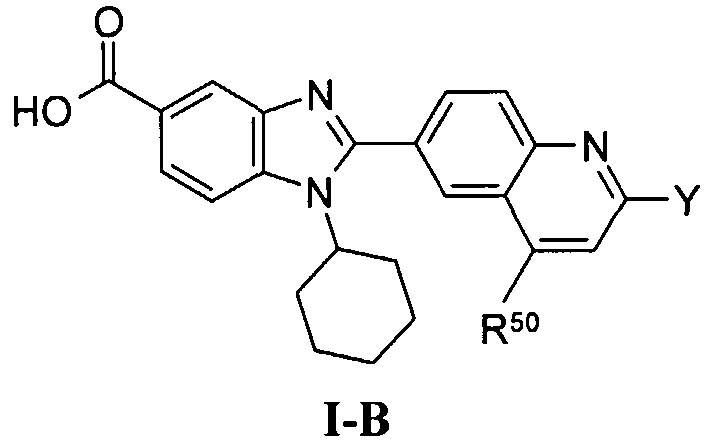
I-B может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 4-замещенной хинолин Het-Y-группой. I-B может быть получено, как показано выше, с использованием в качестве промежуточного продукта соединения 49, синтез которого представлен ниже. Предпочтительное соединение 49 синтезируют по методике получения соединения 19, кроме того, что соединение 7 заменяют алкиларилкетоном, представляющим собой соединение 47, синтез которого раскрыт в: R.P. Thummel, S. Chirayl, C. Hery, J-L. Lim, T-L Wang, J. Org. Chem., 1993, 58, 1666-1671.
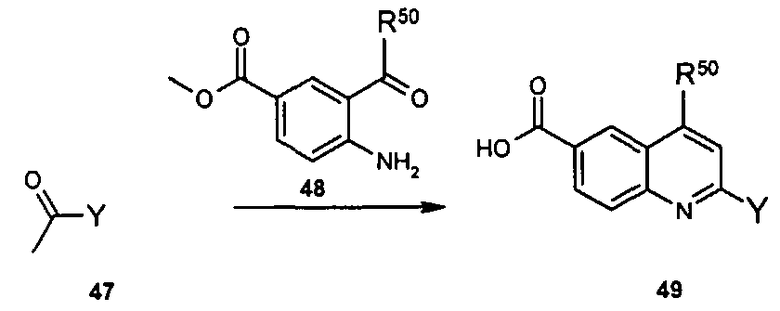
5- или 7- или 8-замещенный хинолин Het-Y
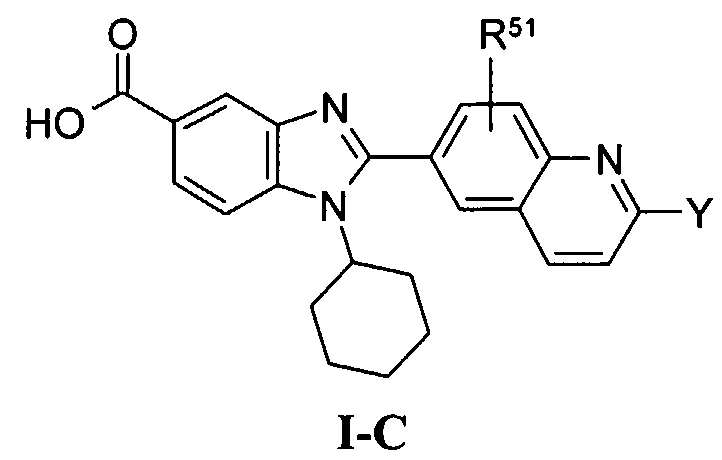
В формуле I-C R51 выбран из водорода, Х и Y, где Х и Y являются такими, как они определены выше. I-C может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 5- или 7- или 8-замещенной хинолин Het-Y-группой. I-С может быть получено из промежуточного продукта 51, синтез которого представлен ниже. Предпочтительный промежуточный продукт синтезируют по методике получения соединения 19, кроме того, что соединение 7 заменяют алкилзамещенными аминоальдегидными аналогами 50, синтез которых раскрыт в: R.P. Thummel, S. Chirayl, C. Hery, J-L. Lim, T-L Wang, J. Org. Chem., 1993, 58, 1666-1671.
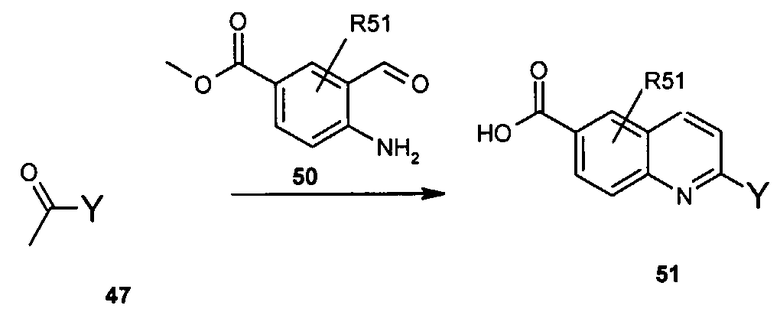
3,7-Хинолин Het-Y
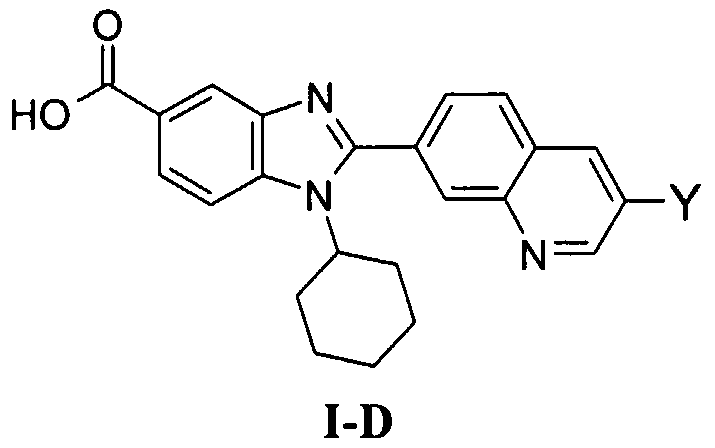
I-D может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-хинолин Het-Y-группой. I-D может быть получено из промежуточного продукта 54, синтез которого представлен ниже. Предпочтительный промежуточный продукт синтезируют по методике получения соединения 19, кроме того, что соединения 7 и 18 заменяют соответственно соединениями 53 и 52, синтез которых раскрыт в: R.P. Thummel, S. Chirayl, C. Hery, J-L. Lim, T-L Wang, J. Org. Chem., 1993, 58, 1666-1671.
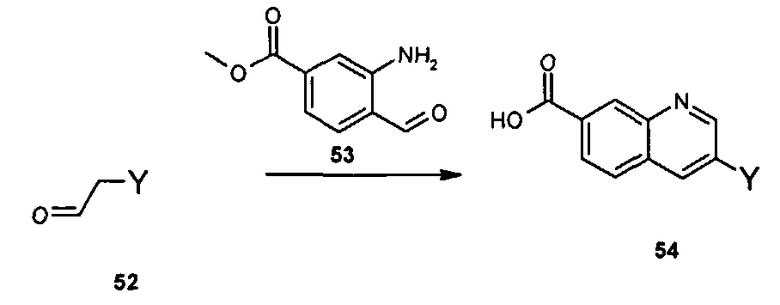
3,7-Изохинолин Het-Y
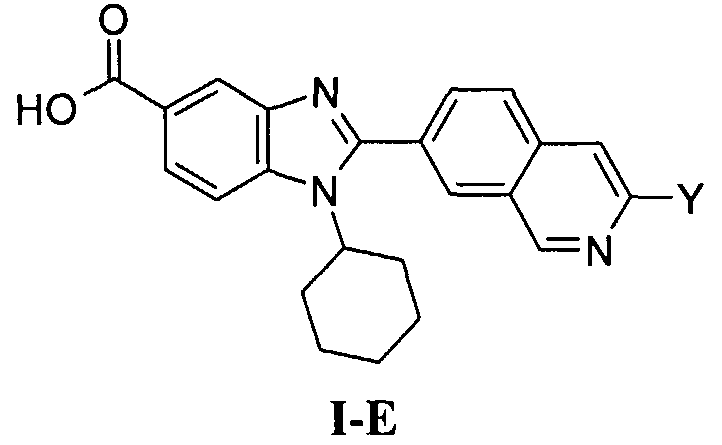
I-Е может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-изохинолин Het-Y-группой. I-Е может быть получено из промежуточного продукта 60, синтез которого представлен ниже. Предпочтительный промежуточный продукт 60, представляющий собой 3,7-изохинолин, синтезируют модификацией реакции Померанца-Фрича, раскрытой в: Gensler W. J., Organic Reactions, 1951, 6, 191 и Kucznierz, R. et al., Synth. Commun., 1999, 29, 1617 и показанной непосредственно ниже цифровыми обозначениями 55-60.
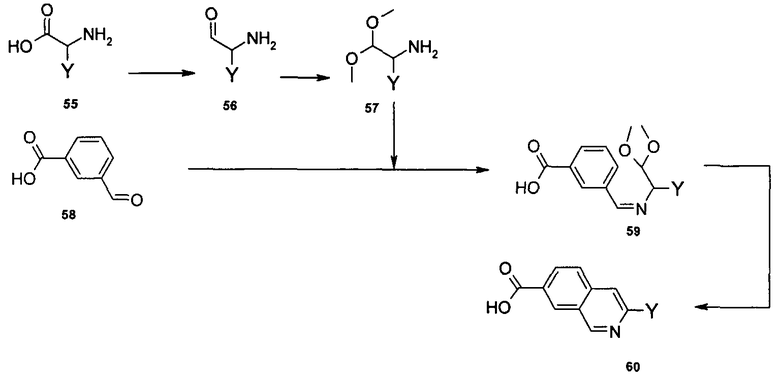
Альтернативно, для синтеза основного 3,7-изохинолинового промежуточного продукта используется другой предпочтительный протокол, включающий модификацию методики, раскрытой в: Numata A., et al., Synthesis, 1999, 306, и последующее восстановление изохинолин N-оксида трифенилфосфином, как описано в: Katrizky, A.R., Lam, J.N., Heterocycles, 1992, 33, 1011, как непосредственно показано ниже соединениями 61-65. Следует отметить, что такой же предпочтительный указанный выше промежуточный продукт дает альтернативная методика, иллюстрирующая протокол второй реакции, в результате которой получают соединение 65. Таким образом, соединение 60 является таким же промежуточным продуктом, как и соединение 65.
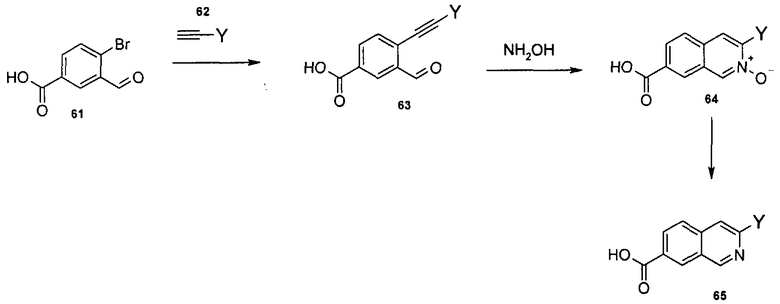
Хиназолин Het-Y
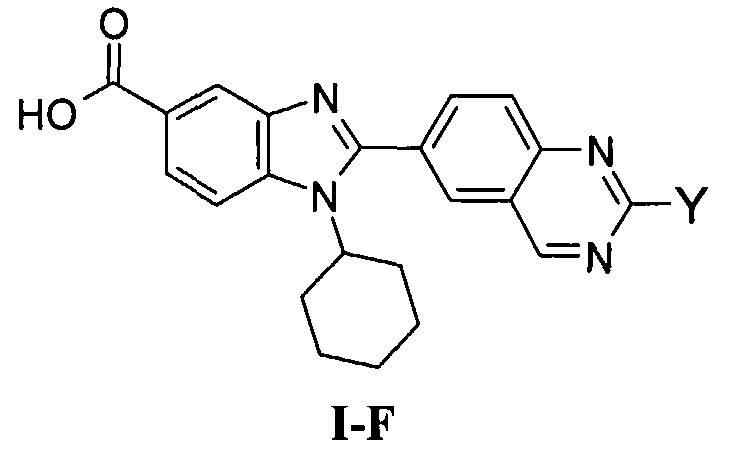
I-F может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-изохинолин Het-Y-группой. I-F может быть получено из промежуточного продукта 69, синтез которого представлен ниже.
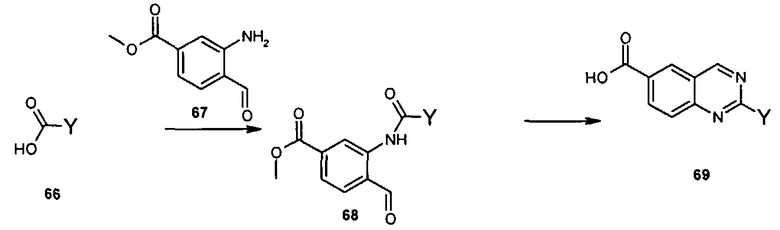
Для образования предпочтительного промежуточного продукта соединение 67 сначала ацилируют соединением 66 с использованием стандартного реагента сочетания (например, HATU). Образовавшийся амид 68 нагревают со спиртовым раствором аммиака, как описано A. Biscler et al., Berichte, 1895, 28, с получением промежуточного продукта 69.
Обратимое 2,6-хинолиновое связующее звено Het-Y
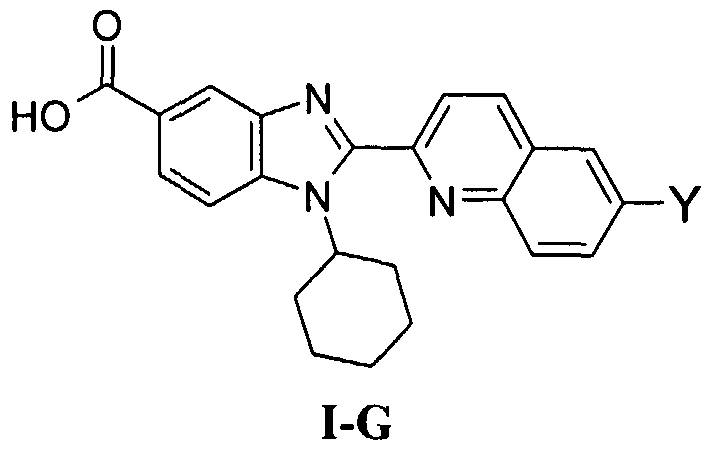
I-G может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 2,6-хинолин Het-Y-группой. I-G может быть получено из промежуточного продукта 72, который получен, как показано ниже.
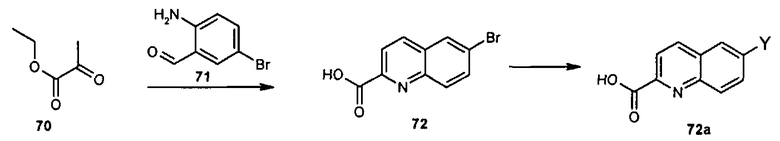
Предпочтительный промежуточный продукт синтезируют по методике получения соединения 19, кроме того, что соединения 7 и 18 заменяют соответственно этилпируватом 70 и 71, как раскрыто в: R.P. Thummel, S. Chirayl, C. Hery, J-L. Lim, T-L Wang, J. Org. Chem., 1993, 58, 1666-1671. Соединение 72 может быть, кроме того, дериватизовано с замещенной арильной группой с использованием стандартных методик сочетания, таких как методика Suzuki, с использованием соответствующим образом замещенной арилбороновой кислоты с получением промежуточного продукта 72а.
3,7-Изохинолин Het-Y
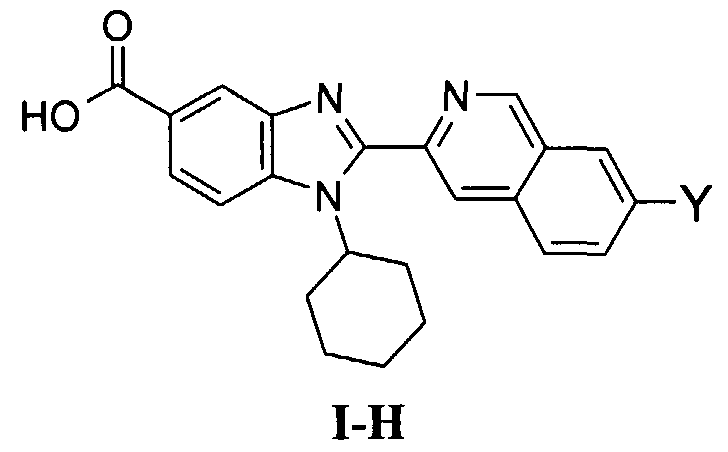
I-Н может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-изохинолин Het-Y-группой. I-Н может быть получено из промежуточного продукта 78, который получен, как показано ниже.
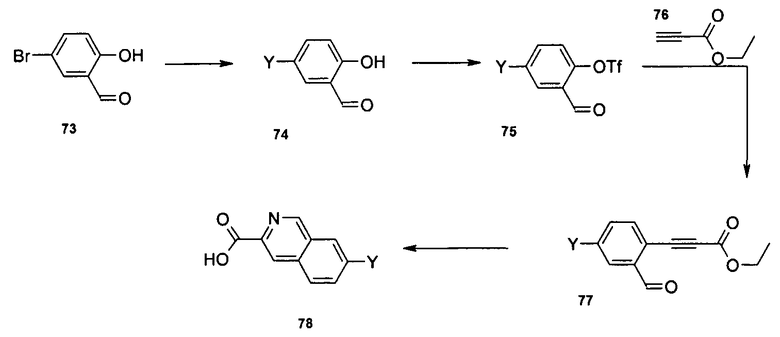
Предпочтительный «обращенный» промежуточный 3,7-изохинолин синтезируют взаимодействием коммерческого 5-бромсалицилового альдегида 73 с соответствующей арилбороновой кислотой в условиях реакции Suzuki. Продукт 74 затем превращают в трифлат 75 с использованием стандартных условий (ангидрид трифторуксусной кислоты, 2,6-лутидин в дихлорметане). Полученный промежуточный продукт и коммерческий этилпропионат 76 затем используют для синтеза требуемого изохинолина модификацией методики, раскрытой в: Numata A., et al., Synthesis, 1999, 306, с последующим восстановлением изохинолин N-оксида трифенилфосфином, как описано в: Katrizky, A.R., Lam, J. N., Heterocycles, 1992, 33, 1011, с получением промежуточного продукта 78.
Обратимое 3,7-хинолиновое связующее звено
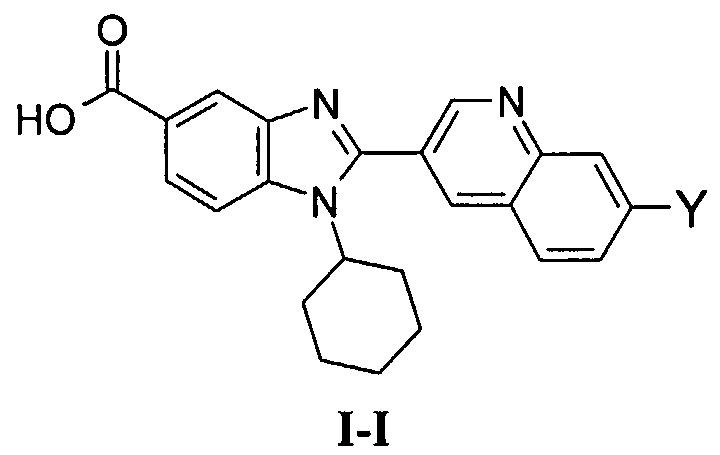
I-I может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с обратимой 3,7-хинолиновой Het-Y-группой. I-I может быть получено из промежуточного продукта 81, который получен, как показано ниже.
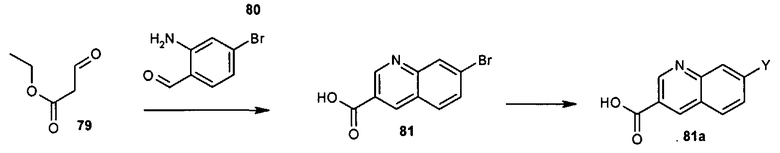
Предпочтительный промежуточный продукт 81 синтезируют по методике получения соединения 19, кроме того, что соединения 7 и 18 заменяют соответственно соединениями 79 и 80, как раскрыто в: R.P. Thummel, S. Chirayl, C. Hery, J-L. Lim, T-L Wang, J. Org. Chem., 1993, 58, 1666-1671, который затем сочетают с использованием условий для реакции Suzuki с соответствующим образом замещенной арилбороновой кислотой с получением промежуточного продукта 81а.
Обратимый хиноксалин Het-Y
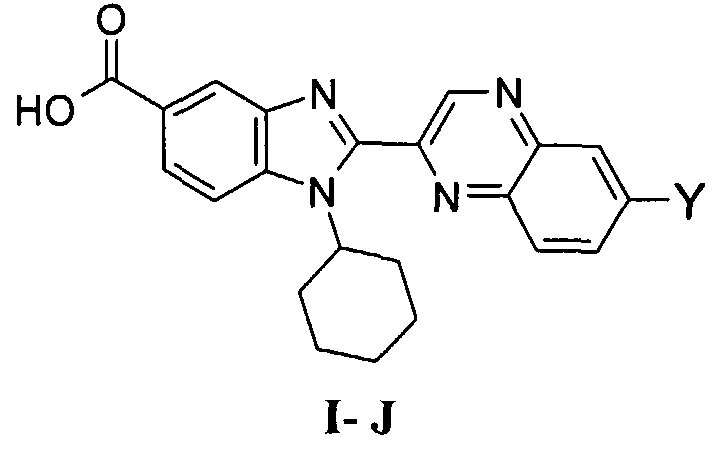
I-J может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с обратимой хиноксалиновой Het-Y-группой. I-J может быть получено из промежуточного продукта 85, который получен, как показано ниже.
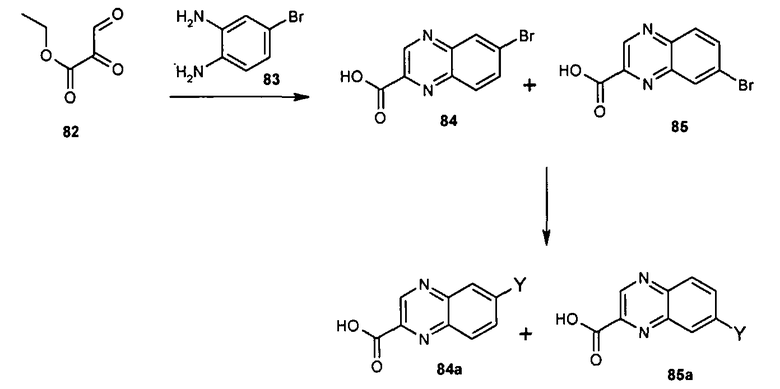
Предпочтительный промежуточный продукт синтезируют по методикам получения соединений 36 и 37 за исключением того, что 3,4-диаминобензойную кислоту 34 и фенилглиоксаль 35 заменяют соответственно соединениями 82 и 83, как раскрыто в: F. Roubinek, V. Bydzovsky и Z. Budesinsky, Coll. Czech. Chem. Commun., 49, 285, 1984. Образовавшиеся изомеры, соединения 84 и 85, затем разделяют и сочетают с использованием условий реакции Suzuki с соответствующим образом замещенной арилбороновой кислотой, при этом получают арилзамещенный обратимый хиноксалин, то есть соединения 84а и 85а.
[1,5]-Нафтиридин Het-Y
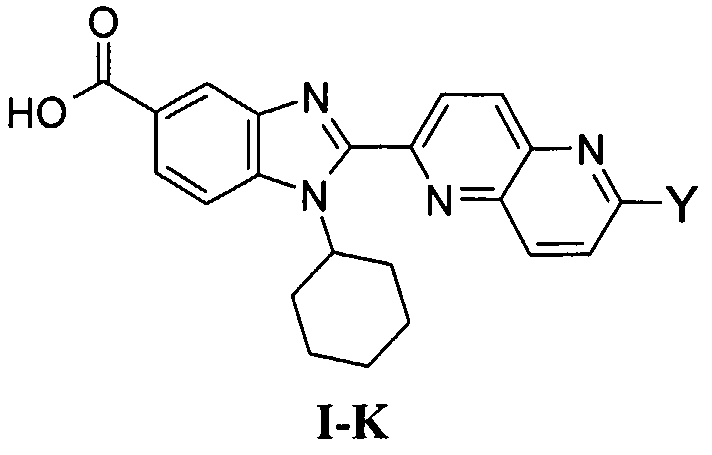
I-K может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с [1,5]нафтиридин Het-Y-группой. I-K может быть получено из промежуточного продукта 88, который получен, как показано ниже.
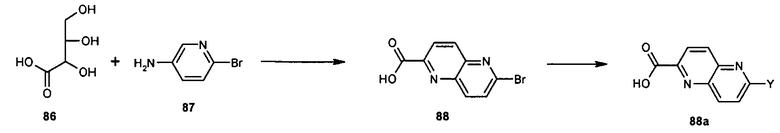
Предпочтительный промежуточный продукт, которым является соединение 88, синтезируют с применением методики, раскрытой в: X. Li, Z. Xu, E. F. Erin, M. C. Kozlowski, Tetrahedron Lett., 43(20), 3747 (2002), и с использованием соединения 87 (синтез раскрыт в: V. S. Binz, Chem. Ber., 68, 1935; 315; 321) и соединения 86. Затем полученный продукт сочетают в условиях реакции Suzuki с соответствующим образом замещенной арилбороновой кислотой с получением продукта арилзамещенного [1,5]нафтиридина, то есть соединения 88а.
3,7-Замещенный [1,8]-нафтиридин Het-Y
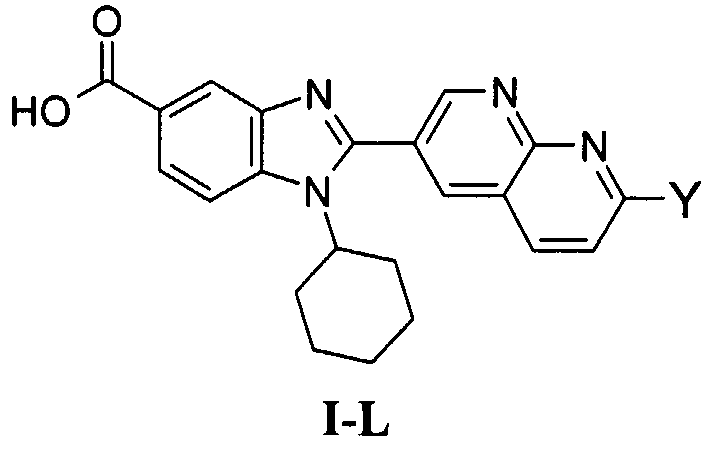
I-L может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-замещенной [1,8]нафтиридин Het-Y-группой. I-L может быть получено из промежуточного продукта 91, который получен, как показано ниже.
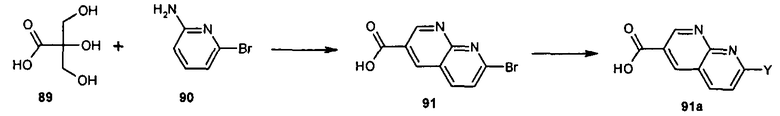
Предпочтительный промежуточный продукт, которым является соединение 91, синтезируют с применением методики, раскрытой в: H. Bock, T.T.H. Van, H. Schoedel, Monatsh. Chem., 127; 4; 1996; 391-396, и с использованием соединения 89 (синтез которого раскрыт в: Coleman, Glattfeld, J. Am. Chem. Soc., 66, 1944: 1183; 1186) и соединения 90. Затем бромзамещенный продукт сочетают в условиях реакции Suzuki с соответствующим образом замещенной арилбороновой кислотой с получением продукта арилзамещенного 3,7-замещенного [1,8]нафтиридина, то есть соединения 91а.
3,6-Замещенный [1,8]нафтиридин Het-Y
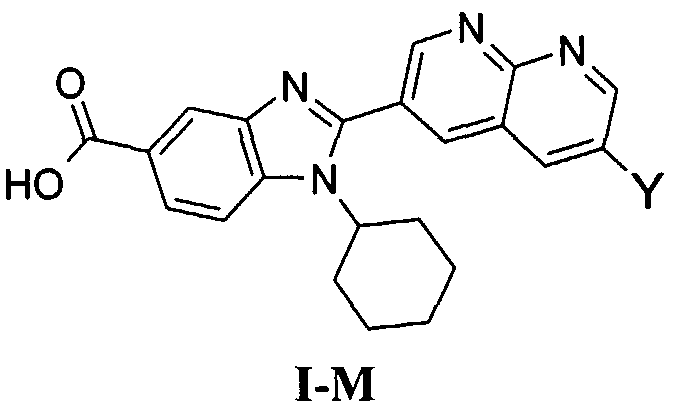
Соединение I-М может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,6-замещенной [1,8]нафтиридин Het-Y-группой. I-М может быть получено из промежуточного продукта 94, который получен, как показано ниже.
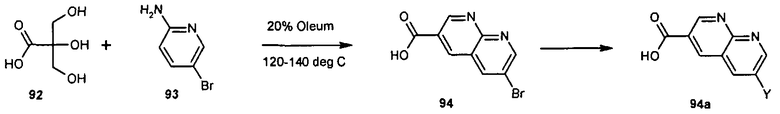
Предпочтительный промежуточный продукт, которым является соединение 94, синтезируют с применением методики, раскрытой в: H. Bock, T.T.H. Van, H. Schoedel, Monatsh. Chem., 127; 4; 1996; 391-396, и с использованием соединения 93 (синтез которого раскрыт в: Coleman, Glattfeld, J. Am. Chem. Soc., 66, 1944; 1183; 1186) и соединения 92. Затем полученный продукт сочетают в условиях реакции Suzuki с соответствующим образом замещенной арилбороновой кислотой с получением продукта арилзамещенного 3,6-замещенного [1,8]нафтиридина, то есть соединения 94а.
3,7-Циннолин Het-Y
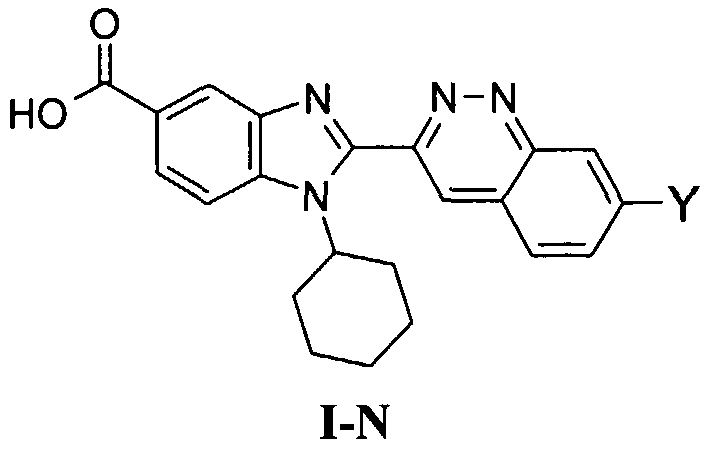
Соединение I-N может быть необязательно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-циннолин Het-Y-группой. I-N может быть получено из промежуточного продукта 102, который получен, как показано ниже.
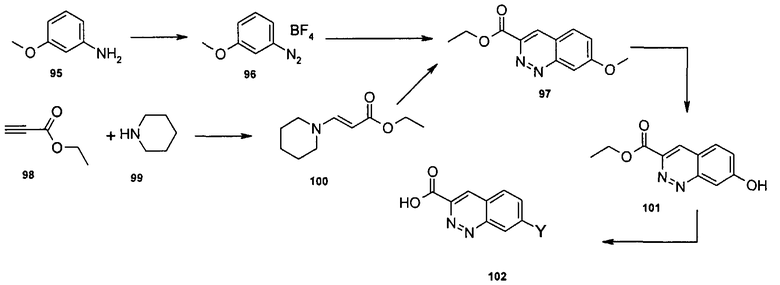
Предпочтительный промежуточный продукт 3,7-циннолин 102 синтезируют превращением коммерческого анизидина 95 в его диазоформу 96 (синтез раскрыт в: Hanson, P. et al., J. Chem. Soc. Perkin Trans. 2, 2002, 6, 1135) и затем сочетают с этил (Е)-3-пиперидиноакрилатом 100 с получением 3-карбоксиэтил-7-метоксициннолина 97, как раскрыто в: Kanner, C.B. Pandit, U. K., Tetrahedron, 1982, 38, 3597. Удаляют метоксильную группу в стандартной BBr3 среде с получением фенола 101. Затем промежуточный продукт 101 превращают в трифлат (не показано) в стандартных условиях (ангидрид трифторуксусной кислоты, 2,6-лутидин в дихлорметане) и, наконец, превращают в предпочтительный промежуточный продукт 102 взаимодействием с соответствующим образом замещенной арилбороновой кислотой в условиях реакции Suzuki.
2,6-1Н-Хинолин-4-он Het-Y
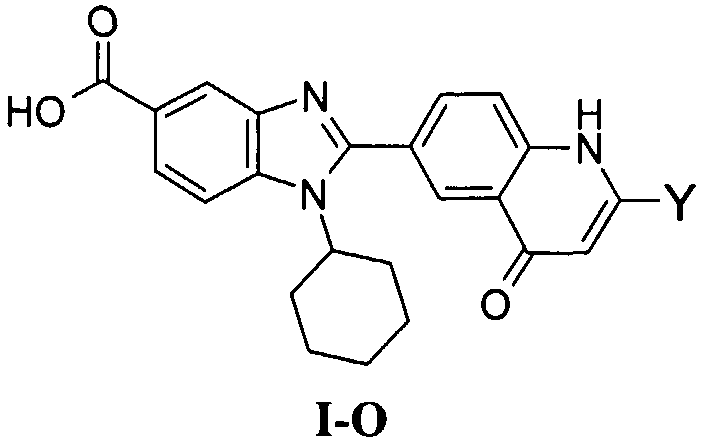
Соединение I-О может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 2,6-1Н-хинолин-4-он Het-Y-группой. I-О может быть получено из промежуточного продукта 107, который получен, как показано ниже.
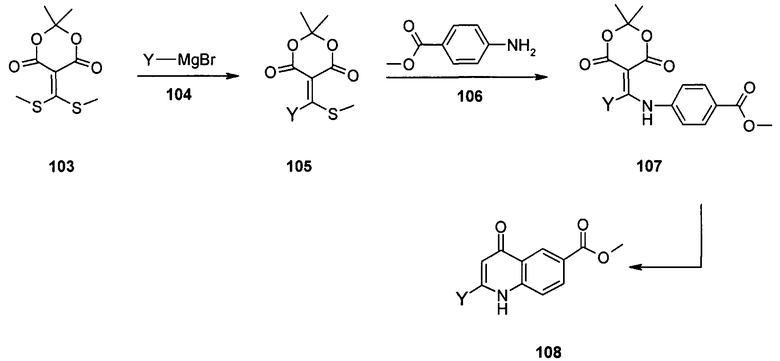
Основной промежуточный продукт 108 синтезируют измененным синтезом Конрада-Лимпача-Кнорра. Коммерческий исходный продукт 103 подвергают взаимодействию с соответствующим ароматическим реактивом Гриньяра, являющимся соединением 104 (или другим подходящим металлоорганическим соединением) с получением соединения 105, как раскрыто в: J. Chem. Perkin Trans. I 10, 1995; 1209-1214. В результате последующей нуклеофильной атаки амина 106 получается соединение 107, как раскрыто в: Synthesis 1987, 5, 482-483. Затем соединение 107 нагревают при 240ºС в Dowtherm с получением соединения 108, как раскрыто в: J. Med. Chem. 38; 22; 1995; 4439-4445 или в: Eur. J. Med. Chem. Chim. Ther. 32; 7-8; 1997; 547-570.
2,6-Хромен-4-он Het-Y
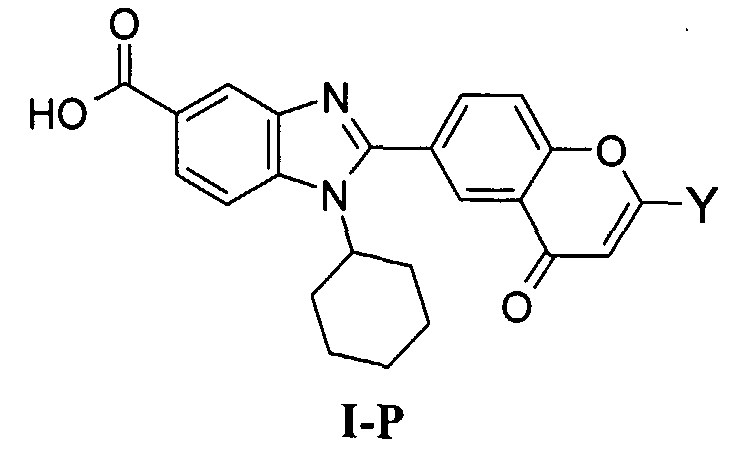
Соединение I-Р может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 2,6-хромен-4-он Het-Y-группой. I-Р может быть получено из промежуточного продукта 112, который получен, как показано ниже.
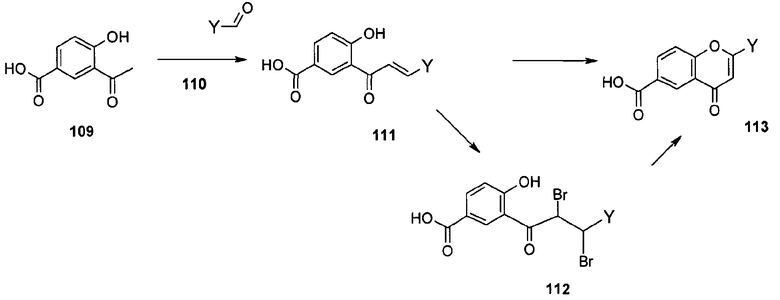
Предпочтительный промежуточный продукт синтезируют альдольной конденсацией, включающей обработку исходного продукта 109 соответствующим замещенным альдегидом 110 и гидроксидом натрия в этаноле, как раскрыто в: Eur. J. Med. Chem. Chim. Ther. 31; 11; 1996; 861-874 или J. Med. Chem. 23; 3; 1980; 335-338. Последующую циклизацию в соединение 113 осуществляют с использованием диоксида селена в амиловом спирте при 150ºС или DDQ, как описано в: JACS 77; 1955; 2223 или Eur. J. Med. Chem. Chim. Ther. 13; 1978; 33-39. Альтернативно двойную связь енона 11 бромируют с получением соединения 112, которое, в свою очередь, циклизуют с получением соединения 113 с использованием в качестве катализатора водного раствора гидроксида калия, как раскрыто в: J. Med. Chem. 23; 3; 1980; 335-338.
3,7-Изохромен-1-он Het-Y
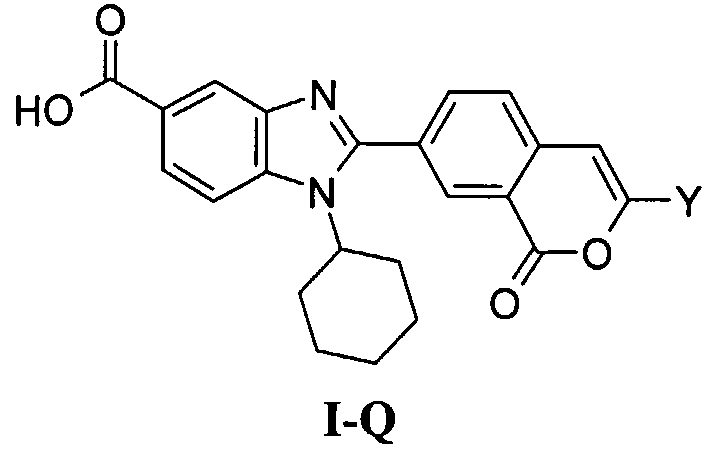
Соединение I-Q может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-изохромен-1-он Het-Y-группой. I-Q может быть получено из промежуточного продукта 119, который получен, как показано ниже.
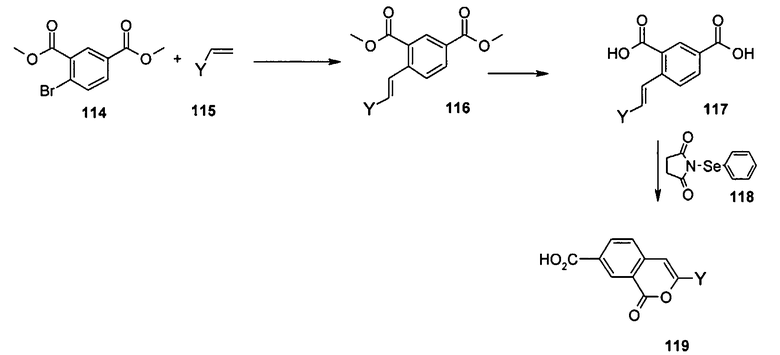
Предпочтительный промежуточный продукт 119 синтезируют модификацией методики, раскрытой в: Izumi, et al., Heterocycl. Chem. 31; 1; 1994; 145-152. Исходный продукт 114 (описанный в: J. Heterocycl. Chem. 31; 1; 1994; 145-152 сочетают с использованием стандартных условий реакции Хека с соответствующим стиролом 115 с получением соединения 116. Гидролиз сложных метиловых эфиров 116 с гидроксидом натрия дает свободную кислоту 117, которую затем циклизуют в окислительной среде с использованием селенового реагента 118 с получением промежуточного продукта 119.
2,6-(2,3-Дигидрофталазин-1,4-дион) Het-Y
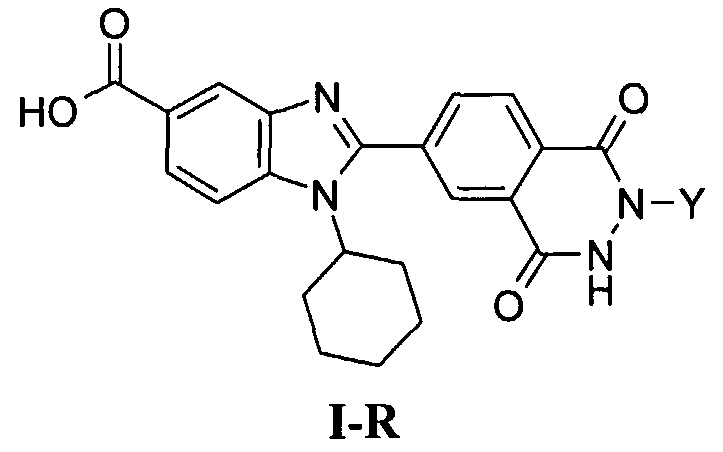
Соединение I-R может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 2,6-(2,3-дигидрофталазин-1,4-дион) Het-Y-группой. I-R может быть получено из промежуточного продукта 124, который получен, как показано ниже.
2,7-(2,3-Дигидрофталазин-1,4-дион) Het-Y
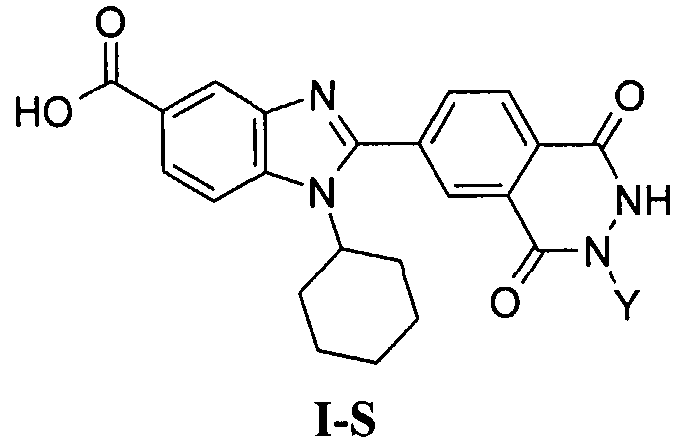
Соединение I-S может быть необязательно дополнительно модифицировано согласно вышеуказанным схемам с получением указанных в заголовке соединений с 2,7-(2,3-дигидрофталазин-1,4-дион) Het-Y-группой. I-S может быть получено из промежуточного продукта 124, который получен, как показано ниже.
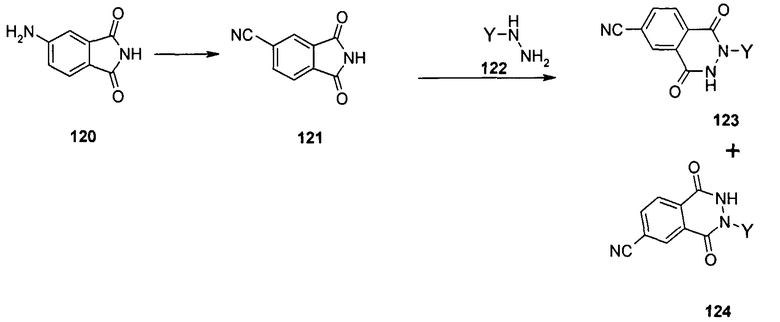
Предпочтительные промежуточные продукты синтезируют модификацией методики, раскрытой в: Watanabe, N., et al., J. Med. Chem. 1998, 41, 3367-3372. Амин 120 конвертируют в соединение 121 за счет образования и последующего нуклеофильного замещения диазониевой соли цианидом. Затем соединение 121 подвергают взаимодействию с соответствующим замещенным гидразином 122 с получением смеси соединений 123 и 124. После чего данную смесь разделяют хроматографией или кристаллизацией на его индивидуальные формы. Промежуточный продукт 123 затем используют для синтеза соединения I-R и промежуточный продукт 124 используют для синтеза соединения I-S.
3,7-Тетрагидрохинолин (I-T) и обращенный 3,7-тетрагидрохинолин (I-U) Het-Y
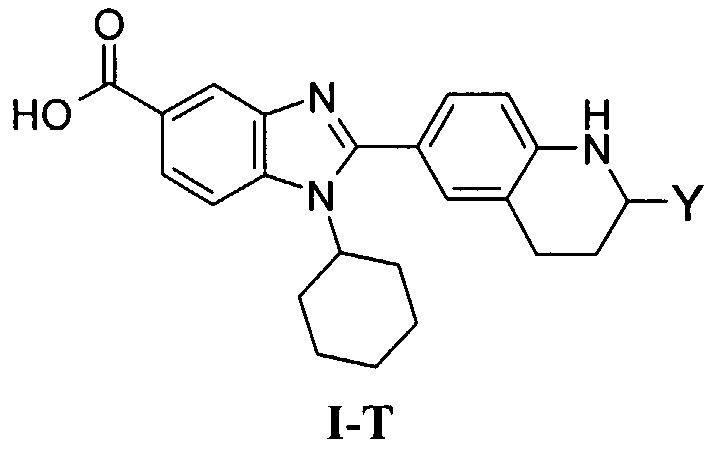
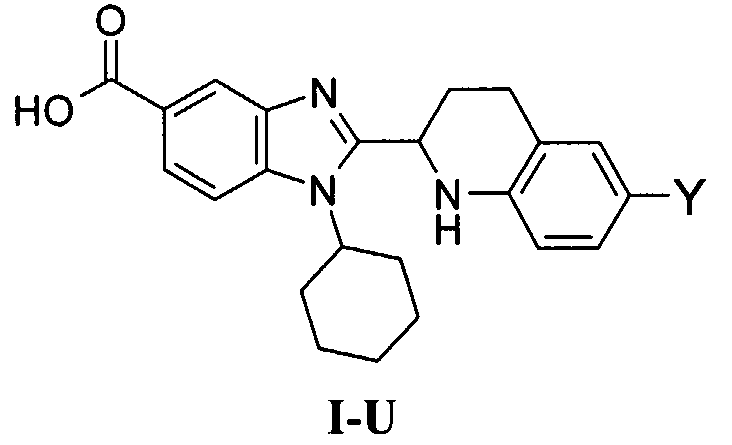
I-T и I-U могут быть необязательно дополнительно модифицированы согласно вышеуказанным схемам с получением указанных в заголовке соединений с 3,7-тетрагидрохинолиновой (I-T) и обращенной 3,7-тетрагидрохинолиновой (I-U) Het-Y-группой. I-T и I-U могут быть получены в результате селективного каталитического восстановления ароматической Het-Y молекулы с помощью PtO2 с использованием модифицированной методики, раскрытой в: Maillard, M.C., et al., J. Med. Chem., 1998, 41, 3048.
3,7-Тетрагидроизохинолин и обращенный 3,7-тетрагидроизохинолин Het-Y
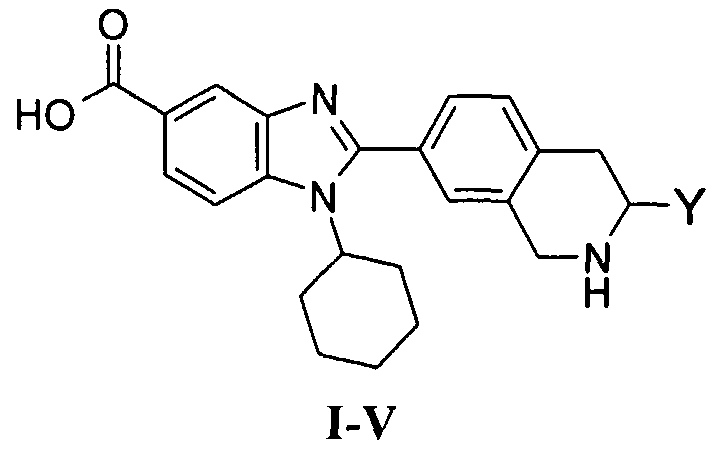
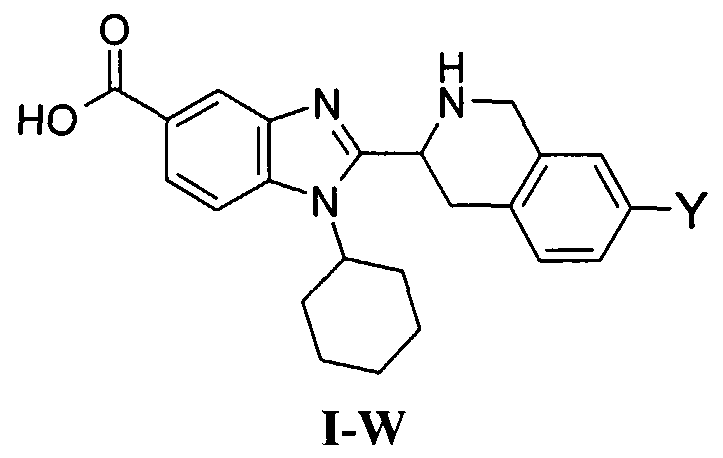
I-V и I-W могут быть использованы в вышеуказанных схемах для получения указанных в заголовке соединений с 3,7-тетрагидроизохинолиновой (I-V) и обращенной 3,7-тетрагидроизохинолиновой (I-W) Het-Y-группой. I-V и I-W могут быть получены в результате селективного каталитического восстановления ароматической Het-Y молекулы с помощью PtO2 с использованием модифицированной методики, раскрытой в: Maillard, M.C., et al., J. Med. Chem., 1998, 41, 3048.
Полезность
В настоящем изобретении предлагаются новые соединения, обладающие противовирусной активностью, включая активность против вирусов семейства Flaviviridae, таких как вирус гепатита С. Соединения данного изобретения угнетают репликацию вируса ингибированием ферментов, вовлеченных в репликацию, включающих РНК-зависимую РНК-полимеразу. Они могут также ингибировать другие ферменты, использованные в активности или пролиферации вирусов семейства Flaviviridae.
Для борьбы с вирусами соединения данного изобретения могут быть использованы в отдельности или в комбинации с другими соединениями.
Введение и фармацевтические композиции
Соединения данного изобретения следует вводить в терапевтически эффективном количестве любым из приемлемых способов введения лекарственных средств, которые служат подобным целям. Действительное количество соединения данного изобретения, то есть активного ингредиента, будет зависеть от многочисленных факторов, таких как тяжесть заболевания, подвергаемого лечению, возраст и общее состояние здоровья больного, действенность используемого соединения, способ и форма введения, и от других факторов. Лекарственное средство может быть введено более одного раза в день, предпочтительно один или два раза в день.
Терапевтически эффективные количества соединений формулы I могут составлять в день от примерно 0,1 до 20 мг/кг массы тела реципиента, более предпочтительно от около 0,1 до 10 мг/кг/день.
Соединения данного изобретения обычно следует вводить в виде фармацевтических композиций одним из следующих способов: пероральное, системное (например, чрескожное, внутриназальное или в виде суппозиториев) или парентеральное (внутримышечное, внутривенное или подкожное) введение. Предпочтительный способ введения представляет собой пероральное введение по общепринятой схеме введения лекарственного средства, которая может быть отрегулирована в соответствии с тяжестью заболевания. Композиции могут иметь форму таблеток, пилюль, капсул, полутвердых веществ, порошков, препаратов пролонгированного действия, растворов, суспензий, эликсиров, аэрозолей или любых других соответствующих композиций. Другим предпочтительным способом введения соединений данного изобретения является ингаляция. Она является эффективным методом доставки лекарственного средства непосредственно в дыхательные пути, в особенности для лечения таких заболеваний, как астма, и подобных заболеваний или родственных заболеваний дыхательных путей (смотри патент США № 5607915).
Выбор формы препарата зависит от различных факторов, таких как способ введения лекарственного средства и его биодоступность. Для доставки ингаляцией соединение может быть приготовлено в виде раствора, суспензий, диспергируемого аэрозоля или сухого порошка и загружено в подходящее приспособление для введения. Имеется несколько типов приспособлений для вдыхания лекарственных средств: аэрозольные ингаляторы, ингаляторы с дозатором (MDI) и ингаляторы для вдыхания сухого порошка (DPI). Аэрозольные ингаляторы создают высокоскоростной воздушный поток, заставляющий лекарственные вещества (которые приготовлены в жидкой форме) разбрызгиваться в виде тумана, переносимого в дыхательные пути больного. MDI обычно представляют собой препараты, заполненные сжатым газом. При действии приспособление выпускает отмеренное количество лекарственного вещества с помощью сжатого газа, обеспечивая таким образом надежный способ введения установленного количества лекарственного вещества. DPI распределяют лекарственные вещества в форме свободнотекущего порошка, который может быть диспергирован приспособлением в дыхательные пути во время дыхания. Для получения свободнотекущего порошка лекарственное вещество формулируют с таким эксципиентом, как лактоза. Отмеренное количество лекарственного вещества хранится в капсульной форме и распределяется при каждом действии.
Недавно разработаны фармацевтические препараты в особенности лекарственных веществ, показывающих плохую биодоступность, основанные на принципе, состоящем в том, что биодоступность может быть повышена за счет увеличения удельной поверхности, то есть уменьшения размера частиц. Так например, в патенте США № 4107288 раскрыт фармацевтический препарат, имеющий размер частиц в диапазоне от 10 до 1000 нм, в котором активное вещество наносится на носитель, представляющий собой структурированную матрицу из макромолекул. В патенте США № 5145684 раскрыто получение фармацевтического препарата, в котором лекарственное вещество измельчено в наночастицы (средний размер частиц 400 нм) в присутствии модификатора поверхности и затем диспергировано в жидкой среде с получением фармацевтического препарата, который показывает значительно более высокую биодоступность.
Композиции содержат в основном соединение формулы I в комбинации с, по меньшей мере, одним фармацевтически приемлемым эксципиентом. Приемлемые эксципиенты представляют собой нетоксичные вспомогательные средства для введения, не оказывающие неблагоприятное действие на соединения формулы I. Такой эксципиент может быть твердым, жидким, полутвердым или в случае аэрозольной композиции газообразным эксципиентом, который обычно доступен специалистам в данной области.
Твердые фармацевтические эксципиенты включают крахмал, целлюлозу, тальк, глюкозу, лактозу, сахарозу, желатин, мальтозу, рис, муку, мел, силикагель, стеарат магния, стеарат натрия, глицеринмоностеарат, хлорид натрия, сухое снятое молоко и подобные эксципиенты. Жидкие и полутвердые эксципиенты могут быть выбраны из глицерина, пропиленгликоля, воды, этанола и различных масел, включающих масла на вазелиновой, животной, растительной или синтетической основе, например арахисовое масло, соевое масло, минеральное масло, сезамовое масло и т.д. Предпочтительные жидкие носители, в особенности для инъекционных растворов, включают воду, физиологический раствор, водный раствор декстрозы и гликоли.
Для диспергирования соединения данного изобретения в аэрозольной форме могут быть использованы сжатые газы. Подходящие для данной цели инертные газы представляют собой азот, диоксид углерода и т.д.
Другие подходящие фармацевтические эксципиенты и содержащие их препараты раскрыты в: Remington's Pharmaceutical Sciences, edited by E.W. Martin (Mack Publishing Company, 18 th ed., 1990).
Количество соединения в препарате может изменяться во всем диапазоне, используемом специалистами в данной области. Обычно препарат будет содержать в массовых процентах (мас.%) около 0,01-99,99 мас.% соединения формулы I, Ia, Ib, II или III в расчете на общую массу препарата, при этом остальным для баланса является один или несколько подходящих фармацевтических эксципиентов. Соединение предпочтительно присутствует в количестве около 1-80 мас.%. Типичные фармацевтические препараты, содержащие соединение формулы I, Ia, Ib, II или III, представлены ниже.
ПРИМЕРЫ
В нижепредставленных примерах и вышеприведенных схемах синтеза следующие сокращения имеют следующие значения. Если сокращение не определено, оно имеет его общепринятое значение.
В нижеизложенных примерах представлены соединения и промежуточные продукты, применимые для получения соединений настоящего изобретения. Обзор протоколов синтеза, применяемых для получения таких соединений, приведен выше.
Если не указано иным образом, методы ВЭЖХ, представленные в примерах, соответствуют следующим методикам:
ВЭЖХ, Методика А: Буфер А состоит из 0,1% ТФУ в дистиллированной воде; Буфер В состоит из 0,1% ТФУ в ацетонитриле; Колонка Yydac с С18 белком и пептидом (250×4,6 мм); В колонке скорость потока 1 мл/мин с градиентом от 20% В до 99% В в течение 20 минут (С18 колонка).
ВЭЖХ, Методика В: Буфер А состоит из 0,1% ТФУ в дистиллированной воде; Буфер В состоит из 0,1% ТФУ в ацетонитриле; Колонка Yydac с С18 белком и пептидом (250×4,6 мм); В колонке скорость потока 2 мл/мин с градиентом от 20% В до 99% В в течение 10 минут (С18 колонка).
ВЭЖХ, Методика С: Буфер А состоит из 0,1% ТФУ в дистиллированной воде; Буфер В состоит из 0,1% ТФУ в ацетонитриле; Колонка Merck K Ga A с Chromolith Performance RP-18e (100×4,6 мм); В колонке скорость потока 4 мл/мин с градиентом от 20% В до 99% В в течение 5 минут (Монолитная колонка).
Пример 1
Получение 1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (Соединение 201)
Стадия 1: Сложный метиловый эфир транс-3-(2-диметиламиновинил)-4-нитробензойной кислоты (соединение 3)
100 мл колбу, снабженную 15 см головкой Вигре, загружали 10 г (49,7 ммоль) сложного метилового эфира 3-метил-4-нитробензойной кислоты, 12,5 мл ДМФА и 14,8 г (124,2 ммоль) N,N-диметилформамиддиметилацеталя. Реакционный сосуд погружали в масляную баню с температурой 140ºС на 18 часов в атмосфере аргона и одновременно отгоняли образующийся метанол. При охлаждении до комнатной температуры содержимое колбы темно-красного цвета затвердевало. Твердое вещество переносили в 250 мл колбу с использованием ДМФА, который удаляли выпариванием. Остаток растирали в петролейном эфире с получением 11,81 г енамина в виде твердого вещества темно-красного цвета.
МС: 251,10 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 8,11 (д, 1H, Ar-H2), 7,80 (д, 1H, Ar-H5), 7,53-7,50 (дд, 1H, Ar-H6), 7,06 (д, 1H, CH=), 5,76 (д, 1H, CH=), 3,93 (с, 3H, OCH3), 2,93 (с, 6H, (CH3)2N).
Стадия 2: Сложный метиловый эфир 3-формил-4-нитробензойной кислоты (соединение 4)
Соединение 3 (11,81 г, 47,2 ммоль) и NaIO4 (30,3 г, 141,6 ммоль) растворяли в 250 мл ТГФ/Н2О 1:1 при комнатной температуре. Раствор темно-красного цвета нагревали до около 40ºС, при этом происходило интенсивное осаждение и цвет изменялся до светло-коричневого. Через 1 час осадок удаляли фильтрацией и промывали 200 мл этилацетата. Органический слой три раза промывали насыщенным раствором NaHCO3, один раз - насыщенным солевым раствором и сушили Na2SO4. Раствор выпаривали досуха и образовавшееся масло очищали на рыхлом слое силикагеля с использованием в качестве элюента смеси ДХМ-гексан (с градиентом ДХМ от 30% до 60%) с получением после выпаривания соединения 4 желтого цвета.
H1-ЯМР (CDCl3): δ (м.д.) 10,39 (с, 1H, CHO), 8,57 (д, 1H, J=2,1 Гц, Ar-H2) 8,40-8,36 (дд, 1H, J=2,1 Гц и 8,4 Гц, Ar-H6), 8,14 (д, 1H, J=8,4 Гц, Ar-H5), 4,00 (с, 3H, OCH3).
Стадия 3: Сложный метиловый эфир 3-диметоксиметил-4-нитробензойной кислоты (соединение 5)
К раствору соединения 4 (1 г, 4,78 ммоль) в 20 мл метанола добавляли 0,5 мл смеси 4н. HCl/диоксан и смесь поддерживали при 90ºС в течение 10 минут. Затем реакционную смесь выпаривали досуха. Твердое вещество белого цвета растворяли в 20 мл метанола и опять обрабатывали 0,5 мл 4н. HCl таким же путем. Твердое вещество сушили в высоком вакууме в течение ночи с получением соединения 5 с количественным выходом.
H1-ЯМР (CDCl3): δ (м.д.) 8,40 (д, 1H, J=1,8 Гц, Ar-H2), 8,14-8,10 (дд, 1H, J=8,1 Гц и 1,8 Гц, Ar-H6), 7,81 (д, 1H, J=8,1 Гц, Ar-H5), 5,89 (с, 1H, Ar-CH), 3,96 (с, 3H, сложный эфир CH3), 3,40 (с, 6H, ацеталь CH3).
Стадия 4: Сложный метиловый эфир 4-амино-3-диметоксиметилбензойной кислоты (соединение 6)
100 мг 10% Pd/C и 1 г MgSO4 суспендировали в 20 мл метанола и гидрировали в аппаратуре Парра при давлении 30 фунт/дюйм2 в течение 15 минут. Устройство открывали и добавляли 1,22 г (4,78 ммоль) соединения 5, растворенного в 40 мл метанола, после чего добавляли 2 мл ТЭА. Смесь гидрировали при давлении 30 фунт/дюйм2 в течение 30 минут, удаляли катализатор фильтрацией и раствор выпаривали досуха. Твердое вещество сушили в течение ночи над смесью P2O5/H3PO4 c получением соединения 6.
H1-ЯМР (ДМСО): δ (м.д.) 7,80 (д, 1H, J=2,1 Гц, Ar-H2), 7,62-7,58 (дд, 1H, J=8,4 Гц и 2,1 Гц, Ar-H6), 6,64 (д, 1H, J=8,4 Гц, Ar-H5), 5,84 (с, 2H, NH2), 5,32 (с, 1H, Ar-CH), 3,72 (с, 3H, сложный эфир CH3), 3,20 (с, 6H, ацеталь CH3).
Стадия 5: Сложный метиловый эфир 4-амино-3-формилбензойной кислоты (соединение 7)
Соединение 6 (0,95 г, 4,2 ммоль) растворяли при комнатной температуре в 15 мл растворяющей смеси, состоящей из: EtOH-уксусная кислота-вода 2:2:1. Через 5 минут раствор ярко-желтого цвета становился светло-желтым. Смеси выдерживали в течение 15 минут перед ее выпариванием досуха и затем в течение ночи сушили в высоком вакууме с получением соединения 7 в виде порошка желтого цвета.
МС: 180,05 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 9,88 (с, 1H, CHO), 8,23 (д, 1H, J=2,1 Гц, Ar-H2), 7,96-7,91 (дд, 1H, J=8,7 Гц и 2,1 Гц, Ar-H6), 6,64 (д, 1H, J=8,4 Гц, Ar-H5), 3,88 (с, 1H, CH3).
Стадия 6: Сложный этиловый эфир 4-хлор-3-нитробензойной кислоты (соединение 9)
4-Хлор-3-нитробензойную кислоту (100 г) растворяли в 500 мл безводного этанола и в течение 5 минут добавляли по каплям 35 мл концентрированной серной кислоты. Смесь кипятили с обратным холодильником в течение ночи и затем вливали в 1 л льда. Остаток отделяли фильтрацией, четыре раза промывали водой и затем сушили на воздухе. После перекристаллизации из 275 мл этанола получали продукт светло-желтого цвета.
H1-ЯМР (CDCl3): δ (м.д.) 8,49 (д, 1H, J=2,1 Гц, Ar-H2), 8,17- 8,13 (дд, 1H, J=8,8 и 2,1 Гц), Ar-H6), 7,63 (д, 1H, J=8,1 Гц, Ar-H5), 4,42 (кв, 2H, J=7,5 Гц, CH2), 1,42 (т, 3H, J=7,5 Гц, CH3).
Стадия 7: Сложный этиловый эфир 4-циклогексиламино-3-нитробензойной кислоты (соединение 10)
Раствор соединения 9 (22,96 г, 100 ммоль), циклогексиламина (15,31 г, 154 ммоль) и ТЭА (13,57 г, 134 ммоль) в 100 мл ацетонитрила кипятили с обратным холодильником в течение ночи. Реакционную смесь вливали в смесь воды со льдом и осажденные кристаллы собирали фильтрацией, промывали три раза водой и затем сушили над пентоксидом фосфора в высоком вакууме с получением соединения 10.
МС: 293,16 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 8,85 (д, 1H, J=2,1 Гц, Ar-H2), 8,40 (д, ушир., 1H, J=6,9 Гц, NH), 8,01-7,97 (дд, 1H, J=9,0 и 2,1 Гц), Ar-H6), 6,86 (д, 1H, J=9,0 Гц, Ar-H5), 4,34 (кв, 2H, J=7,5 Гц, CH2), 3,56 (м, 1H, -CH=), 2,05 (м, 2H), 1,81 (м, 2H), 1,65 (м, 2H), 1,44 (м, 4H), 1,38 (т, 3H, J=7,5 Гц, CH3).
Стадия 8: Сложный этиловый эфир 3-амино-4-циклогексиламинобензойной кислоты (соединение 11)
К раствору 5,84 г (20 ммоль) соединения 10 в 50 мл этилацетата и 30 мл метанола добавляли 100 мг 10% Pd/C и смесь гидрировали при давлении 30 фунт/дюйм2 в течение 6 часов. Катализатор удаляли фильтрацией через слой целита, растворитель выпаривали досуха с получением твердого вещества темно-пурпурного цвета, которое перекристаллизовывали из смеси простой эфир-гексан. Маточный раствор выпаривали и образовавшееся твердое вещество суспендировали в гексане и фильтровали с получением дополнительного количества соединения 11.
МС: 263,18 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 7,57-7,54 (дд, 1H, J=8,7 и 2,1 Гц, Ar-H6), 7,39 (д, 1H, J=2,1 Гц, Ar-H2), 6,57 (д, 1H, J=9,0 Гц, Ar-H5), 4,29 (кв, 2H, J=7,2 Гц, CH2), 3,32 (м, 1H, -CH=), 2,05 (м, 2H), 1,77 (м, 2H), 1,66 (м, 2H), 1,42-1,20 (м, 7H).
Стадия 9: 2-Фенилхинолин-6-карбоновая кислота (Соединение 13, Y=фенил)
К раствору 100 мг (0,56 ммоль) соединения 7 и 67 мг (0,56 ммоль) ацетофенона в 7 мл этанола добавляли 420 мкл раствора 10% КОН/этанол (0,75 ммоль) и смесь в течение ночи кипятили с обратным холодильником в атмосфере аргона. Происходило частичное осаждение продукта в виде кристаллов ярко-желтого цвета, которые не отфильтровывали. Всю смесь выпаривали досуха, остаток растирали в простом эфире с получением продукта в виде калиевой соли. Кислоту выделяли растворением в 10 мл воды и подкислением до рН 4 (около 500 мкл 1М HCl). Осадок собирали фильтрацией, дважды промывали водой и сушили над пентоксидом фосфора в высоком вакууме с получением соединения 13.
МС: 250,10 (М+H+); H1-ЯМР (ДМСО): δ (м.д.) 8,51-8,48 (м, 2H), 8,22-8,08 (м, 4H), 7,96 (д, 1H, J=8,4 Гц), 7,50-7,40 (м, 3H).
Стадия 10: 2-Фенилхинолин-6-карбонилхлорид (соединение 14, Y=фенил)
Соединение 13 (100 мг, 0,4 ммоль) суспендировали в 15 мл тионилхлорида и кипятили с обратным холодильником в течение 1 часа. Смесь выпаривали досуха и остаток дважды совместно выпаривали с толуолом с получением соединения 14 в виде твердого вещества желтого цвета с количественным выходом, которое использовали непосредственно без дальнейшей очистки.
Стадия 11: 1-Циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 201 или соединение 16, Y=фенил)
Соединение 14, полученное из 100 мг (0,4 ммоль) соединения 13, растворяли в 4 мл ДМФА. Затем добавляли 105,2 мг (0,4 ммоль) соединения 11 в виде твердого вещества и затем 69 мкл (0,4 ммоль) DIEA. Смесь затем выпаривали досуха и остаток растворяли в 30 мл ледяной уксусной кислоты. Раствор кипятили с обратным холодильником в течение 3-х часов и выпаривали досуха. Твердое вещество желтого цвета опять растворяли в 15 мл метанола и при 80°С и перемешивании в течение 1 часа добавляли 4 мл 1н. NaOH. Реакционную смесь охлаждали в бане со льдом, подкисляли 4 мл 1н. HCl и выпаривали досуха с получением масла, которое растворяли в 20 мл смеси ДМФА-вода 1:1, содержащей 0,1% ТФУ. Раствор переносили в колонку для проведения ОФ-ВЭЖХ, в результате которой получали чистое соединение 201.
Превращение в HCl соль: Очищенное указанное в заголовке соединение растворяли в 4 мл метанола, добавляли 500 мкл 4M HCl в диоксане и затем 40 мл простого эфира. Осадок белого цвета отделяли фильтрацией и сушили в высоком вакууме в течение ночи.
МС: 448,20 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,70 (м, 1H), 8,47 (с, 1H), 8,33 (м, 5H), 8,22 (м, 1H), 8,09 (м, 1H), 8,00 (м, 2H), 7,58 (м, 3H), 4,44 (м, 1H), 4,23 (ушир., 4H), 2,33 (м, 2H), 2,10 (м, 2H), 1,85 (м, 2H), 1,61 (м, 1H), 1,36 (м, 3H).
Пример 2
Получение 2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты (соединение 229)
К раствору 45 мг (0,1 ммоль) соединения 201 в 500 мкл ДМФА добавляли 22,8 мкл (0,13 ммоль) ТФУ-OPfp и 23 мкл (0,13 ммоль) DIEA. Смесь перемешивали при комнатной температуре в течение 30 минут. К активированному раствору сложного эфира добавляли 29,1 мг (0,13 ммоль) L-5-гидрокситриптофана, растворенного в 500 мкл ДМФА, и затем 40 мкл DIEA. Через 1 час реакция завершилась. Выпаривали ДМФА и оставшееся масло, которое растворяли в 20 мл смеси ДМФА-вода 1:1, содержащей 0,1% ТФУ. Раствор переносили в колонку для проведения ОФ-ВЭЖХ, в результате которой получали чистое соединение 229 в виде соли ТФУ.
Превращение в HCl соль: Очищенное соединение 229 растворяли в 4 мл метанола, добавляли 1 мл 4M HCl в диоксане и затем 40 мл простого эфира. Осадок не совсем белого цвета отделяли фильтрацией и сушили в течение ночи в высоком вакууме.
МС: 650,29 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,52 (д, 1H), 8,93 (д, 1H), 8,71 (д, 1H), 8,49 (д, 1H), 8,35-8,24 (м, 5H), 8,23 (д, 1H), 8,09 (дд, 1H), 7,97 (дд, 1H), 7,63-7,54 (м, 3H), 7,12-7,08 (м, 2H), 6,90 (д, 1H), 6,57 (дд, 1H), 4,46 (м, 1H), 4,44 (м, 1H), 3,32 (м, 2H), 2,33 (м, 2H), 2,10 (м, 2H), 1,85 (м, 2H), 1,60 (м, 1H), 1,32 (м, 3H).
Пример 3
Получение 1-(транс-4-гидроксициклогексил)-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 579)
Стадия 1: Сложный этиловый эфир 3-нитро-4-(транс-4-гидроксициклогексиламино)бензойной кислоты (соединение 579а)
Соединение 9 (689 мг, 3 ммоль) суспендировали в ацетонитриле (5 мл) и затем добавляли триэтиламин (1,3 мл, 9 ммоль). После этого добавляли гидрохлорид транс-4-аминоциклогексанола (682 мг, 4,5 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 12 часов, затем добавляли 2 мл метанола и реакционную смесь кипятили с обратным холодильником в течение еще 24 часов. Добавляли воду (100 мл) и полученный осадок фильтровали, 3 раза промывали водой и сушили на воздухе. Продукт использовали на следующей стадии без дальнейшего исследования. МС: 309,3 (М+Н+).
Стадия 2: Сложный этиловый эфир 3-амино-4-(транс-4-гидроксициклогексиламино)бензойной кислоты (соединение 579b)
Продукт с предыдущей стадии (3 ммоль) растворяли в этилацетате (60 мл) и метаноле (40 мл) и добавляли 10% Pd/C (100 мг). Реакционную смесь гидрировали в вибраторе Парра при давлении 35 фунт/дюйм2 в течение 6 ½ часов при комнатной температуре. Отфильтровывали Pd/C и фильтрат концентрировали. В результате хроматографии (SiO2, метанол/дихлорметан 3:97 об./об.) получали указанный в заголовке промежуточный продукт (265 мг, 0,95 ммоль). МС: 279,2 (М+Н+).
Стадия 3: 1-(Транс-4-гидроксициклогексил)-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 579)
Соединение 36А Y=фенил (200 мг, 0,8 ммоль) активировали в 8 мл ДМФА с использованием TBTU (282 мг, 0,88 ммоль) и DIEA (0,285 мл, 1,6 ммоль) в течение 30 минут при комнатной температуре. Полученный раствор затем добавляли к соединению 579b (265 мг, 0,95 ммоль) и перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь концентрировали до остатка в вакууме и затем растворяли в уксусной кислоте (20 мл) и кипятили с обратным холодильником в течение ночи. Утром уксусную кислоту удаляли в вакууме и неочищенный остаток растворяли в смеси ТГФ (20 мл), метанола (16 мл) и 2М NaOH (4 мл) и раствор нагревали при 60ºС в течение ночи. Затем раствор концентрировали в вакууме до получения водного раствора и добавляли концентрированную HCl до достижения рН 5. Образовавшийся осадок фильтровали, промывали водой и очищали с использованием колонки для ОФ-ВЭЖХ с получением чистого указанного в заголовке соединения.
Превращение в HCl соль: Очищенный ВЭЖХ продукт растворяли в 4 мл метанола, добавляли 500 мкл 4М HCl в диоксане и затем 40 мл простого эфира. Образовавшийся остаток отделяли фильтрацией и сушили в высоком вакууме в течение ночи. Выход: 15,7 г.
МС: 465,21 (M+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 9,72 (с, 1H), 8,45 (с, 1H), 8,41-8,32 (м, 5H), 8,19-8,12 (м, 2H), 7,98 (д, 1H, 8,4 Гц), 7,62 (м, 3H), 4,27 (т, 1H, 12 Гц), 2,53-2,36 (м, 3H), 2,06-1,93 (м, 4H), 1,29-1,22 (м, 2H).
Пример 4
Получение 2-{[1-(циклогексил-2-(2-метилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты (соединение 230)
Стадия 1: 2-Метилхинолин-6-карбоновая кислота (соединение 28)
Соединение 28 синтезировали по методике получения соединения 13 с использованием ацетона вместо ацетофенона.
МС: 188,06 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,88 (д, 1H, J=8,4 Гц), 8,78 (с, 1H), 8,37-8,26 (м, 2H), 7,83-7,80 (м, 1H), 2,88 (с, 3H).
Стадия 2: Сложный этиловый эфир 4-циклогексиламино-3-[(2-метилхинолин-6-карбонил)амино]бензойной кислоты (соединение 29)
Соединение 29 синтезировали из соединения 28 с количественным выходом по методике получения соединения 25.
Стадия 3: Сложный этиловый эфир 1-циклогексил-2-(2-метилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 30)
Соединение 30 синтезировали из соединения 29 с количественным выходом по методике получения соединения 23. МС: 414,24 (М+Н+).
Стадия 4: 1-Циклогексил-2-(2-метилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 31)
Соединение 31 синтезировали из соединения 30 по методике получения соединения 204. Выход: 77%.
МС: 386,21 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,99 (д, 1H, J=8,7 Гц), 8,57 (д, 1H, J=1,8 Гц), 8,52 (д, 1H, J=8,7 Гц), 8,27-8,23 (м, 2H), 8,085 (д, 1H, J=9,0 Гц), 7,92-7,88 (м, 2H), 4,28 (м, 1H), 2,94 (с, 3H), 2,30-2,18 (м, 2H), 1,99 (м, 2H), 1,78 (м, 2H), 1,56 (м, 1H), 1,36-1,20 (м, 3H).
Стадия 4: 2-{[1-Циклогексил-2-(2-метилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовая кислота (соединение 230)
Соединение 230 синтезировали из соединения 31 по методике получения соединения 235. Выход: 32%.
МС: 588,29 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,47 (с, 1H), 8,92 (д, 1H, J=9,0 Гц), 8,79 (д, 1H, J=7,5 Гц), 8,56 (с, 1H), 8,41 (д, 1H, J=8,7 Гц), 8,28-8,21 (м, 2H), 8,10 (д, 1H, J=8,7 Гц), 7,88 (д, 2H, J=8,7 Гц), 7,08-7,04 (м, 2H), 6,86 (д, 1H, J=1,8 Гц), 6,55-6,51 (дд, 1H, J=2,1 Гц, 8,7 Гц), 4,61 (м, 1H), 4,31 (м, 1H), 2,91 (с, 3H), 2,28-2,24 (м, 2H), 2,01 (м, 2H), 1,80 (м, 2H), 1,56 (м, 1H), 1,32-1,19 (м, 3H).
Пример 5
Получение 2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил[амино}-3-гидроксипропионовой кислоты (соединение 231
Соединение 231 синтезировали из соединения 201 по методике получения соединения 235 за исключением того, что вместо L-5-гидрокситриптофана использовали L-серин. Выход: 36%.
МС: 535,26 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,93 (д, 1H, J=7,2 Гц), 8,73 (д, 1H, J=8,4 Гц), 8,54 (д, 1H, J=2,1 Гц), 8,46 (с, 1H), 8,38-8,29 (м, 5H), 8,15-8,11 (м, 2H), 7,73-7,55 (м, 3H), 4,50 (м, 2H), 3,85 (д, 1H, J=5,4 Гц), 2,37-2,32 (м, 2H), 2,15 (м, 2H), 1,86 (м, 2H), 1,61 (м, 1H), 1,39-1,30 (м, 3H).
Пример 6
Получение 6-амино-2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}капроновой кислоты (соединение 232)
Соединение 232 синтезировали из соединения 201 по методике получения соединения 235 за исключением того, что вместо L-5-гидрокситриптофана использовали H-Lys (Boc)-OtBu. На 3-й стадии защищенный промежуточный продукт обрабатывали смесью ТФУ-анизол 8:2 в течение 2-х часов, затем продукт осаждали простым эфиром и очищали ОФ-ВЭЖХ. Выход: 15%.
МС: 576,33 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,90 (д, 1H, J=7,8 Гц), 8,71 (д, 1H, J=8,7 Гц), 8,48 (д, 1H, J=1,8 Гц), 8,41 (д, 1H), 8,35-8,32 (м, 4H), 8,22 (д, 1H, J=9,6 Гц), 8,12-8,08 (дд, 1H, J=1,8 Гц, 8,7 Гц), 8,02 (д, 1H, J=8,7 Гц), 7,86 (ушир., 3H), 7,60-7,54 (м, 3H), 4,42 (м, 2H), 2,78 (м, 2H), 2,36-2,27 (м, 2H), 2,11 (м, 2H), 1,90-1,83 (м, 4H), 1,62 (м, 3H), 1,53-1,25 (м, 6H).
Пример 7
Получение 1-[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]пирролидин-2-карбоновой кислоты (соединение 233)
Соединение 233 синтезировали из соединения 201 по методике получения соединения 235 за исключением того, что вместо L-5-гидрокситриптофана использовали L-пролин. Выход: 15%.
МС: 545,28 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,71 (д, 1H), J=9,0 Гц), 8,49 (д, 1H), 8,36-8,32 (м, 4H, 8,26 (д, 1H, J=8,7 Гц), 8,12-8,08 (дд, 1H, J=1,5 Гц, 8,7 Гц), 7,95 (м, 1H), 7,65-7,53 (м, 2H), 4,44 (м, 1H), 3,56 (м,1Н), 2,30 (м, 3H),2,11 (м, 2H), 1,92-1,83 (м, 6H), 1,65 (м, 1Н), 1,37-1,32 (м, 4H).
Пример 8
Получение 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 203 или соединение 39, Y=фенил)
Стадия 1: 2-Фенилхиноксалин-6-карбоновая кислота (соединение 36А, Y=фенил) и 3-фенилхиноксалин-6-карбоновая кислота (соединение 36В, Y=фенил)
К раствору соединения 34 (850, 75 мг, 5 ммоль) и 3,4-диаминобензойной кислоты в 50 мл уксусной кислоты добавляли соединение 35 (670,7 мг, 5 ммоль), являющееся фенилглиоксалем, и кипятили с обратным холодильником в атмосфере аргона в течение 2,5 часов. Реакционную смесь выпаривали досуха. Полученное серое твердое вещество, содержащее два изомера при их соотношении примерно 2:1, разделяли ВЭЖХ, вследствие чего получали 230 мг (19%) соединения 36А и 140 мг (12%) соединения 36В.
Основной компонент (соединение 36А) получали также альтернативным способом. В качестве растворителя вместо уксусной кислоты использовали этанол и реакционную смесь перемешивали в течение ночи при 0ºС. Образованный во время реакции осадок отфильтровывали, промывали холодным этанолом и сушили с получением соединения 36А. Выход (78%).
Соединение 36А: МС: 251,10 (М+H+); H1-ЯМР (ДМСО): δ (м.д.) 13,5 (с, 1H), 9,67 (с, 1H,), 8,60 (д, 1H, J=1,5 Гц), 8,38-8,34 (м, 2H), 8,31-8,2: (дд, 1H, J=8,7 Гц и 2,1 Гц), 8,20 (д, 1H, J=9 Гц), 7,65-7,59 (м, 3H);
Соединение 36В: МС: 251,10 (М+H+); H1-ЯМР (ДМСО): δ (м.д.) 13,5 (с, 1H), 9,63 (с, 1H,), 8,30 (д, 1H, J=1,2 Гц), 8,38-8,34 (м, 2H), 8,28-8,2' (дд, 1H, J=8,7 Гц и 1,8 Гц), 8,18 (д, 1H, J=8,7 Гц), 7,63-7,57 (м, 3H).
Стадия 2: Сложный этиловый эфир 4-циклогексиламино-3-[(2-фенилхиноксалин-6-карбонил)амино]бензойной кислоты (соединение 37, Y=фенил)
Суспензию 250 мг (1 ммоль) соединения 36 в 4 мл ДМФА активировали обработкой 418 мг (1,1 ммоль) HATU и 383 мкл (2,2 ммоль) DIEA в течение 10 минут при комнатной температуре, при этом в течение указанного времени оставалась суспензия. Добавляли соединение 11 (289 мг, 1,1 ммоль) и смесь перемешивали при комнатной температуре в течение ночи, вследствие чего она превращалась в прозрачный раствор. Выпаривали ДМФА и образовавшееся масло растирали с водой. Затвердевшее вещество фильтровали, промывали водой (3×) и сушили с получением соединения 37 в виде твердого вещества желтого цвета, которое использовали без дальнейшей очистки. МС: 495,27 (М+Н+);
Стадия 3: Сложный этиловый эфир 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 38, Y=фенил)
Соединение 37 (1 ммоль) с предыдущей стадии растворяли в 80 мл ледяной уксусной кислоты и кипятили с обратным холодильником в течение 4-х часов. Выпаривали уксусную кислоту и образовавшееся масло сушили в течение ночи в высоком вакууме с получением соединения 38 в виде полутвердого вещества, которое использовали без дальнейшей очистки. МС: 477,25 (М+Н+).
Стадия 4: 1-Циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 203)
К раствору 1 ммоль соединения 38 в 40 мл этанола добавляли 10 мл 1М NaOH и смесь кипятили с обратным холодильником в течение 1 часа. Реакционную смесь затем охлаждали и выпаривали досуха. Остаток растворяли в 50 мл воды и подкисляли 1М HCl до рН 4. Осадок отфильтровывали, промывали водой (4×) и сушили с получением указанного в заголовке соединения.
МС: 449,23 (М+H+); H1-ЯМР (ДМСО): δ (м.д.) 9,73 (с, 1H), 8,51 (д, 1H, J=1,5 Гц), 8,42-8,35 (м, 4H), 8,24-8,16 (м, 2H), 8,03-7,99 (дд, 1H, J=9 Гц и 1,5 Гц), 7,65-7,61 (м, 3H), 4,41 (м, 1H), 4,5-3,9 (ушир., 2H), 2,31 (м, 2H), 2,10 (м, 2H), 1,85 (м, 2H), 1,61 (м, 1H), 1,40-1,20 (м, 3H).
Пример 9
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты (соединение 234)
Соединение 203 (100 мг, 0,22 ммоль) активировали в 2 мл ДМФА 92 мг (0,24 ммоль) HBTU и 85 мкл DIEA в течение 10 минут при комнатной температуре. Добавляли 56 мг 5-гидрокси-L-триптофана, растворенного в 1 мл ДМФА, и затем 44 мкл DIEA. Смесь перемешивали при комнатной температуре в течение 1 часа, затем выпаривали досуха. Масло очищали с использованием колонки для ОФ-ВЭЖХ с получением соединения 234.
Превращение в HCl соль: Очищенное соединение 234 растворяли в 4 мл метанола и последовательно добавляли 500 мкл 4М HCl в диоксане и затем 40 мл простого эфира. Осадок желтого цвета отделяли фильтрацией и сушили в высоком вакууме в течение ночи. Выход: 76 мг (58%) твердого вещества не совсем желтого цвета.
МС: 651,28 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,49 (д, 1H), 9,71 (с, 1H), 8,73 (д, 1H), 8,41-8,31 (м, 5H), 8,18-8,14 (дд, 1H, J=8,4 Гц и 1,8 Гц), 8,05 (д, 1H, J=9 Гц), 7,85 (дд, 1H, J=9 Гц и 1,8 Гц), 7,67-7,61 (м, 3H), 7,13-7,08 (м, 2H), 6,90 (д, 1H, J=2,1 Гц), 6,59-6,55 (дд, 1HH, J=8,7 Гц и 2,4 Гц), 4,65 (м, 1H), 4,41 (м, 1H), 3,20 (м, 2H), 2,32 (м, 2H), 2,04 (м, 2H), 1,85 (м, 2H), 1,61 (м, 1H), 1,44-1,22 (м, 3H).
Пример 10
Получение 2-{2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты
(соединение 204)
Стадия 1: 1-[2-Гидрокси-5-(пирролидин-1-карбонил)фенил]этанон (соединение 18)
К раствору 500 мг (2,8 ммоль) 3-ацетил-4-гидроксибензойной кислоты в 5 мл ДМФА добавляли 721,6 мкл (4,2 ммоль) ТФУ-OPfp и 731,5 мкл (4,2 ммоль) DIEA. Прозрачный раствор перемешивали при комнатной температуре в течение 15 минут, затем добавляли 467,5 мкл (5,6 ммоль) пирролидина. Смесь перемешивали в течение еще одного часа и затем выпаривали досуха. Маслянистый остаток переносили в смесь 50 мл воды - 50 мл этилацетата, отделяли EtOAc фазу, промывали дважды 1М HCl, водой, насыщенным раствором NaHCO3, насыщенным раствором соли и сушили Na2SO4. Выпаривали EtOAc; масло очищали в открытой колонке с силикагелем с использованием градиента растворителя - смеси толуол/этилацетат, содержащей 5% уксусной кислоты, с получением 410 мг (51%) соединения 18.
МС: 232,12 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 12,02 (с, 1H), 7,99 (д, 1H, J=2,1 Гц), 7,69-7,65 (дд, 1H, J=2,1 Гц, 8,7 Гц), 6,97 (д, 1H, J=8,7 Гц), 3,47-3,32 (м, 4H), 2,65 (с, 3H), 1,90-1,83 (ушир., 4H).
Стадия 2: 2-[2-Гидрокси-5-(пирролидин-1-карбонил)фенил]хинолин-6-карбоновая кислота (соединение 19)
Соединение 18 (410 мг, 1,75 ммоль) и соединение 7 (315 мг, 1,75 ммоль) растворяли в 30 мл этанола, добавляли 2,45 мл раствора 10% КОН/этанол и смесь кипятили с обратным холодильником в атмосфере аргона в течение ночи. Выпаривали этанол, остаток растворяли в воде и подкисляли 3 мл 1М HCl. Образованный гель отверждали добавлением 30 мл этилацетата и 30 мл насыщенного раствора NaCl. Твердое вещество фильтровали, промывали водой и сушили. Выход: 302 мг соединения 19 (48%).
МС: 363,15 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 13,28 (ушир., 1H), 8,72 (м, 2H), 8,50 (м, 1H), 8,37 (с, 1H), 8,25 (м, 1H), 8,14 (д, 1H, J=8,7 Гц), 7,58 (м, 1H), 7,02 (д, 1H, J=8,7 Гц), 3,51 (м, 4H), 1,85 (м, 4H).
Стадия 3: Сложный метиловый эфир 2-[2-гидрокси-5-(пирролидин-1-карбонил)фенил]хинолин-6-карбоновой кислоты (соединение 20)
К раствору 295 мг (0,81 ммоль) соединения 19 в 3 мл метанола добавляли 1 мл смеси 4М HCl/диоксан и смесь нагревали при 60 С в течение ночи. Затем реакционную смесь выпаривали досуха с получением соединения 20 с количественным выходом. МС: 377,18 (М+Н+).
Стадия 4: Сложный метиловый эфир 2-[5-(пирролидин-1-карбонил)-2-трифторметансульфонилоксифенил]хинолин-6-карбоновой кислоты (соединение 21)
Полученное на предыдущей стадии соединение 20 (0,81 ммоль) и 10 мг ДМАП растворяли в 10 мл ДХМ. Затем последовательно добавляли 1 мл пиридина и 450 мкл (2,67 ммоль) ангидрида трифторуксусной кислоты (по каплям) и смесь перемешивалась в течение ночи. Реакционную смесь выпаривали и очищали на силикагеле с использованием градиента растворителя смеси толуол-этилацетат (10-50%). Выход: 320 мг соединения 21 (77%).
МС: 509,11 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,78-8,74 (м, 2H), 8,29-8,25 (дд, 1H, J=2,1 Гц, 9,0 Гц), 8,18 (д, 1H, J=8,7 Гц), 8,1 (д, 1H, J=2,1 Гц), 8,03 (д, 1H, J=8,7 Гц), 7,85-7,81 (дд, 1H, J=2,1 Гц, J=2,1 Гц, 8,4 Гц), 7,67 (д, 1H, J=8,4 Гц), 3,94 (с, 3H), 3,51-3,41 (м, 4H), 1,9-1,82 (м, 4H); FI9-ЯМР: δ -74,58.
Стадия 5: Сложный метиловый эфир 2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-карбоновой кислоты (соединение 23)
Соединение 21 (320 мг, 0,63 ммоль), 4-хлорфенилбороновую кислоту (соединение 22, 148 мг, 0,94 ммоль), 500 мг (2,35 ммоль) K3PO4, 27 мг (0,63 ммоль) LiCl и 36,5 мг (0,031 ммоль) Pd (PPh3)4 растворяли в 30 мл диоксана (дегазированного). Смесь кипятили с обратным холодильником в атмосфере аргона в течение ночи. Черный раствор фильтровали через подушку целита и выпаривали досуха с получением соединения 23 в виде масла желтого цвета, которое использовали без дальнейшей очистки. МС: 471,16 (М+Н+).
Стадия 6: 2-[4'-Хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-карбоновая кислота (соединение 24)
Соединение 23 с предыдущей стадии (0,63 ммоль) растворяли в 15 мл метанола и добавляли 5 мл 1М NaOH. Раствор кипятили с обратным холодильником в течение 2-х часов, затем выпаривали. После этого остаток растворяли в воде, подкисляли 5 мл 1М HCl и осадок отфильтровывали, промывали три раза водой и сушили с получением 276 мг соединения 24 (96%).
МС: 455,12 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 13,1 (ушир., 1H), 8,59 (д, 1H, J=1,8 Гц), 8,33 (д, 1H, J=8,4 Гц), 8,20-8,17 (дд, 1H, J=2,1 Гц, 9,0 Гц), 8,04 (д, 1H, J=8,7 Гц), 7,87 (д, 1H, J=1,8 Гц), 7,74-7,71 (дд, 1H, J=1,8 Гц, 8,1 Гц), 7,55-7,51 (д, 1H, J=8,4 Гц), 7,32-7,3 (м, 2H), 7,17-7,13 (м, 3H), 3,51-3,47 (м, 4H), 1,88-1,83 (м, 4H).
Стадия 7: Сложный этиловый эфир 3-({2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-карбонил}амино-4-циклогексиламино-бензойной кислоты (соединение 25)
Соединение 24 (270 мг, 0,59 ммоль) в 4 мл ДМФА активировали 246,6 мг (0,65 ммоль) HATU и 226 мкл (1,30 ммоль) DIEA при комнатной температуре в течение 15 минут. Добавляли соединение 11 (170 мг, 0,65 ммоль) в виде твердого вещества и смесь перемешивалась в течение ночи. Выпаривали ДМФА; оставшееся масло загустевало при растирании в воде. Твердое соединение 25 отфильтровывали, сушили и использовали без дальнейшей очистки. МС: 701,34 (М+Н+).
Стадия 8: Сложный этиловый эфир 2-{2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 27, Q=этил)
Соединение с предыдущей стадии (0,59 ммоль) растворяли в 80 мл уксусной кислоты и кипятили с обратным холодильником в течение 2,5 часов. Уксусную кислоту выпаривали, остаток сушили с получением соединения 204 с количественным выходом. МС: 683,33 (М+Н+).
Стадия 9: 2-{2-[4'-Хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 204)
Соединение 27, в котором Q=этил, (0,59 ммоль) с предыдущей стадии растворяли в смеси 25 мл этанола и 5 мл 1М NaOH и кипятили с обратным холодильником в течение 2-х часов. Затем реакционную смесь выпаривали досуха. Остаток растворяли в 30 мл воды, подкисляли 1М HCl до рН 4. Образованный осадок отфильтровывали, промывали четыре раза водой и сушили. Выход: 315 мг (73%). Указанное в заголовке соединение могло быть затем очищено с использованием ОФ-ВЭЖХ.
Превращение в HCl соль: Очищенное соединение 204 растворяли в 4 мл метанола и последовательно добавляли 1 мл 4М HCl в диоксане и 40 мл простого эфира. Осадок не совсем белого цвета отделяли фильтрацией и сушили в высоком вакууме в течение ночи. Выход: 28,3 мг твердого вещества.
МС: 655,26 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,41-8,38 (м, 2H), 8,32 (д, 1H, J=1,5 Гц), 8,27-8,19 (м, 2H), 8,10-8,06 (дд, 1H, J=1,8 Гц, 8,7 Гц), 8,02-7,98 (дд, 1H, J=1,5 Гц, 8,7 Гц), 7,92 (д, 1H, J=1,8 Гц), 7,77-7,74 (дд, 1H, J=2,1 Гц, 8,1 Гц), 7,58 (д, 1H, J-7,8 Гц), 7,36-7,33 (м, 2H), 7,25-7,19 (м, 3H), 4,43 (м, 1H), 3,51 (м, 4H), 3,33 (м, 2H), 2,08 (м, 2H), 1,87 (м, 6H), 1,61 (м, 1H), 1,32 (м, 3H).
Пример 11
Получение 1-циклогексил-2-(3-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 205)
Стадия 1: Сложный этиловый эфир 4-циклогексиламино-3-[(3-фенилхиноксалин-6-карбонил)амино]бензойной кислоты (соединение 41)
Раствор 238 мг (0,95 ммоль) соединения 37 в 5 мл ДМФА активировали обработкой 398 мг ((1,05 ммоль) HATU и 365 мкл (2,1 ммоль) DIEA в течение 10 минут при комнатной температуре. Добавляли соединение 11 (275 мг, 1,1 ммоль) и смесь перемешивалась при комнатной температуре в течение ночи. Выпаривали ДМФА, оставшееся масло растирали в воде, отфильтровывали загустевшее вещество, промывали водой (3×) и сушили с получением соединения 41 в виде 92% чистого твердого вещества желтого цвета, которое использовали без дальнейшей очистки. МС: 495,26 (М+Н+).
Стадия 2: Сложный этиловый эфир 1-циклогексил-2-(3-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 42)
Соединение 41 (0,95 ммоль) с предыдущей стадии кипятили с обратным холодильником в 80 мл уксусной кислоты в течение 3,5 часов. Затем смесь выпаривали досуха и сушили в течение ночи в высоком вакууме с получением соединения 42 с количественным выходом. Перед омылением дополнительно не очищали.
Стадия 3: 1-Циклогексил-2-(3-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 205)
К раствору соединения 42 (0,95 ммоль) в 25 мл этанола добавляли 5 мл 1М NaOH и смесь кипятили с обратным холодильником в течение 1 часа. Затем ее охлаждали и выпаривали досуха. Остаток растворяли в 50 мл воды, подкисляли 1М HCl до рН 4. Осадок отфильтровывали, промывали водой (4×) и сушили с получением 345 мг (81%) указанного в заголовке соединения, которое могло быть дополнительно очищено ОФ-ВЭЖХ.
МС: 448,19 (М-H+); H1-ЯМР (ДМСО-): δ (м.д.) 9,72 (с, 1H), 8,48 (д, 1H, J=1,8 Гц), 8,39-8,34 (м, 4H), 8,20-8,11 (м, 2H), 8,01-7,97 (дд, 1H, J=8,7 Гц и 1,5 Гц), 7,63-7,60 (м, 3H), 4,41 (м, 1H), 4,5-3,9 (ушир., 2H), 2,31 (м, 2H), 2,10 (м, 2H), 1,85 (м, 2H), 1,60 (м, 1H), 1,40-1,20 (м, 3H).
Пример 12
Получение 2-[(2-{2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбонил)амино]-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты (соединение 235)
Соединение 204 (100 мг, 0,15 ммоль) в 2 мл ДМФА активировали 64 мг (0,17 ммоль) HBTU и в течение 10 минут при комнатной температуре добавляли 58 мкл (0,33 ммоль) DIEA. Затем последовательно добавляли 40 мг (0,18 ммоль) 5-гидрокситриптофана и 32 мкл (0,25 ммоль) DIEA, растворенного в 1 мл ДМФА, и смесь перемешивали в течение 1 часа. Выпаривали ДМФА; остаток очищали ОФ-ВЭЖХ.
Превращение в HCl соль: Очищенное соединение 235 растворяли в 4 мл метанола, затем последовательно добавляли 1 мл 4М HCl в диоксане и 40 мл простого эфира. Осадок не совсем белого цвета отделяли фильтрацией и сушили в течение ночи в высоком вакууме. Выход: 44,1 мг (32%).
МС: 856,23 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,51 (д, 1H, J=1,8 Гц), 8,89 (д, 1H, J=4,8 Гц), 8,41-8,38 (м, 2H), 8,33 (д, 1H, J=1,5 Гц), 8,28-8,19 (м, 2H), 8,10-8,07 (дд, 1H, J=1,5 Гц, 8,1 Гц), 7,96-7,91 (м, 2H), 7,78-7,74 (дд, 1H, J=1,8 Гц, 8,1 Гц), 7,58 (д, 1H, J=7,8 Гц), 7,37-7,34 (м, 2H), 7,26-7,19 (м, 3H), 7,10 (м, 2H), 6,89 (д, 1H, J=1,8 Гц), 6,58-6,55 (дд, 1H, J=2,1 Гц, 8,7 Гц), 4,65 (м, 1H), 4,43 (м, 1H), 3,51 (м, 4H), 2,33 (м, 2H), 2,08 (м, 2H), 1,87 (м, 6H), 1,61 (м, 1H), 1,32 (м, 3H).
Пример 13
Получение 2-{[1-циклогексил-2-(3-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты (соединение 236)
Соединение 205 (100 мг, 0,22 ммоль) активировали в 2 мл ДМФА 92 мг (0,24 ммоль) HBTU и в течение 10 минут при комнатной температуре добавляли 85 мкл DIEA. Затем последовательно добавляли 5-гидрокси-L-триптофан (56 мг), растворенный в 1 мл ДМФА, и 44 мкл DIEA. Смесь перемешивали при комнатной температуре в течение 1 часа, затем выпаривали досуха. Масло очищали с использованием колонки для ОФ-ВЭЖХ с получением чистого соединения 236.
Превращение в HCl соль: Очищенное соединение 236 растворяли в 4 мл метанола, затем последовательно добавляли 500 мкл 4М HCl в диоксане и 40 мл простого эфира. Осадок темно-серого цвета отделяли фильтрацией и сушили в течение ночи в высоком вакууме. Выход: 87 мг твердого вещества серовато-коричневого цвета (55%).
МС: 649,22 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,54 (д, 1H, J-2,1 Гц), 9,75 (с, 1H), 8,99 (д, 1H, J=7,5 Гц), 8,58 (д, 1H, J=1,8 Гц), 8,41-8,36 (м, 4H), 8,28-8,25 (д, 1H, J=9,0 Гц), 8,18-8,14 (дд, 1H, J=1,8 Гц, 8,7 Гц), 8,02-7,99 (дд, 1H, 1,8 Гц, 8,7 Гц), 7,65-7,60 (м, 3H), 7,12-7,08 (м, 2H), 6,90 (м, 1H), 6,59-6,55 (дд, 1H, J=2,4 Гц, 8,7 Гц), 4,67 (м, 1H), 4,44 (м, 1H), 3,22 (м, 2H), 2,30 (м, 2H), 2,12 (м, 2H), 1,85 (м, 2H), 1,58 (м, 1H), 1,36-1,25 (м, 3H).
Пример 14
Получение 2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пентандиовой кислоты (соединение 237)
Соединение 237 синтезировали из соединения 201 по методике получения соединения 235 с использованием сложного диметилового эфира L-глутаминовой кислоты вместо L-5-гидрокситриптофана. На 3-ей стадии защищенный промежуточный продукт обрабатывали водным раствором гидроксида натрия с получением указанного в заголовке соединения, выход которого составлял 15%.
МС: 577,17 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,72-8,64 (м, 2H), 8,38-8,25 (м, 6H), 8,06-8,02 (м, 2H), 7,89-7,86 (дд, 1H, J=1,5 Гц, 8,7 Гц), 7,60-7,53 (м, 3H), 4,48-4,38 (м, 2H), 2,42-2,28 (м, 4H), 2,16-1,96 (м, 4H), 1,88-1,83 (м, 2H), 1,62 (м, 1H), 1,4-1,22 (м, 3H).
Пример 15
Получение 1-циклогексил-2-(3-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 206)
Стадия 1: 3-Фенилхинолин-6-карбоновая кислота (соединение 206а)
Указанный в заголовке промежуточный продукт синтезировали по методике получения соединения 13 с использованием фенилуксусного альдегида вместо ацетофенона. Выход: 68%.
МС: 248,09 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 9,20 (с, 1H), 8,79 (д, 2H), 8,20-8,00 (м, 2H), 7,95-7,00 (м, 5H).
Стадия 2: Сложный этиловый эфир 4-циклогексиламино-3-[(3-фенилхинолин-6-карбонил)амино]бензойной кислоты (соединение 206b)
Указанный в заголовке промежуточный продукт синтезировали из продукта предыдущей стадии с количественным выходом по методике получения соединения 25.
Стадия 3: Сложный этиловый эфир 1-циклогексил-2-(3-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 206с)
Указанный в заголовке промежуточный продукт синтезировали из продукта предыдущей стадии с количественным выходом по методике получения соединения 27, где Q = этил. МС: 476,26 (М+Н+).
Стадия 4: 1-Циклогексил-2-(3-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота
Указанное в заголовке соединение синтезировали из продукта предыдущей стадии с количественным выходом по методике получения соединения 204. Выход: 91%.
МС: 448,22 (М+H+); H'-ЯМР (ДМСО-d6): δ (м.д.) 9,50 (д, 1H, J=2,4 Гц), 9,05 (д, 1H, J=1,8 Гц), 8,55 (д, 1H, J=1,5 Гц), 8,39-8,34 (м, 2H), 8,24-8,21 (д, 1H, J=8,7 Гц), 8,16-8,12 (дд, 1H, J=9,0 Гц, 1,5 Гц), 8,03-7,94 (м, 3H), 7,61-7,47 (м, 3H), 4,44 (м, 1H), 2,35-2,26 (м, 2H), 2,16-2,08 (м, 2H), 1,86-1,82 (м, 2H), 1,60 (м, 1H), 1,43-1,25 (м, 3H).
Пример 16
Получение 2-{[1-циклогексил-2-(3-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовая кислота (соединение 238)
Указанное в заголовке соединение синтезировали из соединения 206. Выход: 19%.
МС: 650-31 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,52 (с, 1H), 9,49 (д, 1H, J=1,8 Гц), 9,01 (с, 1H), 8,95-8,92 (д, 1H, J=7,5 Гц), 8,56 (с, 1H), 8,39-8,33 (м, 2H), 8,25-8,22 (д, 1H, J=9,0 Гц), 8,15-8,12 (д, 1H, J=8,7 Гц), 7,99-7,94 (м, 3H), 7,61-7,47 (м, 3H), 7,11-7,03 (м, 2H), 6,89 (м, 1H), 6,58-6,55 (м, 1H), 4,70-4,62 (м, 1H), 4,44 (м, 2H), 3,21 (м, 1H), 2,34-2,31 (м, 2H), 2,10 (м, 2H), 1,86-1,82 (м, 2H), 1,59 (м, 1H), 1,45-1,30 (м, 3H).
Пример 17
Получение 2-[(2-фенилхиноксалин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбонил)амино]пропионовой кислоты (соединение 310)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Ala (167 мг, 0,6 ммоль/г) получали 10,2 мг указанного в заголовке соединения (выход 10%).
МС: 520,26 (М+Н+), ВЭЖХ Методика А, время удержания=12,52 мин.
Пример 18
Получение 3-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты (соединение 239)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-β-Ala (167 мг, 0,6 ммоль/г) получали 21 мг указанного в заголовке соединения (выход 39%).
МС: 520,26 (М+Н+), ВЭЖХ Методика А, время удержания=12,25 мин.
Пример 19
Получение 3-бифенил-4-ил-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты (соединение 240)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Bip (125 мг, 0,8 ммоль/г) получали 33 мг указанного в заголовке соединения (выход 51%).
МС: 672,33 (М+Н+), ВЭЖХ Методика А, время удержания=16,33 мин.
Пример 20
Получение 3-(4-бензоилфенил)-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты (соединение 241)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Bpa (125 мг, 0,8 ммоль/г) получали 37 мг указанного в заголовке соединения (выход 50%).
МС: 700,32 (М+Н+), ВЭЖХ Методика А, время удержания=15,46 мин.
Пример 21
Получение 3-циклогексил-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты (соединение 242)
В реакционный сосуд добавляли Fmoc защищенные аминокислоты на смолах Wang ((0,1 ммоль). Затем смолу перемешивали в течение 1 часа с 20% раствором пиперидина в ДМФА. Смолы промывали 6 раз ДМФА. К смоле добавляли раствор соединения 203 (0,5 ммоль в 6 мл ДМФА), предварительно активированный HATU (0,496 ммоль) и DIEA (1,0 ммоль), и перемешивали в течение 16 часов. Затем смолы промывали ДМФА(3 раза по 5 мл), дихлорметаном (3 раза по 5 мл) и диэтиловым эфиром (3 раза по 5 мл). Требуемое соединение отщепляли от смолы с использованием ТФУ, содержащей 2% воды, и конвертировали в HCl соль растворением в 0,8 мл метанола и добавлением 1 мл 4М HCl в диоксане и затем 40 мл простого эфира. Соединение центрифугировали, декантировали растворитель и твердое вещество сушили с получением конечного соединения.
По общей методике с использованием смолы Wang c Fmoc-Cys (167 мг, 0,6 ммоль/г) получали 25 мг указанного в заголовке соединения (выход: 46%). МС: 600,29 (М-Н+), ВЭЖХ Методика А, время удержания=15,76 мин.
Пример 22
Получение циклогексил-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}уксусной кислоты (соединение 243)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Cha (250 мг, 0,4 ммоль/г) получали 29 мг указанного в заголовке соединения (выход 48%).
МС: 586,27 (М-Н+), ВЭЖХ Методика А, время удержания=14,94 мин.
Пример 23
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}янтарной кислоты (соединение 244)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Asp (125 мг, 0,8 ммоль/г) получали 28 мг указанного в заголовке соединения (выход 50%).
МС: 562,20 (М-Н+), ВЭЖХ Методика А, время удержания=12,08 мин.
Пример 24
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пентандиовой кислоты (соединение 245)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Glu (111 мг, 0,9 ммоль/г) получали 25 мг указанного в заголовке соединения (выход 44%).
МС: 576,22 (М-Н+), ВЭЖХ Методика А, время удержания=12,14 мин.
Пример 25
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-фенилпропионовой кислоты (соединение 246)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Phe (167 мг, 0,6 ммоль/г) получали 26 мг указанного в заголовке соединения (выход 44%).
МС: 594,24 (М-Н+), ВЭЖХ Методика А, время удержания=14,58 мин.
Пример 26
Получение {[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}уксусной кислоты (соединение 311)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Gly (125 мг, 0,8 ммоль/г) получали 30 мг указанного в заголовке соединения (выход 55%).
МС: 504,21 (М-Н+), ВЭЖХ Методика А, время удержания=12,32 мин.
Пример 27
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(1Н-имидазол-4-ил)пропионовой кислоты (соединение 247)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-His (250 мг, 0,4 ммоль/г) получали 30 мг указанного в заголовке соединения (выход 51%).
МС: 584,24 (М-Н+), ВЭЖХ Методика А, время удержания=11,16 мин.
Пример 28
Получение 1-[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]-4-гидроксипирролидин-2-карбоновой кислоты (соединение 248)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Hyp (143 мг, 0,7 ммоль/г) получали 23 мг указанного в заголовке соединения (выход 50%).
МС: 560,23 (М-Н+), ВЭЖХ Методика А, время удержания=11,58 мин.
Пример 29
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-метилпентановой кислоты (соединение 249)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Ile (250 мг, 0,4 ммоль/г) получали 23 мг указанного в заголовке соединения (выход 54%).
МС: 560,26 (М-Н+), ВЭЖХ Методика А, время удержания=14,34 мин.
Пример 30
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-4-метилпентановой кислоты (соединение 513)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Leu (111 мг, 0,9 ммоль/г) получали 8,1 мг указанного в заголовке соединения (выход 14%).
МС: 560,25 (М-Н+), ВЭЖХ Методика А, время удержания=17,17 мин.
Пример 31
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-4-метилсульфанилмасляной кислоты (соединение 515)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Met (111 мг, 0,9 ммоль/г) получали 21 мг указанного в заголовке соединения (выход 36%).
МС: 578,21 (М-Н+), ВЭЖХ Методика А, время удержания=15,08 мин.
Пример 32
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}сукцинамовой кислоты (соединение 518)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Asn (167 мг, 0,6 ммоль/г) получали 22 мг указанного в заголовке соединения (выход 36%).
МС: 561,21 (М-Н+), ВЭЖХ Методика А, время удержания=15,04 мин.
Пример 33
Получение 4-карбамоил-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}масляной кислоты (соединение 541)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Gln (167 мг, 0,6 ммоль/г) получали 27 мг указанного в заголовке соединения (выход 47%).
МС: 575,22 (М-Н+), ВЭЖХ Методика А, время удержания=15,02 мин.
Пример 34
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-5-гуанидинопентановой кислоты (соединение 523)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Arg (200 мг, 0,5 ммоль/г) получали 53 мг указанного в заголовке соединения (выход 87%).
МС: 605,35 (М+Н+), ВЭЖХ Методика А, время удержания=14,84 мин.
Пример 35
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-гидроксимасляной кислоты (соединение 512)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Thr (200 мг, 0,5 ммоль/г) получали 26 мг указанного в заголовке соединения (выход 47%).
МС: 548,22 (М-Н+), ВЭЖХ Методика А, время удержания=15,45 мин.
Пример 36
Получение 2-[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (соединение 520)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Tic (143 мг, 0,7 ммоль/г) получали 25 мг указанного в заголовке соединения (выход 41%).
МС: 606,22 (М-Н+), ВЭЖХ Методика А, время удержания=17,18 мин.
Пример 37
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-метилмасляной кислоты (соединение 517)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Val (250 мг, 0,4 ммоль/г) получали 16 мг указанного в заголовке соединения (выход 29%).
МС: 546,23 (М-Н+), ВЭЖХ Методика А, время удержания=16,59 мин.
Пример 38
Получение 2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(4-гидроксифенил)пропионовой кислоты (соединение 519)
По общей методике получения соединения 242 с использованием смолы Wang с Fmoc-Tyr (125 мг, 0,8 ммоль/г) получали 22 мг указанного в заголовке соединения (выход 36%).
МС: 610,22 (М-Н+), ВЭЖХ Методика А, время удержания=16,14 мин.
Пример 39
Получение 2-[2-(4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 387)
Соединение 352 (150 мг, 0,28 ммоль), 4-хлорфенилбороновую кислоту (134 мг, 0,86 ммоль), фосфат калия (452 мг, 2,14 ммоль), хлорид лития (12,1 мг, 0,28 ммоль) и тетракис (трифенилфосфин) палладий (0) (34 мг, 0,028 ммоль) объединяли в 15 мл дегазированного диоксана и смесь кипятили с обратным холодильником в атмосфере аргона в течение ночи. Темную смесь фильтровали через слой целита, выпаривали и очищали с использованием ОФ-ВЭЖХ, при этом получали 31 мг (17%) указанного в заголовке соединения.
МС: 558,24 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,49-8,40 (м, 3H), 8,34-8,30 (м, 2H), 8,17-8,14 (дд, 1H, J=8,4 Гц и 1,5 Гц), 8,10-8,07 (дд, 1H, J=8,4 Гц и 1,2 Гц), 7,87-7,84 (м, 1H), 7,68-7,56 (м, 3H), 7,39-7,36 (м, 2H), 7,30-7,27 (д, 1H, J=8,4 Гц), 7,24-7,21 (м, 2H), 4,50 (м, 1H), 2,35 (м, 2H), 2,15 (м, 2H), 1,90 (м, 2H), 1,65 (м, 1Н), 1,49-1,26 (м, 3H).
Пример 40
Получение 1-циклогексил-2-[2-(2-пирид-4-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 369)
Указанное в заголовке соединение синтезировали по методике получения соединения 387 за исключением того, что вместо 4-хлорфенилбороновой кислоты использовали пиридин-4-бороновую кислоту.
МС: 525,26 (М+H+); H1-ЯМР (ДМСО-d6): δ м.д.) 8,75 (м, 2H), 8,61-8,58 (д, 1H, J=8,4 Гц), 8,41 (д, 1H, 1,5 Гц), 8,32 (д, 1H, 1,5 Гц), 8,13-8,10 (д, 1H, J=8,4 Гц), 8,05-7,90 (м, 4H), 7,82-7,71 (м, 6H), 4,42 (м, 1H), 2,35 (м, 2H), 2,08 (м, 2H), 1,90 (м, 2H), 1,65 (м, 1H), 1,40-1,26 (м, 3H).
Пример 41
Получение 1-циклогексил-2-{2-[3-(пирролидин-1-карбонил)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 370)
Стадия 1: 1-[3-(Пирролидин-1-карбонил)фенил]этанон (соединение 370а)
Указанный в заголовке промежуточный продукт синтезировали по методике получения соединения 18 за исключением того, что вместо 3-ацетил-4-гидроксибензойной кислоты использовали 3-ацетилбензойную кислоту.
H1-ЯМР (ДМСО-d6): δ (м.д.) 8,06-8,02 (м, 2H), 7,80-7,77 (м, 1H), 7,63-7,58 (м, 1H), 3,51 (т, 2H, J=6,6 Гц), 3,40 (т, 2H, J=6,3 Гц), 2,65 (с, 3H), 1,94-1,83 (м, 4H).
Стадия 2: 1-Циклогексил-2-{2-[3-(пирролидин-1-карбонил)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновая кислота (соединение 370)
Указанное в заголовке соединение синтезировали в четыре стадии по методикам получения соединения 13, соединения 25, соединения 27 Q=этил и соединения 204 соответственно за исключением того, что вместо ацетофенона на первой стадии использовали продукт предыдущей стадии.
МС: 545,28 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,78-8,75 (д, 1H, J=8,4 Гц), 8,55 (д, 1H, J=1,5 Гц), 8,50 (с, 1H), 8,47-8,38 (м, 4H), 8,33-8,30 (д, 1H), J=9,0 Гц), 8,17-8,14 (дд, 1H, J=8,7 Гц и 1,5 Гц), 8,10-8,06 (дд, 1H, J=8,7 Гц и 1,8 Гц), 7,74-7,66 (м, 2H), 4,50 (м, 1H), 2,36 (м, 2H), 2,15 (м, 2H), 1,90 (м, 6H), 1,65 (м, 1H), 1,44-1,20 (м, 3H).
Пример 42
Получение 2-[2-(2-бромфенил)-4-метилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 471)
Стадия 1: Сложный метиловый эфир 4-{[1-(2-бромфенил)мет-(Е)илиден]амино}бензойной кислоты (соединение 471а)
Сложный метиловый эфир 4-аминобензойной кислоты (1,51 г, 10 ммоль) и 2-бромбензальдегид (1,45 мл, 12,5 ммоль) растворяли в 15 мл метанола. Смесь выдерживали в течение ночи. Образованный осадок и кристаллы белого цвета отфильтровывали, промывали холодным метанолом (2×) и сушили.
МС: 318,03 и 320,03 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,81 (с, 1H), 8,22-8,19 (дд, 1H, J=7,8 и 1,8 Гц), 8,09-8,05 (м, 2H), 7,63-7,60 (дд, 1H, J=7,8 и 1,2 Гц), 7,43-7,30 (м, 2H), 7,24-7,2 (м, 2H), 3,92 (с, 3H), 1,62 (с, 1H).
Стадия 2: Сложный метиловый эфир 2-(2-бромфенил)-4-метилхинолин-6-карбоновой кислоты (соединение 471b)
Суспензию 1,97 г (6,1 ммоль) продукта предыдущей стадии в 20 мл ацетонитрила и раствор 385 мг (0,61 ммоль) иттербийтрифлата в 20 мл ацетонитрила объединяли и перемешивали при комнатной температуре в течение 10 минут. Затем добавляли одной порцией 1,46 мл (15,3 ммоль) 2-метоксипропена. Суспензия становилась прозрачной. Смесь перемешивали при комнатной температуре в течение ночи. На следующий день реакцию гасили добавлением 20 мл 2,5М HCl. Полученную смесь выпаривали и продукт очищали на подушке из силикагеля с использованием ступенчатого градиента 10-30% растворителя гексан-этилацетат, при этом получали 500 мг (23%) указанного в заголовке соединения (смотри также Y. Makioka, T. Shindo, Y. Taniguchi, K. Takaki, Y. Fujiwara, Synthesis, 1995). МС: 356,05 и 358,05 (М+Н+).
Стадия 3: 2-(2-Бромфенил)-4-метилхинолин-6-карбоновая кислота (соединение 471с)
Соединение 471b (500 мг, 1,4 ммоль) кипятили с обратным холодильником в смеси 15 мл диоксана и 15 мл 1М водного раствора NaOH в течение 1 часа, затем ее выпаривали досуха, остаток растворяли в 50 мл воды и подкисляли 1М раствором HCl до рН 4. Осадок отфильтровывали, промывали четыре раза водой и сушили. Выход: 361 мг (75%).
МС: 344,02 и 342,03 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 7,65-7,62 (дд, 1H, J=8,1 и 0,9 Гц), 7,60-7,51 (м, 4H), 7,46-41 (м, 1H), 7,27-7,25 (м, 2H), 1,98 (с, 3H).
Стадия 4: 2-[2-(2-Бромфенил)-4-метилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 471)
Указанное в заголовке соединение синтезировали последовательностью реакций из трех стадий, осуществляемых в одном реакционном сосуде, по методикам получения соединения 25, соединения 27 Q=этил и соединения 204 соответственно, причем синтез начинали с использованием продукта предыдущей стадии. Выход: 91%.
МС: 540,13 и 542,14 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,639 (с, 1H), 8,4-8,34 (м, 2H), 8,3-8,27 (д, 1H, J=8,7 Гц), 8,21-8,13 (д, 1H, J=8,7 Гц), 8,08-8,05 (д, 1H, J=9,0 Гц), 7,88-7,83 (м, 2H), 7,7-7,67 (дд, 1H, J=7,2 и 1,5 Гц), 7,64-7,59 (м, 1H), 7,54-7,48 (м, 1H), 4,57 (м, 1H), 2,89 (с, 1H), 2,39 (м, 2H), 2,15 (м, 2H), 1,90 (м, 2H), 1,67 (м, 1H), 1,44 (м, 3H).
Пример 43
Получение 2-[2-(4'-хлорбифен-2-ил)-4-метилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 485) и 1-циклогексил-2-(4-метил-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 498)
Соединение 471 обрабатывали по методике получения соединения 23. В результате реакции получали два продукта, которые разделяли с использованием препаративной ОФ-ВЭЖХ.
Соединение 485: МС: 572,21 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,38 (с, 1H), 8,3 (д, 1H, J=1,2 Гц), 8,17-8,05 (м, 3H), 7,96-7,92 (дд, 1H, J=9,0 и 1,5 Гц), 7,78-7,74 (м, 1H), 7,63-7,51 (м, 3H), 7,34-7,31 (м, 2H), 7,21-7,18 (м, 3H), 4,46 (м, 1H), 2,59 (с, 3H), 2,33 (м, 2H), 2,05 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,34 (3H).
Соединение 498: МС: 462,22 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,49 (м, 1H), 8,35-8,30 (м, 4H), 8,23 (с, 1H), 8,19-8,16 (д, 1H, J=8,7 Гц), 8,13-8,09 (дд, 1H, J=8,7 и 1,8 Гц), 8,00-7,97 (дд, 1H, J=8,7 Гц), 7,63-7,55 (м, 3H), 4,48 (м, 1H), 2,86 (с, 1H), 2,34 (м, 2H), 2,10 (м, 2H), 1,86 (м, 2H), 1,62 (м, 1H), 1,35 (м, 3H).
Пример 44
Получение 2-[2-(4'-хлорбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 353)
Стадия 1: 2-(2-Бромфенил)хинолин-6-карбоновая кислота (соединение 353а)
Указанный в заголовке промежуточный продукт синтезировали по методике получения соединения 13 Y=фенил за исключением того, что вместо ацетофенона использовали 2' бромацетофенон.
МС: 326,00 и 328,00 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,72 (д, 1H, J=1,2 Гц), 8,65-8,62 (д, 1H, J=8,4 Гц), 8,25-8,21 (дд, 1H, J=9,0 Гц и 1,8 Гц), 8,11-8,09 (д, 1H, J=8,7 Гц), 7,83-7,77 (м, 2H), 7,64-7,61 (м, 1H), 7,56-7,51 (м, 1H), 7,46-7,40 (м, 1H).
Стадия 2: 2-(4'-Хлорбифен-2-ил)хинолин-6-карбоновая кислота (соединение 353b)
Указанный в заголовке промежуточный продукт синтезировали из продукта предыдущей стадии - соединения 353а, по методике получения соединения 387.
МС: 358,09 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,62 (д, 1H, J=1,2 Гц), 8,36-8,33 (д, 1H, J=8,4 Гц), 8,24-8,21 (дд, 1H, J=9,0 Гц и 1,8 Гц), 8,08-8,05 (д, 1H, J=9 Гц), 7,81-7,78 (дд, 1H, J=6,3 Гц и 2,1 Гц), 7,14-7,12 (д, 1H, J=8,7 Гц), 7,64-7,52 (м, 3H), 7,34-7,31 (м, 2H), 7,18-7,15 (м, 2H).
Стадия 3: 2-[2-(4'-Хлорбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновая кислота (соединение 353)
Указанное в заголовке соединение синтезировали из соединения 353b в две стадии по методике получения соединения 25 и соединения 27 Q=этил соответственно.
МС: 476,11 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 9,03 (м, 1H), 8,71-8,69 (дд, 1H, J=7, Гц), 8,43-8,29 (м, 3H), 8,1-8,07 (дд, 1H, J=7,5 Гц), 7,93-7,84 (м, 2H), 7,68-7,57 (м, 3H), 7,38-7,2 (м, 5H).
Пример 45
Получение 2-[2-(4'-хлорбифен-2-ил)-7-фторхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 408)
Указанное в заголовке соединение синтезировали по методикам получения соединений примеров 42-43 за исключением того, что на стадии 1 примера 42 сложный метиловый эфир 4-аминобензойной кислоты заменяли сложным метиловым эфиром 4-амино-2-фторбензойной кислоты и на второй стадии использовали простой метилвиниловый эфир.
МС: 576,19 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,42-8,40 (д, 1H, J=7,8 Гц), 8,34-8,31 (м, 2H), 8,13-8, 3 (м, 2H), 7,97-7,94 (дд, 1H, J=8,4 и 1,5 Гц), 7,81-7,78 (м, 1H), 7,63-7,51 (м, 3H), 7,35-7,32 (м, 2H), 7,19-7,12 (м, 3H), 4,14 (м, 1H), 2,26 (м, 2H), 1,95 (м, 2H), 1,82 (м, 2H), 1,60 (м, 1H), 1,33 (м, 3H), F19-ЯМР (ДМСО-d6): δ (м.д.) -112,33 (т).
Пример 46
Получение 2-(2-бифен-2-ил-7-фторхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 388)
Указанное в заголовке соединение собирали в качестве побочного продукта синтеза соединения 408.
МС: 541,22 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,39-8,36 (д, 1H, J=7,5 Гц), 8,30 (д, 1H, J=1,5 Гц), 8,26-8,23 (д, 1H, J=8,7 Гц), 8,10-8,04 (м, 2H), 7,96-7,78 (м, 1H), 7,65-7,51 (м, 3H), 7,30-7,26 (м, 3H), 7,18-7,15 (м, 2H), 7,08-7,05 (д, 1H, J=8,7 Гц), 4,14 (м, 1H), 2,26 (м, 2H), 1,95 (м, 2H), 1,82 (м, 2H), 1,60 (м, 1H), 1,32 (м, 3H). F19-ЯМР (ДМСО-d6): δ (м.д.) 112,51 (т).
Пример 47
Получение 2-[2-(4'-хлорбифен-2-ил)-8-метилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 417)
Указанное в заголовке соединение синтезировали по методикам получения соединений примеров 42-43 за исключением того, что на стадии 1 примера 42 сложный метиловый эфир 4-аминобензойной кислоты заменяли сложным метиловым эфиром 4-амино-3-метилбензойной кислоты и на второй стадии использовали простой метилвиниловый эфир.
МС: 572,21 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,43 (д, 1H, J=8,4 Гц), 8,30 (д, 1H, J=1,5 Гц), 8,20-8,17 (м, 2H), 7,99 (дд, 1H, J=8,7 и 1,2 Гц), 7,88-7,83 (м, 2H), 7,62-7,59 (м, 2H), 7,53-7,50 (м, 1H), 7,46 (д, 1H, J=8,7 Гц), 7,33-7,30 (м, 2H), 7,17-7,14 (м, 2H), 4,46 (м, 1H), 2,51 (с, 3H), 2,35-1,28 (м, 10H).
Пример 48
Получение 2-(2-бифен-2-ил-8-метилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 379)
Указанное в заголовке соединение собирали в качестве побочного продукта синтеза соединения 417.
МС: 538,27 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,33-8,27 (м, 2H), 8,12-8,10 (м, 2H), 7,95 (дд, 1H, J=8,7 Гц), 7,86-7,83 (м, 2H), 7,60-7,50 (м, 3H), 7,34 (д, 1H, J=8,7 Гц), 7,26-7,13 (м, 5H), 4,44 (м, 1H), 2,62 (с, 3H), 2,35-1,23 (м, 10H).
Пример 49
Получение 1-циклогексил-2-(8-метил-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 397)
Указанное в заголовке соединение собирали в качестве побочного продукта синтеза соединения 417.
МС: 462,22 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,64 (д, 1H, J=8,7 Гц), 8,38-8,36 (м, 2H), 8,32-8,29 (м, 2H), 8,21 (м, 1H), 8,13 (д, 1H, J=8,1 Гц), 7,97-7,94 (м, 2H), 7,62-7,53 (м, 3H), 4,45 (м, 1H), 2,92 (с, 3H), 2,35-1,23 (м, 10H).
Пример 50
Получение {2-[2-(4'-хлорбифен-2-ил)-7-фторхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-ил}-(4-метилпиперазин-1-ил)метанона (соединение 521)
Указанное в заголовке соединение синтезировали из соединения 408 и N-метилпиперазина с использованием стандартной активации HBTU.
МС: 329,63 (М+2H+)/2; H1-ЯМР (ДМСО-d6): δ (м.д.) 10,95 (с, 1H), 8,34-8,28 (м, 2H), 8,06-8,00 (м, 2H), 7,85 (д, 1H, J=1,8 Гц), 7,80-7,77 (м, 1Н), 7,62-7,50 (м, 3H), 7,43-7,39 (дд, 1H, J=8,1 Гц и 1,5 Гц), 7,35-7,32 (м, 2H), 7,20-7,10 (м, 3H), 4,09 (, 1H), 3,38 (м, 5H), 3,12 (м, 3H), 2,78 (д, 3H, J=4,2 Гц), 2,28 (м, 2H), 1,93-1,80 (м, 4H), 1,59 (м, 1H), 1,33 (м, 3H); FI9-ЯМР (ДМСО-d6): δ (м.д.) -112,71 (т).
Пример 51
Получение {2-[2-(4'-хлорбифен-2-ил)-7-фторхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-ил}-(4-гидроксипиперидин-1-ил)метанона (соединение 514)
Указанное в заголовке соединение синтезировали из соединения 408 и N-гидроксипиперидина с использованием стандартной активации HBTU.
МС: 659,31 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,44-8,36 (м, 2H), 8,11-8,08 (м, 2H), 7,89-7,86 (м, 1H), 7,80 (д, 1H, J=1,2 Гц), 7,70-7,67 (м, 2H), 7,62-7,59 (м, 1H), 7,43-7,41 (м, 3H), 7,24-7,18 (, 3H), 4,17 (м, 1H), 3,83 (м, 1H), 3,3 (м, 1H), 2,37 (, 2H), 2,37-1,41 (м, 15H);
F19-ЯМР (ДМСО-d6): δ (м.д.) 112,67 (т).
Пример 52
Получение [2-(2-бифен-2-ил-7-фторхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-ил]-(4-метилпиперазин-1-ил)метанона (соединение 522)
Указанное в заголовке соединение выделяли в виде побочного продукта синтеза соединения 521.
МС: 312,65 (М+2H+)/2; H1-ЯМР (ДМСО-d6): δ (м.д.) 10,76 (с, 1H), 8,30 (д, 1H, J=7,8 Гц), 8,22 (д, 1H), J=8,7 Гц), 8,05-8,01 (м, 2H), 7,84 (д, 1H, J=1,2 Гц), 7,80-7,77 (м, 2H), 7,61-7,50 (м, 3H), 7,42-7,39 (дд, 1H), J=6,9 Гц и 1,2 Гц), 7,28-7,25 (м, 3H), 7,18-7,14 (м, 2H), 7,05 (д, 1H, J=8,7 Гц), 4,1 (м, 1H), 3,38 (м, 2H),3,12 (м, 3H), 2,79 (д, 3H, J=4,2 Гц), 2,28-1,22 (м, 13H); F19-ЯМР (ДМСО-d6): δ (м.д.) -112,77 (т).
Пример 53
Получение [2-(2-бифен-2-ил-7-фторхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-ил]-(4-гидроксипиперидин-1-ил)метанона (соединение 410)
Указанное в заголовке соединение выделяли в виде побочного продукта синтеза соединения 514.
МС: 625,34 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,32 (д, 10H, J=8,4 Гц), 8,21 (д, 1H, J=8,4 Гц), 8,04-8,97 (м, 2H), 7,79 (м, 1H), 7,71 (д, 1H, J=1,2 Гц), 7,63-7,50 (м, 3H), 7,32 (дд, 1H), J=8,4 Гц и 1,5 Гц), 7,28-7,14 (м, 2H), 7,03 (д, 1H, J=8,7 Гц), 4,09 (м, 1H), 3,73 (м, 1H), 3,20 (м, 2H), 2,25-1,33 (м, 16H), F19-ЯМР (ДМСО-d6): δ (м.д.) -112,81 (т).
Пример 54
Получение 2-[2-(5-бром-2-гидроксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 354)
Стадия 1: 3-Диметоксиметил-4-нитробензойная кислота (соединение 354а)
К раствору 5,49 г (21,5 ммоль) соединения 5 в 200 мл метанола добавляли 50 мл 1М NaOH и смесь перемешивали при комнатной температуре в течение 2-х часов. Затем реакционную смесь выпаривали досуха, остаток растворяли в 100 мл воды, подкисляли 1М HCl до рН 3-4. Осадок затем отфильтровывали, промывали водой (4×) и сушили. Выход: 4,96 г (95%).
МС: 240,08 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,49 (д, 1H, J=1,8 Гц), 8,21-8,18 (дд, 1H, J=8,4 и 1,8 Гц), 7,85-7,82 (д, 1H, J=8,4 Гц), 5,90 (с, 1H), 3,41 (с, 6H).
Стадия 2: Сложный этиловый эфир 4-циклогексиламино-3-(3-диметоксиметил-4-нитробензоиламино)бензойной кислоты (соединение 354b)
Указанный в заголовке промежуточный продукт синтезировали из продукта предыдущей стадии по методике получения соединения 25.
МС: 486,23 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,93 (с, 1H), 8,23-8,15 (м, 2H), 8,05-8,02 (д, 1H, J=8,1 Гц), 7,70-7,67 (м, 2H), 6,78-6,75 (д, 1H, J=8,4 Гц), 5,83 (с, 1H), 5,54-5,51 (д, 1H, J=7,5 Гц), 4,22 (кв, 2H, J=7,2 Гц), 3,39-3,34 (м, 7H), 1,92 (м, 2H), 1,73-1,58 (м, 3H), 1,38-1,12 (м, 8H).
Стадия 3: Сложный этиловый эфир 1-циклогексил-2-(3-диметоксиметил-4-нитрофенил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 354с)
К раствору 1,53 г (3,15 моль) продукта предыдущей стадии в 75 мл уксусной кислоты добавляли 1,5 г 4Å молекулярных сит и смесь кипятили с обратным холодильником в течение 2-х часов. ТСХ показала необратимую реакцию и образование осветленной смеси. Смесь выпаривали досуха, сушили в высоком вакууме и использовали без дальнейшей очистки.
Стадия 4: Сложный этиловый эфир 2-(4-амино-3-диметоксиметилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 354d)
100 мг 10% Pd/C в 20 мл метанола предварительно гидрировали в присутствии 1 г MgSO4 при давлении 30 фунт/дюйм2 в течение 15 минут. К катализатору добавляли соединение 354с (100 мг), растворенное в растворе 20 мл метанола, содержащего 2 мл триэтиламина, и продолжали гидрирование в течение 30 минут. Катализатор и сульфат магния фильтровали с использованием целита. Раствор выпаривали досуха и маслянистый остаток непосредственно использовали на следующей стадии.
Стадия 5: Сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 354е)
Маслянистый продукт предыдущей стадии растворяли в 25 мл смеси этанол-уксусная кислота-вода 2:2:1 и выдерживали в течение 15 минут при комнатной температуре. Смесь выпаривали досуха с получением твердого указанного в заголовке промежуточного продукта, который был достаточно чистым для того, чтобы его можно было использовать на следующей стадии без дальнейшей очистки. МС: 392,25 (М+Н+).
Стадия 6: 2-[2-(5-Бром-2-гидроксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 354)
Указанное в заголовке соединение синтезировали из продукта предыдущей стадии по методике получения соединения 19, после чего осуществляли очистку ОФ-ВЭЖХ.
МС: 542,15 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 12,81 (с, 1H), 8,77-8,74 (д, 1H, J=8,7 Гц), 8,56-8,53 (д, 1H, J=9,0 Гц), 8,41 (м, 2H), 8,30-8,27 (м, 2H), 8,10-8,07 (дд, 1H, J=8,7 и 2,1 Гц), 8,03-8,00 (д, 1H, J=8,7 Гц), 7,90-7,87 (дд, 2H, J=8,7 и 1,5 Гц), 7,57-7,53 (дд, 1H, J=9,0 и 2,4 Гц), 7,02-6,99 (д, 1H, J=9,0 Гц), 4,39 (м, 1H), 2,33 (м, 2H), 2,02 (м, 2H), 1,85 (м, 2H), 1,61 (м, 1H), 1,32 (м, 3H).
Пример 55
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 356)
Указанное в заголовке соединение синтезировали в семь стадий по методике получения соединения 204 за исключением того, что вместе соединения 18 использовали 2-гидрокси-5-метоксиацетофенон.
МС: 588,23 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,38-8,35 (м, 2H), 8,30 (д, 1H, J=1,5 Гц), 8,23 (д, 1H, J=8,7 Гц), 8,15 (д, 1H, J=8,7 Гц), 8,05 (дд, 1H, J=8,7 Гц и 1,5 Гц), 7,97 (дд, 1H, J=9 Гц и 1,5 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,31-7,27 (м, 3H), 7,21-7,17 (м, 2H), 7,13-7,10 (м, 2H), 4,41 (м, 1H), 3,87 (с, 3H), 2,34-1,28 (м, 10H).
Пример 56
Получение 1-циклогексил-2-[2-(4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 499)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 356.
МС: 554,26 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,34-8,24 (м, 4H), 8,13 (д, 1H, J=8,4 Гц), 8,05 (дд, 1H, J=9 Гц), 7, 95 (дд, 1H, J=8,4 Гц и 1,2 Гц), 7,46(д, 1H, J=8,4 Гц), 7,33 (д, 1H, J=2,4 Гц), 7,24-7,10 (м, 7H), 4,42 (м, 1H), 3,88 (с, 3H), 2,34-1,28 (м, 10H).
Пример 57
Получение 1-циклогексил-2-[2-(3-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 486)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 356.
МС: 478,22 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,68 (д, 1H, J=8,7 Гц), 8,43 (д, 1H, J=1,8 Гц), 8,33-8,29 (м, 3H), 8,15 (д, 1H, J=9 Гц), 8,06 (дд, 1H, J=8,7 Гц и 1,5 Гц), 7,97 (дд, 1H, J=8,7 Гц и 1,5 Гц), 7,91-7,87 (м, 2H), 7,53-7,48 (м, 1H), 7,12 (дд, 1H, J=8,4 Гц, 2,4 Гц), 4,43 (м, 1H), 3,89 (с, 3H), 2,35-1,28 (м, 10H).
Пример 58
Получение 2-[2-(4'-хлор-4-гидроксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 500) и 1-циклогексил-2-[2-(3-гидроксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 474) и 1-циклогексил-2-[2-(4-гидроксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 487)
К холодному раствору 2,3 г (3,7 ммоль) соединения 500а в 90 мл ДХМ добавляли 37,2 мл (37,2 ммоль) раствора 1М PBr3 в ДХМ. Смесь перемешивали в течение ночи, затем гасили добавлением 110 мл метанола. Реакционную смесь выпаривали досуха и растирали в воде с получением указанного в заголовке соединения, которое очищали ОФ-ВЭЖХ. После растирания соединение 500 было подходящим для использования в последующих реакциях без дальнейшей очистки. Образовывались также два побочных продукта (соединение 487) и (соединение 474), которые выделяли из реакционной смеси и индентифицировали.
Соединение 500: МС: 574,21 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,38-8,31 (м, 3H), 8,25 (д, 1H, J=8,7 Гц), 8,18 (д, 1H, J=8,7 Гц), 8,08 (дд, 1H, J=8,7 и 2,1 Гц), 7,99 (дд, 1H, J=8,4 и 1,5 Гц), 7,35 (д, 1H, J=8,7 Гц), 7, 28 (м, 2H), 7,21 (д, 1H, J=2,7 Гц), 7,16 (д, 1H, J=8,7 Гц), 7,10 (м, 2H), 7,01 (дд, 1H, J=8,4 и 2,1 Гц), 4,44 (м, 1H), 2,35-1,03 (м, 10H).
Соединение 474: МС: 464,21 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,68 (д, 1H, J=8,7 Гц), 8,47 (д, 1H, J=1,8 Гц), 8,34-8,22 (м, 4H), 8,10 (дд, 1H, J=8,7 и 1,8 Гц), 8,03 (дд, 1H, J=8,7 и 1,5 Гц), 7,76-7,70 (м, 2H), 7,41-7,35 (м, 1H), 6,97-6,94 (м, 1H), 4,44 (м, 1H), 2,35-1,23 (м, 10H).
Соединение 487: МС: 540,25 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,34-8,24 (м, 4H), 8,15 (д, 1H), 8,05 (дд, 1H), 7,98 (дд, 1H), 7,34 (д, 1H, J=8,7 Гц), 7,21 (м, 4H), 7,11-7,08 (м, 3H), 7,01 (дд, 1H, J=8,1 и 2,7 Гц), 5,43 (м, 1H), 2,35-1,33 (м, 10H).
Пример 59
Получение 2-{2-[4'-хлор-4-(2-метоксиэтокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 475)
Стадия 1: Сложный метиловый эфир 2-[2-(4'-хлор-4-гидроксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 475а)
К раствору 2,15 г (3,745 ммоль) соединения 500 в 100 мл метанола добавляли 25 мл 4М HCl в диоксане и смесь нагревали при 55ºС в течение 3-х часов. Затем реакционную смесь выпаривали досуха и оставшееся масло растирали в воде и сушили с получением 1,97 г (89%) указанного в заголовке промежуточного продукта, который использовали без дальнейшей очистки.
Стадия 2: 2-{2-[4'-Хлор-4-(2-метоксиэтокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 475)
Соединение 475а (100 мг, 0,162 ммоль) растворяли в 2 мл ДМФА и обрабатывали 16,8 мг (0,7 ммоль) NaH в течение 30 мин. Добавляли 1-бром-2-метоксиэтан (30,5 мкл) и смесь перемешивали в течение ночи. На следующий день реакционную смесь выпаривали досуха, маслянистый остаток растворяли в 3 мл метанола и затем добавляли 1 мл 1М NaOH. Смесь кипятили с обратным холодильником в течение 2-х часов перед ее выпариванием досуха. Продукт очищали ОФ-ВЭЖХ с получением 19,3 мг указанного в заголовке соединения.
МС: 632,24 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,40-8,34 (м, 2H), 8,32 (д, 1H, J=1,2 Гц), 8,23 (д, 1H, J=8,7 Гц), 8,15 (д, 1H, J=9,0 Гц), 8,07 (дд, 1H, J=9,0 и 1,8 Гц), 7,48 (дд, 1H, J=8,4 и 1,2 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,33-7,29 (м, 3H), 7,23-7,14 (м, 2H), 7,14-7,11 (м, 2H), 4,43 (м, 1H), 4,24 (м, 3H), 3,71 (м, 2H), 3,37 (м,3H), 2,35-1,30 (м, 10H).
Пример 60
Получение 1-циклогексил-2-{2-[4-(2-метоксиэтокси)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 461)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 475.
МС: 598,29 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,33-8,28 (м, 3H), 8,23 (д, 1H, J=9,0 Гц), 8,13-8,03 (м, 2H), 7,95 (дд, 1H, J=8,7 Гц, 1,2 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,34 (д, 1H, J=2,7 Гц), 7,24-7,18 (м, 4H), 7,14-7,10 (м, 3H), 4,41 (м, 1H), 4,22 (м, 2H), 3,5-3,3 (м, 5H вода), 2,34-1,23 (м, 10H).
Пример 61
Получение 1-циклогексил-2-{2-[3-(2-метоксиэтокси)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 445)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 475.
МС: 522,24 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,69 (д, 1H, J=8,7 Гц), 8,44 (д, 1H, J=1,8 Гц), 8,35-8,29 (м, 3H), 8,17 (д, 1H, J=8,7 Гц), 8,08 (дд, 1H, J=8,7 и 1,8 Гц), 8,98 (дд, 1H, J=9,0 и 1,8 Гц), 7,92-7,89 (м, 2H), 7,52-7,47 (м, 1H), 7,15-7,12 (м, 1H), 4,43 (м, 1H), 4,24 (м, 2H), 3,73 (м, 2H), 3,41-3,34 (м, 3H), 2,36-1,2 (м, 10H).
Пример 62
Получение 2-{2-[4'-хлор-4-(2-этоксиэтокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 507)
Указанное в заголовке соединение синтезировали по методике получения соединения 475 за исключением того, что вместо 1-бром-2-метоксиэтана использовали 1-бром-2-этоксиэтан.
МС: 646,29 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,34-8,22 (м, 3H), 8,18 (д, 1H, J=9,0 Гц), 8,08 (д, 1H, J=8,4 Гц), 8,01 (дд, 1H, J=8,4 и 1,5 Гц), 7,91 (дд, 1H, 8,4 и 1,2 Гц), 7,40 (м, 1H), 7,29-7,07 (м, 7H), 4,37 (м, 1H), 4,18 (м, 2H), 3,70 (м, 2H), 3,50 (кв, 2H, J=1,2 Гц), 2,30-1,24 (м, 10H), 1,10 (т, 3H, J=1,2 Гц).
Пример 63
Получение 2-[2-[4-карбоксиметокси-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 393)
Указанное в заголовке соединение синтезировали по методике получения соединения 475 за исключением того, что вместо 1-бром-2-метоксиэтана использовали трет-бутилбромацетат. Трет-бутильную группу удаляли на отдельной стадии перед омылением обработкой ТФУ в течение 1 часа.
МС: 630,16 (М-H+); H1-ЯМР (ДМСО-4): δ (м.д.) 8,41-8,38 (м, 2H), 8,32 (д, 1H, J=1,5 Гц), 8,25-8,18 (м, 2H), 8,09 (дд, 1H, J=8,4 и 1,8 Гц), 8,00 (дд, 1H, J=8,7 и 1,5 Гц), 7,47 (д, 1H, J=8,4 Гц), 7,32-7,29 (м, 3H), 7,23-7,11 (м, 4H), 4,83 (с, 2H), 4,44 (м, 1H), 2,35-1,3 (м, 10H).
Пример 64
Получение 2-[2-(4-карбоксиметоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 375)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 393.
МС: 596,20 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,35-8,29 (м, 3H), 8,25 (д, 1H, J=8,7 Гц), 8,15 (дд, 1H, J=9,0 Гц), 8,07 (дд, 1H, J=9,0 Гц), 7,97 (дд, 1H, 7,2 и 1,8 Гц), 7,46 (д, 1H, J=8,4 Гц), 7,31 (д, 1H, J=2,7 Гц), 7,25-7,11 (м, 8H), 4,82 (с, 2H), 4,42 (м, 1H), 2,43-1,30 (м, 10H).
Пример 65
Получение 2-[2-(3-карбоксиметоксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 359)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 393.
МС: 520,17 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,70 (д, 1H, J=8,7 Гц), 8,45 (д, 1H), 8,32 (м, 3H), 8,19 (д, 1H, J=9,0 Гц), 8,09 (дд, 1H), 8,00-7,87 (м, 3H), 7,50 (м, 1H), 7,11 (м, 1H), 4,83 (с, 2H), 4,44 (м, 1H), 2,35-1,30 (м, 10H).
Пример 66
Получение 2-{2-[4'-хлор-4-(3-пирролидин-1-ил-пропокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 447)
Указанное в заголовке соединение синтезировали по методике получения соединения 475 за исключением того, что для алкилирования вместо 1-бром-2-метоксиэтана использовали 1,3-дибромпропан. Образовавшееся 3-бромпропильное производное обрабатывали in situ избытком пирролидина с получением конечного продукта.
МС: 685,34 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,74 (м, 1H), 8,39-8,36 (м, 2H), 8,32 (д, 1H, J=1,5 Гц), 8,25 (д, 1H, J=8,7 Гц), 8,18 (д, 1H, J=8,7 Гц), 8,07 (дд, 1H, J=8,4 и 1,8 Гц), 8,98 (дд, 1H, J=9,0 и 1,6 Гц), 7,47 (д, 1H, J=8,7 Гц), 7,35-7,29 (м, 3H), 7,23-7,18 (м 2H), 7,14-7,11 (м, 2H), 4,42 (м, 1H), 4,21 (м, 2H), 3,56 (м, 2H), 3,33 (м, 2H), 3,02 (м, 2H), 2,35-1,28 (м, 16H).
Пример 67
Получение 1-циклогексил-2-{2-[4-(3-пирролидин-1-ил-пропокси)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 430)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 447.
МС: 651,36 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,70 (м, 1H), 8,34-8,23 (м, 4H), 8,13 (д, 1H, J=8,4 Гц), 8,06 (дд, 1H, J=8,7 и 1,8 Гц), 7,96 (дд, 1H, J=8,7 и 1,5 Гц), 7,47 (д, 1H, J=8,7 Гц), 7,35 (д, 1H, J=2,7 Гц), 7,26-7,18 (м, 4H), 7,14-7,09 (м, 3H), 4,41 (м, 1H), 4,21 (м, 2H), 3,58 (м, 2H), 3,34 (м, 2H), 3,02 (м, 2H), 2,35-1,23 (м, 16H).
Пример 68
Получение 1-циклогексил-2-{2-[3-(3-пирролидин-1-ил-пропокси)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 414)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 447.
МС: 575,32 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,70 (м, 1H), 8,68 (д, 1H, J=8,7 Гц), 8,42 (д, 1H), 8,30 (м, 3H), 8,14 (д, 1H, J=8,4 Гц), 8,07 (дд, 1H, J=8,4 Гц), 7,97-7,90 (м, 3H), 7,71 (м, 1H), 7,13 (м, 1H), 4,41 (м, 1H), 4,22 (м, 2H), 3,59 (м, 2H), 3,36 (м, 2H), 3,042 (м, 2H), 2,43-1,23 (м, 16H).
Пример 69
Получение 2-{2-[4'-хлор-4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 376)
Указанное в заголовке соединение синтезировали по методике получения соединения 475 за исключением того, что вместо 1-бром-2-метоксиэтана использовали 2-бром-1-пирролидин-1-илэтанон.
МС: 685,34 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,37-8,34 (м, 3H), 8,20 (д, 1H, J=8,4 Гц), 8,12-8,03 (м, 2H), 7,94 (дд, 1H, J=8,7 и 1,2 Гц), 7,43 (д, 1H, J=8,7 Гц), 7,31-7,28 (м, 3H), 7,20-7,11 (м, 4H), 4,87 (с, 2H), 4,41 (м, 1H), 3,49 (м, 2H), 3,33 (м, 2H), 2,35-1,23 (м, 14H).
Пример 70
Получение 1-циклогексил-2-{2-[4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 360)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 376.
МС: 651,34 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,30-8,25 (м, 3H), 8,20 (д, 1H, J=8,4 Гц), 8,05 (м, 2H), 7,192 (дд, 1H, J=8,4 и 1,5 Гц), 7,43 (д, 1H, J=8,4 Гц), 7,30 (д,1Н, J=2,7 Гц), 7,24-7,08 (м, 8H), 4,87 (с, 2H), 4,40 (м, 1H), 3,49 (м, 2H), 3,34 (м, 2H), 2,34-1,23 (м, 14H).
Пример 71
Получение 1-циклогексил-2-{2-[3-(2-оксо-2-пирролидин-1-илэтокси)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 503)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 376.
МС: 575,29 (М+H+); H1-ЯМР (ДМСО- d6): δ (м.д.) 8,66 (д, 1H, J=8,7 Гц), 8,41 (д, 1H, J=1,8 Гц), 8,30-8,26 (м, 3H), 8,12-8,04 (м, 2H), 7,96-7,87 (м, 3H), 7,49 (м, 1H), 7,10 (дд, 1H, J=7,8 и 2,1 Гц), 4,87 (с, 2H), 4,42 (м, 1H), 3,41 (м, 2H), 3,35 (м, 2H), 2,35-1,23 (м, 14H).
Пример 72
Получение 2-[2-(4-карбокси-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 415)
Стадия 1: Сложный метиловый эфир 2-[2-(4'-хлор-4-трифторметансульфонилоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 415а)
К раствору 1 г (1,7 ммоль) соединения 475а в 20 мл ДХМ добавляли 550 мкл (6,8 ммоль) пиридина и 21 мг (0,17 ммоль) ДМАП и всю смесь охлаждали до 0ºС. Добавляли по каплям 860 мкл Tf2O. Затем реакционную смесь перемешивали при комнатной температуре в течение 1 часа. И наконец, реакционную смесь выпаривали и растворенный в этилацетате продукт промывали холодной водой (2х), насыщенным раствором соли (2х), сушили Na2SO4 и выпаривали опять с получением указанного в заголовке промежуточного продукта в виде белой твердой пены с количественным выходом.
Стадия 2: Сложный метиловый эфир 2-[2-(4-карбокси-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 415b)
Смесь 1,334 г (1,85 ммоль) продукта с предыдущей стадии, 350 мкл ангидрида уксусной кислоты, 288 мг (5,55 ммоль) LiO(O)CH, 235 мг (5,55 ммоль) LiCl, 644 мкл (3,7 ммоль) DIEA и 54 мг (92,5 мкмоль) PdCl2 (dppp) в ДМФА нагревали в атмосфере аргона при 80ºС в течение ночи. Выпаривали растворитель и остаток растирали в воде с получением 1 г сырого указанного в заголовке промежуточного продукта, который не выделяли и использовали как таковой на следующих стадиях.
Стадия 3: 2-[2-(4-карбокси-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 415)
Сырой продукт с предыдущей стадии (250 мг) омыляли 5 экв. водного 1М NaOH в метаноле в течение 1 часа при 55ºС. Реакционную смесь выпаривали и продукт очищали ОФ-ВЭЖХ с получением указанного в заголовке соединения в виде твердого вещества желтого цвета.
МС: 600,14 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,41-8,38 (м, 2H), 8,34-8,28 (м, 3H), 8,23 (д, 1H, J=8,4 Гц), 8,14 (дд, 1H, J=8,1 и 1,8 Гц), 8,09 (дд, 1H, J=8,4 и 1,8 Гц), 8,00 (дд, 1H, J=7,2 Гц), 7,67 (д, 1H, J=7,8 Гц), 7,37 (м, 2H), 7,26-7,20 (м, 3H), 4,43 (м 1H), 2,31-1,32 (м, 10H).
Пример 73
Получение 2-{2-[4'-хлор-4-(2-диметиламиноэтилкарбамоил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 491)
Сырой продукт 415b (250 мг, 0,4 ммоль) в 2 мл ДМФА предварительно активировали 193 мг (0,5 ммоль) HATU и 174 мкл (1 ммоль) DIEA в течение 15 мин при комнатной температуре. Добавляли N',N'-диметилэтан-1,2-диамин (100 мкл, 0,9 ммоль) и перемешивали в течение ночи. На следующий день реакционную смесь выпаривали досуха и растирали в воде. Влажное твердое вещество растворяли в 5 мл метанола и омыляли по методике получения соединения 415 с получением после очистки ОФ-ВЭЖХ 8,5 мг указанного в заголовке соединения.
МС: 672,28 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,10 (м, 1H), 9,04 (м, 1H), 8,40-8,36 (м, 2H), 8,31-8,29 (м, 2H), 8,23 (д, 1H, J=8,7 Гц), 8,16-8,04 (м, 3H), 7,94 (дд, 1H, J=8,7 и 1,2 Гц), 7,65 (д, 1H, J=7,8 Гц), 7,36 (м, 2H), 7,22 (м, 3H), 4,41 (м, 1H), 3,69 (м, 2H), 3,31 (м, 2H), 2,84 (с, 6H), 2,36-1,23 (м, 10H).
Пример 74
Получение 1-циклогексил-2-{2-[4-(2-диметиламиноэтилкарбамоил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 504)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 491.
МС: 638,31 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 9,99 (м, 1H), 9,00 (м, 1H), 8,33-8,28 (м, 4H), 8,25 (д, 1H, J=8,7 Гц), 8,14-8,04 (м, 3H), 7,94 (дд, 1H, J=9,0 Гц), 7,66 (д, 1H, J=8,1 Гц), 7,30-7,27 (м, 3H), 7,21-1,13 (м, 3H), 4,41 (м, 1H), 3,68 (м, 2H), 3,31 (м, 2H), 2,83 (с, 6H), 2,35-1,23 (м, 10H).
Пример 75
Получение 2-{2-[4-(карбамоилметилкарбамоил)-4'-хлорбифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 361)
Указанное в заголовке соединение синтезировали по методике получения соединения 491 за исключением того, что вместо N',N'-диметилэтан-1,2-диамина использовали глицинамид.
МС: 658,24 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,92 (м, 1H), 8,41-8,23 (м, 5H), 8,14-8,04 (м, 3H), 7,95 (дд, 1H, J=8,4 и 1,5 Гц), 7,65 (д, 1H, J=8,4 Гц), 7,43-7,35 (м, 3H), 7,26-7,20 (м, 3H), 7,06 (м, 1H), 4,42 (м, 1H), 3,86 (м, 2H), 2,35-1,23 (м, 10H).
Пример 76
Получение 2-{2-[4-(карбамоилметилкарбамоил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 377)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 361.
МС: 624,24 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,90 (м, 1H), 8,33-8,25 (м, 4H), 8,12-8,04 (м, 3H), 7,95 (д, 1H, J=9,0 Гц), 7,64 (д, 1H, J=8,1 Гц), 7,42 (м, 1H), 7,28 (м, 2H), 7,22-7,06 (м, 3H), 4,42 (м, 1H), 3,87 (м, 2H), 2,35-1,23 (м, 10H).
Пример 77
Получение 2-[2-(4'-хлор-4-метилкарбамоилбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 378)
Указанное в заголовке соединение синтезировали по методике получения соединения 491 за исключением того, что вместо N',N'-диметилэтан-1,2-диамина использовали метиламин.
МС: 615,25 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,70 (д, 1H, J=9,3 Гц), 8,46 (д, 1H, J=1,5 Гц), 8,39 (м, 1H), 8,34-8,31 (м, 3H), 8,27-8,19 (м, 2H), 8,10-7,99 (м, 3H), 7,64-7,55 (м, 3H), 7,35 (д, 1H, J=8,4 Гц), 7,27-7,19 (м, 1H), 4,44 (м, 1H), 2,83 (д, 3H), 2,35-1,23 (м, 10H).
Пример 78
Получение 1-циклогексил-2-[2-(4-метилкарбамоилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 362)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 378.
МС: 581,28 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,65 (м, 1H), 8,36-8,25 (м, 5H), 8,15 (д, 1H, J=9,0 Гц), 8,08-8,04 (м, 2H), 7,97 (дд, 1H, J=8,7 и 1,8 Гц), 7,62 (д, 1H, J=7,8 Гц), 7,30-7,15 (м, 6H), 4,43 (м, 1H), 2,84 (д, 3H), 2,35-1,23 (м, 10H).
Пример 79
Получение 2-(2-бифен-2-илхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 395)
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза соединения 378.
МС: 524,22 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,40 (д, 1H, J=1,8 Гц), 8,34-8,28 (м, 3H), 8,23 (д, 1H, J=8,7 Гц), 8,10 (дд, 1H, J=8,4 и 1,7 Гц), 8,02 (дд, 1H, J=8,7 и 1,2 Гц), 7,81 (дд, 1H, J=7,8 и 1,5 Гц), 7,63-7,52 (м, 3H), 7,28-7,14 (м, 6H), 4,44 (м, 1H), 2,35-1,29 (м, 10H).
Пример 80
Получение циклогексил-2-(2,3-дифенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 406)
Стадия 1: 3,4-Бис-трет-бутоксикарбониламинобензойная кислота (соединение 406а)
Раствор 2 г (13,15 ммоль) 3,4-диаминобензойной кислоты, 8,61 г (39,45 ммоль)
(ВОС)2О и 2,04 г (15,78 ммоль) DIEA в 15 мл безводного ДМФА перемешивали при комнатной температуре в течение ночи и затем вливали в 150 мл воды. рН смеси доводили до рН 5 или 6 и затем экстрагировали 3×100 EtOAc. Органический слой промывали 300 мл Н2О, сушили (Na2SO4) и выпаривали растворитель. Остаток очищали на силикагеле с использованием гексана и EtOAc, при этом получали 3 г твердого вещества белого цвета. МС: 351,17 (М-Н+).
Стадия 2: 1-Циклогексил-2-(3,4-диаминофенил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 406b)
Раствор 1 г (2,84 ммоль) продукта предыдущей стадии, 0,91 г (2,84 ммоль) TBTU и 0,73 г (5,68 ммоль) DIEA в 10 мл безводного ДМФА выдерживали при комнатной температуре в течение 15 мин. К указанному раствору добавляли 0,90 г (3,41 ммоль) соединения 11 и раствор выдерживали при комнатной температуре в течение ночи. Затем раствор вливали в 100 мл воды, перемешивали в течение 30 мин., фильтровали и сушили. Полученный таким образом раствор твердых веществ в 50 мл 1М HCl и 25 мл EtOH кипятили с обратным холодильником при 110°С в течение ночи. Удаляли растворители и остаток обрабатывали 14 мл 2М NaOH в 70 мл MeOH при 60ºС в течение ночи. Выпаривали МеОН, остаток разбавляли 70 мл Н2О и подкисляли до рН 6. Осадок фильтровали, промывали Н2О и сушили с получением 0,95 г твердого вещества коричневого цвета. МС: 351,20 (М+Н+).
Стадия 3: 1-Циклогексил-2-(2,3-дифенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 406)
Раствор 100 мг (0,29 ммоль) соединения 406b и 74 мг (0,35 ммоль) бензила перемешивали при комнатной температуре в течение ночи. Выпаривали растворитель и остаток очищали препаративной ВЭЖХ с получением 10 мг.
МС: 523,25 (М-H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,44-8,32 (м, 3H), 8,18-8,12 (м, 2H), 7,97-7,90 (м, 2H), 7,79 (т, 1H, J=7,5 Гц), 7,77-7,60 (м, 1H), 7,53-7,50 (м, 3H), 7,44-7,35 (м, 4H), 4,42 (м, 1H), 2,40-2,20 (м, 2H), 2,09-2,06 (м, 2H), 1,86 (м, 2H), 1,62 (м, 2H), 1,39-1,23 (м, 3H).
Пример 81
Получение 2-[2,3-бис-(4-бромфенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 371)
Указанное в заголовке соединение получали по методике получения соединения 406, с использованием 4,4'-дибромбензила вместо бензила.
МС: 683,04 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,42-8,30 (м, 3H), 7,88-7,81 (м, 3H), 7,65-7,60 (м, 4H), 7,49-7,44 (м, 4H), 4,38 (м, 1H), 2,34-2,27 (м, 2H), 2,08-2,04 (м, 2H), 1,91-1,83 (м, 2H), 1,61 (м, 1H), 1,42-1,23 (м, 3H).
Пример 82
Получение 1-циклогексил-2-(2,3-ди-п-толилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 389)
Указанное в заголовке соединение получали по методике получения соединения 406 с использованием 4,4'-диметилбензила вместо бензила.
МС: 553,26 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,38-8,31 (м, 3H), 8,10 (т, 2H, J=10,5 Гц), 7,93 (д, 1H, J=8,4 Гц), 7,42 (дд, 4H, J=2,7 Гц и 7,8 Гц),7,19 (д, 4H, J=7,8 Гц) 4,40 (м, 1H), 2,41-2,31 (м, 8H), 2,07 (м, 2H), 1,83 (м, 2H), 1,61 (м, 1H), 1,23 (м, 3H).
Пример 83
Получение 2-[2,3-бис(4-фторфенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 409)
Получали с использованием 4,4'-дифторбензила вместо бензила по методике получения соединения 406.
МС: 561,19 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,44 (с, 1H), 8,35(т, 2H, J=9 Гц), 8,15 (м, 2H), 7,59-7,54 (м, 4H), 7,28-7,22 (м, 4H), 4,40 (м, 1H), 2,30 (м, 2H), 2,07 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,43-1,23 (м, 3H).
Пример 84
Получение 2-[2,3-бис(3-метоксифенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 425)
Получали с использованием 3,3'-диметоксибензила вместо бензила по методике получения соединения 406.
МС: 585,25 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,40-8,31 (м, 4H), 8,15 (д, 1H, J=8,4 Гц), 8,06 (д, 1H, J=4,2 Гц), 7,92 (д, 1H, J=8,4 Гц), 7,30 (т, 2H, J=8,1 Гц), 7,07 (м, 3H), 6,99 (д, 2H, J=8,1 Гц), 4,39 (м, 1H), 3,67 (с, 3H), 3,66 (с, 3H), 2,35-2,26 (м, 2H), 2,08-2,04 (м, 2H), 1,87-1,84 (м, 2H), 1,62 (м, 1H), 1,34-1,23 (м, 3H).
Пример 85
Получение 2-[2,3-бис(4-метоксифенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 441)
Получали с использованием 4,4'-диметоксибензила вместо бензила по методике получения соединения 406.
МС: 585,25 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,39 (с, 1H), 8,32 (д, 2H, J=9H), 8,13 (м, 2H), 7,96 (м, 1H), 7,84 (дд, 1H, J=0,9 Гц и 9 Гц), 7,51 (м, 4H), 6,96 (дд, 4H, J=3 Гц, 9 Гц), 4,42 (м, 1H), 3,80 (с, 3H), 3,79 (с, 3H), 2,35-2,27 (м, 2H), 2,09-2,06 (м, 2H), 1,87-1,83 (м, 2H), 1,65-1,61 (м, 1H), 1,38-1,23 (м, 3H).
Пример 86
Получение 2-[2,3-бис-(4-диметиламинофенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 458)
Получали с использованием 4,4'-диметиламинобензила вместо бензила по методике получения соединения 406.
МС: 306,17 (м/2+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,32 (м, 2H), 8,22-8,15 (м, 3H), 8,02-7,96 (м, 3H), 7,49-7,44 (м, 4H), 6,73 (д, 4H, J=9 Гц), 4,43 (м, 1H), 2,97 (с, 6H), 2,96 (с, 6H), 2,35-2,27 (м, 2H), 2,09-2,06 (м, 2H), 1,91-1,83 (м, 2H), 1,61 (м, 1H), 1,38-1,23 (м, 3H).
Пример 87
Получение 1-циклогексил-2-{2-[3',4'-диметокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 419)
Стадия 1: Сложный метиловый эфир 3-ацетил-4-иодбензойной кислоты (соединение 419а)
Суспензию 1,45 г (7,56 ммоль) сложного метилового эфира 3-ацетил-4-аминобензойной кислоты в 15 мл 6н. HCl и 3 мл MeOH перемешивали и охлаждали до 0ºС. (See Padwa, A.; et al. J. Org. Chem. 1997, 62, 4088-4096). К суспензии во время перемешивания добавляли по каплям раствор 0,63 г (9,07 ммоль) NaNO2 в 5 мл
Н2О. Образовавшийся раствор перемешивали при 0ºС в течение 15 мин. К данному раствору добавляли по каплям раствор 3,77 г KI в 25 мл Н2О. Колбу удаляли из охлаждающей ванны и перемешивали в течение ночи. Смесь экстрагировали 3×50 мл EtOAc. Органический слой промывали 10% раствором Na2S2O3 до полного удаления I2. Получали раствор светло-желтого цвета, который сушили (Na2SO4) и концентрировали. Остаток очищали на силикагеле с использованием в качестве элюента гексана и EtOAc с получением 2 г твердого вещества желтого цвета.
Стадия 2: 3-Ацетил-4-иодбензойная кислота (соединение 419b)
Раствор 2 г продукта с предыдущей стадии (6,58 ммоль) в смеси 66 мл МеОН и 33 мл 2н. водного раствора NaOH нагревали при 60ºС в течение ночи. Выпаривали МеОН и остаток подкисляли добавлением 70 мл 1н. водного раствора HCl. Образовавшуюся эмульсию экстрагировали 3×50 мл EtOAc, органический слой промывали 50 мл H2O, сушили (Na2SO4) и выпаривали растворитель с получением 1,92 г твердого вещества желтого цвета.
Стадия 3: 1-[2-Иод-5-(пирролидин-1-карбонил)фенил]этанон (соединение 419с)
Раствор 1,92 г (6,62 ммоль) продукта с предыдущей стадии 1,61 г (15,88 ммоль) Et3N и 3,01 г (7,94 ммоль) HBTU в 10 мл безводного ДМФА выдерживали при комнатной температуре в течение 15 минут. Добавляли пирролидин (2 мл) и раствор выдерживали при комнатной температуре в течение ночи. Удаляли летучие компоненты и остаток очищали на силикагеле с использованием в качестве элюента гексана и EtOAc, при этом получали 1,6 г масла желтого цвета. МС: 343,99 (М+Н+).
Стадия 4: Сложный этиловый эфир 1-циклогексил-2-{2-[иод-5-(пирролидин-1-карбонил)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 419d)
Смесь 1,03 г (3 ммоль) соединения 419с, 1,41 г (3,6 ммоль) соединения 354е и 5,1 мл 10% КОН в EtOH в 50 мл безводного EtOH нагревали при 55ºС в течение 30 мин. Выпаривали растворитель, остаток растворяли в 50 мл Н2О и раствор экстрагировали 3×50 мл EtOAc. Органические слои промывали 50 мл H2O, сушили над Na2SO4 и выпаривали растворитель. Остаток очищали на силикагеле с использованием в качестве элюента сначала смеси гексан/EtOAc и затем смеси CH2Cl2/MeOH с получением 1,09 г твердого вещества желтого цвета. МС: 699,22 (М+Н+).
Стадия 5: 1-циклогексил-2-{2-[3',4'-диметокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 419)
Смесь 50 мг (0,07 ммоль) продукта с предыдущей стадии, 20 мг (0,11 ммоль) 3,4-диметоксифенилбороновой кислоты, 8 мг (0,007 ммоль) Pd(PPh3)4 и 1,25 мл насыщенного водного раствора NaHCO3 в 2,5 мл дегазированного толуола перемешивали при 80ºС в атмосфере аргона в течение ночи. Смесь фильтровали через слой целита, выпаривали растворители и остаток гидролизовали в 2,5 мл МеОН и 0,35 мл 2н. водного раствора NaOH при 65ºС в течение 2,5 часов. Смесь подкисляли 1 мл 4н. HCl в диоксане и удаляли растворители. Остаток очищали ВЭЖХ с получением 10 мг указанного в заголовке соединения.
МС: 681,31 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,47-8,30 (м, 4H), 8,16-8,08 (м, 2H), 7,91 (д, 1H, J=1,5 Гц), 7,75 (м, 1H), 7,63 (д, 1H, J=8,1 Гц), 7,24 (д, 1H, J=8,7 Гц), 6,87-6,80 (м, 3H), 6,68 (м, 1H), 4,40 (м, 1H), 3,56 (с, 3H), 3,55 (м, 4H), 3,54 (с, 3H), 2,30 (м, 2H), 2,17 (м, 2H), 1,88 (м, 4H), 1,59 (с, 1H), 1,25 (м, 3H).
Пример 88
Получение 1-циклогексил-2-{2-[4'-нитро-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 435)
Указанное в заголовке соединение (выход: 5,2 мг) получали по методике получения соединения 419 с использованием 4-нитрофенилбороновой кислоты вместо 3,4-диметоксифенилбороновой кислоты.
МС: 666,27 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,46 (м, 3H), 8,35 (д, 1H, J=1,2 Гц), 8,26 (д, 1H), 8,20-7,98 (м, 5H), 7,81 (м, 1H), 7,48 (д, 2H, J=9 Гц), 7,40 (д, 1H, J=8,7 Гц), 3,55 (м, 4H), 2,38 (м, 2H), 2,15 (м, 2H), 1,89 (м, 4H), 1,63 (м, 1H), 1,30 (м, 3H).
Пример 89
Получение 6-(5-карбокси-1-циклогексил-1Н-бензоимидазол-2-ил)хинолин-2-карбоновой кислоты (соединение 402)
Стадия 1: 6-(1-Циклогексил-5-этоксикарбонил-1Н-бензоимидазол-2-ил)хинолин-2-карбоновая кислота (соединение 402а)
Раствор 500 мг (1,28 ммоль) соединения 354е, 255 мг (2,56 ммоль) пировиноградной кислоты и 436 г (5,16 ммоль) пиперидина в 25 мл безводного МеОН нагревали при 55ºС в течение ночи. Растворитель выпаривали, остаток растворяли в H2O и нейтрализовали. Осадок фильтровали, промывали H2O и сушили с получением 600 мг твердого вещества белого цвета.
МС: 442,18 (М-H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,76 (д, 1H, J=8,4 Гц), 8,50 (д, 1H, J=1,5 Гц), 8,38-8,32 (м, 2H), 8,22 (д, 1H, J=8,4 Гц), 8,16-8,13 (м, 2H), 7,95 (дд, 1H, J=1,8 Гц и 9 Гц), 4,36 (кв, 2H, J=7,2 Гц), 2,31 (м, 2H), 2,07 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,37 (т, 3H, J=6,9 Гц), 1,32 (м, 3H).
Стадия 2: 6-(5-Карбокси-1-циклогексил-1Н-бензоимидазол-2-ил)хинолин-2-карбоновая кислота (соединение 402)
Раствор 90 мг (0,2 ммоль) соединения 402а и 1 мл 2н. водного раствора NaOH в 4 мл MeOH нагревали в течение ночи при 55ºС. Выпаривали растворитель, остаток растворяли в H2O и нейтрализовали. Остаток фильтровали, промывали водой и сушили. Продукт очищали ВЭЖХ с получением 34 мг указанного в заголовке соединения.
МС: 416,17 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 9,23 (с, 1H), 8,76 (д, 1H, J=8,7 Гц), 8, 48 (с, 1H), 8,36 (д, 1H, J=8,7 Гц), 8,30-8,21 (м, 2H), 8,12 (т, 2H, J=8,4 Гц), 8,95 (д, 1H, J=8,7 Гц), 4,32 (м, 1H), 2,30 (м, 2H), 2,06 (м, 2H), 1,85 (м, 2H), 1,63 (м, 1Н), 1,35 (м, 3H).
Пример 90
Получение 2-[2-(1-карбамоилэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 497)
Стадия 1: Сложный этиловый эфир 2-[2-(1-карбамоилэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 497а)
Раствор 100 мг (0,23 ммоль) соединения 402а, 86 мг (0,69 ммоль) L-аланинамида, 322 мг (0,69 ммоль) PyBroP, 84 мг (0,69 ммоль) ДМАП и 89 мг (0,69 ммоль) DIEA в 5 мл безводного CH2Cl2 перемешивали при комнатной температуре в течение 24-х часов. К данному раствору добавляли 214 мг (0,92 ммоль) CSA. Раствор перемешивали в течение еще 24-х часов, разбавляли 10 мл CH2Cl2 и промывали 10 мл H2O. Растворитель выпаривали досуха. Остаток хроматографировали на силикагеле с использованием в качестве элюента сначала смеси гексан/EtOAc, затем смеси CH2Cl2/МеОН, в результате получали 50 мг масла желтого цвета. МС: 514,28 (М+Н+).
Стадия 2: 2-[2-(1-карбамоилэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 497)
Раствор 50 мг (0,1 ммоль) продукта с предыдущей стадии в 2,5 мл ТГФ, 2 мл МеОН и 0,5 мл 2н. водного раствора NaOH выдерживали при комнатной температуре в течение ночи. Растворители удаляли, остаток растворяли в 1 мл H2O и раствор нейтрализовали 1М водным раствором HCl. Осадок очищали ВЭЖХ с получением 7 мг указанного в заголовке соединения.
МС: 486,24 (М+H+); 1H-ЯМР (CD3OD): δ (м.д.) 8,76 (д, 1H, J=8,4 Гц), 8,61-8,51 (м, 3H), 8,40-8,32 (м, 3H), 8,20 (д, 1H, J=8,4 Гц), 4,70 (м, 2H), 2,47 (м, 2H), 2,67 (м, 2H), 2,00 (м, 2H), 1,75 (м, 1H), 1,60 (д, 3H, J=6,9 Гц), 1,45 (м, 3H).
Пример 91
Получение 2-[2-(1-карбамоил-2-метилпропилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 511)
Указанное в заголовке соединение (выход 5 мг) получали с использованием L-валинамида вместо L-аланинамида по методике для соединения 497а и гидролизовали по методике получения соединения 497.
МС: 514,28 (М+H+); 1H-ЯМР (CD3OD): δ (м.д.) 8,72 (д, 1H, J=9 Гц), 8,52-8,47 (м, 3H), 8,40-8,36 (м, 1H), 8,19-8,14 (м, 2H), 7,99 (д, 1H, J=8,4 Гц), 4,58 (м, 2H), 2,44 (м, 2H), 2,29 (м, 1H), 2,19 (м, 2H), 2,02 (м, 3H), 1,74 (м, 1H), 1,44 (м, 3H), 1,10 (м, 6H).
Пример 92
Получение 2-{2-[1-карбамоил-2-(1Н-имидазол-2-ил)этилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 368)
Указанное в заголовке соединение (выход: 8 мг) получали с использованием L-гистидинамида вместо L-аланинамида по методике для соединения 497а и гидролизовали по методике для соединения 497.
МС: 552,25 (М+H+); 1H-ЯМР (CD3OD): δ (м.д.) 8,80 (д, 1H, J=1,5 Гц), 8,71 (д, 1H, J=8,7 Гц), 8,49-8,45 (м, 3H), 8,32 (д, 1H, J=8,7 Гц), 8,21 (м, 2H), 8,15 (дд, 1H, J=1,8 Гц и 8,7 Гц), 7,97 (с, 1H), 7,40 (д, 1H, J=1,2 Гц), 5,05-5,01 (м, 1H), 4,53 (м, 1H), 3,54 (дд, 1H, J=5,4 Гц и 15,3 Гц), 3,52 (т, 1H, J=8,4 Гц), 2,46 (м, 2H), 2,17 (м, 2H), 1,98 (м, 2H), 1,74 (м, 1H), 1,45-1,36 (м, 3H).
Пример 93
Получение 2-[2-(1-карбамоил-2-гидроксиэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 385)
Указанное в заголовке соединение (выход: 5 мг) получали с использованием L-серинамида вместо L-аланинамида по методике получения соединения 497а и гидролизовали по методике для соединения 497.
МС: 502,23 (М+H+); 1H-ЯМР (CD3OD): δ (м.д.) 8,73 (д, 1H, J=8,4 Гц), 8,51 (м, 2H,), 8,40 (д, 1H, J=8,7 Гц), 8,26 (с, 2H), 8,17 (д, 1H, J=9,3), 7,97 (с, 1H), 4,72 (т, 1H, J=4,5 Гц), 4,59 (м, 1H), 4,02 (м, 2H), 3,00 (с, 1H), 2,86 (с, 1H), 2,46 (м, 2H), 2,20 (м, 2H), 1,98 (м, 2H), 1,75 (м, 1H), 1,43 (м, 3H).
Пример 94
Получение 2-[2-(1-карбамоил-2-фенилэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 542)
Указанное в заголовке соединение (выход: 5 мг) получали с использованием L-фенилаланинамида вместо L-аланинамида по методике получения соединения 497а и гидролизовали по методике для соединения 497.
МС: 562,27 (М+H+); 1H-ЯМР (CD3OD): δ (м.д.) 9,06 (д, 1H, J=8,1 Гц), 8,72 (д, 1H, J=8,4 Гц), 8,50 (м, 2H), 8,32 (м, 2H), 8,17 (дд, 1H, J=1,8 Гц и 8,7 Гц), 7,34-7,19 (м, 5H), 4,61 (м, 1H), 3,34 (д, 2H, скрытый растворителем), 3,22 (м, 1H), 2,46 (м, 2H), 2,25 (м, 2H), 2,00 (м, 2H), 1,77 (м, 1H), 1,44 (м, 3H).
Пример 95
Получение 2-[2-(4-хлорфенилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 510)
Стадия 1: Сложный этиловый эфир 2-[2-(4-хлорфенилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 510а)
Указанное в заголовке соединение получали в виде твердого вещества желтого цвета с использованием 4-хлоранилина вместо L-аланинамида по методике получения соединения 497а, выход соединения составил 91 мг. МС: 553,23 (М+Н+).
Стадия 2: 2-[2-(4-хлорфенилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 510)
91 мг продукта с предыдущей стадии гидролизовали по методике для соединения 497, выход указанного в заголовке соединения составил 16 мг.
МС: 525,18 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 10,97 (с, 1H), 8,83 (д, 1H, J=8,7), 8,46 (м, 2H), 8,32 (м, 2H), 8,19 (дд, 1H, J=1,8 Гц и 8,7 Гц), 8,10 (д, 1H, J=8,7 Гц), 8,02 (м, 2H), 7,94 (дд, 1H, J=1,5 Гц и 8,4 Гц), 7,48 (м, 1H), 4,41 (м, 1H), 2,32 (м, 2H), 2,06 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,36 (м, 3H).
Пример 96
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-1Н-индол-6-карбоновой кислоты (соединение 536)
Стадия 1: 2-Амино-5-бромбензальдегид (соединение 536а)
Указанный в заголовке промежуточный продукт синтезировали в пять стадий по методике получения соединения 7, при этом в качестве исходного продукта использовали 5-бром-2-нитротолуол вместо сложного метилового эфира 3-метил-4-нитробензойной кислоты.
МС: 199,97 и 201,97 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 9,75 (с, 1H), 7,71 (с, 1H), 7,39 (д, 1H, J=9,3 Гц), 7,22 (с, 2H), 6,72 (д, 1H, J=9,3 Гц).
Стадия 2: 6-Бром-2-(4'-хлор-4-метоксибифен-2-ил)хинолин (соединение 536с)
Указанный в заголовке промежуточный продукт синтезировали из продукта предыдущей реакции и соединения 525а по методике получения соединения 13 (Y=фенил), выход составил 44%.
МС: 424,03 и 426,03 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 8,20 (д, 1H, J=2,1 Гц), 8,10 (д, 1H, J=9,0 Гц), 7,93-7,83 (м, 2H), 7,40 (д, 1H, J=8,4 Гц), 7,26-7,23 (м, 3H), 7,16-7,03 (м, 4H), 3,85 (с, 3H).
Стадия 3: Производное сложного метилового эфира 3-циклогексил-1Н-индол-6-карбоновой кислоты и 2-бороновой кислоты (соединение 536е)
Соединение 536d (1г, 3 ммоль) (смотри опубликованную международную заявку на патент №WO 03/010141), 890 мг (9 ммоль) ацетата калия, 105 мг (0,15 ммоль) дихлор [1,1'-бис(дифенилфосфино)ферроцен]палладий (II) дихлорметанового аддукта и 6,7 г (30 ммоль) бис(неопентилгликолат)дибора растворяли в 20 мл ДМСО и смесь нагревали при 95ºС в течение ночи. Неочищенный продукт осаждали добавлением 30 мл воды. Его очищали на подушке из силикагеля с использованием градиентного элюирования растворителем, представляющим собой смесь толуол-этилацетат, в результате получали 391 мг (43%) указанного в заголовке соединения.
H1-ЯМР (CDCl3): δ (м.д.) 11,06 (с, 1H), 8,01 (д, 1H, J=1,5 Гц), 7,78 (д, 1H, J=8,4 Гц), 7,47 (дд, 1H, J=8,4 и 1,8 Гц), 3,81 (с, 3H), 1,98-1,33 (м, 11H).
Стадия 4: 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-1Н-индол-6-карбоновая кислота (соединение 536)
Смесь 106 г (0,25 ммоль) соединения 536с, 180 мг (0,6 ммоль) соединения 536е, 58 мг (0,05 ммоль) тетракис(трифенилфосфино)палладия, 6 мл толуола, 1,5 мл метанола и 600 мкл насыщенного раствора бикарбоната натрия нагревали в атмосфере аргона при 80ºС в течение ночи. Затем реакционную смесь выпаривали досуха, полутвердое вещество растворяли в 5 мл метанола, добавляли 3 мл 1М NaOH и нагревали при 85ºС в течение 30 минут. После чего реакционную смесь выпаривали досуха. Выделяли 27,5 мг (19%) чистого указанного в заголовке соединения в виде твердого вещества желтого цвета с использованием ОФ-ВЭЖХ.
МС: 587,23 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 11,66 (с, 1H), 8,39 (д, 1H, J=8,4 Гц), 8,20 (д, 1H, J=8,7 Гц), 8,12 (д, 1H, J=1,5 Гц), 8,00-7,95 (м, 2H), 7,86 (д, 1H, J=8,4 Гц), 7,59 (dd, 1H, J=8,7 и 1,5 Гц), 4,47 (д, 1H, J=8,7 Гц), 7,34-7,28 (м, 3H), 7,22-7,18 (м, 2H), 7,14-7,11 (м, 2H), 3,88 (с, 3H), 2,96 (м, 1H), 2,05-1,22 (м, 10H).
Пример 97
Получение 1-циклогексил-2-(2-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 405)
Стадия 1: Сложный метиловый эфир 4-метил-3-нитробензойной кислоты (соединение 405а)
4-Метил-3-нитробензойную кислоту (12,5 г, 69 ммоль) растворяли в безводном метаноле (500 мл) в 1 л колбе. В раствор барботировали HCl газ до насыщения (3 часа). Затем удаляли источник HCl и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем концентрировали досуха и сушили над пентоксидом фосфора в течение ночи с получением 13,34 г (99%) продукта, степень чистоты которого после очистки квазиколоночной (КК) ВЭЖХ составляла 99%.
H1-ЯМР (CDCl3): δ (м.д.) 8,59 (д, 1H, Ar-H2), 8,13 (дд, 1H, Ar-H6), 7,43 (д, 1H, Ar-H5), 3,96 (с, 3H, OCH3), 2,67 (с, 3H, CH3).
Стадия 2: Сложный метиловый эфир транс-4-(2-диметиламиновинил)-3-нитробензойной кислоты (соединение 405b)
100 мл колбу, снабженную 15 см головкой Вигре, загружали 10 г (49,7 ммоль) продукта с предыдущей стадии, 16,9 мл ДМФА и 21,2 г (196,0 ммоль) N,N-диметилформамиддиметилацеталя. Реакционный сосуд погружали под аргоном в масляную баню с температурой 140ºС на 18 часов, образующийся метанол отгоняли. При охлаждении до комнатной температуры темно-красное содержимое колбы загустевало. Твердое вещество переносили в 250 мл колбу с использованием ДМФА, который затем удаляли выпариванием. Остаток растирали в петролейном эфире с получением 16,16 г (95%) енамина в виде твердого вещества темно-красного цвета, степень чистоты которого после очистки КК-ВЭЖХ составляла 98,4%.
H1-ЯМР (CDCl3): δ (м.д.) 8,48 (д, 1H, Ar-H2), 7,88 (дд, 1H, Ar-H6), 7,45 (д, 1H, Ar-H5), 7, 15 (д, 1H, CH=), 5,91 (д, 1H, CH=), 3,90 (с, 3H, OCH3), 2,95 (с, 6H, (CH3)2N).
Стадия 3: Сложный метиловый эфир 4-формил-3-нитробензойной кислоты (соединение 405с)
Продукт с предыдущей стадии (16,10 г, 64,3 ммоль) и NaIO4 (41 г, 191,7 ммоль) растворяли в 250 мл ТГФ/Н2О 1:1 при комнатной температуре. Темно-красный раствор нагревали примерно до 40ºС, при этом происходило выпадение обильного осадка и цвет раствора изменялся на светло-коричневый. Через 1 час осадок удаляли фильтрацией и промывали 400 мл этилацетата. Органический слой промывали три раза насыщенным раствором NaHCO3, один раз насыщенным солевым раствором и сушили Na2SO4. Раствор выпаривали досуха и образовавшееся масло очищали на подушке из силикагеля с использованием градиентного элюирования смесью этилацетат-гексан (от 30% до 40% этилацетата) с получением после выпаривания 11,07 г (83%) указанного в заголовке промежуточного продукта в виде твердого вещества желтого цвета.
H1-ЯМР (CDCl3): δ (м.д.) 10,45 (с, 1H, CHO), 8,75 (д, 1H, Ar-H2) 8,41 (дд, 1H, Ar-H6), 8,01 (д, 1H, Ar-H5), 4,02 (с, 3H, OCH3).
Стадия 4: Сложный метиловый эфир 4-диметоксиметил-3-нитробензойной кислоты (соединение 405d)
К раствору 11 г (52,6 ммоль) продукта с предыдущей стадии в 220 мл метанола добавляли 5,5 мл смеси 4н. HCl/диоксан. Смесь поддерживали при 90ºС в течение 10 минут перед ее выпариванием досуха. Твердое вещество белого цвета опять растворяли в 20 мл метанола и обрабатывали более 2 раз 5,5 мл 4н. HCl таким же способом. Твердое вещество сушили в течение ночи в высоком вакууме с получением 12,46 г (93%) указанного в заголовке промежуточного продукта в виде масла красноватого цвета (76%).
H1-ЯМР (CDCl3): δ (м.д.) 8,43 (д, 1H, Ar-H2), 8,23 (дд, 1H, Ar-H6), 7,87 (д, 1H, Ar-H5), 5,93 (с, 1H, Ar-CH), 3,97 (с, 3H, сложный эфир CH3), 3,41 (с, 6H, ацеталь CH3).
Стадия 5: Сложный метиловый эфир 3-амино-4-диметоксиметилбензойной кислоты (соединение 405е)
MgSO4 (1 г) и 100 мг 10% Pd/C суспендировали в 20 мл метанола и гидрировали в аппаратуре Парра при давлении 30 фунт/дюйм2 в течение 20 минут. Аппаратуру открывали и последовательно добавляли 1,22 г (4,78 ммоль) продукта с предыдущей стадии, растворенного в 20 мл метанола, и затем 2 мл ТЭА. Смесь гидрировали при давлении 30 фунт/дюйм2 в течение 45 минут, удаляли катализатор фильтрацией и раствор выпаривали досуха. Твердое вещество сушили над P2O5 в течение ночи с получением 84 мг (95,4%) указанного в заголовке промежуточного продукта.
H1-ЯМР (CDCl3): δ (м.д.) 7,37 (д, 2H, Ar-H5+6), 7,31 (д, 1H, Ar-H2), 5,34 (с, 1H, Ar-CH), 4,36 (с, 2H, NH2), 3,88 (с, 3H, сложный эфир CH3), 3,33 (с, 6H, ацеталь CH3).
Стадия 6: Сложный метиловый эфир 3-амино-4-формилбензойной кислоты (соединение 53)
Продукт с предыдущей стадии (100 мг, 0,44 ммоль) растворяли при комнатной температуре в 15 мл растворяющей смеси, состоящей из EtOH-уксусная кислота-вода 2:2:1. Раствор ярко-желтого цвета через 5 минут стал светло-желтым. Смесь выдерживали в течение еще 15 минут, затем выпаривали досуха и затем в течение ночи сушили в высоком вакууме с получением 75 мг (94%) указанного в заголовке промежуточного продукта в виде порошка желтого цвета.
H1-ЯМР (CDCl3): δ (м.д.) 9,92 (с, 1H, CHO), 7,55 (д, 1H, Ar-H2), 7,34 (м, 2H, Ar-H5+6), 3,91 (с, 1H, CH3).
Стадия 7: 2-Фенилхинолин-7-карбоновая кислота (соединение 405f)
К раствору 500 мг (2,8 ммоль) продукта с предыдущей стадии добавляли 340 мг (2,8 ммоль) ацетофенона в 20 мл этанола, 2,1 мл раствора 10% КОН/этанол и смесь кипятили с обратным холодильником в атмосфере аргона в течение ночи. Продукт осаждался частично в виде тусклых кристаллов рыжевато-коричневого цвета, которые не отфильтровывали. Всю смесь выпаривали досуха; остаток растирали в простом эфире с получением продукта в виде калиевой соли. Кислоту получали растворением калиевой соли в 25 мл воды и подкислением до рН 4. Осадок собирали фильтрацией, промывали дважды водой и сушили над пентоксидом фосфора в высоком вакууме с получением 261 мг (54%) указанного в заголовке промежуточного продукта. МС: 250,32 (М+Н+).
Стадия 8: Сложный этиловый эфир 4-циклогексиламино-3-[(2-фенилхинолин-7-карбонил)амино]бензойной кислоты (соединение 405g)
К раствору 250 мг (1,0 ммоль) продукта с предыдущей стадии и 418 мг HATU (1,1 ммоль) в ДМФА (5 мл) добавляли 0,383 мл (2,2 ммоль) DIEA. Реакционную смесь перемешивали при комнатной температуре в течение 15 минут перед добавлением 289 мг (1,1 ммоль) соединения 11. После перемешивания при комнатной температуре в течение 1 часа реакция завершилась. После выпаривания досуха реакционную смесь растворяли в этилацетате и промывали водой (2×100 мл), насыщенным раствором соли (1×100 мл), сушили над сульфатом натрия и выпаривали до получения маслянистого остатка, который затем сушили в течение ночи над пентоксидом фосфора с получением 200 мг (46%) указанного в заголовке промежуточного продукта.
Стадия 9: 1-Циклогексил-2-(2-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 405)
Продукт с предыдущей стадии (200 мг, 0,4 ммоль) растворяли в 30 мл ледяной уксусной кислоты. Раствор кипятили с обратным холодильником в течение 4-х часов, затем выпаривали досуха. Твердое вещество желтого цвета опять растворяли в 20 мл этанола и при 80ºС в течение 1 часа при перемешивании добавляли 4 мл 1н. NaOH. Затем реакционную смесь выпаривали досуха. Твердое вещество растворяли в 20 мл воды, охлаждали на бане со льдом, подкисляли 4 мл 1н. HCl, после чего осадок фильтровали и промывали водой. Твердое вещество в течение ночи сушили над пентоксидом фосфора с получением 25 мг указанного в заголовке соединения.
МС: 448,27 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,64 (д, 1H), 8,44 (с, 1H), 8,30 (м, 5H), 8,18 (д, 1H), 7,95 (дд, 1H), 7,90 (дд, 1H), 7,55 (м, 3H), 3,40 (м, 4H), 2,32 (дд, 2H), 2,08 (д, 2H), 1,85 (д, 2H), 1,62 (д, 1H).
Пример 98
Получение 1-циклогексил-2-(3-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 351)
Стадия 1: 3-Фенилхинолин-7-карбоновая кислота (соединение 351а)
По методике реакции получения соединения 405f и последующей его обработке, 500 мг (2,8 ммоль) соединения 53 подвергали взаимодействию с 340 мг (2,8 ммоль)фенилацетальдегида с получением 603 мг (выход: 87%) указанного в заголовке промежуточного продукта.
МС: 250,17 (М+H+); H1-ЯМР (ДМСО): δ (м.д.) 9,35 (д, 1H), 8,72 (с, 1H), 8,58 (с, 1H), 8,12 (м, 2H); 7,90 (д, 2H), 7,55 (м, 3H).
Стадия 2: Сложный этиловый эфир 4-циклогексиламино-3-[(3-фенилхинолин-7-карбонил)амино]бензойной кислоты (соединение 351b)
По методике реакции получения соединения 405g и последующей его обработки 250 мг (1 ммоль) продукта с предыдущей стадии подвергали взаимодействию с 289 мг (1,1 ммоль) соединения 11 с использованием 418 мг (1,1 ммоль) HATU и 0,383 мл DIEA с получением 448 мг (выход: 91%) указанного в заголовке промежуточного продукта. МС: 494,29 (М+Н+).
Стадия 3: 1-Циклогексил-2-(3-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 351)
По методике реакции получения соединения 405 и последующей его обработки 450 мг (0,9 ммоль) продукта с предыдущей стадии циклизовали с 40 мл уксусной кислоты и омыляли 35 мл EtOH и 7 мл 1М NaOH с получением 70 мг (выход: 17%) указанного в заголовке соединения.
МС: 448,23 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 9,49 (д, 1H), 9,0 (д, 1H), 8,56 (с, 1H), 8,39 (м, 2H), 8,26 (д, 1H), 8,05 (м, 5H), 7,55 (м, 3H), 2,30 (м, 3H), 2,12 (д, 3H), 1,86 (д, 3H), 1,62 (д, 2H), 1,34 (м, 5H).
Пример 99
Получение 2-{[1-циклогексил-2-(3-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты (соединение 516)
К раствору 50 мг (0,11 ммоль) соединения 351 в 2 мл ДМФА добавляли 46 мг (0,12 ммоль) HATU и 40 мкл (0,24 ммоль DIEA). Смесь перемешивали при комнатной температуре в течение 30 минут и к раствору активированного сложного эфира добавляли 27 мг (0,12 ммоль) L-5-гидрокситриптофана. Через 1 час реакция завершалась. ДМФА выпаривали и оставшееся масло растворяли в 20 мл смеси ДМФА-вода 1:1, содержащей 0,1% ТФУ. Раствор помещали в колонку для проведения ОФ-ВЭЖХ, в результате чего получали указанное в заголовке чистое соединение в виде соли ТФУ.
Превращение в HCl соль: Очищенное соединение 516 растворяли в 0,8 мл метанола и последовательно добавляли 1 мл 4М HCl в диоксане и 40 мл простого эфира. Осадок не совсем белого цвета центрифугировали и декантировали простой эфир. Выход: 15 мг (25%) твердого вещества бежевого цвета.
МС: 648,24 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 10,50 (д, 1H), 9,45 (с, 1H), 8,92 (с, 1H), 8,52 (с, 1H), 8,39-8,30 (м, 3H), 8,23 (м, 1H), 7,98 (м, 4H), 7,54 (м, 3H), 7,08 (м, 3H), 6,87 (м, 3H), 6,56 (д, 1H), 4,65 (м, 1H), 4,36 (м, 1H), 2,32 (м, 2H), 2,10 (м, 2H), 1,84 (д, 2H), 1,95(м, 1H), 1,29 (м, 4H).
Пример 100
Получение морфолин-4-иламида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 574)
Раствор соединения 203 (0,25 ммоль) в 3 мл ДМФА предварительно активировали HATU (0,246 ммоль) и DIEA (0,5 ммоль). К раствору добавляли требуемый амин (0,1 ммоль) и реакционную смесь перемешивали в течение 16 часов. После завершения реакции смесь очищали ОФ-ВЭЖХ и превращали в HCl соль выпариванием досуха, растворением в 0,8 мл метанола и добавлением 1 мл 4М HCl в диоксане и затем 40 мл простого эфира. Соединение центрифугировали, растворитель декантировали и твердое вещество сушили с получением конечного соединения.
По данной общей методике с использованием морфолин-4-иламина (9,8 мкл) получали 15 мг указанного в заголовке соединения (выход: 58%). МС: 533,32 (М+Н+), ВЭЖХ Методика А, время удержания=12,87 мин.
Пример 101
Получение 2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}этансульфоновой кислоты (соединение 524)
По общей методике получения соединения 574 с использованием 2-аминоэтансульфоновой кислоты (12,5 мг) получали 28 мг указанного в заголовке соединения (выход: 98%). МС: 556,28 (М+Н+), ВЭЖХ Методика А, время удержания=11,36 мин.
Пример 102
Получение (7-гидроксинафталин-1-ил)амида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 575)
По общей методике получения соединения 574 с использованием 8-аминонафталин-2-ола (15,9 мг) получали 5 мг указанного в заголовке соединения (выход: 20%). МС: 590,25 (М+Н+), ВЭЖХ Методика А, время удержания=15,31 мин.
Пример 103
Получение (5-гидроксинафталин-1-ил)амида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 576)
По общей методике получения соединения 574 с использованием 5-аминонафталин-1-ола (15,9 мг) получали 7 мг указанного в заголовке соединения (выход: 25%). МС: 590,24 (М+Н+), ВЭЖХ Методика А, время удержания=15,26 мин.
Пример 104
Получение 6-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}нафталин-2-карбоновой кислоты (соединение 526)
По общей методике получения соединения 574 с использованием 6-аминонафталин-2-карбоновой кислоты (18,7 мг) получали 15 мг указанного в заголовке соединения (выход: 53%). МС: 618,30 (М+Н+), ВЭЖХ Методика А, время удержания=16,24 мин.
Пример 105
Получение (4-метил-2-оксо-2Н-хромен-7-ил)амида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 577)
По общей методике получения соединения 574 с использованием 7-амино-4-метилхромен-2-она (17,5 мг) получали 8 мг указанного в заголовке соединения (выход: 27%). МС: 606,29 (М+Н+), ВЭЖХ Методика А, время удержания=19,22 мин.
Пример 106
Получение 1-циклогексил-2-(2-фенил-1,2,3,4-тетрагидрохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 215)
Раствор соединения 203 (100 мг, 0,23 ммоль) и оксида платины (12 мг, 0,048 ммоль) в метаноле (5 мл) гидрировали при 40 фунт/дюйм2 в течение 3-х часов. Реакционную смесь выпаривали досуха и очищали ВЭЖХ. Образовавшееся соединение затем превращали в HCl соль по стандартной методике, в результате чего получали 40 мг (выход: 37%) указанного в заголовке соединения.
МС: 452,25 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,31 (д, 1H, J=9), 8,22 (д, 1H, J=1,5), 8,044 (дд, 1H, J=9,1, 1,5), 7,36 (м, 7H), 6,865 (д, 1H, J=9), 4,58 (м, 2H), 2,86 (м, 1H), 2,66 (м, 1H), 2,33 (м, 2H), 2,07 (м, 3H), 1,90 (м, 3H), 1,66 (м, 1H), 1,41 (м, 3H).
Пример 107
Получение 2-[2-(2-бромфенил)-3-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 424)
Стадия 1: 1-(2-Бромфенил)-2-фенилэтанол (соединение 424а)
Смесь 2-бромбензальдегида (1 мл, 5,4 ммоль) в диэтиловом эфире (2 мл) добавляли в высушенную в пламени колбу и промывали аргоном. Температуру снижали до -10ºС и в колбу шприцом медленно добавляли хлорид бензилмагния. Реакционную смесь перемешивали при -10ºС в течение 1 часа и затем перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь вливали в лед и подкисляли до рН 3. Затем ее экстрагировали простым эфиром (3×40 мл). Органические слои объединяли, выпаривали и полученный остаток очищали хроматографией на силикагеле с получением 520 мг (выход: 33%) указанного в заголовке промежуточного продукта.
H1-ЯМР (CDCl3): δ (м.д.) 7,54 (дд, 2H), 7,33 (м, 1H), 7,25 (м, 3H), 7,12 (м, 2H), 5,22 (м, 1H), 3,18 (дд, 3,18, J=2,7, 13,8), 2,715 (дд, 1H, J=13,8, 9).
Стадия 2: 1-(2-Бромфенил)-2-фенилэтанон (соединение 424b)
В высушенную в пламени колбу добавляли периодинан Dess-Martin (1,23 г, 2,9 ммоль) и дихлорметан (30 мл). Смесь охлаждали до 0ºС, добавляли продукт предшествующей реакции (520 мг, 1,8 моль) и перемешивали в течение 1 часа при пониженной температуре перед перемешиванием в течение 48 часов при комнатной температуре. Реакционную смесь выпаривали до получения масла и очищали на силикагеле с получением указанного в заголовке промежуточного продукта (385 мг, выход: 78%).
H1-ЯМР (CDCl3): δ (м.д.) 7,58 (м, 1H), 7,26 (м, 8H), 4,23 (с, 2H).
Стадия 3: 3-(2-Бромфенил)-2-фенилхинолин-6-карбоновая кислота (соединение 424с)
По методике реакции получения соединения 405f и последующей его обработки соединение 53 (235 мг, 1,31 ммоль) подвергали взаимодействию с продуктом предыдущей реакции - соединением 424b (360 мг, 1,31 ммоль) в этаноле (12 мл) с использованием 10 мас./об. КОН в этаноле (1,1 мл), в результате получали указанное в заголовке соединение (210 мг, выход: 40%).
МС: 403,22 (М-H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,69 (с, 1H), 8,28 (д, 1H, J=8,7), 8,04 (с, 1H, J=8,7), 7,93 (с, 1H); 7,542 (д, 1H, J=7,2), 7,40 (м, 3H), 7,25 (м, 4H).
Стадия 4: Сложный этиловый эфир 3-{[2-(2-бромфенил)-3-фенилхинолин-6-карбонил]амино}-4-циклогексиламинобензойной кислоты (соединение 424d)
По методике реакции получения соединения 405 г и последующей его обработки использовали продукт предыдущей реакции - соединение 424с (200 мг, 0,495 ммоль), HATU (207 мг, 0,545 ммоль), DIEA (141 мг, 1,09 ммоль), соединение 11 (143 мг, 0,545 ммоль) и ДМФА (4 мл), в результате получали указанный в заголовке промежуточный продукт (250 мг, выход: 78%). МС: 649,57 (М+Н+).
Стадия 5: 2-[2-(2-бромфенил)-3-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 424)
По методике реакции получения соединения 405 и последующей его обработки продукт предыдущей реакции (250 мг, 0,39 ммоль) подвергали взаимодействию с уксусной кислотой (30 мл) и 1М NaOH (4 мл) с получением указанного в заголовке соединения (60 мг, выход: 25%).
МС 602,15; H1-ЯМР (ДМСО-d6): δ (м.д.) 8,71 (с, 1H), 8,53 (с, 1H), 8,31 (м, 2H), 8,13 (м, 2H), 7,98 (дд, 1H, J=1,5, 8,4), 7,585 (д, 1H, J=7,8), 7,46 (м, 2H), 7,3 (м, 6H), 4,47 (м, 1H), 2,35 (м, 3H), 2,09 (м, 2H), 1,86 (м, 2H), 1,63 (м, 1H), 1,37 (м, 3H).
Пример 108
Получение 2-[2-(4'-хлорбифен-2-ил)-3-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 440)
Соединение 424 (50 мг, 0,083 ммоль), 4-хлорфенилбороновую кислоту (20 мг, 0,125 ммоль) и CsF (143 мг, 0,94 ммоль) добавляли в дегазированный диоксан (6 мл). К реакционному раствору добавляли раствор 2-(дициклогексилфосфино)бифенила (5 мг, 0,0125 ммоль) и ацетат палладия (2 мг, 0,0083 ммоль) в дегазированном диоксане (3 мл). Затем реакционную смесь кипятили с обратным холодильником в атмосфере аргона в течение 3-х часов. После чего реакционную смесь выпаривали досуха и очищали ВЭЖХ с получением указанного в заголовке соединения (4 мг, выход: 10%).
МС 634,18; H1-ЯМР (ДМСО-d6): δ (м.д.) 8,40 (д, 2H, J=4,8), 8,30 (д, 2H, J=8,7), 8,09 (м, 2H), 7,9 (д, 1H, J=8,7), 7,3 (д, 1H, J=7,2), 7,54 (м, 2H), 7,20 (м, 2H), 7,08 (дд, 4H, J=13,8, 7,8), 6,61 (д, 2H, J=6,9), 6,47 (д, 2H, J=8,4), 2,34 (м, 2H), 2,05 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,38 (м, 3H).
Пример 109
Получение 2-(2-бифенил-4-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 390)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-бифенил-4-илэтаноном (51 мг, 0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об. КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (15 мг, выход: 10%).
МС: 524,24 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,71 (д, 1H, J=9), 8,39 (м, 6H), 8,2 (д, 1H, J=8,7), 8,19 (д, 1H, J=9), 8,0 (д, 1H, J=9), 7,9 (д, 2H, J=8,1), 7,79 (д, 2H, J=7,5), 7,52 (м, 2H), 7,42 (м, 1H), 3,56 (с, 1H), 2,45 (м, 2H), 2,10 (м, 2H), 1,86 (м, 2H), 1,62 (с, 1H), 1,34 (м, 3H).
Пример 110
Получение 1-циклогексил-2-[2-(2,4-диметилтиазол-5-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 426)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2,4-диметилтиазол-5-ил)этаноном (40 мг, 0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (14 мг, выход: 12%).
МС: 483,19 (М+H+); H1-ЯМР (ДМСО-d6): 8,61 (м, 1H), 8,37 (м, 1H), 8,26 (м, 1H), 8,0 (м, 5H), 4,38 (с, 1H), 2,72 (с, 3H), 2,66 (с, 3H), 2,28 (м, 2H), 2,02 (м, 2H), 1,82 (м, 2H), 1,62 (м, 1H), 1,30 (м, 3H).
Пример 111
Получение 1-циклогексил-2-(2-пиразин-2-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 442)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-пиразин-2-илэтаноном (32 мг, 0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (15 мг, выход: 10%).
МС: 450,20 (М+H+); H1-ЯМР (ДМСО-d6): 9,79 (д, 1H, J=1,5), 8,84 (м, 3H), 8,62 (д, 1H, J=8,7), 8,53 (д, 1H, J=1,5), 8,40 (д, 1H, J=8,4), 8,34 (д, 1H, J=1,5), 8,22 (д, 1H, J=8,7), 8,15 (дд, 1H, J=9, 2,1), 8,01 (дд, 1H, J=8,4, 1,2), 2,33 (м, 2H), 2,10 (м, 2H), 1,85 (м, 2H), 1,61 (м, 1H), 1,35 (м, 3H).
Пример 112
Получение 1-циклогексил-2-[2-(5-метил-2-фенилтиофен-3-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 472)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(5-метил-2-фенилтиофен-3-ил)этаноном (56 мг, 0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (8 мг, выход: 6%). МС: 544,27 (М+Н+), ВЭЖХ Методика А, время удержания=17,05 мин.
Пример 113
Получение 1-циклогексил-2-(2-пиридин-3-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 355)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-пиридин-3-илэтаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (19 мг, выход: 17%). МС: 449,21 (М+Н+), ВЭЖХ Методика А, время удержания=7,96 мин.
Пример 114
Получение 2-[2-(4-амино-3-бромфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 372)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с N-(4-ацетил-2-бромфенил)ацетамидом (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (16 мг, выход: 15%).
МС: 541,15 (М+H+); H1-ЯМР (ДМСО-d6): 8,80 (д, 1H, J=9), 8,53 (м, 3H), 8,35 (м, 2H), 8,28 (д, 1H, J=9), 8,17 (м, 2H), 8,04 (дд, 1H, J=8,7, 1,2), 6,98 (д, 1H, J=8,7), 4,44 (м, 1H), 2,30 (м, 2H), 2,12 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,35 (м, 3H).
Пример 115
Получение 2-[2-(2-амино-4-метилтиазол-5-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 391)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2-амино-4-метилтиазол-5-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (8 мг, выход: 9%). МС: 484,19 (М+Н+), ВЭЖХ Методика А, время удержания=8,57 мин.
Пример 116
Получение 1-циклогексил-2-[2-(7-гидроксибензофуран-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 411)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(7-гидроксибензофуран-2-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (19 мг, выход: 20%). МС: 504,22 (М+Н+), ВЭЖХ Методика А, время удержания=12,20 мин.
Пример 117
Получение 1-циклогексил-2-(2-пиридин-2-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 427)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-пиридин-2-илэтаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (66 мг, выход: 61%). МС: 449,19 (М+Н+), ВЭЖХ Методика А, время удержания=9,85 мин.
Пример 118
Получение 1-циклогексил-2-(2-пиридин-4-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 443)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-пиридин-4-илэтаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (68 мг, выход: 62%). МС: 449,19 (М+Н+), ВЭЖХ Методика А, время удержания=7,98 мин.
Пример 119
Получение 1-циклогексил-2-[2-(5,6,7,8-тетрагидронафталин-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 459)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(5,6,7,8-тетрагидронафталин-2-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (65 мг, выход: 60%).
МС: 502,26 (М+H+); H1-ЯМР (ДМСО-d6): 8,76 (м, 1H), 8,54 (с, 1H), 8,39 (м, 4H), 8,10 (м, 4H), 7,36 (м, 1H), 4,45 (м, 1H), 2,84 (м, 4H), 2,35 (м, 2H), 2,14 (м, 2H), 1,80 (м, 6H), 1,62 (м, 1H), 1,34 (м, 3H).
Пример 120
Получение 1-циклогексил-2-[2-(4-имидазол-1-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 473)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(4-имидазол-1-илфенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (75 мг, выход: 59%). МС: 514,23 (М+Н+), ВЭЖХ Методика А, время удержания=8,40 мин.
Пример 121
Получение 2-(2-бензо[1,3] диоксол-5-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 412)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-бензо[1,3]диоксол-5-илэтаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (30 мг, выход: 24%).
МС: 492,21 (М+H+); H1-ЯМР (ДМСО-d6): 8,68 (м, 1H), 8,42 (с, 1H), 8,28 (м, 4H), 8,05 (м, 2H), 7,92 (м, 2H), 7,13 (м, 1H), 6,15 (с, 2H), 2,33 (м, 2H), 2,10 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,35 (м, 3H).
Пример 122
Получение 1-циклогексил-2-[2-(4-феноксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 428)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(4-феноксифенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (42 мг, выход: 31%).
МС: 540,25 (М+H+); H1-ЯМР (ДМСО-d6): 8,68 (д, 1H), 8,46 (д, 1H), 8,30 (м, 6H), 8,04 (дд, 2H), 7,44 (м, 2H), 7,16 (м, 5H), 4,45 (м, 1H), 2,32 (м, 2H), 2,10 (м, 2H), 1,85 (м, 2H), 1,65 (м, 1H), 1,35 (м, 3H).
Пример 123
Получение 1-циклогексил-2-[2-(6-метилнафталин-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 444)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(6-метилнафталин-2-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (23 мг, выход: 18%).
МС: 512,26 (М+H+); H1-ЯМР (ДМСО-d6): 8,85 (с, 1H), 8,73 (д, 1H), 8,46 (д, 3H), 8,34 (м, 2H), 8,20 (д, 1H), 8,10 (дд, 1H), 8,02 (м, 3H), 7,57 (с, 1H), 7,44 (1H), 2,32 (м, 2H), 2,08 (м, 2H), 1,85 (м, 2H), 1,64 (м, 1H), 1,36 (м, 3H).
Пример 124
Получение 1-циклогексил-2-[2-(2-гидроксинафталин-1-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 460)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2-гидроксинафталин-1-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (7 мг, выход: 6%). МС: 514,23 (М+Н+), ВЭЖХ Методика А, время удержания=12,20 мин.
Пример 125
Получение 1-циклогексил-2-(2-нафталин-1-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 357)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-нафталин-1-илэтаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (4 мг, выход: 4%).
МС: 498,24 (М+H+); H1-ЯМР (ДМСО-d6): 8,82 (д, 1H), 8,59 (д, 1H), 8,36 (м, 2H), 8,24 (д, 1H), 8,10 (м, 6H), 7,81 (д, 1H), 7,70 (м, 1H), 7,57 (м, 2H), 4,49 (м, 1H), 3,55 (с, 1H), 2,31 (м, 2H), 2,10 (м, 2H), 1,82 (м, 2H), 1,62 (м, 1H), 1,36 (м, 3H).
Пример 126
Получение 1-циклогексил-2-[2-(4-пиперазин-1-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 488)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(4-пиперазин-1-илфенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (120 мг, выход: 91%). МС: 532,21 (М+Н+), ВЭЖХ Методика А, время удержания=7,78 мин.
Пример 127
Получение 2-[2-(4-ацетиламинофенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 501)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с N-(4-ацетилфенил)ацетамидом (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (19 мг, выход: 15%). МС: 505,26 (М+Н+), ВЭЖХ Методика А, время удержания=9,94 мин.
Пример 128
Получение 2-[2-(4-аминофенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 358)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(4-аминофенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (14 мг, выход: 10%). МС: 463,23 (М+Н+), ВЭЖХ Методика А, время удержания=8,62 мин.
Пример 129
Получение 2-[2-(3-карбамоил-4-гидроксифенил)хинолин-6-ил]-1-циклогексил- 1Н-бензоимидазол-5-карбоновой кислоты (соединение 374)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 5-ацетил-2-гидроксибензамидом (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (13 мг, выход: 10%). МС: 507,24 (М+Н+), ВЭЖХ Методика А, время удержания=10,36 мин.
Пример 130
Получение 1-циклогексил-2-[2-(3-гидроксипропил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 392)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 5-гидроксипентан-2-оном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (96 мг, выход: 90%). МС: 430,23 (М+Н+), ВЭЖХ Методика А, время удержания=6,84 мин, степень чистоты: 82,48%.
Пример 131
Получение 2-(2-бензофуран-2-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 413)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-бензофуран-2-илэтаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (75 мг, выход: 62%). МС: 488,22 (М+Н+), ВЭЖХ Методика А, время удержания=14,35 мин.
Пример 132
Получение 1-циклогексил-2-[2-(4-морфолин-4-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 429)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(4-морфолин-4-илфенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (37 мг, выход: 30%). МС: 533,28 (М+Н+), ВЭЖХ Методика А, время удержания=10,39 мин.
Пример 133
Получение 2-[6-(2-нитрофенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 446)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2-нитрофенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (11 мг, выход: 10%). МС: 493,21 (М+Н+), ВЭЖХ Методика А, время удержания=12,72 мин.
Пример 134
Получение 2-[2-(4-бензилокси-2-гидрокси-3-метилфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 462)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(4-бензилокси-2-гидрокси-3-метилфенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (73 мг, выход: 10%). МС: 584,29 (М+Н+), ВЭЖХ Методика А, время удержания=18,27 мин.
Пример 135
Получение 1-циклогексил-2-[2-(2-пиразол-1-ил-этил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 476)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 4-пиразол-1-илбутан-2-оном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (14 мг, выход: 50%). МС: 466,27 (М+Н+), ВЭЖХ Методика А, время удержания=8,41 мин.
Пример 136
Получение 1-циклогексил-2-(2-дипропиламинометилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 489)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-дипропиламинопропан-2-оном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (70 мг, выход: 58%). МС: 485,34 (М+Н+), ВЭЖХ Методика А, время удержания=9,20 мин.
H1-ЯМР (ДМСО-d6): 8,70 (д, 1H), 8,44 (д, 1H), 8,25 (м, 2H), 8,10 (м, 2H), 7,92 (дд, 1H), 7,95 (д, 1H), 4,8 (м, 2H), 3,4 (м, 4H), 3,25 (м, 2H), 2,30 (м, 1H), 2,00 (м, 1H), 1,85 (м, 5H), 1,6 (м, 1H), 1,35 (м, 3H), 0,89 (м, 6H).
Пример 137
Получение 2-[2-(3-карбоксиметил-2,2-диметилциклобутил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 502)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с (3-ацетил-2,2-диметилциклобутил)уксусной кислотой (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (21 мг, выход: 16%). МС: 512,31 (М+Н+), ВЭЖХ Методика А, время удержания=9,07 мин.
Пример 138
Получение 2-[2-(7-бром-5-метоксибензофуран-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 394)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(7-бром-5-метоксибензофуран-2-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (выход: 17%).
МС: 596,12 (М+H+); H1-ЯМР (ДМСО-d6): 8,75 (д, 1H), 8,51 (д, 1H), 8,34 (м, 2H), 8,3 (м, 2H), 8,13 (дд, 1H), 8,05 (дд, 1H), 7,96 (с, 1H), 7,31 (м, 2H), 4,40 (м, 1H), 3,83 (с, 1H), 2,30 (м, 2H), 2,15 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,35 (м, 3H).
Пример 139
Получение 2-{2-[1-(2-хлорпиридин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидро-пиримидин-5-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 431)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 5-ацетил-1-(2-хлорпиридин-3-ил)-1Н-пиримидин-2,4-дионом (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (45 мг, выход: 31%). МС: 593,17 (М+Н+), ВЭЖХ Методика А, время удержания=10,02 мин.
Пример 140
Получение 2-[2-(5-бензилокси-2-метилбензофуран-3-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 448)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(5-бензилокси-2-метилбензофуран-3-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (75 мг, выход: 49%). МС: 608,25 (М+Н+), ВЭЖХ Методика А, время удержания=17,24 мин.
Пример 141
Получение 2-[2-(6-хлор-9-метил-9Н-карбазол-3-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 463)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(6-хлор-9-метил-9Н-карбазол-3-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (18 мг, выход: 12%). МС: 585,21 (М+Н+), ВЭЖХ Методика А, время удержания=16,25 мин.
Пример 142
Получение 1-циклогексил-2-[2-(2,3-дигидробензофуран-5-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 478)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2,3-дигидробензофуран-5-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (34 мг, выход: 28%). МС: 490,19 (М+Н+), ВЭЖХ Методика А, время удержания=11,50 мин.
Пример 143
Получение 1-циклогексил-2-[2-(1-фенил-1Н-пиразол-4-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 449)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(1-фенил-1Н-пиразол-4-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (69 мг, выход: 51%). МС: 514,23 (М+Н+), ВЭЖХ Методика В, время удержания=6,36 мин.
Пример 144
Получение 1-циклогексил-2-[2-(3,5-диметил-1-фенил-1Н-пиразол-4-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 464)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(3,5-диметил-1-фенил-1Н-пиразол-4-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (47 мг, выход: 37%).
МС: 542,27 (М+H+); H1-ЯМР (ДМСО-d6): 8,73 (д, 1H), 8,49 (д, 1H), 8,32 (м, 2H), 8,23 (д, 1H), 8,12 (дд, 1H), 8,02 (дд, 1H), 7,93 (д, 1H), 7,57 (м, 4H), 7,47 (м, 1H), 4,45 (м, 1H), 2,58 (с, 3H), 2,34 (м, 2H), 2,32 (с, 3H), 2,10 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,36 (м, 3H).
Пример 145
Получение 1-циклогексил-2-{2-[3-(3,4-дихлорфенил)изоксазол-5-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 479)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-[3-(3,4-дихлорфенил)изоксазол-5-ил]этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (21 мг, выход: 15%). МС: 583,16 (М+Н+), ВЭЖХ Методика В, время удержания=8,77 мин.
Пример 146
Получение 2-{2-[2-хлор-4-(4-хлорфенокси)фенил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 492)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-[2-хлор-4-(4-хлорфенокси)фенил]этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (75 мг, выход: 49%). МС: 608,17 (М+Н+), ВЭЖХ Методика В, время удержания=8,44 мин.
Пример 147
Получение 2-{2-[5-(4-хлорфенил)-2-метилфуран-3-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 505)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-[5-(4-хлорфенил)-2-метилфуран-3-ил]этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (83 мг, выход: 59%). МС: 562,21 (М+Н+), ВЭЖХ Методика А, время удержания=8,99 мин.
Пример 148
Получение 2-{2-[3-(4-хлорфенил)-5-метилизоксазол-4-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 396)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-[3-(4-хлорфенил)-5-метилизоксазол-4-ил]этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (16 мг, выход: 12%).
МС: 563,20 (М+H+); H1-ЯМР (ДМСО-d6): 8,59 (д, 1H), 8,46 (д, 1H), 8,35 (д, 1H), 8,24 (м, 2H), 8,06 (м, 2H), 7,53 (с, 4H), 7,46 (д, 1H), 4,48 (м, 1H), 3,55 (с, 1H), 2,72 (с, 3H), 2,30 (м, 2H), 2,10 (м, 2H), 1,83 (м, 2H), 1,62 (м, 1H), 1,34 (м, 3H).
Пример 149
Получение 2-{2-[2-(4-хлорфенил)-4-метилтиазол-5-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 416)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-[2-(4-хлорфенил)-4-метилтиазол-5-ил]этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (27 мг, выход: 19%). МС: 580,19 (М+Н+), ВЭЖХ Методика В, время удержания=9,18 мин.
Пример 150
Получение 1-циклогексил-2-[2-(1Н-пиррол-3-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 432)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(1Н-пиррол-3-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (10 мг, выход: 8%).
МС: 437,20 (М+H+); H1-ЯМР (ДМСО-d6): 12,22 (с, 1H), 8,95 (д, 1H), 8,89 (д, 1H), 8,55 (м 2H), 8,42 (д, 1H), 8,31 (м, 2H), 8,15 (д, 1H), 7,90 (д, 1H), 7,49 (с, 1H), 7,15 (с, 1H), 4,39 (м, 1H), 3,55 (с, 1H), 2,32 (м, 2H), 2,05 (м, 2H), 1,85 (м, 2H), 1,66 (м, 1H), 1,35 (м, 3H).
Пример 151
Получение 1-циклогексил-2-[2-(1Н-пиррол-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 450)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(1Н-пиррол-2-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (11 мг, выход: 9%).
МС: 437,16 (М+H+); H1-ЯМР (ДМСО-d6): 12,12 (с, 1H), 8,80 (д, 1H), 8,49 (м, 2H), 8,31 (м, 2H), 8,18 (м, 2H), 7,95 (д, 1H), 7,63 (м, 1H), 7,43 (с, 1H), 6,45 (м, 1H), 4,40 (м, 1H), 3,51 (с, 1H), 2,30 (м, 2H), 2,08 (м, 2H), 1,85 (м, 2H), 1,65 (м, 1H), 1,35 (м, 3H).
Пример 152
Получение 1-циклогексил-2-[2-(3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 465)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 6-ацетил-4Н-бензо[1,4]оксазин-3-оном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (11 мг, выход: 8%).
МС: 519,21 (М+H+); H1-ЯМР (ДМСО-d6): 10,95 (с, 1H), 8,67 (д, 1H), 8,49 (с, 1H), 8,25 (м, 4H), 8,05 (м, 2H), 7,95 (д, 1H), 7,85 (м, 1H), 7,12 (д, 1H), 4,68 (с, 2H), 4,45 (м, 1H), 2,31 (м, 2H), 2,11 (м, 2H), 1,83 (м, 2H), 1,60 (м, 1H), 1,31 (м, 3H).
Пример 153
Получение 2-[2-(3-амино-5-фенилтиофен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 480)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(3-амино-5-фенилтиофен-2-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (19 мг, выход: 14%). МС: 545,24 (М+Н+), ВЭЖХ Методика В, время удержания=8,25 мин.
Пример 154
Получение 1-циклогексил-2-[2-(5-метоксибензофуран-3-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 493)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(5-метоксибензофуран-3-ил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (10 мг, выход: 8%). МС: 518,24 (М+Н+), ВЭЖХ Методика В, время удержания=7,60 мин.
Пример 155
Получение 1-(транс-2-гидроксициклогексил)-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 578)
Стадия 1: Сложный этиловый эфир 3-нитро-4-(транс-2-гидроксициклогексиламино)бензойной кислоты (соединение 578а)
Соединение 9 (689 мг, 3 ммоль) суспендировали в ацетонитриле (5 мл) и затем последовательно добавляли триэтиламин (1,3 мл, 9 ммоль), гидрохлорид транс-2-аминоциклогексанола (682 мг, 4,5 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 12 часов, затем добавляли 2 мл метанола и реакционную смесь кипятили с обратным холодильником в течение еще 24-х часов. Добавляли воду (100 мл) и фильтровали образовавшийся осадок, промывали его три раза водой и сушили на воздухе. Продукт использовали на следующей стадии без исследования. МС: 309,3 (М+Н+).
Стадия 2: Сложный этиловый эфир 3-амино-4-(транс-2-гидроксициклогексиламино)бензойной кислоты (соединение 578b)
Продукт с предыдущей стадии (3 ммоль) растворяли в этилацетате (60 мл) и добавляли метанол (40 мл) и 10% Pd/C (100 мг). Реакционную смесь гидрировали при комнатной температуре в аппаратуре Парра при давлении 35 фунт/дюйм2 в течение 6 ½ часов. Pd/C фильтровали и фильтрат концентрировали. В результате хроматографии (SiO2, смесь этилацетат/толуол 6:4 об./об.) получали указанный в заголовке промежуточный продукт (230 мг, 0,83 ммоль). МС: 279,2 (М+Н+).
Стадия 3: 1-(транс-2-гидроксициклогексил)-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновая кислота (соединение 578)
Соединение 36А Y=фенил (200 мг, 0,8 ммоль) активировали в 8 мл ДМФА с использованием TBTU (282 мг, 0,88 ммоль) и DIEA (0,285 мл, 1,6 ммоль) в течение 30 минут при комнатной температуре. Полученный раствор затем добавляли к соединению 578b (230 мг, 0,83 ммоль) и перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь концентрировали в вакууме до остатка и затем растворяли в уксусной кислоте (20 мл) и кипятили с обратным холодильником в течение ночи. Утром уксусную кислоту удаляли в вакууме и сырой остаток растворяли в смеси ТГФ (20 мл), метанола (16 мл) и 2М NaOH (4 мл) и раствор нагревали при 60ºС в течение ночи. Затем раствор концентрировали в вакууме до получения водного раствора и добавляли концентрированную HCl до рН 5. Образовавшийся осадок фильтровали, промывали водой и очищали с использованием колонки для ОФ-ВЭЖХ, получая указанное в заголовке чистое соединение.
Превращение в HCl соль: Очищенный с помощью ВЭЖХ продукт растворяли в 4 мл метанола и затем последовательно добавляли 500 мкл 4М HCl в диоксане и 40 мл простого эфира. Полученный осадок отделяли фильтрацией и сушили в высоком вакууме в течение ночи. Выход: 18,3 мг.
МС: 465,21 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 9,71 (с, 1H), 8,68 (с, 1H), 8,41-8,32 (м, 5H), 8,2 (д, 1H, J=8,7 Гц), 7,98 (д, 1H, 8,7 Гц), 7,62 (м, 3H), 4,33 (м, 2H), 2,36 (м, 1H), 2,06 (м, 2H), 1,77-1,55 (м, 2H), 1,29-1,22 (м, 2H).
Пример 156
Получение 2-[2-(4-амино-3,5-дихлорфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 363)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(4-амино-3,5-дихлорфенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (31 мг, выход: 25%).
МС: 531,15 (М+H+); H1-ЯМР (ДМСО-d6): 8,68 (д, 1H), 8,49 (д, 1H), 8,34 (м, 6H), 8,09 (м, 2H), 4,48 (м, 1H), 3,55 (с, 1H), 2,30 (м, 2H), 2,12 (м, 2H), 1,82 (м, 2H), 1,60 (м, 1H), 1,30 (м, 3H).
Пример 157
Получение 2-[2-(3-бромфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 482)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(3-бромфенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (15 мг, выход: 12%).
МС: 526,12 (М+H+); H1-ЯМР (ДМСО-d6): 8,72 (д, 1H), 8,53 (м, 1H), 8,48 (д, 1H), 8,35 (м, 4H), 8,23 (д, 1H), 8,10 (дд, 1H), 8,01 (дд, 1H), 7,74 (м, 1H), 7,55 (м, 1H), 4,45 (м, 1H), 3,51 (с, 1H), 2,30 (м, 2H), 2,10 (м, 2H), 1,83 (м, 2H), 1,64 (м, 1H), 1,33 (м, 3H).
Пример 158
Получение 1-циклогексил-2-[2-(3,5-диметоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 495)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(3,5-диметоксифенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (44 мг, выход: 35%).
МС: 508,23 (М+H+); H1-ЯМР (ДМСО-d6): 8,74 (д, 1H), 8,55 (д, 1H), 8,37 (м, 4H), 8,10 (м, 2H), 7,47 (д, 2H), 6,70 (м, 1H), 4,43 (м, 1H), 3,85 (с, 6H), 3,51 (с, 1H), 2,30 (м, 2H), 2,13 (м, 2H), 1,82 (м, 2H), 1,60 (м, 1H), 1,32 (м, 3H).
Пример 159
Получение 1-циклогексил-2-[2-(3,4-дихлорфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 508)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(3,4-дихлорфенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (12 мг, выход: 10%).
МС: 516,14 (М+H+); H1-ЯМР (ДМСО-d6): 8,74 (д, 1H), 8,58 (д, 1H), 8,49 (д, 1H), 8,40 (д, 1H), 8,34 (м, 3H), 8,25 (д, 1H), 8,11 (дд, 1H), 8,03 (дд, 1H), 7,85 (д, 1H), 4,45 (м, 1H), 3,51 (с, 1H), 2,32 (м, 2H), 2,10 (м, 2H), 1,84 (м, 2H), 1,62 (м, 1H), 1,33 (м, 3H).
Пример 160
Получение 1-циклогексил-2-[2-(2,4-дигидросифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 364)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2,4-дигидроксифенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (9,5 мг, выход: 8%).
МС: 480,21 (М+H+); H1-ЯМР (ДМСО-d6): 8,72 (д, 1H), 8,46 (д, 1H), 8,35 (м, 2H), 8,26 (дд, 2H), 8,15 (дд, 1H), 8,03 (д, 2H), 6,47 (дд, 1H), 6,42 (д, 1H), 4,44 (м, 1H), 3,51 (с, 1H), 2,30 (м, 2H), 2,10 (м, 2H), 1,84 (м, 2H), 1,64 (м, 1H), 1,35 (м, 3H).
Пример 161
Получение 1-циклогексил-2-[2-(3,5-дигидроксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 381)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(3,5-дигидроксифенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (22 мг, выход: 18%).
МС: 480,21 (М+H+); H1-ЯМР (ДМСО-d6): 8,66 (д, 1H), 8,46 (д, 1H), 8,32 (м, 1H), 8,25 (м, 2H), 8,11 (м, 2H), 8,01 (м, 1H), 7,15 (д, 2H), 6,41 (м, 1H), 4,46 (м, 1H), 3,51 (с, 1H), 2,32 (м, 2H), 2,15 (м, 2H), 1,84 (м, 2H), 1,62 (м, 1H), 1,32 (м, 3H).
Пример 162
Получение 1-циклогексил-2-(2-гидрокси-5-метил-3-нитрофенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 418)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2-гидрокси-5-метил-3-нитрофенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (40 мг, выход: 31%).
МС: 523,24 (М+H+); H1-ЯМР (ДМСО-d6): 8,870 (д, 1H, J=9,3), 8,61 (д, 1H, J=9,3), 8,49 (с, 2H), 8,41 (д, 1H, J=8,7), 8,30 (с, 1H), 8,15 (д, 2H, J=7,8), 7,97 (д, 1H, J=9,3), 7,89 (с, 1H), 4,20 (м, 1H), 3,55 (с, 1H), 2,42 (с, 3H), 2,32 (м, 2H), 2,08 (м, 2H), 1,84 (м, 2H), 1,62 (м, 1H), 1,37 (м, 3H).
Пример 163
Получение 1-циклогексил-2-[2-(2-гидрокси-6-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 434)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2-гидрокси-6-метоксифенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (75 мг, выход: 69%).
МС: 494,24 (М+H+); H1-ЯМР (ДМСО-d6): 9,03 (д, 1H, J=9,3), 8,63 (с, 1H), 8,42 (д, 1H, J= 8,1), 8,26 (м, 3H), 8,15 (д, 1H, J=8,4), 7,97 (д, 1H, J=9), 7,40 (м, 1H), 6,74 (м, 2H), 4,42 (м, 1H), 3,81 (с, 3H), 3,55 (с, 1H), 2,32 (м, 2H), 2,07 (м, 2H), 1,86 (м, 2H), 1,61 (м, 1H), 1,36 (м, 3H).
Пример 164
Получение 1-циклогексил-2-[2-(2-гидрокси-4,6-диметоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 452)
По методике получения соединения 354 и последующей его обработки соединение 354е (100 мг, 0,256 ммоль) подвергали взаимодействию с 1-(2-гидрокси-4,6-диметоксифенил)этаноном (0,256 ммоль) в этаноле (2 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль), в результате получали указанное в заголовке соединение (85 мг, выход: 65%).
МС: 524,25 (М+H+); H1-ЯМР (ДМСО-d6): 8,98 (д, 1H, J=8,1), 8,59 (с, 1H), 8,40 (д, 1H, J=8,7), 8,33 (м, 2H), 8,24 (д, 1H, J=9), 8,15 (д, 1H, J=8,7), 7,97 (д, 1H, J=8,7), 6,31 (м, 2H), 4,40 (м, 1H), 3,86 (с, 3H), 3,84 (с, 3H), 3,55 (с, 1H), 2,32 (м, 2H), 2,08 (м, 2H), 1,83 (м, 2H), 1,62 (м, 1H), 1,37 (м, 3H).
Пример 165
Получение 2-[2-(4'-хлорбифенил-3-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 483)
В сухой пробирке с винтовым колпачком, покрытым тефлоном, дегазировали раствор соединения 482 (156 мг, 0,31 ммоль), 4-хлорфенилбороновой кислоты (73 мг, 0,465 ммоль) и тетракис-палладия (37 мг, 0,031 ммоль) в толуоле (9 мл), метанола (2 мл) и насыщенного раствора бикарбоната натрия в воде (900 мкл), промывали аргоном и пробирку закупоривали. Реакционную смесь перемешивали в течение 16 часов при 90ºС. После завершения реакции смесь выпаривали досуха, очищали ВЭЖХ и превращали в HCl соль по стандартной методике (которая раскрыта для получения соединения 516), в результате получали указанное в заголовке соединение (73 мг, выход: 42%).
МС: 559,23 (М+H+); H1-ЯМР (ДМСО-d6): 8,76 (д, 1H, J=9), 8,53 (м, 3H), 8,34 (м, 4H), 8,13 (дд, 1H, J=8,7, 1,8), 8,05 (дд, 1H, J=8,7,1,5), 7,86 (м, 3H), 7,70 (т, 1H, J=7,8), 7,57 (м, 2H), 4,47 (м, 1H), 3,55 (с, 1H), 2,33 (м, 2H), 2,13 (м, 2H), 1,85 (м, 2H), 1,61 (м, 1H), 1,36 (м, 3H).
Пример 166
Получение 2-[2-(4'-циано-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 365)
Стадия 1: 2-[2-(2-Бром-5-метоксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 365а)
По методике получения соединения 354 и последующей его обработки соединение 354е (2,28 г, 5,83 ммоль) подвергали взаимодействию с 1-(2-бром-5-метоксифенил)этаноном (1,335 г, 5,83 ммоль) (этанон получали взаимодействием 1-(2-бром-5-метокси)бензойной кислоты с тионилхлоридом с получением 1-(2-бром-5-метокси)бензоилхлорида, который затем подвергали взаимодействию с диметилцинком с получением этанона) в этаноле (45 мл) с использованием 10 мас./об.% КОН в этаноле (11,57 мг, 17,5 ммоль), в результате получали указанный в заголовке промежуточный продукт (2,80 г, выход: 86%).
МС: 557,14 (М+Н+), ВЭЖХ Методика С, время удержания=2,82 мин.
Стадия 2: Сложный метиловый эфир 2-[2-(2-бром-5-метоксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 365b)
В высушенной в пламени колбе с палочкой для перемешивания продукт предыдущей реакции (1,35 г, 2,43 ммоль) растворяли в безводном метаноле (70 мл) и добавляли 4н. HCl в диоксане (10 мл). Реакционную смесь нагревали при 60ºС с обратным холодильником в течение ночи. После завершения реакции смесь выпаривали до получения масла, выпаривали 3 раза совместно с 50 мл безводного метанола и вспенивали из ацетонитрила с получением указанного в заголовке промежуточного продукта (1,38 г, выход: 99%).
МС: 573,12 (М+Н+), ВЭЖХ Методика А, время удержания=3,25 мин.
Стадия 3: 2-[2-(4'-Циано-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 365)
В высушенной в пламени пробирке с винтовым колпачком, покрытым тефлоном, дегазировали раствор продукта предыдущей реакции (100 мг, 0,175 ммоль), 4-цианофенилбороновой кислоты (31 мг, 0,2625 ммоль) и тетракис-палладия (20 мг, 0,0175 ммоль) в толуоле (6,5 мл), метанола (1,6 мл) и насыщенного раствора бикарбоната натрия в воде (800 мкл), промывали аргоном и пробирку закупоривали. Реакционную смесь перемешивали в течение 16 часов при 90ºС. Затем пробирку охлаждали до комнатной температуры и добавляли 10 мас./об.% КОН в метаноле (2 мл, 3,5 ммоль). Реакционную смесь повторно закупоривали и перемешивали при 70ºС в течение 1 часа. После завершения реакции смесь выпаривали досуха, очищали ВЭЖХ и превращали в HCl соль по стандартной методике (которая раскрыта для получения соединения 516), в результате получали указанное в заголовке соединение.
МС: 579,29 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,44-8,41 (м, 2H), 8,33 (с, 1H), 8,24-8,18 (м, 2H), 8,09-8,00 (м, 2H), 7,7-7,68 (м, 2H), 7,50 (д, 1H, J=8,7 Гц), 7,35-7,21 (м, 5H), 4,42 (м, 1H), 3,89 (с, 3H), 2,33-1,28 (м, 10H).
Пример 167
Получение 2-[2-(4'-карбамоил-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 382)
В высушенной в пламени пробирке с винтовым колпачком, покрытым тефлоном, дегазировали раствор соединения 365b (100 мг, 0,175 ммоль), 4-амидофенилбороновой кислоты (31 мг, 0,2625 ммоль) и тетракис-палладия (20 мг, 0,0175 ммоль) в толуоле (6,5 мл), метанола (1,6 мл) и насыщенного раствора бикарбоната натрия в воде (800 мкл), промывали аргоном и закупоривали пробирку. Реакционную смесь перемешивали в течение 16 часов при 90ºС. Затем пробирку охлаждали до комнатной температуры и добавляли 10 мас./об. % КОН в метаноле (2 мл, 3,5 ммоль). Реакционную смесь повторно закупоривали и перемешивали при 70ºС в течение 1 часа. После завершения реакции смесь выпаривали досуха, очищали ВЭЖХ и превращали в HCl соль по стандартной методике (которая раскрыта для получения соединения 516), в результате получали указанное в заголовке соединение.
МС: 597,30 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,39-8,19 (м, 5H), 8,09 (д, 1H, J=9,3 Гц), 7,99 (д, 1H, J=8,4 Гц), 7,91 (м, 1H), 7,74-7,71 (м, 2H), 7,50 (д, 1H, J=8,1 Гц), 7,33-7,31 (м, 2H), 7,23-7,17 (4H), 4,43 (м, 1H), 3,88 (с, 3H), 2,33-1,33 (м, 10H).
Пример 168
Получение 2-[2-(3'-хлор-4'-фтор- 4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 366)
В высушенной в пламени пробирке с винтовым колпачком, покрытым тефлоном, дегазировали раствор соединения 365b (100 мг, 0,175 ммоль), 4-фтор-3-хлорфенилбороновой кислоты (61 мг, 0,2625 ммоль) и тетракис-палладия (20 мг, 0,0175 ммоль) в толуоле (6,5 мл), метанола (1,6 мл) и насыщенного раствора бикарбоната натрия в воде (800 мкл), промывали аргоном и закупоривали пробирку. Реакционную смесь перемешивали в течение 16 часов при 90ºС. Затем пробирку охлаждали до комнатной температуры и добавляли 10 мас./об.% КОН в метаноле (2 мл, 3,5 ммоль). Реакционную смесь повторно закупоривали и перемешивали при 70ºС в течение 1 часа. После завершения реакции смесь выпаривали досуха, очищали ВЭЖХ и превращали в HCl соль по стандартной методике (которая раскрыта для получения соединения 516), в результате получали указанное в заголовке соединение (7 мг, выход: 7%).
МС: 606,20 (м); H1-ЯМР (ДМСО-d6): 8,40 (м, 2H), 8,31 (с, 1H), 8,19 (м, 2H), 8,05 (д, 1H, J=9), 7,96 (д, 1H, J=8,1), 7,49 (д, 1H, J=8,4), 7,37 (м, 1H), 7,30 (м, 2H), 7,20 (м, 2H), 6,98 (с, 1H), 4,40 (м, 1H), 3,75 (с, 3H), 3,55 (с, 1H), 2,30 (м, 2H), 2,05 (м, 2H), 1,85 (м, 2H), 1,63 (м, 1H), 1,30 (м, 3H).
Пример 169
Получение 1-циклогексил-2-[2-(4-метокси-4'-нитробифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 383)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-нитрофенилбороновой кислотой (62 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (15 мг, выход: 14%).
МС: 599,26 (М+H+); H1-ЯМР (ДМСО-d6): 8,40 (м, 2H), 8,29 (с, 1H), 8,10 (м, 5H), 7,97 (м, 1H), 7,53 (д, 1H, J=8,4), 7,36 (м, 4H), 7,24 (м, 1H), 4,40 (с, 1H), 3,90 (с, 3H), 3,55 (с, 1H), 2,30 (м, 2H), 2,06 (м, 2H), 1,84 (м, 2H), 1,62 (с, 1H), 1,32 (м, 3H).
Пример 170
Получение 1-циклогексил-2-[2-(4'-диметиламино-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 401)
По методике получения соединения 366 и его последующей обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-диметиламинофенилбороновой кислотой (44 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (27 мг, выход: 26%).
МС: 597,32 (М+H+); H1-ЯМР (ДМСО-d6): 8,34 (м, 4H), 8,16 (д, 1H, J=9,6), 8,06 (д, 1H, J=9,3), 7,96 (м, 1H), 7,42 (д, 1H, J=9), 7,30 (с, 1H), 7,17 (м, 3H), 7,07 (м, 3H), 4,40 (м, 1H), 3,87 (с, 3H), 2,92 (с, 6H), 2,31 (м, 2H), 2,08 (м, 2H), 1,82 (м, 2H), 1,16 (м, 1H), 1,36 (м, 3H).
Пример 171
Получение 1-циклогексил-2-[2-(4-метокси-3'-нитробифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 420)
По методике получения соединения 366 и его последующей обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 3-нитрофенилбороновой кислотой (44 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (7 мг, выход: 7%).
МС: 599,26 (М+H+); H1-ЯМР (ДМСО-d6): 8,36 (м, 3H), 8,13 (д, 2H, J=9), 8,02 (м, 4H), 7,58 (д, 1H, J=9), 7,50 (м, 2H), 7,37 (м, 2H), 7,24 (м, 1H), 4,37 (м, 1H), 3,90 (с, 3H), 3,55 (с, 1H), 2,28 (м, 2H), 2,06 (м, 2H), 1,85 (м, 2H), 1,61 (м, 1H), 1,34 (м, 3H).
Пример 172
Получение 1-циклогексил-2-[2-(4-метокси-4'-трифторметилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 436)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-трифторметилфенилбороновой кислотой (50 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (14 мг, выход: 12%).
МС: 622,27 (М+H+); H1-ЯМР (ДМСО-d6): 8,40 (м, 2H), 8,32 (с, 1H), 8,21 (д, 2H, J=8,4), 8,06 (дд, 1H, J=8,7, 1,5), 8,00 (д, 1H, J=8,7), 7,58 (д, 2H, J=8,7), 7,51 (д, 1H, J=8,4), 7,32 (м, 4H), 7,22 (м, 2H), 4,45 (м, 1H), 3,89 (с, 3H), 3,55 (с, 1H), 2,32 (м, 2H), 2,07 (м, 2H), 1,84 (м, 2H), 1,06 (м, 1H), 1,35 (м, 3H).
Пример 173
Получение 1-циклогексил-2-[2-(2-фуран-2-ил-5-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 454)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 2-фуранбороновой кислотой (30 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (5 мг, выход: 5%).
МС: 544,25 (М+H+); H1-ЯМР (ДМСО-d6): 8,51 (д, 1H, J=8,4), 8,42 (с, 1H), 8,28 (м, 2H), 8,09 (м, 2H), 7,92 (м, 2H), 7,68 (д, 1H, J=7,8), 7,48 (с, 1H), 7,40 (д, 1H, J=8,4), 7,17 (м, 1H), 6,40 (с, 1H), 6,06 (м, 1H), 4,45 (м, 1H), 3,86 (с, 3H), 2,34 (м, 2H), 2,08 (м, 2H), 1,85 (м, 2H), 1,62 (м, 1H), 1,34 (м, 3H).
Пример 174
Получение 1-циклогексил-2-[2-(4,4'-диметоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 468)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-метоксифенилбороновой кислотой (40 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (15 мг, выход: 15%).
МС: 584,29 (М+H+); H1-ЯМР (ДМСО-d6): 8,37 (м, 4H), 8,20 (д, 1H, J=9,6), 8,10 (д, 1H, J=8,1), 8,00 (д, 1H, J=9), 7,42 (д, 1H, J=8,4), 7,30 (д, 1H, J=1,5), 7,17 (м, 2H), 7,03 (д, 2H, J=8,1), 6,81 (д, 2H, J=8,7), 4,43 (м, 1H), 3,88 (с, 3H), 3,68 (с, 3H), 3,55 (с, 1H), 2,32 (м, 2H), 2,08 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,34 (м, 3H).
Пример 175
Получение 2-[2-(4'-карбокси-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 421)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с бензоатом 4-метилбороновой кислоты (47 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (22 мг, выход: 21%).
МС: 598,26 (М+H+); H1-ЯМР (ДМСО-d6): 8,32 (м, 2H), 8,21 (д, 1H, J=8,7), 8,13 (д, 1H, J=8,7), 8,03 (м, 2H), 7,95 (м, 1H), 7,84 (д, 1H, J=8,7), 7,76 (д, 2H, J=8,4), 7,50 (д, 1H, J=8,4), 7,33 (д, 1H, J=2,4), 7,21 (м, 3H), 4,41 (м, 1H), 3,89 (с, 3H), 3,55 (с, 1H), 2,29 (м, 2H), 2,05 (м, 2H), 1,83 (м, 2H), 1,61 (м, 1H), 1,32 (м, 3H).
Пример 176
Получение 2-[2-(3'-карбокси-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 437)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с бензоатом этил-3-бороновой кислоты (51 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (26 мг, выход: 23%).
МС: 598,27 (М+H+); H1-ЯМР (ДМСО-d6): 8,31 (м, 2H), 8,20 (д, 1H, J=8,7), 8,11 (д, 1H, J=9), 8,03 (м, 1H), 7,93 (м, 1H), 7,74 (м, 2H), 7,49 (д, 1H, J=8,7), 7,31 (м, 3H), 7,19 (м, 3H), 4,40 (м, 1H), 3,89 (с, 3H), 3,55 (с, 1H), 2,29 (м, 2H), 2,04 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,31 (м, 3H).
Пример 177
Получение 1-циклогексил-2-[2-(4'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 455) и этил 1-циклогексил-2-[2-(4'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 554)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-фторфенилбороновой кислотой (37 мг, 0,2625 ммоль), в результате получали оба указанных в заголовке соединения (9 мг, выход: 8%), а также сложный эфир соединения 554.
Соединение 516: МС: 572,27 (М+H+); H1-ЯМР (ДМСО-d6): 8,36 (м, 2H), 8,30 (д, 1H, J=1,8), 8,24 (д, 1H, J=8,7), 8,17 (д, 1H, J=9), 8,07 (дд, 1H, J=8,7, 1,8), 7,98 (дд, 1H, J=8,7, 1,5), 7,45 (д, 1H, J=8,7), 7,31 (д, 1H, J=2,7), 7,13 (м, 6H), 4,41 (м, 1H), 3,87 (с, 3H), 3,55 (с, 1H), 2,33 (м, 2H), 2,06 (м, 2H), 1,84 (м, 2H), 1,62 (м, 1H), 1,32 (м, 3H).
Соединение 554: МС: 586,30 (М+H+); H1-ЯМР (ДМСО-d6): 8,35 (м, 3H), 8,25 (д, 1H, J=8,7), 8,16 (д, 1H, J=8,7), 8,06 (дд, 1H, J=8,7, 1,8), 7,97 (дд, 1H, J=8,4, 1,5), 7,45 (д, 1H, J=8,7), 7,31 (д, 1H, J=3), 7,14 (м, 6H), 4,41 (м, 1H), 3,90 (с, 3H), 3,87 (с, 3H), 3,55 (с, 1H), 2,29 (м, 2H), 2,05 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,34 (м, 3H).
Пример 178
Получение 1-циклогексил-2-[2-(4'-гидрокси-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 469)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-фенилбороновой кислотой (36 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (10 мг, выход: 8%).
МС: 570,27 (М+H+); H1-ЯМР (ДМСО-d6): 8,36 (м, 3H), 8,21 (д, 1H, J=9), 8,10 (дд, 1H, J=8,4,1,2), 8,00 (дд, 1H, J=8,7,1,5), 7,56 (м, 1H), 7,40 (д, 1H, J=8,7), 7,31 (д, 1H, J=2,7), 7,15 (м, 2H), 6,90 (д, 2H, J=8,7), 6,62 (д, 2H, J=8,4), 4,45 (м, 1H), 3,86 (с, 3H), 3,54 (с, 1H), 2,31 (м, 2H), 2,08 (м, 2H), 1,84 (м, 2H), 1,60 (м, 1H), 1,35 (м, 3H).
Пример 179
Получение 1-циклогексил-2-[2-(3',4'-дихлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 403)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 3,4-дихлорфенилбороновой кислотой (50 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (5 мг, выход: 4%).
МС: 622,20 (М+H+); H1-ЯМР (ДМСО-d6): 8,40 (д, 1H, J=9), 8,34 (м, 1H), 8,27 (м, 1H), 8,17 (д, 1H, J=8,4), 8,06 (м, 2H), 7,93 (м, 1H), 7,50 (д, 1H, J=8,4), 7,42 (м, 2H), 7,31 (м, 2H), 7,19 (дд, 1H, J=9, 2,7), 6,96 (дд, 1H, J=8,1, 1,2), 4,45 (м, 1H), 3,88 (с, 3H), 2,29 (м, 2H), 2,05 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,31 (м, 3H).
Пример 180
Получение 2-[2-(3'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 422)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 3-хлорфенилбороновой кислотой (41 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение ( 20 мг, выход: 17%).
МС: 588,23 (М+H+); H1-ЯМР (ДМСО-d6): 8,39 (м, 2H), 8,30 (д, 1H, J=1,8), 8,20 (м, 2H), 8,06 (дд, 1H, J=8,7, 1,8), 7,98 (дд, 1H, J=8,4, 1,5), 7,49 (д, 1H, J=7,5), 7,31 (д, 1H, J=2,7), 7,24 (м, 6H), 6,99 (м, 1H), 4,41 (м, 1H), 3,88 (с, 3H), 3,55 (с, 1H), 2,31 (м, 2H), 2,06 (м, 2H), 1,84 (м, 2H), 1,60 (м, 1H), 1,31 (м, 3H).
Пример 181
Получение 1-циклогексил-2-[2-(4-метокси-4'-метилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 438)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с п-толилбороновой кислотой (36 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (12 мг, выход: 12%).
МС: 568,30 (М+H+); H1-ЯМР (ДМСО-d6): 8,32 (м, 4H), 7,16 (д, 1H, J=9), 8,07 (дд, 1H, J=8,7, 2,1), 7,97 (дд, 1H, J=8,7, 1,8), 7,42 (д, 1H, J=8,7), 7,30 (д, 1H, J=2,7), 7,15 (м, 2H), 7,02 (м, 4H), 4,42 (м, 1H), 3,87 (с, 3H), 3,54 (с, 1H), 2,30 (м, 2H), 2,24 (с, 3H), 2,06 (м, 2H), 1,84 (м, 2H), 1,63 (м, 1H), 1,32 (м, 3H).
Пример 182
Получение 1-циклогексил-2-[2-(4-метокси-3'-метилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 367)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с м-толилбороновой кислотой (36 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (27 мг, выход: 27%).
МС: 568,29 (М+H+); H1-ЯМР (ДМСО-d6): 8,30 (м, 4H), 8,16 (д, 1H, J=8,7), 8,07 (дд, 1H, J=8,4, 1,8), 7,97 (дд, 1H, J=9, 1,8), 7,44 (д, 1H, J=8,4), 7,32 (д, 1H, J=2,7), 7,16 (м, 2H), 7,04 (м, 3H), 6,78 (д, 1H, J=7,2), 4,41 (м, 1H), 3,87 (с, 3H), 3,55 (с, 1H), 2,29 (м, 2H), 2,20 (с, 3H), 2,06 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,31 (м, 3H).
Пример 183
Получение 2-[2-(4'-аминометил-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 384)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-аминометилфенилбороновой кислотой (49 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (48 мг, выход: 46%).
МС: 583,31 (М+H+); H1-ЯМР (ДМСО-d6): 8,31 (м, 3H), 8,14 (д, 1H, J=8,7), 8,05 (дд, 1H, J=8,4, 1,8), 7,95 (дд, 1H, J=8,4, 1,2), 7,70 (м, 1H), 7,58 (м, 1H), 7,43 (д, 1H, J=8,4), 7,45 (д, 2H, J=8,4), 7,28 (д, 1H, J=2,4), 7,17 (м, 4H), 4,40 (м, 1H), 3,87 (с, 3H), 3,55 (с, 1H), 2,30 (м, 2H), 2,05 (м, 2H), 1,83 (м, 2H), 1,64 (м 1H), 1,33 (м, 3H).
Пример 184
Получение 1-циклогексил-2-[2-(4'-этокси-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 456)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-этоксифенилбороновой кислотой (44 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (17 мг, выход: 16%).
МС: 598,32 (М+H+); H1-ЯМР (ДМСО-d6): 8,35 (м, 4H), 8,23 (д, 1H, J=8,4), 8,12 (д, 1H, J=9), 8,02 (д, 1H, J=8,7), 7,42 (д, 1H, J=8,7), 7,32 (м, 1H), 7,16 (м, 2H), 7,02 (д, 2H, J=8,7), 6,78 (м, 2H), 4,43 (м, 1H), 3,94 (м, 2H), 3,86 (с, 3H), 3,54 (с, 1H), 2,32 (м, 2H), 2,08 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,34 (м, 3H), 1,27 (м, 3H).
Пример 185
Получение 1-циклогексил-2-[2-(5-метокси-2-тиофен-2-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 470)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 2-тиофенбороновой кислотой (34 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (26 мг, выход: 27%).
МС: 598,32 (М+H+); H1-ЯМР (ДМСО-d6): 8,48 (м, 2H), 8,34 (м, 2H), 8,27 (д, 1H, J=8,7), 8,12 (д, 1H, J=8,7), 8,04 (д, 1H, J=9), 7,56 (д, 1H, J=8,4), 7,40 (м, 2H), 7,30 (д, 1H, J=2,7), 7,17 (дд, 1H, J=8,4, 2,7), 6,91 (м, 1H), 6,77 (д, 1H, 2,7), 4,46 (м, 1H), 3,86 (с, 3H), 3,55 (с, 1H), 2,31 (м, 2H), 2,11 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,33 (м, 3H).
Пример 186
Получение 1-циклогексил-2-{2-[2-(2,4-диметоксипиримидин-5-ил)-5-метоксифенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 484)
По методике получения соединения 366 и последующей его обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 2,4-диметоксипиримидин-5-бороновой кислотой (34 мг, 0,2625 ммоль), в результате получали указанное в заголовке соединение (8 мг, выход: 7%).
МС: 616,30 (М+H+); H1-ЯМР (ДМСО-d6): 8,55 (д, 1H, J=9), 8,43 (с, 1H), 8,32 (д, 1H, J=0,9), 8,21 (д, 1H, J=8,7), 8,16 (с, 1H), 8,09 (м, 2H), 8,00 (м, 1H), 7,56 (д, 1H, J=8,7), 7,39 (м, 2H), 7,18 (дд, 1H, J=8,7, 2,7), 4,40 (м, 1H), 3,87 (м, 6H), 3,55 (с, 1H), 3,84 (с, 3H), 2,30 (м, 2H), 2,10 (м, 2H), 1,84 (м, 2H), 1,60 (м, 1H), 1,32 (м, 3H).
Пример 187
Получение 2-[2-(2-бромфенил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты (соединение 477)
Стадия 1: 6-Гидрокси-5-нитроникотиновая кислота (соединение 477а)
Раствор 6-гидроксиникотиновой кислоты (10 г, 71,89 ммоль) в дымящей азотной кислоте (100 мл) перемешивали при 50ºС в течение 4-х часов. После выпаривания азотной экстракислоты получали твердое вещество, которое непосредственно использовали на следующей стадии реакции. МС: 185,02 (М+Н+).
Стадия 2: Сложный эфир этил 6-хлор-5-нитроникотиновой кислоты (соединение 477b)
Смесь 6-гидрокси-5-нитроникотиновой кислоты (соединение 477а) (1,5 г, 8,15 ммоль), пентахлорида фосфора (3 г) и фосфорилхлорида (5 мл) перемешивали при 100ºС в течение 2-х часов. Избыток фосфорилхлорида удаляли при пониженном давлении и к остатку при 0ºС добавляли безводный EtOH (2 мл). Добавляли воду (50 мл). Смесь экстрагировали EtOAc. Объединенную органическую фазу промывали водой, сушили над безводным Na2SO4 и выпаривали с получением указанного в заголовке промежуточного продукта (1,24 г, 66%). МС: 230,03 (М+Н+).
Стадия 3: Сложный этиловый эфир 6-циклогексиламино-5-нитроникотиновой кислоты (соединение 477с)
Смесь сложного этилового эфира 6-хлор-5-нитроникотиновой кислоты (соединение 477b) (0,83 г, 3,60 ммоль), DIEA (0,32 мл, 18,0 ммоль) и циклогексиламина (1,25 мл, 10,93 ммоль) в MeCN (15 мл) перемешивали при кипячении с обратным холодильником в атмосфере аргона в течение ночи. После удаления растворителя остаток очищали хроматографией с использованием в качестве элюента смеси CHCl3-гексан (2:1) с получением указанного в заголовке промежуточного продукта (1,0 г, 95%). МС: 294,13 (М+Н+).
Стадия 4: Сложный этиловый эфир 2-[2-(2-бромфенил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты (соединение 477d)
(1) Смесь соединения 477с (0,18 г, 0,614 ммоль) и 5% Pd/C (20 мг) в МеОН встряхивали при давлении H2 40 фунт/дюйм2 в течение 30 минут. Смесь фильтровали через целит и промывали МеОН и ДМФА. Объединенный фильтрат выпаривали досуха с получением амина.
(2) Смесь соединения 353а (0,217 г, 0,661 ммоль), HBTU (0,26 г, 0,686 ммоль) и DIEA (0,267 мл, 1,53 ммоль) в ДМФА (10 мл) перемешивали при комнатной температуре в течение 30 мин и затем переносили в вышеуказанный амин. Полученную реакционную смесь перемешивали при комнатной температуре в течение 6 часов и выпаривали досуха.
(3) К полученному остатку добавляли АсОН (8 мл) и раствор перемешивали при кипячении с обратным холодильником в течение 2-х часов. После удаления растворителя выпариванием остаток очищали хроматографией с использованием в качестве элюентов смеси CHCl3-гексан (10:1) и смеси CHCl3-МеОН (100:1) с получением указанного в заголовке промежуточного продукта. Общий выход 69%. МС: 557,17 (М+Н+).
Стадия 5: 2-[2-(2-Бромфенил)хинолин-6-ил]-3-циклогексил-3Н-имидазо [4,5-b]пиридин-6-карбоновая кислота (соединение 477)
Соединение 477d (0,139 г, 0,25 ммоль) растворяли в МеОН (3 мл) и добавляли 2н. водный раствор NaOH (1,5 мл). Смесь перемешивали при 55 С в течение 2-х часов и затем нейтрализовали при 0 С 5н. HCl до рН 3. Образованный осадок собирали фильтрацией и очищали ОФ-ВЭЖХ (от 15% буфера В до 95% буфера В) с получением указанного в заголовке соединения. Выход: 96%.
МС: 527,17, 529,17 (М+H+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,97 (д, 1H, J=2,1 Гц), 8,67 (д, 1H, J=8,1 Гц), 8,55 (д, 1H, J=1,5 Гц), 8,46 (д, 1H, J=1,5 Гц), 8,26 (д, 1H, J=8,7 Гц), 8,10 (дд, 1H, J=1,8, 8,7 Гц), 7,87 (д, 1H, J=8,4 Гц), 7,81 (дд, 1H, J=1,2, 8,1 Гц), 7,66 (д, 1H, J=2,1, 7,5 Гц), 7,57 (дт, 1H, J=1,2, 7,5 Гц), 7,45 (дт, 1H, J=1,2, 7,7 Гц), 4,42 (м, 1H), 2,72-2,68 (м, 2H), 2,07-2,00 (м, 2H), 1,83 (м, 5H), 1,65 (м, 1Н), 1,30 (м, 4H).
Пример 188
Получение 2-[2-(4'-хлорбифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо [4,5-b]пиридин-6-карбоновой кислоты (соединение 490)
Смесь соединения 477d (0,139 г, 0,25 ммоль), 4-хлорбензолбороновой кислоты (78 мг, 0,50 ммоль) и Pd(PPh3)4 (20 мг) в толуоле (8 мл), МеОН (2 мл) и насыщенного раствора NaHCO3 (0,8 мл) перемешивали в атмосфере аргона при 70ºС в течение 16 часов. После выпаривания растворителя остаток растворяли в CHCl3 (30 мл) и фильтровали. Фильтрат выпаривали досуха. МС: 587,25 (М+Н+).
Остаток гидролизовали 2н. водным раствором NaOH в МеОН по методике получения соединения 477. В результате очистки ОФ-ВЭЖХ (от 15% буфера В до 95% буфера В) получали указанное в заголовке соединение (0,116 г, 83%).
МС: 559,22 (М+H+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,97 (д, 1H, J=1,8 Гц), 8,54 (д, 1H, J=2,1 Гц), 8,43 (д, 1H, J=8,4 Гц), 8,39 (д, 1H, J=1,8 Гц), 8,25 (д, 1H, J=8,7 Гц), 8,11 (дд, 1H, J=1,8, 9,0 Гц), 7,81 (дд, 1H, J=2,1, 6,9 Гц), 7,65-7,60 (м, 2H), 7,54 (дд, 1H, J=2,4, 6,6 Гц), 7,33 (д, 2H, J=8,4 Гц), 7,24 (д, 1H, J=8,4 Гц), 7,19 (д, 2H, J=8,4 Гц), 4,40 (м, 1H), 2,72-2,67 (м, 2H), 2,03-1,99 (м, 2H), 1,83 (м, 5H), 1,65 (м, 1H), 1,29 (м, 4H).
Пример 189
Получение (4'-хлор-2-{6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]хинолин-2-ил}бифен-4-ил)пирролидин-1-илметанона (соединение 259)
Стадия 1: 1-[4'-Хлор-4-(пирролидин-1-карбонил)бифен-2-ил]этанон (соединение 259а)
Смесь соединения 419с (0,29 г, 0,845 ммоль), 4-хлорбензолбороновой кислоты (0,159 мг, 1,02 ммоль) и Pd(PPh3)4 (97 мг) в толуоле (25 мл), МеОН (6 мл) и насыщенного раствора NaHCO3 (2,5 мл) перемешивали в атмосфере аргона при 70ºС в течение 16 часов. После выпаривания растворителя остаток растворяли в CHCl3 (30 мл) и фильтровали. Фильтрат выпаривали досуха. Остаток очищали хроматографией с использованием в качестве элюента смеси CHCl3-МеОН (от 80:1 до 30:1) с получением масла (0,266 г, 96%). МС: 328,08 (М+Н+).
Стадия 2: 2-[4'-Хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-карбоновая кислота (соединение 259е)
К смеси соединения 259а (0,388 г, 1,184 ммоль) и соединения 7 (0,223 г, 1,243 ммоль) добавляли раствор КОН (0,234 г, 3,55 ммоль) в EtOH (18 мл). Реакционную смесь перемешивали в атмосфере аргона при 75ºС в течение 16 часов. Для приготовления чистого раствора добавляли EtOH (10 мл) и раствор нейтрализовали добавлением 4н. HCl в диоксане (примерно 1 мл) до рН 3. После выпаривания растворителя добавляли H2O (15 мл) и осадки собирали фильтрацией, промывали водой и сушили. Выход: 0,125 г, 89%. МС: 457,12, 458,13 (М+Н+).
Стадия 3: (4'-хлор-2-{6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]хинолин-2-ил}бифен-4-ил)пирролидин-1-илметанон (соединение 259)
Соединение 128 (91 мг, 0,316 ммоль) восстанавливали гидрированием в соответствующий амин по методикам, использованным при получении соединения 477d.
Амин подвергали взаимодействию с соединением 259е (0,125 г, 0,274 ммоль) в присутствии HBTU (0,114 г, 0,30 ммоль), после чего осуществляли циклизацию в АсОН по методикам, описанным для получения соединения 477d. В результате разделения ОФ-ВЭЖХ (от 10% буфера В до 85% буфера В) получали указанное в заголовке соединение (42 мг, 23%).
МС: 679,30 (М+H+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,45 (д, 1H, J=1,2 Гц), 8,40-8,37 (м, 2H), 8,29 (д, 1H, J=8,7 Гц), 8,24 (д, 1H, J=9,0 Гц), 8,10-8,06 (м, 2H), 7,92 (д, 1H, J=1,8 Гц), 7,76 (дд, 1H, J=1,8, 8,1 Гц), 7,59 (д, 1H, J=7,8 Гц), 7,35 (д, 2H, J=8,4 Гц), 7,24-7,20 (м, 3H), 4,44 (м, 1H), 3,55-3,49 (м, 4H), 2,43-2,2,28 (м, 2H), 2,09-2,06 (м, 2H), 1,92-1,85 (м, 5H), 1,68-1,62 (м, 1H), 1,45-1,29 (м, 4H).
Пример 190
Получение 2-{2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты (соединение 539)
Соединение 477 с (0,104 г, 0,355 ммоль) гидрировали на 5% Pd/C (11 мг) по методике (1), использованной при получении соединения 477d.
Затем амин подвергали взаимодействию с соединением 259е (0,13 г, 0,284 ммоль) в присутствии HBTU (0,135 г, 0,356 ммоль), после чего осуществляли циклизацию в АсОН и очистку, по методикам (2) и (3), использованным при получении соединения 477d, в результате получали предшественник соединения 539 - сложный эфир.
В результате гидролиза сложного эфира смесью 2н. водный раствор NaOH/MeOH в кислоту и очистки ВЭЖХ получали указанное в заголовке соединение (23 мг, 13%).
МС: 656,30 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,96 (д, 1H, J=1,8 Гц), 8,53 (д, 1H, J=2,1 Гц), 8,37-8,34 (м, включая д, 2H, J=8,1 Гц), 8,20 (д, 1H, J=8,7 Гц), 8,06 (дд, 1H, J=1,8, 8,4 Гц), 7,90 (д, 1H, J=1,8 Гц), 7,75 (дд, 1H, J=1,8, 7,8 Гц), 7,58 (д, 1H, J=7,5 Гц), 7,36 (д, 2H, J=8,4 Гц), 7,22-7,18 (м, 3H), 4,40 (м, 1H), 3,51-3,41 (м, 4H), 2,72-2,68 (м, 2H), 2,02-1,98 (м, 2H), 1,87 (м, 5H), 1,65 (м, 1H), 1,29-1,23 (м, 4H).
Пример 191
Получение {4'-хлор-2-[6-(1-циклогексил-1Н-бензоимидазол-2-ил)хинолин-2-ил]бифенил-4-ил}пирролидин-1-илметанона (соединение 540)
Соединение 259е (50 мг, 0,109 ммоль) подвергали взаимодействию с HBTU (62 мг, 0,163 ммоль) в ДМФА (1,5 мл) в присутствии DIEA (38 мкл, 0,219 ммоль) при комнатной температуре в течение 30 мин. Добавляли N-циклогексилбензол-1,2-диамин (31,2 мг, 0,164 ммоль) (полученный в соответствии с методикой для соединения 11, причем в качестве исходного продукта вместо 4-хлор-3-нитробензойной кислоты использовали 2-хлорнитробензол) и смесь перемешивали при комнатной температуре в течение 16 часов. После выпаривания растворителя к остатку добавляли AcOH (5 мл) и смесь кипятили при перемешивании с обратным холодильником в течение 2-х часов. Выпаривали растворитель и остаток разделяли ОФ-ВЭЖХ (с использованием от 10% буфера В до 85% буфера В) с получением указанного в заголовке соединения (26 мг, 39%).
МС: 611,28 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,47(с, 1H), 8,40 (д, 1H, J=8,7 Гц), 8,31-8,28 (м, включая д, 2H, J=8,7 Гц), 8,12 (д, 1H, J=8,4 Гц), 7,92-7,89 (м, 2H), 7,77 (дд, 1H, J=1,5, 8,1 Гц), 7,65-7,58 (м, 3H), 7,36 (д, 2H, J=8,1 Гц), 7,27 (д, 1H, J=8,1 Гц), 7,21 (д, 2H, J=8,7 Гц), 4,47 (м, 1H), 3,55-3,49 (м, 4H), 2,37-2,29 (м, 2H), 2,15-2,12 (м, 2H), 1,92-1,83 (м, 5H), 1,68-1,61 (м, 1H), 1,46-1,23 (м, 4H).
Пример 192
Получение 2-(4'-хлор-4-метоксибифен-2-ил)-6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол]-2-ил]хинолин (соединение 525)
Стадия 1: 1-(4'-Хлор-4-метоксибифен-2-ил)этанон (соединение 525а)
1-(2-Бром-5-метоксифенил)этанон (полученный в соответствии с методикой примера 166, стадия 1) (12 г, 52,39 ммоль) подвергали взаимодействию с 4-хлорбензолбороновой кислотой (9,02 г, 57,68 ммоль) и катализатором Pd(PPh3)4 (0,605 г) по методике получения соединения 477е. В результате очистки хроматографией с использованием в качестве элюента смеси CHCl3-MeOH (80:1) получали указанный в заголовке промежуточный продукт (12,67 г, 93%). МС: 261,08 (М+Н+), 283,07 (М+Na+).
Стадия 2: 2-(4'-Хлор-4-метоксибифен-2-ил)хинолин-6-карбоновая кислота (соединение 525с)
Соединение 7 (3,06 г, 11,72 ммоль) подвергали взаимодействию с соединением 525а (2,1 г, 11,72 ммоль) и КОН (2,32 г, 35,16 ммоль) в EtOH (150 мл) по методике получения соединения 259е. В результате очистки хроматографией с использованием в качестве элюента CHCl3-MeOH (7:1) получали указанный в заголовке промежуточный продукт (3,1 г, 91%). МС: 388,07 (М+Н+).
Стадия 3: Получение 2-(4'-хлор-4-метоксибифен-2-ил)-6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол]-2-ил]хинолина (соединение 525)
Соединение 128 (98 мг, 0,34 ммоль) восстанавливали в соответствующий амин гидрированием по методике (1), использованной для получения соединения 477d.
Амин подвергали взаимодействию с соединением 525с (0,11 г, 0,34 ммоль) в присутствии HBTU (0,135 г, 0,356 ммоль), после чего проводили циклизацию в АсОН по методике (2), использованной для получения соединения 477d. В результате разделения ОФ-ВЭЖХ (с использованием от 20% буфера В до 99% буфера В) получали указанное в заголовке соединение (51 мг, 25%).
МС: 612,26 (М+Н+), 1H ЯМР (ДМСО-d6): δ (м.д.) 8,54 (д, 1H, J=1,6 Гц), 8,44-8,37 (м, 3H), 8,29 (д, 1H, J=8,7 Гц), 8,19 (д, 1H, J=9,0 Гц), 8,12 (д, 1H, J=8,7 Гц), 7,48-7,42 (м, 2H), 7,33-7,19 (м, 5H), 7,12 (д, 1H, J=8,4 Гц), 4,46 (м, 1H), 3,88 (с, 1H), 2,38-2,34 (м, 2H), 2,13-2,09 (м, 2H), 1,88-1,84 (м, 2H), 1,62 (м, 1H), 1,47-1,30 (м, 3H).
Пример 193
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты (соединение 537)
Стадия 1: Сложный этиловый эфир 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты (соединение 537a)
Соединение 477с (0,225 г, 0,767 ммоль) восстанавливали в соответствующий амин гидрированием по методике (1), использованной для получения соединения 477d.
Амин подвергали взаимодействию с соединением 525с (0,314 г, 0,805 ммоль) в присутствии HBTU (0,32 г, 0,844 ммоль) и DIEA (0,47 мл, 2,68 ммоль) в ДМФА (10 мл), после чего проводили циклизацию в АсОН (10 мл) по методике (2) и (3), использованным для получения соединения 477d. После разделения ОФ-ВЭЖХ (с использованием от 20% буфера В до 99% буфера В) получали указанный в заголовке промежуточный продукт (0,19 г, 40%).
Стадия 2: 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновая кислота (соединение 537)
Гидролиз продукта от предыдущей реакции (63 мг, 0,102 ммоль) смесью 2н. водный раствор NaOH/MeOH и очистку ВЭЖХ осуществляли по методикам получения соединения 477, в результате получали указанное в заголовке соединение (31 мг, 52%).
МС: 589,24 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,96 (д, 1H, J=1,8 Гц), 8,53 (д, 1H, J=2,1 Гц), 8,36-8,33 (м, 2H), 8,20 (д, 1H, J=8,4 Гц), 8,06 (дд, 1H, J=1,8, 9,0 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,31-7,28 (м, 3H), 7,20-7,11 (м, 4H), 4,44-4,36 (м, 1H), 3,88 (с, 3H), 2,72-2,67 (м, 2H), 2,01-1,97 (м, 2H), 1,82 (м, 2H), 1,65 (м, 1H), 1,29-1,22 (м, 3H).
Пример 194
Получение 2-[2-(4'-хлор-4-гидроксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты (соединение 535) и сложного этилового эфира 2-[2-(4'-хлор-4-гидроксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты (соединение 538)
Соединение 537а (71,8 мг) растворяли в безводном CH2Cl2 (8 мл) и при -70ºС добавляли по каплям 1,0М BBr3 в CH2Cl2 (4 мл). Смесь перемешивали при -70ºС в течение 1 часа и при комнатной температуре в течение ночи. Смесь опять охлаждали до -70ºС и добавляли по каплям МеОН (2 мл). К смеси при комнатной температуре добавляли 2н. водный раствор NaOH (1,0 мл) и нейтрализовали 5н. HCl до рН 3. После выпаривания растворителя сухой остаток растворяли в МеОН (10 мл) и отфильтровывали нерастворимые осадки. Фильтрат выпаривали досуха. В результате разделения ОФ-ВЭЖХ (с использованием от 20% буфера В до 99% буфера В) получали указанные в заголовке соединения.
Соединение 535: (25,8 мг) МС: 575,22 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 9,88 (ушир.с, 1H), 8,96 (д, 1H, J=1,8 Гц), 8,53 (д, 1H, J=1,8 Гц), 8,33-8,30 (м, 2H), 8,20 (д, 1H, J=9,0 Гц), 8,06 (дд, 1H, J=2,1, 9,0 Гц), 7,33 (д, 1H, J=8,1 Гц), 7,29-7,25 (м, 2H), 7,19 (д, 1H, J=2,4 Гц), 7,13-7,08 (м, 3H), 6,99 (дд, 1H, J=2,7, 8,4 Гц), 4,41 (м, 1H), 3,88 (с, 3H), 2,72-2,68 (м, 2H), 2,01-1,98 (м, 2H), 1,83 (м, 2H), 1,66 (м, 1Н), 1,30 (м, 3H).
Соединение 538: (10,6 мг): МС: 603,25 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,98 (д, 1H, J=1,8 Гц), 8,55 (д, 1H, J=2,1 Гц), 8,33-8,30 (м, 2H), 8,20 (д, 1H, J=8,7 Гц), 8,06 (дд, 1H, J=1,8, 8,7 Гц), 7,32 (д, 1H, J=8,1 Гц), 7,30-7,25 (м, 3H), 7,19 (д, 1H, J=2,4 Гц), 7,13-7,08 (м, 3H), 6,99 (дд, 1H, J=2,4, 8,4 Гц), 4,42-4,34 (м, 3H), 2,12-2,61 (м, 2H), 2,02-1,98 (м, 2H), 1,83 (м, 2H), 1,67 (м, 1H), 1,37 (т, 3H, J=7,2 Гц), 1,29-1,23 (м, 3H).
Пример 195
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-бензоимидазол-5-карбоновой кислоты (соединение 571)
Стадия 1: 3-Циклогексиламино-4-нитробензойная кислота (соединение 571а)
Смесь 3-фтор-4-нитробензойной кислоты (0,35 г, 1,891 ммоль) и циклогексиламина (2,17 мл, 18,91 ммоль) в НМП (10 мл) перемешивали при 85ºС в атмосфере аргона в течение 6 час. Выпаривали растворитель в высоком вакууме. Остаток очищали хроматографией с использованием в качестве элюента смеси CH3Cl-MeOH (10:1) с получением указанного в заголовке промежуточного продукта с количественным выходом. МС: 263,11 (М-Н+).
Стадия 2: Сложный этиловый эфир 3-циклогексиламино-4-нитробензойной кислоты (соединение 571b)
Раствор продукта с предыдущей стадии (0,4 г) в безводном EtOH (50 мл) медленно барботировали безводным HCl газом в течение 4-х часов и раствор оставляли при комнатной температуре в течение 16 час. Растворитель выпаривали досуха, при этом получали указанный в заголовке промежуточный продукт с количественным выходом. МС: 293,14 (М+Н+).
Стадия 3: 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-бензоимидазол-5-карбоновая кислота (соединение 571)
Продукт с предыдущей стадии (0,14 г, 0,479 ммоль) восстанавливали в соответствующий амин гидрированием по методике получения соединения 477d.
Амин подвергали взаимодействию с соединением 525с (0,215 г, 0,552 ммоль) в присутствии HBTU (0,22 г, 0,58 ммоль) и DIEA 0,17 мл, 0,976 ммоль) в ДМФА (10 мл), после чего проводили циклизацию в АсОН (10 мл) по методикам (2) и (3), использованным для получения соединения 477d.
Осуществляли гидролиз вышеуказанного сложного эфира смесью 2н. водный раствор NaOH/MeOH и очистку ВЭЖХ, по методикам получения соединения 477, в результате получали указанное в заголовке соединение (43,2 мг, 15%).
МС: 588,24 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,48 (с, 1H), 8,42-8,38 (м, 2H), 8,27 (д, 1H, J=9,0 Гц), 8,10 (дд, 1H, J=1,8, 9,0 Гц), 8,03 (дд, 1H, J=1,5, 8,7 Гц), 7,89 (д, 1H, J=8,7 Гц), 7,46 (д, 1H, J=8,7 Гц), 7,32 (д, 1H, J=2,7 Гц), 7,29 (д, 2H, J=8,7 Гц), 7,25-7,19 (м, 2H), 7,13 (д, 2H, J=8,7 Гц), 4,52-4,45 (м, 1H), 3,87 (с, 3H), 2,27-2,12 (м, 4H), 1,86 (ушир.с, 2H), 1,67 (ушир.с, 1H), 1,34 (ушир., 3H).
Пример 196
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-этил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 534)
Стадия 1: Нагрузка смолы 4-хлор-3-нитробензойной кислотой (смола 534а)
К раствору 4-хлор-3-нитробензойной кислоты (0,605 г, 3 ммоль) в этаноле (15 мл) и воде (5 мл) добавляли по каплям 10% водный раствор Cs2CO3 для доведения рН раствора до 7,0. Образовавшуюся смесь выпаривали досуха и четыре раза выпаривали совместно с толуолом (20 мл). Затем остаток сушили над P2O5 в высоком вакууме.
Смесь смолы Merrifield HL (Nova Biochem, 100-200 меш, загрузка: 1,34 ммоль/г, 1,04 г) в безводном ДМФА (8 мл) и полученной, как указано выше, сухой соли цезия спокойно перемешивалась при 50ºС в течение ночи. Раствор сливали и смолу промывали ДМФА (5 мл×5), смесью ДМФА/Н2О (9:1, об./об., 5 мл×5), ДМФА (5 мл×5) и МеОН (5 мл×5). Смолу сушили в высоком вакууме. На основе привеса смолы рассчитывали загрузку, полученную в результате замещения, которая составляла 1,30 ммоль/г.
Стадия 2: Добавление амина
Смесь смолы 534а (0,308 г, 0,40 ммоль), 2,0М раствора этиламина в МеОН (3,9 мл, 7,8 ммоль) и DIEA (0,82 мл, 4,68 ммоль) в НМП (10 мл) встряхивали при комнатной температуре в течение 16 часов. Раствор сливали и смолу промывали ДМФА (5 мл×5), МеОН (5 мл×5) и CH2Cl2 (5 мл×5). Смолу сушили в высоком вакууме.
Стадия 3: Восстановление нитрогруппы
Затем смолу суспендировали в ДМФА (10 мл) и добавляли SnCl2·2H2O (5,42 г, 24 ммоль). Смесь встряхивали в атмосфере аргона при комнатной температуре в течение 32 часов. Раствор сливали и смолу промывали ДМФА (5 мл×5), МеОН (5 мл×5) и CH2Cl2 (5 мл×5). Смолу сушили в высоком вакууме.
Стадия 4: Образование бензоимидазольного кольца
Соединение 525с (0,38 г, 0,97 ммоль) подвергали взаимодействию с HBTU (0,444 г, 1,2 ммоль) в безводном ДМФА (5 мл) в присутствии DIEA (0,41 мл, 2,35 ммоль) в течение 30 мин. Затем смесь переносили в суспензию амин-смола в ДМФА (5 мл). Реакционную смесь встряхивали при комнатной температуре в течение ночи. Раствор сливали и смолу промывали ДМФА (5 мл×5), МеОн (5 мл×5) и CH2Cl2 (5 мл×5). Смолу сушили в высоком вакууме.
Стадия 5: Отщепление смолы
К смоле добавляли АсОН (10 мл) и смесь кипятили с обратным холодильником в течение 3-х часов. После выпаривания АсОН к сухой смоле добавляли ТФУ (3 мл) и TFMSA (0,3 мл). Смесь оставляли при комнатной температуре в течение 2-х часов. Смолу отфильтровывали и промывали ТФУ (3 мл×3) и МеОН (3 мл×2). Фильтрат выпаривали и остаток нейтрализовали раствором соли аммония. Продукт очищали ВЭЖХ с обращенной фазой с использованием от 20% буфера В до 99% буфера А.
МС: 534,16 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,50 (с, 1H), 8,42-8,34 (м, включая д, 2H, J=8,4 Гц), 8,29-8,20 (м, включая д, 2H, J=8,4 Гц), 8,08 (д, 1H, J=8,4 Гц), 8,02 (д, 1H, J=9,0 Гц), 7,46 (д, 1H, J=8,0 Гц), 7,33-7,07 (м, 7H), 4,53 (кв, 2H, J=6,9 Гц), 3,88 (с, 3H), 1,45 (т, 3H, J=5,7 Гц).
Пример 197
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклопропил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 528)
Указанное в заголовке соединение получали из смолы 534а и циклопропиламина по методике, использованной для получения соединения 534.
МС: 546,16 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,70 (с, 1H), 8,46-8,39 (м, 2H), 8,31 (с, 1H), 8,23 (д, 1H, J=9,0 Гц), 8,05 (д, 1H, J=8,4 Гц), 7,90 (д, 1H, J=2,1, 8,7 Гц), 7,48-7,42 (м, 2H), 7,35-7,28 (м, 2H), 7,25-7,07 (м, 4H), 4,12 (м, 1H), 3,88 (с, 3H), 1,19 (д, 2H, J=6,6 Гц), 0,76 (ушир.с, 2H).
Пример 198
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-изопропил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 527)
Указанное в заголовке соединение получали из смолы 534а и изопропиламина по методике, использованной для получения соединения 534.
МС: 548,19 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,38 (с, 1H), 8,36 (д, 1H, J=7,0 Гц), 8,32 (д, 1H, J=1,5 Гц), 8,24 (д, 1H, J=8,7 Гц), 8,14 (д, 1H, J=9,0 Гц), 8,09 (дд, 1H, J=2,1, 8,7 Гц), 7,99 (дд, 1H, J=1,5, 8,7 Гц), 7,46 (д, 1H, J =8,7 Гц), 7,32-7,27 (м, 3H), 7,22-7,18 (м, 2H), 7,14-7,11 (м, 2H), 4,89 (т, 1H, J=7,2 Гц), 3,88 (с, 3H), 1,69 (д, 6H, J=7,2 Гц).
Пример 199
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(2-диметиламиноэтил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 533)
Указанное в заголовке соединение получали из смолы 534а и N,N-диметилэтиленамина по методике, использованной для получения соединения 534.
МС: 577,22 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 10,77 (ушир.с, 1H), 8,47 (с, 1H), 8,42 (д, 1H, J=8,7 Гц), 8,32 (д, 1H, J=0,9 Гц), 8,26-8,21 (м, 2H), 8,00 (с, 2H), 7,45 (д, 2H, J=8,4 Гц), 7,32-7,26 (м, 2H), 7,22-7,17 (м, 2H), 7,14-7,11 (м, 2H), 4,88 (т, 2H, J=7,8 Гц), 3,88 (с, 3H), 3,83 (с, 6H), 3,61 (м, 2H).
Пример 200
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклопентил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 529)
Указанное в заголовке соединение получали из смолы 534а и циклопентиламина по методике, использованной для получения соединения 534.
МС: 574,21 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,39 (д, 1H, J=8,7 Гц), 8,38 (с, 1H), 8,32 (д, 1H, J=1,5 Гц), 8,24 (д, 1H, J=8,7 Гц), 8,10 (дд, 1H, J=2,1, 8,8 Гц), 8,00 (дд, 1H, J=1,5, 8,7 Гц), 7,90 (д, 1H, J=8,4 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,31-7,28 (м, 3H), 7,23-7,18 (м, 2H), 7,15-7,11 (м, 2H), 5,03 (кв, 1H, J=9,3 Гц), 3,88 (с, 3H), 2,23 (м, 4H), 2,02 (м, 2H), 1,72-1,69 (м, 2H).
Пример 201
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-изобутил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 530)
Указанное в заголовке соединение получали из смолы 534а и изобутиламина по методике, использованной для получения соединения 534.
МС: 562,22 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,51 (с, 1H), 8,35 (д, 1H, J=9,0 Гц), 8,32 (с, 1H), 8,22 (ушир.с, 2H), 8,03-7,95 (м, 2H), 7,45 (д, 1H, J=8,4 Гц), 7,34 (д, 1H, J=2,7 Гц), 7,29 (д, 2H, J=8,7 Гц), 7,20 (д, 1H, J=8,4 Гц), 7,18 (д, 1H, J=8,4 Гц), 7,12 (д, 2H, J=8,7 Гц), 4,41 (д, 2H, J=7,8 Гц), 3,88 (с, 3H), 1,98-1,93 (м, 1H), 0,68 (д, 6H, J=6,9 Гц).
Пример 202
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(3-метилбутил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 532)
Указанное в заголовке соединение получали из смолы 534а и изоамиламина по методике, использованной для получения соединения 534.
МС: 576,24 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,49 (с, 1H), 8,37 (д, 1H, J=8,7 Гц), 8,32 (д, 1H, J=1,2 Гц), 8,25-8,17 (м, 2H), 8,03 (дд, 1H, J=1,3, 8,4 Гц), 7,94 (д, 1H, J=8,7 Гц), 7,46 (д, 1H, J=8,7 Гц), 7,33 (д, 1H, J=2,7 Гц), 7,28-7,18 (м, включая д, 4H, J=8,4 Гц), 7,10 (д, 2H, J=8,4 Гц), 4,49 (т, 2H, J=7,2 Гц), 3,88 (с, 3H), 1,71-1,64 (м, 2H), 1,55-1,46 (м, 1H), 0,78 (д, 6H, J=6,6 Гц).
Пример 203
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(1-этилпропил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 564)
Указанное в заголовке соединение получали из смолы 534а и 1-этилпропиламина по методике, использованной для получения соединения 534.
МС: 576,25 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,39 (д, 1H, J=8,4 Гц), 8,35-8,32 (м, 2H), 8,27 (д, 1H, J=8,7 Гц), 8,09-8,02 (м, 2H), 7,98 (д, 1H, J=9,0 Гц), 7,46 (д, 1H, J=8,7 Гц), 7,33 (д, 1H, J=3,0 Гц), 7,30 (д, 2H, J=8,4 Гц), 7,22-7,18 (м, включая д, 2H, J=8,7 Гц), 7,13 (д, 2H, J=8,4 Гц), 4,35-4,30 (м, 1H), 3,88 (с, 3H), 2,25-2,15 (м, 2H), 2,05-1,96 (м, 2H), 0,70 (т, 6H, J=7,2 Гц).
Пример 204
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклопропилметил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 531)
Указанное в заголовке соединение получали из смолы 534а и циклопропилметиламина по методике, использованной для получения соединения 534.
МС: 560,21 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,29 (с, 1H), 8,13 (д, 1H, J=8,4 Гц), 8,11 (д, 1H, J=1,2 Гц), 8,01 (м, 2H), 7,81-7,73 (м, 2H), 7,25 (д, 1H, J=8,4 Гц), 7,46 (д, 1H, J=8,7 Гц), 7,33 (д, 1H, J=2,7 Гц), 7,09 (д, 2H, J=8,7 Гц), 7,00 (д, 1H, J=8,4 Гц), 6,98 (д, 1H, J =8,4 Гц), 6,92 (д, 2H, J=8,7 Гц), 4,23 (д, 2H, J=6,9 Гц), 3,88 (с, 3H), 0,89 (м, 1H), 0,23-0,169 (м, 2H), 0,03-0,02 (м, 2H).
Пример 205
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(тетрагидрофуран-2-ил-метил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 566)
Указанное в заголовке соединение получали из смолы 534а и тетрагидрофурфуриламина по методике, использованной для получения соединения 534.
МС: 590,22 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,49 (с, 1H), 8,31 (д, 1H, J=9,0 Гц), 8,29 (с, 1H), 8,22-8,15 (м, 2H), 7,97-7,89 (м, 2H), 7,45 (д, 1H, J=8,4 Гц), 7,31 (д, 1H, J=2,4 Гц), 7,28 (д, 2H, J=8,4 Гц), 7,19 (д, 1H, J=8,4 Гц), 7,17 (д, 1H, J=8,4 Гц), 7,11 (д, 2H, J=8,4 Гц), 4,61-4,42 (м, 2H), 4,22-4,18 (м, 1H), 3,88 (с, 3H), 1,99-1,90 (м, 2H), 1,77-1,1,67 (м, 2H), 1,58-1,49 (м, 2H).
Пример 206
Получение 1-бицикло[2.2.1]гепт-2-ил-2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 568)
Указанное в заголовке соединение получали из смолы 534а и 2-аминонорборнана по методике, использованной для получения соединения 534.
МС: 600,22 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,39 (д, 1H, J=1,8 Гц), 8,34 (д, 1H, J=8,7 Гц), 8,29 (с, 1H), 8,20 (д, 1H, J=8,7 Гц), 8,12 (дд, 1H, J=1,8, 8,7 Гц), 8,00 (ушир. с, 2H), 7,46 (д, 1H, J=8,4 Гц), 7,33 (д, 1H, J=2,7 Гц), 7,29 (д, 2H, J=8,7 Гц), 7,22-7,18 (м, 2H), 7,15-7,11 (м, 2H), 4,98-4,93 (м, 1H), 3,88 (с, 3H), 3,73-3,65 (м, 2H), 3,49-3,45 (м, 1H), 2,31 (ушир. с, 1H), 2,04-1,93 (м, 1H), 1,86-1,77 (м, 1H), 1,56-1,45 (м, 3H), 1,33-1,30 (м, 1H).
Пример 207
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(4-метилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 543) (цис- или транс-).
Указанное в заголовке соединение получали из смолы 534а и смеси цис- и транс-4-метилциклогексиламина по методике, использованной для получения соединения 534.
МС: 602,25 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,36-8,32 (м, 2H), 8,29 (д, 1H, J=1,5 Гц), 8,19 (д, 1H, J=8,7 Гц), 8,04 (дд, 1H, J=1,8, 8,7 Гц), 7,98 (дд, 1H, J=1,5, 8,7 Гц), 7,91 (д, 1H, J=8,4 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,31-7,27 (м, включая д, 3H, J=8,4 Гц), 7,20-7,17 (м, 2H), 7,12 (д, 2H, J=8,4 Гц), 4,42-4,33 (м, 1H), 3,88 (с, 3H), 2,44-2,34 (м, 2H), 1,97-1,94 (м, 1H), 1,86-1,83 (м, 2H), 1,62 (м, 4H), 1,13 (д, 3H, J=7,2 Гц).
Пример 208
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(4-метилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 547) (транс- или цис-).
Указанное в заголовке соединение получали из смолы 534а и смеси цис- и транс-4-метилциклогексиламина по методике, использованной для получения соединения 534.
МС: 602,25 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,36-8,32 (м, 2H), 8,27 (д, 1H, J=1,5 Гц), 8,19 (д, 1H, J=8,7 Гц), 8,07-8,01 (м, 2H), 7,92 (дд, 1H, J=1,5, 8,7 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,31-7,27 (м, включая д, 3H, J=9,0 Гц), 7,20-7,17 (м, 2H), 7,12 (д, 2H, J=8,7 Гц), 4,42-4,33 (м, 1H), 3,88 (с, 3H), 2,44-2,36 (м, 2H), 2,03-1,99 (м, 2H), 1,82-1,78 (м, 2H), 1,62 (м, 2H), 1,06-1,02 (м, 1H), 0,89 (д, 3H, J=6,6 Гц).
Пример 209
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(3,5,5-триметилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 555)
Указанное в заголовке соединение получали из смолы 534а и 3,3,5-триметилциклогексиламина по методике, использованной для получения соединения 534.
МС: 630,28 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,35-8,32 (м, 2H), 8,29 (д, 1H, J=1,2 Гц), 8,19 (д, 1H, J=8,7 Гц), 8,10 (д, 1H, J=9,0 Гц), 8,05 (дд, 1H, J=1,5, 8,7 Гц), 7,93 (дд, 1H, J=1,5, 8,7 Гц), 7,45 (д, 1H, J=8,4 Гц), 7,32 (д, 1H, J=2,7 Гц), 7,27 (д, 2H, J=8,7 Гц), 7,23-7,17 (м, 2H), 7,09 (д, 2H, J=8,4 Гц), 4,71-4,62 (м, 1H), 3,88 (с, 3H), 2,25-2,15 (м, 1H), 1,94-1,87 (м, 2H), 1,63 (ушир.с, 1H), 1,36-1,32 (м, 1H), 1,23-1,08 (м, 2H), 1,03 (с, 3H), 0,89 (д, 3H, J=7,2 Гц), 0,87 (с, 3H).
Пример 210
Получение циклогексил-2-(4-оксо-2-фенил-4Н-хромен-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 407)
Стадия 1: 4-Гидрокси-3-(3-фенилакрилоил)бензойная кислота (соединение 407а)
3-Ацетил-4-гидроксибензойную кислоту получали по методике, раскрытой J. Pfister et al в: J. Med. Chem. (1980), 23, 335-358. К охлажденному льдом раствору 3-ацетил-4-гидроксибензойной кислоты (4 г, 22,2 ммоль) и бензальдегида (2,44 мл, 24 ммоль, 1,08 экв.) в 60 мл этанола добавляли 20 мл 40% раствора КОН. Полученный темно-красный раствор перемешивали в атмосфере аргона при комнатной температуре до завершения реакции, которую контролировали и оценивали ТСХ (2 дня). Затем смесь медленно вливали в избыточное количество 6 н. HCl и отфильтровывали образовавшийся осадок желтого цвета, который промывали водой и сушили. Сырые вещества перекристаллизовывали из смеси ТГФ-EtOH с получением 2,43 г твердого вещества желто-коричневого цвета (выход: 88%).
МС: 267,10 (М-H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 12,88 (ушир.с, 1H), 12,46 (с, 1H), 8,50 (д, 1H, J=2,1 Гц), 8,03 (дд, 1H, J=2,1 Гц, J=8,8 Гц), 7,85-7,93 (м, 3H), 7,77 (д, 1H, J=15,5 Гц), 7-44-7,48 (м, 3H), 7,08 (д, 1H, J=8,8 Гц).
Стадия 2: 4-Оксо-2-фенил-4Н-хромен-6-карбоновая кислота (соединение 407b)
К 4-гидрокси-3-(3-фенилакрилоил)бензойной кислоте (1 г, 3,72 ммоль) в уксусной кислоте (37,5 мл) добавляли бром (216 мкл, 1,13 экв.) После перемешивания раствора при комнатной температуре в течение 1 дня медленно добавляли 10% водный раствор NaHSO3 (62,5 мл). Образовавшийся осадок отфильтровывали, промывали водой и суспендировали в этаноле (25 мл). МС: 426,93 (М+Н+).
Добавляли гидроксид калия (861 мг, 3,5 экв., 13,05 ммоль), растворенный в воде (12,5 мл), и перемешивание продолжали в течение 4 часов. Реакционную смесь подкисляли 2н. HCl и образовавшийся осадок отфильтровывали, промывали водой, сушили и перекристаллизовывали с получением 621 мг (62%) продукта.
МС: 265,08 (М-H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 8,57 (д, 1H, J=2,1 Гц), 8,30 (дд, 1H, J=2,1 Гц, J=8,5 Гц), 8,11-8,14 (м, 2H), 7,87 (д, 1H, 8,7 Гц), 7,58-7,89 (м, 3H), 7,12 (с, 1Н).
Стадия 3: 1-Циклогексил-2-(4-оксо-2-фенил-4Н-хромен-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 407)
4-Оксо-2-фенил-4Н-хромен-6-карбоновую кислоту (280 мг, 1,05 ммоль) растворяли в ДМФА (5 мл) и добавляли HATU (418 мг, 1,1 экв.) и диизопропилэтиламин (402 мкл). После перемешивания при комнатной температуре в течение 15 минут добавляли сложный этиловый эфир 3-амино-4-циклогексиламинобензойной кислоты (303 мг, 1,1 экв.), растворенный в 2 мл ДМФА. После перемешивания в течение ночи реакционную смесь выпаривали, растворяли в этилацетате и промывали водой и насыщенным раствором соли, сушили сульфатом натрия, выпаривали и сушили в течение ночи. Затем продукт кипятили в уксусной кислоте с обратным холодильником в течение 4-х часов, выпаривали досуха и выпаривали совместно с толуолом более 2-х раз. Проводили омыление растворением остатка в этаноле (10 мл) добавлением 10 экв. 1н. раствора NaOH и перемешиванием при 40ºС в течение 4-х часов. Этанол выпаривали, добавляли воду и подкисляли. Образовавшийся осадок очищали ВЭЖХ с обращенной фазой. Выход: 58 мг.
МС: 465,20 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 8,64 (д, 1H, J=2,3 Гц), 8,49 (с, 1H), 8,30-8,38 (м, 2H), 8,24 (дд, 1H, J=2,3 Гц, J=8,8 Гц), 8,12-8,17 (м, 3H), 7,59-7,66 (м, 3H), 7,10 (с, 1H), 4,55-4,63 (м, 1H), 2,42-2,50 (м, 2H), 2,20-2,24 (м, 2H), 2,00-2,03 (м, 2H), 1,77-1,81 (м, 1H), 1,42-1,49 (м, 3H).
Пример 211
Получение 1-циклогексил-2-(4-оксо-2-фенил-1,4-дигидрохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 373)
4-Оксо-2-фенил-1,4-дигидрохинолин-6-карбоновую кислоту (298,5 мг, 1,05 ммоль) (соединение 481с) растворяли в ДМФА (5 мл) и добавляли HATU (440 мг, 1,1 экв.) и диизопропилэтиламин (402 мкл). После перемешивания при комнатной температуре в течение 15 минут добавляли сложный этиловый эфир 3-амино-4-циклогексиламинобензойной кислоты (303 мг, 1,1 экв.), растворенный в 2 мл ДМФА. После перемешивания в течение ночи реакционную смесь выпаривали, растворяли в этилацетате и промывали водой и насыщенным раствором соли, сушили сульфатом натрия, выпаривали и сушили в течение ночи. Затем продукт кипятили в уксусной кислоте с обратным холодильником в течение 4-х часов, выпаривали досуха и выпаривали совместно с толуолом более 2-х раз. Проводили омыление растворением остатка в этаноле (10 мл), добавлением 10 экв. 1н. раствора NaOH и перемешиванием при 40ºС в течение 4-х часов. Этанол выпаривали, добавляли воду и подкисляли. Образовавшийся осадок очищали ВЭЖХ с обращенной фазой. Выход: 47 мг.
МС: 464,19 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 8,71 (с, 1H), 8,44 (с, 1H), 8,22-8,25 (м, 2H), 8,15 (с, 1H), 7,86-7,89 (м, 2H), 7,61-7,64 (м, 2H), 6,79 (с, 1H), 4,55-4,64 (м, 1H), 2,45-2,53 (м, 2H), 2,19-2,23 (м, 2H), 1,99-2,02 (м, 2H), 1,76-1,80 (м, 2H), 1,41-1,48 (м, 3H).
Пример 212
Получение 1-циклогексил-2-(4-диметиламино-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 481)
Стадия 1: Сложный этиловый эфир 4-оксо-2-фенил-1,4-дигидрохинолин-6-карбоновой кислоты (соединение 481b)
Сложный этиловый эфир 4-аминобензойной кислоты (66 г, 0,4 моль) и сложный этиловый эфир 3-оксо-3-фенилпропионовой кислоты (0,4 моль, 1 экв.) растворяли в 500 мл циклогексана и кипятили с обратным холодильником в течение 2-х дней с использованием ловушки Дина-Старка. Раствор фильтровали, выпаривали растворитель и перекристаллизовывали остаток с получением сложного этилового эфира 4-(2-этоксикарбонил-1-фенилэтилиденамино)бензойной кислоты (соединение 481а) МС: 340,18 (М+Н+). Сложный этиловый эфир 4-(2-этоксикарбонил-1-фенилэтилиденамино)бензойной кислоты растворяли в дифенилметаноне (250 мл) и нагревали до 250ºС в течение 4-х часов. Полученный раствор разбавляли диэтиловым эфиром и фильтровали с получением 48,6 г указанного в заголовке промежуточного продукта в виде кристаллического твердого вещества белого цвета.
МС: 294,13 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 11,98 (ушир.с, 1H), 8,69 (д, 1H, J=1,1 Гц), 8,16 (дд, 1H, J=2,0 Гц, J=8,5 Гц), 7,82-7,86 (м, 3H), 7,56-7,61 (м, 3H), 6,42 (с, 1H), 4,35 (кв, 2H, J=7,0 Гц), 1,36 (т, 3H, J=7,0 Гц).
Стадия 2: 4-Оксо-2-фенил-1,4-дигидрохинолин-6-карбоновая кислота (соединение 481с)
Омыление проводили растворением 26,5 г (0,1 моль) сложного этилового эфира 4-оксо-2-фенил-1,4-дигидрохинолин-6-карбоновой кислоты в этаноле (100 мл), добавлением 10 экв. 1н. раствора NaOH и перемешиванием при 40ºС в течение 4-х часов. Этанол выпаривали, добавляли воду и подкисляли и фильтровали осадок. Продукт белого цвета сушили над P2O5 c получением количественного выхода 4-оксо-2-фенил-1,4-дигидрохинолин-6-карбоновой кислоты.
МС: 266,10 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 12,29 (с, 1H), 8,14 (дд, 1H, J=2,0 Гц, J=8,8 Гц), 7,94 (д, 1H, J-8,8 Гц), 7,84-7,89 (м, 2H), 7,55-7,59 (м, 3H), 6,46 (с, 1H).
Стадия 3: Сложный этиловый эфир 1-циклогексил-2-(4-оксо-2-фенил-1,4-дигидрохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 481d)
4-Оксо-2-фенил-1,4-дигидрохинолин-6-карбоновую кислоту (2,78 г, 1,05 ммоль) растворяли в ДМФА (50 мл) и добавляли HATU (1,1 экв.) и диизопропилэтиламин (2,2 экв., 402 мкл). После перемешивания при комнатной температуре в течение 15 минут добавляли сложный этиловый эфир 3-амино-4-циклогексиламинобензойной кислоты (2,89 г, 1,1 экв.), растворенной в 20 мл ДМФА. После перемешивания в течение ночи реакционную смесь выпаривали, растворяли в этилацетате и промывали водой и насыщенным раствором соли, сушили сульфатом натрия, выпаривали и сушили в течение ночи. Затем продукт кипятили в уксусной кислоте с обратным холодильником в течение 4-х часов, выпаривали досуха и выпаривали совместно с толуолом более 2-х раз. Продукт перекристаллизовывали из метанола с получением 4,13 г продукта.
МС: 492,25 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 11,98 (с, 1H), 8,35 (д, 1H, J=1,5 Гц), 8,27 (д, 1H, 1,7 Гц), 7,95-8,02 (м, 3H), 7,82-7,88 (м, 3H), 7,57-7,69 (м, 3H), 6,43 (с, 1H), 4,29-4,38 (м, 3H), 2,26-2,37 (м, 2H), 1,95-1,99 (м, 2H), 1,84-1,89 (м, 2H), 1,62-1,66 (м, 1H), 1,24-1,42 (м, 6H).
Стадия 4: Сложный этиловый эфир 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 481е)
Сложный этиловый эфир 1-циклогексил-2-(4-оксо-2-фенил-1,4-дигидрохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (4 г, 8,14 ммоль) растворяли в оксихлориде фосфора и нагревали при 100ºС в течение ночи. После выпаривания растворителя продукт перекристаллизовывали из смеси метанол/вода с получением 3,96 г сырого продукта. Результаты очистки указанного в заголовке соединения на силикагеле были неудовлетворительными вследствие разложения продукта в колонке. МС: 510,22 (М+Н+).
Стадия 5: Получение 1-циклогексил-2-(4-диметиламино-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 481)
Сложный этиловый эфир 2-(4-хлор-2-фенилхинолин-6-ил)-1-(1-циклогексил)-1Н-бензоимидазол-5-карбоновой кислоты растворяли в 5 мл НМП и добавляли 1,1 экв. нуклеофила. Реакционную смесь нагревали до 80ºС в течение ночи и затем выпаривали. Проводили омыление растворением остатка в этаноле (10 мл), добавлением 10 экв. 1н. раствора NaOH и перемешиванием при 40ºС течение 4-х часов. Этанол выпаривали и остаток очищали ВЭЖХ с обращенной фазой.
В синтезе указанного в заголовке соединения использовали 51 мг (0,1 ммоль) сырого этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты. Использованный нуклеофил представлял собой чистый ДМФА. В данной реакции НМП не использовали. Выход: 11 мг.
МС: 491,26 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 8,69 (с, 1H), 8,41 (с, 1H), 8,12-8,30 (м, 2H), 7,87-8,08 (м, 4H), 7,62-7,74 (м, 3H), 7,20 (с, 1H), 4,40-4,48 (м, 1H), 3,67 (с, 6H), 2,44-2,48 (м, 2H), 1,96-1,99 (м, 2H), 1,75-1,79 (м, 1H), 1,30-1,42 (м, 3H).
Пример 213
Получение 1-циклогексил-2-(4-этокси-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 494)
Указанное в заголовке соединение выделяли в виде побочного продукта последовательности реакций, использованных для получения соединения 481. Выход: 4 мг.
МС: 492,22 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 8,80 (с, 1H), 8,36-8,46 (м, 3H), 8,12-8,17 (м, 4H), 7,71-97 (м, 4H), 4,75 (кв, 1H, J=7,0 Гц), 4,46-4,57 (м, 1H), 2,42-2,55 (м 2H), 2,13-2,17 (м, 2H), 1,94-1,99 (м, 2H), 1,71-1,76 (м, 1H), 1,69 (т, 3H, J=7,0 Гц), 1,38-1,45 (м, 3H).
Пример 214
Получение 2-[4-(4-хлорфениламино)-2-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 380)
Указанное в заголовке соединение получали по методике получения соединения 481. В данной реакции использовали 102 мг (0,2 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты. Использованный нуклеофил представлял собой п-хлорфениламин. Выход: 89 мг.
МС: 573,22 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 8,98 (д, 1H, J=1,4 Гц), 8,27-8,38 (м, 3H), 8,08-8,16 (м, 2H), 7,86-7,96 (м, 2H), 7,54-7,72 (м, 7H), 7,13 (с, 1H), 4,45 (тт, 1H, J=8,0 Гц, J=4,3 Гц), 2,37-2,48 (м, 2H), 2,13-2,17 (м, 2H), 1,94-1,99 (м, 2H), 1,74-1,78 (м, 1H), 1,37-1,49 (м, 3H).
Пример 215
Получение 1-циклогексил-2-[4-(4-гидроксибутиламино)-2-фенилхинолин -6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 398)
В этой реакции использовали 102 мг (0,2 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты в такой же последовательности реакций, которую использовали для получения соединения 481. Использованный нуклеофил представлял собой 4-аминобутан-1-ол. Выход: 59 мг.
МС: 535,28 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 8,75 (с, 1H), 8,43 (с, 1H), 8,15-8,24 (м, 2H), 8,07-8,10 (дд, 1H, J=0,9 Гц, J=8,8 Гц), 7,98-8,03 (м, 3H), 7,67-7,73 (м, 3H), 7,15 (с, 1Н), 4,34 (м, 1H), 3,75 (т, 2H, 7,0 Гц), 3,67 (т, 2H, J=5,9 Гц), 2,37-2,45 (м, 2H), 2,07-2,11 (м, 2H), 1,90-1,97 (м, 4H), 1,70-1,79 (м, 3H), 1,28-1,45 (м, 3H).
Пример 216
Получение 1-циклогексил-2-(2-фенил-4-фениламинохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 433)
В этой реакции использовали 102 мг (0,2 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты в такой же последовательности реакций, которую использовали для получения соединения 481. Использованный нуклеофил представлял собой анилин. Выход: 143 мг.
МС: 571,30 (М+H+), 539,26; H1-ЯМР (d6-ДМСО): δ (м.д.) 11,10 (ушир., 1H), 9,11 (с, 1H), 8,25-8,36 (м, 3H), 8,05 (д, 1Н, 8,8 Гц), 7,88-7,93 (м, 3H), 7,57-7,67 (м, 7H), 7,39-7,45 (м, 1H), 7,03 (с, 1H), 4,24-4,29 (м, 1H), 2,31-2,37 (м, 2H), 2,02-2,04 (м, 2H), 1,84-1,88 (м, 2H), 1,62-1,66 (м, 1H), 1,21-1,43 (м, 3H).
Пример 217
Получение 1-циклогексил-2-[4-(3-имидазол-1-илпропиламино)-2-фенилхинолин -6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 451)
В этой реакции использовали 102 мг (0,2 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты в такой же последовательности реакций, которую использовали для получения соединения 481. Использованный нуклеофил представлял собой 3-имидазол-1-илпропиламин. Выход: 31 мг.
МС: 571,30 (М+H+), 286,12 ((М+2H+)/2); H1-ЯМР (MeOD): δ (м.д.) 9,03 (с, 1H), 8,91 (с, 1H), 8,46 (с, 1H), 8,09-8,30 (м, 5H), 8,01-8,04 (м, 2H), 7,68-7,74 (м, 4H), 7,56-7,58 (м, 1H), 7,17 (с, 1H), 4,49 (т, 2H, J=7,0 Гц), 4,37-4,47 (м, 1H), 3,83 (т, 2H, J=6,7 Гц), 2,42-2,51 (м, 2H), 2,12-2,16 (2H, м, 2H), 1,95-1,99 (м, 2H), 1,74-1,78 м, 1H), 1,35-1,42 (м, 3H).
Пример 218
Получение 1-циклогексил-2-(4-фенокси-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 496)
В этой реакции использовали 51 мг (0,1 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты в такой же последовательности реакций, которую использовали для получения соединения 481. Использованный нуклеофил представлял собой фенол. Выход: 19 мг.
МС: 540,25 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 8,97 (с, 1H), 8,45-8,50 (м, 2H), 8,32 (д, 1H, J=8,5 Гц), 8,18 (с, 2H), 7,91-7,94 (м, 2H), 7,54-7,65 (м, 5H), 7,41-7,49 (м, 3H), 7,19 (с, 1H), 4,58-4,66 (м, 1H), 2,42-2,49 (м, 2H), 2,17-2,21 (м, 2H), 1,95-2,01 (м, 2H), 1,72-1,84 (м, 1H), 1,41- 1,52 (м, 3H).
Пример 219
Получение 1-циклогексил-2-[4-(7-гидроксинафталин-2-илокси)-2-фенилхинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 509)
В этой реакции использовали 51 мг (0,1 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты в такой же последовательности реакций, которую использовали для получения соединения 481. Использованный нуклеофил представлял собой нафталин-2,7-диол. Выход: 6,2 мг.
МС: 606,28 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 8,66 (с, 1H), 8,29-8,34 (м, 2H), 8,15-8,18 (м, 1H), 8,03-8,11 (м, 3H), 7,91-7,97 (м, 2H), 7,83 (д, 1H, J=8,8 Гц), 7,65 (ушир.с, 1H), 7,47-7,49 (м, 3H), 7,34 (с, 1H), 7,27-7,31 (м, 1H), 7,14 (ушир.с, 1H), 7,07-7,11 (м, 1H), 4,47-4,49 (м, 2H, OH и CH), 2,32 (кв, 2H, J=12,6 Гц), 2,01-2,04 (м, 2H), 1,81-1,84 (м, 2H), 1,58-1,62 (м, 1H), 1,22-1,41 (м, 3H).
Пример 220
Получение 1-циклогексил-2-(2-фенил-4-фенилсульфанилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 467)
В этой реакции использовали 51 мг (0,1 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты в такой же последовательности реакций, которую использовали для получения соединения 481. Использованный нуклеофил представлял собой бензолтиол. Выход: 36 мг.
МС: 556,21 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 8,48 (с, 1H), 8,28-8,31 (м, 2H), 8,16 (д, 1H, J=8,8 Гц), 8,05 (д, 1H, J=8,8 Гц), 7,89-7,97 (м, 3H), 7,66-7,70 (м, 2H), 7,55-7,57 (м, 3H), 7,48-7,53 (м, 4H), 4,43-4,49 (м, 1Н), 2,30-2,40 (м, 2H), 2,00-2,04 (м, 2H), 1,85-1,88 (м, 2H), 1,62-1,66 (м, 1H), 1,22-1,37 (м, 3H).
Пример 221
Получение 1-циклогексил-2-[2-(2-этокси-5-нитрофенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 404)
1-(2-Бром-5-нитрофенил)этанон (61 мг, 0,25 ммоль), полученный методикой, подобной той, которая раскрыта в: Meisenheimer, J., Zimmermann P., и V.Kummer, U. Ann. Der. Chem. 446, pp. 205-228, и сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (98 мг, 0,25 ммоль) растворяли в 500 мкл этанола и добавляли 500 мкл 10% этанольного раствора КОН. Реакционную смесь перемешивали при 75ºС в течение ночи. Реакционную смесь подкисляли 4н. хлористоводородной кислотой, три раза экстрагировали этилацетатом, органические экстракты сушили сульфатом натрия и затем выпаривали. В результате очистки ВЭЖХ с обращенной фазой получали 16 мг продукта (степень чистоты: 97,33%).
МС: 537,23 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 8,71 (д, 1H, J=2,9 Гц), 8,62 (д, 1H, J=8,8 Гц), 8,41 (д, 1H, J=2,7 Гц), 8,37 (дд, 1H, J=3,0 Гц, J=9,0 Гц), 8,29-8,33 (м, 2 Гц), 8,18 (д, 1H, J=8,5 Гц), 8,04-8,08 (м, 2H), 7,92 (1H, дд, J=1,8 Гц, J=8,5 Гц), 7,44 (д, 1H, 8,4 Гц), 4,31-4,44 (м, 3H), 2,26-2,34 (м, 2H), 2,02-2,05 (м, 2H), 1,83-1,86 (м, 2H), 1,61-1,65 (м, 1H), 1,28-1,43 (м, 6H).
Пример 222
Получение 2-[2,4']бихинолинил-6-ил-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 423)
На твердую хинолин-4-карбоновую кислоту (250 мг) добавляли по каплям метилмагнийбромид в диэтиловом эфире (2,4 мл, 3,0М раствора). После перемешивания в течение 15 минут реакцию гасили добавлением метанола. Раствор распределяли между этилацетатом и водой, водную фазу экстрагировали более двух раз этилацетатом, органические фазы сушили сульфатом натрия и затем выпаривали. Сырой продукт, представляющий собой 1-хинолин-4-илэтанон, использовали без дополнительной очистки на следующей стадии.
МС: 172,07 (М+H+); H1-ЯМР (CDCl3): δ (м.д.) 9,01 (д, 1H, J=4,5 Гц), 8,42 (д, 1H, J=9 Гц), 8,14 (д, 1H, J=9 Гц), 7,72-7,78 (м, 1H), 7,59-7,64 (м, 2H), 2,75 (с, 3H)).
(1-Хинолин-4-ил)этанон (43 мг, 0,25 ммоль) и сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (98 мг, 0,25 ммоль) растворяли в 500 мкл этанола и затем добавляли 500 мкл 10% этанольного раствора КОН. Реакционную смесь перемешивали при 75ºС в течение ночи. Реакционную смесь подкисляли 4н. хлористоводородной кислотой, экстрагировали три раза этилацетатом и органические экстракты сушили сульфатом натрия и затем выпаривали. В результате очистки ВЭЖХ с обращенной фазой получали 24 мг продукта.
МС: 499,23 (М+H+); H1-ЯМР (MeOD): δ (м.д.) 9,33 (д, 1H, J=5,5 Гц), 8,87 (д, 1H, J=8,5 Гц), 8,65 (д, 1H, J=1,8 Гц), 8,55 (д, 1H, 8,8 Гц), 8,48-8,52 (м, 2H), 8,37 (д, 1H, 8,5 Гц), 8,30 (д, 5,5 Гц), 8,16-8,27 (м, 5H), 7,94-7,99(м, 1H), 4,62 (тт, 1H, J=8,5 Гц, J=3,9 Гц), 2,43-2,54 (м (ушир.кв), 2H), 2,22-2,26 (м, 2H), 1,99-2,03 (м, 2H), 1,76-1,80 (м, 1H), 1,40-1,53 (м, 3H).
Пример 223
Получение 2-[2-(4'-хлор-4-нитробифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 439)
1-(2-Бром-5-нитрофенил)этанон (1 г, 4 ммоль; полученный методикой, подобной той, которая раскрыты в: Meisenheimer, J., Zimmermann P., и V. Kummer, U.Ann. der Chem. 446, pp. 205-228), п-хлорфенилбороновую кислоту (768 мг, 1,2 экв.) и тетракис (трифенилфосфин) палладий (0) (473 мг, 0,1 экв.) растворяли в 25 мл толуола, 6 мл метанола и 2,5 мл насыщенного раствора бикарбоната натрия. После дегазирования/ультразвуковой обработки раствора закупоренный реакционный сосуд нагревали до 80ºС в течение ночи. Охлажденный раствор распределяли между этилацетатом и водой; водную фазу экстрагировали более 2-х раз этилацетатом и органические фракции объединяли, сушили сульфатом натрия и выпаривали. В результате хроматографии на силикагеле (смесь гексан/этилацетат 4:1) получали 1-(4'-хлор-4-нитробифен-2-ил)этанон (962 мг).
1-(4'-Хлор-4-нитробифен-2-ил)этанон (69 мг, 0,25 ммоль) и сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (98 мг, 0,25 ммоль) растворяли в 500 мкл этанола и добавляли 500 мкл 10% этанольного раствора КОН. Реакционную смесь перемешивали при 75ºС в течение ночи. Реакционную смесь подкисляли 4н. хлористоводородной кислотой, экстрагировали три раза этилацетатом, органические экстракты сушили сульфатом натрия и затем выпаривали. В результате очистки ВЭЖХ с обращенной фазой получали 34 мг продукта.
МС: 603,20 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 8,57 (д, 1H, J=2,3 Гц), 8,38-8,45 (м, 2H), 8,34 (д, 1H, J=1,8 Гц), 8,24-8,28 (м, 2H), 8,05-8,08 (м, (d), 2H), 7,91 (дд, 1H, J=1,5, J=8,8 Гц), 7,82 (д, 1H, J=8,5 Гц), 7,38-7,43 (м, 2 Гц), 7,20-7,27 (м, 3H), 4,34-4,43 (м, 1H), 2,26-2,34 (м, 2H), 2,01-2,05 (м, 2H), 1,83-1,87 (м, 2H), 1,62-1,75 (м, 2H), 1,32-1,43 (м, 3H).
Пример 224
Получение 6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]-2-фенилхиноксалина (соединение 258)
Стадия 1: 4-Циклогексиламино-3-нитробензонитрил (соединение 127)
Раствор 1 г (5,48 ммоль) 4-хлор-3-нитробензонитрила - соединения 126 и 1,14 г (11,51 ммоль)циклогексиламина нагревали в течение ночи в 5 мл безводного ДМФА. После охлаждения до комнатной температуры раствор добавляли по каплям в 100 мл H2O при сильном перемешивании. Твердые частицы собирали фильтрацией и сушили в вакууме с получением 1,34 г (100%) твердых частиц ярко-желтого цвета, которые использовали как таковые без анализа на следующей стадии.
Стадия 2: Циклогексил-[2-нитро-4-(1Н-тетразол-5-ил)фенил]амин (соединение 128)
Раствор 1,10 г (4,49 ммоль) 4-циклогексиламино-3-нитробензонитрила - соединения 127, и 1,11 г (5,39 ммоль) Me3SnN3 в 50 мл толуола кипятили с обратным холодильником в течение ночи. Кристаллы собирали фильтрацией, промывали толуолом, сушили и обрабатывали 50 мл 4M HCl в диоксане в течение 4-х часов. Твердые частицы собирали фильтрацией, промывали диоксаном и сушили с получением 1,14 г (88%) твердых частиц красного цвета. МС: 289,15 (М+Н+).
Стадия 3: N-1-Циклогексил-4-(1Н-тетразол-5-ил)бензол-1,2-диамин (соединение 129)
Указанный в заголовке промежуточный продукт получали из 1,20 г (4,16 ммоль) соединения 128 по методике получения соединения 11, выход продукта: 0,9 г (83%). МС: 259,18 (М+Н+).
Стадия 4: 6-[1-Циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]-2-фенилхиноксалин (соединение 258)
Указанное в заголовке соединение получали из 100 мг (0,39 ммоль) соединения 129 и соединения 36А Y=фенил по методике получения соединения 38 Y=фенил, выход: 21 мг.
МС: 473,25 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 9,73 (с, 1H), 8,46 (д, 2H, J=1,2 Гц), 8,42-8,36 (м, 4H), 8,29 (д, 1H, J=5,6 Гц), 8,19 (дд, 1H, J=1,2 Гц и 5,6 Гц), 8,09 (дд, 1H, J=1 Гц и 5,8 Гц), 7,63 (м, 5H), 4,45 (м, 1H), 2,44-2,35 (м, 2H), 2,12-2,08 (м, 2H), 1,90-1,85 (м, 2H), 1,62 (м, 1H), 1,50-1,29 (м, 3H).
Пример 225
Получение 1-циклогексил-2-(2,3-дифенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 386)
Указанное в заголовке соединение синтезировали в четыре стадии по методикам получения соединения 13, соединения 25, соединения 27 Q=этил и соединения 204 соответственно за исключением того, что на первой стадии вместо ацетофенона использовали дезоксибензоин.
МС: 524,29 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,73 (с, 1H), 8,57 (с, 1H), 8,40-8,37 (м, 2H), 8,31-8,28 (д, 1H, J=8,4 Гц), 8,17-8,14 (д, 1Н, J=8,4 Гц), 8,07-8,04 (д, 1H, J=8,4 Гц), 7,45-7,29 (м, 10H), 4,46 (м, 1H), 2,34-2,26 (м, 2H), 2,14-2,10 (м, 2H), 1,86-1,82 (м, 2H), 1,60 (м, 1H), 1,43-1,21 (м, 3H).
Пример 226
Получение 2-(2-бензгидрилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 457)
Указанное в заголовке соединение синтезировали в четыре стадии по методикам получения соединения 13, соединения 25, соединения 27 Q=этил и соединения 204 соответственно за исключением того, что на первой стадии вместо ацетофенона использовали 1,1-дифенилацетон.
МС: 538,30 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,63-8,60 (д, 1H, J=9,0 Гц), 8,47 (д, 1H, J=1,5 Гц), 8,34 (д, 1H, J=1,2 Гц), 8,29-8,24 (м, 2H), 8,10-8,02 (м, 2H), 7,66-7,63 (д, 1H), J=8,7 Гц), 7,36-7,20 (м, 10H), 6,05 (с, 1H), 4,45-4,41 (м, 1H), 2,33-2,28 (м, 2H), 2,1-2,06 (м, 2H), 1,84-1,79 (м 2H), 1,58 (м, 1H), 1,38-1,20 (м, 3H).
Пример 227
Получение 2-[2-(2-бромфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 352)
Указанное в заголовке соединение синтезировали в четыре стадии по методикам получения соединения 13, соединения 25, соединения 27 Q=этил и соединения 204 соответственно за исключением того, что на первой стадии вместо ацетофенона использовали 2'-бромацетофенон.
МС: 526,14 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,75-8,72 (д, 1H, J=8,7 Гц), 8,55 (д, 1H, J=1,5 Гц), 8,38 (д, 1H, J=1,2 Гц), 8,36-8,33 (д, 1H, J=8,7 Гц), 8,26-8,8,22 (д, 1H, J=8,7 Гц), 8,17-8,13 (дд, 1H, J=8,7 Гц и 1,8 Гц), 8,06-8,02 (дд, 1H, J=8,4 Гц и 1,5 Гц), 7,96-7,93 (д, 1H, J=8,4 Гц), 7,87-7,84 (дд, 1H, J=7,8 Гц и 0,9 Гц), 7,73-7,69 (дд, 1H, J=7,5 Гц и 1,8 Гц), 7,64-7,59 (м, 1H), 7,53-7,47 (м 1H), 4,49 (м, 1H), 2,40-2,32 (м, 2H), 2,15-2,11 (м, 2H), 1,91-1,87 (м, 2H), 1,66 (м, 1H), 1,42-1,34 (м, 3H).
Пример 228
Получение 2-{2-[(4-хлорфенил)метилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 546)
Стадия 1: (4-Хлорфенил)изопропиламин (соединение 546а)
Смесь 1 г (7,84 ммоль) 4-хлоранилина, 0,91 г (15,68 ммоль) ацетона, 0,99 г (15,68 ммоль) NaCNBH3, 4 г MgSO4 в 99 мл безводного EtOH и 1 мл АсОН перемешивали при комнатной температуре в течение ночи, фильтровали и удаляли растворитель. Остаток растворяли в 50 мл EtOAc, промывали 50 мл H2O, сушили (Na2SO4) и выпаривали. Остаток очищали на силикагеле с использованием в качестве элюента смеси гексан/EtOAc с получением 0,86 г бесцветного масла. МС: 170,08 (М+Н+).
Стадия 2: (4-Хлорфенил)циклогексиламин (соединение 546b)
Получали в виде бесцветных кристаллов по вышеуказанной методике с использованием циклогексанона вместо ацетона, выход продукта 1,11 г. МС:210,12 (М+Н+).
Стадия 3: Сложный этиловый эфир 2-{2-[(4-хлорфенил)метилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 546с)
Раствор 100 мг (0,23 ммоль) соединения 402а в 1 мл SOCl2 выдерживали при комнатной температуре в течение 10 мин и удаляли SOCl2. Остаток растворяли в 5 мл безводного CH2Cl2; добавляли 89 мг (0,69 ммоль) DIEA, 84 мг (0,69 ммоль) ДМАП, 98 мг (0,69 ммоль) 4-хлор-N-метиланилина, раствор вращали и давали ему возможность стоять при комнатной температуре в течение ночи. Удаляли растворитель и остаток хроматографировали на силикагеле с использованием в качестве элюента смеси гексан/EtOAc, в результате получали 63 мг масла желтого цвета. МС:576,24 (М+Н+).
Стадия 4: 2-{2-[(4-хлорфенил)метилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 546)
Раствор 63 мг (0,11 ммоль) соединения 546с в 0,55 мл ТГФ, 0,44 мл EtOH и 0,11 мл 2н. водного раствора NaOH выдерживали при комнатной температуре в течение ночи. Реакционную смесь гасили 0,22 мл 1М водного раствора HCl. Растворители удаляли и остаток очищали ВЭЖХ с получением 6 мг указанного в заголовке соединения.
МС: 539,21 (М+H+); 1H-ЯМР (CD3OD): δ (м.д.) 8,47 (м, 3H), 8,31 (м, 2H), 8,10 (м, 2H), 7,84 (м, 1H), 7,23 (м, 4H), 4,58 (м, 1H), 3,58 (с, 3H), 2,45 (м, 2H), 2,19 (м, 2H), 1,98 (м, 2H), 1,74 (м, 1H), 1,46-1,30 (м, 3H).
Пример 229
Получение 2-{2-[(4-хлорфенил)изопропилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 550)
Стадия 1: Сложный этиловый эфир 2-{2-[(4-хлорфенил)изопропилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 550а)
Указанное в заголовке соединение получали по методике получения соединения 546с с использованием соединения 546а вместо 4-хлор-N-метиланилина. МС:595,27 (М+Н+).
Стадия 2: 2-{2-[(4-хлорфенил)изопропилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 550)
Указанное в заголовке соединение получали по методике получения соединения 546, при этом вместо выдержки раствора в течение ночи его нагревали при 50ºС в течение 4-х часов.
МС: 567,25 (М+H+); 1H-ЯМР (CD3OD): δ (м.д.) 8,45 (м, 2H), 8,36 (с, 1H), 8,24 (м, 2H), 8,15 (д, 1H, J=9 Гц), 8,04 (д, 1H, J=8,4 Гц), 7,71 (д, 1H, J=8,4 Гц), 7,24 (дд, 4H, J=8,4 Гц и 18,3 Гц), 5,12 (м, 1H), 4,53 (м, 1H), 2,41 (м, 2H), 2,15 (м, 2H), 1,95 (м, 2H), 1,73 (м, 1H) 1,41 (м, 3H), 1,31 (д, 6H, J=6,6 Гц).
Пример 230
Получение 2-{2-[(4-хлорфенил)циклогексилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 551)
Стадия 1: Сложный этиловый эфир 2-{2-[(4-хлорфенил)циклогексилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 551а)
Указанное в заголовке соединение получали по методике получения соединения 546с с использованием соединения 546b вместо 4-хлор-N-метиланилина. МС:635,31 (М+Н+).
Стадия 2: 2-{2-[(4-хлорфенил)циклогексилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 551)
Указанное в заголовке соединение получали по методике получения соединения 550 с использованием 5 экв. 2н. водного раствора NaOH вместо 1 экв.
МС: 607,28 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,46 (д, 1H, J=8,4 Гц), 8,25 (с, 2H), 7,96 (м, 3H), 7,68 (д, 1H, J=8,4 Гц), 7,26 (с, 4H), 4,61 (м, 1H), 4,34 (м, 1H), 2,29-0,96 (м, 10H).
Пример 231
Получение 1-циклогексил-2-[2-(4'-этил-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 557)
По методике получения соединения 366 и его последующей обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 4-этилфенилбороновой кислотой (39 мг, 0,2625 ммоль) с получением указанного в заголовке соединения (48 мг, выход: 48%).
МС: 582,32 (М+H+); H1-ЯМР (ДМСО-d6): 8,38 (д, 1H, J=l,5), 8,31 (м, 3H), 8,17 (д, 1H, J=8,7), 8,07 (дд, 1H, J=8,7, 1,8), 7,98 (дд, 1H, J=8,4, 1,2), 7,43 (д, 1H, J=8,7), 7,31 (д, 1H, J=2,7), 7,17 (м, 2H), 7,05 (м, 4H), 4,42 (м, 1H), 3,87 (с, 3H), 2,53 (м, 2H), 2,31 (м, 2H), 2,07 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,32 (м, 3H), 1,12 (м, 3H).
Пример 232
Получение 1-циклогексил-2-[2-(3',4'-дифтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 560)
По методике получения соединения 366 и его последующей обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 3,4-дифторфенилбороновой кислотой (42 мг, 0,2625 ммоль) с получением указанного в заголовке соединения (26 мг, выход: 25%).
МС: 590,26 (М+H+); H1-ЯМР (ДМСО-d6): 8,46 (м, 2H), 8,36 (с, 1H), 8,29 (д, 2H, J=9), 8,11 (дд, 1H, J=8,7,1,8), 8,05 (дд, 1H, J=9,1,5), 7,49 (д, 1H, J=8,4), 7,27 (м, 5H), 6,84 (м, 1H), 4,44 (м, 1H), 3,88 (с, 3H), 3,54 (с, 1H), 2,30 (м, 2H), 2,11 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1Н), 1,35 (м, 3H).
Пример 233
Получение 1-циклогексил-2-[2-(3',5'-дихлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 562)
По методике получения соединения 366 и его последующей обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 3,5-дихлорфенилбороновой кислотой (50 мг, 0,2625 ммоль) с получением указанного в заголовке соединения (17 мг, выход: 15%).
МС: 622,20 (М+H+); H1-ЯМР (ДМСО-d6): 8,48 (д, 1H, J=8,4), 8,44 (с, 1H), 8,32 (с, 1H), 8,22 (м, 2H), 8,05 (м, 2H), 7,53 (д, 1H, J=8,4), 7,42 (м, 2H), 7,33 (д, 1H, J=2,7), 7,20 (дд, 1H, H=8,7, 2,7), 7,11 (м, 2H), 4,40 (м, 1H), 3,89 (с, 3H), 2,30 (м, 2H), 2,08 (м, 2H), 1,84 (м, 2H), 1,60 (м, 1H), 1,32 (м, 3H).
Пример 234
Получение амида 1-циклогексил-2-[2-((4'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 570)
Соединение 455 (50 мг, 0,087 ммоль) растворяли в насыщенном аммиаком метаноле (50 мл) и помещали в 100 мл стеклянный баллон. Реакционную смесь промывали аргоном, закупоривали и перемешивали при 70ºС в течение 8 дней. Затем реакционную смесь выпаривали досуха и очищали ВЭЖХ с получением указанного в заголовке соединения (9 мг, выход: 18%).
МС: 571,27 (М+H+); H1-ЯМР (ДМСО-d6): 8,37 (м, 3H), 8,29 (м, 2H), 8,09 (м, 2H), 7,55 (с, 1H), 7,46 (2, 1H, J=8,4), 7,32 (д, 1H, J=2,7), 7,20 (м, 2H), 7,12 (м, 4H), 4,44 (с, 1H), 3,88 (с, 3H), 3,55 (с, 1H), 2,34 (м, 2H), 2,10 (м, 2H), 1,84 (м, 2H), 1,60 (м, 1H), 1,35 (м, 3H).
Пример 235
Получение 1-циклогексил-2-[2-(2'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 544)
По методике получения соединения 366 и его последующей обработки соединение 365b (100 мг, 0,175 ммоль) подвергали взаимодействию с 2-фторфенилбороновой кислотой (37 мг, 0,2625 ммоль) с получением указанного в заголовке соединения (9 мг, выход: 25%).
МС: 572,26 (М+H+); H1-ЯМР (ДМСО-d6): 8,40 (м, 2H), 8,34 (м, 1H), 8,24 (д, 1H, J=8,7), 8,17 (д, 1H, J=9), 8,04 (м, 2H), 7,41 (м, 2H), 7,29 (м, 3H),7,20 (м, 2H), 7,03 (м, 1H), 4,43 (м, 1H), 3,90 (с, 3H), 3,55 (с, 1H), 2,30 (м, 2H), 2,10 (м, 2H), 1,84 (м, 2H), 1,61 (м, 1H), 1,35 (м, 3H).
Пример 236
Получение 2-(2-бифенил-4-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 548)
Стадия 1: 1-(4-Метокси-2'-метилбифен-2-ил)этанон (соединение 548а)
По методике получения соединения 366 и его последующей обработки (без добавления гидроксида калия) 2-бром-5-метоксиацетофенон (80 мг, 0,35 ммоль) подвергали взаимодействию с о-толилбороновой кислотой (71 мг, 0,525 ммоль) с получением указанного в заголовке промежуточного продукта (42 мг, выход: 50%). ВЭЖХ Методика С, время удержания=2,84 мин.
Стадия 2: 2-(2-бифенил-4-илхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 562)
По методике получения соединения 354 и его последующей обработки соединение 5 (68 мг, 0,17 ммоль) подвергали взаимодействию с соединением 548а (42 мг, 0,17 ммоль) в этаноле (3 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль) с получением 29 мг указанного в заголовке соединения. Выход: 28%.
МС: 568,28 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,43 (д, 1H, J=1,8), 8,34 (м, 4H), 8,09 (м, 2H), 7,43 (д, 1H, J=2,4), 7,32 (д, 1H, J=8,4), 7,14 (м, 6H), 4,45 (м, 1H), 3,90 (с, 3H), 3,55 (с, 1H), 2,30 (м, 2H), 2,11 (м, 2H), 1,96 (с, 3H), 1,83 (м, 2H), 1,60 (м, 1H), 1,30 (м, 3H).
Пример 237
Получение 1-циклогексил-2-[2-(4,2'-диметоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 552)
Стадия 1: 1-(4,2'-Диметоксибифен-2-ил)этанон (соединение 552а)
По методике получения соединения 366 и его последующей обработки (без добавления гидроксида калия) 2-бром-5-метоксиацетофенон (80 мг, 0,35 ммоль) подвергали взаимодействию с 2-метоксифенилбороновой кислотой (80 мг, 0,525 ммоль) с получением указанного в заголовке соединения 552а (40 мг, выход: 48%). ВЭЖХ Методика С, время удержания=2,37 мин.
Стадия 2: 1-Циклогексил-2-[2-(4,2'-диметоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновая кислота (соединение 552)
По методике получения соединения 354 и его последующей обработки соединение 5 (68 мг, 0,17 ммоль) подвергали взаимодействию с соединением 552а (40 мг, 0,17 ммоль) в этаноле (3 мл) с использованием 10 мас./об.% КОН в этаноле (506 мкл, 0,64 ммоль) с получением указанного в заголовке соединения (12 мг, выход: 10%).
МС: 584,28 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,50 (м, 2H), 8,37 (м, 2H), 8,27 (д, 1H, J=9), 8,17 (м, 1H), 8,04 (м, 1H), 7,40 (м, 2H), 7,24 (м, 4H), 6,94 (м, 1H), 6,82 (д, 1H, J=8,4), 4,41 (м, 1H), 3,90 (с, 3H), 3,55 (с, 1H), 3,23 (с, 3H), 2,29 (м, 2H), 2,10 (м, 2H), 1,84 (м, 2H), 1,60 (м, 1H), 1,32 (м, 3H).
Пример 238
Получение 1-циклогексил-2-[2-(2-циклогексил-5-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 545)
Стадия 1: 1-(2-Циклогексил-5-метоксифенил)этанон (соединение 545а)
В 25 мл высушенную в пламени и наполненную аргоном колбу добавляли 2-бром-5-метоксиацетофенон (500 мг, 2,185 ммоль), Pd (Р(трет-Bu)3)2 (100 мг, 0,219 ммоль) и НМП (15 мл). Колбу закупоривали и при перемешивании добавляли по каплям бромид циклогексилцинка (5,5 мл, 0,5М в ТГФ). Реакционную смесь перемешивали при 90ºС в течение 20 часов. Затем реакционную смесь выпаривали досуха и очищали ОФ-ВЭЖХ с получением указанного в заголовке промежуточного продукта (50 мг, выход: 10%). ВЭЖХ Методика С, время удержания=3,12 мин.
Стадия 2: 1-циклогексил-2-[2-(2-циклогексил-5-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновая кислота (соединение 545)
По методике получения соединения 354 и его последующей обработки соединение 354е (86 мг, 0,22 ммоль) подвергали взаимодействию с соединением 545а (50 мг, 0,22 ммоль) в этаноле (3 мл) с использованием 10 мас./об.% КОН в этаноле (436 мкл, 0,66 ммоль) с получением указанного в заголовке соединения (26 мг, выход: 21%).
МС: 560,30 (М+H+); H1-ЯМР (ДМСО-d6): δ (м.д.) 8,78 (д, 1H, J=8,7), 8,59 (с, 1H), 8,31 (м, 3H), 8,17 (м, 1H), 8,04 (д, 1H, J=8,7), 7,85 (д, 1H, J=8,7),7,41 (д, 1H, J=8,7), 7,06 (м, 2H), 4,48 (м, 1H), 3,78 (с, 3H), 3,55 (м, 2H), 2,7 (м, 1H), 2,34 (м, 2H), 2,12 (м, 2H), 1,87-1,04 (м, 14H).
Пример 239
Получение 1-циклогексил-2-{2-[4'-фтор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 549)
Стадия 1: Сложный этиловый эфир 1-циклогексил-2-{2-[4'-фтор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 549а)
Смесь 200 мг (0,29 ммоль) соединения 419d, 62 мг (0,44 ммоль) 4-фторфенилбороной кислоты, 32 мг (0,029 ммоль) Pd(PPh3)4 и 2 мл насыщенного раствора NaHCO3 в 16 мл дегазированого МеОН нагревали при 90ºС в атмосфере аргона в течение ночи. Смесь выпаривали досуха, остаток переносили в CH2Cl2 и очищали на силикагеле с использованием в качестве элюента смеси CH2Cl2/МеОН с получением 197 мг оранжевого твердого вещества оранжевого цвета.
Стадия 2: 1-Циклогексил-2-{2-[4'-фтор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновая кислота (соединение 549)
Раствор 197 мг (0,30 ммоль) соединения 549а в 3,75 мл ТГФ, 3 мл МеОН и 0,75 мл 2н. NaOH перемешивали при комнатной температуре в течение ночи и затем нагревали при 50ºС течение 1,5 часа. После добавления 1,5 мл 1М HCl раствор выпаривали досуха и остаток очищали ВЭЖХ с получением 66 мг твердого соединения желтого цвета.
МС: 639,40 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.) 8,43-8,35 (м, 2H), 8,31-8,25 (м, 2H), 8,11 (дд, 1H, J=9 Гц и 1,8 Гц), 8,04 (дд, 1H, J=8,7 Гц и 1,5 Гц), 7,93 (д, 1H, J=1,5 Гц), 7,76 (дд, 1H, J=8,1 Гц и 1,8 Гц), 7,61-7,55 (м, 4H), 7,24 (м, 2H), 7,14 (м, 2H), 4,45 (м, 1H), 3,52 (м, 4H), 2,31 (м, 2H), 2,12 (м, 2H), 1,88 (м, 6H), 1,62 (м, 1H), 1,33 (м, 3H).
Пример 240
Получение 1-циклогексил-2-{2-[4'-метокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 561)
Стадия 1: Сложный этиловый эфир 1-циклогексил-2-{2-[4'-метокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 561а)
Получали с использованием метоксифенилбороновой кислоты вместо 4-фторфенилбороновой кислоты по методике получения соединения 549а.
Стадия 2: 1-Циклогексил-2-{2-[4'-метокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновая кислота (соединение 561)
Получали с использованием соединения 561а вместо соединения 549а по методике получения соединения 549.
МС: 651,32 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.): 8,35-8,27 (м, 3H), 8,15-8,05 (м, 2H), 7,96 (д, 1H, J=8,7 Гц), 8,90 (д, 1H, J=1,2 Гц), 7,73 (дд, 1H, J=7,8 Гц и 1,2 Гц), 7,55 (д, 2H, J=8,1 Гц), 7,15-7,11 (м, 3H), 6,86 (д, 2H, J=8,4 Гц), 4,43 (м, 1H), 3,72 (с, 3H), 3,52 (м, 4H), 2,31 (м, 2H), 2,07 (м, 2H), 1,87 (м, 6H), 1,62 (м, 1H), 1,33 (м, 3H).
Пример 241
Получение 2-[2-(4'-хлор-4-фторбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 563)
1-(2-Бром-5-фторфенил)этанон (868 мг, 4 ммоль) п-хлорфенилбороновую кислоту (768 мг, 1,2 экв.) и тетракис(трифенилфосфин)палладий (0) (473 мг, 0,1 экв.) растворяли в 25 мл толуола, 6 мл метанола и 2,5 мл насыщенного раствора бикарбоната натрия. После дегазации/обработки раствора ультразвуком закупоренный реакционный сосуд нагревали до 80ºС в течение ночи. Охлажденный раствор распределяли между этилацетатом и водой; водную фазу экстрагировали более двух раз этилацетатом и органические фракции объединяли, сушили сульфатом натрия и выпаривали. В результате хроматографии на силикагеле (смесь гексан/этилацетат 5:1) получали 1-(4'-хлор-4-фторбифен-2-ил)этанон (821 мг).
1-(4'-хлор-4-фторбифен-2-ил)этанон (62 мг, 0,25 ммоль) и сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (98 мг, 0,25 ммоль) растворяли в 500 мкл этанола и добавляли 500 мкл 10% этанольного раствора КОН. Реакционную смесь перемешивали при 75ºС в течение ночи. Реакционную смесь подкисляли 4н. хлористоводородной кислотой, экстрагировали три раза этилацетатом, органические экстракты сушили сульфатом натрия и затем выпаривали. В результате очистки ВЭЖХ с обращенной фазой получали 84 мг продукта.
МС: 576,20 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 8,27-8,35 (м, 3H), 8,18 (8д, 1H, J=8,8 Гц), 8,07 (д, 1H, J=8,5 Гц), 8,01 (дд, 1H, J=2,1 Гц, 8,8 Гц), 8,92 (дд, 1H, J=1,4 Гц, 8,5 Гц), 7,84 (дд, 1H, J=5,9 Гц, 8,5 Гц), 7,38-7,47 (м, 2H), 7,31-7,36 (м, 2H), 7,18-7,22 (м,2H), 7,15 (д, 1H, 8,5 Гц) 4,36-4,45 (м, 1H), 2,26-2,35 (м, 2H), 2,01-2,05 (м, 2H), 1,83-1,87 (м, 2H), 1,62-1,75 (м, 1Н), 1,28-1,43 (м, 3H).
Пример 242
Получение 2-[2-(4-амино-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 569)
1-(4'-хлор-4-нитробифен-2-ил)этанон (69 мг, 0,25 ммоль) и сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (98 мг, 0,25 ммоль) растворяли в 500 мкл этанола и добавляли 500 мкл 10% этанольного раствора КОН. Реакционную смесь перемешивали при 75ºС в течение 3-х дней. Реакционную смесь подкисляли 4н. хлористоводородной кислотой, экстрагировали три раза этилацетатом, органические экстракты сушили сульфатом натрия и затем выпаривали. В результате очистки ВЭЖХ с обращенной фазой получали 18 мг продукта.
МС: 563,22 (М+H+); H1-ЯМР (d6-ацетон): δ (м.д.) 8,51-8,59 (м, 2H), 8,12-8,34 (м, 5H), 7,90-7,99 (м, 1H), 7,73 (д, 1H, 8,5 Гц), 7,61-7,68 (м, 1H), 7,15-7,36 (м, 5H), 4,70-4,75 (м, 1H), 2,46-2,58 (м, 2H), 2,22-2,30 (м, 2H), 1,92-2,00 (м, 2H), 1,72-1,75 (м, 1H), 1,46-1,55 (м, 3H).
Пример 243
Получение 1-циклогексил-2-[2-(4,4'-дихлорбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 567)
Стадия 1: 1-(4'-Хлор-4-хлорбифен-2-ил)этанон (соединение 567а)
1-(2-Бром-5-хлорфенил)этанон (467 мг, 2 ммоль; синтезированный из 2-бром-5-хлорбензойной кислоты методикой, подобной методике примера 166), п-хлорфенилбороновую кислоту (384 мг, 1,2 экв.) и тетракис (трифенилфосфин)палладий (0) (237 мг, 0,1 экв.) растворяли в 12,5 мл толуола, 3 мл метанола и 1,3 мл насыщенного раствора бикарбоната натрия. После дегазации/обработки раствора ультразвуком закупоренный реакционный сосуд нагревали до 80ºС в течение ночи. Охлажденный раствор распределяли между этилацетатом и водой; водную фазу экстрагировали более двух раз этилацетатом и органические фракции объединяли, сушили сульфатом натрия и выпаривали. В результате хроматографии на силикагеле (смесь гексан/этилацетат 5:1) получали указанный в заголовке промежуточный продукт (438 мг).
Стадия 2: Указанное в заголовке соединение
1-(4'-Хлор-4-хлорбифен-2-ил)этанон (132 мг, 0,5 ммоль) и сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (98 мг, 0,25 ммоль) растворяли в 500 мкл этанола и добавляли 500 мкл 10% этанольного раствора КОН. Реакционную смесь перемешивали при 75ºС в течение ночи. Реакционную смесь подкисляли 4н. хлористоводородной кислотой, экстрагировали три раза этилацетатом, органические экстракты сушили сульфатом натрия и затем выпаривали. В результате очистки ВЭЖХ с обращенной фазой получали 132 мг продукта.
МС: 592,17 (М+H+); H1-ЯМР (d6-ацетон): δ (м.д.) 8,54-8,55 (м, 2H), 8,19-8,32 (м, 4H), 8,10 (дд, 1H, J=1,0 Гц, 8,5 Гц), 7,88 (д, 1H, 2,0 Гц), 7,62 (дд, 1H, J=2,3 Гц, 8,3 Гц), 7,55 (д, 1H, 8,2 Гц), 7,22-7,33 (м, 5H), 4,73-4,82 (м, 1H), 2,46-2,54 (м, 2H), 2,28-2,32 (м, 2H), 1,94-1,97 (м, 2H), 1,71-1,75 (м, 1H), 1,46-1,55 (м, 3H).
Пример 244
Получение 2-{2-[8-(4-хлорфенил)-3,4-дигидро-2Н-бензо[b][1,4]диоксепин-7-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 565)
Стадия 1: 1-[8-(4-хлорфенил)-3,4-дигидро-2Н-бензо[b][1,4]диоксепин-7-ил]этанон (соединение 565а)
1-(8-Бром-3,4-дигидро-2Н-бензо[b][1,4]диоксепин-7-ил)- (1,08 мг, 4 ммоль), п-хлорфенилбороновую кислоту (768 мг, 1,2 экв.) и тетракис(трифенилфосфин)палладий (0) (473 мг, 0,1 экв.) растворяли в 25 мл толуола, 6 мл метанола и 2,5 мл насыщенного раствора бикарбоната натрия. После дегазации/обработки раствора ультразвуком закупоренный реакционный сосуд нагревали до 80ºС в течение ночи. Охлажденный раствор распределяли между этилацетатом и водой; водную фазу экстрагировали более двух раз этилацетатом и органические фракции объединяли, сушили сульфатом натрия и выпаривали. Для очистки использовали хроматографию на силикагеле (смесь гексан/этилацетат 5:1).
Стадия 2: Указанное в заголовке соединение
1-[8-(4-хлорфенил)-3,4-дигидро-2Н-бензо[b][1,4]диоксепин-7-ил]этанон (76 мг, 0,25 ммоль) и сложный этиловый эфир 2-(4-амино-3-формилфенил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (98 мг, 0,25 ммоль) растворяли в 500 мкл этанола и добавляли 500 мкл 10% этанольного раствора КОН. Реакционную смесь перемешивали при 75ºС в течение ночи. Реакционную смесь подкисляли 4н. хлористоводородной кислотой, экстрагировали три раза этилацетатом, органические экстракты сушили сульфатом натрия и затем выпаривали. В результате очистки ВЭЖХ с обращенной фазой получали 132 мг указанного в заголовке соединения.
МС: 630,23 (М+H+); H1-ЯМР (d6-ДМСО): δ (м.д.) 8,27-8,32 (м, 3H), 8,17 (д, 1H, J=8,8 Гц), 8,07 (д, 1H, 8,5 Гц), 8,02 (дд, 1H, 1,8 Гц, 9,1 Гц), 7,41 (с, 1H), 7,29-7,32 (м, 2H), 7,09-7,15 (м, 4H), 4,36-4,45 (м, 1H), 4,22-4,30 (м, 2H), 2,26-2,34 (м, 2H), 2,17-2,21 (м, 2H), 2,01-2,05 (м, 2H), 1,83-1,86 (м, 2H), 1,62-1,75 (м, 1H), 1,28-1,35 (м, 3H).
Пример 245
Получение 2-[4-(2-трет-бутоксикарбониламиноэтиламино)-2-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 399)
В этой реакции использовали 51 мг (0,1 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты. Использованный нуклеофил представлял собой сложный трет-бутиловый эфир (2-аминоэтил)карбаминовой кислоты. Выход: 21 мг.
МС: 606,32 (М+H+); H1-ЯМР (CD3OD): δ (м.д.) 8,72 (с, 1Н), 8,45 (с, 1H), 8,04-8,27 (м, 6H), 7,68-7,76 (м, 4H), 7,33 (с, 1H), 4,36-4,45 (м, 1H), 3,81 (т, 2H, 5,6 Гц), 3,49 (т, 2H, 5,6 Гц), 2,42-2,48 (м, 2H), 2,14-2,16 (м, 2H), 1,96-2,99 (м, 2H), 1,74-1,80 (м, 1H), 1,35-1,45 (м, 3H), 1,25 (с, 9H).
Пример 246
Получение 1-циклогексил-2-(4-гидразино-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 466)
В этой реакции 102 мг (0,2 ммоль) сырого сложного этилового эфира 2-(4-хлор-2-фенилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты подвергали взаимодействию с гидразином в качестве нуклеофила по методике получения соединения 481. Выход: 3,7 мг.
МС: 478,20 (М+H+); H1-ЯМР (CD3OD): δ (м.д.) 8,74 (с, 1Н), 8,38-8,44 (м, 2H), 8,28-8,31 (м, 1H), 8,05-8,18 (м, 4H), 7,71-7,77 (м, 4H), 4,36-4,45 (м, 1H), 2,44-2,48 (м, 2H), 2,10-2,14 (м, 2H), 1,97-2,01 (м, 2H), 1,83-1,86 (м, 2H), 1,75-1,80 (м, 1H), 1,35-1,42 (м, 3H).
Пример 247
Получение 1-бензил-2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты (соединение 559)
Указанное в заголовке соединение получали из смолы 534а и бензиламина по методике, использованной для получения соединения 534.
МС (ESI) 596,19 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,45 (с, 1H), 8,35 (с, 1H), 8,26 (д, 1H, J=8,7 Гц), 8,17 (с, 2H), 7,95 (дд, 1H, J=1,5, 8,4 Гц), 7,72 (д, 1H, J=8,7 Гц), 7,45 (д, 1H, J=7,5 Гц), 7,32-7,26 (м, 6H), 7,18 (д, 2H, J=8,4 Гц), 7,10 (д, 2H, J=8,4 Гц), 7,04 (д, 2H, J=8,41 Гц), 5,81 (с, 2H), 3,87 (с, 3H).
Пример 248
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-бензоимидазол-4-карбоновой кислоты (соединение 572)
Стадия 1: Сложный этиловый эфир 2-циклогексиламино-3-нитробензойной кислоты
В раствор 2-хлор-3-нитробензойной кислоты (0,85 г, 4,22 ммоль) в безводном EtOH (50 мл) при комнатной температуре барботировали в течение 2-х часов сухой хлористый водород и затем смесь перемешивали при комнатной температуре в течение ночи. После выпаривания растворителя добавляли воду (100 мл) и осадки собирали фильтрацией и сушили с получением сложного этилового эфира 2-хлор-3-нитробензойной кислоты.
Сырой сложный этиловый эфир 2-хлор-3-нитробензойной кислоты растворяли в ацетонитриле (100 мл) и добавляли циклогексиламин (2,5 мл, 21,83 ммоль). Смесь кипятили с обратным холодильником при перемешивании в течение ночи. После выпаривания растворителя добавляли воду (100 мл) и осадки собирали фильтрацией и сушили с получением сложного этилового эфира 2-циклогексиламино-3-нитробензойной кислоты (1,168 г, 95%). МС: 293,16 (М+Н+).
Стадия 2: 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-бензоимидазол-4-карбоновой кислоты (соединение 572)
Сложный этиловый эфир 2-циклогексиламино-3-нитробензойной кислоты (0,165 г, 0,564 ммоль) получали гидрированием по методике (1), использованной для получения соединения 477d.
Амин подвергали взаимодействию с соединением 525с (0,23 г, 0,592 ммоль) в присутствии HBTU (0,135 г, 0,356 ммоль), после чего проводили циклизацию в АсОН по методике (2), использованной при получении соединения 477d. В результате разделения ОФ-ВЭЖХ (от 20% буфера В до 99% буфера В) получали указанное в заголовке соединение (36 мг, 11%).
МС: 588,23 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,38 (д, 1H, J=1,5 Гц), 8,35 (д, 1H, J=9,0 Гц), 8,21 (д, 1H, J=8,7 Гц), 8,08 (дд, 1H, J=1,5, 8,5 Гц), 7,95 (дд, 1H, J=1,1, 8,0 Гц), 7,77 (д, 1H, J=7,5 Гц), 7,53 (д, 1H, J=7,5 Гц), 7,46 (д, 1H, J=8,7 Гц), 7,36 (д, 1H, J=2,4 Гц), 7,29-7,25 (м, 2H), 7,22-7,19 (м, 2H), 7,10(д, 2H, J=8,1 Гц), 4,74-4,65 (м, 1H), 3,88 (с, 3H), 2,11-2,08 (м, 2H), 1,70-1,66 (м, 2H), 1,55-1,48 (м, 2H), 1,23-1,16 (м, 2H), 0,82-0,73-1,23 (м, 2H).
Пример 249
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(2-метилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты (соединение 556)
Указанное в заголовке соединение получали из смолы 534а и 2-метилциклопропиламина (смесь цис- и транс-) по методике, использованной для получения соединения 534. Полученный продукт представлял собой смесь цис- и транс-изомеров. МС: 602,24 (М+Н+).
Пример 250
Получение 2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-пиперидин-4-ил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 558)
Указанное в заголовке соединение получали из смолы 534а и сложного трет-бутилового эфира 4-аминоциклогексанкарбоновой кислоты по методике, использованной для получения соединения 534.
МС: 589,22 (М+Н+); 1H ЯМР (ДМСО-d6): δ (м.д.) 8,36 (д, 1H, J=8,7 Гц), 8,33-8,29 (м, 3H), 8,20 (д, 1H, J=8,7 Гц), 8,08 (дд, 2H, J=2,1, 8,7 Гц), 7,95 (дд, 1H, J=1,2, 8,4 Гц), 7,46 (д, 1H, J=8,4 Гц), 7,32-7,28 (м, 3H), 7,22-7,12 (м, 4H), 4,85 (м, 1H), 3,88 (с, 3H), 3,16-3,03 (м, 3H), 2,92-2,82 (м, 3H), 2,24-2,20 (м, 2H).
Пример 251
Получение 1-циклогексил-2-{2-[5-(пирролидин-1-карбонил)-2-тиофен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 400)
Стадия 1: 1-циклогексил-2-{2-[5-(пирролидин-1-карбонил)-2-тиофен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновая кислота (соединение 400а)
Получали с использованием 4-тиофенбороновой кислоты вместо 4-фторфенилбороновой кислоты по методике получения соединения 402а.
Стадия 2: 1-циклогексил-2-{2-[5-(пирролидин-1-карбонил)-2-тиофен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты (соединение 400)
Получали с использованием соединения 400а вместо соединения 402а по методике получения соединения 402.
МС: 627,25 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.): 8,52-8,49 (м, 2H), 8,38-8,29 (м, 3H), 8,16-8,04 (м, 2H), 7,81-7,69 (м, 3H), 7,54-7,44 (м, 2H), 7,00-6,93 (м, 2H), 4,40 (м, 1H), 3,51 (м, 4H), 2,30 (м, 2H), 2,15 (м, 2H), 1,87 (м, 6H), 1,62 (м, 1H), 1,38 (м, 3H).
Пример 252
Получение 2-{2-[4'-карбокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 453)
Стадия 1: Сложный этиловый эфир 2-{2-[4'-карбокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты (соединение 453а)
Получали с использованием 4-карбоксифенилбороновой кислоты вместо 4-фторфенилбороновой кислоты по методике получения соединения 549а.
Стадия 2: 2-{2-[4'-карбокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновая кислота (соединение 453)
Получали с использованием соединения 453а вместо соединения 549а по методике получения соединения 549.
МС: 665,26 (М+H+); 1H-ЯМР (ДМСО-d6): δ (м.д.): 8,47-8,28 (м, 6H), 8,14-8,06 (м, 2H), 7,97 (д, J=1,8 Гц), 7,85-7,78 (м, 2H), 7,68-7,62 (м, 2H), 7,34-7,26 (м, 2H), 4,47 (м, 1H), 3,39 (м, 4H), 2,47 (м, 2H), 2,12 (м, 2H), 1,88 (м, 6H), 1,62 (м, 1H), 1,34 (м, 3H).
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ
Пример А
Активность против гепатита С
Соединения могут показывать активность против гепатита С ингибированием полимеразы HCV, ингибированием других ферментов, необходимых в цикле репликации, или другими путями. Для оценки указанных активностей опубликован ряд анализов. Общий метод, оценивающий увеличение массы вируса HCV в культуре, раскрыт в патенте США №5738985, выданном Miles et al. Об анализах in vitro сообщалось в: Ferrari et al. Jnl. of Vir., 73: 1649-1654, 1999; Ishii et al., Hepatology, 29: 1227-1235, 1999; Lohmann et al., Jnl. of Bio. Chem., 274: 10807-10815, 1999; и Yamashita et al., Jnl. of Bio. Chem., 273: 15479-15486, 1998.
В заявке WO 97/12033, поданной 27 сентября 1996 г. Emory University, где в качестве авторов-изобретателей перечислены C. Hagedorn и A. Reinoldus, которая притязает на приоритет заявки U.S.S. N. 60/004383, поданной в сентябре 1995 г., описывается анализ полимеразы HCV, который может быть использован для оценки активности раскрытых в ней соединений. О другом анализе полимеразы HCV сообщалось в: Bartholomeusz, et al., Hepatitus C Virus (HCV) RNA polymerase assay using cloned HCV non-structural proteins; Antiviral Therapy 1996:1 (Supp 4) 18-24.
Исследования, в которых измеряют уменьшение активности киназы в результате действия лекарственных средств против HCV, раскрыты в патенте США № 6030785 Katze et al. патенте США Delvecchio et al., и патенте США № 5759795 Jubin et al. Исследования, в которых измеряют ингибирующую активность предложенных против HCV лекарственных средств в отношении протеазы, раскрыты в патенте США № 5861267 Su et al., патенте США № 5739002 De Francesco et al. и патенте США № 5597691 Houghton et al.
Пример В
Анализ репликона
Для исследования соединений настоящего изобретения на их способность ингибировать репликацию вируса HVC использовали линию клеток ЕТ (Huh-lucubineo-ET). Линию клеток ЕТ стабильно подвергали трансфекции РНК транскриптами, укрывающими I389-luc-ubi-neo/NS3-3'/ET репликон со слитым белком люцифераза-убихитин-неомицинфосфотрансфераза светляка и стимулированным EMCV-IRES NS3-5B полипротеином, содержащим адаптивные мутации культуры клеток (E1202G; T12801; K1846T) (Krieger et al, 2001 и неопубликованные). Клетки ЕТ выращивали в DMEM, дополненной 10% фетальной телячьей сывороткой, 2 мМ глутамина, смесью пенициллин (100 IU/мл)/стрептомицин (100 мкг/мл), 1× заменимыми аминокислотами и 250 мкг/мл G418 («Генетицин»). Все они доступны от Life Technologies (Bethesda, MD). Клетки высевали в 96-луночные планшеты, высевая при этом 0,5-1,0×104 клеток/лунку, и инкубировали в течение 24-х часов перед добавлением тестируемых соединений. Затем к клеткам прибавляли каждое из соединений с концентрацией 5 и 50 мкМ. Активность люциферазы измеряли через 48-72 часа добавлением лизирующего буфера и субстрата (номер в каталоге Glo-лизирующего буфера Е2661 и системы Bright-Glo люцифераза Е2620 Promega, Madison, WI). Клетки не должны были быть слишком слитыми во время анализа. Процент ингибирования репликации определяли графически относительно контрольного соединения. При таких же условиях определяли цитотоксичность соединений с использованием реагента для пролиферации клеток WST-1 (Roche, Германия). Для определения IC50 и TC50 выбирали соединения, показывающие противовирусные активности, но не показывающие значительные цитотоксичности.
Пример С
Клонирование и экспрессия рекомбинанта HCV-NS5b
Последовательность кодирования в NS5b белке клонировали PCR от pFKI389 luc/NS3-3'/ET, как описано Lohmann, V., et al. (1999) Science 285, 110-113, с использованием следующих праймеров:
aggacatggatccgcggggtcgggcacgagacag (последов. идентиф. № 1)
aaggctggcatgcactcaatgtcctacacatggac (последов. идентиф. № 2)
Клонированный фрагмент не содержал остатков С-концевой 21 аминокислоты. Клонированный фрагмент внедряли в IPTG-индуцируемую экспрессионную плазмиду, которая обеспечивала эпитопную метку (His)6 в концевой карбоксильной группе белка.
Рекомбинантный фермент экспрессировали в XL-1 клетках и после индуцирования экспрессии белок очищали с использованием аффинной хроматографии в колонке с никель-NTA. Условия хранения: 10 мМ Трис-HCl pH 7,5, 50 мМ NaCl, 0,1 мМ EDTA, 1 мМ DTT, 20% глицерин при -20ºС.
Пример D
Анализ фермента HCV-NS5b
Активность полимеразы оценивали измерением включения меченного радиоактивным изотопом UTP в РНК-продукт с использованием биотинилированной гетерополимерной матрицы, которая включала часть генома HCV. Смесь для анализа (50 мкл) содержала обычно 10 мМ Трис-HCl (рН 7,5), 5 мМ MgCl2, 0,2 мМ EDTA, 10 мМ KCl, 1 ед./мкл РНК sin, 1 мМ DTT, 10 мкМ каждого из NTP, включая [3H]-UTP, и 10 нг/мкл гетерополимерной матрицы. Тестируемые соединения сначала растворяли в 100% ДМСО и затем разбавляли в водном буфере, содержащем 5% ДМСО. Соединения обычно тестировали при концентрациях между 1 нМ и 100 мкМ. Реакции инициировали добавлением фермента и давали им возможность продолжаться при 37ºС в течение 2-х часов. Реакции гасили 8 мкл 100 мМ EDTA и реакционные смеси (30 мкл) переносили в пластины микротитровального планшета (FlashPlates), покрытые стрептавидином вблизи сцинтилляции, и инкубировали при 4ºС в течение ночи. Включение радиоактивности определяли сцинтилляционным счетчиком.
Ниже в таблице IX показаны значения ингибирования фермента, определенные при концентрациях соединения 100 и 33 мкМ (% ингибирования при 100 и % ингибирования при 33 соответственно). Значения процента ингибирования рассчитывали исходя из дифференциального включения радиоактивности по сравнению с контрольной реакцией без соединения:
% ингибирования=100-[(countsINH-countsBKG)/(countsCTRL-countsBKG)]×100,
где countsINH представляет собой импульс тестируемой лунки с ингибитором, countsBKG представляет собой фоновый импульс и countsCTRL представляет собой импульс тестируемой лунки без ингибитора.
Примеры препаратов
Ниже представлены типичные фармацевтические препараты, содержащие соединение формулы I.
Пример 1 препарата
Таблеточный препарат
Следующие ингредиенты однородно смешивали и прессовали в таблетки с одной зарубкой.
Пример 2
Капсульный препарат
Следующие ингредиенты однородно смешивали и загружали в желатиновую капсулу с твердой оболочкой.
Пример 3 препарата
Препарат в форме суспензии
Следующие ингредиенты смешивали с образованием суспензии для перорального введения.
Пример 4 препарата
Инъецируемый препарат
Следующие ингредиенты смешивали с образованием инъецируемого препарата.
Пример 5 препарата
Препарат в форме суппозитория
Суппозиторий общей массой 2,5 г получали смешиванием соединения изобретения с Witepsol® H-15 (триглицериды насыщенной природной жирной кислоты; Riches-Nelson, Inc., New York), он имеет следующий состав:
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗОТСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛА | 2004 |
|
RU2375350C2 |
| КОНДЕНСИРОВАННОЕ ХИНОЛИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2384571C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, МОДЕЛИРУЮЩИЕ АКТИВНОСТЬ ХЕМОКИНОВОГО РЕЦЕПТОРА, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2297413C2 |
| ПИРАЗОЛХИНОЛИНЫ С ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2003 |
|
RU2328496C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ РАЦЕМИЧЕСКОГО АМИНОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА ИЛИ РАЦЕМИЧЕСКОГО АМИНОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОИЗОХИНОЛИНА, СПОСОБЫ ИХ РАЗДЕЛЕНИЯ И РАЦЕМИЗАЦИИ, СПОСОБ ПОЛУЧЕНИЯ КЕТОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА ИЛИ КЕТОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОИЗОХИНОЛИНА, СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРА КОНДЕНСИРОВАННОГО БИЦИКЛИЧЕСКОГО КОЛЬЦА, ЗАМЕЩЕННОГО ПЕРВИЧНЫМ АМИНОМ, ПРОИЗВОДНЫЕ 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА | 2002 |
|
RU2308451C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ IRAK И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2743360C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИМИДАЗО[4,5-с]ПИРИДИНА, В КАЧЕСТВЕ АНТАГОНИСТА ПУТИ HEDGEHOG | 2010 |
|
RU2533825C2 |
| БЕНЗОИМИДАЗОЛЫ КАК ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ | 2009 |
|
RU2531354C2 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЙ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2290179C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2289581C2 |
Настоящее изобретение относится к новым бициклическим производным имидазола, имеющим общую формулу I, в которой: W является СН или N; R выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (C1-С10)алкила, (С3-С10)циклоалкила и замещенного (С3-С10)циклоалкила; Z выбран из группы, состоящей из a) -C(=O)OR7, где R7 выбран из группы, состоящей из водорода и алкила; в) -C(=O)NR8R9, где R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, арила, замещенного арила, гетероциклической группы или, альтернативно, R8 и R9, вместе с атомом азота, к которому они присоединены, образуют гетероциклическую группу или замещенную гетероциклическую группу; с) тетразолила; Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, которые необязательно замещены (Y)q; при условии что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным; каждый Y независимо выбран из группы, состоящей из галогена, (C1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила, замещенного (С3-С10)циклоалкила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -CO2R7, -NR14R15, -NHNR14R15, -C(=O)NR14R15, -OR14, -SR14; где R7 является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (С1-С10)алкила, арила, замещенного арила; n представляет собой целое число, равное 0, 1 или 2; q представляет собой целое число, равное 1, 2 или 3; где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо-карбонильных групп; и его фармацевтически приемлемые соли или таутомеры. Кроме того, настоящее изобретение относится к соединениям, имеющим общие формулы II-VIII, XI и XII, к фармацевтической композиции на основе соединений имеющих общие формулы I-VIII, XI и XII, а также к способу лечения вирусной инфекции млекопитающего, опосредованной частично вирусом из семейства вирусов Flaviviridae с использованием указанной фармацевтической композиции. Технический результат: получены новые соединения, обладающие полезной биологической активностью. 13 н. и 69 з.п. ф-лы, 9 табл.
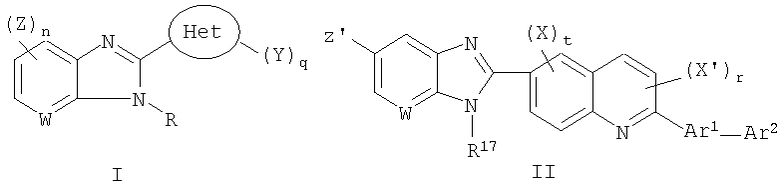
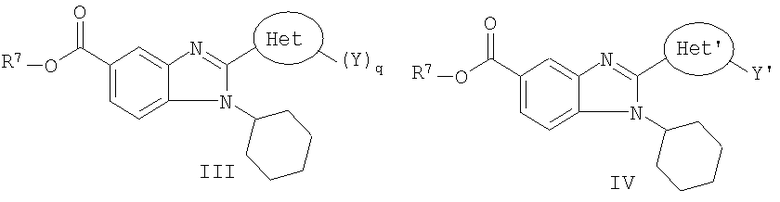
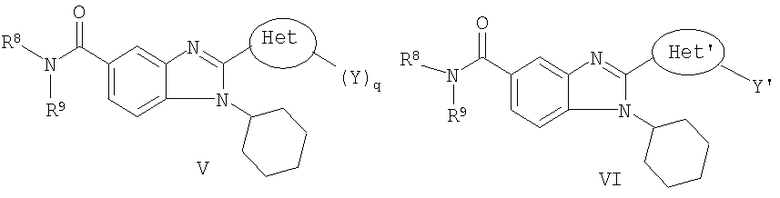
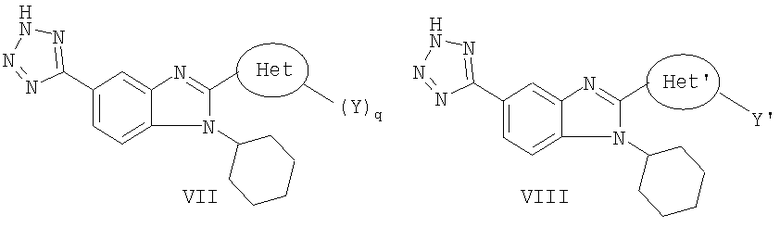
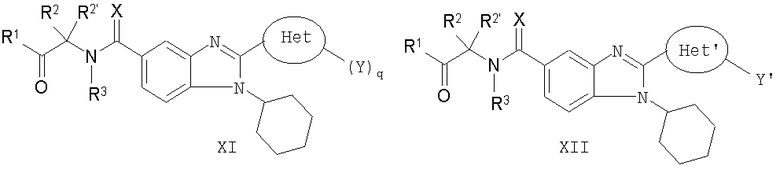
1. Соединение формулы I
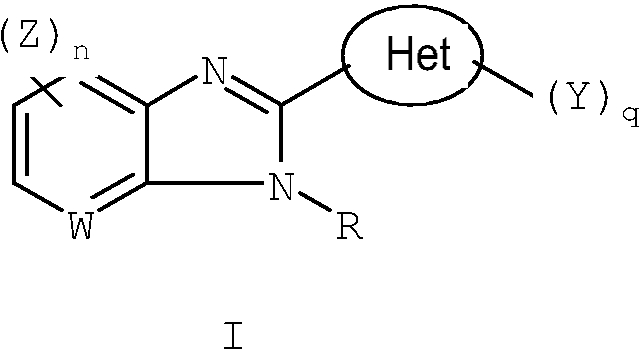
в которой W является СН или N;
R выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила и замещенного (С3-С10)циклоалкила;
Z выбран из группы, состоящей из
a) -C(=O)OR7, где R7 выбран из группы, состоящей из водорода и алкила;
в) -C(=O)NR8R9, где R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, арила, замещенного арила, гетероциклической группы или, альтернативно, R8 и R9, вместе с атомом азота, к которому они присоединены, образуют гетероциклическую группу или замещенную гетероциклическую группу;
с) тетразолила;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильногоциклов, которые необязательно замещены (Y)q; при условии, что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным;
каждый Y независимо выбран из группы, состоящей из галогена, (C1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила, замещенного (С3-С10)циклоалкила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -CO2R7, -NR14R15,
-NHNR14R15, -C(=O)NR14R15, -OR14, -SR14;
где R7 является таким, как он определен выше, и каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (С1-С10)алкила, арила, замещенного арила;
n представляет собой целое число, равное 0, 1 или 2;
q представляет собой целое число, равное 1, 2 или 3;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп;
и его фармацевтически приемлемые соли или таутомеры.
2. Соединение по п.1, в котором n равно единице.
3. Соединение по п.2, в котором Z представляет собой 1Н-тетразол-5-ил или -COOR7.
4. Соединение по п.2, в котором Z выбран из группы, состоящей из 1Н-тетразол-5-ила, -С(=O)ОН и -C(=O)OR'', где R'' является (С1-С6)алкилом.
5. Соединение по п.4, где Z выбран из группы, состоящей из карбокси, метилкарбоксилата, этилкарбоксилата и 1H-тетразол-5-ила.
6. Соединение по п.5, в котором Z является карбокси.
7. Соединение по п.2, в котором Z является -C(=O)NR8R9.
8. Соединение по п.7, в котором R8 представляет собой водород и R9 выбран из группы, состоящей из алкила, арила, замещенного арила и гетероциклической группы.
9. Соединение по п.7, в котором R9 представляет собой арил или замещенный арил.
10. Соединение по п.9, в котором R9 представляет собой замещенный арил.
11. Соединение по п.10, в котором R9 выбран из группы, состоящей из 7-гидроксинафт-1-ила, 6-гидроксинафт-1-ила, 5-гидроксинафт-1-ила, 4-метил-2-оксо-2Н-хромен-7-ила, 6-карбоксинафт-2-ила, (4-НООССН2-) фенила, (3,4-дикарбокси)фенила, 3-карбоксифенила и 3-карбокси-4-гидроксифенила.
12. Соединение по п.8, в котором R9 представляет собой гетероциклическую группу.
13. Соединение по п.12, в котором гетероциклическая группа представляет собой N-морфолино.
14. Соединение по п.7, в котором R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое или замещенное гетероциклическое кольцо.
15. Соединение по п.14, в котором гетероциклические и замещенные гетероциклические кольца включают 4-8-членные кольца, содержащие 1-2 гетероатома.
16. Соединение по п.15, в котором указанные 1-2 гетероатома включают 1-2 атома азота.
17. Соединение по п.15, в котором гетероциклическое или замещенное гетероциклическое кольцо выбрано из группы, состоящей из пиперидина, замещенного пиперидина, пиперазина, замещенного пиперазина, морфолино, замещенного морфолино, замещенного морфолино.
18. Соединение по п.17, в котором гетероциклическое или замещенное гетероциклическое кольцо выбрано из группы, состоящей из 4-гидроксипиперидин-1-ила, 1,2,3,4-тетрагидро-3-карбоксиизохинолин-2-ила, 4-метилпиперизин-1-ила, морфолин-4-ила и тиоморфолин-4-ила.
19. Соединение по п.1, в котором R выбран из группы, состоящей из водорода,
(С1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила и замещенного (С3-С10)циклоалкила.
20. Соединение по п.19, в котором R выбран из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила и замещенного циклоалкила.
21. Соединение по п.20, в котором R выбран из группы, состоящей из водорода, этила, изопропила, втор-бутила, 3-метил-н-бутила, циклопропила, циклопентила, циклогексила, циклопропилметила, 2-(N,N-диметиламино)эт-1-ила.
22. Соединение по п.21, в котором R представляет собой циклогексил.
23. Соединение по п.1, в котором W является N.
24. Соединение по п.1, в котором W является СН.
25. Соединение по п.1, в котором гетероциклическое или гетероарильное кольцо Het группы представляет собой азотсодержащее гетероциклическое или гетероарильное кольцо.
26. Соединение по п.25, в котором Het группа содержит от 1 до 2 циклических атомов азота и необязательно 1 циклический гетероатом, выбранных из -O-.
27. Соединение по п.26, в котором Het группа выбрана из группы, состоящей из хинолинила, изохинолинила, хиноксалинила, хиназолинила, циннолинила, [1,8]нафтиридинила, [1,5]нафтиридинила, 1,2,3,4-тетрагидрохинолинила, 1,4-диоксо-1,4-дигидрофталазинила, 4-оксо-1,4-дигидрохинолинила, 4-оксо-1,4-дигидрохиназолинила, 1,1-диоксо-1,4-дигидро-1л6-бензо-[1,2,4]тиадиазинила и 1,4-дигидроизохинолинила.
28. Соединение по п.27, в котором Het группа выбрана из группы, состоящей из хинолин-6-ила, изохинолин-6-ила, хинолин-7-ила, хиноксалин-6-ила, хиназолин-7-ила, циннолин-3-ила, [1,8]нафтиридин-3-ила, [1,5]нафтиридин-2-ила, 1,2,3,4-тетрагидрохинолин-6-ила, 1,4-диоксо-1,4-дигидрофталазин-6-ила, 4-оксо-1,4-дигидрохинолин-6-ила, 4-оксо-1,4-дигидрохиназолин-6-ила, 1,1-диоксо-1,4-дигидро-1л6-бензо [1,2,4]тиадиазин-7-ила и 1,4-дигидроизохинолин-6-ила.
29. Соединение по п.1, в котором гетероциклическое или гетероарильное кольцо Het группы представляет собой кислородсодержащее гетероциклическое или гетероарильное кольцо.
30. Соединение по п.31, в котором Het группа содержит 1-2 циклических атома кислорода.
31. Соединение по п.29, в котором Het группа выбрана из группы, состоящей из 2-оксо-2Н-хроменила, 4-оксо-2Н-хроменила и 4-оксо-4Н-хромен-6-ила.
32. Соединение по п.31, в котором Het группа выбрана из группы, состоящей из 2-оксо-2Н-хромен-7-ила, 4-оксо-2Н-хромен-6-ила, 4-оксо-2Н-хромен-7-ила и 4-оксо-4Н-хромен-6-ила.
33. Соединение по п.1, в котором Y выбран из группы, состоящей из (С1-С10)алкила, замещенного (С1-С10)алкила, амино, замещенного амино, арила, замещенного арила, циклоалкила, замещенного циклоалкила, галогена, гетероарила, замещенного гетероарила, замещенной гетероциклической группы, -OR14 и -SR14.
34. Соединение по п.33, в котором, по меньшей мере, один Y выбран из группы, состоящей из аминозамещенного амино(гидразин)а и моно- и дизамещенных аминогрупп.
35. Соединение по п.34, в котором Y представляет собой монозамещенную аминогруппу, выбранную из группы, состоящей из алкиламино, замещенного алкиламино, ариламино, замещенного ариламино.
36. Соединение по п.34, в котором Y представляет собой дизамещенную аминогруппу, в которой каждый заместитель независимо выбран из алкильной, замещенной алкильной, арильной и замещенной арильной групп.
37. Соединение по п.34, в котором Y выбран из группы, состоящей из амино, фениламино, [2-(трет-бутоксикарбониламиноэтил]амино, N-(4-хлорфенил)амино, N,N-диметиламино, 4-гидроксибутиламино, 3-имидазол-1-ил-пропиламино и гидразино.
38. Соединение по п.33, в котором, по меньшей мере, один Y выбран из группы, состоящей из (С1-С10)алкила, замещенного (С1-С10)алкила, циклоалкила и замещенного циклоалкила.
39. Соединение по п.38, в котором заместители для замещенной (C1-С10)алкильной группы выбраны из группы, состоящей из гидрокси, амино, замещенного амино, арила, замещенного арила, гетероарила и замещенного гетероарила.
40. Соединение по п.38, в котором заместители для замещенной циклоалкильной группы независимо выбраны из группы, состоящей из карбоксиметила и метила.
41. Соединение по п.39, в котором Y выбран из группы, состоящей из метила, 3-гидроксипропила, (N,N-ди-н-пропил)аминометила, дифенилметил(бензгидрила), 2-(пиразол-1-ил)эт-1-ила и 3-карбоксиметил-2,2-диметилциклобутила.
42. Соединение по п.33, в котором, по меньшей мере, один Y выбран из группы, состоящей из галогена, циано, нитро, карбокси и группы сложных эфиров карбоновой кислоты.
43. Соединение по п.33, в котором, по меньшей мере, один Y представляет собой -C(O)NR14R15, где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, арила и замещенного арила.
44. Соединение по п.43, в котором заместители в замещенном алкиле и замещенном ариле выбраны из группы, состоящей из галогена, гидрокси и карбамоила.
45. Соединение по п.44, в котором Y выбран из группы, состоящей из 1-карбамоилэтилкарбамоила, 1-карбамоил-2-(1Н-имидазол-2-ил)этилкарбамоила, 1-карбамоил-2-гидроксиэтилкарбамоила, 1-карбамоил-2-метилпропилкарбамоила, 4-хлорфенилкарбамоила и пирролидин-1-илкарбонила.
46. Соединение по п.33, в котором, по меньшей мере, один Y представляет собой арильную группу.
47. Соединение по п.46, в котором Y выбран из группы, состоящей из фенила, нафталин-1-ила и 5,6,7,8-тетрагидронафталин-2-ила.
48. Соединение по п.33, в котором, по меньшей мере, один Y представляет собой замещенную арильную группу.
49. Соединение по п.48, в котором замещенная арильная группа замещена неарильными группами.
50. Соединение по п.48, в котором замещенная арильная группа замещена заместителем, выбранным из группы, состоящей из ациламино, амино, замещенного амино, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, алкокси, замещенного алкокси, арилокси, замещенного арилокси, галогена, гетероциклической группы, замещенной гетероциклической группы, гидрокси, нитро и -C(O)NR14R15, где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, арила и замещенного арила, или где R14 и R15 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую и замещенную гетероциклическую группу.
51. Соединение по п.50, в котором замещенная арильная Y группа выбрана из группы, состоящей из 4-ацетиламинофенила, 4-аминофенила, 4-амино-3-бромфенила, 4-амино-3,5-дихлорфенила, 4-бензилокси-2-гидрокси-3-метилфенила, 2-бромфенила, 3-бромфенила, 4-бромфенила, 5-бром-2-гидроксифенила, 3-карбамоил-4-гидроксифенила, 3-карбоксиметоксифенила, 3,4-дихлорфенила, 2,4-дигидроксифенила, 3,5-дигидроксифенила, 4-(N,N-диметиламино)фенила, 4-фторфенила, 2-фуран-2-ил-5-метоксифенила, 3-гидроксифенила, 2-гидрокси-4,6-диметоксифенила, 2-гидроксинафталин-1-ила, 2-гидрокси-6-метоксифенила, 2-гидрокси-5-метил-3-нитрофенила, 4-(имидазол-1-ил)фенила, 3-(2-метоксиэтокси)фенила, 2-метокси-5-нитрофенила, 3-метоксифенила, 4-метоксифенила, 5-метокси-2-тиофен-2-илфенила, 4-метилфенила, 4-морфолинофенила, 6-метилнафталин-2-ила, 2-нитрофенила, 3-(2-оксо-2-пирролидин-1-илэтокси)фенила, 4-феноксифенила, (4-пиперазин-1-ил)фенила, 3-[пирролидин-1-илкарбонил] фенила, 3-[3-пирролидин-1-илпропокси] фенила, 2-(2,4-диметоксипиримидин-5 -ил)-4-метоксифенила и 2-(пирид-4-ил)фенила.
52. Соединение по п.48, в котором замещенный арил замещен одной или двумя арильными или замещенными арильными группами, причем замещенная арильная группа необязательно дополнительно замещена в одном из ее арильных колец 1-3 заместителями, выбранными из группы, состоящей из ациламино, амино, замещенного амино, алкила, замещенного алкила, алкокси, замещенного алкокси, арила, замещенного арила, арилокси, замещенного арилокси, галогена, гетероциклической группы, замещенной гетероциклической группы, гетероарила, замещенного гетероарила, гидрокси, нитро и -C(O)NR14R15, где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, арила и замещенного арила, или где R14 и R15 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую и замещенную гетероциклическую группу.
53. Соединение по п.52, в котором замещенные арильные Y группы выбраны из группы, состоящей из бифен-2-ила, бифен-4-ила, 4-амино-4'-хлорбифен-2-ила, 4'-аминометил-4-метоксибифен-2-ила, 4-карбамоил-4'-метоксибифен-2-ила, 4-(карбамоилметилкарбамоил)бифен-2-ила, 4-(карбамоилметилкарбамоил)-4'-хлорбифен-2-ила, 4-карбамоил-4'-фторбифен-2-ила, 4-карбамоил-4'-нитробифен-2-ила, 4-карбамоил-4'-метоксибифен-2-ила, 4-карбокси-4'-хлорбифен-2-ила, 3-карбокси-4'-метоксибифен-2-ила, 4-карбокси-4'-метоксибифен-2-ила, 4'-карбокси-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4-карбоксиметоксибифен-2-ила, 4-карбоксиметокси-4'-хлорбифен-2-ила, 4'-хлорбифен-2-ила, 4'-хлор-4-хлорбифен-2-ила, 4'-хлор-4-(диметиламиноэтилкарбамоил)бифен-2-ила, 4'-хлор-4-(2-этоксиэтокси)бифен-2-ила, 3'-хлор-4'-фтор-4-метоксибифен-2-ила, 4'-хлор-4-фторбифен-2-ила, 4'-хлор-4-гидроксибифен-2-ила, 3'-хлор-4-метоксибифен-2-ила, 4'-хлор-4-метилкарбамоилбифен-2-ила, 4'-хлор-4-метоксибифен-2-ила, 4'-хлор-4-(2-метоксиэтокси)бифен-2-ила, 4'-хлор-4-нитробифен-2-ила, 4'-хлор-4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ила, 4'-хлор-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4'-хлор-4-(3-пирролидин-1-илпропокси)бифен-2-ила, 4'-циано-4-метоксибифен-2-ила, 3',4'-дихлор-4-метоксибифен-2-ила, 4,4'-диметоксибифен-2-ила, 3',4'-диметокси-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4'-диметиламино-4-метоксибифен-2-ила, 4-(2-диметиламиноэтилкарбамоил)бифен-2-ила, 4'-этокси-4-метоксибифен-2-ила, 4'-фтор-4-метоксибифен-2-ила, 4-гидроксибифенила, 4-метоксибифенила, 4-метокси-4'-гидроксибифен-2-ила, 4-(2-метоксиэтокси)бифен-2-ила, 4-метокси-4'-метилбифен-2-ила, 4-метокси-3'-нитробифен-2-ила, 4-метокси-4'-нитробифен-2-ила, 4-метилкарбамоилбифен-2-ила, 3'-метил-4-метоксибифен-2-ила, 4'-нитро-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ила, 4-(3-пирролидин-1-илпропокси)бифен-2-ила и 4'-трифторметил-4-метоксибифен-2-ила.
54. Соединение по п.33, в котором, по меньшей мере, один Y представляет собой гетероарильную группу.
55. Соединение по п.54, в котором Y группы выбраны из группы, состоящей из бензо[1,3]диоксол-5-ила, бензофуран-2-ила, 2,3-дигидробензофуран-5-ила, пиразин-2-ила, пирид-2-ила, пирид-3-ила, пирид-4-ила, 1Н-пиррол-2-ила, 1H-пиррол-3-ила, хинолин-4-ила, 3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ила и тиен-2-ила.
56. Соединение по п.33, в котором по меньшей мере, один Y представляет собой замещенную гетероарильную группу.
57. Соединение по п.56, в котором заместители в указанной замещенной гетероарильной группе выбраны из группы, состоящей из амино, замещенного амино, алкила, замещенного алкила, арила, замещенного арила, алкокси, замещенного алкокси, галогена, гетероарила, замещенного гетероарила, гидрокси, нитро и циано.
58. Соединение по п.57, в котором замещенная гетероарильная Y группа выбрана из группы, состоящей из 2-амино-4-метилтиазол-5-ила, 3-амино-5-фенилтиофен-2-ила, 5-бензилокси-2-метилбензофуран-3-ила, 7-бром-5-метоксибензофуран-2-ила, 6-хлор-9-метил-9Н-карбазол-3-ила, 5-(4-хлорфенил)-2-метилфуран-2-ила, 3-(4-хлорфенил)-5-метилизоксазол-4-ила, 2-(4-хлорфенил)-4-метилтиазол-5-ила, 1-(2-хлорпирид-3-ил)-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ила, 3-(3,4-дихлорфенил)изоксазол-5-ила, 7-гидроксибензофуран-2-ила, 5-метоксибензофуран-3-ила, 3,5-диметил-1-фенил-1Н-пиразол-4-ила, 2,4-диметилтиазол-5-ила, 5-метил-2-фенилтиофен-3-ила и 1-фенил-1Н-пиразол-4-ила.
59. Соединение по п.33, в котором, по меньшей мере, один Y выбран из группы, состоящей из алкокси, тиоалкокси, замещенного алкокси, замещенного тиоалкокси, арилокси и замещенного арилокси.
60. Соединение по п.59, в котором Y выбран из группы, состоящей из 2-хлор-4-(4-хлорфенил)фенокси, этокси, 7-гидроксинафталин-2-окси, фенокси и фенилсульфанила.
61. Соединение согласно формуле II
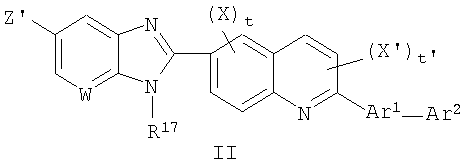
в которой W является СН или N;
Z' выбран из группы, состоящей из карбокси, группы сложного эфира карбоновой кислоты и тетразолила,
R17 выбран из группы, состоящей из циклоалкила, циклоалкила, замещенного 1-3 алкильными группами, гетероциклической группы;
Х и X' независимо выбраны из группы, состоящей из алкила, замещенного алкила, галогена;
Ar1 и Ar2 независимо выбраны из группы, состоящей из арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической и замещенной гетероциклической группы;
t представляет собой целое число, равное 0, 1 или 2; и
t' представляет собой целое число, равное 0 или 1,
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
и его фармацевтически приемлемые соли.
62. Соединение по п.61, в котором W представляет собой СН.
63. Соединение по п.62, в котором R17 представляет собой циклоалкил.
64. Соединение по п.63, в котором R17 представляет собой циклогексил.
65. Соединение по п.64, в котором -Ar1-Ar2- выбраны из группы, состоящей из -арил-арила, -арил-замещенного арила, -замещенный арил-арила и -замещенный арил-замещенного арила.
66. Соединение по п.63, в котором -Ar1-Ar2- выбраны из группы, состоящей из бифен-2-ила, бифен-4-ила, 4-амино-4'-хлорбифен-2-ила, 4'-аминометил-4-метоксибифен-2-ила, 4-карбамоил-4'-метоксибифен-2-ила, 4-карбамоил-4'-фторбифен-2-ила, 4-карбамоил-4'-метоксибифен-2-ила, 4-карбамоил-4'-нитробифен-2-ила, 4-(карбамоилметилкарбамоил)бифен-2-ила, 4-(карбамоилметилкарбамоил)-4' -хлорбифен-2-ила, 4-карбокси-4'-хлорбифен-2-ила, 3-карбокси-4'-метоксибифен-2-ила, 4-карбокси-4'-метоксибифен-2-ила, 4'-карбокси-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4-карбоксиметоксибифен-2-ила, 4-карбоксиметокси-4'-хлорбифен-2-ила, 4'-хлорбифен-2-ила, 4'-хлор-4-хлорбифен-2-ила, 4'-хлор-4-(диметиламиноэтилкарбамоил)бифен-2-ила, 4'-хлор-4-(2-этоксиэтокси)бифен-2-ила, 3'-хлор-4'-фтор-4-метоксибифен-2-ила, 4'-хлор-4-фторбифен-2-ила, 4'-хлор-4-гидроксибифен-2-ила, 3'-хлор-4-метоксибифен-2-ила, 4'-хлор-4-метилкарбамоилбифен-2-ила, 4'-хлор-4-метоксибифен-2-ила, 4'-хлор-4-(2-метоксиэтокси)бифен-2-ила, 4'-хлор-4-нитробифен-2-ила, 4'-хлор-4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ила, 4'-хлор-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4'-хлор-4-(3-пирролидин-1-илпропокси)бифен-2-ила, 4'-циано-4-метоксибифен-2-ила, 3',4'-дихлор-4-метоксибифен-2-ила, 4,4'-диметоксибифен-2-ила, 3',4'-диметокси-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4'-диметиламино-4-метоксибифен-2-ила, 4-(2-диметиламиноэтилкарбамоил)бифен-2-ила, 4'-этокси-4-метоксибифен-2-ила, 4'-фтор-4-метоксибифен-2-ила, 4-гидроксибифенила, 4-метоксибифенила, 4-метокси-4'-гидроксибифен-2-ила, 4-(2-метоксиэтокси)бифен-2-ила, 4-метокси-4'-метилбифен-2-ила, 4-метокси-3'-нитробифен-2-ила, 4-метокси-4'-нитробифен-2-ила, 4-метилкарбамоилбифен-2-ила, 3'-метил-4-метоксибифен-2-ила, 4'-нитро-4-(пирролидин-1-илкарбонил)бифен-2-ила, 4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ила, 4-(3-пирролидин-1-илпропокси)бифен-2-ила и 4'-трифторметил-4-метоксибифен-2-ила.
67. Соединение по п.61, в котором -Ar1-Ar2- выбраны из группы, состоящей из -арил-гетероарила, -арил-замещенного гетероарила, -замещенный арил-гетероарила, -замещенный арил-замещенного гетероарила, гетероарил-арила, гетероарил-замещенного арила, замещенный гетероарил-арила и замещенный гетероарил-замещенного арила.
68. Соединение по п.67, в котором -Ar1-Ar2- выбраны из группы, состоящей из 2-фуран-2-ил-5-метоксифенила, 4-(имидазол-1-ил)фенила, 5-метокси-2-тиофен-2-илфенила, 2-(2,4-диметоксипиримидин-5-ил)-4-метоксифенила, 2-(пирид-4-ил)-фенила, 3-амино-5-фенилтиофен-2-ила, 5-(4-хлорфенил)-2-метилфуран-2-ила, 3-(4-хлорфенил)-5-метилизоксазол-4-ила, 2-(4-хлорфенил)-4-метилтиазол-5-ила, 3-(3,4-дихлорфенил)изоксазол-5-ила, 3,5-диметил-1-фенил-1Н-пиразол-4-ила, 5-метил-2-фенилтиофен-3-ила и 1-фенил-1H-пиразол-4-ила.
69. Соединение по п.61, в котором -Ar1-Ar2- выбраны из группы, состоящей из -арил-гетероциклической группы, арил-замещенной гетероциклической группы, замещенный арил-гетероциклической группы и замещенный арил-замещенной гетероциклической группы.
70. Соединение по п.69, в котором -Ar1-Ar2- выбраны из группы, состоящей из (4-пиперазин-1-ил)фенила, 2-циклогексил-5-метоксифенила и 4-морфолинофенила.
71. Соединение формулы III
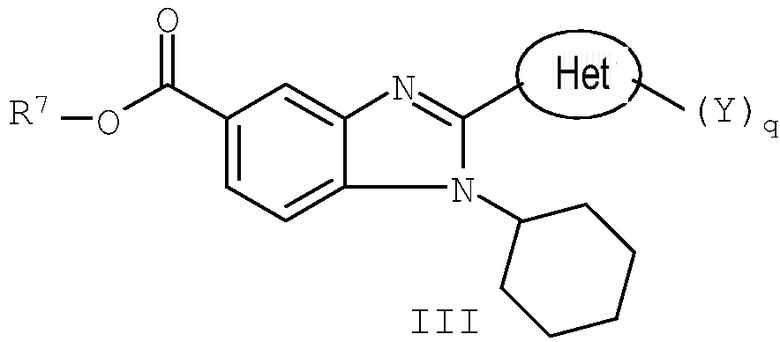
в которой R7 выбран из группы, состоящей из водорода, алкила;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии, что по меньшей мере один 6-членный цикл в бицикле является гетероциклическим или гетероарильным;
каждый Y независимо выбран из группы, состоящей из галогена, (С1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила, замещенного (С3-С10)циклоалкила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -NR14R15, -NHNR14R15, -C(=O)NR14R15, -OR14, -SR14;
где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (С1-С10)алкила, арила, замещенного арила;
q представляет собой целое число, равное 1, 2 или 3;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 карбонильных групп; и
и его фармацевтически приемлемые соли или таутомеры.
72. Соединение формулы IV
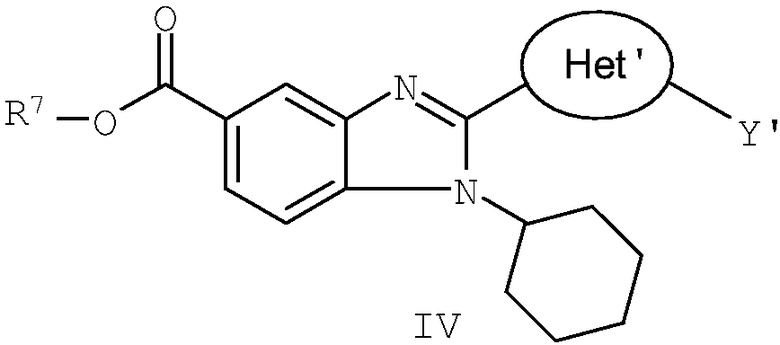
в которой R7 выбран из группы, состоящей из водорода и алкила;
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов; при условии, что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
и его фармацевтически приемлемые соли и/или таутомеры.
73. Соединение формулы V
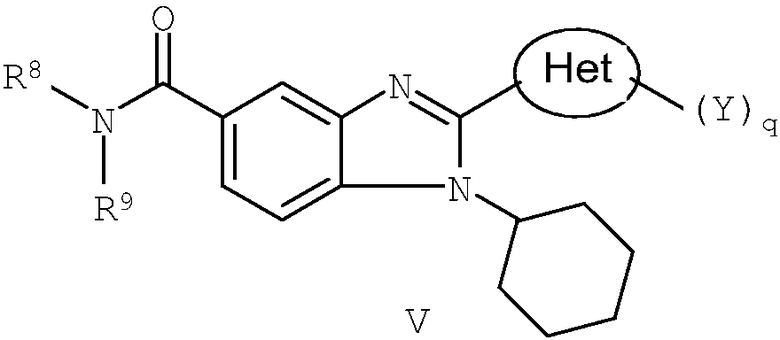
в которой R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической или, альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую, замещенную гетероциклическую, гетероарильную или замещенную гетероарильную циклическую группу;
Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии, что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным;
каждый Y независимо выбран из группы, состоящей из галогена, (C1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила, замещенного (С3-С10)циклоалкила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила и замещенного гетероарила, -NR14R15, -NHNR14R15, -C(=O)NR14R15, -OR14, -SR14;
где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (С1-С10)алкила, арила, замещенного арила;
q представляет собой целое число, равное 1, 2 или 3;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
его фармацевтически приемлемые соли или таутомеры.
74. Соединение формулы VI
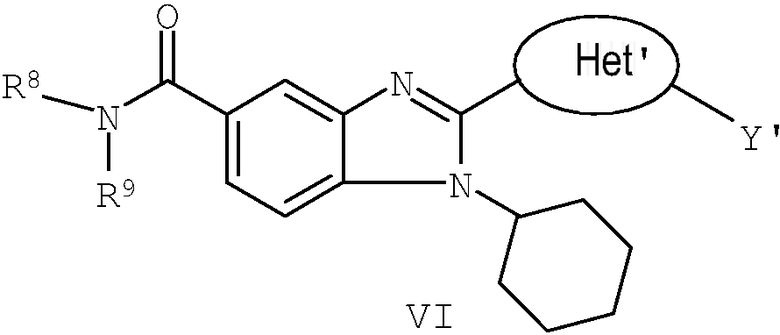
в которой R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклической группы и замещенной гетероциклической группы или, альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую, замещенную гетероциклическую, гетероарильную или замещенную гетероарильную циклическую группу;
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов; при условии, что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклом или гетероарилом;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
его фармацевтически приемлемые соли или таутомеры.
75. Соединение формулы VII
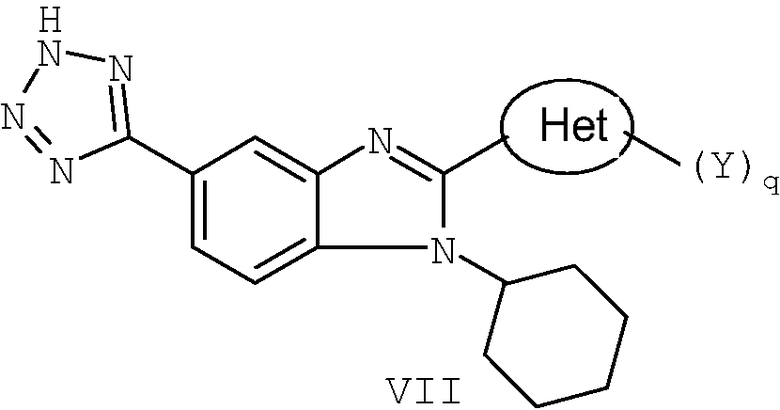
в которой Het представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, циклоалкильного, циклоалкенильного, гетероциклического или гетероарильного циклов, необязательно замещенных (Y)q; при условии, что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклическим или гетероарильным;
каждый Y независимо выбран из группы, состоящей из галогена, (C1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила, замещенного (С3-С10)циклоалкила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -NR14R15, -NHNR14R15, -C(=O)NR14R15, -OR14, -SR14;
где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (С1-С10)алкила, арила, замещенного арила;
q представляет собой целое число, равное 1, 2 или 3;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
его фармацевтически приемлемые соли или таутомеры.
76. Соединение формулы VIII
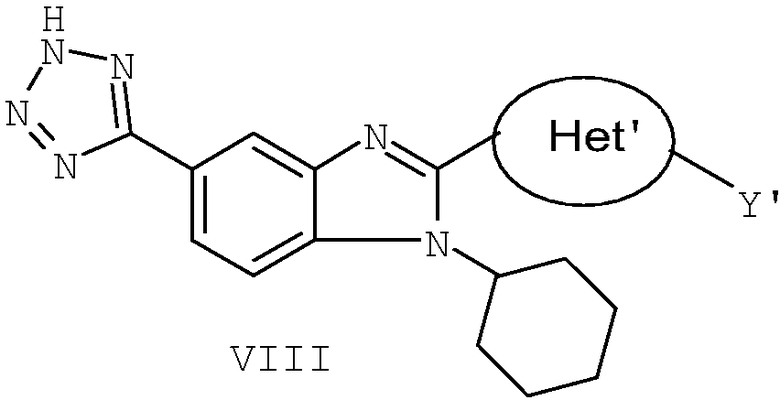
в которой Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов; при условии, что, по меньшей мере, один 6-членный цикл в бицикле является гетероциклом или гетероарилом;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
его фармацевтически приемлемые соли и/или таутомеры.
77. Соединение формулы XI
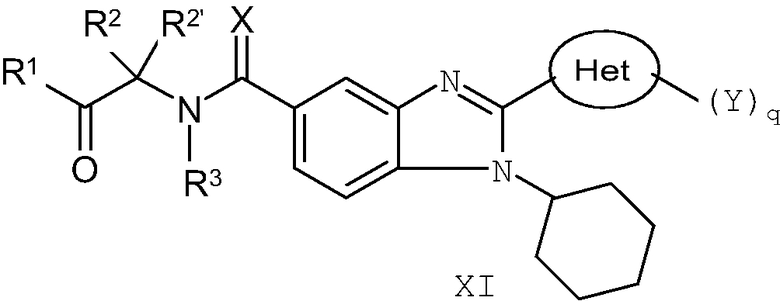
в которой Х представляет собой =O;
R1 представляет собой -OR7, где R7 представляет собой водород или алкил;
каждый R2 и R2' независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила;
R3 выбран из группы, состоящей из водорода и алкила;
Het представляет собой хинолинил, необязательно замещенный (Y)q;
каждый Y независимо выбран из группы, состоящей из галогена, (С1-С10)алкила, замещенного (С1-С10)алкила, (С3-С10)циклоалкила, замещенного (С3-С10)циклоалкила, гетероциклической группы, замещенной гетероциклической группы, арила, замещенного арила, гетероарила, замещенного гетероарила, -NR14R15, -NHNR14R15, -С(=Х)NR14R15, -OR14, -SR14; где X является таким, как он определен выше;
где каждый из R14 и R15 независимо выбран из группы, состоящей из водорода, (С1-С10)алкила, замещенного (С1-С10)алкила, арила, замещенного арила;
q представляет собой целое число, равное 1, 2 или 3;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
его фармацевтически приемлемые соли или таутомеры.
78. Соединение формулы XII
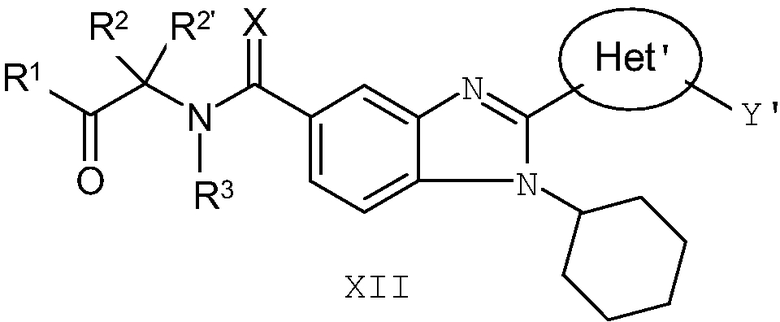
в которой Х представляет собой =O;
R1 представляет собой -OR7, где R7 представляет собой водород или алкил;
каждый R2 и R2' независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила;
R3 выбран из группы, состоящей из водорода и алкила;
Het' представляет собой конденсированный 6,6-бицикл, обеспеченный конденсированной связью двух любых 6-членных циклов, выбранных из арильного, замещенного арильного, гетероциклического, замещенного гетероциклического, гетероарильного или замещенного гетероарильного циклов; при условии, что, по меньшей мере, один 6-членный цикл в бицикле является ароматическим;
Y' независимо выбран из группы, состоящей из алкила, арила, гетероарила, замещенного арила и замещенного гетероарила;
где гетероциклическая группа относится к насыщенной или ненасыщенной группе, имеющей 1 кольцо или несколько сконденсированных колец, содержащих от 1 до 10 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода внутри кольца, которое необязательно содержит от 1 до 2 экзо карбонильных групп; и
его фармацевтически приемлемые соли и/или таутомеры.
79. Соединение, выбранное из группы, состоящей из
1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимилдазол-5-карбоновой кислоты;
2-{2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1H-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(3-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(3-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-фенил-1,2,3,4-тетрагидрохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(3-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(2-бромфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(5-бром-2-гидроксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-пиридин-3-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-нафталин-1-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-аминофенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3-карбоксиметоксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[4-(2-оксо-2-пирролидин-1-илэтокси)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5
-карбоновой кислоты;
2-{2-[4-(карбамоилметилкарбамоил)-4'-хлорбифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-метилкарбамоилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-амино-3,5-дихлорфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2,4-дигидроксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-циано-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3'-хлор-4'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-метокси-3'-метилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[1-карбамоил-2-(1Н-имидазол-2-ил)этилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[3-(пирролидин-1-карбонил)фенил]хинолин-6-ил}-1H-бензоимидазол-5-карбоновой кислоты;
2-[2,3-бис-(4-бромфенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-амино-3-бромфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(4-оксо-2-фенил-1,4-дигидрохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3-карбамоил-4-гидроксифенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-карбоксиметоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[4'-хлор-4-(2-оксо-2-пирролидин-1-ил-этокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[4-(карбамоилметилкарбамоил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метилкарбамоилбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бифен-2-ил-8-метилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[4-(4-хлорфениламино)-2-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3,5-дигидроксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-карбамоил-4-метоксибифен-2-ил)хинолин-6-ил]-l-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-метокси-4'-нитробифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-аминометил-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(1-карбамоил-2-гидроксиэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2,3-дифенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бифен-2-ил-7-фторхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2,3-ди-п-толилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бифенил-4-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(2-амино-4-метилтиазол-5-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3-гидроксипропил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-карбоксиметокси-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(7-бром-5-метоксибензофуран-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бифен-2-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[3-(4-хлорфенил)-5-метилизоксазол-4-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(8-метил-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[4-(4-гидроксибутиламино)-2-фенилхинолин-6-ил]-1H-бензоимидазол-5-карбоновой кислоты;
2-[4-(2-трет-бутоксикарбониламиноэтиламино)-2-фенилхинолин-6-ил]-1-циклогексил-1H-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[5-(пирролидин-1-карбонил)-2-тиофен-2-ил]хинолин-6-ил}-1H-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4'-диметиламино-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
6-(5-карбокси-1-циклогексил-1Н-бензомидазол-2-ил)хинолин-2-карбоновой кислоты;
1-циклогексил-2-[2-(3',4'-дихлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-этокси-5-нитрофенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2,3-дифенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(4-оксо-2-фенил-4Н-хромен-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифен-2-ил)-7-фторхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2,3-бис-(4-фторфенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
[2-(2-бифен-2-ил-7-фторхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-ил]-(4-гидроксипиперидин-1-ил)метанон;
1-циклогексил-2-[2-(7-гидроксибензофуран-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бензо[1,3]диоксол-5-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бензофуран-2-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[3-(3-пирролидин-1-ил-пропокси)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-карбокси-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[2-(4-хлорфенил)-4-метилтиазол-5-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифен-2-ил)-8-метилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-гидрокси-5-метил-3-нитрофенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[3',4'-диметокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-метокси-3'-нитробифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-карбокси-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2,4']бихинолинил-6-ил-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(2-бромфенил)-3-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2,3-бис(3-метоксифенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2,4-диметилтиазол-5-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-пиридин-2-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-феноксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-морфолин-4-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[4-(3-пирролидин-1-ил-пропокси)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[1-(2-хлорпиридин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(1Н-пиррол-3-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-фенил-4-фениламинохинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-гидрокси-6-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[4'-нитро-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-метокси-4'-трифторметилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3'-карбокси-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-метокси-4'-метилбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-нитробифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифен-2-ил)-3-фенилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2,3-бис-(4-метоксифенил)хиноксалин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-пиразин-2-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-пиридин-4-ил-хинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(6-метилнафталин-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[3-(2-метоксиэтокси)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-[6-(2-нитрофенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[4'-хлор-4-(3-пирролидин-1-ил-пропокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(5-бензилокси-2-метилбензофуран-3-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(1-фенил-1Н-пиразол-4-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(1Н-пиррол-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[4-(3-имидазол-1-ил-пропиламино)-2-фенилхинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-гидрокси-4,6-диметоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[4'-карбокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-фуран-2-ил-5-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4'-этокси-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бензгидрилхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2,3-бис-(4-диметиламинофенил)хиноксалин-6-ил]-1-циклогексил-1H-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(5,6,7,8-тетрагидронафталин-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-гидроксинафталин-1-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[4-(2-метоксиэтокси)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-бензилокси-2-гидрокси-3-метилфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(6-хлор-9-метил-9Н-карбазол-3-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3,5-диметил-1-фенил-1Н-пиразол-4-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-6-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(4-гидразино-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-фенил-4-фенилсульфанилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4,4'-диметоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4'-гидрокси-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(5-метокси-2-тиофен-2-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(2-бромфенил)-4-метилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(5-метил-2-фенилтиофен-3-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-имидазол-1-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3-гидроксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[4'-хлор-4-(2-метоксиэтокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-пиразол-1-ил-этил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(2-бромфенил)хинолин-6-ил]-3-циклогексил-3Н-имидазо [4,5b] пиридин-6-карбоновой кислоты;
1-циклогексил-2-[2-(2,3-дигидробензофуран-5-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[3-(3,4-дихлорфенил)изоксазол-5-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3-амино-5-фенилтиофен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(4-диметиламино-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3-бромфенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифенил-3-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[2-(2,4-диметоксипиримидин-5-ил)-5-метоксифенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифен-2-ил)-4-метилхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-гидроксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-пиперазин-1-илфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(2-дипропиламинометилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлорбифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты;
2-{2-[4'-хлор-4-(2-диметиламиноэтилкарбамоил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[2-хлор-4-(4-хлорфенокси)фенил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(5-метоксибензофуран-3-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(4-этокси-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3,5-диметоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(4-фенокси-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(1-карбамоилэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-(4-метил-2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-гидроксибифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-ацетиламинофенил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(3-карбоксиметил-2,2-диметилциклобутил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[3-(2-оксо-2-пирролидин-1-ил-этокси)фенил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[4-(2-диметиламиноэтилкарбамоил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[5-(4-хлорфенил)-2-метилфуран-3-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[4'-хлор-4-(2-этоксиэтокси)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3,4-дихлорфенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[4-(7-гидроксинафталин-2-илокси)-2-фенилхинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-хлорфенилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(1-карбамоил-2-метилпропилкарбамоил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(1-карбамоил-2-фенилэтилкарбамоил)хинолин-6-ил]-1-циклогексил-1H-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(4-метилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(2-циклогексил-5-метоксифенил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[(4-хлорфенил)метилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(4-метилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-(2-бифенил-4-ил-хинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[4'-фтор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[(4-хлорфенил)изопропилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[(4-хлорфенил)циклогексилкарбамоил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4,2'-диметоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
этил 1-циклогексил-2-[2-(4'-фтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(3,3,5-триметилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(2-метилциклогексил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4'-этил-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-пиперидин-4-ил-1Н-бензоимидазол-5-карбоновой кислоты;
1-бензил-2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3',4'-дифтор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-{2-[4'-метокси-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(3',5'-дихлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-фторбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(1-этилпропил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-{2-[8-(4-хлорфенил)-3,4-дигидро-2Н-бензо[b][1,4]диоксепин-7-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(тетрагидрофуран-2-ил-метил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-циклогексил-2-[2-(4,4'-дихлорбифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
1-бицикло[2.2.1]гепт-2-ил-2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4-амино-4'-хлорбифен-2-ил)хинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-карбоновой кислоты;
2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
2-{[1-циклогексил-2-(2-метилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-гидроксипропионовой кислоты;
6-амино-2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}капроновой кислоты;
1-[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]пирролидин-2-карбоновой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
2-[2-{2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-1-циклогексил-1Н-бензоимидазол-5-карбонил)амино]-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
2-{[1-циклогексил-2-(3-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пентандиовой кислоты;
2-{[1-циклогексил-2-(3-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
3-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты;
3-бифенил-4-ил-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты;
3-(4-бензоилфенил)-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты;
3-циклогексил-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пропионовой кислоты;
1-циклогексил-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}уксусной кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}янтарной кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}пентандиовой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-фенилпропионовой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(1Н-имидазол-4-ил)пропионовой кислоты;
1-[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]-4-гидроксипирролидин-2-карбоновой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-метилпентановой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-гидроксимасляной кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-4-метилпентановой кислоты;
{2-[2-(4'-хлорбифен-2-ил)-7-фторхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-ил}-(4-гидроксипиперидин-1-ил)метанона;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-4-метилсульфанилмасляной кислоты;
2-{[1-циклогексил-2-(3-фенилхинолин-7-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-метилмасляной кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}сукцинамовой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(4-гидроксифенил)пропионовой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты;
{2-[2-(4'-хлорбифен-2-ил)-7-фторхинолин-6-ил]-1-циклогексил-1Н-бензоимидазол-5-ил}-(4-метилпиперазин-1-ил)метанона;
[2-(2-бифен-2-ил-7-фторхинолин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-ил]-(4-метилпиперазин-1-ил)метанона;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-5-гуанидинопентановой кислоты;
2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}этансульфоновой кислоты;
4-карбамоил-2-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}масляной кислоты;
морфолин-4-иламида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
(7-гидроксинафталин-1-ил)амида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
(5-гидроксинафталин-1-ил)амида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
(4-метил-2-оксо-2Н-хромен-7-ил)амида 1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]-2-фенилхиноксалина;
(4'-хлор-2-{6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]хинолин-2-ил}бифен-4-ил)пирролидин-1-илметанона;
2-(4'-хлор-4-метоксибифен-2-ил)-6-[1-циклогексил-5-(1Н-тетразол-5-ил)-1Н-бензоимидазол-2-ил]хинолина;
2-[(2-(2-фенилхиноксалин-6-ил)-1-циклогексил-1Н-бензоимидазол-5-карбонил)амино]пропионовой кислоты;
{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1H-бензоимидазол-5-карбонил]амино}уксусной кислоты;
6-{[1-циклогексил-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}нафталин-2-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-изопропил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклопропил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклопентил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-изобутил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-циклопропилметил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(3-метилбутил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-(2-диметиламиноэтил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-1-этил-1Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-гидроксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-1Н-индол-6-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты;
сложного этилового эфира 2-[2-(4'-хлор-4-гидроксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты;
2-{2-[4'-хлор-4-(пирролидин-1-карбонил)бифен-2-ил]хинолин-6-ил}-3-циклогексил-3Н-имидазо[4,5-b]пиридин-6-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-бензоимидазол-5-карбоновой кислоты;
2-[2-(4'-хлор-4-метоксибифен-2-ил)хинолин-6-ил]-3-циклогексил-3Н-бензоимидазол-4-карбоновой кислоты;
6-(1-циклогексил-5-этоксикарбонил-1Н-бензоимидазол-2-ил)хинолин-2-карбоновой кислоты;
1-(транс-2-гидроксициклогексил)-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
1-(транс-4-гидроксициклогексил)-2-(2-фенилхиноксалин-6-ил)-1Н-бензоимидазол-5-карбоновой кислоты;
2-{[1-циклогексил-2-(2-фенилхинолин-6-ил)-1Н-бензоимидазол-5-карбонил]амино}-3-(5-гидрокси-1Н-индол-3-ил)пропионовой кислоты;
{4'-хлор-2-[6-(1-циклогексил-1Н-бензоимидазол-2-ил)хинолин-2-ил]бифенил-4-ил}пирролидин-1-илметанона; и их фармацевтически приемлемых таутомеров или солей.
80. Фармацевтическая композиция для лечения вирусной инфекции у теплокровных опосредованных по крайней мере частично вирусом семейства Flaviviridae, содержащая фармацевтически приемлемый разбавитель и терапевтически эффективное количество соединения по одному любому из пп.1, 61, 71-76 и 77-79 или смеси двух или более таких соединений.
81. Способ лечения вирусной инфекции млекопитающего, опосредованной, по меньшей мере, частично вирусом из семейства вирусов Flaviviridae, включающий введение млекопитающему, у которого выявлена вирусная инфекция или который имеет повышенный риск развития вирусной инфекции, фармацевтической композиции по п.80.
82. Способ по п.81, в котором вирус является вирусом гепатита С.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 4329459 А, 11.05.1982 | |||
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 1992 |
|
RU2193561C2 |
Авторы
Даты
2009-05-20—Публикация
2004-07-30—Подача