Данное изобретение относится к различным способам получения и разделения рацемических аминозамещенных конденсированных бициклических кольцевых систем, в частности аминозамещенных тетрагидрохинолинов или тетрагидроизохинолинов. В одном из способов используют селективное гидрирование аминозамещенного конденсированного бициклического кольца. В альтернативном способе рацемическую аминозамещенную конденсированную бициклическую кольцевую систему получают через нитрозирование. Кроме того, настоящее изобретение относится к ферментативному разделению рацемической смеси с целью получения (R)- и (S)-форм аминозамещенных конденсированных бициклических кольцевых систем, таких как аминозамещенный 5,6,7,8-тетрагидрохинолин или 5,6,7,8-тетрагидроизохинолин. Другой аспект изобретения касается способа рацемизации энантиомерно обогащенных (R)- и (S)-форм аминозамещенных конденсированных бициклических кольцевых систем. Кроме того, данное изобретение относится к асимметрическому синтезу аминозамещенного конденсированного бициклического кольца для получения требуемого энантиомера.
У специалистов в данной области существует потребность в получении энантиомерных форм фармацевтических соединений, так как такие энантиомеры часто проявляют повышенную активность в отношении отдельных заболеваний по сравнению с рацемической формой того же самого соединения. Например, 8-амино-5,6,7,8-тетрагидрохинолины применяются в качестве промежуточных соединений при получении новых гетероциклических соединений, которые связываются с хемокиновыми рецепторами и обладают защитным действием против инфицирования клеток-мишеней вирусом иммунодефицита человека (ВИЧ). См. WO 00/56729.
Описано приблизительно 40 хемокинов человека, которые функционируют, по меньшей мере, частично, путем модулирования комплекса и перекрывания ряда биологических активностей, важных для движения лимфоидных клеток, экстравазации и инфильтрации лейкоцитов в ответ на инициирующее действие агентов (см., например: P.Ponath, Exp. Opin. Invest. Drugs, 7:1-18,1998). Такие хемотаксические цитокины, или хемокины, составляют семейство белков, размером приблизительно 8-10 кДа. По-видимому, хемокины участвуют в образовании общего структурного мотива, который состоит из 4 консервативных цистеинов, участвующих в поддержании третичной структуры. Существует два главных подсемейства хемокинов: "СС" или β-хемокины и "CXC" или α-хемокины. Рецепторы таких хемокинов классифицированы на основе хемокина, который составляет природный лиганд рецептора. Рецепторы β-хемокинов определяют как "CCR"; в то время как рецепторы α-хемокинов определяют как "CXCR".
Хемокины считаются основными медиаторами инициации и поддержания воспаления. Точнее, было установлено, что хемокины играют важную роль в регуляции функции эндотелиальных клеток, включая пролиферацию, миграцию и дифференцировку в процессе ангиогенеза и реэндотелиализации после повреждения (Gupta и др., J. Biolog. Chem., 7:4282-4287, 1998). Два специфических хемокина вовлечены в этиологию инфицирования вирусом иммунодефицита человека (ВИЧ).
Например, в патенте США № 5583131, в патенте США № 5698546 и патенте США № 5817807 описаны циклические соединения, которые активны против ВИЧ-1 и ВИЧ-2. Такие соединения проявляют анти-ВИЧ-активность, связываясь с хемокиновым рецептором CXCR-4, экспрессируемым на поверхности определенных клеток иммунной системы. Таким образом, такое конкурентное связывание защищает такие клетки-мишени от инфицирования ВИЧ, который использует рецептор CXCR-4 для проникновения. Кроме того, такие соединения являются антагонистами связывания, передачи сигналов и хемотаксических эффектов природного CXC-хемокина по отношению к CXCR-4, фактору 1α, получаемому из стромальных клеток (SDF-1).
Кроме того, циклические полиаминные антивирусные агенты, описанные в вышеупомянутых патентах, оказывают усиливающее действие на продукцию белых клеток крови с таким же успехом, как проявляют противовирусные свойства. См. патент США 6365583. Следовательно, такие агенты применимы для контроля побочных эффектов химиотерапии, повышения успешности трансплантации костного мозга, улучшения ранозаживления и лечения ожогов с таким же успехом, как для борьбы с бактериальными инфекциями при лейкемии.
Следовательно, специалистов в данной области могли бы заинтересовать более эффективные и действенные способы получения рацематов и энантиомеров различных кольцевых систем. Такие способы предлагаются в настоящем изобретении.
Краткое содержание изобретения
Изобретение относится к способу получения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина, включающему:
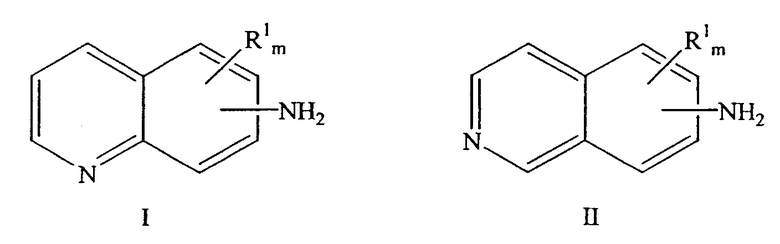
a) взаимодействие аминозамещенного хинолина формулы I или аминозамещенного изохинолина формулы II с соединением, имеющим аминозащитную группу, в органическом растворителе с получением аминозамещенного хинолина или изохинолина с защищенной аминогруппой:
b) гидрирование аминозамещенного хинолина или изохинолина с защищенной аминогруппой в сильнокислом растворителе при повышенной температуре с образованием 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина; и
c) гидролиз аминозащитной группы с получением требуемого рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина;
причем NH2-группа находится в любом положении бензольной части молекулы хинолина или изохинолина, R1 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и где R1 выбран из группы, состоящей из нитро, циано, карбоновой кислоты, алкила, алкокси, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
Изобретение также относится к способу получения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина, включающему:
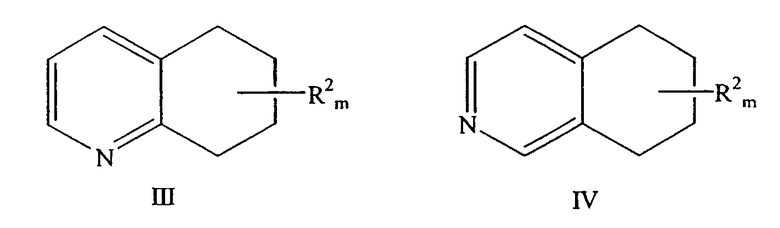
a) взаимодействие либо замещенного 5,6,7,8-тетрагидрохинолина формулы III, либо замещенного 5,6,7,8-тетрагидроизохинолина формулы IV
по меньшей мере, с 2 эквивалентами алкиллитиевого основания или основания амида лития, амида натрия или амида калия и затем с нитрозирующим агентом с образованием оксима; и
b) восстановление оксима с получением рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина;
причем аминогруппа находится в положении 8 молекулы хинолина или в положении 5 молекулы изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и где R2 выбран из группы, состоящей из галогена, нитро, циано, защищенной карбоновой кислоты, алкила, алкенила, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
Кроме того, предлагается способ получения кетозамещенного 5,6,7,8-тетрагидрохинолина или кетозамещенного 5,6,7,8-тетрагидроизохинолина, включающий:
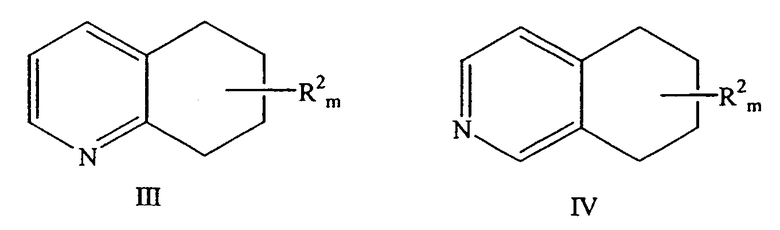
a)взаимодействие либо замещенного 5,6,7,8-тетрагидрохинолина формулы III, либо замещенного 5,6,7,8-тетрагидроизохинолина формулы IV
по меньшей мере, с 2 эквивалентами алкиллитиевого основания, или основания амида лития, амида натрия или амида калия; и затем с нитрозирующим агентом с образованием оксима; и
b) гидролиз оксима с получением соответствующего кетона;
причем кетогруппа находится в положении 8 молекулы хинолина или в положении 5 молекулы изохинолина; R2 находится в положении любого другого атома водорода молекулы хинолина или изохинолина; m равно 0-4; и R2 выбран из группы, состоящей из галогена, нитро, циано, защищенной карбоновой кислоты, алкила, алкенила, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
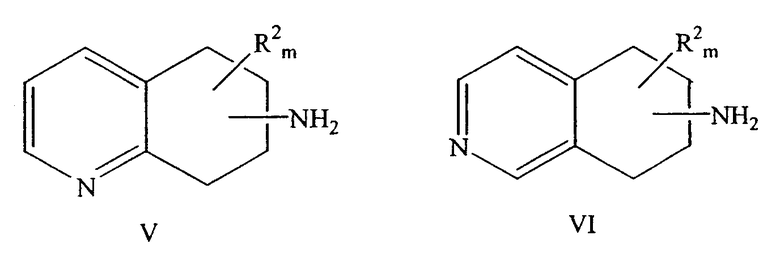
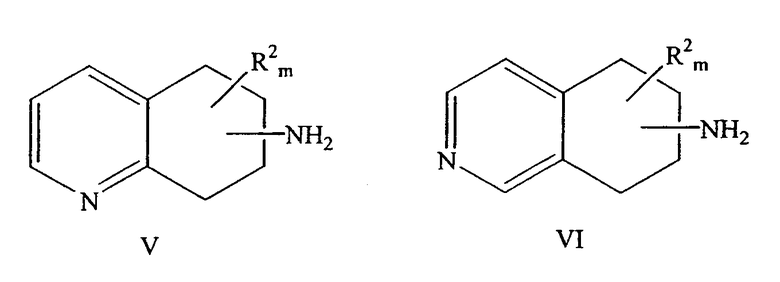
Также настоящее изобретение относится к способу разделения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина формулы V или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина формулы VI с получением двух энантиомеров,
включающий
а) энантиоселективное ацилирование или карбамоилирование рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина в присутствии энантиоселективного фермента в качестве катализатора; и
b) отделение непрореагировавшего аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина в виде первого энантиомера от энантиомерного амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина; и
c) отщепление амидной или карбаматной группы с выделением второго энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
причем NH2 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тио, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической и гетероциклической групп.
Другой способ, предлагаемый для разделения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина формулы V или аминозамещенного 5,6,7,8-тетрагидроизохинолина формулы VI с получением одного из энантиомеров
включает
a) энантиоселективное ацилирование или карбамоилирование рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина в присутствии энантиоселективного фермента в качестве катализатора с получением смеси соответствующего непрореагировавшего амина в первой энантиомерной форме и прореагировавшего амида или карбамата во второй энантиомерной форме; и
b) выделение первого энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
причем NH2 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
Способ, предлагаемый для разделения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина с получением двух энантиомеров, включает
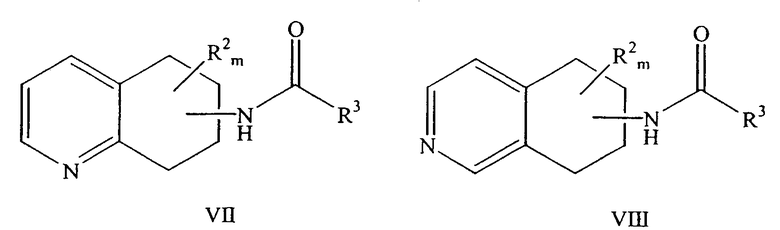
a) взаимодействие рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина формулы VII или рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидроизохинолина формулы VIII
с водой, спиртом, первичным или вторичным амином в присутствии энантиоселективного фермента в качестве катализатора с получением смеси соответствующего амина в первой энантиомерной форме и непрореагировавшего амида или карбамата во второй энантиомерной форме;
b) отделение первого энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или аминозамещенного 5,6,7,8-тетрагидроизохинолина от непрореагировавшего амида или карбамата; и
c) отщепление амидной или карбаматной группы с получением второго энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или аминозамещенного 5,6,7,8-изохинолина;
причем амидная или карбаматная группа находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы; и R3 представляет собой необязательно замещенный атом углерода или необязательно замещенный атом кислорода.
Кроме того, настоящее изобретение относится к способу разделения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина с получением одного из энантиомеров, включающему
a) взаимодействие рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина формулы VII или рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидроизохинолина формулы VIII

с водой, спиртом, первичным или вторичным амином в присутствии энантиоселективного фермента в качестве катализатора с получением смеси соответствующего амина в первой энантиомерной форме и непрореагировавшего амида или карбамата во второй энантиомерной форме; и
b) выделение первого энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
причем амид или карбамат находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы; и R3 представляет собой необязательно замещенный атом углерода или необязательно замещенный атом кислорода.
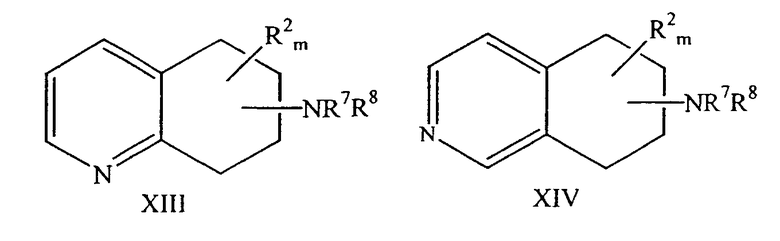
Способ рацемизации энантиомерно обогащенного аминозамещенного 5,6,7,8-тетрагидрохинолина формулы XIII или аминозамещенного 5,6,7,8-тетрагидроизохинолина формулы XIV, с получением соответствующей рацемической смеси,
включает
а) нагревание энантиомерно обогащенного аминозамещенного 5,6,7,8-тетрагидрохинолина или аминозамещенного 5,6,7,8-тетрагидроизохинолина, неразбавленного или в органическом растворителе в присутствии или в отсутствие добавки; и
b) когда либо R7, либо R8 не является водородом, отщепление R7- или R8-группы в условиях, отвечающих образованию соответствующей аминогруппы;
причем NR7R8 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4;
R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тио, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы; и
каждый из R7 и R8 выбран из группы, состоящей из водорода, алкила, арила, гетероалкила, гетероарила, аралкила, алканоила, алкилсульфонила, карбонильной или сульфонильной группы, замещенной ароматическим или гетероциклическим кольцом, арилоксикарбонила, алкоксикарбонила, арилкарбамоила, алкилкарбамоила, арилтиокарбонила, алкилтиокарбонила и карбамоила.
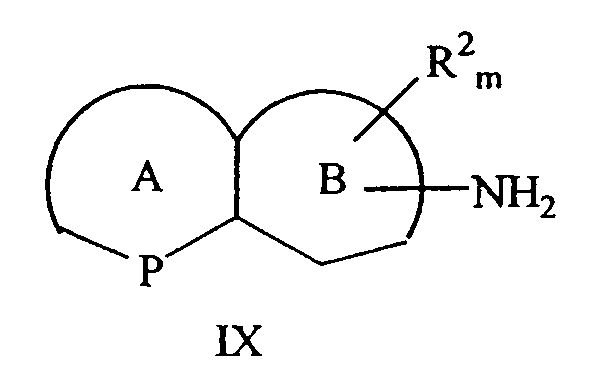
Способ получения энантиомера конденсированного бициклического кольца, замещенного первичным амином, формулы IX включает
a) образование основания Шиффа кетогруппы, находящейся на цикле B конденсированного бициклического кольца, путем ее взаимодействия с энантиомерно чистым вспомогательным хиральным первичным амином R*NH2 формулы X
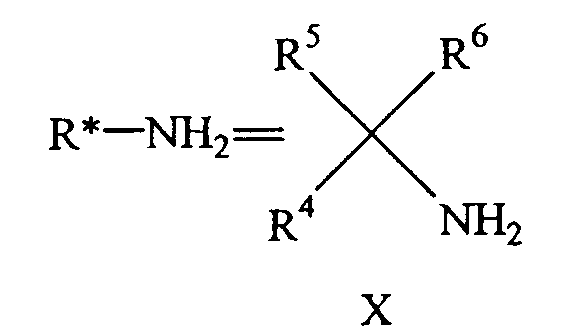
с получением соответствующего энантиомерно чистого имина конденсированного бициклического кольца;
b) диастереоселективное восстановление имина с получением соответствующего энантиомерно чистого вторичного амина конденсированного бициклического кольца; и
c) удаление вспомогательного хирального фрагмента R* с образованием энантиомера конденсированного бициклического кольца, замещенного первичным амином;
причем цикл А представляет собой 5- или 6-членный гетероароматический цикл, P представляет собой атом азота, атом серы или атом кислорода; цикл B представляет собой 5- или 6-ченный циклоалкил или гетероциклоалкил;
причем NH2 находится в положении цикла B; а R2 находится в положении любого другого атома водорода конденсированного бициклического кольца;
где m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы; и
R4, R5 и R6 отличаются друг от друга и выбраны из группы, состоящей из водорода, алкила, алкенила, циклоалкила, циклоалкенила и 5- или 6-членного ароматического цикла; и, по меньшей мере, один из R4, R5 или R6 представляет собой 5- или 6-ченный ароматический цикл.
Подробное описание изобретения
Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения для обозначения абсолютной конфигурации молекулы относительно ее хирального центра(ов) применяют префиксы R и S. Префиксы "d" и "l" или (+) и (-) используют для определения направления вращения соединением плоскополяризованного света, (-) или "l" означает, что соединение является "левовращающим", (+) или "d" означает, что соединение является "правовращающим". Корреляции между номенклатурой соединений с абсолютной стереохимией и вращением энантиомера не существует. Такие соединения, называемые "стереоизомерами", с точки зрения химического строения идентичны, за исключением того, что они являются зеркальными отражениями друг друга. Конкретный стереоизомер может называться "энантиомером", а смесь таких изомеров часто называют "энантиомерной" или "рацемической" смесью. См., например, Streitwiesser A. и Heathcock C. H., INTRODUCTION TO ORGANIC CHEMISTRY 2-е издание, глава 7 (MacMillan Publishing Co., США, 1981). В настоящей заявке обозначение (R,S) соответствует рацемической смеси R- и S-энантиомеров, и индивидуальные энантиомеры также могут быть обозначены, например, как (8R)- и/или (8S)-амино-5,6,7,8-тетрагидрохинолин.
Термины "энантиомерно чистый" или "энантиомерно обогащенный", или "оптически чистый", или "в основном оптически чистый" или "энантиочистый", применяемые в данном описании, означают, что энантиомер или изомер в основном не содержит оптического антипода энантиомера или изомера, причем композиция содержит, по меньшей мере, 90 мас.% требуемого изомера и 10 мас.% или менее оптического антипода изомера. При более предпочтительном воплощении термины означают, что композиция содержит, по меньшей мере, 99 мас.% требуемого изомера и 1 мас.% или менее оптического антипода изомера или энантиомера. Указанные проценты определяются, исходя из общего количества соединения в композиции.
Термин "энантиомерный избыток" или "э.и." относится к термину "оптическая чистота", оба из которых являются характеристикой одного и того же явления. Значение "э.и." будет равно числу в диапазоне от 0 до 100; при значении, равном 0, соединение является рацемическим, а при значении, равном 100, является чистым отдельным энантиомером. Соединение, которое упоминается как оптически чистое на 98%, можно описать как соединение с 98% э.и. См., например, March J., ADVANCED ORGANIC CHEMISTRY: REACTIONS, MECHANISMS AND STRUCTURES, 3-е издание, глава 4 (John Wiley & Sons, США, 1985). Процент оптической чистоты данного образца определяется как:
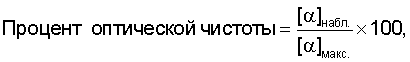
где [α]набл. представляет собой наблюдаемый угол вращения плоскости поляризованного света, а [α]макс. представляет собой максимально возможный угол вращения (то есть угол вращения, который наблюдался бы на энантиомерно чистом образце). Если предположить, что между [α] и концентрацией существует линейная зависимость, то оптическая чистота будет равна избытку одного энантиомера по сравнению с другим, выраженному в процентах:
оптическая чистота = энантиомерный избыток (э.и.)
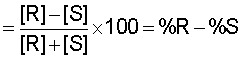
Указанные ниже замещающие группы могут быть необязательно замещенными; поэтому, когда применяется, например, термин "алкил", он также включает замещенные алкилы.
В общем случае структуры можно описать следующим образом: цикл А или цикл C представляют собой необязательно замещенный 5- или 6-членный гетероароматический цикл, а P представляет собой необязательно замещенный атом углерода, необязательно замещенный атом азота, атом серы или кислорода. Цикл B или цикл D представляет собой необязательно замещенный 5-6-членный циклоалкил с насыщенными или частично насыщенными атомами углерода или гетероциклоалкил.
Примерами необязательно замещенного 5- или 6-членного цикла А или цикла C являются пиридин, пиримидин, пиразин, пиридазин, триазин, имидазол, пиразол, триазол, оксазол, тиазол. Цикл А или цикл C предпочтительно представляют собой шестичленные циклы, в частности пиридин.
Примерами необязательно замещенного цикла B или цикла D являются циклогексан, пиперидин, пиперазин, гексагидропиридазин, тетрагидрофуран, тетрагидротиофен, тетрагидропиран и тетрагидротиапиран, предпочтительно сочетание циклов А и B или C и D представляет собой 5,6,7,8-тетрагидрохинолин и 5,6,7,8-тетрагидроизохинолин.
В упомянутых выше примерах "необязательными заместителями" циклов A, B, C и D могут быть нитрогруппа, цианогруппа, карбоновая кислота, необязательно замещенная алкильная или циклоалкильная группы, необязательно замещенная гидроксильная группа, необязательно замещенная тиольная группа, необязательно замещенная аминогруппа или ацильная группа, необязательно замещенная карбоксилатная, карбоксамидная или сульфонамидная группа, необязательно замещенная ароматическая или гетероциклическая группа.
Примеры необязательно замещенного алкила включают C1-l2-акил, включая метил, этил, пропил и т.д., а примеры необязательно замещенных циклоалкильных групп включают C3-10-циклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д. В таких случаях предпочтительны C1-6-алкил и циклоалкил. Необязательным заместителем также может быть необязательно замещенный аралкил (например, фенил-C1-4-алкил) или гетероалкил, например, фенилметил (бензил), фенетил, пиридинилметил, пиридинилэтил и т.д. Гетероциклическая группа может представлять собой 5- или 6-членный цикл, содержащий 1-4 гетероатома.
Примеры необязательно замещенных гидроксильных и тиольных групп включают необязательно замещенный алкил (например, С1-10-акил), такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил и т.д., предпочтительно C1-6-алкил; необязательно замещенный циклоалкил (например, C3-7-циклоалкил и т.д., такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д.); необязательно замещенный аралкил (например, фенил-C1-4-алкил, например, бензил, фенетил и т.д.). Когда имеется два расположенных по соседству гидроксильных или тиольных заместителя, гетероатомы могут быть связаны через алкильную группу, такую как O(CH2)nО и S(CH2)nS (где n=1-5). Примеры включают группы метилендиокси, этилендиокси и т.д. Также включены оксиды простых тиоэфирных групп, такие как сульфоксиды и сульфоны.
Другие примеры необязательно замещенной гидроксильной группы включают необязательно замещенный C2-4-алканоил (например, ацетил, пропионил, бутирил, изобутирил и т.д.), C1-4 -акилсульфонил (например, метансульфонил, этансульфонил и т.д.) и необязательно замещенную ароматическую или гетероциклическую карбонильную группу, включая бензоил, пиридинкарбонил и т.д.
Заместители необязательно замещенной аминогруппы могут быть связаны друг с другом с образованием циклической аминогруппы (например, 5-6-членной циклической аминогруппы и т.д., такой как тетрагидропиррол, пиперазин, пиперидин, пирролидин, морфолин, тиоморфолин, пиррол, имидазол и т.д.). Указанная циклическая аминогруппа может иметь заместитель, примеры заместителей включают галоген (например, фтор, хлор, бром, йод и т.д.), нитро, циано, гидроксильную группу, тиольную группу, аминогруппу, карбоксильную группу, необязательно галогенированный Cl-4-алкил (например, трифторметил, метил, этил и т.д.), необязательно галогенированный C1-4-алкокси (например, метокси, этокси, трифторметокси, трифторэтокси и т.д.), C2-4-алканоил (например, ацетил, пропионил и т.д.), C1-4-алкилсульфонил (например, метансульфонил, этансульфонил и т.д.), количество предпочтительных заместителей составляет от 1 до 3.
Аминогруппа также может быть замещена одной или двумя (с образованием вторичного или третичного амина) группами, такими как необязательно замещенная алкильная группа, включая С1-10-алкил (например, метил, этил, пропил и т.д.) или необязательно замещенная циклоалкильная группа, такая как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д. В таких случаях предпочтительными группами являются C1-6-алкил и циклоалкил. Аминогруппа также может быть необязательно замещена ароматической или гетероциклической группой, аралкилом (например, фенил-C1-4-алкилом) или гетероалкилом, например, фенилом, пиридином, фенилметилом (бензилом), фенетилом, пиридинилметилом, пиридинилэтилом и т.д. Гетероциклическая группа может представлять собой 5- или 6-членный цикл, содержащий 1-4 гетероатома. Необязательные заместители "необязательно замещенных аминогрупп" являются такими же, как указаны выше для "необязательно замещенной циклической аминогруппы".
Аминогруппа может быть замещена необязательно замещенным C2-4-алканоилом, например, ацетилом, пропионилом, бутирилом, изобутирилом и т.д., или С1-4-алкилсульфонилом (например, метансульфонилом, этансульфонилом и т.д.), или ароматическим или гетероциклическим кольцом, замещенным карбонилом или сульфонилом, например, бензолсульфонилом, бензоилом, пиридинсульфонилом, пиридинкарбонилом и т.д. Гетероциклы такие же, как указано выше. Необязательные заместители описанных выше заместителей аминогруппы такие же, как указаны выше для "необязательно замещенной циклической аминогруппы".
Примеры необязательно замещенных ацильных групп, которые являются заместителями на циклах A, B, C и D, включают карбонильную группу или сульфонильную группу, связанную с водородом; необязательно замещенный алкил (например, C1-10-алкил, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил, октил, нонил, децил и т.д., предпочтительно низший (С1-6)алкил и т.д.; необязательно замещенный циклоалкил (например, C3-7-циклоалкил и т.д., такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д.); необязательно замещенную 5-6-членную моноциклическую ароматическую группу (например, фенил, пиридил и т.д.).
Примеры необязательно замещенной карбоксилатной группы (сложноэфирные группы) включают необязательно замещенный алкил (например, С1-10-алкил, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил, октил, нонил, децил и т.д., предпочтительно низший (С1-6)алкил и т.д.); необязательно замещенный циклоалкил (например, C3-7-циклоалкил и т.д., такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д.); необязательно замещенный арил (например, фенил, нафтил и т.д.) и C1-4-арил, например, бензил, фенетил и т.д. Также включены такие группы, как метоксиметил, метоксиэтил и т.д.
Примеры необязательно замещенных карбоксамидной и сульфонамидной групп идентичны примерам, относящимся к аминогруппе, приведенным выше при определении "необязательно замещенной аминогруппы".
Примеры необязательно замещенных ароматических или гетероциклических групп, являющихся заместителями циклов A, B, C и D, представляют собой фенил, нафтил или 5- или 6-членное гетероциклическое кольцо, содержащее 1-4гетероатома. Необязательные заместители в основном идентичны заместителям, перечисленным выше для циклов A, B, C и D.
В упомянутых выше примерах число заместителей на циклах A, B, C и D может составлять 1-4, предпочтительно 1-2. Заместители на необязательно замещенных группах такие же, как описанные выше необязательно замещенные группы. Предпочтительные заместители представляют собой галоген (фтор, хлор и т.д.), нитро, циано, гидроксильную группу, тиольную группу, аминогруппу, карбоксильную группу, карбоксилатную группу, сульфонатную группу, сульфонамидную группу, карбоксамидную группу, необязательно галогенированную С1-4-алкоксигруппу (например, трифторметокси и т.д.), С2-4-алканоил (например, ацетил, пропионил и т.д.) или ароил, С1-4-алкилсульфонил (например, метансульфонил, этансульфонил и т.д.), необязательно замещенный арил или гетероциклическую группу. Число заместителей в указанных группах предпочтительно составляет 1-3.
Предпочтительный заместитель для циклов A, B, C и D представляет собой аминогруппу, замещенную необязательно замещенным С2-4-алканоилом, например, ацетилом, пропионилом, бутирилом, изобутирилом и т.д., или C1-4-алкилсульфонил (например, метансульфонил, этансульфонил и т.д.) или ароматическое или гетероциклическое кольцо, замещенное карбонилом или сульфонилом; наиболее предпочтительной является ацетилзамещенная аминогруппа.
Примеры заместителей амидогруппы включают необязательно замещенный алкил (например, C1-10-алкил, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил, октил, нонил, децил и т.д., предпочтительно низший (С1-6)алкил, и т.д.; необязательно замещенный циклоалкил (например, C3-7-циклоалкил и т.д., такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д.); необязательно замещенную 5-6-членную моноциклическую ароматическую группу (например, фенил, пиридил и т.д.). Необязательными заместителями также могут быть необязательно замещенный аралкил (например, фенил-C1-4-алкил) или гетероалкил, например, фенилметил (бензил), фенетил, пиридинилметил, пиридинилэтил и т.д. Гетероциклическая группа может представлять собой 5- или 6-членный цикл, содержащий 1-4 гетероатома. Необязательные заместители также включают галогены (фтор, хлор, бром и т.д.) и необязательно замещенные гетероатомы, такие как кислород, сера, азот и т.д.
Во время проведения специфической стадии способа аминогруппы можно защитить от взаимодействия такими группами, как ацилы, карбаматы, енамины или сульфонамиды и т.п. Гидроксилы можно защитить через кетоны, сложные или простые эфиры; карбоновые кислоты и тиолы можно защитить с помощью образования сложных или простых эфиров.
Ниже в настоящем изобретении описываются различные способы получения и разделения энантиомерных форм аминозамещенных бициклических конденсированных кольцевых систем.
Способ селективного гидрирования
В настоящем изобретении предлагается селективное гидрирование конденсированной бициклической кольцевой системы. Система содержит необязательно замещенный 5- или 6-членный гетероароматический цикл, конденсированный с необязательно замещенным 5- или 6-членным гетероароматическим или ароматическим циклом, где конденсированная бициклическая кольцевая система также содержит аминогруппу в любом положении, кроме места нахождения гетероатома или места конденсации колец. Гетероароматический цикл включает: пиридин, пиримидин, пиразин, пиридазин, триазин, имидазол, пиразол, триазол, оксазол и тиазол. Оба цикла представляют собой предпочтительно шестичленные циклы, а конденсированная бициклическая кольцевая система наиболее предпочтительно представляет собой хинолины и изохинолины.
Предлагаемый способ получения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина включает
a) взаимодействие аминозамещенного хинолина формулы I или аминозамещенного изохинолина формулы II с соединением, имеющим аминозащитную группу, в органическом растворителе с получением хинолина или изохинолина, замещенного защищенной аминогруппой;

b) гидрирование хинолина или изохинолина, замещенного защищенной аминогруппой, в сильнокислом растворителе при повышенной температуре с образованием 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина; и
c) гидролиз аминозащитной группы с получением требуемого рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина;
причем NH2-группа находится в любом положении бензольной части молекулы хинолина или изохинолина, R1 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и где R1 выбран из группы, состоящей из нитро, циано, карбоновой кислоты, алкила, алкокси, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
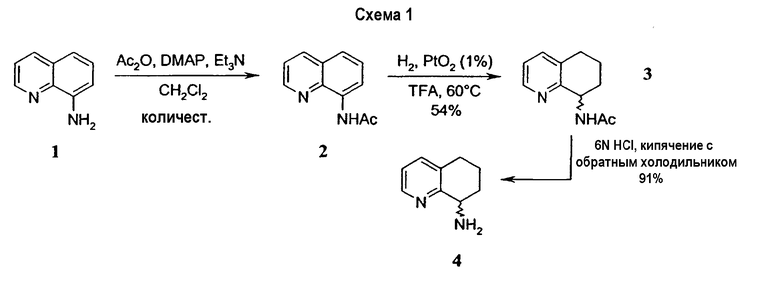
Например, предпочтительный способ получения рацемического 8-амино-5,6,7,8-тетрагидрохинолина посредством селективного гидрирования описан на схеме 1. Схема включает исходный 8-аминохинолин 1, который имеется в продаже, его ацетилирование с применением уксусного ангидрида в органическом растворителе с образованием соответствующего производного ацетамида 2: N-(хинолин-8-ил)ацетамида. При последующем гидрировании ацетамида в сильно кислом растворителе при повышенной температуре образуется 5,6,7,8-тетрагидрохинолин 3, затем путем кислотного гидролиза ацетамид расщепляют с получением требуемой рацемической смеси или (R,S)-8-амино-5,6,7,8-тетрагидрохинолинов 4.
Аминозамещенный хинолин или изохинолин взаимодействует с аминозащитной группой в органическом растворителе с образованием хинолина или изохинолина с защищенной аминогруппой. Защитную группу применяют для того, чтобы предотвратить гидрогенолиз требуемого амина во время гидрирования. Следовательно, можно применять любую аминозащитную группу, такую как ацил, карбамат или сульфонамид и т.п. Аминозащитная группа предпочтительно представляет собой ацетил. Аминозамещенное соединение взаимодействует с уксусным ангидридом с образованием ацетамида, причем органический растворитель представляет собой триэтиламин (Et3N) в дихлорметане с 4-диметиламинопиридином (DMAP) в качестве катализатора.
Гидрирование проводят в сильно кислом растворителе, таком как трифторуксусная кислота, фтористоводородная кислота, соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, трихлоруксусная кислота, уксусная кислота или любое их сочетание. Предпочтительным растворителем является трифторуксусная кислота.
Катализаторы гидрирования могут включать: платиновую чернь, платину-на-угле (0,5-20%), платину на оксиде алюминия (0,5-20%), оксид платины(IV), гидрат оксида платины(IV) (катализатор Адамса), любые другие соли, ковалентные соединения или координационные комплексы платины, которые в условиях реакции приводят к образованию активного платинового(0) катализатора. Предпочтительные катализаторы включают оксид платины(IV) и катализатор Адамса. Содержание катализатора составляет обычно от 0,1% до 50 мас.%, наиболее предпочтительно содержание катализатора составляет от 1 до 3 мас.%.
Реакцию гидрирования обычно проводят при повышенных температурах в диапазоне приблизительно от 50 до 150°C, предпочтительно температура составляет приблизительно от 50 до 70°C, а наиболее предпочтительно около 60°C. Однако реакцию гидрирования в случае необходимости можно провести при температуре около 20-50°C.
Концентрация при проведении реакции составляет приблизительно от 0,01 M до 5 M, предпочтительно концентрация составляет приблизительно от 0,2 M до 0,5 M; тогда как давление водорода составляет приблизительно от 0,1 до 100 атмосфер, предпочтительно составляет около 1 атмосферы. Продолжительность реакции составляет приблизительно от 30 минут до 2 дней, предпочтительно продолжительность реакции составляет приблизительно от 2 до 18 часов.
Предпочтительно проводят гидрирование 0,3 раствора субстрата в TFA в присутствии 5 мол.% PtO2 при 60°C и 1 атмосфере водорода. Также предпочтительно, когда аминогруппа находится в положении 8 хинолина, m равно 0 или 1, и R1 представляет собой метил или метокси.
Гидролиз амидной группы с получением соответствующего амина проводят стандартными способами, включая, но этим не ограничиваясь, нагревание с водным раствором кислоты (например, кипячение с обратным холодильником в 6н водном растворе соляной кислоты), нагревание с водным раствором основания (например, кипячение с обратным холодильником в 6н водном растворе гидроксида натрия) и нагревание в подходящем растворителе в присутствии гидразина.
Способ нитрозирования
Настоящее изобретение также относится к региоселективному нитрозированию конденсированных бициклических кольцевых систем, при этом способ включает металлирование насыщенной части бициклического кольца сильным основанием, последующий захват полученного аниона подходящим нитрозирующим агентом с получением соответствующего нитрозосоединения. Самопроизвольная внутримолекулярная перегруппировка такого промежуточного соединения приводит к образованию производного оксима. Оксим можно восстановить с образованием соответствующего аминопроизводного или можно подвергнуть гидролизу с получением соответствующего кетона. Конденсированная бициклическая кольцевая система содержит необязательно замещенный 5- или 6-членный гетероароматический цикл, конденсированный с необязательно замещенным 5- или 6-членным частично или полностью насыщенным циклоалкилом или гетероциклоалкилом, таким как, например, 5,6,7,8-тетрагидрохинолин или 5,6,7,8-тетрагидроизохинолин. Гетероароматический цикл включает пиридин, пиримидин, пиразин, пиридазин, триазин, имидазол, пиразол, триазол, оксазол и тиазол. Насыщенный цикл включает циклогексан, пиперидин, пиперазин, гексагидропиридазин, тетрагидрофуран, тетрагидротиофен, тетрагидропиран и тетрагидротиапиран.
Описанный способ получения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина включает
a)взаимодействие либо замещенного 5,6,7,8-тетрагидрохинолина формулы III, либо замещенного 5,6,7,8-тетрагидроизохинолина формулы IV

по меньшей мере, с 2 эквивалентами алкиллитиевого основания или основания амида лития, амида натрия или амида калия и затем с нитрозирующим агентом с образованием оксима; и
b)восстановление оксима с получением рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина;
причем аминогруппа находится в положении 8 молекулы хинолина или в положении 5 молекулы изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и где R2 выбран из группы, состоящей из галогена, нитро, циано, защищенной карбоновой кислоты, алкила, алкенила, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
Кроме того, предлагается способ получения кетозамещенного 5,6,7,8-тетрагидрохинолина или кетозамещенного 5,6,7,8-тетрагидроизохинолина, включающий
a)взаимодействие либо замещенного 5,6,7,8-тетрагидрохинолина формулы III, либо замещенного 5,6,7,8-тетрагидроизохинолина формулы IV

по меньшей мере, с 2 эквивалентами алкиллитиевого основания, или основания амида лития, амида натрия или амида калия; и затем с нитрозирующим агентом с образованием оксима; и
b) гидролиз оксима с получением соответствующего кетона;
причем кетогруппа находится в положении 8 молекулы хинолина или в положении 5 молекулы изохинолина; R2 находится в положении любого другого атома водорода молекулы хинолина или изохинолина; m равно 0-4; и где R2 выбран из группы, состоящей из галогена, нитро, циано, защищенной карбоновой кислоты, алкила, алкенила, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
Настоящее изобретение также относится к способу получения (R,S)-8-амино-5,6,7,8-тетрагидрохинолина, который является предпочтительным, путем нитрозирования (схема 2). Используемый в качестве исходного продукта 5,6,7,8-тетрагидрохинолин 5, который имеется в продаже, подвергают взаимодействию с сильным основанием в простом органическом эфире для депротонирования тетрагидрохинолина, затем тетрагидрохинолин взаимодействует с алкилнитритом с образованием производного оксима 6: 6,7-дигидро-5H-хинолин-8-оноксима. Последующее восстановление оксима до амина приводит к рацемическому продукту 4: (R,S)-8-амино-5,6,7,8-тетрагидрохинолину. Альтернативно гидролиз оксима можно провести с образованием 6,7-дигидро-5H-хинолин-8-она 7.
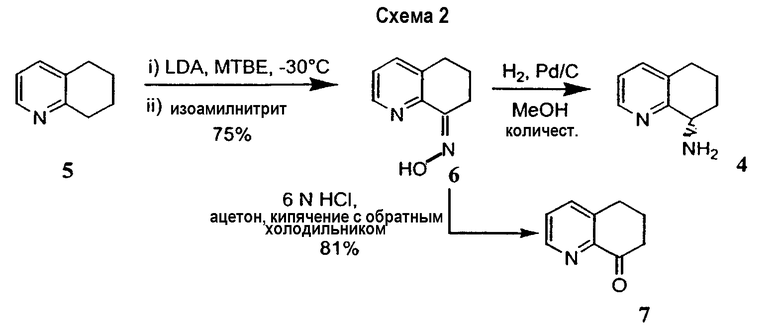
Реакцию нитрозирования проводят в растворителе или при сочетании растворителей, таких как простые эфиры (диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, метил-трет-бутиловый эфир, дипентиловый эфир, трет-амилметиловый эфир, диметоксиэфир, 2-метоксиэтиловый эфир, диэтиленгликольдиметиловый эфир, дифениловый эфир, дибензиловый эфир, тетрагидрофуран, 1,4-диоксан или морфолин), ароматические растворители (бензол, толуол, этилбензол, o-ксилол, м-ксилол, п-килол, мезитилен, хлорбензол, o-дихлорбензол, п-дихлорбензол, 1,2,4-трихлорбензол, нафталин, пиридин, фуран или тиофен), биполярные апротонные растворители (сероуглерод, диметилформамид, диметилсульфоксид или 1-метил-2-пирролидинон), алкановые растворители (петролейный эфир, уайт-спириты, пентан, гексан, гептан, октан, изооктан, нонан, декан, гексадекан, 2-метилбутан, циклопентан или циклогексан) и алкеновые растворители (1-пентен, 1-гексен, циклопентен или циклогексен). Наиболее предпочтительными растворителями являются простые эфиры, в частности диэтиловый эфир, метил-трет-бутиловый эфир, тетрагидрофуран (ТГФ), диметоксиэтан, 2-метоксиэтиловый эфир и 1,4-диоксан. Предпочтительными аддитивными добавками (активирующими сорастворителями) являются тетраметилэтилендиамин, пентаметилдиэтилентриамин, диметилпропиленмочевина или гексаметилтриамид фосфорной кислоты или любое их сочетание.
Продолжительность реакции металлирования составляет приблизительно от 5 минут до 4 часов, предпочтительно приблизительно от 15 минут до 1 часа; тогда как продолжительность реакции нитрозирования составляет приблизительно от 5 минут до 4 часов, предпочтительно приблизительно от 15 минут до 2 часов.
Для нитрозирования требуется, по меньшей мере, 2 эквивалента основания, однако, меньше 10 эквивалентов, предпочтительно требуется от 2 до 3 эквивалентов. Кроме того, основание не должно обладать значительной нуклеофильностью, чтобы не вступать в реакцию с выбранным нитрозирующим агентом. Поэтому применяемые основания представляют собой алкиллитиевые основания (метиллитий, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, изобутиллитий, фениллитий, этиллитий, н-гексиллитий или изопропиллитий), основания алкоксидов лития, натрия или калия (метилат натрия, этилат натрия или трет-бутилат натрия), или основания амидов лития, натрия или калия (амид лития, амид натрия, амид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, диизопропиламид лития, диэтиламид лития, дициклогексиламид лития или 2,2,6,6-тетраметилпиперидинамид лития) или любое подходящее их сочетание. Предпочтительными основаниями являются н-бутиллитий, трет-бутиллитий, диизопропиламид лития, дициклогексиламид лития, 2,2,6,6-тетраметилпиперидинамид лития (LTMP) и гексаметилдисилазид калия, и более предпочтительным является LTMP.
Реакцию нитрозирования проводят при температуре приблизительно от -100°C до 60°C, предпочтительно в интервале приблизительно от -30°C до 0°C.
Реакцию нитрозирования проводят при концентрации приблизительно от 0,01 M до 10 M, предпочтительно в интервале приблизительно от 0,2 до 0,5. Нитрозирующими агентами являются алкилнитриты (н-бутилнитрит, втор-бутилнитрит, трет-бутилнитрит, изобутилнитрит, изоамилнитрит, н-амилнитрит, этилнитрит, изопропилнитрит или н-пропилнитрит) и алкилдинитриты (1,3-пропандинитрит, 1,4-бутандинитрит или 1,5-пентандинитрит). Нитрозирующими агентами предпочтительно являются трет-бутилнитрит и изоамилнитрит. Применяют приблизительно от 0,5 до 10 эквивалентов нитрозирующего агента, предпочтительно приблизительно от 2 до 3 эквивалентов нитрозирующего агента.
Нитрозирование 5,6,7,8-тетрагидрохинолина проводят предпочтительно в ТГФ при температуре приблизительно от -40°C до -78°C, при концентрации приблизительно 0,2 M и в присутствии приблизительно 2,5 эквивалентов LTMP. Причем также предпочтительно, когда аминогруппа находится в положении 8 молекулы 5,6,7,8-тетрагидрохинолина или в положении 5 молекулы 5,6,7,8-тетрагидроизохинолина; m равно 0 или 1; и R2 представляет собой метил.
Восстановление оксима проводят стандартными способами, например, водородом в метаноле в присутствии 10% палладия-на-угле; водородом в метаноле в присутствии никеля Ренея; металлическим цинком в соляной кислоте; или металлическим цинком в трифторуксусной кислоте. В некоторых случаях для повышения выхода требуемого энантиомера было бы предпочтительно применять хиральный катализатор гидрирования или хирально модифицированный восстановитель.
Альтернативно оксим можно подвергнуть гидролизу с получением кетона стандартными способами, такими как кипячение с обратным холодильником с применением раствора водной 6н соляной кислоты в ацетоне или кипячение с обратным холодильником в водном 6н растворе соляной кислоты.
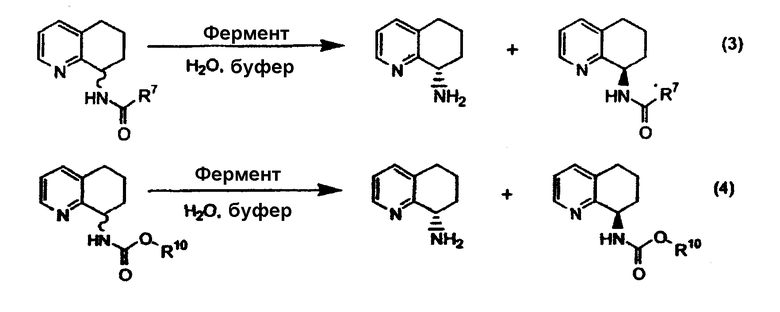
Способ ферментативного разделения
В настоящем изобретении предлагается применение ферментативных способов разделения рацемических смесей аминозамещенных конденсированных бициклических кольцевых систем, причем фермент либо селективно ацилирует или карбамоилирует рацемический амин, либо опосредует гидролиз, алкоголиз или аминолиз рацемических амидов или карбаматов. При каждом из способов получают смесь энантиомера в виде амина и другого (противоположного) энантиомера в виде амида или карбамата. При разделении энантиомеров и последующем отщеплении амида или карбамата получают оба энантиомера. Конденсированная бициклическая кольцевая система содержит необязательно замещенный 5- или 6-членный гетероароматический цикл (цикл C), конденсированный с необязательно замещенным 5- или 6-членным, частично или полностью насыщенным циклоалкилом или гетероциклоалкилом (цикл D).
Гетероароматический цикл включает пиридин, пиримидин, пиразин, пиридазин, триазин, имидазол, пиразол, триазол, оксазол и тиазол. Насыщенный цикл включает циклогексан, пиперидин, пиперазин, гексагидропиридазин, тетрагидрофуран, тетрагидротиофен, тетрагидропиран и тетрагидротиапиран.
В данном изобретении предлагается способ разделения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина формулы V или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина формулы VI с получением двух энантиомеров, включающий

а) энантиоселективное ацилирование или карбамоилирование рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина в присутствии энантиоселективного фермента в качестве катализатора; и
b) отделение непрореагировавшего аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина в виде первого энантиомера, от энантиомерного амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина; и
c) отщепление амидной или карбаматной группы с выделением второго энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
причем NH2 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тио, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической и гетероциклической групп.
Предпочтительный способ разделения энантиомеров 8-амино-5,6,7,8-тетрагидрохинолина с применением фермента также описан на схеме 3. Фермент можно применять в качестве катализатора в способе, при котором отдельный энантиомер рацемической смеси 8-амино-5,6,7,8-тетрагидрохинолина взаимодействует с подходящим сложным эфиром, карбоновой кислотой или карбонатом с образованием, соответственно, смеси либо соответствующих амидов, либо карбаматов, а непрореагировавший амин остается в энантиомерно чистой форме (уравнения 1 и 2). Такой способ можно применять для получения любого из двух энантиомеров 8-амино-5,6,7,8-тетрагидрохинолина, либо путем выделения разделенного на энантиомеры амина или путем отщепления амидной или карбаматной группы в разделенном на энантиомеры защищенном продукте.
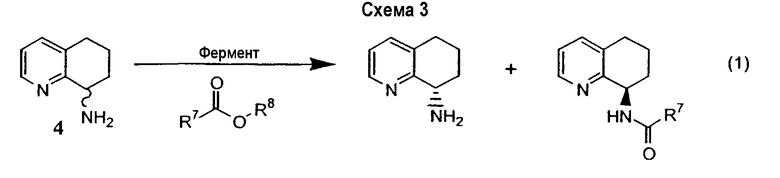
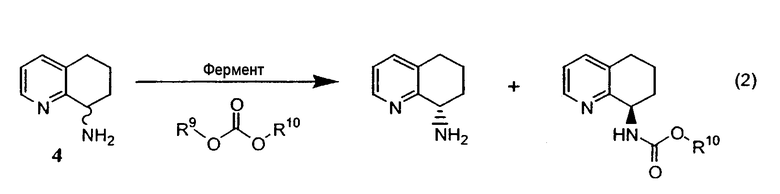
В сложных эфирах R7 выбран из группы, состоящей из H, низшего алкила (от С1 до C12), алкенила, алкинила, арила, гетероарила, замещенного арила, замещенного гетероарила, циклоалкила, циклоалкенила, карбоциклического, гетероциклического, бензила, винила и аллила; R8 выбран из группы, состоящей из H, низшего алкила (от С1 до C12), винила, бензила, аллила, трифторэтила, алкенила, алкинила, арила, гетероарила, замещенного арила, замещенного гетероарила, циклоалкила, циклоалкенила, карбоциклического и гетероциклического. В карбаматах R9 и R10 являются одинаковыми или разными и выбраны из группы, состоящей из низшего алкила (от С1 до C12), винила, аллила, бензила, трифторэтила, алкенила, алкинила, арила, гетероарила, замещенного арила, замещенного гетероарила, циклоалкила, циклоалкенила, карбоциклического и гетероциклического.
Другой способ разделения рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина с получением двух энантиомеров, включает
a) взаимодействие рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина формулы VII или рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидроизохинолина формулы VIII

с водой, спиртом, первичным или вторичным амином в присутствии энантиоселективного фермента в качестве катализатора с получением смеси соответствующего амина в виде первой энантиомерной формы, и непрореагировавшего амида или карбамата в виде второй энантиомерной формы;
b) отделение первого энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или аминозамещенного 5,6,7,8-тетрагидроизохинолина от непрореагировавшего амида или карбамата; и
c) отщепление амидной или карбаматной группы с получением второго энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или аминозамещенного 5,6,7,8-изохинолина;
причем амидная или карбаматная группа находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической и гетероциклической групп; и R3 представляет собой необязательно замещенный атом углерода или необязательно замещенный атом кислорода.
Альтернативно фермент можно применять для катализа при осуществлении способа, в котором рацемическая смесь подходящего амида или карбамата, производного от 8-амино-5,6,7,8-тетрагидрохинолина, подвергается энантиоселективному гидролизу с получением отдельного энантиомера 8-амино-5,6,7,8-тетрагидрохинолина и исходного амида или карбамата в энантиомерно чистой форме (уравнения 3 и 4). Такой способ можно применять для получения любого из энантиомеров 8-амино-5,6,7,8-тетрагидрохинолина, либо путем выделения разделенного на энантиомеры гидролизованного амина, либо путем отщепления амидной или карбаматной группы в разделенном на энантиомеры, защищенном продукте.
Подходящими ферментами в упомянутых выше способах служат (но ими не ограничивается) следующие ферменты:
Липазы:
Candida antarctica (A и B)
Candida rugosa (также называемая Candida cylindracea)
Pseudomonas fluorescens (также называемая Pseudomonas cepacia; также как Burkholderia cepacia)
Pseudomonas aeruginosa
липаза вида Alcaligenes
Burkholderia plantarii (Pseudomonas plantarii)
Липаза вида Pseudomonas
липаза Chromobacterium viscosum (Burkholderia glumae)
липаза поджелудочной железы свиньи
вида Mucor (липаза Mucor miehei)
липаза Rhizopus delemar
липаза Rhizomucor miehei
Rhizopus niveus и
Humicola lanuginosa;
Протеазы:
Substilin Carlsberg и
Substilin BPN′; и
Пенициллинацилаза Alcaligenes faecalis.
Описано применение некоторых ферментов для селективного разделения рацемических аминов (или для селективного гидролиза рацемических амидов). См:
1. Reetz М.T.; Driesbach C., Chimia, 1994, 48, 570;
2. Iglesias L.E.; Sanchez V.M.; Rebolledo F.; Gotor V., Tetrahedron: Asymmetry, 1997, 8, 2675;
3. Takayama S.; Lee S.T.; Hung S.-C.; Wong C.-H., Chem. Commun., 1999, 2, 127;
4. Smidt H.; Fisher А.; Fisher Р.; Schmid R.D., Biotechnol. Tech., 1996, 10, 335;
5. Koeller K.M., Wong C.H. Nature, 2001, 409, 232;
6. Carrea G., Riva S., Angew. Chem. Int. Ed. Engl., 2000, 39, 2226;
7. Van Rantwijk F., Hacking М.A.P.J., Sheldon R.A. Monat. Chem. 2000, 131, 549;
8. Hacking М.A.P.J., vanRantwijk F., Sheldon R.A. J. of MolecularCatalysis B: Enzymatic. 2000, 9, 201;
9. Gotor V., Biocat. Biotrans., 2000, 18, 87;
10. Morgan B., Zaks A., Dodds D.R., Liu J.C., Jain R., Megati S., Njoroge F.G., Girijavallabhan V.M. J. Org. Chem., 2000, 65, 5451;
11. Kazlauskas R.J.; Weissfloch A.N.E.; J. of MolecularCatalysis B: Enzymatic. 1997, 3, 65-72;
12. Sanchez V.M.; Rebolledo F.; Gotor V. Tet. Asym., 1997, 8, 37-40.
13. Wagegg T.; Enzelberger М.M.; Bornscheuer U.T.; Schmid R.D. Journal of Biotechnology, 1998, 61, 75-78;
14. Messina F.; Botta M.; Corelli F.; Schneider М.P.; Fazio F. J. Org. Chem. 1999, 64, 3767-3769;
15. Soledad de Castro M.; Dominguez P.; Sinisterra J.V., Tetrahedron, 2000, 56, 1387-1391;
16. Maestro А.; Astrorga C.; Gotor V. Tet. Asym., 1997, 8, 3153-3159;
17. Balkenhohl F.; Ditrich K.; Hauer B.; Ladner W. J. Prakt. Chem. 1997, 339, 381-384;
18. Luna A.; Astorga C.; Fulop F.; Gotor V. Tet. Asym., 1998, 9, 4483-4487;
19. Van Langen L.M.; Oosthoek N.H.P.; Guranda D.T.; Van Rantwijk F.; Svedas V.K.; Sheldon R.A., Tet. Asym. 2000, 11, 4593-4600; и
20. Ami E.; Horui H. Biosci. Biotechnol. Biochem., 1999, 63, 2150-2156.
Ферментативные способы осуществляют в присутствии предпочтительно липазы или протеазы в качестве энантиоселективного фермента, которые выбраны из группы, состоящей более предпочтительно из Candida antarcticaA и B, Candida rugosa,Pseudomonas fluorescens, Substilin Carlsberg, Substilin BPN′ и пенициллина Alcaligenes faecalis.
Ацилирующий агент представляет собой либо необязательно замещенную кислоту, необязательно замещенный сложный эфир, либо необязательно замещенный первичный, вторичный или третичный амид. Карбамоилирующий агент представляет собой необязательно замещенный карбонат. Предпочтительно, когда ацилирующий агент представляет собой этилацетат, а карбамоилирующий агент представляет собой дибензилкарбонат или диалкилкарбонат.
Ферментативное разделение предпочтительно проводят в растворителе или комбинации растворителей, таких как: простые эфиры (например, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, метил-трет-бутиловый эфир, дипентиловый эфир, трет-амилметиловый эфир, диметоксиэтан, 2-метоксиэтиловый эфир, диэтиленгликольдиметиловый эфир (диглим), дифениловый эфир, дибензиловый эфир, тетрагидрофуран, 1,4-диоксан, морфолин и т.д.), ароматические растворители (например, бензол, толуол, этилбензол, o-ксилол, м-ксилол, п-ксилол, ксилолы, мезитилен, нитробензол, хлорбензол, o-дихлорбензол, п-дихлорбензол, 1,2,4-тихлорбензол, нафталин, пиридин, 1-метилпиррол, фуран, тиофен и т.д.), растворители на основе хлорированных алкилов (например, метиленхлорид, хлороформ, дихлорэтан, трихлорэтилен и т.д.), биполярные апротонные растворители (например, сероуглерод, диметилформамид, диметилсульфоксид, 1-метил-2-пирролидинон, ацетонитрил, нитрометан, нитроэтан и т.д.), алкановые растворители (например, петролейный эфир, уайт-спириты (лигроин), пентан, гексан, гексаны, гептан, октан, изооктан, нонан, декан, гексадекан, 2-метилбутан, циклопентан, циклогексан и т.д.), алкеновые растворители (например, 1-пентен, 1-гексен, циклопентен, циклогексен и т.д.), кетонные растворители (например, ацетон, бутанон, 2-пентанон, 3-пентанон, метилизобутилкетон, циклопентанон, циклогексанон, циклогептанон и т.д.), вода. Ферментативное ацилирование или карбамоилирование предпочтительно проводят либо в диизопропиловом эфире, либо в метил-трет-бутиловом эфире, хотя в таких случаях в качестве растворителя можно также применять ацилирующий агент или карбамоилирующий агент. Ацилирующий агент в таком случае предпочтительно представляет собой этилацетат, в то время как карбамоилирующие агенты предпочтительно представляют собой дибензилкарбонат и диаллилкарбонат. Растворителем при ферментативном гидролизе, алкоголизе и аминолизе предпочтительно является вода, хотя в таких случаях в качестве растворителя можно также применять нуклеофильные спирт или амин.
Температура реакции составляет приблизительно от 0°C до 120°C, предпочтительно температура составляет приблизительно от 50° до 60°C.
Концентрация исходного субстрата при ферментативном разделении составляет приблизительно от 0,01 M до 10 М, предпочтительно концентрация составляет приблизительно от 0,3 до 0,6 M, тогда как количество эквивалентов фермента по отношению к субстрату составляет приблизительно от 0,01 до 10 по массе, предпочтительно количество эквивалентов составляет приблизительно от 0,3 до 0,4 эквивалентов по массе. Как правило, продолжительность реакции составляет приблизительно от 30 минут до 48 часов, предпочтительно приблизительно от 2 до 6 часов.
Амид- или карбаматзамещенные соединения подвергаются гидролизу при стандартных условиях, таких как кипячение с обратным холодильником в растворе соляной кислоты в ацетоне или кипячение с обратным холодильником в соляной кислоте. Аминогруппа предпочтительно находится в положении 8 молекулы 5,6,7,8-тетрагидрохинолина или в положении 5 молекулы 5,6,7,8-тетрагидроизохинолина, m равно 0 или 1, и R2 представляет собой метил.
Способ рацемизации
В настоящем изобретении раскрывается методика рацемизации отдельных энантиомеров необязательно замещенных аминозамещенных конденсированных бициклических кольцевых систем XII, где путем обработки в жестких экспериментальных условиях энантиомерно чистый или энантиомерно обогащенный амин, либо в виде первичного, вторичного или третичного амина, либо в виде производного амина преобразуется до рацемата. В тех случаях, когда амин замещен в виде аминопроизводного (такого как амид, карбамат или мочевина), гидролиз такой функциональной группы в кислых или основных условиях после процедуры рацемизации дает соответствующий рацемический амин. Конденсированная бициклическая кольцевая система содержит необязательно замещенный 5- или 6-членный гетероароматический цикл (цикл C), конденсированный с необязательно замещенным 5- или 6-членным частично или полностью насыщенным циклоалкилом или гетероциклоалкилом (цикл D). Гетероароматический цикл включает пиридин, пиримидин, пиразин, пиридазин, триазин, имидазол, пиразол, триазол, оксазол и тиазол. Насыщенный цикл включает циклогексан, пиперидин, пиперазин, гексагидропиридазин, тетрагидрофуран, тетрагидротиофен, тетрагидропиран и тетрагидротиапиран. Необязательные заместители аминогруппы (R7 и R8 выше) включают водород, необязательно замещенный алкил, арил, гетероалкил, гетероарил, аралкил, алканоил, алкилсульфонил, карбонил или группу, замещенную ароматическим или гетероциклическим кольцом, арилоксикарбонил, алкоксикарбонил, арилкарбамоил, алкилкарбамоил, арилтиокарбонил, алкилтиокарбонил и карбамоил.
Настоящее изобретение относится к способу рацемизации отдельного энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина формулы XIII или аминозамещенного 5,6,7,8-тетрагидроизохинолина формулы XIV для получения соответствующей рацемической смеси:

включающий:
а) нагревание энантиомерно обогащенного аминозамещенного 5,6,7,8-тетрагидрохинолина или энантиомерно обогащенного аминозамещенного 5,6,7,8-тетрагидроизохинолина, неразбавленного или в органическом растворителе в присутствии или в отсутствие добавки; и
b) когда либо R7 либо R8 не является водородом, отщепление группы R7 или R8 при соответствующих условиях (например, гидролиз, промотированный кислотой, в случае амидов и карбаматов) с получением соответствующего рацемического амина,
причем NR7R8 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тио, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
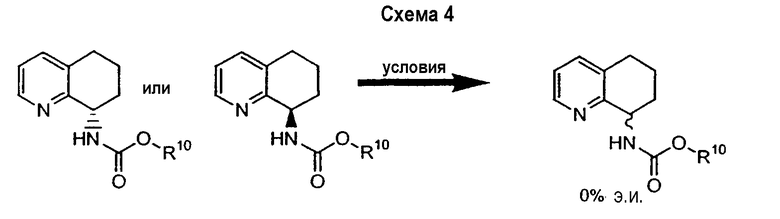
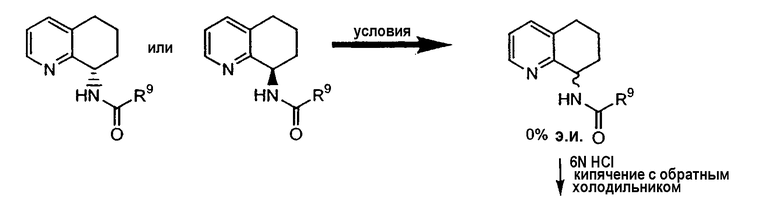
Также описан предпочтительный способ рацемизации энантиообогащенного (R)- или (S)-8-амино-5,6,7,8-тетрагидрохинолина или энантиообогащенных (R)- или (S)-N-(5,6,7,8-тетрагидрохинолин-8-ил)амидов и карбаматов (Схема 4). Такой способ можно применять для рацемизации либо энантиомера 8-амино-5,6,7,8-тетрагидрохинолина, либо его соответствующих амидов или карбаматов.
Для получения соответствующего амина в случае амидов и карбаматов амидные и карбаматные группы могут быть удалены. В любом случае полученный таким образом рацемический амин можно повторно подвергнуть ферментативному разделению, описанному выше, и таким образом рециркулировать.
В амидах R9 выбран из группы, состоящей из H, C1-С12-алкила, алкенила, алкинила, арила, гетероарила, замещенного арила, замещенного гетероарила, циклоалкила, циклоалкенила, карбоциклического, гетероциклического, бензила, винила и аллила. В карбаматах R10 выбран из группы, состоящей из C1-С12-алкила, винила, аллила, бензила, трифторэтила, алкенила, алкинила, арила, гетероарила, замещенного арила, замещенного гетероарила, циклоалкила, циклоалкенила, карбоциклической и гетероциклической группы.
Реакцию рацемизации предпочтительно проводят с неразбавленным веществом или в растворителе, или в комбинации растворителей, таких как простые эфиры (например, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, метил-трет-бутиловый эфир, дипентиловый эфир, трет-амилметиловый эфир, диметоксиэтан, 2-метоксиэтиловый эфир, диэтиленгликольдиметиловый эфир (диглим), дифениловый эфир, дибензиловый эфир, тетрагидрофуран, 1,4-диоксан, морфолин и т.д.), ароматические растворители (например, бензол, толуол, этилбензол, o-ксилол, м-ксилол, п-ксилол, ксилолы, мезитилен, нитробензол, хлорбензол, o-дихлорбензол, п-дихлорбензол, 1,2,4-тихлорбензол, нафталин, пиридин, 1-метилпиррол, фуран, тиофен и т.д.), растворители на основе хлорированных алкилов (например, метиленхлорид, хлороформ, дихлорэтан, трихлорэтилен и т.д.), биполярные апротонные растворители (например, сероуглерод, диметилформамид, диметилсульфоксид, 1-метил-2-пирролидинон, ацетонитрил, нитрометан, нитроэтан и т.д.), алкановые растворители (например, петролейный эфир, уайт-спириты (лигроин), пентан, гексан, гексаны, гептан, октан, изооктан, нонан, декан, гексадекан, 2-метилбутан, циклопентан, циклогексан и т.д.), алкеновые растворители (например, 1-пентен, 1-гексен, циклопентен, циклогексен и т.д.), кетонные растворители (например, ацетон, бутанон, 2-пентанон, 3-пентанон, метилизобутилкетон, циклопентанон, циклогексанон, циклогептанон и т.д.) или вода. Рацемизацию незамещенного первичного амина или соответствующего амида или карбамата наиболее предпочтительно проводить с неразбавленым веществом (в отсутствие растворителя).
Температура реакции составляет приблизительно от 0°C до 300°C, предпочтительно температура составляет приблизительно от 120°C до 150°C.
В тех случаях, когда используют растворитель, концентрация исходного субстрата при рацемизации составляет приблизительно от 0,01 до 10, предпочтительно концентрация составляет приблизительно от 0,3 до 0,6 M.
Реакцию рацемизации можно проводить необязательно в присутствии либо каталитического, либо стехиометрического количества подходящей добавки или при сочетании добавок, таких как основания, кислоты Льюиса, альдегид или кетон. Подходящими основаниями являются гидроксиды лития, натрия, калия или цезия (KOH, NaOH, LiOH, CsOH), алкоксиды лития, натрия, калия или цезия (метилат натрия, этилат натрия, изопропилат натрия, трет-бутилат натрия, трет-бутилат калия, метилат лития), гидриды лития, натрия, калия (LiH, NaH, KH), алкиллитиевые основания (метиллитий, н-бутиллитий, втор-бутиллитий, трет-бутиллитий, изобутиллитий, фениллитий, этиллитий, н-гексиллитий или изопропиллитий) или основания амидов лития, натрия или калия (амид лития, амид натрия, амид калия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, диизопропиламид лития, диэтиламид лития, дициклогексиламид лития или литий-2,2,6,6-тетраметилпиперидинамид) или любое их подходящее сочетание. Подходящими кислотами Льюиса являются соли металлов (AlCl3, FeCl3, CrCl2, HgCl2, CuCl, TiCl4, Yb(OTf3), InOTf, TiCl2OiPr2, Ti(OiPr)4), металлоорганические соединения (триметилалюминий, хлорид диметилалюминия) и соединения бора (BF3, B(OMe3), B(OiPr)3). Подходящими альдегидами являются бензальдегид, 4-метоксибензальдегид, 2,6-дихлорбензальдегид, ацетальдегид и формальдегид. Подходящими кетонами являются ацетон, ацетофенон, бутанон, 2-пентанон и циклогексанон. Предпочтительное количество добавки, определяемое как количество добавляемых к субстрату эквивалентов, составляет приблизительно от 0,01 до 10 по массе, предпочтительное количество эквивалентов составляет приблизительно от 0,1 до 1 эквивалента по массе. Рацемизацию незамещенного первичного амина или соответствующего амида или карбамата проводят предпочтительно в отсутствие добавки.
Как правило, продолжительность реакции составляет приблизительно от 30 минут до 48 часов, предпочтительно приблизительно от 1 до 2 часов.
Рацемизацию предпочтительно проводят в инертной атмосфере, наиболее предпочтительно в атмосфере сухого азота или аргона.
Рацемические амид- или карбаматзамещенные соединения подвергают гидролизу в стандартных условиях, таких как кипячение с обратным холодильником в растворе соляной кислоты в ацетоне или кипячение с обратным холодильником в соляной кислоте. Аминогруппа предпочтительно находится в положении 8 молекулы 5,6,7,8-тетрагидрохинолина или в положении 5 молекулы 5,6,7,8-тетрагидроизохинолина, m равно 0 или 1, R9 представляет собой метил, а R10 представляет собой метил, аллил или бензил.
Способ асимметрического получения
В изобретении также описан способ образования аминогруппы, занимающей определенное стереоположение, путем образования имина между аминогруппой хирального вспомогательного энантиомерно чистого первичного амина и кетонным субстратом с последующим диастереоселективным восстановлением полученного имина с получением вторичного амина, и затем удаление хирального вспомогательного фрагмента с получением на субстрате энантиомера первичной аминогруппы. Можно получить любую из двух энантиомерных форм первичного амина. Альтернативно, кетон образуется окислением соответствующей гидроксильной группы в стандартных условиях на предварительной стадии.
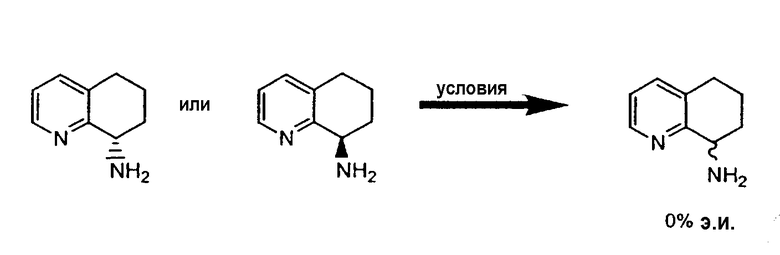
Способ получения энантиомера конденсированного бициклического кольца, замещенного первичным амином, формулы IX, включает

a) образование основания Шиффа кетогруппы, находящейся на цикле B конденсированного бициклического кольца, при ее взаимодействии с первичной аминогруппой энантиомерно чистого вспомогательного хирального соединения R*NH2 формулы X

с получением соответствующего энантиомерно чистого имина конденсированного бициклического кольца;
b) диастереоселективное восстановление имина с получением соответствующего энантиомерно чистого вторичного амина конденсированного бициклического кольца; и
c) удаление вспомогательного хирального фрагмента R* с образованием энантиомера конденсированного бициклического кольца, замещенного первичным амином;
причем цикл А представляет собой 5- или 6-членный гетероароматический цикл, P представляет собой атом азота, атом серы или атом кислорода; цикл B представляет собой 5- или 6-ченный частично или полностью насыщенный циклоалкил или гетероциклоалкил;
причем NH2 находится в положении цикла B; а R2 находится в положении любого другого атома водорода конденсированного бициклического кольца;
где m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы; и R4, R5 и R6 отличаются друг от друга и выбраны из группы, состоящей из водорода, алкила, алкенила, циклоалкила, циклоалкенила и 5- или 6-членного ароматического цикла; и, по меньшей мере, один из R4, R5 или R6 представляет собой 5- или 6-членный ароматический или гетероароматический цикл.
Предпочтительный способ получения энантиомерно обогащенного 8-амино-5,6,7,8-тетрагидрохинолина с использованием хирального вспомогательного фрагмента описан на схеме 5 (схема 5).
Методика включает образование основания Шиффа 6,7-дигидро-5H-хинолин-8-она 10 с подходящим энантиомерно чистым первичным бензиламином (R*-NH2) с получением имина 11. Последующее восстановление 11 подходящим гидридным реагентом (например, борогидридом натрия), сопровождаемое восстановительным отщеплением хирального вспомогательного фрагмента, приводит к получению указанного в заголовке соединения 8 в энантиомерно чистой (или энантиомерно обогащенной) форме. Такой путь получения можно адаптировать для получения любого из двух энантиомеров 8, в зависимости от выбора хирального вспомогательного фрагмента.
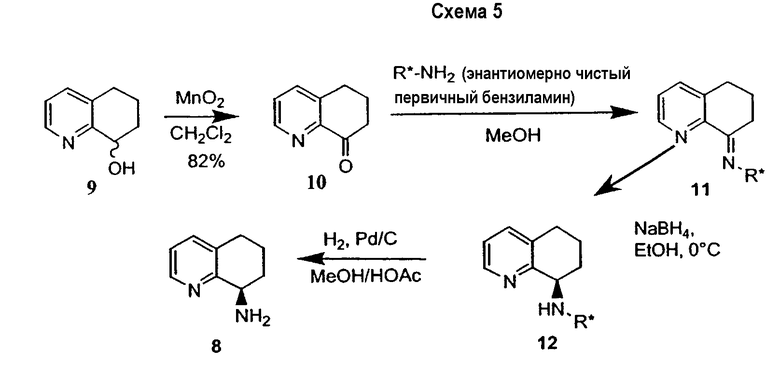
Подходящие хиральные вспомогательные соединения, применяемые в указанной последовательности, имеют общую формулу X, где R4, R5 и R6 неравнозначны. По меньшей мере, один из R4-R6 должен представлять собой ароматическую группу (либо 5- или 6-членный арил, гетероарил, замещенный арил, либо замещенный гетероарил); или же R4-R6 могут быть выбраны из указанного ниже списка:

где R4, R5 и R6 одинаковые или отличаются и выбраны из группы, состоящей из H, алкила (С1-C12), алкенила, алкинила, арила, гетероарила, замещенного арила, замещенного гетероарила, циклоалкила, циклоалкенила, карбоциклического, гетероциклического, карбоксилата, амида, карбоновой кислоты и бензила.
Примерами подходящих хиральных вспомогательных соединений являются (но ими не ограничиваются) следующие соединения:
(R) или (S)-1-фенилэтиламин,
(R) или (S)-1-(1-нафтил)этиламин,
(R) или (S)-1-(2-нафтил)этиламин,
(R) или (S)-2-фенилглицинол,
(R) или (S)-1-(4-бромфенил)этиламин,
(R) или (S)-α-метил-4-нитробензиламин,
(1S,2R) или (1R,2S)-2-амино-1,2-дифенилэтанол,
(R) или (S)-1-фенилпропиламин,
(R) или (S)-1-(п-толил)этиламин,
(1S,2R) или (1R,2S)-цис-1-амино-2-инданол,
(R) или (S)-1-аминоиндан,
(R) или (S)-1-фенил-2-(п-толил)этиламин,
(R) или (S)-1-аминотетралин,
(R) или (S)-3-бром-α-метилбензиламин,
(R) или (S)-4-хлор-α-метилбензиламин,
(R) или (S)-3-метокси-α-метилбензиламин,
(R) или (S)-2-метокси-α-метилбензиламин,
(R) или (S)-4-метокси-α-метилбензиламин,
(R) или (S)-3-амино-3-фенилпропан-1-ол и
(R) или (S)-1-амино-1-фенил-2-метоксиэтан.
Хиральное вспомогательное соединение представляет собой предпочтительно фенилэтиламин, нафтилэтиламин, фенилпропиламин или метоксифенилэтиламин, более предпочтительно (R)-(+)-фенилэтиламин, (R)-(+)-1-фенилпропиламин или (S)-(-)-1-(4-метоксифенил)этиламин.
Подходящими растворителями при образовании имина и/или восстановлении имина до амина являются, сами по себе или в комбинации простые эфиры (диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, метил-трет-бутиловый эфир, дипентиловый эфир, трет-амилметиловый эфир, диметоксиэтан, 2-метоксиэтиловый эфир, диэтиленгликольдиметиловый эфир, дифениловый эфир, дибензиловый эфир, тетрагидрофуран, 1,4-диоксан или морфолин), ароматические растворители (бензол, толуол, этилбензол, o-килол, м-ксилол, п-ксилол, мезитилен, нитробензол, хлорбензол, o-дихлорбензол, п-дихлорбензол, 1,2,4-трихлорбензол, нафталин, пиридин, 1-метилпиррол, фуран или тиофен), хлорированные алкильные растворители (метиленхлорид, хлороформ, дихлорэтан, трихлорэтан), алкановые растворители (петролейный эфир, уайт-спириты, пентан, гексан, гептан, октан, изооктан, нонан, декан, гексадекан, 2-метилбутан, циклопентан или циклогексан) и спирты (метанол, этанол, пропанол, изопропанол, н-бутанол, изобутанол, втор-бутанол, пентанол, изоамиловый спирт или циклогексанол). Предпочтительными растворителями являются хлорированные алкильные растворители, такие как метиленхлорид, и спирты, такие как метанол и этанол.
Восстановителями являются восстановители на основе борогидридов (борогидрид натрия, борогидрид лития, борогидрид калия, цианоборогидрид натрия, триацетоксиборогидрид натрия, три-втор-бутилборогидрид лития, триэтилборогидрид лития, трисиамилборогидрид лития, катехолборан, 9-BBN, дисиамилборан, тексилборан или боран), реагенты на основе алюмогидридов(диизобутилалюмогидрид, алюмогидрид лития или натрий-бис-(2-метоксиэтокси)алюмогидрид) и газообразный водород в сочетании с подходящим металлическим катализатором (палладий-на-угле, оксид платины, никель Ренея, родий-на-угле или рутений-на-угле).
Количество эквивалентов восстановителя составляет приблизительно от 0,2 до 10 эквивалентов, предпочтительно приблизительно от 1 до 2 эквивалентов. Концентрация исходного субстрата составляет приблизительно от 0,01 до 10, предпочтительно приблизительно от 0,2 до 0,6 M, тогда как температура реакции составляет приблизительно от -100 до 100°C, наиболее предпочтительно приблизительно от -30 до 25°C.
Стехиометрическое отношение между исходным бициклическим кольцом и хиральным вспомогательным соединением составляет приблизительно от 1:0,5 до 1:5, предпочтительно 1:1.
Удаление хирального вспомогательного фрагмента осуществляют стандартными способами, такими как гидрирование в подходящем растворителе или в присутствии металлического катализатора, или путем отщепления, опосредованного кислотой.
Конденсированное бициклическое кольцо предпочтительно представляет собой аминозамещенный 5,6,7,8-тетрагидрохинолин или 5,6,7,8-тетрагидроизохинолин, m равно 0 или 1, и R2 представляет собой метил.
Настоящее изобретение также относится к новым промежуточным соединениям, которые указаны в примерах. Наиболее предпочтительными являются те, которые представляют собой энантиомеры.
Следующие примеры предназначены для того, чтобы проиллюстрировать изобретение, но изобретение ими не ограничивается.
ПРИМЕРЫ
Получение (R,S)-8-амино-5,6,7,8-тетрагидрохинолина селективным гидрированием N-(хинолин-8-ил)ацетамида
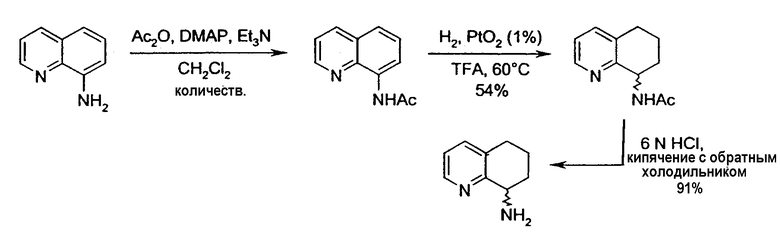
Получение N-(хинолин-8-ил)ацетамида
К раствору 8-аминохинолина (33,37 г, 0,231 моль), DMAP (4-диметиламинопиридин) (1,40 г, 0,011 моль) и триэтиламина (Et3N) (37 мл, 0,265 моль) в CH2Cl2 (хлористом метилене) (275 мл) при перемешивании добавляют уксусный ангидрид (Ac2О) (26,5 мл, 0,281 моль). Спустя 20 часов реакционную смесь выливают в насыщенный водный раствор NaHCO3 (бикарбонат натрия). Фазы разделяют и водную фазу экстрагируют эфиром (3×150мл). Объединенные органические фазы сушат (Na2SO4)(сульфат натрия), фильтруют и концентрируют в вакууме, получая при этом 43,56 г (100%) N-(хинолин-8-ил)ацетамида в виде твердого вещества бежевого цвета. Полученное вещество без дальнейшей очистки используют на следующих стадиях. 1H ЯМР (CDCl3) δ 2,35 (с, 3H), 7,42-7,56 (м, 3H), 8,15 (дд, 1H, J=1,5, 8,4 Гц), 8,76 (дд, 1H, J=1,8, 7,2 Гц), 8,79 (дд, 1H, J=1,5, 4,2 Гц), 9,78 (уш.с, 1H); 13C ЯМР (CDCl3) δ 25,5, 116,8 121,8, 122,0, 127,8, 128,3, 134,9, 136,8, 138,6, 148,5, 169,2. ES-МС m/z 187(M+H).
Получение (R,S)-N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамида
N-(хинолин-8-ил)ацетамид (173,27 г, 0,930 моль) растворяют в трифторуксусной кислоте (TFA) (2,7л) в 10л трехгорлой круглодонной колбе, оснащенной тефлоновой трубкой для пропускания газа, устройством для контроля температуры и вертикальной механической мешалкой. Раствор нагревают при энергичном перемешивании до 60°C и дегазируют в течение 20 минут газообразным азотом. Добавляют оксид платины (PtO2) (2,11 г, 9,3 ммоль) в виде твердого вещества. Затем через раствор медленно барботируют газообразный водород (H2) из резервуара. По данным GC-анализа (газовой хроматографии) аликвот реакционной смеси, реакция завершается спустя 5,5 час. Затем реакционную смесь дегазируют азотом и охлаждают до 30°C. Содержимое фильтруют через стеклянную фритту для удаления катализатора и удаляют растворитель в вакууме. Полученный продукт обрабатывают насыщенным водным раствором NaOH (гидроксид натрия), пока pH раствора не достигнет 14. Раствор экстрагируют CH2Cl2 (8×500 мл), сушат над сульфатом магния (MgSO4), фильтруют и концентрируют в вакууме. Сырой продукт очищают флэш-хроматографией на колонке с силикагелем (элюция 1% MeOH (метанол) в CH2Cl2, затем 5% MeOH (метанол) в CH2Cl2), получая при этом 95,37 г (54%) (R,S)-N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамида. 1H ЯМР (CDCl3) δ 1,80-2,00 (м, 4H), 2,79-2,85 (м, 2H), 2,90-3,00 (м, 2H), 3,91 (с, 3H), 7,95 (с, 1H), 8,93 (с, 1H); 13C ЯМР (CDCl3) δ 22,8, 23,1, 28,9, 30,0, 33,1, 52,5, 123,7, 132,5, 138,0, 148,2, 162,6, 166,5. ES-МС m/z 192 (M+H).
Получение (R,S)-8-амино-5,6,7,8-тетрагидрохинолина
8-Ацетамидо-5,6,7,8-тетрагидрохинолин (41,94 г, 0,220 моль) растворяют в 6н HCl (соляной кислоте) (550 мл) и кипятят с обратным холодильником. Спустя 17 часов, реакционную смесь охлаждают до комнатной температуры и обрабатывают насыщенным водным раствором NaOH до тех пор, пока pH раствора не достигнет 14. Затем смесь экстрагируют CH2Cl2 (4×500 мл) и объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме. Полученный сырой продукт очищают перегонкой по методу Кюгельрора (Kugelrohr), получая при этом 29,62 г (91%) (R,S)-8- амино-5,6,7,8-тетрагидрохинолина в виде бесцветного маслянистого вещества. 1H ЯМР (CDC13) δ 1,52-1,62 (м, 2H), 1,78-1,85 (м, 1H), 1,91 (уш.с, 2H), 2,02-2,06 (м, 1H), 2,60-2,65 (м, 2H), 3,83-3,87 (м, 2H), 6,91 (дд, 1H, J=8,5 Гц), 7,21 (дд, 1H, J=8,1 Гц), 8,26 (д, 1H, J=5 Гц); 13C ЯМР (CDCl3) δ 19,6, 28,7, 31,7, 51,0, 121,3, 131,2, 136,4, 146,7, 159,2. ES-МС m/z 149 (M+H).
Дополнительные примеры селективного гидрирования представлены ниже в таблице и в уравнении 6.
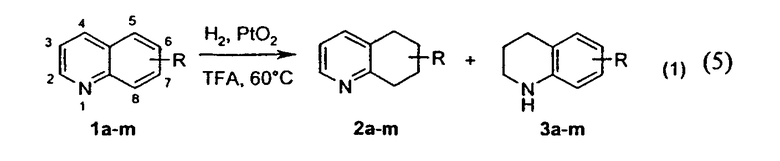
Гидрирование замещенных хинолинов 1а-m (уравнение 5)а
(%)
2-Me
2-Me
b) Выходы приблизительны, так как реакцию проводили в небольшом масштабе (30 мг 1f) с 20% PtO2.
c) Обнаружены следовые количества (≈ 2%) гидрированных продуктов (хинолин, 1,2,3,4-THQ, 5,6,7,8-THQ).
d) 16% исходного продукта осталось непрореагировавшим.
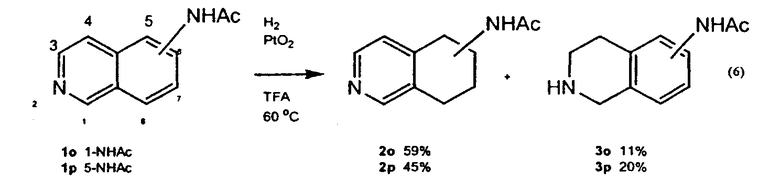
Получение сложного метилового эфира 5,6,7,8-тетрагидрохинолин-3-карбоновой кислоты
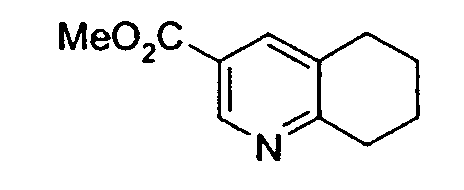
Типичная методика для проведения реакций гидрирования в небольшом масштабе. В 2- или 3-горлую круглодонную колбу емкостью 100 мл с магнитной мешалкой добавляют метилхинолин-3-карбоксилат (170 мг, 0,908 ммоль) и оксид платины (IV) (10,3 мг, 5 мол.%). Колба снабжена двумя выпускными отверстиями, которые герметизированы с помощью резиновых прокладок и содержат запорные тефлоновые краны. В реакционную колбу с помощью пластмассового шприца в атмосфере азота добавляют трифторуксусную кислоту (3,0 мл), которая была продута аргоном для удаления кислорода. Реакционную смесь перемешивают с трифторуксусной кислотой и колбу заполняют газообразным водородом из баллона с помощью иглы через одно из отверстий с герметизирующей прокладкой. Запорные тефлоновые краны закрывают, нагревают реакционную смесь до 60°C и перемешивают в течение 5 часов. За ходом реакции следят с помощью ГХ(GC) и TCX. Реакционную смесь охлаждают до комнатной температуры и добавляют насыщенный водный раствор бикарбоната натрия, пока смесь не станет нейтральной. Затем смесь экстрагируют CH2Cl2 (3×30 мл), сушат (MgSO4) и удаляют растворитель в вакууме. Полученный таким образом сырой продукт выделяют с помощью флэш-хроматографии (силикагель, 10% EtOAc в гексане). Указанное в заголовке соединение получают в виде желтоватой жидкости (121 мг, 70%), данные ЯМР которой соответствуют: 1Н ЯМР (CDCl3, 300 МГц) δ 1,80-2,00 (м, 4H), 2,79-2,85 (м, 2H), 2,90-3,00 (м, 2H), 3,91 (с, 3H), 7,95 (с, 1H), 8,93 (с, 1H); 13C ЯМР (CDCl3): δ 22,8, 23,1, 28,9, 30,0, 33,1, 52,5, 123,7, 132,5, 138,0, 148,2, 162,6, 166,5; МС m/z: 192 (M+H+). Также выделяют сложный метиловый эфир 1,2,3,4-тетрагидрохинолин-3-карбоновой кислоты (19 мг, 11%).
С помощью описанной методики проведения реакций в небольшом масштабе из N-(хинол-2-ил)ацетамида (164 мг, 0,881 ммоль) получают N-(5,6,7,8-тетрагидрохинолин-2-ил)ацетамид (114 мг, 69%); из N-(хинол-3-ил)ацетамида (138 мг, 0,741 ммоль) получают N-(5,6,7,8-тетрагидрохинолин-3-ил)ацетамид (89 мг, 63%); из N-(хинол-5-ил)ацетамида (158 мг, 0,849 ммоль) получают N-(5,6,7,8-тетрагидрохинолин-5-ил)ацетамид (72 мг, 45%) и N-(1,2,3,4-тетрагидрохинолин-5-ил)ацетамид (44 мг, 27%); из N-(хинол-6-ил)ацетамида (143 мг, 0,768 ммоль) получают N-(5,6,7,8-тетрагидрохинолин-6-ил)ацетамид (71 мг, 49%) и N-(1,2,3,4-тетрагидрохинолин-6-ил)ацетамид (40 мг, 28%), из N-(хинол-8-ил)ацетамида (186,1 мг, 0,999 ммоль) получают N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамид (118,3мг, 62%) и N-(1,2,3,4-тетрагидрохинолин-8-ил)ацетамид (26,7 мг, 14%), из 2-фенилхинолина (162 мг, 0,781 ммоль) получают 2-фенил-5,6,7,8-тетрагидрохинолин (111 мг, 68%) и 2-фенил-1,2,3,4-тетрагидрохинолин (20 мг, 10%). При взаимодействии сложного метилового эфира хинолин-2-карбоновой кислоты (160 мг, 0,855 ммоль) получают сложный метиловый эфир 5,6,7,8-тетрагидрохинолин-2-карбоновой кислоты (83 мг, 51%) и сложный метиловый эфир 1,2,3,4-тетрагидрохинолин-2-карбоновой кислоты (33 мг, 20%).
Получение N-(2-метил-5,6,7,8-тетрагидрохинолин-4-ил)ацетамида
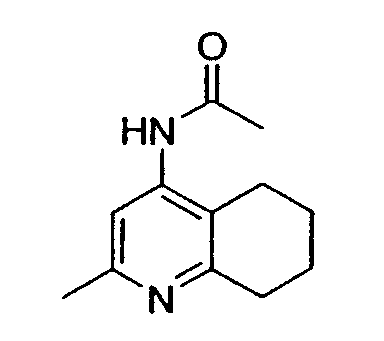
При взаимодействии N-(2-метилхинолин-4-ил)ацетамида (136 мг, 0,679 ммоль) с помощью описанной методики гидрирования в небольшом масштабе (вместо насыщенного NaHCO3 обрабатывают NaOH) получают N-(2-метил-5,6,7,8-тетрагидрохинолин-4-ил)ацетамид (109 мг, 78%): 1H ЯМР δ 1,83-1,90 (м, 4H), 2,21 (с, 3H), 2,47 (с, 3H), 2,46-2,53 (м, 2H), 2,84-2,87 (м, 2H), 7,18 (уш.с, 1H), 7,82 (уш.с, 1H); 13C ЯМР δ 22,7, 22,8, 23,5, 24,6, 25,3, 33,1, 112,3, 117,3, 143,7, 156,4, 157,3, 169,0; МС m/z: 205 (M+H+).
Получение N-(5,6,7,8-тетрагидрохинолин-7-ил)ацетамида
При взаимодействии N-(хинол-7-ил)ацетамида (33мг, 0,177 ммоль) с помощью описанной методики гидрирования в небольшом масштабе (вместо насыщенного NaHCO3 обрабатывают NaOH) получают N-(5,6,7,8-тетрагидрохинолин-7-ил)ацетамид (8,3 мг, 25%): 1H ЯМР δ 1,72-1,83 (м, 1H), 1,99 (с, 3H), 2,04-2,20 (м, 2H), 2,72-2,95 (м, 3H), 3,25 (дд, 1H, J=5,17 Гц), 4,29-4,40 (м, 1H), 5,72 (уш.с, 1H), 7,05 (дд, 1H, J=4,8 Гц), 7,38 (д, 1H, J=8 Гц), 8,35 (д, 1H, J=4 Гц); 13C ЯМР δ 23,9, 26,5, 28,7, 39,0, 45,6, 121,9, 131,4, 137,0, 147,7, 154,8, 170,1; МС m/z: 213 (M+Na+). Также выделяют N-(1,2,3,4-тетрагидрохинолин-7-ил)ацетамид (6,5 мг, 20%): 1H ЯМР δ 1,24-1,28 (с, 1H), 1,87-1,95 (м, 2H), 2,70 (дд, 2H, J=6,6 Гц), 3,28 (дд, 2H, J=5,5 Гц), 6,46 (д, 1Н, J=8 Гц), 6,84 (д, 1Н, J=8 Гц), 6,93 (с, 1Н), 7,03 (уш.с, 1Н); 13С ЯМР δ 22,1, 24,7, 26,6, 37,9, 105,6, 108,3, 117,6, 129,6, 136,5, 145,1, 168,1; МС m/z: 213(M+Na+).
Получение N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамида
При взаимодействии N-(2-метилхинол-8-ил)ацетамида (159 мг, 0,795 ммоль) с помощью описанной методики гидрирования в небольшом масштабе (вместо насыщенного NaHCO3 обрабатывают NaOH) получают N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамид (92 мг, 57%): 1H ЯМР δ 1,57-1,66 (м, 1H), 1,77-1,86 (м, 2H), 2,02 (с, 3H), 2,44 (с, 3H), 2,43-2,57 (м, 1H), 2,68-2,73 (м, 2H), 4,67-4,74 (м, 1H), 6,79 (уш.с, 1H), 6,92 (д, 1H, J=8 Гц), 7,24 (д, 1H, J=8 Гц); 13C ЯМР δ 21,6, 25,4, 25,8, 29,6, 31,0, 53,0, 123,4, 131,4, 139,2, 155,9, 157,2, 172,2; МС m/z: 227 (M+Na+). Также выделяют N-(2-метил-1,2,3,4-тетрагидрохинолин-8-ил)ацетамид (25 мг, 15%) в виде таутомерной смеси ациклических и циклических изомеров в отношении приблизительно 1:2, которой соответствуют следующие данные: 1H ЯМР δ 1,21-1,25 (м), 1,45-1,61 (м), 1,90 (с), 1,90-1,95 (м), 2,20 (с), 2,71-2,91 (м), 3,32-3,43 (м), 4,00 (уш.с), 6,56 (дд, J=8,8 Гц), 6,63 (дд, J=8,8 Гц), 6,66 (уш.с), 6,83 (д, J=8 Гц), 6,87 (д, J=8 Гц), 6,94 (д, J=8 Гц), 7,02 (д, J=8 Гц), 7,06 (уш.с); МС m/z: 205 (M+H+).
Получение 3-метокси-5,6,7,8-тетрагидрохинолина
При взаимодействии 3-метоксихинолина (181 мг, 1,16 ммоль) с помощью описанной методики гидрирования в небольшом масштабе получают 3-метокси-5,6,7,8-тетрагидрохинолин (127мг, 65%): 1H ЯМР δ 1,74-1,93 (м, 4H), 2,75 (дд, 2H, J=6,6 Гц), 2,85 (дд, 2H, J=6,6 Гц), 3,82 (с, 3H), 6,88 (д, 1H, J=3 Гц), 8,06 (д, 1H, J=3 Гц); 13C ЯМР δ 23,0, 23,7, 29,4, 32,0, 55,9, 121,5, 132,9, 134,9, 149,8, 154,1; МС m/z: 164,1 (M+H+). Также получают смесь (5 мг) гидрированных продуктов (хинолина, 1,2,3,4-тетрагидрохинолина и 5,6,7,8-тетрагидрохинолина, которые определяли методом ГХ(GC) путем сравнения с коммерческими образцами).
Получение сложного метилового эфира
5,6,7,8-тетрагидрохинолин-6-карбоновой кислоты
При взаимодействии сложного метилового эфира хинолин-6-карбоновой кислоты (170 мг, 0,908 ммоль) с помощью описанной методики гидрирования в небольшом масштабе получают сложный метиловый эфир 5,6,7,8-тетрагидрохинолин-6-карбоновой кислоты (49 мг, 30%): 1H ЯМР δ 1,91-2,05 (м, 1H), 2,25-2,34 (м, 1H), 2,74-2,84 (м, 1H), 2,90-3,11 (м, 4H), 3,74 (с, 3H), 7,06 (дд, 1H, J=4,8 Гц), 7,39 (д, 1H, J=8 Гц), 8,37 (д, 1H, J=4 Гц); 13C ЯМР δ 26,1, 31,2, 31,7, 39,6, 52,3, 121,6, 130,5, 137,2, 147,6, 156,3, 175,7; МС m/z: 214 (M+Na+). Также выделяют сложный метиловый эфир 1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (66 мг, 39%).
Получение сложного метилового эфира
5,6,7,8-тетрагидрохинолин-8-карбоновой кислоты
При взаимодействии сложного метилового эфира хинолин-8-карбоновой кислоты (156 мг, 0,833 ммоль) с помощью описанной методики гидрирования в небольшом масштабе получают сложный метиловый эфир 5,6,7,8-тетрагидрохинолин-8-карбоновой кислоты (58мг, 36%). Также выделяют сложный метиловый эфир 1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (45 мг, 28%): 1H ЯМР δ 1,87-1,96 (м, 2H), 2,76-2,81 (м, 2H), 3,40-3,45 (м, 2H), 3,83 (с, 3H), 6,43 (дд, 1H, J=7,8 Гц), 7,03 (д, 1H, J=7 Гц), 7,69 (д, 1H, J=8 Гц), 7,76 (уш.с, 1H); 13C ЯМР δ 21,2, 28,2, 41,6, 51,7, 108,8, 113,9, 122,4, 129,8, 134,1, 148,8, 169,6; МС m/z: 192 (M+H+).
Получение N-(5,6,7,8-тетрагидроизохинолин-1-ил)ацетамида
При взаимодействии N-(изохинол-1-ил)ацетамида (159 мг, 0,854 ммоль) с помощью описанной методики гидрирования в небольшом масштабе (вместо насыщенного NaHCO3 обрабатывают NaOH) получают N-(5,6,7,8-тетрагидроизохинолин-1-ил)ацетамид (96мг, 59%): 1H ЯМР δ 1,74-1,76 (м, 4H), 2,16-2,19 (м, 3H), 2,60-2,70 (м, 2H), 2,70-2,76 (м, 2H), 6,86 (д, 1H, J=5 Гц), 8,03 (д, 1H, J=5 Гц); 13C ЯМР δ 22,3, 22,8, 23,8, 25,1, 29,6, 122,9, 144,4 (2C), 149,5, 150,2, 170,6; МС m/z: 213 (M+Na+). Также выделяют N-(1,2,3,4-тетрагидроизохинолин-1-ил)ацетамид (16 мг, 11%): 1Н ЯМР δ 2,28 (м, 3H), 2,96-3,01 (м, 2H), 3,56-3,61 (м, 2H), 7,20 (д, 1H, J=8 Гц), 7,33-7,38 (м, 1H), 7,44-7,49 (м, 1H), 8,27 (д, 1H, J=8 Гц); 13C ЯМР δ 27,2, 28,7, 29,7, 39,3, 127,3, 127,5, 128,0, 132,6, 137,9, 162,8, 188,0; МС m/z: 191 (M+H+).
Получение N-(5,6,7,8-тетрагидроизохинолин-5-ил)ацетамида
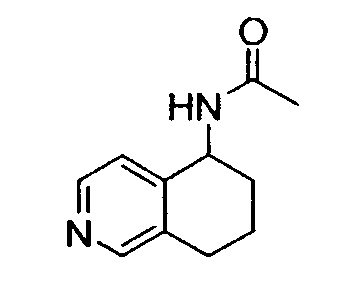
При взаимодействии N-(изохинол-5-ил)ацетамида (171 мг, 0,918 ммоль) с помощью описанной методики гидрирования в небольшом масштабе (вместо насыщенного NaHCO3 обрабатывают NaOH) получают N-(5,6,7,8-тетрагидроизохинолин-5-ил)ацетамид (79 мг, 45%): 1H ЯМР δ 1,60-1,70 (м, 1H), 1,70-1,09 (м, 2H), 1,98 (с, 3H), 1,98-2,08 (м, 1H), 2,65-2,68 (м, 2H), 5,03-5,11 (м, 1H), 6,63 (уш.д, 1H), 7,08 (д, 1H, J=5 Гц), 8,17 (с, 1H), 8,20 (д, 1H, J=5 Гц); 13C ЯМР δ 20,7, 23,7, 26,4, 30,1, 47,1, 122,9, 133,3, 146,3, 147,5, 150,7 170,1; МС m/z: 191 (M+H+). Также выделяют N-(1,2,3,4-тетрагидроизохинолин-5-ил)ацетамид (35 мг, 20%).
Получение (R,S)-8-амино-5,6,7,8-тетрагидрохинолина нитрозированием 5,6,7,8-тетрагидрохинолина
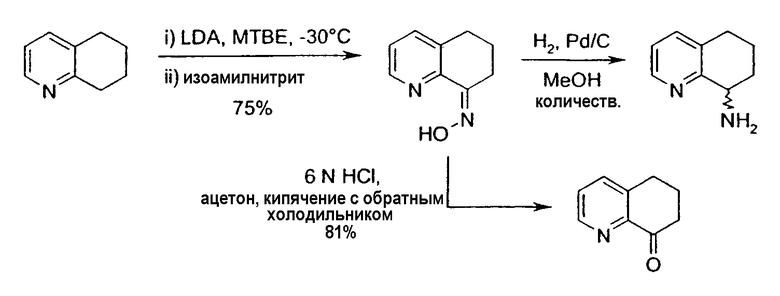
Получение оксима 6,7-дигидро-5H-хинолин-8-она
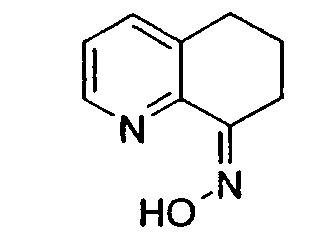
Раствор 5,6,7,8-тетрагидрохинолина (10,83 г, 81,3 ммоль) и литийдиизопропиламида (LDA) (22,80 мл, 163 ммоль) в безводном MTBE (простом трет-бутилметиловом эфире) (100 мл) перемешивают в течение 10 минут при одновременном продувании через систему сухого N2 (азота). Затем раствор охлаждают на бане из ацетона и сухого льда до температуры от -30°C до -20°C. Затем в течение 5 мин добавляют 2,5 М раствор н-BuLi (н-бутиллития) в гексане (101,0 мл, 253 ммоль). Во время добавления раствора температуру охлаждающей бани поддерживают ниже -20°C. Затем полученную таким образом оранжевую/красную смесь с помощью канюли переносят в предварительно охлажденный раствор изоамилнитрита (38,40 мл, 285 ммоль) в безводном MTBE (100 мл) при -30°C; перенос осуществляют в течение приблизительно 10 мин. Полученную смесь перемешивают при -30°C в течение 40 минут, во время перемешивания в виде одной порции добавляют воду (4,80 мл). Погашенной смеси дают медленно нагреться до температуры окружающей среды. Из сырой смеси осаждается твердое вещество коричневого цвета, которое собирают при фильтровании. Выделенное твердое вещество снова растворяют в CH2Cl2 (300 мл) и затем фильтруют, чтобы удалить все нерастворимые продукты. Растворитель удаляют в вакууме, остаток перекристаллизовывают из смеси MTBE-гексаны в отношении 1:1, получая при этом 10,05 г (75%) указанного в заголовке соединения в виде твердого вещества бежевого цвета. 1H ЯМР (CDCl3) δ 1,87-1,96 (м, 2H), 2,81 (т, 2H, J=6 Гц), 2,93 (т, 2H, J=8 Гц), 7,18 (дд, 1H, J=9,6 Гц), 7,48 (дд, 1H, J=9,1 Гц), 8,52 (дд, 1H, J=6,1 Гц), 9,63 (уш.с, 1H); 13C ЯМР (CDCl3) δ 20,8, 23,8, 28,9, 123,4, 134,5, 136,7, 148,2, 148,9, 152,7. ES-МС m/z 163 (M+H).
Получение 6,7-дигидро-5H-хинолин-8-она
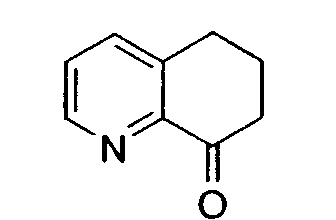
К раствору оксима 6,7-дигидро-5H-хинолин-8-она (220 мг, 1,36 ммоль) в ацетоне (5,0 мл) при перемешивании добавляют 6н HCl (2,0 мл). Полученную смесь кипятят с обратным холодильником в течение 16 часов, затем охлаждают до комнатной температуры. Реакционную смесь доводят до основного рН минимальным количеством 3н NaOH, затем экстрагируют CH2Cl2 (3×30мл), и объединенные органические экстракты сушат (над MgSO4), фильтруют и концентрируют в вакууме. Флэш-хроматографией полученного таким образом сырого продукта (силикагель, смесь CH2Cl2-MeOH-NH4OH в отношении 20:2:1) получают 161 мг (81%) указанного в заголовке соединения в виде светло-желтого твердого вещества. 1H ЯМР (CDCl3) δ 2,17-2,25 (м, 2H), 2,82 (т, 2H, J=7 Гц), 3,04 (т, 2H, J=6 Гц), 7,37 (дд, 1H, J=9,6 Гц), 7,66 (дд, 1H, J=9,1 Гц), 8,71 (дд, 1H, J=6,1 Гц); 13C ЯМР (CDCl3) δ 22,2, 28,6, 39,2, 126,6, 137,3, 140,5, 147,6, 148,6, 196,5. ES-МС m/z 148 (M+H).
Получение (R,S)-8-амино-5,6,7,8-тетрагидрохинолина
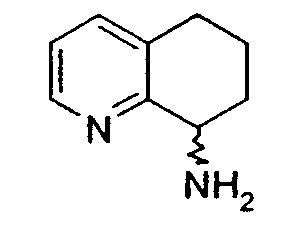
В колбу для гидрирования помещают оксим 6,7-дигидро-5H-хинолин-8-она (266 мг, 1,64 ммоль) и MeOH (2,5 мл). Колбу обрабатывают струей азота в течение 5 минут, затем добавляют 10% палладий-на-угле (Pd/C) (26 мг) в виде одной порции. Полученную смесь встряхивают в аппарате гидрирования Парра при давлении водорода 45 фунт/кв.дюйм в течение 18 часов. Оставшийся продукт фильтруют через подушку целита, элюируя CH2Cl2 (20 мл), и затем растворитель удаляют в вакууме. При этом получают 243 мг (100%) указанного в заголовке соединения в виде светло-желтого, маслянистого вещества. Спектры полученного продукта идентичны спектрам, описанным выше.
Получение (R,S)-8-амино-5,6,7,8-тетрагидрохинолина
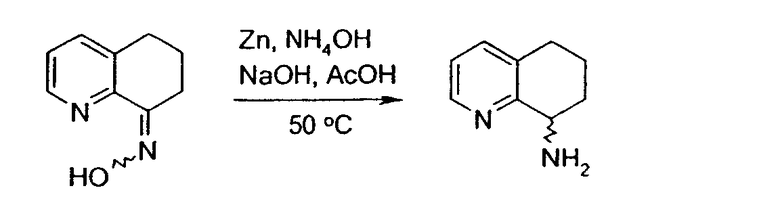
К смеси оксима 6,7-дигидро-5H-хинолин-8-она (96 кг, 554 моль) в NH4OH (243 кг), воды (279 кг) и 50% NaOH (72 кг) добавляют уксусную кислоту (40 кг). Трубопровод промывают водой (18 кг). Смесь под контролем нагревают до 50°C (со скоростью приблизительно 5°C/час), затем добавляют цинковую пыль (144 кг, 2216 моль), поделенную на 10 порций, поддерживая максимальную температуру 65°C. После окончания добавления реакционную смесь перемешивают в течение 10-16 часов при 50°C, затем путем проведения ТСХ подтверждают завершение реакции. Реакционную смесь охлаждают под контролем до 22°C, затем добавляют NaCl (108 кг) и толуол (720 кг). После перемешивания в течение 1 часа смесь фильтруют через подушку целита и дальше промывают толуолом (2 раза по 90 кг). Слои разделяют и органический слой оставляют в резерве. К водному слою добавляют NaCl (45 кг) и толуол (720 кг) и еще раз фильтруют реакционную смесь через подушку целита. После отслоения органический слой оставляют в резерве. Органические слои объединяют и концентрируют в вакууме, затем растворяют в дихлорметане. Полученный раствор промывают 2,5% раствором NaOH (45 кг) и NH4OH (270 кг). Органический слой оставляют в резерве, а водный слой экстрагируют дихлорметаном (297 кг). После разделения фаз органические слои объединяют и концентрируют досуха, получая при этом 69 кг (84%-й выход) указанного в заголовке соединения.
Ферментативное разделение
(R,S)-8-амино-5,6,7,8-тетрагидрохинолина
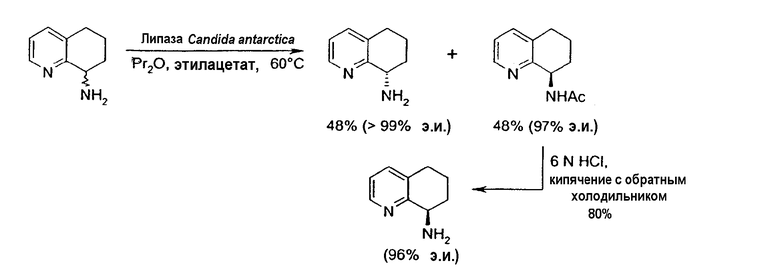
Получение (R)-(-)-N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамида и (S)-(+)-8-амино-5,6,7,8-тетрагидрохинолина
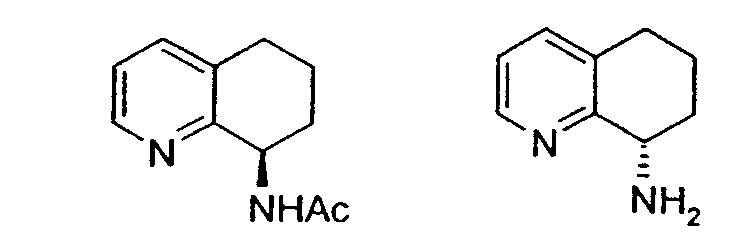
Смесь (R,S)-8-амино-5,6,7,8-тетрагидрохинолина (1,00 г, 6,75 ммоль), липазы Candida antarctica (Novozyme 435, 300 мг) и EtOAc (этилацетата) (2,64 мл, 27,0 ммоль) в безводном i-Pr2O (простом диизопропиловом эфире) (15 мл) нагревают до 60°C и энергично перемешивают в течение 3 часов. Затем реакционную смесь фильтруют через воронку со стеклянным фильтром и концентрируют. Флэш-хроматографией сырого продукта (силикагель, смесь CH2Cl2-MeOH в отношении 10:1, затем смесь CH2Cl2-MeOH-NH4OH (гидроксид аммония) в отношении 20:2:1) получают 0,62 г (R)-(-)-N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамида (48%) при 97% э.и. (выделение путем хиральной ГХ(GC) на колонке J&W CycloSil B, изотермический режим при 150°C, (S)-(+)-энантиомеркт=84,25 мин, (R)-(-)-энантиомеркт=86,16 мин). [α]D=-177,5 (c 1,00, CHCl3); 1H ЯМР (CDC13) δ 1,57-1,63 (м, 1H), 1,74-1,79 (м, 2H), 1,93 (с, 3H), 2,30-2,36 (м, 1H), 2,66-2,71 (м, 2H), 4,78 (дд, 1H, J=14,6 Гц), 6,97 (дд,1H, J=8,5Гц), 7,13 (уш.с, 1H), 7,29 (д, 1H, J=8 Гц), 8,19 (д, 1H, J=5 Гц); 13C ЯМР (CDCl3) δ 19,5, 23,1, 28,0, 29,3, 49,9, 50,6, 122,1, 132,9, 136,9, 146,4, 154,9, 170,3. ES-МС m/z 191 (M+H). Для C11H14N2O.0,3H2O рассчитано: C 67,53; H 7,52; N 14,32. Найдено: C 67,60; H 7,20; N 14,12.
Также получают 0,48г (48%) (S)-(+)-8-амино-5,6,7,8-тетрагидрохинолина при >99% э.и. (выделение путем хиральной ГХ(GC) на колонке J&W CycloSil B, начальная температура: 160°C, начальное время: 0 мин, скорость: 1°C/мин, конечная температура: 130°C, конечное время: 0 мин, (S)-(+)-энантиомеркт=12,43 мин, (R)-(-)-энантиомеркт=13,13 мин). [α]D=+124,1 (c 0,99, CHCl3); 1H ЯМР (CDCl3) δ 1,52-1,62 (м, 2H), 1,78-1,85 (м, 1H), 1,91 (уш.с, 2H), 2,02-2,06 (м, 1H), 2,60-2,65 (м, 2H), 3,83-3,87 (м, 2H), 6,91 (дд, 1H, J=8,5 Гц), 7,21 (дд, 1H, J=8,1 Гц), 8,26 (д, 1H, J=5 Гц); 13C ЯМР (CDCl3) δ 19,6, 28,7, 31,7, 51,0, 121,3, 131,2, 136,4, 146,7, 159,2. ES-МС m/z 149 (M+H).
Получение (R)-(-)-8-амино-5,6,7,8-тетрагидрохинолина
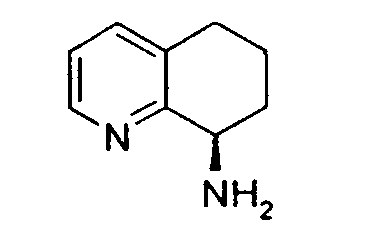
Раствор (R)-(-)-N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамида (230 мг, 1,21 ммоль, 97% э.и.) в 6н водном растворе HCl (4,0 мл) нагревают при перемешивании до 130°C в течение 2 часов. Затем реакционную смесь охлаждают до комнатной температуры и осторожно доводят до основного рН минимальным количеством насыщенного водного раствора NaOH, затем разбавляют CH2Cl2 (10 мл). Фазы отделяют и водную фазу промывают CH2Cl2 (5×20мл), затем объединенные органические фазы сушат (над MgSO4) и концентрируют. Флэш-хроматографией через слой силикагеля (элюция смесью CH2Cl2-MeOH-NH4OH в отношении 20:2:1) получают 143 мг (80%) (R)-(-)-8-амино-5,6,7,8-тетрагидрохинолина при 96% э.и. (выделение путем хиральной ГХ(GC) на колонке J&W CycloSil B, начальная температура: 160°C, начальное время: 0 мин, скорость: 1°C/мин, конечная температура: 130°C, конечное время: 0 мин, (S)-(+)-энантиомеркт=12,43мин, (R)-(-)-энантиомеркт=13,13 мин). [α]D=-125,7 (c 0,56, CHCl3); 1H ЯМР (CDCl3) δ 1,52-1,62 (м, 2H), 1,78-1,85 (м, 1H), 1,91 (уш.с, 2H), 2,02-2,06 (м, 1H), 2,60-2,65 (м, 2H), 3,83-3,87 (м, 2H), 6,91 (дд, 1H, J=8,5 Гц), 7,21 (дд, 1H, J=8,1 Гц), 8,26 (д, 1H, J=5 Гц); 13С ЯМР (CDCl3) δ 19,6, 28,7, 31,7, 51,0, 121,3, 131,2, 136,4, 146,7, 159,2. ES-МС m/z 149 (M+H).
Дальнейшие примеры ферментативного разделения представлены ниже в таблице.
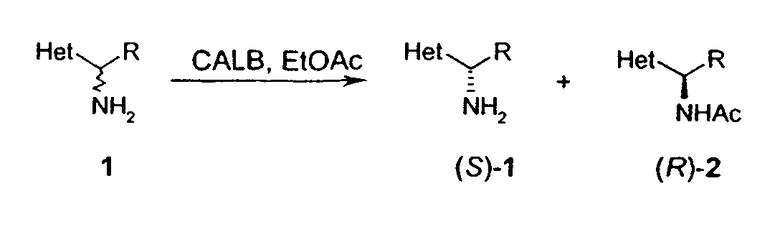
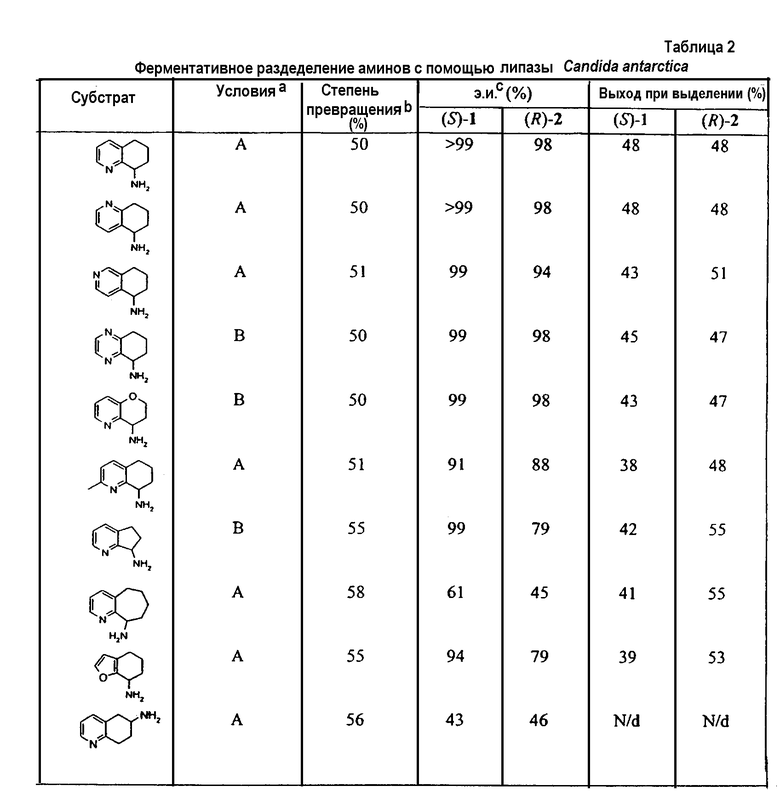
а) Все реакции проводят при 60°C. Продолжительность реакции варьируется от 2 час до 24 час. Условие A: реакция, выполненная в простом изопропиловом эфире с 4-5 эквивалентами EtOAc; Условие B: реакция, выполненная в неразбавленном EtOAc. b)Процент превращения, определяемый путем 1H ЯМР. c)Энантиомерный избыток, определяемый путем хиральной ГХ (GC).
Общая методика проведения реакции разделения
Смесь амина (1 эквивалент; ˜0,2 M), липазы B Candida antarctica (Novozyme 435) (30 мас.%) и этилацетата (4-5 эквивалентов) в безводном простом изопропиловом эфире (условие A) или неразбавленном этилацетате (условие B) нагревают до 60°C и энергично перемешивают. Применяют безводные растворители (99,9%), приобретенные у компании Aldrich. За ходом реакции следят с помощью ГХ(GC), применяя хиральную колонку J&W CycloSil B. После завершения реакции (обычно 2-24 часа) смесь фильтруют на воронке со стеклянным фильтром, промывают EtOAc или метанолом и концентрируют в вакууме. Непрореагировавший амин и ацетамид отделяют хроматографией на силикагеле. Энантиомерный избыток амина и ацетамида определяют с помощью метода хиральной ГХ(GC) путем сравнения времен удерживания с независимо полученными рацемическими образцами. Оптическое вращение образцов измеряют на поляриметре Kruss P3001.
Получение (R)-N-(5,6,7,8-тетрагидрохинолин-5-ил)ацетамида и (S)-5,6,7,8-тетрагидрохинолин-5-иламина
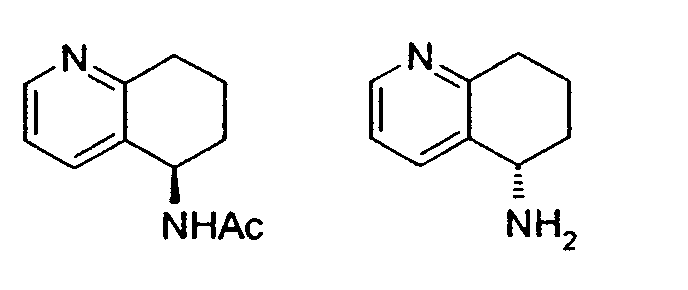
Следуя общей методике, 5,6,7,8-тетрагидрохинолин-5-иламин (213,2 мг, 1,44 ммоль), CALB (64 мг), EtOAc (0,56 мл) и iPr2O (4,8 мл) перемешивают в течение 6 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 5,07 м.д. (CHNHAc) и 3,91 м.д. (CHNH2), составляет 50%. Флэш-хроматографией продукта на силикагеле, применяя смесь MeOH:CH2Cl2 в отношении 1:10, а затем смесь CH2Cl2-MeOH-NH4OH в отношении 20:2:1, получают (R)-N-(5,6,7,8-тетрагидрохинолин-5-ил)ацетамид ((132 мг, 48%) при 98% э.и.(способ хиральной ГХ(GC)): изотермический режим при 85°C в течение 220 минут со скоростью изменения 5°C/мин до 210°C, выдержка 5 мин, (S)-энантиомеркт=248,2 мин, (R)-энантиомеркт=248,5 мин); [α]D=+110 (c 1,32, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,69-1,81 (м, 1H), 1,84-2,00 (м, 2H), 2,04 (с, 3H), 2,01-2,18 (м, 1H), 2,86-2,99 (м, 2H), 5,19-5,27 (м, 1H), 5,78 (уш.с, 1H), 7,10 (дд, 1H, J=7,8, 4,8 Гц), 7,58 (д, 1H, J=7,8 Гц), 8,41 (д, 1H, J=4,8 Гц); 13C ЯМР (CDCl3) δ 20,2, 23,8, 30,1, 32,6, 47,4, 121,9, 133,0, 136,9, 148,7, 157,7, 170,0; MCm/z: 191(M+H+). Непрореагировавший (S)-5,6,7,8-тетрагидрохинолин-5-иламин (выделение с 48% выходом (103 мг) и 99% э.и. (хиральная ГХ(GC): (S)-энантиомеркт=236,0 мин, (R)-энантиомеркт=236,6 мин); [α]D=+39 (c 1,03, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,50-1,70 (м, 3H), 1,74-1,85 (м, 1H), 1,86-2,09 (м, 2H), 2,76-2,99 (м, 2H), 3,94 (м, 1H), 7,07 (дд, 1H, J=7,8, 4,5 Гц), 7,70 (д, 1H, J=7,8 Гц), 8,35 (дд, 1H, J=4,5, 1,5 Гц); 13C ЯМР (CDCl3) δ 19,8, 32,9, 34,0, 49,6, 121,7, 136,2, 136,6, 148,1, 157,3; МС m/z: 149 (M+H+).
Получение (R)-N-(5,6,7,8-тетрагидроизохинолин-5-ил)ацетамида и (S)-5,6,7,8-тетрагидроизохинолин-5-иламина
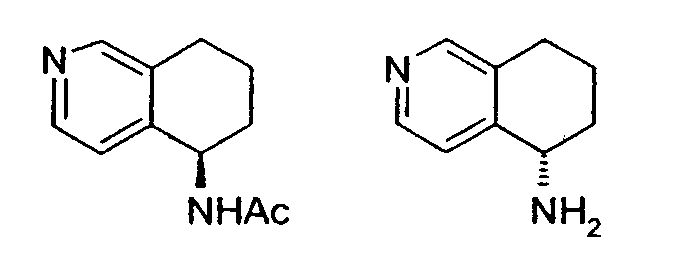
Следуя общей методике, 5,6,7,8-тетрагидроизохинолин-5-иламин (268,3 мг, 1,81 ммоль), CALB (80 мг), EtOAc (0,71 мл) и iPr2O (6,0мл) перемешивают в течение 23 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 5,16 м.д. (CHNHAc) и 3,90 м.д. (CHNH2), составляет 51%. Флэш-хроматографией на силикагеле, применяя смесь MeOH:CH2Cl2 в отношении 1:4, а затем смесь CH2Cl2-MeOH-NH4OH в отношении 4:1:1, получают (R)-N-(5,6,7,8-тетрагидрохинолин-5-ил)ацетамид ((181мг, 51%) при 94% э.и. (способ хиральной ГХ(GC)): 160°C в течение 20 минут со скоростью изменения 5°C/мин до 200°C, выдержка при 200°C в течение 20 минут, (S)-энантиомеркт=38,3 мин, (R)-энантиомеркт=39,1 мин); [α]D=+95 (c 1,81, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,58-1,69 (м, 1H), 1,70-1,92 (м, 2H), 1,96 (с, 3H), 1,94-2,04 (м, 1H), 2,61-2,68 (м, 2H), 5,00-5,10 (м, 1H), 6,82 (уш.д, 1H, J=8,7 Гц), 7,05 (д, 1H, J=5,4 Гц), 8,13 (с, 1H), 8,17 (д, 1H, J=5,4 Гц); 13C ЯМР (CDCl3) δ 18,6, 21,6, 24,4, 28,1, 45,1 120,9, 131,4, 144,6, 145,4, 148,6, 168,4; МС m/z: 191 (M+H+), 132 (М-NHAc). Непрореагировавший (S)-5,6,7,8-тетрагидроизохинолин-5-иламин (выделение с 43% выходом (114 мг) и 99% э.и. (хиральная ГХ(GC)):(S)-энантиомеркт=15,9 мин, (R)-энантиомеркт=16,2 мин); [α]D=+63 (c 1,14, CHCl3). 1H ЯМР (CDCl3, 300 МГц) δ 1,26-1,69 (м, 3H), 1,70-1,85 (м, 1H), 1,86-2,11 (м, 2H), 2,67-2,79 (м, 2H), 3,91 (т, 1H, J=5,4 Гц), 7,32 (д, 1H, J=4,3 Гц), 8,32 (с, 1H), 8,37 (д, 1H, J=4,3 Гц); 13C ЯМР (CDCl3) δ 20,1, 26,7, 33,7, 49,3, 122,5, 132,6, 147,6, 149,9, 150,8; МС m/z: 149 (M+H+), 132 (М-NH2).
Получение (R)-N-5,6,7,8-тетрагидрохиноксалин-5-ил)ацетамида и (S)-5,6,7,8-тетрагидрохиноксалин-5-иламина
Следуя общей методике, 5,6,7,8-тетрагидрохиноксалин-5-иламин (263 мг, 1,76 ммоль), CALB (45 мг) и EtOAc (7,0 мл) перемешивают в течение 2 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 4,94м.д. (CHNHAc) и 4,01 м.д. (CHNH2), составляет 50%. Флэш-хроматографией продукта на силикагеле, применяя смесь MeOH:EtOAc в отношении 1:4 и затем смесь NH4OH:MeOH:EtOAc в отношении 1:1:4, получают (R)-N-(5,6,7,8-тетрагидрохиноксалин-5-ил)ацетамид ((157мг, 47%) при 98% э.и. (способ хиральной ГХ(GC):130°C в течение 180 мин, (S)-энантиомеркт=183,5 мин, (R)-энантиомеркт=183,7 мин); [α]D=-78 (c 1,40, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,62-1,75 (м, 1H), 1,85-2,04 (м, 2H), 2,06 (с, 3H), 2,48-2,57 (м, 1H), 2,90-3,13 (м, 2H), 4,96-5,03 (м, 1H), 6,34 (уш.с, 1H), 8,35 (д, 1H, J=2,4 Гц), 8,39 (д, 1H, J=2,4 Гц); 13C ЯМР (CDCl3) δ 19,9, 23,6, 29,7, 31,8, 50,6, 142,1, 143,3, 152,0, 154,0, 170,7; МС m/z: 214 (M+Na+). Непрореагировавший (S)-5,6,7,8-тетрагидрохиноксалин-5-иламин (выделение с 45% выходом (118 мг) и 99% э.и. ((S)-энантиомеркт=25,9 мин, (R)-энантиомеркт=29,0 мин); [α]D=+61 (c 0,71, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,62-1,79 (м, 1H), 1,80-2,18 (м, 4H), 2,18-2,30 (м, 1H), 2,91-3,01 (м, 2H), 4,07 (дд, 1H, J=8,4, 5,4 Гц), 8,32-8,38 (м, 2H); 13C ЯМР (CDCl3): δ 19,7, 31,7, 32,2, 51,5, 142,0, 142,5, 152,6, 155,4; МС m/z:150 (M+H+), 133 (М-NH2).
Получение (R)-N-(3,4-дигидро-2H-пирано[3,2-b]пиридин-4-ил)ацетамида и (S)-3,4-дигидро-2H-пирано[3,2-b]пиридин-4-иламина
Следуя общей методике, 3,4-дигидро-2H-пирано[3,2-b]пиридин-4-иламин (243 мг, 1,62 ммоль), CALB (73 мг) и EtOAc (6,0 мл) перемешивают в течение 2 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 7,93 м.д. и 8,16 м.д., составляет 50% (сигналы CHNH2 и CHNHAc неотчетливые). Флэш-хроматографией продукта на силикагеле, применяя смесь MeOH:CH2Cl2 в отношении 1:10 и затем смесь NH4OH:MeOH:CH2Cl2 в отношении 1:1:10, получают (R)-N-(3,4-дигидро-2H-пирано[3,2-b]пиридин-4-ил)ацетамид ((145 мг, 47%) при 98% э.и. (способ хиральной ГХ(GC): 140°C в течение 16 мин, изменение со скоростью 5°C/мин до 160°C, выдержка при 160°C в течение 50 мин, (S)-энантиомеркт=41,5 мин, (R)-энантиомеркт=40,9 мин); [α]D=-69 (c 1,45, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,91-2,00 (м, 1H), 1,97 (с, 3H), 2,47-2,57 (м, 1H), 4,18-4,22 (м, 2H), 4,85-4,92 (м, 1H), 6,97 (м, 2H), 7,24 (уш.с, 1H), 7,93-7,95 (дд, 1H, J=1,8, 3,9 Гц); 13C ЯМР (CDCl3) δ 23,3, 28,9, 47,2, 64,4, 124,3, 124,7, 141,3, 141,7, 152,0, 170,9; МС m/z: 215 (M+Na+). Непрореагировавший (S)-3,4-дигидро-2H-пирано[3,2-b]пиридин-4-иламин (выделение с 43% выходом (104 мг) и 99%э.и. ((S)-энантиомеркт=14,7 мин, (R)-энантиомеркт=15,6 мин); [α]D=-13 (c 0,72, CHCl3); 1H ЯМР (CDCl3, 300 МГц): δ 1,84 (уш.с, 2H), 1,90-2,01 (м, 1H), 2,24-2,34 (м, 1H), 4,12 (дд, 1H, J=5,7, 6,9 Гц), 4,18-4,26 (м, 1H), 4,28-4,36 (м, 1H), 7,06-7,13 (м, 2H), 8,15 (дд, 1H, J=1,8, 3,6 Гц); 13C ЯМР (CDCl3) δ 31,5, 47,8, 64,2, 123,8, 124,5, 142,1, 147,0, 151,1; МС m/z: 151,0 (M+H+), 134,0 (М-NH2). Для C8H10N2О·0,1H2О рассчитано: C 63,22; H 6,76; N 18,43. Найдено: C 62,99; Н 6,81; N 18,22.
Получение (R)-N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамида и (S)-2-метил-5,6,7,8-тетрагидрохинолин-8-иламина
Следуя общей методике, 2-метил-5,6,7,8-тетрагидрохинолин-8-иламин (412,7 мг, 2,78 ммоль), CALB (128 мг), EtOAc (0,63 мл) и iPr2O (7 мл) перемешивают в течение 9 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 4,73 м.д. (CHNHAc) и 4,00 м.д. (CHNH2), составляет 51%. Флэш-хроматографией продукта на силикагеле, применяя смесь MeOH:CH2Cl2 в отношении 1:10, затем смесь CH2Cl2-MeOH-NH4OH в отношении 10:1:1, получают (R)-N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамид (167 мг, 47%) при 88% э.и. (способ хиральной ГХ(GC): начальная температура 140°C, начальное время 22 мин, скорость изменения температуры 1°C/мин, конечная температура 150°C, конечное время 70 мин, (S)-энантиомеркт=89,4 мин, (R)-энантиомеркт=91,6мин); [α]D=-102 (c 1,67, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,56-1,66 (м, 1H), 1,82-1,91 (м, 2H), 2,08 (с, 3H), 2,51 (с, 3H), 2,61 (ддд, 1H, J=13,2, 5,1, 5,1 Гц), 2,76 (т, 1H, J=6,6 Гц), 4,72-4,79 (м, 1H), 6,61 (уш.с, 1H), 6,98 (д, 1H, J=7,8 Гц), 7,31 (д, 1H, J=7,8 Гц); 13C ЯМР (CDCl3) δ 20,1, 23,8, 24,2, 28,2, 29,6, 51,5, 122,4, 130,1, 137,8, 154,4, 155,7, 170,8; МС m/z: 205 (M+H+), 146 (М-NHAc). Непрореагировавший (S)-2-метил-5,6,7,8-тетрагидрохинолин-8-иламин (выделение с 38% выходом (107мг) и 91%э.и. (хиральная ГХ(GC): (S)-энантиомеркт=19,9 мин, (R)-энантиомеркт=20,6 мин); [α]D=+65 (c 1,07, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,62-1,82 (м, 2H), 1,84-2,00 (м, 3H), 2,11-2,20 (м, 1H), 2,49 (с, 3H), 2,61-2,82 (м, 2H), 3,93-4,00 (м, 1H), 6,91 (д, 1H, J=7,8 Гц), 7,25 (д, 1H, J=7,8 Гц); 13C ЯМР (CDCl3) δ 20,4, 24,6, 29,1, 32,6, 51,8, 121,7, 128,6, 137,6, 155,9, 159,0; МС m/z: 163 (M+H+).
Получение (R)-N-(6,7-дигидро-5H-[1]пиридин-7-ил)ацетамида и (S)-6,7-дигидро-5H-[1]пиридин-7-иламина
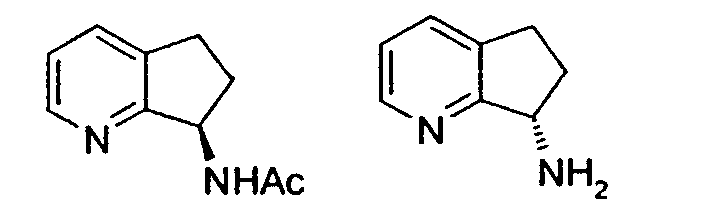
Следуя общей методике, 6,7-дигидро-5H-[1]пиридин-7-иламин (271 мг, 2,02 ммоль), CALB (81 мг) и EtOAc (6,5 мл) перемешивают в течение 7 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 5,17 м.д. (CHNHAc) и 4,21 м.д. (CHNH2), составляет 55%. Флэш-хроматографией продукта на силикагеле, применяя смесь MeOH:CH2Cl2 в отношении 1:10, затем смесь NH4OH:MeOH:CH2Cl2 в отношении 1:1:4, получают (R)-N-(6,7-дигидро-5H-[1]пиридин-7-ил)ацетамид (194мг, 41%). Два энантиомера ацетамида нельзя разделить с помощью ГХ(GC) или ВЭЖХ, и, следовательно, % э.и. следует определить косвенным путем. Небольшой образец ацетамида обрабатывают 1н раствором HCl, чтобы превратить его в амин, и полученный амин разделяют с помощью хиральной ГХ(GC) (способ хиральной ГХ(GC): 85°C в течение 120 минут, изменение температуры до 210°C со скоростью 5°C/мин, конечное время 5 мин; (S)-энантиомеркт=124,3 мин, (R)-энантиомеркт=126,1 мин), получая при этом 79% э.и.; [α]D=-41 (c 1,49, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,75-1,89 (м, 1H), 2,07 (с, 3H), 2,80-2,98 (м, 3H), 5,19-5,27 (м, 1H), 6,32 (уш.с, 1H), 7,14 (дд, 1H, J=7,5, 5,0 Гц), 7,55 (д, 1H, J=7,5 Гц), 8,39 (д, 1H, J=4,5 Гц); 13C ЯМР (CDCl3) δ 23,6, 28,3, 33,9, 55,7, 123,0, 133,3, 137,2, 148,2, 148,4, 162,7, 171,0. Непрореагировавший (S)-6,7-дигидро-5H-[1]пиридин-7-иламин выделяется с 42% выходом (113 мг) и 99% э.и. (хиральная ГХ(GC), (S)-энантиомеркт=124,3 мин, (R)-энантиомеркт=126,1 мин) и имеет спектры, идентичные исходному продукту: 1H ЯМР (CDCl3, 300 МГц) δ 1,68-1,88 (м, 1H), 2,50-2,61 (м, 3H), 2,75-2,86 (м, 1H), 2,92 (ддд, 1H, J=13,2, 9,0, 3,0 Гц), 4,32 (дд, 1Н, J=7,8, 7,8 Гц), 7,08 (дд, 1Н, J=7,8, 4,8 Гц), 7,51 (д, 1Н, J=7,8 Гц), 8,40 (д, 1Н, J=4,8 Гц). Темная окраска амина после очистки колоночной хроматографией препятствует определению его оптического вращения.
Получение (R)-N-(6,7,8,9-тетрагидро-5H-циклогепта[b]пиридин-9-ил)ацетамида и (S)-6,7,8,9-тетрагидро-5H-циклогепта[b]пиридин-9-иламина
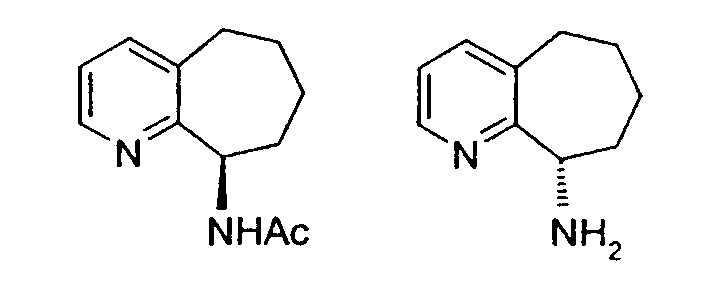
Следуя общей методике, 6,7,8,9-тетрагидро-5H-циклогепта[b]пиридин-9-иламин (195 мг, 1,20 ммоль), CALB (59 мг), EtOAc (0,48 мл) и iPr2O (4,6 мл) перемешивают в течение 24 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 5,05 м.д. (CHNHAc) и 4,34 м.д. (CHNH2), составляет 58%. Флэш-хроматографией продукта на силикагеле, применяя смесь MeOH:CH2Cl2 в отношении 1:10 и затем смесь NH4OH:MeOH:CH2Cl2 в отношении 1:1:4, получают (R)-N-(6,7,8,9-тетрагидро-5H-циклогепта[b]пиридин-9-ил)ацетамид (134 мг, 55%) при 45% э.и. (способ хиральной ГХ(GC): 180°C в течение 15 минут, скорость изменения температуры 10°C/мин до 210°C, выдержка 10 минут, (S)-(-)-энантиомеркт=17,4 мин, (R)-(+)-энантиомеркт=17,1 мин); [α]D=-10 (c 1,34, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,09-1,31 (м, 2H), 1,80-2,03 (м, 3H), 2,06 (с, 3H), 2,24 (д, 1H, J=13,5 Гц), 2,65-2,71 (м, 1H), 2,75-2,85 (м, 1H), 4,96-5,01 (м, 1H), 7,06 (дд, 1H, J=7,0, 4,8 Гц), 7,38 (д, 1H, J=7,0 Гц), 8,11 (уш.с, 1H), 8,28 (д, 1H, J=4,8 Гц); 13C ЯМР (CDCl3) δ 24,0, 27,3, 30,1, 34,5, 34,8, 53,8, 122,8, 137,0, 137,5, 145,5, 159,2, 169,6; MCm/z: 205(M+H+). Непрореагировавший (S)-6,7,8,9-тетрагидро-5H-циклогепта[b]пиридин-9-иламин выделяют с 41% выходом (81 мг) и 61% э.и. (хиральная ГХ(GC), (S)-энантиомеркт=5,81 мин, (R)-энантиомеркт=6,00 мин); [α]D=+2 (c 1,13, CHCl3); и имеет спектры, идентичные исходному продукту: 1H ЯМР (CDCl3, 300 МГц) δ 1,20-1,35 (м, 1H), 1,36-1,53 (м, 1H), 1,75-2,01 (м, 4H), 2,15 (уш.с, 2H), 2,69-2,77 (м, 2H), 4,16 (д, 1H, J=8,7 Гц), 6,95-7,06 (м, 1H), 7,32 (д, 1H, J=6,0 Гц), 8,34 (уш.с, 1H).
Получение (R)-N-(4,5,6,7-тетрагидробензофуран-7-ил)ацетамида и (S)-4,5,6,7-тетрагидробензофуран-7-иламина
Следуя общей методике, 4,5,6,7-тетрагидробензофуран-7-иламин (150 мг, 1,09 ммоль), CALB (45 мг), EtOAc (0,43 мл) и iPr2O (4,0мл) перемешивают в течение 17 часов. Степень превращения, определяемая из данных 1H ЯМР путем интегрирования пиков, соответствующих 5,09 м.д. (CHNHAc) и 3,95 м.д. (CHNH2), составляет 55%. Флэш-хроматографией продукта на силикагеле, применяя смесь MeOH:CH2Cl2 в отношении 1:20 и затем смесь NH4OH:MeOH:CH2Cl2 в отношении 1:1:4, получают (R)-N-(4,5,6,7-тетрагидробензофуран-7-ил)ацетамид ((104 мг, 53%) при 79% э.и. (способ хиральной ГХ(GC): 120°C в течение 15 минут, скорость изменения температуры 2°C/мин до 160°C, выдержка 20 минут при 160°C, (S)-(-)-энантиомеркт=43,6 мин, (R)-(+)-энантиомеркт=45,8 мин); [α]D=+58 (c 1,04, CHCl3); 1H ЯМР (CDCl3, 300 МГц) δ 1,65-1,86 (м, 3H), 1,90-2,04 (м, 1H), 1,94 (с, 3H), 2,30-2,50 (м, 2H), 5,09 (уш.с, 1H), 6,16 (с, 1H), 7,24 (с, 1H); 13C ЯМР (CDCl3) δ 20,6, 22,4, 23,6, 31,0, 43,6, 110,7, 120,9, 142,2, 148,8, 170,1; МС m/z: 180 (M+H+). Непрореагировавший (S)-4,5,6,7-тетрагидробензофуран-7-иламин (выделяется с 39% выходом (59 мг) и 94% э.и. (хиральная ГХ(GC), (S)-энантиомеркт=12,6 мин, (R)-энантиомеркт=13,5 мин); [α]D=-18 (c 0,59, CHCl3); 1H ЯМР (CDCl3, 300 МГц): δ 1,50-1,75 (м, 4H), 1,76-1,90 (м, 1H), 2,01-2,20 (м, 1H), 2,30-2,50 (м, 2H), 3,94 (т, 1H, J=5,7 Гц), 6,17 (д, 1H, J=1,5 Гц), 7,26 (д, 1H, J=1,5 Гц); 13C ЯМР (CDCl3) δ 21,1, 22,6, 34,0, 45,5, 110,5, 117,9, 141,3, 153,6; МС m/z: 160 (M+Na+).
Получение (R)-N-(5,6,7,8-тетрагидрохинолин-6-ил)ацетамида и (S)-5,6,7,8-тетрагидрохинолин-6-иламина
Следуя общей методике, в течение 23 часов перемешивают 5,6,7,8-тетрагидрохинолин-6-иламин (251,4 мг, 1,70 ммоль), CALB (75 мг), EtOAc (0,60 мл) и iPr2O (4,8 мл). Энантиомерный избыток 5,6,7,8-тетрагидрохинолин-6-иламина и N-(5,6,7,8-тетрагидрохинолин-6-ил)ацетамида в реакционной смеси в данный момент составляет соответственно 15% и 62% (способ хиральной ГХ(GC): 160°C в течение 10 мин, изменение температуры до 150°C со скоростью 1°C/мин, выдержка 50 мин: (S)-2jкт=81,7 мин, (R)-2jкт=82,2 мин); (S)-1jкт=10,2 мин, (R)-1jкт=10,5 мин). Затем добавляют 2,0 мл EtOAc и 75 мг CALB и реакционную смесь перемешивают в течение 5 часов. При энантиомерном избытке (S)-5,6,7,8-тетрагидрохинолин-6-иламина и (R)-N-(5,6,7,8-тетрагидрохинолин-6-ил)ацетамида в сырой (непрореагировавшей до конца) реакционной смеси, составляющем соответственно 43% и 46%, реакцию останавливают.
Рацемизация (R)-N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамида и (R)-(5,6,7,8-тетрагидрохинолин-8-ил)амина
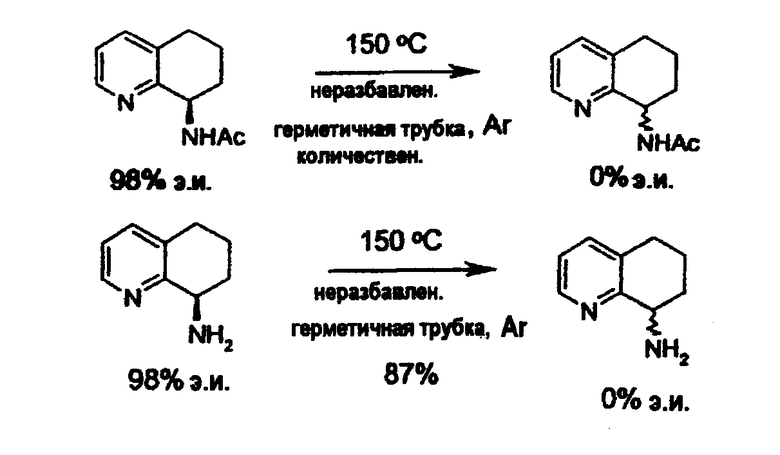
(R)-5,6,7,8-N-(тетрагидроизохинолин-8-ил)ацетамид (200 мг; 98% э.и., установленном методом хиральной ГХ(GC)) помещают в герметичную трубку, продутую аргоном. Реакционную трубку помещают на горячую (150°C) масляную баню до тех пор, пока исходный продукт не расплавится, и продолжают нагревание в течение 40 минут. Энтиомерный избыток продукта в данный момент времени составляет 0% э.и., а его спектр 1H ЯМР не изменяется по сравнению с э.и. % исходного продукта. Выход рацемизированного продукта составляет 200 мг (100%).
(R)-(5,6,7,8-тетрагидрохинолин-8-ил)амин (38 г; 98% э.и., определенный с помощью хиральной ГХ(GC)) нагревают до 150°C в круглодонной колбе с помощью нагреваемого кожуха (сетки). Полная рацемизация наблюдается (хиральная ГХ(GC)) спустя 30 минут, а окраска продукта изменяется на темную. Реакционный сосуд охлаждают до комнатной температуры. При перегонке продукта по методу Кюгельрора (Kugelrohr) получают амин с 87% выходом (33 г).
Рацемизация (R)-5,6,7,8-N-(тетрагидроизохинолин-5-ил)ацетамида
(R)-5,6,7,8-N-(тетрагидроизохинолин-5-ил)ацетамид (60 мг; 94% э.и., установленный методом хиральной ГХ(GC)) помещают в герметичную трубку, продутую аргоном. Реакционную трубку помещают на горячую (150°C) масляную баню до тех пор, пока исходный продукт не расплавится, и продолжают нагревание в течение 2 часов. Энтиомерный избыток продукта в данный момент времени составляет 0% э.и., а его спектр 1H ЯМР не изменяется по сравнению с э.и.% исходного продукта. Выход рацемизированного продукта составляет 60 мг (100%).
Асимметрический синтез (R(-)-8-амино-5,6,7,8-тетрагидрохинолина
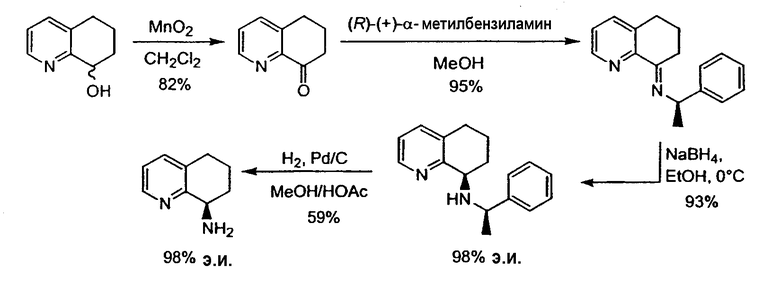
Примечание: Такой способ можно применять для образования либо (R)-(-)-8-амино-5,6,7,8-тетрагидрохинолина, либо (S)-(+)-8-амино-5,6,7,8-тетрагидрохинолина в энантиомерно чистой форме, в зависимости от того, какое хиральное вспомогательное соединение применяется (например, либо (R)-(+)-, либо (S)-(-)-α-метилбензиламин, оба из которых имеются в продаже). Промежуточный 8-гидрокси-5,6,7,8-тетрагидрохинолин получают согласно методике, описанной в международной заявке PCT/CA00/00321 Bridger и др. Для иллюстрации описано получение (R)-(-)-8-амино-5,6,7,8-тетрагидрохинолина.
Получение 6,7-дигидро-5H-хинолин-8-она
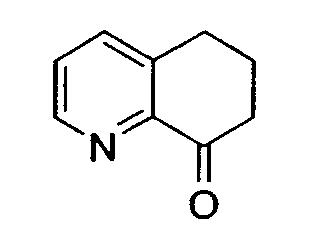
К раствору 8-гидрокси-5,6,7,8-тетрагидрохинолина (13,96 г, 93,6 ммоль) в безводном CH2Cl2 (400 мл) при перемешивании добавляют твердый активированный на 85% MnO2 (оксид марганца IV) (82,22 г, 804 ммоль) с размером частиц <5 микрон. Полученную суспензию черного цвета перемешивают в течение 18 час, после чего смесь фильтруют через подушку целита и промывают CH2Cl2 (3×50мл). Объединенные после промывки фазы концентрируют, получая при этом 11,27 г (82%) указанного в заголовке соединения в виде светло-желтого твердого вещества, которое применяют в следующих реакциях без дальнейшей очистки. Полученный продукт имеет спектры, идентичные тем, о которых сообщалось выше.
Получение (R)-(-)-(6,7-дигидро-5H-хинолин-8-илиден)-
(1-фенилэтил)амина
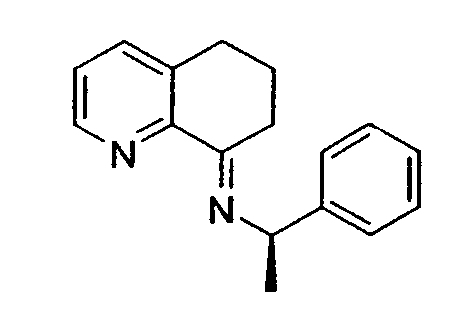
К раствору 6,7-дигидро-5H-хинолин-8-она (3,02г, 20,5 ммоль) в безводном MeOH (100 мл) при перемешивании через шприц добавляют (R)-(+)-α-метилбензиламин (2,61 мл, 20,5 ммоль). Полученную смесь перемешивают в течение 24 час, после чего дополнительно добавляют (R)-(+)-α-метилбензиламин (0,26 мл, 2,0 ммоль) и перемешивают реакционную смесь еще в течение 24 час. Растворитель удаляют в вакууме и сушат образец в течение 3 дней при комнатной температуре при пониженном давлении (0,1 торр), получая при этом 5,38 г (95%) указанного в заголовке соединения в виде красного/коричневого твердого вещества. [α]D=-126,0 (c 1,04, CHCl3); 1H ЯМР (CDCl3) δ 1,55 (д, 3H, J=6,9 Гц), 2,17-2,29 (м, 2H), 7,35 (т, 2H, J=7,8 Гц), 4,39 (кв, 1H, J=6,6 Гц), 4,72 (т, 1H, J=4,7 Гц), 5,50 (уш.с, 1H), 7,07 (дд, 1H, J=7,5, 5,1 Гц) 7,20-7,47 (м, 6H), 8,37 (д, 1H, J=2,4 Гц); 13C ЯМР (CDCl3) δ 21,99, 25,68, 28,29, 53,79, 98,12, 122,43, 126,33, 127,03, 128,92, 132,63, 135,09, 139,47, 146,36, 150,48. ES-МС m/z 251 (M+H).
Получение (-)-(1-(R)-1-фенилэтил)-(8-(R)-5,6,7,8-тетрагидрохинолин-8-ил)амина
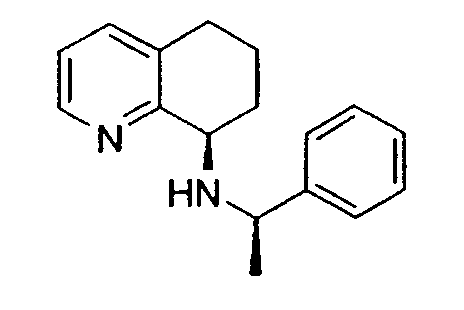
К охлажденному (0°C) раствору (R)-(-)-(6,7-дигидро-5H-хинолин-8-илиден)-(1-фенилэтил)амина (500 мг, 2,00 ммоль) в безводном этаноле (EtOH) (40 мл) при перемешивании добавляют твердый NaBH4 (борогидрид натрия) (227 мг, 6,00 ммоль) одной порцией.
Полученную смесь перемешивают в течение 3 час при 0°C, затем медленно нагревают до комнатной температуры и перемешивают еще 18 час. Добавляют насыщенный водный раствор NaHCO3 (40 мл) и разделяют фазы. Водный слой экстрагируют CH2Cl2 (3×50 мл), сушат (MgSO4) объединенные органические экстракты и концентрируют. Флэш-хроматографией (силикагель, смесь CHCl3-MeOH-NH4OH в отношении 20:2:1) сырого продукта получают 470 мг (93%) указанного в заголовке соединения при 98% э.и. (выделение с помощью хиральной ГХ(GC) на колонке J&W CycloSil B, изотермический режим при 180°C, (R,R)-диастереомеркт=46,10 мин, (S,R)-диастереомеркт=46,92 мин). [α]D=-31,0 (c 0,65, CHCl3); 1H ЯМР (CDCl3) δ 1,48 (д, 3H, J=7 Гц), 1,55-1,64 (м, 2H), 2,65-2,79 (м, 3H), 3,86 (т, 1H, J=6 Гц), 4,10 (кв, 1H, J=7 Гц), 7,05 (дд, 1H, J=8,4 Гц), 7,14-7,46 (м, 6H), 8,42 (д, 1H, J=4 Гц); 13C ЯМР (CDCl3) δ 19,9, 24,7, 30,1, 31,1, 58,3, 58,8, 77,1, 77,5, 77,9, 122,4, 127,3, 127,5, 128,7, 137,4, 147,2. ES-МС m/z 253 (M+H).
Получение (R)-(-)-8-амино-5,6,7,8-тетрагидрохинолина
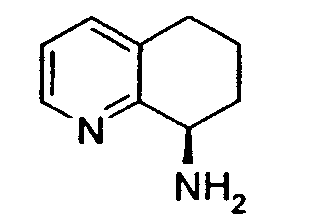
Раствор (-)-(1-(R)-1-фенилэтил)-(8-(R)-5,6,7,8-тетрагидрохинолин-8-ил)амина (140 мг, 0,55 ммоль) и уксусной кислоты (127 мкл, 2,20 ммоль) в безводном MeOH (3 мл) продувают струей азота, затем добавляют 10% палладий-на-угле (32 мг); смесь гидрируют (50 фунт/кв.дюйм) в вибрационном аппарате Парра в течение 18 час. Сырой продукт фильтруют через подушку целита и промывают MeOH (3Ч10 мл), затем объединенные промытые фазы концентрируют. Флэш-хроматографией (силикагель, смесь CH2Cl2-MeOH-NH4OH в отношении 20:2:1) сырого продукта получают 49 мг (59%) указанного в заголовке соединения при 98% э.и. (выделение с помощью хиральной ГХ(GC) на колонке J&W CycloSil B, начальная температура: 160°C, начальное время: 0 мин, скорость: 1°C/мин, конечная температура: 130°C, конечное время: 0 мин, (S)-(+)-энантиомеркт=12,43 мин, (R)-(-)-энантиомеркт=13,13 мин). [α]D=-124,3 (c 0,42, CHCl3). Спектры полученного продукта идентичны тем, о которых сообщалось выше.
Дополнительный пример применения (R)-(+)-1-фенилпропиламина в качестве хирального вспомогательного соединения приведен ниже.
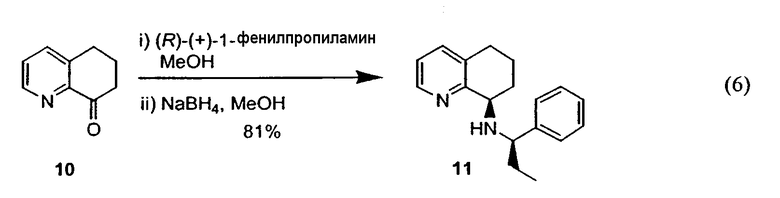
Асимметрическое получение (S)-(-)-8-амино-5,6,7,8-тетрагидрохинолина с помощью (S)-(-)-1-(4-метоксифенил)этиламина в качестве хирального вспомогательного соединения
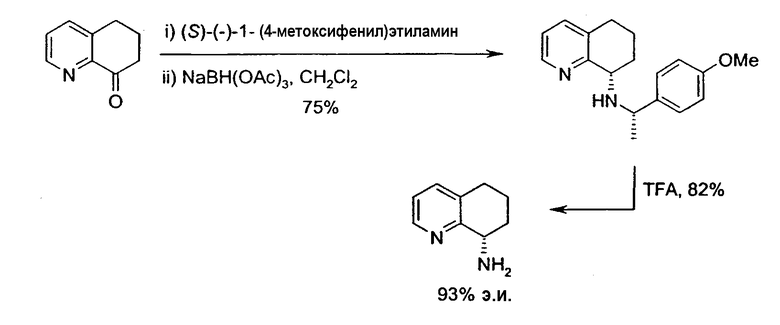
Получение (1-(S)-1-(4-метоксифенил)этил)-(8-(S)-5,6,7,8-тетрагидрохинолин-8-ил)амина
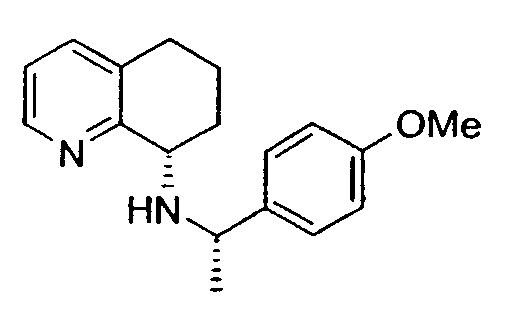
К раствору 6,7-дигидро-5H-хинолин-8-она (630мг, 4,28 ммоль) и (S)-(-)-1-(4-метоксифенил)этиламина (647мг, 4,28 ммоль) в безводном СН2Cl2 (15 мл) при перемешивании добавляют твердый триацетоксиборогидрид натрия (1,44 г, 6,42 ммоль) одной порцией. Полученную смесь перемешивают в течение 16 часов. После чего добавляют 1н водный раствор NaOH (10 мл), чтобы погасить реакцию. Слои разделяют и водную фазу экстрагируют СН2Cl2 (2×10 мл). Объединенные органические фракции сушат (MgSO4) и затем концентрируют в вакууме. Флэш-хроматографией (силикагель, этилацетат) полученного таким образом остатка получают 905 мг (75%) указанного в заголовке соединения в виде желтоватого маслянистого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,49 (м, 1Н), 7,37-7,30 (м, 3Н), 7,04 (м, 1Н), 6,84 (дд, J=3,3, 1,0 Гц, 1Н), 4,03 (дд, J=6,6, 6,6 Гц), 3,85-3,78 (м, 4Н), 2,73-2,65 (м, 3Н), 1,82-1,71 (м, 2Н), 1,57-1,43 (м, 4Н).
Получение (S)-(+)-8-амино-5,6,7,8-тетрагидрохинолина
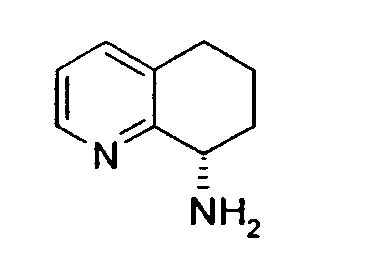
В круглодонную колбу помещают (1-(S)-1-(4-метоксифенил)этил)-(8-(S)-5,6,7,8-тетрагидрохинолин-8-ил)амин (341 мг, 1,2 ммоль) и трифторуксусную кислоту (5 мл). Полученную смесь перемешивают при 60°С в течение 4 часов. После чего большую часть трифторуксусной кислоты удаляют в вакууме и остаток помещают в СН2Cl2 (20 мл) и добавляют 5н раствор NaOH (10 мл). Слои разделяют и водную фазу экстрагируют СН2Cl2 (3×20 мл). Объединенные органические слои сушат (MgSO4) и концентрируют в вакууме, получая при этом 146 мг (82%) указанного в заголовке соединения в виде желтого маслянистого вещества при 93% э.и. (выделение путем хиральной ГХ(GC) на колонке J&W CycloSil B, начальная температура: 160°С, начальное время: 0 мин, скорость 1°С/мин, конечная температура: 130°С, конечное время: 0 мин, (S)-(+)-энантиомеркт=12,43 мин, (R)-(-)-энантиомеркт=13,13 мин). Спектры полученного продукта идентичны спектрам, о которых сообщалось выше.
Другие соединения, полученные на основе описанных выше способов, представляют собой:
N-(2-метил-5,6,7,8-тетрагидрохинолин-4-ил)ацетамид
N-(1,2,3,4-тетрагидрохинолин-7-ил)ацетамид
N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамид
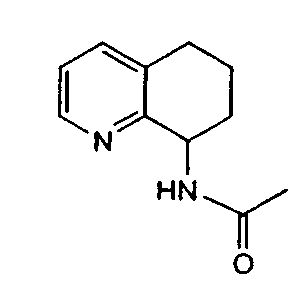
(R,S)-N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамид
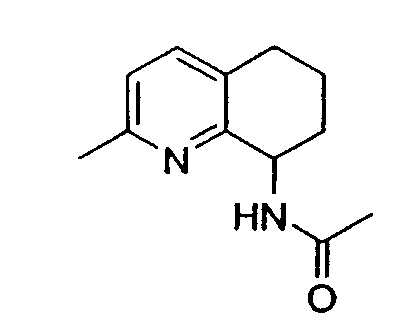
сложный метиловый эфир 1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты
(R,S)-N-(2-метил-1,2,3,4-тетрагидрохинолин-8-ил)ацетамид
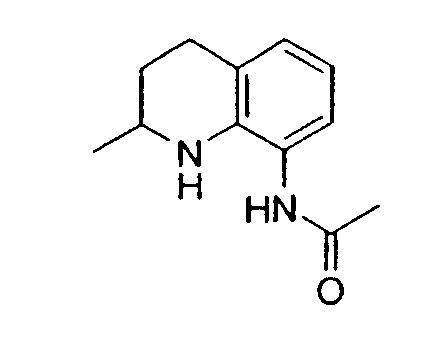
3-метокси-5,6,7,8-тетрагидрохинолин
(R,S)-8-амино-2-метил-5,6,7,8-тетрагидрохинолин
(R)-N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамид
(S)-8-амино-2-метил-5,6,7,8-тетрагидрохинолин
(S)-5-амино-5,6,7,8-тетрагидрохинолин
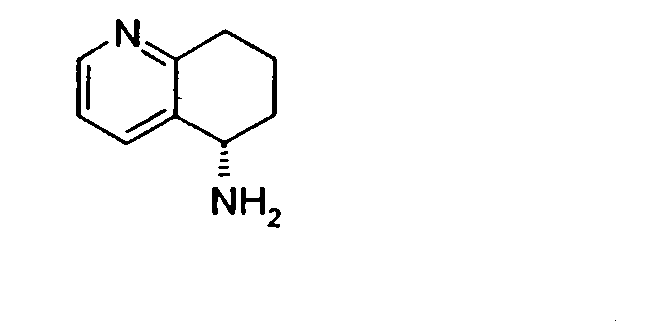
(R)-N-(5,6,7,8-тетрагидрохинолин-5-ил)ацетамид
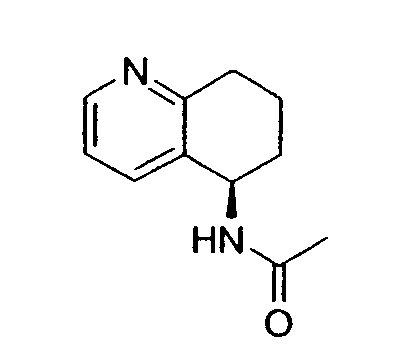
(S)-6-амино-5,6,7,8-тетрагидрохинолин
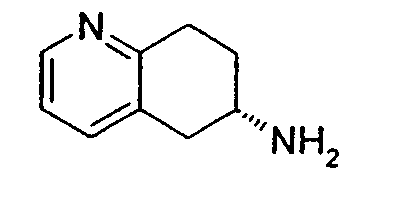
(R)-N-(5,6,7,8-тетрагидрохинолин-6-ил)ацетамид
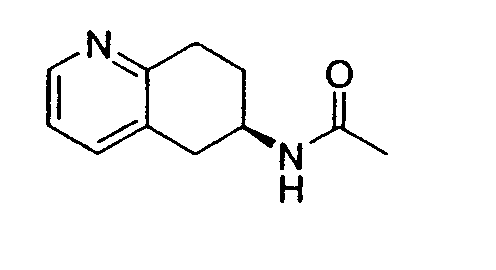
(R,S)-5-амино-5,6,7,8-тетрагидроизохинолин
(S)-5-амино-5,6,7,8-тетрагидроизохинолин
(R)-N-(5,6,7,8-тетрагидроизохинолин-5-ил)ацетамид
(S)-6,7-дигидро-5H-[1]пиридин-7-иламин
(R)-N-(6,7-дигидро-5H-[1]пиридин-7-ил)ацетамид
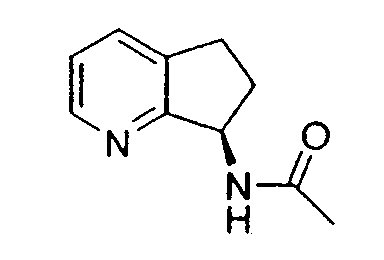
(S)-6,7,8,9-тетрагидро-5H-циклогепта[b]пиридин-9-иламин
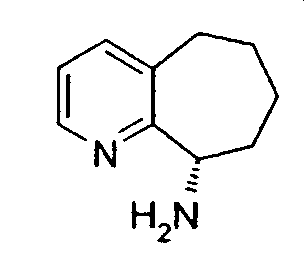
(R)-N-(6,7,8,9-тетрагидро-5H-циклогепта[b]пиридин-9-ил)ацетамид
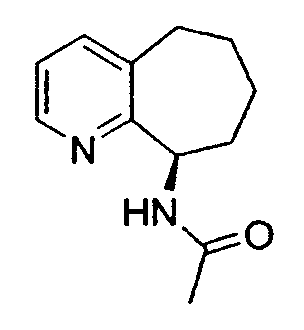
(S)-5,6,7,8-тетрагидрохиноксалин-5-иламин
(R)-N-(5,6,7,8-тетрагидрохиноксалин-5-ил)ацетамид
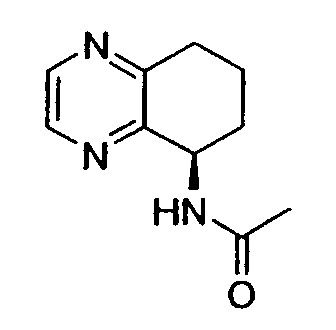
(S)-3,4-дигидро-2H-пирано[3,2-b]пиридин-4-иламин
(R)-N-(3,4-дигидро-2H-пирано[3,2-b]пиридин-4-ил)ацетамид
(S)-4,5,6,7-тетрагидробензофуран-7-иламин
(R)-N-(4,5,6,7-тетрагидробензофуран-7-ил)ацетамид
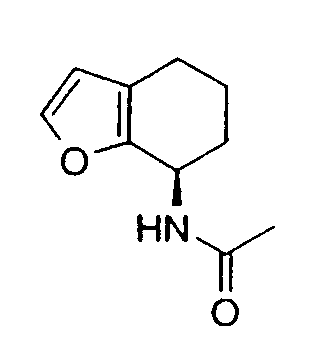
(1-(R)-1-фенилпропил)-(8-(R)-5,6,7,8-тетрагидрохинолин-8-ил)амин
Понятно, что описанные здесь примеры и воплощения являются только иллюстрацией, и что в свете сказанного различные модификации или изменения, которые будут предлагаться специалистами в данной области, должны быть включены в объем настоящей заявки и в объем формулы изобретения. Все публикации, патенты и заявки на патенты, процитированные здесь, тем самым включены путем ссылки.
Цитирование упомянутых выше документов не означает признания того, что любой из упомянутых выше документов имеет отношение к предшествующему уровню техники, и не служит каким-либо признанием в отношении содержания или данных таких документов.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИНОЗАМЕЩЕННЫЕ ПИРАЗОЛЫ И ПРОМЕЖУТОЧНЫЕ АМИНОЗАМЕЩЕННЫЕ ПИРАЗОЛЫ | 1993 |
|
RU2142455C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОИЗОХИНОЛИНА | 2005 |
|
RU2378257C2 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО-3Н-ПИРАЗОЛО[3,4-D]ПИРИМИДИН-3-ОНЫ | 2019 |
|
RU2812726C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СОСТОЯНИЙ, ОПОСРЕДОВАННЫХ СХСR4 И CCR5 | 2001 |
|
RU2277092C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА Р2Х7 | 2018 |
|
RU2724350C1 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА, ДЕМОНСТРИРУЮЩИЕ ЗАЩИТНОЕ ОТ ВИЧ-ИНФЕКЦИИ ДЕЙСТВИЕ | 2005 |
|
RU2350604C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2289581C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2005 |
|
RU2433127C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, МОДЕЛИРУЮЩИЕ АКТИВНОСТЬ ХЕМОКИНОВОГО РЕЦЕПТОРА, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2297413C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗО[4,5-С]ПИРИДИНА В КАЧЕСТВЕ АГОНИСТОВ TOLL-ПОДОБНОГО РЕЦЕПТОРА | 2020 |
|
RU2785124C1 |
Изобретение относится к способам получения и разделения рацемических аминозамещенных конденсированных бициклических кольцевых систем. В одном из способов применяют селективное гидрирование аминозамещенной конденсированной ароматической кольцевой системы. В альтернативном способе получают рацемическую аминозамещенную конденсированную бициклическую кольцевую систему через нитрозирование. Кроме того, изобретение относится к ферментативному разделению рацемической смеси с получением (R)- и (S)-форм аминозамещенных конденсированных бициклических колец, а также к способу рацемизации для повторного получения непредпочтительного энантиомера. Настоящее изобретение также предлагает способ получения энантиомера конденсированного бициклического кольца, замещенного первичным амином путем получения соответствующего энантиомерно чистого имина конденсированного бициклического кольца, диастереоселективного восстановления его и удаления вспомогательного хирального фрагмента. В указанных процессах используют соединения формулы I, II, III, IV, V, VI, VII, VIII, XIII, XIV, которые раскрыты в описании изобретения вместе со значениями радикалов. Также изобретение касается производных 5,6,7,8-тетрагидрохинолина: N-(2-метил-5,6,7,8-тетрагидрохинолин-4-ил)ацетамид или N-(1,2,3,4-тетрагидрохинолин-7-ил)ацетамид, или N-(5,6,7,8-тетрагидрохинолин-8-ил)ацетамид, или (R,S)-N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамид, или сложный метиловый эфир 1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты, или (R,S)-N-(2-метил-1,2,3,4-тетрагидрохинолин-8-ил)ацетамид, или 3-метокси-5,6,7,8-тетрагидрохинолин, или (R,S)-8-амино-2-метил-5,6,7,8-тетрагидрохинолин или (R)-N-(2-метил-5,6,7,8-тетрагидрохинолин-8-ил)ацетамид, или (S)-8-амино-2-метил-5,6,7,8-тетрагидрохинолин, или (S)-5-амино-5,6,7,8-тетрагидрохинолин, или (R)-N-(5,6,7,8-тетрагидрохинолин-5-ил)ацетамид, или (S)-6-амино-5,6,7,8-тетрагидрохинолин, или (R)-N-(5,6,7,8-тетрагидрохинолин-6-ил)ацетамид, или (R,S)-5-амино-5,6,7,8-тетрагидроизохинолин, или (S)-5-амино-5,6,7,8-тетрагидроизохинолин, или (R)-N-(5,6,7,8-тетрагидроизохинолин-5-ил)ацетамид, или (S)-6,7-дигидро-5Н-[1]пиридин-7-иламин, или (R)-N-(6,7-дигидро-5Н-[1]пиридин-7-ил)ацетамид, или (S)-6,7,8,9-тетрагидро-5Н-циклогепта[b]пиридин-9-иламин, или (R)-N-(6,7,8,9-тетрагидро-5Н-циклогепта[b]пиридин-9-ил)ацетамид, или (S)-5,6,7,8-тетрагидрохиноксалин-5-иламин, или (R)-N-(5,6,7,8-тетрагидрохиноксалин-5-ил)ацетамид, или (S)-3,4-дигидро-2Н-пирано[3,2-b]пиридин-4-иламин, или (R)-N-(3,4-дигидро-2Н-пирано[3,2-b]пиридин-4-ил)ацетамид, или (S)-4,5,6,7-тетрагидробензофуран-7-иламин, или (R)-N-(4,5,6,7-тетрагидробензофуран-7-ил)ацетамид, или (1-(R)-1-фенилпропил)-(8-(R)-5,6,7,8-тетрагидрохинолин-8-ил)амин. Технический результат - более эффективные и действенные способы получения рацематов и энантиомеров различных кольцевых систем. 10 н. и 34 з.п. ф-лы, 2 табл.
а) взаимодействие аминозамещенного хинолина формулы I или аминозамещенного изохинолина формулы II с соединением, имеющим аминозащитную группу, в органическом растворителе с получением аминозамещенного хинолина или изохинолина с защищенной аминогруппой:
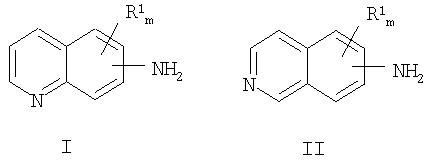
b) гидрирование аминозамещенного хинолина или изохинолина с защищенной аминогруппой в сильнокислом растворителе при повышенной температуре в присутствии катализатора или без него с образованием 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
c) гидролиз аминозащитной группы с получением требуемого рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина;
причем NH2-группа находится в любом положении бензольной части молекулы хинолина или изохинолина, R1 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и где R1 выбран из группы, состоящей из нитро, циано, карбоновой кислоты, алкила, алкокси, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
а) взаимодействие либо замещенного 5,6,7,8-тетрагидрохинолина формулы III, либо замещенного 5,6,7,8-тетрагидроизохинолина формулы IV
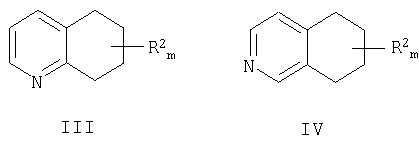
по меньшей мере, с 2 эквивалентами алкиллитиевого основания, или основания амида лития, амида натрия или амида калия; и затем с нитрозирующим агентом с образованием оксима; и
b) восстановление оксима с получением рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина в присутствии катализатора или без него;
причем аминогруппа находится в положении 8 молекулы хинолина или в положении 5 молекулы изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; и где R2 выбран из группы, состоящей из галогена, нитро, циано, защищенной карбоновой кислоты, алкила, алкенила, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
а) взаимодействие либо замещенного 5,6,7,8-тетрагидрохинолина формулы III либо замещенного 5,6,7,8-тетрагидроизохинолина формулы IV

по меньшей мере, с 2 эквивалентами алкиллитиевого основания или основания амида лития, амида натрия или амида калия и затем с нитрозирующим агентом с образованием оксима;
b) гидролиз оксима с получением соответствующего кетона;
причем кетогруппа находится в положении 8 молекулы хинолина или в положении 5 молекулы изохинолина; R2 находится в положении любого другого атома водорода молекулы хинолина или изохинолина; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, защищенной карбоновой кислоты, алкила, алкенила, циклоалкила, защищенного гидроксила, защищенного тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
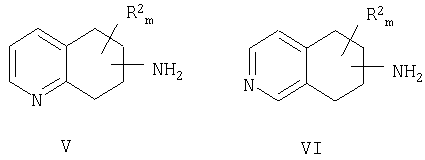
включающий
a) энантиоселективное ацилирование или карбамоилирование рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина с ацилирующим или карбамоильным агентом в присутствии энантиоселективного фермента в качестве катализатора; и
b) отделение непрореагировавшего аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина в виде первого энантиомера от энантиомерного амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
c) отщепление амидной или карбаматной группы с выделением второго энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
причем NH2 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической и гетероциклической групп.

включающий
a) энантиоселективное ацилирование или карбамоилирование рацемического аминозамещенного 5,6,7,8-тетрагидрохинолина или рацемического аминозамещенного 5,6,7,8-тетрагидроизохинолина в присутствии энантиоселективного фермента в качестве катализатора с получением смеси соответствующего непрореагировавшего амина в первой энантиомерной форме и прореагировавшего амида или карбамата во второй энантиомерной форме;
b) выделение первого энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
причем NH2 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы.
а) взаимодействие рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина формулы VII или рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидроизохинолина формулы VIII
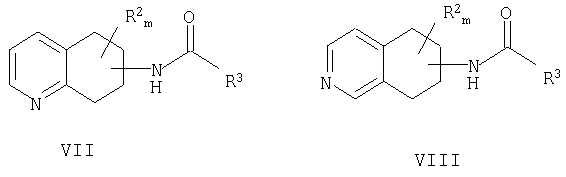
с водой, спиртом, первичным или вторичным амином в присутствии энантиоселективного фермента в качестве катализатора с получением смеси соответствующего амина в первой энантиомерной форме и непрореагировавшего амида или карбамата во второй энантиомерной форме;
b) отделение первого энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или аминозамещенного 5,6,7,8-тетрагидроизохинолина от непрореагировавшего амида или карбамата;
c) отщепление амидной или карбаматной группы с получением второго энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или аминозамещенного 5,6,7,8-изохинолина;
причем амидная или карбаматная группа находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы; R3 представляет собой необязательно замещенный атом углерода или необязательно замещенный атом кислорода.
а) взаимодействие рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидрохинолина формулы VII или рацемического амид- или карбаматзамещенного 5,6,7,8-тетрагидроизохинолина формулы VIII

с водой, спиртом, первичным или вторичным амином в присутствии энантиоселективного фермента в качестве катализатора с получением смеси соответствующего амина в первой энантиомерной форме и непрореагировавшего амида или карбамата во второй энантиомерной форме;
b) выделение первого энантиомера аминозамещенного 5,6,7,8-тетрагидрохинолина или 5,6,7,8-тетрагидроизохинолина;
причем амид или карбамат находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы; R3 представляет собой необязательно замещенный атом углерода или необязательно замещенный атом кислорода.
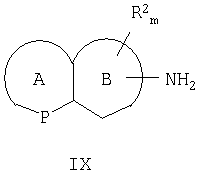
а) образование основания Шиффа кетогруппы, находящейся на цикле В конденсированного бициклического кольца, путем ее взаимодействия с энантиомерно чистым хиральным вспомогательным первичным амином R*NH2 формулы Х
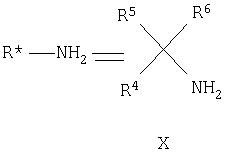
с получением соответствующего энантиомерно чистого имина конденсированного бициклического кольца;
b) диастереоселективное восстановление имина с получением соответствующего энантиомерно чистого вторичного амина конденсированного бициклического кольца;
c) удаление вспомогательного хирального фрагмента R* с образованием энантиомера конденсированного бициклического кольца, замещенного первичным амином;
причем цикл А представляет собой 5- или 6-членный гетероароматический цикл, Р представляет собой атом азота, атом серы или атом кислорода; цикл В представляет собой 5- или 6-членный циклоалкил или гетероциклоалкил;
причем NH2 находится в положении цикла В; R2 находится в положении любого другого атома водорода конденсированного бициклического кольца;
причем m равно 0-4; R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тиола, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы;
R4, R5 и R6 отличаются друг от друга и выбраны из группы, состоящей из водорода, алкила, алкенила, циклоалкила, циклоалкенила и 5- или 6-членного ароматического цикла, и, по меньшей мере, один из R4, R5 или R6 представляет собой 5- или 6-членный ароматический или гетероароматический цикл.
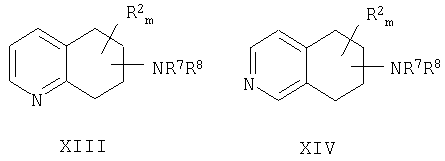
включающий
a) нагревание энантиомерно обогащенного аминозамещенного 5,6,7,8-тетрагидрохинолина или энантиомерно обогащенного аминозамещенного 5,6,7,8-тетрагидроизохинолина, неразбавленного или в органическом растворителе в присутствии или в отсутствии добавки;
b) когда либо R7 либо R8 не является водородом, отщепление группы R7 или R8 при соответствующих условиях с получением соответствующей аминогруппы;
причем NR7R8 находится в любом положении насыщенной части молекулы хинолина или изохинолина; R2 находится в положении любого другого атома водорода хинолинового или изохинолинового цикла; m равно 0-4;
R2 выбран из группы, состоящей из галогена, нитро, циано, карбоновой кислоты, алкила, алкенила, циклоалкила, гидроксила, тио, защищенной аминогруппы, ацила, карбоксилата, карбоксамида, сульфонамида, ароматической группы и гетероциклической группы;
каждый из R7 и R8 выбран из группы, состоящей из водорода, алкила, арила, гетероалкила, гетероарила, аралкила, алканоила, алкилсульфонила, карбонильной или сульфонильной группы, замещенной ароматическим или гетероциклическим циклом, арилоксикарбонила, алкоксикарбонила, арилкарбамоила, алкилкарбамоила, арилтиокарбонила, алкилтиокарбонила и карбамоила.
| Hiroshi Tanida et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Journal of Heterocyclic Chemistry | |||
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
| WO 00/56729 A1, 28.09.2000 | |||
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАГИДРОХИНОЛИНА (ИЛИ -ХИНАЛЬДИНА) | 0 |
|
SU239961A1 |
Авторы
Даты
2007-10-20—Публикация
2002-09-12—Подача