Родственные заявки
Эта заявка представляет собой заявку в частичное продолжение на патент США № 10/334886, которая была подана 15 июля 2002 г., и представляет собой национальную фазу делопроизводства по заявке US02/22449, которая была подана 15 июля 2002 г. и которая претендует на приоритет заявки на патент США № 60/386227, которая была подана 13 июля 2001 г.
Область изобретения
Изобретение относится к введению средств, нацеленных на сосуды, в частности средств, связывающих тубулин, для лечения глазных заболеваний.
Предпосылки изобретения
Глаз является фундаментально одним из важнейших органов в течение жизни. Вследствие старения, заболеваний и других факторов, которые могут неблагоприятно повлиять на зрение, способность поддерживать здоровье глаза становится очень важной. Основной причиной слепоты является неспособность введения препаратов или терапевтических средств в глаз и поддержания указанных препаратов или средств в терапевтически эффективной концентрации в нем. Прием препарата внутрь или инъекция препарата в место, отличное от глаза, обеспечивает системную доставку препарата. Однако такое системное введение не обеспечивает эффективные уровни препарата именно в глазу и, следовательно, может обусловить необходимость введения часто неприемлемо высоких уровней средства для достижения эффективных внутриглазных концентраций.
Желтое пятно представляет собой область сетчатки, которая содержит повышенную концентрацию светочувствительных клеток, которые ответственны за четкое детальное зрение (обобщенное анатомическое графическое изображение человеческого глаза показано на фиг.1). Дегенерация желтого пятна представляет собой неточное историческое название, присвоенное недостаточно понятой группе заболеваний, которые вызывают потерю функции светочувствительных клеток желтого пятна. Результатом дегенерации желтого пятна является потеря жизненно важного центрального зрения и детального зрения. Пациенты, пораженные дегенерацией желтого пятна, воспринимают пустое пятно в центре их поля зрения и часто теряют способность читать мелкий шрифт (источник: Macular Degeneration Foundation, San Jose, CA: www.eyesight.org).
Более 12 миллионов американцев имеют какую-либо форму дегенерации желтого пятна. Один из шести американцев в возрасте от 55 до 64 лет будет поражен дегенерацией желтого пятна, и частота встречаемости заболевания увеличивается с возрастом. По оценкам каждый год 1,2 миллиона из 12 миллионов людей с дегенерацией желтого пятна будут страдать тяжелой потерей центрального зрения. Каждый год 200000 лиц потеряют центральное зрение полностью в одном или обоих глазах.
Несмотря на то, что точная причина дегенерации желтого пятна неизвестна, архитектура желтого пятна раскрывает причину того, как может инициироваться заболевание. Желтое пятно содержит высокоактивные фоторецепторы, которые потребляют большое количество энергии. Генерирование данной энергии требует богатого снабжения кислородом и питательными веществами. Желтое пятно имеет одну из самых высоких скоростей кровотока через снабжающие его сосуды (известные так же как собственно сосудистая оболочка глаза). Все, что препятствует данному богатому кровоснабжению, может вызвать нарушение функции желтого пятна. Лишенное кислорода желтое пятно реагирует выработкой цитокинов, которые сигнализируют росту эндотелиальных клеток и разрастанию новых сосудов (неоваскуляризации).
Существуют два основных типа дегенерации желтого пятна: сухая форма и влажная форма. Приблизительно от 85 до 90% случаев дегенерации желтого пятна относятся к сухому типу. При сухой форме заболевания повреждение сетчатки связано с образованием желтых отложений под желтым пятном, известных как друзы. Отложение друз коррелирует с уменьшением толщины клеток сетчатки, которые содержит желтое пятно. Степень потери центрального зрения прямо связана с локализацией и тяжестью вызванного друзами утончения сетчатки. Сухая форма дегенерации желтого пятна имеет тенденцию прогрессировать медленнее, чем влажная форма заболевания. Не существует эффективного лечения сухой формы дегенерации желтого пятна. У небольшой процентной доли лиц, страдающих сухой формой дегенерации желтого пятна, заболевание прогрессирует во влажную форму дегенерации желтого пятна. На фиг.2 показаны здоровое желтое пятно и сухая форма дегенерации желтого пятна.
Влажная форма дегенерации желтого пятна представляет собой быстро прогрессирующее заболевание, которое почти всегда приводит к тяжелой потере зрения. Потеря зрения, связанная с влажной дегенерацией желтого пятна, является результатом подсетчаточной неоваскуляризации. Быстрый рост подсетчаточных кровеносных сосудов вызывает выгибание лежащего поверх слоя сетчаточных клеток, и он становится отслоенным от богатой питательными веществами собственно сосудистой оболочки глаза. В крайних случаях влажной дегенерации желтого пятна пролиферирующие сосуды проникают через сетчатку и инфильтрируют стекловидное тело. Существует несколько способов лечения по поводу влажной дегенерации желтого пятна, но ни один из них не дает отдаленных удовлетворительных результатов. На фиг.3 показаны здоровое желтое пятно и влажная форма дегенерации желтого пятна.
Современное стандартное лечение по поводу дегенерации желтого пятна представляет собой лазерную фотокоагуляцию. Офтальмолог, выполняющий лазерную фотокоагуляцию, определяет локализацию аберрантных сосудов флуоресцентной ангиографией и избирательно прижигает сосуды методом лазерного удаления. Побочным эффектом лазерной операции является разрушение сетчаточного слоя, лежащего непосредственно поверх аберрантных сосудов. У пациентов, получивших лечение лазерной фотокоагуляцией, имеется выраженная потеря зрения непосредственно после лечения, и это представляет собой неприемлемый отрицательный побочный эффект. В целом, лазерная хирургия рассматривается как паллиативное лечение, которое лишь умеренно эффективно в плане замедления развития заболевания.
Фотодинамическая терапия представляет собой современное состояние в области лечения по поводу дегенерации желтого пятна. Департамент по контролю за качеством пищевых продуктов и лекарственных препаратов США утвердил вертепорфин для инъекций (Visudyne™, разработанный Ciba Vision & QLT) для лечения влажной формы возрастной дегенерации желтого пятна. Пациенту, получающему фотодинамическую терапию, инъецируют фотореактивное соединение (вертепорфин) и сразу лечат неразрушающим глазным лазером. Офтальмолог, выполняющий операцию, выявляет аберрантные сосуды и направляет лазерный пучок в направлении аберрантных сосудов. Вертепорфин при активации лазером генерирует транзиторную вспышку энергии, которая эффективно выжигает любые клетки в пределах непосредственной близости к активированной молекуле. (Источник: HHS News, US Dept. of Health and Human Services, April 13, 2000).
Ионизирующее излучение используют для уничтожения пролиферирующих сосудов (пролиферирующие клетки более чувствительны к облучению, чем покоящиеся клетки). Ионизирующее излучение обычно подают пучком, который достаточно велик для контакта с как можно большей частью глаза. В 1993 г. группа в университете Белфаста в Северной Ирландии сообщила о том, что они испытали применение рентгеновского излучения на небольшом числе пациентов с влажной формой дегенерации желтого пятна. Их положительные результаты были подтверждены несколькими аналогичными исследованиями использования рентгеновского излучения, проведенными другими исследовательскими группами в Европе.
Другим инвалидизирующим глазным заболеванием является ретинопатия недоношенных (ROP). ROP представляет собой глазное заболевание, которое встречается у значительной процентной доли недоношенных младенцев. Последние 12 недель доношенной беременности (с 28 по 40 недели) являются особенно активными месяцами в развитии глаз плода. Дородовое развитие кровоснабжения сетчатки (собственно сосудистой оболочки глаз) начинается у зрительного нерва на 16-й неделе и прогрессирует радиальным типом в направлении передней области сетчатки до рождения (40 недель). Если рождение преждевременное, у сосудистой сети сетчатки нет достаточного времени для полного развития и передние края сетчатки становятся лишенными кислорода. Отсутствие оксигенации передних отделов сетчатки представляет собой причину, лежащую в основе развития ROP. (Источник: The Association of Retinopathy and Related Diseases, Franklin, MI).
У недоношенных младенцев значительная часть переднего отдела сетчатки лишена адекватного кровоснабжения. Лишенный кислорода передний отдел сетчатки реагирует сигнализацией к росту новых сосудов. Патологическая неоваскуляризация в зоне между передней и задней сетчаткой инициирует каскад явлений с тяжелыми патологическими последствиями. По мере того как новые сосуды растут в ответ на химические сигналы, артериовенозные шунты формируются в зоне между снабженной сосудами задней сетчаткой и бессосудистой передней сетчаткой. Указанные сосудистые шунты постепенно увеличиваются, становясь толще и более приподнятыми. Новые сосуды сопровождаются инфильтрирующими фибробластами, которые образуют фиброзную рубцовую ткань. В конечном итоге, образуется кольцо рубцовой ткани, которое прикреплено к сетчатке, а также к стекловидному гелю. Кольцо рубцовой ткани может простираться на 360 градусов вокруг внутренности глаза. Когда указанная рубцовая ткань сокращается, она тянет сетчатку и создает отслоение сетчатки. Если образуется достаточное количество рубцовой ткани, сетчатка может стать полностью отслоенной. Недоношенным новорожденным угрожает развитие ROP, потому что они были удалены из защитной среды матки и подвержены воздействию множества ангиогенных стимулов, включая лекарственные средства, высокие уровни кислорода и изменения освещения и температуры. Некоторые из всех указанных факторов могут оказывать воздействие на развитие ROP. К счастью, у большинства недоношенных младенцев не развивается ROP, и у большинства младенцев с ROP происходит спонтанное улучшение. Если ROP развивается, это обычно происходит между 34-й и 40-й неделями после зачатия, независимо от срока беременности при рождении.
Было показано, что методика, названная криотерапией, оказывает благоприятный эффект при лечении ROP. Криотерапия включает помещение зонда, имеющего температуру ниже нуля, на наружную стенку глаза (склеру). Зонд вызывает образование зоны кристаллизации на поверхности сетчатки между склерой и стекловидным телом. Для лечения всей бессосудистой области, которая расположена спереди от гребня новых сосудов, производят множество сеансов криотерапии. Лечение самого гребня избегают, поскольку гребень имеет тенденцию к кровотечению и может вызвать при замораживании кровоизлияние в стекловидное тело.
Механизм действия криотерапии понятен не полностью. Рабочая гипотеза состоит в том, что криотерапия, вероятно, повреждает бессосудистый слой передней сетчатки. Данное повреждение приводит к утончению сетчатки, которое обеспечивает возможность облегченной диффузии кислорода в остающиеся жизнеспособные клетки. Кроме того, в сетчатке, подвергнутой криотерапии, имеется меньшее количество жизнеспособных клеток и, следовательно, сниженная потребность в кислороде. Сниженная потребность в кислороде притупляет ангиогенные стимулы и останавливает неоваскуляризацию. Было обнаружено, что криотерапия снижает риск отслоения сетчатки с 43% в не подвергнутых лечению глазах до 21% в подвергнутых лечению глазах. Однако криотерапия имеет возможные осложнения; процедуру часто выполняют под общей анестезией, которая может быть рискованной для недоношенных младенцев.
Лазерная фотокоагуляция, описанная выше, использует аналогичные принципы при лечении ROP. Лазерная обработка направлена на переднюю сетчатку, которая еще не имеет кровоснабжения. Целью лечения является устранение патологических сосудов перед тем, как они уложат количество рубцовой ткани, достаточное для того, чтобы вызвать отслоение сетчатки. Кроме того, бессосудистая передняя сетчатка по краям утончается лазером, снижая потребность в кислороде и притупляя ангиогенные стимулы, в значительной степени подобно криотерапии. Лазерная терапия превосходит криотерапию в том, что она направлена на сетчатку, а не на всю толщину стенки глаза. Поскольку лазерная терапия вовлекает меньше ткани и безболезненна, значительно уменьшается воспаление после обработки. По сравнению с криотерапией лазерная терапия имеет преимущества, потому что имеется сниженная необходимость в анестетиках.
Если лазерная терапия или криотерапия неуспешна в прекращении прогрессирования ROP, имеются некоторые виды хирургического лечения. Если имеется неглубокое отслоение сетчатки вследствие небольшой тяги со стороны фибрососудистой рубцовой ткани, благоприятной может быть процедура, называемая сгибанием склеры. Сгибание склеры включает помещение силиконовой ленты вокруг экватора глаза и ее затягивание для того, чтобы создать незначительное вдавливание на внутренности глаза. Данная лента уменьшает тягу стекловидного геля, оттягивающую фиброзную рубцовую ткань и сетчатку. Это обеспечивает возможность сетчатке уплощиться на стенку глаза и восстановить нормальную функцию. Младенцы, которым провели сгибание склеры, могут сохранять хорошее зрение глаза, особенно если не было отслоения желтого пятна. Обычно окружающую ленту необходимо удалить через несколько месяцев или лет, потому что глаз будет продолжать расти, создавая постепенно увеличивающееся сдавливание глазного яблока и вызванную близорукость.
На поздней стадии ROP с полным отслоением сетчатки вследствие рубцовой ткани на сетчатке, сгибания склеры недостаточно для уменьшения тяги. Для данных младенцев можно рассматривать витрэктомию. Витрэктомия включает выполнение нескольких маленьких разрезов в глазу и, используя отсасывающее/режущее устройство, удаление стекловидного геля. Стекловидное тело заменяют солевым раствором для поддержания формы глаза, и глаз способен поддерживать свою форму и давление неопределенно без стекловидного геля. После удаления стекловидного тела рубцовую ткань на сетчатке можно отслоить или отрезать, обеспечивая сетчатке возможность расслабиться и уложиться назад на стенку глаза. Для того чтобы сетчатка стала вновь прикрепленной после операции, может потребоваться несколько недель, и если во время процедуры в сетчатке образуются отверстия или разрывы, сетчатка обычно не прикрепится вновь. Для обеспечения возможности полного иссечения рубцовой ткани часто необходимо удалить хрусталик глаза, но в настоящее время испытываются некоторые более новые методики, которые могут сохранить хрусталик.
Однако частота успеха операции витрэктомии по поводу ROP в определенной степени ограничена. Опубликованные данные о частоте анатомического успеха, который означает получение повторного прикрепления сетчатки к стенке глаза, находится в диапазоне от 25 до 50% пациентов, подвергнутых операции. Частота функционального успеха, которая означает способность хорошо видеть, значимо ниже. Из глаз, которые были подвергнуты "успешной" операции витрэктомии (анатомический успех), только около 1/4 способны видеть достаточно хорошо для того, чтобы достать и схватить объект или различать образцы.
Еще одно инвалидизирующее глазное заболевание встречается у пациентов, которые страдают сахарным диабетом. Приблизительно у 14 миллионов американцев имеется сахарный диабет. В дополнение к вызываемым многочисленным системным осложнениям (таким как почечная недостаточность, гипертензия и сердечно-сосудистые заболевания) диабет является одной из ведущих причин слепоты среди американцев трудоспособного возраста. Действительно, риск слепоты у лиц с диабетом в 25 раз выше, чем риск общей популяции. У многих пациентов с диабетическими глазными проблемами они протекают бессимптомно, несмотря на наличие заболевания, угрожающего зрению. Если диабетическое глазное заболевание остается без лечения, оно может привести к серьезной потере зрения. Сниженное зрение вследствие диабета может быть вызвано несколькими механизмами, и лечение необходимо подбирать в соответствии с потребностями индивидуума. (Источник: The Center for Disease Control, "The Prevention and Treatment of Diabetes Mellitus - A Guide for Primary Care Practitioners": www.cdc.gov/health/diseases.htm).
Многие больные сахарным диабетом замечают нечеткость зрения, когда сахар крови у них особенно высокий или низкий. Указанное затуманенное зрение возникает в результате изменений формы хрусталиков глаз и обычно устраняется, когда их сахар крови возвращается к нормальному уровню. Сахарный диабет представляет собой заболевание, которое воздействует не только на уровни сахара в крови, но также на кровеносные сосуды. Симптомы, связанные с сахарным диабетом (включая повышенное артериальное давление), вызывают повреждение микроциркуляторной системы, включая капилляры, связанные с сетчаткой. Повреждение капилляров приводит к сниженному потоку крови к отдельным областям сетчатки. Кроме того, поврежденные кровеносные сосуды имеют тенденцию к утечке, что вызывает отек внутри сетчатки.
Существуют две основных категории диабетических глазных заболеваний. Первая категория называется фоновой диабетической ретинопатией или непролиферативной ретинопатией. Это по существу самая ранняя стадия диабетической ретинопатии. Данная стадия характеризуется поражением мелких кровеносных сосудов сетчатки, что приводит к вытеканию жидкости (крови) в сетчатку. Наиболее значительная часть потери зрения в течение данной стадии происходит вследствие жидкости, накапливающейся в желтом пятне. Данное накопление жидкости называется отеком желтого пятна и оно может вызвать временное или постоянное сниженное зрение. Вторая категория диабетической ретинопатии называется пролиферативной диабетической ретинопатией. Пролиферативная ретинопатия представляет собой конечный результат вызванного диабетом повреждения, которому подвергается капиллярное ложе сетчатки (собственно сосудистая оболочка сетчатки). Повреждение собственно сосудистой оболочки сетчатки вызывает кислородное голодание сетчатки. Ткань сетчатки реагирует на свою аноксическую среду продукцией ангиогенных цитокинов, которые стимулируют неоваскуляризацию. Как указывалось ранее, неоваскуляризация сетчатки вызывает кровотечение в глазу, образование рубцовой ткани сетчатки, отслоения сетчатки, и любой из указанных симптомов может вызвать сниженное зрение или слепоту. Больные диабетом также часто страдают глаукомой вследствие неоваскуляризации, которая проявляется краснотой, кровеносными сосудами, нарастающими на радужку, что вызывает закрытие угла.
Диабетическая ретинопатия может возникнуть и при диабете I типа (начало диабета до 40 лет), и при диабете II типа (начало после 40 лет), хотя она имеет тенденцию встречаться чаще и протекать тяжелее у пациентов I типа. Поскольку диабет II типа часто не диагностируют, хотя у пациента заболевание имелось в течение многих лет, диабетическая ретинопатия может присутствовать у пациента II типа в то время, когда выявляется диабет.
Лечение диабетической ретинопатии зависит от множества факторов, включая тип и степень ретинопатии, связанные факторы, такие как катаракта или кровоизлияние в стекловидное тело, и медицинский анамнез пациента. Варианты лечения включают те же варианты, которые были обсуждены для ROP, а именно лазерная фотокоагуляция, криотерапия (замораживание) и операция витрэктомии. Слепоту вследствие диабетической ретинопатии можно предотвратить в большинстве случаев.
Внутриглазные раковые опухоли любого типа встречаются наиболее редко. Однако глазные опухоли являются крайне тяжелыми в том, что раковые опухоли сосудистой оболочки глаза в целом метастазируют в другие области тела и из них. Наиболее часто встречающаяся первичная злокачественная опухоль глаза, меланома сосудистой оболочки глаза, встречается у 7 лиц на миллион общей популяции в год - менее одной десятой части встречаемости рака легких. Ретинобластома встречается как заболевание детского возраста приблизительно так же часто, как гемофилия. Указанные две внутриглазные опухоли очень различаются и связаны только анатомической близостью. Выбор лечения по поводу глазного рака зависит от того, где раковая опухоль находится в глазу, как далеко она распространилась и от общего состояния здоровья и возраста пациента. (Источник: The Eye Cancer Network: eyecancer.com ; OncoLink: cancer.med.upenn.edu).
Ретинобластома представляет собой рак одного или обоих глаз, который возникает у маленьких детей. Имеется приблизительно 350 новых диагностированных случаев в год в США. Ретинобластома поражает одного из 15000-30000 живых младенцев, которые рождены в США. Ретинобластома поражает детей всех рас и мальчиков, и девочек.
Опухоль (опухоли) ретинобластомы возникает в сетчатке, светочувствительном слое глаза, который дает возможность глазу видеть. Лечение ретинобластомы индивидуализировано для каждого пациента и зависит от возраста ребенка, вовлечения одного или обоих глаз и от того, распространился или нет рак на другие части тела. Если ребенка оставить без лечения, он может умереть. Способы лечения по поводу ретинобластомы включают энуклеацию, внешнее облучение лучевым пучком, радиоактивные бляшки, лазерную терапию, криотерапию и химическое уменьшение.
Энуклеация представляет собой самую часто встречающуюся форму лечения по поводу ретинобластомы. Во время энуклеации осуществляют хирургическое удаление глаза. Это необходимо, потому что это единственный способ полного удаления раковой опухоли. Невозможно удалить раковую опухоль изнутри глаза без удаления всего глаза. Хотя по поводу некоторых других видов раковых опухолей глаза возможна частичная энуклеация, она рискованна и может даже способствовать распространению рака у пациентов с ретинобластомой.
При вовлечении обоих глаз иногда производят энуклеацию более пораженного или "худшего" глаза, в то время как другой глаз можно лечить одним из способов лечения, сохраняющих зрение, таких как внешнее облучение лучевым пучком, терапия бляшками, криотерапия, лазерная терапия и химическое уменьшение, которые описаны ниже.
Внешнее облучение лучевым пучком использовали с начала 1900-х гг. в качестве способа спасения глаза (глаз) и зрения. Ретинобластома чувствительна к облучению, и лечение часто является успешным. Лучевую терапию проводят на амбулаторной основе пять раз в неделю в течение периода от 3 до 4 недель. Изготавливают по заказу гипсовые формы для предотвращения движения головы во время лечения и иногда перед лечением назначают седативные средства.
Опухоли обычно становятся меньше (происходит их регрессия) и выглядят зарубцевавшимися после лечения внешним облучением лучевым пучком, но они редко исчезают полностью. В действительности, они могут даже стать более очевидными по мере того, как они сморщиваются, потому что розовато-серое опухолевое, объемное образование замещается белым кальцием. Непосредственно после лечения кожа может стать загорелой или небольшая бляшка волос может быть потеряна на затылке в результате положения выхода лучевого пучка. После внешнего облучения лучевым пучком отдаленные эффекты могут включать катаракты, лучевую ретинопатию (кровотечение и экссудаты сетчатки), нарушение зрения и подавление роста височной кости (костей на стороне головы, которые не растут нормально). Облучение может также увеличить риск развития у ребенка других опухолей вне глаза, у тех детей, которые имеют аномальный ген в каждой клетке их тел.
Радиоактивные бляшки представляют собой диски радиоактивного материала, которые были разработаны в 1930-х гг., для облучения ретинобластомы. В настоящее время используется изотоп йод-125 и бляшки изготавливают на заказ для каждого ребенка. В целом, для данной процедуры ребенка необходимо госпитализировать и его подвергают двум отдельным операциям (одна для введения бляшки и одна для ее удаления) в течение 3-7 дней.
Лазерная терапия, иногда именуемая фотокоагуляцией или лазерной гипертермией (которые представляют собой две различные методики), представляет собой неинвазивное лечение по поводу ретинобластомы. Лазеры эффективно разрушают более мелкие опухоли ретинобластомы. Данный тип лечения обычно выполняют фокусировкой света через зрачок на раковые опухоли в глазу и окружающие их ткани. Недавно новое устройство подачи лазерного излучения, называемое диопексическим зондом, обеспечило возможность лечения рака нацеливанием света через стенку глаза, а не через зрачок. Лазерное лечение проводят под местной или общей анестезией, обычно это не вызывает какую-либо послеоперационную боль, связанную с ним, и не требует никаких послеоперационных медикаментозных средств. Лазер можно использовать отдельно или в дополнение к внешнему облучению лучевым пучком, бляшкам или криотерапии.
Криотерапию можно также проводить у пациентов, страдающих ретинобластомой. Криотерапия выполняется под местной или общей анестезией и замораживает более мелкие опухоли ретинобластомы. Подобный перу зонд помещают на склеру в непосредственной близости к опухоли, и опухоль замораживают. Криотерапию обычно необходимо повторять много раз для успешного разрушения всех раковых клеток. Побочный эффект криотерапии состоит в том, что она вызывает отек век и глаза в течение от 1 до 5 дней; иногда отек настолько велик, что дети неспособны открыть свои веки в течение нескольких дней. Для уменьшения отека часто назначают глазные капли или мазь.
Химическое уменьшение представляет собой лечение ретинобластомы химиотерапией. Химиотерапевтические средства в целом вводят ребенку внутривенно, они проходят через поток крови и в случае успешного лечения вызывают сокращение опухолей в объеме в пределах нескольких недель. Химиотерапию одним или более препаратов можно проводить однократно, дважды или более. В зависимости от препарата (препаратов) и от учреждения ребенка в течение данного процесса можно госпитализировать или не госпитализировать. После химиотерапии ребенка повторно обследуют и остающуюся опухоль (опухоли) лечат криотерапией, лазером или радиоактивной бляшкой. Количество сеансов лечения, которое может потребоваться у детей, доходит до двадцати с повторными обследованиями глаза под анестезией через каждые 3 недели.
Хотя ретинобластому редко удается излечить сразу, ретинобластома может распространяться (метастазировать) вне глаза в мозг, центральную нервную систему (головной и спинной мозг) и кости. В данном случае химиотерапию назначает педиатр-онколог, и химиотерапевтические препараты вводят через периферические кровеносные сосуды или в мозг в течение от нескольких месяцев до нескольких лет после первоначальной диагностики метастатического заболевания.
В глазу возникают опухоли, отличные от ретинобластомы и меланомы, и они часто являются предвестниками заболевания другой локализации. Метастаз в сосудистую оболочку глаза является самым часто встречающимся внутриглазным злокачественным поражением и он может быть первоначальным проявлением системной злокачественности. Метастазы в сосудистую оболочку глаза напоминают непигментированные меланомы. На флуоресцеиновой ангиограмме они имеют внешний вид, аналогичный меланоме, и проявляют едва заметные эхографические различия на ультразвуковой эхограмме. Однако метастазы в сосудистую оболочку глаза растут быстрее и с большей вероятностью вызовут большие экссудативные отслоения сетчатки.
В целом, при обнаружении метастатического заболевания в глазу прогноз на выживание является неблагоприятным. Однако по мере того как выживание у пациентов с системными раковыми поражениями улучшается, успешное лечение глазных метастазов играет все более важную роль в поддержании хорошего качества жизни.
Первичная глазная лимфома представляет собой одну из наиболее интригующих внутриглазных опухолей. Ее связь с первичной лимфомой центральной нервной системы и склонность опухоли к пролиферации в подсетчаточном пигментном эпителиальном пространстве, где не существует лимфоидная ткань, как раз представляют собой два характерных аспекта данной высокоагрессивной лимфомы. Известно, что клинические проявления первичной глазной лимфомы имитируют доброкачественные воспалительные поражения сосудистой оболочки глаза и таким образом на месяцы задерживают правильную диагностику. Неопластические клетки при глазной лимфоме могут оставаться ограниченными в пространстве между сетчаточным пигментным эпителием и мембраной Bruch. Поскольку витрит, связанный с данными агрегатами лимфомы, часто состоит из реактивных лимфоцитов, биопсия стекловидного тела может не являться диагностической. Это привело к ложной концепции о том, что трудно интерпретировать внутриглазную цитологию, когда хирурги в действительности не получают опухолевые клетки. Положительный выход в результате внутриглазной биопсии можно увеличить в некоторых случаях, если хирург производит аспирационную биопсию посредством ретинотомии в подсетчаточном пигментном эпителиальном пространстве. Первичная глазная лимфома состоит из крупных, цитологически атипичных клеток, которые окрашиваются положительно на общий лейкоцитарный антиген. Аспираты обычно связаны с большими количествами некротических фрагментов ткани. В прошлом иммунофенотипический анализ был проблематичным. В некоторых ранних исследованиях не удалось обнаружить какие-либо поверхностные маркеры, и их авторы пришли к заключению, что глазная лимфома представляет собой опухоль из "нулевых" клеток. Предварительная обработка клеток гиалуронидазой увеличила выход иммунопатогистологических исследований.
Другой формой глазного рака является меланома сосудистой оболочки. Меланома сосудистой оболочки представляет собой первичный рак глаза. Она исходит из пигментированных клеток сосудистой оболочки глаза и не представляет собой опухоль, которая возникает где-то в другом месте и распространяется на глаз. Хотя некоторые меланомы сосудистой оболочки больше угрожают жизни, чем другие, почти все их следует лечить так, как если бы они были злокачественными. Оказывается, что некоторые меланомы сосудистой оболочки остаются "спящими" и не растут. Большинство из них медленно увеличиваются с течением времени и приводят к потере зрения. Данные опухоли могут распространяться на другие части тела и в конечном счете приводят к смерти. Сообщалось о многочисленных случаях глазной меланомы, метастазирующей в печень. (Источник: The Eye Cancer Network: www.eyecancer.com)
В течение многих лет обычным лечением по поводу меланомы сосудистой оболочки глаза являлась энуклеация. Если опухоль не распространилась на другие части тела, удаление глаза в целом полностью избавляет пациента от опухоли. Начиная со Второй мировой войны, при меланоме сосудистой оболочки глаза использовали облучение. В течение последних 20 лет данный способ лечения был усовершенствован. Облучение в соответствующих частотах доз и в нужных физических формах направлено на устранение растущих опухолевых клеток, не вызывая повреждение нормальной ткани, достаточное для того, чтобы требовать удаления глаза. По мере того как клетки погибают, опухоль сокращается, но она обычно полностью не исчезает. Наиболее перспективный широко доступный способ облучения средней меланомы сосудистой оболочки глаза включает конструирование небольшой бляшки с радиоактивными гранулами, приклеенными с одной стороны. Однако облучение обычно сопровождается неблагоприятными побочными эффектами, такими как рвота и облысение.
Для облучения опухолей можно также использовать высокоэнергетические частицы (облучение ионами гелия или пучком протонов) из циклотрона. Операцию выполняют сначала для пришивания небольших металлических клипсов к склере с тем, чтобы можно было точно нацелить пучок частиц. Лечение проводят в течение нескольких последовательных дней. Оборудование, необходимое для данных способов лечения, имеется только в нескольких медицинских центрах в мире. Сообщалось о хороших результатах у некоторых пациентов, но многие пациенты, получавшие лечение таким способом, наблюдались лишь в течение нескольких лет. Поэтому отдаленные результаты указанных форм лучевой терапии по сравнению с более широко используемой бляшкой неизвестны.
В течение многих лет у небольшого числа пациентов использовали другие способы лечения. Фотокоагуляция с использованием белого света или лазерного света использовалась для сжигания мелких опухолей, и криотерапия применялась для уничтожения опухолей их замораживанием. Считают, что указанные методики эффективны только при очень маленьких опухолях. Некоторые врачи комбинировали лазерную или криотерапию с облучением, но такие способы лечения являются экспериментальными. У нескольких пациентов проводили резекцию стенки глаза или родственную процедуру для удаления опухолей из их глаз. Указанные способы лечения считаются экспериментальными большинством врачей и использовались только по поводу небольшого числа опухолей. Не существует лечения, которое может гарантировать разрушение опухоли, сохранить зрение или обеспечить нормальную продолжительность жизни.
Другой глазной рак представляет собой внутриглазную меланому, редкий вид рака, при котором раковые клетки обнаруживают в части глаза, называемой сосудистой оболочкой глазного яблока. Сосудистая оболочка глазного яблока содержит клетки, называемые меланоцитами, которые содержат пигмент. Когда данные клетки становятся злокачественными, рак именуют меланомой. Сосудистая оболочка глазного яблока включает радужку (цветную часть глаза), ресничное тело (мышца в глазу) и собственно сосудистую оболочку глаза (слой ткани в задней части глаза). Радужка открывается и закрывается для изменения количества света, поступающего в глаз. Ресничное тело изменяет форму хрусталика внутри глаза с тем, чтобы он мог фокусировать. Собственно сосудистая оболочка глаза расположена вслед за сетчаткой, частью глаза, которая создает картину. Если имеется меланома, которая начинается в радужке, она может выглядеть как темное пятно на радужке. Если меланома находится в ресничном теле или собственно сосудистой оболочке глаза, у человека может быть затуманенное зрение или не быть симптомов, и рак может расти до тех пор, пока не будет замечен. (Источник: The Eye Cancer Network: www.eyecancer.com).
Вероятность выздоровления (прогноз) при внутриглазной меланоме зависит от размера и клеточного типа рака, того, где рак расположен в глазу, и от того, распространился ли рак. Существуют способы лечения для всех пациентов с внутриглазной меланомой. Обычно назначают три типа лечения, а именно операцию (удаление раковой опухоли), лучевую терапию (с использованием высокой дозы рентгеновского облучения или других высокоэнергетических лучей для "уничтожения" раковых клеток) и фотокоагуляции (разрушения кровеносных сосудов, которые питают опухоль).
Операция представляет собой самый распространенный способ лечения внутриглазной меланомы. Врач может удалить раковую опухоль с использованием одной из следующих операций:
- иридэктомия - удаление только частей радужки, и;
- иридотрабекулэктомия - удаление частей радужки и поддерживающих тканей вокруг роговицы, прозрачного слоя, покрывающего переднюю часть глаза;
- иридоциклэктомия - удаление частей радужки и ресничного тела;
- хороидэктомия - удаление частей собственно сосудистой оболочки глаза;
- энуклеация - удаление всего глаза.
Лучевую терапию можно также использовать для подачи рентгеновского излучения или других высокоэнергетических лучей на область, где существуют раковые клетки, с тем, чтобы уничтожить раковые клетки и сморщить опухоль. Облучение можно использовать отдельно или в комбинации с операцией. Можно также использовать фотокоагуляционное лечение, при котором очень маленький пучок лучей света, обычно от лазера, подают на глаз для разрушения кровеносных сосудов и уничтожения опухоли.
В подавляющем большинстве предложенных способов терапии для лечения глазных заболеваний, в частности подсетчаточной неоваскуляризации и глазных опухолей, первоначально используется операция или лучевая терапия. При лечении пациентов лекарственными средствами, отдельно или после операции, введение лекарственного средства в целом осуществляют системно, или посредством инъекции, или орально. Как отмечено выше, и операция, и лучевая терапия по поводу глазных заболеваний болезненны, часто требуют длительных периодов восстановления и могут сопровождаться неблагоприятными побочными эффектами. Кроме того, системное введение посредством приема внутрь лекарственного препарата или инъекции в место, отличное от глаза, часто обеспечивается в неэффективных количествах, вызывая необходимость введения часто неприемлемо высоких уровней препарата для достижения эффективных внутриглазных концентраций. Таким образом, существует большая потребность в успешной несистемной терапии для лечения глазных заболеваний, таких как неоваскуляризация в роговице и сетчатке. Кроме того, большой проблемой остается доставка препаратов и лекарственных препаратов в глаз без неблагоприятных побочных эффектов. Обсуждаемое изобретение предоставляет такую терапию, обеспечивая эффективное несистемное введение средства, связывающего тубулин, для лечения глазного заболевания с минимальными побочными эффектами.
Сущность изобретения
Настоящее изобретение направлено на введение нацеленного на сосуды средства ("VTA"), в частности средства, связывающего тубулин, для лечения злокачественных или незлокачественных сосудистых пролиферативных расстройств в глазной ткани.
Неоваскуляризация глазной ткани представляет собой патологическое состояние, характеризующееся сосудистой пролиферацией, и она возникает при различных сосудистых заболеваниях с меняющимися степенями недостаточности зрения. Введение VTA для фармакологической борьбы с неоваскуляризацией, связанной с незлокачественными сосудистыми пролиферативными расстройствами, такими как влажная дегенерация желтого пятна, пролиферативная диабетическая ретинопатия или ретинопатия недоношенных, потенциально было бы благоприятно для пациентов, для которых имеются немногочисленные варианты лечения. В другом варианте осуществления изобретение предоставляет введение VTA для фармакологической борьбы с неоваскуляризацией, связанной со злокачественными сосудистыми пролиферативными расстройствами, такими как глазные опухоли.
Гематосетчаточный барьер (BRB) составлен из специализированных нефенестрированных плотно соединенных эндотелиальных клеток, которые образуют транспортный барьер для определенных веществ между сетчаточными капиллярами и тканью сетчатки. Возникающие сосуды роговицы и сетчатки, связанные с ретинопатиями, являются аберрантными, очень похожими на сосуды, связанные с солидными опухолями. Средства, связывающие тубулин, ингибиторы полимеризации тубулина и средства, нацеленные на сосуды, могут быть способны атаковать образующиеся аберрантные сосуды, потому что данные сосуды не имеют общих архитектурных аналогий с гематосетчаточным барьером. Средства, связывающие тубулин, могут остановить прогрессирование заболевания, это очень похоже на то, как они поступают с сосудистой сетью опухоли. Местную (несистемную) доставку средств, связывающих тубулин, в глаз можно достичь с использованием инъекции в стекловидное тело, инъекции под субэписклеральное пространство, ионтофорезом глазных капель и имплантатов и/или вкладышей. Системное введение можно осуществить введением средств, связывающих тубулин, в поток крови в место, которое отделено измеряемым расстоянием от больного или пораженного органа или ткани, в данном случае глаза. Предпочтительные способы системного введения включают парентеральное или оральное введение.
Детали одного или более вариантов реализации изобретения изложены ниже. Хотя в практике или тестировании настоящего изобретения можно применять любые способы и материалы, подобные или эквивалентные описанным, в настоящем описании раскрываются предпочтительные способы и материалы. Другие признаки, цели и преимущества изобретения будут очевидны из описания. В описании и прилагаемой формуле изобретения формы единственного числа также включают множественное число до тех пор, пока контекст ясно не указывает обратное. При отсутствии других определений все технические и научные термины, используемые здесь, имеют такое же значение, как значение, обычно понимаемое любым специалистом в данной области, для которого предназначено данное изобретение. Все патенты и публикации, приведенные в данном описании, включены в настоящее описание в качестве ссылки.
Подробное описание чертежей
Изобретение будет лучше понятно при ссылке на прилагаемые чертежи, в которых
фиг.1 представляет собой упрощенную анатомическую иллюстрацию глаза млекопитающего, вид спереди и сбоку;
фиг.2А иллюстрирует здоровое желтое пятно;
фиг.2В иллюстрирует сухую форму дегенерации желтого пятна;
фиг.2С иллюстрирует влажную форму дегенерации желтого пятна;
фиг.3А и 3В представляют собой увеличенные фотографии части роговицы, показывающие ингибирование роста сосудов на 28-й день после введения СА4Р, в сравнении с контрольным глазом после введения носителя; и
фиг.4А и 4В иллюстрируют микроскопическую гистологию изменений в роговице (ингибирование роста сосудов) на 28-й день после системного введения СА4Р в сравнении с контрольным глазом.
Фиг.5А иллюстрирует воздействие однократной дозы СА4Р на васкуляризацию глазной опухоли на экспериментальной модели ретинобластомы у животного.
Фиг.5В иллюстрирует степень регрессии опухоли на экспериментальной модели ретинобластомы у животного после повторного введения СА4Р.
Подробное описание изобретения
Настоящее изобретение направлено на способы и композиции для лечения или профилактики глазных заболеваний у субъекта. Способ включает стадии получения лекарственной формы, содержащей фармацевтически эффективную дозировку средства, связывающего тубулин, и введения фармацевтически эффективной дозировки нуждающемуся в ней субъекту.
Один вариант осуществления представляет собой способ лечения или профилактики глазных заболеваний введением средства, связывающего тубулин, в глаз нуждающегося в нем субъекта в дозе, достаточной для достижения концентрации средства, связывающего тубулин, в глазу в диапазоне от приблизительно 1 нМ до приблизительно 100 мМ водянистой влаги ткани.
Другой способ настоящего изобретения представляет собой введение средства, связывающего тубулин, нуждающемуся в нем субъекту в дозе, достаточной для уменьшения утечки экссудата из поражения в глазу субъекта, имеющего неовасуляризацию сосудистой оболочки, и идентифицированного как имеющего поражение.
Другой способ настоящего изобретения представляет собой введение средства, связывающего тубулин, нуждающемуся в нем субъекту в дозе, достаточной для того, чтобы вызвать регрессию пролиферирующей сосудистой сети в глазу субъекта, страдающего неовасуляризацией сосудистой оболочки.
Настоящее изобретение также относится к фармацевтическому лекарственному средству для лечения или профилактики глазных заболеваний, включающее терапевтически эффективное количество средства, связывающего тубулин, для уменьшения глазной неоваскуляризации в сочетании с фармацевтически приемлемым носителем, наполнителем, разбавителем или адъювантом для введения нуждающемуся в нем субъекту.
Субъект представляет собой предпочтительно млекопитающее, предпочтительнее человека. Предпочтительные средства, связывающие тубулин, для композиций и способов настоящего изобретения включают комбретастатин А4 и пролекарство комбретастатина А4.
Глазные заболевания, подвергающиеся лечению или профилактике настоящими композициями и способами, включают неоваскляризацию сетчатки, неоваскуляризацию сосудистой оболочки, неоваскуляризацию глазных опухолей, диабетическую ретинопатию, ретинопатию недоношенности, ретинобластому, неоваскуляризацию роговицы и дегенерацию желтого пятна. Конкретнее, подходящие заболевания включают заболевания, которые проявляют неоваскуляризацию сосудистой оболочки под ямкой, включая патологическую миопию и экссудативную возрастную дегенерацию желтого пятна. Патологическую миопию можно альтернативно именовать пролиферативной миопатией или миопической дегенерацией желтого пятна. Все используемые здесь термины «патологическая миопия, пролиферативная миопатия и миопическая дегенерация желтого пятна» относятся к одному и тому же патологическому состоянию. Глазные опухоли могут включать ретинобластому, первичную глазную лимфому, меланому сосудистой оболочки и внутриглазную меланому.
Средство, связывающее тубулин, может доставляться или системно, или несистемно. Предпочтительные варианты осуществления несистемного введения включают инъекцию в стекловидное тело, инъекцию под конъюнктиву, инъекцию в ткани, окружающие глаз, инъекцию в субэписклеральное пространство, глазные капли, ионтофорез и глазной имплантат и/или глазной вкладыш. Подходящий диапазон дозировки для несистемно введенных средств, связывающих тубулин, находится в промежутке от приблизительно 0,1 мг/мл до приблизительно 100 мг/мл.
Предпочтительные варианты осуществления системного введения включают парентаральное и оральное. Более конкретные системные пути введения включают внутривенный, внутрикожный, внутримышечный, подкожный, ингаляционный, через слизистые оболочки и ректальный. Подходящий диапазон дозировки для системно введенных средств, связывающих тубулин, находится в промежутке от приблизительно 0,1 до приблизительно 120 мг/м2. Предпочтительные диапазоны дозировки включают от приблизительно 2 до приблизительно 90 мг/м2, от приблизительно 15 до приблизительно 50 мг/м2, от приблизительно 10 до приблизительно 80 мг/м2 и от приблизительно 20 до приблизительно 60 мг/м2. Особенно предпочтительной дозировкой для системно введенных средств, связывающих тубулин, диапазон дозировки, использованный для лечения пациента, описанного в примере 9, составляет 27 мг/м2. Когда средство, связывающее тубулин, представляет собой фосфатное пролекарство, дозировка рассчитывается на основании количества свободной кислоты фосфата.
Предпочтительный вариант осуществления композиции настоящего изобретения включает количество СА4Р в суспензии, эмульсии или растворе в диапазоне от приблизительно 0,1 мг/мл до приблизительно 100 мг/мл; приблизительно 5 мг/мл карбоксиметилцеллюлозы и приблизительно 9 мг/мл NaCl. Эта композиция предпочтительно имеет конечный рН в диапазоне от приблизительно 6,6 до 8,6, осмолярность в диапазоне от приблизительно 291 до 492 мосмоль/кг Н2О и вязкость в диапазоне от приблизительно 50 до 66 мПа·с.
Глаз человека обладает несколькими структурно уникальными свойствами: он подвержен воздействию окружающей среды, он богато снабжен нервами, он имеет высокую скорость кровотока в собственно сосудистой оболочке глаза, при этом передняя камера и стекловидное тело являются полностью бессосудистыми и изолированными от системы кровообращения. Исключительная архитектура глаза обеспечивает достаточную возможность для доставки средств, связывающих тубулин, одним или более несистемных способов введения для лечения глазных состояний, заболеваний, опухолей и расстройств. Упрощенная анатомическая иллюстрация глаза показана на фиг.1.
Как указывалось ранее, неоваскуляризация глазной ткани представляет собой патогенное состояние, которое возникает при различных глазных заболеваниях и связано с меняющимися степенями недостаточности зрения. Фармакологическая борьба с неоваскуляризацией была бы потенциально благоприятной для пациентов, страдающих такими заболеваниями, как влажная дегенерация желтого пятна, пролиферативная диабетическая ретинопатия и ретинопатия недоношенных.
Средства, связывающие тубулин, ингибируют сборку тубулина связыванием со связывающими тубулин кофакторами или комплексами кофактора-тубулина в клетке во время митоза и предотвращают деление, а следовательно, пролиферацию клетки. Средства, связывающие тубулин, включают широкий класс соединений, которые ингибируют полимеризацию тубулина и которые в целом функционируют в качестве избирательных в отношении опухолей средств, нацеливающихся на сосуды, которые можно применять для химиотерапии рака, а также для других видов применения, отличных от лечения рака, таких как лечение глазных заболеваний.
Как обсуждено выше, одним из недостатков системного введения лекарственных препаратов для лечения глазных заболеваний является то, что системное введение в целом не обеспечивает эффективные уровни препарата специфически в глазу. Поскольку препараты, введенные системно, могут метаболизироваться в организме даже еще до того, как они достигнут глаза, для достижения эффективных внутриглазных концентраций понадобится введение более высоких уровней препарата. Несистемное или местное введение препаратов непосредственно в глаз (глаза) пациента, страдающего глазным заболеванием, обеспечивает возможность введения эффективной концентрации препарата, что весьма благоприятно для пациента.
Глазные заболевания, которые можно лечить несистемным или системным введением средств, связывающих тубулин, в соответствии с настоящим изобретением включают незлокачественные сосудистые пролиферативные заболевания, характеризующиеся неоваскуляризацией роговицы, радужки, трабекулярной сети, сетчатки, подсетчаточного слоя, головки зрительного нерва или сосудистой оболочки глаза, а также злокачественные сосудистые пролиферативные заболевания, такие как глазные опухоли и раковые поражения.
Неоваскуляризация роговицы возникает при следующих заболеваниях: трахома (Chlamydia trachomatis), вирусный интерстициальный кератит, микробный кератоконъюнктивит, трансплантация и ожоги роговицы. Она может быть вызвана инфекцией (трахома, герпес, лейшманиоз, онхоцеркоз), трансплантация, ожоги (термические, щелочные), травма, недостаточность питания и повреждение, вызванное контактной линзой. Заболевания, включающие неоваскуляризацию радужки, включают рубоз радужки, гетерохромный иридоциклит Fuch и связанную с развитием гипоплазией радужки.
Неоваскуляризация сетчатки и/или сосудистой оболочки глаза (хориоидальная неоваскуляризация) возникает при дегенерации желтого пятна, диабетической ретинопатии, серповидноклеточной ретинопатии и ретинопатии недоношенных. Неоваскуляризация сосудистой оболочки происходит, когда сосудистая оболочка растет через разрыв оболочки Bruch в подсетчаточный пигментный эпителий или подсетчаточное пространство, проявляющееся в виде накопления жидкости (отека) и/или кровоизлияний. Это само по себе может привести к тяжелой потере зрения, однако сетчаточный пигментный эпителий или нейросенсорная сетчатка могут также отслаиваться. В предпочтительном варианте осуществления изобретение включает лечение высокопролиферативной неоваскуляризации субфовеальной сосудистой оболочки, которая происходит в результате или одновременно с экссудативными (влажными) формами возрастной дегенерации желтого пятна, диабетической ретинопатией, ретинопатией новорожденных, патологической миопией, задним увеитом, хроническим увеитом, синдромом глазного гистоплазмоза, отеком желтого пятна, окклюзией вен сетчатки, ангиоидными полосками, разрывом сосудистой оболочки, многоочаговым хороидитом, ишемическим заболеванием сетчатки и другими нозологическими увеитными формами.
Особенно предпочтительная форма субфовеальной неоваскуляризации сосудистой оболочки происходит в результате или одновременно с патологической миопией. Высокая миопия (крайняя степень близорукости) представляет собой состояние, характеризуемое аномальным ростом глазного яблока, вызывающим растяжение сетчатки и мембраны Bruch. Постепенное снижение зрения возникает, когда желтое пятно истончается в результате растяжения сетчатки. Истончение мембраны Bruch может привести к трещинам, через которые новые сосуды могут расти из сосудистой оболочки под сетчаткой. Неоваскуляризация субфовеальной сосудистой оболочки может вызвать внезапную и тяжелую потерю зрения. Другая особенно предпочтительная форма неоваскуляризации субфовеальной сосудистой оболочки происходит в результате или одновременно с экссудативной, возрастной дегенерацией желтого пятна. Неоваскуляризация передней камеры происходит при неоваскулярной глаукоме.
К несистемным способам введения средств, связывающих тубулин, предусмотренным настоящим изобретением, относятся введение в стекловидное тело (инъекция), введение под конъюнктиву, введение в ткани, окружающие глаз, инъекция в субэписклеральное пространство, ионтофоретическая доставка, местное введение глазными каплями, гелями или мазями и посредством глазного вкладыша или имплантата.
Средства, связывающие тубулин, можно вводить посредством инъекции непосредственно в стекловидное тело глаза. Средства, связывающие тубулин, можно также вводить под конъюнктиву инъекцией под конъюнктиву и вокруг глаза посредством инъекции в ткани, окружающие глаз.
Средства, связывающие тубулин, можно также вводить инъекцией в субэписклеральное пространство (под капсулу Tenon) канюлей Connor с тупым наконечником. Используя соответствующую методику, медицинский работник, вводящий дозу средства, связывающего тубулин, может избежать прокола глазного яблока и повреждения зрительного нерва. После доставки участок инъекции прижигают и пространство служит в качестве депо препарата. Введение в субэписклеральное пространство менее инвазивно, чем инъекция в стекловидное тело.
В другом варианте осуществления настоящего изобретения средство, связывающее тубулин, можно изготовить в виде биологически совместимого, биологически разрушаемого и/или биологически эродируемого имплантата или вкладыша, содержащего средство, связывающее тубулин, с тем, чтобы обеспечить медленное высвобождение препарата и поддержание терапевтически эффективной концентрации препарата в течение длительного периода времени. Содержащие лекарственный препарат биологически эродируемые глазные имплантаты для имплантации или вставления в глаз млекопитающего описаны, например, в патенте США № 5904144 и патенте США № 5766242, которые полностью включены в настоящее описание в качестве ссылки. Глазные имплантаты в целом включают капсулу, которую помещают в желательное положение в глазу. Капсула может включать одно или более лекарственных средств или может включать клетки, которые продуцируют биологически активную молекулу для продолжительной контролируемой доставки в глаз. Количество препарата, которое можно использовать в данном варианте реализации, будет варьировать в зависимости от эффективной дозировки препарата и скорости высвобождения из вкладыша или имплантата на глаз или внутрь него.
Ввиду того, что склера обнажена, ионтофоретический зонд можно наложить на поверхность глаза. При ионтофорезе используется электрический ток для стимуляции потока ионных соединений через клеточную мембрану. Данную методику в настоящее время используют для трансдермальной доставки ионных препаратов. Двумя основными механизмами, которыми ионтофорез стимулирует транспорт препаратов, являются: (а) ионтофорез, при котором заряженный ион вытесняется из электрода того же заряда, и (b) электроосмос, конвективное движение растворителя, которое происходит через заряженную "пору" в ответ на предпочтительное прохождение противоионов, когда подается электрическое поле.
Композиции средств, связывающих тубулин, можно также составить для местного введения в глаз в форме стерильных, глазных капель.
В соответствии с настоящим изобретением предпочтительным средством, связывающим тубулин, является комбретастатин А4 ("СА4"), мощное нацеливающееся на сосуды средство. СА4, по существу, нерастворим в воде. Данная характеристика мешает составлению композиций фармацевтических препаратов данного соединения. Так, наиболее предпочтительную пролекарственную форму комбретастатина А4 ("СА4Р") используют для компенсации в целом плохой растворимости СА4. Используемый здесь термин «СА4Р» относится ко всем пролекарственным солям комбретастатина А4. Подходящие соли СА4Р включают, наряду с другими, фосфатные пролекарства, описанные в патенте США № 5561122, и TRIS пролекарство, описанное в WO 021/22626. Однако изобретение не ограничено в данном отношении, и композиции СА4 могут работать также хорошо или лучше, чем СА4Р.
Комбретастатины получают из тропических и субтропических кустарников и деревьев семейства Combretaceae, которые представляют практически неисследованный резервуар новых веществ с потенциально полезными биологическими свойствами. Иллюстративным является род Combretum с 25 видами (10% от общего количества), известный в примитивных медицинских практиках Африки и Индии для таких разнообразных видов применения, как лечение проказы (См.: Watt, J.M. et al, "The Medicinal and Poisonous Plants of Southern and Eastern Africa", E.& S. Livingstone, Ltd., London, 1962, p. 194) (корень вида Combretum) и рака (Combretum latifolium).
Было обнаружено, что комбретастатины являются противоопухолевыми веществами. Многочисленные комбретастатины были выделены, структурно исследованы и синтезированы. В патентах США №№ 5409953 и 559786 описываются выделение и синтез комбретастатинов, обозначенных А-1, А-2, А-3, В-1, В-2, В-3 и В-4. Описания данных патентов полностью включены в настоящее описание в качестве ссылки. Родственный комбретастатин, обозначенный как "Комбретастатин А4", был описан в патенте США № 4996237, выданном Pettit, который полностью включен в настоящее описание в качестве ссылки.
СА4Р представляет собой производное подтипа естественного комбретастатина А4, описанного в патенте США № 5561122, полное описание которого включено в настоящее описание в качестве ссылки. Предпочтительное соединение СА4Р замещает динатрийфосфатное производное на группу -ОН в структуре СА4, и данное соединение обеспечивает возможность обратного метаболического превращения СА4Р в нерастворимый в воде СА4 in vivo. Однако изобретение не ограничено фосфатным производным, и другие пролекарственные части можно заместить на группу -ОН в соединении СА4. Кроме того, ожидается, что фосфатные соли пролекарств, отличные от динатриевой соли СА4Р, работают по существу таким же образом в целях данного изобретения. Примеры других фосфатных солей пролекарств, включая соли TRIS, описаны в патентных заявках РСТ WO 02/22626 и WO 99/35150, описания которых включены в настоящее описание.
СА4Р является первым в новом классе лекарственных препаратов - противоопухолевых нацеливающихся на сосуды средств, которые вызывают сокращение солидных опухолей в объеме избирательным нацеливанием и разрушением специфичных для опухоли кровеносных сосудов, сформированных ангиогенезом. Прицельное действие против опухолевых сосудов и ингибирование ангиогенеза являются родственными способами лечения рака, которые радикально отходят от обычных подходов к лечению рака. В отличие от традиционных способов, включающих непосредственную атаку на раковые клетки, указанные новые лекарственные препараты нацелены на систему поддержания жизни опухоли, сеть вновь возникающих кровеносных сосудов, которые формируются в результате ангиогенеза, прорастание новых кровеносных сосудов из ранее существующих сосудов. Преклинические исследования показали, что применение данных способов лечения может вызвать сокращение в объеме и в конечном счете исчезновение опухоли. Кроме того, когда СА4Р использовали на моделях клеток животных in vitro и in vivo, он проявлял необычную специфичность в плане токсичности в отношении сосудов (Int. J. Radiat. Oncol. Biol. Phys. 42(4): 895-903, 1998; Cancer Res. 57(10): 1839-1834, 1997).
Хотя и ингибиторы ангиогенеза, и средства, нацеленные против опухолевых сосудов, такие как комбретастатины, нацелены на кровеносные сосуды опухоли, они отличаются по их подходу и конечному результату. При ингибировании ангиогенеза целью является предотвращение роста опухолей ингибированием образования специфичных для опухоли кровеносных сосудов, которые питают и поддерживают опухоль. С другой стороны, при нацеливании против опухолевых сосудов целью является облитерация опухолей избирательным воздействием и разрушением их существующих кровеносных сосудов, создавая быстрое и необратимое выключение указанных кровеносных сосудов. Такой эффект не наблюдается при использовании препаратов против ангиогенеза. Только противососудистая нацеливающая активность может разрушить существующие кровеносные сосуды, поддерживающие опухолевой рост. Комбретастатин также способен ингибировать пролиферацию эндотелиальных клеток, которые продуцируют и выстилают новую сосудистую сеть опухоли (антиангиогенная активность). Следовательно, считают, что комбретастатин может вести себя и как средство, нацеливающееся против опухолевых сосудов, и как антиангиогенный препарат. В преклинических исследованиях было показано, что оба вида лечения оставляют непораженными кровеносные сосуды, связанные со здоровой тканью. Настоящее изобретение предусматривает введение СА4Р и отдельно, и/или в комбинации с современными лекарственными средствами для лечения глазных заболеваний.
Сосудистую сеть, формируемую ангиогенезом, также наблюдали при заболеваниях, отличных от рака, включая заболевания глаз, например дегенерации желтого пятна, пролиферативной диабетической ретинопатии и ретинопатии новорожденных. Предварительная работа в направлении уменьшения такой сосудистой сети на экспериментальной модели глаза проводилась в лаборатории Donald Armstrong, Ph.D., D.Sc., University of Florida, College of Veterinary Medicine, Division of Ophthalmology, который показал, что СА4Р ускорял частоту регрессии предварительно сформированных сосудов в глазу экспериментальной модели у животных. На фиг.3А, 3В, 4А и 4В показана регрессия предварительно сформированных сосудов в глазах кроликов, исследованных в данном эксперименте.
СА4 и СА4Р в настоящее время проходят клиническое испытание для лечения разнообразных заболеваний и показаний, включая применение в качестве средств, нацеливающихся против опухолевых сосудов, и в качестве ингибитора ангиогенеза. Кроме того, СА4Р продемонстрировал способность лечить глазные заболевания, такие как подсетчаточная неоваскуляризация.
Настоящее изобретение также предусматривает применение синтетических аналогов комбретастатинов, как описано в публикации Bioorg. Med. Chem. Lett. 11(2001) 871-874, 3073-3076, J. Med. Chem. (2002), 45: 1697-1711, WO 02/50007, WO 01/12579, WO 00/35865, WO 00/48590, WO 01/12579, патент США № 5525632, патент США № 5674906 и патент США № 5731353.
Другие средства, связывающие тубулин, которые можно вводить в качестве VTA, включают следующие средства или их пролекарства: 2,3-дизамещенные бензо[b]тиофены (патенты США №№ 5886025; 6162930 и 6350777), 2,3-дизамещенные бензо[b]фураны (WO 98/39323), 2,3-дизамещенные индолы (WO 01/19794), дизамещенные дигидронафталины (WO 01/68654) или аналоги колхицина (WO 99/02166). Кроме того, дополнительные нецитотоксичные пролекарства средств, нацеливающихся на сосуды, которые превращаются по существу в цитотоксичный препарат действием эндотелиального фермента, избирательно индуцируемого на повышенных уровнях в участках пролиферации сосудов, как описаны в WO 00/48606.
Дополнительные известные средства, ингибирующие тубулин, которые можно вводить в соответствии с настоящим изобретением, включают таксаны, винбластин (алкалоиды винки), колхицины (колхициноиды), доластатины, подофиллотоксины, стеганацины, амфтетинилы, флаваноиды, ризоксины, курацины А, эфотилоны А и В, велвистатины, фенстатины, 2-стрилхиназолин-4(3Н)-оны, стильбены, 2-арил-1,8-нафтиридин-4(1Н)-оны и 5,6-дигидроиндол(2,1-а)изохинолины.
В отношении введения и доставки средств, связывающих тубулин, в глаз субъекта, нуждающегося в них, важно учитывать, что глаз человека обладает несколькими структурно уникальными свойствами: он подвержен воздействию окружающей среды, он богато снабжен нервами, он имеет высокую скорость кровотока в собственно сосудистой оболочке глаза, при этом передняя камера и стекловидное тело являются полностью бессосудистыми и изолированными от системы кровообращения. Исключительная архитектура глаза обеспечивает достаточную возможность для альтернативных способов доставки препарата. В этом отношении четыре несистемных способа введения предусмотрены настоящим изобретением, а именно введение в стекловидное тело (инъекция), инъекция в субэписклеральное пространство, ионтофоретическая доставка, имплантаты/вкладыши и доставка глазными каплями.
Результаты раздражения глаз и исследований биологического распределения и ингибирования роста сосудов на экспериментальных моделях у животных неоваскуляризации роговицы, собственно сосудистой оболочки глаза или сетчатки после введения СА4Р описаны ниже в разделе "Примеры".
Неоваскулярные ретинопатии, а также глазные опухоли, таким образом, являются жизнеспособной мишенью для терапии СА4Р и другими средствами, связывающими тубулин, по множеству причин, а именно:
средства, связывающие тубулин, могут быть способны атаковать образующиеся аберрантные сосуды, связанные с ретинопатией, потому что данные сосуды не имеют общих архитектурных аналогий с гематосетчаточным барьером (BRB). Средства, связывающие тубулин, могут остановить прогрессирование заболевания очень похоже на то, как они поступают с сосудистой сетью опухоли. Кроме того, средства, связывающие тубулин, могут быть способны вызвать регрессию развивающихся сосудов, как наблюдалось в различных преклинических исследованиях;
поскольку нет 100% эффективных способов лечения по поводу подсетчаточной неоваскуляризации, средства, связывающие тубулин, могут быть эффективными препаратами при использовании в комбинации со способами лечения при современном состоянии данной проблемы;
большинство утвержденных в настоящее время способов лечения по поводу ретинопатий включают хирургическое вмешательство, которое может быть болезненным и требовать длительных периодов восстановления. Несистемное или системное введение средств, связывающих тубулин, может представлять собой нехирургический вид лечения;
при системной или несистемной доставке СА4Р проявляет себя перспективным в качестве нацеливающегося на сосуды средства на животных моделях ангиогенеза роговицы, сетчатки или собственно сосудистой оболочки глаза и на животных моделях глазных опухолей.
Как указывалось, СА4Р, а также другие средства, нацеливающиеся на сосуды и связывающие тубулин, проявляют перспективность при системной доставке на моделях ангиогенеза роговицы, сетчатки или собственно сосудистой оболочки глаза, а также других глазных заболеваний и опухолей. Предпочтительные способы системного введения включают парентеральное и оральное введение. Парентеральное введение представляет собой путь введения препаратов инъекцией под или через один или более слоев кожи или слизистых оболочек. Парентеральные пути введения, по определению, включают любой путь, отличный от орально-желудочно-кишечного (энтерального) тракта. Парентеральное введение включает внутривенный, внутримышечный и подкожный пути.
Фармацевтические композиции изобретения составлены для совместимости с предполагаемым путем введения. Фармацевтические композиции для глазного местного введения могут включать глазные растворы, глазные гели, аэрозоли, мази, перфузионные растворы и вкладыши. Местно доставляемая композиция средства, связывающего тубулин, должна оставаться устойчивой в течение периода времени, достаточно длительного для достижения желательных терапевтических эффектов. Кроме того, средство должно проникать через поверхностные структуры глаза и накапливаться в значительных количествах в участке заболевания. Кроме того, местно доставляемое средство не должно вызывать избыточное количество местной токсичности.
Глазные растворы в виде глазных капель в целом состоят из водных сред. Для того чтобы соответствовать широким диапазонам лекарственных препаратов, которые имеют различные степени полярности, можно добавить буферы, органические носители, неорганические носители, эмульгаторы, смачивающие агенты и т.д. Фармацевтически приемлемые буферы для глазных местных композиций среди других включают фосфатные, боратные, ацетатные и глюкоронатные буферы. Лекарственные носители могут включать воду, водную смесь низших алканолов, растительные масла, полиалкиленовые гликоли, желе на вазелиновой основе, этилцеллюлозу, этилолеат, карбоксиметилцеллюлозу, поливинилпирролидон и изопропилмиристат. Глазные аэрозоли в целом дают такие же результаты, как глазные капли, и могут составляться в композиции аналогичным образом. Некоторые офтальмологические препараты обладают плохой проникающей способностью через глазные барьеры и их нельзя вводить в виде капель или аэрозоля. Таким образом, мази можно применять для продления времени контакта и увеличения количества впитавшегося препарата. Продолжительную и постоянную перфузию глаза растворами, содержащими препарат, можно достичь помещением полиэтиленовой трубки в конъюнктивальный мешок. Скорость потока перфузата можно регулировать посредством устройства мининасоса для создания продолжительного орошения глаза. Вкладыши подобны мягким контактным линзам, расположенным на роговице, за исключением того, что вкладыши в целом помещаются в верхний слепой мешок или реже в нижний конъюнктивальный мешок, а не прикрепляются к открытой роговице. Вкладыши в целом изготовлены из биологически растворимых материалов, которые растворяются в слезной жидкости или распадаются, одновременно высвобождая препарат.
В одном варианте реализации активные соединения нанесены на имплантаты или вкладыши, которые имплантированы в глаз. Одним примером такого имплантата, предусмотренного настоящим изобретением, является имплантат от Oculex Pharnaceuticals, Inc., Sunnyvale, CA. Имплантат Oculex представляет собой биологически разрушаемое устройство доставки лекарственных препаратов BDD™, состоящее из биологически разрушаемой полимерной системы микроскопического размера, которая обеспечивает возможность имплантации микроинкапсулированного терапевтического препарата внутрь глаза. Имплантат обеспечивает возможность высвобождения желательного препарата непосредственно в область глаза, требующую лекарственного воздействия в течение заданного периода времени от нескольких дней до нескольких месяцев и даже до сроков, достигающих многих лет.
Особенно предпочтительно составлять местные композиции в дозированной стандартной лекарственной форме для легкости введения и равномерности дозировки. Используемый здесь термин "дозированная стандартная лекарственная форма" относится к физически дискретным единицам, подобранным в виде стандартных дозировок для субъекта, подлежащего лечению, причем каждая единица содержит заданное количество активного соединения, рассчитанного для того, чтобы вызвать желательный терапевтический эффект, в сочетании с требуемым фармацевтическим носителем. Спецификации дозированных стандартных лекарственных форм изобретения продиктованы и непосредственно зависят от уникальных характеристик активного соединения и определенного терапевтического эффекта, который должен быть достигнут, и от ограничений, присущих проблеме смешивания такого активного соединения для лечения индивидуумов. Дополнительную известную информацию в отношении способов изготовления композиций в соответствии с настоящим изобретением можно найти в стандартных ссылках в данной области, таких как, например, "Remington's Pharmaceutical Sciences", Mack Publishing Co., Easter, PA, 15th Ed. (1975).
В дополнение к несистемным путям введения, обсужденным ранее, примеры системных путей введения включают парентеральное, например внутривенное, внутрикожное, подкожное, оральное (например, ингаляционное) введение, введение через слизистые оболочки и ректальное введение. Растворы или суспензии, используемые для парентерального или подкожного применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, фиксированные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулировки тоничности, такие как хлорид натрия или декстроза. рН можно регулировать кислотами или основаниями, такими как хлористоводородная кислота или гидроокись натрия. Парентеральный препарат может быть помещен в ампулы, одноразовые шприцы или флакончики, изготовленные из стекла или пластика, содержащие множество доз.
Фармацевтические композиции, подходящие для применения в виде инъекций, включают стерильные водные растворы (при растворимости в воде) или дисперсии и стерильные порошки для приготовления стерильных растворов или дисперсии для инъекций для немедленного введения. Для внутривенного введения подходящие носители включают физиологический солевой раствор, бактериостатическую воду, Cremophor EL (BASF, Parsippany, N.J.) или солевой раствор с фосфатным буфером (PBS). Во всех случаях композиция должна быть стерильной и должна быть текучей в той степени, чтобы ее можно было легко набрать в шприц. Она должна быть устойчивой в условиях изготовления и хранения и должна быть защищена против загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и им подобные) и их подходящие смеси. Соответствующую текучесть можно поддерживать, например, использованием покрытия, такого как лецитин, поддержанием требуемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Предотвращение действия микроорганизмов можно достичь различными антибактериальными и противогрибковыми средствами, например парабенами, хлорбутанолом, фенолом, аскорбиновой кислотой, тимеросалом и им подобными. Во многих случаях будет предпочтительно включить в композицию изотонические агенты, например сахара, полиспирты, такие как маннит, сорбит, хлорид натрия. Длительное всасывание композиций для инъекций можно достичь включением в композицию агента, который задерживает всасывание, например моностеарата алюминия и желатина.
Стерильные растворы для инъекций можно приготовить включением активного соединения (например, средства, нацеливающегося на сосуды) в требуемом количестве в соответствующем растворителе по требованию с одним или комбинацией перечисленных выше ингредиентов с последующей стерилизацией фильтрацией. В целом, дисперсии получают включением активного соединения в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для приготовления стерильных инъецируемых растворов способами получения являются вакуумная сушка и лиофилизация, которая дает порошок активного ингредиента плюс любой дополнительный желательный ингредиент из его предварительно стерилизованного фильтрацией раствора.
Оральные композиции в целом включают инертный разбавитель или съедобный носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для цели орального терапевтического введения активное соединение можно включить с наполнителями и применять в виде таблеток, пастилок или капсул. Оральные композиции можно также получить с использованием текучего носителя для использования в качестве раствора для полоскания ротовой полости, причем соединение в текучем носителе вводят в ротовую полость и после полоскания выплевывают или глотают. Фармацевтически совместимые связывающие агенты и/или адъювантные материалы можно включить в качестве части композиции. Таблетки, пилюли, капсулы, пастилки и им подобные могут содержать любой из следующих ингредиентов или соединений аналогичной природы: связывающее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, разрыхляющий агент, такой как альгиновая кислота, Primogel или кукурузный крахмал; смазывающий агент, такой как стеарат магния или Sterotes; глянцующий агент, такой как коллоидный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или корригент, такой как мята перечная, метилсалицилат или апельсиновая отдушка.
Для введения ингаляцией соединения доставляются в виде аэрозольного распыления из находящегося под давлением контейнера или средства подачи, которое содержит подходящий вытеснитель, например газ, такой как диоксид углерода, или распылитель.
Системное введение может также осуществляться посредством введения через слизистые оболочки или через кожу. Для введения через слизистые оболочки или через кожу в композиции используют вещества, способствующие проникновению через соответствующий барьер, через который предстоит проникнуть. Такие вещества, способствующие проникновению, в целом известны в данной области и включают, например, для введения через слизистые оболочки детергенты, желчные соли и производные фусидовой кислоты. Введение через слизистые оболочки можно осуществить посредством применения аэрозолей для носовой полости или суппозиториев. Для трансдермального введения активные соединения включают в различные мази, бальзамы, гели или кремы, как в целом известно в данной области.
Соединения можно также получить в форме суппозиториев (например, с обычными основами суппозиториев, такими как масло какао и другие глицериды), или удерживаемых клизм для ректальной доставки.
В дополнение к описанным выше средствам, связывающим тубулин, изобретение также включает применение фармацевтических композиций и препаративных форм, включающих средство, связывающее тубулин, в ассоциации с фармацевтически приемлемым носителем, разбавителем или наполнителем, но не ограничиваясь этим, таким как, например, вода, глюкоза, лактоза, гидроксипропилметилцеллюлоза, а также другими фармацевтически приемлемыми носителями, разбавителями или наполнителями, в целом известными в данной области.
Другой целью настоящего исследования является предоставление синергических комбинаций средств, связывающих тубулин, и других терапевтических средств, таких как антиоксиданты, противовоспалительные композиции, такие как интерферон-альфа, ангиостатические стероиды, такие как AnnocortaveTM, производные стауроспорина или антиангиогенные агенты, которые препятствуют в неовсакуляризации, индуцированной VEGF, такие как ангиопоэтин-2, фактор, происходящий из пигментного эпителия (PEDF), AvastinTM, MacugenTM. Еще одной целью настоящего изобретения является предоставление способа лечения для повышения эффективности имеющихся в настоящее время методов симптоматического лечения по поводу глазной неоваскуляризации, включая механические вспомогательные приспособления для слабовидящих, лазерную фотокоагуляционную терапию или фотодинамическую терапию.
Используемые термины "фармакологически эффективное количество", "фармацевтически эффективная дозировка" или "терапевтически эффективное количество" означают то количество препарата или фармацевтического средства, которое вызовет биологическую или медицинскую реакцию ткани, системы, животного или человека, которую ожидает исследователь или клиницист. Соответствующая реакция может включать предотвращение начала заболевания, предотвращение прогрессирования заболевания или регрессии заболевания. В предпочтительном варианте осуществления введение фармацевтически эффективной дозировки по настоящему изобретению приводит к регрессии субфовеальной неоваскуляризации сосудистой оболочки глаза. Более предпочтительный вариант осуществления приводит к регрессии патологической миопии. Другой предпочтительный вариант осуществления приводит к регрессии экссудативной возрастной дегенерации желтого пятна. Используемый термин «регрессия неоваскуляризации сосудистой оболочки глаза» относится к уменьшению количества неоваскулярных поражений на сетчатку, уменьшению среднего размера неоваскулярных поражений на сетчатку или уменьшению общей площади неоваскуляризации по данным измерения кумулятивного размера неоваскулярных поражений в сетчатке. Это уменьшение общей площади неоваскуляризации можно оценить различными методиками, включая, например, флуоресцеиновую ангиографию и анализ изображения.
Реакцию можно оценить тестами по определению остроты зрения, флуоресцеиновой ангиографией или одним из ряда других глазных исследований. Предпочтительный вариант осуществления оценки реакции представляет собой тест на остроту зрения, когда зрение пациента улучшается, по меньшей мере, на 2 строки в тесте на остроту зрения. В альтернативном варианте осуществления реакцию можно оценить измерением уменьшения количества истечения экссудата в подвергнутом лечению глазу. Это уменьшение истечения экссудата можно измерить различными методиками, включая, например, площадь гиперфлуоресценции через различные периоды времени после инъекции флуоресцеина.
Дозировка СА4Р для введения в глаз субъекта (несистемное введение) находится в диапазоне от приблизительно 0,01 до 100 мг/мл. Концентрация СА4Р, достигаемая в глазу, должна быть терапевтически адекватной и находиться в диапазоне от приблизительно 1 наномоля до 100 миллимолей. Более предпочтительная концентрация СА4Р в глазу находится в диапазоне от примерно 1 микромоля до 100 микромолей. При введении СА4Р системно количество пролекарства комбретастатина А4 в диапазоне от приблизительно 0,1 до приблизительно 120 мг/м2 преимущественно вводят парентерально. В особенно предпочтительном варианте осуществления СА4Р вводят внутривенно в дозе 27 мг/м2.
Предполагается, что системное и несистемное введение средств, связывающих тубулин, в соответствии с настоящим изобретением будет предназначено для введения млекопитающим, в частности людям. Однако изобретение в данном отношении не ограничивается и препаративные формы можно также получить в соответствии с ветеринарными руководствами для введения также животным.
Далее изобретение определено ссылкой на следующие примеры. Для специалистов в данной области будет очевидно, что множество модификаций, материалов и способов можно осуществить без отхода от цели и интереса изобретения.
ПРИМЕРЫ
Пример 1. Исследования раздражения глаз и определение средней переносимой дозировки (СПД) СА4Р при введении местно в глаз с использованием трех путей введения
(i) Введение в стекловидное тело
Тестируемое изделие, СА4Р, оценивали для выявления возможности вызвать внутриглазное раздражение после инъекции в стекловидное тело у кроликов. После общей анестезии СА4Р в дозе 0,2 мл вводили в правые глаза восьми кроликов. 0,9% раствор хлорида натрия в соответствии с Фармакопеей США в дозе 0,2 мл вводили в левые глаза кроликов для того, чтобы они служили в качестве отрицательных контролей. Тестировали четыре различные концентрации СА4Р. Каждую из четырех концентраций (0,1 мг/мл, 1,0 мг/мл, 10 мг/мл и 100 мг/мл) вводили в правые глаза двух кроликов. Приблизительно через 48 часов после обработки глаза исследовали биомикроскопической щелевой лампой и непрямым офтальмоскопом. Регистрировали балльные оценки и проводили эвтаназию кроликов. Непосредственно после эвтаназии отсасывали образцы стекловидной жидкости и с помощью гемацитометра определяли количество лейкоцитов. Количества менее или равные 200 клеток/мм3 считали приемлемыми.
В контрольных глазах не было значимых изменений глазных тканей на основании исследования биомикроскопической щелевой лампой и офтальмоскопом. В глазах, подвергнутых тестирующей обработке, данные раздражения были отмечены у одного животного в концентрации 1 мг/мл и у обоих в концентрации 100 мг/мл. Среднее количество клеток в стекловидной жидкости составило 9 клеток/мм3 для глаз, в которые вводили концентрацию 0,1 мг/мл; 962 клетки/мм3 для глаз, в которые вводили концентрацию 1 мг/мл; 10 клеток/мм3 для глаз, в которые вводили концентрацию 10 мг/мл; 409 клеток/мм3 для глаз, в которые вводили концентрацию 100 мг/мл и 5 клеток/мм3 для контрольных глаз.
В условиях исследования контроли реагировали, как ожидалось, отсутствием значимой реакции, отмеченной при исследованиях глаз и анализе стекловидной жидкости. У животных, подвергнутых тестируемой обработке, у обоих животных, которым вводили концентрацию 100 мг/мл, было выраженное раздражение и воспаление при обоих офтальмологических исследованиях, и у них проявлялись данные воспаления по анализу лейкоцитов в стекловидной жидкости. Для всех более низких уровней доз (0,1 мг/мл, 1,0 мг/мл и 10 мг/мл) не было четких данных наличия раздражения или воспаления.
(ii) Введение в субэписклеральное пространство
Тестируемое изделие, СА4Р, оценивали для выявления первичного раздражения глаз. Две инъекции в объеме 0,1 мл соответствующей концентрации СА4Р (0,1, 1,0, 10 и 100 мг/мл) вводили в субэписклеральное пространство правого глаза двух кроликов. Порцию в объеме 0,2 мл солевого раствора с буфером инъецировали в субэписклеральное пространство левых глаз для того, чтобы они служили в качестве отрицательного контроля. Глазные реакции оценивали через 24, 48 и 72 ч после введения образца. На 3-й день проводили эвтаназию кроликов и удаляли глаза. Образцы фиксировали и заливали и проводили гистологическое исследование. Патогистологические изменения в тканях глаза регистрировали с обращением особого внимания на исследование изменений в субэписклеральном пространстве.
В условиях данного исследования не наблюдали раздражения в глазах, обработанных концентрациями 0,1 мг/мл и 1,0 мг/мл, по сравнению с соответствующими глазами, служившими отрицательными контролями. Небольшое раздражение наблюдали в глазах, обработанных концентрациями 10 мг/мл и 100 мг/мл, по сравнению с соответствующими глазами, служившими отрицательными контролями.
(iii) Местные капли
Тестируемое изделие, СА4Р, оценивали для выявления первичного раздражения глаз. Однократную дозу 0,2 мл разведения СА4Р (0,1, 1,0, 10 и 100 мг/мл) помещали в нижний конъюнктивальный мешок левого глаза для того, чтобы служить сравнительным контролем. В противоположный глаз вводили солевой раствор с буфером. Глазные реакции оценивали через 24, 48 и 72 ч после введения образца.
В условиях данного исследования макроскопическую реакцию на все разведения тестируемого изделия считали незначительной по сравнению с реакций контроля. Микроскопически тестируемое изделие не расценивали как раздражающее по сравнению с контрольным изделием в виде солевого раствора с буфером.
Обобщение результатов представлено в таблице:
Пример 2. Оценка биологического распределения СА4Р при местном введении в глаз с использованием различных путей введения
Для того чтобы быть эффективным при лечении глазной неоваскуляризации, несистемный способ введения лекарственного препарата должен обеспечивать его проникновение через релевантные структуры в глазу и доставку лекарственного препарата в терапевтически значимых количествах к участку заболевания. Для подтверждения того, что различные способы несистемной инъекции могут привести к значимому биологическому распределению СА4Р, провели эксперименты по биологическому распределению препарата, меченного радиоактивной меткой.
Методы:
При отсутствии ниже замечаний для каждого эксперимента по биологическому распределению соблюдали следующий протокол.
14С-СА4Р (OXiGENE Inc., Watertown, MA) ресуспендировали в 100 мкл солевого раствора и инъецировали иглой калибра 30G в правые глаза наркотизированных самцов новозеландских кроликов (в возрасте 4 месяцев, массой 1,8-2,5 кг, n=3 на образец). Тестировали три различных концентрации 14С-СА4Р (1, 10, 100 мг/мл), соответствующих дозам 1, 5 и 50 мкКи воздействующей радиоактивности, соответственно. Была также включена не подвергавшаяся обработке контрольная группа. Кроликов анестезировали через 1, 6, 24 и 48 ч для взятия образцов крови. После взятия крови животных подвергали эвтаназии инъекцией фенобарбитала и обработанные глаза удаляли у исследуемых животных. Образцы ткани глаз отсекали от роговицы, водянистой влаги, стекловидной жидкости, собственно сосудистой оболочки глаза или сетчатки, помещали в 20 мл стеклянные сцинтилляционные флакончики, перемешивали встряхиванием и инкубировали в течение 24 часов с 500 мкл переваривающей жидкости. Плазму отделяли от цельной крови центрифугированием (1800g в течение 10 минут). Образцы глазной ткани и плазму инкубировали при комнатной температуре с 16 мл сцинтилляционной жидкости Hionic Fluor™ в течение периода 24 часов перед подсчетом радиоактивности. Каждый образец подсчитывали в течение 5 минут в счетчике Betamatic V (Bio-Tek Kontron Instruments, St Quentin en Yvelines, France). Превращение циклов в минуту ("cpm") в распады в минуту ("dpm") проводилось автоматически бета-счетчиком с использованием калибровочных кривых, полученных от стандартов 14С и кривых гашения от соответствующих гашеных матриц, подвергнутых уколам стандартами 14С. Концентрацию лекарственного средства определяли в соответствии с нанограммовыми эквивалентами СА4Р (нг-экв/г ткани), который подсчитывали по измеренной величине dpm, массе образца ткани и удельной активности препарата (0,37 мКи/мг) с последующим вычитанием соответствующей фоновой величины от контрольной глазной ткани. Тканевая концентрация 1 мкмоль СА4Р равна 440 нэкв/г ткани.
Результаты:
(i) Введение в стекловидное тело
В таблице 1 приведены результаты биологического распределения после инъекции в стекловидное тело. Во всех исследованных тканях степень проникновения в глаз зависела от концентрации СА4Р, помещенного на поверхность глаза. Самые высокие концентрации препарата в глазу ("Сmax") были достигнуты в пределах первого часа после введения. Терапевтически релевантные концентрации препарата (>1 мкмоль) были доставлены к сетчатке при всех исследованных концентрациях. Высокие концентрации препарата были также обнаружены в стекловидном теле и роговице. Относительно мало препарата было обнаружено в водянистой влаге глаза или плазме крови.
после инъекции в стекловидное тело
(ii) Введение в субэписклеральное пространство
(1) Биологическое распределение
В таблице 2 приведены результаты изучения биологического распределения после инъекции в субэписклеральное пространство. Во всех исследованных тканях степень проникновения в глаз зависела от концентрации СА4Р, введенного в ткань, окружающую глаз. Самые высокие концентрации препарата в глазу были достигнуты в пределах первого часа после введения. Терапевтически релевантные концентрации препарата (>1 мкмоль) были доставлены к сетчатке и собственно сосудистой оболочке глаза при введенной дозе 100 и 10 мг/мл. Высокие концентрации препарата были также обнаружены в склере. Относительно мало препарата было обнаружено в стекловидном теле, водянистой влаге глаза или плазме крови.
после инъекции в субэписклеральное пространство
(iii) Субконъюнктивальное введение
Субконъюнктивальные инъекции вводили в дозах 0,1, 1, 10 и 100 мг/мл. Растворы 14С-СА4Р составляли в композиции с 0,24% 10 н. KOH и 0,01% бензалконийхлоридом и инъецировали в объеме 100 мкл. Животных обрабатывали в применяемой дозе 5 мкКи однократной субконъюнктивальной инъекцией в правый глаз. После доставки глаз аккуратно держали закрытым в течение 2-5 секунд. Результаты эксперимента представлены ниже в таблице 3.
Самые высокие концентрации препарата в глазу были отмечены в пределах первого часа после введения. Терапевтически релевантные концентрации препарата (>1 мкмоль) были доставлены к роговице, сетчатке и собственно сосудистой оболочке глаза при введенной дозе 100, 10 и 1 мг/мл. Относительно мало препарата было обнаружено в стекловидном теле или плазме крови.
после субконъюнктивальной инъекции
(iv) Введение в окологлазную ткань
В таблице 4 представлены результаты биологического распределения после инъекции в окологлазные ткани. Во всех исследованных тканях степень проникновения в глаз зависела от концентрации СА4Р, введенного в ткань, окружающую глаз. Самые высокие концентрации препарата в глазу были достигнуты в пределах первого часа после введения. Терапевтически релевантные концентрации препарата (>1 мкмоль) были доставлены к сетчатке и собственно сосудистой оболочке глаза при всех введенных дозах. Высокая концентрация препарата также наблюдалась в склере. Относительно мало препарата было обнаружено в стекловидном теле или плазме крови.
после инъекции в окологлазную ткань
(v) Местные препаративные формы
Местные гели и растворы были разработаны для применения в качестве местных препаративных форм, пригодных для местной доставки СА4Р на поверхность глаза. Местные растворы (1, 3 и 10%) непосредственно готовили в 0,9% NaCl (Aguettant, Lyon, France) и стерилизовали фильтром 0,2 мкм (рН от 6,4 до 8,5, осмолярность от 290 до 459 мосмоль/кг Н2О. Местные гели (1, 3 и 10%) с низкой вязкостью готовили в 0,5% карбоксиметилцеллюлозе (Sigma Aldrich Chimie, St. Quentin Fallavier Cedex, France) с 0,9% NaCl. Физико-химические спецификации каждого геля приведены в таблице 5.
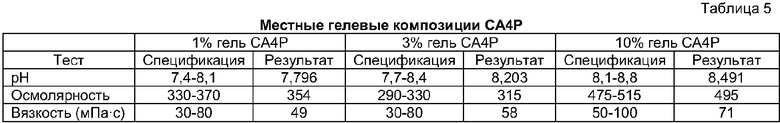
Местные препаративные формы наносили на поверхность правых глаз в применяемой дозе 5 мкКи в объеме 50 мкл. Брали образцы роговицы вместо склеры. Образцы брали через 0,5, 1, 6 и 24 часа.
В таблице 6 приведены результаты изучения биологического распределения после введения каждой местной гелевой композиции СА4Р. Во всех исследованных тканях степень проникновения в глаз зависела от концентрации СА4Р в каждой гелевой препаративной форме. Самые высокие концентрации препарата в глазу были достигнуты в пределах первого часа после введения. Терапевтически релевантные концентрации препарата (>1 мкмоль) были доставлены к роговице, сетчатке и собственно сосудистой оболочке глаза всеми тремя гелевыми препаративными формами. Относительно мало препарата было обнаружено в плазме крови.
после местного нанесения геля
В таблице 7 приведены результаты изучения биологического распределения после введения каждой местной препаративной формы СА4Р в виде раствора. Во всех исследованных тканях степень проникновения в глаз зависела от концентрации СА4Р в растворе композиции. Самые высокие концентрации лекарственного средства в глазу были достигнуты в пределах первого часа после введения. Терапевтически релевантные концентрации препарата (>1 мкмоль) были доставлены к роговице всеми тремя композициями в виде раствора, в то время как доза 10 мг/мл привела к доставке значительного количества препарата к сетчатке и собственно сосудистой оболочке глаза.
после местного нанесения раствора
Из указанных экспериментов очевидно, что несистемная доставка СА4Р любым из разнообразия способов является эффективной в достижении терапевтически релевантной концентрации препарата в роговице, сетчатке или собственно сосудистой оболочке глаза. Каждая из указанных тканей представляет собой потенциальный участок неоваскуляризации глаза.
Пример 3. Введение СА4Р в глаз посредством ионтофореза
СА4Р может ионизироваться при физиологическом рН и поэтому поддается ионтофоретической доставке. Эффективность ионтофоретической доставки СА4Р через склеру оценивали с использованием глазного кроличьего офтальмического аппликатора (IOMED Inc., Salt Lake City, UT), составленного из силиконовой приемной оболочки емкостью 180 мкл, подкладкой которой служит компонент распределения тока, изготовленный из серебряной фольги, покрытой хлоридом серебра, соединительной проводящей ток проволоки и одного слоя импрегнированной гидрогелем матрицы из поливинилацеталя, на которую наносили СА4Р (10 мг/мл). Площадь контактной поверхности аппликатора составила 0,54 см2. Аппликатор помещали на склеру в правые глаза новозеландских белых кроликов (3-3,5 кг, n=6 для каждой обработки) в верхний слепой мешок у лимба при расположении переднего края на 1-2 мм дистальнее роговично-склерального соединения. Анодный ионтофорез постоянным током выполняли каждым аппликатором при питании 2, 3 и 4 мА в течение 20 минут с использованием Phoresor II™ PM 700 (IOMED Inc., Salt Lake City, UT). В качестве контроля использовали пассивный ионтофорез (0 мА в течение 20 минут). После обработки животных подвергали эвтаназии и энуклеацию глаз производили через 30 минут после обработки, прополаскивали водопроводной водой и замораживали при -70°С. Сетчатку и собственно сосудистую оболочку глаза отделяли от указанных образцов.
Количественный анализ СА4Р, СА и диэтилстильбестрола внутреннего стандарта (Sigma Chemical Company) проводили приблизительно 100 мг ткани с использованием способа хроматографии тандемной масс-спектрометрии ("ЖХ/МС/МС"). Аликвотное количество метонального экстракта инъецировали в устройство для ЖХ/МС/МС SCIEX APIO 3000, оборудованное колонкой ВЭЖХ. Измеряли площадь пика m/z 315->285 иона продукта СА43 и m/z 395->79 иона продукта СА4Р в сравнении с площадью пика m/z 267->237 иона продукта внутреннего стандарта. Количественный анализ проводили с использованием анализов регрессии взвешенным (1/x) линейным методом наименьших квадратов, генерированных по обогащенным калибровочным стандартам, полученным непосредственно перед каждым сеансом анализа. Исходные количества комбретастатина были значимо выше, чем диапазон количественного определения, и поэтому их нужно было экстраполировать после анализа. Как показано в таблице 8, доставка общего количества комбретастатина к собственно сосудистой оболочке глаза и сетчатке усиливается ионтофорезом приблизительно в 15 раз при сравнении с пассивной доставкой. Указанные уровни представляют избыток в несколько тысяч раз сверх того, что считается терапевтически релевантной концентрацией для ингибирования связывания тубулина (2-3 мкмоль). Однако доставка к сетчатке/собственно сосудистой оболочке глаза не оказалась зависимой от тока.
к сетчатке собственно сосудистой оболочки глаза
(средняя величина ± стандартное отклонение)
Пример 4. Лечение неоваскуляризации роговицы посредством системного введения СА4Р
Для имитации патогенного глазного ангиогенеза неоваскуляризацию глаз вызывали введением гидропероксида липида (LHP) внутрироговичной инъекцией в дозировке 30 мкг в глаза кроликов. Через 7-14 дней глазные сосуды формировались в инъецированных глазах вследствие повреждения, вызванного LHP. Субъекты были разделены на две группы; животным из первой группы вводили динатрийфосфат комбретастатина А4 внутривенным введением в дозировке 40 мг/кг один раз/день в течение 5 дней, в то время как носитель без динатрийфосфата комбретастатина А4 вводили другой группе внутривенным введением в виде дозировки воды в течение того же периода времени. Глаза животных обеих групп исследовали через 7 дней. Уменьшение сосудов на 40% или более наблюдали в группе, получавшей лечение динатрийфосфатом комбретастатина А4, но его не было в другой группе.
Пример 5. Лечение неоваскуляризации роговицы посредством системного введения СА4Р
Для оценки способности СА4Р ингибировать неоваскуляризацию роговицы использовали модель роговицы кролика, на которой неоваскуляризацию вызывали инъекцией гидропероксида линолевой кислоты ("LHP") (Ueda et al., Angiogenesis, 1997, 1: 174-184). Инъекция LHP в роговичную строму стимулирует локализованную продукцию ангиогенных цитокинов внутри роговицы. Кровеносные сосуды в окружающем лимб сплетении реагируют на ангиогенную стимуляцию миграцией в направлении к участку инъекции LHP. Терапевтическую эффективность системно доставленного СА4Р оценивали измерением длины указанных пролиферирующих сосудов.
Экспериментальные методы:
Как показано в таблице 9, взрослым самцам новозеландских кроликов (2,7-3,0 кг) инъецировали 10 мкл суспензии LHP (60 мкг) в 5 мм от верхнего лимба для того, чтобы вызвать роговичный ангиогенез. Сосуды росли со скоростью 0,25 мм/день. Группам 2 и 4 внутрибрюшинно ("в/б") инъецировали СА4Р (50 мг/кг) соответственно через 3 и 10 дней роста сосудов. Группам лечения 1 и 3 инъецировали солевой контроль на 3-й и 10-й дни после инъекции LHP. Поверхностные фотографии роговицы делали на 0, 3, 6, 12, 17 и 28-й дни после инъекции LHP. После каждого сеанса фотографирования сосуды роговицы наблюдали под оперативным микроскопом и использовали штангенциркуль Castroviejo для измерения длины наиболее выступающего сосуда.
В дополнение к измерению самого длинного сосуда предпринимали гистологический анализ на 28-й день для оценки количества растворенной внеклеточной матрицы, толщины стенки сосудов и степени разветвления сосудов. У подвергнутых эвтаназии животных производили энуклеацию глаз и из каждого глаза удаляли стекловидное тело перед фиксацией в 4% параформальдегиде в течение 45 минут и 0,2 М какодилатном буфере (рН 7,4) в течение ночи. Глаза помещали в парафин, делали срезы толщиной 3 мкм и окрашивали гемолизином и эозином.
Результаты:
В таблицах 10 и 11 суммированы воздействия СА4Р на длину сосудов как функции вмешательства-времени и количества лечебных процедур. Когда лечение СА4Р использовали для вмешательства в пределах 3 дней от исходной ангиогенной стимуляции (таблица 10, группа 2), препарат вызывал полное ингибирование роста новых сосудов. Напротив, сосуды в группе контроля носителя продолжали расти. Указанный эффект можно квалифицировать как подавление ангиогенеза или антиангиогенный эффект. Когда лечение СА4Р использовали для вмешательства через 10 дней после ангиогенной стимуляции (таблица 11, группа 2), эффект был таким же.
на 12-й день
на 24-й день
Фиг.3В представляет собой фотографию поверхности глаза, обработанного СА4Р на 28-й день. Данная фотография дополнительно иллюстрирует ингибирование роста сосудов на 28-й день после введения СА4Р по сравнению с глазом контроля носителя, изображенным на фиг.3А.
Микрофотографии, представленные на фиг.4А и 4В (увеличение ×400), являются примерами окрашенных гистологических образцов, полученных у одних и тех же животных на 28-й день. У животных, получавших носитель (фиг.4А), сосуды оказались круглыми и многочисленными. Напротив, у животных, получавших лечение СА4Р (фиг.4В), сосуды оказались узкими и менее многочисленными. Кроме того, данные за регрессию сосудов наблюдались на более поздних стадиях вмешательства введением СА4Р (данные не показаны). Оказалось, что СА4Р был способен уменьшить ширину образовавшихся сосудов и значительно ингибировать прорастание ветвей из сосудов, что указывает на дополнительный нацеленный на сосуды эффект.
Пример 6. Лечение неоваскуляризации собственно сосудистой оболочки глаза на экспериментальной модели дегенерации желтого пятна посредством системного введения СА4Р
Неоваскуляризация собственно сосудистой оболочки глаза является основной причиной тяжелой потери зрения у пациентов с возрастной или влажной дегенерацией желтого пятна. Для исследования способности СА4Р ингибировать рост сосудов в собственно сосудистой оболочке глаза испытывали модель неоваскуляризации собственно сосудистой оболочки глаза у мышей. На данной модели исследователь использует криптоновый лазер для создания раны на базальной пластинке мыши C57BL/6J. В каждом глазу производили несколько ожогов. Ожог вызывал классическую реакцию заживления раны, которая включала неоваскуляризацию внутри собственно сосудистой оболочки глаза. Данный способ фотокоагуляции криптоновым лазером был описан в публикации Tobe et al., Am. J. of Pathology, 1998, 153(5):1641-6. У подгруппы животных (n=19) СА4Р системно вводили в/б (IP) инъекцией в дозе 100 мг/кг/день. Патогистологию и флуоресцеиновую ангиографию использовали для идентификации неоваскуляризации, окружающей ожог. Электронную микроскопию использовали для измерения диаметра просвета фенестрированной сети новых сосудов внутри неоваскулярных поражений собственно сосудистой оболочки глаза. Таблица 12 иллюстрирует результаты влияния лечения СА4Р на среднюю площадь просвета сосудов. У животных, получавших лечение СА4Р, площадь просвета сосудов (мм2) была приблизительно на 50% меньше при сравнении с животными, получавшими лечение солевым раствором (n=33). Статистический анализ результатов продемонстрировал высокую степень значимости.
получавших лечение СА4Р и носителем
Пример 7. Лечение неоваскуляризации сетчатки на модели ретинопатии недоношенных у мышей посредством системного введения СА4Р
Внутренняя сетчатка глаза млекопитающих получает кислород из поверхностного сетчаточного капиллярного ложа. Данное капиллярное ложе расположено под внутренней ограничивающей мембраной, которая служит в качестве поверхности раздела между внутренней сетчаткой и наружным бессосудистым стекловидным телом. Патология неоваскуляризации сетчатки или ретинопатия возникает вследствие вызванного ишемией роста новой сосудистой сети за пределами сетчаточной внутренней ограничивающей мембраны и в стекловидное тело, вызывая тяжелую потерю зрения и часто приводя к отслоению сетчатки. Хорошо охарактеризованная мышиная модель вызванной кислородом неоваскуляризации сетчатки близко имитирует ретинопатию недоношенности ("ROP"), проявляющуюся у преждевременно родившихся младенцев человека и имеющую характеристики, общие для различных других ретинопатий, вызванных ишемией, включая диабетическую ретинопатию (Smith et al., Invest. Ophthalmol. Vis. Sci., 1994, 35:101-11). В данной модели новорожденные мыши подвергаются воздействию стойких гипероксидных условий (75% кислород в течение 7 дней), которые ингибируют развитие поверхностного сетчаточного капиллярного ложа. Когда мышонка удаляют из среды чистого кислорода и помещают в относительную гипоксию кислорода окружающей среды, недоразвитое поверхностное сетчаточное капиллярное ложе неспособно доставить достаточные количества кислорода к сетчатке. Сетчатка реагирует на отсутствие кислорода продукцией ангиогенных цитокинов, которые вызывают тяжелые патологические последствия. Локализованная продукция ангиогенных цитокинов может вызвать прорастание новых сосудов из недоразвитого поверхностного сетчаточного капиллярного ложа, которые разрушают внутреннюю ограничивающую мембрану. Рост аберрантных кровеносных сосудов в стекловидном теле вызывает образование значительного количества рубцовых тканей и вызванное тягой отслоение сетчатки.
Ожидается, что лечение новорожденной мыши СА4Р сразу после ее удаления из гипероксидных условий может быть эффективным способом лечения по поводу ROP. Неоваскуляризацию сетчатки можно количественно охарактеризовать подсчетом количества химически окрашенных ядер проникающих эндотелиальных клеток в срезе ткани сетчатки глаз, получавших и не получавших лечение, в соответствии с существующими способами (Majka et al., Invest. Ophthalmol. Vis. Sci. 2001, 42: 210-15). Ожидается, что количество ядер клеток, проникающих через внутреннюю ограничивающую мембрану, должно быть значительно уменьшено в глазах, получавших лечение СА4Р.
Пример 8. Лечение глазных опухолей на мышиной модели ретинобластомы посредством субконъюнктивального введения СА4Р
Использовали мышиную трансгенную модель ретинобластомы, в которой у мышей с наличием крупного Т антигена SV-40 развивается двухсторонняя ретинобластома, напоминающая ретинобластому у детей. На данной модели опухоли сначала появляются в возрасте 4 недель и развиваются устойчивым и воспроизводимым образом (Hayden et al., Arch. Ophthalmol. 2002; 120(3): 353-9). В одном эксперименте животных 12-недельного возраста (n=48) лечили однократной субконъюнктивальной инъекцией 20 мкл СА4Р (100 мг/мл) только в правый глаз. Контрольных мышей (n=8) лечили сбалансированным солевым раствором ("BSS"). Образцы глаз брали путем энуклеации на 1, 3, 7, 14, 21 и 28-й дни после лечения (n=8 глаз на выборку). Образцы фиксировали, помещали в парафин, делали серийные срезы и окрашивали гематоксилином, эозином после предварительно проведенной PAS-реакции (Шик-реакции). Каждый образец ткани исследовали для выявления патогистологической реакции сосудов опухоли. Как показано на фиг.5А, значительное уменьшение внутриопухолевой васкуляризации было очевидно на 1, 3 и 7-й дни.
В отдельном эксперименте введения животных (n=48) лечили 6-серийными субконъюнктивальными инъекциями СА4Р 2 раза/неделя в концентрациях 100, 10, 1, 0,1 или 0,01 мг/мл в объеме 20 мкл (n=6 глаз на выборку). Контрольной группе (n=6) проводили серийные субконъюнктивальные инъекции BSS. Энуклеацию глаз проводили через 28 дней после лечения и исследовали для выявления уменьшения объема опухоли. Фиг.5В иллюстрирует зависимый от дозы эффект СА4Р на сосудистый объем опухоли в сравнении с контролем. Внутриопухолевая сосудистая сеть отсутствовала при уровнях лечебных доз выше 10 мг/мл, и ни в одной точке времени или лечебной дозе не были отмечены данные о токсичности.
Пример 9. Лечение патологической миопии у человека посредством системного введения СА4Р
35-летний мужчина был первоначально обследован в 1-й день после его жалоб на зрительные помехи в правом глазу. Приблизительно 2 года тому назад пациенту для коррекции по поводу миопии имплантировали искусственные хрусталики в оба глаза. Пациенту был поставлен диагноз патологической миопии (так же известной как пролиферативная миопатия и миопатическая дегенерация желтого пятна), и он получил всего 4 курса фотодинамической терапии (PDT, VisudyneTM) левого глаза в течение последующих 8 мес. Однако пациент снова предъявлял жалобы на резкую потерю зрения левым глазом, и после обследования в левом глазу было выявлено истечение крови и жидкости. В июне 2003 г. пациенту был поставлен также диагноз патологической миопии правого глаза.
Примерно через 3 мес пациент был включен в открытое поисковое (фаза I/II) исследование безопасности и переносимости повышения дозы СА4Р. В это время наилучшая корригированная острота зрения пациента, по данным определения остроты зрения обратным освещением по Snellen, составляла 20/50-3 в левом глазу и 20/25-3 в правом глазу. После обследования в обоих глазах было выявлено истечение крови и жидкости. В 1-й день исследования было начато лечение пациента внутривенным вливанием СА4Р (свободной кислоты) в дозе 27 мг/м2 в течение 10-минутного периода. На 8-й день исследования у пациента была выявлена острота зрения 20/20-1 в левом глазу и 20/20-0 в правом глазу. При флуоресцеиновой ангиографии обоих глаз не наблюдалось активное истечение. Пациенту провели второе, третье и четвертое вливания СА4Р на 8-й, 15-й и 22-й дни исследования при сохранении остроты зрения и отсутствии активного истечения в обоих глазах. Пациент в последующем сообщил, что его зрение резко улучшилось с начала лечения СА4Р, и, что примечательно, он сообщил, что может читать текст с нормальным размером шрифта.
Данные приведенного выше примера истории болезни следующие:
1. Субъективное улучшение зрения. Пациент сообщил, что его ухудшающееся зрение значительно улучшилось с начала лечения СА4Р.
2. Объективное улучшение зрения. Острота зрения пациента, определяемая по Snellen, улучшилась на 5 строчек до зрения 20/20 в левом глазу.
3. Оценка патологической миопии флуоресцеиновой ангиографией. Перед началом лечения СА4Р оценка состояния обоих глаз пациента выявила истечение жидкости и кровотечение. Для сравнения при флуоресцеиновой ангиографии сразу после лечения и в течение остального периода исследования кровотечение или экссудат не наблюдали.
Пример 10. Лечение возрастной дегенерации желтого пятна у людей посредством системного введения СА4Р
Трое пациентов в возрасте 50 лет или старше были включены в открытое поисковое (фаза I/II) исследование безопасности и переносимости повышения дозы СА4Р. Каждый пациент соответствовал критериям включения в исследование: острота зрения менее чем 20/40 в исследуемом глазу и острота зрения лучше или равная 20/800 во втором глазу по данным определения Исследования раннего лечения диабетической ретинопатии (ETDRS). Флуоресцеиновая ангиография (FA) исследуемого глаза каждого пациента выявила субфовеальную неоваскуляризацию собственно сосудистой оболочки глаза, вызванную возрастной дегенерацией желтого пятна, при общем размере поражения (включая атрофию/фиброз кровеносных сосудов и неоваскуляризацию) менее чем 12 общих площадей диска, из которых, по меньшей мере, 50% состояли из активной неоваскуляризации собственно сосудистой оболочки глаза. Ни у одного из пациентов не проявлялась клинически значимая сердечная патология или данные за удлинение интервала QT на ЭКГ. Кроме того, ни один из пациентов ранее не получал субфовеальную термическую лазерную терапию или какое-либо другое лечение глаз в пределах 12 недель перед скринингом. Ни у одного из пациентов не было рубцевания или атрофии более 25%, и у всех были прозрачные глазные среды и расширение зрачка, адекватное для обеспечения возможности получения стереоскопической фотографии глазного дна хорошего качества.
В 1-й день исследования после завершения 2-4-недельного периода оценки начинали лечение каждого пациента внутривенным вливанием свободной кислоты СА4Р в дозе 27 мг/м2 в солевом растворе, вводимой в течение 10-минутного периода. Каждый пациент получал второе, третье и четвертое вливания СА4Р (раствора свободной кислоты в дозе 27 мг/м2) на 8-й, 15-й и 22-й дни исследования. Для введения СА4Р использовали инфузионный насос или шприцевой насос, соединенный с магистральным фильтром (<5 микронов). СА4Р для инъекции состоял из стерильной, лиофилизированной динатриевой соли с достаточным избытком во флаконе для обеспечения 90 мг свободной кислоты. Содержимое каждого флакона с СА4Р для инъекций растворяли 11 мл стерильной воды для инъекций по Фармакопее США для получения концентрации 9 мг/мл лекарственного продукта в виде свободной кислоты. Ее далее разбавляли приблизительно 100-150 мл физиологического раствора для достижения концентраций от 0,6 мг/мл до 1,1 мг/мл в виде свободной кислоты перед внутривенным введением. Вводимую общую дозу СА4Р округляли до ближайшего миллиграмма, а площадь поверхности тела рассчитывали, используя фактический рост и массу пациента. Для пациента с площадью поверхности тела (BSA) >2,0 м2 дозу СА4Р рассчитывали, используя BSA = 2,0 м2.
FA выполняли через 1 ч после первого вливания и непосредственно перед вторым, третьим и четвертым вливаниями СА4Р. FA также выполняли во время контрольного обследования через 4 недели и 8 недель после четвертого введения СА4Р. Количество истекающего экссудата измеряли по разности площади гиперфлуоресценции через 30 с и 3 мин после инъекции флуоресцеина. Балльную оценку площади неоваскуляризации проводили, используя матрицу, накладываемую на проецируемые изображения FA. Состав поражения и толщину сетчатки также оценивали с помощью оптической когерентной томографии (ОСТ) во время каждого обследования глаз. У каждого пациента во время каждого обследования глаз также оценивали остроту зрения с помощью протокола ETDRS определения рефракции.
У пациентов при тестах остроты зрения выявлено улучшение на 2 или 3 строки.
Другие варианты осуществления
Следует понимать, что хотя изобретение было описано в связи с его подробным описанием, предшествующее описание предназначено для иллюстрации, а не для ограничения диапазона притязаний изобретения, который определен диапазоном притязаний прилагаемой формулы изобретения.
Следует также понимать, что чертежи необязательно представлены в масштабе, они просто являются концептуальными.
Группа изобретений относится к медицине, а именно к офтальмологии, и касается использования комбретастатина и его фосфатного пролекарства для лечения или предупреждения патологической миопии. Использование предложенных изобретений позволяет улучшить остроту зрения у пациента, страдающего патологической миопией, уменьшить экссудативные явления, индуцировать регрессию пролиферации сосудов, подавить рост пролиферирующей сосудистой сети. 7 н. и 33 з.п.ф-лы, 10 ил., 13 табл.
1. Способ лечения или предупреждения патологической миопии, включающий следующие стадии:
a) приготовление лекарственной формы, включающей фармацевтически эффективную дозу комбретастатина или его фосфатного пролекарства;
b) введение фармацевтически эффективной дозировки нуждающемуся в ней субъекту.
2. Способ по п.1, где указанный комбретастатин или его фосфатное пролекарство представляет собой комбретастатин А4.
3. Способ по п.1, где указанный комбретастатин или его фосфатное пролекарство представляет собой комбретастатин А4 фосфат.
4. Способ по п.1, где указанную фармацевтически эффективную дозировку вводят указанному субъекту системно.
5. Способ по п.1, где указанную фармацевтически эффективную дозу вводят внутривенным вливанием.
6. Способ по п.4, где указанная фармацевтически эффективная доза, введенная системно, включает количество пролекарства комбретастатина А4 фосфата в диапазоне от приблизительно 0,1 мг/м2 до приблизительно 120 мг/м2.
7. Способ по п.4, где указанная фармацевтически эффективная доза, введенная системно, включает количество пролекарства комбретастатина А4 фосфата в диапазоне от приблизительно 2 мг/м2 до приблизительно 90 мг/м2.
8. Способ по п.4, где указанная фармацевтически эффективная доза, введенная системно, включает количество пролекарства комбретастатина А4 фосфата в диапазоне от приблизительно 15 мг/м2 до приблизительно 50 мг/м2.
9. Способ по п.4, где указанная фармацевтически эффективная доза, введенная системно, включает приблизительно 27 мг/м2 свободной кислоты фосфата комбретастатина А4.
10. Способ по п.9, где указанную фармацевтически эффективную дозу вводят 1 раз/нед в течение 4 недель.
11. Способ улучшения остроты зрения у субъекта, страдающего патологической миопией, включающий введение дозы комбретастатина или его фосфатного пролекарства, пригодного для введения указанному субъекту.
12. Способ по п.11, где указанный комбретастатин или его фосфатное пролекарство представляет собой комбретастатин А4.
13. Способ по п.11, где указанный комбретастатин или его фосфатное пролекарство, представляет собой свободную кислоту фосфата комбретастатина А4.
14. Способ по п.13, где указанная доза находится в диапазоне от приблизительно 2 мг/м2 до приблизительно 90 мг/2.
15. Способ по п.13, где указанная доза находится в диапазоне от приблизительно 15 мг/м2 до приблизительно 50 мг/м2.
16. Способ по п.13, где указанная доза включает приблизительно 27 мг/м2.
17. Способ по п.16, где указанную фармацевтически эффективную дозу вводят 1 раз/нед в течение 4 недель.
18. Способ снижения истечения экссудата из поражения в глазу субъекта, имеющего патологическую миопию и идентифицированного как имеющего поражение, включающий введение дозы комбретастатина или его фосфатного пролекарства указанному субъекту.
19. Способ по п.18, где указанный комбретастатин или его фосфатное пролекарство представляет собой комбретастатин А4.
20. Способ по п.18, где указанный комбретастатин или его фосфатное пролекарство представляет собой свободную кислоту фосфата комбретастатина А4.
21. Способ по п.20, где указанная доза находится в диапазоне от приблизительно 2 мг/м2 до приблизительно 90 мг/м2.
22. Способ по п.20, где указанная доза находится в диапазоне от приблизительно 15 мг/м2 до приблизительно 50 мг/м2.
23. Способ по п.20, где указанная доза включает приблизительно 27 мг/м2.
24. Способ по п.23, где указанную фармацевтически эффективную дозу вводят 1 раз/нед в течение 4 недель.
25. Способ индукции регрессии пролиферации сосудистой сети в глазу субъекта, страдающего патологической миопией, включающий введение дозы комбретастатина или его фосфатного пролекарства указанному субъекту.
26. Способ по п.25, где указанный комбретастатин или его фосфатное пролекарство представляет собой комбретастатин А4.
27. Способ по п.26, где указанный комбретастатин или его фосфатное пролекарство представляет собой свободную кислоту фосфата комбретастатина А4.
28. Способ по п.27, где указанная доза находится в диапазоне от приблизительно 2 мг/м2 до приблизительно 90 мг/ м2.
29. Способ по п.27, где указанная доза находится в диапазоне от приблизительно 15 мг/м2 до приблизительно 50 мг/м2.
30. Способ по п.27, где указанная доза включает приблизительно 27 мг/м2.
31. Способ по п.30, где указанную фармацевтически эффективную дозу вводят 1 раз/нед в течение 4 недель.
32. Способ подавления роста пролиферирующей сосудистой сети в глазу субъекта, страдающего патологической миопией, включающий введение дозы комбретастатина или его фосфатного пролекарства указанному субъекту.
33. Способ по п.32, где указанный комбретастатин или его фосфатное пролекарство представляет собой комбретастатин А4.
34. Способ по п.33, где указанный комбретастатин или его фосфатное пролекарство представляет собой свободную кислоту комбретастатина А4 фосфата.
35. Способ по п.34, где указанная доза находится в диапазоне от приблизительно 2 мг/м2 до приблизительно 90 мг/м2.
36. Способ по п.34, где указанная доза находится в диапазоне от приблизительно 15 мг/м2 до приблизительно 50 мг/м2.
37. Способ по п.34, где указанная доза включает приблизительно 27 мг/м2.
38. Способ по п.37, где указанную фармацевтически эффективную дозу вводят 1 раз/нед в течение 4 недель.
39. Фармацевтическая композиция для лечения или предупреждения патологической миопии, включающая от приблизительно 15 мг/м2 до приблизительно 50 мг/м2 свободной кислоты фосфата комбретастатина А4 вместе с фармацевтически приемлемым носителем, наполнителем, разбавителем или адъювантом для системного введения нуждающемуся в ней пациенту.
40. Фармацевтическая композиция для лечения или предупреждения патологической миопии, включающая от приблизительно 15 мг/м2 до приблизительно 50 мг/м2 свободной кислоты фосфата комбретастатина А4 вместе с фармацевтически приемлемым носителем, наполнителем, разбавителем или адъювантом для несистемного введения нуждающемуся в ней пациенту.
| US 5504074, 02.04.1996 | |||
| Приспособление для непрерывной автоматической рехтовки пути | 1931 |
|
SU35865A1 |
| US 5561122 A, 01.10.1996 | |||
| AVILA MP et al., Natural history of choroidal neovascularization in degenerative myopia, Ophthalmology, 1984, vol | |||
| Огнетушитель | 0 |
|
SU91A1 |
Авторы
Даты
2009-06-27—Публикация
2004-12-03—Подача