Изобретение относится к области медицины и может быть использовано в трансплантологии для удаления патологических антител из крови.
Удаление антител из цельной крови пациента является перспективным методом для решения ряда медицинских проблем в трансплантологии, при лечении аутоиммунных заболеваний, а также осложнений, вызванных ошибками переливания крови или эритроцитов. В частности, пересадка аллотрансплантата требует тщательного подбора пары донор-реципиент не только по антигенам гистосовместимости, но и по антигенам крови системы АВ0, а при лечении синдрома Гийена-Барре удаление аутоантител позволяет предотвратить разрушение нервных окончаний.
Существуют различные способы решения проблемы удаления из крови патологических антител, специфические и неспецифические. К последним относится гемодиализ, когда вместе с патологическими антителами из крови тотально удаляются все белки. Промежуточным решением является удаление всех или большей части антител, включая патологические, с помощью аффинного сорбента с протеином А или G. Очевидным недостатком этих подходов, кроме высокой цены, является потеря пациентом важнейших для его здоровья белков, необходимость их замещения и, как следствие, риск заражения при частом применении препаратов крови.
Принципиально другим решением является специфическая сорбция антител на соответствующем сорбенте, представляющем собой антиген (гаптен), привязанный к твердой фазе. Применение такого сорбента позволяет удалять исключительно патологические антитела, оставляя в крови все остальные белки, в том числе нормальные антитела. Обычно, применяемые сейчас методики требуют предварительного разделения крови на плазму и клетки крови (плазмаферез), затем проведения процедуры сорбции на колонке с сорбентом и последующего воссоединения клеток с очищенной плазмой перед возвращением их пациенту; такие методики требуют дорогого оборудования и квалифицированного персонала на стадии плазмафереза. Если при применении обычных сорбентов не проводить плазмаферез, а пропускать через колонку неразделенную кровь, то из-за малого размера частиц и каналов между частицами происходят повреждение тромбоцитов и других клеток крови и проистекающие из этого осложнения. Кроме того, снижается кислородная емкость крови, общий уровень иммуноглобулинов и артериальное давление. Поэтому для гемосорбции используют модифицированные носители, например покрывают обычные частицы сорбента полупроницаемой мембраной [Chang Т.M.S. //Trans Am Soc Artif Intern Organs. 1980. V. XXVI, P.546-549]. Размер частиц традиционных носителей, таких как сефароза, агарозные гранулы, силикагель, около 5-20 мкм обеспечивает высокую сорбционную емкость и эффективность сорбционной колонки, однако приводит к созданию значительного гидравлического сопротивления и, как следствие, к повреждению клеток. Для преодоления этого препятствия нужны частицы значительно большего размера, не травмирующие клетки крови. Однако увеличение размера частиц сорбента приводит к уменьшению площади его поверхности и, как следствие, к резкому падению специфической емкости (способности сорбировать антитела).
Задачей изобретения является создание новых материалов, которые при миллиметровых размерах частиц сохраняли бы емкость традиционных сорбентов, то есть были пригодными для практической гемосорбции, когда объем колонки остается небольшим, а время сорбции сравнимо со временем проведения процедур плазмасорбции. Кроме того, материал матрицы-носителя должен быть нетоксичным и биосовместимым, антиген (гаптен) не должен выходить в кровоток и сорбироваться должны как антитела класса IgG, так и IgM.
Поставленная задача решается сорбентом для удаления антител из цельной крови, представляющим собой гидрогелевые микросферы, состоящие из солей альгиновой кислоты - нерастворимой в воде (альгината кальция) или растворимой (альгината натрия), и из гликоконъюгата (антигена). Все перечисленные компоненты заключены в полиэлектролитную альгинат-поликатионную мембрану.
В качестве поликатионного полимера сорбент может включать хитозан, или поли-L-лизин, или поли-L-аргинин, или поли-L-орнитин, или DEAE-декстран.
Антиген представляет собой высокомолекулярный водорастворимый конъюгат полимера с сахаридом. Обычно мольный % замещенных сахаридом мономерных звеньев полимера в конъюгате составляет 1-30% (предпочтительно 1-20%).
Полимер представляет собой полиакриламид, или полиакриловую кислоту, или их сополимер, или хитозан.
В качестве сахарида может быть использован олигосахарид группы крови А или В, или олигосахаридная часть ганглиозида или сульфатированного гликолипида, или опухолеассоциированный олигосахарид.
Раствор, содержащий альгинат натрия и антиген, с помощью специального устройства добавляют по каплям в раствор соли кальция, а полученные микросферы на основе альгината кальция выдерживают в растворе поликатионного полимера с целью образования дополнительной полиэлектролитной мембраны (состоящей из альгината и поликатиона) на поверхности этих микросфер. Размер микросфер лежит в диапазоне 0,2-1,2 мм.
Затем полученные микросферы могут быть обработаны комплексоном для ионов кальция, например этилендиаминтетраацетатом (ЭДТА), в результате чего получают микросферы, наполненные более жидким гелем.
Идея сорбента, позволяющего работать с цельной кровью, состоит в замене мелких частиц (обычный сорбент) на микросферы значительно большего размера. Микросферы имеют полупроницаемую мембрану, пропускающую белки молекулярной массы менее 1000 кДа, в том числе иммуноглобулины G и М; внутри микросферы находится растворимый конъюгированный антиген молекулярной массы более 1000 кДа. Микросферы сформированы таким образом, что антитела проходят через мембрану и внутри связываются с антигеном; в то же время антиген не может выйти из микросферы наружу. Таким образом, все антитела могут войти и выйти из микросфер, но только патологические антитела, связавшиеся внутри капсулы со «своим» антигеном, выводятся из кровотока. Традиционные сорбенты имеют высокоразвитую поверхность, на которой иммобилизуются антигены, что приводит к их высокой эффективности. В предложенном решении площадь поверхности на порядки ниже, а эффективность связывания антител достигается за счет объемного размещения антигена внутри микросферы в растворенном виде. Микросферы заполнены либо Са-альгинатным гидрогелем, либо альгиновой кислотой (когда ионы кальция удалены путем обработки микросфер комплексоном). В первом случае гидрогель приобретает более жесткую структуру.
Такое общее решение проблемы требовало решить ряд частных задач:
- Обеспечить полупроницаемость мембраны микросфер.
- Синтезировать такой антиген (в общем виде), который имел бы значительно большую массу (гидродинамический размер молекулы), чем иммуноглобулин М, но при этом оставался бы растворимым.
- Сформировать мембрану микросфер, имеющую проницаемость, достаточную для обеспечения диффузии антител внутрь, но в то же время достаточно механически прочную.
- Материал микросфер должен быть устойчив к действию компонентов крови, нетоксичен, не сорбировать компоненты крови неспецифически.
- Скорость процесса сорбции должна быть высокой.
- Сорбционная емкость микросфер должна быть высокой, чтобы минимизировать объем колонки, упакованной микросферами.
Данные частные задачи решались следующим образом.
Для получения микросфер использовали альгинат натрия и поликатионный полимер. Альгинат является наиболее широко применяемым полимером для включения различных биологических объектов. Альгинат - природный полисахарид, состоящий из нерегулярно чередующихся остатков β-D-маннуроновой и α-L-гулуроновой кислот, связанных 1-4 гликозидными связями. Носители на основе альгината обычно получают путем сшивки карбоксильных групп катионами Са2+. В данном изобретении для стабилизации Са-альгинатных микросфер в физиологических условиях и предотвращения выхода включенных в них гликоконъюгатов (антигенов) частицы покрывали мембраной из поликатионного полимера. В качестве такого полимера могут быть использованы, например, полилизин или полиаргинин, или другие, но наиболее предпочтительным является хитозан. Хитозан - это дезацетилированный хитин, состоящий из бета-1-4-связанных остатков 2-амино-2-дезокси-D-глюкопиранозы. Дополнительная роль поликатионного слоя заключается в регулировании проницаемости мембраны микросфер.
Размер микросфер (0,2-1,2 мм) можно варьировать, меняя различные параметры, такие как вязкость раствора альгината натрия, скорость его подачи, диаметр иглы, через которую раствор альгината по каплям добавляют в раствор хлорида кальция, и др.
Толщину мембраны регулируют, варьируя несколько параметров, а именно величину молекулярной массы хитозана, концентрацию хитозана и время формирования альгинат-хитозановой мембраны, величину рН раствора хитозана.
На фиг.1 представлена схема получения сорбента в виде микросфер.
На фиг.2 приведена фотография полученных микросфер.
На фиг.3 показана диаграмма распределения альгинат-хитозановых микросфер по размерам.
На фиг.4 показан график, характеризующий кинетику высвобождения флуоресцентно-меченного гликоконъюгата из альгинат-хитозановых микросфер.
На фиг.5 (А, Б) представлены диаграммы, иллюстрирующие сорбцию моноклональных IgM антител сахаридсодержащими микросферами и сефарозой (к которой привязан тот же углевод, для сравнения) после 1 часа (А) и 24 часов (Б) инкубации.
На фиг.6 показана экспериментальная установка для получения микросфер.
Способ изготовления сорбента описан ниже на примере использования хитозана. Аналогичным образом изготавливались микросферы с использованием других поликатионных полимеров, в том числе поли-L-лизина, или поли-L-аргинина, или поли-L-орнитина, или DEAE-декстрана.
Экспериментальная установка для приготовления Са-альгинатных микросфер представлена на фиг.6. Раствор, содержащий альгинат и гликоконъюгат, с помощью перистальтического насоса (0,28-3 мл/мин) подавали в прибор 1, снабженный иглой 2 (элементы крепления иглы 3, 4), где этот раствор распылялся потоком сжатого воздуха и в виде мелких капель попадал в раствор CaCl2.
Сформированные Са-альгинатные микросферы промывали 0,9% NaCl, переносили в раствор поликатиона (рН 4,5), инкубировали 5-30 минут при комнатной температуре и снова промывали 0,9% NaCl. Таким образом, получали альгинат-поликатионные микросферы (см. схему на фиг.1). Далее микросферы обрабатывали 0,1М раствором ЭДТА (комнатная температура, 10-30 мин). Приготовленные альгинат-хитозановые микросферы хранили в 0,9% NaCl при 4°С.
Размер микросфер контролировался концентрацией раствора альгината натрия, скоростью его подачи с помощью перистальтического насоса, давлением сжатого воздуха, диаметром иглы 2, расстоянием между поверхностью раствора CaCl2 и иглой 2. Были найдены оптимальные условия для получения Са-альгинатных микросфер правильной сферической формы: давление - 5 бар; объем раствора CaCl2 25 мл; скорость подачи полимерного раствора альгината 0,28 мл/мин; диаметр иглы 0,8 мм. Соотношение масс антигена и альгината в микросферах было в пределах от 1:40 до 1:2.
Увеличение скорости подачи полимерного раствора (выше 3 мл/мин) или уменьшение (ниже 0,28 мл/мин) приводит к деформации сферической формы микрочастиц и, как следствие, к потере антигена, что, в свою очередь, ведет к уменьшению антителосорбирующей способности. Поэтому была выбрана оптимальная скорость 0,28 мл/мин, а получаемый при этом размер составлял ~900 мкм. В указанных условиях получались микросферы правильной сферической формы.
Толщину мембраны (от 40 до 100 мкм) регулируют, варьируя несколько параметров, а именно величину молекулярной массы хитозана, концентрацию хитозана и время формирования альгинат-хитозановой мембраны, величину рН раствора хитозана. Для формирования устойчивой мембраны Са-альгинатные микросферы инкубируют в растворе поликатиона не менее 5 минут при рН 4,5.
Как видно из фиг.2, 3, полученные альгинат-хитозановые микросферы имеют правильную сферическую форму и узкое распределение по размерам.
Антиген вводится в систему на стадии приготовления смеси для формирования частиц, технически это реализуется добавлением его в раствор альгината.
Эффективность включения гликоконъюгата (антигена) в микросферы определяли с помощью его меченого варианта, а именно Atri-PAA-fluo, где Аtri - это трисахаридный антиген группы крови А, РАА - полиакриламид молекулярной массы около 2000 кДа, a fluo - остаток флуоресцеина. Степень включения Atri-PAA-fluo в альгинат-хитозановые микросферы составляла ~40% от исходного количества. После обработки альгинат-хитозановых микросфер раствором ЭДТА содержание в них Atri-PAA-fluo уменьшалось почти в два раза. Можно предположить, что удаление ионов кальция из полимерной мембраны приводило к увеличению ее проницаемости и, как следствие, к дополнительному выходу низкомолекулярных фракций гликоконъюгата из микросфер. Использованная методология позволяет удалять низкомолекулярную фракцию гликоконъюгата (которая всегда имеется даже в составе максимально высокомолекулярных полимеров) в процессе изготовления (промывки) микросфер, поэтому специального предварительного фракционирования гликоконъюгата не требуется.
На фиг.4 показана зависимость выхода Atri-PAA-fluo в супернатант (физ. раствор) из альгинат-хитозановых микросфер от времени. Видно, что даже после 16 дней хранения потери гликоконъюгата не превышали 3,5%.
Параллельно изучали сорбцию из раствора анти-Bdi и анти-Аtri антител микросферами, не содержащими антиген (контроль); сорбция в контроле (т.е. неспецифическое связывание антител с микросферами) составляла менее 5%.
Сорбционную емкость альгинат-поликатионных микросфер сравнили с наиболее часто используемым сегодня сорбентом-носителем сефарозой FF, к которой ковалентно привязан тот же антиген. Нагрузка Аtri в обоих случаях была одинаковой, а именно 0,6 ммоль/мл. Результаты представлены на фиг.5. Видно, что специфическая сорбция антител микросферами при малых величинах разведения антител протекает медленнее, чем в случае сефарозы. Однако спустя 24 часа в обоих случаях процесс выходит на плато.
Таким образом, полученные данные подтверждают возможность использования предлагаемого материала для сорбции антиуглеводных антител. Полученные микросферы по сорбционной емкости не уступают модифицированной сефарозе. Совместимость разработанного сорбента с цельной кровью была проверена на кроличьей крови, то есть кровь многократно пропускали через слой микросфер. При этом не наблюдалось ни повреждения клеток крови (гемолиза, тромбообразования), ни разрушения капсул компонентами крови. Оптимальный средний размер микросфер лежит в интервале 0,2-1,2 мм; микросферы большего размера медленно сорбируют антитела; микросферы меньшего размера могут травмировать клетки крови.
ПРИМЕРЫ
Материалы. Использовали следующие реагенты: хлорид натрия, хлорид кальция, альгинат натрия, ЭДТА, Tween 20 (Sigma, USA). Хитозан (MB 3,7 кДа) был получен химической деструкцией коммерческого высокомолекулярного хитозана. Синтетические гликоконъюгаты Bdi-РАА, Аtri-РАА, Atri-PAA-fluo (MB ~2000 кДа) были получены, как описано в [Shilova N.V., Galanina О.Е., Pochechueva Т.V., Chinarev A.A., Kadykov V.A., Tuzikov A.A. and Bovin N.V. // Glycoconjugate J. 2005. V.22. P.43-51]. Все растворы были приготовлены на 0,9% NaCl.
Пример 1. Для получения Са-альгинатных микросфер 4% раствор альгината натрия смешивают с раствором Bdi-PAA (2,5 мг/мл) в соотношении 1:1 (об.) и по каплям добавляют к 25 мл 2% раствора CaCl2. Экспериментальная установка для приготовления Са-альгинатных микросфер представлена на фиг.5. Раствор альгината, содержащий Bdi-PAA, с помощью перистальтического насоса подают в корпус прибора 1 (скорость подачи 0,28 мл/мин), снабженный иглой 2 (диаметр 0,8 мм), где распыляют потоком сжатого воздуха, и в виде мелких капель раствор альгината попадает в 2% раствор CaCl2. Сформированные Са-альгинатные микросферы промывают 3 раза 0,9% NaCl, переносят в 0,2% раствор хитозана (рН 4,5), инкубируют 5 минут при комнатной температуре и снова промывают 0,9% NaCl (см. схему на фиг.1). Приготовленные альгинат-хитозановые микросферы хранят в 0,9% NaCl при 4°С. В этих условиях средний размер полученных микросфер составлял 900 мкм, а средняя толщина мембраны - 40 мкм.
Пример 2. Микросферы готовят по примеру 1, но при этом для удаления ионов кальция микросферы обрабатывают в течение 30 мин 0,1 М раствором ЭДТА при комнатной температуре. Все дальнейшие операции делают, как в примере 1.
Пример 3. Микросферы готовят по примеру 1, но при этом для получения мембраны микросферы инкубируют в 0,2% растворе поли-L-лизина (рН 4,5) с молекулярной массой 15000-30000 Да, далее все делают, как в примере 1.
Пример 4. Микросферы готовят по примеру 1, но при этом для получения мембраны микросферы инкубируют в 0,2% растворе поли-L-аргинина (рН 4,5) с молекулярной массой 10000-40000 Да. Все дальнейшие операции делают, как в примере 1.
Пример 5. Микросферы готовят по примеру 1, но при этом для получения мембраны микросферы инкубируют в 0,2% растворе DEAE-декстрана (рН 4,5) с молекулярной массой ~6500 Да, далее все делают, как в примере 1.
Пример 6. Микросферы готовят по примеру 1, но при этом для получения мембраны микросферы инкубируют в 0,2% растворе поли-L-орнитина (рН 4,5) с молекулярной массой 15000-25000 Да. Все дальнейшие операции делают, как в примере 1.
В таблицах 1-4 приведены величины сорбции антител микросферами, полученными в различных условиях с использованием различных антигенов и полимеров. Процент (%) сорбировавшихся антител определяли как разность значений оптической плотности до и после инкубации раствора антител с микросферами.
Пример 7. Микросферы готовят по примеру 1, но при этом скорость подачи полимерного раствора составляет 3 мл/мин. Все дальнейшие операции делают, как в примере 1.
Пример 8. Микросферы готовят по примеру 1, но при этом скорость подачи полимерного раствора составляет 0,28 мл/мин. Все дальнейшие операции делают, как в примере 1.
Пример 9. Микросферы готовят по примеру 1, но при этом скорость подачи полимерного раствора составляет 0,7 мл/мин. Все дальнейшие операции делают, как в примере 1.
Пример 10. Смесь для приготовления микросфер готовят по примеру 1, но при этом антигеном (гликоконъюгатом) является Аtri-РАА и его количество в смеси 2,7 мг (Таблица 3). Все дальнейшие операции делают, как в примере 1.
Пример 11. Смесь для приготовления микросфер готовят по примеру 1, но при этом антигеном является Аtri-РАА и его количество в смеси 2,5 мг; варьируется количество альгината (Таблица 3). Все дальнейшие операции делают, как в примере 1.
Пример 12. Смесь для приготовления микросфер готовят по примеру 1, но при этом антигеном является Аtri-РАА и его количество в смеси 1 мг (Таблица 3).
Пример 13. Микросферы получают по примеру 1, инкубируя в 0,2% растворе хитозана (рН 4,5) в течение 10 минут (Таблица 4).
Пример 14. Микросферы получают по примеру 1, инкубируя в 0,2% растворе хитозана (рН 4,5) 30 минут (Таблица 4).
Пример 15. Характеристика альгинат-хитозановых микросфер
Размер микросфер и толщину их мембраны определяли с помощью светового микроскопа Биолам-П1 ("Ломо", Россия), имеющего окуляр с масштабной линейкой. Для лучшей визуализации мембраны использовали суспензию латексных частиц (диаметр 600 нм, Sigma, USA). Для этого суспензию латексных частиц добавляли в раствор альгината и получали Са-альгинатные микросферы с включенными в них латексными частицами, покрытые альгинат-поликатионовой мембраной, как описано выше. Для осаждения латексных частиц на внутреннюю поверхность мембраны микросферы инкубировали в 0,1 М растворе ЭДТА и далее центрифугировали (10000 об/мин, 10 мин).
Толщина мембраны микросфер, полученных после удаления кальция с помощью ЭДТА, составляет 40-100 мкм (фиг.5). Полученные микросферы обладают высокой механической прочностью (выдерживают центрифугирование в течение 10 мин при 10000 об/мин). При увеличении времени центрифугирования до 30 минут количество деформировавшихся микросфер составляет не более 5%.
Пример 16. Изучение эффективности включения гликоконъюгата
Эффективность включения гликоконъюгата в альгинат-поликатионовые микросферы определяли с помощью Аtri-РАА, меченного флуоресцентной меткой. Для этого Аtri-РАА-fluo смешивали с 4% раствором альгината в соотношении 1:1 (об.) и использовали для приготовления микросфер по методу, описанному выше. Степень включения Аtri-РАА-fluo определяли следующим образом: аликвоты приготовленных микросфер (50 мкл плотного осадка) растворяли в воде, добавляя в нее NaOH (pH 11,5) и измеряли флуоресценцию (485/535 нм), используя Perkin Elmer Instrument, Wallac 1420. Степень десорбции низкомолекулярных фракций Аtri-РАА-fluo из микрокапсул в процессе их хранения в 0,9% NaCl оценивали по величине флуоресценции супернатанта.
Пример 17. Изучение эффективности сорбции антител
Для изучения сорбции антител аликвоты микросфер и сефарозы (по 50 мкл плотного осадка) инкубировали с растворами антител в соотношении 1:10 (об.) в течение 1 или 24 часов. Процесс сорбции проводили при 24 и 37°С. В зависимости от типа включенного гликоконъюгата и класса сорбируемых антител для инкубации использовали поликлональные анти-Bdi (IgG+IgM) антитела (начальная концентрация 254 мкг/мл) или асцитную жидкость, содержащую моноклональные антитела класса IgM, в различных разведениях (Таблица 5).
Эффективность сорбции антител микросферами и сефарозным сорбентом определяли с помощью иммуноферментного анализа. Для адсорбции антигенов использовали 96-луночные планшеты (NUNC MaxiSorp, Дания). В каждую лунку вносили по 100 мкл гликоконъюгата (Вdi-РАА или Atri-РАА) с концентрацией 10 мкг/мл в 50 мМ карбонатном буфере при рН 9,6 и инкубировали в течение ночи при 4°С. Затем планшет промывали дистиллированной водой, добавляли в каждую лунку по 100 мкл 1% BSA/PBS, инкубировали 40 мин при 37°С и снова промывали три раза 0,05% Tween 20/PBS. Далее в лунки вносили по 200 мкл антител (после инкубации с микрокапсулами или с сефарозой, табл.2), делали серии двукратных разведений в 0,3% растворе BSA и инкубировали 1 час при 37°С. Далее планшет промывали 3 раза 0,05% раствором Tween 20/PBS и добавляли по 100 мкл на лунку anti-human Ig (IgM+IgG) HRP в разведении 1:8000 (при работе с человеческими антителами) или anti-mouse IgM-biotin в разведении 1:1000 и затем streptavidin-HRP в разведении 1:8000 с последующей инкубацией в течение 1 часа при 37°С (при работе с мышиными антителами). После трехкратной промывки 0,05% раствором Tween 20/PBS в лунки вносили по 100 мкл о-фенилендиамина (0,4 мг/мл) в фосфат-цитратном буфере, содержащем 4 мкл 30% Н2O2. Спустя 30 минут реакцию останавливали добавлением 50 мкл 1М H2SO4. Результаты оценивали с помощью ридера (Perkin Elmer Instrument, Wallac 1420) при 492 нм.
Аналогично было проведено удаление антител из сыворотки крови микросферами: 1) с включенными в них конъюгатами полиакриловой кислоты; 2) с включенными в них конъюгатами сополимера полиакриламида и полиакриловой кислоты; 3) с включенным в них конъюгатом трисахарида Neu5Acα2-3Galβ1-4Glc (углеводная часть ганглиозида GM3); 4) с включенным в них сульфатированным олигосахаридом 3-HSO3-OGal,; 5) с включенным в них опухолеассоциированным тетрасахаридом Tk.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ ДЛЯ ДОСТАВКИ ДНК В МАКРООРГАНИЗМ | 2009 |
|
RU2409384C1 |
| СПОСОБ ДОСТАВКИ ДНК В МАКРООРГАНИЗМ ДЛЯ РАЗРАБОТКИ ВАКЦИН И СОМАТИЧЕСКОЙ ГЕННОЙ ТЕРАПИИ | 2006 |
|
RU2336090C2 |
| МИКРОКАПСУЛЬНЫЙ ПРЕПАРАТ НА ОСНОВЕ АЛЬГИНАТА-АЦИЛЬНЫХ ПРОИЗВОДНЫХ ХИТОЗАНА, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2011 |
|
RU2542509C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСОРБЕНТА ДЛЯ СВЯЗЫВАНИЯ ГРУППОСПЕЦИФИЧЕСКИХ АНТИТЕЛ α- И β- -АГГЛЮТИНИНОВ | 1988 |
|
RU2040274C1 |
| 3-Аминопропилгликозиды дисахаридов в качестве лигандов иммуносорбентов для связывания группоспецифических антител анти-А и анти-В | 1988 |
|
SU1616924A1 |
| ЭНТЕРОСОРБЕНТ ДЛЯ НАПРАВЛЕННОЙ СОРБЦИИ ХОЛЕРНОГО ЭКЗОТОКСИНА, ЛЕКАРСТВЕННАЯ ФОРМА ЭНТЕРОСОРБЕНТА ДЛЯ НАПРАВЛЕННОЙ СОРБЦИИ ХОЛЕРНОГО ЭКЗОТОКСИНА | 2015 |
|
RU2611356C2 |
| МЕДИЦИНСКАЯ МНОГОСЛОЙНАЯ ПОВЯЗКА С МНОГОФУНКЦИОНАЛЬНЫМИ НАНОМЕМБРАНАМИ И ИЗДЕЛИЯ НА ЕЕ ОСНОВЕ | 2014 |
|
RU2578458C2 |
| Гемостатическое средство | 2023 |
|
RU2826361C1 |
| СПОСОБ ГЛИКОКОНЪЮГАЦИИ | 2013 |
|
RU2672053C2 |
| СПОСОБ ОХЛАЖДЕНИЯ И КОНСЕРВИРОВАНИЯ РЫБЫ И МОРЕПРОДУКТОВ | 2016 |
|
RU2650532C2 |
Изобретение относится к области медицины и может быть использовано в трансплантологии для удаления патологических тел из крови. Сорбент для удаления антител из цельной крови включает микросферы размером 0,2-1,2 мм, состоящие из антигена и альгиновой кислоты или альгината кальция, заключенных в полупроницаемую мембрану из поликатионного полимера, пропускающую белки молекулярной массы менее 1000 кДа. В качестве поликатионного полимера сорбент может включать хитозан, или поли-L-лизин, или поли-L-аргинин. При этом антиген представляет собой высокомолекулярный водорастворимый конъюгат полимера с сахаридом. Полимер представляет собой полиакриламид, или полиакриловую кислоту, или их сополимер, или хитозан. Кроме того, сахарид может представлять собой олигосахарид группы крови А или В, или олигосахаридную часть ганглиозида или сульфатированного гликолипида, или опухолеассоциированный олигосахарид. Для осуществления способа получения сорбента инжектируют капли раствора альгината натрия и антигена в раствор соли кальция и полученный материал выдерживают в растворе поликатионного полимера с образованием микросфер, которые затем могут быть обработаны комплексоном для удаления ионов кальция, например этилендиаминтетраацетатом (ЭДТА). 2 н. и 8 з.п. ф-лы, 6 ил., 5 табл.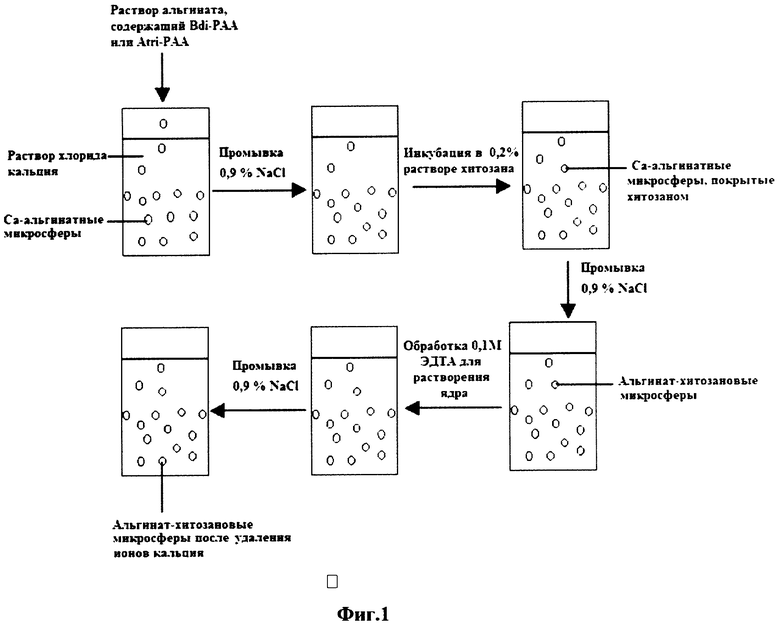
1. Сорбент для удаления антиуглеводных антител из цельной крови, включающий микросферы размером 0,2-1,2 мм, состоящие из антигена и альгиновой кислоты или альгината кальция, заключенных в полупроницаемую мембрану из поликатионного полимера, пропускающую белки молекулярной массы менее 1000 кДа, где антиген представляет собой высокомолекулярный водорастворимый конъюгат полимера с сахаридом.
2. Сорбент по п.1, отличающийся тем, что в качестве поликатионного полимера он включает хитозан, или поли-L-лизин, или поли-L-аргинин, или поли-L-орнитин, или DEAE-декстран.
3. Сорбент по п.1, отличающийся тем, что полимер представляет собой полиакриламид, или полиакриловую кислоту, или их сополимер, или хитозан.
4. Сорбент по п.1, отличающийся тем, что сахарид представляет собой олигосахарид группы крови А или В, или олигосахаридную часть ганглиозида или сульфатированного олигосахарида, или опухолеассоциированный олигосахарид.
5. Способ получения сорбента для удаления антиуглеводных антител из цельной крови, заключающийся в том, что капли раствора альгината натрия и антигена инжектируют в раствор соли кальция, а сформированные Са-альгинатные микросферы выдерживают в растворе поликатионного полимера с получением микросфер размером 0,2-1,2 мм, покрытых полупроницаемой альгинат-поликатионной мембраной, пропускающей белки с молекулярной массой менее 1000 кДа.
6. Способ по п.5, отличающийся тем, что полученные микросферы обрабатывают комплексоном для удаления ионов кальция, например этилендиаминтетраацетатом.
7. Способ по п.6, отличающийся тем, что в качестве поликатионного полимера используют хитозан, или поли-L-лизин, или поли-L-аргинин, или поли-L-орнитин, или DEAE-декстран.
8. Способ по п.5, отличающийся тем, что в качестве антигена используют высокомолекулярный водорастворимый конъюгат полимера с сахаридом.
9. Способ по п.8, отличающийся тем, что в качестве полимера используют полиакриламид, или полиакриловую кислоту, или их сополимер, или хитозан.
10. Способ по п.8, отличающийся тем, что в качестве сахарида используют олигосахарид группы крови А или В, или олигосахаридную часть ганглиозида или сульфатированного олигосахарида, или опухолеассоциированный олигосахарид.
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСОРБЕНТА ДЛЯ СВЯЗЫВАНИЯ ГРУППОСПЕЦИФИЧЕСКИХ АНТИТЕЛ α- И β- -АГГЛЮТИНИНОВ | 1988 |
|
RU2040274C1 |
| RU 94042052 A1, 20.09.1996 | |||
| СПОСОБ СОРБЦИИ ИММУННОЙ СЫВОРОТКИ КРОВИ | 2000 |
|
RU2200324C2 |
| DE 4228395 A1, 03.03.1994 | |||
| US 7294591 B2, 13.11.2007. | |||
Авторы
Даты
2009-07-10—Публикация
2008-03-04—Подача