Изобретение относится к медицине, а именно к хирургии и интенсивной терапии, и может быть использовано для раннего прогнозирования развития тромбоэмболических осложнений.
Несмотря на значительные достижения в хирургии, профилактика тромбоэмболических осложнений (ТЭО) остается одной из наиболее актуальных и сложных проблем. Об этом свидетельствует тот факт, что ТЭО являются главной причиной заболеваемости и смертности в развитых странах [5, 6]. В Европе частота тромбоза глубоких вен составляет 160 на 100000 населения. В Англии 0,9% всех госпитализированных умирают от тромбоэмболии легочной артерии. Во Франции с населением в 55 млн. ежегодно отмечается 150000 новых случаев тромбоза глубоких вен. Тромбоэмболия легочной артерии наблюдается в 80000 случаев, при этом 20000 пациентов умирает. В США с населением более 200 млн. ежегодно диагностируется 600000 тромбоэмболии легочной артерии, при этом погибает 200000 больных [4].
Внимание многих исследователей отдается вопросам прогнозирования развития тромбоэмболических осложнений в ранние сроки после оперативного вмешательства. При этом отсутствуют объективные критерии прогнозирования развития ТЭО после хирургического вмешательства.
Известен способ прогнозирования срока возможного возникновения тромбоэмболии легочной артерии после операции, основанный на определении гемокоагуляционного потенциала [9]. Анализируют показатели системы свертывания крови, объема кровопотери и инфузионной терапии. С помощью формулы определяют время (Т) возможного начала развития тромбоэмболии легочной артерии (в часах).
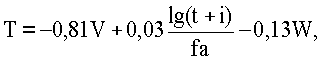 где Т - время возможного образования тромбоэмболии легочной артерии, ч; V - объем инфузионной терапии, мл; W - объем операционной кровопотери, мл; t - время рекальцификации плазмы, мин; i - протромбиновый индекс; f - количество фибриногена, мг/л; а - возраст больного, год.
где Т - время возможного образования тромбоэмболии легочной артерии, ч; V - объем инфузионной терапии, мл; W - объем операционной кровопотери, мл; t - время рекальцификации плазмы, мин; i - протромбиновый индекс; f - количество фибриногена, мг/л; а - возраст больного, год.
Однако данный способ является недостаточно точным, так как не учитывает функциональную состоятельность сосудистого русла и не позволяет четко выделить группу пациентов, подлежащих своевременной профилактике, направленной на раннее улучшение тканевой перфузии.
Известен способ прогнозирования микроциркуляторных и гемореологических нарушений при доброкачественных опухолях в ранний послеоперационный период [8]. Данный метод включает в себя забор крови из общего кровотока и анализ показателей крови из сосудов дна матки. Определяют вязкость крови из сосудов дна матки, сравнивают ее с вязкостью крови из общего кровотока и с нормальным показателем вязкости при заданной скорости течения крови. При повышении вязкости из сосудов матки и общего кровотока по сравнению с нормой прогнозируют угрозу тромбоэмболических осложнений, а при уменьшении значений вязкости крови из сосудов матки и общего кровотока по сравнению с нормой - возможность возникновения геморрагических состояний.
Однако данный метод определяет только физические свойства крови (вязкость). Он является менее точным, так как направлен на изучение только одного фактора и не учитывает состояние микроциркуляторного русла.
Известен способ прогнозирования тромбоэмболических осложнений при эндопротезировании крупных суставов нижних конечностей №2272560 [7]. С помощью данного метода определяют уровень микроциркуляторного кровотока в динамике до операции и в раннем послеоперационном периоде. При повышении уровня фонового микроциркуляторного кровотока в послеоперационном периоде в проекции сосудистого пучка паховой области более 120% от дооперационного уровня, при снижении уровня фонового микроциркуляторного кровотока в средней трети бедра и средней трети голени более 20% от дооперационного уровня, при снижении уровня фонового микроциркуляторного кровотока на первом пальце стопы более 10% от дооперационного уровня; при снижении микроциркуляторного кровотока на оперируемой конечности в послеоперационном периоде при проведении пробы с задержкой дыхания более 60% от дооперационного уровня; отсутствие снижения максимального кровотока на оперируемой конечности в послеоперационном периоде при проведении постокклюзионной пробы, при уровне максимального кровотока после окклюзии ниже 6 мл/мин/100 г при постокклюзионной пробе, при достижении максимального кровотока после окклюзии на второй минуте, времени достижения максимального кровотока более 45 с в до- и послеоперационном периодах, при среднем приросте максимального кровотока менее 0,5 в до- и послеоперационном периодах, при снижении времени полувосстановления в послеоперационном периоде более 15% по сравнению с дооперационным уровнем - прогнозируют развитие тромбоэмболических осложнений.
Данный способ основан на исследовании состояния кровенаполнения сосудистого русла. Он является недостаточно точным, так как не учитывает состояние свертывающей системы крови.
Известен способ прогнозирования тромбоэмболических осложнений, основанный на определении показателя Международного нормализованного отношения (MHO), взятый в качестве прототипа. Он является дополнительным способом представления результатов протромбинового теста, рекомендованным комитетом экспертов ВОЗ, Международным комитетом по изучению тромбозов и гемостаза и Международным комитетом по стандартизации в гематологии. MHO рассчитывается по формуле: INR (MHO)=(Протромбиновое время пациента/Нормальное среднее протромбиновое время)isi, где ISI (International Sensitivity Index of thromboplastin), он же МИЧ (Международный индекс чувствительности) - показатель чувствительности тромбопластина к снижению концентрации факторов протромбинового комплекса относительно международного стандарта тромбопластина. В норме Международное нормализованное отношение равно 1. Снижение MHO говорит о состоянии гиперкоагуляции и расценивается как риск тромбообразования [1].
Данный способ основан на исследовании состояния свертывающей системы крови. Он является недостаточно точным, так как рассматривает только один фактор и не учитывает состояния микроциркуляторного русла.
Для повышения точности прогнозирования тромбоэмболических осложнений, после операций на органах брюшной полости, определяют Международное нормализованное отношение, амплитуду колебаний миогенного, нейрогенного и дыхательного компонентов колебаний кровотока на передней поверхности средней трети голени (с помощью метода лазерной доплеровской флоуметрии). Затем рассчитывают коэффициент Т по формуле: T=(MHOp/MHOd)×((AmaxN×AmaxM/AmaxD)p/(AmaxN×АmaxМ/AmaxD)d), где MHO - Международное нормализованное отношение, AmaxN - максимальная амплитуда нейрогенного компонента, АmaxМ - максимальная амплитуда миогенного компонента, AmaxD - максимальная амплитуда дыхательного компонента, р - указывает на значения после операции, d - на показатели до оперативного вмешательства. При значении Т<0,40 прогнозируют развитие тромбоэмболических осложнений.
Способ осуществляют следующим образом. Для определения MHO, до операции и на первые сутки после оперативного вмешательства, образцы крови получают путем пункции локтевой вены иглой d 0,9 мм с минимальной компрессией в полиэтиленовую центрифужную пробирку со стабилизатором 3,8% раствором основного цитрата натрия, в соотношении 9 частей крови и одной части раствора. Стабилизированную венозную кровь центрифугируют 15 минут при 3000 об/мин. Полученную после центрифугирования плазму исследуют коагулогическим методом с определением протромбинового времени [3]. MHO вычисляют по стандартной формуле: MHO=(Протромбиновое время пациента/Нормальное среднее протромбиновое время)МИЧ.
До операции и на первые сутки после оперативного вмешательства проводят лазерное доплеровское флоуметрическое исследование кровотока. Больному в горизонтальном положении лежа на спине на переднюю поверхность в средней трети голени устанавливают датчик компьютеризированного лазерного анализатора микроциркуляции крови (например, ЛАКК-02, НПП «Лазма», Россия), в течение 7 минут регистрируют ритмы колебаний кровотока в микроциркуляторном русле и после вейвлет-преобразования осцилляции на персональном компьютере получают параметры амплитудно-частотного спектра и тонуса сосудов (максимальные амплитуды нейрогенного, миогенного и дыхательного компонентов).
Место установки датчика для проведения лазерной доплеровской флоуметрии на передней поверхности средней трети голени объясняется тем, что именно в этой области чаще всего происходит венозный застой. Уменьшение амплитуды колебаний нейрогенного и миогенного компонентов связано со спазмом микрососудов и ухудшением тканевой перфузии, а увеличение амплитуды дыхательного компонента отражает застойные изменения в венозном русле [2]. Метод позволяет учитывать в комплексе как исходное состояние микрокровотока, так и его изменение в послеоперационном периоде.
Исследования проводят больным в первые сутки после оперативного вмешательства на органах брюшной полости, когда необходимо решить вопрос о прогнозе развития тромбоэмболических осложнений. При Т<0,40 наблюдалось развитие тромбообразования. По нашему мнению, использование предлагаемого способа прогнозирования позволяет выделить группу больных, которым требуется раннее проведение профилактики тромбоэмболических осложнений в послеоперационном периоде, направленной на улучшение микрокровотока.
Способ использован при лечении 40 пациентов с различной хирургической патологией, подвергшихся оперативному вмешательству на органах брюшной полости.
Клинические примеры.
Больная С-а, 52 лет, история болезни №8444, поступила в первое хирургическое отделение городской клинической больницы №1 г.Читы 15.12.2006 с диагнозом: Желчно-каменная болезнь. Хронический калькулезный холецистит, стадия обострения. До операции исследованы показатели: MHO (=1), максимальные амплитуды нейрогенного (=0,28 пф.ед), миогенного (=0,20 пф.ед) и дыхательного компонентов (=0,07 пф.ед). Проведена лапароскопическая холецистэктомия. В первые сутки после оперативного вмешательства определены показатели MHO (=0,78), максимальные амплитуды нейрогенного (=0,22 пф.ед), миогенного (=0,16 пф.ед) и дыхательного компонентов (=0,10 пф.ед), рассчитан коэффициент Т (Т=0,34). Таким образом, у пациентки есть риск развития тромбоэмболических осложнений. Больной проведена профилактика тромбоэмболических осложнений (введение фраксипарина 0,3 × 2 раза в день, лечебная физическая культура, эластическое бинтование нижних конечностей, инфузия дезагрегантов). Пациентка выписана в удовлетворительном состоянии.
Больная К-а, 44 лет, история болезни №3500, поступила в первое хирургическое отделение городской клинической больницы №1 г.Читы 01.06.2007 с диагнозом: Желчно-каменная болезнь. Хронический калькулезный холецистит, стадия обострения. До операции исследованы показатели: MHO (=1), максимальные амплитуды нейрогенного (=0,32 пф.ед), миогенного (=0,24 пф.ед) и дыхательного компонентов (=0,10 пф.ед). Проведена лапароскопическая холецистэктомия. В первые сутки после оперативного вмешательства определены показатели MHO (=0,89), максимальные амплитуды нейрогенного (=0,27 пф.ед), миогенного (=0,18 пф.ед) и дыхательного компонентов (=0,12 пф.ед), рассчитан коэффициент Т (Т=0,47). Пациентке не требовалась профилактика тромбоэмболических осложнений. Выписана в удовлетворительном состоянии.
Больная К-а, 47 лет, история болезни №7822, поступила в первое хирургическое отделение городской клинической больницы №1 г.Читы 18.12.2006 с диагнозом: Острый панкреатит. До операции исследованы показатели: MHO (=1,11), максимальные амплитуды нейрогенного (=0,30 пф.ед), миогенного (=0,26 пф.ед) и дыхательного компонентов (=0,12 пф.ед). Сделана операция: Лапаротомия, ревизия, холецистостомия, санация, дренирование брюшной полости и забрюшинного пространства. В первые сутки после оперативного вмешательства определены показатели MHO (=0,89), максимальные амплитуды нейрогенного (=0,21 пф.ед), миогенного (=0,20 пф.ед) и дыхательного компонентов (=0,16 пф.ед), рассчитан коэффициент Т (Т=0,32). Несмотря на проводимую профилактику тромбоэмболических осложнений у больной развилась тромбоэмболия легочной артерии (на вскрытии тромбоэмболия мелких ветвей легочной артерии).
Литература
1. Гаранина Е.Н. Стандартизация и контроль качества исследования протромбинового времени / Е.Н.Гаранина, Н.А.Авдеева // Клиническая и лабораторная диагностика. - 1994. - №6. - С.23-25.
2. Крупаткин А.И. Лазерная доплеровская флоуметрия микроциркуляции крови / Крупаткин А.И., Сидоров В.В. - М.: Медицина; 2005. - 256 с.
3. Лабораторные методы исследования гемостаза / В.П.Балуда, З.С.Баркаган, Е.Д.Гольдберг, Б.И.Кузник и др. - Томск, 1980. - 314 с.
4. Саенко В.Ф. Профилактика тромбоэмболических осложнений в хирургии: Метод, рекомендации / Украинский центр научной медицинской информации и патентно-лицензионной работы. - Киев, 1997. - 16 с.
5. Стрекаловский В.П. Профилактика тромбоэмболических осложнений при лапароскопической холецистэктомии/В.П.Стрекаловский, Ю.Г.Старков, К.В.Шишин // Хирургия. Журнал им. Н.И.Пирогова. - 2004. - №2. - С.48-52.
6. Шулутко A.M. Анализ факторов тромбоопасности у стариков при лапароскопической и открытой холецистэктомии / Шулутко A.M., Лащик М.Г., Данилов А.И. // Эндоскопическая хирургия. - 2002. - №4. - С.11-13.
7. Патент №2272560. Способ прогнозирования тромбоэмболических осложнений при эндопротезировании крупных суставов нижних конечностей / Прохоренко В.М.
8. Заявка на изобретение №96120749 от 21.10.1996. Способ прогнозирования микроциркуляторных и гемореологических нарушений при доброкачественных опухолях в ранний послеоперационный период / Коптилова Е.Н.
9. Заявка на изобретение №2004138349 от 27.12.2004. Способ прогнозирования тромбоэмболии легочной артерии после операции / Клочков Н.Д.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ ПРИ ПЕРЕЛОМАХ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ | 2010 |
|
RU2432573C1 |
| Способ прогнозирования тромбоэмболических послеоперационных осложнений | 2020 |
|
RU2732246C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ РАНЕВОЙ ИНФЕКЦИИ В РАННЕМ ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ В АБДОМИНАЛЬНОЙ ХИРУРГИИ | 2024 |
|
RU2831806C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ ПРИ ОПЕРАЦИЯХ НА ЗАБРЮШИННОМ ПРОСТРАНСТВЕ С ИСПОЛЬЗОВАНИЕМ РЕТРОПНЕВМОПЕРИТОНЕУМА | 2022 |
|
RU2800316C1 |
| СПОСОБ КЛАССИФИКАЦИИ ПЕРЕЛОМОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ | 2010 |
|
RU2438564C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ | 2016 |
|
RU2621298C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАРУШЕНИЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ ПРИ ПЕРЕЛОМАХ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ | 2010 |
|
RU2436097C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ТРОМБОТИЧЕСКИХ ОСЛОЖНЕНИЙ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ ПОСЛЕ ВЫПОЛНЕНИЯ ТРАНСЪЮГУЛЯРНОГО ВНУТРИПЕЧЕНОЧНОГО ПОРТОСИСТЕМНОГО ШУНТИРОВАНИЯ | 2019 |
|
RU2717210C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ С ЗАБОЛЕВАНИЯМИ ЛЕГКИХ | 2014 |
|
RU2552309C1 |
| Способ прогнозирования развития тромбоэмболических осложнений у пациентов с политравмой | 2018 |
|
RU2699050C1 |
Изобретение относится к медицине, а именно к хирургии и интенсивной терапии, и может быть использовано для раннего прогнозирования тромбоэмболических осложнений после операций на органах брюшной полости. Проводят исследование свертывающей системы крови с помощью определения Международного нормализованного отношения (MHO) и исследование кровотока. Проводят исследование методом лазерной доплеровской флоуметрии на передней поверхности в средней трети голени, с помощью которого определяют максимальную амплитуду колебаний миогенного, нейрогенного и дыхательного компонентов. Рассчитывают показатель Т по формуле с учетом значений MHO и максимальных амплитуд вышеуказанных компонентов, полученных до и после оперативного вмешательства. При значении Т<0,40 прогнозируют развитие тромбоэмболических осложнений. Способ позволяет прогнозировать развитие тромбоэмболических осложнений после операций на органах брюшной полости и выделить группу больных, которым требуется раннее проведение профилактики тромбоэмболических осложнений в послеоперационном периоде, направленной на улучшение микрокровотока.
Способ раннего прогнозирования развития тромбоэмболических осложнений после операций на органах брюшной полости, включающий определение Международного нормализованного отношения, отличающийся тем, что дополнительно проводят инструментальное исследование кровотока на передней поверхности в средней трети голени с помощью лазерной допплеровской флоуметрии, регистрируют показатели максимальных амплитуд нейрогенного, миогенного и дыхательного компонентов, рассчитывают коэффициент Т по формуле:
T=(MHOp/MHOd)·((AmaxN·AmaxM/AmaxD)p/(AmaxN·AmaxM/AmaxD)d),
где MHOp - Международное нормализованное отношение после операции;
AmaxNp - максимальная амплитуда нейрогенного компонента после операции;
AmaxMp - максимальная амплитуда миогенного компонента после операции;
AmaxDp - максимальная амплитуда дыхательного компонента после операции;
MHOd - Международное нормализованное отношение до операции;
AmaxNd - максимальная амплитуда нейрогенного компонента до операции;
AmaxMd - максимальная амплитуда миогенного компонента до операции;
AmaxDd - максимальная амплитуда дыхательного компонента до операции,
и при значении коэффициента Т<0,40 прогнозируют развитие тромбоэмболических осложнений.
| СПОСОБ ДИАГНОСТИКИ НЕЙРОЦИРКУЛЯТОРНОЙ АСТЕНИИ | 2003 |
|
RU2253368C2 |
| СПОСОБ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ ХРОНИЧЕСКОЙ ГИПОКСИИ ПЛОДА | 1998 |
|
RU2131126C1 |
| БАРКАГАН З.C | |||
| и др | |||
| Методики, реагенты и интерпретация теста «Протромбиновое время», научное общество «Клиническая гемостазиология», добавлено 10.02.2008 [он лайн] [найдено 22.10.2008] найдено из Интернет http://www.hemostas.ru/public/p11.htm | |||
| КРУПАТКИН А.И | |||
| и др | |||
| Лазерная | |||
Авторы
Даты
2009-09-20—Публикация
2008-03-04—Подача