ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в общем относится к области профилактики и терапии злокачественных опухолей. В частности, предлагаются изолированные белки, регулирующие апоптоз, или их пептидные фрагменты, которые способны вызывать иммунные ответы против злокачественной опухоли. В частности, предлагается применение таких белков, относящихся к семейству белков Bcl-2, и их иммуногенных пептидных фрагментов при лечении, диагностике и прогнозировании злокачественных опухолей.
УРОВЕНЬ ТЕХНИКИ
Развитие резистентности злокачественных клеток к широкому множеству химиотерапевтических средств является основным препятствием для успешного лечения злокачественной опухоли. Лекарственная резистентность наблюдается в широком диапазоне типов злокачественных клеток. Многие механизмы вносят вклад в лекарственную резистентность, включая инактивацию лекарственных средств, вытеснение лекарственного средства наносами клеточной мембраны, мутации в мишенях лекарственных средств и неспособность инициировать апоптоз. Предотвращение апоптоза может возникать в результате множества условий, включая удерживание потенциала митохондриальной мембраны и цитокинную стимуляцию.
Поиск белков, ответственных за резистентные к лекарственным средствам фенотипы, показал участие противоапоптозной молекулы Bcl-2. Сверхэкспрессия Bcl-2 играет роль в развитии лекарственной резистентности при лейкозе и других подверженных апоптозу опухолях и, следовательно, в плохом прогнозе при различных злокачественных опухолях человека. Bcl-2 относится к семейству белков, семейству Bcl-2, представители которого регулируют апоптоз. В семейство входят как проапоптозные, так и противоапоптозные представители. Хотя точное понимание того, каким образом Bcl-2 оказывает свое противоапоптозное влияние, остается труднодостижимым, обнаружено, что он экспрессируется во многих злокачественных опухолях, включая рак легкого, ободочной и прямой кишки, простаты и молочной железы, а также лейкозы и лимфомы.
Таким образом, Bcl-2 является решающим клеточным фактором, так как повышенные уровни экспрессии данного белка придают резистентность к апоптозным стимулам, тем самым внося вклад в патогенез и прогрессирование злокачественной опухоли.
Способ, благодаря которому иммунная система млекопитающих узнает и взаимодействует с чужеродными или посторонними веществами, является сложным. Важным аспектом системы является T-клеточный ответ. Указанный ответ требует, чтобы T-клетки узнавали и взаимодействовали с комплексами молекул клеточной поверхности, называемых лейкоцитарными антигенами человека (HLA), составляющими главный комплекс гистосовместимости человека (MHC), и пептидов. Пептиды происходят из более крупных молекул, которые процессируются клетками, которые, в свою очередь, представляют молекулу HLA/MHC. Взаимодействие T-клеток и комплексов HLA/пептид ограничено, при этом требуется T-клетка, которая специфична по отношению к конкретной комбинации молекулы HLA и пептида. Если специфичная T-клетка не присутствует, то T-клеточный ответ отсутствует, даже если имеется комплекс партнеров. Подобным образом, ответа нет, если отсутствует конкретный комплекс, а T-клетка присутствует.
Механизм, посредством которого T-клетки узнают клеточные аномалии, также вовлечен в развитие злокачественной опухоли. Например, в W092/20356 описано семейство генов, которые процессируются в пептиды, которые, в свою очередь, экспрессируются на клеточных поверхностях и могут приводить к лизису опухолевых клеток специфическими CTL. Указанные гены названы семейством MAGE и кодируют так называемые «предшественники антигенов отторжения опухоли», или молекулы «TRAP», и полученные из них пептиды называют «антигенами отторжения опухоли», или «TRA».
В WO 94/05304 описаны нонапептиды, которые связываются с молекулой HLA-A1. В указанной работе обнаружено, что учитывая известную специфичность конкретных пептидов по отношению к конкретным молекулам HLA, следует предполагать, что конкретный пептид связывает одну молекулу HLA, но не связывает другие. Это имеет важное значение, так как разные люди имеют разные HLA-фенотипы. В результате, несмотря на то, что идентификация конкретного пептида как партнера для конкретной молекулы HLA имеет диагностическое и терапевтическое направления, они уместны только для людей с данным конкретным фенотипом HLA.
Таким образом, хорошо установлено, что пептидные эпитопы, происходящие из ассоциированных с опухолями антигенов (TAA), могут узнаваться в качестве антигенов цитотоксическими T-лимфоцитами (CTL) в контексте молекул MHC. Однако хотя общепринято, что большинство, если не все опухоли являются антигенными, только немногие действительно являются иммуногенными в том смысле, что прогрессирование опухоли легко контролируется иммунной системой.
Чтобы преодолеть указанное ограничение, начато несколько иммунотерапевтических исследований, например вакцинации полученными из TAA пептидами. В случае миеломы, опухоли, для которой охарактеризовано наибольшее количество определяемых CTL TAA, сильные CTL-ответы против антигенов были индуцированы вакцинацией, и у некоторых пациентов имела место полная ремиссия заболевания. Однако большинство пептидных эпитопов, используемых в указанных испытаниях вакцинации, являются специфичными для меланоцитов, и указанные пептиды не могут быть применены в случае опухолей немеланоцитного происхождения. Кроме того, экспрессия указанных TAA гетерогенна в разных опухолях от разных пациентов и может варьироваться даже среди метастазов, полученных от одного пациента. Однако в последнюю пару лет идентифицирован ряд специфичных для опухолей пептидных антигенов, которые экспрессируются в нескольких разных злокачественных опухолях, т.е. HER-2, Muc-1 и теломераза.
Апоптоз представляет собой генетическую программу самоубийства клеток, и было выдвинуто предположение, что ингибирование апоптоза является важным механизмом, вовлеченным в образование злокачественной опухоли посредством удлинения продолжительности жизни клеток, способствующего накоплению трансформирующих мутаций. Сурвивин является недавно идентифицированным представителем семейства ингибиторов апоптозных белков (IAP). При общем анализе экспрессии генов, охватывающем примерно 4 миллиона транскриптов, сурвивин идентифицирован как один из основных генов, неизменно подвергаемых повышающей регуляции во многих типах злокачественной опухоли, но не в нормальной ткани. Солидные злокачественные образования, сверхэкспрессирующие сурвивин, включают рак легкого, ободочной кишки, молочной железы, поджелудочной железы и простаты, а также гематопоэтические злокачественные образования. Кроме того, сообщалось, что ряд меланомных и немеланомных злокачественных опухолей кожи неизменно являются сурвивин-положительными. Сверхэкспрессия сурвивина в большинстве злокачественных опухолей человека свидетельствует о главной роли ингибирования апоптоза в прогрессировании опухоли, эта точка зрения подтверждается наблюдением, что в случае рака прямой и ободочной кишки и рака мочевого пузыря, а также нейробластомы экспрессия сурвивина связана с неблагоприятным прогнозом. В отличие от этого сурвивин не выявляется в нормальных тканях взрослого организма. Указанные характеристики квалифицируют сурвивин как подходящий TAA как в диагностических, так и терапевтических целях.
Таким образом в последнее десятилетие идентифицировано большое количество TAA, которые узнаются CTL ограниченным по главному комплексу гистосовместимости (MHC) образом. Так как сурвивин сверхэкспрессируется в большинстве злокачественных опухолей человека и ингибирование его функции приводит к повышенному апоптозу, указанный белок может служить в качестве мишени для терапевтических CTL-ответов.
Белок сурвивин и его возможное диагностическое и терапевтическое применение описаны в (1) и патенте США 6245523, которые включены в данное описание в виде ссылки. Сурвивин представляет собой цитоплазматический белок с молекулярной массой 16,5 кД, содержащий один BIR и высокозаряженную двуспиральную область на карбоксильном конце вместо пальца RING, который ингибирует апоптоз, индуцированный отменой фактора роста (IL-3), при перенесении в предшественники B-клеток. Ген, кодирующий сурвивин, почти идентичен последовательности протеазного рецептора-1 эффекторных клеток (EPR-1), но ориентирован в противоположном направлении, таким образом свидетельствуя о существовании двух отдельных генов, дуплицированных в конфигурации «голова к голове». Соответственно, сурвивин может быть описан как антисмысловой продукт EPR-1. Функционально ингибирование экспрессии сурвивина повышающей регуляцией его природного антисмыслового транскрипта EPR-1 приводит к массивному апоптозу и снижению клеточного роста.
В US 6245523 описано выделение очищенного сурвивина и предлагаются молекулы нуклеиновой кислоты, которые кодируют белок сурвивин, и антитела и другие молекулы, которые связываются с сурвивином. В US 6245523 также описаны активные против апоптоза фрагменты белка сурвивина и его варианты, в которых аминокислотный остаток был встроен с N- или C-конца или внутри описанной последовательности сурвивина. В частности, заявлено, что такие пептиды должны содержать ключевые функциональные остатки, необходимые для апоптоза, например Trp в положении 67, Pro в положении 73 и Cys в положении 84.
В последнее десятилетие многочисленные клинические испытания показали возможность специфичной вакцинации пептидами для индукции противоопухолевых T-клеточных ответов у пациентов со злокачественной опухолью. Однако протекание болезни у пациентов в большинстве случаев не улучшалось. Указанное несоответствие во многих случаях объяснялось механизмами ускользания опухолевых клеток от иммунного надзора. В случае терапевтической методики целенаправленного воздействия на антигены, которые играют незначительную роль в злокачественном росте, селекция дефицитных по антигену злокачественных клеток является общеизвестным ограничением.
Однако в случае пациентов с раком молочной железы наблюдали парадоксальную роль белка Bcl-2. В первичных опухолях молочной железы негативность по Bcl-2 была связана с плохим клиническим исходом. Кроме того, сообщалось, что сверхэкспрессия белка Bcl-2 коррелирует с опухолями, позитивными по рецептору эстрогена, и опосредована элементами ответа на рецептор эстрогена в промоторной области гена Bcl-2. Прогноз эстроген-позитивных опухолей является более благоприятным, чем прогноз негативных по рецептору эстрогена опухолей. Предлагалось несколько возможных объяснений указанных видимо парадоксальных результатов, например ингибирующее влияние Bcl-2 на пролиферацию клеток, регуляция экспрессии Bcl-2 эстрогеном и/или присутствие антагонистов Bcl-2, которые ингибируют его цитопротекторную функцию.
Однако указанные выше исследования также показали, что сверхэкспрессия Bcl-2 в злокачественной опухоли молочной железы коррелирует с лекарственной резистентностью и что понижающая регуляция Bcl-2 антисмысловыми олигонуклеотидами модулирует лекарственную чувствительность в связи с апоптозом. Кроме того, трансфекция гена Bcl-2 в линии раковых клеток молочной железы неизменно приводила к повышенной резистентности к апоптозу. Кроме того, описано, что присутствие другого ингибитора апоптоза, белка сурвивина в карциноме молочной железы, тесно связано с экспрессией Bcl-2 и с пониженным индексом апоптоза (AI) и плохой общей выживаемостью. Сходная связь между сурвивином и Bcl-2 описана при нейробластоме, раке желудка, раке прямой и ободочной кишки, лимфоме Ходжкина с высокой степенью злокачественности. Таким образом, при карциноме молочной железы, как и в случае большинства других злокачественных опухолей человека, ингибирование апоптоза является общим признаком, и экспрессии противоапоптозных генов, например генов сурвивина и/или Bcl-2, может вызывать более выраженные противоапоптозные эффекты, которые отражаются в виде пониженного апоптозного индекса. Недавно показано, что сурвивин является мишенью для спонтанной T-клеточной реактивности у пациентов с различными злокачественными опухолями. Указанные первоначальные находки позже были подтверждены и подкреплены (авторами данного изобретения и другими исследователями).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии того, что пептиды, ограниченные классом I MHC, могут быть получены из другого класса регулирующих апоптоз белков, отличных от сурвивина, т.е. семейства белков Bcl-2, которые способны связываться с HLA-молекулами класса I MHC и при этом вызывать иммунные ответы CTL у пациентов, страдающих злокачественными заболеваниями. Указанные наблюдения показывают, что белки, относящиеся к семейству белков Bcl-2, действуют как молекулы TRAP, которые процессируются клетками in vivo в пептиды, обладающие функцией TRA. Указанные наблюдения открывают путь для новых терапевтических и диагностических способов, которые в общем могут быть применимы в борьбе со злокачественными заболеваниями.
В настоящем изобретении выявлено, что Bcl-2 является подходящей мишенью для иммунотерапии ряда злокачественных заболеваний. Bcl-2 является важным клеточным фактором, и его экспрессия имеет важное значение для жизнеспособности опухолевых клеток. Таким образом, Bcl-2 является привлекательной мишенью для вакцинации, поскольку ускользание от иммунного надзора при понижающей регуляции или утрате экспрессии данного белка нарушило бы устойчивый опухолевый рост. Кроме того, в исследованиях, которые привели к настоящему изобретению, авторы проводили поиск и выявили спонтанную T-клеточную реактивность в PBL против полученных из Bcl-2 пептидов у пациентов с раком молочной железы с использованием анализа ELISPOT.
Соответственно, настоящее изобретение в первом аспекте относится к изолированному белку, относящемуся к семейству белков Bcl-2, или его иммуногенно активному пептидному фрагменту для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли. В частности, изобретение относится к изолированным иммуногенно активным пептидным фрагментам, полученным из белка, относящегося к семейству белков Bcl-2, для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли.
В следующем аспекте изобретение относится к фармацевтической композиции, содержащей указанный выше белок и/или пептидный фрагмент согласно изобретению.
Также аспект изобретения относится к композиции вакцины, содержащей изолированный белок, относящийся к семейству белков Bcl-2, или его иммуногенно активный пептидный фрагмент или нуклеиновую кислоту, кодирующую указанный белок или указанный пептидный фрагмент, для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли.
В следующих аспектах изобретение относится к диагностическому набору для диагностики ex vivo или in situ наличия у пациента со злокачественной опухолью T-клеток в PBL или в опухолевой ткани, которые взаимодействуют с представителем семейства белков Bcl-2, при этом набор содержит пептидный фрагмент согласно изобретению, который определен выше; комплекс пептидного фрагмента согласно изобретению и молекулы HLA класса I или фрагмента такой молекулы.
Целью изобретения также является способ выявления у пациента со злокачественной опухолью наличия T-клеток, взаимодействующих с представителем семейства белков Bcl-2, при этом способ включает в себя осуществление контакта образца опухолевой ткани или образца крови с комплексом согласно изобретению, который определен выше, выявление связывания комплекса с тканью или клетками крови.
Кроме того, предлагается молекула, которая способна специфически связываться с пептидным фрагментом согласно изобретению, и молекула, которая способна блокировать такое связывание.
В другом аспекте изобретение относится к способу лечения злокачественного заболевания, при этом способ включает в себя введение пациенту, страдающему от заболевания, эффективного количества фармацевтической композиции согласно изобретению, молекулы согласно изобретению, которая способна специфически связываться с пептидным фрагментом согласно изобретению, и/или молекулы согласно изобретению, которая способна блокировать такое связывание.
В еще одном аспекте изобретение относится к применению белка или пептидного фрагмента, который определен в данном описании, в производстве лекарственного средства для лечения злокачественного заболевания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Основной целью настоящего изобретения является получение изолированных белков, относящихся к семейству белков Bcl-2, или их иммунологически активных пептидных фрагментов для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли.
Семейство белков Bcl-2 включает в себя несколько белков, которые регулируют апоптоз. К данному семейству относятся как проапоптозные, так и противоапоптозные представители. В данном описании представлено исследование потенциальных возможностей данного семейства белков в качестве фармацевтических или диагностически активных веществ при злокачественной опухоли, с конкретной ссылкой на белок Bcl-2. Кроме того, подробно описаны потенциальные возможности Bcl-XL и Mcl-1 в качестве фармацевтически и диагностически активного вещества. Однако весьма вероятно, что иммунные ответы, подобные иммунным ответам, наблюдаемым против белка Bcl-2 или его фрагментов, существуют или могут быть внесены пациентам со злокачественной опухолью против других представителей семейства белков Bcl-2, например других противоапоптозных белков, таких как Mcl-1 или Bcl-XL, которые также связаны с лекарственной резистентностью и сверхэкспрессируются в злокачественной опухоли. Соответственно, изобретение относится к любому представителю семейств белков Bcl-2, предпочтительно любому противоапоптозному представителю, который способен вызывать иммунные ответы у пациентов со злокачественной опухолью, например к белку, выбранному из группы, состоящей из Bcl-2, Bcl-w, Mcl-1, Bfl-1/A1, Bcl-b, Bcl2-L-10 и Bcl-XL, предпочтительно выбранному из группы, состоящей из Bcl-2, Mcl-1, Bcl-w и Bcl-XL, более предпочтительно выбранному из группы, состоящей из Bcl-2, Mcl-1 и Bcl-XL.
Представители противоапоптозного семейства Bcl-2 проявляют свое онкогенное влияние посредством ингибирования апоптоза в клетках, которым в норме суждено погибнуть, тем самым способствуя накоплению клеток in vivo.
Все представители семейства белков Bcl-2 содержат по меньшей мере один из четырех консервативных мотивов, известных как домены гомологии Bcl-2 (BH) (BH1, BH2, BH3 и BH4). Кроме наличия доменов BH предпочтительные противоапоптозные молекулы имеют заякоривающий в мембране домен на карбоксильном конце (TM). Противоапоптозные представители, такие как Bcl-2 и Bcl-XL, содержат все четыре домена BH наряду с трансмембранным доменом. Многодоменные проапоптозные белки, такие как Bax и Bak, содержат все, кроме домена BH4. Вторая подгруппа проапоптозных белков, известных как белки «только с BH3-доменом» (например, Bad и Bid), состоит из молекул, которые содержат только домен BH3 и в которых отсутствуют другие домены BH. В проапоптозных белках, таких как Bcl-XS и Mcl-1S, представляющих собой альтернативно сплайсированные формы генов bcl-x и mcl-1 соответственно, отсутствуют домены BH1 и BH2. Кроме того, в Mcl-1S отсутствует трансмембранный домен. Белки, относящиеся к семейству Bcl-2, описаны, например, в ссылке 6.
Хотя предпочтительно, чтобы белок, относящийся к семейству белков Bcl-2, обладал противоапоптозными свойствами, в настоящем изобретении также подразумевается, что белок, относящийся к семейству Bcl-2, может быть проапоптозным белком, например белком, выбранным из группы, состоящей из Bax, Bok/Mtd, Bad, Bik/Nbk, Bid, Hrk/DP5, Bim, Noxa, Bmf и PUMA/bbc3.
В одном предпочтительном варианте осуществления изобретения белком, относящимся к семейству белков Bcl-2, является Bcl-2, предпочтительно Bcl-2 человека, более предпочтительно Bcl-2, имеющий последовательность с исходным номером доступа P10415 в базе данных SwissProt.
В другом предпочтительном варианте осуществления изобретения белком, относящимся к семейству белков Bcl-2, является Bcl-XL, предпочтительно Bcl-XL человека, более предпочтительно Bcl-XL, имеющий последовательность с исходным номером доступа Q07817 в базе данных SwissProt.
В еще одном предпочтительном варианте осуществления изобретения белком, относящимся к семейству Bcl-2, является Mcl-1, предпочтительно Mcl-1 человека, более предпочтительно Mcl-1, имеющий последовательность с исходным номером доступа Q07820 в базе данных SwissProt.
Так как в ряде злокачественных опухолей человека экспрессируются высокие уровни Bcl-2 и других представителей семейства Bcl-2, иммунотерапевтическая методика, нацеленная на указанные антигены, может иметь широкие клинические применения. Основное беспокойство при таком подходе может вызывать введение аутореактивных иммунных ответов. Таким образом, будущее вакцинации, основанной на представителях данного семейства белков, будет зависеть как от терапевтической эффективности, так и от типа побочных эффектов, которые могут следовать после иммунизации. Когда впервые использовали пептиды, полученные из антигенов дифференцировки меланоцитов, для лечения пациентов с меланомой в стадии IV, предполагали, что это может привести к выраженному разрушению меланоцитов, которое, в свою очередь, проявилось бы клинически, например, в виде витилиго или ретинита. Однако клинический опыт показал, что частота витилиго у пациентов, получавших вакцинации, не была значимо выше, чем частота связанной с меланомой гипопигментации у пациентов, получавших другие формы терапии. Кроме того, не сообщалось о серьезных побочных эффектах в различных испытаниях вакцины против аутоантигенов.
В одном применимом варианте предлагаются новые пептидные фрагменты, ограниченные классом I MHC (также называемые в данном изобретении «пептидами»), которые характеризуются наличием по меньшей мере одного из нескольких признаков, одним из которых является способность связываться с молекулой HLA класса I, по которой он ограничен, с аффинностью, измеряемой по количеству пептида, которое способно к половине от максимального улавливания молекулы HLA класса I (значение C50), которое составляет не более 50 мкМ, как определено с помощью анализа связывания при сборке, который описан в данной публикации. Указанный анализ сборки осуществляют, как описано ранее (2), и анализ основан на стабилизации молекулы HLA после нагрузки пептидом дефицитной по переносчику пептидов линии клеток T2. Затем имеющие правильную укладку стабильные тяжелые цепи HLA подвергают иммунопреципитации, используя конформационно-зависимые антитела, и количественно оценивают связывание пептида.
Анализ обеспечивает простой способ скрининга выбранных для исследования пептидов в отношении их способности связываться с молекулой данного аллеля HLA с указанной выше аффинностью. В предпочтительных вариантах пептидный фрагмент согласно изобретению представляет собой фрагмент, имеющий значение C50, которое не превышает 30 мкМ, например значение C50, которое не превышает 20 мкМ, включая значения C50, не превышающие 10 мкМ, не превышающие 5 мкМ и не превышающие 2 мкМ.
Однако более предпочтительными пептидами согласно настоящему изобретению являются пептиды, способные вызывать специфичный T-клеточный ответ, который определяют анализом ELISPOT, например анализом ELISPOT, описанным в данной публикации ниже в примере 1, раздел 4. Некоторые пептиды, хотя и не связываются с MHC с высокой аффинностью, все же могут вызывать T-клеточный ответ, определяемый в ELISPOT. Другие пептиды, способные к связыванию с MHC с высокой аффинностью, также вызывают T-клеточный ответ, определяемый в ELISPOT. Оба вида пептидов являются предпочтительными пептидами согласно изобретению.
Следовательно, предпочтительными пептидами согласно настоящему изобретению являются пептиды, способные вызывать специфичный T-клеточный ответ, измеряемый в анализе ELISPOT, при этом измеряют более 50 специфичных для пептида пятен на 108 клеток, более предпочтительно на 107, еще более предпочтительно на 106, еще более предпочтительно на 105 клеток, например на 104 клеток.
Как указано выше, система HLA представляет собой главную систему гистосовместимости человека (MHC). В общем, системы MHC контролируют ряд параметров: трансплантационные антигены, тимусзависимые иммунные ответы, некоторые факторы комплемента и предрасположенность к определенным заболеваниям. Более конкретно, MHC кодирует три разных типа молекул, т.е. молекулы класса I, II и III, которые определяют более общие характеристики MHC. Из указанных молекул молекулы класса I представляют собой так называемые молекулы HLA-A, HLA-B и HLA-C, которые представлены на поверхности большинства нуклеированных клеток и тромбоцитов.
Пептиды согласно настоящему изобретению характеризуются своей способностью связываться (являются ограниченными по) конкретной молекуле HLA класса I MHC. Таким образом, в одном варианте пептид представляет собой пептид, который ограничен молекулой HLA-A класса I MHC, включая HLA-A1, HLA-A2, HLA-A3, HLA-A9, HLA-A10, HLA-A11, HLA-Aw19, HLA-A23(9), HLA-A24(9), HLA-A25(10), HLA-A26(10), HLA-A28, HLA-A29(w19), HLA-A30(w19), HLA-A31(w19), HLA-A32(w19), HLA-Aw33(w19), HLA-Aw34(10), HLA-Aw36, HLA-Aw43, HLA-Aw66(10), HLA-Aw68(28), HLA-A69(28). В литературе также используют более простые обозначения, в которых используют только основное числовое обозначение, например HLA-A19 или HLA-A24 вместо HLA-Aw19 и HLA-A24(49) соответственно. В конкретных вариантах пептид согласно изобретению ограничен типом молекулы HLA класса I MHC, выбранным из группы, состоящей из HLA-A1, HLA-A2, HLA-A3, HLA-A11 и HLA-A24.
Пептиды согласно изобретению могут быть получены, например, из известных последовательностей представителя семейства белков Bcl-2 (3). В предпочтительном варианте осуществления изобретения пептид содержит (или, более предпочтительно, состоит из) не более чем 200, предпочтительно не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, и еще более предпочтительно, не более чем 15, например не более чем 10, например, в диапазоне от 9 до 10 следующих друг за другом аминокислот одного из указанных выше представителей семейства белков Bcl-2, предпочтительно из Bcl-2 с исходным номером доступа P10415, Mcl-1 с исходным номером доступа Q07820 или Bcl-XL с исходным номером доступа Q07817 в базе данных SwissProt.
Отбор пептидов, потенциально обладающих способностью связываться с конкретной молекулой HLA, можно осуществить посредством выравнивания известных последовательностей, которые связываются с данной конкретной молекулой HLA, чтобы таким образом выявить преобладание нескольких родственных аминокислот в конкретных положениях пептидов. Такие преобладающие аминокислотные остатки также называют в данном описании «якорные остатки» или «мотивы якорных остатков». Следуя такому относительно простому способу, основанному на известных данных о последовательностях, которые можно найти в доступных базах данных, можно получить пептиды из молекулы семейства белков Bcl-2, которые вероятно связываются с конкретной молекулой HLA. Типичные примеры таких анализов для ряда молекул HLA приведены ниже:
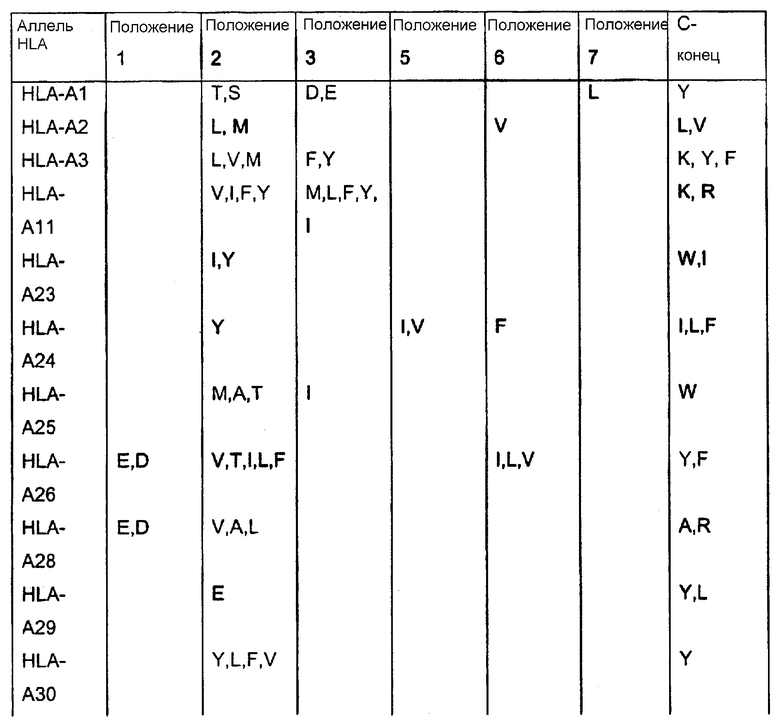
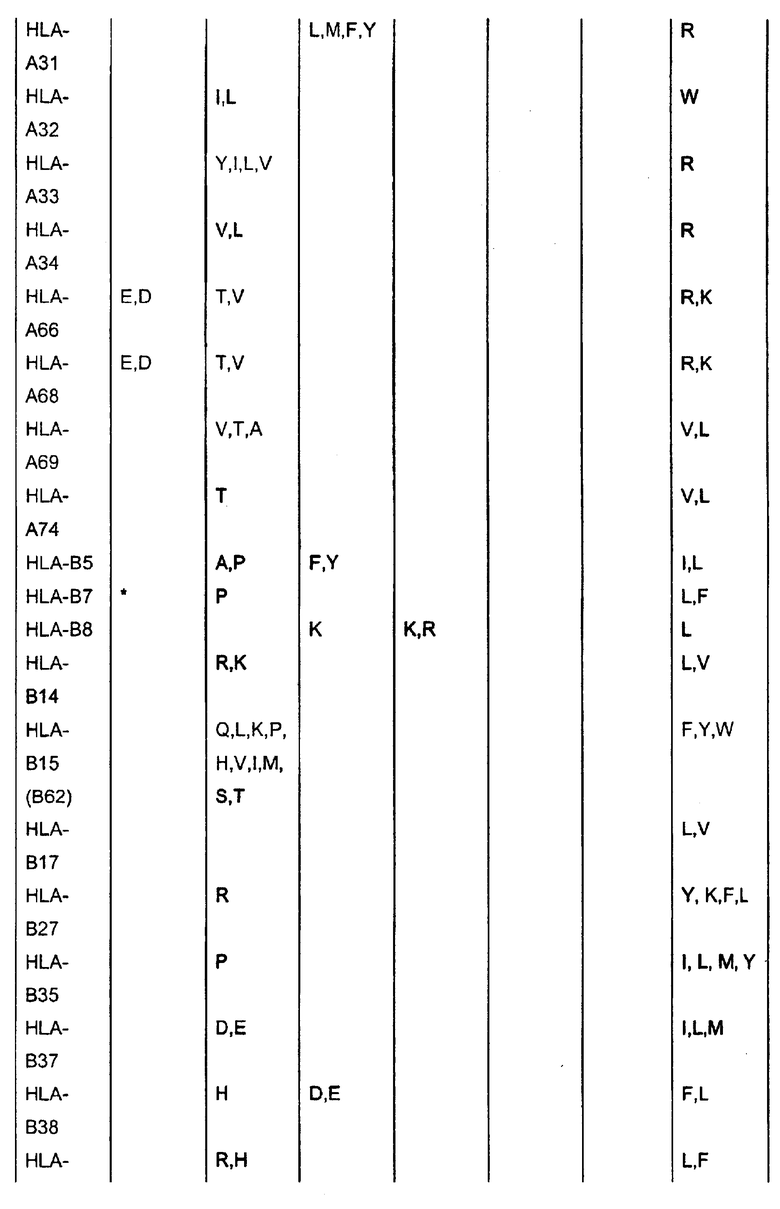
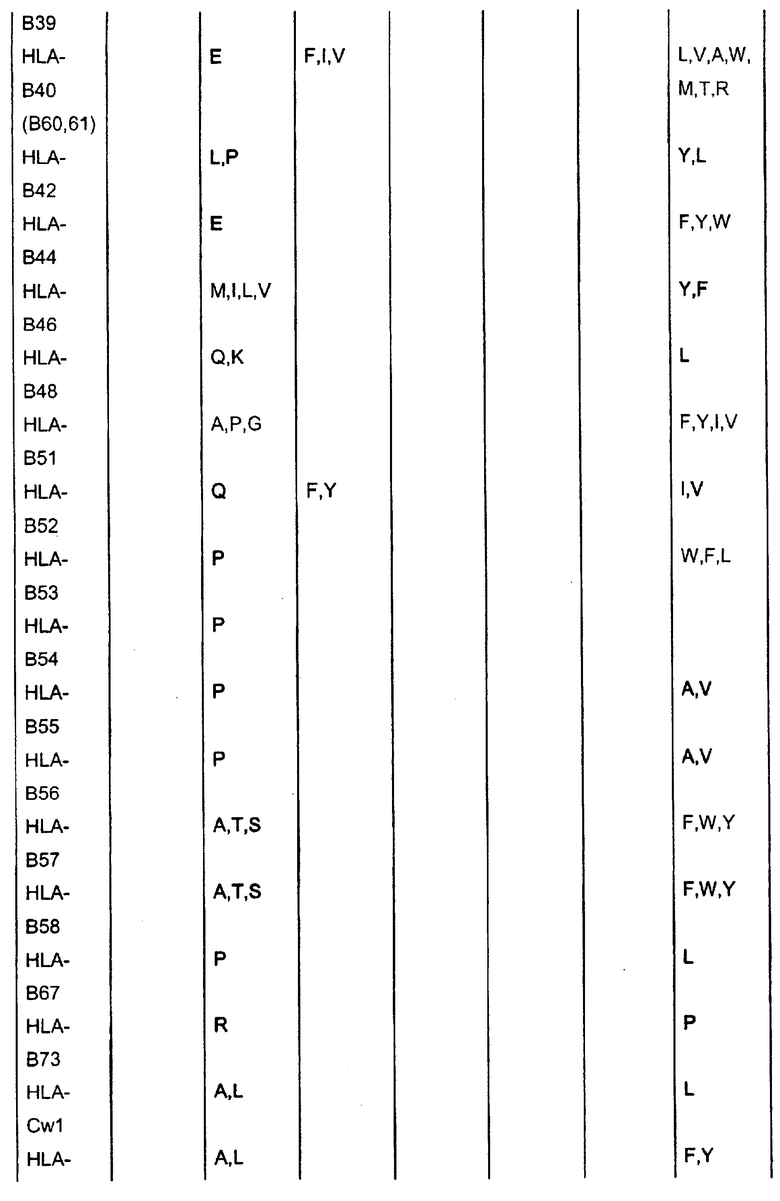
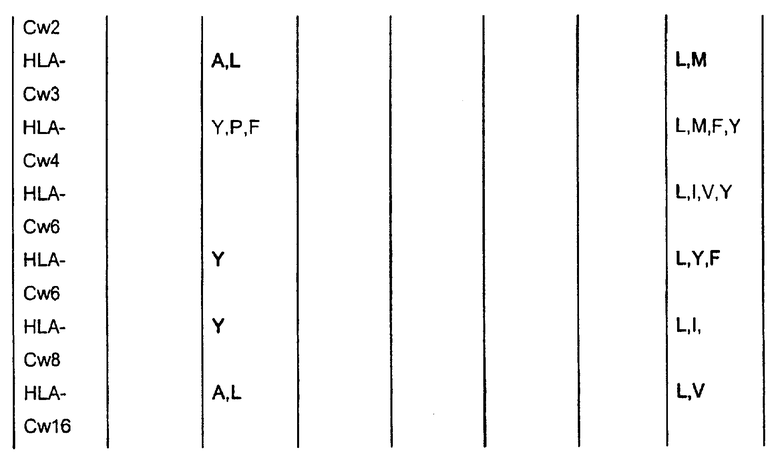
* В одном варианте нет конкретного якорного остатка для данного положения, однако в предпочтительном варианте якорным остатком является R или A.
Таким образом, в качестве примера нонапептиды, потенциально обладающие способностью связываться с HLA-A1, могли бы иметь одну из следующих последовательностей: Xaa-T-D-Xaa-Xaa-Xaa-L-Xaa-Y, Xaa-T-E-Xaa-Xaa-Xaa-L-Xaa-Y; Xaa-S-D-Xaa-Xaa-Xaa-L-Xaa-Y или Xaa-S-E-Xaa-Xaa-Xaa-L-Xaa-Y (Xaa означает любой аминокислотный остаток). Подобным образом могут быть сконструированы последовательности, потенциально обладающие способностью связываться с любой другой молекулой HLA.
Будет понятно, что специалист в данной области сможет идентифицировать дополнительные «мотивы якорных остатков» для данной молекулы HLA.
Таким образом, в применимых вариантах пептиды согласно изобретению включают пептиды, последовательности которых содержат в случае каждого из конкретных аллелей HLA, перечисленных в таблице, любой из аминокислотных остатков, которые указаны в таблице.
Таким образом, пептидами согласно изобретению могут быть любые из указанных выше пептидов, содержащих непрерывные последовательности из представителей семейства белков Bcl-2, в которых в пределах от 1 до 10, предпочтительно в пределах от 1 до 5, более предпочтительно в пределах от 1 до 3, еще более предпочтительно в пределах от 1 до 2, еще более предпочтительно, если 1 аминокислота заменена другой аминокислотой, предпочтительно таким образом, чтобы пептид содержал одну или несколько, предпочтительно все якорные остатки данного конкретного пептида HLA-A, которые указаны в таблице выше.
Неограничивающий пример того, как получить пептиды представителей семейства белков Bcl-2, содержащие якорные остатки данного специфичного для HLA-A пептида, описан в примере 3 в разделе «ответ на модифицированные пептиды». Соответственно в одном варианте осуществления изобретения пептид может представлять собой любой пептид, содержащий не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из RLKRDWLVK (SEQ ID NO: 62), QSDEIISRY (SEQ ID NO: 63) и QSEEIISRY (SEQ ID NO: 64), более предпочтительно, выбранной из группы, состоящей из RLKRDWLVK (SEQ ID NO: 62).
Таким образом, простой способ идентификации пептидов согласно изобретению включает в себя следующие стадии: выбор конкретной молекулы HLA, например молекулы, с высокой частотой встречающейся в данной популяции, осуществление анализа на основе выравнивания, который описан выше для идентификации «мотивов якорных остатков» в белке из семейства белков Bcl-2, выделение или конструирование пептидов подходящего размера, которые содержат один или несколько идентифицированных якорных остатков, и тестирование полученных в результате пептидов в отношении (i) способности связываться с конкретной молекулой HLA с использованием анализа сборки, который описан в данной публикации, (ii) способности пептидов вызывать появление INF-γ-продуцирующих клеток в популяции PBL пациента со злокачественной опухолью с частотой, составляющей по меньшей мере 1 на 104 PBL, определяемой в анализе ELISPOT, описанном в данном публикации, и/или (iii) способности пептидов выявлять in situ в опухолевой ткани CTL, которые реагируют на тестируемые эпитопные пептиды.
В конкретных вариантах пептид согласно изобретению является ограниченным по HLA-A2 пептидом, полученным из Bcl-2, имеющим последовательность, выбранную из следующих последовательностей: ALVGACITL (SEQ ID NО:1), ALSPVPPVV (SEQ ID NO:2), SLALVGACI (SEQ ID NO:3), KTLLSLALV (SEQ ID NO:4), LLSLALVGA (SEQ ID NO:5), WLSLKTLLSL (SEQ ID NO:6), AAAGPALSPV (SEQ ID NO:7), PLFDFSWLSL (SEQ ID NO:8), FTARGRFATV (SEQ ID NO:9), YLNRHLHTWI (SEQ ID NO:10), NIALWMTEYL (SEQ ID NO:11).
В одном предпочтительном варианте пептидом может быть любой пептид, состоящий из не более чем 200, предпочтительно не более чем 100, более предпочтительно не более чем 50, еще более предпочтительно не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из ALVGACITL (SEQ ID NO:1), ALSPVPPW (SEQ ID NO:2), SLALVGACI (SEQ ID NO:3), KTLLSLALV (SEQ ID NO:4), LLSLALVGA (SEQ ID NO:5), WLSLKTLLSL (SEQ ID NO:6), AAAGPALSPV (SEQ ID NO:7), PLFDFSWLSL (SEQ ID NO:8), FTARGRFATV (SEQ ID NO:9), YLNRHLHTWI (SEQ ID NO:10), NIALWMTEYL (SEQ ID NO:11), более предпочтительно, выбранной из группы, состоящей из NIALWMTEYL (SEQ ID NO: 11), YLNRHLHTWI (SEQ ID NO: 10), PLFDFSWLSL (SEQ ID NO: 8) и WLSLKTLLSL (SEQ ID NO: 6), еще более предпочтительно выбранной из группы, состоящей из PLFDFSWLSL (SEQ ID NO: 8) и WLSLKTLLSL (SEQ ID NO: 6).
В другом предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из EMQVLVSRI (SEQ ID NO: 44), TAYQSFEQV (SEQ ID NO: 43), YLNDHLEPWI (SEQ ID NO: 42), RIAAWMATYL (SEQ ID NO: 45), WMATYLNDHL (SEQ ID NO: 46), VLVSRIAAWM (SEQ ID NO: 48) и VAFFSFGGAL (SEQ ID NO: 49), более предпочтительно, из группы, состоящей из TAYQSFEQV (SEQ ID NO: 43), YLNDHLEPWI (SEQ ID NO: 42), RIAAWMATYL (SEQ ID NO: 45), WMATYLNDHL (SEQ ID NO: 46), VLVSRIAAWM (SEQ ID NO: 48) и VAFFSFGGAL (SEQ ID NO: 49), еще более предпочтительно, выбранной из группы, состоящей из TAYQSFEQV (SEQ ID NO: 43), VAFFSFGGAL (SEQ ID NO: 49), VLVSRIAAWM (SEQ ID NO: 48) и RIAAWMATYL (SEQ ID NO: 45) или выбранной из группы, состоящей из TAYQSFEQV (SEQ ID NO: 43) и WMATYLNDHL (SEQ ID NO: 46) или выбранной из группы, состоящей из YLNDHLEPWI (SEQ ID NO: 42).
В еще одном предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из RIAAWMATY (SEQ ID NO: 50) и ALCVESVDK (SEQ ID NO: 51), более предпочтительно, выбранной из группы, состоящей из RIAAWMATY (SEQ ID NO: 50).
В еще одном предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из YLREQATGAK (SEQ ID NO: 52), SITDVLVRTK (SEQ ID NO: 53), LISFGAFVAK (SEQ ID NO: 54), RLLFFAPTR (SEQ ID NO: 55), RTKRDWLVK (SEQ ID NO: 56) и DIKNEDDVK (SEQ ID NO: 57), более предпочтительно, выбранной из группы, состоящей из RLLFFAPTR (SEQ ID NO: 55) и RTKRDWLVK (SEQ ID NO: 56).
В еще одном предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из PAEEEEDDLY (SEQ ID NO: 58), SPEEELDGY (SEQ ID NO: 59), QSLEIISRY (SEQ ID NO: 60) и AGVGAGLAY (SEQ ID NO: 61), более предпочтительно, выбранной из группы, состоящей из PAEEEEDDLY (SEQ ID NO: 58) и QSLEIISRY (SEQ ID NO: 60).
В следующих применимых вариантах пептид согласно изобретению является пептидом, который ограничен по молекуле HLA-B класса I MHC, включая любую из следующих молекул: HLA-B5, HLA-B7, HLA-B8, HLA-B12, HLA-B13, HLA-B14, HLA-B15, HLA-B16, HLA-B17, HLA-B18, HLA-B21, HLA-Bw22, HLA-B27, HLA-B35, HLA-B37, HLA-B38, HLA-B39, HLA-B40, HLA-Bw41, HLA-Bw42, HLA-B44, HLA-B45, HLA-Bw46 и HLA-Bw47. В конкретных вариантах тип HLA-B класса I MHC, с которым пептид согласно изобретению способен связываться, выбран из HLA-B7, HLA-B35, HLA-B44, HLA-B8, HLA-B15, HLA-B27 и HLA-B51.
В следующих применимых вариантах пептид согласно изобретению является пептидом, который ограничен по молекуле HLA-C класса I MHC, включая следующие молекулы: HLA-Cw1, HLA-Cw2, HLA-Cw3, HLA-Cw4, HLA-Cw5, HLA-Cw6, HLA-Cw7 и HLA-Cw1.
Предпочтительно пептидный фрагмент согласно изобретению содержит менее 50 аминокислотных остатков и более предпочтительно он содержит не более чем 20 аминокислотных остатков, например не более чем 10 аминокислотных остатков. В конкретных вариантах пептид является гептапептидом, октопептидом, нонапептидом, декапептидом или ундекапептидом.
Пептид согласно изобретению, как указано выше, получен из представителя семейства белков Bcl-2 или его фрагмента. Белок, из которого может быть получен пептид, может являться любым представителем семейства белков Bcl-2 из любого вида животных, у которого белок экспрессируется. В предпочтительных вариантах исходный белок получен из вида млекопитающих, включая вид грызунов, кролика и вид приматов, таких как человек. На основании последовательности выбранного белка пептид согласно изобретению получают посредством любой подходящей химической или ферментативной обработки исходного белкового вещества, которая приводит к получению пептида подходящего размера, который указан выше, или пептид может быть синтезирован любыми обычными способами синтеза пептидов, которые известны специалисту в данной области.
Пептид согласно изобретению может иметь последовательность, которая является нативной последовательностью представителя семейства белков Bcl-2, из которого его получают. Однако пептиды, имеющие более высокую аффинность по отношению к любой данной молекуле HLA, могут быть получены из такой нативной последовательности путем модификации последовательности замещением, делетированием или добавлением по меньшей мере одного аминокислотного остатка, например, на основе способа, описанного выше, посредством чего идентифицируют мотивы якорных остатков в отношении данной молекулы HLA.
Важным характерным признаком пептида согласно изобретению является его способность распознавать или вызывать появление INF-γ-продуцирующих иммунореактивных T-клеток, т.е. цитотоксических T-клеток (CTL), которые специфически узнают конкретный пептид, в популяции PBL или опухолевых клетках пациента со злокачественной опухолью (клетках-мишенях). Указанную активность легко определить, подвергая PBL или опухолевые клетки от пациента анализу ELISPOT, который описан в ссылке (4) и в следующем примере. Перед анализом может быть предпочтительным стимулировать анализируемую популяцию PBL или опухолевых клеток посредством контактирования клеток с тестируемым пептидом. Предпочтительно пептид способен вызывать появление или распознавать INF-γ-продуцирующие T-клетки с частотой по меньшей мере 1 на 104 PBL, которую определяют анализом ELISPOT, используемым в данном изобретении. Более предпочтительно частота составляет по меньшей мере 5 на 104 PBL, наиболее предпочтительно по меньшей мере 10 на 104 PBL, например по меньшей мере 50 или 100 на 104 PBL.
Анализ ELISPOT представляет собой мощное средство для наблюдения за ответами T-клеток, специфичных по отношению к пептиду, полученному из семейства Bcl-2. Однако, хотя было показано, что реактивность в ELISPOT в большинстве случаев коррелирует со способностью CTL лизировать клетки-мишени, заключительное доказательство для указанного представления может быть получено только непосредственно. Поэтому главным выводом приведенных в данном описании наблюдений является то, что пептиды согласно изобретению могут быть экспрессированы и находиться в комплексе с молекулами HLA на злокачественных клетках. Это делает указанные злокачественные клетки чувствительными к разрушению клетками CTL и делает применимой иммунизацию белками семейства Bcl-2 для контролирования роста неоплазм. Наличие спонтанных CTL-ответов в PBL от пациентов с раком молочной железы на ограниченные по HLA эпитопы пептидов, полученных из Bcl-2, доказывает возможность иммунотерапии, основанной на указанных опухолевых антигенах, не только для пациентов с раком молочной железы, но также, поскольку представители семейства белков Bcl-2 сверхэкспрессируются во многих злокачественных опухолях, включая рак легкого, прямой и ободочной кишки, простаты, и при лейкозе и лимфомах, в случае широкого ряда злокачественных заболеваний.
Соответственно в другом предпочтительном варианте пептид согласно изобретению способен вызывать появление INF-γ-продуцирующих клеток в популяции PBL у пациента, имеющего злокачественное заболевание, при котором экспрессируется семейство белков Bcl-2, включая гематопоэтические злокачественные опухоли, например хронический лимфолейкоз и хронический миелолейкоз, меланому, рак молочной железы, рак шейки матки, рак яичника, рак легкого, рак ободочной кишки, рак поджелудочной железы и рак простаты.
Кроме способности вызывать иммунные ответы в популяциях PBL, также предполагается, что пептиды согласно изобретению способны вызывать цитолитические иммунные ответы in situ, т.е. в тканях солидных опухолей. Это можно показать, получая комплексы HLA-пептид, например мультимеризованные и снабженные регистрируемой меткой, и используя такие комплексы для иммуногистохимических окрашиваний, чтобы выявить в опухолевой ткани CTL, которые являются реактивными в отношении пептидного эпитопа согласно изобретению. Соответственно, следующим важным признаком пептида согласно изобретению является то, что он обеспечивает выявление in situ в опухолевой ткани CTL, которые являются реактивными по отношению к пептидному эпитопу.
Также предполагается, что пептиды согласно изобретению, кроме способности связываться с молекулами HLA, что приводит к презентации комплексов HLA и пептидов на клеточной поверхности, и указанные комплексы, в свою очередь, действуют как эпитопы или мишени для цитолитических T-клеток, могут вызывать другие типы иммунных ответов, такие как B-клеточные ответы, приводящие к продукции антител против комплексов, и/или реакция гиперчувствительности замедленного типа (РГЗТ). Последний тип иммунного ответа определяют в виде покраснения и пальпируемого уплотнения в месте инъекции пептида согласно изобретению.
Композиция вакцины согласно настоящему изобретению может содержать нуклеиновую кислоту, кодирующую белок, относящийся к семейству белков Bcl-2, или его пептидный фрагмент. Указанная нуклеиновая кислота таким образом может кодировать любой из указанных выше белков и пептидных фрагментов. Нуклеиновая кислота может представлять собой например ДНК, РНК, LNA, HNA, PNA, предпочтительно нуклеиновая кислота представляет собой ДНК или РНК.
Нуклеиновые кислоты согласно изобретению могут находиться в любом подходящем векторе, таком как экспрессирующий вектор. Имеется множество векторов, и специалист сможет выбрать подходящий вектор для конкретной цели. Вектор может быть, например, в форме плазмиды, космиды, вирусной частицы или искусственной хромосомы. Подходящая последовательность нуклеиновой кислоты может быть встроена в вектор рядом способов, например ДНК может быть встроена в подходящий сайт(ы) эндонуклеазы рестрикции с использованием способов, известных в данной области. Кроме последовательности нуклеиновой кислоты согласно изобретению, вектор может дополнительно содержать один или несколько из следующих элементов: сигнальную последовательность, начало репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. Вектор также может содержать дополнительные последовательности. При конструировании подходящих векторов, содержащих один или несколько из указанных компонентов, применяют стандартные способы лигирования, которые известны специалисту в данной области. Вектор предпочтительно является экспрессирующим вектором, содержащим нуклеиновую кислоту, оперативно связанную с регуляторной последовательностью нуклеиновой кислоты, управляющей ее экспрессией в подходящей клетке. В объеме настоящего изобретения указанная регуляторная последовательность нуклеиновой кислоты в общем должна быть способна управлять экспрессией в клетке млекопитающего, предпочтительно в клетке человека, более предпочтительно в антигенпредставляющей клетке.
В одном предпочтительном варианте вектор является вирусным вектором. Указанный вирусный вектор может, кроме нуклеиновой кислоты, кодирующей представитель семейства белков Bcl-2 или его пептидный фрагмент, содержать вторую последовательность нуклеиновой кислоты, кодирующую стимулирующий T-клетки полипептид. Стимулирующий T-клетки полипептид предпочтительно выбран из группы, состоящей из B7.1, ICAM-1 и LFA-3.
Вектор также может представлять собой бактериальный вектор, такой как вектор на основе аттенуированных бактерий. Аттенуированные бактериальные векторы могут быть использованы для того, чтобы индуцировать длительные иммунные ответы слизистой оболочки в местах инфекции и персистенции. В качестве векторов могут быть использованы различные рекомбинантные бактерии, например бактериальный вектор может быть выбран из группы, состоящей из Salmonella, Lactococcus и Listeria. В общем может быть показана индукция иммунитета на гетерологичный антиген L1 или E7 HPV16 с сильной индукцией CTL и регрессией опухоли у мышей.
Изобретение также относится к набору компонентов, содержащему
i) любую из композиций вакцины, описанных в данной публикации, и/или
ii) любой из белков, относящихся к семейству белков Bcl-2, описанных в данной публикации, и/или
iii) любой из пептидных фрагментов белков по п. ii), описанных в данной публикации, и/или
iv) любую из нуклеиновых кислот, кодирующих белки по п. ii) или пептиды по п. iii), и
дополнительный противоопухолевый агент.
Компоненты набора предпочтительно входят в отдельные композиции, однако в объем настоящего изобретения входит вариант, в котором все компоненты набора входят в одну и ту же композицию. Таким образом, компоненты набора могут быть введены одновременно или последовательно в любом порядке.
Противоопухолевым агентом может быть агент, используемый в химиотерапии или генной терапии, иммуностимулирующие вещества или антитела. Иммуностимулирующими веществами могут быть, например, цитокины, такие как цитокины, выбранные из группы, состоящей из GM-CSF, IFN типа I, интерлейкина 12 и интерлейкина 15. Антитело предпочтительно является иммуностимулирующим антителом, таким как анти-CD40- или анти-CTLA-4-антитела. Иммуностимулирующим веществом также может быть вещество, способное истощать ингибирующие иммунитет клетки (например, регуляторные T-клетки) или факторы, указанным веществом могут быть, например, лигазы убиквитина E3. Лигазы убиквитина E3 (HECT, RING и U-бокс-белки) возникли как ключевые молекулярные регуляторы функции иммунных клеток, и каждая из них может быть вовлечена в регуляцию иммунных ответов во время инфекции посредством целенаправленного воздействия на специфичные ингибирующие молекулы для протеолитического разрушения. В настоящее время несколько белков HECT и RING E3 также связывают с индукцией и поддержанием иммунной аутотолерантности: c-Cbl, Cbl-b, GRAIL, Itch и Nedd4, каждый из которых негативно регулирует продукцию фактора роста T-клеток и пролиферацию.
Очевидно, что полученные данные согласно настоящему изобретению обеспечивают основу терапевтических, а также диагностических применений белка или пептидного фрагмента согласно изобретению.
Соответственно, в следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей белок или пептидный фрагмент согласно изобретению, в частности к фармацевтической композиции, которая при введении пациенту со злокачественной опухолью способна вызывать иммунный ответ против злокачественного заболевания, включая продукцию у вакцинируемого пациента эффекторных T-клеток, обладающих цитотоксическим действием против злокачественных клеток.
Так как хорошо известно, что разные молекулы HLA по-разному распространены в основных популяциях человечества, существует необходимость в идентификации пептидных эпитопов, ограниченных несколькими молекулами класса I HLA, чтобы расширить категорию пациентов, которых можно лечить согласно способам, предлагаемым в настоящем изобретении. Характеристика множества эпитопов Bcl-2 с разными элементами ограничения по HLA расширяет клинические возможности данного антигена-мишени по двум важным направлениям: (i) она увеличивает количество пациентов, подходящих для иммунотерапии, основанной на пептидах, полученных из Bcl-2. Антиген HLA-A2 экспрессируется примерно у 50% людей в популяциях европеоидов и азиатов, оба антигена HLA-A1 и HLA-A3 экспрессируются примерно у 25% европеоидов и 5% азиатов, тогда как антиген HLA-A11 экспрессируется примерно у 15% европеоидов и 30% азиатов. Даже при том, что указанные числа нельзя сложить вследствие совместной экспрессии, комбинация пептидов, ограниченных многими из указанных антигенов, конечно, могла бы охватить большинство пациентов со злокачественной опухолью. (ii) Совместное целенаправленное воздействие на несколько элементов ограничения у каждого пациента, вероятно, снижает риск ускользания от иммунного надзора при утрате HLA-аллеля. Утрата одного HLA-аллеля является важным компонентом изменений MHC, описанных для злокачественных клеток, тогда как общая утрата экспрессии молекул класса I является довольно редким событием. Таким образом, при идентификации эпитопов Bcl-2, ограниченных разными аллелями HLA, можно целенаправленно воздействовать на более чем одну молекулу HLA одновременно у пациентов с перекрыванием аллелей.
Таким образом, возможна разработка высокоиммуногенных мультиэпитопных вакцин. Предпочтительно такие вакцины необходимо конструировать так, чтобы облегчить одновременную доставку лучше всего подходящих пептидов, полученных из Bcl-2, необязательно в комбинации с другими подходящими пептидами и/или адъювантами, которые описаны далее. Настоящее изобретение охватывает такие мультиэпитопные вакцины, содержащие полученные из Bcl-2 пептиды необязательно в комбинации с дополнительными белками или пептидными фрагментами, не относящимися или не полученными из семейства белков Bcl-2, и/или адъювантами, которые описаны далее, и/или ограниченными классом II MHC эпитопами, которые описаны ниже.
Повышенное внимание было сосредоточено на том, чтобы вызвать специфичный по отношению к опухоли клеточный T-хелперный иммунитет, т.е. на вакцинации эпитопами, ограниченными классом II MHC, несмотря на тот факт, что опухоли обычно не экспрессируют MHC класса II. Это основано на недавно полученных данных о том, что индукция и эффективность индуцированного вакциной противоопухолевого ответа во многих случаях требует кооперации специфичных по отношению к опухоли CD4-позитивных Th-клеток. Таким образом, важным движущим фактором разработки вакцин, имеющих более сложный состав, является желание целенаправленно воздействовать на многочисленные опухолевые антигены, например, посредством создания вакцин, содержащих или кодирующих набор тщательно отобранных CTL-эпитопов и Th-клеточных эпитопов.
Очевидно, что мультиэпитопные вакцины представляют собой эффективный способ повышения иммунитета против эпитопов, полученных из нескольких разных антигенов, без необходимости введения потенциально опасных белков, таких как онкобелки (или кодирующих их генов). Такие вакцины также позволяют избирательно индуцировать иммунитет против субдоминантных и криптических T-клеточных эпитопов, которые могут иметь особенно важное значение в случае ассоциированных с опухолями аутоантигенов, в случае которых может существовать толерантность в отношении эпитопов, которые в значительной степени представлены в нормальных тканях. Кроме того, антигенпредставляющие клетки могут быть не в состоянии представлять некоторые эпитопы, которые экспрессируются на опухолевых клетках, вследствие функциональных различий между иммунопротеосомами антигенпредставляющих клеток и «конститутивными» протеосомами, присутствующими в большинстве опухолевых клеток. В случае вакцин, основанных на пептидах, такие эпитопы могут быть введены в «MHC-готовой» форме, которая обеспечивает представление посредством экзогенной нагрузки независимо от захвата и процессинга антигена антигенпредставляющими клетками хозяина.
Так как пептиды согласно изобретению являются относительно небольшими молекулами, в таких композициях может требоваться комбинирование пептидов с различными веществами, такими как адъюванты, чтобы получить вакцины, иммуногенные композиции и т.д. Адъюванты в широком смысле являются веществами, которые стимулируют иммунные ответы. Часто предпочтительным адъювантом является полный или неполный адъювант Фрейнда или убитые организмы B. pertussis, используемые, например, в комбинации с преципитированным квасцами антигеном. Общее обсуждение адъювантов представлено в Goding, Monoclonal Antibodies: Principles & Practice (2nd edition, 1986), стр.61-63. Однако Goding отмечает, что в том случае, когда представляющий интерес антиген имеет низкую молекулярную массу или является слабоиммуногенным, рекомендуется связывание с иммуногенным носителем. Примеры таких молекул-носителей включают гемоцианин морского блюдечка «замочная скважина», бычий сывороточный альбумин, овальбумин и птичий иммуноглобулин. Также отмечалось, что различные экстракты сапонина применимы в качестве адъювантов в иммуногенных композициях. Недавно предложено применение в качестве адъюванта колониестимулирующего фактора гранулоцитов-макрофагов (GM-CSF), хорошо известного цитокина (WO 97/28816).
Композиции вакцины согласно изобретению предпочтительно содержат адъювант и/или носитель. Примеры применимых адъювантов и носителей приведены ниже в данном описании. Таким образом, белок, относящийся к семейству белков Bcl-2, или его пептидный фрагмент, присутствующий в композиции, может быть связан с носителем, таким, например, как белок или антигенпредставляющая клетка, такая, например, как дендритная клетка (DC), способная представлять белок семейства белков Bcl-2 или его пептидный фрагмент T-клетке.
Адъюванты представляют собой любое вещество, смешивание которого с композицией вакцины увеличивает или иным образом модифицирует иммунный ответ на белок семейства белков Bcl-2 или его пептидный фрагмент. Носители являются скелетными структурами, например полипептидом или полисахаридом, с которым может быть связан белок семейства белков Bcl-2 или его пептидный фрагмент.
Адъюванты могут быть выбраны, например, из группы, состоящей из AlK(SO4)2, AlNa(SO4)2, AlNH4(SO4), диоксида кремния, квасцов, Al(OH)3, Ca3(PO4)2, каолина, угля, гидроксида алюминия, мурамилдипептидов, N-ацетилмурамил-L-треонил-D-изоглутамина (thr-DMP), N-ацетилнормурамил-L-аланил-D-изоглутамина (CGP 11687, также называемого nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'2'-дипальмитоил-sn-глицеро-3-гидроксфосфорилокси)этиламина (CGP 19835A, также называемого MTP-PE), RIBI (MPL+TDM+CWS) в эмульсии 2% сквален/твин-80, RTM, липополисахаридов и их различных производных, включая липид A, полного адъюванта Фрейнда (FCA), неполного адъюванта Фрейнда, адъюванта Merck Adjuvant 65, полинуклеотидов (например, поли-IC- и поли-AU-кислоты), воска D из Mycobacterium tuberculosis, веществ, обнаруженных в Corynebacterium parvum, Bordetella pertussis, и представителях рода Brucella, липосом или других липидных эмульсий, Titermax, ISCOM, Quil A, ALUN (см. US 58767 и 5554372), производных липида A, производных холерного токсина, производных HSP, производных LPS, синтетических пептидных матриц или GMDP, интерлейкина 1, интерлейкина 2, Montanide ISA-51 и QS-21. Предпочтительные адъюванты, используемые в изобретении, включают адъюванты на основе масел/поверхностно-активных вещества, такие как адъюванты Montanide (доступные из Seppic, Belgium), предпочтительно Montanide ISA-51. Другими предпочтительными адъювантами является основанные на бактериальной ДНК адъюванты, такие как адъюванты, содержащие CpG-олигонуклеотидные последовательности. Другими предпочтительными адъювантами являются адъюванты на основе вирусной днРНК, такие как поли-I:C. Имидазохинилины являются другими примером предпочтительных адъювантов. Кроме того, предпочтительным адъювантом являются липосомы. Наиболее предпочтительными адъювантами являются адъюванты, подходящие для применения на человеке.
Адъюванты Montanide (доступные из Seppic, Belgium) могут быть выбраны из группы, состоящей из Montanide ISA-51, Montanide ISA-50, Montanide ISA-70, Montanide ISA-206, Montanide ISA-25, Montanide ISA-720, Montanide ISA-708, Montanide ISA-763A, Montanide ISA-207, Montanide ISA-264, Montanide ISA-27, Montanide ISA-35, Montanide ISA 51F, Montanide ISA 016D и Montanide IMS, предпочтительно из группы, состоящей из Montanide ISA-51, Montanide IMS и Montanide ISA-720, более предпочтительно, из группы, состоящей из Montanide ISA-51. Montanide ISA-51 (Seppic, Inc.) является адъювантом на основе смеси масло/поверхностно-активное вещество, в котором разные поверхностно-активные вещества комбинируют с неметаболизируемым минеральным маслом, метаболизируемым маслом или с их смесью. Адъюванты готовят для применения в виде эмульсии с водным раствором, содержащим белок, относящийся к семейству белков Bcl-2, или его пептидный фрагмент. Поверхностно-активным веществом является олеат маннида. QS-21 (Antigenics; Aquila Biopharmaceuticals, Framingham, MA) является высокоочищенным водорастворимым сапонином, который используют в виде водного раствора. Адъюванты QS-21 и Montanide ISA-51 могут поставляться в стерильных одноразовых флаконах.
Общее обсуждение адъювантов представлено в Goding, Monoclonal Antibodies: Principles & Practice (2nd edition, 1986), стр.61-63. Однако Goding отмечает, что в том случае, когда представляющий интерес антиген имеет низкую молекулярную массу или является слабоиммуногенным, рекомендуется связывание с иммуногенным носителем. Примеры таких молекул-носителей включают гемоцианин морского блюдечка «замочная скважина», бычий сывороточный альбумин, овальбумин и птичий иммуноглобулин. Также отмечалось, что различные экстракты сапонина применимы в качестве адъювантов в иммуногенных композициях. Недавно предложено применение в качестве адъюванта колониестимулирующего фактора гранулоцитов-макрофагов (GM-CSF), хорошо известного цитокина (WO 97/28816).
Требуемые функциональные свойства адъювантов, которые можно использовать согласно настоящему изобретению, перечислены в таблице 1 ниже.
Таблица 1. Способы действия адъювантов.
Источник: Cox, J. C. и Coulter, A. R. (1997). Vaccine 15, 248-56.
Композиция вакцины согласно настоящему изобретению может содержать несколько разных адъювантов. Кроме того, изобретение охватывает терапевтическую композицию, дополнительно содержащую любое адъювантное вещество, включая любое из указанных выше веществ и их комбинации. Также предполагается, что белок, относящийся к семейству белков Bcl-2, или его пептидные фрагменты и адъювант могут быть введены отдельно в любой подходящей последовательности.
Носитель может присутствовать независимо от адъюванта. Функция носителя может, например, заключаться в увеличении молекулярной массы, в частности, пептидных фрагментов, чтобы увеличить их активность или иммуногенность, придать стабильность, повысить биологическую активность или увеличить время полужизни в сыворотке. Кроме того, носитель может помогать представлять белок, относящийся к семейству Bcl-2, или его пептидные фрагменты T-клеткам. Носителем может быть любой подходящий носитель, известный специалисту в данной области, например белок или антигенпредставляющая клетка. Белковым носителем может быть без ограничения гемоцианин морского блюдечка «замочная скважина», сывороточные белки, такие как трансферрин, бычий сывороточный альбумин, сывороточный альбумин человека, тиреоглобулин или овальбумин, иммуноглобулины или гормоны, такие как инсулин или пальмитиновая кислота. Для иммунизации людей носителем может быть физиологически приемлемый носитель, приемлемый для человека и безопасный. Однако в одном варианте осуществления изобретения подходящими носителями являются столбнячный токсоид и/или дифтерийный токсоид. Альтернативно носителем могут быть декстраны, например сефароза.
Соответственно изобретение относится к терапевтической композиции, дополнительно содержащей адъювантное вещество, включая любое из указанных выше веществ или их комбинации. Также предполагается, что антиген, т.е. пептид согласно изобретению и адъювант, могут быть введены одновременно или отдельно в любой подходящей последовательности.
Выбор антигена в фармацевтической композиции согласно изобретению будет зависеть от параметров, определяемых специалистом в данной области. Как указано, каждый из разнообразных пептидов согласно изобретению представлен на поверхности клеток конкретной молекулой HLA. По существу, если подвергаемого лечению субъекта типируют в отношении HLA-фенотипа, то выбирают такой пептид/пептиды, который, как известно, связывается с данной конкретной молекулой HLA.
Альтернативно представляющий интерес антиген выбирают на основе распространенности различных фенотипов HLA в данной популяции. В качестве примера HLA-A2 является наиболее распространенным фенотипом в популяции европеоидов, и поэтому композиция, содержащая полученный из сурвивина пептид, связывающийся с HLA-A2, будет активным у большой части данной популяции. Однако композиция согласно изобретению также может содержать комбинацию двух или более полученных из сурвивина пептидов, которые специфически взаимодействуют с разными молекулами HLA, так чтобы охватить большую часть целевой популяции. Таким образом, в качестве примера фармацевтическая композиция может содержать комбинацию пептида, ограниченного молекулой HLA-A, и пептида, ограниченного молекулой HLA-B, например, включая такие молекулы HLA-A и HLA-B, которые соответствуют преобладающим фенотипам HLA в целевой популяции, таким, например, как HLA-A2 и HLA-B35. Кроме того, композиция может содержать пептид, ограниченный молекулой HLA-C.
Предполагается, что подходящие иммуногенные композиции согласно изобретению, кроме пептида, полученного из представителя семейства белков Bcl-2, который определен в данном описании, могут содержать иммуногенно эффективное количество самого представителя семейства белков Bcl-2, который определен в данном описании, или его иммуногенного фрагмента.
Количество иммуногенного пептида согласно изобретению в фармацевтической композиции может варьироваться в зависимости от конкретного применения. Однако однократная доза иммуногена предпочтительно везде составляет примерно от 10 мкг до примерно 5000 мкг, более предпочтительно примерно от 50 мкг до 2500 мкг, например, примерно от 100 мкг до 1000 мкг. Способы введения включают интрадермальное, подкожное и внутривенное введение, имплантацию в форме препарата длительного высвобождения и т.д. В данном случае осуществляют любую и все формы введения, известные в данной области. Также предусмотрена любая и все обычные дозированные формы, которые известны в данной области, как подходящие для приготовления инъекционной иммуногенной пептидной композиции, такие как лиофилизованные формы и растворы, суспензии или эмульсионные формы, содержащие при необходимости обычные фармацевтически приемлемые носители, разбавители, консерванты, адъюванты, буферные компоненты и т.д.
Фармацевтические композиции могут быть приготовлены и введены с использованием любого обычного протокола, известного специалисту в данной области. В примере 5 приведен неограничивающий пример получения композиции вакцины согласно изобретению, а также неограничивающий пример введения такой вакцины. Специалисту в данной области будет понятно, что протокол может быть легко адаптирован для любой из композиций вакцин, приведенных в данном описании.
В следующем варианте согласно изобретению фармацевтическая композиция согласно изобретению применима для лечения пациента со злокачественной опухолью, когда в ходе прогрессирования злокачественной опухоли у данного пациента в злокачественных клетках развилась пониженная чувствительность к химиотерапевтически активному противоопухолевому лекарственному средству и/или к лучевой терапии.
Фармацевтическая композиция согласно изобретению преимущественно может содержать по меньшей мере один дополнительный иммуногенный белок или его пептидный фрагмент, выбранный из белка или пептидного фрагмента, не относящегося к семейству белков Bcl-2 или полученного не из такого белка, включая белок, вовлеченный в регуляцию апоптоза клеток, или полученный из него пептидный фрагмент. В качестве одного примера таким дополнительным белком или пептидом является сурвивин, который определен выше, или его пептидный фрагмент. В конкретных вариантах дополнительным иммуногенным полученным из сурвивина пептидом является ограниченный по HLA-A2 пептид, имеющий последовательность, выбранную из следующих последовательностей: FLKLDRERA (сурвивин101-109) (SEQ ID NO: 12), TLPPAWQPFL (сурвивин5-14) (SEQ ID NO: 13), ELTLGEFLKL (сурвивин95-104) (SEQ ID NO: 14), LLLGEFLKL (SEQ ID NO: 15) и LMLGEFLKL (SEQ ID NO: 16). (Обозначения в скобках указывают положения остатков в белке сурвивине, которые описаны в US 6245523). LLLGEFLKL (SEQ ID NO: 15) является последовательностью, полученной из сурвивина96-104 заменой «T» в положении 2 пептида остатком «L», и LMLGEFLKL (SEQ ID NO: 16) получают из сурвивина96-104 заменой «T» в положении 2 остатком «M». В следующих конкретных вариантах дополнительным иммуногенным полученным из сурвивина пептидом является ограниченный по HLA-B35 полученный из сурвивина пептид, имеющий последовательность, выбранную из следующих последовательностей: CPTENEPDL (сурвивин46-54) (SEQ ID NO: 17), EPDLAQCFF (сурвивин51-59) (SEQ ID NO: 18), CPTENEPDY (SEQ ID NO: 19) и EPDLAQCFY (SEQ ID NO: 20). (Обозначения в скобках указывают положения остатков в белке сурвивине, которые описаны в US 6245523). CPTENEPDY (SEQ ID NO: 19) является последовательностью, полученной из сурвивина46-54 заменой «L» на C-конце пептида остатком «Y», и EPDLAQCFY (SEQ ID NO: 20) получают из сурвивина51-59 заменой остатка «F» на C-конце 2 остатком «Y».
В следующих вариантах дополнительным пептидом является ограниченный по HLA-A1 пептид, имеющий последовательность, выбранную из следующих последовательностей: сурвивин38-46 (Sur38Y9) (C заменен на Y в P9, MAEAGFIHY) (SEQ ID NO: 21), сурвивин47-56 (Sur47Y10) (Q заменен на Y в P10, PTENEPDLAY (SEQ ID NO: 22)), сурвивин92-101 (Sur92-101) (QFEELTLGEF) (SEQ ID NO: 23) и
сурвивин93-101 (Sur93T2 (E заменен на T в P2, FTELTLGEF (SEQ ID NO: 24)). Пептидом согласно изобретению также может быть ограниченный по HLA-A3 пептид, такой как
сурвивин18-24 (Sur18K10) (F заменен на K в P10, RISTFKNWPK (SEQ ID NO: 25) и/или ограниченный по HLA-A11 пептид, такой как сурвивин53-62 (Sur53-62) (DLAQCFFCFK) (SEQ ID NO: 26), и/или ограниченный по HLA-A2 пептид, такой как сурвивин18-28 (Sur18-28) (RISTFKNWPFL) (SEQ ID NO: 27).
Однако в одном предпочтительном варианте осуществления изобретения композиции вакцины не содержат сурвивина или его фрагментов.
Другие применимые дополнительные пептиды включают известный полипептид ингибитора апоптоза ML-IAP, который имеет довольно избирательную экспрессию и выявляется в меланомах. Таким образом фрагменты ML-IAP, способные вызывать специфичный T-клеточный ответ, т.е. цитотоксический T-клеточный ответ или хелперный T-клеточный ответ, необязательно могут быть включены в композицию согласно настоящему изобретению. Применимые пептидные фрагменты ML-IAP включают любой из фрагментов ML-IAP, описанных в заявке на выдачу патента WO 2004/089980, которая тем самым включена в виде ссылки в полном объеме, предпочтительно ML-IAP245 (RLQEERTCKV)(SEQ ID NО:28), ML-IAP280 (QLCPICRAPV)(SEQ ID NO:29), ML-IAP90 (RLASFYDWPL)(SEQ ID NO:30), ML-IAP154 (LLRSKGRDFV)(SEQ ID NO:31), ML-IAP230 (VLEPPGARDV)(SEQ ID NO:32), ML-IAP98 (PLTAEVPPEL)(SEQ ID NO:33), ML-IAP34 (SLGSPVLGL)(SEQ ID NO:34), ML-IAP54 (QILGQLRPL)(SEQ ID NO:35), ML-IAP99 (LTAEVPPEL)(SEQ ID NO:36), ML-IAP83 (GMGSEELRL)(SEQ ID NO:37) и ML-IAP200 (ELPTPRREV)(SEQ ID NO:38).
Другие подходящие дополнительные пептиды включают TRAG-3 и его пептидные фрагменты. TRAG-3 существует по меньшей мере в двух альтернативно сплайсируемых формах, и пептиды всех форм сплайсинга TRAG-3 применимы в качестве дополнительных пептидов. В частности, фрагменты любой из форм сплайсинга TRAG-3 в том случае, когда указанные фрагменты способны вызывать специфичный T-клеточный ответ, т.е. цитотоксический T-клеточный ответ или хелперный T-клеточный ответ, необязательно могут быть включены в композицию согласно настоящему изобретению.
Кроме того, композиция согласно настоящему изобретению может быть представлена в виде мультиэпитопной вакцины, содержащей ограниченный по классу I эпитоп и ограниченные по классу II эпитопы, которые определены в данном описании выше.
Иммунопротекторное действие композиции согласно изобретению можно определить, используя несколько способов, например, как описано в WO 97/28816 выше. Успешный иммунный ответ также можно определить по появлению реакций РГЗТ после иммунизации и/или выявлению антител, специфически узнающих пептид(ды) композиции вакцины.
В предпочтительных вариантах фармацевтической композицией согласно изобретению является композиция вакцины. Таким образом, фармацевтическая композиция может представлять собой иммуногенную композицию или вакцину, способную вызывать иммунный ответ против злокачественного заболевания. В используемом в данном описании смысле выражение «иммуногенная композиция или вакцина» относится к композиции, вызывающей по меньшей мере один тип иммунного ответа, направленного против злокачественных клеток. Соответственно такой иммунный ответ может представлять собой любой из типов, указанных выше: CTL-ответ, при котором образуются CTL, которые способны узнавать комплекс HLA/пептид, представленный на клеточной поверхности, приводящие к лизису клеток, т.к. вакцина вызывает продуцирование у вакцинируемого субъекта эффекторных T-клеток, обладающих цитотоксическим действием против злокачественных клеток; B-клеточный ответ, вызывающий продукцию противоопухолевых антител; и/или РГЗТ-тип иммунного ответа.
В применимых вариантах иммуногенный ответ, направленный против злокачественного заболевания, вызывают введением пептида согласно изобретению либо посредством нагрузки молекул MHC класса I антигенпредставляющих клеток (АПК) от пациента, выделения PBL от пациента и инкубации клеток с пептидом перед инъецированием клеток снова в организм пациента, либо посредством выделения предшественников АПК из организма пациента и дифференцировки клеток в профессиональные АПК с использованием цитокинов и антигена перед инъецированием клеток снова в организм пациента.
Таким образом, в одном аспекте изобретения предлагаются композиции вакцины, содержащие антигенпредставляющие клетки, содержащие белок, относящийся к семейству Bcl-2, или его пептидный фрагмент или нуклеиновую кислоту, кодирующую указанный белок или указанный пептидный фрагмент. Антигенпредставляющей клеткой может быть любая клетка, способная представлять антиген T-клетке. Предпочтительными антигенпредставляющими клетками являются дендритные клетки. Дендритные клетки (ДК) могут быть получены и использованы в терапевтическом способе согласно любому подходящему протоколу, например, как описано в данной публикации ниже. Специалисту в данной области будет понятно, что протокол может быть адаптирован для применения в случае пациентов с разным типом HLA и разными заболеваниями.
На дендритные клетки (ДК) импульсно действуют 50 мкг/мл ограниченного по HLA пептида (синтезированного с качеством GMP) в течение 1 час при 37°C, и 5 x 106 клеток вводят подкожно в 1 и 14 день, затем каждый 4 недели, дополнительный лейкаферез после 5 вакцинаций. Создание ДК для клинического применения и контроль качества можно осуществлять, по существу, как описано в ссылке 5.
Таким образом, в одном варианте настоящего изобретения способ лечения пациентов со злокачественной опухолью представляет собой способ, при котором пептид вводят посредством презентации пептида антигенпредставляющим клеткам (АПК) пациента ex vivo с последующей инъекцией обработанных таким образом АПК снова в организм пациента. Существуют по меньшей мере два альтернативных пути осуществления указанного. Одной альтернативой является выделение АПК из организма пациента со злокачественной опухолью и инкубация (нагрузка) молекул MHC класса I пептидом. Нагрузка молекул MHC класса I означает инкубацию АПК с пептидом для того, чтобы АПК с молекулами MHC класса I, специфичными в отношении пептидов, связались с пептидом и следовательно были способны представлять его T-клеткам. Затем АПК снова инъецируют пациенту. Другой альтернативный способ основан на недавних открытиях, сделанных в области биологии дендритных клеток. В данном случае моноциты (являющиеся предшественниками дендритных клеток) выделяют из организма пациента и дифференцируют in vitro в профессиональные АПК (или дендритные клетки) с использованием цитокинов и антигена. Затем на образованные in vitro ДК импульсно воздействуют пептидом и инъецируют в организм пациента.
Вследствие того факта, что представители семейства белков Bcl-2, по-видимому, экспрессируются в ряде форм злокачественных опухолей, весьма вероятно, что могут быть получены вакцины согласно изобретению для борьбы с любым типом злокачественного заболевания, при котором такие белки экспрессируются. Таким образом, в качестве примеров композиция вакцины согласно изобретению является иммунологически активной против гематопоэтической злокачественной опухоли, включая хронический лимфолейкоз и хронический миелолейкоз, меланому, рак молочной железы, рак шейки матки, рак яичника, рак легкого, рак ободочной кишки, рак поджелудочной железы и рак простаты.
Из приведенного выше описания специалист легко поймет, что белки и/или пептиды согласно изобретению применимы в качестве средств диагностики злокачественной опухоли. Поэтому пептиды согласно изобретению обеспечивают основу для разработки широко применимых диагностических и прогностических способов, касающихся злокачественных заболеваний. Таким образом, в других применимых вариантах композиция согласно изобретению представляет собой композицию для диагностики ex vivo или in situ наличия у пациента злокачественной опухоли, например, на основе выявления T-клеток, реактивных по отношению к представителям семейства белков Bcl-2, среди PBL или в опухолевой ткани.
Соответственно в следующих аспектах предлагается диагностический набор для диагностики ex vivo или in situ наличия у пациента со злокачественной опухолью T-клеток, реактивных по отношению к представителям семейства Bcl-2, среди PBL или в опухолевой ткани, содержащий один или несколько пептидов согласно изобретению, и способ выявления у пациента со злокачественной опухолью наличия таких реактивных T-клеток, при этом способ заключается в контактировании опухолевой ткани или образца крови с комплексом пептида согласно изобретению и молекулы HLA класса I или фрагмента такой молекулы и выявлении связывания комплекса с тканью или клетками крови.
Другой применимый диагностический или прогностический способ основан на образовании антител у гетерологичного вида животного, например мышиных антител, направленных против пептида, полученного из представителя семейства белков Bcl-2, согласно изобретению, которые затем можно использовать, например, для диагностики наличия злокачественных клеток, представляющих пептид. Для целей иммунизации количество пептида может быть меньше, чем количество, используемое в курсе терапии in vivo, такой как указано выше. В общем предпочтительная доза может быть в пределах примерно от 1 мкг до 750 мкг пептида. Также можно получать моноклональные антитела на основе иммунизации пептидом согласно изобретению. Соответственно настоящее изобретение также относится к молекуле, в частности моноклональному или поликлональному антителу, включая его фрагмент, которое способно специфически связываться с пептидом согласно изобретению, и к молекуле, которая способна блокировать такое связывание, например антителу, выработанному против моноклонального или поликлонального антитела, направленного против пептида согласно изобретению. Изобретение, кроме того, относится к изолированным рецепторам T-клеток, способным специфически связываться с пептидом или белком согласно изобретению, а также к кодирующим их изолированным нуклеиновым кислотам. Такие рецепторы T-клеток могут быть, например, клонированы из специфичных по отношению к белку или пептиду T-клеток с использованием стандартных способов, хорошо известных специалисту.
В одном аспекте изобретение также относится к изолированным T-клеткам, содержащим рецепторы T-клеток, способные специфически связываться с любым из белков, относящихся к семейству Bcl-2, и/или их пептидными фрагментами, описанными в данной публикации. Изолированные T-клетки предпочтительно являются T-клетками, которые были размножены in vitro. Способы размножения T-клеток in vitro хорошо известны специалисту. Такие T-клетки могут быть, в частности, применимы для лечения злокачественной опухоли с помощью адаптивного переноса или аутологичного клеточного переноса. Таким образом, изобретение также относится к способам лечения, заключающимся во введении T-клеток, содержащих рецепторы T-клеток, способные специфически связываться с белком, относящимся к семейству Bcl-2, или его пептидными фрагментами, человеку, такому как человек, страдающий от злокачественной опухоли. Изобретение, кроме того, относится к применению T-клеток, содержащих рецепторы T-клеток, способные специфически связываться с белком, относящимся к семейству Bcl-2, или его пептидными фрагментами, для получения лекарственного средства для лечения злокачественной опухоли. Аутологичный клеточный перенос можно осуществить, по существу, как описано в ссылке 7.
В одном аспекте изобретение относится к комплексу пептида согласно изобретению и молекулы HLA класса I или фрагмента такой молекулы, который применим в качестве диагностического реагента, такого как описан выше. Такой комплекс может быть мономерным или мультимерным.
Настоящее изобретение относится к способам облегчения или излечения злокачественного заболевания. Соответственно в следующем аспекте изобретения предлагается способ лечения злокачественного заболевания, связанного с экспрессией представителя семейства белков Bcl-2, включая в качестве примеров: гематопоэтическую злокачественную опухоль, включая хронический лимфолейкоз и хронический миелолейкоз, меланому, рак молочной железы, рак шейки матки, рак яичника, рак легкого, рак ободочной кишки, рак поджелудочной железы и рак простаты, и указанный способ заключается во введении пациенту, страдающему от заболевания, эффективного количества фармацевтической композиции согласно изобретению, молекулы, которая способна специфически связываться с пептидом согласно изобретению, и/или молекулы, которая способна блокировать связывание такой молекулы.
В некоторых случаях подходящим будет является комбинирование способа лечения согласно изобретению с обычным лечением злокачественной опухоли, таким как химиотерапия, лучевая терапия, лечение иммуностимулирующими веществами, генная терапия, лечение антителами и лечение с использованием дендритных клеток. Так как повышенная экспрессия представителей семейства белков Bcl-2 в опухолевых клетках коррелирует с лекарственной резистентностью, то комбинирование основанной на Bcl-2 иммунотерапии, которая раскрыта в настоящем изобретении, с цитотоксической иммунотерапией может быть эффективным способом лечения злокачественной опухоли.
В одном аспекте изобретение относится к способам контролирования иммунизации, при этом указанный способ включает в себя стадии
i) получения образца крови от индивидуума;
ii) получение белка, относящегося к семейству белков Bcl-2, или его пептидного фрагмента, при этом указанным белком или пептидом может быть любой из белков или пептидов, указанных в данном описании;
iii) определения того, содержит ли указанный образец крови антитела или T-клетки, содержащие рецепторы T-клеток, специфически связывающие белок или пептид;
iv) таким образом определяя, был ли повышен иммунный ответ к указанному белку или пептиду у указанного индивидуума.
Индивидуумом предпочтительно является человек, например человек, который был иммунизирован белком, относящимся к семейству белков Bcl-2, или его пептидным фрагментом, или нуклеиновой кислотой, кодирующей указанный белок или пептид.
Далее изобретение будет проиллюстрировано следующими неограничивающими примерами и чертежами, где
на фиг. 1 показана идентификация пептидов, связывающих HLA-A2, полученных из Bcl-2. Полосы тяжелой цепи MHC класса I количественно оценивали, используя устройство для визуализации люминесценции. Количество стабилизированной тяжелой цепи HLA-A2 прямо зависит от аффинности связывания добавляемого пептида. Связывание ограниченного по HLA-A2 позитивного контрольного пептида Pol476 HIV (черные квадраты) сравнивали с пептидами Bcl172 (черные треугольники), Bcl180 (черные кружки) и Bcl200 (белые кружки); и
фиг. 2 иллюстрирует T-клеточный ответ против пептидов Bcl172, Bcl180, Bcl208 и
Bcl214. Анализировали PBL от 15 пациентов с раком молочной железы. T-лимфоциты однократно стимулировали пептидом перед посевом 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии пептида. Среднее количество специфичных для пептида пятен (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US).
Фиг. 3 иллюстрирует T-клеточные ответы против Bcl-2, которые измерены в анализе ELISPOT INF-γ. Анализировали PBL от десяти позитивных по HLA-A2 пациентов с CLL, трех позитивных по HLA-A2 пациентов с AML и двух пациентов с раком поджелудочной железы (PC). Исследовали пептиды Bcl208 (A) и Bcl214 (B). T-лимфоциты однократно стимулировали пептидом перед посевом 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии пептида. Среднее количество специфичных для пептида пятен (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US). Отвечающие индивидуумы (определяемые по среднему количеству антиген-специфичных пятен ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) отмечены черными квадратами, тогда как не отвечающие индивидуумы отмечены белыми квадратами.
Фиг. 4 иллюстрирует выявление Bcl-2-специфичных CTL в анализе ELISPOT гранзима B. T-лимфоциты от четырех пациентов с раком молочной железы в разной конечной стадии (b19, b20, b22, b16) и здоровых контрольных доноров (h1) однократно стимулировали пептидом перед посевом 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии пептида Bcl208 (A) или Bcl214 (B). Среднее количество пептидоспецифичных пятен гранзима B (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US). Отвечающие индивидуумы (определяемые по среднему количеству антиген-специфичных пятен ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) отмечены черными квадратами, тогда как не отвечающие индивидуумы отмечены белыми квадратами.
Фиг. 5 иллюстрирует цитолитическую способность Bcl-2-специфичных CTL. Bcl208-реактивные CTL выделяли из PBL от пациента с раком молочной железы с использованием магнитных шариков, покрытых HLA-A2/Bcl208. A) Основную массу выделенной культуры анализировали в отношении специфичного лизиса клеток T2 с пептидом Bcl208 (черные квадраты) или без него (белые квадраты). B) Лизис Bcl208-выделенными T-клетками HLA-A2-позитивной линии клеток рака молочной железы MDA-MB-231 (черные кружки) и HLA-A2-негативной линии клеток рака молочной железы ZR75-1 (белый кружки).
Фиг.6 иллюстрирует ограниченные по HLA-A2 T-клеточные ответы против Bcl-XL, измеренные в анализе ELISPOT INF-γ. Анализировали PBL от двенадцати здоровых человек, восемнадцати пациентов с раком молочной железы (BC-пациенты), шести пациентов с меланомой и двух пациентов с раком поджелудочной железы (PC-пациенты). Все люди были HLA-A2-позитивными. Исследовали пептиды Bcl-XL173-182 (YLNDHLEPWI) (SEQ ID NO: 48) (A), Bcl-XL141-150 (VAFFSFGGAL) (SEQ ID NO: 49) (B), Bcl-XL161-170 (VLVSRIAAWM) (SEQ ID NO: 48) (C) и Bcl-XL165-174 (RIAAWMATYL) (SEQ ID NO: 45) (D). T-лимфоциты однократно стимулировали пептидом перед посевом 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии соответствующего пептида. Среднее количество специфичных для пептида пятен (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US). Отвечающие индивидуумы (определяемые по среднему количеству антиген-специфичных пятен ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) отмечены черными квадратами, тогда как не отвечающие индивидуумы отмечены белыми квадратами.
Фиг. 7 иллюстрирует выявление Bcl-XL-специфичных CTL в анализе ELISPOT гранзима В. T-лимфоциты от трех разных пациентов с раком молочной железы (BC35, BC36 и BC17) однократно стимулировали пептидом перед посевом 3 х 105 клеток на лунку в трех повторах либо в отсутствии, либо в присутствии пептида Bcl-XL173-182 (YLNDHLEPWI). Среднее количество пептидоспецифичных пятен гранзима B (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US). Отвечающие индивидуумы (определяемые по среднему количеству антиген-специфичных пятен ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) отмечены черными квадратами, тогда как не отвечающие индивидуумы отмечены белыми квадратами.
Фиг. 8 иллюстрирует анализ Bcl-XL-специфичных CD8-позитивных клеток в PBL от пациента с раком молочной железы. PBL от пациента BC36 однократно стимулировали Bcl-XL173-182 in vitro и перед анализом выделяли клетки CD8+. FACS-окрашивание культуры с использованием анти-CD8-антитела и пентамерного комплекса HLA-A2/Bcl-XL173-182 выявило, что 95,5% клеток были CD8-позитивными и 0,24% из них были позитивными в отношении пентамера (A). Пентамер HLA-A2/HIV использовали в качестве негативного контроля (B). Культуру клеток дополнительно анализировали с помощью ELISPOT (C).
Фиг. 9 иллюстрирует ограниченные по HLA-A2 T-клеточные ответы против Bcl-XL, измеренные в анализе ELISPOT INF-γ. Анализировали PBL от двенадцати здоровых человек, восемнадцати пациентов с раком молочной железы (BC-пациенты), шести пациентов с меланомой и двух пациентов с раком поджелудочной железы (PC-пациенты). Все люди были HLA-A2-позитивными. Исследовали пептиды Bcl-XL118-12 (TAYQSFEQV) (SEQ ID NO: 43) (A) и Bcl-XL169-178 (WMATYLNDHL) (SEQ ID NO: 46) (B). T-лимфоциты однократно стимулировали пептидом перед посевом 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии соответствующего пептида. Среднее количество специфичных для пептида пятен (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US). Отвечающие индивидуумы (определяемые по среднему количеству антиген-специфичных пятен ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) отмечены черными квадратами, тогда как не отвечающие индивидуумы отмечены белыми квадратами.
Фиг. 10 иллюстрирует ограниченные по HLA-A3 T-клеточные ответы против Bcl-XL, измеренные в анализе ELISPOT INF-γ. T-лимфоциты однократно стимулировали пептидом перед посевом 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии пептида Bcl-XL165-173 (RIAAWMATY) (SEQ ID NO: 50). Анализировали PBL от семи здоровых человек, пяти пациентов с раком молочной железы, четырех пациентов с меланомой, двух пациентов с раком поджелудочной железы и пяти пациентов с множественной миеломой. Все люди были HLA-A3-позитивными. Среднее количество специфичных для пептида пятен (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US).
Фиг. 11 иллюстрирует ограниченные по HLA-A3 T-клеточные ответы против Mcl-1, измеренные в анализе ELISPOT INF-γ. T-лимфоциты однократно стимулировали пептидом перед посевом 3 x 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии пептида. Исследовали PBL от десяти здоровых людей, шести пациентов с раком молочной железы (BC), двух пациентов с раком поджелудочной железы (PC) и шести пациентов с CLL против пептида Mcl-195-103 (слева) и пептида Mcl-1300-308 (справа). Все люди были HLA-A3-позитивными. Среднее количество специфичных для пептида пятен (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US). Отвечающие индивидуумы (определяемые по среднему количеству антиген-специфичных пятен ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) отмечены черными квадратами, тогда как не отвечающие индивидуумы отмечены белыми квадратами.
Фиг. 12 иллюстрирует ограниченные по HLA-A1 T-клеточные ответы против Mcl-1, измеренные в анализе ELISPOT INF-γ. T-лимфоциты однократно стимулировали пептидом перед посевом 3 х 105 клеток на лунку в трех повторах либо в отсутствие, либо в присутствии пептида Mcl-1166-175 или Mcl-1177-185. Исследовали PBL от шести здоровых людей, четырех пациентов с раком молочной железы (BC) и семи пациентов с меланомой против пептида Mcl-195-103 (слева) и пептида Mcl-1300-308 (справа). Все люди были HLA-A1-позитивными. Среднее количество специфичных для пептида пятен (после вычитания пятен без добавления пептида) рассчитывали для каждого пациента, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US). Отвечающие индивидуумы (определяемые по среднему количеству антиген-специфичных пятен ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) отмечены черными квадратами, тогда как не отвечающие индивидуумы отмечены белыми квадратами.
ПРИМЕРЫ
Пример 1
Иммунные ответы против Bcl-2 у пациентов с раком молочной железы.
Материалы и способы
1. Пациенты
Лимфоциты периферической крови (PBL) собирали у пациентов с раком молочной железы. PBL выделяли, используя разделение Lymphoprep, типировали по HLA (Department of Clinical Immunology, University Hospital, Copenhagen, Denmark) и замораживали в FCS с 10% ДМСО. Ни один из пациентов не получал иммунотерапию перед отбором образцов крови.
2. Анализ сборки в отношении связывания пептида с молекулами MHC класса I
Аффинность связывания синтетических пептидов (Invitrogen, Carlsbad, CA, USA) с молекулами HLA-A2, метаболически меченными [35S]-метионином, измеряли в анализе сборки, который описан ранее. Анализ основан на опосредованной пептидом стабилизации «пустых» молекул HLA, высвобождаемых при лизисе клеток из дефицитной по TAP линии клеток T2. HLA-молекулы со стабильной укладкой иммунопреципитировали, используя специфичные для HLA класса I конформационно-зависимые мАт W6/32, и разделяли электрофорезом в геле с изоэлектрическим фокусированием (IEF). Полосы тяжелой цепи MHC количественно оценивали, используя программу для устройства визуализации люминесценции ImageGauge (FUJI photo film Co., Carrollton, TX, USA). Интенсивность полосы находится в прямой зависимости от количества связанного с пептидом комплекса MHC класса I, извлекаемого в ходе анализа. Затем степень стабилизации HLA-A2 прямо связывали с аффинностью связывания добавляемого пептида. Извлечение HLA-A2 измеряли в присутствии 50, 5, 0,5, 0,05 мкМ соответствующего пептида. Значение C50 рассчитывали для каждого пептида в виде концентрации пептида, достаточной для полумаксимальной стабилизации.
3. Антигенная стимуляция PBL
Чтобы увеличить чувствительность анализа ELISPOT, PBL однократно стимулировали in vitro перед анализом. В 0 день PBL или измельченные лимфатические узлы оттаивали и высевали в 2 мл/лунку в концентрации 2 x 106 клеток в 24-луночные планшеты (Nunc, Denmark) в среду X-vivo (Bio Whittaker, Walkersville, Maryland), 5% инактивированную нагреванием сыворотку человека и 2 мМ L-глутамина в присутствии 10 мкМ пептида. Спустя два дня к культурам добавляли 20 ед./мл рекомбинантного интерлейкина-2 (IL-2) (Chiron, Ratingen, Germany). Культивируемые клетки тестировали в отношении реактивности в ELISPOT на 12 день.
4. Анализ ELISPOT
Анализ ELISPOT использовали для количественной оценки эффекторных клеток, высвобождающих специфичный по отношению к пептидному эпитопу интерферон-γ, как описано ранее (4). Коротко, 96-луночные планшеты с нитроцеллюлозным дном (MultiScreen MAIP N45, Millipore, Hedehusene, Denmark) покрывали анти-IFN-γ-антителом (1-D1K, Mabtech, Nacka, Sweden). Лунки промывали, блокировали средой X-vivo и добавляли клетки в двух повторах в двух разных концентрациях клеток. Затем в каждую лунку добавляли пептиды и планшеты инкубировали в течение ночи. На следующий день среду отбрасывали и лунки промывали перед добавлением биотинилированного второго антитела (7-B6-1-Biotin, Mabtech). Планшеты инкубировали в течение 2 часов, промывали и в каждую лунку добавляли конъюгат авидин-фермент (AP-Avidin, Calbiochem, Life Technologies). Планшеты инкубировали при комнатной температуре в течение 1 часа и в каждую лунку добавляли субстрат фермента NBT/BCIP (Gibco, Life Technologies) и инкубировали при комнатной температуре в течение 5-10 мин. Реакцию останавливали промывкой водопроводной водой при появлении темно-фиолетовых пятен. Пятна подсчитывали, используя анализатор ImmunoSpot® серии 2.0 (CTL Analyzers, LLC, Cleveland, US), и частоту специфичных в отношении пептида CTL можно было рассчитать на основании количества клеток, образующих пятна. Все анализы осуществляли в трех повторах для каждого пептидного антигена.
5. Результаты
Связывание полученных из Bcl-2 пептидов с HLA-A2
Проводили скрининг аминокислотной последовательности белка Bcl-2 в отношении большинства возможных нона- и декамерных пептидных эпитопов HLA-A2, используя основные специфичные по отношению к HLA-A2 якорные остатки (2). Синтезировали тринадцать происходящих из Bcl-2 пептидов и исследовали в отношении связывания с HLA-A2 по сравнению с позитивным высокоаффинным по отношению к HLA-A2 контрольным эпитопом из pol476-484 HIV-1 (ILKEPVHGV) (SEQ ID NO: 39) посредством анализа сборки. Анализ сборки основан на стабилизации молекулы класса I после нагрузки разными концентрациями пептида дефицитной по TAP линии клеток T2. Затем подвергнутые правильной укладке стабильные тяжелые цепи MHC иммунопреципитировали, используя конформационно-зависимые антитела. Степень стабилизации молекул MHC класса I прямо зависит от аффинности связывания добавляемого пептида, как показано на фиг. 1. Концентрация пептида, необходимая для полумаксимального извлечения молекул MHC класса I (значение C50), составляла 0,7 мкМ для pol476-484 HIV-1 (таблица 2). Восемь полученных из Bcl-2 пептидов связывались с почти одинаковой высокой аффинностью, что и позитивный контроль; Bcl224, Bcl85, Bcl222, Bcl218, Bcl220, Bcl214, Bcl124 и Bcl172 (C50 = 0,7, 1, 1, 2, 1, 3, 1 и 2 мкмМ соответственно) (таблица 2). Пептиды Bcl80, Bcl208 и Bcl180 связывались только с промежуточной или слабой аффинностью (C50 = 36,7 и 20 мкМ, соответственно. Два из исследованных пептидов (Bcl216, Bcl200) совсем не связывались с HLA-A2. Список пептидов, включенных в данное исследование, показан в таблице 2:
Таблица 2. Пептиды, изученные в данном исследовании


a Ряд значений, внесенных в список в виде подстрочного индекса, указывает положение первой аминокислоты в последовательности
b Значение C50 указывает концентрацию пептида, необходимую для полумаксимального связывания HLA-A2.
CTL-ответы против пептидов, полученных из Bcl-2, у подвергнутых химиотерапии пациентов с раком молочной железы
Используя анализ секреции INF-γ ELISPOT, авторы исследовали наличие специфичных T-клеточных ответов против полученных из Bcl-2 пептидов в T-клетках периферической крови от пациентов с раком молочной железы. Указанный способ ранее был высокоэффективным при идентификации специфичных в отношении опухоли CTL у пациентов со злокачественной опухолью.
PBL от 15 позитивных по HLA-A2 пациентов с раком молочной железы однократно стимулировали in vitro перед исследованием посредством анализа ELISPOT. Указанный способ был выбран для того, чтобы повысить чувствительность ELISPOT, как описано в (4). Так как многие описанные CTL-эпитопы в действительности являются низкоаффинными пептидами, авторы включили все тринадцать рассчитанных на основе Bcl-2 пептидов в первую очередь экспериментов. Выявляли индивидуумов с ответами против Bcl172, Bcl180, Bcl208 и Bcl214, и данные только для указанных пептидов приведены на фиг. 2. Выявили спонтанные CTL-ответы против Bcl172 в PBL от восьми пациентов (50%) и против Bcl180 у четырех пациентов (≈25%) (фиг. 2). Однако наиболее частые ответы выявляли против Bcl208 и Bcl214, так как двенадцать (≈80%) пациентов имели регистрируемый CTL-ответ против Bcl208 и одиннадцать пациентов (≈75%) имели Bcl214-ответ (фиг. 2).
Пример 2
Иммуногенность Bcl-2 у пациентов со злокачественной опухолью
Сущность
В данном примере авторы описывают спонтанную T-клеточную реактивность против Bcl-2 в периферической крови пациентов, страдающих в результате опухолей неродственных типов, т.е. рака поджелудочной железы, AML и CLL. Кроме того, авторы показывают, что указанные Bcl-2-реактивные T-клетки действительно являются специфичными по отношению к пептиду цитотоксическими эффекторными клетками. Таким образом, Bcl-2 может служить в качестве важной и широко применимой мишени для способов противоопухолевой иммунотерапии, например, в комбинации с обычной лучевой и химиотерапией.
Введение
Семейство Bcl-2 включает в себя несколько ключевых исполнителей, участвующих в регуляции апоптоза, и включает как проапоптозные, так и противоапоптозные молекулы. Bcl-2 является важным клеточным фактором, вносящим вклад в патогенез и прогрессирование злокачественной опухоли. В настоящем исследовании авторы исследовали природную клеточную иммуногенность Bcl-2 у пациентов со злокачественной опухолью.
Способы
Пациенты
PBL выделяли, используя разделение Lymphoprep, типировали по HLA (Department of Clinical Immunology, University Hospital, Copenhagen, Denmark) и замораживали в FCS с 10% ДМСО. Ни один из пациентов не получал иммунотерапию перед отбором образцов крови. От пациентов получали согласие на основе предоставленной информации перед любым из указанных измерений. Лимфоциты периферической крови (PBL) собирали от тринадцати позитивных по HLA-A2 пациентов с раком молочной железы, представляющим прогрессирующее заболевание с отдаленными метастазами, с определенной стадией заболевания IV; большая часть пациентов имели более одного места локализации опухоли (8/13 пациентов). Предыдущее лечение включало химиотерапию, эндокринную терапию и лучевую терапию. Восемь пациентов ранее лечили химиотерапией, тогда как пять пациентов получили только эндокринную терапию и не получали химиотерапии перед включением в исследование. Кроме того, были включены двенадцать позитивных по HLA-A2 пациентов с локализованной операбельной злокачественной опухолью молочной железы, и образцы крови собирали перед первичной хирургической операцией и химиотерапией. Кроме того, PBL собирали от двух позитивных по HLA-A2 пациентов с раком поджелудочной железы, представляющим прогрессирующее заболевание с отдаленными метастазами, с определенной стадией заболевания IV. Наконец, собирали PBL от десяти HLA-A2-пациентов с недавно диагностированным CLL и трех с AML до лечения. PBL от двенадцати HLA-A2-позитивных здоровых людей служили в качестве контролей.
ELISPOT гранзима B
Анализ ELISPOT гранзима B (GrB) использовали для измерения цитотоксичности антиген-специфичных CTL, как описано. Коротко, 96-луночные планшеты с нитроцеллюлозным дном (MultiScreen MAIP N45, Millipore) покрывали улавливающим GrB антителом (BD Biosciences, Brondby, Denmark). Лунки промывали и блокировали средой X-vivo с 5% сыворотки человека. Добавляли клетки с разной концентрацией клеток. Затем в каждую лунку добавляли клетки T2 и пептиды и планшеты инкубировали 4 часа, среду отбрасывали и лунки промывали перед добавлением антитела для выявления GrB (BD Biosciences). Планшеты инкубировали в течение 2 часов, промывали и в каждую лунку добавляли авидин-пероксидазу хрена (BD Biosciences). Планшеты инкубировали при комнатной температуре в течение 1 часа, в каждую лунку добавляли реагент - субстрат AEC (BD Biosciences) и инкубировали при комнатной температуре в течение 5-10 мин. Реакцию останавливали промывкой водопроводной водой при появлении красных пятен. Пятна подсчитывали и частоту специфичных по отношению к пептиду CTL рассчитывали подобно анализу ELISPOT INF-γ. Все анализу проводили в двух или трех повторах для каждого пептидного антигена.
Выделение специфичных по отношению к пептиду T-клеток
Антиген-специфичные клетки выделяли с помощью магнитных шариков, покрытых Bcl208/HLA-A2, как описано ранее. Биотинилированные мономеры (Prolmmune, Oxford, UK) связывали с магнитными шариками, покрытыми стрептавидином (Dynabeads M-280, Dynal A/S, Oslo, Norway), посредством инкубации 2,5 мкг мономеров с 5×106 шариков в 40 мкл PBS в течение 20 мин при комнатной температуре. Магнитные комплексы промывали три раза в PBS в магнитном поле (Dynal A/S, Oslo, Norway) и затем смешивали с PBL в соотношении 1:10 в PBS с 5% БСА и вращали очень осторожно в течение 1 часа. Антиген-специфичные T-клетки CD8+, связывающиеся с магнитными комплексами, осторожно промывали три раза. Изолированные клетки ресуспендировали много раз в X-vivo с 5% HS и инкубировали в течение 2 часов, затем магнитные шарики высвобождали и удаляли из клеточной суспензии. Изолированные клетки культивировали в 48-луночном планшете в X-vivo, 5% HS и 106 покрытых анти-CD28, анти-CD3 искусственных основанных на клетках антигенпредставляющих клетках (K32/41BBL), которые экспрессируют лиганд 4-1BB (4-1BBL) (любезно предоставленные Dr. Carl H. June, Department of Pathology and Laboratory Medicine, University of Pennsylvania). Через день после выделения добавляли 20 единиц/мл IL-2, и на 5 день тестировали способность указанных клеток убивать клетки-мишени в любом из стандартных анализов высвобождения 51Cr.
Клонирование посредством лимитирующего разведения
Клоны CTL создавали из выделенных культур способом лимитирующего разведения в 96-луночных планшетах с использованием облученных PBMC в качестве питающих клеток в присутствии 40 ед./мл IL-2 и 1 мкг/мл ФГА в X-vivo с 5% HS. Свежую среду и IL-2 добавляли к клонам каждые 3-4 дня.
Анализ цитотоксичности
Обычные анализы высвобождения [51Cr] в отношении опосредованной CTL цитотоксичности осуществляли, как описано в других публикациях. Клетками-мишенями были клетки T2 в присутствии или в отсутствие соответствующего пептида, HLA-A2-позитивная линия клеток рака молочной железы MDA-MB-231 и HLA-A2-негативная линия клеток рака молочной железы ZR75-1. Обе линии клеток рака молочной железы экспрессировали Bcl-2, как исследовано обратной транскрипцией-ПЦР (данные не показаны).
Результаты
CTL-ответы против полученных из Bcl-2 пептидов
Чтобы исследовать, присутствуют ли Bcl-2-специфичные T-клетки также в PBL от пациентов с лейкозом, авторы исследовали PBL от десяти HLA-A2-позитивных пациентов с CLL и трех пациентов с AML в отношении реактивности против двух пептидов bcl208 и bcl214. Bcl-2-ответы имели место у пяти пациентов с CLL и двух пациентов с AML (фиг.3). Кроме того, авторы исследовали PBL из двух злокачественных опухолей поджелудочной железы и выявили, что у обоих пациентов имел место CTL-ответ против пептидов bcl208 и bcl214 (фигура 3). Подобным образом исследовали PBL от 12 здоровых HLA-A2-позитивных людей. Неожиданно выявили слабый CTL-ответ против пептида bcl208 у одного из здоровых людей (данные не показаны).
Bcl-2-специфичное высвобождение гранзима B в PBL
Используя ELISPOT GrB, авторы исследовали то, обладают ли bcl-2-специфичные T-клетки, выявленные в PBL, цитотоксической функцией. Соответственно PBL от трех bcl-2-реактивных пациентов с раком молочной железы (пациенты No: 19, 20 и 22) анализировали в отношении реактивности против двух эпитопов bcl208 и bcl214 (фиг.4). У всех трех пациентов ответы против обоих пептидов можно было выявить с частотой примерно 50-140 специфичных для пептида CTL на 105 PBL. В качестве контроля авторы включили пациента (пациент No. 16), у которого авторы могли выявить только ответ против bcl172, но не против bcl208 и bcl214 в анализе ELISPOT INF-γ, и контроль в виде здорового человека (h1). Как и предполагалось, не выявлено высвобождения GrB против bcl208 или bcl214 ни у пациента с раком молочной железы No. 16, ни в случае здорового контроля.
Функциональная способность Bcl-2-реактивных CTL
Чтобы дополнительно охарактеризовать функциональную способность Bcl-2-реактивных CTL, проводили обогащение по указанным клеткам с помощью магнитных шариков, покрытых комплексами HLA-A2/bcl208, как описано. Клетки однократно стимулировали пептидом in vitro перед выделением. Небольшую часть выделенных клеток клонировали посредством лимитирующего разведения. Размножающиеся культуры исследовали в отношении узнавания клеток T2 либо в отсутствие пептида, либо импульсно обработанных bcl208 в ELISPOT GrB. Несколько из полученных клонов проявляли специфичное узнавание импульсно обработанных
bcl208 клеток T2 (данные не показаны). Однако, к сожалению, авторы не могли размножить указанные клоны для дальнейшего анализа.
Через день после выделения к оставшимся клеткам добавляли IL-2 и на 5 день тестировали способность клеток убивать нагруженные пептидом клетки T2 в стандартном анализе высвобождения 51Cr. С этой целью либо ненагруженные клетки T2, либо клетки T2, нагруженные пептидом bcl208, служили в качестве мишеней. Указанный анализ выявил, что были убиты только клетки T2, импульсно обработанные bcl208 (фиг.5a). Указанные обогащенные и стимулированные in vitro bcl208-реактивные T-клетки далее использовали для тестирования способности убивать HLA-A2-позитивные экспрессирующие Bcl-2 клетки рака молочной железы линии MDA-MB-231. Обогащенные T-клетки эффективно лизировали клетки MDA-MB-231, тогда как в отличие от этого не наблюдали цитотоксичности, направленной против экспрессирующих Bcl-2, HLA-A2-негативных клеток рака молочной железы линии ZR75-1 (фиг.5b).
Пример 3
Иммуногенность Bcl-X(L) у пациентов со злокачественной опухолью
Сущность
В данном примере авторы показывают, что Bcl-XL является мишенью для узнавания T-клетками у пациентов со злокачественной опухолью. Соответственно авторы описывают спонтанные ограниченные по HLA-A2 и HLA-A3 цитотоксические T-клеточные ответы против пептидных эпитопов, полученных из Bcl-XL, с помощью ELISPOT и окрашивания с проточной цитометрией. Таким образом, клеточные иммунные ответы против ингибиторов апоптоза, подобных белкам семейства Bcl-2, по-видимому, представляют собой общее явление при злокачественной опухоли, и следовательно, данная группа белков представляет собой привлекательные универсальные белки-мишени для противоопухолевой иммунотерапии. Кроме того, поскольку повышенная экспрессия указанных белков в клетках коррелирует с лекарственной резистентностью, то комбинирование иммунотерапии с цитотоксической химиотерапией является очень привлекательным способом лечения злокачественной опухоли.
Введение
Противоапоптозный белок Bcl-XL продуцируется из длинной формы альтернативного сплайсинга гена bcl-x, тогда как проапоптозный Bcl-XS происходит из короткой формы альтернативного сплайсинга того же гена. Bcl-XL играет важную роль в злокачественной опухоли, так как он был непосредственно связан с резистентностью к обычным формам терапии и плохим прогнозом. Функциональное ингибирование Bcl-XL восстанавливает процесс апоптоза и делает неопластические клетки чувствительными к химической и лучевой терапии, тогда как обработка линий злокачественных клеток так, чтобы они экспрессировали высокие уровни Bcl-XL, приводит к фенотипу множественной лекарственной резистентности. Сообщалось о повышенной экспрессии Bcl-XL во множестве разных злокачественных опухолей, включая AML и множественную миелому, а также солидные злокачественные опухоли, подобные раку мочевого пузыря, раку молочной железы, раку поджелудочной железы и меланоме.
Идеальными мишенями для иммунотерапии являются продукты генов, молчащих в нормальных тканях, сверхэкспрессируемых в злокачественных клетках и непосредственно вовлеченных в жизнеспособность злокачественных клеток и прогрессирование.
Материалы и способы
Пациенты
Лимфоциты периферической крови (PBL) собирали от пациентов, страдающих от злокачественной опухоли различного происхождения, и от здоровых людей в качестве контроля, и выделяли, используя разделение Lymphoprep, типировали по HLA (Department of Clinical Immunology, University Hospital, Copenhagen, Denmark) и замораживали в FCS с 10% ДМСО. Ни один из пациентов не получал иммунотерапию перед отбором образцов крови. От пациентов получали согласие на основе предоставленной информации перед любым из указанных измерений.
Проточная цитометрия (FACS)
PBL от пациента с раком молочной железы однократно стимулировали in vitro соответствующим пептидом и на седьмой день выделяли клетки CD8+ из PBL, используя CD8-негативный набор для выделения Dynal (Dynal Biotech ASA, Oslo, Norway). Полученную в результате CD8-позитивную культуру T-клеток красили связанными с PE пентамерами MHC Pro5TM (Prolmmune, Oxford, UK) с последующим окрашиванием антителами с использованием связанных с флуорохромом мАт: CD8-APC и CD3-ФИТЦ (Becton Dickinson, Immunocytometry Systems, San Jose, CA). Оба окрашивания осуществляли в PBS + 2% FCS в течение 30 мин при 4°C в темноте. Использовали комплексы пентамеров MHC Pro5TM: HLA-A2/Bcl-XL173-182 (YLNDHLEPWI) (SEQ ID NO: 42) и HLA-A2/pol476-484 HIV-1 (ILKEPVHGV) (SEQ ID NO: 39). Образцы анализировали в FACS BD, используя компьютерную программу DIVA (BD, San Jose, CA).
Результаты
Спонтанные CTL-ответы против полученных из Bcl-X L пептидов
Ген bcl-x транскрибируется в две мРНК посредством альтернативного сплайсинга. Противоапоптозный белок Bcl-XL продуцируется из длинной формы альтернативного сплайсинга, тогда как проапоптозный Bcl-XS происходит из короткой формы альтернативного сплайсинга данного гена. Белковый продукт более крупного BCL-XL отличается от белка Bcl-XS областью инсерции (аминокислоты 126-188). Таким образом, чтобы выяснить, является ли Bcl-XL природной мишенью для T-клеток у пациентов со злокачественной опухолью, авторы тщательно исследовали данную область инсерции (включая девять аминокислот на каждом конце) в отношении предполагаемых HLA-A2-эпитопов, используя основные специфичные для HLA-A2 якорные остатки. Затем авторы синтезировали семь рассчитанных на основе Bcl-XL пептидов (Bcl-XL158-166 (EMQVLVSRI) (SEQ ID NO: 44), Bcl-XL118-126 (TAYQSFEQV) (SEQ ID NO: 43), Bcl-XL173-182 (YLNDHLEPWI) (SEQ ID NO: 42), Bcl-XL165-174 (RIAAWMATYL) (SEQ ID NO: 45), Bcl-XL169-178 (WMATYLNDHL) (SEQ ID NO: 46), Bcl-XL161-170 (VLVSRIAAWM) (SEQ ID NO: 48), Bcl-XL141-150 (VAFFSFGGAL) (SEQ ID NO: 49)) и тщательно исследовали PBL от пациентов HLA-A2+ со злокачественной опухолью разного происхождения с помощью ELISPOT против указанных пептидов. Ранее было показано, что данный способ является высокоэффективным для идентификации специфичных для опухоли CTL у пациентов со злокачественной опухолью. Действительно, сильные и имеющие высокую частоту CTL-ответы выявляли против четырех из исследованных пептидов (Bcl-XL173-182, Bcl-XL141-150, Bcl-XL161-170 и Bcl-XL165-174) у пациентов со злокачественной опухолью разного происхождения (фиг.6). В общем, у пятнадцати из восемнадцати пациентов HLA-A2+ с раком молочной железы имел место иммунный ответ против по меньшей мере одного из указанных четырех пептидов Bcl-XL (отвечающих индивидуумов определяли по среднему количеству антиген-специфичных клеток ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов). Подобным образом четыре из шести исследованных пациентов с меланомой и один из двух исследованных пациентов с раком поджелудочной железы имели иммунный ответ против по меньшей мере одного их указанных четырех пептидов. Таким образом, девять из восемнадцати исследованных пациентов с раком молочной железы имели иммунный ответ против Bcl-XL173-182, в то время как два из шести исследованных пациентов с меланомой HLA-A2+ имели иммунный ответ против данного пептида (фиг.6a). Четыре из восемнадцати исследованных пациентов с раком молочной железы имели иммунный ответ против Bcl-XL141-150, в то же время авторы выявили ответы в PBL от одного из двух исследованных пациентов с раком поджелудочной железы. Авторы не смогли выявить ответ в PBL ни от одного из пяти исследованных пациентов с меланомой против данного пептида (фиг.6b). Подобным образом авторы выявили ответ в PBL от шести пациентов с раком молочной железы и одного исследованного пациента с раком поджелудочной железы против Bcl-XL161-170 (фиг.6c). Наконец, четыре пациента с раком молочной железы, два пациента с меланомой и один пациент с раком поджелудочной железы имели ответ против Bcl-XL165-174 (фиг.6d). В качестве контроля исследовали PBL от 12 здоровых людей HLA-A2+. Важно, что не выявлено ответов против любого из пептидов Bcl-XL173-182, Bcl-XL141-150,
Bcl-XL161-170 или Bcl-XL165-174 ни у одного из здоровых людей (фиг.6).
Специфичное для Bcl-X L высвобождение гранзима B в PBL
Используя ELISPOT GrB, авторы оценивали то, обладают ли Bcl-XL-специфичные T-клетки, выявленные в PBL, цитотоксической функцией. Таким образом, PBL от двух Bcl-XL-реактивных пациентов с раком молочной железы (пациенты No. 35 и 36) анализировали в отношении реактивности против Bcl-XL173-182 (фиг.7). У обоих пациентов можно было выявить ответы против Bcl-XL173-182 с частотой примерно 50-100 специфичных в отношении пептида CTL на 3 x 105 клеток. В качестве контроля авторы включали пациента (пациент No. 17), у которого авторы могли выявить ответ только против Bcl-XL141-150, но не против Bcl-XL173-182 в ELISPOT INF-γ. Как ожидалось, не выявлено высвобождения GrB против Bcl-XL173-182 у пациента с раком молочной железы No. 17.
FACS-анализы специфичных в отношении Bcl-X L T-клеток
Спонтанное появление специфичных в отношении Bcl-XL173-182 CTL в PBL от пациентов с раком молочной железы далее оценивали, используя FACS-анализы и окрашивание пентамером MHC Pro5TM. PBL от пациента с раком молочной железы No. 36 однократно стимулировали in vitro пептидом и выделяли CD8-позитивные клетки. Полученную культуру окрашивали комплексом пентамера HLA-A2/BCL-X. FACS-анализы выявили легко обнаруживаемую популяцию позитивных по пентамеру T-клеток, составляющих 0,24% T-клеток CD8+ (фиг.8a). Для сравнения, среди тех же самых T-клеток CD8+ наблюдали примерно 1,4% специфичных в отношении Bcl-XL173-182 секретирующих IFN-γ T-клеток CD8+ при анализе с помощью ELISPOT (фиг.8c).
Дополнительные ограниченные по HLA-A2 эпитопы Bcl-X(L)
Авторы тщательно исследовали PBL от пациентов HLA-A2+ со злокачественными опухолями разного происхождения с помощью ELISPOT против Bcl-XL118-126 (TAYQSFEQV) (SEQ ID NO: 43) (фиг.9a) и Bcl-XL169-178 (WMATYLNDHL) (SEQ ID NO: 46) (фиг.9b), идентифицируя слабый спонтанный CTL-ответ у пациентов со злокачественными опухолями разного происхождения против обоих пептидов.
Ограниченные по HLA-A3 ответы против Bcl-X(L)
Кроме того, авторы тщательно исследовали область инсерции (включая девять аминокислот на каждом конце) в отношении предполагаемых HLA-A3-эпитопов, используя основные HLA-A3-специфичные якорные остатки. Затем авторы синтезировали два пептида: Bcl-XL165-173 (RIAAWMATY) (SEQ ID NO: 50) и Bcl-XL149-157 (ALCVESVDK) (SEQ ID NO: 51). Затем авторы тщательно исследовали PBL от пациентов HLA-A3+ со злокачественными опухолями разного происхождения с помощью ELISPOT против пептида Bcl-XL165-173 (RIAAWMATY) (SEQ ID NO:50) и Bcl-XL149-157 (ALCVESVDK) (SEQ ID NO: 51). Ранее было показано, что данный способ является высокоэффективным для идентификации специфичных в отношении опухоли CTL у пациентов со злокачественной опухолью. Действительно, сильные и имеющие высокую частоту CTL-ответы выявляли против Bcl-XL165-173 (RIAAWMATY) (SEQ ID N0: 50) у пациентов со злокачественными опухолями разного происхождения. Авторы смогли выявить ответ против Bcl-XL165-173 в PBL HLA-A3+ у четырех из пяти исследованных пациентов с раком молочной железы (отвечающих индивидуумов определяют по среднему количеству антиген-специфичных клеток ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов), у четырех из четырех исследованных пациентов с меланомой, двух из двух исследованных пациентов с раком поджелудочной железы, а также у одного из четырех исследованных пациентов с множественной миеломой (фиг.10). Важно, что авторы не могли выявить ответ ни у одного из семи здоровых людей HLA-A3+, которых исследовали в качестве контролей (фиг.10).
Пример 4
Иммуногенность Mcl-1 у пациентов со злокачественной опухолью
Сущность
В данном примере авторы показывают, что Mcl-1 является мишенью для узнавания T-клетками у пациентов со злокачественной опухолью. Соответственно авторы описывают спонтанные ограниченные по HLA-A1 и HLA-A3 цитотоксические T-клеточные ответы против пептидных эпитопов, полученных из Mcl-1, с помощью ELISPOT.
Введение
Миелоидный клеточный фактор-1 (Mcl-1) является ингибирующим гибель представителем семейства Bcl-2, который экспрессируется при ранней дифференцировке моноцитов и может повышать жизнеспособность при трансфекции в незрелые миелоидные клетки. Mcl-1 у трансгенных мышей стимулирует выживаемость ряда типов гематопоэтических клеток и иммортализацию миелоидных клеток. Сообщалось о повышенных уровнях Mcl-1 в ряде злокачественных опухолей человека, включая пациентов с раком простаты, раком поджелудочной железы, меланомой, раком молочной железы, раком яичника и раком шейки матки, а также с B-клеточным хроническим лимфоцитарным лейкозом (B-CLL) и AML и ALL при рецидиве. У пациентов с B-CLL высокие уровни Mcl-1 строго коррелируют с невозможностью достичь полной ремиссии после терапии одним лекарственным средством. При множественной миеломе Mcl-1 играет важную роль в жизнеспособности злокачественных клеток. В этой связи показано, что у мышей, экспрессирующих трансген mcl-1 под контролем своего собственного промотора, с высокой частотой развиваются B-клеточные неоплазии в диапазоне от фолликулярной лимфомы до диффузной крупноклеточной лимфомы.
Ограниченные по HLA-A3 ответы против Mсl-1
Чтобы выяснить, является ли Mcl-1 природной мишенью для T-клеток у пациентов со злокачественной опухолью, авторы исследовали последовательность белка в отношении большинства возможных нона- и декамерных пептидных эпитопов HLA-A3, используя основные HLA-A3-специфичные якорные остатки. Затем авторы синтезировали шесть рассчитанных на основе Mcl-1 пептидов (Mc1-1185-194 (YLREQATGAK) (SEQ ID NO: 52), Mcl-1293-302 (SITDVLVRTK) (SEQ ID NO: 53), Mcl-1267-276 (LISFGAFVAK) (SEQ ID NO: 54), Mcl-195-103 (RLLFFAPTR) (SEQ ID NO: 55), Mcl-1300-308 (RTKRDWLVK) (SEQ ID NO: 56), Mcl-1236-244 (DIKNEDDVK) (SEQ ID NO: 57)) и тщательно исследовали PBL от пациентов HLA-A3+ со злокачественными опухолями разного происхождения в отношении реактивности против указанных пептидов, отдавая преимущество анализу ELISPOT. Ранее было показано, что данный способ является высокоэффективным для идентификации специфичных в отношении опухоли CTL у пациентов со злокачественной опухолью. Действительно, сильные и имеющие высокую частоту CTL-ответы выявили против двух полученных из Mcl-1 пептидов у пациентов со злокачественной опухолью различного происхождения (Mcl-195-103 и Mcl-1300-303) (фиг.11). В общем, пять из шести исследованных пациентов HLA-A3+ с раком молочной железы имели иммунный ответ против одного из указанных двух пептидов Mcl-1. Соответственно пять пациентов с раком молочной железы имели ответ против Mcl-195-103 (отвечающих индивидуумов определяют по среднему количеству антиген-специфичных клеток ± Ѕ стандартного отклонения > 25 на 105 лимфоцитов) и три пациента имели ответ против Mcl-1300-308 (фигура 11). Кроме того, два из двух исследованных пациентов HLA-A3+ с раком поджелудочной железы имели иммунный ответ против пептида Mcl-195-103, при этом один из них также реагировал против Mcl-1300-308. Кроме того, авторы исследовали PBL от шести пациентов, страдающих от B-CLL, и идентифицировали ответ против Mcl-195-103 у двух из указанных пациентов. В качестве контроля исследовали PBL от 10 здоровых людей HLA-A3+. Важно, что не выявлено ответов ни против пептида Mcl-195-103, ни против пептида Mcl-1300-308 ни у одного из здоровых доноров (фиг.11). Подобным образом не выявлено ответов против ни одного из дополнительных четырех полученных из Mcl-1 пептидов ни у одного из пациентов со злокачественными опухолями и ни у здоровых доноров в контроле (данные не показаны).
Ограниченные по HLA-A1 ответы против Mcl-1
Чтобы выяснить, является ли Mcl-1 природной мишенью для T-клеток у пациентов со злокачественной опухолью, авторы исследовали последовательность белка в отношении большинства возможных нона- и декамерных пептидных эпитопов HLA-A1, используя основные HLA-A1-специфичные якорные остатки. Затем авторы синтезировали четыре рассчитанных на основе Mcl-1 пептида (Mcl-1166-175 (PAEEEEDDLY) (SEQ ID NO: 58), Mcl-1121-129 (SPEEELDGY) (SEQ ID NO: 59), Mcl-1177-185 (QSLEIISRY) (SEQ ID NO: 60), Mcl-1339-347 (AGVGAGLAY) (SEQ ID NO: 61)) и тщательно исследовали PBL от пациентов HLA-A1+ со злокачественными опухолями разного происхождения в отношении реактивности против указанных пептидов, отдавая преимущество анализу ELISPOT. Действительно, CTL-ответы выявляли против двух полученных из Mcl-1 пептидов у пациентов со злокачественными опухолями разного происхождения (Mcl-1166-175 и Mcl-1177-185) (фиг.12). А общем, трое из четырех исследованных пациентов HLA-A1+ с раком молочной железы имели иммунный ответ против Mc1-1177-185 и один из них, кроме того, имел ответ против Mcl-1166-175 (фиг.12). Кроме того, один из семи пациентов с меланомой имел иммунный ответ против пептида Mcl-1177-185, а другой из них имел ответ против Mcl-1166-175. В качестве контроля исследовали PBL от шести здоровых людей HLA-A1+. Важно, что не выявлено ответов ни против пептида Mc1-1166-175, ни против пептида Mcl-1177-185 ни у одного из здоровых доноров (фиг.12).
Ответы на модифицированные пептиды
Иммуногенность ограниченного по HLA-A3 пептида Mcl-1300-308 увеличивали заменой треонина в положении 2 более хорошим якорным остатком HLA-A3, а именно лейцином (Mcl-1300-308L2 (RLKRDWLVK) (SEQ ID NO: 62)). Спонтанные иммунные ответы выявили у двух пациентов с раком молочной железы против Mcl-1300-308L2 (данные не показаны). Подобным образом, чтобы создать более иммуногенный эпитоп, авторы модифицировали ограниченный по HLA-A1 пептид Mcl-1177-185 (QSLEIISRY)(SEQ ID NO: 60) в положении 3, создавая два пептида
Mcl-1177-185D3 (QSDEIISRY) (SEQ ID NO: 63) и Mcl-1177-185E3 (QSEEIISRY) (SEQ ID NO: 64).
Обсуждение
Почти все злокачественные новообразования характеризуются дефектами передачи сигналов апоптоза. Это делает злокачественные клетки резистентными к эндогенным апоптозным стимулам, а также к экзогенным стимулам, таким как химиотерапевтические лекарственные средства и облучение. Дефектный апоптоз, наблюдаемый в злокачественных опухолях человека, часто возникает в результате сверхэкспрессии противоапоптозных белков семейства белков Bcl-2, т.е. Bcl-2, Bcl-XL, и Mcl-1, Bcl-w, Bfl-1A1, Bcl-b и Bcl2-L-10. Использование ингибиторов таких апоптозных белков в целях вакцинации имеет преимущество вследствие понижающей регуляции или отсутствия экспрессии указанных белков, так некоторые формы ускользания от иммунного надзора могут нарушать устойчивый рост опухоли, так как для выживания опухолевых клеток требуются функционально активные представители семейства Bcl-2. Для способов терапии, целенаправленно воздействующих на антигены, которые играют важную роль в отношении роста и жизнеспособности опухолевых клеток, селекция дефицитных по антигену опухолей является общеизвестным ограничением. Кроме того, так как повышенная экспрессия белков семейства Bcl-2 в клетках коррелирует с лекарственной резистентностью, комбинация основанной на семействе Bcl-2 иммунотерапии с цитотоксической химиотерапией является очень привлекательным способом лечения злокачественной опухоли.
Авторы сканировали белки Bcl-2, Bcl-X(L) и Mcl-1 в отношении наличия связывающих пептидных мотивов и использовали их для поиска специфичных T-клеточных ответов у пациентов со злокачественной опухолью. С этой целью выявляли спонтанную T-клеточную реактивность против всех представителей семейства Bcl-2 у пациентов, страдающих от опухолей неродственных типов, т.е. рака поджелудочной железы, рака молочной железы, меланомы, AML и CLL, с помощью ELISPOT. Наличие специфичных для Bcl-XL клеток CD8+ в PBL от пациентов со злокачественными опухолями подтверждали окрашиваниями CD8/пентамером при FACS-анализе. Полученные данные, вместе взятые, показывают, что CTL-определенные эпитопы из указанных белков могут быть широко применимы для терапевтических вакцинаций против злокачественной опухоли и поэтому имеют важное иммунотерапевтическое значение.
Кроме того, одиннадцать пациентов с раком молочной железы имели Bcl-2-специфичные CTL, восемь из указанных пациентов ранее получали лечение по меньшей мере одним типом химиотерапии. У двух пациентов (пациенты No. 14 и 17) не выявлялись CTL-ответы к четырем разным пептидам Bcl-2. Оба пациента ранее получали антигормональную терапию, но не получали химиотерапию. Подобным образом, авторы не могли выявить никаких ответов у пациентов с первичной локализованной злокачественной опухолью молочной железы перед химиотерапией. Таким образом, у пациентов с раком молочной железы Bcl-2-ответы выявляли только у пациентов, которые получали химиотерапию. Хотя опухолевая нагрузка может играть важную роль, это может свидетельствовать о том, что иммунные ответы вызваны или увеличены как следствие индуцированного лечением увеличения экспрессии Bcl-2. Это указывает на сценарий, при котором комбинирование основанной на семействе Bcl-2 иммунотерапии с цитотоксической химиотерапией может синергически улучшать степени данного ответа. Данных о состоянии лечения пациентов, исследованных в отношении Bcl-X(L)- и Mcl-1-ответов, не имеется.
В настоящем исследовании авторы отдали преимущество анализу ELISPOT GrB, чтобы показать, что Bcl-2- или Bcl-X(L)-специфичные CTL в PBL пациентов действительно являются цитотоксическими эффекторными клетками. Чтобы дополнительно подтвердить это представление, авторы провели обогащение Bcl-2-реактивными T-клетками из PBL пациента и показали, что полученная в результате линия T-клеток обладала способностью лизировать импульсно обработанные пептидом клетки T2-клетки в обычном анализе высвобождения 51Cr. Кроме того, указанная линия Bcl-2-реактивных T-клеток обладала способностью убивать совпадающую по HLA линию клеток рака молочной железы, не убивая при этом HLA-A2-негативные клетки-мишени. Полученные данные показывают, что злокачественные клетки действительно процессируют и представляют пептид Bcl-2 в контексте молекулы HLA-A2. Наконец, авторы смогли клонировать указанные выделенные клетки и показали, что они высокоспецифически реагировали против пептидного эпитопа Bcl-2.
В том случае, когда пептиды, полученные из антигенов дифференцировки меланоцитов, впервые использовали для лечения пациентов с меланомой IV стадии, предполагалось, что это могло привести к выраженному разрушению меланоцитов, что, в свою очередь, могло бы проявиться клинически, например, в виде витилиго или ретинита. Однако клинический опыт показал, что частота появления витилиго у пациентов, получавших вакцинации, не была существенно выше, чем частота ассоциированной с меланомой гипопигментации у пациентов, получавших другие формы терапии. Кроме того, не сообщалось о серьезных побочных эффектах при различных испытаниях вакцинации против аутоантигенов. Полученные авторами данные, вместе взятые, подтверждают, что клеточные иммунные ответы против группы белков семейства Bcl-2 являются общим признаком при злокачественной опухоли. При попытке максимизировать воздействие иммунотерапии привлекательный способ мог бы заключаться в том, чтобы учитывать профиль экспрессии и прогностическое значение выбранной мишени при конкретном заболевании или патологическом состоянии, подвергаемом лечению. Таким образом, в то время как в некоторых злокачественных опухолях или конкретном состоянии болезни наблюдается совместная экспрессия Bcl-2, Mcl-1 и Bcl-XL, в других злокачественных опухолях наблюдается экспрессия только одного или другого белка. Таким образом, при некоторых заболеваниях, подобных раку яичника, экспрессия Mcl-1, но не экспрессия Bcl-2, связана с продвинутой стадией и плохой выживаемостью, и по этой причине Mcl-1 может быть основным антигеном, тогда как при таких заболеваниях, как CLL, при которых Bcl-2 и Mcl-1 совместно сверхэкспрессируются, одновременное целенаправленное воздействие на оба белка может представлять собой более эффективный способ, чем целенаправленное воздействие на одну любую молекулу. Подобным образом Tanaka et al. описали, что наличие другого белка ингибитора апоптоза - сурвивина в карциноме молочной железы строго связано с экспрессией Bcl-2 и с пониженным апоптозным индексом (AI) и плохой общей выживаемостью. Сходная связь между сурвивином и Bcl-2 описана при нейробластоме, раке желудка, раке прямой и ободочной кишки и неходжкинской лимфоме высокой злокачественности. Безопасность и потенциальная эффективность полученных из сурвивина пептидов при терапевтических вакцинациях против злокачественной опухоли в настоящее время исследуется в фазе I/II клинических испытаний (J. Becker, персональное сообщение). Таким образом, привлекательным иммунотерапевтическим способом может быть целенаправленное воздействие как на семейство белков Bcl-2, так и на сурвивин, тем более что они выполняют свою противоапоптозную функцию посредством разных клеточных путей.
Пример 5
Пептидная вакцина
Пептиды семейства белков Bcl-2 могут быть, например, синтезированы в устройстве UVA Biomolecular Core со свободным амидным NH2-концом и свободным кислотным COOH-концом. Каждый поставляется в виде лиофилизованного пептида, который затем перерастворяют в стерильной воде и разбавляют раствором лактата Рингера (LR, Baxter Healthcare, Deerfield, IL) в качестве буфера до конечной концентрации 67-80% лактата Рингера в воде. Затем полученные растворы стерильно фильтруют, помещают во флаконы из боросиликатного стекла и подвергают серии исследований в отношении гарантии качества, включающих подтверждение идентичности, стерильности, общей безопасности и чистоты в соответствии с руководствами FDA, как определено в IND 6453. Тесты на стабильность пептидов не показали снижения чистоты или концентрации пептида, когда указанные растворы пептидов хранили при -20°C в течение 3 лет.
На практике пациенты будут получать вакцину, содержащую примерно 100 мкг ограниченного по HLA класса I пептида вместе с ограниченным по HLA класса II хелперным пептидом или без него. Пациентов, например, вакцинируют примерно 100 мкг пептида HLA класса I в адъюванте отдельно или, например, вакцинируют примерно 100 мкг ограниченного по HLA класса I пептида плюс 190 мкг ограниченного по классу II хелперного пептида. Рассчитывают более высокую дозу вспомогательного пептида, чтобы обеспечить эквимолярные количества хелперных и цитотоксических эпитопов. Кроме того, пациентов можно вакцинировать более длинным пептидом, содержащим аминокислотные последовательности обоих пептидов.
Указанные выше пептиды в водном растворе объемом 1 мл можно вводить либо в виде раствора/суспензии примерно с 100 мкг QS-21, либо в виде эмульсии примерно с 1 мл адъюванта Montanide ISA-51.
Пациентов иммунизируют, например, в 0 день и в 1, 2, 3, 6, 9, и 12 месяц пептидами плюс адъювант, используя всего семь иммунизаций. За редким исключением вакцинации проводят в ту же самую руку каждой вакциной. Пептиды предпочтительно вводят подкожно.
ССЫЛКИ
1. Altieri, D. С., Marchisio, P. С., and Marchisio, C. Survivin apoptosis: an interloper be-tween cell death and cell proliferation in cancer. Lab Invest, 79: 1327-1333, 1999.
2. Andersen, M. H., L. Tan, I. Sondergaard, J. Zeuthen, T. Elliott. and J. S. Haurum. 2000. Poor correspondence between predicted and experimental binding of peptides to class I MHC molecules. Tissue Antigens 55:519.
3. Reed, J. C. 1998. Bcl-2 family proteins. Oncogene 17:3225.
4. Andersen, M. H., L. O. Pedersen, J. C. Becker, and P. thor Straten. 2001. Identification of a Cytotoxic T Lymphocyte Response to the Apoptose Inhibitor Protein Survivin in Cancer Patients. Cancer Res. 61:869.
5. Thumer, В., Roder, C., Dieckmann, D., Heuer, M., Kruse, M., Glaser, A., Keikavoussi, P., Kampgen, E., Bender, A., and Schuler, G. (1999) Generation of large numbers of fully mature and stable dendritic cells from leukapheresis products for clinical application. J.Immunol.Methods 223, 1.
6. Shangary S. and Johnson D.E. (2003). Recent advances in the development of anticancer agents targeting cell death inhibitors in the Bcl-2 protein family. Leukemia 17:1470-1482.
7. Rosenberg S.A. and Dudley M.E. (2004). Cancer regression in patients with metastatic melanoma after the transfer of autologous antitumor lymphocytes. PNAS 101:14639-14645.
















| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА НА ОСНОВЕ ПЕПТИДОВ СУРВИВИНА | 2006 |
|
RU2396088C2 |
| ПЕПТИДЫ MPHOSPH1 И ВАКЦИНЫ, ВКЛЮЧАЮЩИЕ ИХ | 2012 |
|
RU2612905C2 |
| ПЕПТИДЫ UBE2T И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2013 |
|
RU2663350C2 |
| ПЕПТИДЫ KNTC2 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2014 |
|
RU2671395C2 |
| ПЕПТИДЫ ТОРК И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2012 |
|
RU2633503C2 |
| ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2600888C2 |
| ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2733985C2 |
| ПЕПТИДЫ ТЕМ8 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2008 |
|
RU2498993C2 |
| ПЕПТИД CDCA1 И ВКЛЮЧАЮЩЕЕ ЕГО ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО | 2008 |
|
RU2486195C2 |
| ПЕПТИДНЫЕ ВАКЦИНЫ ДЛЯ РАКОВ, ЭКСПРЕССИРУЮЩИХ ОПУХОЛЕСПЕЦИФИЧЕСКИЕ АНТИГЕНЫ | 2008 |
|
RU2464275C2 |
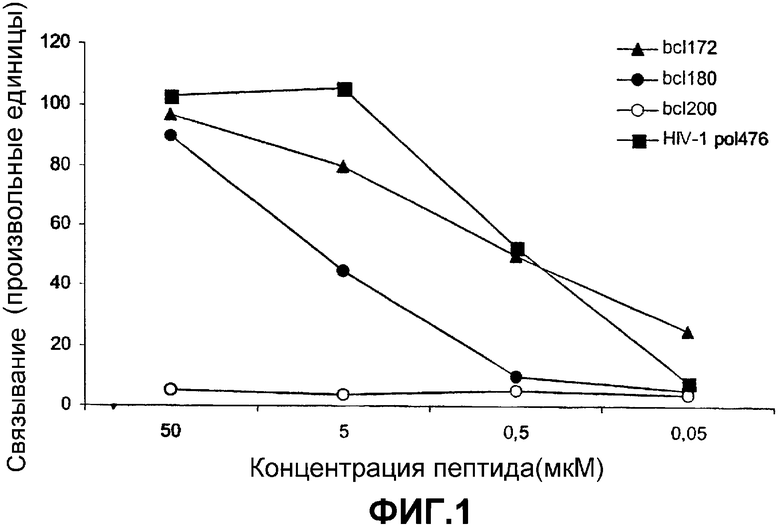
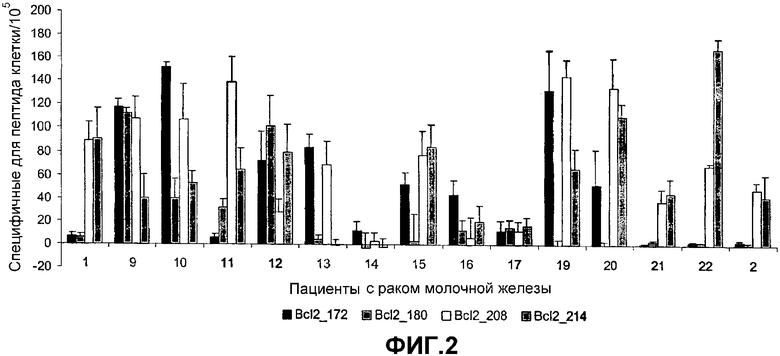
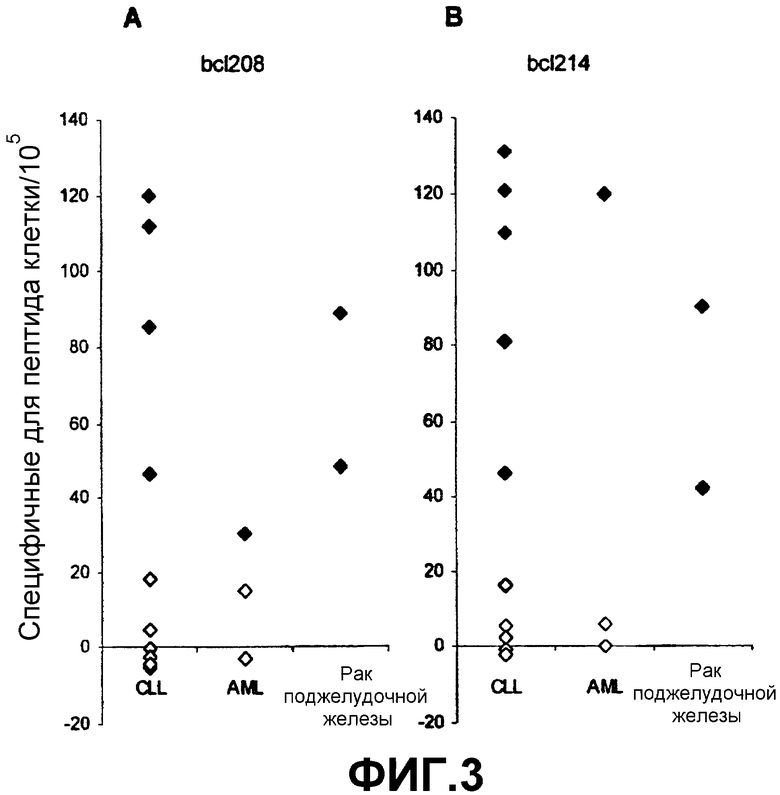
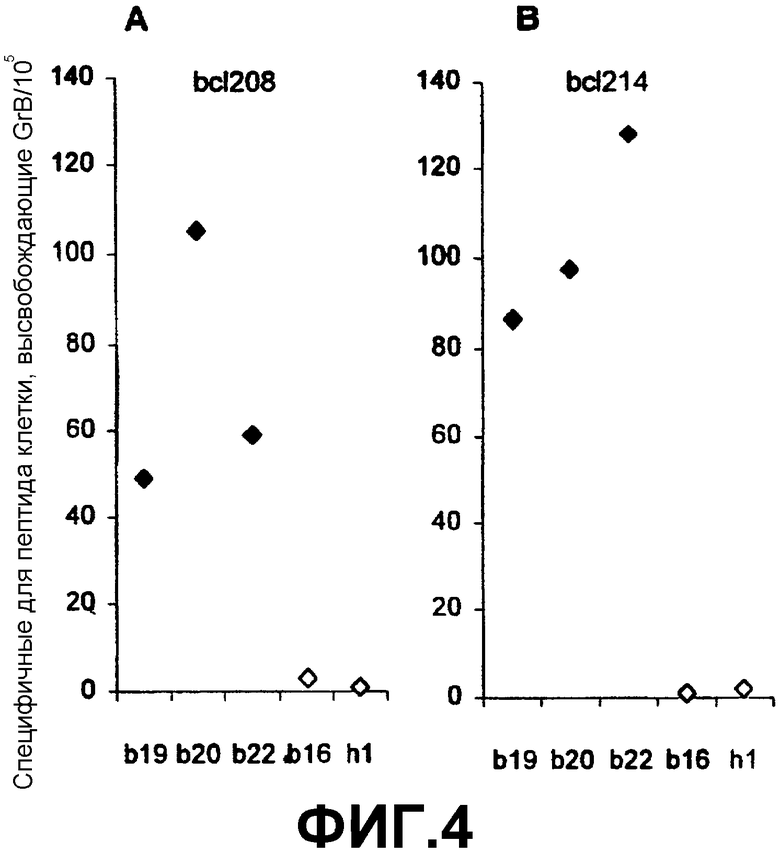
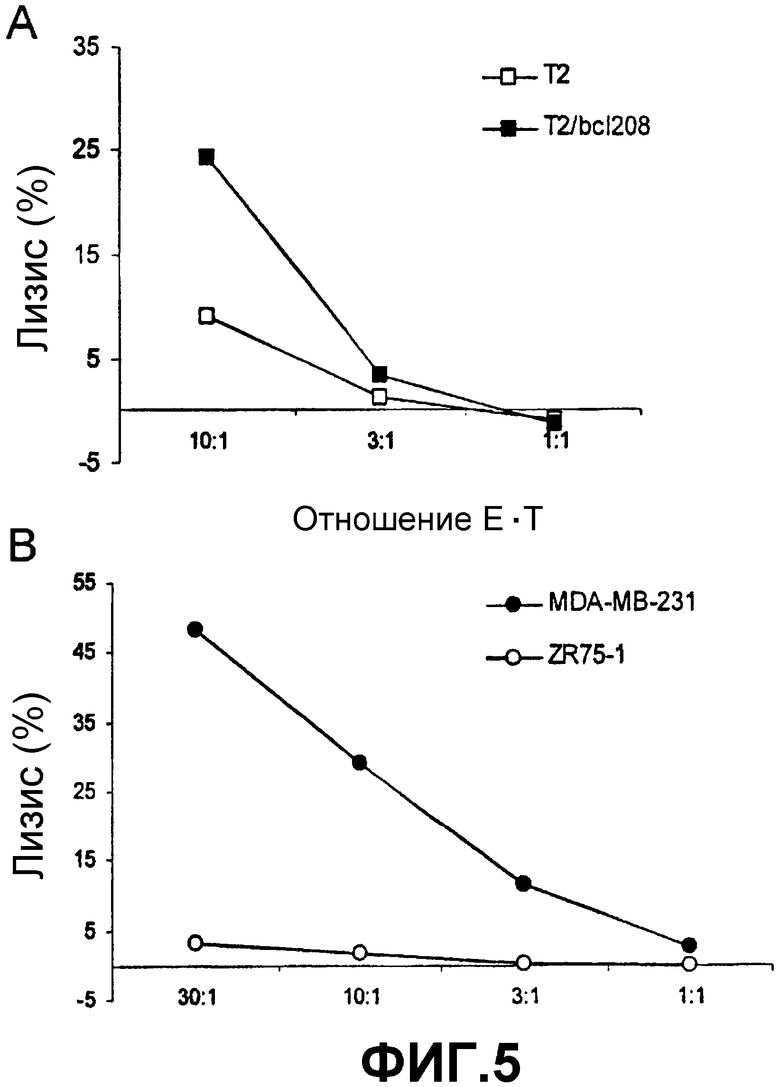
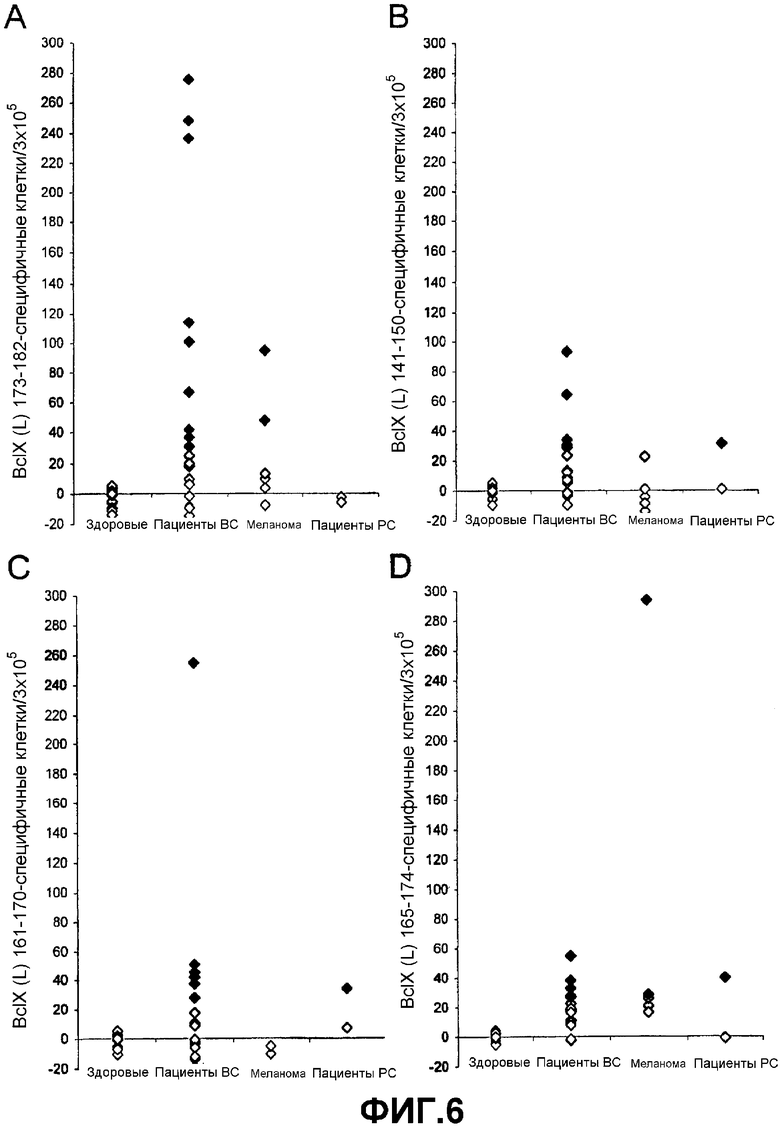
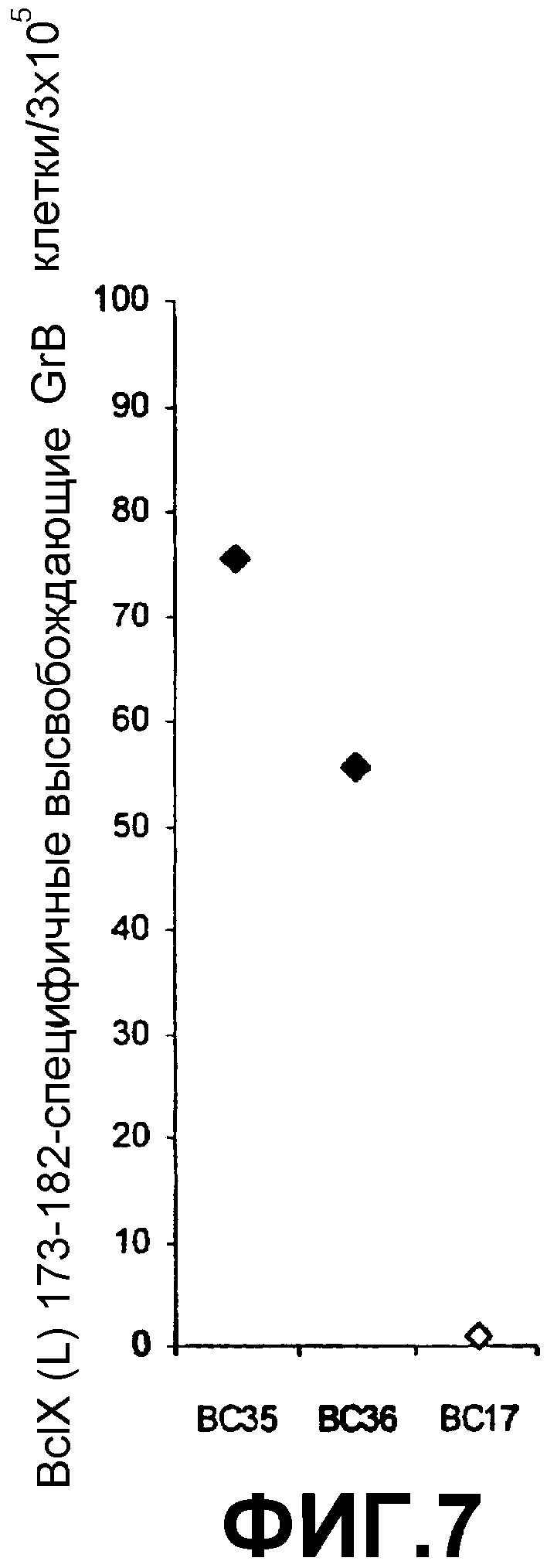
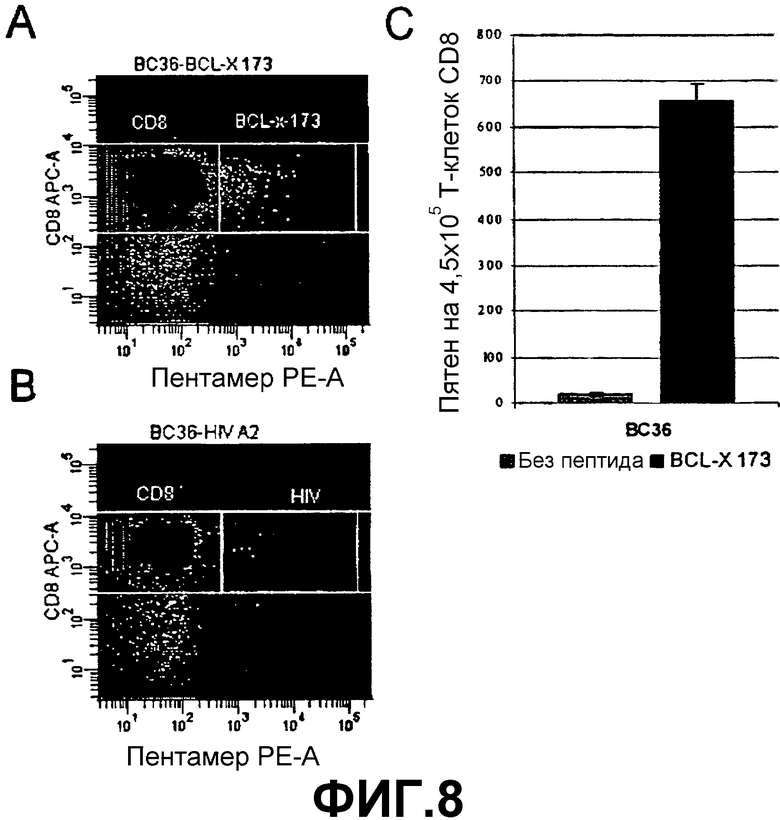
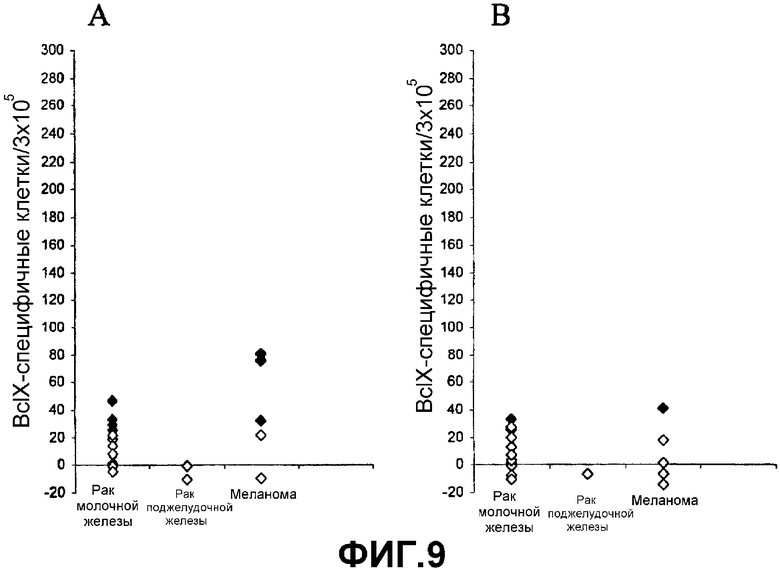
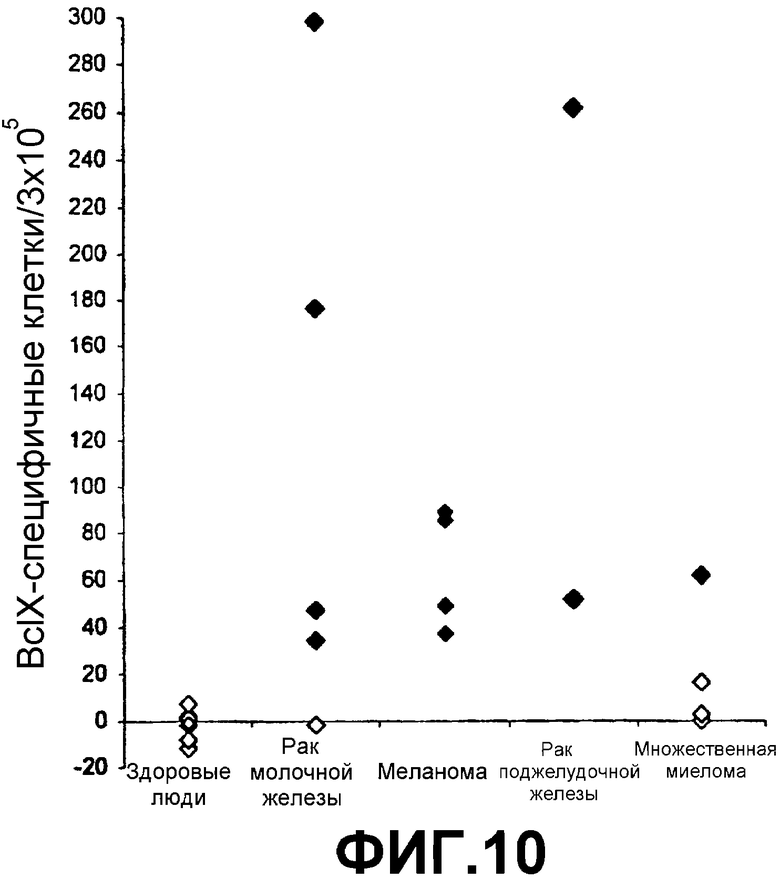
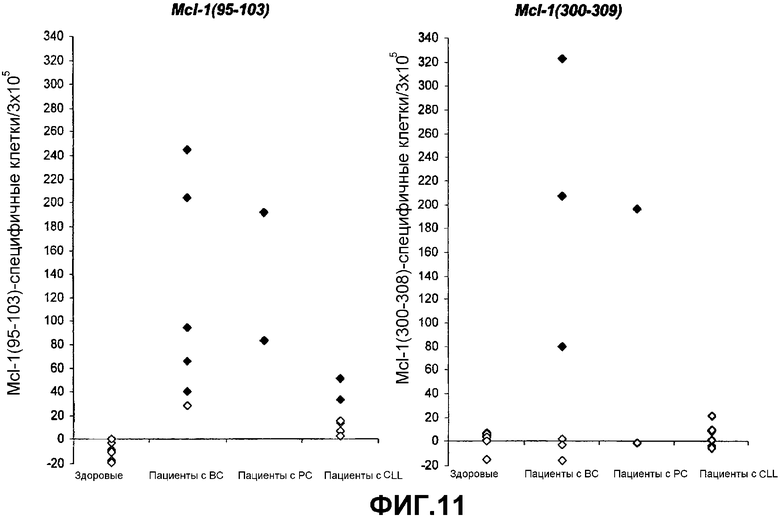
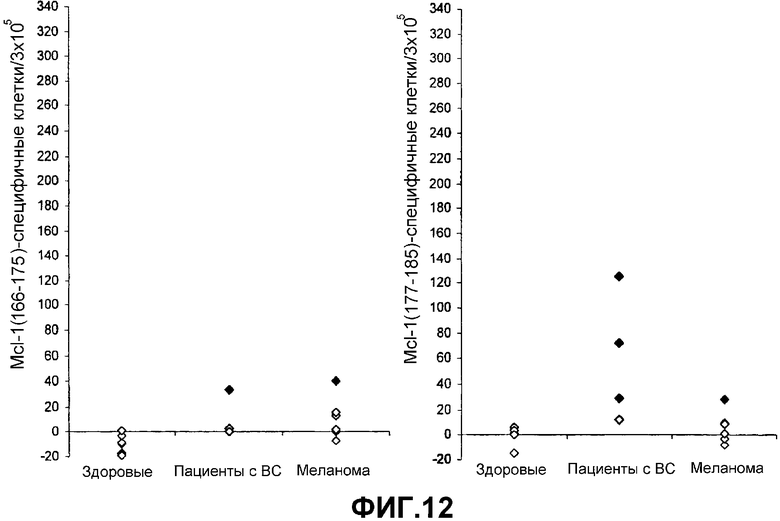
Изобретение относится к области медицины и касается белков, относящихся к семейству Bcl-2, их фрагментов, а также к их применению для пациентов со злокачественной опухолью. Сущность изобретения заключается в том, что заявленные белки и пептидные фрагменты, в частности, применимы в композициях вакцин для лечения злокачественной опухоли. Изобретение, кроме того, относится к способам лечения с применением указанных композиций. Также аспектом изобретения является получение Т-клеток и рецепторов Т-клеток, специфически узнающих заявленные белки и пептидные фрагменты. Преимущество изобретения заключается в повышении эффективности лечения опухолевых заболеваний. 11 н. и 50 з.п. ф-лы, 2 табл., 12 ил.
1. Композиция вакцины, содержащая изолированный иммуногенно активный пептид размером не более 15 аминокислотных остатков, полученный из члена семейства белков Bcl-2, где указанный пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, 8,10, 11, 42, 43, 45, 46, 48, 49, 50, 55, 56, 58, 60 и 62, для применения в качестве лекарственного средства для лечения злокачественных опухолей, экспрессирующих член семейства белков Bcl-2.
2. Композиция по п.1, которая при введении пациенту со злокачественной опухолью способна вызывать иммунный ответ против злокачественного заболевания.
3. Композиция по п.1, которая при введении пациенту со злокачественной опухолью, в которой экспрессируется член семейства белков Bcl-2, способна вызывать иммунный ответ против злокачественного заболевания.
4. Композиция вакцины по п.3, в которой белком является Bcl-2.
5. Композиция вакцины по п.3, в которой белком является Bcl-XL.
6. Композиция вакцины по п.3, в которой белком является Mcl-1.
7. Изолированный иммуногенно активный пептидный фрагмент размером не более 15 аминокислотных остатков, полученный из члена семейства белков Bcl-2, где указанный пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, 8, 10, 11, 42, 43, 45, 46, 48, 49, 50, 55, 56, 58, 60 и 62, для применения в качестве лекарственного средства для лечения злокачественной опухоли, экспрессирующей белок-член семейства белков Bcl-2.
8. Пептидный фрагмент по п.7, в котором белком является Bcl-2.
9. Пептидный фрагмент по п.7, в котором белком является Bcl-XL.
10. Пептидный фрагмент по п.7, в котором белком является Mcl-1.
11. Пептидный фрагмент по любому из пп.7-10, который способен вызывать клеточный иммунный ответ у пациента со злокачественной опухолью.
12. Пептидный фрагмент по любому из пп.7-10, который является пептидом, ограниченным МНС класса I, имеющим по меньшей мере один из следующих характерных признаков:
(i) способен связываться с молекулой HLA класса I, которым он ограничен, с аффинностью, измеряемой по количеству пептида, которое способно обеспечить полумаксимальное извлечение молекулы HLA класса (значение С50), составляющей не более 50 мкм на основании определения в описанном здесь анализе связывания при сборке,
(ii) способен вызывать появление клеток, продуцирующих INF-γ, в популяции лимфоцитов периферической крови (PBL) пациента со злокачественной опухолью, с частотой по меньшей мере 1 на 104 PBL, которую определяют в анализе ELISPOT, и/или
(iii) способен обеспечивать выявление in situ в опухолевой ткани цитотоксических лимфоцитов (CTL), которые реактивны в отношении пептидного эпитопа.
13. Пептидный фрагмент по п.12, имеющий значение С50, которое составляет не более 30 мкм.
14. Пептидный фрагмент по п.12, имеющий значение C50, которое составляет не более 20 мкм.
15. Пептидный фрагмент по п.12, ограниченный молекулой HLA-A класса I MHC.
16. Пептидный фрагмент по п.15, ограниченный типом HLA класса I MHC, выбранным из группы, состоящей из HLA-A1, HLA-A2, HLA-A3, HLA-A11 и HLA-A24.
17. Пептидный фрагмент по п,16, который ограничен HLA-A2.
18. Пептидный фрагмент по любому из пп.7-17, который содержит последовательность, выбранную из группы, состоящей из WLSLKTLLSL (SEQ ID NO: 6), PLFDFSWLSL (SEQ ID NO: 8), YLNRHLHTWI (SEQ ID NO: 10) и NIALWMTEYL (SEQ ID NO: 11).
19. Пептидный фрагмент по любому из пп.7-17, где пептид содержит последовательность, выбранную из группы, состоящей из TAYQSFEQV (SEQ ID NO: 43), YLNDHLEPWI (SEQ ID NO: 42), RIAAWMATYL (SEQ ID NO: 45), WMATYLNDHL (SEQ ID NO: 46), VLVSRIAAWM (SEQ ID NO: 48) и VAFFSFGGAL (SEQ ID NO: 49).
20. Пептидный фрагмент по любому из пп.7-17, где пептид содержит последовательность RIAAWMATY (SEQ ID NO: 50).
21. Пептидный фрагмент по любому из пп.7-17, где пептид содержит последовательность, выбранную из группы, состоящей из RLLFFAPTR (SEQ ID NO: 55) и RTKRDWLVK (SEQ ID NO: 56).
22. Пептидный фрагмент по любому из пп.7-17, где пептид содержит последовательность, выбранную из группы, состоящей из PAEEEEDDLY (SEQ ID NO: 58) и QSLEIISRY (SEQ ID NO: 60).
23. Пептидный фрагмент по любому из пп.7-17, где пептид выбран из группы, состоящей из RLKRDWLVK (SEQ ID NO: 62).
24. Пептидный фрагмент по любому из пп.7-17, который является нанопептидом или декапептидом.
25. Белок или пептидный фрагмент по любому из пп.7-24, который является нативной последовательностью, выделенной или полученной из млекопитающего.
26. Белок или пептидный фрагмент по любому из пп.7-24, который является нативной последовательностью, выделенной из человеческого белка.
27. Пептидный фрагмент по любому из пп.7-26, который получен из нативной последовательности члена семейства белков Bcl-2 путем замены, делеции или добавления по меньшей мере одного аминокислотного остатка.
28. Пептидный фрагмент по любому из пп.7-27, который способен вызывать появление клеток, продуцирующих INF-γ, в популяции PBL пациента со злокачественной опухолью с частотой по меньшей мере 10 на 104 PBL.
29. Пептидный фрагмент по любому из пп.7-28, который способен вызывать появление клеток, продуцирующих INF-γ, в популяции PBL пациента, имеющего злокачественное заболевание, при котором экспрессируется белок, относящийся к семейству белков Bcl-2.
30. Пептидный фрагмент по п.29, в котором злокачественное заболевание выбрано из группы, состоящей из гематопоэтической злокачественной опухоли, включая хронический лимфолейкоз и хронический миелолейкоз, меланомы, рака молочной железы, рака шейки матки, рака яичника, рака легкого, рака ободочной кишки, рака поджелудочной железы и рака простаты.
31. Композиция вакцины по п.1, содержащая пептидный фрагмент по любому из пп.7-30.
32. Композиция вакцины по п,31, вызывающей у вакцинируемого пациента продукцию эффекторных Т-клеток, обладающих цитотоксическим действием против злокачественных клеток.
33. Композиция вакцины по п.31, дополнительно содержащая иммуногенный белок или пептидный фрагмент, выбранный из белка или пептидного фрагмента, не относящегося или не полученного из семейства белков Bcl-2.
34. Композиция вакцины по п.33, где белком или пептидным фрагментом, не относящимся к семейству белков Bcl-2 или не полученным из этого семейства, является белок, участвующий в регуляции клеточного апоптоза, или полученный из него пептидный фрагмент.
35. Композиция вакцины по п.33, где иммуногенным белком или пептидным фрагментом, выбранным из белка или пептидного фрагмента, не относящегося к семейству белков Bcl-2 или не полученного из этого семейства, является сурвивин или его пептидный фрагмент.
36. Композиция вакцины по п.33, где иммуногенным белком или пептидным фрагментом, выбранным из белка или пептидного фрагмента, не относящегося к семейству белков Bcl-2 или не полученного из этого семейства, является ML-IAP или его пептидный фрагмент.
37. Композиция вакцины по п.31, содержащая адъювант.
38. Композиция вакцины по п.37, где адъювант выбран из группы, состоящей из адъювантов, на основе бактериальной ДНК, адъювантов на основе масла/поверхностно-активного вещества, адъювантов на основе вирусной днРНК и имидазохинилинов.
39. Композиция вакцины по п.31, содержащая антигенпредставляющие клетки, содержащие пептидный фрагмент.
40. Композиция вакцины по п.39, где антигенпредставляющей клеткой является дендритная клетка.
41. Композиция вакцины по п.31, содержащая липосому.
42. Набор, содержащий композицию вакцины по любому из пп.1-6 и 31-41 и дополнительное противоопухолевое средство.
43. Набор по п.42, в котором противоопухолевым средством является антитело.
44. Набор по п.42, в котором противоопухолевым средством является цитокин.
45. Композиция для диагностики ex vivo или in situ наличия у пациента со злокачественной опухолью Т-клеток в PBL или в опухолевой ткани, которые являются реактивными в отношении представителя семейства белков Вс1-2, при этом композиция содержит пептидный фрагмент по любому из пп.7-30.
46. Диагностический набор для диагностики ех vivo или in situ наличия у пациента со злокачественной опухолью Т-клеток в PBL или в опухолевой ткани, которые являются реактивными в отношении представителя семейства белков Всl-2, при этом набор содержит пептидный фрагмент по любому из пп.7-30.
47. Комплекс пептидного фрагмента по любому из пп.7-30 и молекулы HLA класса I или фрагмента такой молекулы для применения в качестве диагностического реагента.
48. Комплекс по п.47, который является мономерным.
49. Комплекс по п,47, который является мультимерным.
50. Способ выявления у пациента со злокачественной опухолью наличия Т-клеток, реактивных в отношении члена семейства белков Всl-2, предусматривающий приведение опухолевой ткани или образца крови в контакт с комплексом по п.47 и выявление связывания комплекса с тканью или клетками крови.
51. Молекула, которая способна специфически связываться с пептидным фрагментом по любому из пп.7-30, где указанная молекула является антителом или его фрагментом, или рецептором Т-клеток.
52. Способ лечения злокачественного заболевания, при котором экспрессируется член семейства белков Всl-2, предусматривающий введение пациенту, страдающему от указанного заболевания, эффективного количества композиции по любому из пп.1-6 и 31-41 или набора по любому из пп.42-44.
53. Способ по п.52, где злокачественное заболевание выбрано из группы, состоящей из гематопоэтической злокачественной опухоли, включая хронический лимфолейкоз и хронический миелолейкоз, меланомы, рака молочной железы, рака шейки матки, рака яичника, рака легкого, рака ободочной кишки, рака поджелудочной железы и рака простаты.
54. Способ по п.52, который комбинируют с дополнительным лечением злокачественной опухоли.
55. Способ по п.54, где дополнительное лечение выбрано из группы, состоящей из химиотерапии, лучевой терапии, лечения иммуностимулирующими веществами, генной терапии, лечения антителами и лечения с использованием дендритных клеток.
56. Применение пептидного фрагмента по любому из пп.7-30 или композиции вакцины по любому из пп.1-6 и 31-41 в производстве лекарственного средства для лечения или профилактики злокачественного заболевания, при котором экспрессируется член семейства белков Bcl-2.
57. Применение по п.56, согласно которому злокачественное заболевание выбрано из группы, состоящей из гематопоэтической злокачественной опухоли, включая хронический лимфолейкоз и хронический миелолейкоз, меланомы, рака молочной железы, рака шейки матки, рака яичника, рака легкого, рака ободочной кишки, рака поджелудочной железы и рака простаты.
58. Применение по п.57, которое комбинируют с дополнительным лечением злокачественной опухоли.
59. Применение по п.58, где дополнительное лечение выбрано из группы, состоящей из химиотерапии, лучевой терапии, лечения иммуностимулирующими веществами, генной терапии, лечения антителами и лечения с использованием дендритных клеток.
60. Способ мониторинга иммунизации пептидным фрагментом по любому из пп.7-30 или вакцинной композицией по любому из пп.1-6 и 31-41, предусматривающий стадии
i) получения образца крови от индивидуума,
ii) получения белка, относящегося к семейству белков Bcl-2, или его пептидного фрагмента,
iii) определения того, содержит ли указанный образец крови антитела или Т-клетки, содержащие рецепторы Т-клеток, специфически связывающие белок или пептид,
iv) определения таким образом, того, повышен ли иммунный ответ к указанному белку или лептиду у указанного индивидуума.
61. Способ по п.60, где пептидным фрагментом является пептидный фрагмент по любому из пп.7-30.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| US 5856171 A, 05.01.1999 | |||
| AKATSUKA Y | |||
| et al., Identification a polymorphic gene, BCL2A1, encoding two novel hematopoietic lineage-specific minor histocompatibility antigens, J | |||
| Exp | |||
| Med., 2003 June 2, v.197, №11, pp.1489 - 1500 | |||
| SCHMIDT S.M | |||
| et al., Survivin is a shared tumor-associated antigen expressed in a broad | |||
Авторы
Даты
2009-09-20—Публикация
2004-11-18—Подача