Область техники
По настоящей заявке испрашивается приоритет Предварительной заявки США № 61/210512, поданной 18 марта 2009 г., полное содержание которой приведено в настоящем документе в качестве ссылки.
Настоящее изобретение относится к области биологической науки, более конкретно - к области терапии злокачественных опухолей. В частности, настоящее изобретение относится к новым пептидам, являющимся чрезвычайно эффективными в качестве противораковых вакцин и лекарственных средств для лечения и предотвращения опухолей.
Предпосылки изобретения
Показано, что CD8-положительные CTL узнают пептиды-эпитопы, происходящие из опухолеассоциированных антигенов (TAA), на молекуле главного комплекса гистосовместимости (MHC) класса I, и затем уничтожают клетки опухолей. Со времени открытия семейства антигенов меланомы (MAGE) как первого примера TAA множество других TAA открыто иммунологическими способами (NPL 1/Boon T, Int J Cancer 1993 May 8, 54(2):177-80; NPL 2/Boon T & van der Bruggen P, J Exp. Med. 1996 Mar 1, 183(3):725-9), и некоторые из TAA в настоящее время находятся в процессе клинической разработки в качестве иммунотерапевтических мишеней.
Идентификация новых TAA, индуцирующих сильные и специфические противоопухолевые иммунные ответы, обеспечивает дальнейшее развитие клинического применения способа пептидной вакцинации при различных типах злокачественных опухолей (NPL 3/Harris C.C, J Natl. Cancer Inst 1996 Oct 16, 88(20):1442-55; NPL 4/Butterfield L.H. et al., Cancer Res 1999 Jul 1, 59(13): 3134-42; NPL 5/Vissers J.L. et al., Cancer Res 1999 Nov 1, 59(21):5554-9; NPL 6/van der Burg S.H. et al., J Immunol. 1996 May 1, 156(9):3308-14; NPL 7/Tanaka F. et al., Cancer Res 1997 Oct 15, 57(20):4465-8; NPL 8/Fujie T. et al., Int J Cancer 1999 Jan 18, 80(2):169-72; NPL 9/Kikuchi M. et al., Int J Cancer 1999 May 5, 81(3):459-66; NPL 10/Oiso M. et al., Int J Cancer 1999 May 5, 81(3):387-94). До настоящего времени опубликовано несколько клинических исследований с использованием этих пептидов, происходящих из опухолеассоциированных антигенов. К сожалению, только низкую частоту объективных ответов можно наблюдать в этих исследованиях противораковых вакцин до настоящего времени (NPL 11/Belli F et al., J Clin. Oncol. 2002 Oct 15, 20(20):4169-80; NPL 12/Coulie PG et al., Immunol. Rev 2002 Oct, 188:33-42; NPL 13/Rosenberg SA et al., Nat. Med. 2004 Sep, 10(9):909-15).
Преимущественные в качестве мишени для иммунотерапии TAA являются необходимыми для пролиферации и выживаемости клеток злокачественных опухолей, поскольку применение таких TAA может минимизировать хорошо описанный риск ускользания от иммунного ответа клеток злокачественных опухолей, связанного с делецией, мутацией или понижающей регуляцией TAA в качестве последствия терапевтически направляемого иммунного отбора.
С другой стороны, подобный эндонуклеазе Nei VIII белок 3 (NEIL3) выделили в качестве члена, принадлежащего к классу ДНК-гликозилаз, гомологичных семейству бактериальных Fpg/Nei (NPL 14/Bandaru et al., DNA Repair (Amst). 2002 Jul 17; 1(7):517-29). Эти гликозилазы инициируют первую стадию в эксцизионной репарации оснований посредством расщепления оснований, поврежденных реакционноспособными видами кислорода, и введения разрыва цепи ДНК посредством ассоциированной лиазной реакции. NEIL3, по-видимому, играет роль в механизме репарации ДНК, однако его связь с канцерогенезом не выяснена.
Список ссылок
Непатентная литература
[NPL 1] Boon T, Int J Cancer 1993 May 8, 54(2):177-80
[NPL 2] Boon T. & van der Bruggen P, J Exp. Med. 1996 Mar 1, 183(3):725-9
[NPL 3] Harris C.C, J Natl. Cancer Inst 1996 Oct 16, 88(20):1442-55
[NPL 4] Butterfield L.H et al., Cancer Res 1999 Jul 1, 59(13):3134-42
[NPL 5] Vissers J.L. et al., Cancer Res 1999 Nov 1, 59(21):5554-9
[NPL 6] van der Burg S.H. et al., J Immunol. 1996 May 1, 156(9):3308-14
[NPL 7] Tanaka F. et al., Cancer Res 1997 Oct 15, 57(20):4465-8
[NPL 8] Fujie T. et al., Int J Cancer 1999 Jan 18, 80(2):169-72
[NPL 9] Kikuchi M. et al., Int J Cancer 1999 May 5, 81(3):459-66
[NPL 10] Oiso M. et al., Int J Cancer 1999 May 5, 81(3):387-94
[NPL 11] Belli F. et al., J Clin. Oncol. 2002 Oct 15, 20(20):4169-80
[NPL 12] Coulie P.G. et al., Immunol. Rev 2002 Oct, 188:33-42
[NPL 13] Rosenberg S.A. et al., Nat Med 2004 Sep, 10(9):909-15
[NPL 14] Bandaru et al., DNA Repair (Amst). 2002 Jul 17; 1(7):517-29
Краткое изложение сущности изобретения
Настоящее изобретение основано, по меньшей мере, частично на открытии применимых мишеней для иммунотерапии. Поскольку TAA в основном узнаются иммунной системой как «свое», и, таким образом, часто не обладают иммуногенностью, открытие подходящих мишеней обладает чрезвычайной важностью. Как указано выше, NEIL3 (SEQ ID NO:45, кодируемый геном с инвентарным № в GenBank NM_018248 (например, SEQ ID NO:44)) идентифицирован как обладающий повышающей регуляцией в злокачественных опухолях, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, немелкоклеточный рак легкого (NSCLC), остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, мелкоклеточный рак легкого (SCLC), опухоль мягких тканей, острый миелоидный лейкоз (AML) и хронический миелоидный лейкоз (CML). Таким образом, NEIL3 является кандидатом на мишень для иммунотерапии злокачественных опухолей/опухолей.
Настоящее изобретение основано, по меньшей мере, частично на идентификации специфических пептидов-эпитопов продуктов генов NEIL3, обладающих способностью индуцировать CTL, специфические для NEIL3. Как подробно обсуждают ниже, мононуклеарные клетки периферической крови (PBMC), полученные от здорового донора, стимулировали с использованием связывания HLA-A*2402 или HLA-A*0201 с пептидами-кандидатами, происходящими из NEIL3. Получены линии CTL со специфической цитотоксичностью против положительных по HLA-A24 или HLA-A2 клеток-мишеней, сенсибилизированных каждым из пептидов-кандидатов. Эти результаты показывают, что эти пептиды представляют собой рестриктированные по HLA-A24 или HLA-A2 пептиды-эпитопы, которые могут индуцировать сильные и специфические иммунные ответы против клеток, экспрессирующих NEIL3. Кроме того, они показывают, что NEIL3 является сильно иммуногенным, и его эпитопы представляют собой эффективные мишени для иммунотерапии злокачественных опухолей/опухолей.
Соответственно, настоящее изобретение относится к выделенным пептидам, связывающимся с антигеном HLA, состоящим из NEIL3 (SEQ ID NO:45) или его иммунологически активных фрагментов. Ожидают, что эти пептиды обладают способностью индуцировать CTL, и их можно использовать для индукции CTL ex vivo или для введения субъекту для индукции иммунных ответов против злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, эндометриоз, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, SCLC и AML. Предпочтительно, эти пептиды представляют собой нонапептид или декапептид и, более предпочтительно, состоят из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-43. В частности, для пептидов, состоящих из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, показали сильную способность индуцировать CTL.
Пептиды по настоящему изобретению включают в себя пептиды, в которых одна, две или более аминокислот заменены, делетированы или добавлены, при условии, что модифицированные пептиды сохраняют исходную способность индуцировать CTL.
Кроме того, настоящее изобретение относится к выделенным полинуклеотидам, кодирующим любые пептиды по настоящему изобретению. Эти полинуклеотиды можно использовать для индукции или получения APC со способностью индуцировать CTL или с возможностью введения субъекту для индукции иммунных ответов против злокачественных опухолей, также как настоящие пептиды.
При введении субъекту настоящие пептиды являются представленными на поверхности APC и затем индуцируют CTL, нацеленные на соответствующие пептиды. Таким образом, один из аспектов настоящего изобретения относится также к композициям или веществам, включающим любые пептиды или полинуклеотиды по настоящему изобретению, для индукции CTL. Более того, композиции или вещества, включающие любые пептиды или полинуклеотиды, можно использовать для лечения и/или профилактики злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML, и/или предотвращения их послеоперационного рецидива. Таким образом, настоящее изобретение также относится к фармацевтическим композициям или веществам для лечения и/или профилактики злокачественных опухолей, и/или предотвращения их послеоперационного рецидива, включающим любые пептиды или полинуклеотиды по настоящему изобретению. Настоящие фармацевтические композиции или вещества могут включать APC или экзосомы, представляющие любой из настоящих пептидов, вместо/помимо настоящих пептидов или полинуклеотидов в качестве активных ингредиентов.
Пептиды или полинуклеотиды по настоящему изобретению могут индуцировать APC, представляющие на своей поверхности комплекс антигена HLA и настоящего пептида, например, посредством приведения APC, полученных от субъекта, в контакт с пептидом или введения полинуклеотида, кодирующего пептид по настоящему изобретению, в APC. Такие APC обладают сильной способностью индуцировать CTL против пептидов-мишеней и находят применение в иммунотерапии злокачественных опухолей. Таким образом, настоящее изобретение относится к способам индукции APC со способностью индуцировать CTL и к APC, полученным этими способами.
Настоящее изобретение также относится к способу индукции CTL, включающему в себя стадию совместного культивирования CD8-положительных клеток с APC или экзосомами, представляющими пептид по настоящему изобретению на своей поверхности, или стадию введения гена, включающего полинуклеотид, кодирующий полипептид субъединицы T-клеточного рецептора (TCR), связывающей настоящий пептид. CTL, полученные этими способами, могут находить применение для лечения и/или профилактики злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML. Таким образом, настоящее изобретение относится к CTL, полученным настоящими способами.
Более того, настоящее изобретение относится к способам индукции иммунного ответа против злокачественных опухолей, где способы включают в себя стадию введения композиций или веществ, включая полипептиды NEIL3 или их иммунологически активные фрагменты, полинуклеотиды, кодирующие полипептиды NEIL3, экзосомы или APC, представляющие полипептиды NEIL3.
Настоящее изобретение также относится к способу диагностики злокачественной опухоли, включая, в качестве неограничивающих примеров, злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML.
Настоящее изобретение можно применять для любых заболеваний, связанных со сверхэкспрессией NEIL3, таких как злокачественная опухоль, где примеры злокачественных опухолей включают в себя злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML.
Краткое описание фигур
[Фиг.1] На фиг.1 изображены фотографии, изображающие результаты анализа ELISPOT IFN-гамма для CTL, индуцированных с помощью пептидов, происходящих из NEIL3. Для CTL в лунке номер №8, стимулированных с помощью NEIL3-A2-9-585 (SEQ ID NO:3) (a), №2 - с помощью NEIL3-A2-9-127 (SEQ ID NO:4) (b), №4 и 5 - с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (c), №3 - с помощью NEIL3-A2-9-71 (SEQ ID NO:6) (d), №1 - с помощью NEIL3-A2-9-271 (SEQ ID NO:11) (e), №3 - с помощью NEIL3-A2-10-198 (SEQ ID NO:15) (f), №1 - с помощью NEIL3-A2-10-340 (SEQ ID NO:17) (g), №2 и 3 - с помощью NEIL3-A2-10-590 (SEQ ID NO:21) (h), №6 - с помощью NEIL3-A2-10-378 (SEQ ID NO:22) (i) и №9, 10, 12 и 13 - с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (для HLA-A0206) (j), показали сильную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих фигурах показывает, что клетки из соответствующей лунки размножали для получения линий CTL. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.2-1] На фиг.2-1 изображены линейные графики, показывающие продукцию IFN-гамма для линий CTL, стимулированных с помощью NEIL3-A2-585 (SEQ ID NO:3) (a), NEIL3-A2-9-127 (SEQ ID NO:4) (b), NEIL3-A2-9-416 (SEQ ID NO:5) (c)(d) и NEIL3-A2-9-71 (SEQ ID NO:6) (e), детектированную посредством анализа ELISA IFN-гамма. Они показывают, что для линий CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигурах «+» указывает на продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» указывает на продукцию IFN-гамма против клеток-мишеней не сенсибилизированных никакими пептидами.
[Фиг.2-2] На фиг.2-2 изображены линейные графики, показывающие продукцию IFN-гамма линий CTL, стимулированных с помощью NEIL3-A2-9-271 (SEQ ID NO:11) (f), NEIL3-A2-10-198 (SEQ ID NO:15) (g), NEIL3-A2-10-590 (SEQ ID NO:21) (h)(i) и NEIL3-A2-9-416 (SEQ ID NO:5) (для HLA-A0206) (j)(k), детектированную посредством анализа ELISA IFN-гамма. Показано, что для линий CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.3] На фиг.3 показана продукция IFN-гамма клонов CTL, полученных предельным разведением из линий CTL, стимулированных с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b), NEIL3-A2-10-198 (SEQ ID NO:15) (c), NEIL3-A2-10-590 (SEQ ID NO:21) (d) и NEIL3-A2-9-416 (SEQ ID NO:5) (e) (для HLA-A0206). Показано, что для клонов CTL, полученных стимуляцией с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b), NEIL3-A2-10-198 (SEQ ID NO:15) (c), NEIL3-A2-10-590 (SEQ ID NO:21) (d) и NEIL3-A2-9-416 (SEQ ID NO:5) (e) (для HLA-A0206), показали сильную продукцию IFN-гамма по сравнению с контролем. На фигуре «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b), NEIL3-A2-10-198 (SEQ ID NO:15) (c), NEIL3-A2-10-590 (SEQ ID NO:21) (d) и NEIL3-A2-9-416 (SEQ ID NO:5) (для HLA-A0206) (e), и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.4-1] На фиг.4 показаны линейные графики, показывающие специфическую активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*0201 или HLA-A*0206. Клетки COS7, трансфицированные геном HLA-A*0201, HLA-A*0206 или полноразмерного NEIL3, получали в качестве контроля. Для клонов CTL, полученных с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b) и NEIL3-A2-10-198 (SEQ ID NO:15) (c), показана специфическая активность CTL против клеток COS7, трансфицированных как NEIL3, так и HLA-A*0201 (черные ромбы). С другой стороны, не детектировали значительной специфической активности CTL против клеток-мишеней, экспрессирующих либо HLA (треугольники), либо NEIL3 (круги).
[Фиг.4-2] На фиг.4 изображены линейные графики, показывающие специфическую активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*0201 или HLA-A*0206. Клетки COS7, трансфицированные геном HLA-A*0201, HLA-A*0206 или полноразмерного NEIL3, получали в качестве контроля. Для клонов CTL, полученных с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (d) (для HLA-A0206), показана специфическая активность CTL против клеток COS7, трансфицированных как NEIL3, так и HLA-A*0206 (черные ромбы). С другой стороны, не детектировали значительной специфической активности CTL против клеток-мишеней, экспрессирующих либо HLA (треугольники), либо NEIL3 (круги).
[Фиг.5] На фиг.5 показаны фотографии, показывающие экспрессию NEIL3 при раке печени. На части A показана экспрессия NEIL3 в тканях при клиническом раке печени, оцененная полуколичественной RT-PCR. На части B показана экспрессия NEIL3 в линиях клеток HCC, оцененная полуколичественной RT-PCR.
[Фиг.6] На фиг.6 изображены фотографии, изображающие результаты анализа ELISPOT IFN-гамма для CTL, индуцированных с помощью пептидов, происходящих из NEIL3. Для CTL в лунке номер №7, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), №6 - с помощью NEIL3-A24-9-362 (SEQ ID NO:33) (b), №2 и №8 - с помощью NEIL3-A24-10-320 (SEQ ID NO:35) (c), №8 - с помощью NEIL3-A24-10-544 (SEQ ID NO:41) (d), №1 и №4 - с помощью NEIL3-A24-10-87 (SEQ ID NO:43) (e), показали сильную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих фигурах показывает, что клетки из соответствующей лунки размножали для получения линии CTL. В отличие от этого, в качестве типичного случая отрицательных данных, не показана специфическая продукция IFN-гамма из CTL, стимулированных с помощью NEIL3-A24-9-364 (SEQ ID NO:25) (f), против активированных пептидом клеток-мишеней. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.7] На фиг.7 изображены линейные графики, показывающие продукцию IFN-гамма для линий CTL, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), NEIL3-A24-9-362 (SEQ ID NO:33) (b), NEIL3-A24-10-320 (SEQ ID NO:35) (c), NEIL3-A24-10-544 (SEQ ID NO:41) (d) и NEIL3-A24-10-87 (SEQ ID NO:43) (e), детектированную посредством анализа ELISA IFN-гамма. Показано, что для линий CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.8] На фиг.8 изображены линейные графики, показывающие продукцию IFN-гамма для клонов CTL, полученных предельным разведением из линий CTL, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), NEIL3-A24-10-320 (SEQ ID NO:35) (b) и NEIL3-A24-10-544 (SEQ ID NO:41) (c). Они показывают, что для клонов CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигуре «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.9] На фиг.9 изображен линейный график, показывающий специфическую активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*2402. Клетки COS7, трансфицированные геном HLA-A*2402 или полноразмерного NEIL3, получали в качестве контрольных. Для клона CTL, полученного с помощью NEIL3-A24-9-545 (SEQ ID NO:24), показана специфическая активность CTL против клеток COS7, трансфицированных как NEIL3, так и HLA-A*2402 (черные ромбы). С другой стороны, не детектировали значительной специфической активности CTL против клеток-мишеней, экспрессирующих либо HLA-A*2402 (треугольники), либо NEIL3 (круги).
Описание вариантов осуществления
Хотя любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, можно использовать для практического осуществления или тестирования вариантов осуществления настоящего изобретения, в настоящее время описаны предпочтительные способы, устройства и материалы. Однако, до описания настоящих материалов и способов, следует понимать, что настоящее изобретение не является ограниченным конкретными размерами, формами, измерениями, материалами, способами, протоколами и т.д., описанными в настоящем документе, поскольку их можно менять, в соответствии с общепринятыми экспериментами и/или оптимизацией. Понятно также, что терминология, применяемая в описании, предназначена только для описания конкретных версий или вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который ограничен только прилагаемой формулой изобретения.
I. Определения
Варианты слов в единственном числе, как применяют в настоящем документе, означают «по меньшей мере один», если конкретно не указано иначе.
Термины «полипептид», «пептид» и «белок» используют в настоящем документе взаимозаменяемо, и они относятся к полимеру из остатков аминокислот. Термины применяют к аминокислотным полимерам, в которых один или более остаток(остатков) аминокислот могут представлять собой модифицированный остаток(остатки), или неприродный остаток(остатки), такой как искусственный химический миметик(и) соответствующей природной аминокислоты(аминокислот), также как к природным аминокислотным полимерам.
Термин «аминокислота», как применяют в настоящем документе, относится к природным и синтетическим аминокислотам, также как к аналогам аминокислот и миметикам аминокислот с функцией, сходной с функцией природных аминокислот. Аминокислота может представлять собой L-аминокислоту или D-аминокислоту. Природными аминокислотами являются аминокислоты, кодируемые генетическим кодом, также как аминокислоты, модифицированные после трансляции в клетках (например, гидроксипролин, гамма-карбоксиглутамат и O-фосфосерин). Словосочетание «аналог аминокислоты» относится к соединениям, обладающим такой же основной химической структурой (альфа-углеродный атом, связанный с водородом, карбокси-группой, аминогруппой и R-группой), как природная аминокислота, но обладающим одной или более модифицированной R группой(группами) или модифицированными остовами (например, гомосерин, норлейцин, метионин, сульфоксид, метионин-метил-сульфоний). Словосочетание «миметик аминокислоты» относится к химическим соединениям, обладающим различными структурами, но сходными функциями с главными аминокислотами.
Аминокислоты можно обозначать в настоящем документе их общеизвестными трехбуквенными символами или буквенными символами, рекомендованными Комиссией по Биохимической номенклатуре IUPAC-IUB.
Термины «ген», «полинуклеотиды», «нуклеотиды» и «нуклеиновые кислоты» используют взаимозаменяемо в настоящем документе и, если конкретно не указано иначе, они являются сходными с аминокислотами, обозначаемыми их общепринятыми однобуквенными кодами.
Если не определено иначе, термин «злокачественная опухоль» относится к злокачественным опухолям со сверхэкспрессией гена NEIL3, неограничивающие примеры которых включают в себя злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML.
Если не определено иначе, термины «цитотоксический T-лимфоцит», «цитотоксическая T-клетка» и «CTL» используют взаимозаменяемо в настоящем документе, и если конкретно не указано иначе, они относятся к подгруппе T-лимфоцитов, способных узнавать не свои клетки (например, клетки опухолей/злокачественных опухолей, инфицированные вирусом клетки) и индуцировать гибель таких клеток.
Если не определено иначе, термин «HLA-A24» относится к типу HLA-A24, содержащему подтипы, такие как HLA-A*2402.
Если не определено иначе, термин «HLA-A2», как применяют в настоящем документе, относится к репрезентативным подтипам, таким как HLA-A*0201 и HLA-A*0206.
Если не определено иначе, термин «набор», как применяют в настоящем документе, используют для обозначения комбинации реагентов и других материалов. В настоящем документе предусмотрено, что набор может включать в себя микромассив, чип, маркер и т.д. Не предусмотрено, что термин «набор» является ограниченным конкретной комбинацией реагентов и/или материалов.
Если не определено иначе, все технические и научные термины, применяемые в настоящем документе, обладают таким же значением, какое является общепринятым для специалиста в области, к которой относится настоящее изобретение.
II. Пептиды
Чтобы показать, что пептиды, происходящие из NEIL3, функционируют как антиген, узнаваемый CTL, пептиды, происходящие из NEIL3 (SEQ ID NO:45), анализировали, чтобы определить, являются ли они антигенными эпитопами, рестриктированными по HLA-A24 или A2, которые являются часто встречающимися аллелями HLA (Date Y et al., Tissue Antigens 47:93-101, 1996; Kondo A. et al., J Immunol. 155:4307-12, 1995; Kubo R.T. et al., J Immunol. 152:3913-24, 1994).
Кандидатов на связывающие HLA-A2 пептиды, происходящие из NEIL3, идентифицировали с использованием информации об аффинности их связывания с HLA-A2. Пептиды-кандидаты представляют собой пептиды, выбранные из группы, состоящей из SEQ ID NO:1-23.
Более того, после стимуляции T-клеток in vitro дендритными клетками (DC), сенсибилизированными (нагруженными) этими пептидами, CTL успешно получали с использованием каждого из следующих пептидов;
NEIL3-A2-9-585 (SEQ ID NO:3),
NEIL3-A2-9-127 (SEQ ID NO:4),
NEIL3-A2-9-416 (SEQ ID NO:5),
NEIL3-A2-9-71 (SEQ ID NO:6),
NEIL3-A2-9-271 (SEQ ID NO:11),
NEIL3-A2-10-198 (SEQ ID NO:15),
NEIL3-A2-10-340 (SEQ ID NO:17),
NEIL3-A2-10-590 (SEQ ID NO:21) и
NEIL3-A2-10-378 (SEQ ID NO:22).
Кандидатов на связывающие HLA-A24 пептиды, происходящие из NEIL3, идентифицировали на основании аффинности их связывания с HLA-A24. Пептиды-кандидаты представляют собой пептиды, выбранные из группы, состоящей из SEQ ID NO:24-43.
Более того, после стимуляции T-клеток in vitro дендритными клетками (DC), сенсибилизированными (нагруженными) этими пептидами, CTL успешно получали с использованием каждого из следующих пептидов;
NEIL3-A24-9-545 (SEQ ID NO:24),
NEIL3-A24-9-362 (SEQ ID NO:33),
NEIL3-A24-10-320 (SEQ ID NO:35),
NEIL3-A24-10-544 (SEQ ID NO:41) и
NEIL3-A24-10-87 (SEQ ID NO:43).
Для этих полученных CTL показали сильную специфическую активность CTL против клеток-мишеней, сенсибилизированных соответствующим пептидами. Эти результаты показывают, что NEIL3 является антигеном, узнаваемым CTL, и что тестированные пептиды представляют собой пептиды-эпитопы из NEIL3, рестриктированные по HLA-A24 или HLA-A2.
Поскольку ген NEIL3 сверхэкспрессирован в клетках злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML, и не экспрессирован в большинстве нормальных органов, он является хорошей мишенью для иммунотерапии злокачественных опухолей. Таким образом, настоящее изобретение относится к нонапептидам (пептидам, состоящим из девяти аминокислотных остатков) и декапептидам (пептидам, состоящим из десяти аминокислотных остатков) из узнаваемых CTL эпитопов из NEIL3. Альтернативно, настоящее изобретение относится к выделенным пептидам, которые связывают антигены HLA и индуцируют цитотоксические T лимфоциты (CTL), где пептид состоит из аминокислотной последовательности из SEQ ID NO:45 или представляет собой ее иммунологически активный фрагмент. Более конкретно, в некоторых вариантах осуществления, настоящее изобретение относится к пептидам, состоящим из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43.
Как правило, программное обеспечение, доступное в настоящее время, например, в Интернет, такое как описанное в Parker K.C. et al., J Immunol. 1994 Jan 1, 152(1):163-75 и Nielsen M. et al., Protein Sci 2003; 12:1007-17, можно использовать для расчета аффинностей связывания между различными пептидами и антигенами HLA in silico. Аффинность связывания с антигенами HLA можно измерять, как описано, например, в Parker K.C. et al., J Immunol. 1994 Jan 1, 152(1):163-75, Kuzushima K. et al., Blood 2001, 98(6):1872-81, Larsen M.V. et al. BMC Bioinformatics. 2007 Oct 31; 8:424, Buus S. et al. Tissue Antigens., 62:378-84, 2003, Nielsen M. et al., Protein Sci 2003; 12:1007-17 и Nielsen M. et al. PLoS ONE 2007; 2: e796, которые обобщены, например, в Lafuente E.M. et al., Current Pharmaceutical Design, 2009, 15, 3209-3220. Способы определения аффинности связывания описаны, например, в Journal of Immunological Methods, 1995, 185:181-190; Protein Science, 2000, 9:1838-1846. Таким образом, можно выбирать фрагменты, происходящие из NEIL3, обладающие высокой аффинностью связывания с антигенами HLA, с использованием такого программного обеспечения. Таким образом, настоящее изобретение относится к пептидам, состоящим из любых фрагментов, происходящих из NEIL3, которые можно определить как связывающиеся с антигенами HLA посредством таких известных программ. Более того, такие пептиды могут включать в себя пептид, состоящий из полноразмерного NEIL3.
Пептиды по настоящему изобретению могут быть фланкированы дополнительными аминокислотными остатками, при условии, что пептиды сохраняют свою способность индуцировать CTL. Дополнительные аминокислотные остатки могут состоять из любых видов аминокислот, при условии, что они не нарушают способность исходного пептида индуцировать CTL. Таким образом, настоящее изобретение относится к пептидам с аффинностью связывания с антигенами HLA, включая пептиды, происходящие из NEIL3. Такие пептиды составляют, например, менее приблизительно 40 аминокислот, часто менее приблизительно 20 аминокислот, обычно менее приблизительно 15 аминокислот.
В основном, известно, что модификации одной или нескольких аминокислот в пептиде не влияют на функцию пептида, или, в некоторых случаях, усиливают желаемую функцию исходного белка. Фактически, известно, что модифицированные пептиды (т.е. пептиды, состоящие из аминокислотной последовательности, модифицированной посредством замены, делеции или добавления одного, двух или более аминокислотных остатков к исходной контрольной последовательности) сохраняют биологическую активность исходного пептида (Mark et al., Proc. Natl. Acad. Sci USA 1984, 81:5662-6; Zoller and Smith, Nucleic Acids Res 1982, 10: 6487-500; Dalbadie-McFarland et al., Proc. Natl. Acad Sci USA 1982, 79:6409-13). Таким образом, в одном из вариантов осуществления настоящего изобретения, пептид, обладающий способностью индуцировать CTL по настоящему изобретению, может состоять из пептида, состоящего из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, где одна, две или даже более аминокислот добавлены, делетированы и/или заменены.
Специалисту в данной области понятно, что отдельные добавления, делеции или замены в аминокислотной последовательности, изменяющие отдельную аминокислоту или небольшой процент аминокислот, приводят к сохранению исходных свойств боковых цепей аминокислот; их, таким образом, обозначают как «консервативная замена» или «консервативная модификация», где изменение белка приводит к белку со сходными функциями. Таблицы консервативных замен, предоставляющие функционально сходные аминокислоты, хорошо известны в данной области. Примеры свойств боковых цепей аминокислот представляют собой гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T) и боковые цепи, обладающие следующими общими функциональными группами или характеристиками: алифатическая боковая цепь (G, A, V, L, I, P); содержащая гидроксильную группу боковая цепь (S, T, Y); содержащая атом серы боковая цепь (C, M); содержащая карбоновую кислоту и амид боковая цепь (D, N, E, Q); содержащая основание боковая цепь (R, K, H); и содержащая ароматическую группу боковая цепь (H, F, Y, W). Кроме того, каждая из следующих восьми групп содержит аминокислоты, представляющие собой консервативные замены друг для друга:
1) Аланин (A), Глицин (G);
2) Аспарагиновая кислота (D), Глутаминовая кислота (E);
3) Аспарагин (N), Глутамин (Q);
4) Аргинин (R), Лизин (K);
5) Изолейцин (I), Лейцин (L), Метионин (M), Валин (V);
6) Фенилаланин (F), Тирозин (Y), Триптофан (W);
7) Серин (S), Треонин (T); и
8) Цистеин (C), Метионин (M) (см., например, Creighton, Proteins 1984).
Такие пептиды с консервативной модификацией также рассматривают как пептиды по настоящему изобретению. Однако пептиды по настоящему изобретению не являются ограниченными ими и могут включать в себя неконсервативные модификации, при условии, что пептид сохраняет способность индуцировать CTL. Более того, модифицированные пептиды не исключают способные индуцировать CTL пептиды из полиморфных вариантов, межвидовых гомологов и аллелей NEIL3.
Для сохранения необходимой способности индуцировать CTL можно модифицировать (добавлять или заменять) небольшое число (например, 1, 2 или более) или небольшой процент аминокислот. В настоящем документе термин «несколько» означает 5 или менее аминокислот, например, 3 или менее. Процент подлежащих модификации аминокислот может составлять 20% или менее, например, 15% или менее, например, 10% или 1-5%.
Более того, в пептидах можно заменять или добавлять такие аминокислотные остатки, чтобы достигать более высокой аффинности связывания. При применении в иммунотерапии злокачественных опухолей, настоящие пептиды представлены на поверхности клетки или экзосомы в форме комплекса с антигеном HLA. В дополнение к пептидам, экспонированным естественным образом, поскольку закономерности последовательностей пептидов, экспонируемых посредством связывания с антигенами HLA, уже известны (J Immunol. 1994, 152:3913; Immunogenetics 1995, 41:178; J Immunol. 1994, 155:4307), модификации на основании этих закономерностей можно вводить в иммуногенные пептиды по настоящему изобретению.
Например, пептиды, для которых показана высокая аффинность связывания HLA-A2, обладающие второй аминокислотой с N-конца, замененной на лейцин или метионин, и пептиды, с аминокислотой на C-конце, замененной на валин или лейцин, также можно преимущественно использовать. Таким образом, пептиды, обладающие аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21 и 22, где вторая аминокислота с N-конца аминокислотной последовательности из SEQ ID NO заменена на лейцин или метионин, и/или пептиды, где C-конец аминокислотной последовательности из SEQ ID NO заменен на валин или лейцин, относятся к настоящему изобретению.
С другой стороны, пептиды, обладающие высокой аффинностью связывания HLA-A24, обладают второй аминокислотой с N-конца, замененной на фенилаланин, тирозин, метионин или триптофан, и аминокислотой на C-конце, замененной на фенилаланин, лейцин, изолейцин, триптофан или метионин. Таким образом, пептиды, обладающие аминокислотными последовательностями из SEQ ID NO:24, 33, 35, 41 и 43, где вторая аминокислота с N-конца заменена на фенилаланин, тирозин, метионин или триптофан, и/или где C-конец заменен на фенилаланин, лейцин, изолейцин, триптофан или метионин, относятся к настоящему изобретению.
Замены можно вводить не только в концевые аминокислоты, но также в положение потенциального узнавания пептидов T-клеточным рецептором (TCR). В нескольких исследованиях показали, что пептид с аминокислотными заменами может обладать эквивалентной или лучшей функцией, чем исходный, например, CAP1, p53 (264-272), Her-2/neu (369-377) или gp100 (209-217) (Zaremba et al. Cancer Res. 57, 4570-4577, 1997, T. K. Hoffmann et al. J Immunol. (2002) Feb 1;168(3):1338-47, S. O. Dionne et al. Cancer Immunol immunother. (2003) 52:199-206 и S. O. Dionne et al. Cancer Immunology, Immunotherapy (2004) 53, 307-314).
Более того, одну, две или более аминокислот можно также добавлять к N и/или C-концу настоящих пептидов. Такие модифицированные пептиды с высокой аффинностью связывания антигенов HLA и сохраненной способностью индуцировать CTL также включены в настоящее изобретение.
Однако, когда пептидная последовательность является идентичной части аминокислотной последовательности эндогенного или экзогенного белка, обладающего отличной функцией, могут быть индуцированы побочные эффекты, такие как аутоиммунные нарушения или аллергические симптомы против конкретных веществ. Таким образом, можно проводить поиски гомологии с использованием доступных баз данных, чтобы избежать ситуаций, в которых последовательность пептида совпадает с аминокислотной последовательностью другого белка. Когда из поисков гомологии становится ясно, что не существует даже пептида с отличиями 1 или 2 аминокислот от целевого пептида, целевой пептид можно модифицировать для увеличения аффинности его связывания с антигенами HLA и/или увеличения его способности индуцировать CTL без какой-либо опасности таких побочных эффектов.
Хотя ожидают, что пептиды, обладающие высокой аффинностью связывания с антигенами HLA, как описано выше, являются высокоэффективными, пептиды-кандидаты, выбранные в соответствии с присутствием высокой аффинности связывания в качестве показателя, дополнительно исследуют на присутствие способности индуцировать CTL. В настоящем документе словосочетание «способность индуцировать CTL» указывает на способность пептида индуцировать CTL при представлении на антигенпредставляющих клетках (APC). Кроме того, «способность индуцировать CTL» включает в себя способность пептида индуцировать активацию CTL, пролиферацию CTL, стимулировать лизис клеток-мишеней посредством CTL и увеличивать продукцию в CTL IFN-гамма.
Подтверждение способности индуцировать CTL осуществляют посредством индукции APC, несущих антигены MHC человека (например, B-лимфоциты, макрофаги и дендритные клетки (DC)), или более конкретно - DC, происходящих из мононуклеарных лейкоцитов периферической крови человека, и после стимуляции пептидами, смешивания с CD8-положительными клетками, и затем измерения продуцированного и высвобожденного посредством CTL IFN-гамма против клеток-мишеней. В качестве реакционной системы можно использовать трансгенных животных, полученных для экспрессии антигена HLA человека (например, животных, описанных в BenMohamed L, Krishnan R, Longmate J, Auge C, Low L, Primus J, Diamond D.J, Hum Immunol. 2000 Aug, 61(8):764-79, Related Articles, Books, Linkout Induction of CTL response by a minimal эпитоп вакцина in HLA A*0201/DR1 transgenic mice: dependent on MHC (HLA) class II restricted T(H) response). Например, клетки-мишени можно подвергать радиоактивному мечению с помощью 51Cr и т.п., и цитотоксическую активность можно рассчитывать по радиоактивности, высвобождаемой из клеток-мишеней. Альтернативно, ее можно исследовать посредством измерения IFN-гамма, продуцированного и высвобожденного посредством CTL в присутствии APC, несущих иммобилизованные пептиды, и визуализации зоны ингибирования в среде с использованием моноклональных антител против IFN-гамма.
В результате оценки способности пептидов индуцировать CTL, как описано выше, для нонапептидов или декапептидов, выбранных из пептидов, состоящих из аминокислотных последовательностей, указанных на SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, показали особенно высокую способность индуцировать CTL, также как высокую аффинность связывания с антигеном HLA. Таким образом, эти пептиды представляют собой примеры вариантов осуществления настоящего изобретения.
Более того, результат анализа гомологии показал, что эти пептиды не обладают значительной гомологией с пептидами, происходящими из любых других известных продуктов генов человека. Это снижает возможность неизвестных или нежелательных иммунных ответов при применении для иммунотерапии. Таким образом, также в этом аспекте, эти пептиды находят применение для пациентов со злокачественными опухолями против NEIL3. Таким образом, пептиды по настоящему изобретению, предпочтительно, представляют собой пептиды, состоящие из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43.
В дополнение к модификации настоящих пептидов, обсуждаемой выше, пептиды по настоящему изобретению можно связывать с другими пептидами, при условии, что они сохраняют способность индуцировать CTL. Примеры других пептидов включают в себя: пептиды по настоящему изобретению или способные индуцировать CTL пептиды, происходящие из других TAA. Линкеры между пептидами хорошо известны в данной области, например, AAY (P. M. Daftarian et al., J Trans Med 2007, 5:26), AAA, NKRK (R. P. M. Sutmuller et al., J Immunol. 2000, 165:7308-7315) или K (S. Ota et al., Can Res. 62, 1471-1476, K. S. Kawamura et al., J Immunol. 2002, 168:5709-5715).
Например, не относящиеся к NEIL3 опухолеассоциированные антигенные пептиды также можно использовать по существу одновременно для увеличения иммунного ответа через HLA класса I и/или класса II. Точно установлено, что клетки злокачественных опухолей могут экспрессировать более одного опухолеассоциированного гена. В объем общепринятых для обычного специалиста в данной области экспериментов входит определение, экспрессируются ли у конкретного субъекта дополнительные опухолеассоциированные гены, и затем включение связывающих HLA класса I и/или HLA класса II пептидов, происходящих из продуктов экспрессии таких генов, в композиции или вакцины с NEIL3 по настоящему изобретению.
Примеры связывающих HLA класса I и HLA класса II пептидов известны обычному специалисту в данной области (например, см. Coulie, Stem Cells 13:393-403, 1995), и их можно использовать по изобретению способом, подобным описанным в настоящем документе. Обычный специалист в данной области может получать полипептиды, включающие один или более пептидов NEIL3 и один или более не относящихся к NEIL3 пептидов, или нуклеиновые кислоты, кодирующие такие полипептиды, согласно общепринятым способам молекулярной биологии.
Таким образом, такие «политопы» представляют собой группу из двух или более потенциально иммуногенных или стимулирующих иммунный ответ пептидов, которые можно соединять вместе в различных расположениях (например, конкатенированные, перекрывающиеся). Политоп (или нуклеиновую кислоту, кодирующую политоп) можно вводить общепринятым способом иммунизации, например, животным, для тестирования эффективности политопа для стимуляции, усилении и/или вызова иммунного ответа.
Пептиды можно соединять вместе напрямую или посредством использования фланкирующих последовательностей для образования политопов, и применение политопов в качестве вакцин хорошо известно в данной области (см., например, Thomson et al., Proc. Natl. Acad. Sci USA 92(13):5845-5849, 1995; Gilbert et al., Nature Biotechnol. 15(12):1280-1284, 1997; Thomson et al., J Immunol. 157(2):822-826, 1996; Tarn et al., J Exp. Med. 171(1):299-306, 1990). Политопы, содержащие различные количества и сочетания эпитопов, можно получать и тестировать по узнаванию посредством CTL и по эффективности для увеличения иммунного ответа.
Более того, пептиды по настоящему изобретению можно дополнительно связывать с другими веществами, при условии, что они сохраняют способность индуцировать CTL. Такие вещества могут включать в себя: пептиды, липиды, сахар и сахарные цепи, ацетильные группы, природные и синтетические полимеры и т.д. Пептиды могут содержать модификации, такие как гликозилирование, окисление боковой цепи или фосфорилирование; при условии, что модификации не нарушают биологическую активность пептидов, как описано в настоящем описании. Эти виды модификаций можно осуществлять для придания дополнительных функций (например, функция нацеливания и функция доставки) или для стабилизации полипептида.
Например, для увеличения стабильности полипептида in vivo, в данной области известно введение D-аминокислот, миметиков аминокислот или неприродных аминокислот; эту концепцию можно принимать также для настоящих полипептидов. Стабильность полипептида можно анализировать рядом способов. Например, пептидазы и различные биологические среды, такие как плазма и сыворотка человека, можно использовать для тестирования стабильности (см., например, Verhoef et al., Eur J Drug Metab. Pharmacokin 1986, 11:291-302).
Более того, как указано выше, среди модифицированных пептидов, в которых заменены, делетированы или добавлены один, два или более аминокислотных остатков, можно проводить скрининг или отбор пептидов, обладающих одинаковой или более высокой активностью по сравнению с исходными пептидами. Настоящее изобретение, таким образом, относится также к способу скрининга или отбора пептидов, обладающих одинаковой или более высокой активностью по сравнению с исходными пептидами. Например, способ может включать в себя стадии:
a: замены, делеции или добавления, по меньшей мере, одного аминокислотного остатка пептида по настоящему изобретению,
b: определения активности пептида, и
c: отбора пептида, обладающего одинаковой или более высокой активностью по сравнению с исходным пептидом.
В настоящем документе активность может включать в себя активность связывания MHC, способность индуцировать APC или CTL и цитотоксическую активность.
В настоящем документе пептиды по настоящему изобретению можно описывать также как «NEIL3 пептид(ы)» или «NEIL3 полипептид(ы)».
III. Получение пептидов NEIL3
Пептиды по настоящему изобретению можно получать с использованием хорошо известных способов. Например, пептиды можно получать синтетически, посредством способа рекомбинантной ДНК или химического синтеза. Пептиды по настоящему изобретению можно синтезировать по отдельности или в форме более длинных полипептидов, включая два или более пептидов. Пептиды можно выделять, т.е. очищать или выделять по существу свободными от других встречающихся в природе белков клетки-хозяина и их фрагментов, или любых других химических веществ.
Пептиды по настоящему изобретению могут содержать модификации, такие как гликозилирование, окисление боковых цепей или фосфорилирование; при условии, что модификации не нарушают биологическую активность пептидов, как описано в настоящем описании. Другие модификации включают в себя включение D-аминокислот или других миметиков аминокислот, которые можно использовать, например, для увеличения времени полужизни пептидов в сыворотке.
Пептид по настоящему изобретению можно получать посредством химического синтеза на основе выбранной аминокислотной последовательности. Например, общепринятые способы синтеза пептидов, которые можно принимать для синтеза, включают в себя:
(i) Peptide Synthesis, Interscience, New York, 1966;
(ii) The Proteins, Vol.2, Academic Press, New York, 1976;
(iii) Peptide Synthesis (in Japanese), Maruzen Co., 1975;
(iv) Basics and Experiment of Peptide Synthesis (in Japanese), Maruzen Co., 1985;
(v) Development of Pharmaceuticals (second volume) (in Japanese), Vol.14 (peptide synthesis), Hirokawa, 1991;
(vi) WO99/67288; и
(vii) Barany G. & Merrifield R.B., Peptides Vol.2, «Solid Phase Peptide Synthesis», Academic Press, New York, 1980, 100-118.
Альтернативно, настоящие пептиды можно получать, принимая любые известные способы генной инженерии для получения пептидов (например, Morrison J, J Bacteriology 1977, 132:349-51; Clark-Curtiss & Curtiss, Methods in Enzymology (eds. Wu et al.) 1983, 101:347-62). Например, сначала получают подходящий вектор, несущий полинуклеотид, кодирующий целевой пептид в поддающейся экспрессии форме (например, на 3’-конце от регуляторной последовательности, соответствующей промоторной последовательности), и трансформируют подходящую клетку-хозяина. Такие векторы и клетки-хозяева также относятся к настоящему изобретению. Затем клетку-хозяина культивируют для получения интересующего пептида. Пептид можно также получать in vitro, принимая систему трансляции in vitro.
IV. Полинуклеотиды
Настоящее изобретение относится к полинуклеотидам, кодирующим любой из вышеупомянутых пептидов по настоящему изобретению. Они включают в себя полинуклеотиды, полученные из встречающегося в природе гена NEIL3 (инвентарный № в GenBank NM_018248 (например, SEQ ID NO:44)), и полинуклеотиды, обладающие консервативно модифицированными нуклеотидными последовательностями из них. В настоящем документе фраза «консервативно модифицированная нуклеотидная последовательность» относится к последовательности, кодирующей идентичные или по существу идентичные аминокислотные последовательности. Из-за вырожденности генетического кода большое число функционально идентичных нуклеиновых кислот кодирует любой данный белок. Например, кодоны GCA, GCC, GCG и GCU - все кодируют аминокислоту аланин. Таким образом, в каждом положении, где аланин определен кодоном, кодон можно заменять любым из описанных соответствующих кодонов без изменения кодируемого полипептида. Такие варианты нуклеиновой кислоты представляют собой «молчащие варианты», которые являются одним из видов консервативно модифицированных вариантов. Любая последовательность нуклеиновой кислоты в настоящем документе, которая кодирует пептид, описывает также любой возможный молчащий вариант нуклеиновой кислоты. Специалисту в данной области понятно, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является единственным кодоном для метионина, и TGG, который обычно является единственным кодоном для триптофана) можно модифицировать для получения функционально идентичной молекулы. Соответственно, каждый молчащий вариант нуклеиновой кислоты, кодирующей пептид, в неявной форме описан в каждой описанной последовательности.
Полинуклеотид по настоящему изобретению может состоять из ДНК, РНК или их производных. Как это хорошо известно в данной области, молекула ДНК состоит из оснований, таких как природные основания A, T, C и G, и T заменен на U в РНК. Специалисту в данной области понятно, что неприродные основания также включают в полинуклеотиды.
Полинуклеотид по настоящему изобретению может кодировать множество пептидов по настоящему изобретению в присутствии или в отсутствие вставленных аминокислотных последовательностей. Например, вставленная аминокислотная последовательность может обеспечивать участок расщепления (например, последовательность узнавания фермента) полинуклеотида или пептидов после трансляции. Более того, полинуклеотид может включать любые дополнительные последовательности в кодирующую последовательность, кодирующую пептид по настоящему изобретению. Например, полинуклеотид может представлять собой рекомбинантный полинуклеотид, включающий регуляторные последовательности, необходимые для экспрессии пептида, или может представлять собой экспрессирующий вектор (плазмиду) с маркерными генами и т.д. Как правило, такие рекомбинантные полинуклеотиды можно получать посредством манипуляции с полинуклеотидами посредством общепринятых рекомбинантных способов с использованием, например, полимераз и эндонуклеаз.
Как рекомбинантные способы, так и способы химического синтеза можно использовать для получения полинуклеотидов по настоящему изобретению. Например, полинуклеотид можно получать посредством вставки в подходящий вектор, который можно экспрессировать при трансфекции в компетентную клетку. Альтернативно, полинуклеотид можно использовать с использованием способов PCR или экспрессии в подходящих хозяевах (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, 1989). Альтернативно, полинуклеотид можно синтезировать с использованием твердофазных способов, как описано в Beaucage S.L. & Iyer R.P, Tetrahedron 1992, 48:2223-311; Matthes et al., EMBO J 1984, 3:801-5.
V. Экзосомы
Кроме того, настоящее изобретение относится к внутриклеточным носителям, называемым экзосомами, с настоящими комплексами, сформированными между пептидами по настоящему изобретению и антигенами HLA, на их поверхности. Экзосомы можно получать, например, с использованием способов, подробно описанных в публикациях японских патентных заявок Kohyo № Hei 11-510507 и WO99/03499, и их можно получать с использованием APC, полученных от пациентов, подвергаемых лечению и/или профилактике. Экзосомы по настоящему изобретению можно вводить в виде вакцин, сходным образом с пептидами по настоящему изобретению.
Тип антигенов HLA, включенных в комплексы, должен совпадать с типом антигенов HLA субъекта, нуждающегося в лечении и/или предотвращении. Например, для японцев, HLA-A24 и HLA-A2, в частности, HLA-A*2402 и HLA-A*0201 и HLA-A*0206, часто являются подходящими. Применение типа A24 или типа A2, экспрессия которых является высокой у японцев и кавказоидов, является преимущественной для получения эффективных результатов, и такие подтипы, как A*2402, A*0201 и A*0206, находят применение. Как правило, в клинике, тип антигена HLA пациента, нуждающегося в лечении, исследуют заранее, что позволяет соответствующий выбор пептидов, обладающих высоким уровнем аффинности связывания с этим антигеном, или обладающих способностью индуцировать CTL посредством представления антигена. Более того, для получения пептидов, обладающих высокой аффинностью связывания и способностью индуцировать CTL, можно осуществлять замену, делецию или добавление 1, 2 или более аминокислот на основании аминокислотной последовательности встречающегося в природе частичного пептида NEIL3.
В случае использования антигена HLA типа A2 для экзосомы по настоящему изобретению пептиды, включающие последовательность из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21 и 22, находят применение.
Альтернативно, в случае использования антигена HLA типа A24 для экзосомы по настоящему изобретению, пептиды, обладающие последовательностью из любого из SEQ ID NO:24, 33, 35, 41 и 43 и 61, находят применение.
VI. Антигенпредставляющие клетки (APC)
Настоящее изобретение также относится к выделенным APC, представляющим комплексы, сформированные с антигенами HLA и пептидами по настоящему изобретению, на их поверхности. APC можно получать от пациентов, подвергаемых лечению и/или профилактике, и их можно вводить в качестве вакцин отдельно или в сочетании с другими лекарственными средствами, включая пептиды по настоящему изобретению, экзосомы или CTL.
APC не являются ограниченными конкретным видом клеток и включают в себя DC, клетки Лангерганса, макрофаги, B-клетки и активированные T-клетки, которые, как известно, представляют белковые антигены на их клеточной поверхности, так чтобы они были узнаваемыми лимфоцитами. Поскольку DC является репрезентативной APC, обладающей самой сильной активностью индукции CTL из APC, DC находят применение в качестве APC по настоящему изобретению.
Например, APC по настоящему изобретению можно получать индукцией DC из моноцитов периферической крови и затем приведением их в контакт (стимуляцией) пептидами по настоящему изобретению in vitro, ex vivo или in vivo. Когда пептиды по настоящему изобретению вводят субъектам, APC, представляющие пептиды по настоящему изобретению, подвергаются индукции в организме субъекта. Таким образом, APC по настоящему изобретению можно получать сбором APC от субъекта после введения субъекту пептидов по настоящему изобретению. Альтернативно, APC по настоящему изобретению можно получать приведением APC, собранных от субъекта, в контакт с пептидом по настоящему изобретению.
APC по настоящему изобретению можно вводить субъекту для индукции иммунного ответа против злокачественной опухоли у субъекта отдельно или в сочетании с другими лекарственными средствами, включая пептиды, экзосомы или CTL по настоящему изобретению. Например, введение ex vivo может включать в себя стадии:
a: сбора APC от первого субъекта,
b: приведения APC со стадии a в контакт с пептидом, и
c: введения APC со стадии b второму субъекту.
Первый субъект и второй субъект могут являться одним и тем же индивидуумом, или могут являться разными индивидуумами. APC, полученные на стадии b, могут представлять собой вакцину для лечения и/или предотвращения злокачественной опухоли, такой как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML.
Согласно аспекту настоящего изобретения, APC обладают высоким уровнем способности индуцировать CTL. В термине «высокий уровень способности индуцировать CTL» уровень является высоким по сравнению с уровнем для APC, не контактировавших с пептидом или контактировавших с пептидами, которые не могут индуцировать CTL. Такие APC, обладающие высоким уровнем способности индуцировать CTL, можно получать способом, включающим в себя стадию переноса полинуклеотида, кодирующего пептид по настоящему изобретению, в APC in vitro, так же как способом, упомянутым выше. Вводимые гены могут присутствовать в форме ДНК или РНК. Примеры способов для введения включают в себя, без конкретных ограничений, различные способы, общепринятые в данной области, такие как липофекция, электропорация или способ с фосфатом кальция. Более конкретно, их можно осуществлять, как описано в Cancer Res 1996, 56:5672-7; J Immunol. 1998, 161:5607-13; J Exp. Med. 1996, 184:465-72; Опубликованном переводе Международной публикации № 2000-509281 на японский. Посредством переноса гена в APC ген подвергается транскрипции, трансляции и т.д. в клетке, и затем полученный белок процессируется посредством MHC класса I или класса II и проходит через путь представления для представления частичных пептидов.
VII. Цитотоксические T-лимфоциты (CTL)
CTL, индуцированный против любого из пептидов по настоящему изобретению, усиливает иммунный ответ, нацеленный на клетки злокачественных опухолей in vivo и, таким образом, его можно использовать в качестве вакцин сходным с пептидами образом. Таким образом, настоящее изобретение относится к выделенным CTL, специфически индуцированным или активированным посредством любого из настоящих пептидов.
Такие CTL можно получать посредством (1) введения пептида(пептидов) по настоящему изобретению субъекту или (2) приведения в контакт (стимуляции) полученных от субъекта APC, и CD8-положительных клеток, или мононуклеарных лейкоцитов периферической крови in vitro с пептидом(пептидами) по настоящему изобретению или (3) приведения в контакт CD8-положительных клеток или мононуклеарных лейкоцитов периферической крови in vitro с APC или экзосомами, представляющими комплекс из антигена HLA и пептида на их поверхности, или (4) введения гена, включающего полинуклеотид, кодирующий субъединицу T-клеточного рецептора (TCR), связывающую пептид по настоящему изобретению. Такие APC или экзосомы можно получать способами, описанными выше, и способ из (4) подробно описан ниже в разделе «VIII. T-клеточный рецептор (TCR)».
CTL по настоящему изобретению можно получать от пациентов, подвергаемых лечению и/или профилактике, и их можно вводить отдельно или в сочетании с другими лекарственными средствами, включая пептиды по настоящему изобретению или экзосомы, с целью регуляции эффектов. Полученные CTL специфически действуют против клеток-мишеней, представляющих пептиды по настоящему изобретению, например, те же самые пептиды, применяемые для индукции. Клетки-мишени могут представлять собой клетки с эндогенной экспрессией NEIL3, такие как клетки злокачественных опухолей, или клетки, трансфицированные геном NEIL3; и клетки, представляющие пептид по настоящему изобретению на клеточной поверхности, благодаря стимуляции пептидом, также могут служить мишенями для атаки активированных CTL.
VIII. T-клеточный рецептор (TCR)
Настоящее изобретение также относится к композиции, включающей в себя нуклеиновые кислоты, кодирующие полипептиды, способные формировать субъединицу T-клеточного рецептора (TCR), и к способам ее применения. Субъединицы TCR обладают способностью формировать TCR, который придает специфичность T-клеткам против клеток опухолей, представляющих NEIL3. С использованием известных в данной области способов можно идентифицировать нуклеиновые кислоты альфа- и бета-цепей в качестве субъединиц TCR из CTL, индуцированных одним или более пептидами по настоящему изобретению (WO2007/032255 и Morgan et al., J Immunol, 171, 3288 (2003)). Например, способ PCR является предпочтительным для анализа TCR. Праймеры для PCR для анализа могут представлять собой, в качестве неограничивающих примеров, 5'-R праймеры (5'-gtctaccaggcattcgcttcat-3') в качестве 5'-концевых праймеров (SEQ ID NO:48), и 3-TRa-C праймеры (5'-tcagctggaccacagccgcagcgt-3'), специфические для C-области альфа-цепи TCR (SEQ ID NO:49), 3-TRb-C1 праймеры (5'-tcagaaatcctttctcttgac-3'), специфические для C1-области бета-цепи TCR (SEQ ID NO:50) или праймеры 3-TRbeta-C2 (5'-ctagcctctggaatcctttctctt-3'), специфические для C2-области бета-цепи TCR (SEQ ID NO:51), в качестве 3'-концевых праймеров. Производные TCR могут связывать клетки-мишени, экспонирующие пептид NEIL3 с высокой авидностью, и, необязательно, опосредовать эффективное уничтожение клеток-мишеней, представляющих пептид NEIL3 in vivo и in vitro.
Нуклеиновые кислоты, кодирующие субъединицы TCR, можно включать в подходящие векторы, например, ретровирусные векторы. Эти векторы хорошо известны в данной области. Нуклеиновые кислоты или включающие их векторы можно практично переносить в T-клетку, например, T-клетку от пациента. Преимущественно, настоящее изобретение относится к готовой композиции, позволяющей быструю модификацию собственных T-клеток пациента (или T-клеток другого млекопитающего) для быстрого и простого получения модифицированных T-клеток, обладающих отличными свойствами уничтожения клеток злокачественных опухолей.
Специфический TCR представляет собой рецептор, способный специфически узнавать комплекс из пептида по настоящему изобретению и молекулы HLA, придающий T-клетке специфическую активность против клетки-мишени, когда TCR присутствует на поверхности T-клетки. Специфическое узнавание вышеуказанного комплекса можно подтверждать любыми известными способами, и предпочтительные способы включают в себя, например, анализ окрашивания мультимеров HLA с использованием молекул HLA и пептидов по настоящему изобретению и анализ ELISPOT. Посредством проведения анализа ELISPOT можно подтверждать, что T-клетка, экспрессирующая TCR на клеточной поверхности, узнает клетку посредством TCR, и затем сигнал переносится внутри клетки. Подтверждение, что вышеупомянутый комплекс может придавать T-клетке цитотоксическую активность, когда комплекс существует на поверхности T-клетки, также можно осуществлять известным способом. Предпочтительный способ включает в себя, например, определение цитотоксической активности против положительной по HLA клетки-мишени, например, анализ высвобождения хрома.
Настоящее изобретение относится также к CTL, полученным посредством трансдукции с помощью нуклеиновых кислот, кодирующих полипептиды субъединиц TCR, связывающих пептид NEIL3, например, из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21 и 22 в контексте HLA-A2, а также пептиды из SEQ ID NO:24, 33, 35, 41 и 43 в контексте HLA-A24.
Трансдуцированные CTL являются способными к хомингу клеток злокачественных опухолей in vivo, и их можно размножать хорошо известными способами культивирования in vitro (например, Kawakami et al., J Immunol., 142, 3452-3461 (1989)). CTL по настоящему изобретению можно использовать для формирования иммуногенной композиции, применимой для лечения или предотвращения злокачественной опухоли у пациента, нуждающегося в терапии или профилактике (WO2006/031221).
IX. Фармацевтические вещества или композиции
Предотвращение и профилактика включают в себя любую активность, уменьшающую нагрузку смертности или заболеваемости в отношении заболевания. Предотвращение и профилактику можно проводить «на первичном, вторичном и третичном уровнях предотвращения». В то время как первичное предотвращение и профилактика не допускают развития заболевания, вторичные и третичные уровни предотвращения и профилактики включают в себя активности, нацеленные на предотвращение и профилактику прогрессирования заболевания и появления симптомов, также как на уменьшение отрицательного вклада уже возникшего заболевания посредством восстановления функций и уменьшения связанных с заболеванием осложнений. Альтернативно, предотвращение и профилактика включают в себя широкий ряд видов профилактической терапии, нацеленной на облегчение тяжести конкретного нарушения, например, уменьшение пролиферации и метастазирования опухолей, уменьшение ангиогенеза.
Обработка для профилактики злокачественной опухоли и/или предотвращение ее послеоперационного рецидива включают в себя(включает в себя) любую из следующих стадий, таких как хирургическое удаление клеток злокачественных опухолей, ингибирование роста злокачественных клеток, сокращение или регрессию опухоли, индукцию ремиссии и супрессию возникновения злокачественной опухоли, регрессию опухоли и уменьшение или ингибирование метастазирования. Эффективное лечение и/или профилактика злокачественной опухоли уменьшает смертность и улучшает прогноз для индивидуумов, страдающих злокачественной опухолью, уменьшает уровни маркеров опухоли в крови и облегчает поддающиеся детекции симптомы, сопровождающие злокачественную опухоль. Например, уменьшение или улучшение симптомов включает в себя эффективное лечение и/или профилактику, включая уменьшение на 10%, 20%, 30% или более, или стабильное заболевание.
Поскольку экспрессия NEIL3 специфически повышена при злокачественной опухоли, такой как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML, по сравнению с нормальной тканью, пептиды или полинуклеотиды по настоящему изобретению можно использовать для лечения и/или для профилактики злокачественной опухоли, и/или предотвращения ее послеоперационного рецидива. Таким образом, настоящее изобретение относится к фармацевтическому веществу или композиции для лечения и/или для профилактики злокачественной опухоли, и/или предотвращения ее послеоперационного рецидива, включающим в себя один или более пептидов или полинуклеотидов по настоящему изобретению в качестве активного ингредиента. Альтернативно, настоящие пептиды могут быть экспрессированы на поверхности любой из вышеуказанных экзосом или клеток, таких как APC, для применения в качестве фармацевтических веществ или композиций. Кроме того, вышеупомянутые CTL, нацеленные на любые из пептидов по настоящему изобретению, можно использовать также в качестве активного ингредиента настоящих фармацевтических веществ или композиций.
Настоящие фармацевтические вещества или композиции находят применение в качестве вакцины. По настоящему изобретению термин «вакцина» (обозначаемая также как иммуногенная композиция) относится к веществу, обладающему функцией индукции противоопухолевого иммунитета при введении животным.
Фармацевтические средства или композиции по настоящему изобретению можно использовать для лечения и/или предотвращения злокачественных опухолей, и/или предотвращения их послеоперационного рецидива у субъектов или пациентов, включая человека и любого другого млекопитающего, в качестве неограничивающих примеров, мышь, крысу, морскую свинку, кролика, кошку, собаку, овцу, козу, свинью, крупный рогатый скот, лошадь, мартышку, бабуина и шимпанзе, в частности, коммерчески важное животное или домашнее животное.
В другом варианте осуществления настоящее изобретение также относится к применению активного ингредиента, выбранного из:
(a) пептида по настоящему изобретению;
(b) нуклеиновой кислоты, кодирующей такой пептид, как описано в настоящем документе, в поддающейся экспрессии форме;
(c) APC или экзосомы, представляющей пептид по настоящему изобретению на поверхности; и
(d) цитотоксической T-клетки по настоящему изобретению,
в изготовлении фармацевтической композиции или вещества для лечения или предотвращения злокачественной опухоли или опухоли.
Альтернативно, настоящее изобретение, кроме того, относится к активному ингредиенту, выбранному из:
(a) пептида по настоящему изобретению;
(b) нуклеиновой кислоты, кодирующей такой пептид, как описано в настоящем документе, в поддающейся экспрессии форме;
(c) APC или экзосомы, представляющей пептид по настоящему изобретению на поверхности; и
(d) цитотоксической T-клетки по настоящему изобретению,
для применения в лечении или предотвращении злокачественной опухоли или опухоли.
Альтернативно, настоящее изобретение, кроме того, относится к способу или процессу изготовления фармацевтической композиции или вещества для лечения или предотвращения злокачественной опухоли или опухоли, где способ или процесс включает в себя стадию составления фармацевтически или физиологически пригодного носителя с активным ингредиентом, выбранным из:
(a) пептида по настоящему изобретению;
(b) нуклеиновой кислоты, кодирующей такой пептид, как описано в настоящем документе, в поддающейся экспрессии форме;
(c) APC или экзосомы, представляющей пептид по настоящему изобретению на поверхности; и
(d) цитотоксической T-клетки по настоящему изобретению,
в качестве активных ингредиентов.
В другом варианте осуществления настоящее изобретение также относится к способу или процессу для изготовления фармацевтической композиции или вещества для лечения или предотвращения злокачественной опухоли или опухоли, где способ или процесс включает в себя стадии смешивания активного ингредиента с фармацевтически или физиологически пригодным носителем, где активный ингредиент выбран из:
(a) пептида по настоящему изобретению;
(b) нуклеиновой кислоты, кодирующей такой пептид, как описано в настоящем документе, в поддающейся экспрессии форме;
(c) APC или экзосомы, представляющей пептид по настоящему изобретению на поверхности; и
(d) цитотоксической T-клетки по настоящему изобретению.
В соответствии с настоящим изобретением, обнаружено, что пептиды, включающие аминокислотную последовательность из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, являются рестриктированными по HLA-A24 или HLA-A2 пептидами-эпитопами или кандидатами, которые могут индуцировать сильный и специфический иммунный ответ. Таким образом, настоящие фармацевтические вещества или композиции, включающие любой из этих пептидов с аминокислотными последовательностями из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, являются особенно подходящими для введения субъектам, антиген HLA которых представляет собой HLA-A24 или HLA-A2. То же самое относится к фармацевтическим веществам или композициям, включающим полинуклеотиды, кодирующие любые из этих пептидов (т.е. полинуклеотиды по настоящему изобретению).
Злокачественные опухоли, подлежащие лечению посредством фармацевтических веществ или композиций по настоящему изобретению, не являются ограниченными и включают в себя любую злокачественную опухоль, в которую вовлечен NEIL3 (например, является сверхэкспрессированным), например, злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML.
Настоящие фармацевтические вещества или композиции могут включать в себя, в дополнение к вышеупомянутым активным ингредиентам, другие пептиды, обладающие способностью индуцировать CTL против злокачественных клеток, другие полинуклеотиды, кодирующие другие пептиды, другие клетки, представляющие другие пептиды, или т.п. В настоящем документе в качестве неограничивающих примеров других пептидов, обладающих способностью индуцировать CTL против злокачественные клеток, приведены специфические для злокачественных опухолей антигены (например, идентифицированные TAA).
При необходимости фармацевтические вещества или композиции по настоящему изобретению могут, необязательно, включать в себя другие терапевтические вещества в качестве активного ингредиента, при условии, что вещество не ингибирует противоопухолевый эффект активного ингредиента, например, любого из настоящих пептидов. Например, составы могут включать в себя противовоспалительные вещества или композиции, обезболивающие средства, химиотерапевтические средства и т.п. В дополнение к другим терапевтическим средствам в самом лекарственном средстве, лекарственные средства по настоящему изобретению можно вводить также последовательно или одновременно с одним или несколькими другими фармакологическими веществами или композициями. Количество лекарственного средства и фармакологического вещества или композиции зависит, например, от того, какой тип фармакологического вещества(веществ) или композиции(композиций) использован/использованы, заболевания, подлежащего лечению, и от расписания и способов введения.
Следует понимать, что в дополнение к ингредиентам, конкретно упомянутым в настоящем документе, фармацевтические вещества или композиции по настоящему изобретению могут включать в себя другие вещества или композиции, общепринятые в данной области, учитывая тип рассматриваемого состава.
В одном варианте осуществления настоящего изобретения настоящие фармацевтические вещества или композиции можно включать в изделия и наборы, содержащие материалы, применимые для лечения патологических состояний заболевания, подлежащего лечению, например, злокачественной опухоли. Изделие может включать в себя контейнер любого из настоящих фармацевтических веществ или композиций с этикеткой. Пригодные контейнеры включают в себя бутыли, флаконы и пробирки. Контейнеры могут быть изготовлены из множества материалов, таких как стекло или пластик. На этикетке на контейнере должно быть указано, что вещество или композицию используют для лечения или предотвращения одного или нескольких состояний заболевания. На этикетке могут быть указаны также инструкции для введения и т.д.
В дополнение к вышеописанному контейнеру, набор, включающий фармацевтическое вещество или композицию по настоящему изобретению, может, необязательно, дополнительно включать второй контейнер, содержащий фармацевтически пригодный разбавитель. Он может дополнительно включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями для применения.
Фармацевтические композиции можно, если желательно, представлять в упаковке или устройстве для распределения, которые могут содержать одну или более единичных дозированных форм, содержащих активный ингредиент. Упаковка может, например, включать металлическую или полимерную пленку, например, блистерная упаковка. Упаковку или устройство для распределения можно сопровождать инструкциями для введения.
(1) Фармацевтические вещества или композиции, содержащие пептиды в качестве активного ингредиента
Пептиды по настоящему изобретению можно вводить непосредственно в качестве фармацевтического вещества или композиции, или, при необходимости, их составляют общепринятыми способами составления. В последнем случае, в дополнение к пептидам по настоящему изобретению, носители, наполнители и т.д., которые обычно используют для лекарственных средств, можно включать соответствующим образом, без конкретных ограничений. Примеры таких носителей представляют собой стерилизованную воду, физиологический солевой раствор, фосфатный буфер, культуральную жидкость и т.п. Более того, фармацевтические вещества или композиции могут содержать, по необходимости, стабилизаторы, суспензии, консерванты, поверхностно-активные вещества и т.п. Фармацевтические вещества или композиции по настоящему изобретению можно использовать против злокачественных опухолей.
Пептиды по настоящему изобретению можно получать в комбинации, включающей два или более из пептидов по настоящему изобретению, для индукции CTL in vivo. Пептиды могут присутствовать в коктейле, или их можно конъюгировать друг с другом с использованием общепринятых способов. Например, пептиды можно соединять химически или экспрессировать в форме одной слитой полипептидной последовательности, которая может обладать одной или более аминокислотой(аминокислотами) в качестве линкера (например, лизиновый линкер: K. S. Kawamura et al. J. Immunol. 2002, 168:5709-5715). Пептиды в комбинации могут являться одинаковыми или различными. Посредством введения пептидов по настоящему изобретению пептиды являются представленными с высокой плотностью посредством антигенов HLA на APC, затем CTL, специфически узнающие комплекс, сформированный между экспонированным пептидом и антигеном HLA, подвергаются индукции. Альтернативно, APC (например, DC) удаляют у субъектов и затем стимулируют пептидами по настоящему изобретению для получения APC, представляющих любой из пептидов по настоящему изобретению на их клеточной поверхности. Эти APC повторно вводят субъектам для индукции CTL у субъектов, и, в результате, можно увеличивать агрессивность против ассоциированного с опухолью эндотелия.
Фармацевтические вещества или композиции для лечения и/или предотвращения злокачественной опухоли, включающие любой из пептидов по настоящему изобретению в качестве активного ингредиента, могут включать адъювант, так что можно эффективно вызывать клеточный иммунитет, или их можно вводить с другими активными ингредиентами, и их можно вводить посредством составления в гранулы. Адъювант относится к любому соединению, веществу или композиции, усиливающим иммунный ответ против белка при введении вместе (или последовательно) с белком, обладающим иммунологической активностью. Адъювант, который можно применять, включает в себя адъюванты, описанные в литературе (Clin. Microbiol. Rev 1994, 7:277-89). Адъюванты включают в себя в качестве неограничивающих примеров фосфат алюминия, гидроксид алюминия, квасцы, холерный токсин, токсин сальмонеллы, неполный адъювант Фрейнда (IFA), полный адъювант Фрейнда (CFA), ISCOMatrix, GM-CSF, CpG, эмульсию O/W и т.п.
Более того, можно удобно использовать липосомные составы, гранулярные составы, в которых пептид является связанным с бусинами диаметром несколько микрометров, и составы, в которых липид является связанным с пептидом.
В другом варианте осуществления настоящего изобретения пептиды по настоящему изобретению можно вводить также в форме фармацевтически приемлемой соли. Предпочтительные примеры солей включают в себя соли со щелочным металлом, соли с металлом, соли с органическим основанием, соли с органической кислотой и соли с неорганической кислотой.
В некоторых вариантах осуществления фармацевтические вещества или композиции по настоящему изобретению включают в себя компонент, примирующий CTL. Липиды идентифицированы как вещества или композиции, способные примировать CTL in vivo против вирусных антигенов. Например, остатки пальмитиновой кислоты можно присоединять к эпсилон- и альфа-аминогруппам остатка лизина и затем связывать с пептидом по настоящему изобретению. Липидированный пептид можно затем вводить либо напрямую в мицелле или частице, включенным в липосому, либо эмульгированным в адъюванте. В качестве другого примера липида, примирующего ответы CTL, липопротеины E. coli, такие как трипальмитоил-S-глицерил-цистеинил-серил-серин (P3CSS), можно использовать для примирования CTL при ковалентном связывании с соответствующим пептидом (см., например, Deres et al., Nature 1989, 342:561-4).
Способ введения может представлять собой пероральный, внутрикожный, подкожный, внутривенную инъекцию или т.п., и системное введение или местное введение поблизости от намеченных участков. Введение можно осуществлять посредством однократного введения или проводить бустер-введение посредством множественных введений. Дозу пептидов по настоящему изобретению можно регулировать подходящим образом, в соответствии с заболеванием, подлежащим лечению, возрастом пациента, массой, способом введения и т.п., и она обычно составляет 0,001 мг - 1,000 мг, например, 0,001 мг - 1,000 мг, например, 0,1 мг - 10 мг, и ее можно вводить один раз в несколько суток - несколько месяцев. Специалист в данной области может подходящим образом выбирать подходящую дозу.
(2) Фармацевтические вещества или композиции, содержащие полинуклеотиды в качестве активного ингредиента
Фармацевтические вещества или композиции по настоящему изобретению могут включать также нуклеиновые кислоты, кодирующие пептид(ы), описанные в настоящем документе, в поддающейся экспрессии форме. В настоящем документе фраза «в поддающейся экспрессии форме» означает, что полинуклеотид, при введении в клетку, экспрессируется in vivo в качестве полипептида, индуцирующего противоопухолевый иммунитет. В иллюстративном варианте осуществления последовательность нуклеиновой кислоты интересующего полинуклеотида включает в себя элементы, необходимые для экспрессии полинуклеотида. Полинуклеотид(ы) можно комплектовать так, чтобы достигать стабильной вставки в геном клетки-мишени (см., например, в Thomas K.R. & Capecchi M.R, Cell 1987, 51:503-12 описание векторов с кассетами для гомологичной рекомбинации. См. также, например, Wolff et al., Science 1990, 247:1465-8; патенты США № 5580859; 5589466; 5804566; 5739118; 5736524; 5679647; и WO 98/04720). Примеры основанных на ДНК способов доставки включают в себя «голую ДНК», облегченную (бупивакаином, полимерами, опосредованную пептидом) доставку, катионные липидные комплексы и опосредованную частицами («генная пушка») или опосредованную давлением доставку (см., например, патент США № 5922687).
Пептиды по настоящему изобретению можно экспрессировать также посредством вирусных или бактериальных векторов. Примеры экспрессирующих векторов включают в себя ослабленных вирусных хозяев, таких как осповакцина или оспа-дифтерит птиц. Этот способ включает в себя применение вакцинного вируса, например, в качестве вектора для экспрессии нуклеотидных последовательностей, кодирующих пептид. При введении хозяину рекомбинантный вакцинный вирус экспрессирует иммуногенный пептид и, таким образом, вызывает иммунный ответ. Вакцинные векторы и способы, применимые в протоколах иммунизации, описаны, например, в патенте США № 4722848. Другим вектором является BCG (бацилла Кальмета-Герена). Векторы BCG описаны в Stover et al., Nature 1991, 351:456-60. Широкое множество других векторов, применимых для терапевтического введения или иммунизации, например, адено- и аденоассоциированные вирусные векторы, ретровирусные векторы, векторы Salmonella typhi, векторы с детоксифицированным токсином сибирской язвы и т.п., является очевидным. См., например, Shata et al., Mol. Med. Today 2000, 6:66-71; Shedlock et al., J Leukoc Biol. 2000, 68:793-806; Hipp et al., In Vivo 2000, 14:571-85.
Доставка полинуклеотида пациенту может являться прямой - в этом случае пациента подвергают прямому воздействию несущего полинуклеотид вектора, или опосредованной - в этом случае клетки сначала трансформируют интересующим полинуклеотидом in vitro, затем клетки трансплантируют пациенту. Эти два способа известны, соответственно, как in vivo и ex vivo генотерапия.
Общие обзоры способов генотерапии см. в Goldspiel et al., Clinical Pharmacy 1993, 12:488-505; Wu and Wu, Biotherapy 1991, 3:87-95; Tolstoshev, Ann Rev Pharmacol. Toxicol. 1993, 33:573-96; Mulligan, Science 1993, 260:926-32; Morgan & Anderson, Ann Rev Biochem 1993, 62:191-217; Trends in Biotechnology 1993, 11(5):155-215). Способы, общеизвестные в данной области технологии рекомбинантной ДНК, которые также можно применять по настоящему изобретению, описаны в eds. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, NY, 1993; и Krieger, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY, 1990.
Способ введения может представлять собой пероральный, внутрикожный, подкожный, внутривенную инъекцию или т.п., и системное введение или местное введение поблизости от намеченных участков находят применение. Введение можно осуществлять посредством однократного введения или проводить бустер-введение посредством множественных введений. Дозу полинуклеотида в подходящем носителе или клеток, трансформированных полинуклеотидом, кодирующим пептиды по настоящему изобретению, можно регулировать подходящим образом, в соответствии с заболеванием, подлежащим лечению, возрастом пациента, массой, способом введения и т.п., и она обычно составляет 0,001 мг - 1000 мг, например, 0,001 мг - 1000 мг, например, 0,1 мг - 10 мг, и ее можно вводить один раз в несколько суток - несколько месяцев. Специалист в данной области может подходящим образом выбирать подходящую дозу.
X. Способы с использованием пептидов, экзосом, APC и CTL
Пептиды и полинуклеотиды по настоящему изобретению можно использовать для получения или индукции APC и CTL. Экзосомы и APC по настоящему изобретению также можно использовать для индукции CTL. Пептиды, полинуклеотиды, экзосомы и APC можно использовать в сочетании с любыми другими соединениями при условии, что соединения не ингибируют их способность индуцировать CTL. Таким образом, любое из вышеупомянутых фармацевтических веществ или композиций по настоящему изобретению можно использовать для индукции CTL, и в дополнение к этому, фармацевтические вещества или композиции, включающие пептиды и полинуклеотиды, можно использовать также для индукции APC, как объяснено ниже.
(1) Способ индукции антигенпредставляющих клеток (APC)
Настоящее изобретение относится к способам индукции APC с высокой способностью индуцировать CTL с использованием пептидов или полинуклеотидов по настоящему изобретению.
Способы по настоящему изобретению включают в себя стадию приведения APC в контакт с пептидами по настоящему изобретению in vitro, ex vivo или in vivo. Например, способ приведения APC в контакт с пептидами ex vivo может включать в себя стадии:
a: сбора APC от субъекта; и
b: приведения APC со стадии a в контакт с пептидом.
APC не являются ограниченными конкретным видом клеток и включают в себя DC, клетки Лангерганса, макрофаги, B-клетки и активированные T-клетки, которые, как известно, представляют белковые антигены на их клеточной поверхности, так чтобы их узнавали лимфоциты. Предпочтительно, можно использовать DC, поскольку они обладают наиболее сильной способностью индуцировать CTL среди APC. Любые пептиды по настоящему изобретению можно использовать отдельно или с другими пептидами по настоящему изобретению.
С другой стороны, когда пептиды по настоящему изобретению вводят субъекту, APC вступают в контакт с пептидами in vivo, затем APC с высокой способностью индуцировать CTL подвергаются индукции в организме субъекта. Таким образом, настоящее изобретение относится к введению пептидов субъекту по настоящему изобретению. Подобным образом, когда полинуклеотиды по настоящему изобретению вводят субъекту в поддающейся экспрессии форме, пептиды по настоящему изобретению экспрессируются и вступают в контакт с APC in vivo, в результате чего APC с высокой способностью индуцировать CTL подвергаются индукции в организме субъекта. Таким образом, настоящее изобретение может относиться также к введению полинуклеотидов субъекту по настоящему изобретению. «Поддающаяся экспрессии форма» описана выше в разделе «IX. Фармацевтические вещества или композиции, (2) Фармацевтические вещества или композиции, содержащие полинуклеотиды в качестве активного ингредиента».
Более того, настоящее изобретение может относиться к введению полинуклеотида по настоящему изобретению в APC для индукции APC со способностью индуцировать CTL. Например, способ может включать в себя стадии:
a: сбора APC от субъекта; и
b: введения полинуклеотида, кодирующего пептид по настоящему изобретению.
Стадию b можно осуществлять, как описано выше в разделе «VI. Антигенпредставляющие клетки».
Альтернативно, настоящее изобретение относится к способу получения антигенпредставляющей клетки (APC), которая специфически индуцирует активность CTL против NEIL3, где способ может включать в себя одну из следующих стадий:
(a) приведения APC в контакт с пептидом по настоящему изобретению in vitro, ex vivo или in vivo; и
(b) введения полинуклеотида, кодирующего пептид по настоящему изобретению, в APC.
(2) Способ индукции CTL
Более того, настоящее изобретение относится к способам индукции CTL с использованием пептидов, полинуклеотидов, экзосом или APC по настоящему изобретению.
Настоящее изобретение также относится к способам индукции CTL с использованием полинуклеотида, кодирующего полипептид, способный формировать субъединицу T-клеточного рецептора (TCR), узнающего комплекс пептидов по настоящему изобретению и антигенов HLA. Предпочтительно, способы индукции CTL могут включать в себя по меньшей мере одну стадию, выбранную из группы, состоящей из:
a) приведения CD8-положительной T-клетки в контакт с антигенпредставляющей клеткой и/или экзосомой, представляющей на ее поверхности комплекс из антигена HLA и пептида по настоящему изобретениию; и
b) введения полинуклеотида, кодирующего полипептид, способный формировать субъединицу TCR, узнающую комплекс из пептида по настоящему изобретению и антигена HLA, в CD8-положительную клетку.
Когда пептиды, полинуклеотиды, APC или экзосомы по настоящему изобретению вводят субъекту, CTL подвергаются индукции в организме субъекта, и сила иммунного ответа, нацеленного на клетки злокачественных опухолей, увеличивается. Таким образом, способы по настоящему изобретению включают в себя стадию введения пептидов, полинуклеотидов, APC или экзосом субъекту по настоящему изобретению.
Альтернативно, CTL можно также индуцировать с использованием их ex vivo, и после индукции CTL активированные CTL можно возвращать субъекту. Например, способ может включать в себя стадии:
a: сбора APC от субъекта;
b: приведения APC со стадии a в контакт с пептидом; и
c: совместного культивирования APC со стадии b с CD8-положительными клетками.
APC для совместного культивирования с CD8-положительными клетками на вышеуказанной стадии c можно также получать посредством переноса гена, включающего полинуклеотид по настоящему изобретению, в APC, как описано выше в разделе «VI. Антигенпредставляющие клетки»; но они не являются ограниченными ими, и любые APC, эффективно представляющие на их поверхности комплекс из антигена HLA и пептида по настоящему изобретению, можно использовать по настоящему способу.
Вместо таких APC можно использовать также экзосомы, представляющие на их поверхности комплекс из антигена HLA и пептида по настоящему изобретению. А именно, настоящее изобретение может включать в себя стадию совместного культивирования экзосом, представляющих на их поверхности комплекс из антигена HLA и пептида по настоящему изобретению. Такие экзосомы можно получать способами, описанными выше в разделе «V. Экзосомы».
Более того, CTL можно индуцировать посредством введения гена, включающего полинуклеотид, кодирующий субъединицу TCR, связывающую пептид по настоящему изобретению, в CD8-положительные клетки. Такую трансдукцию можно проводить, как описано выше в разделе «VIII. T-клеточный рецептор (TCR)».
Кроме того, настоящее изобретение относится к способу или процессу для изготовления фармацевтического вещества или композиции, индуцирующих CTL, где способ включает в себя стадию смешивания или составления пептида по настоящему изобретению с фармацевтически приемлемым носителем.
(3) Способ индукции иммунного ответа
Более того, настоящее изобретение относится к способам индукции иммунного ответа против заболеваний, связанных с NEIL3. Подходящие заболевания могут включать в себя злокачественную опухоль, например, в качестве неограничивающих примеров, злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML.
Способы могут включать в себя стадию введения вещества(веществ) или композиции(композиций), содержащих любой из пептидов по настоящему изобретению или кодирующих их полинуклеотидов. Способ по настоящему изобретению может включать в себя также введение экзосом или APC, представляющих любой из пептидов по настоящему изобретению. Подробности см. в разделе «IX. Фармацевтические вещества или композиции», в частности, в части, описывающей применение фармацевтических веществ или композиций по настоящему изобретению в качестве вакцин. Кроме того, экзосомы и APC, которые можно применять в настоящих способах для индукции иммунного ответа, подробно описаны в разделах «V. Экзосомы», «VI. Антигенпредставляющие клетки (APC)», и (1) и (2) из «X. Способы с использованием пептидов, экзосом, APC и CTL», выше.
Настоящее изобретение также относится к способу или процессу для изготовления фармацевтического вещества или композиции, индуцирующих иммунный ответ, где способ может включать в себя стадию смешивания или составления пептида по настоящему изобретению с фармацевтически приемлемым носителем.
Альтернативно, способ по настоящему изобретению может включать в себя стадию введения вакцины или фармацевтической композиции, содержащих:
(a) пептид по настоящему изобретению;
(b) нуклеиновую кислоту, кодирующую такой пептид, как описано в настоящем документе, в поддающейся экспрессии форме;
(c) APC или экзосому, представляющую пептид по настоящему изобретению на поверхности; или
(d) цитотоксическую T-клетку по настоящему изобретению.
По настоящему изобретению злокачественную опухоль со сверхэкспрессией NEIL3 можно обрабатывать этими активными ингредиентами. Злокачественная опухоль включает в себя в качестве неограничивающих примеров злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML. Соответственно, перед введением вакцин или фармацевтических композиций, включающих активные ингредиенты, является предпочтительным подтверждать, является ли уровень экспрессии NEIL3 в клетках или тканях, подлежащих обработке, увеличенным по сравнению с нормальными клетками из того же самого органа. Таким образом, в одном варианте осуществления, настоящее изобретение относится к способу лечения злокачественной опухоли, (сверх)экспрессирующей NEIL3, где способ может включать в себя стадии:
i) определения уровня экспрессии NEIL3 в клетках или ткани(тканях), полученных от субъекта со злокачественной опухолью, подлежащей лечению;
ii) сравнения уровня экспрессии NEIL3 с нормальным контролем; и
iii) введения по меньшей мере одного компонента, выбранного из группы, состоящей из (a)-(d), описанных выше, субъекту со злокачественной опухолью со сверхэкспрессией NEIL3 по сравнению с контролем.
Альтернативно, настоящее изобретение также относится к вакцине или фармацевтической композиции, включающей по меньшей мере один компонент, выбранный из группы, состоящей из (a)-(d), описанных выше, для применения для введения субъекту со злокачественной опухолью со сверхэкспрессией NEIL3. Иными словами, настоящее изобретение, кроме того, относится к способу идентификации субъекта, подлежащего лечению с помощью полипептида NEIL3 по настоящему изобретению, где способ может включать в себя стадию определения уровня экспрессии NEIL3 в полученных от субъекта клетках или ткани(тканях), где увеличение уровня по сравнению с нормальным контролем указывает на то, что субъект может обладать злокачественной опухолью, которую можно лечить с помощью полипептида NEIL3 по настоящему изобретению. Способ лечения злокачественной опухоли по настоящему изобретению более подробно описан ниже.
В контексте настоящего изобретения контрольный уровень, определенный из биологического образца, как известно, не относящегося к злокачественной опухоли, обозначают как «нормальный контрольный уровень». С другой стороны, если контрольный уровень определяют по биологическому образцу из злокачественной опухоли, его определяют как «контрольный уровень для злокачественной опухоли».
Субъект, подлежащий лечению по настоящему способу, предпочтительно представляет собой млекопитающее. Млекопитающие включают в себя в качестве неограничивающих примеров человека, не относящегося к человеку примата, мышь, крысу, собаку, кошку, лошадь и корову.
В соответствии с настоящим изобретением, можно определять уровень экспрессии NEIL3 в клетках или тканях, полученных от субъекта. Уровень экспрессии можно определять на уровне продукта транскрипции (нуклеиновой кислоты), с использованием способов, известных в данной области. Например, мРНК NEIL3 можно оценивать количественно с использованием зондов способами гибридизации (например, Нозерн-гибридизации). Детекцию можно осуществлять на чипе, массиве или как таковую. Применение массива может являться предпочтительным для детекции уровня экспрессии NEIL3. Специалисты в данной области могут получать такие зонды с использованием информации о последовательности NEIL3. Например, кДНК NEIL3 можно использовать в качестве зондов. При необходимости зонды можно метить подходящей меткой, такой как красители, флуоресцентные вещества и изотопы, и уровень экспрессии гена можно детектировать как интенсивность прогибридизовавшихся меток.
Более того, продукт транскрипции NEIL3 (например, SEQ ID NO:45) можно оценивать количественно с использованием праймеров посредством основанных на амплификации способов детекции (например, RT-PCR). Такие праймеры можно получать на основе доступной информации о последовательности гена.
Конкретно, зонд или праймер, применяемый по настоящему способу, гибридизуется в условиях строгости, умеренной строгости или низкой строгости, с мРНК NEIL3. Как применяют в настоящем документе, фраза «строгие условия (гибридизации)» относится к условиям, при которых зонд или праймер гибридизуются с их последовательностью-мишенью, но не с другими последовательностями. Строгие условия являются зависимыми от последовательности и являются различными в различных условиях. Специфическую гибридизацию более длинных последовательностей наблюдают при более высоких температурах, чем для более коротких последовательностей. Как правило, температуру для строгих условий выбирают приблизительно на 5°C ниже, чем термическая температура плавления (Tm) для специфической последовательности при определенной ионной силе и pH. Tm представляет собой температуру (при определенной ионной силе, pH и концентрации нуклеиновой кислоты), при которой 50% зондов, комплементарных их последовательности-мишени, гибридизуются с последовательностью-мишенью в равновесии. Поскольку последовательности-мишени, как правило, присутствуют в избытке, при Tm, 50% зондов заняты при равновесии. Как правило, строгие условия являются такими, при которых концентрация соли составляет менее приблизительно 1,0 M ион натрия, как правило, приблизительно 0,01-1,0 M ион натрия (или другие соли) при pH 7,0-8,3, и температура составляет по меньшей мере приблизительно 30°C для коротких зондов или праймеров (например, 10-50 нуклеотидов) и по меньшей мере приблизительно 60°C для более длинных зондов или праймеров. Строгих условий можно достигать также с помощью добавления дестабилизирующих веществ, таких как формамид.
Альтернативно, продукт трансляции можно детектировать для диагностики по настоящему изобретению. Например, можно определять количество белка NEIL3 (SEQ ID NO:45) или его иммунологически активного фрагмента. Способы определения количества белка как продукта трансляции включают в себя способы иммуноанализа, в которых применяют антитело, специфически узнающее белок. Антитело может являться моноклональным или поликлональным. Более того, любой фрагмент или модификацию (например, химерное антитело, scFv, Fab, F(ab')2, Fv и т.д.) антитела можно использовать для детекции, при условии, что фрагмент или модифицированное антитело сохраняет способность связывания с белком NEIL3. Такие антитела против пептидов по настоящему изобретению и их фрагменты также относятся к настоящему изобретению. Способы для получения этих видов антител для детекции белков хорошо известны в данной области, и любой способ можно применять по настоящему изобретению для получения таких антител и их эквивалентов.
В качестве другого способа детекции уровня экспрессии гена NEIL3 на основании продукта его трансляции, интенсивность окрашивания можно измерять посредством иммуногистохимического анализа с использованием антитела против белка NEIL3. А именно, при этом измерении, сильное окрашивание указывает на увеличенные присутствие/уровень белка и в то же самое время на высокий уровень экспрессии гена NEIL3.
Уровень экспрессии гена-мишени, например, гена NEIL3, в клетках злокачественных опухолей можно определять как увеличенный, если уровень увеличивается по сравнению с контрольным уровнем (например, уровнем в нормальных клетках) гена-мишени, например, на 10%, 25% или 50%; или увеличивается более чем в 1,1 раза, более чем в 1,5 раза, более чем в 2,0 раза, более чем в 5,0 раз, более чем в 10,0 раз, или более.
Контрольный уровень можно определять в одно и то же время с клетками злокачественных опухолей с использованием образца(образцов), ранее собранных и сохраненных от субъекта(субъектов), состояние(состояния) заболевания которых (наличие злокачественной опухоли или отсутствие злокачественной опухоли) известно/известны. Кроме того, нормальные клетки, полученные из не относящихся к злокачественной опухоли областей органа, обладающего злокачественной опухолью, подлежащей лечению, можно использовать в качестве нормального контроля. Альтернативно, контрольный уровень можно определять статистическим способом на основании результатов, полученных анализом ранее определенного уровня(уровней) экспрессии гена NEIL3 в образцах от субъектов, состояния заболевания которых известны. Более того, контрольный уровень можно выводить из базы данных картин экспрессии ранее тестированных клеток. Более того, в аспекте настоящего изобретения, уровень экспрессии гена NEIL3 в биологическом образце можно сравнивать с множеством контрольных уровней, определенных из множества контрольных образцов. Является предпочтительным использовать контрольный уровень, определенный из сравнительного образца, происходящего из типа ткани, сходного с типом ткани происходящего из субъекта биологического образца. Более того, является предпочтительным использовать стандартное значение уровней экспрессии гена NEIL3 в популяции с известным состоянием заболевания. Стандартное значение можно получать любым способом, известным в данной области. Например, диапазон среднее +/- 2 S.D. или среднее +/- 3 S.D. можно использовать в качестве стандартного значения.
Когда уровень экспрессии гена NEIL3 является увеличенным по сравнению с нормальным контрольным уровнем, или является сходным/эквивалентным с контрольным уровнем для злокачественной опухоли, у субъекта можно диагностировать злокачественную опухоль, подлежащую лечению.
Более конкретно, настоящее изобретение относится к способу (i) диагностики, обладает ли предполагаемый субъект злокачественной опухолью, подлежащей лечению, и/или (ii) выбора субъекта для лечения злокачественной опухоли, где способ может включать в себя стадии:
a) определения уровня экспрессии NEIL3 в клетках или ткани(тканях), полученных от субъекта, как предполагают, обладающего злокачественной опухолью, подлежащей лечению;
b) сравнения уровня экспрессии NEIL3 с нормальным контрольным уровнем;
c) диагностирования субъекта как обладающего злокачественной опухолью, подлежащей лечению, если уровень экспрессии NEIL3 является увеличенным по сравнению с нормальным контрольным уровнем; и
d) выбора субъекта для лечения злокачественной опухоли, если субъект диагностирован как обладающий злокачественной опухолью, подлежащей лечению, на стадии c).
Альтернативно, такой способ может включать в себя стадии:
a) определения уровня экспрессии NEIL3 в клетках или ткани(тканях), полученных от субъекта, как предполагают, обладающего злокачественной опухолью, подлежащей лечению;
b) сравнения уровня экспрессии NEIL3 с контрольным уровнем для злокачественной опухоли;
c) диагностирования субъекта как обладающего злокачественной опухолью, подлежащей лечению, если уровень экспрессии NEIL3 является сходным или эквивалентным с контрольным уровнем для злокачественной опухоли; и
d) выбора субъекта для лечения злокачественной опухоли, если субъект диагностирован как обладающий злокачественной опухолью, подлежащей лечению, на стадии c).
Настоящее изобретение также относится к диагностическому набору для диагностики или определения субъекта, который страдает или, как предполагают, страдает от злокачественной опухоли, которую можно лечить с помощью полипептида NEIL3 по настоящему изобретению, который может также находить применение в оценке и/или мониторинге эффективности или применимости в иммунотерапии злокачественных опухолей. Предпочтительно, злокачественная опухоль включает в себя в качестве неограничивающих примеров злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML. Более конкретно, набор, предпочтительно, может включать в себя по меньшей мере один реагент для детекции экспрессии гена NEIL3 в происходящей из субъекта клетке, где реагент может являться выбранным из группы из:
(a) реагента для детекции мРНК гена NEIL3;
(b) реагента для детекции белка NEIL3 или его иммунологического фрагмента; и
(c) реагента для детекции биологической активности белка NEIL3.
Подходящие реагенты для детекции мРНК гена NEIL3 могут включать в себя нуклеиновые кислоты, которые специфически связывают или идентифицируют мРНК NEIL3, такие как олигонуклеотиды, обладающие последовательностью, комплементарной части мРНК NEIL3. В качестве примеров этих видов олигонуклеотидов можно привести праймеры и зонды, специфические для мРНК NEIL3. Эти виды олигонуклеотидов можно получать на основании способов, хорошо известных в данной области. При необходимости реагент для детекции мРНК NEIL3 можно иммобилизовывать на твердом матриксе. Более того, в набор можно включать более одного реагента для детекции мРНК NEIL3.
С другой стороны, подходящие реагенты для детекции белка NEIL3 или его иммунологически активного фрагмента могут включать в себя антитела против белка NEIL3 или его иммунологически активного фрагмента. Антитело может являться моноклональным или поликлональным. Более того, любой фрагмент или модификацию (например, химерное антитело, scFv, Fab, F(ab')2, Fv и т.д.) антитела можно использовать в качестве реагента, при условии, что фрагмент или модифицированное антитело сохраняет способность связывания с белком NEIL3 или его иммунологически активным фрагментом. Способы получения этих видов антител для детекции белков хорошо известны в данной области, и любой способ можно применять по настоящему изобретению для получения таких антител и их эквивалентов. Более того, антитело можно метить с помощью образующих сигнал молекул посредством способа прямого связывания или непрямого мечения. Метки и способы для мечения антител и детекции связывания антител с их мишенями хорошо известны в данной области, и любые метки и способы можно применять по настоящему изобретению. Более того, в набор можно включать более одного реагента для детекции белка NEIL3.
Набор может содержать более одного из вышеупомянутых реагентов. Например, образцы тканей, полученные от субъектов без злокачественной опухоли или страдающих от злокачественной опухоли, могут служить применимыми контрольными реагентами. Набор по настоящему изобретению может дополнительно включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку (например, записи, пленка, CD-ROM и т.д.) с инструкциями для применения. Эти реагенты и т.п. можно сохранять в контейнере с этикеткой. Подходящие контейнеры могут включать в себя бутыли, флаконы и пробирки. Контейнеры можно изготавливать из множества материалов, таких как стекло или пластик.
В одном из вариантов осуществления настоящего изобретения, когда реагент представляет собой зонд против мРНК NEIL3, реагент можно иммобилизовывать на твердом матриксе, таком как пористая полоса, для формирования по меньшей мере одного участка детекции. Область измерения или детекции пористой полосы может включать в себя множество участков, каждый из которых содержит нуклеиновую кислоту (зонд). Тестовая полоса может также содержать участки для отрицательного и/или положительного контроля. Альтернативно, контрольные участки могут быть локализованы на полосе, отдельной от тестовой полосы. Необязательно, различные участки детекции могут содержать различные количества иммобилизованных нуклеиновых кислот, т.е. более высокое количество в первом участке детекции и меньшие количества в последующих участках. При добавлении тестируемого образца число участков, для которых показан поддающийся детекции сигнал, предоставляет количественный показатель количества мРНК NEIL3, присутствующей в образце. Участкам детекции можно придавать любую поддающуюся детекции форму, и они, как правило, имеют форму полосы или точки, перекрывающей ширину тестовой полосы.
Набор по настоящему изобретению может дополнительно включать образец положительного контроля или стандартный образец NEIL3. Образец положительного контроля по настоящему изобретению можно получать сбором положительных по NEIL3 образцов и затем анализом уровней NEIL3. Альтернативно, очищенный белок или полинуклеотид NEIL3 можно добавлять к клеткам, не экспрессирующим NEIL3, для получения положительного образца или стандартного образца NEIL3. По настоящему изобретению очищенный NEIL3 может представлять собой рекомбинантный белок. Уровень NEIL3 в образце положительного контроля составляет, например, более пороговой величины.
В одном варианте осуществления настоящее изобретение, кроме того, относится к диагностическому набору, включающему белок или частичный белок из него, способный к специфическому узнаванию антитела по настоящему изобретению или его фрагмента.
Примеры частичного пептида белка по настоящему изобретению включают в себя полипептиды, состоящие по меньшей мере из 8, предпочтительно 15 и более предпочтительно 20 непрерывных аминокислот в аминокислотной последовательности белка по настоящему изобретению. Злокачественную опухоль можно диагностировать посредством детекции антитела в образце (например, крови, ткани) с использованием белка или пептида (полипептида) по настоящему изобретению. Способ получения белка по настоящему изобретению и пептидов является таким, как описано выше.
Диагностический способ для злокачественной опухоли можно осуществлять посредством определения различий между количеством антитела против NEIL3 и этим количеством в соответствующем контрольном образце, как описано выше. Подозревают, что субъект страдает от злокачественной опухоли, если клетки или ткани субъекта содержат антитела против продуктов экспрессии (NEIL3) гена, и определено, что количество антитела против NEIL3 больше, чем пороговая величина на уровне, сравнимом с уровнем в нормальном контроле.
В другом варианте осуществления диагностический набор по настоящему изобретению может включать пептид по настоящему изобретению и связывающуюся с ним молекулу HLA. Способ детекции специфических для антигена CTL с использованием антигенных пептидов и молекул HLA уже разработан (например, Altman J.D. et al., Science. 1996, 274(5284): 94-6). Таким образом, комплекс пептида по настоящему изобретению и молекулы HLA можно применять в способе детекции для детекции специфических для антигена CTL, таким образом, позволяя более раннюю детекцию злокачественной опухоли, рецидива и/или метастазирования злокачественной опухоли. Кроме того, его можно применять для отбора субъектов, для которых можно применять лекарственные средства, включающие пептид по настоящему изобретению в качестве активного ингредиента, или для оценки эффекта лекарственных средств.
В частности, согласно известному способу (см., например, Altman J.D. et al., Science. 1996, 274(5284):94-6), можно получать олигомерный комплекс, такой как тетрамер, радиоактивно меченной молекулы HLA и пептида по настоящему изобретению. С использованием комплекса диагностику можно проводить, например, посредством количественного определения специфических для антигенного пептида CTL в лимфоцитах периферической крови, полученных от субъекта, как подозревают, страдающего от злокачественной опухоли.
Настоящее изобретение, кроме того, относится к способу или диагностическим средствам для оценки иммунологического ответа субъекта с использованием пептидных эпитопов, как описано в настоящем описании. В одном варианте осуществления по изобретению рестриктированные по HLA пептиды, как описано в настоящем описании, можно использовать в качестве реагентов для оценки или предсказания иммунного ответа субъекта. Иммунный ответ, подлежащий оценке, можно индуцировать посредством приведения иммуногена в контакт с иммунокомпетентными клетками in vitro или in vivo. В некоторых вариантах осуществления любые вещества или композиции, которые могут приводить к продукции специфических для антигена CTL, узнающих и связывающих пептидный эпитоп (эпитопы), можно применять в качестве реагента. Пептидные реагенты необязательно использовать в качестве иммуногена. Системы анализа, которые используют для такого анализа, включают в себя относительно недавние технические разработки, такие как тетрамеры, окрашивание по внутриклеточным лимфокинам и анализы высвобождения интерферона, или анализы ELISPOT. В предпочтительном варианте осуществления иммунокомпетентные клетки, подлежащие приведению в контакт с пептидным реагентом, могут представлять собой антигенпредставляющие клетки, включая дендритные клетки.
Например, пептиды по настоящему изобретению можно использовать в анализе окрашивания тетрамеров для оценки присутствия в мононуклеарных клетках периферической крови специфических для антигена CTL после воздействия антигена или иммуногена клеток опухоли. Тетрамерный комплекс HLA можно использовать для непосредственной визуализации специфических для антигена CTL (см., например, Ogg et al., Science 279:2103-2106, 1998; и Altman et al, Science 174:94-96, 1996) и определения популяции специфических для антигена CTL в образце мононуклеарных клеток периферической крови. Тетрамерный реагент с использованием пептида по изобретению можно получать, как описано ниже.
Пептид, связывающий молекулу HLA, подвергают повторному сворачиванию в присутствии тяжелой цепи соответствующего HLA и бета-2-микроглобулина для получения тримолекулярного комплекса. В комплексе C-конец тяжелой цепи является биотинилированным в участке, предварительно вставленном в белок с помощью генной инженерии. Затем стрептавидин добавляют к комплексу для формирования тетрамера, состоящего из тримолекулярного комплекса и стрептавидина. Посредством флуоресцентно меченного стрептавидина, тетрамер можно использовать для окрашивания специфических для антигена клеток. Затем клетки можно идентифицировать, например, посредством проточной цитометрии. Такой анализ можно использовать для диагностических или прогностических целей. Клетки, идентифицированные этим способом, также можно использовать для терапевтических целей.
Настоящее изобретение также относится к реагентам для оценки вызова иммунного ответа (см., например, Bertoni et al, J. Clin. Invest. 100:503-513, 1997 и Penna et al., J Exp. Med. 174:1565-1570, 1991), включающим пептиды по настоящему изобретению. Например, в образцах PBMC пациента от индивидуумов со злокачественной опухолью, подлежащей лечению, можно анализировать присутствие специфических для антигена CTL с использованием специфических пептидов. Образец крови, содержащий мононуклеарные клетки, можно оценивать посредством культивирования PBMC и стимуляции клеток с помощью пептида по изобретению. После соответствующего периода культивирования размноженную популяцию клеток можно анализировать, например, по активности CTL.
Пептиды можно также использовать в качестве реагентов для оценки эффективности вакцины. PBMC, полученные от пациента, вакцинированного с помощью иммуногена, можно анализировать с использованием, например, любого из способов, описанных выше. Пациента типируют по HLA, и реагенты с пептидным эпитопом, узнающим аллелеспецифические молекулы, присутствующие у пациента, выбирают для анализа. Иммуногенность вакцины можно показывать по присутствию специфических для эпитопа CTL в образце PBMC. Пептиды по изобретению можно также использовать для получения антител с использованием способов, хорошо известных в данной области (см., например, CURRENTPROTOCOLSINIMMUNOLOGY, Wiley/Greene, NY; и Antibodies A Laboratory Manual, Harlow and Lane, Cold Spring Harbor Laboratory Press, 1989), и они могут находить применение в качестве реагентов для диагностики, детекции или мониторирования злокачественной опухоли. Такие антитела могут включать в себя антитела, узнающие пептид в контексте молекулы HLA, т.е. антитела, связывающие комплекс пептид-MHC.
Альтернативно, изобретение относится также к ряду применений, некоторые из которых описаны в настоящем документе. Например, настоящее изобретение относится к способу диагностики или детекции нарушения, характеризующегося экспрессией иммуногенного полипептида NEIL3. Эти способы включают в себя определение экспрессии связывающего HLA пептида NEIL3 или комплекса связывающего HLA пептида NEIL3 и молекулы HLA класса I в биологическом образце. Экспрессию пептида или комплекса пептида и молекулы HLA класса I можно определять или детектировать посредством анализа с помощью партнера по связыванию пептида или комплекса. В предпочтительном варианте осуществления партнер по связыванию для пептида или комплекса может представлять собой антитело, узнающее и специфически связывающее пептид. Экспрессию NEIL3 в биологическом образце, таком как биоптат опухоли, также можно тестировать общепринятыми способами амплификации PCR с использованием праймеров NEIL3. Пример экспрессии в опухоли представлен в настоящем документе, и дополнительное описание иллюстративных условий и праймеров для амплификации NEIL3 можно найти в WO2003/27322.
Предпочтительно, диагностические способы включают в себя приведение биологического образца, выделенного от субъекта, в контакт со связывающим HLA пептидом NEIL3 для детекции присутствия связывающего HLA пептида NEIL3 в биологическом образце. Как применяют в настоящем документе, «приведение в контакт» означает помещение биологического образца достаточно близко к средству и в соответствующих условиях, например, концентрации, температуры, времени, ионной силы, чтобы позволять специфическое взаимодействие между средством и связывающим HLA пептидом NEIL3, присутствующим в биологическом образце. Как правило, условия для приведения средства в контакт с биологическим образцом представляют собой условия, известные специалисту в данной области для облегчения специфического взаимодействия между молекулой и узнаваемой ею молекулой (например, белок и узнаваемый им рецептор, антитело и узнаваемый им белковый антиген, нуклеиновая кислота и узнаваемая ею комплементарная последовательность) в биологическом образце. Иллюстративные условия для облегчения специфического взаимодействия между молекулой и узнаваемой ею молекулой описаны в патенте США № 5108921, выданном Low et al.
Диагностический способ по настоящему изобретению можно осуществлять in vivo или in vitro, или и in vivo, и in vitro. Соответственно, биологический образец может быть локализован in vivo или in vitro по настоящему изобретению. Например, биологический образец может представлять собой ткань in vivo, и средство, специфическое для иммуногенного полипептида NEIL3, можно использовать для детекции присутствия таких молекул в ткани. Альтернативно, биологический образец можно собирать или выделять in vitro (например, образец крови, биоптат опухоли, экстракт ткани). В особенно предпочтительном варианте осуществления биологический образец может являться содержащим клетки образцом, более предпочтительно, содержащим клетки опухоли образцом, собранным от субъекта, подлежащего диагностике или лечению.
Альтернативно, диагностику можно проводить способом, позволяющим прямое количественное определение специфических для антигена T-клеток посредством окрашивания с помощью меченных флуоресцеином мультимерных комплексов HLA (например, Altman, J. D. et al., 1996, Science 274:94; Altman, J. D. et al., 1993, Proc. Natl. Acad. Sci. USA 90:10330). Предоставлены также окрашивание внутриклеточных лимфокинов и анализы высвобождения интерферона-гамма или анализы ELISPOT. Окрашивание мультимеров, окрашивание внутриклеточных лимфокинов и анализы ELISPOT - все, по-видимому, являются по меньшей мере в 10 раз более чувствительными, чем более общепринятые анализы (Murali-Krishna, K. et al., 1998, Immunity 8:177; Lalvani, A. et al., 1997, J. Exp. Med. 186:859; Dunbar, P. R. et al., 1998, Curr. Biol. 8:413). Можно использовать также пентамеры (например, US 2004-209295A), декстрамеры (например, WO 02/072631) и стрептамеры (например, Nature medicine 6. 631-637 (2002)).
XI. Антитела
Кроме того, настоящее изобретение относится к антителам, связывающим пептид по настоящему изобретению. Предпочтительные антитела связываются с пептидом по настоящему изобретению и не связываются (или слабо связываются) с пептидом, не относящимся к настоящему изобретению. Альтернативно, антитела связываются с пептидом по изобретению, также как с его гомологами. Антитела против пептида по изобретению могут находить применение в диагностических и прогностических анализах злокачественных опухолей и способах визуализации. Подобным образом, такие антитела могут находить применение в лечении, диагностике и/или прогнозировании других злокачественных опухолей в тех случаях, когда NEIL3 также экспрессирован или сверхэкспрессирован у пациента со злокачественной опухолью. Более того, экспрессированные внутри клеток антитела (например, одноцепочечные антитела) могут находить терапевтическое применение для лечения злокачественных опухолей, в которые вовлечена экспрессия NEIL3, например, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML.
Настоящее изобретение также относится к различным иммунологическим анализам для детекции и/или количественного определения белка NEIL3 (SEQ ID NO:45) или его фрагментов, включая полипептид, состоящий из аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43. Такие анализы могут включать в себя одно или более антител против NEIL3, способных узнавать и связывать белок NEIL3 или его фрагменты соответствующим образом. По настоящему изобретению антитела против NEIL3, связывающие полипептид NEIL3, предпочтительно узнают полипептид, состоящий из аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43. Специфичность связывания антитела можно подтверждать с помощью теста ингибирования. То есть, когда связывание между антителом, подлежащим анализу, и полноразмерным полипептидом NEIL3 является ингибированным в присутствии любого фрагмента полипептидов, состоящих из аминокислотной последовательности из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, показано, что антитело специфически связывается с фрагментом. По настоящему изобретению такие иммунологические анализы проводят в пределах различных форматов иммунологического анализа, хорошо известных в данной области, включая в качестве неограничивающих примеров, различные типы радиоиммунного анализа, способ иммунохроматографии, твердофазные иммуноферментные анализы (ELISA), твердофазные иммунофлуоресцентные ферментные анализы (ELIFA) и т.п.
Родственные иммунологические, но не связанные с антителами анализы по изобретению могут включать в себя также анализы иммуногенности T-клеток (ингибирующие или стимулирующие), также как анализы связывания MHC. Кроме того, изобретение относится также к иммунологическим способам получения изображений, способным детектировать злокачественные опухоли, экспрессирующие NEIL3, включая, в качестве неограничивающих примеров, радиосцинтиграфические способы получения изображений с использованием меченых антител по настоящему изобретению. Такие анализы могут находить клиническое применение для детекции, мониторирования и прогнозирования экспрессирующих NEIL3 злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML.
Настоящее изобретение также относится к антителу, связывающему пептид по изобретению. Антитело по изобретению можно использовать в любой форме, такой как моноклональные или поликлональные антитела, и они включают в себя антисыворотку, полученную посредством иммунизации животного, такого как кролик, с помощью пептида по изобретению, все классы поликлональных и моноклональных антител, человеческие антитела и гуманизированные антитела, полученные посредством генетической рекомбинации.
Пептид по изобретению, применяемый в качестве антигена для получения антитела, может происходить из любого вида животных, но предпочтительно происходит из такого животного, как человек, мышь или крыса, более предпочтительно - из человека. Происходящий из человека пептид может быть получен из нуклеотидных или аминокислотных последовательностей, описанных в настоящем документе.
В соответствии с настоящим изобретением, пептид, подлежащий использованию в качестве антигена для иммунизации, может представлять собой полный белок или частичный пептид белка. Частичный пептид может включать в себя, например, амино (N)-концевой или карбокси (C)-концевой фрагмент пептида по настоящему изобретению.
В настоящем документе антитело определяют как белок, узнающий либо полноразмерный пептид NEIL3, либо фрагмент пептида NEIL3. В предпочтительном варианте осуществления антитело по настоящему изобретению может узнавать фрагменты пептидов NEIL3, состоящие из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43. Способы синтеза олигопептидов хорошо известны в данной области. После синтеза пептиды, необязательно, можно очищать перед использованием в качестве иммуногена. По настоящему изобретению олигопептид (например, 9- или 10-членник) можно конъюгировать или связывать с носителями для усиления иммуногенности. Гемоцианин морского блюдечка (KLH) является хорошо известным в качестве носителя. Способы конъюгации KLH и пептида также хорошо известны в данной области.
Альтернативно, ген, кодирующий пептид по изобретению или его фрагмент, можно вставлять в известный экспрессирующий вектор, который затем используют для трансформации клетки-хозяина, как описано в настоящем описании. Желаемый пептид или его фрагмент можно выделять из внешнего или внутреннего пространства клеток-хозяев любым общепринятым способом, и затем можно использовать в качестве антигена. Альтернативно, целые клетки, экспрессирующие пептид, или их лизаты, или химически синтезированный пептид можно использовать в качестве антигена.
Любого млекопитающего животного можно иммунизировать с помощью антигена, но предпочтительно совместимость с родительскими клетками, используемыми для слияния клеток, принимают во внимание. Как правило, можно использовать животных из Rodentia, Lagomorpha или Primates. Животные из Rodentia включают в себя, например, мышь, крысу и хомяка. Животные из Lagomorpha включают в себя, например, кролика. Животные из Primates включают в себя, например, обезьян из Catarrhini (обезьян старого света), таких как Macaca fascicularis, макак-резус, гамадрила и шимпанзе.
Способы иммунизации животных с помощью антигенов известны в данной области. Внутрибрюшинная инъекция или подкожная инъекция антигенов является общепринятым способом иммунизации млекопитающих. Более конкретно, антигены можно разводить и суспендировать в соответствующем количестве фосфатно-солевого буфера (PBS), физиологического солевого раствора и т.д. Если желательно, суспензию антигена можно смешивать с соответствующим количеством общепринятого адъюванта, такого как полный адъювант Фрейнда, переводить в эмульсию и затем вводить млекопитающим животным. Предпочтительно, за этим следует несколько введений антигена, смешанного с соответствующим количеством неполного адъюванта Фрейнда, каждые 4-21 сутки. Подходящий носитель также можно использовать для иммунизации. После иммунизации, как выше, в сыворотке можно оценивать общепринятым способом увеличение количества желаемых антител.
Поликлональные антитела против пептидов по настоящему изобретению можно получать посредством сбора крови от иммунизированного млекопитающего, оценки увеличения уровня желаемых антител в сыворотке и отделения сыворотки от крови любым общепринятым способом. Поликлональные антитела, включая сыворотку, содержащую поликлональные антитела, также как фракцию, содержащую поликлональные антитела, можно выделять из сыворотки. Иммуноглобулин G или M можно получать из фракции, узнающей только пептид по настоящему изобретению, с использованием, например, аффинной колонки с присоединенным пептидом по настоящему изобретению, и дополнительно очищая эту фракцию с использованием колонки с белком A или белком G.
Для получения моноклональных антител иммунные клетки собирают от млекопитающего, иммунизированного антигеном, и проверяют увеличенный уровень желательных антител в сыворотке, как описано выше, и подвергают слиянию клеток. Иммунные клетки, применяемые для слияния клеток, можно предпочтительно получать из селезенки. Другие предпочтительные родительские клетки для слияния с вышеуказанным иммуноцитом включают в себя, например, клетки миеломы млекопитающих и, более предпочтительно, клетки миеломы, обладающие приобретенным свойством для отбора слитых клеток посредством лекарственных средств.
Вышеупомянутые иммуноцит и клетки миеломы можно подвергать слиянию известными способами, например, способ Milstein et al. (Galfre and Milstein, Methods Enzymol. 73:3-46 (1981)).
Полученные в результате гибридомы, полученные слиянием клеток, можно отбирать посредством их культивирования в общепринятой селективной среде, такой как среда HAT (среда, содержащая гипоксантин, аминоптерин и тимидин). Культивирование клеток, как правило, продолжают в среде HAT в течение нескольких суток - нескольких недель, времени, достаточного, чтобы позволить гибель всех других клеток, за исключением желательной гибридомы (не слитых клеток). Затем можно проводить общепринятое предельное разведение для скрининга и клонирования клетки гибридомы, продуцирующей желаемое антитело.
В дополнение к вышеуказанному способу, в котором не относящегося к человеку животного иммунизируют антигеном для получения гибридомы, лимфоциты человека, такие как инфицированные вирусом EB, можно иммунизировать пептидом, экспрессирующими пептид клетками или их лизатами in vitro. Затем иммунизированные лимфоциты сливают с происходящими из человека клетками миеломы, способными к неограниченному делению, такими как U266, для получения гибридомы, продуцирующей желаемое человеческое антитело, способное связываться с пептидом (не рассмотренная опубликованная патентная заявка Японии № Sho 63-17688).
Затем полученные гибридомы трансплантируют в брюшную полость мыши и выделяют асциты. Полученные моноклональные антитела можно очищать, например, посредством осаждения сульфатом аммония, колонки с белком A или белком G, ионообменной хроматографии на DEAE или аффинной колонки, с которой связан пептид по настоящему изобретению. Антитело по настоящему изобретению можно использовать не только для очистки и детекции пептида по настоящему изобретению, но также в качестве кандидата на агонисты и антагонисты пептида по настоящему изобретению.
Альтернативно, иммунную клетку, такую как иммунизированный лимфоцит, продуцирующую антитела, можно подвергать иммортализации посредством онкогена и использовать для получения моноклональных антител.
Моноклональные антитела, полученные таким образом, можно также получать рекомбинантным способом с использованием способов генной инженерии (см., например, Borrebaeck and Larrick, Therapeutic Monoclonal Antibodies, published in the United Kingdom by MacMillan Publishers LTD (1990)). Например, ДНК, кодирующую антитело, можно клонировать из иммунной клетки, такой как гибридома или иммунизированный лимфоцит, продуцирующей антитело, вставлять в подходящий вектор и вводить в клетки-хозяева для получения рекомбинантного антитела. Настоящее изобретение также относится к рекомбинантным антителам, полученным, как описано выше.
Более того, антитело по настоящему изобретению может представлять собой фрагмент антитела или модифицированное антитело, при условии, что оно связывается с одним или более из пептидов по изобретению. Например, фрагмент антитела может представлять собой Fab, F(ab')2, Fv или одноцепочечное Fv (scFv), в котором Fv фрагменты из H и L цепей лигированы посредством подходящего линкера (Huston et al., Proc. Natl. Acad. Sci USA 85:5879-83 (1988)). Более конкретно, фрагмент антитела можно получать обработкой антитела ферментом, таким как папаин или пепсин. Альтернативно, ген, кодирующий фрагмент антитела, можно конструировать, вставлять в экспрессирующий вектор и экспрессировать в подходящей клетке-хозяине (см., например, Co et al., J Immunol. 152:2968-76 (1994); Better and Horwitz, Methods Enzymol 178:476-96 (1989); Pluckthun and Skerra, Methods Enzymol 178:497-515 (1989); Lamoyi, Methods Enzymol 121:652-63 (1986); Rousseaux et al., Methods Enzymol 121:663-9 (1986); Bird and Walker, Trends Biotechnol 9:132-7 (1991)).
Антитело можно модифицировать посредством конъюгации с множеством молекул, таких как полиэтиленгликоль (PEG). Настоящее изобретение относится к таким модифицированным антителам. Модифицированное антитело можно получать химической модификацией антитела. Эти способы модификации являются общепринятыми в данной области.
Альтернативно, антитело по настоящему изобретению можно получать в форме химерного антитела, между вариабельной областью, происходящей из не относящегося к человеку антитела, и константной областью, происходящей из антитела человека, или в форме гуманизированного антитела, включающего определяющую комплементарность область (CDR), происходящую из не относящегося к человеку антитела, каркасную область (FR) и константную область, происходящую из антитела человека. Такие антитела можно получать известным способом. Гуманизацию можно проводить посредством замены последовательностями нескольких CDR или одной CDR грызунов соответствующих последовательностей из антитела человека (см., например, Verhoeyen et al., Science 239:1534-1536 (1988)). Соответственно, такие гуманизированные антитела представляют собой химерные антитела, где по существу менее чем интактный вариабельный домен человека заменен на соответствующую последовательность из не относящихся к человеку видов.
Можно использовать также полностью человеческие антитела, включающие человеческие вариабельные области в дополнение к человеческим каркасным и константным областям. Такие антитела можно получать с использованием различных способов, известных в данной области. Например, способы in vitro включают в себя использование рекомбинантных библиотек фрагментов антител человека, экспонированных на бактериофаге (например, Hoogenboom & Winter, J. Mol. Biol. 227:381 (1991). Подобным образом, человеческие антитела можно получать введением локусов иммуноглобулинов человека трансгенным животным, например, мышам, у которых эндогенные гены иммуноглобулинов частично или полностью инактивированы. Этот способ описан, например, в патентах США №№ 6150584, 5545807; 5545806; 5569825; 5625126; 5633425; 5661016.
Антитела, полученные, как изложено выше, можно очищать до гомогенности. Например, выделение и очистку антитела можно осуществлять способами выделения и очистки, применяемыми для обычных белков. Например, антитело можно отделять и выделять посредством соответствующим образом выбранного и комбинированного использования видов хроматографии на колонках, таких как аффинная хроматография, фильтрация, ультрафильтрация, высаливание, диализ, SDS-полиакриламидный гель-электрофорез и изоэлектрическая фокусировка (Antibodies: A Laboratory Manual. Ed Harlow and David Lane, Cold Spring Harbor Laboratory (1988)), но не ограниченных ими. Колонку с белком A и колонку с белком G можно использовать в качестве аффинной колонки. Иллюстративные колонки с белком A, подлежащие использованию, включают в себя, например, Hyper D, POROS и Sepharose F.F. (Pharmacia).
Иллюстративная хроматография, за исключением аффинной, включает в себя, например, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, обращеннофазовую хроматографию, адсорбционную хроматографию и т.п. (Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press (1996)). Способы хроматографии можно осуществлять посредством жидкофазной хроматографии, такой как HPLC и FPLC.
Например, измерение абсорбции, твердофазный иммуноферментный анализ (ELISA), ферментный иммуноанализ (EIA), радиоиммунный анализ (RIA) и/или иммунофлуоресценцию можно использовать для измерения активности связывания антигена для антитела по изобретению. В ELISA антитело по настоящему изобретению иммобилизуют на планшете, пептид по изобретению наносят на планшет, и затем наносят образец, содержащий желаемое антитело, такой как культуральный супернатант продуцирующих антитело клеток, или очищенные антитела. Затем наносят вторичное антитело, которое узнает первичное антитело и является меченым ферментом, таким как щелочная фосфатаза, и планшет инкубируют. Затем, после промывки, субстрат для фермента, такой как п-нитрофенилфосфат, добавляют в планшет и измеряют оптическую плотность для оценки активности связывания антигена из образца. Фрагмент пептида, такой как C-концевой или N-концевой фрагмент, можно использовать в качестве антигена для оценки активности связывания антитела. BIAcore (Pharmacia) можно использовать для оценки активности антитела в соответствии с настоящим изобретением.
Вышеуказанные способы позволяют детекцию или измерение пептида по изобретению посредством подвергания антитела по изобретению воздействию образца, предположительно, содержащего пептид по изобретению, и детекции или измерения иммунного комплекса, сформированного антителом и пептидом.
Поскольку способом детекции или измерения пептида по изобретению можно специфически детектировать или измерять пептид, способ может находить применение во множестве экспериментов, в которых используют пептид.
XII. Векторы и клетки-хозяева
Настоящее изобретение также относится к вектору и клетке-хозяину, в которые введен нуклеотид, кодирующий пептид по настоящему изобретению. Вектор по настоящему изобретению может находить применение для сохранения нуклеотида, особенно ДНК, по настоящему изобретению в клетке-хозяине для экспрессии пептида по настоящему изобретению или для введения нуклеотида по настоящему изобретению для генотерапии.
Когда E. coli является клеткой-хозяином, и вектор амплифицируют и продуцируют в большом количестве в E. coli (например, JM109, DH5 альфа, HB101 или XL1Blue), вектор должен обладать «ori» для амплификации в E. coli и маркерным геном для отбора трансформированной E. coli (например, ген устойчивости к лекарственному средству для селекции посредством лекарственного средства, такого как ампициллин, тетрациклин, канамицин, хлорамфеникол или т.п.). Например, можно использовать векторы M13-серий, векторы pUC-серий, pBR322, pBluescript, PCR-Script и т.д. Кроме того, pGEM-T, pDIRECT и pT7 также можно использовать для субклонирования и выделения кДНК, также как векторы, описанные выше. Когда вектор используют для получения белка по настоящему изобретению, экспрессирующий вектор может находить применение. Например, экспрессирующий вектор для экспрессии в E. coli должен обладать вышеуказанными характеристиками для амплификации в E. coli. Когда E. coli, такую как JM109, DH5 альфа, HB101 или XL1 Blue используют в качестве клетки-хозяина, вектор должен обладать промотором, например, промотором lacZ (Ward et al., Nature 341:544-6 (1989); FASEB J 6:2422-7 (1992)), промотором araB (Better et al., Science 240:1041-3 (1988)), промотором T7 или т.п., которые могут эффективно экспрессировать желательный ген в E. coli. В этом отношении pGEX-5X-1 (Pharmacia), «QIAexpress system» (Qiagen), pEGFP и pET (в этом случае хозяин предпочтительно представляет собой BL21, экспрессирующий T7 РНК-полимеразу), например, можно использовать вместо вышеуказанных векторов. Кроме того, вектор может также содержать сигнальную последовательность для секреции пептида. Иллюстративной сигнальной последовательностью, направляющей подлежащий секреции пептид в периплазму E. Coli, является сигнальная последовательность pelB (Lei et al., J Bacteriol. 169:4379 (1987)). Способы введения векторов в намеченные клетки-хозяева включают в себя, например, способ с хлоридом кальция и способ электропорации.
В дополнение к E. coli, например, экспрессирующие векторы, полученные из млекопитающих (например, pcDNA3 (Invitrogen) и pEGF-BOS (Nucleic Acids Res 18(17):5322 (1990)), pEF, pCDM8), экспрессирующие векторы, полученные из клеток насекомых (например, «Bac-to-BAC baculovirus expression system» (GIBCO BRL), pBacPAK8), экспрессирующие векторы, полученные из растений (например, pMH1, pMH2), экспрессирующие векторы, полученные из вирусов животных (например, pHSV, pMV, pAdexLcw), экспрессирующие векторы, полученные из ретровирусов (например, pZIpneo), экспрессирующий вектор, полученный из дрожжей (например, «Pichia Expression Kit» (Invitrogen), pNV11, SP-Q01), и экспрессирующие векторы, полученные из Bacillus subtilis (например, pPL608, pKTH50), можно использовать для получения полипептида по настоящему изобретению.
Для экспрессии вектора в клетках животных, таких как клетки CHO, COS или NIH3T3, вектор должен обладать промотором, необходимым для экспрессии в таких клетках, например, промотором SV40 (Mulligan et al., Nature 277:108 (1979)), промотором MMLV-LTR, промотором EF1 альфа (Mizushima et al., Nucleic Acids Res 18:5322 (1990)), промотором CMV и т.п. и предпочтительно маркерным геном для отбора трансформантов (например, ген устойчивости к лекарственному средству для селекции посредством лекарственного средства (например, неомицин, G418)). Примеры известных векторов с этими характеристиками включают в себя, например, pMAM, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
XIII. Способ диагностики злокачественных опухолей:
Настоящее изобретение также относится к способу диагностики злокачественных опухолей. Обнаружено, что экспрессия NEIL3 специфически повышена в нескольких видах клеток злокачественных опухолей (таблица 1 и фиг.5). Таким образом, гены, идентифицированные в настоящем документе, также как продукты их транскрипции и трансляции, находят диагностическое применение в качестве маркеров злокачественных опухолей, и посредством измерения экспрессии NEIL3 в биологическом образце (например, образце клеток) можно диагностировать злокачественную опухоль. Конкретно, настоящее изобретение относится к способу диагностики злокачественной опухоли посредством определения уровня экспрессии NEIL3 у субъекта. Злокачественные опухоли, которые можно диагностировать настоящим способом, включают в себя в качестве неограничивающих примеров злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, рак предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML. Более того, NSCLC, включая аденокарциному легких и плоскоклеточную карциному легких (SCC), также можно диагностировать или детектировать по настоящему изобретению.
В соответствии с настоящим изобретением, можно предоставлять промежуточный результат для оценки состояния субъекта. Такой промежуточный результат можно объединять с дополнительной информацией, чтобы помогать врачу, медицинской сестре или другому практикующему специалисту в постановке диагноза, что субъект страдает заболеванием. Альтернативно, настоящее изобретение можно использовать для детекции злокачественных клеток в полученной от субъекта ткани и обеспечения врача полезной информацией для постановки диагноза, что субъект страдает заболеванием.
Конкретно, настоящее изобретение относится к следующим способам [1]-[10]:
[1] Способ диагностики злокачественной опухоли, где указанный способ включает в себя стадии:
(a) детекции уровня экспрессии гена, кодирующего аминокислотную последовательность NEIL3, в биологическом образце; и
(b) корреляции детектированного уровня экспрессии по сравнению с нормальным контрольным уровнем гена с присутствием заболевания.
[2] Способ по [1], где уровень экспрессии по меньшей мере на 10% более нормального контрольного уровня.
[3] Способ по [1], где уровень экспрессии детектируют способами, выбранными из:
(a) детекции мРНК, включающей последовательность NEIL3,
(b) детекции белка, включающего аминокислотную последовательность NEIL3, и
(c) детекции биологической активности белка, включающего аминокислотную последовательность NEIL3.
[4] Способ по [1], где злокачественная опухоль выбрана из группы из злокачественной опухоли мочевого пузыря, злокачественной опухоли молочной железы, злокачественной опухоли шейки матки, холангиоцеллюлярной карциномы, злокачественной опухоли ободочной и прямой кишки, эндометриоза, злокачественной опухоли пищевода, злокачественной опухоли печени, NSCLC, остеосаркомы, злокачественной опухоли поджелудочной железы, злокачественной опухоли предстательной железы, карциномы почки, SCLC, опухоли мягких тканей, AML и CML.
[5] Способ по [3], где уровень экспрессии определяют посредством детекции гибридизации зонда с генным транскриптом гена.
[6] Способ по [3], где уровень экспрессии определяют посредством детекции связывания антитела против белка, кодируемого геном, в качестве уровня экспрессии гена.
[7] Способ по [1], где биологический образец включает в себя биоптат, слюну, кровь, плевральный выпот или мочу.
[8] Способ по [1], где полученный от субъекта биологический образец включает в себя эпителиальную клетку.
[9] Способ по [1], где полученный от субъекта биологический образец включает в себя клетку злокачественной опухоли.
[10] Способ по [1], где полученный от субъекта биологический образец включает в себя злокачественную эпителиальную клетку.
Альтернативно, настоящее изобретение относится к способу детекции или идентификации клеток злокачественных опухолей в полученном от субъекта образце ткани, где указанный способ включает в себя стадию определения уровня экспрессии гена NEIL3 в полученном от субъекта биологическом образце, где увеличение указанного уровня экспрессии по сравнению с нормальным контрольным уровнем указанного гена указывает на присутствие или подозрение на присутствие клеток злокачественных опухолей в ткани.
Такой результат можно объединять с дополнительной информацией, чтобы помогать врачу, медицинской сестре или другому практикующему специалисту в постановке диагноза, что субъект страдает заболеванием. Иными словами, настоящее изобретение может обеспечивать врача полезной информацией для постановки диагноза, что субъект страдает заболеванием. Например, в соответствии с настоящим изобретением, когда присутствуют сомнения относительно присутствия клеток злокачественных опухолей в ткани, полученной от субъекта, клинические заключения можно получать с учетом уровня экспрессии гена NEIL3, плюс различных аспектов заболевания, включая патологию тканей, уровни известного маркера(маркеров) опухоли в крови и течение заболевания у субъекта и т.д.
Например, некоторые хорошо известные диагностические маркеры в крови злокачественной опухоли мочевого пузыря, злокачественной опухоли молочной железы, злокачественной опухоли шейки матки, холангиоцеллюлярной карциномы, злокачественной опухоли ободочной и прямой кишки, эндометриоза, злокачественной опухоли пищевода, злокачественной опухоли печени, NSCLC, остеосаркомы, злокачественной опухоли поджелудочной железы, злокачественной опухоли предстательной железы, карциномы почки, SCLC, опухоли мягких тканей, AML и CML являются следующими:
злокачественная опухоль мочевого пузыря; SCC, TPA или IAP
злокачественная опухоль молочной железы; BCA225, TPA, CEA, IAP или CA15-3
злокачественная опухоль шейки матки; SCC, TPA или CA125
холангиоцеллюлярная карцинома; CA19-9 или CEA
злокачественная опухоль ободочной и прямой кишки; CEA
эндометриоз; CA125
злокачественная опухоль пищевода; CEA, DUPAN-2, IAP, NSE, SCC, SLX или Span-1
злокачественная опухоль печени; AFP или ICDH
NSCLC; CEA
остеосаркома; ALP
злокачественная опухоль поджелудочной железы; BFP, CA19-9, CA125 или CEA
злокачественная опухоль предстательной железы; PSA или PAP
почечноклеточный рак; IAP
SCLC; ProGRP или NSE
AML; активность TK
CML; активность TK
А именно, в этом конкретном варианте осуществления настоящего изобретения результат анализа экспрессии гена служит промежуточным результатом для дальнейшей диагностики состояния заболевания субъекта.
В другом варианте осуществления настоящее изобретение относится к способу детекции диагностического маркера злокачественной опухоли, где указанный способ включает в себя стадию детекции экспрессии гена NEIL3 в полученном от субъекта биологическом образце в качестве диагностического маркера злокачественной опухоли пузыря, злокачественной опухоли молочной железы, злокачественной опухоли шейки матки, холангиоцеллюлярной карциномы, злокачественной опухоли ободочной и прямой кишки, эндометриоза, злокачественной опухоли пищевода, злокачественной опухоли печени, NSCLC, остеосаркомы, злокачественной опухоли поджелудочной железы, злокачественной опухоли предстательной железы, карциномы почки, SCLC, опухоли мягких тканей, AML и CML, но ограниченных ими.
Способ диагностики злокачественной опухоли более подробно описан ниже.
Субъект, подлежащий диагностике по настоящему способу, предпочтительно является млекопитающим. Млекопитающие включают в себя в качестве неограничивающих примеров, например, человека, не относящегося к человеку примата, мышь, крысу, собаку, ковку, лошадь и корову.
Является предпочтительным отбирать биологический образец у субъекта, подлежащего диагностике, для проведения диагностики. Любой биологический материал можно использовать в качестве биологического образца для определения, при условии, что он включает целевой продукт транскрипции или трансляции NEIL3. Биологические образцы включают в себя, в качестве неограничивающих примеров, ткани и жидкости организма, такие как кровь, слюна и моча. В некоторых вариантах осуществления биологический образец содержит популяцию клеток, содержащую эпителиальную клетку, более предпочтительно - злокачественную эпителиальную клетку или эпителиальную клетку, происходящую из ткани, предположительно, злокачественной. Кроме того, при необходимости, клетку можно очищать из полученных тканей и жидкостей организма, и затем использовать в качестве биологического образца.
В соответствии с настоящим изобретением, определяют уровень экспрессии NEIL3 в полученном от субъекта биологическом образце. Уровень экспрессии можно определять на уровне продукта транскрипции (нуклеиновой кислоты) с использованием способов, известных в данной области. Например, мРНК NEIL3 можно количественно оценивать с использованием способов гибридизации с зондами (например, Нозерн-гибридизация). Детекцию можно осуществлять на чипе или массиве. Применение массива может являться предпочтительным для детекции уровня экспрессии множества генов (например, различных специфических для злокачественных опухолей генов), включая NEIL3. Специалисты в данной области могут получать такие зонды с использованием информации о последовательности NEIL3 (SEQ ID NO:44; инвентарный номер в GenBank: NM_018248). Например, кДНК NEIL3 можно использовать в качестве зондов. При необходимости зонд можно метить подходящей меткой, такой как красители, флуоресцентные вещества и изотопы, и уровень экспрессии гена можно детектировать как интенсивность прогибридизовавшихся меток.
Более того, продукт транскрипции NEIL3 можно оценивать количественно с использованием праймеров посредством основанных на амплификации способов детекции (например, RT-PCR). Такие праймеры можно также получать на основе доступной информации о последовательности гена. Например, праймеры (SEQ ID NO:46 и 47), используемые в примере, можно применять для детекции посредством RT-PCR или Нозерн-блоттинга, однако настоящее изобретение не является ограниченным этим.
Конкретно, зонд или праймер, применяемый по настоящему способу, гибридизуется в условиях строгости, умеренной строгости или низкой строгости с мРНК NEIL3.
Альтернативно, продукт трансляции можно детектировать для диагностики по настоящему изобретению. Например, можно определять количество белка NEIL3. Способ определения количества белка как продукта трансляции включает в себя способы иммуноанализа, в которых применяют антитело, специфически узнающее белок. Антитело может являться моноклональным или поликлональным. Более того, любой фрагмент или модификацию (например, химерное антитело, scFv, Fab, F(ab')2, Fv и т.д.) антитела можно использовать для детекции, при условии, что фрагмент или модифицированное антитело сохраняет способность связывания с белком NEIL3. Способы для получения этих видов антител для детекции белков хорошо известны в данной области, и любой способ можно применять по настоящему изобретению для получения таких антител и их эквивалентов.
В качестве другого способа детекции уровня экспрессии гена NEIL3 на основании продукта его трансляции интенсивность окрашивания можно измерять посредством иммуногистохимического анализа с использованием антитела против белка NEIL3. А именно, наблюдение сильного окрашивания указывает на присутствие белка и в то же самое время на высокий уровень экспрессии гена NEIL3.
Более того, в дополнение к уровню экспрессии гена NEIL3, уровень экспрессии других опухолеассоциированных генов, например, генов с известной дифференциальной экспрессией при злокачественной опухоли, также можно определять для улучшения точности диагностики.
Уровень экспрессии маркерного гена злокачественных опухолей, включая ген NEIL3, в биологическом образце можно рассматривать как увеличенный, если он увеличен по сравнению с контрольным уровнем соответствующего маркерного гена злокачественных опухолей, например, на 10%, 25% или 50%; или увеличен более чем в 1,1 раза, более чем в 1,5 раза, более чем в 2,0 раза, более чем в 5,0 раз, более чем в 10,0 раз или более.
Контрольный уровень можно определять в одно и то же время с тестируемым биологическим образцом с использованием образца(образцов), ранее собранных и сохраненных от субъекта/субъектов, состояние заболевания которых (наличие злокачественной опухоли или отсутствие злокачественной опухоли) известно/известны. Альтернативно, контрольный уровень можно определять статистическим способом на основании результатов, полученных анализом ранее определенного уровня(уровней) экспрессии гена NEIL3 в образцах от субъектов, состояние заболевания которых известно. Более того, контрольный уровень может представлять собой базу данных картин экспрессии ранее тестированных клеток. Более того, в аспекте настоящего изобретения, уровень экспрессии гена NEIL3 в биологическом образце можно сравнивать с множеством контрольных уровней, определенных из множества контрольных образцов. Является предпочтительным использовать контрольный уровень, определенный из сравнительного образца, происходящего из типа ткани, сходного с типом ткани, происходящего из субъекта биологического образца. Более того, является предпочтительным использовать стандартное значение уровней экспрессии гена NEIL3 в популяции с известным состоянием заболевания. Стандартное значение можно получать любым способом, известным в данной области. Например, диапазон среднее +/- 2 S.D. или среднее +/- 3 S.D. можно использовать в качестве стандартного значения.
Когда уровень экспрессии гена NEIL3 является увеличенным по сравнению с нормальным контрольным уровнем, или является сходным с контрольным уровнем для злокачественной опухоли, субъекта можно диагностировать как страдающего злокачественной опухолью или подверженного риску развития злокачественной опухоли. Более того, в случае, когда сравнивают уровни экспрессии множества связанных со злокачественной опухолью генов, сходство картины экспрессии гена между образцом и сравнительным образцом, являющимся злокачественным, указывает на то, что субъект является страдающим злокачественной опухолью или подверженным риску развития злокачественной опухоли.
Разницу между уровнями экспрессии тестируемого биологического образца и контрольным уровнем можно нормализовать по уровню экспрессии контрольных нуклеиновых кислот, например, генов домашнего хозяйства, уровни экспрессии которых, как известно, не изменяются в зависимости от злокачественного или незлокачественного состояния клетки. Контрольные гены включают в себя в качестве неограничивающих примеров, бета-актин, глицеральдегид-3-фосфатдегидрогеназу и рибосомальный белок P1.
Хотя способы и материалы, сходные или эквивалентные с описанными в настоящем документе, можно использовать в практическом осуществлении или тестировании настоящего изобретения, подходящие способы и материалы описаны ниже. Полное содержание всех публикаций, патентных заявок, патентов и других документов, упомянутых в настоящем документе, приведено в качестве ссылки. В случае конфликта настоящее описание, включая определения, имеет преимущество. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Изобретение далее описано в следующих примерах, не ограничивающих объем изобретения, описанный в формуле изобретения.
Примеры
Материалы и методы
Линии клеток
T2 (HLA-A2), линия B-лимфобластных клеток человека, и COS7, линия клеток африканской зеленой мартышки, закуплены в ATCC, и PSCCA0922 (HLA-*A0206) закуплена в Japan Health Sciences Foundation. TISI, HLA-A*2402-положительная линия B-лимфобластных клеток закуплена в IHWG Cell and Gene Bank (Seattle, WA).
Отбор кандидатов из пептидов, происходящих из NEIL3
9-членные и 10-членные пептиды, происходящие из NEIL3, связывающиеся с молекулой HLA-A*0201, предсказывали с использованием программного обеспечения для предсказания связывания «BIMAS» (www-bimas.cit.nih.gov/molbio/hla_bind) (Parker et al. (J Immunol. 1994, 152(1):163-75), Kuzushima et al. (Blood 2001, 98(6):1872-81)). 9-членные и 10-членные пептиды, происходящие из NEIL3, связывающиеся с молекулой HLA-A*2402, предсказывали с использованием сервера для предсказания связывания «NetMHC3.0» (www.cbs.dtu.dk/services/NetMHC/) (Buus et al. (Tissue Antigens., 62:378-84, 2003), Nielsen et al. (Protein Sci., 12:1007-17, 2003, Bioinformatics, 20(9):1388-97, 2004)). Эти пептиды синтезировали в Biosynthesis Inc. (Lewisville, TX) общепринятым способом твердофазного синтеза и очищали обращеннофазовой высокоэффективной жидкостной хроматографией (HPLC). Чистоту (>90%) и идентичность пептидов определяли аналитической HPLC и анализом масс-спектрометрии, соответственно. Пептиды растворяли в диметилсульфоксиде (DMSO) при 20 мг/мл и сохраняли при -80°C.
Индукция CTL in vitro
Происходящие из моноцитов дендритные клетки (DC) использовали в качестве антигенпредставляющих клеток (APC) для индукции ответов цитотоксических T-лимфоцитов (CTL) против пептидов, представляемых на лейкоцитарном антигене человека (HLA). DC получали in vitro, как описано в другом месте (Nakahara S. et al., Cancer Res 2003 Jul 15, 63(14):4112-8). Конкретно, мононуклеарные клетки периферической крови (PBMC), выделенные от нормального добровольца (положительного по HLA-A*0201 или HLA-A*0206) посредством раствора Ficoll-Plaque (Pharmacia), разделяли посредством адгезии к пластиковой чашке для культивирования клеток (Becton Dickinson), так чтобы обогатить их как фракцию моноцитов. Обогащенную моноцитами популяцию культивировали в присутствии 1000 ед./мл гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) (R&D System) и 1000 ед./мл интерлейкина (IL)-4 (R&D System) в среде AIM-V (Invitrogen), содержащей 2% инактивированную нагреванием аутологичную сыворотку (AS). Через 7 суток культивирования индуцированные цитокином DC активировали 20 микрограмм/мл каждого из синтезированных пептидов в присутствии 3 микрограмм/мл бета-2-микроглобулина в течение 3 час при 37°C в среде AIM-V. Полученные клетки, по-видимому, экспрессируют DC-ассоциированные молекулы, такие как CD80, CD83, CD86 и HLA класса II, на их клеточных поверхностях (данные не представлены). Затем эти сенсибилизированные пептидом DC инактивировали облучением рентгеновскими лучами (20 Гр) и смешивали в соотношении 1:20 с аутологичными CD8+ T-клетками, полученными положительным отбором с помощью набора для выделения положительных по CD8 клеток (Dynal). Эти культуры организовывали в 48-луночных планшетах (Corning); где каждая лунка содержит 1,5×104 сенсибилизированных пептидом DC, 3×105 CD8+ T-клеток и 10 нг/мл IL-7 (R&D System) в 0,5 мл среды AIM-V/2% AS. Через трое суток эти культуры дополняли IL-2 (CHIRON) до конечной концентрации 20 ИЕ/мл. На сутки 7 и 14 T-клетки дополнительно стимулировали с помощью сенсибилизированных аутологичным пептидом DC. DC каждый раз получали одним и тем же способом, как описано выше. CTL тестировали против сенсибилизированных пептидом клеток T2 или PSCCA0922 после 3-го цикла стимуляции пептидом на сутки 21 (Tanaka H. et al., Br J Cancer 2001 Jan 5, 84(1):94-9; Umano Y. et al., Br J Cancer 2001 Apr 20, 84(8):1052-7; Uchida N. et al., Clin. Cancer Res 2004 Dec 15, 10(24):8577-86; Suda T. et al., Cancer Sci 2006 May, 97(5):411-9; Watanabe T. et al., Cancer Sci 2005 Aug, 96(8):498-506).
Способ размножения CTL
CTL размножали в культуре с использованием способа, сходного со способом, описанным в Riddell et al. (Walter E.A. et al., N Engl. J Med. 1995 Oct 19, 333(16):1038-44; Riddell S.R. et al., Nat. Med. 1996 Feb, 2(2):216-23). Всего 5×104 CTL суспендировали в 25 мл среды AIM-V/5% AS с 2 видами линий B-лимфобластных клеток человека, инактивированных посредством MMC, в присутствии 40 нг/мл моноклонального антитела против CD3 (Pharmingen). Через одни сутки после начала культивирования 120 ИЕ/мл IL-2 добавляли к культурам. Культуры подпитывали свежей средой AIM-V/5% AS, содержащей 30 ИЕ/мл IL-2 на сутки 5, 8 и 11 (Tanaka H. et al., Br J Cancer 2001 Jan 5, 84(1):94-9; Umano Y. et al., Br J Cancer 2001 Apr 20, 84(8):1052-7; Uchida N. et al., Clin. Cancer Res 2004 Dec 15, 10(24):8577-86; Suda T. et al., Cancer Sci 2006 May, 97(5):411-9; Watanabe T. et al., Cancer Sci 2005 Aug, 96(8):498-506).
Получение клонов CTL
Проводили разведения для получения 0,3, 1 и 3 CTL/лунку в 96-луночном круглодонном планшете для микротитрования (Nalge Nunc International). CTL культивировали с 1×104 клеток/лунку 2 видов линий B-лимфобластных клеток человека, 30 нг/мл антитела против CD3 и 125 ед./мл IL-2 всего в 150 микролитров/лунку среды AIM-V, содержащей 5%AS. 50 микролитров/лунку IL-2 добавляли к среде через 10 суток для достижения конечной концентрации 125 ед./мл IL-2. Активность CTL тестировали на 14-е сутки, и клоны CTL размножали с использованием такого же способа, как описано выше (Uchida N. et al., Clin. Cancer Res 2004 Dec 15, 10(24):8577-86; Suda T. et al., Cancer Sci 2006 May, 97(5):411-9; Watanabe T. et al., Cancer Sci 2005 Aug, 96(8):498-506).
Специфическая активность CTL
Для оценки специфической активности CTL проводили точечный иммуноферментный анализ (ELISPOT) интерферона (IFN)-гамма и твердофазный иммуноферментный анализ (ELISA) IFN-гамма. Конкретно, сенсибилизированные пептидом T2 (1×104/лунку) получали в качестве стимулирующих клеток. Культивированные клетки в 48 лунках использовали в качестве отвечающих клеток. Анализ ELISPOT IFN-гамма и анализ ELISA IFN-гамма проводили по способу производителя.
Трансфекция плазмидой
кДНК, кодирующую открытую рамку считывания генов-мишеней, HLA-A*0201, HLA-A*0206 или HLA-A*2402, амплифицировали посредством PCR. Амплифицированный продукт PCR клонировали в вектор. Плазмидами трансфицировали COS7, представляющие собой линию клеток, отрицательную по генам-мишеням и HLA-A2- и A24-, с использованием липофектамина 2000 (Invitrogen), согласно рекомендованным производителем способам. Через 2 суток после трансфекции трансфицированные клетки собирали с помощью раствора Версена (Invitrogen) и использовали в качестве клеток-мишеней (5×104 клеток/лунку) для анализа активности CTL.
Полуколичественный анализ RT-PCR
Тотальную РНК выделяли с помощью набора Qiagen RNeasy (Qiagen) или реагента тризола (Life Technologies, Inc.) согласно способам производителя. Аликвоты по десять микрограмм тотальной РНК подвергали обратной транскрипции до одноцепочечных кДНК с использованием поли-dT12-18-праймера (Amersham Pharmacia Biotech) с помощью обратной транскриптазы Superscript II (Life Technologies). Каждый препарат одноцепочечной кДНК разводили для последующей амплификации PCR посредством общепринятых экспериментов RT-PCR, проводимых в объемах по 12 микролитров буфера для PCR (TAKARA). Амплификацию проводили в течение 4 мин при 94°C для денатурации, с последующими 28 циклами 94°C в течение 30 с, 60°C в течение 30 с и 72°C в течение 60 с в системе для PCR GeneAmp 9700 (Perkin-Elmer, Foster City, CA). Последовательности праймеров представляли собой для NEIL3: прямой, 5'-TTGGTCCTCCTCTGTTTCATAGA-3' (SEQ ID NO:46) и обратный, 5'-GCTTCTCCCCAGTTACAAGAGAC-3' (SEQ ID NO:47).
Результаты
Увеличенная экспрессия NEIL3 в злокачественных опухолях
Данные общей картины экспрессии генов, полученные для различных злокачественных опухолей с использованием кДНК-микромассивов, выявили, что экспрессия NEIL3 (инвентарный № в GenBank NM_018248; SEQ ID NO:44) являлась повышенной. Экспрессия NEIL3 являлась воспроизводимо повышенной в 4 из 20 AML, 5 из 6 видов злокачественной опухоли мочевого пузыря, 10 из 11 видов злокачественной опухоли молочной железы, 8 из 8 видов злокачественной опухоли шейки матки, 1 из 1 холангиоцеллюлярной карциномы, 12 из 12 CML, 3 из 6 видов злокачественной опухоли ободочной и прямой кишки, 1 из 1 эндометриоза, 4 из 8 злокачественных опухолей пищевода, 6 из 10 видов злокачественной опухоли печени, 7 из 7 NSCLC, 16 из 16 остеосарком, 1 из 1 злокачественной опухоли поджелудочной железы, 10 из 10 видов злокачественной опухоли предстательной железы, 2 из 2 карцином почки, 12 из 12 SCLC и 12 из 12 опухолей мягких тканей по сравнению с соответствующей нормальной тканью (таблица 1).
Соотношение наблюдаемой повышающей регуляции NEIL3 в злокачественной ткани по сравнению с соответствующей нормальной тканью
(Эксперимент 1)
Предсказание связывающих HLA-A2 пептидов, происходящих из NEIL3
В таблице 2 показаны связывающие HLA-A2 пептиды из NEIL3 в порядке высоты аффинности связывания. Всего 23 пептида с потенциальной способностью связывания HLA-A2 выбраны и оценены для определения пептидов-эпитопов (таблица 2).
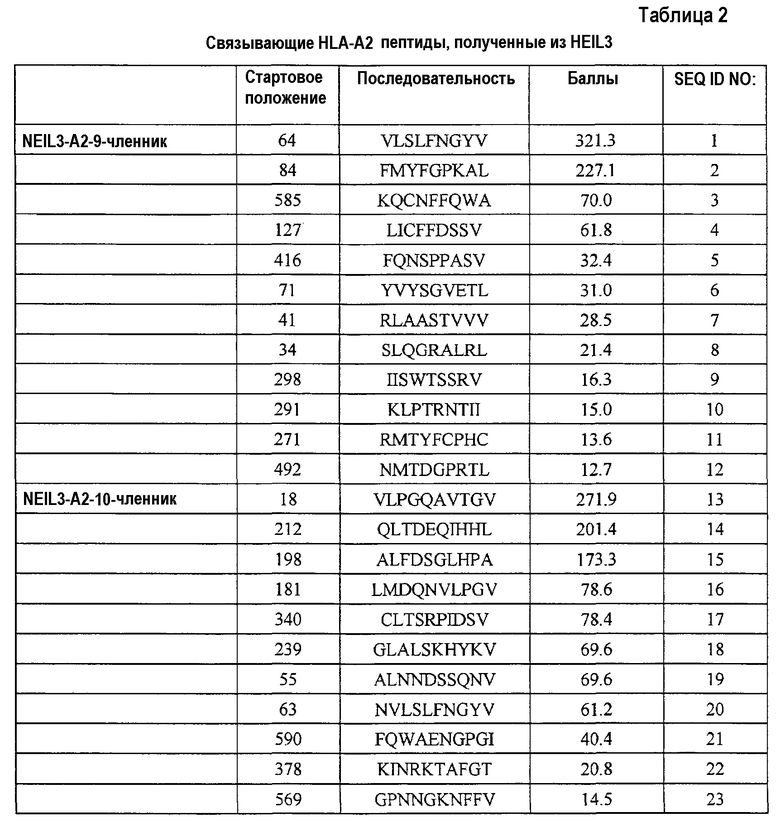
Стартовое положение указывает номер аминокислотного остатка от N-конца NEIL3.
Баллы связывания получены из «BIMAS».
Индукция CTL с помощью предсказанных пептидов из NEIL3, рестриктированных по HLA-A*0201 или 0206, и получение линий CTL, стимулированных с помощью полученных из NEIL3 пептидов
CTL для этих пептидов, происходящих из NEIL3, получали согласно способам, как описано в разделе «Материалы и методы». Специфическую для пептида активность CTL определяли посредством анализа ELISPOT IFN-гамма (фиг.1a-j). На них показано, что для лунки №8, стимулированной с помощью NEIL3-A2-9-585 (SEQ ID NO:3) (a), №2 - с помощью NEIL3-A2-9-127 (SEQ ID NO:4) (b), №4 и 5 - с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (c), №3 - с помощью NEIL3-A2-9-71 (SEQ ID NO:6) (d), №1 - с помощью NEIL3-A2-9-271 (SEQ ID NO:11) (e), №3 - с помощью NEIL3-A2-10-198 (SEQ ID NO:15) (f), №1 - с помощью NEIL3-A2-10-340 (SEQ ID NO:17) (g), №2 и 3 - с помощью NEIL3-A2-10-590 (SEQ ID NO:21) (h) и №6 - с помощью NEIL3-A2-10-378 (SEQ ID NO:22) (i), показали сильную продукцию IFN-гамма по сравнению с контрольными лунками. Кроме того, для лунок №9, 10, 12 и 13 с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (j) показали сильную продукцию IFN-гамма против сенсибилизированных пептидом положительных по A0206 клеток PSCCA0922. Более того, клетки в положительной лунке №8, стимулированные с помощью NEIL3-A2-9-585 (SEQ ID NO:3), №2 - с помощью NEIL3-A2-9-127 (SEQ ID NO:4), №4 и 5 - с помощью NEIL3-A2-9-416 (SEQ ID NO:5), №3 - с помощью NEIL3-A2-9-71 (SEQ ID NO:6), №1 - с помощью NEIL3-A2-9-271 (SEQ ID NO:11), №3 - с помощью NEIL3-A2-10-198 (SEQ ID NO:15) и, №2 и 3 - с помощью NEIL3-A2-10-590 (SEQ ID NO:21), размножали и получали линии CTL, и №10 и 12 - с помощью NEIL3-A2-9-416 для A0206 (SEQ ID NO:5) также размножали и получали линии CTL. Активность CTL этих линий CTL определяли анализом ELISA IFN-гамма (фиг.2a-k). На них показано, что для всех линий CTL показали сильную продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, по сравнению с клетками-мишенями без сенсибилизации пептидом. С другой стороны, не удалось получить линии CTL стимуляцией с помощью других пептидов, показанных в таблице 2, несмотря на то, что эти пептиды обладали возможной активностью связывания с HLA-A*0201 (данные не представлены). В результате, показано, что 7 пептидов, происходящих из NEIL3, отобраны при скрининге в качестве пептидов, которые могут индуцировать активные CTL.
Получение клонов CTL против специфических пептидов NEIL3
Клоны CTL получали предельным разведением из линий CTL, как описано в разделе «Материалы и методы», и продукцию IFN-гамма клонов CTL против клеток-мишеней, сенсибилизированных пептидом, определяли анализом ELISA IFN-гамма. Определили сильную продукцию IFN-гамма клонами CTL, стимулированными с помощью SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:15 и SEQ ID NO:21 на фиг.3.
Специфическая активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*0201 или HLA-A*0206
Полученные линии CTL, стимулированные против этих пептидов, оценивали по их способности узнавать клетки-мишени с эндогенной экспрессией NEIL3 и молекулы HLA-A*0201 или HLA-A*0206. Специфическую активность CTL против клеток COS7, трансфицированных геном как полноразмерного NEIL3, так и молекулы HLA-A*0201 или HLA-A*0206 (специфическая модель для клеток-мишеней с экзогенной экспрессией гена NEIL3 и HLA-A*0201 или HLA-A*0206), тестировали с использованием линий CTL, стимулированных соответствующим пептидом, в качестве эффекторных клеток. Клетки COS7, трансфицированные геном либо полноразмерного NEIL3, либо HLA-A* 0201 или HLA-A*0206, получали в качестве контроля. На фиг.4 для CTL, стимулированных с помощью SEQ ID NO:5, SEQ ID NO:6 и SEQ ID NO:15, показали сильную активность CTL против клеток COS7, экспрессирующих как NEIL3, так и HLA-A* 0201, и для CTL, стимулированных с помощью SEQ ID NO:5, также показали сильную активность CTL против клеток COS7, экспрессирующих как NEIL3, так и HLA-A* 0206. С другой стороны, не детектировали значительной специфической активности CTL против контроля. Таким образом, эти данные ясно показывают, что NEIL3-A2-9-416 (SEQ ID NO:5), NEIL3-A2-9-71 (SEQ ID NO:6) и NEIL3-A2-10-198 (SEQ ID NO:15) являлись естественным образом экспрессированными на клетках-мишенях с молекулой HLA-A*0201 и являлись узнаваемыми CTL, и NEIL3-A2-9-416 (SEQ ID NO:5) также являлся естественным образом экспрессированным на клетках-мишенях с молекулой HLA-A*0206 и являлся узнаваемым CTL. Эти результаты показывают, что эти пептиды, происходящие из NEIL3, могут являться доступными для применения в противораковых вакцинах для пациентов с экспрессирующими NEIL3 опухолями.
Анализ гомологии антигенных пептидов
Для CTL, стимулированных с помощью NEIL3-A2-9-585 (SEQ ID NO:3), NEIL3-A2-9-127 (SEQ ID NO:4), NEIL3-A2-9-416 (SEQ ID NO:5), NEIL3-A2-9-71 (SEQ ID NO:6), NEIL3-A2-9-271 (SEQ ID NO:11), NEIL3-A2-10-198 (SEQ ID NO:15), NEIL3-A2-10-340 (SEQ ID NO:17), NEIL3-A2-10-590 (SEQ ID NO:21) и NEIL3-A2-10-378 (SEQ ID NO:22), показали значительную и специфическую активность CTL. Этот результат может быть обусловлен тем фактом, что последовательности NEIL3-A2-9-585 (SEQ ID NO:3), NEIL3-A2-9-127 (SEQ ID NO:4), NEIL3-A2-9-416 (SEQ ID NO:5), NEIL3-A2-9-71 (SEQ ID NO:6), NEIL3-A2-9-271 (SEQ ID NO:11), NEIL3-A2-10-198 (SEQ ID NO:15), NEIL3-A2-10-340 (SEQ ID NO:17), NEIL3-A2-10-590 (SEQ ID NO:21) и NEIL3-A2-10-378 (SEQ ID NO:22) являются гомологичными пептидам, происходящим из других молекул, известных как сенсибилизирующие иммунную систему человека. Для исключения этой возможности для этих пептидных последовательностей в качестве запросов проводили анализы гомологии с использованием алгоритма BLAST (www.ncbi.nlm.nih.gov/blast/blast.cgi), которые не выявили последовательностей со значительной гомологией. Результаты анализов гомологии показывают, что последовательности NEIL3-A2-9-585 (SEQ ID NO:3), NEIL3-A2-9-127 (SEQ ID NO:4), NEIL3-A2-9-416 (SEQ ID NO:5), NEIL3-A2-9-71 (SEQ ID NO:6), NEIL3-A2-9-271 (SEQ ID NO:11), NEIL3-A2-10-198 (SEQ ID NO:15), NEIL3-A2-10-340 (SEQ ID NO:17), NEIL3-A2-10-590 (SEQ ID NO:21) и NEIL3-A2-10-378 (SEQ ID NO:22) являются уникальными, и, таким образом, существует небольшая возможность, насколько известно авторам настоящего изобретения, что эти молекулы стимулируют непредусмотренный иммунологический ответ на какую-либо неродственную молекулу.
В заключение, идентифицированы новые пептиды-эпитопы для HLA-A2, полученные из NEIL3. Более того, показано, что пептиды-эпитопы из NEIL3 могут являться применимыми для иммунотерапии злокачественных опухолей.
Повышенная экспрессия NEIL3 в широком множестве злокачественных опухолей человека
Последующий полуколичественный анализ RT-PCR выявил увеличенную экспрессию NEIL3 в 7 из 8 ICC, которые подвергали анализу на микромассивах (фиг.5a).
Для подтверждения картины экспрессии этого гена при раке печени авторы настоящего изобретения проводили полуколичественный анализ RT-PCR с использованием клинических образцов рака печени и нормальных тканей человека, включая нормальные клетки печени. В результате авторы настоящего изобретения обнаружили, что NEIL3, для которого показана повышенная экспрессия в 7 из 8 клинических образцов рака печени (слабо дифференцированные очаги) по сравнению с нормальными клетками печени (фиг.5a), являлся сверхэкспрессированным в 5 из 5 линий клеток HCC и не экспрессировался в других нормальных тканях (фиг.5b).
(Эксперимент 2)
Предсказание связывающих HLA-A24 пептидов, происходящих из NEIL3
В таблицах 3a и 3b показаны связывающие HLA-A24 9-членные и 10-членные пептиды из NEIL3 в порядке высоты аффинности связывания. Всего 21 пептид с потенциальной способностью связывания HLA-A24 выбран и оценен для определения пептидов-эпитопов.
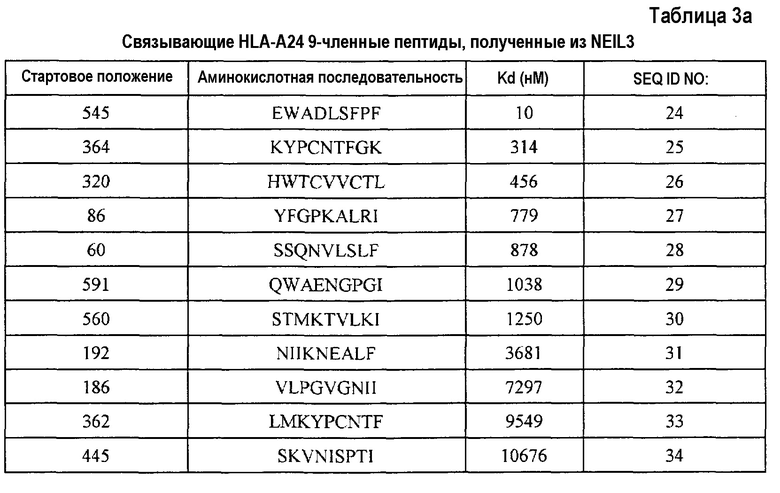
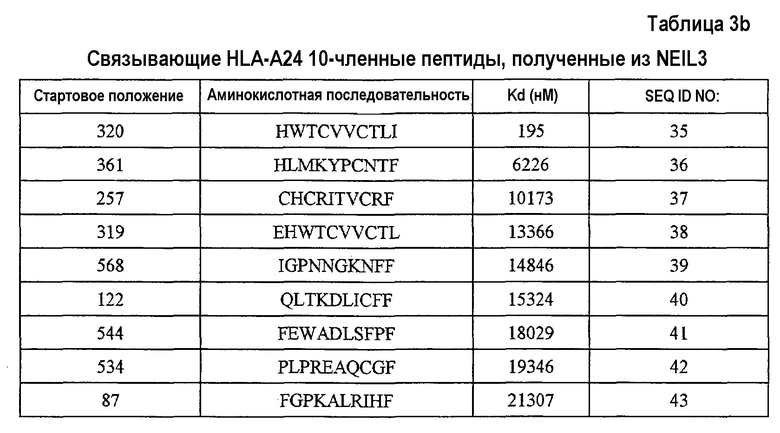
Стартовое положение указывает номер аминокислотного остатка от N-конца NEIL3.
Константы диссоциации [Kd (нМ)] получены из «NetMHC3.0».
Индукция CTL с помощью предсказанных пептидов из NEIL3, рестриктированных по HLA-A*2402
CTL для этих пептидов, происходящих из NEIL3, получали согласно способам, как описано в разделе «Материалы и методы». Специфическую для пептида активность CTL определяли посредством анализа ELISPOT IFN-гамма (фиг.6a-e). На них показано, что для лунки № 7, стимулированной с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), №6, стимулированной с помощью NEIL3-A24-9-362 (SEQ ID NO:33) (b), №2 и №8, стимулированных с помощью NEIL3-A24-10-320 (SEQ ID NO:35) (c), №8 стимулированной с помощью NEIL3-A24-10-544 (SEQ ID NO:41) (d), и №1 и №4, стимулированных с помощью NEIL3-A24-10-87 (SEQ ID NO:43) (e), показали сильную продукцию IFN-гамма по сравнению с контрольными лунками. С другой стороны, не определили специфической активности CTL при стимуляции другими пептидами, показанными в таблицах 3a и 3b, несмотря на то, что эти пептиды обладали возможной активностью связывания с HLA-A*2402. Например, типичные отрицательные данные ответа CTL, стимулированного с помощью NEIL3-A24-9-364 (SEQ ID NO:25), против сенсибилизированных пептидом клеток-мишеней (f). В результате, показано, что 5 пептидов, происходящих из NEIL3, отобраны при скрининге в качестве пептидов, которые могут индуцировать активные CTL.
Получение линий и клонов CTL против происходящих из NEIL3 пептидов
Клетки, для которых показана специфическая для пептида активность CTL, детектированная анализом ELISPOT IFN-гамма в лунке № 7 с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), №6 - с помощью NEIL3-A24-9-362 (SEQ ID NO:33) (b), №8 - с помощью NEIL3-A24-10-320 (SEQ ID NO:35) (c), №8 - с помощью NEIL3-A24-10-544 (SEQ ID NO:41) (d) и №1 - с помощью NEIL3-A24-10-87 (SEQ ID NO:43) (e), размножали и получали линии CTL. Активность CTL этих линий CTL определяли анализом ELISA IFN-гамма (фиг.7a-e). На них показано, что для всех линий CTL показали сильную продукцию IFN-гамма против клеток-мишеней, активированных соответствующим пептидом, по сравнению с клетками-мишенями без сенсибилизации пептидом. Более того, клоны CTL получены предельным разведением из линий CTL, и продукцию IFN-гамма из клонов CTL против клеток-мишеней, сенсибилизированных пептидом, определяли анализом ELISA IFN-гамма. Сильную продукцию IFN-гамма определили для клонов CTL, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), NEIL3-A24-10-320 (SEQ ID NO:35) (b) и NEIL3-A24-10-544 (SEQ ID NO:41) (c) на фиг.8.
Специфическая активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*2402
Полученные линии и клоны CTL, стимулированные против каждого из пептидов, оценивали по их способности узнавать клетки-мишени с эндогенной экспрессией гена NEIL3 и HLA-A*2402. Специфическую активность CTL против клеток COS7, трансфицированных геном как полноразмерного NEIL3, так и HLA-A*2402 (специфическая модель для клеток-мишеней с экзогенной экспрессией гена NEIL3 и HLA-A*2402), тестировали с использованием линий и клонов CTL, стимулированных соответствующим пептидом, в качестве эффекторных клеток. Клетки COS7, трансфицированные геном либо полноразмерного NEIL3, либо HLA-A* 2402, получали в качестве контрольных. На фиг.9 для CTL, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24), показали сильную активность CTL против клеток COS7, экспрессирующих как NEIL3, так и HLA- A*2402. С другой стороны, не детектировали значительной специфической активности CTL против контроля. Таким образом, эти данные ясно показывают, что NEIL3-A24-9-545 (SEQ ID NO:24) являлся естественным образом экспрессированным на клетках-мишенях с молекулой HLA-A*2402 и являлся узнаваемым CTL. Эти результаты показывают, что этот пептид, происходящий из NEIL3, может являться доступным для применения в противораковых вакцинах для пациентов с экспрессирующими NEIL3 опухолями.
Анализ гомологии антигенных пептидов
Для CTL, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24), NEIL3-A24-9-362 (SEQ ID NO:33), NEIL3-A24-10-320 (SEQ ID NO:35), NEIL3-A24-10-544 (SEQ ID NO:41) и NEIL3-A24-10-87 (SEQ ID NO:43), показали значительную и специфическую активность CTL. Этот результат может быть обусловлен тем фактом, что последовательности NEIL3-A24-9-545 (SEQ ID NO:24), NEIL3-A24-9-362 (SEQ ID NO:33), NEIL3-A24-10-320 (SEQ ID NO:35), NEIL3-A24-10-544 (SEQ ID NO:41) и NEIL3-A24-10-87 (SEQ ID NO:43) являются гомологичными пептидам, происходящим из других молекул, известных как сенсибилизирующие иммунную систему человека. Для исключения этой возможности для этих пептидных последовательностей в качестве запросов проводили анализы гомологии с использованием алгоритма BLAST (www.ncbi.nlm.nih.gov/blast/blast.cgi), которые не выявили последовательностей со значительной гомологией. Результаты анализов гомологии показывают, что последовательности NEIL3-A24-9-545 (SEQ ID NO:24), NEIL3-A24-9-362 (SEQ ID NO:33), NEIL3-A24-10-320 (SEQ ID NO:35), NEIL3-A24-10-544 (SEQ ID NO:41) и NEIL3-A24-10-87 (SEQ ID NO:43) являются уникальными, и, таким образом, существует небольшая возможность, насколько известно авторам настоящего изобретения, что эти молекулы стимулируют непредусмотренный иммунологический ответ на какую-либо неродственную молекулу.
В заключение, идентифицированы новые пептиды-эпитопы для HLA-A*2402, полученные из NEIL3. Более того, показано, что NEIL3 может являться применимым для иммунотерапии злокачественных опухолей.
Промышленная применимость
Настоящее изобретение относится к новым TAA, в частности, полученным из NEIL3, которые могут индуцировать сильные и специфические противоопухолевые иммунные ответы и обладать применимостью для широкого множества типов злокачественных опухолей. Такие TAA могут находить применение в диагностике и лечении злокачественных опухолей.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ONCOTHERAPY SCIENCE, INC.
<120> ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ
<130> ONC-A0905P
<150> US 61/210,512
<151> 2009-03-18
<160> 51
<170> PatentIn версии 3.5
<210> 1
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 1
Val Leu Ser Leu Phe Asn Gly Tyr Val
1 5
<210> 2
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 2
Phe Met Tyr Phe Gly Pro Lys Ala Leu
1 5
<210> 3
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 3
Lys Gln Cys Asn Phe Phe Gln Trp Ala
1 5
<210> 4
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 4
Leu Ile Cys Phe Phe Asp Ser Ser Val
1 5
<210> 5
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 5
Phe Gln Asn Ser Pro Pro Ala Ser Val
1 5
<210> 6
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 6
Tyr Val Tyr Ser Gly Val Glu Thr Leu
1 5
<210> 7
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 7
Arg Leu Ala Ala Ser Thr Val Val Val
1 5
<210> 8
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 8
Ser Leu Gln Gly Arg Ala Leu Arg Leu
1 5
<210> 9
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 9
Ile Ile Ser Trp Thr Ser Ser Arg Val
1 5
<210> 10
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 10
Lys Leu Pro Thr Arg Asn Thr Ile Ile
1 5
<210> 11
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 11
Arg Met Thr Tyr Phe Cys Pro His Cys
1 5
<210> 12
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 12
Asn Met Thr Asp Gly Pro Arg Thr Leu
1 5
<210> 13
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 13
Val Leu Pro Gly Gln Ala Val Thr Gly Val
1 5 10
<210> 14
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 14
Gln Leu Thr Asp Glu Gln Ile His His Leu
1 5 10
<210> 15
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 15
Ala Leu Phe Asp Ser Gly Leu His Pro Ala
1 5 10
<210> 16
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 16
Leu Met Asp Gln Asn Val Leu Pro Gly Val
1 5 10
<210> 17
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 17
Cys Leu Thr Ser Arg Pro Ile Asp Ser Val
1 5 10
<210> 18
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 18
Gly Leu Ala Leu Ser Lys His Tyr Lys Val
1 5 10
<210> 19
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 19
Ala Leu Asn Asn Asp Ser Ser Gln Asn Val
1 5 10
<210> 20
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 20
Asn Val Leu Ser Leu Phe Asn Gly Tyr Val
1 5 10
<210> 21
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 21
Phe Gln Trp Ala Glu Asn Gly Pro Gly Ile
1 5 10
<210> 22
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 22
Lys Ile Asn Arg Lys Thr Ala Phe Gly Thr
1 5 10
<210> 23
<211> 10
<212> PRT
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 23
Gly Pro Asn Asn Gly Lys Asn Phe Phe Val
1 5 10
<210> 24
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 24
Glu Trp Ala Asp Leu Ser Phe Pro Phe
1 5
<210> 25
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 25
Lys Tyr Pro Cys Asn Thr Phe Gly Lys
1 5
<210> 26
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 26
His Trp Thr Cys Val Val Cys Thr Leu
1 5
<210> 27
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 27
Tyr Phe Gly Pro Lys Ala Leu Arg Ile
1 5
<210> 28
<211> 9
<212> PRT
<213> Вирус морщинистой мозаики артишока
<400> 28
Ser Ser Gln Asn Val Leu Ser Leu Phe
1 5
<210> 29
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 29
Gln Trp Ala Glu Asn Gly Pro Gly Ile
1 5
<210> 30
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 30
Ser Thr Met Lys Thr Val Leu Lys Ile
1 5
<210> 31
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 31
Asn Ile Ile Lys Asn Glu Ala Leu Phe
1 5
<210> 32
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 32
Val Leu Pro Gly Val Gly Asn Ile Ile
1 5
<210> 33
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 33
Leu Met Lys Tyr Pro Cys Asn Thr Phe
1 5
<210> 34
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 34
Ser Lys Val Asn Ile Ser Pro Thr Ile
1 5
<210> 35
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 35
His Trp Thr Cys Val Val Cys Thr Leu Ile
1 5 10
<210> 36
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 36
His Leu Met Lys Tyr Pro Cys Asn Thr Phe
1 5 10
<210> 37
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 37
Cys His Cys Arg Ile Thr Val Cys Arg Phe
1 5 10
<210> 38
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 38
Glu His Trp Thr Cys Val Val Cys Thr Leu
1 5 10
<210> 39
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 39
Ile Gly Pro Asn Asn Gly Lys Asn Phe Phe
1 5 10
<210> 40
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 40
Gln Leu Thr Lys Asp Leu Ile Cys Phe Phe
1 5 10
<210> 41
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 41
Phe Glu Trp Ala Asp Leu Ser Phe Pro Phe
1 5 10
<210> 42
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 42
Pro Leu Pro Arg Glu Ala Gln Cys Gly Phe
1 5 10
<210> 43
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> искусственно синтезированная пептидная последовательность
<400> 43
Phe Gly Pro Lys Ala Leu Arg Ile His Phe
1 5 10
<210> 44
<211> 2402
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (118)..(1935)
<400> 44
gacgcgcgcg agatttgaat ttcctctgcg tgcggtcagt gcccgcgcag cgttgagttg 60
cacagcggta ttctcaccag gccctgcaat cggtgggcca cagtgccggc cacagag 117
atg gtg gaa gga cca ggc tgt act ctg aat gga gag aag att cgc gcg 165
Met Val Glu Gly Pro Gly Cys Thr Leu Asn Gly Glu Lys Ile Arg Ala
1 5 10 15
cgg gtg ctc ccg ggc cag gcg gtg acc ggc gtg cgg gga agc gct ctg 213
Arg Val Leu Pro Gly Gln Ala Val Thr Gly Val Arg Gly Ser Ala Leu
20 25 30
cgg agt ctg cag ggc cgc gcc ttg cgg ctc gca gcc tcc acg gtt gtg 261
Arg Ser Leu Gln Gly Arg Ala Leu Arg Leu Ala Ala Ser Thr Val Val
35 40 45
gtc tcc ccg cag gct gct gca ctg aat aat gat tcc agc cag aat gtc 309
Val Ser Pro Gln Ala Ala Ala Leu Asn Asn Asp Ser Ser Gln Asn Val
50 55 60
ttg agc ctg ttt aat gga tat gtt tac agt ggc gtg gaa act ttg ggg 357
Leu Ser Leu Phe Asn Gly Tyr Val Tyr Ser Gly Val Glu Thr Leu Gly
65 70 75 80
aag gag ctc ttt atg tac ttt gga cca aaa gct tta cgg att cat ttc 405
Lys Glu Leu Phe Met Tyr Phe Gly Pro Lys Ala Leu Arg Ile His Phe
85 90 95
gga atg aaa ggc ttc atc atg att aat cca ctt gag tat aaa tat aaa 453
Gly Met Lys Gly Phe Ile Met Ile Asn Pro Leu Glu Tyr Lys Tyr Lys
100 105 110
aat gga gct tct cct gtt ttg gaa gtg cag ctc acc aaa gat ttg att 501
Asn Gly Ala Ser Pro Val Leu Glu Val Gln Leu Thr Lys Asp Leu Ile
115 120 125
tgt ttc ttt gac tca tca gta gaa ctc aga aac tca atg gaa agc caa 549
Cys Phe Phe Asp Ser Ser Val Glu Leu Arg Asn Ser Met Glu Ser Gln
130 135 140
cag aga ata aga atg atg aaa gaa tta gat gta tgt tca cct gaa ttt 597
Gln Arg Ile Arg Met Met Lys Glu Leu Asp Val Cys Ser Pro Glu Phe
145 150 155 160
agt ttc ttg aga gca gaa agt gaa gtt aaa aaa cag aaa ggc cgg atg 645
Ser Phe Leu Arg Ala Glu Ser Glu Val Lys Lys Gln Lys Gly Arg Met
165 170 175
cta ggt gat gtg cta atg gat cag aac gta ttg cct gga gta ggg aac 693
Leu Gly Asp Val Leu Met Asp Gln Asn Val Leu Pro Gly Val Gly Asn
180 185 190
atc atc aaa aat gaa gct ctc ttt gac agt ggt ctc cac cca gct gtt 741
Ile Ile Lys Asn Glu Ala Leu Phe Asp Ser Gly Leu His Pro Ala Val
195 200 205
aaa gtt tgt caa tta aca gat gaa cag atc cat cac ctc atg aaa atg 789
Lys Val Cys Gln Leu Thr Asp Glu Gln Ile His His Leu Met Lys Met
210 215 220
ata cgt gat ttc agc att ctc ttt tac agg tgc cgt aaa gca gga ctt 837
Ile Arg Asp Phe Ser Ile Leu Phe Tyr Arg Cys Arg Lys Ala Gly Leu
225 230 235 240
gct ctc tct aaa cac tat aag gtt tac aag cgt cct aat tgt ggt cag 885
Ala Leu Ser Lys His Tyr Lys Val Tyr Lys Arg Pro Asn Cys Gly Gln
245 250 255
tgc cac tgc aga ata act gtg tgc cgc ttt ggg gac aat aac aga atg 933
Cys His Cys Arg Ile Thr Val Cys Arg Phe Gly Asp Asn Asn Arg Met
260 265 270
aca tat ttc tgt cct cac tgt caa aaa gaa aat cct caa cat gtt gac 981
Thr Tyr Phe Cys Pro His Cys Gln Lys Glu Asn Pro Gln His Val Asp
275 280 285
ata tgc aag cta ccg act aga aat act ata atc agt tgg aca tct agc 1029
Ile Cys Lys Leu Pro Thr Arg Asn Thr Ile Ile Ser Trp Thr Ser Ser
290 295 300
agg gtg gat cat gtt atg gac tcc gtg gct cgg aag tcg gaa gag cac 1077
Arg Val Asp His Val Met Asp Ser Val Ala Arg Lys Ser Glu Glu His
305 310 315 320
tgg acc tgt gtg gtg tgt act tta atc aat aag ccc tct tct aag gca 1125
Trp Thr Cys Val Val Cys Thr Leu Ile Asn Lys Pro Ser Ser Lys Ala
325 330 335
tgt gat gct tgc ttg acc tca agg cct att gat tca gtg ctc aag agt 1173
Cys Asp Ala Cys Leu Thr Ser Arg Pro Ile Asp Ser Val Leu Lys Ser
340 345 350
gaa gaa aat tct act gtc ttt agc cac tta atg aag tac ccg tgt aat 1221
Glu Glu Asn Ser Thr Val Phe Ser His Leu Met Lys Tyr Pro Cys Asn
355 360 365
act ttt gga aaa cct cat aca gaa gtc aag atc aac aga aaa act gca 1269
Thr Phe Gly Lys Pro His Thr Glu Val Lys Ile Asn Arg Lys Thr Ala
370 375 380
ttt gga act aca act ctt gtc ttg act gat ttt agc aat aaa tcc agt 1317
Phe Gly Thr Thr Thr Leu Val Leu Thr Asp Phe Ser Asn Lys Ser Ser
385 390 395 400
act ttg gaa aga aaa aca aag caa aac cag ata cta gat gag gag ttt 1365
Thr Leu Glu Arg Lys Thr Lys Gln Asn Gln Ile Leu Asp Glu Glu Phe
405 410 415
caa aac tct cct cct gct agt gtt tgt ttg aat gat ata cag cac ccc 1413
Gln Asn Ser Pro Pro Ala Ser Val Cys Leu Asn Asp Ile Gln His Pro
420 425 430
tcc aag aag aca aca aac gat ata act caa cca tcc agc aaa gta aac 1461
Ser Lys Lys Thr Thr Asn Asp Ile Thr Gln Pro Ser Ser Lys Val Asn
435 440 445
ata tca cct aca atc agt tca gaa tct aaa tta ttt agt cca gca cat 1509
Ile Ser Pro Thr Ile Ser Ser Glu Ser Lys Leu Phe Ser Pro Ala His
450 455 460
aaa aaa ccg aaa aca gcc caa tac tca tca cca gag ctt aaa agc tgc 1557
Lys Lys Pro Lys Thr Ala Gln Tyr Ser Ser Pro Glu Leu Lys Ser Cys
465 470 475 480
aac cct gga tat tct aac agt gaa ctt caa att aat atg aca gat ggc 1605
Asn Pro Gly Tyr Ser Asn Ser Glu Leu Gln Ile Asn Met Thr Asp Gly
485 490 495
cct cgt acc tta aat cct gac agc cct cgc tgc agt aaa cac aac cgc 1653
Pro Arg Thr Leu Asn Pro Asp Ser Pro Arg Cys Ser Lys His Asn Arg
500 505 510
ctc tgc att ctc cga gtt gtg agg aag gat ggg gaa aac aag ggc agg 1701
Leu Cys Ile Leu Arg Val Val Arg Lys Asp Gly Glu Asn Lys Gly Arg
515 520 525
cag ttt tat gcc tgt cct cta cct aga gaa gca caa tgt gga ttt ttt 1749
Gln Phe Tyr Ala Cys Pro Leu Pro Arg Glu Ala Gln Cys Gly Phe Phe
530 535 540
gaa tgg gca gat ttg tcc ttc cca ttc tgc aac cat ggc aag cgt tcc 1797
Glu Trp Ala Asp Leu Ser Phe Pro Phe Cys Asn His Gly Lys Arg Ser
545 550 555 560
acc atg aaa aca gta ttg aag att gga cct aac aat gga aag aat ttt 1845
Thr Met Lys Thr Val Leu Lys Ile Gly Pro Asn Asn Gly Lys Asn Phe
565 570 575
ttt gtg tgt cct ctt ggg aag gaa aaa caa tgc aat ttt ttc cag tgg 1893
Phe Val Cys Pro Leu Gly Lys Glu Lys Gln Cys Asn Phe Phe Gln Trp
580 585 590
gca gaa aat ggg cca gga ata aaa att att cct gga tgc taa 1935
Ala Glu Asn Gly Pro Gly Ile Lys Ile Ile Pro Gly Cys
595 600 605
tatctgtaga ttctctggca tttagtctct tcaaactgtg tataatgttt ggtcctcctc 1995
tgtttcatag aaaagtcata gaatatctat gatacattga aaagttactg caatatttga 2055
gaactgttct ttttttttct tgtgtgtgcc atctttccat tgttggctac gtcttttctt 2115
ttgccttgat gaacgttcta tgtatttcat cggatataca gcatattcca tttaggatgt 2175
gtatttaatg catttagtaa tgacgataaa gtgtttttag tatgctttta gtctcttgta 2235
actggggaga agcagtgttt tttttttagg aaaggattat gcgacacaat aaaataagat 2295
attctgtctg tagtgaatac atttctcatg tactaacact atttataata tatgattaaa 2355
gatatttctt gttttattaa ataataagaa ataagatctc ctttatg 2402
<210> 45
<211> 605
<212> PRT
<213> Homo sapiens
<400> 45
Met Val Glu Gly Pro Gly Cys Thr Leu Asn Gly Glu Lys Ile Arg Ala
1 5 10 15
Arg Val Leu Pro Gly Gln Ala Val Thr Gly Val Arg Gly Ser Ala Leu
20 25 30
Arg Ser Leu Gln Gly Arg Ala Leu Arg Leu Ala Ala Ser Thr Val Val
35 40 45
Val Ser Pro Gln Ala Ala Ala Leu Asn Asn Asp Ser Ser Gln Asn Val
50 55 60
Leu Ser Leu Phe Asn Gly Tyr Val Tyr Ser Gly Val Glu Thr Leu Gly
65 70 75 80
Lys Glu Leu Phe Met Tyr Phe Gly Pro Lys Ala Leu Arg Ile His Phe
85 90 95
Gly Met Lys Gly Phe Ile Met Ile Asn Pro Leu Glu Tyr Lys Tyr Lys
100 105 110
Asn Gly Ala Ser Pro Val Leu Glu Val Gln Leu Thr Lys Asp Leu Ile
115 120 125
Cys Phe Phe Asp Ser Ser Val Glu Leu Arg Asn Ser Met Glu Ser Gln
130 135 140
Gln Arg Ile Arg Met Met Lys Glu Leu Asp Val Cys Ser Pro Glu Phe
145 150 155 160
Ser Phe Leu Arg Ala Glu Ser Glu Val Lys Lys Gln Lys Gly Arg Met
165 170 175
Leu Gly Asp Val Leu Met Asp Gln Asn Val Leu Pro Gly Val Gly Asn
180 185 190
Ile Ile Lys Asn Glu Ala Leu Phe Asp Ser Gly Leu His Pro Ala Val
195 200 205
Lys Val Cys Gln Leu Thr Asp Glu Gln Ile His His Leu Met Lys Met
210 215 220
Ile Arg Asp Phe Ser Ile Leu Phe Tyr Arg Cys Arg Lys Ala Gly Leu
225 230 235 240
Ala Leu Ser Lys His Tyr Lys Val Tyr Lys Arg Pro Asn Cys Gly Gln
245 250 255
Cys His Cys Arg Ile Thr Val Cys Arg Phe Gly Asp Asn Asn Arg Met
260 265 270
Thr Tyr Phe Cys Pro His Cys Gln Lys Glu Asn Pro Gln His Val Asp
275 280 285
Ile Cys Lys Leu Pro Thr Arg Asn Thr Ile Ile Ser Trp Thr Ser Ser
290 295 300
Arg Val Asp His Val Met Asp Ser Val Ala Arg Lys Ser Glu Glu His
305 310 315 320
Trp Thr Cys Val Val Cys Thr Leu Ile Asn Lys Pro Ser Ser Lys Ala
325 330 335
Cys Asp Ala Cys Leu Thr Ser Arg Pro Ile Asp Ser Val Leu Lys Ser
340 345 350
Glu Glu Asn Ser Thr Val Phe Ser His Leu Met Lys Tyr Pro Cys Asn
355 360 365
Thr Phe Gly Lys Pro His Thr Glu Val Lys Ile Asn Arg Lys Thr Ala
370 375 380
Phe Gly Thr Thr Thr Leu Val Leu Thr Asp Phe Ser Asn Lys Ser Ser
385 390 395 400
Thr Leu Glu Arg Lys Thr Lys Gln Asn Gln Ile Leu Asp Glu Glu Phe
405 410 415
Gln Asn Ser Pro Pro Ala Ser Val Cys Leu Asn Asp Ile Gln His Pro
420 425 430
Ser Lys Lys Thr Thr Asn Asp Ile Thr Gln Pro Ser Ser Lys Val Asn
435 440 445
Ile Ser Pro Thr Ile Ser Ser Glu Ser Lys Leu Phe Ser Pro Ala His
450 455 460
Lys Lys Pro Lys Thr Ala Gln Tyr Ser Ser Pro Glu Leu Lys Ser Cys
465 470 475 480
Asn Pro Gly Tyr Ser Asn Ser Glu Leu Gln Ile Asn Met Thr Asp Gly
485 490 495
Pro Arg Thr Leu Asn Pro Asp Ser Pro Arg Cys Ser Lys His Asn Arg
500 505 510
Leu Cys Ile Leu Arg Val Val Arg Lys Asp Gly Glu Asn Lys Gly Arg
515 520 525
Gln Phe Tyr Ala Cys Pro Leu Pro Arg Glu Ala Gln Cys Gly Phe Phe
530 535 540
Glu Trp Ala Asp Leu Ser Phe Pro Phe Cys Asn His Gly Lys Arg Ser
545 550 555 560
Thr Met Lys Thr Val Leu Lys Ile Gly Pro Asn Asn Gly Lys Asn Phe
565 570 575
Phe Val Cys Pro Leu Gly Lys Glu Lys Gln Cys Asn Phe Phe Gln Trp
580 585 590
Ala Glu Asn Gly Pro Gly Ile Lys Ile Ile Pro Gly Cys
595 600 605
<210> 46
<211> 23
<212> ДНК
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
праймера
<400> 46
ttggtcctcc tctgtttcat aga 23
<210> 47
<211> 23
<212> ДНК
<213> Искусственная
<220>
<223> искусственно синтезированная пептидная последовательность
праймера
<400> 47
gcttctcccc agttacaaga gac 23
<210> 48
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 48
gtctaccagg cattcgcttc at 22
<210> 49
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 49
tcagctggac cacagccgca gcgt 24
<210> 50
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 50
tcagaaatcc tttctcttga c 21
<210> 51
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 51
ctagcctctg gaatcctttc tctt 24
<---
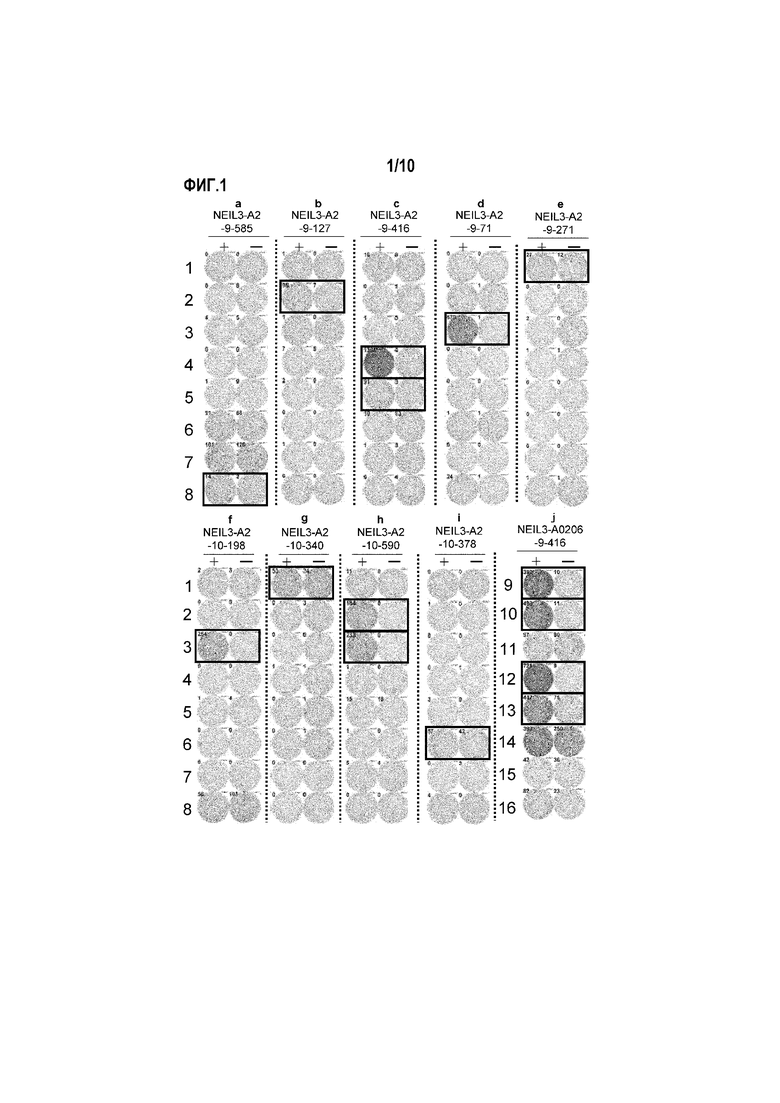
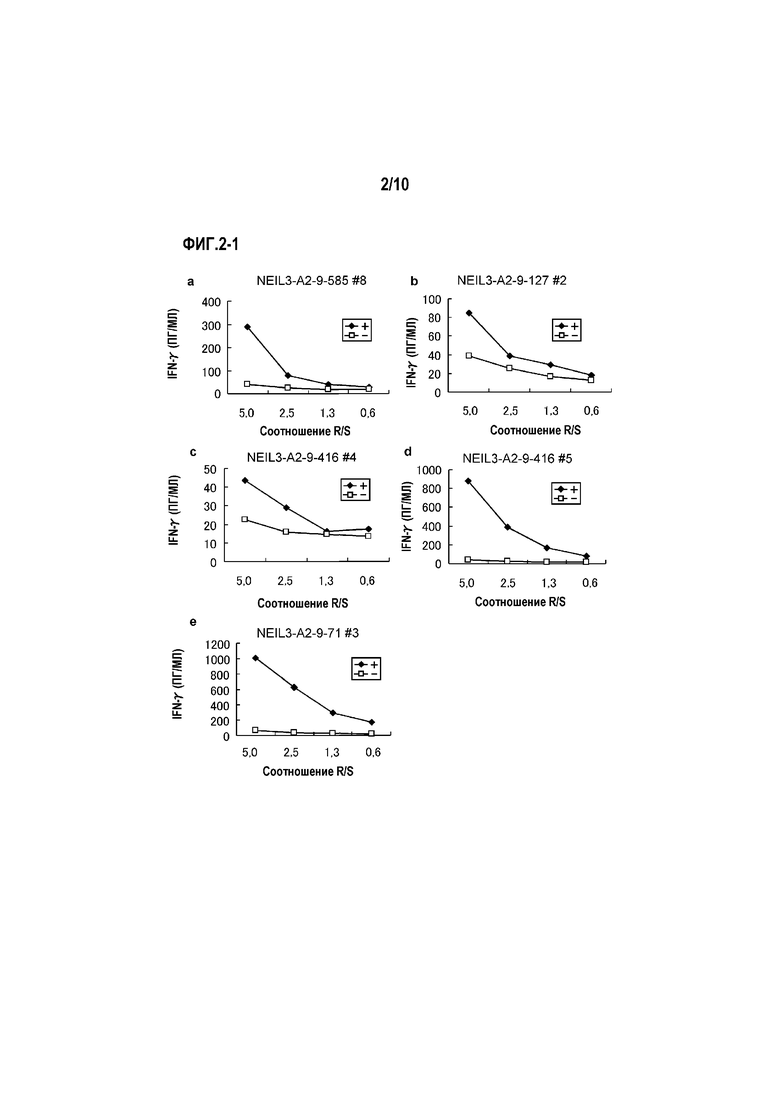
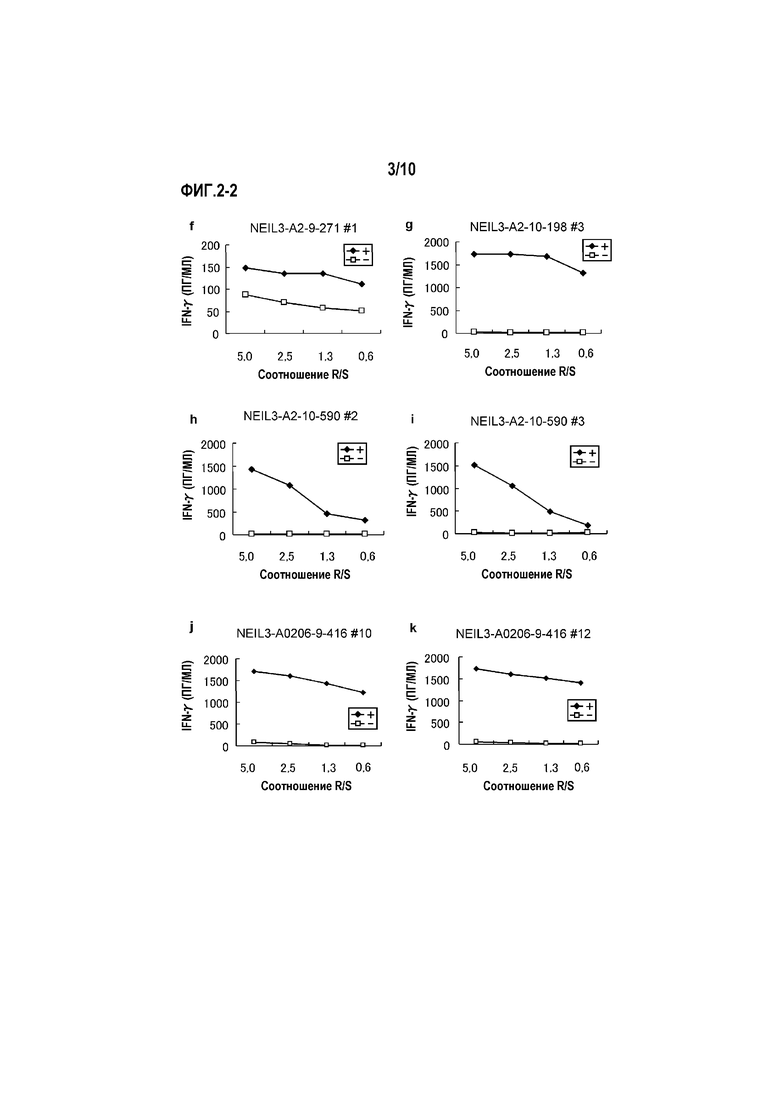
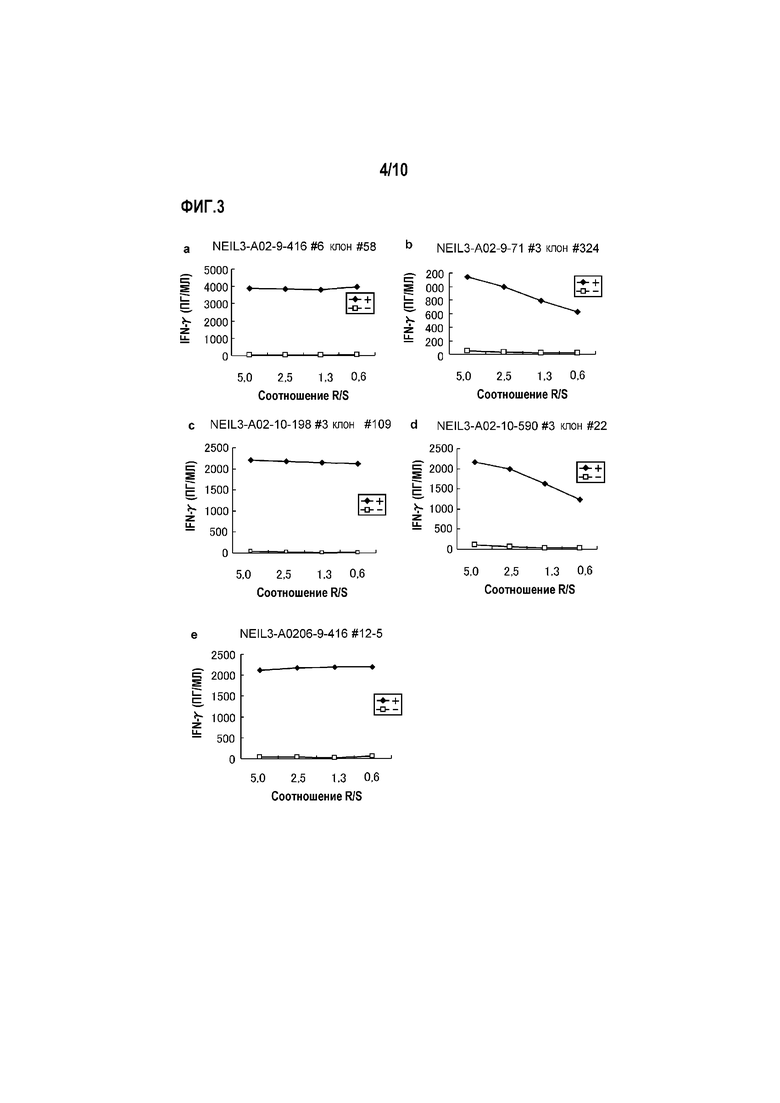
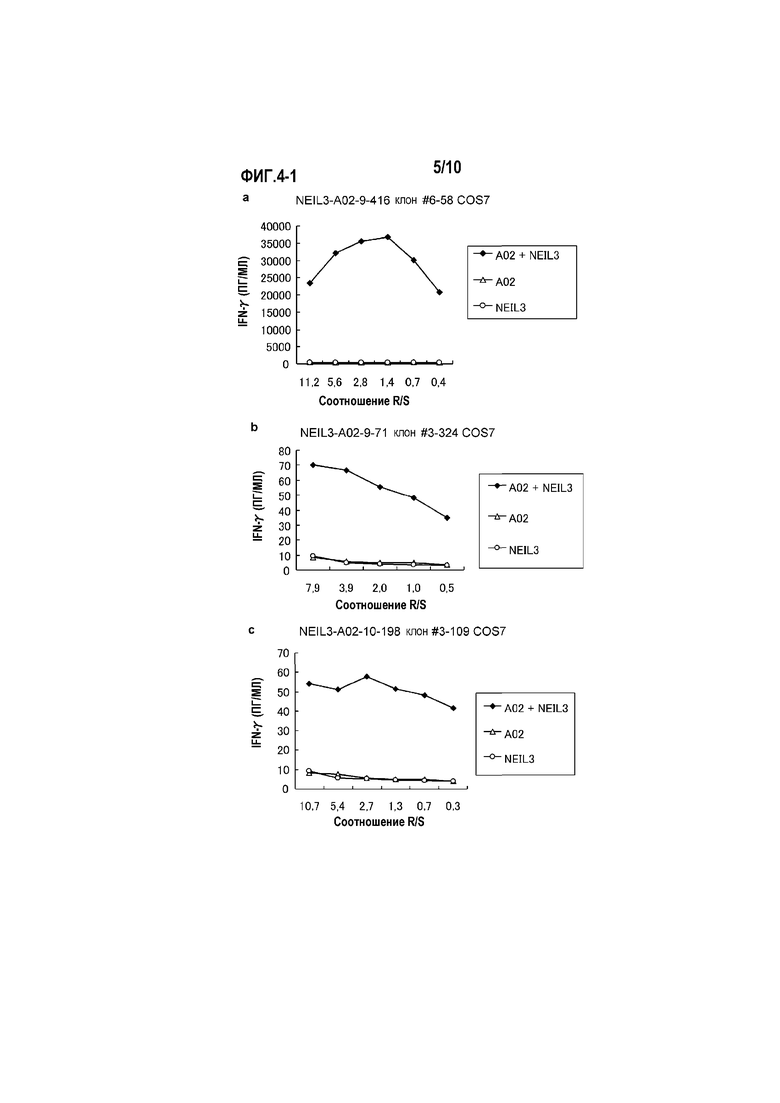
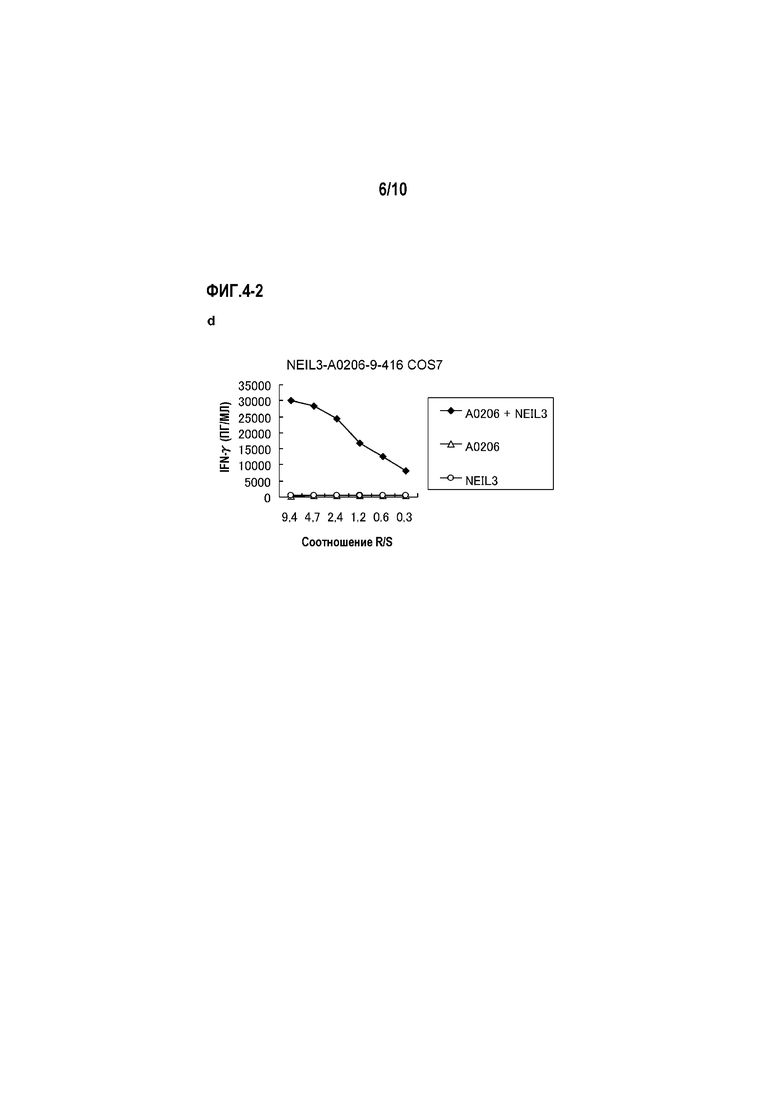

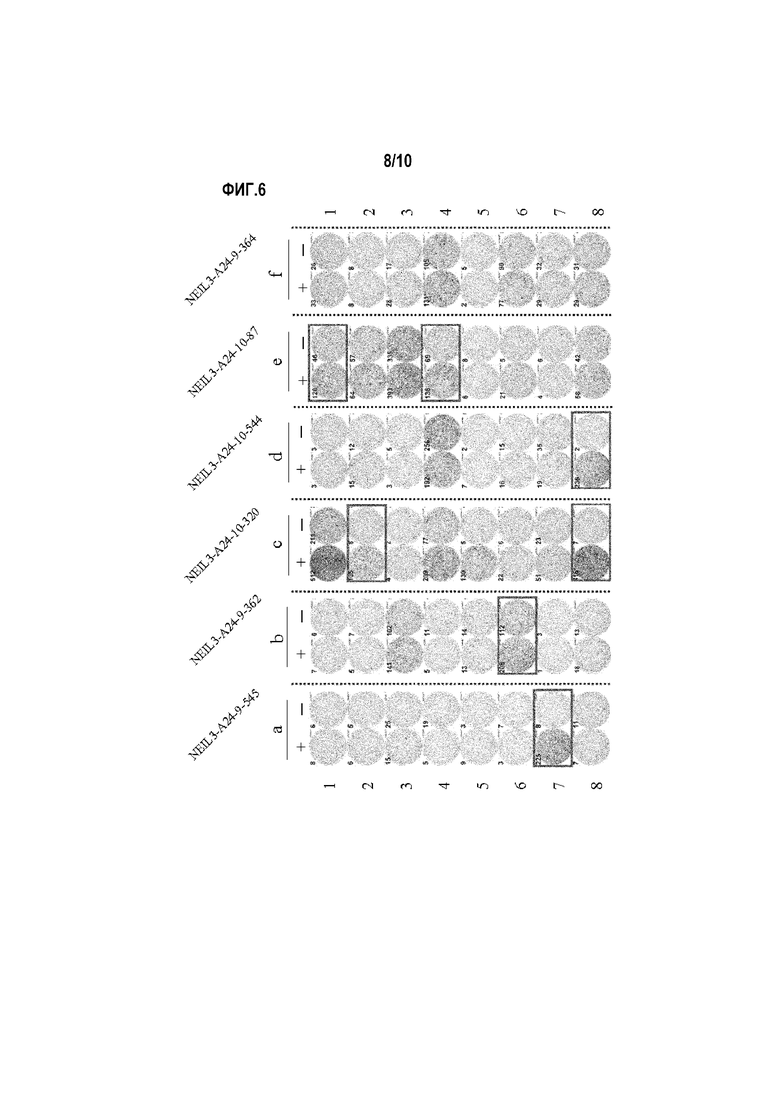
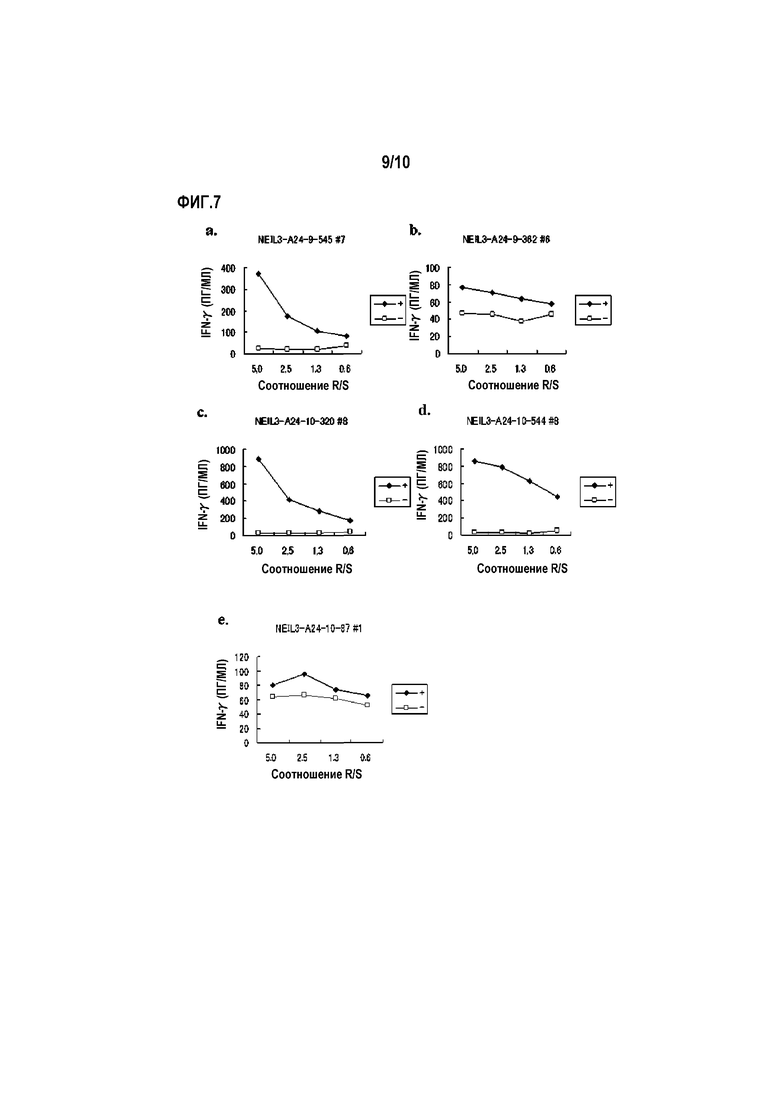
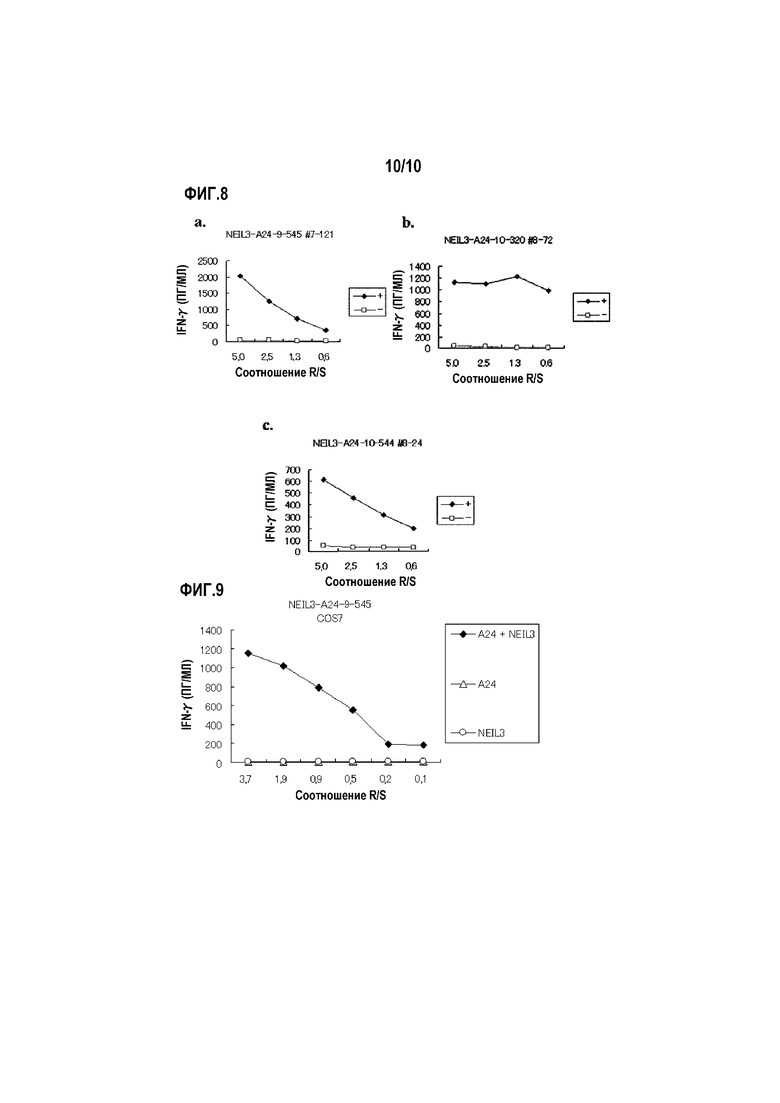
Настоящая группа изобретений относится к биологии. Предложен выделенный пептид, обладающий способностью в присутствии антигенпредставляющей клетки (APC), несущей HLA-A*240, индуцировать цитотоксические T лимфоциты (CTL) против антигена NEIL3. Кроме того, предложены: кодирующий полинуклеотид, вектор, фармацевтическая композиция, способы индукции APC и CTL, а также выделенная APC, экзосома, способ индукции иммунного ответа против злокачественной опухоли, экспрессирующей NEIL3, и применение пептида, APC или экзосомы по настоящему изобретению в производстве фармацевтической композиции. Данная группа изобретений может найти дальнейшее применение в терапии заболеваний, связанных с NEIL3. 11 н. и 3 з.п. ф-лы, 9 ил., 3 табл.
1. Выделенный пептид по пункту (a) или (b) ниже, где указанный пептид обладает способностью индуцировать цитотоксические T лимфоциты (CTL) в присутствии антигенпредставляющей клетки (APC), несущей HLA-A*2402:
(a) выделенный пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NOs: 24, 33, 35, 41 и 43; или
(b) выделенный пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NOs: 24, 33, 35, 41 и 43, в котором 1 или 2 аминокислоты заменены,
где указанная замена представляет собой одну или более из приведенных ниже:
(i) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NOs: 24, 33, 35, 41 или 43 заменена на аминокислоту, выбранную из группы, состоящей из фенилаланина, тирозина, метионина и триптофана; и
(ii) C-концевая аминокислота аминокислотной последовательности SEQ ID NOs: 24, 33, 35, 41 или 43 заменена на аминокислоту, выбранную из группы, состоящей из фенилаланина, лейцина, изолейцина, триптофана и метионина.
2. Выделенный полинуклеотид, кодирующий пептид по п.1.
3. Композиция для индукции CTL в присутствии APC, несущей HLA-A*2402, где композиция содержит один или более пептидов по п.1 в подходящей дозе в качестве активного ингредиента и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция для лечения или профилактики злокачественных опухолей, экспрессирующих NEIL3, и/или предотвращения их послеоперационного рецидива, в присутствии APC, несущей HLA-A*2402, где композиция содержит один или более пептидов по п.1 в подходящей дозе в качестве активного ингредиента и фармацевтически приемлемый носитель.
5. Фармацевтическая композиция по п.4, предназначенная для введения субъекту, антиген HLA которого представляет собой HLA-A*2402.
6. Фармацевтическая композиция по п.4 или 5, предназначенная для лечения злокачественной опухоли.
7. Способ индукции антигенпредставляющей клетки (APC) со способностью индуцировать CTL, включающий стадию, выбранную из группы, состоящей из:
приведения APC, несущей HLA-A*2402, в контакт с пептидом по п.1 in vitro, ex vivo или in vivo.
8. Способ индукции CTL способом, включающим стадию, выбранную из группы, состоящей из:
(a) совместного культивирования CD8-положительной T-клетки с APC, представляющей на своей поверхности комплекс HLA-A*2402 и пептида по п.1; и
(b) совместного культивирования CD8-положительной T-клетки с экзосомой, представляющей на своей поверхности комплекс HLA-A*2402 и пептида по п.1.
9. Выделенная APC, обладающая способностью индуцировать CTL, представляющая на поверхности комплекс HLA-A*2402 и пептида по п.1.
10. APC по п.9, индуцированная способом по п.7.
11. Способ индукции иммунного ответа против злокачественной опухоли, экспрессирующей NEIL3, у субъекта, в присутствии APC, несущей HLA-A*2402, включающий введение субъекту композиции, содержащей пептид по п.1 в подходящей дозе в качестве активного ингредиента и фармацевтически приемлемый носитель.
12. Экзосома для инцуцирования CTL, представляющая комплекс, содержащий пептиды по п.1 и HLA-A*2402.
13. Вектор, содержащий нуклеотидную последовательность, кодирующую пептид по п.1, для экспрессии указанного пепетида в клетке-хозяине.
14. Применение по меньшей мере одного компонента, выбранного из группы, состоящей из (a)-(b), в подходящей дозе в качестве активного ингредиента, в производстве фармацевтической композиции для лечения или предотвращения рака или опухоли, экспрессирующих NEIL3 в присутствии APC, несущей HLA-A*2402:
(a) пептид по п.1;
(b) APC или экзосома, представляющие пептид по п.1.
| TORISU K | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| HAN J.F | |||
| et al | |||
| Питательное приспособление к трепальным машинам для лубовых растений | 1922 |
|
SU201A1 |
| KONDO A | |||
| et al | |||
Авторы
Даты
2020-10-09—Публикация
2010-03-15—Подача