Область техники, к которой относится изобретение
Настоящее изобретение относится к соединению, обладающему ингибирующим действием на киназу 5 (ALK5), подобную рецептору активина, который представляет собой рецептор TGF-P типа I. Настоящее изобретение также относится к ускорителю роста клеток волосяных фолликулов, стимулятору роста волос и средству для роста волос, каждый из которых содержит функциональный ингибитор ALK5 в качестве активного ингредиента.
Описание предшествующего уровня техники
Трансформирующий фактор роста-β (TGF-β), а также активин, BMP и подобные представляет собой молекулярную структурную единицу, относящуюся к суперсемейству TGF-β. Существуют 2 различных передающих сигналы рецептора для TGF-β (типа I и типа II), оба из которых имеют в своих соответствующих клетках области серин/треонинкиназы. После объединения TGF-β с рецептором рецептор типа I фосфорилируется рецептором типа II и, таким образом, активируется, так что сигнал передается к ядру по пути Smad.2/3 или пути ТАВ1/ТАК1.
Было очевидно, что TGF-β оказывает достаточно большое количество физиологических воздействий, и в качестве одного из таких воздействий, как хорошо известно, TGF-β обладает свойством накопления внеклеточного матрикса в тканях посредством стимуляции продукции и подавления разрушения белков, которые составляют внеклеточный матрикс (Massague, Annu Rev. Cell Biol. 6, 597-641 (1990)). Таким образом, продолжительная избыточная продукция TGF-β и активация системы передачи сигналов может привести к различным фиброзным заболеваниям. Например, в случае почки было показано, что TGF-β глубоко вовлечен в фиброз или гломерулонефрит при почечных заболеваниях, таких как гломерулонефрит или диабетическая нефропатия (Okuda et al., J. Clin. Invest. 86, 453-462 (1990), и в случае печени, было показано, что TGF-β способствует продукции внеклеточного матрикса в непаренхимных клетках и затем участвует в возникновении печеночного фиброза и цирроза печени (Barnard et al., Biochim. Biophys. Acta 1032, 79-87 (1990)). Кроме того, одной из причин таких неизлечимых заболеваний, как легочный фиброз или пролиферативная витреоретинопатия, сопровождающихся существенным фиброзом, является накопление внеклеточного матрикса вследствие повышенной функции TGF-β.
Сообщалось, что ингибитор ALK5 подавляет накопление внеклеточного матрикса, вызванное TGF-β, путем блокирования сигналов TGF-β/Smads (Grygieiko et al., J. Am. Soc. Nephrol. 13 (Abst Iss), 5A (F-FC022), 2002), так что считают, что этот ингибитор полезен в качестве фармацевтических продуктов для лечения или профилактики различных заболеваний, связанных с фиброзом почек, печени или легких и т.д.
С другой стороны, известно, что TGF-β проявляет значительное ингибирующее рост действие против различных клеток, таких как эпителиальные клетки, клетки сосудистого эндотелия, гематоциты или лимфоциты (Soma et al., J. Invest. Dermatol. 111, 948-954 (1998)). Что касается волосяных фолликулов, то сообщалось, что избыточная экспрессия TGF-β вызывает подавление роста/апоптоз клеток волосяных фолликулов, и затем волосяной цикл сдвигается от анагена к телогену, и, таким образом, стало очевидным, что TGF-β глубоко вовлечен в прогрессирование облысения (Foitzik et al., FASEB J. 14, 752-760 (2000)).
Однако исследования неполностью показали, какой путь передачи сигналов от рецептора TGF-β в первую очередь участвует в подавлении роста/апоптоза клеток волосяных фолликулов, и, таким образом, еще не сообщалось о предотвращении/лечении эффекта облысения, который основан на блокаде сигналов TGF-β/Smad, вызванных ингибитором ALK5.
Хотя вещества, оказывающие ингибирующее действие на подобную рецептору активина киназу 5 (ALK5), который представляет собой рецептор TGF-β типа I, описаны в WO 00/61576A, WO 01/7273A, WO 01/62756A, WO 02/40468A, WO 03/87304A и подобные, соединение тиозолилимидазола в соответствии с настоящим изобретением не было раскрыто.
Кроме того, хотя имидизольное соединение, имеющее структуру, аналогичную структуре соединения в соответствии с настоящим изобретением хорошо известно из WO 99/03837A, WO 96/03387A, WO 03/62215A, WO 01/85723A, WO 01/44203A, JP 2001163861A, JP 07112975A, патент США № 6770663, WO 04/005264A и подобных, об ингибирующем действии этих соединений против подобной рецептору активина киназы 5 (ALK5) еще не сообщалось.
Описание изобретения
Целью настоящего изобретения является предоставление стимулятора роста волос или средства для роста волос, которое основано на обеспечении ингибирующего вещества против ALK5, которое представляет собой рецептор TGF-β типа I и его новом действии.
В результате проведения различных исследований для решения этих проблем, авторы настоящего изобретения обнаружили, что ингибитор ALK5 ингибирует подавление роста клеток волосяных фолликулов посредством TGF-β, и затем также обнаружили, что определенный вид новой группы соединений ингибирует ALK5 и, кроме того, обнаружили промежуточное соединение для получения описанной выше группы соединений для осуществления настоящего изобретения.
Таким образом, настоящее изобретение предоставляет производное тиазола, представленное формулой (I)
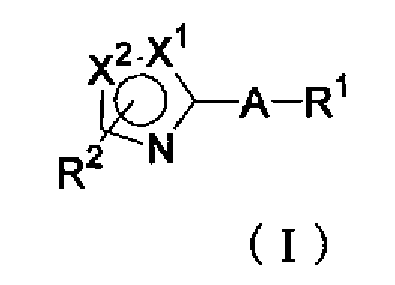
или его фармацевтически приемлемую соль, где:
Х1 и Х2 отличаются друг от друга и представляют атом серы или атом углерода;
R1 представляет фенильную группу;
фенильную группу, замещенную 1-5 членами, выбранными из группы, состоящей из атомов галогена, алкильной группы, имеющей 1-6 атомов углерода, алкоксигруппы, имеющей 1-6 атомов углерода, гидроксигруппы, фенилалкоксигруппы, имеющей 7-12 атомов углерода, и алкиламиногруппы, имеющей 1-6 атомов углерода;
фенильную группу, конденсированную с 5-7-членным гетероароматическим или неароматическим кольцом, имеющим по меньшей мере один гетероатом, выбранный из группы, состоящей из N, O и S;
пиридильную группу;
хинолильную группу;
изохинолильную группу или
пиридильную группу, конденсированную с 5-7-членным гетероароматическим кольцом, имеющим по меньшей мере один гетероатом, выбранный из группы, состоящей из N, O и S;
R2 представляет атом водорода, атом галогена, алкильную группу, имеющую 1-6 атомов углерода, алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена, алкоксигруппу, имеющую 1-6 атомов углерода, алканоильную группу, имеющую 1-6 атомов углерода, или гидроксиалкильную группу, имеющую 1-5 атомов углерода; и
А представляет группу, которая представлена формулой

или
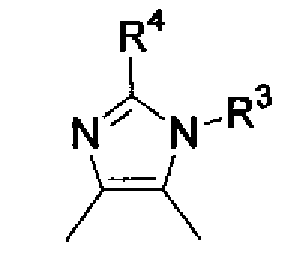
где:
R3 представляет атом водорода;
гидроксигруппу;
алкильную группу, имеющую 1-6 атомов углерода;
фенилалкильную группу, имеющую 7-12 атомов углерода; или
фенилалкильную группу, имеющую 7-12 атомов углерода, замещенную гидроксигруппой, алкоксигруппой, имеющей 1-6 атомов углерода, алкоксигруппой, имеющей 1-6 атомов углерода, замещенной алкоксигруппой, имеющей 1-6 атомов углерода, или алкоксигруппой, имеющей 1-6 атомов углерода, замещенной алкиламиногруппой, имеющей 1-6 атомов углерода,
R4 представляет фенильную группу;
фенильную группу, замещенную 1-5 членами, выбранными из группы, состоящей из атомов галогена, алкильной группы, имеющей 1-6 атомов углерода, алкоксигруппы, имеющей 1-6 атомов углерода, карбамоильной группы и цианогруппы;
атом водорода;
алкильную группу, имеющую 1-12 атомов углерода;
алкенильную группу, имеющую 2-12 атомов углерода;
циклоалкильную группу, имеющую 3-7 атомов углерода;
алкильную группу, имеющую 1-12 атомов углерода, замещенную алкоксигруппой, имеющей 1-6 атомов углерода, гидроксигруппой, алкоксифенилалкоксигруппой, имеющей 8-12 атомов углерода, фталимидоильной группой, толуолсульфонилоксигруппой или морфолиногруппой;
алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена;
циклоалкильную группу, имеющую 3-9 атомов углерода, замещенную оксогруппой;
тетрагидропиранильную группу;
4-пиперидинильную группу;
пиперидинильную группу, замещенную алкильной группой, имеющей 1-6 атомов углерода, или трет-бутоксикарбонильной группой;
циклогексанспиро-2'-(1,3-диоксоранильную) группу;
пирролидин-2-он-5-ильную группу;
группу, представленную формулой -Y1-Z1-NR5-Z2-Y2-R6,
где:
Y1 и Y2 одинаковые или отличаются друг от друга и представляют простую связь или алкиленовую группу, имеющую 1-12 атомов углерода;
R5 представляет атом водорода или алкильную группу, имеющую 1-12 атомов углерода;
Z1 и Z2 одинаковые или отличаются друг от друга и представляют простую связь;
алкиленовую группу, имеющую 1-7 атомов углерода;
-СО-;
-СО2-;
-SO2- или
-ОСО-, и
R6 представляет
циклоалкильную группу, имеющую 3-7 атомов углерода;
алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-3 атомами галогена;
алкенильную группу, имеющую 2-6 атомов углерода;
алкинильную группу, имеющую 2-6 атомов углерода;
аминогруппу;
аминогруппу, замещенную 1-2 группами, выбранными из группы, состоящей из алкильной группы, имеющей 1-6 атомов углерода, циклоалкильной группы, имеющей 3-7 атомов углерода, и трет-бутоксикарбонильной группой;
пиперидиногруппу;
пиперидинильную группу;
пиперидинильную группу, замещенную алкильной группой, имеющей 1-6 атомов углерода;
пирролидинильную группу;
пиперазинильную группу;
пиперазинильную группу, замещенную алкильной группой, имеющей 1-6 атомов углерода;
морфолиногруппу;
гидроксигруппу;
алкоксигруппу, имеющую 1-6 атомов углерода;
алкоксигруппу, имеющую 1-6 атомов углерода, замещенную гидроксигруппой или алкоксигруппой, имеющей 1-6 атомов углерода;
оксетан-2-ильную группу;
тетрагидрофуранильную группу;
тетрагидропиранильную группу;
атом водорода;
фенильную группу;
фенильную группу, замещенную алкоксигруппой, имеющей 1-4 атома углерода; или
группу, которая образует кольцо при присоединении к атому азота указанной выше формулы; или
группу, представленную формулой Y3-CO-R41,
где:
Y3 представляет простую связь или алкиленовую группу, имеющую 1-7 атомов углерода,
R41 представляет
гидроксигруппу;
алкоксигруппу, имеющую 1-6 атомов углерода;
пиперидиногруппу;
пиперазин-1-ильную группу, замещенную алкильной группой, имеющей 1-6 атомов углерода, морфолиноалкильной группой, имеющей 5-10 атомов углерода, или алкиламиноалкильной группой, имеющей 2-14 атомов углерода;
или
морфолиногруппу.
Другой вариант осуществления настоящего изобретения представляет собой ингибитор ALK5, который содержит описанное выше тиазолилимидазольное производное или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, другой вариант осуществления настоящего изобретения представляет собой средство для роста волос, которое содержит в качестве активного ингредиента вещество для ингибирования функции ALK5, участвующей в передаче сигналов TGF-β, и, таким образом, настоящее изобретение предоставляет совершенно новую концепцию, в которой механизм действия отличается от механизма действия обычного средства для роста волос.
Кроме того, другой вариант осуществления настоящего изобретения представляет собой промежуточное соединение для получения соединения, представленного формулой (I), где часть, соответствующая А описанной выше формулы (I), представляет собой группы, как описано ниже,
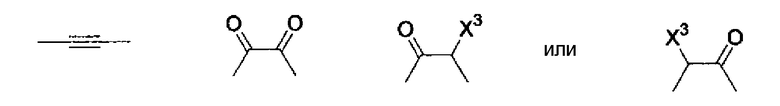
где Х3 представляет атом водорода или атом галогена.
Предпочтительные соединения формулы (I) в соответствии с настоящим изобретением включают соединение, где R2 представляет собой атом водорода, атом галогена, алькильную группу, имеющую 1-6 атомов углерода, или алькильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена, предпочтительнее соединение, где R2 представляет собой алькильную группу, имеющую 1-6 атомов углерода, или трифторметильную группу, и еще предпочтительнее соединение, где R2 представляет собой метильную группу или трифторметильную группу.
Предпочтительными являются соединения, где R1 представляет собой фенильную группу, конденсированную с 5-7-членным гетероароматическим или неароматическим кольцом, содержащим по меньшей мере 1 гетероатом, выбранный из группы, состоящей из N, O и S. Предпочтительны также соединения, где Х1 представляет собой атом серы и X2 представляет собой атом углерода.
Хотя используемый в настоящем описании термин «средство для роста волос» означает фармацевтический продукт или квази лекарственное средство, которое применяется с целью индукции роста волос, стимуляции роста волос или предотвращения облысения, требуется, чтобы этот термин понимался в широком смысле и не должен использоваться исключительно в каком-либо одном смысле. Когда средство для роста волос по настоящему изобретению используется в виде фармацевтического продукта, оно может применяться для облегчения или предотвращения, например, очагового облысения или облысения по мужскому типу, но применение средства для роста волос по настоящему изобретению не ограничивается этим.
Настоящее изобретение показывает, что вещество, которое ингибирует функцию ALK5, действует в качестве облегчающего или профилактического средства против гипофункции клеток волосяных фолликулов.
Вещество, которое ингибирует функцию ALK5, представляет собой вещество, которое подавляет фосфорилирование Samd2 и Smad3, когда сигнал передается от рецептора TGF-β, и, например, иллюстративные соединения описаны в пп.1-6 формулы настоящего изобретения. Поскольку описанный выше механизм действия может полностью ингибировать эффект подавления роста, оказываемый TGF-β против клеток волосяных фолликулов, которые также являются клетками, вырабатывающими кератин волос, то ожидается, что это вещество эффективно в отношении симптомов, которые облегчались или предотвращались обычным средством для роста волос.
Кроме того, ожидается также, что это вещество оказывает синергический эффект в комбинации с другими стимуляторами роста волос или средствами для роста волос, имеющими другую эффективность.
Хотя средство для роста волос в соответствии с настоящим изобретением можно вводить в различных дозировках и в различных дозированных формах в зависимости от природы веществ, предпочтительно, чтобы это вещество применялось наружно или вводилось перорально ввиду необходимости продолжительного введения. Не все такие дозировки можно однородно выразить в цифровых величинах. Однако, что касается соединений 1-202 и 228-249, то может быть необходимо вводить примерно от 0,0001 до 10 мас.% указанных веществ, предпочтительно, от 0,001 до 5 мас.% указанных веществ, и более предпочтительно, от 0,001 до 1 мас.% указанных веществ в виде лосьона, мази или геля для наружного применения, или, альтернативно, может быть необходимо ввести примерно 1-100 мг/кг такого соединения в виде порошкообразного лекарственного средства или капсулы для перорального введения. Описанные выше композиции можно получить путем использования обычных методик получения препаративных форм.
Дозированная форма средства для роста волос в соответствии с настоящим изобретением конкретно не ограничена определенной формой, но в случае препарата для наружного применения средство для роста волос, содержащее ингибитор ALK5, такой как любое из соединений 1-202 и 228-249, в качестве активного ингредиента, предпочтительно предоставлена в виде растворимой в воде композиции. В целом для получения такой растворимой в воде композиции можно использовать разнообразные добавки (увлажнители, загустители, консерванты, антиоксиданты, отдушки и красители и т.д.), используемые для изготовления лекарственных средств, квази препаратов или косметических средств. Средство для роста волос в соответствии с настоящим изобретением может быть предоставлено, например, в виде композиции для ухода за волосами, такой как лекарственное средство для волос, масло для волос, мусс для волос или гель, композиции для мытья волос, такой как шампунь или средство для ополаскивания волос, или альтернативно, как мазь.
Когда средство для роста волос в соответствии с настоящим изобретением представлено в виде жидкого лекарственного средства, то ингибитор ALK5, такой как любое из соединений 1-202 и 228-249, соответственно объединяется с очищенной водой, подходящим буферным раствором, таким как фосфатный буфер, физиологическим солевым раствором, таким как солевой раствор, раствор Рингера или раствор Лока, этанолом, глицерином и обычно используемым поверхностно-активным веществом, для получения лекарственного средства в форме стерилизованного водного раствора, неводного раствора, суспензии, липосом или эмульсии. Этот препарат местно применяют в виде жидкого препарата для волосистой кожи головы. В этом случае жидкий препарат можно непосредственно наносить на волосистую кожу головы или его можно наносить с помощью инъекционного сопла для распыления.
Когда средство для роста волос в соответствии с настоящим изобретением представлено в виде полутвердого препарата, то ингибитор ALK5, такой как любое из соединений 1-202 и 228-249, можно смешать с жиром, жирным маслом, ланолином, вазелином, парафином, воском, мазью, смолой, пластиком, гликолями, высшим спиртом, глицерином, водой, эмульгаторами, суспендирующими агентами или подобными веществами, и затем местно наносить в качестве лекарственного средства для наружного применения, такого как мазь или крем.
Когда средство для роста волос в соответствии с настоящим изобретением представлено в виде твердого препарата, то ингибитор ALK5, такой как любое из соединений 1-202 и 228-249, можно соответствующим образом смешать с подходящей добавкой для получения лекарственного средства для наружного применения, такого как порошкообразный препарат или композиция в виде присыпки, или альтернативно ингибитор, если требуется, можно растворить или суспендировать в растворителе для получения твердой композиции для нанесения на волосистую кожу головы.
Далее, в случае перорального введения ингибитор ALK5, такой как любое из соединений 1-202 и 228-249, можно смешать с фармацевтически приемлемым носителем (эксципиентами, связывающими агентами, дезинтегрантами, ароматизирующими веществами и эмульгаторами и т.д.), разбавителем, солюбилизирующим агентом или подобным веществом, и полученный таким образом фармацевтический продукт предпочтительно предоставлен в виде таблетки, капсулы, гранулы, порошкообразного препарата, сиропа, суспензии, раствора или подобной форме, которую можно получить в соответствии с обычной методикой.
В настоящем изобретении атом галогена представляет собой атом фтора, атом хлора, атом брома или атом иода.
Алкильная группа, имеющая 1-6 атомов углерода, означает насыщенную алкильную группу с линейной или разветвленной цепью, имеющей 1-6 атомов углерода, и включает, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, трет-пентильную группу и н-гексильную группу.
Алкоксигруппа, имеющая 1-6 атомов углерода, означает алкоксигруппу с линейной или разветвленной цепью, имеющей 1-6 атомов углерода, и включает, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, пентилоксигруппу и гексилоксигруппу.
Фенилалкоксигруппа из 7-12 атомов углерода означает фенилалкоксигруппу, имеющую 7-12 атомов углерода, и включает, например, бензилоксигруппу и фенетилоксигруппу.
Алкиламиногруппа, имеющая 1-6 атомов углерода, означает моно- или диалкиламиногруппу с линейной или разветвленной цепью, имеющей 1-6 атомов углерода, и включает, например, метиламиногруппу, этиламиногруппу и N,N-диметиламминогруппу.
Фенильная группа, конденсированная с 5-7-членным гетероароматическим или неароматическим кольцом, имеющим по меньшей мере один гетероатом, выбранный из группы, состоящей из N, O и S, включает, например, бензотиазолильную группу, бензоксазолильную группу и бензо(1,3)диоксолильную группу.
Пиридильная группа, конденсированная с 5-7-членным гетероароматическим кольцом, имеющим по меньшей мере один гетероатом, выбранный из группы, состоящей из N, O и S, включает, например, пиразолпиридильную группу, имидазолпиридильную группу и триазолпиридильную группу.
Алканоильная группа, имеющая 1-6 атомов углерода, означает алканоильную группу с линейной или разветвленной цепью, имеющей 1-6 атомов углерода, и включает, например, формильную группу, ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, валерильную группу, гексаноильную группу и пивалоильную группу.
Гидроксилкильная группа, имеющая 1-5 атомов углерода, означает гидроксилкильную группу с линейной или разветвленной цепью, имеющей 1-5 атомов углерода, и включает, например, гидроксиметильную группу, 1-гидроксиэтильную группу и 2-гидроксиэтильную группу.
Фенилалкильная группа из 7-12 атомов углерода означает фенилалкильную группу, имеющую 7-12 атомов углерода, и включает, например, бензильную группу и фенетильную группу.
Алкильная группа, имеющая 1-12 атомов углерода, означает насыщенную алкильную группу с линейной или разветвленной цепью, имеющей 1-12 атомов углерода, и включает, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, 1-этилпропильную группу, н-гексильную группу и н-додецильную группу.
Алкенильная группа, имеющая 2-12 атомов углерода, означает алкенильную группу с линейной или разветвленной цепью, имеющей 2-12 атомов углерода, и включает, например, винильную группу, 1-пропенильную группу, аллильную группу, изопропенильную группу, бутенильную группу, изобутенильную группу, гексенильную группу и додеценильную группу.
Циклоалкильная группа из 3-7 атомов углерода означает циклоалкильную группу, имеющую 3-7 атомов углерода, и включает, например, циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
Алкоксифенилалкоксигруппа, имеющая 8-12 атомов углерода, означает фенилалкоксигруппу, имеющую 8-12 атомов углерода, в которой бензольное кольцо замещено алкоксигруппой, и включает, например, 4-метоксибензилоксигруппу и 4-метоксифенэтоксигруппу.
Циклоалкильная группа из 3-9 атомов углерода, замещенная оксогруппой, означает циклоалкильную группу, имеющую 3-9 атомов углерода, замещенную оксогруппой в кольце, и включает, например, 4-оксоциклогексильную группу.
Тетрагидропиранильная группа включает, например, 2-тетрагидропиранильную группу, 3-тетрагидропиранильную группу и 4-тетрагидропиранильную группу.
Алкиленовая группа, имеющая 1-12 атомов углерода, означает алкиленовую группу с линейной или разветвленной цепью, имеющей 1-12 атомов углерода, и включает, например, метиленовую группу, этиленовую группу, триметиленовую группу, тетраметиленовую группу, петаметиленовую группу, гексаметиленовую группу и додекаметиленовую группу.
Алкиленовая группа, имеющая 1-7 атомов углерода, означает алкиленовую группу с линейной или разветвленной цепью, имеющей 1-7 атомов углерода, и включает, например, метиленовую группу, этиленовую группу, триметиленовую группу, тетраметиленовую группу, петаметиленовую группу, гексаметиленовую группу и гептаметиленовую группу.
Алкенильная группа, имеющая 2-6 атомов углерода, означает алкенильную группу с линейной или разветвленной цепью, имеющей 2-6 атомов углерода, и включает, например, винильную группу, 1-пропенильную группу, аллильную группу, изопропенильную группу, бутенильную группу, изобутенильную группу и гексенильную группу.
Алкинильная группа, имеющая 2-6 атомов углерода, означает алкинильную группу с линейной или разветвленной цепью, имеющей 2-6 атомов углерода, и включает, например, этинильную группу, 1-пропинильную группу и 2-пропинильную группу.
Пиперидинильная группа включает, например, 2-пиперидинильную группу, 3-пиперидинильную группу и 4-пиперидинильную группу.
Пирролидинильная группа включает, например, 2-пирролидинильную группу, 3-пирролидинильную группу и 4-пирролидинильную группу.
Пиперазинильная группа включает, например, 2-пиперазинильную группу и 3-пиразинильную группу.
Тетрагидрофуранильная группа включает, например, 2-тетрагидрофуранильную группу и 3-тетрагидрофуранильную группу.
Фенильная группа, замещенная алкоксигруппой, имеющей 1-4 атома углерода, включает, например, 4-метоксифенильную группу.
Морфолиноалкильная группа, имеющая 5-10 атомов углерода, означает алкильную группу с линейной или разветвленной цепью, имеющей 1-6 атомов углерода, замещенную морфолиногруппой, и включает, например, морфолинометильную группу, 1-морфолиноэтильную группу и 2-морфолиноэтильную группу.
Алкиламиноалкильная группа, имеющая 2-14 атомов углерода, означает алкильную группу с линейной или разветвленной цепью, имеющей 1-6 атомов углерода, замещенную моно- или диалкиламиногруппой с линейной или разветвленной цепью, и включает, например, N-метиламинометильную группу, N-этиламинометильную группу, N,N-диметиламинометильную группу и N,N-диметиламиноэтильную группу.
Алкильная группа, имеющая 1-6 атомов углерода, замещенную 1-5 атомами галогена, означает насыщенную алкильную группу с линейной или разветвленной цепью, имеющей 1-6 атомов углерода, и включает, например, хлорметильную группу, трифторметильную группу и пентафторэтильную группу.
Кроме того, фармацевтически приемлемая соль представляет собой соль с щелочным металлом, щелочноземельным металлом, аммонием, алкиламмонием или подобным соединением, или, альтернативно, соль с неорганической кислотой или органической кислотой. Примеры описанной выше соли включают соль натрия, соль калия, соль кальция, соль аммония, соль алюминия, соль триэтиламмония, ацетат, пропионат, бутират, формиат, трифторацетат, малеат, тартрат, цитрат, стеарат, сукцинат, этилсукцинат, лактобионат, глюконат, глюкогептонат, бензоат, метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, бензолсульфонат, паратолуолсульфонат, лаурилсульфат, малат, аспартат, глутамат, адипат, соль с цистеином, соль с N-ацетилцистеином, гидрохлорид, гидробромид, фосфат, сульфат, гидроиодид, никотинат, оксалат, пикрат, тиоцианат, ундеканоат, соль с акриловым полимером и соль с карбоксивиниловым полимером.
Лучший способ осуществления изобретения
Соединение в соответствии с настоящим изобретением можно синтезировать, например, способом, описанным ниже. Таким образом, реакцию сочетания соединения, представленного формулой (а)
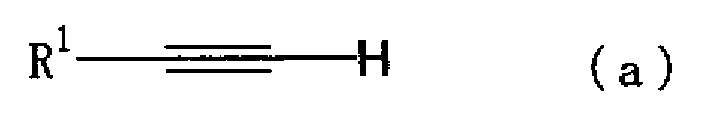
(где R1 имеет указанное выше значение), с соединением, представленным формулой (b)
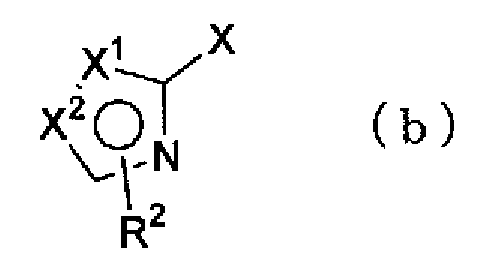
(где Х1, Х2 и R2 имеют такие же значения, как указано выше, и X представляет атом галогена) можно провести в растворителе в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий, и основания, синтезируя соединение по настоящему изобретению, представленное формулой (с)
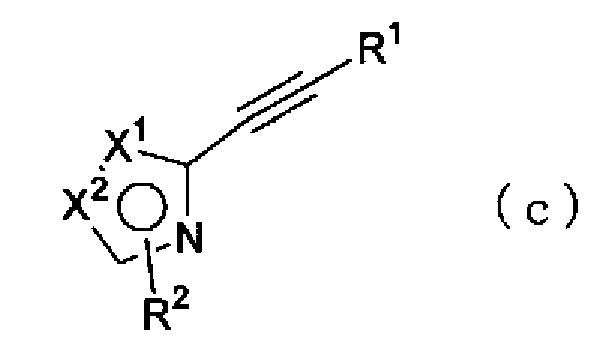
(где Х1, Х2, R1 и R2 имеют такие же значения, как указано выше).
Кроме того, полученное соединение (с) можно окислить, например, способом, в котором соединение (с) подвергают контактированию с хлоридом палладия (II) в диметилсульфоксиде, или способом, в котором соединение (с) подвергают контактированию с перманганатом калия в растворе ацетона-буфера, синтезируя соединение по настоящему изобретению, представленное формулой (d)
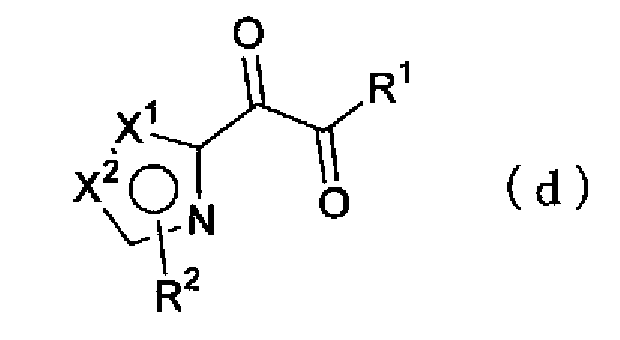
(где Х1, Х2, R1 и R2 имеют такие же значения, как указано выше).
Кроме того, взаимодействие соединения, представленного формулой (е)
(где R4 имеет указанное выше значение), с ацетатом аммония можно проводить в растворителе, синтезируя соединение по настоящему изобретению, представленное формулой (f)
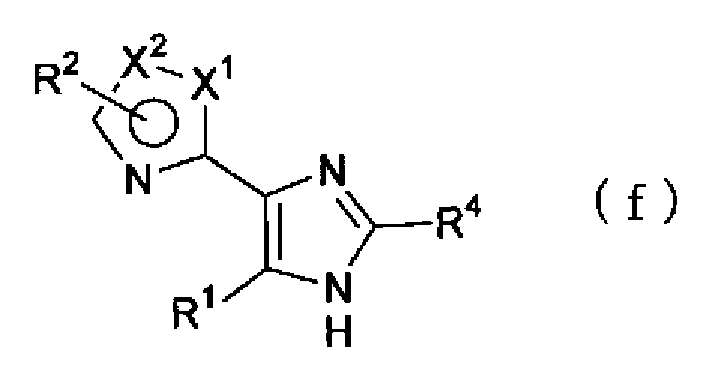
(где Х1, Х2, R1, R2 и R4 имеют такие же значения, как указано выше).
Альтернативно, соединение в соответствии с настоящим изобретением можно также синтезировать, например, следующим способом. То есть взаимодействие соединения, представленного формулой (g)
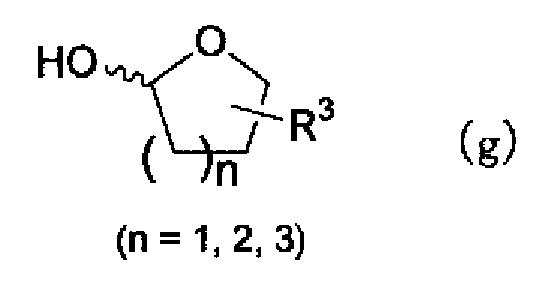
(где R3 имеет указанное выше значение), с соединением описанной выше формулы (d) и ацетатом аммония можно проводить в растворителе, синтезируя соединение по настоящему изобретению, представленное формулой (f)
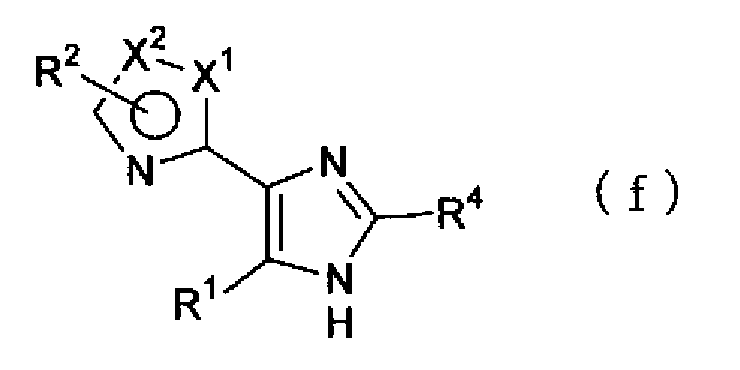
(где Х1, Х2, R1, R2 и R4 имеют такие же значения, как указано выше).
Кроме того, соединение в соответствии с настоящим изобретением можно также синтезировать, например, следующим способом. То есть соединение, представленное формулой (с)
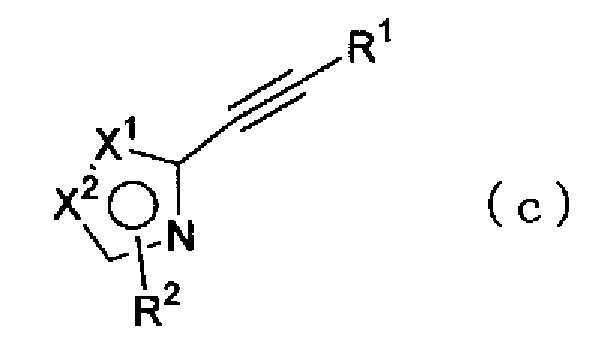
(где Х1, Х2, R1 и R2 имеют такие же значения, как указано выше), можно, например, гидратировать обработкой сульфатом ртути (II) и серной кислотой в растворителе, синтезируя соединение по настоящему изобретению, представленное формулой (h) или (i),
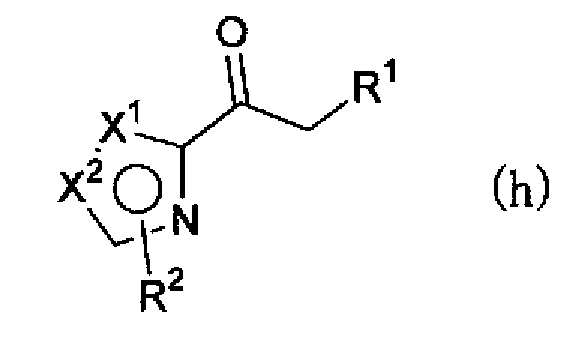
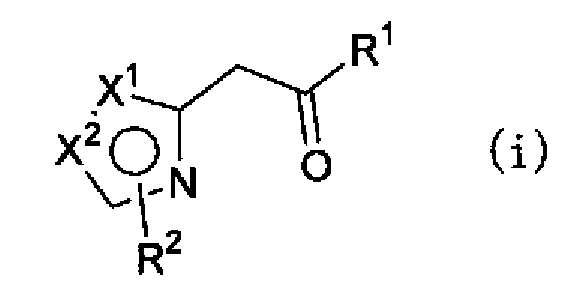
(где Х1, Х2, R1 и R2 имеют такие же значения, как указано выше), или смеси соединения описанной выше формулы (h) и описанной выше формулы (i). Далее, соединение формулы (h) или формулы (i) или смесь соединений формул (h) и (i) можно, например, обработать нитритом натрия в водном растворе хлористоводородной кислоты с получением соединения, представленного формулой (j) или формулой (k)
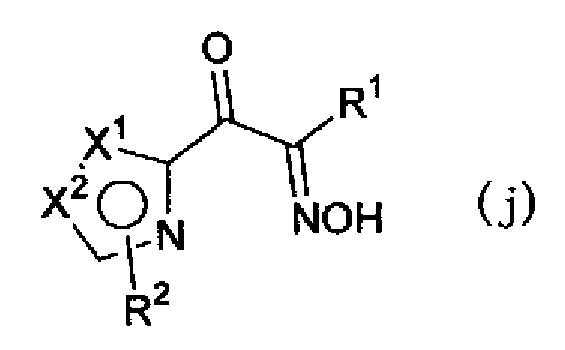
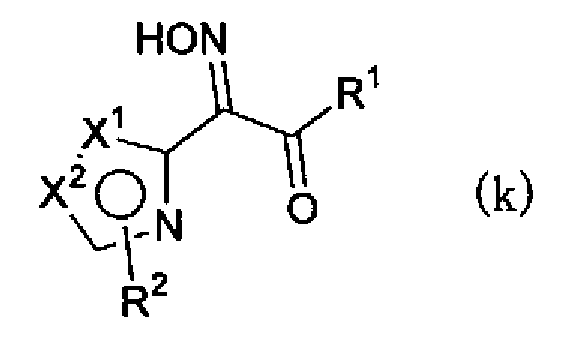
(где Х1, Х2, R1 и R2 имеют такие же значения, как указано выше), или смеси соединений описанных выше формул (j) и (k) и, далее, обработать соединением, представленным формулой (е)
(где R4 имеет указанное выше значение), и ацетатом аммония в растворителе. Затем полученную композицию восстанавливают триэтилфосфитом или подобным соединением, необязательно в растворителе, с получением соединения по настоящему изобретению, представленного формулой (f)
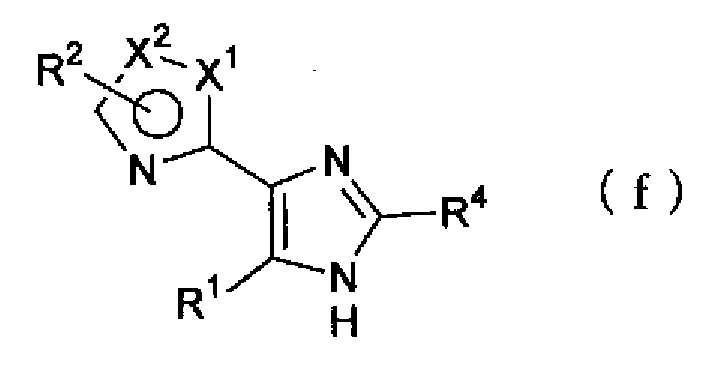
(где Х1, Х2, R1, R2 и R4 имеют такие же значения, как указано выше).
Соединение в соответствии с настоящим изобретением можно также синтезировать, например, следующим способом. То есть используя способ, в котором соединение, представленное формулой (l)
(где R1 имеет указанное выше значение), подвергают взаимодействию с N,O-диметилгидроксиламином через галогенангидрид кислоты в растворителе или конденсируют с N,O-диметилгидроксиламином в присутствии конденсирующего агента, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимид, получая соединение, представленное формулой (m)
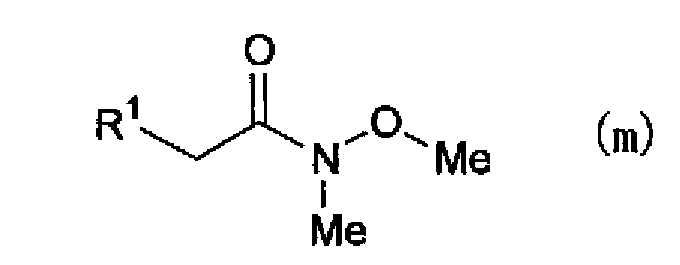
(где R1 имеет указанное выше значение), и затем соединение, представленное формулой (n)
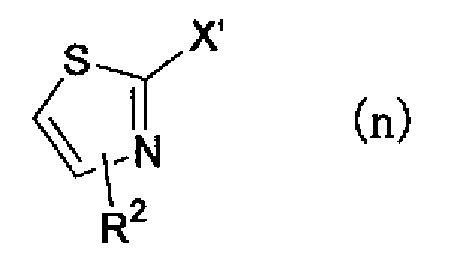
(где R2 имеет указанное выше значение, и X' представляет атом галогена или атом водорода) подвергают взаимодействию с основанием, таким как н-бутиллитий, в растворителе. Полученному аниону можно предоставить возможность взаимодействовать с соединением описанной выше формулы (m) с получением соединения по настоящему изобретению, представленного формулой (о)
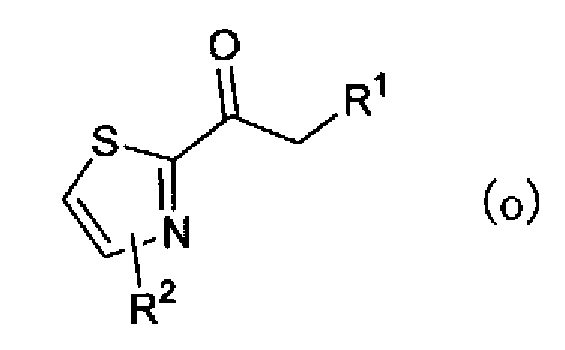
(где R1 и R2 имеют такие же значения, как указано выше). Далее, соединение формулы (о) можно галогенировать бромидом меди (II) в растворителе с получением соединения по настоящему изобретению, представленного формулой (р)
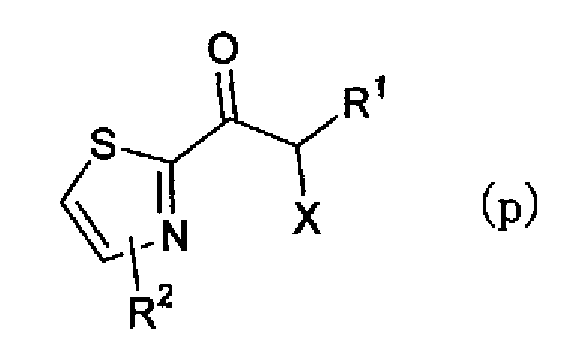
(где R1 и R2 имеют такие же значения, как указано выше, и X представляет атом галогена). Затем соединению, представленному формулой (р), дают возможность взаимодействовать с соединением, представленным формулой (q)
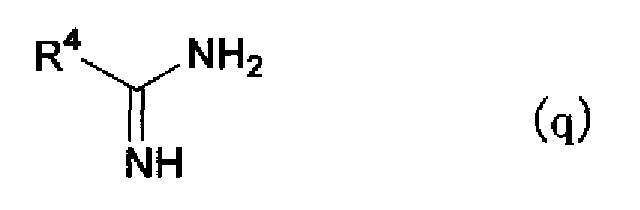
(где R4 имеет указанное выше значение), в растворителе с получением соединения по настоящему изобретению, представленного формулой (r)
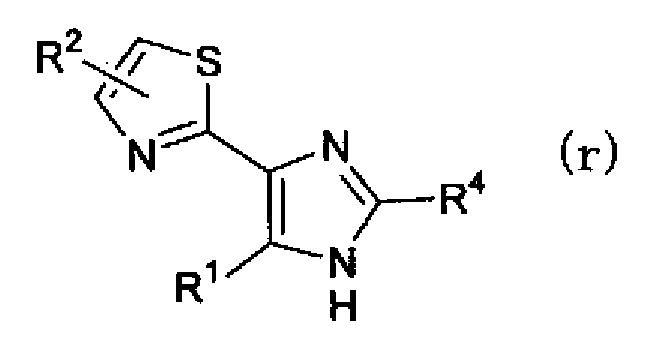
(где R1, R2 и R4 имеют такие же значения, как указано выше). В дополнение соединению, представленному формулой (r), дают возможность взаимодействовать с соединением, представленным формулой (s)
(где R3 имеет указанное выше значение и X” представляет атом галогена), в растворителе в присутствии основания, такого как гидрид натрия, и затем можно синтезировать соединение по настоящему изобретению, представленное формулой (t) или формулой (u)
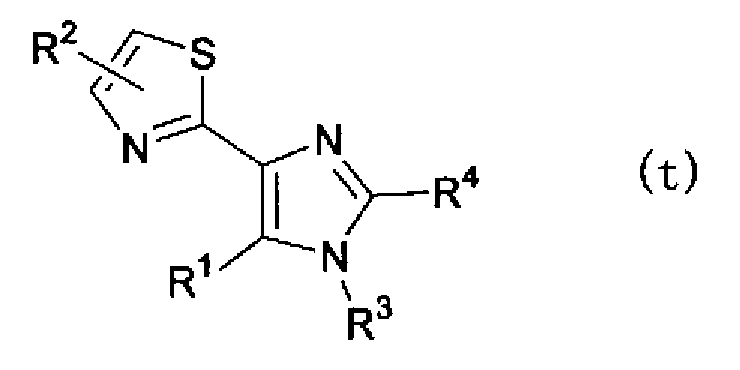
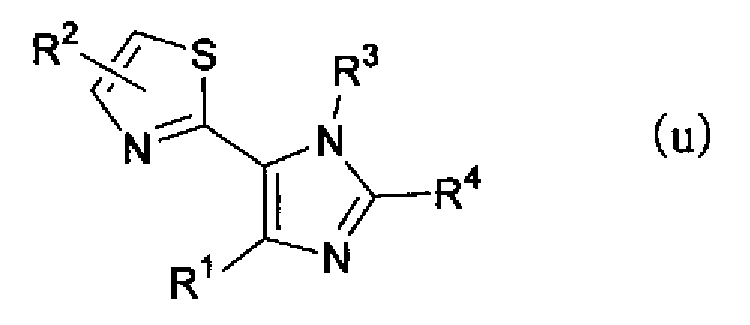
(где R1, R2, R3 и R4 имеют такие же значения, как указано выше), или смеси соединений описанных выше формул (t) и (u).
Соединение в соответствии с настоящим изобретением можно также синтезировать взаимообменом R1, R2, R3 и R4 в соединениях по настоящему изобретению, полученных описанными выше способами.
Примерами основания, используемого для описанных выше реакций, являются: соль щелочных металлов, такая как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, димсилнатрий, гидрид натрия, амид натрия и трет-бутилкалий; амины, такие как триэтиламин, диизопропиламин, пирролидин и пиперидин; ацетат натрия и ацетат калия. В качестве реакционного растворителя можно использовать растворитель, который является инертным в ходе реакции, и он включает воду; спирты, такие как метанол, этанол, изопропиловый спирт и трет-бутиловый спирт; простые эфиры, такие как диоксан и тетрагидрофуран; диметилформамид, диметилсульфоксид, пиридин, метиленхлорид, хлороформ, ацетон и уксусную кислоту.
ПРИМЕРЫ
Настоящее изобретение теперь будет описано более детально со ссылкой на примеры и примеры испытаний.
Пример 1
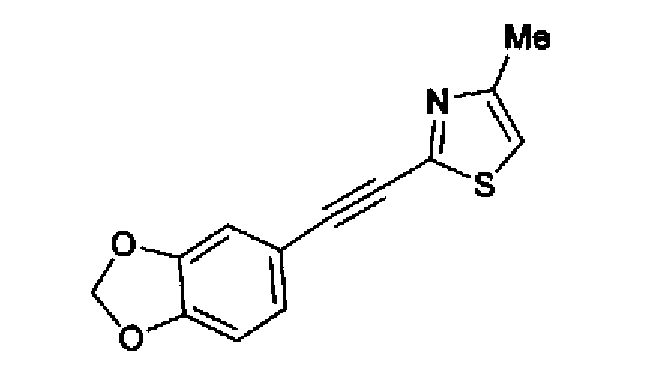
Синтез соединения 217
Триэтиламин (25 мл), тетракис(трифенилфосфин)палладий (642 мг и 5-этинилбензо(1,3)диоксол (1,79 г) добавляют к раствору 2-иод-4-метилтиазола (2,50 г) в ацетонитриле (50 мл) и затем смесь перемешивают в течение 4 ч при кипячении с обратным холодильником. После выпаривания растворителя остаток очищают колоночной флэш-хроматографией на силикагеле, используя смешанный растворитель из этилацетата, хлороформа и гексана, с получением указанного в заголовке соединения (2,38 г).
1H-ЯМР (300 MГц, CDCl3) δ м.д.: 2,49 (3H, д, J=0,9 Гц), 6,01 (2H, с), 6,81 (1H, д, J=8,1 Гц), 6,91 (1H, д, J=0,9 Гц), 7,01 (1H, д, J=1,6 Гц), 7,13 (1H, дд, J=8,1, 1,6 Гц); т.пл.: 111,5-112,0°С.
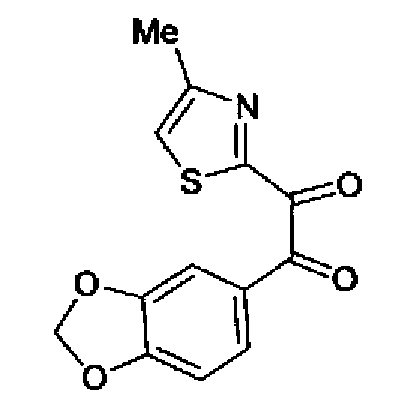
Хлорид палладия (II) (139 мг) добавляют к раствору соединения 217 (1,91 г) в диметилсульфоксиде (13 мл) и затем смесь перемешивают в течение 3 ч при 125°С. Полученный раствор разбавляют этилацетатом и затем фильтруют, полученный раствор последовательно промывают водой и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, используя смешанный растворитель из этилацетата и гексана, с получением указанного в заголовке соединения (960 мг).
1H-ЯМР (300 MГц, CDCl3) δ м.д.: 2,52 (3H, д, J=0,9 Гц), 6,09 (2H, c), 6,88 (1H, д, J=8,7 Гц), 7,40 (1H, д, J=0,9 Гц), 7,48-7,54 (2H, м); т.пл.: 131,5-132,5°С.
Пример 3
Синтез соединения 8
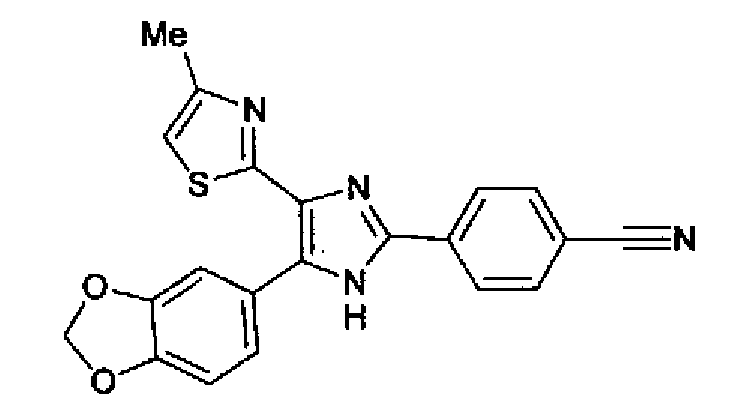
Ацетат аммония (1,50 г) добавляют к раствору соединения 203 (893 мг) и 4-цианобензальдегида (510 мг) в уксусной кислоте (40 мл) и затем смесь перемешивают в течение 4 ч при кипячении с обратным холодильником. После выпаривания растворителя раствор нейтрализуют водным аммиаком и экстрагируют дважды хлороформом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Полученный остаток очищают перекристаллизацией из метанола и хлороформа с получением указанного в заголовке соединения (575 мг).
1H-ЯМР (300 MГц, ДМСО-d6) δ м.д.: 2,36 (3H, c), 6,10 (2H, c), 7,06 (1H, д, J=7,6 Гц), 7,20 (1H, c), 7,55 (1H, ушир.д, J=7,6 Гц), 7,73 (1H, ушир.c), 7,97 (2H, д, J=8,3 Гц), 8,26 (2H, д, J=8,3 Гц), 13,05 (1H, ушир.с).
Пример 4
Синтез соединения 9
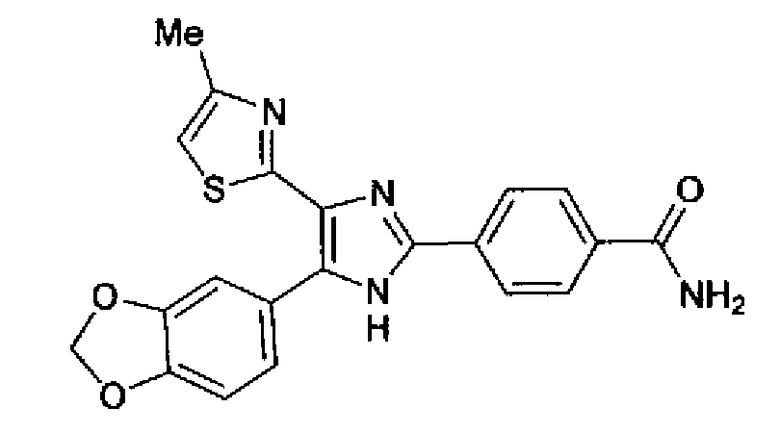
Гидроксид калия (584 мг) добавляют к раствору соединения 8 (575 мг) в трет-бутаноле (100 мл) и затем смесь перемешивают в течение ночи при кипячении с обратным холодильником. После выпаривания растворителя раствор разбавляют этилацетатом и промывают водой. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Полученный остаток перекристаллизовывают из метанола с получением указанного в заголовке соединения (556 мг).
1H-ЯМР (300 MГц, ДМСО-d6) δ м.д.: 2,36 (3H, c), 6,10 (2H, c), 7,05 (1H, д, J=8,1 Гц), 7,18 (1H, c), 7,42 (1H, ушир.c), 7,58 (1H, ушир.д, J=8,1 Гц), 7,75 (1H, ушир.c), 7,94-8,08 (3H, м), 8,15 (2H, д, J=8,2 Гц), 12,87 (1H, ушир.с); т.пл.: 276,0-277,0°С.
Пример 5
Синтез соединения 213
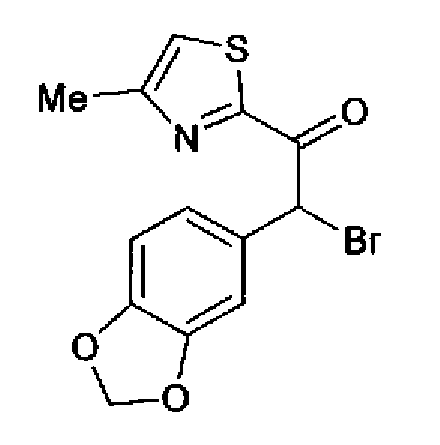
(1) Тионилхлорид (39,6 г) и каплю диметилформамида добавляют к раствору бензо(1,3)диоксол-5-илуксусной кислоты (30,0 г) в толуоле (200 мл) и затем смесь перемешивают в течение 2,5 ч при 60°С, после отгонки растворителя получают неочищенный бензо(1,3)диоксол-5-илацетилхлорид. Раствор гидроксида натрия (20,0 г) в воде (150 мл) добавляют к раствору гидрохлорида N,O-диметилгидроксиламина (19,5 г) в толуоле (200 мл) при 0°С, далее добавляют неочищенный бензо(1,3)диоксол-5-илацетилхлорид и затем смесь перемешивают в течение 3 ч. Реакционную смесь экстрагируют толуолом и сушат над безводным сульфатом магния, затем выпаривают растворитель с получением неочищенного 2-бензо(1,3)диоксол-5-ил-N-метокси-N-метилацетамида (35,4 г).
1H-ЯМР (200 MГц, CDCl3) δ м.д.: 3,19 (3H, c), 3,64 (3H, c), 3,67 (2H, c), 5,82 (2H, c), 6,71-6,83 (3H, м).
(2) 2,6М раствор н-бутиллития в гексане (34 мл) по каплям добавляют в раствор 4-метилтиазола (8,0 г) в тетрагидрофуране (150 мл) при -70°С и смесь перемешивают в течение 30 мин. Затем по каплям добавляют раствор 2-бензо(1,3)диоксол-5-ил-N-метокси-N-метилацетамида (20,0 г) в тетрагидрофуране (20 мл) и смесь перемешивают в течение 1 ч. Полученный раствор, к которому добавляют насыщенный водный раствор хлорида аммония, экстрагируют этилацетатом и после сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, используя смешанный растворитель из этилацетата и гексана, с получением 2-бензо(1,3)диоксол-5-ил-1-(4-метилтиазол-2-ил)этанона (19,3 г).
1H-ЯМР (300 MГц, CDCl3) δ м.д.: 2,56 (3H, д, J=0,9 Гц), 4,34 (2H, c), 5,93 (2H, c), 6,76 (1H, д, J=7,8 Гц), 6,80 (1H, дд, J=7,8, 1,6 Гц), 6,86 (1H, д, J=1,6 Гц), 7,25 (1H, кв, J=0,9 Гц).
(3) Бромид меди (II) (24,7 г) добавляют к перемешиваемому раствору 2-бензо(1,3)диоксол-5-ил-1-(4-метилтиазол-2-ил)этанона (19,3 г) в этилацетате (200 мл) и хлороформе (200 мл) и смесь перемешивают в течение 3 ч при кипячении с обратным холодильником. После фильтрования реакционной смеси растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, используя смешанный растворитель из этилацетата и хлороформа, с получением указанного в заголовке соединения (8,96 г).
1H-ЯМР (300 MГц, CDCl3) δ м.д.: 2,54 (3H, д, J=0,9 Гц), 5,95-5,99 (2H, м), 6,75 (1H, д, J=8,1 Гц), 6,78 (1H, c), 7,09 (1H, дд, J=7,9, 1,9 Гц), 7,21 (1H, д, J=1,9 Гц), 7,32 (1H, кв, J=0,9 Гц).
Пример 6
Синтез соединения 20
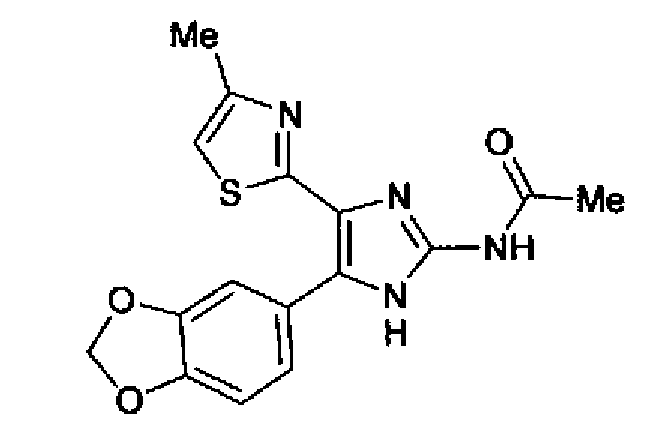
1-Ацетилгуанидин (1,63 г) добавляют к раствору соединения 213 (1,83 г) в ацетонитриле (20 мл) и смесь перемешивают в течение 16 ч при кипячении с обратным холодильником. После выпаривания растворителя раствор разбавляют хлороформом и затем последовательно промывают водой и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Полученный остаток элюируют смешанным растворителем из хлороформа и гексана через NH-силикагель (Chromatorex, производимый Fuji Silysia Chemical LTD.) колоночной флэш-хроматографией. Остаток из элюата перекристаллизовывают из смешанного растворителя из этилацетата и гексана с получением указанного в заголовке соединения (590 мг).
1H-ЯМР (300 MГц, ДМСО-d6) δ м.д.: 2,09 (3H, c), 2,34 (3H, д, J=0,9 Гц), 6,07 (2H, c), 6,98 (1H, д, J=8,2 Гц), 7,13 (1H, д, J=0,9 Гц), 7,45 (1H, дд, J=8,2, 1,7 Гц), 7,78 (1H, д, J=1,7 Гц), 11,28 (1H, ушир.c), 11,76 (1H, ушир.с); т.пл.: 169,0-173,0°С.
Пример 7
Синтез соединения 19
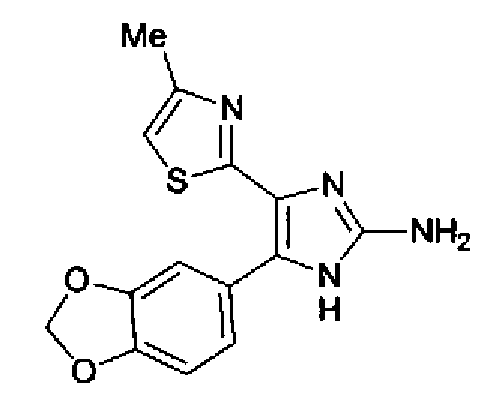
Концентрированную серную кислоту (0,58 мл) добавляют к смешанному раствору соединения 20 (578 мг) с метанолом (10 мл) и водой (10 мл) и смесь перемешивают в течение 3 ч при кипячении с обратным холодильником. В него добавляют водный раствор гидроксида калия, чтобы сделать реакционный раствор щелочным, и затем полученный раствор экстрагируют 3 раза хлороформом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Полученный остаток элюируют смешанным растворителем из метанола и хлороформа через NH-силикагель колоночной флэш-хроматографией. Остаток из элюата перекристаллизовывают из смешанного растворителя из хлороформа и гексана с получением указанного в заголовке соединения (260 мг).
1H-ЯМР(300 MГц, CDCl3) δ м.д.: 2,39 (3H, д, J=0,9 Гц), 6,00 (2H, c), 6,60 (1H, д, J=0,9 Гц), 6,84 (1H, д, J=7,9 Гц), 7,15 (1H, дд, J=7,9, 1,7 Гц), 7,19 (1H, д, J=1,7 Гц); т.пл.: 205,5-208,0°С.
Пример 8
Синтез соединения 21
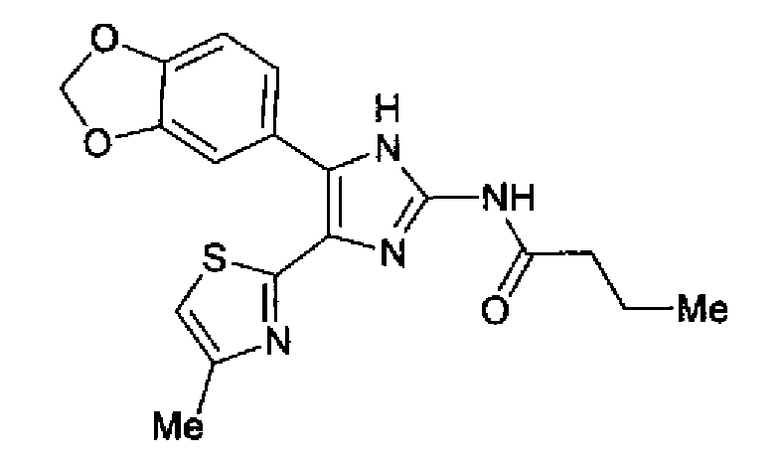
н-Бутилхлорид (36 мкл) добавляют к раствору соединения 19 (70 мг) в пиридине (0,7 мл) и смесь перемешивают в течение 2,5 ч при комнатной температуре. После разбавления реакционной смеси этилацетатом полученную смесь промывают последовательно насыщенным водным раствором гидрокарбоната натрия и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Полученный остаток очищают через NH-силикагель колоночной флэш-хроматографией, используя в качестве растворителя хлороформ, с получением указанного в заголовке соединения (84 мг).
1H-ЯМР (300 MГц, ДМСО-d6) δ м.д.: 0,93 (3H, т, J=7,3 Гц), 1,63 (2H, квт, J=7,3, 7,3 Гц), 2,28-2,41 (5H, м), 6,07 (2H, c), 6,98 (1H, д, J=8,1 Гц), 7,12 (1H, c), 7,46 (1H, ушир.д, J=8,1 Гц), 7,79 (1H, ушир.c), 11,25 (1H, ушир.c), 11,78 (1H, ушир.с).
Пример 9
Синтез соединения 135
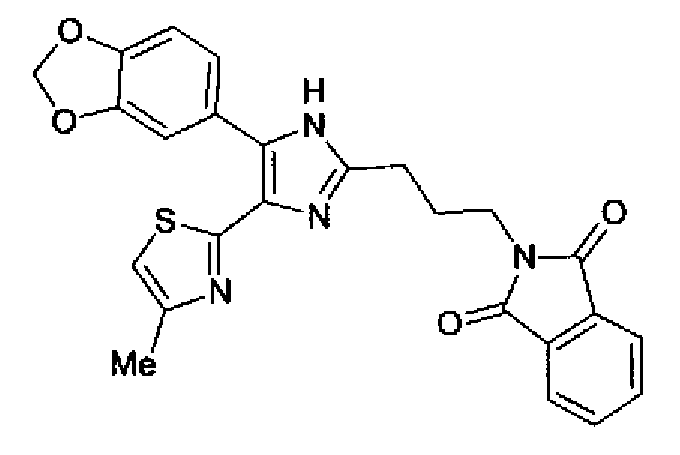
Раствор ацетата аммония (4,20 г) в метаноле (55 мл) добавляют к раствору соединения 203 (1,50 г) и 4-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)бутилальдегида (1,78 г) в тетрагидрофуране (55 мл) и смесь перемешивают в течение 2,5 ч при кипячении с обратным холодильником. После выпаривания растворителя раствор разбавляют хлороформом и затем промывают насыщенным водным раствором карбоната натрия. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, используя смешанный растворитель из метанола и хлороформа, с получением указанного в заголовке соединения (970 мг).
1H-ЯМР(300 MГц, ДМСО-d6) δ м.д.: 2,05-2,10 (2H, м), 2,32 (3H, д, J=0,8 Гц), 2,70 (2H, т, J=7,7 Гц), 3,70 (2H, т, J=6,8 Гц), 6,06 (2H, c), 6,98 (1H, д, J=8,2 Гц), 7,07 (1H, д, J=1,1 Гц), 7,46 (1H, дд, J=8,2, 1,9 Гц), 7,77-7,84 (5H, м), 12,19 (1H, c).
Пример 10
Синтез соединения 29
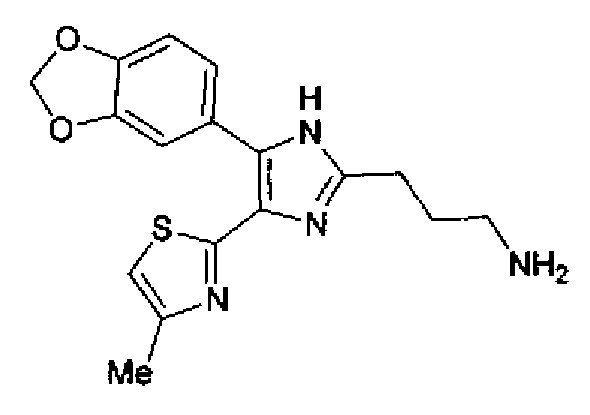
Гидразинмоногидрат (984 мг) добавляют к раствору соединения 135 (928 мг) в этаноле (50 мл) и смесь перемешивают в течение 3 ч при кипячении с обратным холодильником. После выпаривания растворителя остаток очищают колоночной хроматографией на NH-силикагеле, используя смешанный растворитель из метанола и хлороформа, с получением указанного в заголовке соединения (458 мг).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,90 (2H, тт, J=6,4, 6,4 Гц), 2,43 (3H, д, J=0,9 Гц), 2,84-3,01 (4H, м), 5,99 (2H, c), 6,69 (1H, д, J=0,9 Гц), 6,84 (1H, д, J=8,1 Гц), 7,26 (1H, дд J=8,1, 1,7 Гц), 7,38 (1H, д, J=1,7 Гц).
Пример 11
Синтез соединения 30
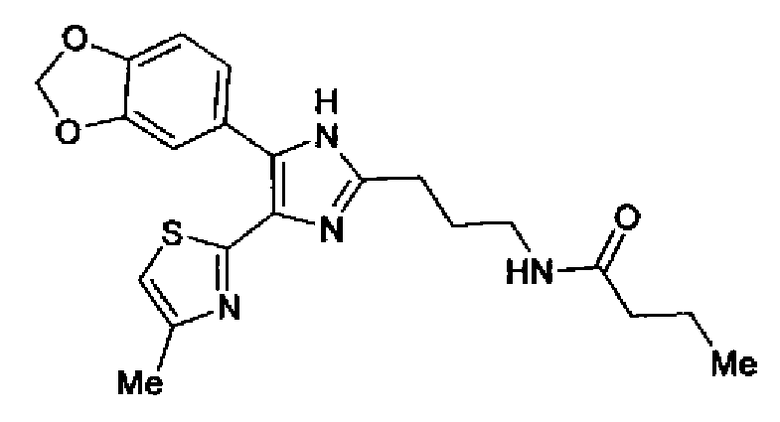
Гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (54 мг) добавляют к раствору соединения 29 (80 мг), масляной кислоты (25 мг) и моногидрата 1-гидроксибензотриазола (38 мг) в диметилформамиде (0,8 мл) и смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют этилацетатом и затем последовательно промывают насыщенным водным раствором гидрокарбоната натрия и рассолом. После сушки органического слоя над сульфатом магния растворитель выпаривают. Полученный остаток элюируют смешанным растворителем из метанола и хлороформа колоночной хроматографией на NH-силикагеле. Остаток из элюата перекристаллизовывают из смешанного растворителя из этилацетата и гексана с получением указанного в заголовке соединения (18 мг).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,96 (3H, т, J=7,4 Гц), 1,69 (2H, квт, J=7,4, 7,4 Гц), 1,80-1,94 (2H, м), 2,22 (2H, т, J=7,4 Гц), 2,45 (3H, д, J=0,9 Гц), 2,79 (т, J=6,2 Гц), 3,40 (2H, тд, J=6,2, 5,9 Гц), 5,99 (2H, c), 6,03 (1H, ушир.c), 6,72 (1H, c), 6,87 (1H, д, J=8,1 Гц), 7,39 (1H, ушир.д, J=8,1 Гц), 7,55 (1H, ушир.с); т.пл.: 134,0-139,0°С.
Пример 12
Синтез соединения 31
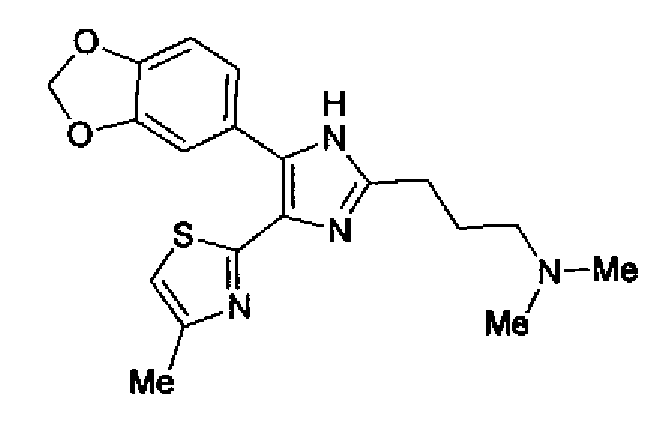
Соединение 29 (100 мг) и уксусную кислоту (51 мкл) добавляют к раствору формальдегида (72 мг) в тетрагидрофуране (2 мл) и смесь перемешивают в течение 30 мин при комнатной температуре. Реакционную смесь, к которой добавляют триацетоксиборгидрид натрия (248 мг), перемешивают в течение 16 ч. К реакционной смеси добавляют водный раствор гидрокарбоната натрия и полученную смесь экстрагируют дважды этилацетатом. После сушки объединенного органического слоя над сульфатом магния растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на NH-силикагеле, используя смешанный растворитель из метанола и хлороформа, с получением указанного в заголовке соединения (74 мг).
1H-ЯМР (200 МГц, ДМСО-d6) δ м.д.: 1,82 (2H, тт, J=7,7, 6,9 Гц), 2,15 (6H, c), 2,28 (2H, т, J=6,9 Гц), 2,35 (3H, д, J=0,9 Гц), 2,66 (2H, т, J=7,7 Гц), 6,07 (2H, c), 6,99 (1H, д, J=8,1 Гц), 7,09 (1H, д, J=0,9 Гц), 7,46 (1H, ушир.д, J=8,1 Гц), 7,75 (1H, ушир.c), 12,33 (1H, ушир.с).
Пример 13
Синтез соединения 167
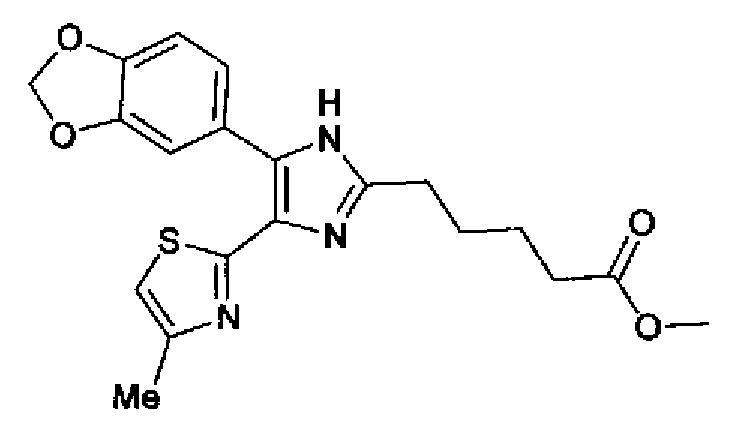
Ацетат аммония (4,20 г) добавляют к смешанному раствору соединения 203 (1,50 г) и метил-6-оксогексаноата (1,38 г) с тетрагидрофураном (20 мл) и метанолом (10 мл) и смесь перемешивают в течение 4 ч при кипячении с обратным холодильником. После выпаривания растворителя раствор разбавляют хлороформом и промывают насыщенным водным раствором карбоната натрия. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на NH-силикагеле, используя смешанный растворитель из метанола и хлороформа, с получением указанного в заголовке соединения (797 мг).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 1,67-1,90 (4H, м), 2,39 (2H, т, J=6,9 Гц), 2,43 (3H, д, J=1,1 Гц), 2,81 (2H, т, J=7,2 Гц), 3,69 (3H, c), 6,00 (2H, c), 6,69 (1H, ушир.c), 6,86 (1H, д, J=8,1 Гц), 7,17-7,37 (2H, м); т.пл.: 158,0-159,0°С.
Пример 14
Синтез соединения 41
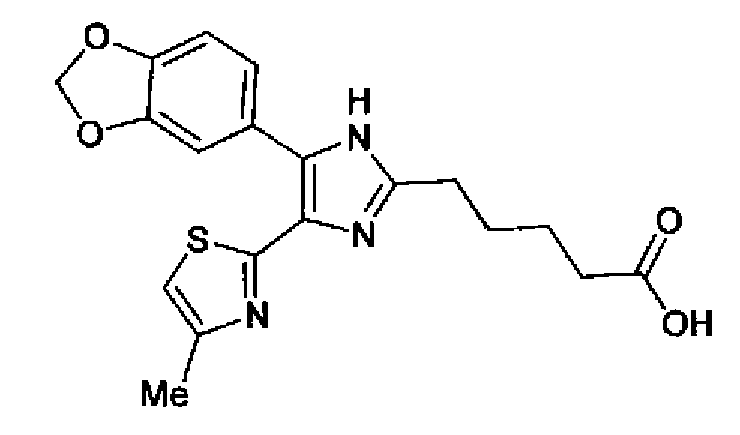
Водный раствор (10 мл) гидроксида натрия (227 мг) добавляют к раствору соединения 167 (767 мг) в метаноле (25 мл) и смесь перемешивают в течение 1 ч при кипячении с обратным холодильником. Полученный раствор нейтрализуют 2н. раствором хлористоводородной кислоты и затем экстрагируют дважды хлороформом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают с получением указанного в заголовке соединения (790 мг).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 1,82 (2H, м), 2,05 (2H, м), 2,42 (3H, c), 2,53 (2H, т, J=6,8 Гц), 3,28 (2H, т, J=7,8 Гц), 6,03 (2H, c), 6,89 (1H, д, J=0,9 Гц), 6,89 (1H, д, J=8,1 Гц), 7,14 (1H, д, J=1,7 Гц), 7,20 (1H, дд, J=8,1, 1,7 Гц).
Пример 15
Синтез соединения 42
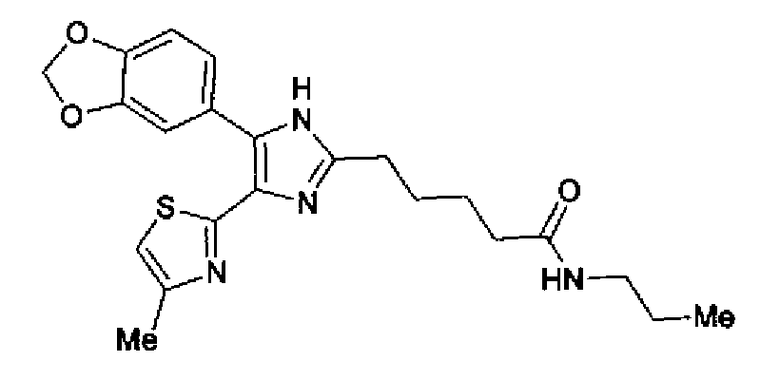
Гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (69 мг) добавляют к раствору соединения 41 (120 мг), н-пропиламина (21 мг) и моногидрата 1-гидроксибензотриазола (49 мг) в N,N-диметилформамиде (1,2 мл) и смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют этилацетатом и затем последовательно промывают насыщенным водным раствором гидрокарбоната натрия и рассолом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, используя смешанный растворитель из этилацетата и метанола, с получением указанного в заголовке соединения (51 мг).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,91 (3H, т, J=7,3 Гц), 1,51 (2H, квт, J=7,3, 7,3 Гц), 1,69-1,91 (4H, м), 2,27 (2H, т, J=6,4 Гц), 2,44 (3H, д, J=0,9 Гц), 2,84 (2H, т, J=6,7 Гц), 3,21 (2H, тд, J=7,3, 6,1 Гц), 5,76 (1H, ушир.c), 6,00 (2H, c), 6,71 (1H, д, J=0,9 Гц), 6,86 (1H, д, J=8,1 Гц), 7,33 (1H, ушир.д, J=8,1 Гц), 7,43 (1H, ушир.с).
Пример 16
Синтез соединения 45
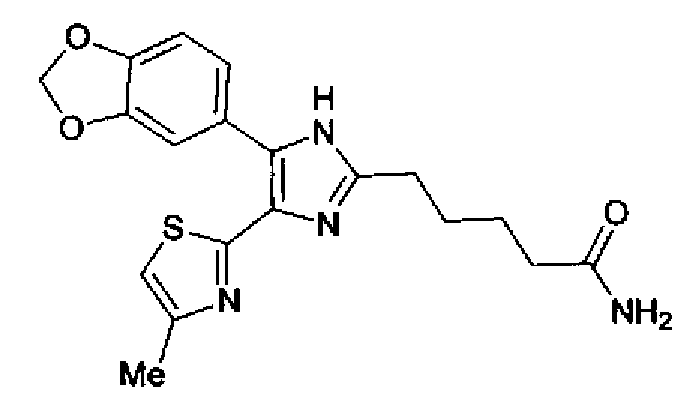
Тионилхлорид (0,3 мл) добавляют к раствору соединения 41 (131 мг) в хлороформе (1 мл) и смесь перемешивают в течение 2,5 ч при кипячении с обратным холодильником. После выпаривания растворителя из реакционной смеси к ней добавляют 28% водный аммиак и полученную смесь экстрагируют дважды хлороформом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Полученный остаток очищают колоночной флэш-хроматографией на силикагеле, используя смешанный растворитель из метанола и хлороформа, с получением указанного в заголовке соединения (42 мг).
1H-ЯМР(300 МГц, ДМСО-d6) δ м.д.: 1,48-1,75 (4H, м), 2,09 (2H, т, J=7,2 Гц), 2,34 (3H, д, J=1,0 Гц), 2,64 (2H, т, J=7,5 Гц), 6,07 (2H, c), 6,72 (1H, ушир.c), 6,99 (1H, д, J=8,2 Гц), 7,09 (1H, д, J=1,0 Гц), 7,26 (1H, ушир.c), 7,50 (1H, дд, J=8,2, 1,7 Гц), 7,82 (1H, д, J=1,7 Гц), 12,21 (1H, ушир.с).
Пример 17
Синтез соединения 216
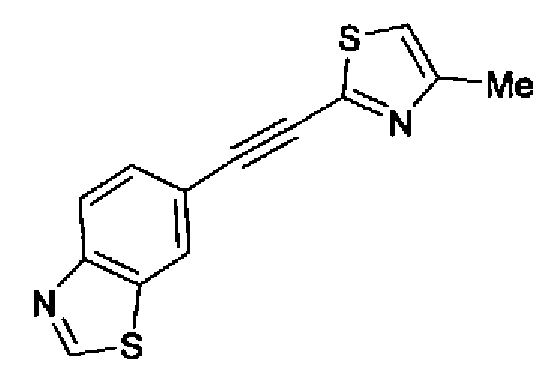
(1) Триметилсилилацетилен (106 мл), иодид меди (I) (0,948 г) и дихлорид бис(трифенилфосфин)палладия (II) (1,75 г) добавляют к 6-бромбензотиазолу (53,3 г) в триэтиламине (260 мл) и смесь перемешивают в течение 2,5 ч при 80°С. После выпаривания растворителя полученный остаток загружают на короткую колонку (силакагель; гексан:этилацетат=2:1) для элюирования. Остаток из элюата перекристаллизовывают из смешанного растворителя гексан-этилацетат с последующим получением 6-триметилсиланилэтинилбензотиазола (20,0 г) в виде бесцветного порошка (т.пл.: 104,5-105,0°С). Повторно подвергая фильтрат перекристаллизации (н-гексан-этилацетат), получают вторичные кристаллы (12,1 г), третичные кристаллы (9,68 г) и четвертичные кристаллы (4,61 г) в виде бесцветного порошка.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,27 (9H, c), 7,60 (1H, дд, J=8,5, 1,6 Гц), 8,05 (1H, дд, J=8,5, 0,6 Гц), 8,09 (1H, дд, J=1,6, 0,6 Гц), 9,03 (1H, c).
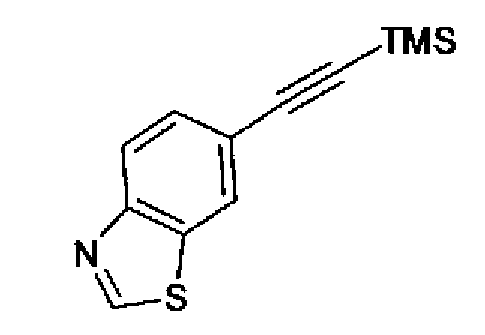
(2) Карбонат калия (29,7 г) добавляют к раствору 6-триметилсиланилэтинилбензотиазола (45,1 г) в метаноле (600 мл) и смесь перемешивают в течение 1,5 ч при комнатной температуре. Реакционный раствор фильтруют и затем полученную смесь последовательно промывают метанолом и этилацетатом. Фильтрат концентрируют, к нему добавляют воду и затем экстрагируют этилацетатом. Органический слой, промытый рассолом, сушат над безводным сульфатом магния. После выпаривания растворителя остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=4:1→1:1) с получением 6-этинилбензотиазола (30,0 г) в виде светло-желтого твердого вещества (т.пл.: 47,5-49,0°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 3,16 (1H, c), 7,63 (1H, дд, J=8,4, 1,6 Гц), 8,08 (1H, дд, J=8,5, 0,6 Гц), 8,11 (1H, д, J=1,4 Гц), 9,04 (1H, c)
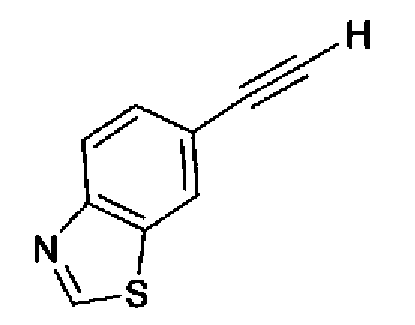
(3) Триэтиламин (280 мл) и тетракис(трифенилфосфин)палладий (6,8 г) добавляют к раствору 6-этинилбензотиазола (29,5 г) и 2-иод-4-метилтиазола (45,9 г) в ацетонитриле (600 мл) в атмосфере азота. Полученный раствор нагревают при кипении с обратным холодильником в течение 5 ч в атмосфере азота. После выпаривания растворителя остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1→1:1) с получением указанного в заголовке соединения (41,2 г) в виде светло-желтого порошка (т.пл.: 116,0-117,0°С).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 2,51 (3H, д, J=0,9 Гц), 6,96 (1H, д, J=0,9 Гц),7,71 (1H, дд, J=8,4, 1,8 Гц), 8,12 (1H, д, J=7,9 Гц), 8,20 (1H, д, J=1,8 Гц), 9,07 (1H, c)
Пример 18
Синтез соединения 204
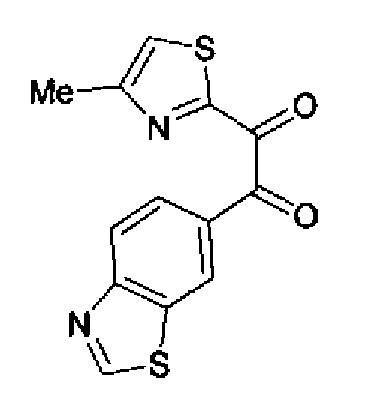
Перманганат калия (49,3 г) добавляют к смешанному раствору соединения 216 (40,0 г), ацетона (3,0 л)-буфера* (1,8 л) и смесь перемешивают в течение 30 мин при комнатной температуре. Реакционный раствор охлаждают на льду и после медленного добавления нитрита натрия (20,7 г) в него по каплям добавляют 10% серную кислоту (210 мл). После перемешивания полученного раствора в течение 30 мин при охлаждении на льду надосадочную жидкость экстрагируют хлороформом и водный слой дополнительно экстрагируют хлороформом. Объединенный органический слой промывают насыщенным водным раствором гидрокарбоната натрия и затем сушат над безводным сульфатом магния. После выпаривания растворителя остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1→1:1) с получением указанного в заголовке соединения (30,1 г) в виде светло-желтого порошка (т.пл.: 134,5-135,5˚С).
Буфер*: Гидрокарбонат натрия (6,8 г) и безводный сульфат магния (68,0 г), растворенные в воде (3,0 л).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,51 (3H, д, J=0,8 Гц), 7,45 (1H, д, J=0,8 Гц), 8,16 (1H, дд, J=8,5, 1,7 Гц), 8,26 (1H, дд, J=8,5, 0,6 Гц), 8,64 (1H, дд, J=1,7, 0,6 Гц), 9,23 (1H, c).
Пример 19
Синтез соединения 16
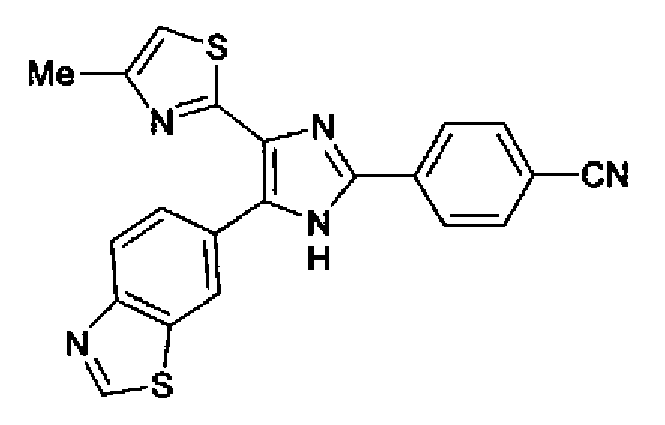
Ацетат аммония (321 мг) добавляют к раствору соединения 204 (200 мг) и цианобензальдегида (109 мг) в уксусной кислоте (8,0 мл) и смесь перемешивают в течение 2 ч при кипячении с обратным холодильником и в течение 14 ч при комнатной температуре. Реакционный раствор загружают водой и нейтрализуют 28% водным аммиаком. Полученный раствор дважды экстрагируют хлороформом и после сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Полученный остаток промывают хлороформом и кристаллы отфильтровывают с получением указанного в заголовке соединения (138 мг) в виде бесцветного порошка (т.пл.: 295,0-295,5°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,34 (3H, c), 7,24 (1H, c), 8,00 (2H, д, J=8,5 Гц), 8,10-8,37 (4H, м), 8,86 (1H, ушир.c), 9,48 (1H, c), 13,33 (1H, ушир.с).
Пример 20
Синтез соединения 50
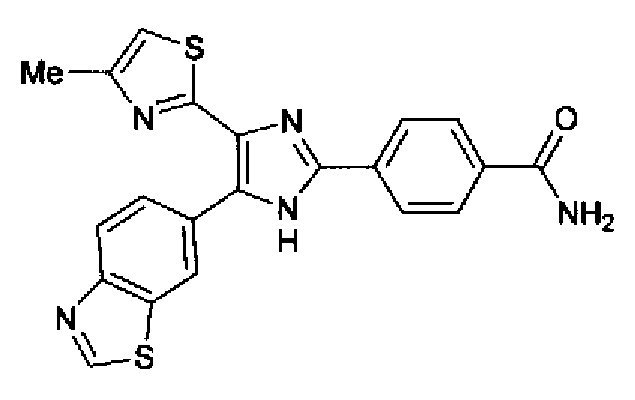
Раствор перекиси водорода (1,56 мл) добавляют к суспензии соединения 16 (130 мг) и карбоната калия (148 мг) в диметилсульфоксиде (5,2 мл) и смесь перемешивают в течение 1 ч при 100°С. Полученной суспензии дают возможность охладиться до комнатной температуры, добавляют воду и затем осажденные кристаллы отфильтровывают. Кристаллы очищают колоночной хроматографией на силикагеле (хлороформ:метанол=100:0→90:10) и затем перекристаллизовывают (хлороформ-метанол-н-гексан) с получением указанного в заголовке соединения (75,4 мг) в виде светло-желтого порошка (т.пл.: >300°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,34 (3H, c), 7,22 (1H, c), 7,44 (1H, ушир.c), 8,00-8,20 (7H, м), 8,87 (1H, ушир.c), 9,47 (1H, c), 13,15 (1H, ушир.с).
Пример 21
Синтез соединения 71
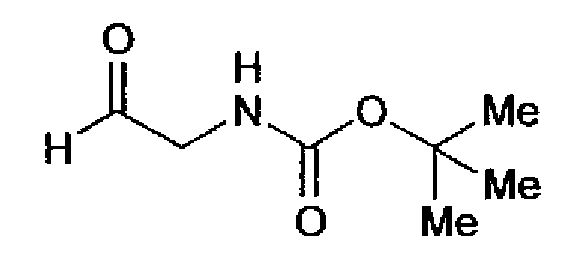
(1) 1,02М раствор диизобутилалюминийгидрида в толуоле (27 мл) добавляют по каплям к раствору метил-трет-бутоксикарбониламиноацетата (2,00 г) в толуоле (40 мл) при -70°С и смесь перемешивают в течение 1 ч. Реакционный раствор, в который добавляют метанол (10 мл) при -70°С, гасят и затем оставляют при комнатной температуре. После разбавления реакционного раствора этилацетатом полученный раствор промывают 1н. водным раствором хлористоводородной кислоты. Органический слой промывают рассолом, фильтруют через целит, сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=60:40→30:70) с получением трет-бутил(2-оксоэтил)карбамата (895 мг) в виде бесцветного масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 1,46 (9H, c), 4,05-4,11 (2H, м), 5,18 (1H, c), 9,66 (1H, c).
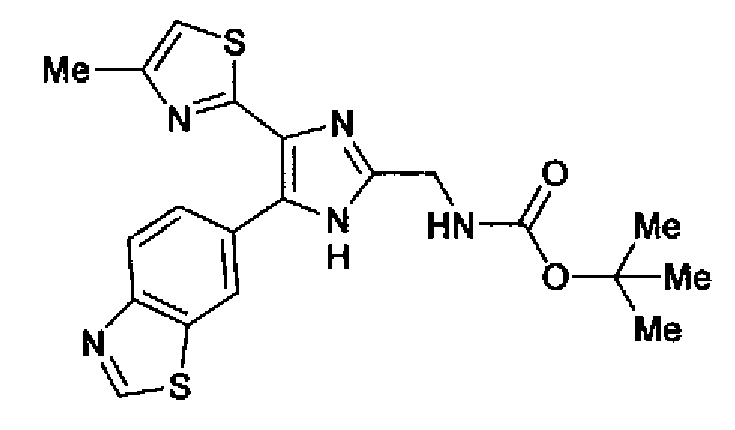
(2) Раствор ацетата аммония (811 мг) в метаноле (5,0 мл) добавляют к раствору соединения 204 (300 мг) и трет-бутил(2-оксоэтил)карбамата (294 мг) в тетрагидрофуране (10 мл) и смесь перемешивают в течение 2 ч при комнатной температуре. Реакционный раствор, в который добавляют насыщенный водный раствор гидрокарбоната натрия, нейтрализуют и затем дважды экстрагируют этилацетатом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=40:60→20:80) с получением указанного в заголовке соединения (291 мг) в виде светло-желтого аморфного вещества.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 1,49 (9H, c), 2,44 (3H, д, J=0,9 Гц), 4,43 (2H, д, J=6,1 Гц), 5,29 (1H, ушир.c), 6,76 (1H, c), 7,86 (1H, дд, J=8,5, 1,8 Гц), 8,18 (1H, д, J=8,4 Гц), 8,55 (1H, ушир.c), 9,04 (1H, c).
Пример 22
Синтез соединения 70
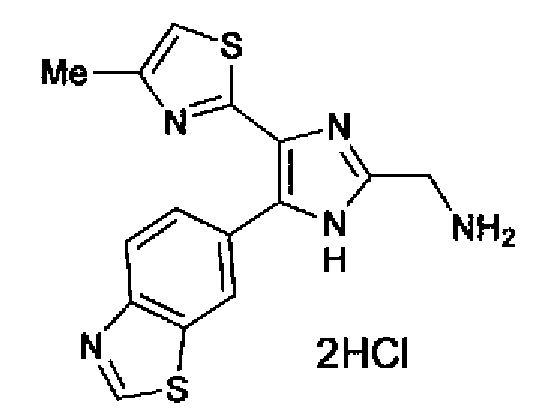
4н. Хлористый водород/диоксан (1,0 мл) добавляют к раствору соединения 71 (100 мг) в хлороформе (10 мл) и смесь перемешивают в течение 1,5 ч при комнатной температуре. Растворитель выпаривают и затем остаток перекристаллизовывают (метанол-диэтиловый эфир) с получением указанного в заголовке соединения (80 мг) в виде светло-коричневого порошка (т.пл.: 229,0-233,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,37 (3H, д, J=0,9 Гц), 4,16-4,25 (2H, м), 7,22 (1H, д, J=0,9 Гц), 8,08 (1H, дд, J=8,6, 1,8 Гц), 8,18 (1H, д, J=8,5 Гц), 8,60 (3H, ушир.), 8,90 (1H, д, J=0,9 Гц), 9,47 (1H, c).
Пример 23
Синтез соединения 72
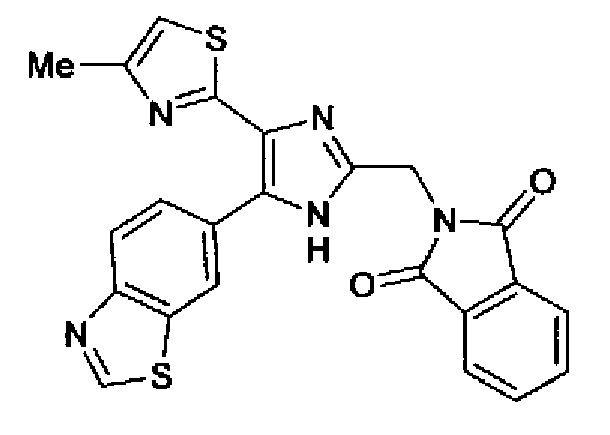
Раствор ацетата аммония (5,40 г) в метаноле (50 мл) добавляют к раствору соединения 204 (2,00 г) и (1,3-диоксо-1,3-дигидроиндол-2-ил)ацетальдегида (2,00 г) в тетрагидрофуране (70 мл) и смесь перемешивают в течение 3,5 ч при комнатной температуре. Реакционный раствор, в который добавляют насыщенный водный раствор гидрокарбоната натрия, нейтрализуют и затем 3 раза экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=40:60→20:80), (хлороформ:метанол=95:5) и (хлороформ:этилацетат=35:65) с получением указанного в заголовке соединения (1,9 г) в виде светло-желтого порошка (т.пл.: 250,5-255,0°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,44 (3H, д, J=0,8 Гц), 5,08 (2H, c), 6,74 (1H, ушир.c), 7,71-7,94 (6H, м), 8,16 (1H, д, J=8,5 Гц), 9,03 (1H, c).
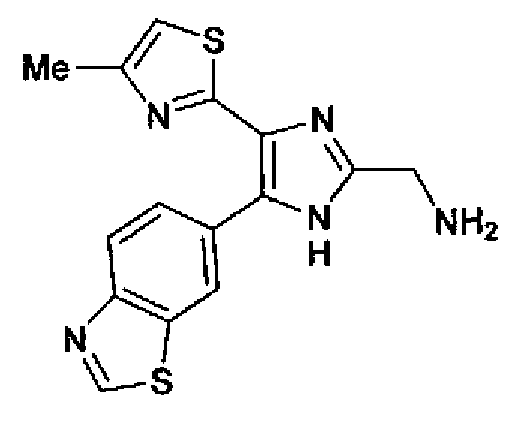
Пример 24
Синтез соединения 105
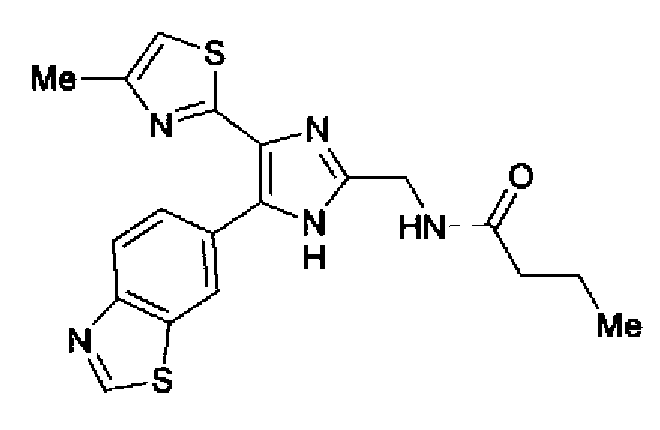
(1) Гидразинмоногидрат (2,12 г) добавляют к суспензии соединения 72 (1,88 г) в этаноле (45 мл) и смесь перемешивают в течение 24 ч при комнатной температуре. Метанол и хлороформ добавляют в реакционный раствор для полного растворения содержащегося в нем осадка. После добавления NH-силикагеля в полученный раствор растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (хлороформ:метанол=95:5) и затем колоночной хроматографией на силикагеле (хлороформ:метанол=90:10→хлороформ:метанол:аммиак= 100:1:1) с получением свободной формы соединения 70 (761 мг) в виде светло-желтого аморфного вещества.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,44 (3H, д, J=1,1 Гц), 4,12 (2H, c), 6,73 (1H, ушир.), 7,87 (1H, дд, J=8,5, 1,7 Гц), 8,17 (1H, дд, J=8,5, 0,5 Гц), 8,47 (1H, ушир.), 9,03 (1H, c).
(2) Бутирилхлорид (0,21 мл) по каплям добавляют в раствор свободной формы соединения 70 (600 мг) и триэтиламина (370 мг) в хлороформе (15,0 мл) при охлаждении на льду. После перемешивания в течение 30 мин при охлаждении льдом реакционный раствор загружают водой и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. После очистки остатка колоночной хроматографией на силикагеле (этилацетат→хлороформ:метанол=90:10) очищенное вещество перекристаллизовывают (этилацетат-гексан) с получением указанного в заголовке соединения (441 мг) в виде желтого порошка (т.пл.: 190,0-191,0°С.
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 0,89 (3H, т, J=7,4 Гц), 1,47-1,64 (2H, м), 2,14 (2H, т, J=7,5 Гц), 2,34 (3H, c), 4,36 (2H, д, J=5,6 Гц), 7,15 (1H, д, J=0,9 Гц), 8,08 (1H, c), 8,14 (1H, д, J=8,5 Гц), 8,34 (1H, т, J=5,1 Гц), 8,85 (1H, c), 9,43 (1H, c), 12,72 (1H, c).
Пример 25
Синтез соединения 88
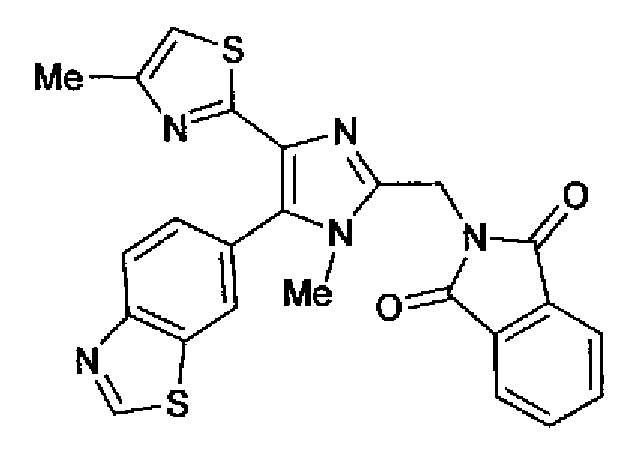
Соединение 72 (100 мг) добавляют к суспензии гидрида натрия (13 мг) в N,N-диметилформамиде (2,0 мл) при охлаждении льдом и смесь перемешивают в течение 10 мин. Полученную суспензию, в которую добавляют метилиодид (0,14 мл) при охлаждении льдом, перемешивают в течение 1,5 ч при охлаждении льдом. Реакционный раствор, к которому добавляют рассол, экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. После очистки остатка колоночной хроматографией на силикагеле (этилацетат) очищенное вещество перекристаллизовывают (этилацетат-гексан) с получением указанного в заголовке соединения (35 мг) в виде бесцветного порошка (т.пл.: 257,0-259,5°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,28 (3H, д, J=0,9 Гц), 3,65 (3H, c), 5,06 (2H, c), 6,60 (1H, д, J=0,9 Гц), 7,56 (1H, дд, J=8,4, 1,7 Гц), 7,72-7,93 (4H, м), 8,11 (1H, д, J=1,6 Гц), 8,23 (1H, д, J=8,5 Гц), 9,09 (1H, c).
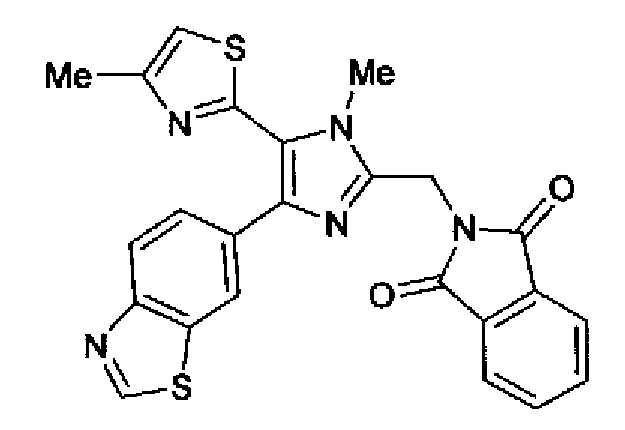
Фильтрат концентрируют с получением 2-(4-бензотиазол-6-ил-1-метил-5-(4-метилтиазол-2-ил)-1Н-имидазол-2-илметил)изоиндол-1,3-диона (15 мг), как представлено следующей формулой, в виде бесцветного, аморфного вещества.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,54 (3H, д, J=1,1 Гц), 3,87 (3H, c), 5,05 (2H, c), 6,95 (1H, д, J=0,9 Гц), 7,52 (1H, дд, J=8,5, 1,7 Гц), 7,72-7,93 (4H, м), 7,96 (1H, дд, J=8,5, 0,6 Гц), 8,17 (1H, дд, J=1,7, 0,5 Гц), 8,93 (1H, c).
Пример 26
Синтез соединения 89
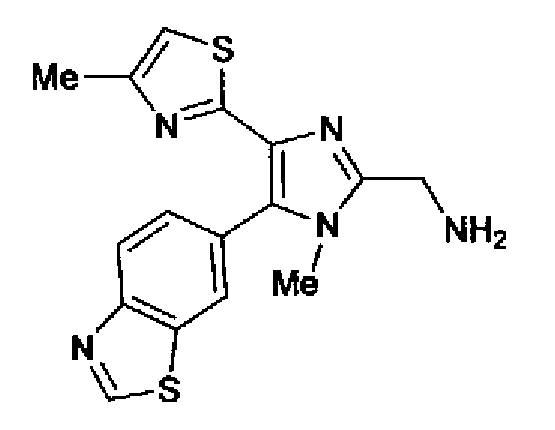
Гидразинмоногидрат (290 мг) добавляют к суспензии соединения 88 (328 мг) в метаноле (5,0 мл) и смесь перемешивают в течение 3 ч при комнатной температуре. Реакционный раствор разбавляют водой и дважды экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол =90:10→хлороформ:метанол:аммиак=100:10:1) с получением указанного в заголовке соединения (166 мг) в виде бесцветного порошка (т.пл.: 183,0-184,5°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,36 (3H, д, J=0,9 Гц), 3,52 (3H, c), 4,06 (2H, c), 6,61 (1H, д, J=0,9 Гц), 7,56 (1H, дд, J=8,5, 1,6 Гц), 8,10 (1H, дд, J=1,6, 0,5 Гц), 8,26 (1H, дд, J=8,4, 0,5 Гц), 9,10 (1H, c).
Пример 27
Синтез соединения 90
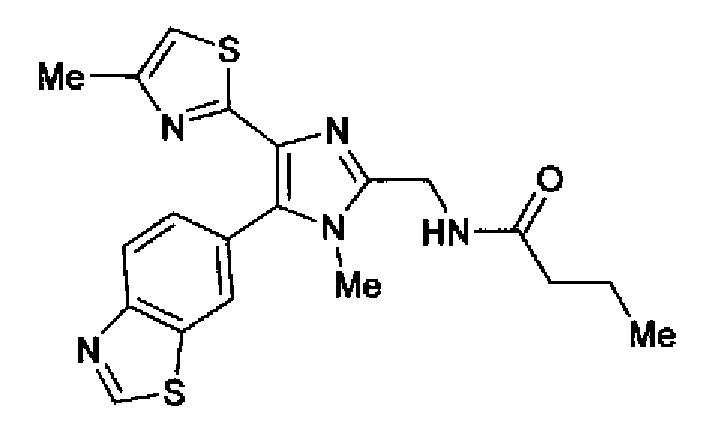
Бутирилхлорид (0,06 мл) добавляют по каплям в раствор соединения 89 (159 мг) и триэтиламина (101 мг) в хлороформе (5,0 мл) при охлаждении льдом. После перемешивания в течение 1 ч при охлаждении льдом реакционный раствор загружают водой и дважды экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. После очистки остатка колоночной хроматографией на силикагеле (хлороформ:метанол=9:1) и затем колоночной хроматографией на NH-силикагеле (этилацетат) очищенное вещество перекристаллизовывают (этилацетат-гексан) с получением указанного в заголовке соединения (137 мг) в виде бесцветного порошка (т.пл.: 212,5-213,5°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 0,88 (3H, т, J=7,4 Гц), 1,47-1,63 (2H, м), 2,09-2,18 (5H, м), 3,47 (3H, c), 4,46 (2H, д, J=5,8 Гц), 7,04 (1H, д, J=0,9 Гц), 7,64 (1H, дд, J=8,5, 1,7 Гц), 8,17 (1H, дд, J=8,5, 0,5 Гц), 8,34 (1H, дд, J=1,7, 0,5 Гц), 8,46 (1H, ушир.т, J=5,6 Гц), 9,49 (1H, c).
Пример 28
Синтез соединения 95
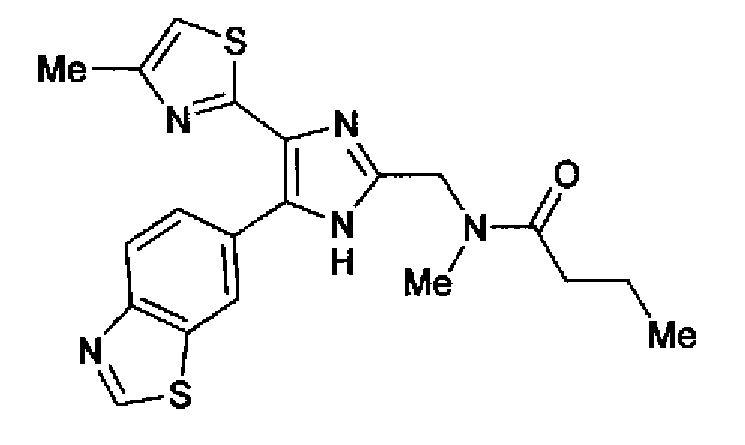
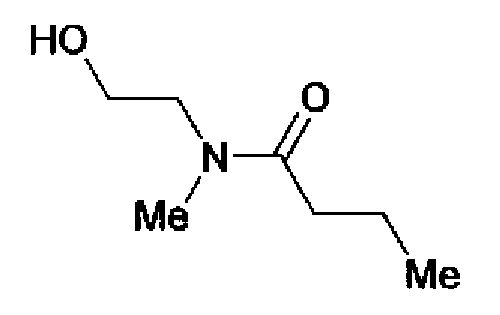
(1) Бутирилхлорид (4,6 мл) добавляют по каплям в раствор 2-(метиламино)этанола (3,0 г) и триэтиламина (11,0 мл) в хлороформе (30 мл) при охлаждении льдом. Смесь перемешивают в течение 20 мин при охлаждении льдом и затем добавляют воду. Смесь экстрагируют дважды хлороформом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:3→1:4 и затем (хлороформ:метанол=9:1) с получением N-(гидроксиэтил)-N-метилбутиламида (2,8 г) в виде светло-желтого масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,91-1,02 (3H, м), 1,58-1,77 (2H, м), 2,26-2,46 (2H, м), 2,96 и 3,07 (3H, 2c), 3,47 и 3,56 (2H, 2т, J=5,7 Гц), 3,78 (2H, т, J=5,1 Гц).
(2) Реагент Десса-Мартина (1,9 г) добавляют к раствору N-(гидроксиэтил)-N-метилбутиламида (600 мг) в дихлорметане (6,0 мл) и смесь перемешивают в течение 1,5 ч при комнатной температуре. Растворитель выпаривают с получением неочищенных кристаллов N-метил-N-(2-оксоэтил)бутиламида без очистки. К раствору N-метил-N-(2-оксоэтил)бутиламида и соединения 204 (301 мг) в тетрагидрофуране (15 мл) добавляют раствор ацетата аммония (820 мг) в метаноле (5,0 мл) и смесь перемешивают в течение 14 ч при комнатной температуре. Реакционный раствор нейтрализуют насыщенным водным раствором гидрокарбоната натрия и затем дважды экстрагируют этилацетатом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (гексан:этилацетат=35:65→хлороформ:метанол=95:5) и затем перекристаллизовывают (этилацетат-гексан) с получением указанного в заголовке соединения (233 мг) в виде светло-желтого порошка (т.пл.: 175,0-175,5°С).
1H-ЯМР(300 МГц, ДМСО-d6) δ м.д.: 0,87-0,98 (3H, м), 1,48-1,67 (2H, м), 2,26-2,44 (5H, м), 2,90 и 3,07 (3H, 2c), 4,63 (2H, c), 7,15 (1H, м), 8,03-8,19 (2H, м), 8,84 (1H, м), 9,44 (1H, д, J=1,2 Гц), 12,67 и 12,84 (1H, 2 ушир.).
Пример 29
Синтез соединения 96

(1) 1,02М раствор диизобутирилалюминийгидрида (16 мл) в толуоле по каплям добавляют к раствору (2-оксопирролидин-1-ил)ацетата (1,01 г) в толуоле (10 мл) при -78°С и смесь перемешивают в течение 1 ч. Реакционный раствор гасят метанолом при -78°С, затем разбавляют 1н. водным раствором хлористоводородной кислоты и дают нагреться до комнатной температуры при перемешивании. Реакционный раствор фильтруют через целит и затем фильтрат сушат. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=95:5→90:10 с получением 2-оксопирролидин-1-илацетальдегида (120 мг) в виде бесцветного масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,04-2,20 (2H, м), 2,46 (2H, т, J=8,2 Гц), 3,47 (2H, т, J=8,2 Гц), 4,17 (2H, c), 9,61 (1H, c).
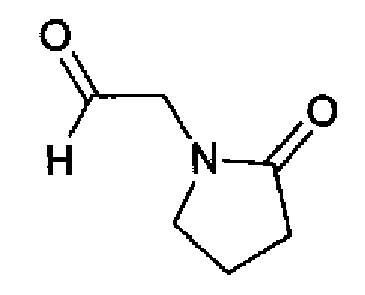
(2) Раствор ацетата аммония (640 мл) в метаноле (5,0 мл) добавляют к раствору 2-оксопирролидин-1-илацетальдегида (120 мг) и соединения 204 (230 мг) в тетрагидрофуране (10 мл) и смесь перемешивают в течение 1,5 ч при комнатной температуре. Реакционный раствор нейтрализуют насыщенным водным раствором гидрокарбоната натрия и затем дважды экстрагируют хлороформом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (этилацетат→хлороформ:метанол=90:10) и затем перекристаллизовывают (хлороформ-этилацетат-гексан) с получением указанного в заголовке соединения (161 мг) в виде бесцветного порошка (т.пл.: 209,5-210,5°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,90-2,05 (2H, м), 2,25-2,33 (2H, м), 2,33 (3H, c), 3,43 (2H, т, J=7,2 Гц), 4,50 (2H, c), 7,15 (1H, д, J=1,1 Гц), 8,08 (1H, ушир.c), 8,13 (1H, д, J=8,4 Гц), 8,81 (1H, ушир.c), 9,43 (1H, c), 12,82 (1H, ушир.).
Пример 30
Синтез соединения 197
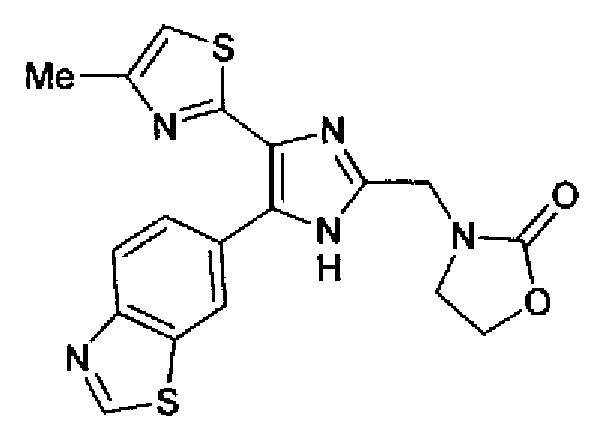
(1) Оксазолидин-2-он (331 мг) добавляют к суспензии гидрида натрия (181 мг) в N,N-диметилформамиде (5,0 мл) при охлаждении льдом и смесь перемешивают в течение 20 мин. К полученной суспензии по каплям добавляют раствор 2-бромэтоксиметилбензола (1,11 г) в N,N-диметилформамиде (3,0 мл) при охлаждении льдом и затем смесь перемешивают в течение 1 ч при комнатной температуре. Реакционный раствор разбавляют этилацетатом и дважды промывают рассолом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:3) с получением 3-(2-бензилоксиэтил)оксазолидин-2-она (281 мг) в виде бесцветного масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 3,46-3,52 (2H, м), 3,63-3,72 (4H, м), 4,25-4,34 (2H, м), 4,53 (2H, c), 7,27-7,40 (5H, м).
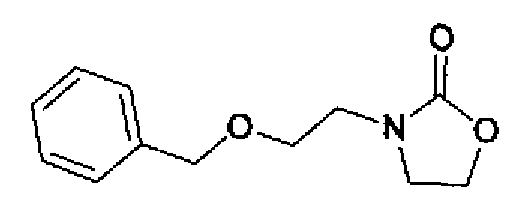
(2) 20% Гидроксид палладия (138 мг) добавляют к раствору 3-(2-бензилоксиэтил)оксазолидин-2-она (278 мг) в метаноле (10 мл) и смесь перемешивают в течение 2 ч при комнатной температуре в атмосфере водорода. Реакционный раствор фильтруют через целит и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=90:10) с получением 3-(2-гидроксиэтил)оксазолидин-2-она (144 мг) в виде бесцветного масла.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 2,29 (1H, ушир.), 3,39-3,47 (2H, м), 3,64-3,77 (2H, м), 3,78-3,89 (2H, м), 4,30-4,43 (2H, м).

(3) Реагент Десса-Мартина (516 мг) добавляют к раствору 3-(2-гидроксиэтил)оксазолидин-2-она (144 мг) в дихлорметане (5,0 мл) и смесь перемешивают в течение 1 ч при комнатной температуре. Растворитель выпаривают с получением неочищенных кристаллов (2-оксооксазолидин-3-ил)ацетальдегида без очистки. К суспензии (2-оксооксазолидин-3-ил)ацетальдегида и соединения 204 (286 мг) в тетрагидрофуране (10 мл) добавляют раствор ацетата аммония (771 мг) в метаноле (5,0 мл) и смесь перемешивают в течение 2 недель при комнатной температуре. Реакционный раствор нейтрализуют насыщенным водным раствора гидрокарбоната натрия и затем дважды экстрагируют этилацетатом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (хлороформ→хлороформ:метанол=95:5) и затем перекристаллизовывают (метанол-этилацетат-гексан) с получением указанного в заголовке соединения (149 мг) в виде бесцветного порошка (т.пл.: 232,0-233,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,34 (3H, c), 3,60-3,68 (2H, м), 4,28-4,36 (2H, м), 4,49 (2H, c), 7,16 (1H, д, J=0,9 Гц), 8,08 (1H, ушир.), 8,14 (1H, д, J=8,4 Гц), 8,83 (1H, ушир.), 9,44 (1H, c), 12,93 (1H, ушир.).
Пример 31
Синтез соединения 138
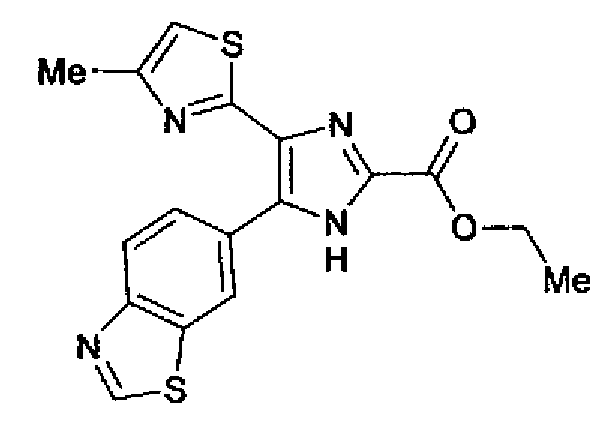
Раствор ацетата аммония (5,35 г) в метаноле (40 мл) добавляют к раствору этилглиоксилата (45% водный раствор, 2,36 г) и соединения 204 (2,0 г) в тетрагидрофуране (60 мл) и смесь перемешивают в течение 12 ч при комнатной температуре. Полученный раствор разбавляют этилацетатом и затем последовательно промывают насыщенным водным раствором гидрокарбоната натрия и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=5:5→3:7→1:9) и затем колоночной хроматографией на NH-силикагеле (хлороформ:метанол=50:1), с последующей перекристаллизацией (этилацетат-гексан) с получением указанного в заголовке соединения (1,01 г) в виде бесцветного порошка (т.пл.: 238,5-239,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,37 (3H, т, J=7,1 Гц), 2,31 (3H, c), 4,40 (2H, кв, J=6,8 Гц), 7,24 (1H, c), 8,03 (1H, д, J=8,7 Гц), 8,14 (1H, д, J=8,5 Гц), 8,74 (1H, c), 9,48 (1H, c), 14,02 (1H, c).
Пример 32
Синтез соединения 82
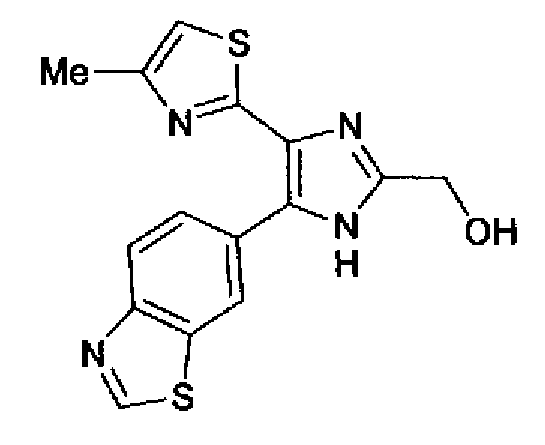
Соединение 138 (700 мг) добавляют к суспензии литийалюминийгидрида (134 мг) в тетрагилдрофуране (30 мл) при -40°С, смесь перемешивают до тех пор, пока температура не достигнет 0°С, и дополнительно перемешивают в течение 30 мин при 0°С. Полученный раствор загружают 2н. водным раствором хлористоводородной кислоты и перемешивают в течение 5 мин. Раствор разбавляют этилацетатом и последовательно промывают насыщенным водным раствором гидрокарбоната натрия и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=20:1→10:1) и перекристаллизовывают (хлороформ-метанол-гексан) с получением указанного в заголовке соединения (309 мг) в виде светло-оранжевого порошка (т.пл.: 222,0-223,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,34 (3H, д, J=0,8 Гц), 4,53 (2H, c), 5,50 (1H, ушир.c), 7,15 (1H, д, J=0,9 Гц), 8,05-8,18 (2H, м), 8,87 (1H, ушир.c), 9,43 (1H, c), 12,80 (1H, ушир.).
Пример 33
Синтез соединения 198
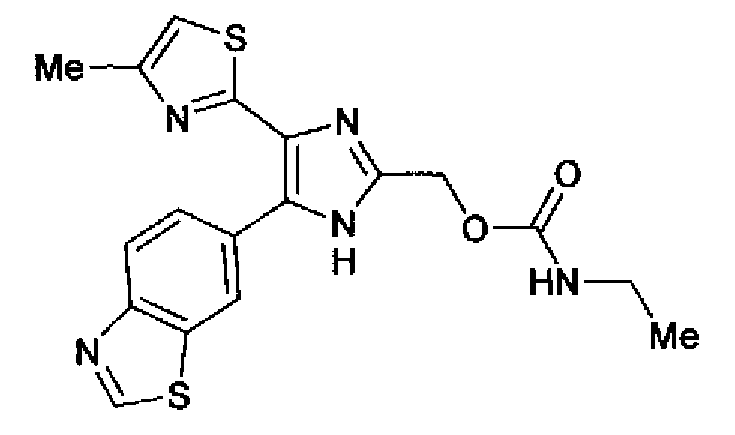
Этилизоцианат (57 мг) добавляют к суспензии соединения 82 (239 мг), хлорида меди (I) (7 мг) и пиридина (1,0 мл) в толуоле (2,0 мл) и смесь перемешивают в течение 2 ч при 50°С. В полученный раствор добавляют воду и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=30:1) и перекристаллизовывают (этилацетат-гексан) с получением указанного в заголовке соединения (151 мг) в виде бесцветного порошка (т.пл.: 144,0-145,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,04 (3H, т, J=7,2 Гц), 2,34 (3H, c), 2,99-3,12 (2H, м), 5,04 (2H, c), 7,18 (1H, д, J=0,8 Гц), 7,34 (1H, ушир.т, J=5,7 Гц), 8,03-8,20 (2H, м), 8,90 (1H, ушир.c), 9,45 (1H, c), 13,06 (1H, ушир.с).
Пример 34
Синтез соединения 81
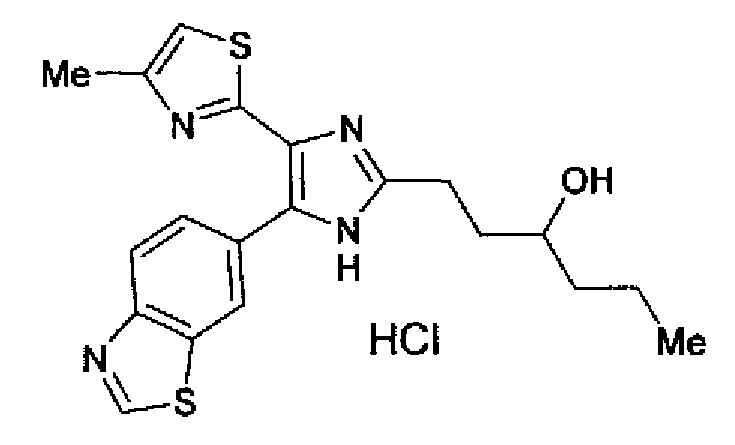
(1) 1,02М раствор диизобутилалюминийгидрида в толуоле (23,4 мл) добавляют по каплям к раствору 5-пропилдигидрофуран-2-она (1,50 г) в толуоле (30 мл) в течение 50 мин при -70°С в атмосфере азота и смесь перемешивают в течение 1 ч при -70°С. Реакционный раствор гасят метанолом (3,0 мл) при -70°С и затем оставляют при комнатной температуре. После добавления 10% водного раствора лимонной кислоты реакционный раствор перемешивают в течение 5 мин. Затем полученный раствор экстрагируют этилацетатом и органический слой промывают рассолом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают и затем остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=90:10→80:20) с получением 5-пропилтетрагидрофуран-2-ола (440 мг) в виде бесцветного масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,9-0,98 (3H, м), 1,29-2,21 (7H, м), 2,45-2,56 (1H, м), 3,94-4,26 (1H, м), 5,41-5,60 (1H, м).
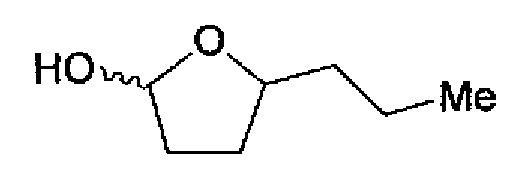
(2) Раствор ацетата аммония (1,98 г) в метаноле (18 мл) добавляют к раствору соединения 204 (741 мг) и 5-пропилтетрагидрофуран-2-ола (435 мг) в тетрагидрофуране (25 мл) и смесь перемешивают в течение 13 ч при комнатной температуре. После разбавления этилацетатом реакционный раствор последовательно промывают водой и рассолом. Органический слой сушат над безводным сульфатом натрия и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат→хлороформ:метанол=40:1). Очищенное вещество растворяют в метаноле, к которому добавляют 4н. раствор хлористый водород/этилацетат. После выпаривания растворителя полученное вещество перекристаллизовывают (метанол-этилацетат) с получением указанного в заголовке соединения (165 мг) в виде бесцветного порошка.
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 0,82-0,96 (3H, м), 1,25-1,49 (4H, м), 1,70-2,09 (2H, м), 2,33-2,48 (3H, м), 2,90-3,29 (2H, м), 3,51 (1H, м), 7,37 (1H, c), 7,84 (1H, дд, J=8,5, 1,8 Гц), 8,29 (1H, д, J=8,5 Гц), 8,61 (1H, д, J=1,7 Гц), 9,58 (1H, c).
Пример 35
Синтез соединения 201
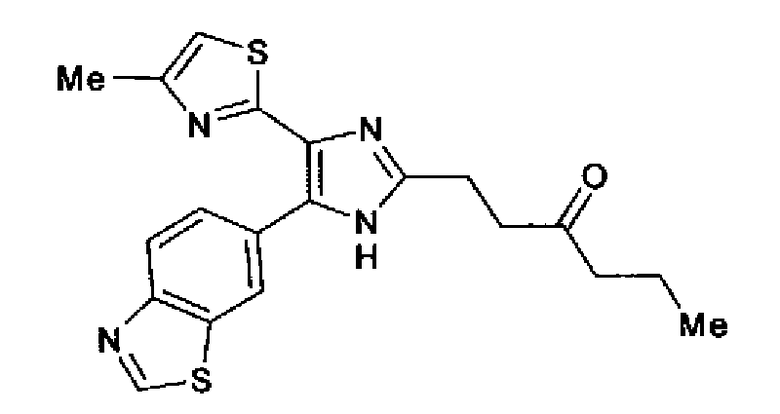
Реагент Десса-Мартина (400 мг) добавляют к раствору свободной формы соединения 81 (342 мг) в дихлорметане (7,0 мл) и смесь перемешивают в течение 2 ч при комнатной температуре. В реакционный раствор добавляют воду и экстрагируют хлороформом. После промывания органического слоя рассолом полученное вещество сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=1:1→3:7→1:9) и затем перекристаллизовывают (этилацетат-гексан) с получением указанного в заголовке соединения (225 мг) в виде бесцветного порошка (т.пл.: 145,0-146,0°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,93 (3H, т, J=7,4 Гц), 1,58-1,71 (2H, м), 2,44 (3H, д, J=0,9 Гц), 2,44-2,50 (2H, м), 2,95-3,11 (4H, м), 6,72 (1H, д, J=0,9 Гц), 7,86 (1H, дд, J=8,5, 1,8 Гц), 8,16 (1H, дд, J=8,5, 0,6 Гц), 8,48 (1H, ушир.), 9,03 (1H, c).
Пример 36
Синтез соединения 73
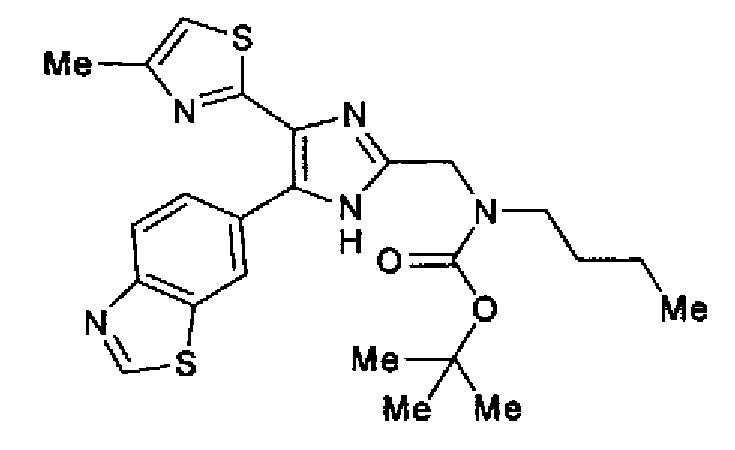
(1) Ди-трет-бутилдикарбонат (5,87 г) добавляют по каплям к раствору 2-бутиламиноэтанола (3,00 г) в хлороформе (30 мл) и смесь перемешивают в течение 15 мин при комнатной температуре. Растворитель выпаривают с получением трет-бутилбутил(2-гидроксиэтил)карбамата (6,10 г) в виде бесцветного масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,93 (3H, т, J=7,3 Гц), 1,22-1,56 (13H, м), 3,22 (2H, т, J=7,3 Гц), 3,38 (2H, т, J=5,1 Гц), 3,69-3,80 (2H, м).
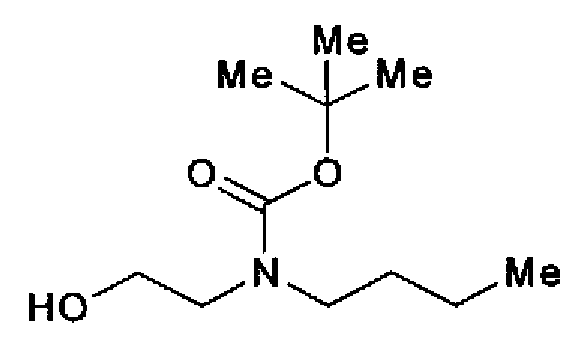
(2) Реагент Десса-Мартина (2,15 г) добавляют к раствору трет-бутилбутил(2-гидроксиэтил)карбамата (1,00 г) в дихлорметане (20 мл) при комнатной температуре и смесь перемешивают в течение 15 мин при комнатной температуре. После выпаривания растворителя остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=80:20→75:25) с получением трет-бутилбутил(2-гидроксиэтил)карбамата (755 мг) в виде бесцветного масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,93 (3H, т, J=7,2 Гц), 1,20-1,55 (13H, м), 3,19-3,36 (2H, м), 3,82 (1H, c), 3,92 (1H, c), 9,58 (1H, c).
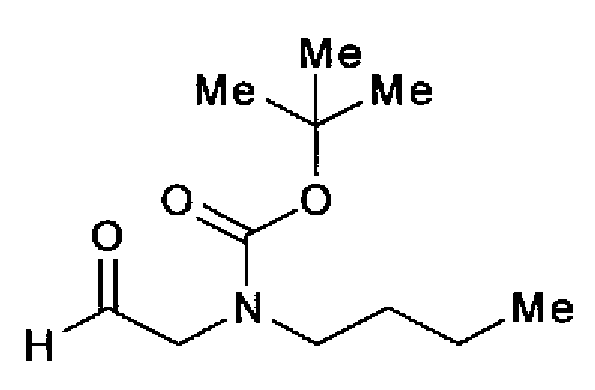
(3) Раствор ацетата аммония (2,00 г) в метаноле (20 мл) добавляют к раствору соединения 204 (750 мг) и трет-бутилбутил(2-оксоэтил)карбамата (728 мг) в тетрагидрофуране (30 мл) и смесь перемешивают в течение 1 ч при комнатной температуре. Реакционный раствор разбавляют этилацетатом и затем последовательно промывают водой и рассолом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=80:20→50:50) с получением указанного в заголовке соединения (865 мг) в виде бесцветного аморфного вещества.
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 0,88 (3H, т, J=7,2 Гц), 1,20-1,59 (13H, м), 2,34 (3H, c), 3,29 (2H, ушир.c), 4,46 (2H, ушир.c), 7,14 (1H, c), 8,02-8,18 (2H, м), 8,86 (1H, ушир.c), 9,43 (1H, c), 12,73 (1H, ушир.с).
Пример 37
Синтез соединения 74
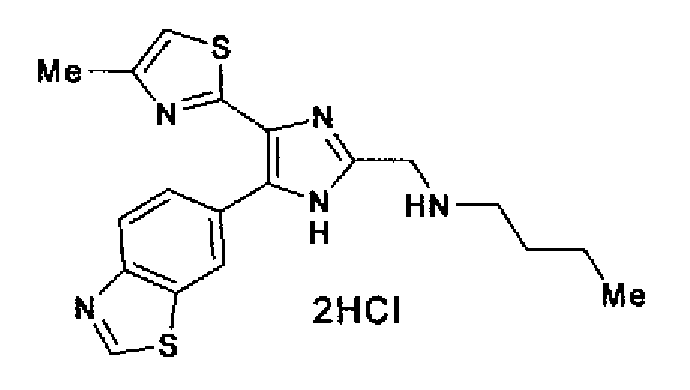
Соединение 73 (875 мг) в 10% растворе хлористого водорода в метаноле (10 мл) перемешивают в течение 4 ч при комнатной температуре. Реакционный раствор перемешивают в течение 30 мин при комнатной температуре после добавления 4н. раствора хлористого водорода в диоксане (1,0 мл). После выпаривания растворителя остаток перекристаллизовывают (метанол-диэтиловый эфир) с получением указанного в заголовке соединения (730 мг) в виде бесцветного порошка.
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 0,91 (3H, т, J=7,4 Гц), 1,31-1,45 (2H, м), 1,62-1,75 (2H, м), 2,38 (3H, д, J=1,1 Гц), 3,00-3,15 (2H, м), 4,32-4,41 (2H, м), 7,25 (1H, д, J=0,9 Гц), 8,12 (1H, дд, J=8,7, 1,8 Гц), 8,19 (1H, дд, J=8,7, 0,6 Гц), 8,94 (1H, д, J=1,2 Гц), 9,49 (1H, c), 9,69 (2H, ушир.с).
Пример 38
Синтез соединения 78
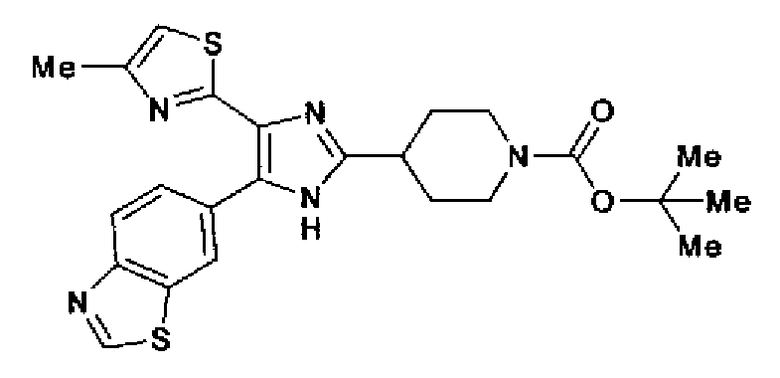
(1) Ди-трет-бутилдикарбонат (4,17 г) добавляют к пиперидин-4-илметанолу (2,00 г) в смешанном растворителе из этилацетата (20 мл) и тетрагидрофурана (10 мл) и смесь перемешивают в течение 22 ч при комнатной температуре. Растворитель выпаривают, в остаток добавляют этилацетат и последовательно промывают насыщенным водным раствором хлорида аммония и рассолом. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают с получением трет-бутил-4-гидроксиметилпиперидин-1-карбоксилата (4,06 г) в виде светло-розового масла.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,02-1,82 (5H, м), 1,46 (9H, c), 2,59-2,81 (2H, м), 3,43-3,59 (2H, м), 4,02-4,23 (2H, м).
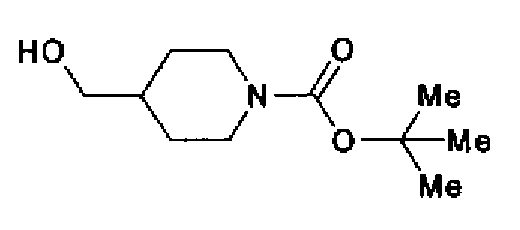
(2) Реагент Десса-Мартина (7,89 г) добавляют к раствору трет-бутил-4-гидроксиметилпиперидин-1-карбоксилата (4,00 г) в дихлорметане (40 мл) и смесь перемешивают в течение 1,5 ч при комнатной температуре. После разбавления этилацетатом реакционный раствор последовательно промывают 1% водным раствором гидроксида натрия и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1→1:1) с получением трет-бутил-4-формилпиперидин-1-карбоксилата (2,43 г) в виде бесцветного масла.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,46 (9H, c), 1,38-1,99 (4H, м), 2,41 (1H, м), 2,83-3,03 (2H, м), 3,87-4,08 (2H, м), 9,66 (1H, c).
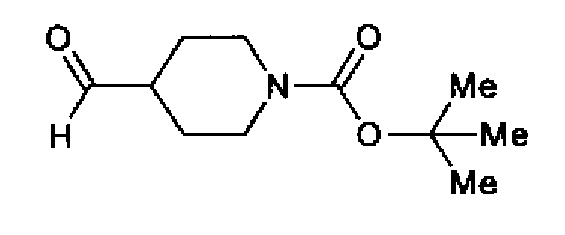
(3) Раствор ацетата аммония (5,35 г) в метаноле (35 мл) добавляют к раствору соединения 204 (2,00 г) и трет-бутил-4-формилпиперидин-1-карбоксилата (2,22 г) в тетрагидрофуране (70 мл) и смесь перемешивают в течение 15 ч при комнатной температуре. После разбавления этилацетатом реакционный раствор последовательно промывают водой и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=50:1→20:1) с получением указанного в заголовке соединения (3,27 г) в виде светло-желтого аморфного вещества.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,47 (9H, c), 1,67-2,17 (4H, м), 2,43 (3H, д, J=0,9 Гц), 2,76-3,09 (3H, м), 4,13-4,33 (2H, м), 6,68 (1H, c), 7,85 (1H, дд, J=8,6, 1,5 Гц), 8,17 (1H, д, J=8,4 Гц), 8,30 (1H, c), 9,02 (1H, c).
Пример 39
Синтез соединения 77
4н. Раствор хлористого водорода в этилацетате (10,4 мл) добавляют к раствору соединения 78 (2,00 г) в метаноле (20 мл) и смесь перемешивают в течение 1 ч при комнатной температуре, затем в течение 1,5 ч при 50°С. После разбавления реакционного раствора хлороформом органический слой промывают насыщенным водным раствором гидрокарбоната натрия. Водный слой насыщают хлоридом натрия и затем экстрагируют хлороформом. Объединенный органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на NH-силикагеле (хлороформ:метанол=50:1→20:1) и затем перекристаллизовывают из этилацетата с получением указанного в заголовке соединения (793 мг) в виде бесцветного порошка (т.пл.: 199,5-200,5°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 1,76-2,17 (4H, м), 2,45 (3H, д, J=0,9 Гц), 2,72-2,85 (2H, м), 3,02 (1H, м), 3,20-3,32 (2H, м), 6,68 (1H, ушир.c), 7,85 (1H, дд, J=8,5, 1,7 Гц), 8,17 (1H, дд, J=8,5, 0,3 Гц), 8,32 (1H, ушир.), 9,03 (1H, c).
Пример 40
Синтез соединения 226
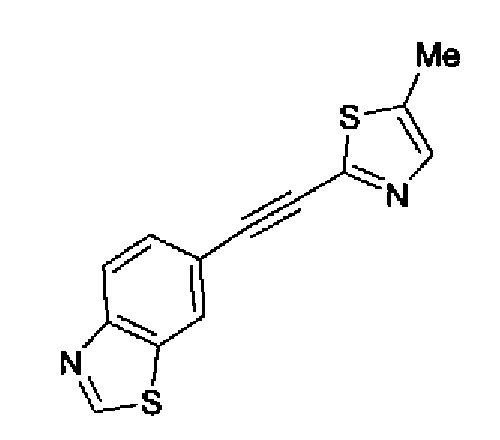
(1) После добавления по каплям трет-бутилнитрита (1,99 г) к суспензии 2-амино-5-метилтиазола (2,00 г) в ацетонитриле (20 мл) при охлаждении льдом к ней постепенно добавляют бромид меди (II) (4,30 г). Полученную суспензию перемешивают в течение 3 ч при 0°С. В реакционный раствор добавляют 1н. хлористоводородную кислоту (100 мл) и затем экстрагируют этилацетатом (200 мл). После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (нейтральная среда; гексан:этилацетат=80:20). с получением 2-бром-5-метилтиазола (1,31 г) в виде желтого масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,44 (3H, д, J=1,2 Гц), 7,25 (1H, д, J=1,1 Гц).
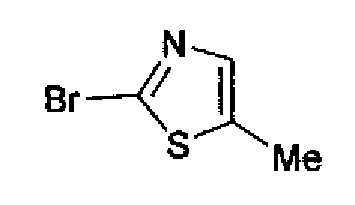
(2) 2,59М раствор н-бутиллития в гексане (2,40 мл) добавляют по каплям к раствору 2-бром-5-метилтиазола (1,00 г) в тетрагидрофуране (10 мл) при -78°С и смесь перемешивают в течение 40 мин при той же температуре. К ней добавляют по каплям раствор иода (1,55 г) в тетрагидрофуране (5 мл) при -78°С и смесь перемешивают в течение 30 мин при той же температуре. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония (20 мл), чтобы погасить реакцию, и полученный раствор оставляют при комнатной температуре. В полученный раствор добавляют воду (20 мл) и дважды экстрагируют этилацетатом (100 мл). Органический слой промывают насыщенным водным раствором тиосульфата натрия (50 мл) и затем сушат над безводным сульфатом магния. После выпаривания растворителя остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=85:15) с получением 2-иод-5-метилтиазола (764 мг) в виде коричневого масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: (300 МГц, CDCl3) δ м.д.: 2,47 (3H, д, J=1,2 Гц), 7,26 (1H, д, J=1,2 Гц).
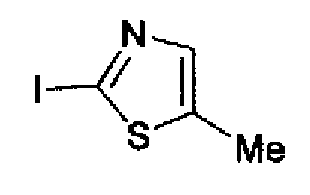
(3) К раствору 6-этинилбензотиазола (483 мг), синтезированного в примере 17-(2), и 2-иод-5-метилтиазола (740 мг) в ацетонитриле (10 мл), добавляют триэтиламин (15 мл) и тетракис(трифенилфосфин)палладий (179 мг) в атмосфере азота. Полученный раствор нагревают при кипячении с обратным холодильником в течение 6 ч в атмосфере азота. После выпаривания растворителя остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=85:15→50:50) с получением указанного в заголовке соединения (601 мг) в виде желтого порошка. (т.пл.: 137,0-140,0°С).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 2,53 (3H, д, J=1,1 Гц), 7,53 (1H, д, J=1,1 Гц), 7,71 (1H, дд, J=8,5, 1,6 Гц), 8,13 (1H, дд, J=8,5, 0,6 Гц), 8,20 (1H, дд, J=1,6, 0,5 Гц), 9,07 (1H, c).
Пример 41
Синтез соединения 227
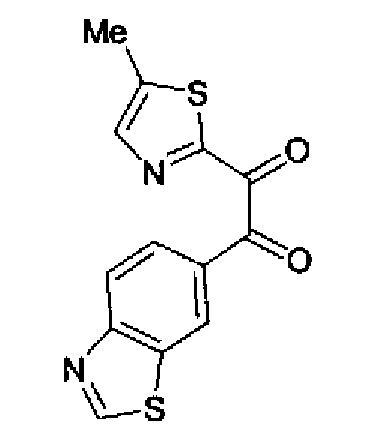
Перманганат калия (733 мг) добавляют к соединению 226 (593 мг) в смешанном растворе ацетон (45,7 мл)-буфер* (25,5 мл) и смесь перемешивают в течение 30 мин при комнатной температуре. Реакционный раствор охлаждают на льду и после медленного добавления к нему нитрита натрия (297 мг) по каплям добавляют 10% серную кислоту (3,0 мл). После перемешивания раствора в течение 15 мин при охлаждении на льду к реакционному раствору добавляют хлороформ (100 мл) и воду (30 мл) и затем полученный раствор фильтруют через целит. Фильтрат отделяют и водный слой экстрагируют снова хлороформом (100 мл). Объединенный органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают дважды колоночной хроматографией на силикагеле (нейтральная; гексан:этилацетат=65:35→45:55), (нейтральная; гексан:этилацетат=5:95) с получением указанного в заголовке соединения (429 мг) в виде желтого порошка (т.пл.: 154,0-155,0˚С).
Буфер*: Гидрокарбонат натрия (6,8 г) и безводный сульфат магния (68,0 г), растворенные в воде (3,0 л).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,65 (3H, д, J=1,1 Гц), 7,78 (1H, д, J=1,1 Гц), 8,15 (1H, дд, J=8,5, 1,7 Гц), 8,24 (1H, дд, J=8,5, 0,6 Гц), 8,63 (1H, дд, J=1,7, 0,6 Гц), 9,22 (1H, c).
Пример 42
Синтез соединения 228
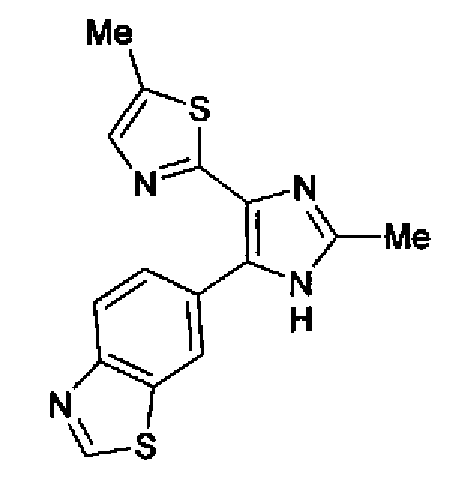
Ацетальдегид (0,15 мл) и раствор ацетата аммония (900 мг) в метаноле (10 мл) добавляют к раствору соединения 227 (414 мг) в тетрагидрофуране (10 мл) и смесь перемешивают в течение 13 ч при комнатной температуре. Реакционный раствор, к которому добавляют насыщенный водный раствор гидрокарбоната натрия (70 мл) для нейтрализации, дважды экстрагируют этилацетатом (150 мл). Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат→хлороформ:метанол=90:10) и затем перекристаллизовывают (н-гексан-этиилацетат) с получением указанного в заголовке соединения (230 мг) в виде бесцветного порошка (т.пл.: 210,0-211,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,37 (3H, c), 2,42 (3H, c), 7,44 (1H, ушир.c), 8,09-8,15 (2H, м), 8,78 (1H, ушир.), 9,42 (1H, c), 12,53 (1H, ушир.).
Пример 43
Синтез соединения 239
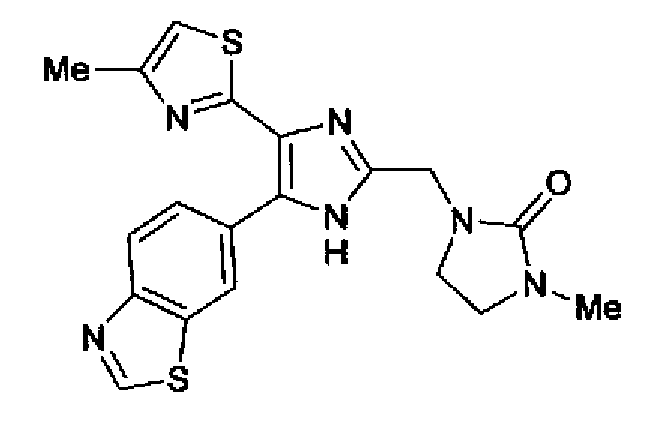
(1) Имидазол (9,63 г) и хлор-трет-бутилдиметилсилан (9,77 г) добавляют к раствору 1-(2-гидроксиэтил)-2-имидазолидинона (7,67 г) в N,N-диметилформамиде (75 мл) и смесь перемешивают в течение 2 ч при комнатной температуре. В реакционный раствор добавляют воду, разбавляют этилацетатом и затем органический слой промывают рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=35:65→0:100) с получением 1-[2-(трет-бутилдиметилсиланилокси)этил]имидазолидин-2-она (8,73 г) в виде бесцветного твердого вещества (т.пл.: 53,5-57,0°С).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 0,06 (6H, c), 0,89 (9H, c), 3,30 (2H, т, J=5,3 Гц), 3,34-3,46 (2H, м), 3,54-3,65 (2H, м), 3,74 (2H, т, J=5,3 Гц).
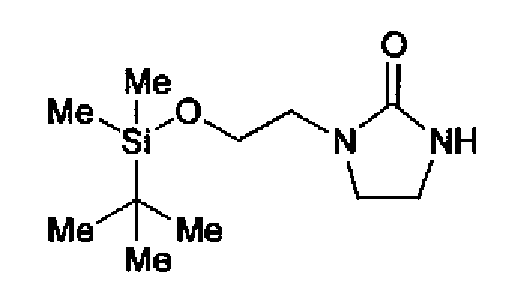
(2) Гидрид натрия (393 мг) дважды промывают гексаном и затем добавляют тетрагидрофуран (10 мл). Сосуд охлаждают на ледяной бане и в него по каплям добавляют 1-[2-(трет-бутилдиметилсиланилокси)этил]имидазолидин-2-он (2,00 г) в тетрагидрофуране (10 мл), поддерживая температуру внутри сосуда ниже 10°С. После перемешивания полученного раствора в течение 15 мин к нему по каплям добавляют иодметан (766 мкл) при той же температуре и смесь перемешивают в течение 20 мин при комнатной температуре. К ней добавляют воду, чтобы погасить реакцию, и полученный раствор разбавляют этилацетатом. Полученную смесь последовательно промывают 2н. хлористоводородной кислотой, насыщенным водным раствором гидрокарбоната натрия и рассолом. Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=35:65→0:100, хлороформ:метанол=4:1) с получением смеси маслянистых веществ (*). Все водные слои объединяют и концентрируют, полученный остаток суспендируют в смеси хлороформ-метанол и затем смесь фильтруют. После сушки полученного вещества над безводным сульфатом магния растворитель выпаривают. Остаток и ранее полученную смесь масел (*) очищают колоночной хроматографией на силикагеле (хлороформ:метанол=9:1) с получением 1-(2-гидроксиэтил)-3-метилимидазолидин-2-она (907 мг) в виде светло-желтого масла.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 2,80 (3H, c), 3,29-3,45 (6H, м), 3,74-3,79 (2H, м).

(3) Реагент Десса-Мартина (1,094 г) добавляют к раствору 1-(2-гидроксиэтил)-3-метилимидазолидин-2-она (372 мг) в хлороформе (10 мл) и смесь перемешивают в течение 1,5 ч при комнатной температуре. Реакционный раствор, к которому добавляют метанол (10 мл), соединение 204 (400 мг) и ацетат аммония (856 мг), перемешивают в течение 2,5 ч при комнатной температуре. После разбавления реакционного раствора хлороформом полученный раствор промывают насыщенным водным раствором гидрокарбоната натрия. После сушки органического слоя над безводным сульфатом магния растворитель выпаривают. Остаток очищают 3 раза колоночной хроматографией на силикагеле (хлороформ:метанол=20:1→15:1), (хлороформ:ацетон=2:1→1:1) и колоночной хроматографией на силикагеле типа NH (хлороформ) и перекристаллизовывают (этилацетат-диэтиловый эфир) с получением указанного в заголовке соединения (27 мг) в виде бесцветного порошка (т.пл.: 232,0-233,5°С).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 2,45 (3H, д, J=0,9 Гц), 2,83 (3H, c), 3,30-3,54 (4H, м), 4,47 (2H, c), 6,75 (1H, c), 7,89 (1H, дд, J=8,6, 1,5 Гц), 8,12-8,21 (1H, м), 9,03 (1H, c).
Пример 44
Синтез соединения 240
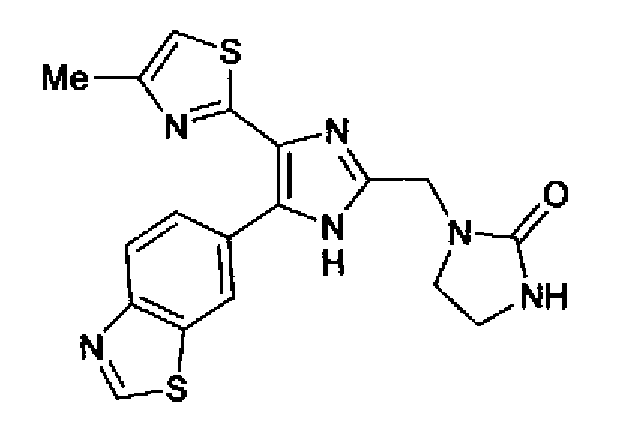
(1) Гидрид натрия (393 мг) дважды промывают гексаном и затем к нему добавляют тетрагидрофуран (10 мл). Сосуд охлаждают на ледяной бане и в него по каплям добавляют раствор соединения, синтезированного в примере 43-(1) (2,00 г) в тетрагидрофуране (10 мл), поддерживая температуру внутри сосуда ниже 10°С. После перемешивания полученного раствора в течение 5 мин к нему по каплям добавляют ди-трет-бутилдикарбонат (2,31 г) в тетрагидрофуране (10 мл) при той же температуре и смесь перемешивают в течение 2 ч при комнатной температуре и затем в течение 18 ч при 50°С. К реакционной смеси последовательно добавляют насыщенный водный раствор хлорида аммония и этилацетат и после промывания органического слоя рассолом и сушки над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1) с получением трет-бутил-3-[2-(трет-бутилдиметилсиланилокси)этил]-2-оксоимидазолидин-1-карбоксилата (1,54 г) в виде бесцветного порошка (т.пл.: 35,5-45,5°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 0,05 (6H, c), 0,89 (9H, c), 1,53 (9H, c), 3,35 (2H, т, J=5,2 Гц), 3,48-3,55 (2H, м), 3,71-3,79 (4H, м).
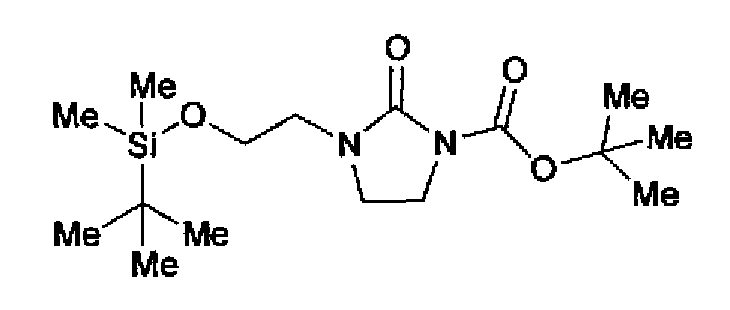
(2) 1,0М раствор фторида тетра-н-бутиламмония в тетрагидрофуране (4,35 мл) добавляют к раствору трет-бутил-3-[2-(трет-бутилдиметилсиланилокси)этил]-2-оксоимидазолидин-1-карбоксилата (1,50 г) в тетрагидрофуране (15 мл) и смесь перемешивают в течение 1 ч при комнатной температуре. К реакционному раствору добавляют метанол (1 мл) и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=20:1→10:1) с получением трет-бутил-3-(2-гидроксиэтил)-2-оксоимидазолидин-1-карбоксилата (940 мг) в виде бесцветного масла.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,39-1,58 (9H, м), 3,27-3,86 (8H, м).
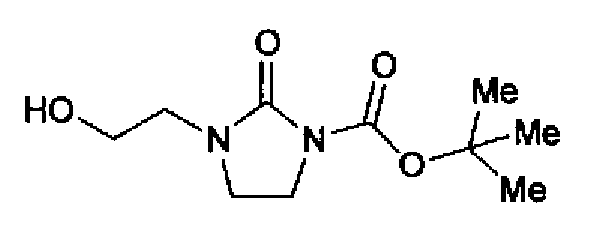
(3) Реагент Десса-Мартина (1,47 г) добавляют к раствору трет-бутил-3-(2-гидроксиэтил)-2-оксоимидазолидин-1-карбоксилата (800 мг) в хлороформе (8 мл) и смесь перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь разбавляют этилацетатом, фильтруют через целит и из фильтрата выпаривают растворитель. Остаток, к которому добавляют тетрагидрофуран (30 мл), метанол (15 мл), соединение 204 (1,0 г) и ацетат аммония (2,14 г), перемешивают в течение 16 ч при комнатной температуре. После разбавления реакционного раствора хлороформом полученный раствор промывают насыщенным водным раствором гидрокарбоната натрия. Водный слой экстрагируют хлороформом. После объединения органических слоев вместе и сушки над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=40:1→20:1) с получением трет-бутил-3-[5-бензотиазол-6-ил-4-(4-метилтиазол-2-ил)-1Н-имидазол-2-илметил]-2-оксоимидазолидин-1-карбоксилата (983 мг) в виде светло-желтого аморфного вещества.
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 1,49 (9H, c), 2,44 (3H, д, J=0,9 Гц), 3,50-3,58 (2H, м), 3,76-3,84 (2H, м), 4,58 (2H, c), 6,76 (1H, c), 7,88-7,96 (1H, м), 8,14 (1H, д, J=8,7 Гц), 9,03 (1H, c).
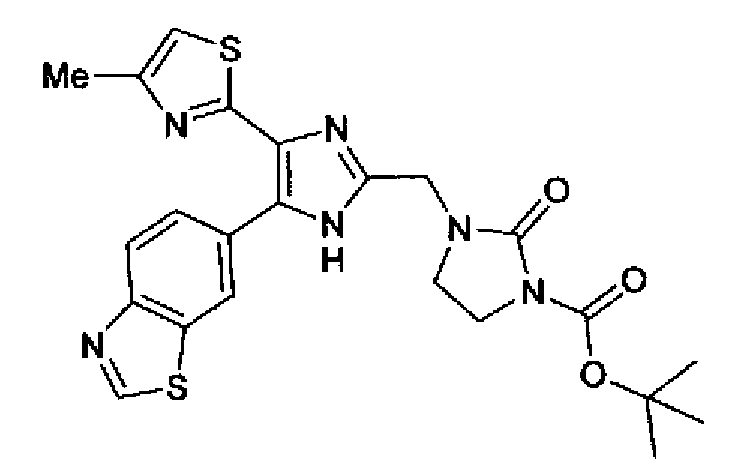
(4) 4н. раствор хлористого водорода в этилацетате (4,03 мл) добавляют к раствору трет-бутил-3-[5-бензотиазол-6-ил-4-(4-метилтиазол-2-ил)-1Н-имидазол-2-илметил]-2-оксоимидазолидин-1-карбоксилата (800 мг) в метаноле (8 мл) и смесь перемешивают в течение 18 ч при комнатной температуре. После разбавления реакционного раствора хлороформом полученный раствор промывают насыщенным водным раствором гидрокарбоната натрия. Водный слой экстрагируют хлороформом. После объединения органических слоев вместе и сушки над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=20:1→10:1) и перекристаллизовывают (хлороформ-этилацетат) с получением указанного в заголовке соединения (393 мг) в виде бесцветного порошка (т.пл.: 236,0-237,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,34 (3H, c), 3,23-3,32 (2H, м), 3,40-3,48 (2H, м), 4,35 (2H, c), 6,53 (1H, c), 7,16 (1H, д, J=0,9 Гц), 8,10-8,17 (2H, м), 8,86 (1H, ушир.c), 9,44 (1H, c), 12,83 (1H, ушир.с).
Пример 45
Синтез соединения 242
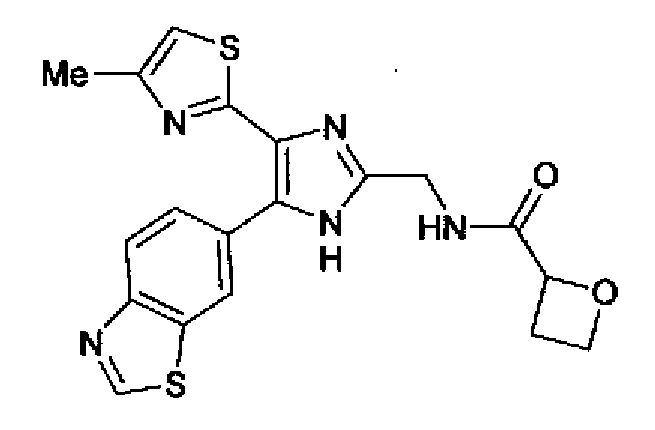
(1) Серную кислоту (2,86 мл) и воду (6 мл) последовательно добавляют к раствору оксида хрома (VI) в воде (3 мл) при охлаждении льдом. Полученный раствор по каплям добавляют к раствору 2-гидроксиметилоксетана (1,00 г) в ацетоне (22 мл) при охлаждении льдом при поддержании внутренней температуры ниже 20°С и смесь перемешивают в течение 2 ч при комнатной температуре. К ней добавляют 2-пропанол, чтобы погасить реакцию, полученный раствор разбавляют этилацетатом и фильтруют через целит. Фильтрат промывают рассолом и водный слой экстрагируют этилацетатом. После объединения органических слоев вместе и сушки над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (нейтральная; хлороформ:метанол=9:1→4:1) с получением оксетан-2-карбоновой кислоты (83 мг) в виде светло-желтого масла.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 2,70-2,90 (1H, м), 3,01-3,21 (1H, м), 4,68-4,87 (2H, м), 5,19 (1H, дд, J=9,2, 6,6 Гц).
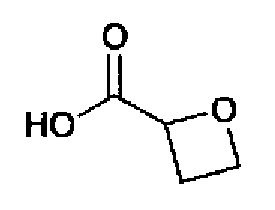
(2) Гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (167 мг) добавляют к раствору соединения 70 (301 мг), оксетан-2-карбоновой кислоты (74 мг) и моногидрата 1-гидроксибензотриазола (118 мг) в N,N-диметилформамиде (1,5 мл) и смесь перемешивают в течение 3 ч при комнатной температуре. После разбавления реакционной смеси хлороформом полученную смесь промывают насыщенным водным раствором гидрокарбоната натрия. Водный слой экстрагируют дважды хлороформом. После объединения органических слоев и сушки над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=30:1→15:1) и перекристаллизовывают (хлороформ-этилацетат) с получением указанного в заголовке соединения (265 мг) в виде бесцветного порошка (т.пл.: 224,5-226,5°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,34 (3H, c), 2,52-2,63 (1H, м), 2,86-3,00 (1H, м), 4,38-4,67 (4H, м), 4,99 (1H, дд, J=9,0, 6,5 Гц), 7,15 (1H, д, J=0,9 Гц), 8,03-8,17 (2H, м), 8,52 (1H, т, J=5,8 Гц), 8,87 (1H, c), 9,44 (1H, c), 12,72 (1H, c).
Соединения, перечисленные в таблице 1, получают, применяя методики примеров 1-48, используя соответствующие вещества.
Пример 46
Синтез соединения 250
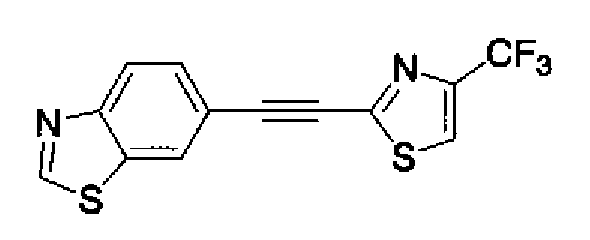
(1) трет-Бутилнитрит (679 мг) добавляют по каплям к раствору 2-амино-4-трифторметилтиазола (1,00 г) в ацетонитриле (10 мл) при охлаждении льдом и затем постепенно добавляют иодид меди (I) (1,25 г). Реакционную смесь перемешивают в течение 2 ч при 0°С, затем загружают 1н. хлористоводородной кислотой (100 мл) и экстрагируют дважды этилацетатом (100 мл). Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=80:20) с получением 2-иод-4-трифторметилтиазола (747 мг) в виде коричневого твердого вещества (т.пл.: 35,5-36,0°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 7,75 (1H, кв, J=0,9 Гц).
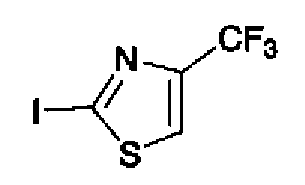
(2) К раствору 6-этинилбензотиазола (402 мг), синтезированного в примере 17-(2), и 2-иод-4-трифторметилтиазола (708 мг) в ацетонитриле (8 мл) добавляют триэтиламин (12,5 мл) и тетракис(трифенилфосфин)палладий (151 мг) в атмосфере азота и затем нагревают при кипении с обратным холодильником в течение 3 ч в атмосфере азота. После выпаривания растворителя остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=85:15→70:30) с получением указанного в заголовке соединения (573 мг) в виде желтого порошка (т.пл.: 153,0-154,0°С).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 7,74 (1H, дд, J=8,5, 1,6 Гц), 7,81 (1H, кв, J=0,9 Гц), 8,16 (1H, дд, J=8,5, 0,6 Гц), 8,24 (1H, дд, J=1,7, 0,6 Гц), 9,11 (1H, c).
Пример 47
Синтез соединения 251
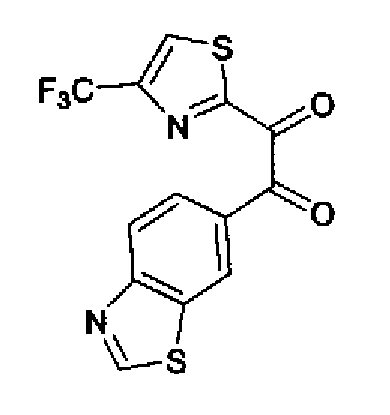
Перманганат калия (572 мг) добавляют к соединению 250 (562 мг) в смешанном растворе ацетон (35,9 мл)-буфер* (20,0 л) и смесь перемешивают в течение 30 мин при комнатной температуре. Реакционную смесь охлаждают на льду и после медленного добавления к нему нитрита натрия (234 мг) по каплям добавляют 10% серную кислоту (2,4 мл). После перемешивания полученного раствора в течение 15 мин при охлаждении на льду к реакционному раствору добавляют хлороформ (100 мл) и воду (30 мл) и затем полученный раствор фильтруют через целит. Фильтрат отделяют и водный слой снова экстрагируют хлороформом (100 мл). Объединенный органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (нейтральная; гексан:этилацетат=50:50) с получением указанного в заголовке соединения (113 мг) в виде желтого порошка (т.пл.: 163,5-16,5°С).
Буфер*: Гидрокарбонат натрия (6,8 г) и безводный сульфат магния (68,0 г), растворенные в воде (3,0 л).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 8,14-8,32 (3H, м), 8,69 (1H, м), 9,27 (1H, c).
Пример 48
Синтез соединения 244
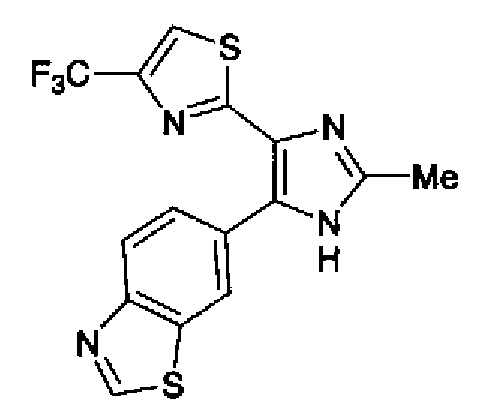
Ацетальдегид (0,15 мл) и раствор ацетата аммония (194 мг) в метаноле (3 мл) добавляют к раствору соединения 251 (107 мг) в тетрагидрофуране (5 мл) и смесь перемешивают в течение 3,5 ч при комнатной температуре. Реакционную смесь нейтрализуют добавлением насыщенного водного раствора гидрокарбоната натрия (50 мл) и дважды экстрагируют этилацетатом (100 мл). Органический слой сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=30:70→1:99) и затем перекристаллизовывают (н-гексан-этиилацетат) с получением указанного в заголовке соединения (25 мг) в виде бесцветного порошка. (т.пл.: 190,5-192,0°С).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 2,40 (3H, c), 8,03 (1H, дд, J=8,6, 1,5 Гц), 8,15 (1H, д, J=8,6 Гц), 8,34 (1H, c), 8,89 (1H, ушир.c), 9,45 (1H, c), 12,78 (1H, ушир.).
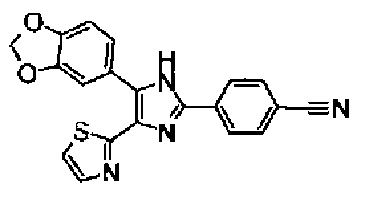
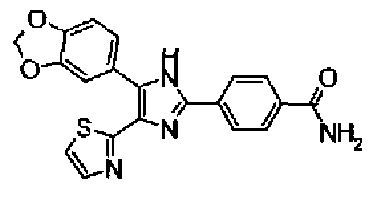

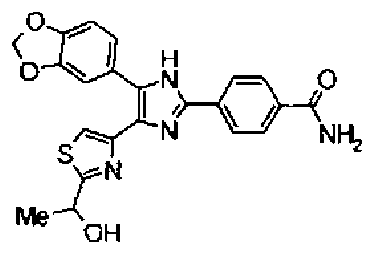
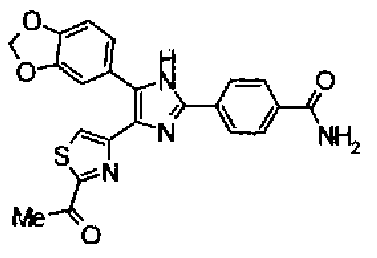
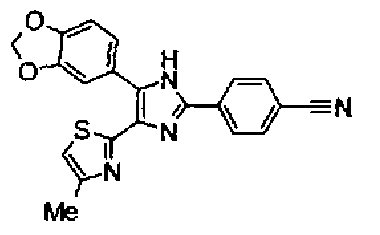
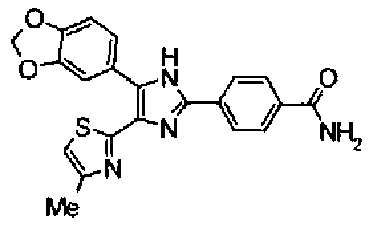
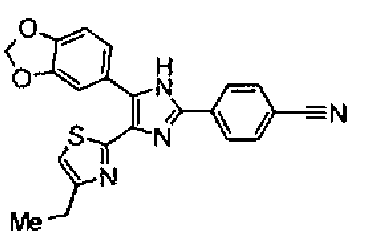
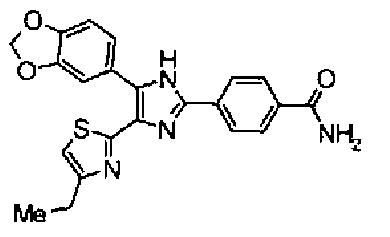
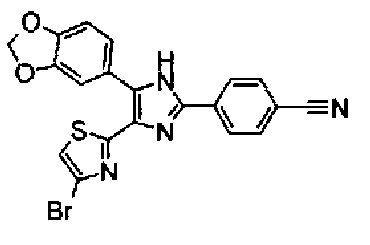
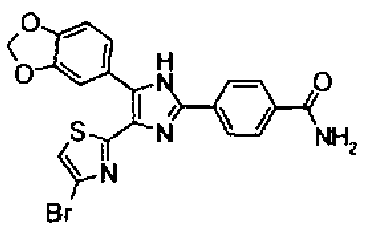
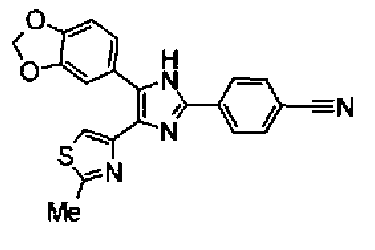
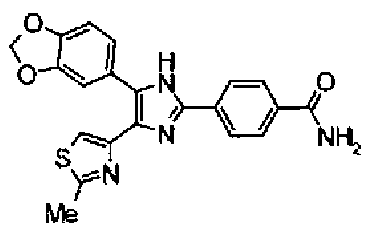
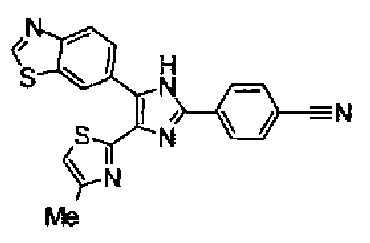
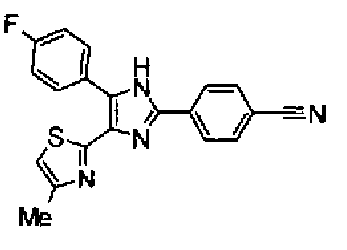
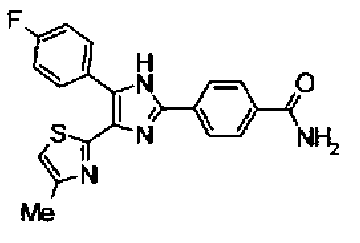
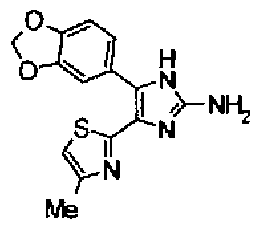
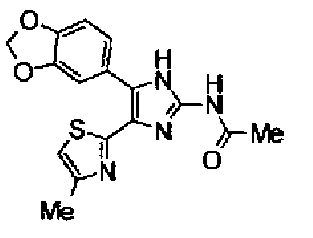
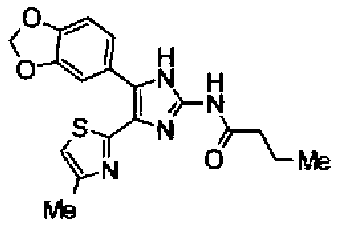
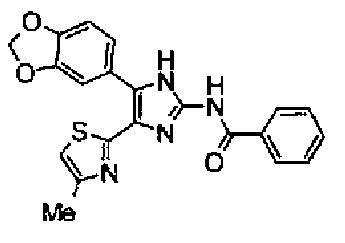
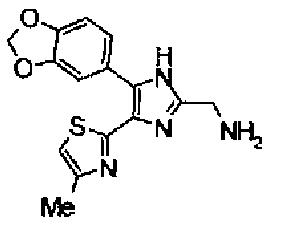
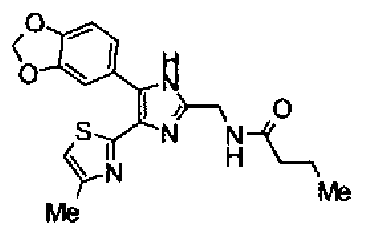
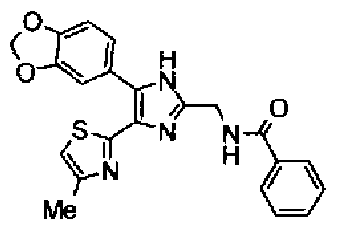
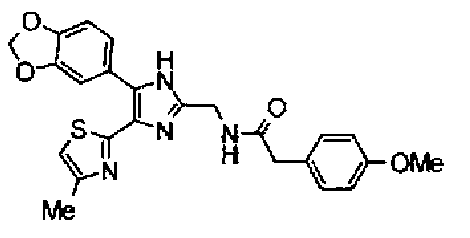
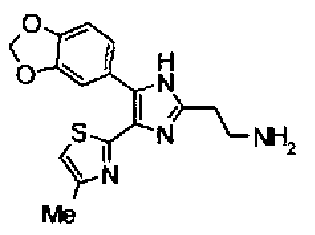
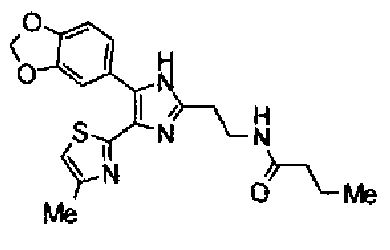
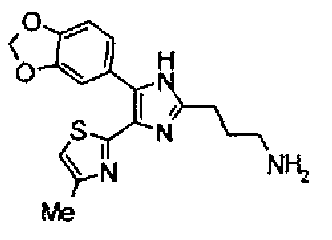
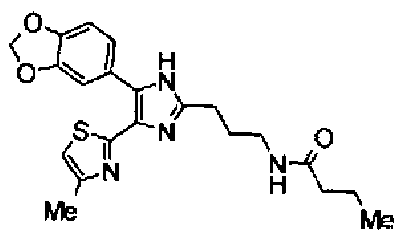
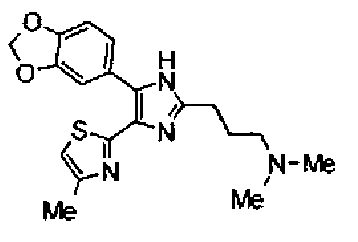
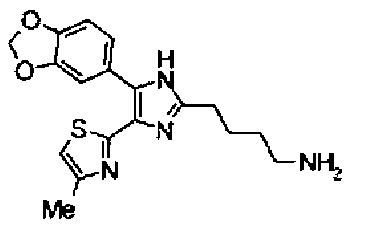
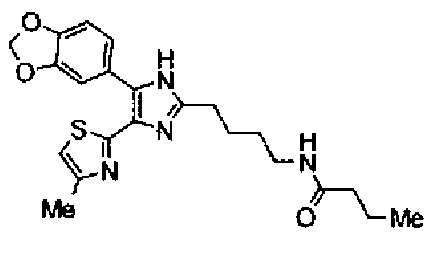
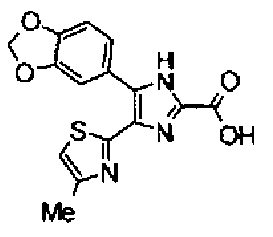
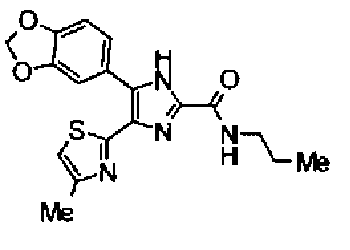
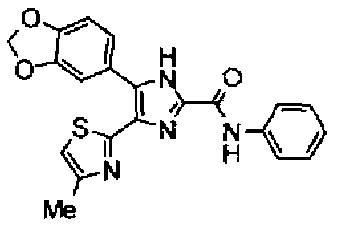
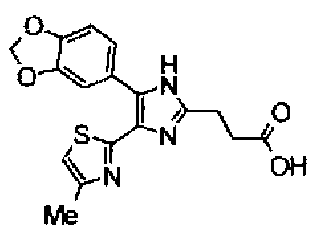
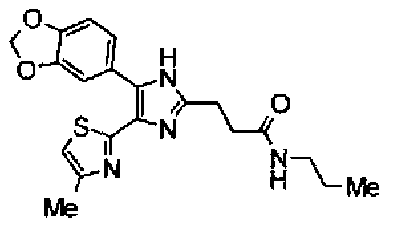
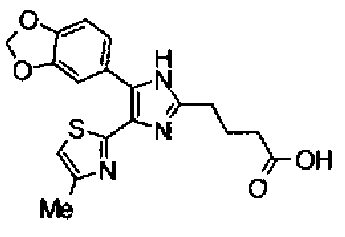
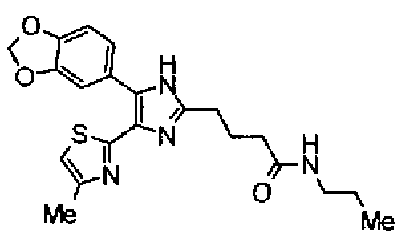
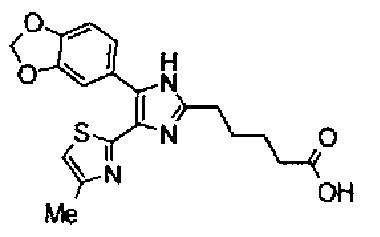
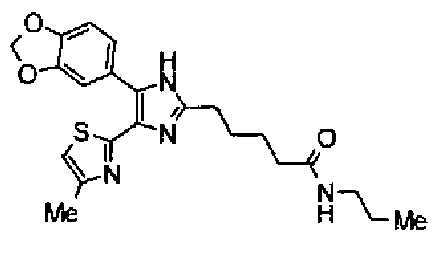
6,1 Гц), 5,76 (1H, ушир.c), 6,00 (2H, c), 6,71 (1H, д, J=0,9 Гц), 6,86 (1H, д, J=8,1 Гц), 7,33 (1H, ушир.д, J=8,1 Гц), 7,43(1H, ушир.с)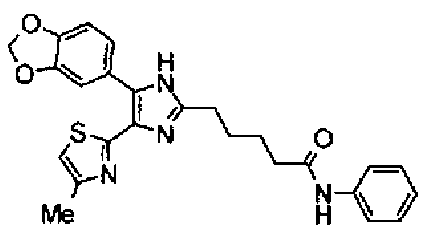
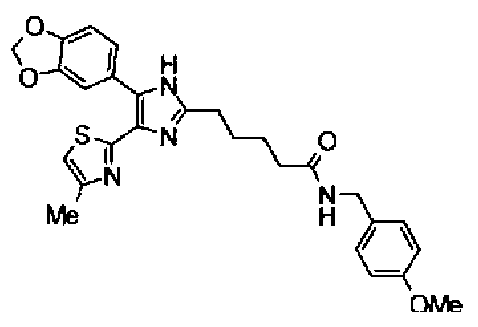
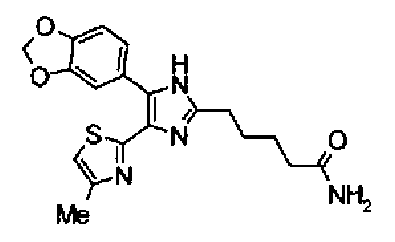
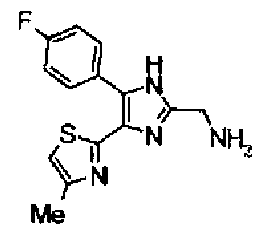
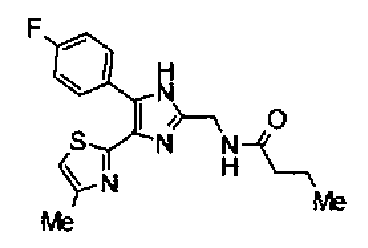
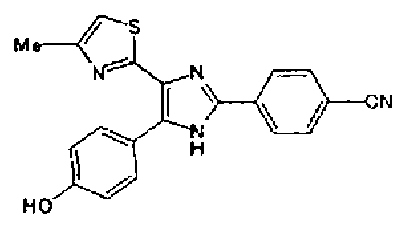
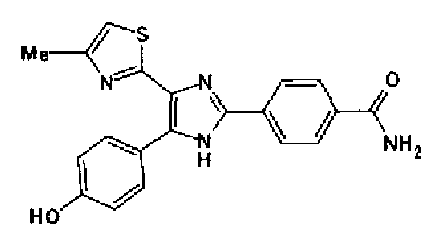
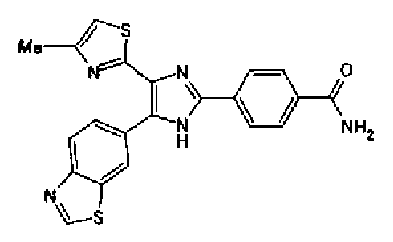
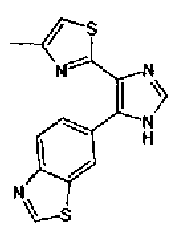
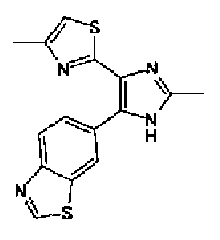

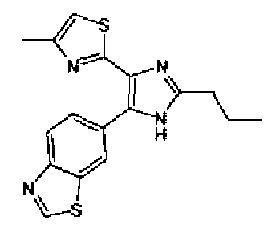
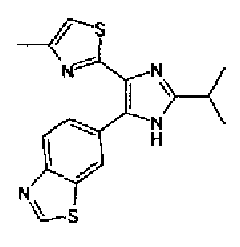
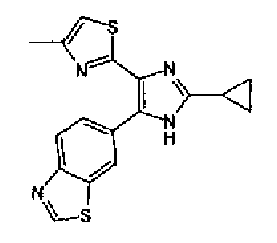
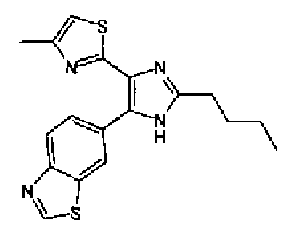
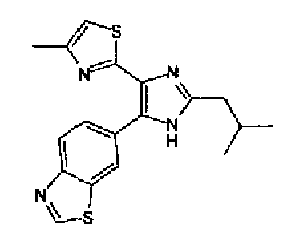
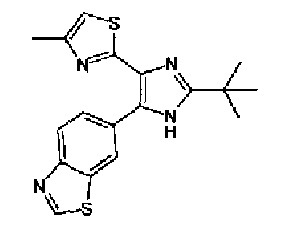
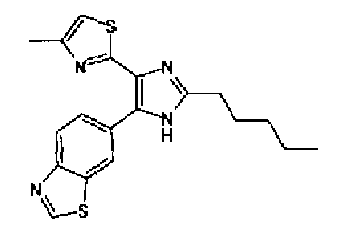
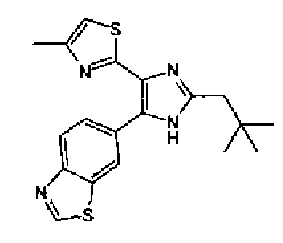
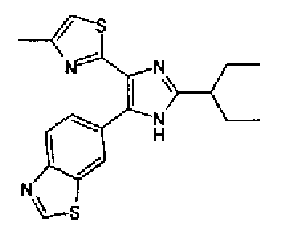
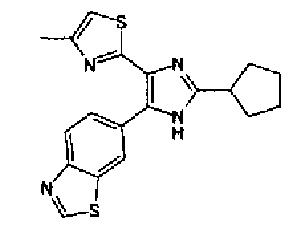
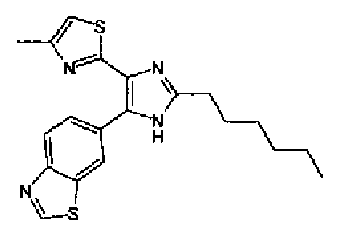
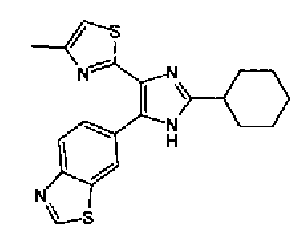
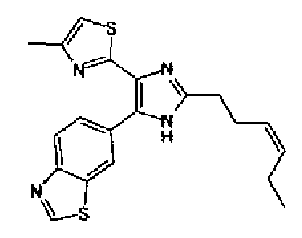
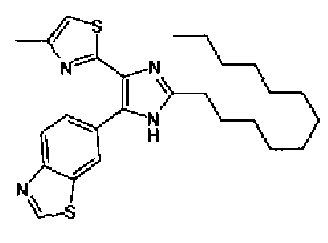
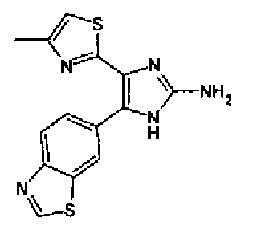
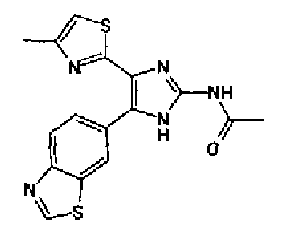
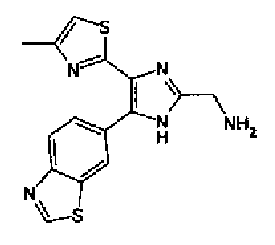
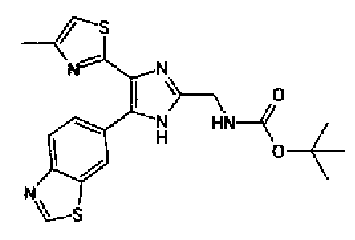
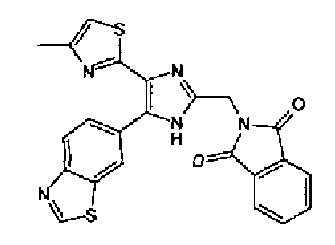
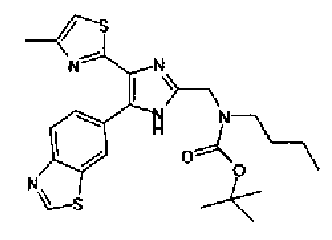
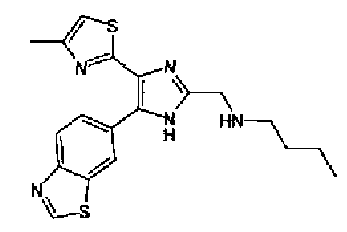
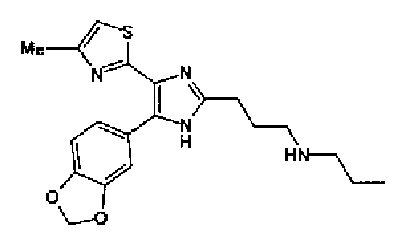
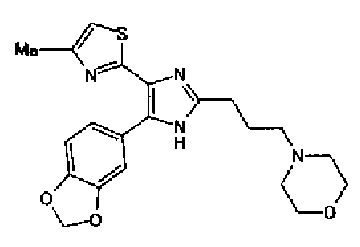
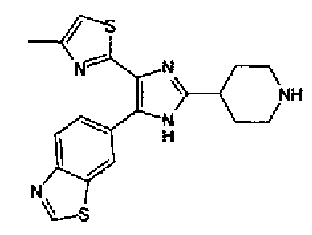
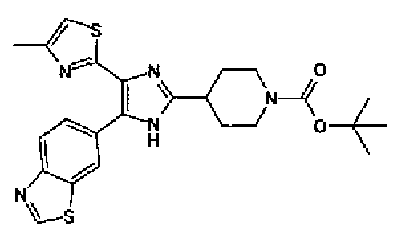
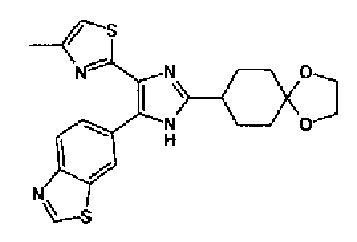

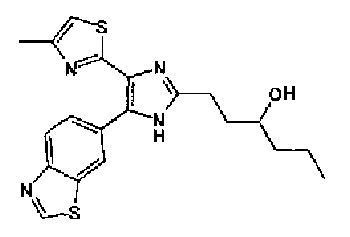
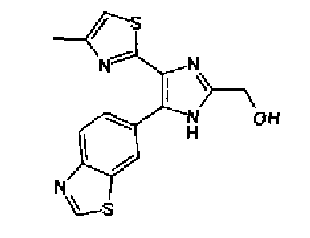
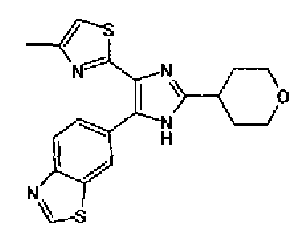
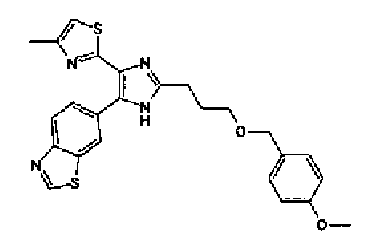
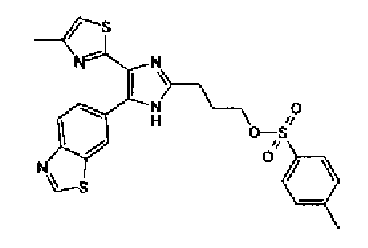
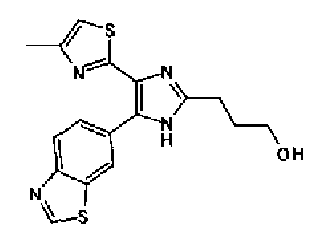
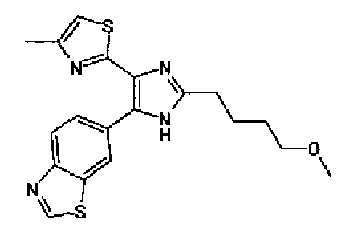
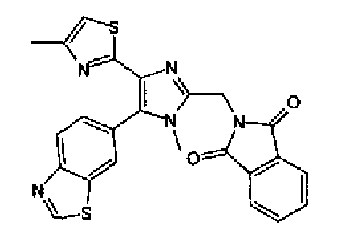
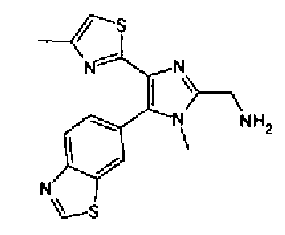
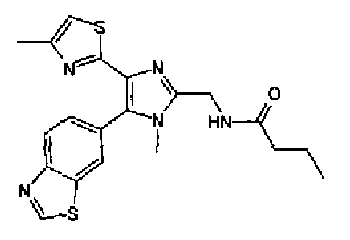
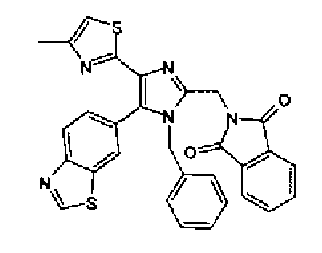
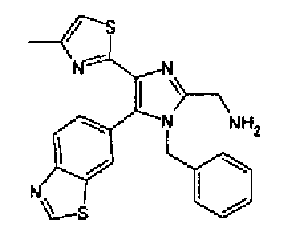
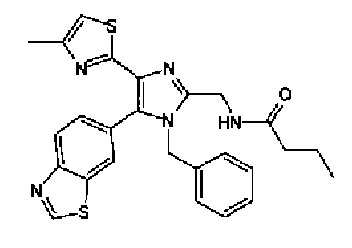
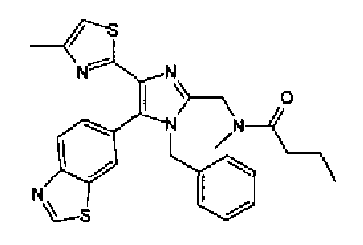
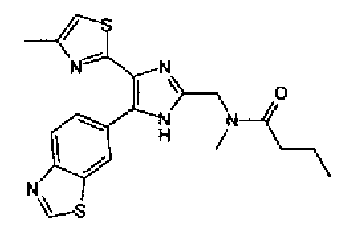
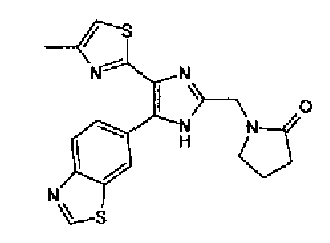
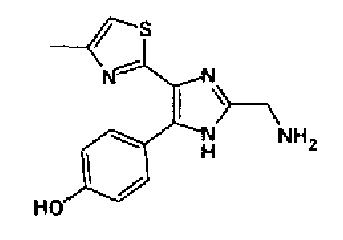
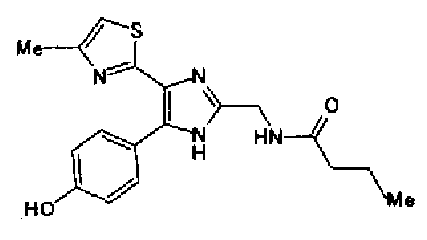
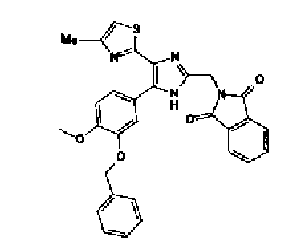
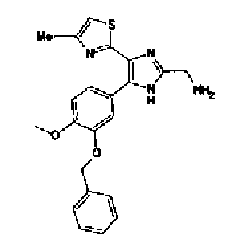
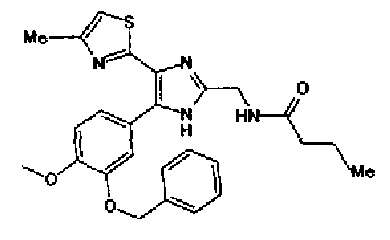
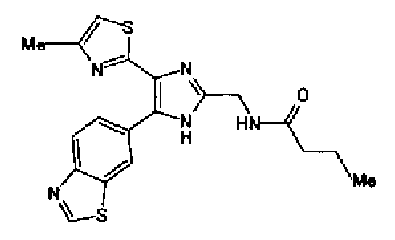
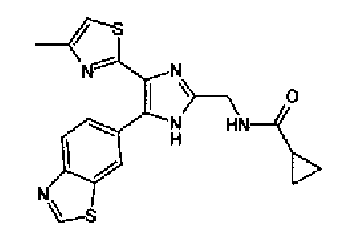
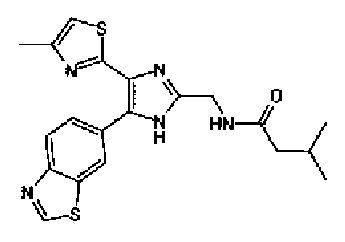
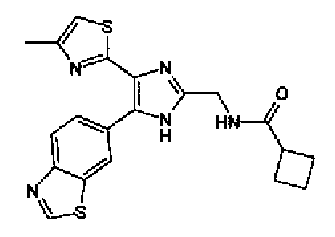
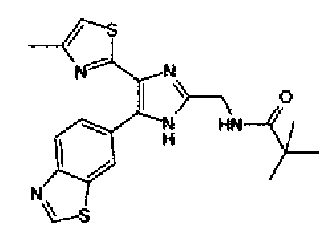
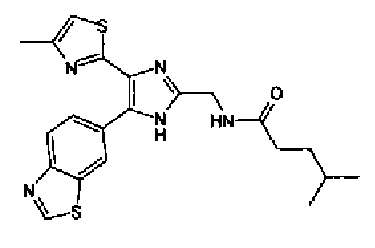

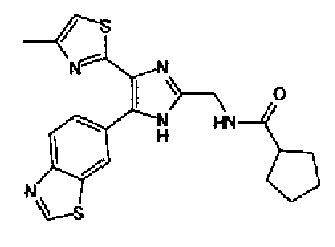
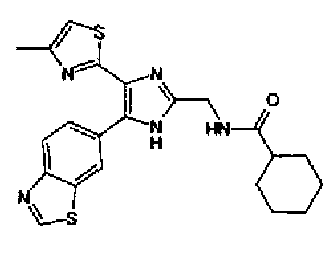
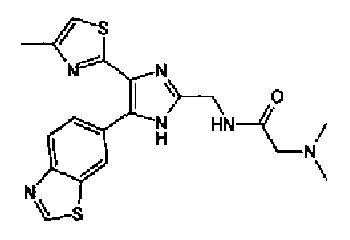
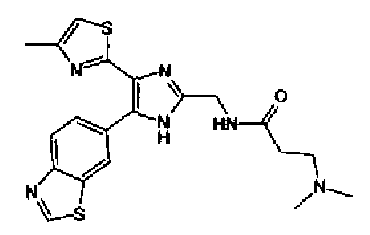
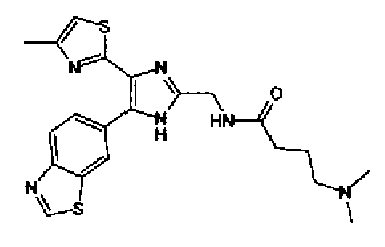
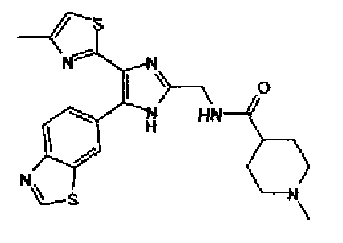
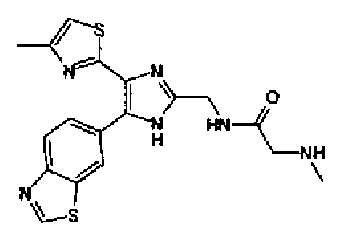
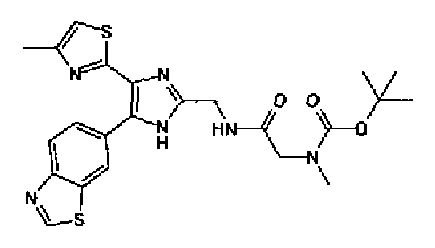
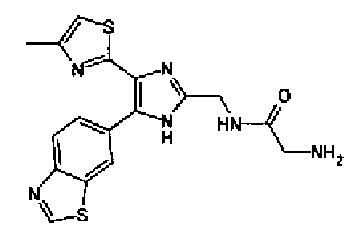
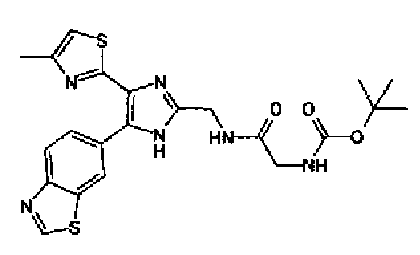

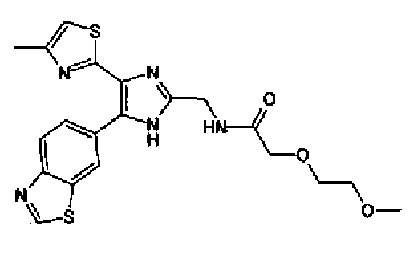
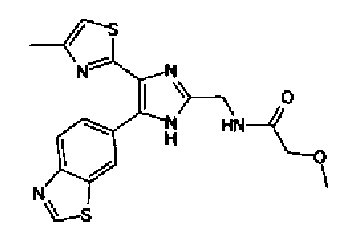
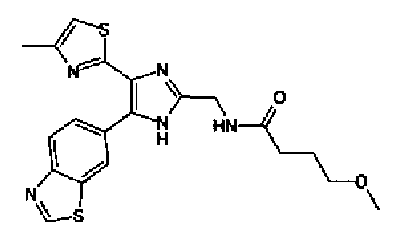
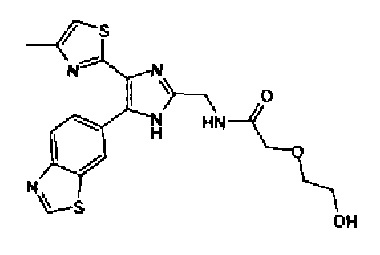
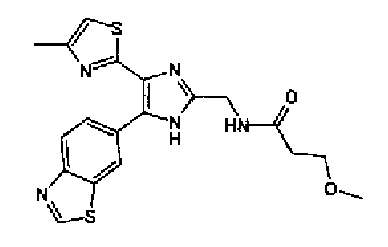
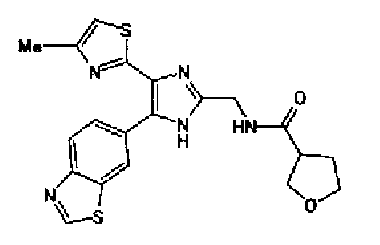
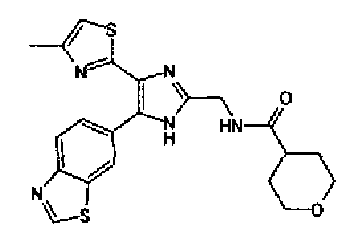
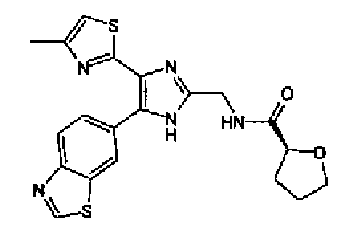
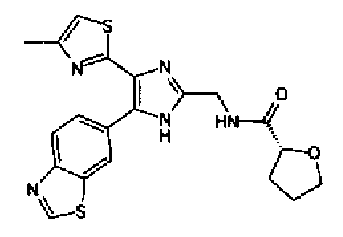
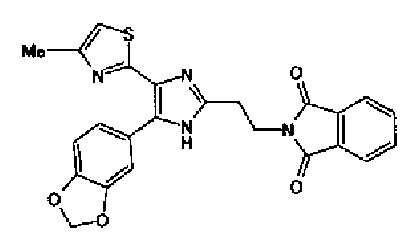
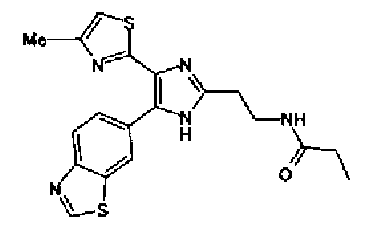
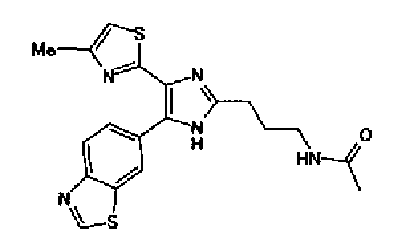
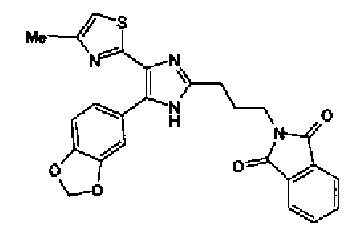
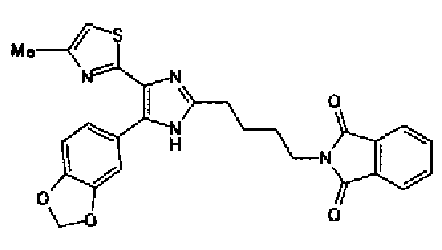
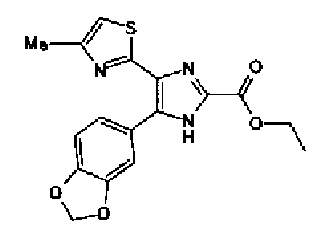
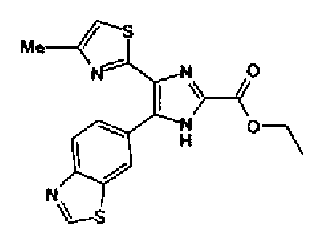

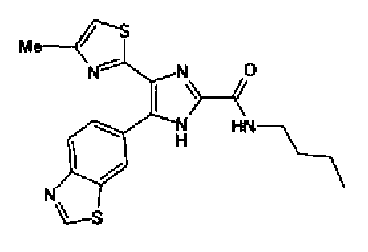
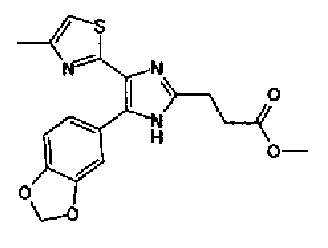
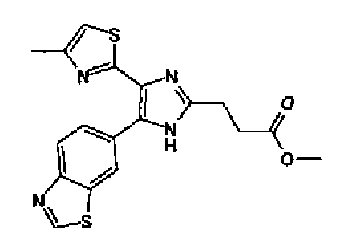
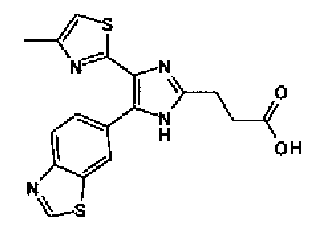
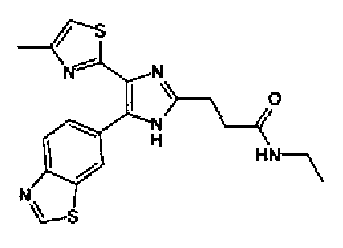
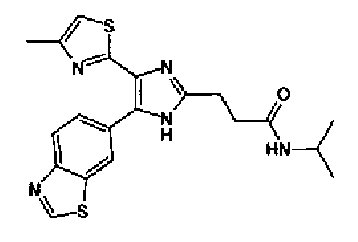
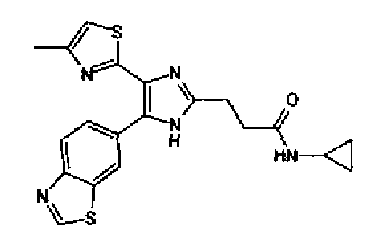
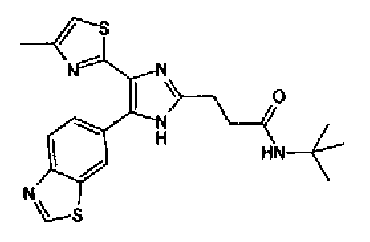
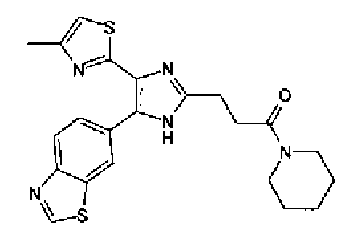
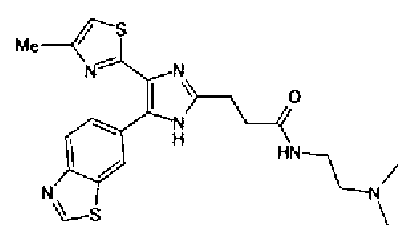
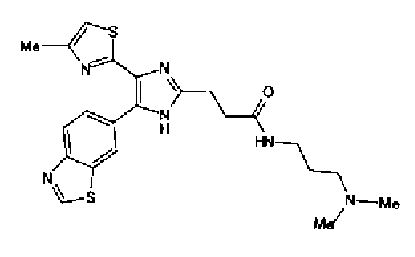
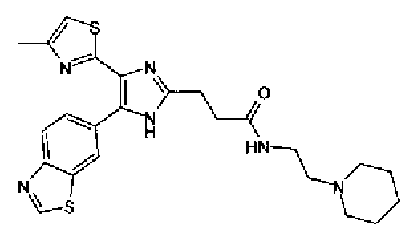
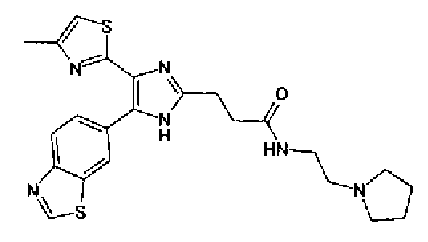
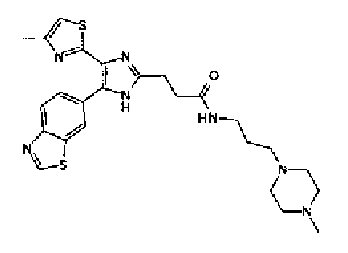
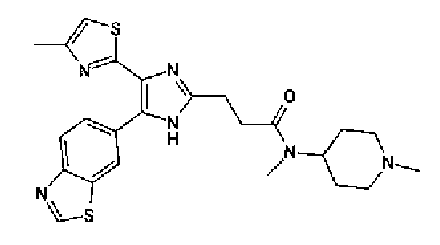
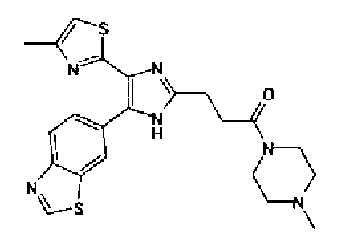
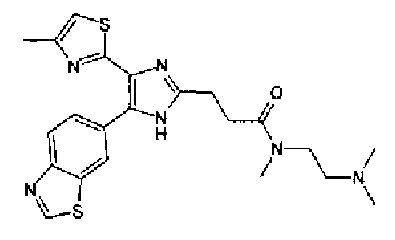
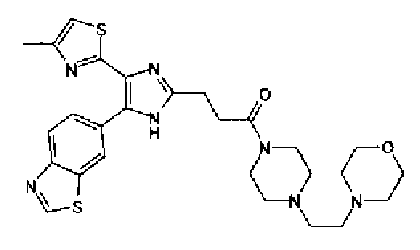
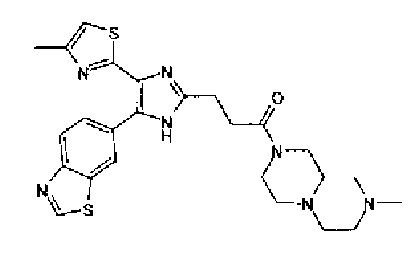
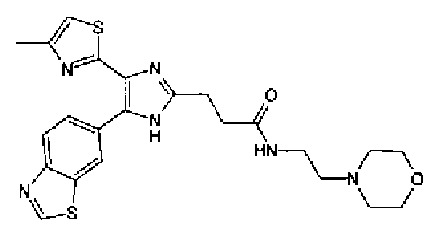
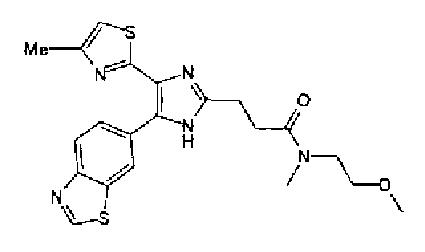

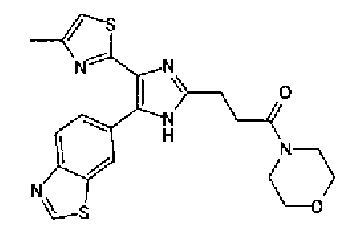
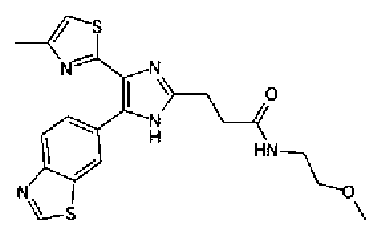
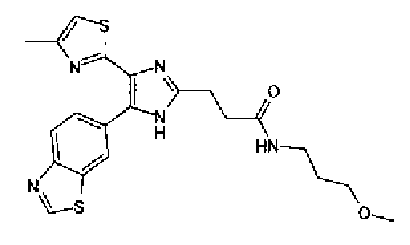
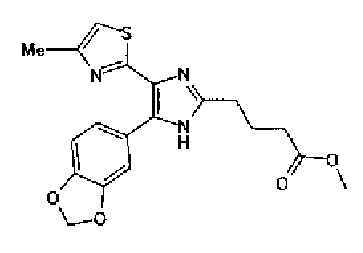
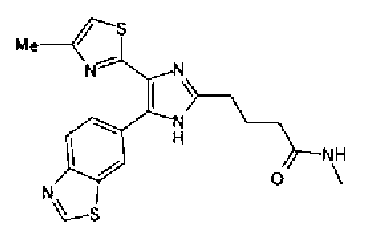
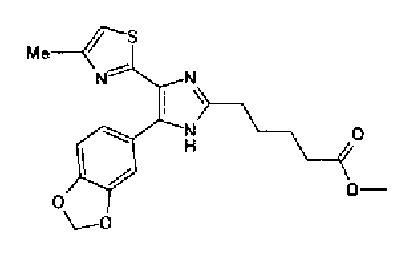
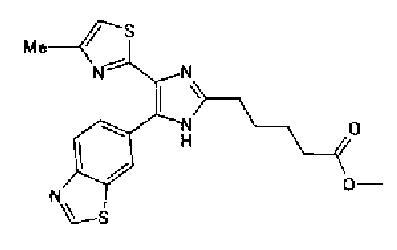
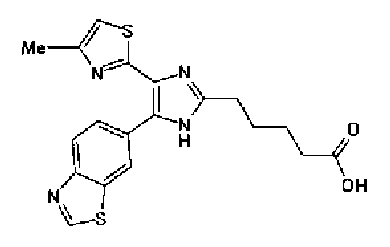
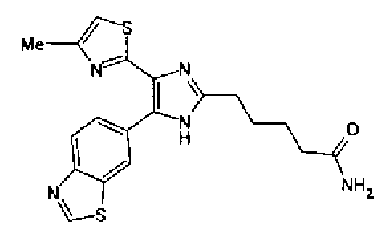
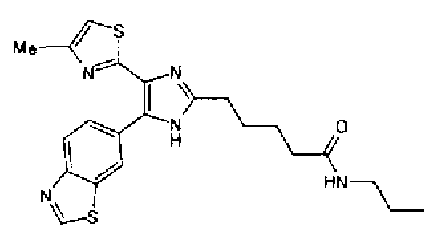
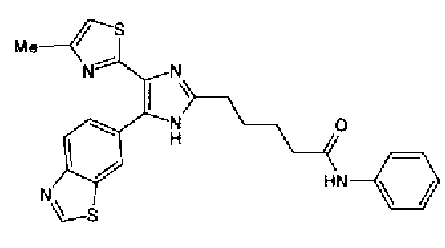
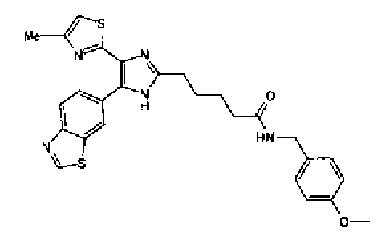
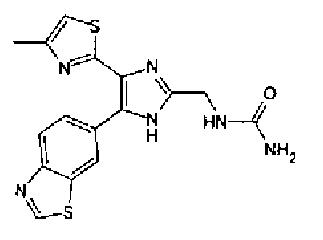
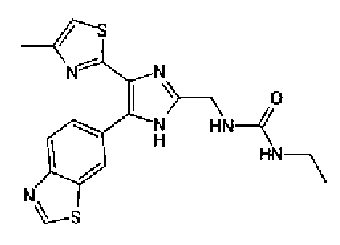
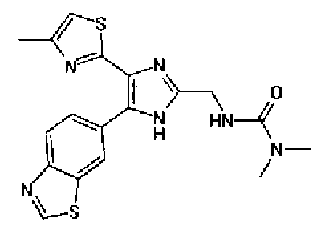
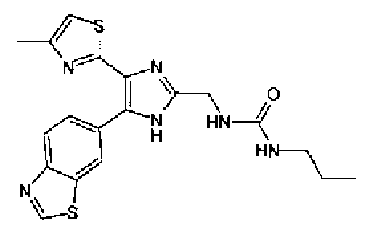
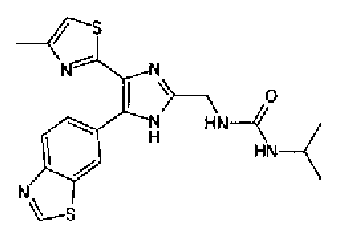
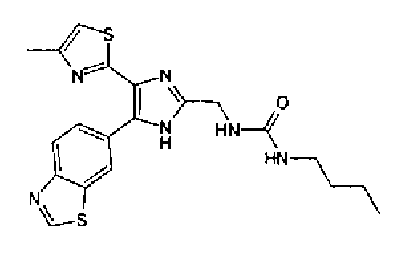
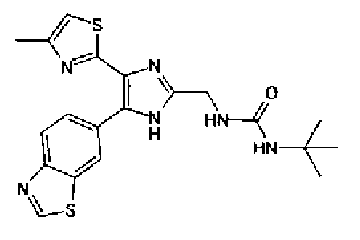
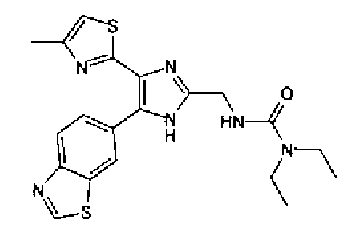
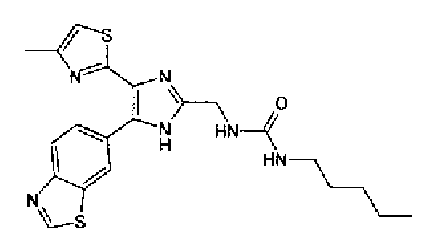
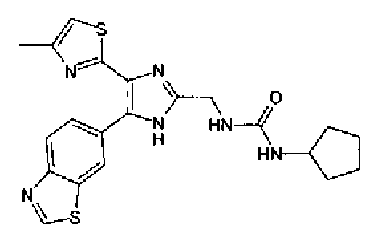
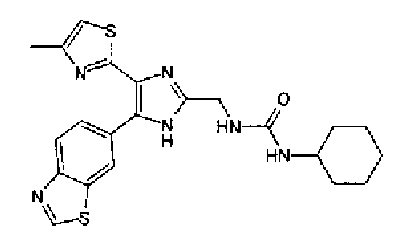
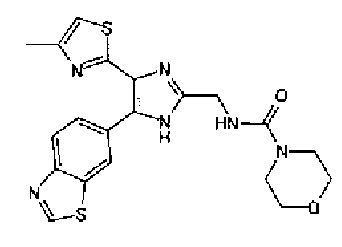
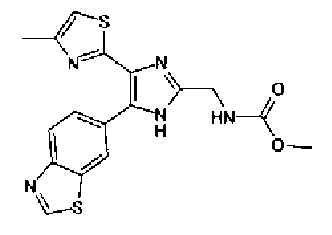
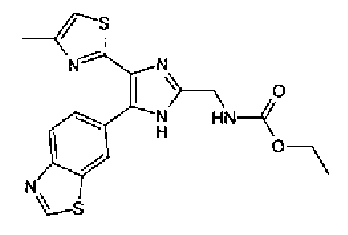
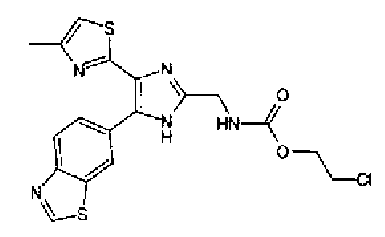
(разл.)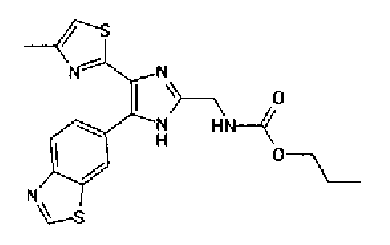
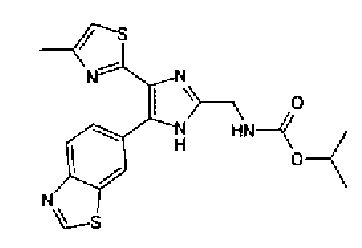
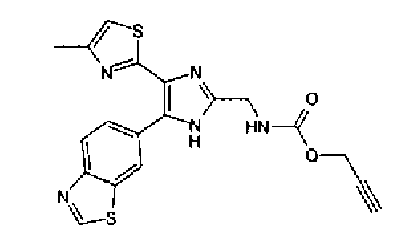
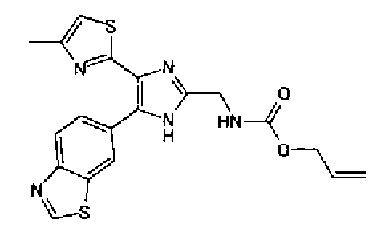
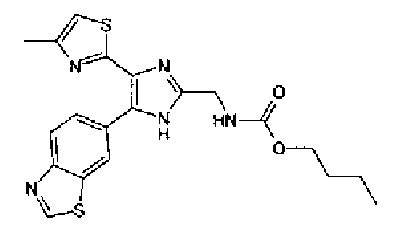
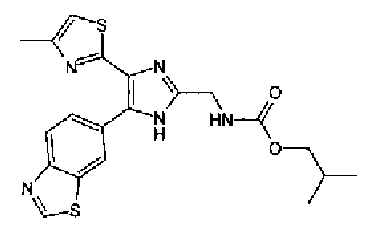
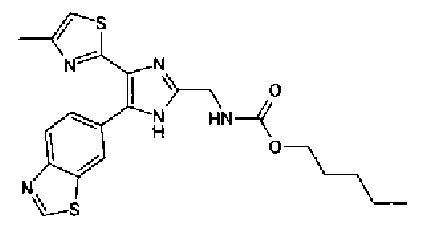
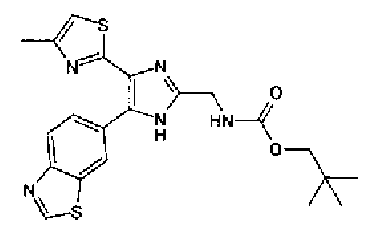
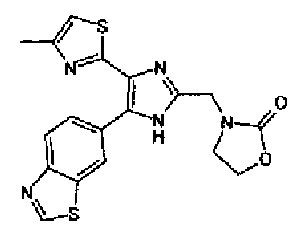

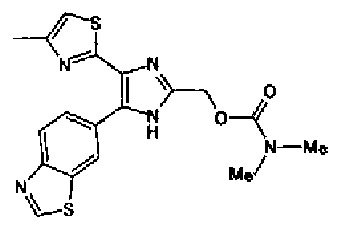
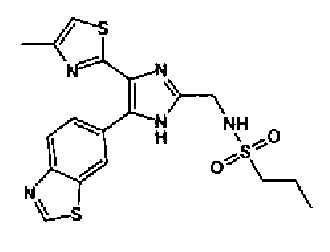
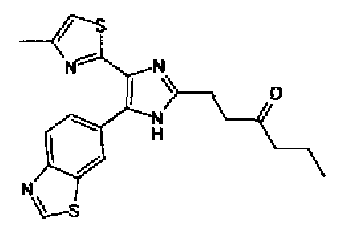
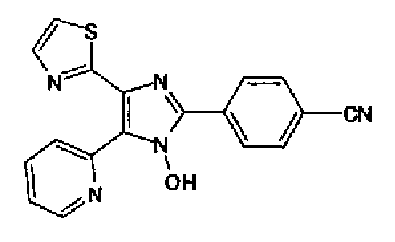
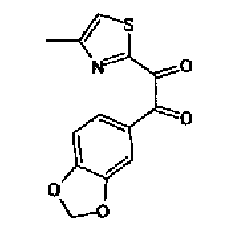
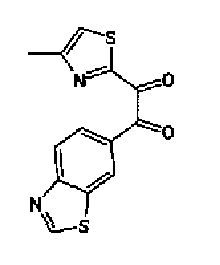
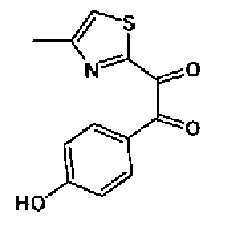
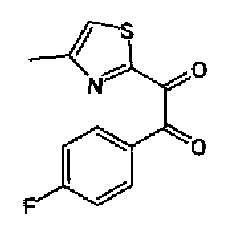
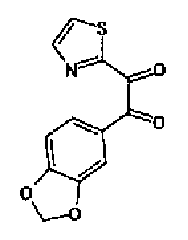
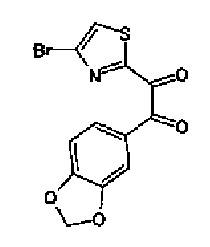
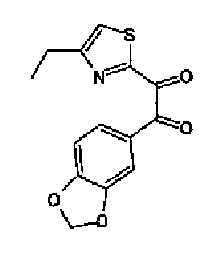
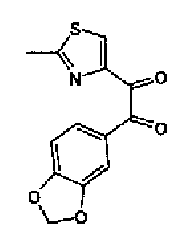
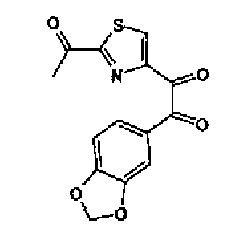
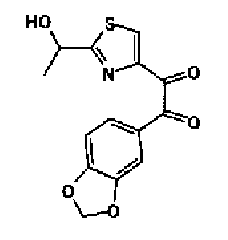
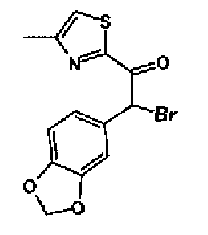
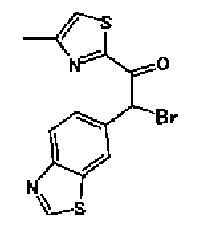
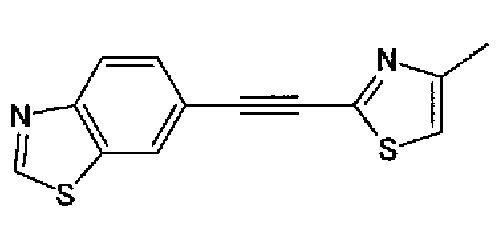
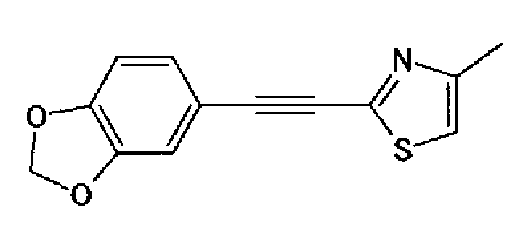
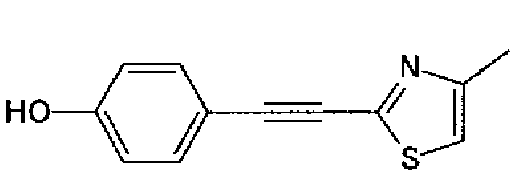
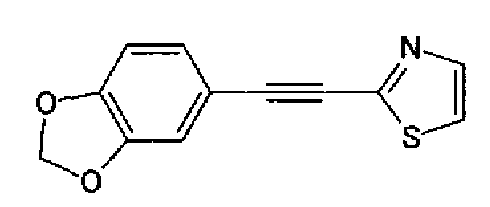
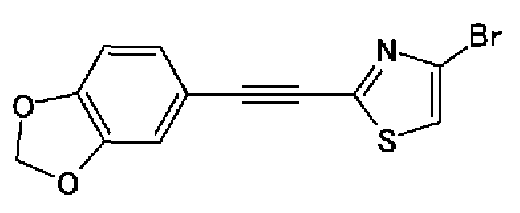
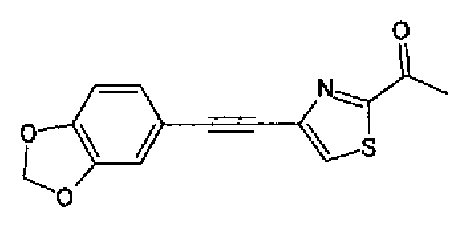
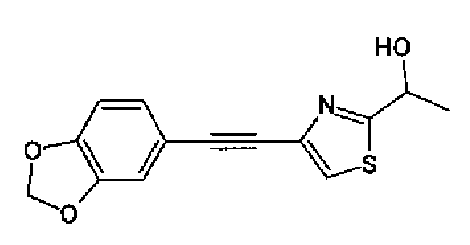
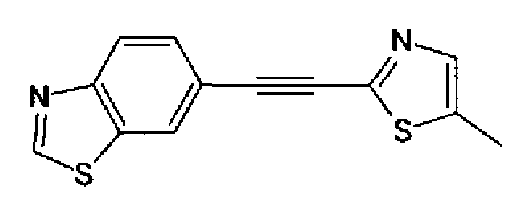
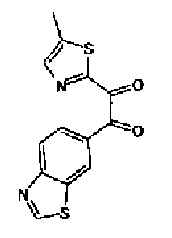
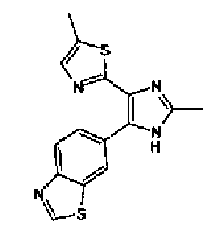
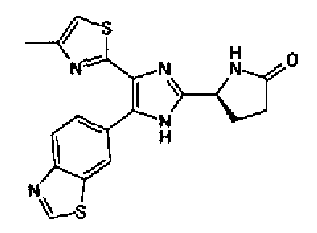
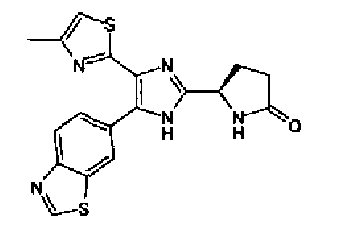
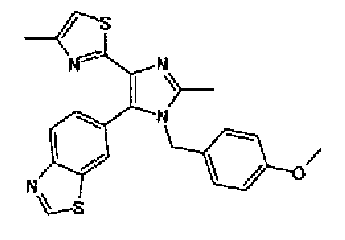
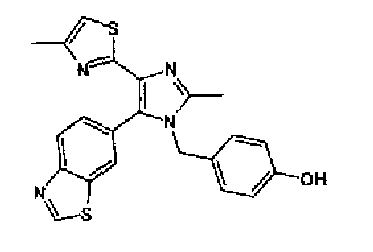
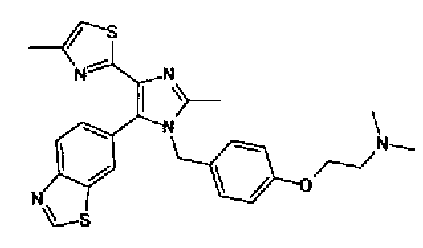
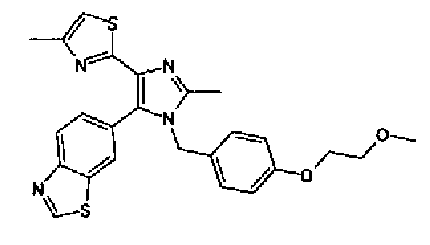
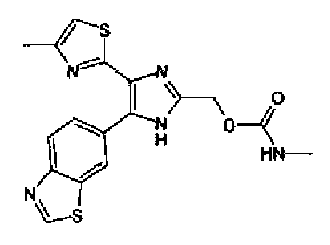
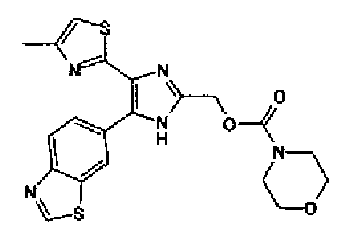
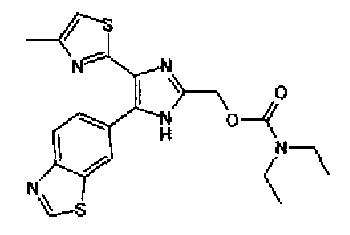
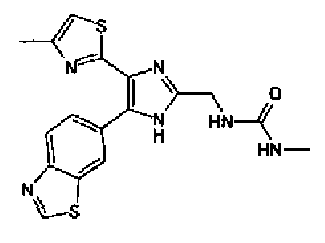
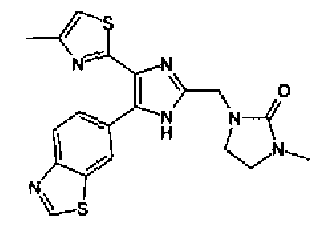
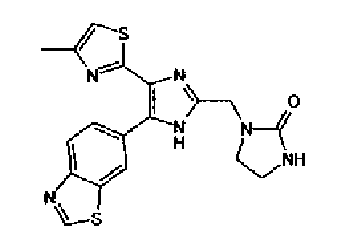
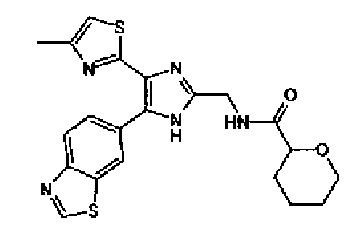
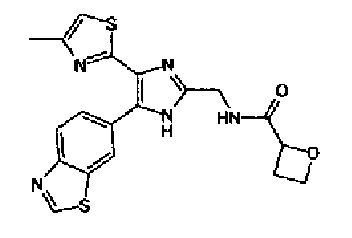
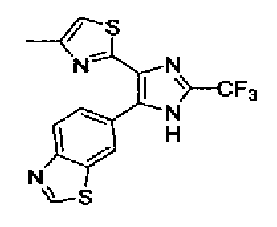
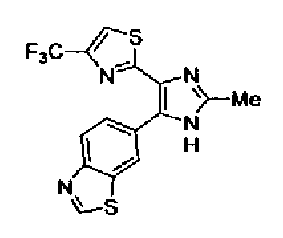
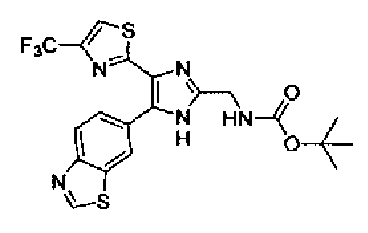
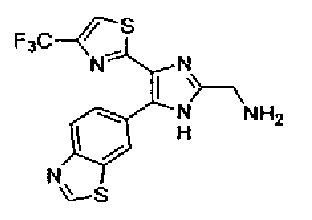
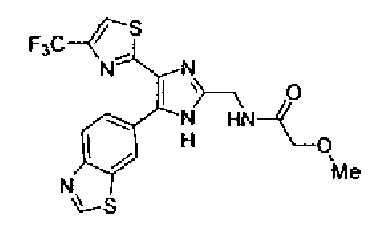
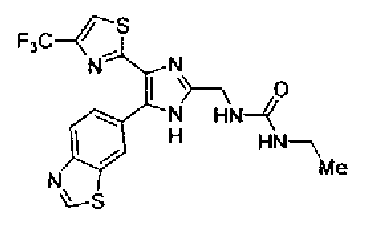
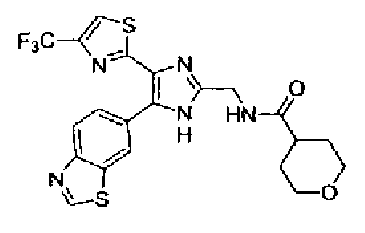
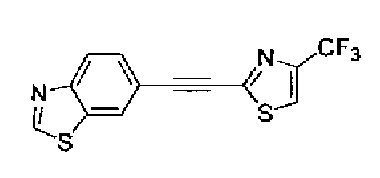
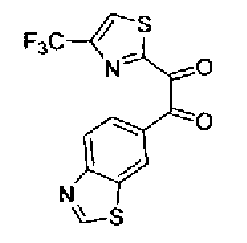
Пример испытания 1
Тест на ингибирующую активность в отношении фосфорилирования Smad2/3
Клетки А549 высевают на планшет и культивируют в течение ночи в среде Ham F-12 с добавкой 10% FBS (фетальная телячья сыворотка). Среду заменяют такой же средой, содержащей соединения или не содержащей соединения, после инкубации в течение еще 2 ч к ней добавляют TGF-β1 для доведения конечной концентрации до 1 нг/мл и дополнительно инкубируют в течение 1 ч. После завершения инкубации среду удаляют и клетки промывают PBS (забуференный фосфатом солевой раствор) и затем лизируют раствором RIPA. Раствор клеточных лизатов подвергают иммунопреципитации, используя антитело против Smad2/3, и затем проводят вестерн-блоттинг. Используя кроличье антитело против фосфорилированного серина в качестве первичного антитела, анти-кроличье IgG антитело, меченное HRP, в качестве вторичного антитела, и реагенты детектирования ECL вестерн-блоттингом в качестве реагента детектирования, измеряют величину светоизлучения, используя Limi-Imager F1 (Roche Diagnostics) и т.д.
Следуя описанным выше способам, измеряют ингибирующую активность соответствующих соединений против фосфорилирования Smad2/3, вызванного стимуляцией TGF-β1, и рассчитывают величины IC50.
Результаты показаны в таблице 2.
Пример испытания 2
Тест пролиферации клеток волосяных фолликулов
В соответствии со способом, описанным Arase et al. (Arase et al., J Dermatol Sci 2, 66-70 (1991)), клетки волосяных фолликулов выделяют из человеческих волос и культивируют с использованием KGM-1 (Clonetics).
После высевания фолликулярных клеток на 24-луночный планшет и культивирования в течение ночи среду заменяют другой средой, содержащей соединения или не содержащей соединения, и после инкубации в течение еще 2 ч к ней добавляют TGF-β1 для доведения конечной концентрации до 0,1 нг/мл и дополнительно инкубируют еще 72 ч. За 2 ч до завершения культивирования к среде добавляют реагент Аламар синий, количество которого составляет 1/10 добавленной среды, и измеряют интенсивность флоресценции среды (возбуждение: 544 нм, испускание: 590 нм) для определения количества живых клеток. На чертеже показаны количества живых клеток, когда в них вводят один TGF-β1 и когда в них одновременно вводят TGF-β1 и соединение, при условии что количество живых клеток, определенное, когда эти клетки культивировались в течение 72 ч без добавления TGF-β1, принимается за 100%.
Промышленная применимость
Соединения в соответствии с настоящим изобретением оказывают ингибирующее действие на ALK5, который представляет собой рецептор TGF-β1 типа I, и они полезны в качестве фармацевтических продуктов для лечения или предотвращения различных заболеваний, таких как облысение или диабетическая нефропатия, связанные с ALK5, рецептором TGF-β1 типа I.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРРОЛОПИРИДИНЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2006 |
|
RU2435769C2 |
| СОЕДИНЕНИЯ ИНДОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ КЛЕТОЧНОГО НЕКРОЗА | 2008 |
|
RU2477282C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА И ХИНАЗОЛИНА СО СРОДСТВОМ К 5HT-РЕЦЕПТОРАМ | 2004 |
|
RU2402533C2 |
| НОВОЕ ПРОИЗВОДНОЕ ТЕТРАГИДРОИЗОХИНОЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, ПРИМЕНЕНИЕ ЕГО И СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЗАБОЛЕВАНИЯ | 2009 |
|
RU2474575C2 |
| СОЕДИНЕНИЕ 4-ОКСОХИНОЛИНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА ВИЧ ИНТЕГРАЗЫ | 2003 |
|
RU2275361C2 |
| ПРОИЗВОДНОЕ ДИФЕНИЛСУЛЬФИДА И ФАРМАЦЕВТИЧЕСКИЙ ПРОДУКТ, КОТОРЫЙ СОДЕРЖИТ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2011 |
|
RU2566296C2 |
| КОНДЕНСИРОВАННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, СОДЕРЖАЩАЯ ЕГО ЛЕЧЕБНАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2006 |
|
RU2418803C2 |
| ПРОИЗВОДНОЕ 6-(ГЕТЕРОЦИКЛЗАМЕЩЕННЫЙ БЕНЗИЛ)-4-ОКСОХИНОЛИНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА ИНТЕГРАЗЫ ВИЧ | 2007 |
|
RU2399616C1 |
| АНТАГОНИСТ CASR | 2004 |
|
RU2315036C2 |
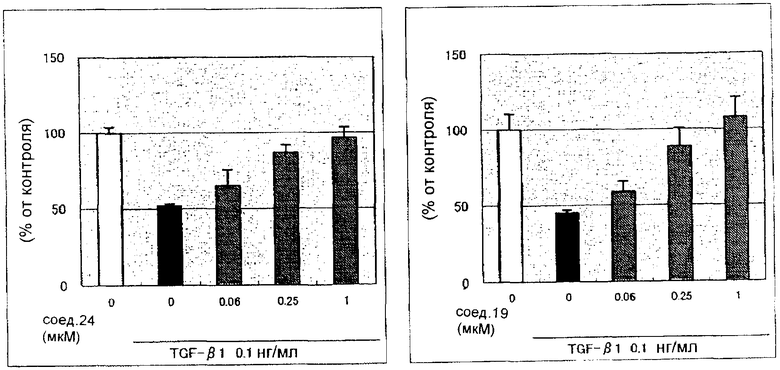
Настоящее изобретение относится к производным тиазола формулы (I) и их фармацевтически приемлемым солям. В формуле I:
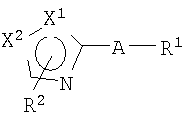
X1 и X2 отличаются друг от друга и представляют атом серы или атом углерода; R1 представляет фенильную группу; фенильную группу, замещенную 1-2 членами, выбранными из группы, состоящей из атомов галогена, алкоксигруппы, имеющей 1-6 атомов углерода, гидроксигруппы, фенилалкоксигруппы, имеющей 7-12 атомов углерода; фенильную группу, конденсированную с 5-7-членным гетероароматическим или неароматическим кольцом, имеющим по меньшей мере один гетероатом, состоящий из N, О и S; пиридильную группу; R2 представляет атом водорода, атом галогена, алкильную группу, имеющую 1-6 атомов углерода, алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена, алкоксигруппу, имеющую 1-6 атомов углерода, или гидроксиалкильную группу, имеющую 1-5 атомов углерода; А представляет группу, которая представлена формулой 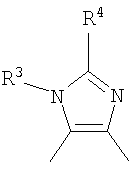 или
или 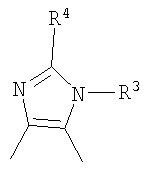
Изобретение также относится к ингибитору ALK5, содержащему соединение изобретения в качестве активного ингредиента, стимуляторам пролиферации волосяных фолликулов и роста волос, а также к производному тиазола формулы  ,
,
где А1 представляет 
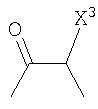 .
.
5 н. и 7 з.п. ф-лы, 2 табл., 1 ил.
1. Производное тиазола, представленное формулой (I)
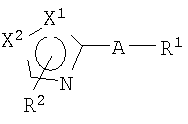
или его фармацевтически приемлемая соль,
где X1 и X2 отличаются друг от друга и представляют атом серы или атом углерода;
R1 представляет фенильную группу;
фенильную группу, замещенную 1-2 членами, выбранными из группы, состоящей из атомов галогена, алкоксигруппы, имеющей 1-6 атомов углерода, гидроксигруппы, фенилалкоксигруппы, имеющей 7-12 атомов углерода;
фенильную группу, конденсированную с 5-7-членным гетероароматическим или неароматическим кольцом, имеющим по меньшей мере один гетероатом, состоящий из N, О и S;
пиридильную группу;
R2 представляет атом водорода, атом галогена, алкильную группу, имеющую 1-6 атомов углерода, алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена, алкоксигруппу, имеющую 1-6 атомов углерода, или гидроксиалкильную группу, имеющую 1-5 атомов углерода; и
А представляет группу, которая представлена формулой
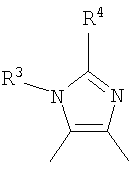
или
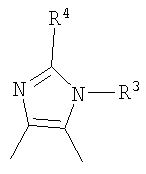
где R3 представляет атом водорода;
алкильную группу, имеющую 1-6 атомов углерода;
фенилалкильную группу, имеющую 7-12 атомов углерода; или
фенилалкильную группу, имеющую 7-12 атомов углерода, замещенную гидроксигруппой, алкоксигруппой, имеющей 1-6 атомов углерода, алкоксигруппой, имеющей 1-6 атомов углерода, замещенной алкоксигруппой, имеющей 1-6 атомов углерода, или алкоксигруппой, имеющей 1-6 атомов углерода, замещенной алкиламиногруппой, имеющей 1-6 атомов углерода,
R4 представляет
фенильную группу, замещенную 1 членом, выбранным из группы, состоящей из карбамоильной группы и цианогруппы;
атом водорода;
алкильную группу, имеющую 1-12 атомов углерода;
алкенильную группу, имеющую 2-12 атомов углерода;
циклоалкильную группу, имеющую 3-7 атомов углерода;
алкильную группу, имеющую 1-6 атомов углерода, замещенную алкоксигруппой, имеющей 1-6 атомов углерода, гидроксигруппой, алкоксифенилалкоксигруппой, имеющей 8-12 атомов углерода, фталимидоильной группой, толуолсульфонилоксигруппой или морфолиногруппой;
алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена;
циклоалкильную группу, имеющую 3-9 атомов углерода, замещенную оксогруппой;
тетрагидропиранильную группу;
4-пиперидинильную группу;
пиперидинильную группу, замещенную трет-бутоксикарбонильной группой;
циклогексанспиро-2'-(1,3-диоксоранильную) группу;
пирролидин-2-он-5-ильную группу;
группу, представленную формулой -Y1-Z1-NR5-Z2-Y2-R6,
где Y1 и Y2 одинаковые или отличаются друг от друга и представляют простую связь или алкиленовую группу, имеющую 1-12 атомов углерода;
R5 представляет атом водорода или алкильную группу, имеющую 1-12 атомов углерода;
Z1 и Z2 одинаковые или отличаются друг от друга и представляют простую связь;
алкиленовую группу, имеющую 1-7 атомов углерода;
-СО-;
-CO2-;
-SO2- или
-OCO-, и
R6 представляет
циклоалкильную группу, имеющую 3-7 атомов углерода;
алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-3 атомами галогена;
алкенильную группу, имеющую 2-6 атомов углерода;
алкинильную группу, имеющую 2-6 атомов углерода;
аминогруппу;
аминогруппу, замещенную 1-2 группами, выбранными из группы, состоящей из алкильной группы, имеющей 1-6 атомов углерода, циклоалкильной группы, имеющей 3-7 атомов углерода, и трет-бутоксикарбонильной группы;
пиперидиногруппу;
пиперидинильную группу;
пиперидинильную группу, замещенную алкильной группой, имеющей 1-6 атомов углерода;
пирролидинильную группу;
пиперазинильную группу;
пиперазинильную группу, замещенную алкильной группой, имеющей 1-6 атомов углерода;
морфолиногруппу;
гидроксигруппу;
алкоксигруппу, имеющую 1-6 атомов углерода;
алкоксигруппу, имеющую 1-6 атомов углерода, замещенную гидроксигруппой или алкоксигруппой, имеющей 1-6 атомов углерода;
оксетан-2-ильную группу;
тетрагидрофуранильную группу;
тетрагидропиранильную группу;
атом водорода;
фенильную группу;
фенильную группу, замещенную алкоксигруппой, имеющей 1-4 атома углерода; или
группу, которая образует оксазолидин-2-он или имидазолидин-2-он при присоединении к атому азота указанной выше формулы; или
группу, представленную формулой Y3-CO-R41,
где Y3 представляет простую связь или алкиленовую группу, имеющую 1-7 атомов углерода,
R41 представляет
гидроксигруппу;
алкоксигруппу, имеющую 1-6 атомов углерода;
пиперазин-1-ильную группу, замещенную алкильной группой имеющей 1-6 атомов углерода, морфолиноалкильной группой, имеющей 5-10 атомов углерода, или алкиламиноалкильной группой, имеющей 2-14 атомов углерода;
или
морфолиногруппу.
2. Производное тиазола или его фармацевтически приемлемая соль по п.1, где R2 представляет собой атом водорода, атом галогена, алкильную группу, имеющую 1-6 атомов углерода, или алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена.
3. Производное тиазола или его фармацевтически приемлемая соль по п.1, где R2 представляет собой алкильную группу, имеющую 1-6 атомов углерода, или трифторметильную группу.
4. Производное тиазола или его фармацевтически приемлемая соль по п.1, где R2 представляет собой метальную группу или трифторметильную группу.
5. Производное тиазола или его фармацевтически приемлемая соль по любому из пп.1-4, где R1 представляет собой фенильную группу, конденсированную с 5-7-членным гетероароматическим или неароматическим кольцом, содержащим по меньшей мере один гетероатом, выбранный из группы, состоящей из N, О и S.
6. Производное тиазола или его фармацевтически приемлемая соль по п.1, где X1 представляет собой атом серы и Х2 представляет собой атом углерода.
7. Ингибитор ALK5, содержащий в качестве активного ингредиента производное тиазола или его фармацевтически приемлемую соль по пп.1-6 и фармацевтически приемлемый носитель.
8. Ингибитор ALK5 по п.7, который представляет собой терапевтическое средство против гломерулонефрита, диабетической нефропатии, печеночного фиброза, цирроза печени, легочного фиброза, пролиферативной витреоретинопатии или облысения или средство для роста волос.
9. Ингибитор ALK5 по п.7 или 8, который представляет собой лекарственное средство для наружного применения.
10. Стимулятор пролиферации волосяных фолликулов, содержащий ингибитор ALK5 по пп.1-6 в качестве активного ингредиента.
11. Стимулятор роста волос или средство для роста волос, содержащий(ее) ингибитор ALK5 по пп.1-6 в качестве активного ингредиента.
12. Производное тиазола, представленное формулой

или его фармацевтически приемлемая соль,
где X1 и X2 отличаются друг от друга и представляют атом серы или атом углерода;
R1 представляет
фенильную группу, замещенную 1 членом, выбранным из группы, состоящей из атомов галогена, алкоксигруппы, имеющей 1-6 атомов углерода, гидроксигруппы;
бензо[1,3]диоксол;
бензотиазол;
R2 представляет атом водорода, атом галогена, алкильную группу, имеющую 1-6 атомов углерода, алкильную группу, имеющую 1-6 атомов углерода, замещенную 1-5 атомами галогена, алканоильную группу, имеющую 1-6 атомов углерода, или гидроксиалкильную группу, имеющую 1-5 атомов углерода; и
А1 представляет группу, которая представлена формулой
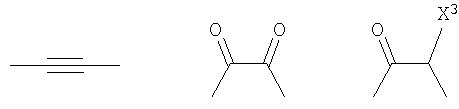
где X3 представляет атом галогена,
при условии, что когда X1 представляет атом серы, X2 представляет атом углерода, А1 представляет собой  то R1 не является 4-метоксифенилом.
то R1 не является 4-метоксифенилом.
| RU 2001131556 А, 20.09.2003 | |||
| WO 03042207 A1, 22.05.2003 | |||
| WO 03087304 A2, 23.10.2003 | |||
| ПРЕДОХРАНИТЕЛЬНОЕ УСТРОЙСТВО ОТ ПЕРЕГРУЗКИ | 0 |
|
SU240476A1 |
| Осевой компрессор | 1988 |
|
SU1627756A1 |
| WO 03080592 A1, 02.10.2003. | |||
Авторы
Даты
2009-09-20—Публикация
2005-03-04—Подача