Область техники
Настоящее изобретение относится к соединению (или его фармакологически приемлемой соли), имеющему особую химическую структуру, обладающему превосходным ингибирующим действием в отношении ацил-кофермента А: диацилглицерин-ацилтрансферазы (Ацил-СоА: диацилглицерин-ацилтрансфераза, в дальнейшем также называемая DGAT) и превосходным подавляющим потребление пищи действием.
Предшествующий уровень техники
Тучность представляет собой состояние, при котором масса тела существенно превышает нормальную в результате накопления нейтральных жиров (триацилглицерин или триглицерид, в дальнейшем также называемый TG) в жировых клетках вследствие непрерывного избыточного потребления энергии по сравнению с ее расходом организмом (Непатентный документ 1). Тучность приводит к развитию заболевания, связанного с образом жизни (например, гиперлипидемия, гипертриглицеридемия, диабет, гипертензия и артериосклероз), цереброваскулярному расстройству, болезни коронарной артерии, дыхательной недостаточности, боли в пояснице, остеоартриту коленного сустава, подагре, желчнокаменной болезни и так далее. Тучность при наличии осложнения, имеющего отношение к вышеперечисленным болезням, или тучность, которая может позже привести к развитию такого осложнения, определяют как ожирение и лечат как болезнь.
Кроме того, как было установлено в последние годы, ожирение является одной из основных причин развития болезни, связанной с образом жизни, называемой метаболический синдром (Непатентный документ 2). Имеются сообщения, что у индивидуумов, страдающих ожирением, жирные кислоты и факторы, такой как TNF-α, высвобождаются из накопленных жиров внутренних органов и индуцируют резистентность к инсулину в скелетных мышцах, печени и жировой ткани, облегчая синтез нейтральных жиров в печени, что приводит к развитию гиперлипидемии. Кроме того, увеличение концентрации сывороточного инсулина, вызванное инсулинорезистентностью, увеличивает периферическое сосудистое сопротивление через повышение почечной реабсорбции ионов натрия и активацию симпатических нервов, вызывая гипертензию. Также считают, что гиперлипидемия, диабет и гипертензия, вызванные ожирением, инициируют развитие ангиопатии, как, например, цереброваскулярное расстройство или болезнь коронарной артерии, вызванные артериосклерозом, что приводит к серьезным опасным для жизни клиническим состояниям.
В настоящее время медикаментозное лечение ожирения осуществляется исходя из имеющихся лекарственных средств в каждой стране, и анорексигенные средства центрального действия, такие как мазиндол (Непатентный документ 3) и сибутрамин (Непатентный документ 4), и ингибиторы абсорбции липидов, такой как орлистат, ингибитор панкреатической липазы, прописывают, в основном, с целью регулирования потребления калорий. Эти лекарственные средства неудовлетворительны в лечении, хотя и приводят к достижению некоторых лечебных эффектов. Анорексигенные средства центрального действия имеют побочные действия, такие как сухость во рту, запор, неприятные ощущения в желудке, и в некоторых случаях вызывают слуховую галлюцинацию и зрительную галлюцинацию. Орлистат (Непатентный документ 5) может вызывать неблагоприятные действия в желудочно-кишечном тракте, такие как, например, понос, недержание, стеаторея и метеоризм. Таким образом существует необходимость в разработке более сильнодействующих лекарственных средств с меньшим проявлением побочных действий. При таких обстоятельствах были проведены активные научные исследования и разработки с целью создания новых лекарственных средств против ожирения, большая часть из которых оказалась лекарственными средствами, снижающими аппетит, т.е. анорексигенными средствами.
Животные и растения запасают липиды в виде нерастворимых TG и продуцируют энергию, диссимилируя TG согласно необходимости. TG, поступающие с пищей, гидролизуются в жирную кислоту и моноацилглицерин в просвете тонкой кишки под действием желчной кислоты и панкреатической липазы. Мицеллы, состоящие из свободной жирной кислоты, моноацилглицерина и желчной кислоты, абсорбируются в эпителиальных клетках тонкой кишки, в которых TG затем вновь синтезируется в эндоплазматическом ретикулуме под действием ацил-кофермент А-синтетазы (в дальнейшем называемой ACS), ацил-кофермента A: моноацилглицерин-ацилтрансферазы и DGAT. TG соединяется с фосфолипидом, холестерином и аполипопротеином и секретируется в форме хиломикронов в лимфатические сосуды в желудке и кишечнике. Затем TG секретируется в кровь через ствол лимфатического сосуда и переносится на периферию для использования. С другой стороны, TG также синтезируется в жировой ткани из глицерин-3-фосфата и свободной жирной кислоты под действием ACS, глицерин-3-фосфат-ацилтрансферазы, лизофосфатидная кислота-ацилтрансферазы и DGAT (Непатентный документ 6). Таким образом TG, поступивший в неумеренном количестве, накапливается в жировой ткани, что приводит к ожирению.
DGAT, внутриклеточный фермент, обнаруженный в эндоплазматическом ретикулуме, катализирует наиболее важную реакцию в финальной стадии на пути синтеза TG, то есть реакцию переноса ацильных групп ацил-кофермента A в 3-положение 1,2-диацилглицерина (Непатентные документы 7-9). Имеются сообщения, что DGAT имеет два изофермента DGAT1 (Непатентный документ 10) и DGAT2 (Непатентный документ 11). Поскольку DGAT1 и DGAT2 экспрессируются в высокой степени в тонкой кишке и жировой ткани и в печени и жировой ткани соответственно, то предполагают, что DGAT1 вовлечен, в основном, в абсорбцию жиров из тонкой кишки и накопление жиров в жировой ткани и DGAT2 вовлечен, в основном, в синтез TG или секрецию ЛОНП (липопротеин очень низкой плотности) в печени и накопление жиров в жировой ткани. Несмотря на то, что различие между ролями DGAT1 и DGAT2 еще полностью не выяснено, было выдвинуто предположение о наличии связи между DGAT и ожирением, липидным метаболизмом, метаболизмом глюкозы и т.п. (Непатентный документ 12). DGAT представляет собой ключевой фермент в синтезе TG в эпителиальных клетках желудочно-кишечного тракта и жировой ткани. Лекарственные средства, которые ингибируют DGAT, подавляют синтез TG и тем самым сдерживают абсорбцию жиров в желудочно-кишечном тракте и накопление жиров в жировой ткани. Следовательно, такие лекарственные средства, как предполагают, являются полезными в качестве терапевтических или профилактических средств для лечения, например, тучности, ожирения, гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, диабета, неалкогольного стеатогепатита или гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, диабета, неалкогольного стеатогепатита, гипертензии, артериосклероза, цереброваскулярного расстройства или болезни коронарной артерии, вызванных ожирением (Непатентные документы 13-17).
Анорексигенные средства непосредственно или косвенно регулируют систему контроля аппетита, и механизмы действия вышеуказанных лекарственных средств в общих чертах классифицированы по их центральному и периферическому действиям. Анорексигенные средства центрального действия непосредственно подавляют аппетит путем их воздействия на гипоталамическую нейронную систему, содержащую центры питания и насыщения, или на моноаминергическую нейронную систему в головном мозге, регулирующую эту гипоталамическую нейронную систему. С другой стороны, периферически действующие анорексигенные средства подавляют аппетит опосредованно путем их воздействия на механизм обнаружения и передачи информации о потреблении пищи или накоплении избыточной энергии.
В последние годы все больше и больше склоняются к механизму действия, при котором, например, гормон желудочно-кишечного тракта (CCK, GLP-1, PYY, и т.д.) (Непатентный документ 18), секретируемый в тесной связи с перевариванием и всасыванием пищи, или лептин (Непатентный документ 19), секретируемый из жировых клеток в ответ на количество аккумулированной энергии (количество жиров), передает гормональные или нейронные сигналы, регулирующие аппетит, с периферии к центральной нервной системе. Новые анорексигенные средства, ассоциируемые с этими периферическими сигналами, как предполагают, будут служить в качестве более эффективных лекарственных средств против ожирения с меньшим проявлением побочных реакций.
Патентный документ 1 раскрывает соединения, по структуре аналогичные соединениям по данному изобретению. Этот документ описывает соединения, содержащие две замещенные фенильные группы, связанные через мочевиновые и амидные связи или через мочевиновые и сложноэфирные связи с циклом тетрагидроизохинолина, и применение их в качестве ингибитора DGAT. Кроме того, Патентный документ 2 описывает применение этих соединений в качестве средства для подавления потребления пищи. Однако эти патентные документы раскрывают лишь соединения, в которых атом азота на тетрагидроизохинолиновом цикле замещен замещенной фенильной группой посредством амидной или сложноэфирной связи. С другой стороны, в соединениях по данному изобретению атом азота на цикле тетрагидроизохинолина замещен замещенной циклоалкильной или циклоалкенильной группой через сложноэфирную связь или т.п.
Помимо этого, известны некоторые соединения, обладающие ингибирующим действием в отношении DGAT. Однако все эти соединения по своей структуре отличаются от соединений по данному изобретению (например, Патентные документы 3, 4 и 5 и Непатентные документы 20-24). Кроме того, известны некоторые соединения, обладающие подавляющим потреблением пищи действием. Однако все эти соединения отличаются от соединений по данному изобретению своей структурой (см., например, Патентные документы 6 и 7).
Патентный документ 1: US No. 2007/0249620
Патентный документ 2: Международная публикация No. WO2007/074753, брошюра
Патентный документ 3: Выложенный патент Японии No. 2007-131584
Патентный документ 4: Международная публикация No. WO2006/019020, брошюра
Патентный документ 5: Выложенный патент Японии No. 2002-306199
Патентный документ 6: Международная публикация No. WO2005/072740, брошюра
Патентный документ 7: EP No. 1411881
Непатентный документ 1: Eiji Itagaki, "STEP series, Metabolism, Endocrinology", KAIBASHOBO, LTD. 1st ed., 1998, p. 105
Непатентный документ 2: Zimmet, P. et al., Nature, 2001, vol. 414, p. 782-787
Непатентный документ 3: Engstrom, R. G. et al., Arch. Intern. Pharmacodyn., 1975, vol. 214, p. 308-321
Непатентный документ 4: Bray, G. A. et al., Obes. Res., 1996, vol. 4, p. 263-270
Непатентный документ 5: Davidson, M. H. et al., The Journal of the American Medical Association, 1999, vol. 281, p. 235-242
Непатентный документ 6: Coleman, R., Bell, R., J. Biol. Chem., 1976, vol. 251, p. 4537-4543
Непатентный документ 7: Coleman, R., Methods in Enzymology, 1992, vol. 209, p. 98-104
Непатентный документ 8: Lehner, R., Kuksis, A., Prog. Lipid Res., 1996, vol. 35, p. 169-201
Непатентный документ 9: R. Bell., Ann. Rev. Biochem., 1980, vol. 49, p. 459-487
Непатентный документ 10: Cases, S. et al., Proc. Natl. Acad. Sci. USA., 1998, vol. 95, p. 13018-13023
Непатентный документ 11: Cases, S. et al., J. Biol. Chem., 2001, vol. 276, p. 38870-38876
Непатентный документ 12: Coleman, R. A., Lee, D. P., Progress in Lipid Research, 2004, vol. 43, p. 134-176
Непатентный документ 13: Smith, S. J. et al., Nat. Genet., 2000, vol. 25, p. 87-90
Непатентный документ 14: Chen, H. C., J. Clin. Invest., 2002, vol. 109, p. 1049-1055
Непатентный документ 15: Buhman, K. K., J. Biol. Chem., 2002, vol. 277, p. 25474-25479
Непатентный документ 16: Gaziano, J., et al., Circulation, 1997, vol. 96, p. 2520-2525
Непатентный документ 17: Yamaguchi, K. et al., Hepatology, 2008, vol. 47, p. 625-635
Непатентный документ 18: Strader, A. D. et al., Gastroenterology, 2005, vol. 128, p. 175-191
Непатентный документ 19: Campfield, L. A. et al., Science, 1995, vol. 269, p. 546-549
Непатентный документ 20: Tomoda, H. et al., J. Antibiot. (Tokyo), 1995, vol. 48, p. 937-941
Непатентный документ 21: Yang, D. J. et al., J. Antibiot. (Tokyo), 1996, vol. 49, p. 223-229
Непатентный документ 22: Tomoda, H. et al., J. Antibiot. (Tokyo), 1999, vol. 52, p. 689-694
Непатентный документ 23: Tabata, N. et al., Phytochemistry, 1997, vol. 46, p. 683-687
Непатентный документ 24: Gang Zhao et al., J. Med. Chem., 2008, vol. 51, p. 380-383
Раскрытие изобретения
Задачи, подлежащие решению согласно данному изобретению
Авторами были проведены тщательные исследования, направленные на изыскание соединений, проявляющих ингибирующее действие в отношении DGAT и подавляющее потребление пищи действие, и в результате было обнаружено, что соединения, имеющие конкретную химическую структуру, обладают превосходным ингибирующим действием в отношении DGAT, в частности высоким ингибирующим действием в отношении DGAT1. Авторами было также установлено, что эти соединения проявляют превосходное действие, направленное на подавление потребления пищи. Кроме того, авторами было обнаружено, что эти соединения являются полезными в качестве активного ингредиента для фармацевтических средств, предназначенных для предотвращения и/или лечения болезни, выбранной из группы, состоящей из тучности, ожирения, гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета у беременных, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, ишемической болезни сердца и булимии, или в качестве активного ингредианта для фармацевтических средств, предназначенных для лечения и/или предотвращения болезни, выбранной из группы, состоящей из гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета у беременных, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, гипертензии, цереброваскулярного расстройства, болезни коронарной артерии, жировой инфильтрации печени, дыхательной недостаточности, боли в нижнем отделе спины, остеоартрита коленного сустава, подагры и желчнокаменной болезни, вызванной ожирением.
Кроме того, авторами было обнаружено, что эти соединения также обладают высокой безопасностью, продолжительностью действия, незначительным переходом в центральную нервную систему и высокой ферментативной селективностью. Исходя из этих полученных данных, настоящее изобретение завершено.
Средство для решения поставленных задач
Настоящее изобретение относится к
(1) соединению, представленному общей формулой (I):

[где
R1 представляет собой фениламинокарбонильную группу, которая может быть замещена 1-5 группой(ами), независимо выбранными из замещающей группы A, гетероариламинокарбонильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A, бензоксазол-2-ильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A, бензотиазол-2-ильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A, (C1-C6 алкил, который может быть монозамещен C3-C6 циклоалкильной группой)аминокарбонильную группу, (C3-C6 циклоалкил)аминокарбонильную группу или адамантиламинокарбонильную группу;
R2 независимо представляет собой C1-С6 алкильную группу;
R3 представляет собой гетероциклическую группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A, группу, представленную формулой -C(=O)-O-R4, или группу, представленную формулой -C(=O)-N(R5)R6;
R4 представляет собой атом водорода, C1-С6 алкильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы В, или C3-С6 циклоалкильную группу, которая может быть монозамещенной карбоксильной группой;
R5 представляет собой атом водорода, С1-С6 алкильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы В, С3-С6 циклоалкильную группу, которая может быть монозамещенной карбоксильной группой, или гетероциклическую группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A;
R6 представляет собой атом водорода, C1-C6 алкильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы В, или C3-C6 циклоалкильную группу, которая может быть монозамещена карбоксильной группой;
в тех случаях, когда оба R5 и R6 представляют собой C1-C6 алкильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы B, их атомы углерода могут быть связаны друг с другом, образуя 4-6-членный насыщенный цикл;
X представляет собой атом кислорода, метиленовую группу, группу, представленную формулой -NH-, метиленовую группу, монозамещенную C1-C6 алкильной группой, или группу, представленную формулой -N(R7)-;
R7 представляет собой C1-C6 алкильную группу;
L представляет собой простую связь, метиленовую группу, 1,1-диметилметиленовую группу, этиленовую группу, группу, представленную формулой -CH=, или метиленовую группу, монозамещенную C1-C6 алкильной группой;
..... представляет собой простую связь или двойную связь (однако,..... представляет собой простую связь, когда L представляет собой группу, представленную формулой -CH=);
m представляет собой 1 или 2;
n представляет собой целое число, равное от 0 до 5;
Замещающая группа A представляет собой группу заместителей, выбранных из атома галогена, C1-С6 алкильной группы, C1-С6 галогенированной алкильной группы, C1-C6 алкоксигруппы, C1-C6 галогенированной алкоксигруппы, (C1-С6 алкокси)-(C1-С6 алкильной) группы, C1-C6 алкилтиогруппы, карбоксильной группы, C2-C7 алкилкарбонильной группы, C2-C7 алкоксикарбонильной группы, аминогруппы, моно-С2-С7 алкилкарбониламиногруппы, моно-C1-С6 алкилсульфониламиногруппы, моно-C1-C6 алкиламиногруппы, ди-(C1-С6 алкил)аминогруппы, цианогруппы, нитрогруппы, гидроксигруппы, C1-C6 алкилсульфинильной группы и оксогруппы; и
Замещающая группа В представляет собой группу заместителей, выбранных из C3-C6 циклоалкильной группы, фенильной группы, карбоксильной группы, аминогруппы и гидроксигруппы]
или его фармакологически приемлемой соли.
Предпочтительно, настоящее изобретение относится к
(2) соединению или его фармакологически приемлемой соли согласно (1), где
R1 представляет собой фениламинокарбонильную группу, которая может быть замещена 1-5 группой(ами), независимо выбранными из замещающей группы A, гетероариламиноаминокарбонильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A, бензоксазол-2-ильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы А, или бензотиазол-2-ильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A; R5 представляет собой атом водорода, C1-С6 алкильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы В, или C3-C6 циклоалкильную группу, которая может быть монозамещена карбоксильной группой; X представляет собой атом кислорода, метиленовую группу или группу, представленную формулой -NH-; L представляет собой простую связь, метиленовую группу, 1,1-диметилметиленовую группу, этиленовую группу или группу, представленную формулой -CH=; и замещающая группа A представляет собой группу заместителей, выбранных из атома галогена, C1-C6 алкильной группы, C1-C6 галогенированной алкильной группы, C1-С6 алкоксигруппы, C1-С6 галогенированной алкоксигруппы, (C1-C6 алкокси)-(C1-C6 алкильной) группы, C1-С6 алкилтиогруппы, карбоксильной группы, C2-C7 алкилкарбонильной группы, C2-C7 алкоксикарбонильной группы, аминогруппы, моно-С2-С7 алкилкарбониламиногруппы, моно-C1-C6 алкилсульфониламиногруппы, моно-C1-С6 алкиламиногруппы, ди-(C1-С6 алкил)аминогруппы, цианогруппы, нитрогруппы и гидроксигруппы;
(3) соединению или его фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II) или (III):

где
R представляет собой фенильную группу, которая может быть замещена 1-5 группой(ами), независимо выбранными из замещающей группы А, или С3-С6 циклоалкильную группу; и
R3, X и замещающая группа А такие, как определены в общей формуле (I);
(4) соединению или его фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II):

где
R представляет собой фенильную группу, которая может быть замещена 1-5 группой(ами), независимо выбранными из замещающей группы A, или C3-C6 циклоалкильную группу; и
R3, X и замещающая группа A такие, как определены в общей формуле (I);
(5) соединению или его фармакологически приемлемой соли согласно (3) или (4), где
R представляет собой фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, C1-С6 алкильной группы, С1-С6 галогенированной алкильной группы, C1-С6 алкоксигруппы и C1-C6 галогенированной алкоксигруппы, или C3-C6 циклоалкильную группу;
(6) соединению или его фармакологически приемлемой соли согласно (3) или (4), где
R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 4-трифторметилфенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу, 2,4,5-трифторфенильную группу, 3,4,5-трифторфенильную группу или циклопентильную группу;
(7) соединению или его фармакологически приемлемой соли согласно (3) или (4), где
R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу или 2,4,5-трифторфенильную группу;
(8) соединению или его фармакологически приемлемой соли согласно (3) или (4), где
R представляет собой 2-фторфенильную группу, 3-изопропилфенильную группу, 3-этоксифенильную группу, 2-этокси-5-фторфенильную группу, 2,4,5-трифторфенильную группу или 3,4,5-трифторфенильную группу;
(9) соединению или его фармакологически приемлемой соли согласно любому из (1)-(8), где
R3 представляет собой гетероциклическую группу, способную служить в качестве эквивалента карбоновой кислоты или карбоксильной группы;
(10) соединению или его фармакологически приемлемой соли согласно любому из (1)-(8), где
R3 представляет собой 4-карбоксиоксазол-2-ильную группу, 5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-ильную группу, 5-гидрокси-2H-пиразол-3-ильную группу, 3-гидроксиизоксазол-5-ильную группу, тетразол-5-ильную группу или карбоксильную группу;
(11) соединению или его фармакологически приемлемой соли согласно любому из (1)-(8), где
R3 представляет собой карбоксильную группу;
(12) соединению или его фармакологически приемлемой соли согласно любому из (1)-(11), где
X представляет собой атом кислорода или метиленовую группу;
(13) соединению или его фармакологически приемлемой соли согласно любому из (1)-(11), где
X представляет собой атом кислорода;
(14) соединению или фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II) или (III), где R представляет собой фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, C1-C6 алкильной группы, C1-С6 галогенированной алкильной группы, C1-C6 алкоксигруппы и C1-C6 галогенированной алкоксигруппы, или C3-C6 циклоалкильную группу; R3 представляет собой гетероциклическую группу, способную служить в качестве эквивалента карбоновой кислоты или карбоксильной группы ; и X представляет собой атом кислорода или метиленовую группу;
(15) соединению или фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II) или (III), где R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 4-трифторметилфенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу, 2,4,5-трифторфенильную группу, 3,4,5-трифторфенильную группу или циклопентильную группу; R3 представляет собой 4-карбоксиоксазол-2-ильную группу, 5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-ильную группу, 5-гидрокси-2H-пиразол-3-ильную группу, 3-гидроксиизоксазол-5-ильную группу, тетразол-5-ильную группу или карбоксильную группу; и X представляет собой атом кислорода;
(16) соединению или его фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II) или (III), где R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу или 2,4,5-трифторфенильную группу; R3 представляет собой карбоксильную группу; и X представляет собой атом кислород;
(17) соединению или его фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II), где R представляет собой фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, C1-С6 алкильной группы, C1-С6 галогенированной алкильной группы, C1-С6 алкоксигруппы и C1-С6 галогенированной алкоксигруппы, или С3-С6 циклоалкильную группу; R3 представляет собой гетероциклическую группу, способную служить в качестве эквивалента карбоновой кислоты или карбоксильной группы; и X представляет собой атом кислорода или метиленовую группу;
(18) соединению или его фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II), где R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 4-трифторметилфенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу, 2,4,5-трифторфенильную группу, 3,4,5-трифторфенильную группу или циклопентильную группу; R3 представляет собой 4-карбоксиоксазол-2-ильную группу, 5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-ильную группу, 5-гидрокси-2H-пиразол-3-ильную группу, 3-гидрокси-изоксазол-5-ильную группу, тетразол-5-ильную группу или карбоксильную группу; и X представляет собой атом кислорода;
(19) соединению или его фармакологически приемлемой соли согласно (1), где
общая формула (I) представляет собой общую формулу (II), где R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу или 2,4,5-трифторфенильную группу; R3 представляет собой карбоксильную группу; и X представляет собой атом кислорода;
(20) соединению или его фармакологически приемлемой соли согласно (1), где соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
t-4-карбоксиметил-c-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
[4-(2-{6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-ил}-2-оксоэтил)циклогексил]уксусную кислоту,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-м-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-циклопентилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
t-4-карбоксиметил-трет-2-метил-r-1-циклогексиловый эфир 6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
t-4-карбоксиметил-трет-2-метил-r-1-циклогексиловый эфир 6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты или
t-4-карбоксиметил-трет-2-метил-r-1-циклогексиловый эфир 6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты;
(21) соединению или его фармакологически приемлемой соли согласно (1), и это соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-м-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты или
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты;
(22) соединению согласно (1), и это соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-м-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты или
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты;
(23) соединению или его фармакологически приемлемой соли согласно (1), и это соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-фтор-2-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этокси-5-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-метокси-5-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
t-4-карбоксиметил-c-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты или
t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты;
(24) соединению или его фармакологически приемлемой соли согласно (1), и это соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этокси-5-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
t-4-карбоксиметил-c-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты или
t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты;
(25) соединению согласно (1), и это соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этокси-5-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты,
t-4-карбоксиметил-c-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты или
t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты;
(26) ингибитору ацил-кофермента A: диацилглицерин-ацилтрансферазы, содержащему в качестве активного ингредиента соединение или его фармакологически приемлемую соль согласно любому из (1)-(25);
(27) препарату для подавления потребления пищи и/или анорексигенному средству, содержащему в качестве активного ингредиента соединение или его фармакологически приемлемую соль согласно любому из (1)-(25);
(28) фармацевтической композиции, содержащей в качестве активного ингредиента соединение или его фармакологически приемлемую соль согласно любому из (1)-(25);
(29) фармацевтической композиции согласно (28), и эта фармацевтическая композиция обладает ингибирующим действием в отношении ацил-кофермента A: диацилглицерин-ацилтрансферазы;
(30) фармацевтической композиции согласно (28), и эта фармацевтическая композиция обладает подавляющим потребление пищи действием и/или анорексигенным (снижающим аппетит) действием;
(31) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначена для лечения и/или предотвращения болезни, лечение и/или предотвращение которой направлены на ингибирование действия ацил-кофермента А: диацилглицерин-ацилтрансферазы;
(32) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначена для лечения и/или предотвращения болезни, вызванной повышенной активностью ацил-кофермента А: диацилглицерин-ацилтрансферазы;
(33) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначена для лечения и/или предотвращения болезни, симптомы проявления которой лечат, подвергают воздействию с положительной динамикой, смягчают и/или предотвращают путем ингибирования ацил-кофермента A: диацилглицерин-ацилтрансферазы так, что подавляется синтез триглицеридов, что приводит к подавлению абсорбции триглицеридов;
(34) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначается для лечения и/или предотвращения болезни, симптомы проявления которой лечат, подвергают воздействию с положительной динамикой, смягчают и/или предотвращают путем ингибирования ацил-кофермента A: диацилглицерин-ацилтрансферазы так, что подавляется синтез триглицеридов;
(35) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначается для лечения и/или предотвращения тучности, ожирения, гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета при беременности, неалкогольного стеатогепатита (жирового гепатита), синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, ишемической болезни сердца или булимии;
(36) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначается для лечения и/или предотвращения тучности или ожирения;
(37) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначается для лечения и/или предотвращения гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета у беременных, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, гипертензии, цереброваскулярного расстройства, болезни коронарной артерии, жировой инфильтрации печени, дыхательной недостаточности, боли в нижнем отделе спины, остеоартрита коленного сустава, подагры или желчнокаменной болезни, вызванной ожирением;
(38) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначается для лечения и/или предотвращения гиперлипидемии, гипертриглицеридемии, диабета, артериосклероза или гипертензии, вызванной ожирением;
(39) фармацевтической композиции согласно (28), и эта фармацевтическая композиция предназначается для подавления абсорбции жиров из тонкой кишки;
(40) применению соединения или его фармакологически приемлемой соли согласно любому из (1)-(25) для получения фармацевтической композиции;
(41) применению согласно (40), где фармацевтическая композиция представляет собой композицию, предназначенную для ингибирования ацил-кофермента А: диацилглицерин-ацилтрансферазы;
(42) применению согласно (40), где фармацевтическая композиция представляет собой композицию, предназначенную для подавления потребления пищи и/или аппетита;
(43) применению согласно (40), где фармацевтическая композиция представляет собой композицию, предназначенную для лечения и/или предотвращения тучности, ожирения, гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета при беременности, неалкогольного жирового гепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, ишемической болезни сердца или булимии;
(44) применению согласно (40), где фармацевтическая композиция представляет собой композицию, предназначенную для лечения и/или предотвращения тучности или ожирения;
(45) применению согласно (40), где фармацевтическая композиция представляет собой композицию, предназначенную для лечения и/или предотвращения гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макрооангиопатию), катаракты, сахарного диабета у беременных, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, гипертензии, цереброваскулярного расстройства, болезни коронарной артерии, жировой инфильтрации печени, дыхательной недостаточности, боли в нижнем отделе спины, остеоартрита коленного сустава, подагры или желчнокаменной болезни, вызванной ожирением;
(46) применению согласно (40), где фармацевтическая композиция представляет собой композицию, предназначенную для лечения и/или предотвращения гиперлипидемии, гипертриглицеридемии, диабета, артериосклероза или гипертензии, вызванной ожирением;
(47) применению согласно (40), где фармацевтическая композиция представляет собой композицию, предназначенную для подавления абсорбции жиров из тонкой кишки;
(48) способу ингибирования ацил-кофермента A: диацилглицерин-ацилтрансферазы, включающему введение теплокровному животному фармакологически эффективного количества соединения или его фармакологически приемлемой соли согласно любому из (1)-(25);
(49) способу подавления потребления пищи и/или аппетита, включающему введение фармакологически эффективного количества соединения или его фармакологически приемлемой соли согласно любому из (1)-(25) теплокровному животному;
(50) способу лечения и/или предотвращения болезни, включающему введение фармакологически эффективного количества соединения или его фармакологически приемлемой соли согласно любому из (1)-(25) теплокровному животному;
(51) способу согласно (50), где болезнь представляет собой тучность, ожирение, гиперлипидемию, гипертриглицеридемию, липидоз, синдром инсулинорезистентности, нарушение толерантности к глюкозе, диабет, диабетические осложнения (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракту, сахарный диабет при беременности, неалкогольный стеатогепатит, синдром поликистоза яичников, артериосклероз, атеросклероз, диабетический атеросклероз, ишемическую болезнь сердца или булимию;
(52) способу согласно (50), где болезнь представляет собой тучность или ожирение;
(53) способу согласно (50), где болезнь представляет собой гиперлипидемию, гипертриглицеридемию, липидоз, синдром инсулинорезистентности, нарушение толерантности к глюкозе, диабет, диабетические осложнения (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракту, сахарный диабет при беременности, неалкогольный стеатогепатит, синдром поликистоза яичников, артериосклероз, атеросклероз, диабетический атеросклероз, гипертензию, цереброваскулярное расстройство, болезнь коронарной артерии, жировую инфильтрацию печени, дыхательную недостаточность, боль в нижнем отделе спины, остеоартрит коленного сустава, подагру или желчнокаменную болезнь, вызванную ожирением;
(54) способу согласно (50), где болезнь представляет собой гиперлипидемию, гипертриглицеридемию, диабет, артериосклероз или гипертензию, обусловленную ожирением;
(55) способу подавления абсорбции жиров из тонкой кишки, включающему введение теплокровному животному фармакологически эффективного количества соединения или его фармакологически приемлемой соли согласно любому из (1)-(25); и
(56)способу согласно любому из (48)-(55), где теплокровным животным является человек.
В настоящем изобретении термин "атом галогена" относится к атому фтора, атому хлора, атому брома или атому йода. Атом галогена представляет собой предпочтительно атом фтора или атом хлора и более предпочтительно атом фтора.
В настоящем изобретении термин "C1-C6 алкильная группа" относится к прямой или разветвленной алкильной группе, содержащей от 1 до 6 атомов углерода. Примеры такой группы включают метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, 2-метилбутильную группу, неопентильную группу, 1-этилпропильную группу, гексильную группу, изогексильную группу, 4-метилпентильную группу, 3-метилпентильную группу, 2-метилпентильную группу, 1-метилпентильную группу, 3,3-диметилбутильную группу, 2,2-диметилбутильную группу, 1,1-диметилбутильную группу и 1,2-диметилбутильную группу. C1-C6 алкильная группа представляет собой предпочтительно прямую или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода (C1-C4 алкильная группа), более предпочтительно метильную группу или этильную группу (C1-C2 алкильная группа) и еще более предпочтительно метильную группу для R2 и R7.
В настоящем изобретении термин "C1-C6 галогенированная алкильная группа" относится к группе, в которой от 1 до 5 вышеупомянутых "атомов галогена", одинаковых или отличных друг от друга, связаны с вышеупомянутой "C1-С6 алкильной группой. Примеры вышеуказанной группы включают трифторметильную группу, трихлорметильную группу, дифторметильную группу, дихлорметильную группу, дибромметильную группу, фторметильную группу, 2,2,2-трифторэтильную группу, 2,2,2-трихлорэтильную группу, 2-бромэтильную группу, 2-хлорэтильную группу и 2-фторэтильную группу. C1-C6 галогенированная алкильная группа представляет собой предпочтительно группу, в которой от 1 до 5 одинаковых или различных вышеупомянутых "атомов галогена" связаны с вышеупомянутой "C1-C4 алкильной группой" (C1-C4 галогенированная алкильная группа), более предпочтительно группу, в которой от 1 до 5 одинаковых или различных вышеупомянутых "атомов галогена" связаны с вышеупомянутой "C1-C2 алкильной группой" (C1-C2 галогенированная алкильная группа), и еще более предпочтительно трифторметильную группу.
В настоящем изобретении "C1-С6 алкоксигруппа" относится к группе, в которой вышеупомянутая "C1-С6 алкильная группа" связана с атомом кислорода, и представляет собой прямую или разветвленную алкоксигруппу, содержащую от 1 до 6 атомов углерода. Примеры вышеуказанной группы включают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, пентоксигруппу, 2-метилбутоксигруппу, 3-этилпропоксигруппу, гексилоксигруппу и 2,3-диметилбутоксигруппу. C1-C6 алкоксигруппа представляет собой предпочтительно прямую или разветвленную алкоксигруппу, содержащую от 1 до 4 атомов углерода (C1-C4 алкоксигруппа), и более предпочтительно метоксигруппу или этоксигруппу (C1-C2 алкоксигруппа).
В настоящем изобретении термин "С1-С6 галогенированная алкоксигруппа" относится к группе, в которой от 1 до 5 одинаковых или отличных друг от друга вышеупомянутых "атомов галогена" связаны с вышеупомянутой "C1-С6 алкоксигруппой". Примеры вышеуказанной группы включают трифторметоксигруппу, трихлорметоксигруппу, дифторметоксигруппу, дихлорметоксигруппу, дибромметоксигруппу, фторметоксигруппу, 2,2,2-трифторэтоксигруппу, 2,2,2-трихлорэтоксигруппу, 2-фторэтоксигруппу и пентафторэтоксигруппу. C1-С6 галогенированная алкоксигруппа представляет собой предпочтительно группу, в которой от 1 до 5 одинаковых или отличных друг от друга вышеупомянутых "атомов галогена" связаны с вышеупомянутой "C1-C4 алкоксигруппой" (C1-C4 галогенированная алкоксигруппа), более предпочтительно группу, в которой от 1 до 5 одинаковых или различных вышеупомянутых "атомов галогена" связаны с вышеупомянутой "C1-C2 алкоксигруппой" (C1-C2 галогенированная алкоксигруппа), и еще более предпочтительно трифторметоксигруппу.
В настоящем изобретении термин "(C1-C6 алкокси)-(C1-C6 алкильная) группа" относится к группе, в которой одна вышеупомянутая "C1-С6 алкоксигруппа" связана с вышеупомянутой "C1-С6 алкильной группой". Примеры вышеопределенной группы включают метоксиметильную группу, этоксиметильную группу, пропоксиметильную группу, изопропоксиметильную группу, бутоксиметильную группу, втор-бутоксиметильную группу, трет-бутоксиметильную группу, 2-метоксиэтильную группу и 3-изопропоксипропильную группу. (C1-С6 алкокси)-(С1-С6 алкильная) группа представляет собой предпочтительно группу, в которой одна вышеупомянутая "C1-C4 алкоксигруппа" связана с вышеупомянутой "C1-C4 алкильной группой" ((C1-C4 алкокси)-(C1-C4 алкильная) группа), более предпочтительно группу, в которой одна вышеупомянутая "C1-C2 алкоксигруппа" связана с вышеупомянутой "C1-C2 алкильной группой" ((C1-C2 алкокси)-(C1-C2 алкильная) группа), и еще более предпочтительно метоксиметильную группу.
В настоящем изобретении термин "C1-C6 алкилтиогруппа" относится к группе, в которой одна вышеупомянутая "C1-С6 алкильная группа" связана с атомом серы, и представляет собой прямую или разветвленную алкилтиогруппу, содержащую от 1 до 6 атомов углерода. Примеры вышеопределенной группы включают метилтиогруппу, этилтиогруппу, пропилтиогруппу, изопропилтиогруппу, бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, пентилтиогруппу, 1-этилпропилтиогруппу и гексилтиогруппу. C1-C6 алкилтиогруппа представляет собой предпочтительно прямую или разветвленную алкилтиогруппу, содержащую от 1 до 4 атомов углерода (C1-C4 алкилтиогруппа), более предпочтительно метилтиогруппу или этилтиогруппу (C1-C2 алкилтиогруппа) и еще более предпочтительно метилтиогруппу.
В настоящем изобретении термин "C1-C6 алкилсульфинильная группа" относится к группе, в которой одна вышеупомянутая "C1-С6 алкильная группа" связана с сульфинильной группой, и представляет собой прямую или разветвленную алкилсульфинильную группу, содержащую от 1 до 6 атомов углерода. Примеры вышеопределенной группы включают метилсульфинильную группу, этилсульфинильную группу, пропилсульфинильную группу, изопропилсульфинильную группу, бутилсульфинильную группу, пентилсульфинильную группу и гексилсульфинильную группу. C1-C6 алкилсульфинильная группа представляет собой предпочтительно прямую или разветвленную алкилсульфинильную группу, содержащую от 1 до 4 атомов углерода (C1-C4 алкилсульфинильная группа), более предпочтительно метилсульфинильную группу или этилсульфинильную группу (C1-C2 алкилсульфинильная группа) и еще более предпочтительно метилсульфинильную группу.
В настоящем изобретении термин "C2-C7 алкилкарбонильная группа" относится к группе, в которой одна вышеупомянутая "C1-С6 алкильная группа" связана с карбонильной группой. Примеры вышеопределенной группы включают ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, пентаноильную группу, пивалоильную группу и валерильную группу. C2-С7 алкилкарбонильная группа представляет собой предпочтительно группу, в которой одна вышеупомянутая "C1-C4 алкильная группа" связана с карбонильной группой (C2-C5 алкилкарбонильная группа), более предпочтительно ацетильную группу или пропионильную группу (C2-C3 алкилкарбонильная группа) и еще более предпочтительно ацетильную группу.
В настоящем изобретении термин "C2-C7 алкоксикарбонильная группа" относится к группе, в которой одна вышеупомянутая "C1-С6 алкоксигруппа" связана с карбонильной группой. Примеры вышеопределенной группы включают метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, изопропоксикарбонильную группу, бутоксикарбонильную группу, изобутоксикарбонильную группу, втор-бутоксикарбонильную группу и трет-бутоксикарбонильную группу. C2-C7 алкоксикарбонильная группа представляет собой предпочтительно группу, в которой одна вышеопределенная "C1-C4 алкоксигруппа" связана с карбонильной группой (C2-C5 алкоксикарбонильная группа), более предпочтительно метоксикарбонильную группу или этоксикарбонильную группу (C2-C3 алкоксикарбонильная группа) и еще более предпочтительно метоксикарбонильную группу.
В настоящем изобретении термин "моно-C2-C7 алкилкарбониламиногруппа" относится к группе, в которой карбонильная группа, к которой присоединена одна вышеупомянутая "C1-С6 алкильная группа", связана с аминогруппой. Примеры вышеопределенной группы включают ацетамидную группу, этилкарбониламиногруппу, пропилкарбониламиногруппу, изопропилкарбониламиногруппу, бутилкарбониламиногруппу и изобутилкарбониламиногруппу. Моно-C2-C7 алкилкарбониламиногруппа представляет собой предпочтительно группу, в которой карбонильная группа, к которой присоединена одна вышеупомянутая "С1-С4 алкильная группа", связана с аминогруппой (моно-C2-C5 алкилкарбониламиногруппа), более предпочтительно ацетамидную группу или этилкарбониламиногруппу (моно-С2-С3 алкилкарбониламиногруппа) и еще более предпочтительно ацетамидную группу.
В настоящем изобретении термин "моно-C1-C6 алкилсульфониламиногруппа" относится к группе, в которой сульфонильная группа, к которой присоединена одна вышеупомянутая "C1-С6 алкильная группа", связана с аминогруппой. Примеры вышеопределенной группы включают метилсульфониламиногруппу, этилсульфониламиногруппу, пропилсульфониламиногруппу, изопропилсульфониламиногруппу, бутилсульфониламиногруппу, трет-бутилсульфониламиногруппу и 2-этилбутилсульфониламиногруппу. Моно-C1-C6 алкилсульфониламиногруппа представляет собой предпочтительно группу, в которой сульфонильная группа, к которой присоединена одна вышеупомянутая "C1-C4 алкильная группа", связана с аминогруппой (моно-C1-C4 алкилсульфониламиногруппа), более предпочтительно метилсульфониламиногруппу или этилсульфониламиногруппу (моно-C1-C2 алкилсульфониламиногруппа) и еще более предпочтительно метилсульфониламиногруппу.
В настоящем изобретении термин "моно-С1-С6 алкиламиногруппа" относится к группе, в которой одна вышеупомянутая "C1-С6 алкильная группа" связана с аминогруппой. Примеры вышеопределенной группы включают метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу, бутиламиногруппу, изобутиламиногруппу, втор-бутиламиногруппу, трет-бутиламиногруппу, пентиламиногруппу, изопентиламиногруппу, 2-метилбутиламиногруппу, неопентиламиногруппу, 1-этилпропиламиногруппу, гексиламиногруппу и изогексиламиногруппу. Моно-C1-С6 алкиламиногруппа представляет собой предпочтительно группу, в которой одна вышеупомянутая "C1-C4 алкильная группа" связана с аминогруппой (моно-C1-C4 алкиламиногруппа), более предпочтительно метиламиногруппу или этиламиногруппу (моно-С1-С2 алкиламиногруппа) и еще более предпочтительно метиламиногруппу.
В настоящем изобретении термин "ди-(C1-C6 алкил)аминогруппа" относится к группе, в которой две из одинаковых или отличных друг от друга вышеупомянутых "С1-C6 алкильных групп" связаны с аминогруппой. Примеры вышеопределенной группы включают диметиламиногруппу, диэтиламиногруппу, дипропиламиногруппу, диизопропиламиногруппу, дибутиламиногруппу, диизобутиламиногруппу, дипентиламиногруппу, диизопентиламиногруппу, динеопентиламиногруппу, дигексиламиногруппу, N-этил-N-метиламиногруппу, N-метил-N-пропиламиногруппу, N-изопропил-N-метиламиногруппу, N-бутил-N-метиламиногруппу, N-изобутил-N-метиламиногруппу, N-метил-N-пентиламиногруппу, N-изопентил-N-метиламиногруппу, N-этил-N-пропиламиногруппу, N-этил-N-изопропиламиногруппу, N-бутил-N-этиламиногруппу и N-этил-N-изопентиламиногруппу. Ди-(C1-С6 алкил)аминогруппа представляет собой предпочтительно группу, в которой две из одинаковых или различных вышеупомянутых "C1-C4 алкильных групп" связаны с аминогруппой (ди-(C1-C4 алкил)аминогруппа), более предпочтительно диметиламиногруппу, диэтиламиногруппу или N-этил-N-метиламиногруппу (ди-(C1-C2 алкил)аминогруппа) и еще более предпочтительно диметиламиногруппу.
В настоящем изобретении термин "C3-C6 циклоалкильная группа" относится к циклопропильной группе, циклобутильной группе, циклопентильной группе или циклогексильной группе и представляет собой предпочтительно циклопентильную группу для R или циклопропильную группу для других частей.
В настоящем изобретении термин "фениламинокарбонильная группа, которая может быть замещена 1-5 группой(ами), независимо выбранными из замещающей группы A", относится к группе, в которой аминогруппа, к которой присоединена фенильная группа (которая может быть замещена 1-5 группой(ами), независимо выбранными из замещающей группы A), связана с карбонильной группой и представляет собой предпочтительно фениламинокарбонильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, С1-С6 алкильной группы, С1-С6 галогенированной алкильной группы, С1-С6 алкоксигруппы и С1-С6 галогенированной алкоксигруппы, более предпочтительно фениламинокарбонильную группу, 2-фторфениламинокарбонильную группу, 3-фторфениламинокарбонильную группу, 3-метилфениламинокарбонильную группу, 3-этилфениламинокарбонильную группу, 3-метоксифениламинокарбонильную группу, 3-этоксифениламинокарбонильную группу, 4-трифторметилфениламинокарбонильную группу, 3-трифторметоксифениламинокарбонильную группу, 3,4-дифторфениламинокарбонильную группу, 2-фтор-5-метоксифениламинокарбонильную группу, 2,4,5-трифторфениламинокарбонильную группу или 3,4,5-трифторфениламинокарбонильную группу и еще более предпочтительно фениламинокарбонильную группу, 2-фторфениламинокарбонильную группу, 3-фторфениламинокарбонильную группу, 3-метилфениламинокарбонильную группу, 3-этилфениламинокарбонильную группу, 3-метоксифениламинокарбонильную группу, 3-этоксифениламинокарбонильную группу, 3-трифторметоксифениламинокарбонильную группу, 3,4-дифторфениламинокарбонильную группу, 2-фтор-5-метоксифениламинокарбонильную группу или 2,4,5-трифторфениламинокарбонильную группу.
В настоящем изобретении "фенильная группа, которая может быть замещена 1-5 группой(ами), независимо выбранными из замещающей группы A", представляет собой предпочтительно фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, C1-C6 алкильной группы, C1-C6 галогенированной алкильной группы, C1-C6 алкоксигруппы и C1-C6 галогенированной алкоксигруппы, более предпочтительно фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 4-трифторметилфенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу, 2,4,5-трифторфенильную группу или 3,4,5-трифторфенильную группу и еще более предпочтительно фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу или 2,4,5-трифторфенильную группу.
В настоящем изобретении термин "гетероарильная группа" относится к 4-7-членной гетероарильной группе, которая содержит от 1 до 3 атома(ов) серы, атома(ов) кислорода и/или атома(ов) азота и может, кроме того, содержать 1 или 2 атома азота, и в которой атом(ы) серы может быть связан с 2 атомами кислорода. Примеры вышеопределенной группы включают фурильную группу, тиенильную группу, пирролильную группу, азепинильную группу, пиразолильную группу, имидазолильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу, 1,3,4-оксадиазолильную группу, 1,3,4-тиадиазолильную группу, триазолильную группу, тетразолильную группу, тиадиазолильную группу, пиранильную группу, пиридильную группу, пиридазинильную группу, пиримидинильную группу и пиразинильную группу. Гетероарильная группа может быть конденсирована с другой ароматической циклической группой, такой как бензольное кольцо. Примеры такой гетероарильной группы включают бензотиенильную группу, бензотиазолильную группу, бензоксазолильную группу, хинолильную группу и индолильную группу. Гетероарильная группа представляет собой предпочтительно пиразолильную группу, изоксазолильную группу, тиазолильную группу, пиридильную группу или пиразинильную группу и более предпочтительно 5-пиразолильную группу, 3-изоксазолильную группу, 2-тиазолильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу или 2-пиразинильную группу.
В настоящем изобретении "гетероариламинокарбонильная группа, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A," относится к группе, в которой аминогруппа, к которой присоединена вышеупомянутая "гетероарильная группа" (которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A), связана с карбонильной группой, и представляет собой предпочтительно пиразолильную, изоксазолильную, тиазолильную, пиридильную или пиразинильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, C1-С6 алкильной группы и C1-С6 алкоксигруппы, более предпочтительно 5-пиразолильную, 3-изоксазолильную, 2-тиазолильную, 2-пиридильную, 3-пиридильную, 4-пиридильную или 2-пиразинильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома хлора, метильной группы и метоксигруппы.
В настоящем изобретении "бензоксазол-2-ильная группа, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A", представляет собой предпочтительно бензоксазол-2-ильную группу или 6-хлорбензоксазол-2-ильную группу.
В настоящем изобретении "бензотиазол-2-ильная группа, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A", представляет собой предпочтительно бензотиазол-2-ильную группу.
В настоящем изобретении "(C1-C6 алкил, который может быть монозамещен C3-C6 циклоалкильной группой)аминокарбонильная группа" относится к группе, в которой аминогруппа, к которой присоединена вышеупомянутая "C1-C6 алкильная группа" (которая может быть монозамещена вышеупомянутой "С3-С6 циклоалкильной группой"), связана с карбонильной группой и представляет собой предпочтительно циклогексилметиламинокарбонильную группу.
В настоящем изобретении "(C3-C6 циклоалкил)аминокарбонильная группа" представляет собой циклопропиламинокарбонильную группу, циклобутиламинокарбонильную группу, циклопентиламинокарбонильную группу или циклогексиламинокарбонильную группу, предпочтительно циклопентиламинокарбонильную группу или циклогексиламинокарбонильную группу и более предпочтительно циклопентиламинокарбонильную группу.
В настоящем изобретении "гетероциклическая группа" относится к 4-7-членной гетероциклической группе, которая содержит от 1 до 3 атомов серы, атомов кислорода и/или атомов азота и может, кроме того, содержать 1 или 2 атома азота и в которой атом(ы) серы может быть связан с 2 атомами кислорода. Примеры вышеопределенной группы включают "ароматическую гетероциклическую группу", такую как фурильная группа, тиенильная группа, пирролильная группа, азепинильная группа, пиразолильная группа, имидазолильная группа, оксазолильная группа, изоксазолильная группа, тиазолильная группа, изотиазолильная группа, 1,3,4-оксадиазолильная группа, 1,3,4-тиадиазолильная группа, триазолильная группа, тетразолильная группа, тиадиазолильная группа, пиранильная группа, пиридильная группа, пиридазинильная группа, пиримидинильная группа и пиразинильная группа; и "частично или полностью восстановленную насыщенную гетероциклическую группу", такую как тетрагидропиранильную группу, тетрагидротиенильную группу, морфолинильную группу, тиоморфолинильную группу, пирролидинильную группу, пирролинильную группу, имидазолидинильную группу, пиразолидинильную группу, пиперидинильную группу, пиперазинильную группу, оксазолинильную группу, оксазолидинильную группу, изоксазолидинильную группу, тиазолинильную группу, тиазолидинильную группу, диоксоланильную группу, диоксанильную группу и 5,6-дигидро-4H-1,3-оксазиновую группу. Гетероциклическая группа может быть конденсирована с другой циклической группой, такой как бензольное кольцо ("конденсированная гетеробициклическая группа"). Примеры такой конденсированной гетеробициклической группы включают бензотиенильную группу, бензотиазолильную группу, бензоксазолильную группу, изобензофуранильную группу, 1,3-дигидроизобензофуранильную группу, хинолильную группу, 1,3-бензодиоксоланильную группу, 1,4-бензодиоксанильную группу, индолильную группу, изоиндолильную группу и индолинильную группу. Гетероциклическая группа представляет собой предпочтительно оксазольную группу, 4,5-дигидро[1,2,4]оксадиазольную группу, пиразольную группу, изоксазольную группу или тетразольную группу и более предпочтительно оксазол-2-ильную группу, 4,5-дигидро-[1,2,4]оксадиазол-3-ильную группу, 2H-пиразол-3-ильную группу, изоксазол-5-ильную группу или тетразол-5-ильную группу.
В настоящем изобретении "эквивалент карбоновой кислоты (карбоксильной группы)" относится к гидроксамовой кислоте (R-CO-NH-OH), ацилцианамиду (R-CO-NH-CN) или ацилсульфонамиду (R-CO-NH-SO2-R'); планарным гетероциклам (например, тетразол) или непланарным кислотным группам, содержащим серу или фосфор. Они демонстрируют in vivo химические, биологические, физические и физиохимические свойства и поведения, подобные перечисленным свойствам и поведению карбоновой кислоты, и имеют кислотность, эквивалентную кислотности карбоновой кислоты. Например, в документе (The Practice of Medicinal Chemistry (First Part), p. 248, TECHNOMICS, INC., First Edition) сообщается о функциональных группах или гетероциклах, таких как гидроксамовая кислота, ацилцианамид, тетразол, меркаптазол, сульфинилазол, сульфонилазол, изоксазол, изотиазол, гидрокситиадиазол, гидрокси-γ-пирон, фосфиновая кислота, фосфоновая кислота, фосфонамид, сульфоновая кислота, сульфонамид и ацилсульфонамид. Другие такие эквиваленты карбоновой кислоты описаны, например, в Bioorg. Med. Chem. Lett. 15 (2005) 4053-4056; and Lipinski, C. A. and Chenard, B. L. Pestic. Sci. 1990, 290, 227-240.
В настоящем изобретении примеры "гетероциклической группы, способной служить в качестве эквивалента карбоновой кислоты", включают 4-карбоксиоксазол-2-ильную группу, 5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-ильную группу, 5-гидрокси-2H-пиразол-3-ильную группу, 3-гидроксиизоксазол-5-ильную группу и тетразол-5-ильную группу.
В настоящем изобретении "гетероциклическая группа, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A", относится к вышеупомянутой "гетероциклической группе", которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы A, и представляет собой предпочтительно гетероциклическую группу, способную служить в качестве эквивалента карбоновой кислоты, и более предпочтительно 4-карбоксиоксазол-2-ильную группу, 5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-ильную группу, 5-гидрокси-2H-пиразол-3-ильную группу, 3-гидроксиизоксазол-5-ильную группу или тетразол-5-ильную группу для R3 или более предпочтительно тетразол-5-ильную группу для R5.
В настоящем изобретении "группа, представленная формулой -C(=O)-O-R4", представляет собой предпочтительно карбоксильную группу.
В настоящем изобретении "группа, представленная формулой -C(=О)-N(R5)R6", представляет собой предпочтительно 1-карбокси-1-метил-1-этилкарбамоильную группу.
В настоящем изобретении "C1-C6 алкильная группа, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы B" относится к вышеупомянутой "C1-С6 алкильной группе", которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы B, и представляет собой предпочтительно метильную группу или 2,3-дигидропропильную группу для R4 или предпочтительно метильную группу, карбоксиметильную группу, 1-карбокси-1-этильную группу или 1-карбокси-1-метил-1-этильную группу для R5 и R6.
В настоящем изобретении "C3-C6 циклоалкильная группа, которая может быть монозамещена карбоксильной группой", относится к вышеупомянутой "C3-C6 циклоалкильной группе", которая может быть монозамещена карбоксильной группой, и представляет собой предпочтительно 1-карбоксициклопропильную группу.
В настоящем изобретении "4-6-членный насыщенный цикл" в предложении "в тех случаях, когда как R5, так и R6 представляют собой C1-С6 алкильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы B, их атомы углерода могут быть связаны друг с другом с образованием 4-6-членного насыщенного цикла", относится к 4-6-членному насыщенному циклу, образованному посредством связи между углеродными атомами C1-С6 алкильной группы, представляющей R5, и C1-С6 алкильной группы, представляющей R6, вместе с атомом азота, соответствующим образом связанного с R5 и R6. 4-6-членный насыщенный цикл представляет собой предпочтительно пирролидиновую группу.
В настоящем изобретении "метиленовая группа, монозамещенная C1-C6 алкильной группой", относится к метиленовой группе, монозамещенной “C1-C6 алкильной группой”, иллюстрированной выше, и представляет собой предпочтительно метилметиленовую группу.
В настоящем изобретении "группа, представленная формулой -N(R7)-", представляет собой предпочтительно группу, представленную формулой -N(CH3)-.
В настоящем изобретении общая формула (I) представляет собой предпочтительно общую формулу (II) или (III), более предпочтительно общую формулу (II).
В настоящем изобретении R1 представляет собой предпочтительно фениламинокарбонильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, C1-С6 алкильной группы, C1-С6 галогенированной алкильной группы, C1-С6 алкоксигруппы и C1-С6 галогенированной алкоксигруппы, или (С3-С6 циклоалкил)аминокарбонильную группу, более предпочтительно фениламинокарбонильную группу, 2-фторфениламинокарбонильную группу, 3-фторфениламинокарбонильную группу, 3-метилфениламинокарбонильную группу, 3-этилфениламинокарбонильную группу, 3-метоксифениламинокарбонильную группу, 3-этоксифениламинокарбонильную группу, 4-трифторметилфениламинокарбонильную группу, 3-трифторметоксифениламинокарбонильную группу, 3,4-дифторфениламинокарбонильную группу, 2-фтор-5-метоксифениламинокарбонильную группу, 2,4,5-трифторфениламинокарбонильную группу, 3,4,5-трифторфениламинокарбонильную группу или циклопентиламинокарбонильную группу и еще более предпочтительно фениламинокарбонильную группу, 2-фторфениламинокарбонильную группу, 3-фторфениламинокарбонильную группу, 3-метилфениламинокарбонильную группу, 3-этилфениламинокарбонильную группу, 3-метоксифениламинокарбонильную группу, 3-этоксифениламинокарбонильную группу, 3-трифторметоксифениламинокарбонильную группу, 3,4-дифторфениламинокарбонильную группу, 2-фтор-5-метоксифениламинокарбонильную группу или 2,4,5-трифторфениламинокарбонильную группу.
В настоящем изобретении R представляет собой предпочтительно фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, C1-C6 алкильной группы, a C1-C6 галогенированной алкильной группы, C1-C6 алкоксигруппы и C1-C6 галогенированной алкоксигруппы, или С3-С6 циклоалкильную группу, более предпочтительно фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 4-трифторметилфенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу, 2,4,5-трифторфенильную группу, 3,4,5-трифторфенильную группу или циклопентильную группу и еще более предпочтительно фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу или 2,4,5-трифторфенильную группу.
В настоящем изобретении R2 представляет собой предпочтительно метильную группу.
В настоящем изобретении R3 представляет собой предпочтительно гетероциклическую группу, способную служить в качестве эквивалента карбоновой кислоты или карбоксильной группы, более предпочтительно 4-карбоксиоксазол-2-ильную группу, 5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-ильную группу, 5-гидрокси-2H-пиразол-3-ильную группу, 3-гидроксиизоксазол-5-ильную группу, тетразол-5-ильную группу или карбоксильную группу и еще более предпочтительно карбоксильную группу.
В настоящем изобретении R4 представляет собой предпочтительно атом водорода.
В настоящем изобретении R5 представляет собой предпочтительно метильную группу.
В настоящем изобретении R6 представляет собой предпочтительно атом водорода.
В настоящем изобретении R7 представляет собой метильную группу.
В настоящем изобретении X представляет собой предпочтительно атом кислорода или метиленовую группу и более предпочтительно атом кислорода.
В настоящем изобретении L представляет собой предпочтительно метиленовую группу.
В настоящем изобретении ..... представляет собой предпочтительно простую связь.
В настоящем изобретении m равно предпочтительно 2.
В настоящем изобретении n равно предпочтительно 0 или 1 и более предпочтительно 0.
В настоящем изобретении в тех случаях, когда n равно 1, R2 предпочтительно связан с атомом углерода, прилежащим к атому углерода, связанному с X.
Соединение или его фармакологически приемлемая соль, представленные общей формулой (I), по данному изобретению представлены в данном контексте во всех присущих им формах изомеров (таких как кетоенольный изомер, диастереомер, оптический изомер, ротамер, и т.д.).
Соединение или его фармакологически приемлемая соль, представленные общей формулой (I), по данному изобретению имеют различные изомеры, поскольку в его молекуле существуют асимметричный(е) атом(ы) углерода. Эти изомеры и смеси этих изомеров по данному изобретению, все, представлены одной формулой, в частности общей формулой (I). Соответственно, настоящее изобретение включает все эти изомеры и все смеси этих изомеров при произвольных соотношениях.
Вышеупомянутые стереоизомеры могут быть получены, синтезируя соединение по данному изобретению с использованием оптически активного соединения - исходного материала или используя метод асимметрического синтеза или технику асимметрической индукции, или путем выделения синтезированного соединения по данному изобретению, используя метод оптического разделения или технику обычного разделения, по желанию.
"Его фармакологически приемлемая соль" относится к соли, которая лишена заметно проявляемой токсичности и которая может быть использована в качестве фармацевтического препарата. Соединение, представленное общей формулой (I), по данному изобретению может быть превращено в соль путем взаимодействия с кислотой в случае, если соединение имеет основную группу, такую как аминогруппа, или путем взаимодействия с основанием в случае наличия у соединения кислой группы, такой как карбоксильная группа.
Примеры солей, полученных исходя из основной группы, включают соли галогенводородных кислот, такие как гидрофториды, гидрохлориды, гидробромиды или гидроиодиды, соли неорганических кислот, такие как нитраты, перхлораты, сульфаты или фосфаты; C1-С6 алкилсульфонаты, такие как метансульфонаты, трифторметансульфонаты или этансульфонаты, арилсульфонаты, такие как бензолсульфонаты или п-толуолсульфонаты; соли органиеских кислот, такие как ацетаты, малаты, фумараты, сукцинаты, цитраты, аскорбаты, тартраты, оксалаты или малеаты; и соли аминокислот, такие как соли глицина, лизина, аргинина, орнитина, глутаминовой кислоты и аспарагиновой кислоты.
С другой стороны, примеры солей, полученных исходя из наличия кислотных групп, включают соли металлов, такие как соли щелочных металлов, такие как соли натрия, соли калия или соли лития, соли щелочноземельных металлов, такие как соли кальция или соли магния, соли металлов, такие как соли алюминия или соли железа; соли аминов, такие как соли неорганических аминов, такие как соли аммония, или соли органических аминов, такие как соли трет-октиламина, дибензиламина, морфолина, глюкозамина, алкиловых сложных эфиров фенилглицина, этилендиамина, N-метилглюкамина, гуанидина, диэтиламина, триэтиламина, дициклогексиламина, N,N'-дибензилэтилендиамина, хлорпрокаина, прокаина, диэтаноламина, N-бензилфенетиламина, пиперазина, тетраметиламмония или трис(гидроксиметил)аминометана; и соли аминокислот, такие как соли глицина, лизина, аргинина, орнитина, глутаминовой кислоты и аспарагиновой кислоты.
Соединение или его фармакологически приемлемая соль, представленные общей формулой (I), по данному изобретению могут быть превращены в гидрат путем включения молекулы(молекул) воды будучи оставленным в атмосферных условиях или при перекристаллизации, и такие гидраты также включены в перечень солей по данному изобретению.
Соединение или его фармакологически приемлемая соль, представленные общей формулой (I), по данному изобретению могут быть превращены в сольват посредством абсорбирования другого типа растворителя, и такие сольваты также включены в перечень солей по данному изобретению.
Преимущества данного изобретения
Соединение по данному изобретению, представленное общей формулой (I), или его фармакологически приемлемая соль обладает превосходным ингибирующим действием в отношении DGAT и сильным подавляющим потребление пищи действием и поэтому является полезным в качестве фармацевтического средства, предназначенного для предотвращения и/или лечения заболевания, выбранного из группы, состоящей из тучности, ожирения, гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета у беременных, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, ишемической болезни сердца и булимии, или болезни, выбранной из группы, состоящей из гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета при беременности, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, гипертензии, цереброваскулярного расстройства, болезни коронарной артерии, жировой инфильтрации печени, дыхательной недостаточности, боли в нижнем отделе спины, остеоартрита коленного сустава, подагры или желчнокаменной болезни, вызванной ожирением, у теплокровных животных (предпочтительно млекопитающих, включая людей). Кроме того, новое соединение, представленное общей формулой (I), или его фармакологически приемлемая соль, разработанные согласно данному изобретению, обладают превосходным ингибирующим действием в отношении DGAT и поэтому являются полезным в качестве активного ингредиента для фармацевтического средства, предназначенного для предотвращения и/или лечения любого из вышеуказанных заболеваний у теплокровных животных (предпочтительно, млекопитающих, включая людей). Предпочтительно, соединение по данному изобретению, представленное общей формулой (I), или его фармакологически приемлемая соль могут быть использованы в качестве фармацевтического средства, предназначенного для лечения любой из болезней, описанных выше.
Лучший вариант осуществления изобретения
Соединение, представленное общей формулой (I), по данному изобретению можно получить согласно нижеизложенным способам A-С.
Растворители, используемые в реакциях на каждой стадии способов A-С, особенно не ограничены при условии, что они не тормозят реакцию и растворяют исходные продукты до некоторой степени. Например, растворители выбирают из группы растворителей, состоящей из углеводородов, таких как пентан, гексан, октан, петролейный эфир, лигроин или циклогексан; амидов, таких как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метил-2-пирролидинон или триамид гексаметилфосфорной кислоты; простых эфиров, таких как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; спиртов, таких как метанол, этанол, н-пропанол, изопропанол, н-бутанол, 2-бутанол, 2-метил-1-пропанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; сульфоксидов, таких как диметилсульфоксид; сульфонов, таких как сульфолан; нитрилов, таких как ацетонитрил, пропионитрил, бутиронитрил или изобутиронитрил; сложных эфиров, таких как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; кетонов, таких как ацетон, метилэтилкетон, 4-метил-2-пентанон, метилизобутилкетон, изофорон или циклогексанон; нитросоединений, таких как нитроэтан или нитробензол; галогенированных углеводородов, таких как дихлорметан, 1,2-дихлорэтан, хлорбензол, дихлорбензол, хлороформ или тетрахлорид углерода; ароматических углеводородов, таких как бензол, толуол или ксилол; карбоновых кислот, таких как уксусная кислота, муравьиная кислота, пропионовая кислота, масляная кислота или трифторуксусная кислота; аминов, таких как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 2,6-лутидин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) или пиперидин; воды и смесей вышеперечисленных растворителей.
Примеры оснований, используемых в реакциях на каждой стадии способов A-С, включают неорганические основания, такие как карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат лития или карбонат цезия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; ацетаты щелочных металлов, такие как ацетат натрия, ацетат калия, ацетат лития или ацетат цезия; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия или гидрид калия; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия, гидроксид бария или гидроксид лития; и фториды щелочных металлов, такие как фторид натрия или фторид калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития; триалкилсилоксиды щелочных металлов, такие как триметилсилоксид натрия, триметилсилоксид калия или триметилсилоксид лития; меркаптаны щелочных металлов, такие как тиометоксид натрия или тиоэтоксид натрия; органические основания, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 2,6-лутидин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU); металлоорганические основания, такие как н-бутиллитий, литийдиизопропиламид или литийбис(триметилсилил)амид; и аминокислоты, такие как, например, пролин.
Примеры конденсирующих агентов, используемых в реакциях на каждой стадии способов А-С, включают гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), 1-циклический ангидрид пропанфосфоновой кислоты (T3P), дициклогексилкарбодиимид (DCCD), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (EDCI), изобутилхлорформиат (IBCF), 1,1'-карбонилбис-1H-имидазол (CDI), диэтилцианофосфонат (DEPC), дифенилфосфорилазид (DPPA), N-гидроксисукцинимид, 1-гидроксибензотриазол, N-гидрокси-5-норборнен-2,3-дикарбоксимид, гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония (BOP), трифенилфосфин и дипиридилдисульфид.
Примеры восстановителей, используемых в реакциях на каждой стадии способов A-С, включают боргидриды щелочных металлов, такие как боргидрид натрия, боргидрид лития, цианоборгидрид натрия или триацетоксиборгидрид натрия; комплексы борана, такие как комплексы боран-тетрагидрофуран или комплексы боран-диметилсульфид; алюминийгидридные соединения, такие как диизобутилалюминийгидрид, литийалюминийгидрид или литийэтоксиалюминийгидрид; гидридные реагенты восстановителей на основе алюминийорганического гидрида, такие как натрийгидротеллурид, диизобутилалюминийгидрид или натрийбис(метоксиэтокси)алюминийгидрид; и щелочные металлы, такие как натрий или литий.
Примеры катализаторов палладия, используемых в реакциях на каждой стадии способов A-С, включают катализаторы двухвалентного палладия или палладия нулевой валентности, такие как тетракис(трифенилфосфин)палладий(0), палладий-активированный уголь, ацетат палладия(II), трифторацетат палладия(II), палладиевая чернь, бромид палладия(II), хлорид палладия(II), иодид палладия(II), цианид палладия(II), нитрат палладия(II), оксид палладия(II), сульфат палладия(II), дихлорбис(ацетонитрил)палладий(II), дихлорбис(бензонитрил)палладий(II), дихлор(1,5-циклооктадиен)палладий(II), ацетилацетонат палладия(II), сульфид палладия(II), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид, трис(дибензилиденацетон)дипалладий(0), тетрафторборат тетракис(ацетонитрил)палладия(II) и димеры хлорида арилпалладия.
В реакциях на каждой стадии способов A-C температура реакции варьируется в зависимости от растворителей, исходных продуктов, реагентов и т.д., и время реакции изменяется в зависимости от растворителей, исходных продуктов, реагентов, температур реакции и т.д.
В реакциях на каждой стадии способов A-C после их завершения каждое желаемое соединение извлекают из реакционной смеси в соответствии с обычными способами. Желаемое соединение получают, например, следующим образом. Реакционную смесь нейтрализуют надлежащим образом и нерастворимое вещество, если оно присутствует, удаляют фильтрацией. Затем добавляют воду и несмешивающийся органический растворитель, такой как этилацетат, и органический слой, содержащий желаемое соединение, отделяют. Органический слой промывают водой или т.п. и затем сушат над безводным сульфатом магния, безводным сульфатом натрия, безводным бикарбонатом натрия или т.п. и фильтруют. Затем растворитель выпаривают. Полученное желаемое соединение может быть выделено и очищено, если это необходимо, путем комбинирования обычных методов, например методов, используемых для выделения и очистки органических соединений, таких как перекристаллизация и повторное осаждение, и элюирования подходящим элюентом при применении хроматографии. Желаемое соединение, нерастворимое в растворителе, может быть очищено промыванием полученного твердого неочищенного продукта растворителем. Желаемое соединение с каждой стадии может быть также использовано для последующей реакции в том виде, как оно есть, без очистки.
Способ A представляет собой способ получения соединения, представленного общей формулой (Ia), где X представляет собой атом кислорода, группу, представленную формулой -NH-, или группу, представленную формулой -N(R7)-.
Способ А

В настоящем изобретении R1, R2, R3, L, m и n такие, как определены выше; X1 представляет собой атом кислорода, группу, представленную формулой -NH-, или группу, представленную формулой -N(R7)- (где R7 такой, как определен выше); и R1a и R3a представляют собой группы R1 и R3, в которых аминогруппа, гидроксигруппа и/или карбоксильная группа, содержащаяся в качестве заместителя в группах R1 и R3, представляет собой необязательно защищенную аминогруппу, гидроксигруппу и/или карбоксильную группу, или представляют собой такие же группы, как определены для групп R1 и R3.
Стадия A1
Эта стадия представляет собой стадию получения соединения, представленного общей формулой (Ia), и состоит из этапов (i)-(ii).
(i) На этом этапе осуществляют взаимодействие соединения, представленного общей формулой (IV), с трифосгеном в присутствии основания в растворителе.
Соединение, представленное общей формулой (IV), где X1 представляет собой атом кислорода, используемое на этой стадии, представляет собой соединение, известное в данной области, или его легко получают способом, известным в данной области, или способом, подобным этому, используя в качестве исходного продукта соединение, известное в данной области.
Соединение, представленное общей формулой (IV), где X1 представляет собой группу, представленную формулой -NH-, или группу, представленную формулой -N(R7)-, используемое на этом этапе, представляет собой соединение, известное в данной области (например, J. Med. Chem., 2000, 43, 1878), или его легко получают согласно способу, известному в данной области (например, J. Med. Chem., 2000, 43, 1878), или способом, аналогичным этому, используя в качестве исходного продукта соединение, известное в данной области.
Растворитель, используемый на этом этапе, представляет собой предпочтительно галогенированный углеводород, более предпочтительно дихлорметан.
Основание, используемое на этом этапе, представляет собой предпочтительно органическое основание, более предпочтительно пиридин, в случае, если X1 = атом кислорода или более предпочтительно триэтиламин, в случае, если X1 = группа, представленная формулой -NH-, или группа, представленная формулой -N(R7)-.
Температура реакции на этом этапе обычно находится в диапазоне от -20°C до 40°C, предпочтительно от 0°C до 25°C.
Время реакции на этом этапе находится обычно в диапазоне от 0,1 часа до 24 часов, предпочтительно от 0,5 часов до 2 часов.
(ii) На этом этапе осуществляют взаимодействие соединения, полученного на стадии (i), с соединением, представленным общей формулой (V), в присутствии основания в растворителе и затем, если это необходимо, удаления защитной группы(групп) для амино, гидрокси и/или карбоксильных групп в R1a и R3a.
Соединение, представленное общей формулой (V), используемое на этой стадии, является соединением, известным в данной области (например, WO2006/4200, Japanese Patent Laid-Open Nos. 2006-45209 и 2007-131584, и US2007/0249620), или его легко получают способом, известным в данной области (например, WO2006/4200, выложенные патенты Японии № 2006-45209 и 2007-131584, и US2007/0249620), или способом, подобным этому, используя в качестве исходного продукта соединение, известное в данной области.
Растворитель, используемый на этом этапе, представляет собой предпочтительно галогенированный углеводород, более предпочтительно дихлорметан.
Основание, используемое на этом этапе, представляет собой предпочтительно органическое основание, более предпочтительно триэтиламин.
Температура реакции на этом этапе находится обычно в диапазоне от -20°C до 100°C, предпочтительно от 20°C до 30°C.
Время реакции на этом этапе составляет обычно диапазон от 0,1 часа до 96 часов, предпочтительно от 1 часа до 24 часов.
Способ В представляет собой способ получения соединения, представленного общей формулой (Ib), где X представляет собой метиленовую группу или метиленовую группу, монозамещенную C1-С6 алкильной группой.
Способ В

В настоящем изобретении R1, R2, R3, L, m, n, R1a и R3a такие, как определены выше; и R8 представляет собой атом водорода или C1-С6 алкильную группу.
Стадия B1
Эта стадия представляет собой стадию получения соединения, представленного общей формулой (Ib).
Эту стадию осуществляют путем взаимодействия соединения, представленного общей формулой (VI), с соединением, представленным общей формулой (V), и конденсирующим средством в присутствии основания в растворителе и затем, если это необходимо, удаления защитной группы(групп) для амино, гидрокси и/или карбоксильных групп в R1a и R3a.
Соединение, представленное общей формулой (VI), используемое на этой стадии, представляет собой соединение, известное в данной области (например, US2001/9912), или его легко получают способом, известным в данной области (например, US2001/9912), или способом, подобным этому, используя в качестве исходного продукта соединение, известное в данной области.
Растворитель, используемый на этой стадии, представляет собой предпочтительно амид, более предпочтительно N,N-диметилацетамид.
Основание, используемое на этой стадии, представляет собой предпочтительно органическое основание, более предпочтительно триэтиламин.
Конденсирующий агент, используемый на этой стадии, представляет собой предпочтительно T3P или BOP.
Температура реакции для этой стадии находится обычно в диапазоне от -20°C до 180°C, предпочтительно от 0°C до 60°C.
Время реакции для этой стадии составляет обычно диапазон от 0,1 часа до 96 часов, предпочтительно от 1 часа до 24 часов.
Способ С представляет собой способ получения соединения, представленного общей формулой (IV), используемого на стадии A1 способа A и представленного общей формулой (X) или (XII), в которой R3a представляет собой группу, представленную формулой -C(=О)-О-R4a; X1 представляет собой атом кислорода; и L представляет собой группу, представленную формулой -CH=, или метиленовую группу.
Способ С

В настоящем изобретении R2, m, и n такие, как определены выше; R4a представляет собой группу, в которой аминогруппа, гидроксигруппа и/или карбоксильная группа, содержащаяся в качестве заместителя в группе R4, представляет собой необязательно защищенную аминогруппу, гидроксигруппу и/или карбоксильную группу или представляет собой такие же группы, которые определены для групп R4; Prot представляет собой защитную группу для гидроксигруппы.
Стадия С1
Эта стадия представляет собой стадию получения соединения, представленного общей формулой (IX).
Эту стадию осуществляют путем взаимодействия соединения, представленного общей формулой (VII), с соединением, представленным общей формулой (VIII), в присутствии основания в растворителе.
Соединение, представленное общей формулой (VII), и соединение, представленное общей формулой (VIII), используемые на этой стадии, представляют собой соответственно соединение, известное в данной области, или их легко получают способом, известным в данной области, или способом, подобным этому, используя в качестве исходного продукта соединение, известное в данной области.
Растворитель, используемый на этой стадии, представляет собой предпочтительно амид, более предпочтительно N,N-диметилформамид.
Основание, используемое на этой стадии, представляет собой предпочтительно гидрид щелочного металла, более предпочтительно гидрид натрия.
Температура реакции на этой стадии находится обычно в диапазоне от -20°C до 100°C, предпочтительно от 0°C до 60°C.
Время реакции для этой стадии составляет обычно диапазон от 0,1 часа до 96 часов, предпочтительно от 1 часа до 24 часов.
Стадия C2
Эта стадия представляет собой стадию получения соединения, представленного общей формулой (X).
Эту стадию осуществляют путем удаления защитной группы для гидроксигруппы в соединении, представленном общей формулой (IX).
Стадия C3
Эта стадия представляет собой стадию получения соединения, представленного общей формулой (XI).
Эту стадию осуществляют путем гидрирования соединения, представленного общей формулой (IX), в присутствии катализатора палладия в растворителе в атмосфере водорода.
Растворитель, используемый на этой стадии, представляет собой предпочтительно спирт, более предпочтительно этанол.
Катализатор палладия, используемый на этой стадии, представляет собой предпочтительно палладий-активированный уголь.
Температура реакции на этой стадии находится обычно в диапазоне от 0°C до 100°C, предпочтительно от 20°C до 80°C.
Время реакции для этой стадии составляет обычно от 0,5 часов до 96 часов, предпочтительно от 2 часов до 48 часов.
Стадия C4
Эта стадия представляет собой стадию получения соединения, представленного общей формулой (XII).
Эту стадию осуществляют путем удаления защитной группы для гидроксигруппы в соединении, представленном общей формулой (XI).
Стадия C5
Эта стадия представляет собой стадию получения соединения, представленного общей формулой (XII).
Эту стадию осуществляют путем взаимодействия соединения, представленного общей формулой (XIII), с восстановителем в растворителе.
Соединение, представленное общей формулой (XIII), используемое на этой стадии, представляет собой соединение, известное в данной области (например, J. Med. Chem., 2006, 49, 2496), или его легко получают в соответствии со способом, известным в данной области (например, J. Med. Chem., 2006, 49, 2496), или способом, подобным этому, используя в качестве исходного продукта соединение, известное в данной области.
Растворитель, используемый на этой стадии, представляет собой предпочтительно спирт, более предпочтительно метанол.
Восстановитель, используемый на этой стадии, представляет собой предпочтительно боргидрид щелочного металла, более предпочтительно боргидрид натрия.
Температура реакции на этой стадии находится обычно в диапазоне от -78°C до 100°C, предпочтительно от 0°C до 30°C.
Время реакции для этой стадии составляет обычно от 0,1 часа до 96 часов, предпочтительно от 0,5 часа до 24 часов.
В вышеизложенном описании защитная группа для "аминогруппы, которая может быть защищенной", "гидроксигруппы, которая может быть защищенной" и "карбоксильной группы, которая может быть защищенной", в определениях R1a, R3a и R4a относится к защитной группе, которая может быть отщеплена химическим способом, таким как гидрогенолиз, гидролиз, электролиз или фотолиз, и представляет собой защитную группу, обычно используемую в химии органического синтеза (см., например, T. W. Greene et al. Protective Groups in Organic Synthesis, 3rd Edition, John Wiley & Sons, Inc. (1999)).
В вышеизложенном описании выбор "защитной группы" для "гидроксигруппы, которая может быть защищенной", в определениях R1a, R3a и R4a особенно не ограничен при условии, что она представляет собой защитную группу для гидроксигрупп, используемых в области химии органического синтеза. Примеры вышеуказанной группы включают формильную группу; "алкилкарбонильные группы", такие как "C2-C7 алкилкарбонильная группа", иллюстрируемая выше, галогенированные алкилкарбонильные группы (например, хлорацетил, дихлорацетил, трихлорацетил и трифторацетил), алкоксиалкилкарбонильные группы (например, метоксиацетил) и ненасыщенные алкилкарбонильные группы (например, акрилоил, пропиолоил, метакрилоил, кротоноил, изокротоноил и (E)-2-метил-2-бутеноил); "арилкарбонильные группы", такие как арилкарбонильные группы (например, бензоил, α-нафтоил и β-нафтоил), галогенированные арилкарбонильные группы (например, 2-бромбензоил и 4-хлорбензоил), C1-С6 алкилированные арилкарбонильные группы (например, 2,4,6-триметилбензоил и 4-толуоил), С1-С6 алкоксилированные арилкарбонильные группы (например, 4-анизоил), нитрированные арилкарбонильные группы (например, 4-нитробензоил и 2-нитробензоил), C2-C7 алкоксикарбонилированные арилкарбонильные группы (например, 2-(метоксикарбонил)бензоил) и арилированные арилкарбонильные группы (например, 4-фенилбензоил); "алкоксикарбонильные группы", такие как "C2-C7 алкоксикарбонильная группа", иллюстрированная выше, и C2-C7 алкоксикарбонильные группы, замещенные галогеном или три-(C1-C6 алкил)силильной группой (например, 2,2,2-трихлорэтоксикарбонил и 2-триметилсилилэтоксикарбонил); "тетрагидропиранильные или тетрагидротиопиранильные группы", такие как тетрагидропиран-2-ил, 3-бромтетрагидропиран-2-ил, 4-метокситетрагидропиран-4-ил, тетрагидротиопиран-2-ил и 4-метокситетрагидротиопиран-4-ил; "тетрагидрофуранильные или тетрагидротиофуранильные группы", такие как тетрагидрофуран-2-ил и тетрагидротиофуран-2-ил; "силильные группы", такие как три(C1-C6 алкил)силильные группы (например, триметилсилил, триэтилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, метилдиизопропилсилил, метил-ди-трет-бутилсилил и триизопропилсилил), и (C1-C6 алкил)диарилсилильные или ди-(C1-C6 алкил)арилсилильные группы (например, дифенилметилсилил, дифенилбутилсилил, дифенилизопропилсилил и фенилдиизопропилсилил); "алкоксиметильные группы", такие как (C1-C6 алкокси)метильные группы (например, метоксиметил, 1,1-диметил-1-метоксиметил, этоксиметил, пропоксиметил, изопропоксиметил, бутоксиметил и трет-бутоксиметил), (C1-С6 алкокси)-(С1-С6 алкокси)метильные группы (например, 2-метоксиэтоксиметил), и (C1-С6 галогенированный алкокси)метил (например, 2,2,2-трихлорэтоксиметил и бис(2-хлорэтокси)метил); "замещенные этильные группы", такие как (C1-С6 алкокси)этильные группы (например, 1-этоксиэтил и 1-(изопропокси)этил) и галогенированные этильные группы (например, 2,2,2-трихлорэтил); "аралкильные группы", такие как C1-C6 алкильные группы, замещенные 1-3 арильными группами (например, бензил, α-нафтилметил, β-нафтилметил, дифенилметил, трифенилметил, α-нафтилдифенилметил, и 9-антрилметил) и C1-C6 алкильные группы, замещенные 1-3 арильными группами, имеющими арильный цикл, замещенный C1-С6 алкилом, C1-C6 алкокси, нитро, галогеном или цианогруппой (например, 4-метилбензил, 2,4,6-триметилбензил, 3,4,5-триметилбензил, 4-метоксибензил, 4-метоксифенилдифенилметил, 2-нитробензил, 4-нитробензил, 4-хлорбензил, 4-бромбензил и 4-цианобензил); "алкенилоксикарбонильные группы", такие как винилоксикарбонил и аллилоксикарбонил; и "аралкилоксикарбонильные группы", арильный цикл которых может быть замещен 1 или 2 C1-C6 алкокси или нитрогруппами, такие как бензилоксикарбонил, 4-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 2-нитробензилоксикарбонил и 4-нитробензилоксикарбонил. Защитная группа представляет собой предпочтительно алкилкарбонильную группу, силильную группу или аралкильную группу.
В вышеизложенном описании выбор "защитной группы" для "карбоксильной группы, которая может быть защищенной", в определениях R1a, R3a и R4a особенно не ограничен при условии, что она представляет собой защитную группу для карбоксильных групп, используемых в химии органического синтеза. Примеры вышеуказанной группы включают "C1-C6 алкильную группу", иллюстрированную выше; "C2-C6 алкенильные группы", такие как этенил, 1-пропенил, 2-пропенил и 1-метил-2-пропенил; "С2-С6 алкинильные группы", такие как этинил, 1-пропинил, 2-пропинил и 1-метил-2-пропинил; "C1-C6 галогенированную алкильную группу", иллюстрированную выше; С1-С6 гидроксиалкильные группы, такие как гидроксиметил и 2-гидроксиэтил; (C2-C7 алкилкарбонил)-(C1-С6 алкильные группы), такие как ацетилметил; "аралкильные группы", иллюстрированные выше; и "силильные группы", иллюстрированные выше. Защитная группа представляет собой предпочтительно C1-C6 алкильную группу или аралкильную группу.
В вышеизложенном описании выбор "защитной группы" для "аминогруппы, которая может быть защищенной", в определениях R1a, R3a и R4a особенно не ограничен при условии, что она представляет собой защитную группу для аминогрупп, используемых в области химии органического синтеза. Примеры вышеуказанной группы включают группы, подобные "алкилкарбонильным группам", "арилкарбонильным группам", "алкоксикарбонильным группам", "силильным группам", "аралкильным группам", "алкенилоксикарбонильным группам" и "аралкилоксикарбонильным группам", иллюстрированным в качестве "защитной группы для гидроксигрупп"; и "замещенные метиленовые группы, которые образуют основание Шиффа", такие как N,N-диметиламинометилен, бензилиден, 4-метоксибензилиден, 4-нитробензилиден, салицилиден, 5-хлорсалицилиден, дифенилметилен и (5-хлор-2-гидроксифенил)фенилметилен. Защитная группа представляет собой предпочтительно алкилкарбонильную группу, арилкарбонильную группу или алкоксикарбонильную группу, более предпочтительно алкоксикарбонильную группу.
Стадии, требующие проведения реакций защиты/снятия защиты, осуществляют согласно известным способам (например, способы, описанные в Theodora W. Greene, Peter G. M. Wuts, "Protective Groups in Organic Synthesis," 1999, A Wiley-Interscience Publication, и т.д.).
Соединение или его фармакологически приемлемая соль по данному изобретению могут быть введены с помощью различных лекарственных форм. Примеры путей введения включают пероральное введение, используя таблетки, капсулы, гранулы, эмульсии, пилюли, порошки, сиропы (растворы) и т.п., и парентеральное введение, используя инъекции (внутривенное, внутримышечное, подкожное или интраперитонеальное введение), капельницы, суппозитории (ректальное введение), и т.п. Эти различные препараты можно получить в виде готовых лекарственных форм в соответствии с обычными способами, используя, помимо активного ингредиента, вспомогательные вещества, обычно используемые в области технологии приготовления лекарственных средств, такие как наполнители, связующие, дезинтеграторы, смазки, ароматизирующие вещества, растворяющие агенты, суспендирующие средства и средства для покрытия.
При использовании в виде таблетки примеры носителей, которые могут быть использованы, включают наполнители, такие как лактоза, сахароза, хлорид натрия, глюкоза, мочевина, крахмал, карбонат кальция, каолин, кристаллическая целлюлоза и кремниевая кислота; связующие, такие как вода, этанол, пропанол, простой сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия и поливинилпирролидон; дезинтеграторы, такие как обезвоженный крахмал, альгинат натрия, порошок агара, порошок ламинарана, гидрокарбонат натрия, карбонат кальция, полиоксиэтиленовый эфир сорбита и жирной кислоты, лаурилсульфат натрия, стеариновый моноглицерид, крахмал и лактоза; ингибиторы дезинтеграции, такие как сахароза, стеарин, масло какао и гидрогенизированное масло; усилители абсорбции, такие как соли четвертичного аммония и лаурилсульфат натрия; смачивающие средства, такие как глицерин и крахмал; адсорбирующие вещества, такие как крахмал, лактоза, каолин, бентонит и коллоидальная кремниевая кислота; смазки, такие как очищенный тальк, стеарат, порошок борфтороводородной кислоты и полиэтиленгликоль, и так далее. Кроме того, если требуется, можно получить обычными способами таблетки, покрытые оболочкой, такие как, например, таблетки с сахарным покрытием, таблетки с желатиновым покрытием, таблетки с энтеросолюбильным покрытием, таблетки с пленочным покрытием, двухслойные таблетки и многослойные таблетки.
При использовании в виде пилюли примеры носителей, которые могут быть использованы, включают наполнители, такие как глюкоза, лактоза, масло какао, крахмал, гидрогенизированное растительное масло, каолин и тальк; связующие, такие как порошкообразная аравийская камедь, порошкообразный трагакант, желатин и этанол; дезинтеграторы, такие как ламинаран и агар, и так далее.
При использовании в виде суппозитория может быть использован широкий ряд носителей, известных в этой области, и примеры их включают полиэтиленгликоль, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетические глицериды и так далее.
При использовании в виде инъекции препараты можно получить в виде растворов, эмульсий или суспензий. Предпочтительно, эти растворы, эмульсии и суспензии стерилизуют и они являются изотоническими в отношении крови. Выбор растворителей для получения этих растворов, эмульсий и суспензий особенно не ограничен при условии, что они могут быть использованы в качестве разбавителей для медицинского применения, и их примеры включают воду, этанол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт, полиоксиэтиленовые эфиры сорбита и жирной кислоты и так далее. В этом случае для получения изотонического раствора в препарат может быть добавлено достаточное количество хлорида натрия, глюкозы или глицерина и, кроме того, могут быть добавлены обычные растворяющие вспомогательные вещества, буферы, успокаивающие средства и т.п.
Кроме того, если необходимо, в вышеупомянутый препарат могут быть добавлены красители, консерванты, отдушки, вкусовые вещества, подслащивающие вещества и т.п. Кроме того, могут быть добавлены и другие лекарственные средства.
Количество активного соединения-ингредиента, содержащегося в вышеупомянутых препаратах, особенно не ограничено, но составляет обычно от 0,5 до 70 мас.% общей композиции, предпочтительно от 1 до 30 мас.%.
Доза варьируется в зависимости от симптомов, возраста и т.п. пациента (теплокровного животного, в частности человека). В случае перорального применения рекомендуемая суточная доза взрослого человека составляет от 0,1 мг как нижнего предела (предпочтительно 1 мг, более предпочтительно 10 мг) до 2000 мг как верхнего предела (предпочтительно 100 мг), которую делят на 1-6 доз в зависимости от симптомов.
ПРИМЕРЫ
В дальнейшем настоящее изобретение более конкретно описывается, ссылаясь на Примеры и Примеры испытаний. Однако объем настоящего изобретения, как полагают, не ограничивается этими Примерами и Тест-примерами.
В этих Примерах элюирование на колоночной хроматографии осуществляют под контролем с помощью ТСХ (тонкослойная хроматография). При контроле с использованием ТСХ в качестве несущей пластинки в тонкослойной хроматографии выбирают силикагель 6OF254, производимый компанией Merck; в качестве проявляющих растворителей выбирают растворители, используемые в качестве элюирующих растворителей в колоночной хроматографии; и в качестве метода регистрации выбран Уф-детектор. В качестве силикагеля для колонок используют силикагель SK-85 (230-400 меш), также производимый компанией Merck, или Chromatorex NH (200-350 меш, FUJI SILYSIA CHEMICAL LTD). Помимо обычной колоночной хроматографии, соответствующим образом используют Biotage автоматический хроматографический аппарат (SP-1). Растворители, описанные в каждом Примере, используют в качестве элюирующих растворителей при заданном отношении (или это отношение изменяют соответствующим образом согласно необходимости). Аббревиатуры, используемые в Примерах, означают нижеследующее: мг: миллиграмм, г: грамм, мл: миллилитр, МГц: мегагерц.
В нижеприведенных Примерах спектры ядерного магнитного резонанса (в дальнейшем обозначаемого 1H ЯМР) представлены в величинах δ (м.д.), отражающих значения химического сдвига относительно тетраметилсилана в качестве внутреннего стандарта. Картины расщепления представлены в виде с (s) синглета, д (d) дублета, т (t) триплета и (q) квартета.
Масс-спектрометрию (в дальнейшем обозначаемую МС) осуществляют в соответствии с типом применяемого метода ионизации: FAB (бомбардировка быстрыми атомами), EI (ионизация электронами) или ESI (электрораспылительная ионизация).
(Пример 1) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
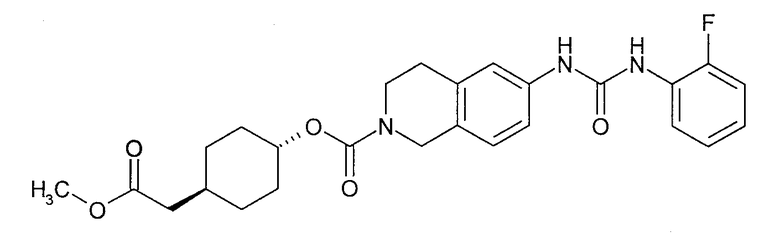
(1a) метиловый эфир (1,4-диоксаспиро[4.5]дец-8-илиден)уксусной кислоты
К раствору триметилфосфоноацетата (26 мл) в ДМФА (50 мл) добавляют гидрид натрия (чистота: 55% или выше, 7,03 г) небольшими порциями при 0°C. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 30 минут. Туда небольшими порциями при комнатной температуре добавляют раствор 1,4-циклогександионмоноэтиленкеталя (25,2 г) в ДМФА (50 мл). Эту суспензию перемешивают в течение 19 часов и разбавляют насыщенным водным раствором хлорида аммония с последующими двумя экстракциями этилацетатом. Органический слой промывают насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают хроматографией (смесь гексан/этилацетат=5:1), получая указанное в заголовке соединение (29,7 г, 87%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 5,75-5,65 (1Н, м), 3,99 (4H, с), 3,70 (3H, с), 3,01 (2H, т, J=6,7 Гц), 2,39 (2H, т, J=6,7 Гц), 1,81-1,75 (4H, м);
МС (EI) m/z: 212 (M)+.
(1b) метиловый эфир (1,4-диоксаспиро[4.5]дец-8-ил)уксусной кислоты
Суспензию метилового эфира (1,4-диоксаспиро[4.5]дец-8-илиден)уксусной кислоты (6,57 г), полученного в Примере (1a), и палладия-на-углероде (10 мас.%) в этаноле (50 мл) подвергают восстановлению водородом при комнатной температуре в течение 24 часов. Реакционную смесь фильтруют и концентрируют. Остаток очищают хроматографией (смесь гексан/этилацетат=5:1) с получением указанного в заголовке соединения (4,99 г, 75%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,94 (4H, с), 3,67 (3H, с), 2,25 (2H, д, J=7,0 Гц), 1,89-1,81 (1H, м), 1,74 (4H, д, J=9,8 Гц), 1,63-1,53 (2H, м), 1,36-1,25 (2H, м);
МС (EI) m/z: 214 (M)+.
(1c) метиловый эфир (4-оксоциклогексил)уксусной кислоты
Смесь 1N водный раствор хлористоводородной кислоты (50 мл)/ацетон (200 мл), содержащую метиловый эфир (1,4-диоксаспиро[4.5]дец-8-ил)уксусной кислоты (4,99 г), полученный в Примере (1b), перемешивают при комнатной температуре в течение 15 часов. Органический растворитель удаляют, используя испаритель. Оставшийся водный раствор подвергают двум экстракциям этилацетатом. Органический слой промывают насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют, получая указанное в заголовке соединение (4,30 г, количественный выход) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,71 (3H, с), 2,41-2,24 (7H, м), 2,12-2,05 (2H, м), 1,54-1,43 (2H, м);
МС (EI) m/z: 170 (M)+.
(1d) метиловый эфир транс-(4-гидроксициклогексил)уксусной кислоты и метиловый эфир цис-4-(гидроксициклогексил)уксусной кислоты
К раствору метилового эфира (4-оксоциклогексил)уксусной кислоты (4,18 г), полученного в Примере (1c), в метаноле (50 мл) добавляют боргидрид натрия (1,86 г) небольшими порциями при 0°C. Реакционную смесь перемешивают в течение 1 часа и разбавляют 10% водным раствором хлорида аммония (100 мл). Органический растворитель удаляют, используя испаритель. Оставшийся водный раствор подвергают двум экстракциям этилацетатом. Органический слой промывают насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют, получая метиловый эфир транс-(4-гидроксициклогексил)уксусной кислоты (2,56 г, 60%) в виде бесцветного масла и метиловый эфир цис-(4-гидроксициклогексил)уксусной кислоты (0,517 г, 12%) в виде бесцветного масла.
Транс-форма; 1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,67 (3H, с), 3,67-3,60 (1H, м), 2,20 (2H, д, J=6,7 Гц), 2,00-1,94 (2H, м), 1,82-1,67 (4H, м), 1,35-1,26 (2H, м), 1,10-1,00 (2H, м).
Цис-форма: 1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,04-3,96 (1H, м), 3,68 (3H, с), 2,26 (2H, д, J=7,0 Гц), 1,94-1,24 (10H, м).
(1e) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К раствору трифосгена (569 мг) в дихлорметане (10 мл) постепенно по каплям при 0°C добавляют раствор в дихлорметане (10 мл) метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (850 мг), полученного в Примере (1d), и пиридина (0,39 мл). Реакционную смесь нагревают до комнатной температуры, затем перемешивают в течение 3,5 часов и затем концентрируют. Остаток энергично перемешивают в диизопропиловом эфире и фильтруют. Фильтрат концентрируют, получая хлорформиат в виде бесцветного масла. Раствор (10 мл) этого масла в дихлорметане добавляют при комнатной температуре к суспензии в дихлорметане (10 мл) гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1)(1,03 г) и триэтиламина (1,3 мл). Через 1 час реакционную смесь концентрируют и очищают колоночной хроматографией (смесь дихлорметан/этилацетат), получая указанное в заголовке соединение (1,55 г, количественный выход) в виде белого твердого вещества
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,01 (1Н, с), 8,52 (1H, д, J=2,7 Гц), 8,15 (1H, ддд, J=11,6, 11,6 и 4,2 Гц), 7,32 (1H, с), 7,25 (1H, дд, J=8,2 и 1,6 Гц), 7,22 (2H, дд, J=8,0 и 1,4 Гц), 7,16-7,08 (1H, м), 7,04-6,98 (1H, м), 4,51-4,44 (3H, м), 3,60-3,55 (2H, м), 3,59 (3H, с), 2,76 (2H, т, J=6,0 Гц), 2,22 (2H, д, J=7,0 Гц), 1,95-1,88 (2H, м), 1,79-1,62 (3H, м), 1,79-1,62 (2H, м), 1,15-1,05 (2H, м);
МС (ESI) m/z: 484 (M + H)+.
(Пример 2) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

К смеси 4-метоксикарбонилметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,48 г), полученного в Примере 1, в 1,4-диоксане (20 мл) добавляют при комнатной температуре гидроксид тетрабутиламмония (1,0 моль/л водный раствор, 4,0 мл). Реакционную смесь перемешивают в течение 22 часов и концентрируют. Остаток подкисляют 1N водным раствором (30 мл) хлористоводородной кислоты, затем разбавляют этилацетатом и энергично перемешивают до полного растворения. Отделенный органический слой промывают насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают хроматографией (смесь дихлорметан/метанол). Полученное твердое вещество перекристаллизовывают (изопропиловый спирт), получая указанное в заголовке соединение (1,04 г, 72%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,03 (1H, с), 8,55 (1H, с), 8,16 (1H, дд, J=7,8 и 7,8 Гц), 7,32 (1H, с), 7,26-7,20 (2H, м), 7,16-7,08 (2H, м), 7,04-6,97 (1H, м), 4,52-4,42 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,12 (2H, д, J=7,1 Гц), 1,97-1,89 (2H, м), 1,79-1,71 (2H, м), 1,70-1,60 (1H, м), 1,40-1,29 (2H, м), 1,14-1,01 (2H, м);
МС (ESI) m/z: 470 (M + H)+.
(Пример 3) 4-карбоксиметилциклогексиловый эфир цис-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
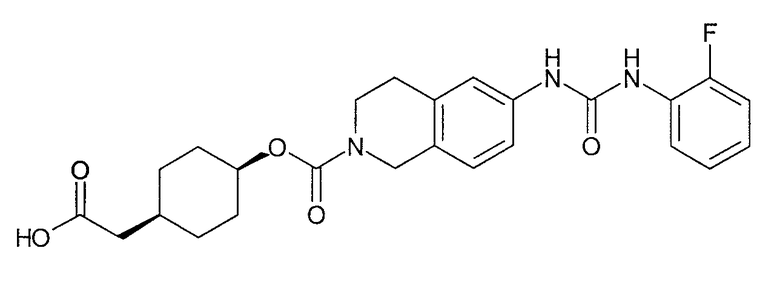
Метиловый сложный эфир (143 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира цис-(4-гидроксициклогексил)уксусной кислоты (62 мг), полученного в Примере (1d), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (83 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (86 мг, 71%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, с), 9,01 (1H, с), 8,53 (1H, с), 8,16 (1H, дд, J=9,0 и 9,0 Гц), 7,35-6,95 (6H, м), 4,85-4,77 (1H, м), 4,58-4,39 (2H, м), 3,66-3,53 (2H, м), 2,82-2,74 (2H, м), 2,17 (2H, д, J=7,0 Гц), 2,20-2,08 (1H, м), 1,82-1,69 (3H, м), 1,59-1,47 (3H, м), 1,38-1,22 (2H, м);
МС (ESI) m/z: 469 (M + H)+.
(Пример 4) метиловый эфир [4-({6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбонил}амино)циклогексил]уксусной кислоты

Указанное в заголовке соединение (84 мг, 54%) получают таким же способом, как в Примере (1e), из метилового эфира (4-аминоциклогексил)уксусной кислоты (J. Med. Chem. 2000, 9, 1878) (82 мг) и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (103 мг).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 8,99 (1H, с), 8,16 (1H, дд, J=8,4 и 8,4 Гц), 7,33-7,18 (4H, м), 7,14 (1H, дд, J=7,8 и 7,8 Гц), 7,07-6,98 (3H, м), 6,25-6,15 (1H, м), 4,42-4,40 (2H, м), 3,60-3,59 (3H, м), 3,55-3,50 (2H, м), 2,76-2,70 (2H, м), 2,35-2,150 (2H, м), 2,00-1,95 (1H, м), 1,80-1,66 (2H, м), 1,58-1,43 (4H, м), 1,24-1,16 (1H, м), 1,06-0,98 (1H, м);
МС (ESI) m/z: 483 (M + H)+.
(Пример 5) [4-({6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбонил}амино)циклогексил]уксусная кислота

Метиловый эфир [4-({6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбонил}амино)циклогексил]уксусной кислоты (74 мг), полученный в Примере 4, гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (20 мг, 28%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, с), 8,99 (1H, с), 8,52 (1H, с), 8,16 (1H, дд, J=8,8 и 8,8 Гц), 7,35-6,97 (7H, м), 6,20-6,18 (1H, м), 4,46-4,39 (2H, м), 3,55-3,49 (2H, м), 2,77-2,71 (2H, м), 2,10 (2H, д, J=6,7 Гц), 1,97-1,88 (1H, м), 1,83-1,67 (2H, м), 1,63-1,43 (2H, м), 1,31-1,16 (2H, м), 1,07-0,93 (2H, м);
МС (ESI) m/z: 469 (M + H)+.
(Пример 6) 3-карбоксиметилциклопентиловый эфир цис-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (469 мг, 90%) получают таким же способом, как в Примере (1e), из метилового эфира цис-(3-гидроксициклопентил)уксусной кислоты (Helvetica Chimica Acta 1992, 75, 1944) (221 мг) и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (321 мг). Этот метиловый сложный эфир гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (455 мг, количественный выход) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,04 (1H, с), 8,55 (1H, д, J=2,3 Гц), 8,15 (1H, дт, J=11,6 и 4,2 Гц), 7,32 (1H, ушир.с), 7,25 (1H, дд, J=8,2 и 1,6 Гц), 7,22 (1H, дд, J=8,2 и 1,2 Гц), 7,14 (1H, дд, J=8,6 и 8,6 Гц), 7,10 (1H, д, J=8,2 Гц), 7,03-6,98 (1H, м), 4,99 (1H, т, J=3,7 Гц), 4,47 (2H, ушир.с), 3,57 (2H, т, J=5,6 Гц), 2,77 (2H, т, J=5,9 Гц), 2,31 (2H, д, J=7,1 Гц), 2,23-2,14 (2H, м), 1,84-1,77 (2H, м), 1,73-1,68 (1H, м), 1,37-1,29 (2H, м);
МС (ESI) m/z: 456 (M + H)+.
(Пример 7) 3-карбоксиметилциклопентиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (583 мг, 96%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(3-гидроксициклопентил)уксусной кислоты (Helvetica Chimica Acta 1992, 75, 1944) (280 мг) и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (418 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (357 мг, 63%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,10 (1H, с), 8,61 (1H, д, J=1,1 Гц), 8,15 (1H, дт, J=11,5 и 4,1 Гц), 7,32 (1H, ушир.с), 7,25 (1H, дд, J=8,0 и 1,4 Гц), 7,24-7,21 (1H, м), 7,16-7,10 (2H, м), 7,03-6,98 (1H, м), 5,05-5,01 (1H, м), 4,46 (2H, ушир.с), 3,56 (2H, т, J=5,7 Гц), 2,76 (2H, т, J=5,9 Гц), 2,39-2,33 (1H, м), 2,26-2,23 (2H, м), 2,04-1,96 (1H, м), 1,94-1,85 (2H, м), 1,66-1,58 (1H, м), 1,48-1,41 (1H, м), 1,23-1,14 (1H, м);
МС (ESI) m/z: 456 (M + H)+.
(Пример 8) 4-карбоксициклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
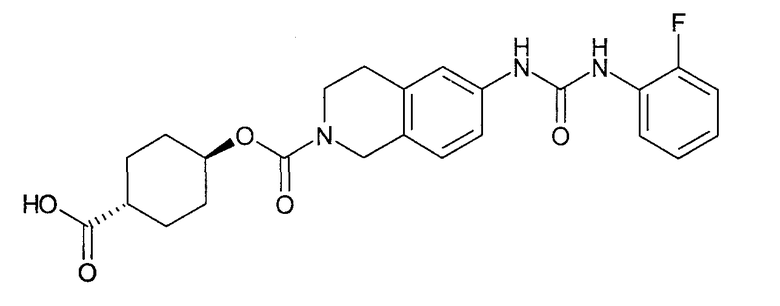
Метиловый сложный эфир (76 мг, 16%) получают таким же способом, как в Примере (1e), из транс-4-карбометоксициклогексанола (J. Org. Chem. 1962, 27, 4141.) (221 мг) и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (321 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (36 мг, 49%) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,2 (1Н, ушир.с), 9,04 (1H, с), 8,55 (1H, д, J=2,3 Гц), 8,15 (1H, дт, J=11,7 и 4,1 Гц), 7,33 (1H, ушир.с), 7,25 (1H, дд, J=8,2 и 1,6 Гц), 7,22 (1H, дд, J=8,3 и 1,5 Гц), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,55-4,50 (1H, м), 4,47 (2H, с), 3,57 (2H, т, J=5,9 Гц), 2,77 (2H, т, J=5,9 Гц), 2,26-2,20 (1H, м), 1,95-1,90 (4H, м), 1,46-1,37 (4H, м);
МС (ESI) m/z: 456 (M + H)+.
(Пример 9) 4-карбоксициклогексиловый эфир цис-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (469 мг, количественный выход) получают таким же способом, как в Примере (1e), из цис-4-карбометоксициклогексанола (J. Org. Chem. 1962, 27, 4141) (249 мг) и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (321 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (156 мг, 34%) в виде светло-коричневого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,02 (1H, с), 8,53 (1H, д, J=2,7 Гц), 8,16 (1H, дт, J=11,5 и 4,1 Гц), 7,33 (1H, с), 7,26-7,21 (2H, м), 7,16-7,10 (2H, м), 7,03-6,98 (1H, м), 4,79 (1H, ушир.с), 4,49 (2H, ушир.с), 3,60 (2H, ушир.с), 2,79 (2H, ушир.с), 2,34 (1H, т, J=6,5 Гц), 1,77-1,62 (8H, м);
МС (ESI) m/z: 456 (M + H)+.
(Пример 10) 4-(2-карбоксиэтил)циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
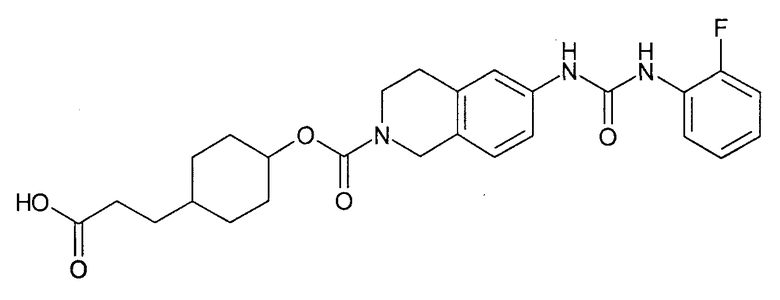
Метиловый сложный эфир (429 мг, 66%) получают таким же способом, как в Примере (1e), из метилового эфира 3-(4-гидроксициклогексил)пропионовой кислоты (Tetrahedron 1966, 22, 861.) (360 мг) и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (418 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (65 мг, 16%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, ушир.с), 9,02 (1H, с), 8,54 (1H, д, J=2,3 Гц), 8,16 (1H, дд, J=8,2 и 8,2 Гц), 7,33 (1H, с), 7,27-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,83-4,47 (3H, м), 3,64-3,55 (3H, м), 2,79-2,75 (2H, м), 2,23 (2H, дд, J=16,3 и 8,8 Гц), 1,95-1,72 (3H, м), 1,53-1,42 (4H, м), 1,32-1,20 (3H, м);
МС (ESI) m/z: 484 (M + H)+.
(Пример 11) 4-карбоксиметиленциклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(11a) метиловый эфир (4-оксоциклогексилиден)уксусной кислоты
С метилового эфира (1,4-диоксаспиро[4.5]дец-8-илиден)уксусной кислоты (594 мг), полученного в Примере (1a), снимают защиту таким же путем, как в Примере (1с), получая указанное в заголовке соединение (395 мг, 84%).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 5,87 (1Н, с), 3,73 (3H, с), 3,22 (2H, дт, J=9,8 и 3,6 Гц), 2,67 (2H, т, J=6,8 Гц), 2,50 (4H, дт, J=7,2 и 7,2 Гц).
(11b) метиловый эфир (4-гидроксициклогексилиден)уксусной кислоты
Указанное в заголовке соединение (335 мг, 84%) получают в виде бесцветного масла таким же способом, как в Примере (1d), из метилового эфира (4-оксоциклогексилиден)уксусной кислоты (395 мг), полученного в Примере (11a).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 5,67 (1H, с), 3,97-3,93 (1H, м), 3,32 (3H, с), 3,39-3,32 (1H, м), 2,55-2,48 (1H, м), 2,46-2,40 (1H, м), 2,22-2,15 (1H, м), 2,01-1,93 (2H, м), 1,65-1,54 (3H, м).
(11с) 4-карбоксиметиленциклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (258 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира (4-гидроксициклогексилиден)уксусной кислоты (119 мг), полученного в Примере (11b), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (161 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (80 мг, 34%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, ушир.с), 9,02 (1H, с), 8,54 (1H, д, J=2,0 Гц), 8,16 (1H, дт, J=11,6 и 4,2 Гц), 7,33 (1H, ушир.с), 7,25 (1H, дд, J=8,2 и 1,2 Гц), 7,23 (1H, дд, J=6,3 и 2,0 Гц), 7,16-7,11 (2H, м), 7,03-6,98 (1H, м), 5,64 (1H, с), 4,88-4,83 (1H, м), 4,54-4,47 (2H, м), 3,63-3,58 (2H, м), 3,00-2,92 (1H, м), 2,83-2,79 (1H, м), 2,78 (2H, т, J=5,6 Гц), 2,42-2,33 (1H, м), 2,26-2,19 (1H, м), 1,91-1,79 (2H, м), 1,74-1,60 (2H, м);
МС (ESI) m/z: 468 (M + H)+.
(Пример 12) 4-карбоксиметилциклогекс-3-ениловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(12a) метиловый эфир (4-оксоциклогекс-1-енил)уксусной кислоты
С метилового эфира (1,4-диоксаспиро[4.5]дец-7-ен-8-ил)-уксусной кислоты (2,21 г), полученного в качестве побочного продукта в Примере (1a), снимают защиту таким же путем, как в Примере (1с), получая указанное в заголовке соединение (996 мг, 57%).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 5,64 (1Н, с), 3,71 (3H, с), 3,12 (2H, с), 2,91-2,90 (2H, м), 2,55-2,51 (4H, м).
(12b) метиловый эфир (4-гидроксициклогекс-1-енил)уксусной кислоты
Указанное в заголовке соединение (677 мг, 67%) получают в виде бесцветного масла таким же способом, как в Примере (1d), из метилового эфира (4-оксоциклогекс-1-енил)уксусной кислоты (996 мг), полученного в Примере (12a).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 5,47 (1H, с), 3,99-3,95 (1H, м), 3,69 (3H, с), 2,99 (2H, с), 2,40 (1H, д, J=18,4 Гц), 2,17-2,16 (2H, м), 2,09-2,03 (2H, м), 2,09-2,03 (1H, м), 2,09-2,03 (1H, м).
(12c) 4-карбоксиметилциклогекс-3-ениловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (256 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира (4-гидроксициклогекс-1-енил)уксусной кислоты (119 мг), полученного в Примере (12b), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (161 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (191 мг, 77%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,2 (1H, ушир.с), 9,04 (1H, с), 8,55 (1H, д, J=1,9 Гц), 8,15 (1H, дт, J=11,5 и 4,1 Гц), 7,32 (1H, ушир.с), 7,25 (1H, дд, J=8,0 и 1,4 Гц), 7,22 (1H, дд, J=8,2 и 1,6 Гц), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 5,41 (1H, с), 4,84-4,81 (1H, м), 4,47 (2H, с), 3,57 (2H, т, J=6,9 Гц), 2,91 (2H, с), 2,76 (2H, т, J=5,9 Гц), 2,50-2,45 (1H, м), 2,39-2,32 (1H, м), 2,14-2,04 (2H, м), 1,83-1,70 (2H, м);
МС (ESI) m/z: 468 (M + H)+.
(Пример 13) 4-(карбокси-1-метилэтил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
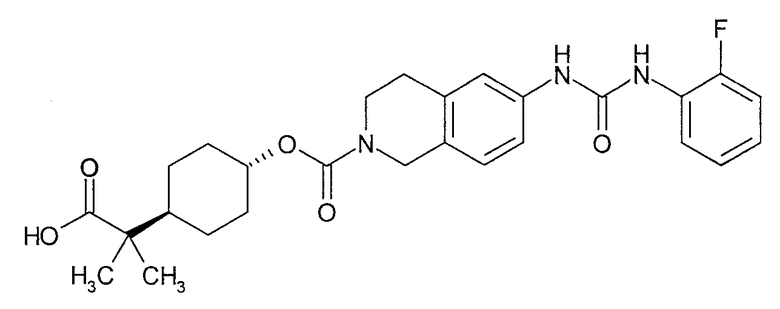
(13a) метиловый эфир (1,4-диоксаспиро[4.5]дец-8-ил)-2-метилпропионовой кислоты
К раствору метилового эфира (1,4-диоксаспиро[4.5]дец-8-ил)уксусной кислоты (1,40 г), полученного в Примере (1b), в тетрагидрофуране (10 мл) добавляют при 0°C LDA (1,8 моль/л смеси гептан/тетрагидрофуран/этилбензол, 11 мл). Через 30 минут к реакционной смеси добавляют йодметан (4,1 мл). Образовавшуюся суспензию нагревают до комнатной температуры на протяжении 2 часов или более длительного периода времени, затем перемешивают в течение 18 часов и разбавляют водой с последующей экстракцией этилацетатом. Органический слой промывают 10% водным раствором лимонной кислоты и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают хроматографией (смесь гексан/этилацетат=4:1). Полученное соединение в виде масла повторно подвергают воздействию этих операций обработки, получая указанное в заголовке соединение (666 мг, 42%) в виде светло-коричневого масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,94 (4H, с), 3,67 (3H, с), 1,82-1,74 (2H, м), 1,69-1,47 (5H, м), 1,41-1,27 (2H, м), 1,13 (6H, с);
МС (FAB) m/z: 243 (M + H)+.
(13b) метиловый эфир 2-метил-2-(4-оксоциклогексил)пропионовой кислоты
Указанное в заголовке соединение (544 мг, 100%) получают в виде бесцветного масла таким же способом, как в Примере (1c), из метилового эфира (1,4-диоксаспиро[4.5]дец-8-ил)-2-метилпропионовой кислоты (666 мг), полученного в Примере (13a).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,70 (3H, с), 2,45-2,30 (4H, м), 2,13-2,04 (1H, м), 1,96-1,90 (2H, м), 1,55-1,44 (2H, м), 1,18 (6H, с);
МС (EI) m/z: 198 (M)+.
(13c) метиловый эфир 2-(4-гидроксициклогексил)-2-метилпропионовой кислоты
Указанное в заголовке соединение (398 мг, 73%) получают в виде бесцветного масла таким же способом, как в Примере (1d), из метилового эфира 2-метил-2-(4-оксоциклогексил)пропионовой кислоты, полученного в Примере (13b).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,69 (3H, ушир.с), 3,67 (1H, с), 3,60-3,48 (1H, м), 2,14-1,97 (2H, м), 1,73-1,53 (3H, м), 1,35-1,14 (4H, м), 1,11 (6H, с).
(13d) 4-(карбокси-1-метилэтил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (123 мг, 96%) получают таким же способом, как в Примере (1e), из метилового эфира 2-(4-гидроксициклогексил)-2-метилпропионовой кислоты (74 мг), полученного в Примере (13c), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (80 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (29 мг, 24%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,09 (1H, с), 8,60 (1H, с), 8,15 (1H, дд, J=8,2 и 8,2 Гц), 7,33 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,50-4,41 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,1 Гц), 2,03-1,95 (2H, м), 1,66-1,50 (3H, м), 1,38-1,24 (2H, м), 1,19-1,05 (2H, м), 1,02 (6H, с);
МС (ESI) m/z: 498 (M + H)+.
(Пример 14) c-4-карбоксиметил-c-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(14a) цис-7-метил-1,4-диоксаспиро[4.5]декан-8-ол
К раствору 7-метил-1,4-диоксаспиро[4.5]декан-8-она (Tetrahedron Asymmetry 2001, 12, 1683) (9,50 г) в тетрагидрофуране (100 мл) постепенно добавляют при -78°C K-Selectride (1,0 моль/л тетрагидрофурановый раствор, 65 мл). Через 1 час реакционную смесь нагревают до 0°C и туда постепенно добавляют 1N водный раствор (120 мл) гидроксида натрия и 30% водный гидропероксид (100 мл). Очищенную водную смесь перемешивают на протяжении ночи, затем следует две экстракции дихлорметаном. Органический слой промывают насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают хроматографией (смесь гексан/этилацетат=4:1→2:1→1:1), получая указанное в заголовке соединение (8,18 г, 85%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,02-3,91 (4H, м), 4,02-3,91 (1H, м), 1,81-1,23 (8H, м), 0,99 (3H, д, J=7,0 Гц).
(14b) цис-4-гидрокси-3-метилциклогексанон
Смешанный раствор 1N хлористоводородная кислота (250 мл)/ацетон (250 мл) цис-7-метил-1,4-диоксаспиро[4.5]декан-8-ола (19,9 г), полученного в Примере (14a), перемешивают при комнатной температуре в течение 16 часов. Органический растворитель удаляют при пониженном давлении. Оставшуюся водную смесь подвергают 6 экстракциям этилацетатом. Органический слой промывают насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток сушат при пониженном давлении, получая указанное в заголовке соединение (14,4 г, 97%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,05-3,99 (1H, м), 2,71-2,61 (1H, м), 2,47 (1H, дд, J=13,3 и 13,3 Гц), 2,28-2,01 (5H, м), 1,94-1,81 (1H, м), 1,07 (3H, д, J=6,7 Гц).
(14c) цис-4-(трет-бутилдиметилсиланилокси)-3-метилциклогексанон
К раствору в диметилформамиде (100 мл) цис-4-гидрокси-3-метилциклогексанона (14,4 г), полученного в Примере (14b), и имидазола (15,3 г) добавляют при комнатной температуре трет-бутилдиметилсилилхлорид (25,3 г). Реакционную смесь перемешивают в течение 27 часов, разбавляют этилацетатом, промывают водой (дважды) и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают хроматографией (смесь гексан/этилацетат=1:0→40:1→20:1→10:1), получая указанное в заголовке соединение (21,6 г, 80%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,83-3,79 (1H, м), 2,61-2,49 (1H, м), 2,37 (1H, дд, J=13,3 и 13,3 Гц), 2,11-1,82 (4H, м), 1,73-1,66 (1H, м), 0,89 (3H, д, J=6,7 Гц), 0,83 (9H, с), 0,00 (6H, с).
(14d) метиловый эфир цис-{4-(трет-бутилдиметилсиланилокси)-3-метилциклогексилиден}уксусной кислоты
Указанное в заголовке соединение (23,0 г, 87%) получают в виде бесцветного масла таким же способом, как в Примере (1a), из цис-4-(трет-бутилдиметилсиланилокси)-3-метилциклогексанона (21,6 г), полученного в Примере (14c).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 5,62 (1Н, д, J=8,2 Гц), 3,86-3,81 (1H, м), 3,68 (3H, с), 3,45-3,31 (1H, м), 2,57-2,22 (2H, м), 2,08-1,81 (2H, м), 1,74-1,64 (1H, м), 1,62-1,48 (1H, м), 0,95-0,90 (12H, м), 0,08-0,05 (6H, м);
МС (FAB) m/z: 321 (M + Na)+, m/z: 299 (M + H)+.
(14e) метиловый эфир цис-{4-(трет-бутилдиметилсиланилокси)-3-метилциклогексил}-1-уксусной кислоты (цис относительная конфигурация при С3 против C4 и смесь цис/транс относительной конфигурации при С1 против C3 или C1 против C4).
Указанное в заголовке соединение (21,4 г, 92%) получают в виде масла (диастереомерная смесь) таким же способом, как в Примере (1b) из метилового эфира цис-{4-(трет-бутилдиметилсиланилокси)-3-метилциклогексилиден}уксусной кислоты (23,0 г), полученного в Примере (14d).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,76-3,71 (1H, м), 3,67 (3H, с), 2,20 (2H, д, J=7,4 Гц), 1,85-1,70 (2H, м), 1,54-1,11 (6H, м), 1,54-1,11 (9H, м), 0,85 (3H, д, J=7,0 Гц), 0,04-0,00 (6H, м);
МС (FAB) m/z: 323 (M + Na)+, m/z: 301 (M + H)+.
(14f) метиловый эфир (c-4-гидрокси-c-3-метилциклогексил)-r-1-уксусной кислоты
К раствору метилового эфира цис-{4-(трет-бутилдиметилсиланилокси)-3-метилциклогексил}-1-уксусной кислоты (21,4 г), полученного в Примере (14e), в тетрагидрофуране (100 мл) добавляют при комнатной температуре комплекс (20 мл) гидрофторид/пиридин. Реакционную смесь перемешивают в течение 19 часов и разбавляют водой с последующими двумя экстракциями этилацетатом. Органический слой промывают дважды насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают хроматографией (смесь гексан/этилацетат=2:1→1:1), получая указанное в заголовке соединение (8,57 г, 65%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,83-3,78 (1H, м), 3,68 (3H, с), 2,22 (2H, дд, J=7,0 и 2,4 Гц), 1,90-1,79 (2H, м), 1,65-1,25 (6H, м), 1,10 (1H, дд, J=25,0 и 12,5 Гц), 0,96 (3H, д, J=7,0 Гц).
(14g) метиловый эфир (t-4-гидрокси-t-3-метилциклогексил)-r-1-уксусной кислоты
Указанное в заголовке соединение получают в виде бесцветного масла в качестве побочного продукта (1,24 г, 9%) в синтезе примера (14f).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,76-3,70 (1Н, м), 3,67 (3H, с), 2,26-2,17 (2H, м), 2,10-2,00 (1H, м), 1,85-1,74 (3H, м), 1,70-1,50 (2H, м), 1,33-1,20 (2H, м), 1,12-1,02 (1H, м), 0,98 (3H, д, J=7,0 Гц).
(14h) с-4-карбоксиметил-с-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (120 мг, 86%) получают таким же способом, как в Примере (1e), из метилового эфира (с-4-гидрокси-с-3-метилциклогексил)-r-1-уксусной кислоты (73 мг), полученного в Примере (14f), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (90 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (53 мг, 53%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, ушир.с), 9,12 (1H, с), 8,63 (1H, с), 8,20-8,07 (1H, м), 7,37-6,92 (6H, м), 4,78-4,71 (1H, м), 4,57-4,42 (2H, м), 3,69-3,53 (2H, м), 2,82-2,73 (2H, м), 2,14 (2H, д, J=6,7 Гц), 1,87-1,60 (3H, м), 1,54-1,42 (3H, м), 1,19-0,96 (2H, м), 0,86-0,78 (3H, м);
МС (ESI) m/z: 484 (M + H)+.
(Пример 15) t-4-карбоксиметил-c-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (1,49 г, 80%) получают таким же способом, как в Примере (1e), из метилового эфира (t-4-гидрокси-t-3-метилциклогексил)-r-1-уксусной кислоты (841 мг), полученного в Примере (14g), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (1,21 г). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (780 мг, 54%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,02 (1H, с), 8,54 (1H, с), 8,18-8,14 (1H, м), 7,32 (1H, с), 7,27-7,21 (2H, м), 7,16-7,10 (2H, м), 7,03-6,98 (1H, м), 4,69-4,64 (1H, м), 4,54-4,43 (2H, м), 3,64-3,54 (2H, м), 2,83-2,73 (2H, м), 2,20-1,93 (4Н, м), 1,76-1,53 (3H, м), 1,35-1,24 (1H, м), 1,16-1,06 (1H, м), 0,92 (3H, д, J=7,1 Гц), 0,93-0,88 (1H, м);
МС (ESI) m/z: 484 (M + H)+.
(Пример 16) t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
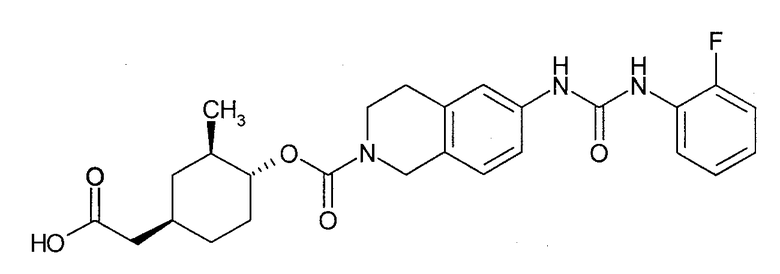
(16a) метиловый эфир (t-4-гидрокси-с-3-метилциклогексил)-r-1-уксусной кислоты
К раствору метилового эфира (c-4-гидрокси-c-3-метилциклогексил)-r-1-уксусной кислоты (8,57 г), полученного в Примере (14f), в дихлорметане (100 мл) добавляют при комнатной температуре Dess-Martin реагент (23,4 г). Реакционную смесь перемешивают в течение 20 часов, затем разбавляют насыщенным водным раствором бикарбоната натрия и затем фильтруют. Фильтрат подвергают экстракции дихлорметаном. Органический слой промывают дважды насыщенным водным раствором бикарбоната натрия, затем сушат над сульфатом натрия и затем концентрируют. Остаток сушат при пониженном давлении, получая кетон (7,55 г). Этот кетон (7,55 г) восстанавливают таким же способом, как в Примере (1d), получая указанное в заголовке соединение (3,10 г, 36%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,68 (3H, с), 3,16-3,09 (1H, м), 2,20 (2H, д, J=7,1 Гц), 2,00-1,94 (1H, м), 1,90-1,70 (3H, м), 1,52 (1H, ушир.с), 1,44-1,25 (2H, м), 1,11-1,04 (1H, м), 1,01 (3H, д, J=6,2 Гц), 0,79 (1H, дт, J=12,4 и 12,5 Гц).
(16b) t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (1,95 г) получают таким же способом, как в Примере (1e), из метилового эфира (t-4-гидрокси-с-3-метилциклогексил)-r-1-уксусной кислоты (842 мг), полученного в Примере (16a), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (1,22 г). Этот метиловый сложный эфир гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (1,33 г, 73%, две стадии) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,02 (1H, с), 8,54 (1H, с), 8,16 (1H, дд, J=8,2 и 8,2 Гц), 7,33 (1H, с), 7,27-7,22 (2H, м), 7,16-7,10 (2H, м), 7,03-6,98 (1H, м), 4,54-4,43 (2H, м), 4,22-4,16 (1Н, м), 3,64-3,55 (2H, м), 2,77 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=6,7 Гц), 1,96-1,90 (1H, м), 1,77-1,68 (3H, м), 1,66-1,56 (1H, м), 1,35-1,24 (1H, м), 1,11-0,99 (1H, м), 0,90-0,80 (4H, м);
МС (ESI) m/z: 484 (M + H)+.
(Пример 17) [4-(2-{6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-ил}-2-оксоэтил)циклогексил]уксусная кислота

Раствор в диметилформамиде (5 мл) (4-метоксикарбонилметилциклогексил)уксусной кислоты (US2001/9912 A1) (378 мг), гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (82 мг), T3P (1,3 мл) и триэтиламина (0,62 мл) перемешивают в течение 24 часов. Реакционную смесь разбавляют этилацетатом, промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают хроматографией (смесь дихлорметан/этилацетат), получая метиловый сложный эфир (533 мг, 74%). Этот метиловый сложный эфир гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (456 мг, 88%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, ушир.с), 9,04-9,04 (1H, м), 8,56 (1H, с), 8,17-8,13 (1H, м), 7,35-7,31 (1H, м), 7,26-7,19 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,59-4,54 (2H, м), 3,66 (2H, т, J=5,5 Гц), 2,81 (1H, т, J=5,1 Гц), 2,72-2,71 (1H, м), 2,28-2,26 (3H, м), 2,08-2,06 (1H, м), 1,97-1,83 (2H, м), 1,73-1,53 (3H, м), 1,50-1,29 (2H, м), 0,97-0,94 (3H, м);
МС (ESI) m/z: 468 (M + H)+.
(Пример 18) 4-карбамоилметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Раствор в DMF (15 мл) 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (527 мг), полученного в Примере 2, HOBt (166 мг), EDCI (236 мг) и водного раствора аммиака (0,5 мл) перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь разбавляют этилацетатом, промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, затем сушат и концентрируют. Остаток очищают хроматографией (NH силикагель, смесь дихлорметан/метанол=30:1→5:1), получая твердое вещество. Это твердое вещество перекристаллизовывают (изопропанол), получая указанное в заголовке соединение (89 мг, 17%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,03 (1Н, с), 8,55 (1H, д, J=2,7 Гц), 8,15 (1H, дт, J=11,7 и 4,2 Гц), 7,32 (1H, ушир.с), 7,26-7,21 (3H, м), 7,16-7,10 (2H, м), 7,03-6,98 (1H, м), 6,73 (1H, ушир.с), 4,52-4,47 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 1,94 (2H, д, J=7,1 Гц), 1,92-1,91 (2H, м), 1,73 (2H, д, J=13,3 Гц), 1,68-1,62 (1H, м), 1,38-1,28 (2H, м), 1,08-0,98 (2H, м);
МС (ESI) m/z: 469 (M + H)+.
(Пример 19) 4-[(1-карбокси-1-метил-1-этилкарбамоил)метил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (58 мг, 19%) получают таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (246 мг), полученного в Примере 2, и гидрохлорида метилового эфира 2-амино-2-метилпропионовой кислоты (89 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (18 мг, 32%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,2 (1H, ушир.с), 9,11 (1H, с), 8,63 (1H, д, J=2,7 Гц), 8,24 (1H, дт, J=11,7 и 4,2 Гц), 8,07 (1H, с), 7,41 (1H, д, J=1,9 Гц), 7,35-7,30 (2H, м), 7,25-7,18 (2H, м), 7,12-7,08 (1H, м), 4,59-4,53 (3H, м), 3,66 (2H, т, J=5,7 Гц), 2,85 (2H, т, J=5,9 Гц), 2,05-1,99 (4H, м), 1,85-1,80 (2H, м), 1,77-1,70 (2H, м), 1,46-1,35 (2H, м), 1,40 (6H, с), 1,17-1,07 (2H, м);
МС (ESI) m/z: 555 (M + H)+.
(Пример 20) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (142 мг, 89%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (81 мг), полученного в Примере (1d), и гидрохлорида 1-(3-этоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (109 мг). Этот метиловый сложный эфир гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (81 мг, 59%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 8,78 (1H, с), 8,73 (1H, с), 7,35-7,31 (1H, м), 7,24-7,07 (4H, м), 6,92-6,89 (1H, м), 6,56-6,52 (1H, м), 4,53-4,43 (3H, м), 3,99 (2H, кв., J=7,1 Гц), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,0 Гц), 1,98-1,88 (2H, м), 1,79-1,52 (4H, м), 1,39-1,27 (1H, м), 1,32 (3H, т, J=7,1 Гц), 1,12-1,02 (2H, м);
МС (ESI) m/z: 496 (M + H)+.
(Пример 21) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (193 мг, 93%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (101 мг), полученного в Примере (1d), и гидрохлорида 1-(2-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (140 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (91 мг, 49%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1Н, с), 9,25 (1H, с), 8,20 (1H, с), 8,13 (1H, с), 7,33 (1H, с), 7,23-7,24 (1H, м), 7,12-6,85 (4H, м), 4,54-4,40 (3H, м), 3,88 (3H, с), 3,61-3,53 (2H, м), 2,80-2,72 (2H, м), 2,12 (2H, д, J=7,1 Гц), 1,99-1,87 (2H, м), 1,81-1,60 (3H, м), 1,40-1,27 (2H, м), 1,14-1,00 (2H, м);
МС (ESI) m/z: 482 (M + H)+.
(Пример 22) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-фтор-2-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(22a) трет-бутиловый эфир 6-[3-(5-фтор-2-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Раствор 5-фтор-2-метоксибензойной кислоты (1,00 г) в тетрагидрофуране (20 мл), DPPA (1,25 мл) и триэтиламина (1,6 мл) нагревают при температуре образования флегмы в течение 1 часа. Раствор 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (1,00 г) в тетрагидрофуране (10 мл) добавляют к реакционной смеси. Далее реакционную смесь нагревают при температуре образования флегмы в течение 5,5 часов, затем охлаждают до комнатной температуры и затем концентрируют. Остаток очищают хроматографией (смесь дихлорметан/этилацетат=20:1→4:1), получая указанное в заголовке соединение (1,51 г, 90%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,33 (1H, с), 8,38 (1H, с), 8,05-7,97 (1H, м), 7,38-7,28 (1H, м), 7,24-7,16 (1H, м), 7,10-7,05 (1H, м), 7,02-6,97 (1H, м), 6,77-6,69 (1H, м), 4,41 (2H, с), 3,84 (3H, с), 3,51 (2H, т, J=6,1 Гц), 2,73 (2H, т, J=7,0 Гц), 1,41 (9H, с);
МС (FAB) m/z: 416 (M + H)+.
(22b) гидрохлорид 1-(5-фтор-2-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Суспензию трет-бутилового эфира 6-[3-(5-фтор-2-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,20 г), полученного в Примере (22a), и 4N хлористоводородной кислоты (раствор в 1,4-диоксане, 10 мл) перемешивают при комнатной температуре в течение 15 часов и разбавляют диизопропиловым эфиром. Осадок собирают фильтрацией и сушат, получая указанное в заголовке соединение (1,20 г, 94%) в виде светло-бежевого твердого вещества.
МС (ESI) m/z: 316 (M + H)+.
(22c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-фтор-2-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (134 мг, 91%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (74 мг), полученного в Примере (1d), и гидрохлорида 1-(5-фтор-2-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (101 мг), полученного в Примере (22b). Этот метиловый сложный эфир (129 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (61 мг, 53%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1Н, ушир.с), 9,35 (1H, с), 8,40 (1H, с), 8,02 (1H, дд, J=11,4 и 3,1 Гц), 7,33 (1H, с), 7,23-7,18 (1H, м), 7,13-7,08 (1H, м), 7,01 (1H, дд, J=9,0 и 5,5 Гц), 6,75 (1H, ддд, J=8,6, 8,6 и 3,2 Гц), 4,53-4,43 (3H, м), 3,87 (3H, с), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,6 Гц), 2,12 (2H, д, J=7,1 Гц), 1,97-1,88 (2H, м), 1,80-1,71 (2H, м), 1,71-1,60 (1H, м), 1,40-1,30 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 500 (M + H)+.
(Пример 23) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-метокси-5-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (103 мг, 81%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (65 мг), полученного в Примере (1d), и гидрохлорида 1-(2-метокси-5-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (88 мг). Этот метиловый сложный эфир (92 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (38 мг, 43%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, ушир.с), 9,24 (1H, с), 8,14 (1H, с), 7,99 (1H, с), 7,35 (1H, с), 7,23-7,15 (1H, м), 7,12-7,05 (1H, м), 6,89 (1H, д, J=8,3 Гц), 6,74 (1H, д, J=9,0 Гц), 4,52-4,41 (3H, м), 3,83 (3H, с), 3,57 (2H, т, J=5,6 Гц), 2,75 (2H, т, J=5,5 Гц), 2,22 (3H, с), 2,12 (2H, д, J=6,7 Гц), 1,98-1,88 (2H, м), 1,81-1,60 (3H, м), 1,42-1,28 (2H, м), 1,14-1,00 (2H, м);
МС (ESI) m/z: 496 (M + H)+.
(Пример 24) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-метоксипиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(24a) трет-бутиловый эфир 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К раствору 4-нитрофенилхлорформиата (812 мг) в дихлорметане (10 мл) постепенно добавляют при 0°C раствор в дихлорметане (10 мл) 6-амино-2N-Boc-l,2,3,4-тетрагидроизохинолина (1,00 г) и пиридина (0,33 мл). Реакционную смесь перемешивают при 0°C в течение 1 часа и при комнатной температуре в течение 2 часов и затем концентрируют. Остаток энергично перемешивают в смешанном растворе диизопропилового эфира и воды (диизопропиловый эфир/вода). Осадок собирают фильтрацией и сушат при пониженном давлении, получая указанное в заголовке соединение (1,46 г, 88%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,40-8,24 (3H, м), 7,50-6,99 (4H, м), 5,33 (1H, ушир.с), 4,67-4,49 (2H, м), 4,67-4,49 (2H, м), 2,97-2,79 (2H, м), 1,50 (9H, с).
(24b) трет-бутиловый эфир 6-[3-(2-метоксипиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Смесь трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,46 г), полученного в Примере (24a), 3-амино-2-метоксипиридина (441 мг) и ацетонитрила (20 мл) нагревают при температуре образования флегмы в течение 5 часов и концентрируют. Остаток разбавляют этилацетатом, затем промывают насыщенным водным раствором бикарбоната натрия (дважды) и насыщенным раствором соли и затем концентрируют. Остаток очищают хроматографией (смесь дихлорметан/этилацетат), получая указанное в заголовке соединение (770 мг, 55%) в виде беловатой пены
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,46 (1Н, д, J=9,4 Гц), 7,79 (1H, д, J=5,1 Гц), 7,52-6,94 (5H, м), 6,89 (1H, дд, J=7,8 и 5,1 Гц), 4,52 (2H, с), 3,93 (3H, с), 3,62 (2H, т, J=5,9 Гц), 2,81-2,72 (2H, м), 1,51 (9H, с);
МС (ESI) m/z: 399 (M + H)+
(24c) дигидрохлорид 1-(2-метоксипиридин-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (720 мг, количественный выход) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2-метоксипиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (755 мг), полученного в Примере (24b).
МС (ESI) m/z: 299 (M + H)+.
(24d) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-метоксипиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (115 мг, 72%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (84 мг), полученного в Примере (1d), и дигидрохлорида 1-(2-метоксипиридин-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (119 мг), полученного в Примере (24c). Этот метиловый сложный эфир (110 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (54 мг, 50%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, ушир.с), 9,28 (1H, с), 8,42-8,38 (1H, м), 8,33 (1H, с), 7,80-7,72 (1H, м), 7,32 (1H, с), 7,25-7,19 (1H, м), 7,14-7,07 (1H, м), 6,99-6,91 (1H, м), 4,55-4,41 (3H, м), 3,97 (3H, с), 3,62-3,54 (2H, м), 2,80-2,73 (2H, м), 2,12 (2H, д, J=7,1 Гц), 1,98-1,89 (2H, м), 1,81-1,61 (3H, м), 1,42-1,28 (2H, м), 1,14-1,01 (2H, м);
МС (ESI) m/z: 483 (M + H)+.
(Пример 25) 4-карбоксиметилциклогексиловый эфир транс-6-(бензоксазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(25a) гидрохлорид бензоксазол-2-ил-(1,2,3,4-тетрагидроизохинолин-6-ил)амина
Раствор 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (1,00 г) и 2-хлорбензоксазола (0,50 мл) в 1-бутаноле (10 мл) нагревают при температуре образования флегмы в течение 11 часов, затем охлаждают до комнатной температуры и затем разбавляют этилацетатом. Осадок собирают фильтрацией, затем промывают этилацетатом и сушат при пониженном давлении, получая указанное в заголовке соединение (791 мг, 65%) в виде бежевого твердого вещества.
МС (ESI) m/z: 266 (M + H)+.
(25b) 4-карбоксиметилциклогексиловый эфир транс-6-(бензоксазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (103 мг, 72%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (74 мг), полученного в Примере (1d), и гидрохлорида бензоксазол-2-ил-(1,2,3,4-тетрагидроизохинолин-6-ил)амина (93 мг), полученного в Примере (25a). Этот метиловый сложный эфир (100 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (46 мг, 45%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, ушир.с), 10,6 (1H, с), 7,64-7,45 (3H, м), 7,26-7,11 (4H, м), 4,58-4,46 (3H, м), 3,59 (2H, т, J=5,9 Гц), 2,81 (2H, т, J=5,3 Гц), 2,12 (2H, д, J=6,7 Гц), 1,98-1,88 (2H, м), 1,81-1,61 (3H, м), 1,41-1,28 (2H, м), 1,15-0,99 (2H, м);
МС (ESI) m/z: 450 (M + H)+.
(Пример 26) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(26a) трет-бутиловый эфир 6-[3-(2-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Раствор 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (981 мг) и 2-этоксифенилизоцианата (0,9 мл) в тетрагидрофуране (10 мл) перемешивают при комнатной температуре в течение 4 часов и затем концентрируют. Остаток очищают хроматографией (смесь гексан:этилацетат=5:1→1:1 и затем смесь метиленхлорид:этилацетат=1:0→1:1), получая указанное в заголовке соединение (1,62 г, количественный выход) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,14 (1Н, дд, J=7,7 и 2,2 Гц), 7,32-7,29 (2H, м), 7,22-7,17 (1H, м), 7,06 (1H, д, J=7,0 Гц), 7,01-6,94 (2H, м), 6,85 (1H, дд, J=7,4 и 2,0 Гц), 6,78 (1H, с), 4,54 (2H, с), 4,04 (2H, кв., J=7,0 Гц), 3,63 (2H, ушир.с), 2,80 (2H, т, J=5,9 Гц), 1,50 (9H, с), 1,35 (3H, т, J=7,1 Гц).
(26b) гидрохлорид 1-(2-этоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,37 г, количественный выход) получают в виде желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,63 г), полученного в Примере (26a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,63 (1H, с), 9,22 (1H, ушир.с), 8,17 (1H, с), 8,11 (1H, дд, J=8,1 и 1,8 Гц), 7,43 (1H, д, J=1,9 Гц), 7,29 (1H, дд, J=8,2 и 2,3 Гц), 7,13 (1H, д, J=8,6 Гц), 7,01 (1H, дд, J=8,2 и 1,5 Гц), 6,93 (1H, дт, J=10,8 и 3,9 Гц), 6,88 (1H, дт, J=10,7 и 3,8 Гц), 4,19 (2H, с), 4,13 (2H, кв., J=7,1 Гц), 3,36 (2H, т, J=6,4 Гц), 3,36 (2H, т, J=6,4 Гц), 1,42 (3H, т, J=6,9 Гц).
(26c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (477 мг, 94%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (241 мг), полученного в Примере (1d), и гидрохлорида 1-(2-этоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (347 мг), полученного в Примере (26b). Этот метиловый сложный эфир (477 мг) гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (362 мг, 78%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, ушир.с), 9,35 (1H, с), 8,12 (1H, дд, J=7,8 и 1,9 Гц), 8,06 (1H, с), 7,34 (1H, с), 7,23 (1H, д, J=7,1 Гц), 7,09 (1H, д, J=8,2 Гц), 7,01 (1H, дд, J=7,8 и 1,5 Гц), 6,92 (1H, дт, J=10,8 и 3,8 Гц), 6,87 (1H, дт, J=10,7 и 3,8 Гц), 4,51-4,47 (3H, м), 4,13 (2H, кв., J=7,0 Гц), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,41 (3H, т, J=6,9 Гц), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 496 (M + H)+.
(Пример 27) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этокси-5-фторфенил)урреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(27a) трет-бутиловый эфир 6-[3-(2-этокси-5-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,56 г, 91%) получают в виде белого твердого вещества таким же способом, как в Примере (22a), из 6-амино-2N-Boc-l,2,3,4-тетрагидроизохинолина (996 мг) и 2-этокси-5-фторбензойной кислоты (WO2006004200 A1) (736 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,06 (1H, дд, J=10,9 и 3,2 Гц), 7,39 (1H, ушир.с), 7,19 (1H, ушир.с), 7,15 (1H, м), 6,74 (1H, дд, J=9,0 и 5,1 Гц), 6,66-6,61 (2H, м), 4,55 (2H, с), 4,01 (2H, кв., J=6,8 Гц), 3,64 (2H, т, J=5,2 Гц), 2,83 (2H, т, J=5,9 Гц), 1,50 (9H, с), 1,33 (3H, т, J=7,0 Гц).
(27b) гидрохлорид 1-(2-этокси-5-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,33 г, 99%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2-этокси-5-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,56 г), полученного в Примере (27a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,79 (1Н, с), 9,22 (1H, ушир.с), 8,38 (1H, с), 8,02 (1H, дд, J=11,3 и 3,1 Гц), 7,44 (1H, д, J=2,0 Гц), 7,29 (1H, дд, J=8,4 и 2,2 Гц), 7,15 (1H, д, J=8,2 Гц), 7,01 (1H, дд, J=9,0 и 5,1 Гц), 6,73 (1H, дт, J=12,5 и 4,3 Гц), 4,20 (2H, ушир.с), 4,12 (2H, кв., J=7,0 Гц), 3,37 (2H, т, J=6,6 Гц), 2,99 (2H, т, J=6,2 Гц), 1,41 (3H, т, J=7,1 Гц).
(27c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этокси-5-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (532 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (241 мг), полученного в Примере (1d), и гидрохлорида 1-(2-этокси-5-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (365 мг), полученного в Примере (27b). Этот метиловый сложный эфир (532 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (439 мг, 85%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,2 (1H, ушир.с), 9,47 (1H, с), 8,25 (1H, с), 8,02 (1H, дд, J=11,8 и 3,1 Гц), 7,35 (1H, с), 7,22 (1H, д, J=7,8 Гц), 7,11 (1H, д, J=8,6 Гц), 7,00 (1H, дд, J=9,0 и 5,4 Гц), 6,72 (1H, дт, J=12,4 и 4,3 Гц), 4,49-4,47 (3H, м), 4,12 (2H, кв., J=7,0 Гц), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,0 Гц), 1,94-1,90 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,40 (3H, т, J=7,0 Гц), 1,39-1,29 (2H, м), 1,11-1,02 (2Н, м);
МС (ESI) m/z: 514 (M + H)+.
(Пример 28) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(28a) трет-бутиловый эфир 6-[3-(2-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К раствору трифосгена (474 мг) в дихлорметане (10 мл) постепенно при комнатной температуре добавляют раствор 2-изопропиланилина (540 мг) и триэтиламина (1,2 мл) в дихлорметане (10 мл). Через 2 часа туда добавляют раствор 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг) и триэтиламина (1,2 мл) в дихлорметане (10 мл). Реакционную смесь перемешивают в течение 30 минут и концентрируют. Остаток очищают хроматографией (смесь дихлорметан/этилацетат), получая указанное в заголовке соединение (1,32 г, 81%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,43-7,38 (2H, м), 7,33-7,27 (3H, м), 7,16 (1H, ушир.с), 7,02 (1H, д, J=7,8 Гц), 6,35 (1H, с), 6,18 (1H, с), 4,51 (2H, с), 3,61 (2H, т, J=5,5 Гц), 3,25-3,18 (1H, м), 2,79 (2H, т, J=5,9 Гц), 1,49 (9H, с), 1,22 (6H, д, J=6,7 Гц).
(28b) гидрохлорид 1-(2-изопропилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,12 г, количественный выход) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,32 г), полученного в Примере (28a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,12-9,06 (3H, м), 7,39 (1H, с), 7,28 (1H, дд, J=8,4 и 2,1 Гц), 7,18-7,17 (1H, м), 7,15-7,12 (2H, м), 6,89 (1H, дд, J=7,8 и 1,5 Гц), 6,53 (1H, дд, J=8,2 и 2,4 Гц), 4,57-4,51 (1H, м), 4,19 (2H, с), 3,38-3,32 (2H, м), 2,98 (2H, т, J=6,2 Гц), 1,26 (6H, д, J=5,8 Гц).
(28c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (498 мг, 98%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (241 мг), полученного в Примере (1d), и гидрохлорида 1-(2-изопропилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (345 мг), полученного в Примере (28b). Этот метиловый сложный эфир (498 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (352 мг, 73%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 8,95 (1H, с), 7,98 (1H, с), 7,66 (1Н, дд, J=7,8 и 1,2 Гц), 7,33 (1H, с), 7,28 (1H, дд, J=7,8 и 1,5 Гц), 7,22 (1H, д, J=9,0 Гц), 7,14 (1H, дт, J=10,7 и 3,9 Гц), 7,09-7,05 (2H, м), 4,48-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 3,18-3,11 (1H, м), 2,75 (2H, т, J=5,6 Гц), 2,11 (2H, д, J=6,6 Гц), 1,94-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,19 (6H, д, J=6,7 Гц), 1,12-1,01 (2H, м);
МС (ESI) m/z: 494 (M + H)+.
(Пример 29) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(29a) трет-бутиловый эфир 6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,48 г, 90%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 3-изопропиланилина (540 мг) и 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,28-7,24 (3H, м), 7,18-7,15 (2H, м), 7,01 (2H, д, J=7,5 Гц), 6,76 (2H, ушир.с), 4,52 (2H, с), 3,62 (2H, т, J=4,9 Гц), 2,92-2,85 (1H, м), 2,79 (2H, т, J=5,9 Гц), 1,50 (9H, с), 1,24 (6H, д, J=6,6 Гц).
(29b) гидрохлорид 1-(3-изопропилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,25 г, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,48 г), полученного в Примере (29a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,07 (2H, с), 9,01 (1H, с), 7,41 (1H, д, J=1,9 Гц), 7,36 (1H, ушир.с), 7,28 (1H, дд, J=8,4 и 2,1 Гц), 7,26-7,23 (1H, м), 7,19 (1H, дд, J=7,8 и 7,8 Гц), 7,12 (1H, д, J=8,6 Гц), 6,86 (1H, д, J=7,4 Гц), 4,19 (2H, с), 3,37-3,32 (2H, м), 2,97 (2H, т, J=6,1 Гц), 2,87-2,80 (1H, м), 1,19 (6H, д, J=7,1 Гц).
(29c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (537 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (241 мг), полученного в Примере (1d), и гидрохлорида 1-(3-изопропилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (345 мг), полученного в Примере (29b). Этот метиловый сложный эфир (537 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (459 мг, 93%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1Н, ушир.с), 8,57 (2H, д, J=10,5 Гц), 7,34 (2H, д, J=7,8 Гц), 7,24-7,16 (3H, м), 7,08 (1H, д, J=8,6 Гц), 7,08 (1H, д, J=8,6 Гц), 4,49-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,88-2,81 (1H, м), 2,75 (2H, т, J=5,9 Гц), 2,12 (2H, д, J=7,1 Гц), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,19 (6H, д, J=7,1 Гц), 1,12-1,02 (2H, м);
МС (ESI) m/z: 494 (M + H)+.
(Пример 30) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(30a) трет-бутиловый эфир 6-[3-(3-изопропоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,70 г, количественный выход) получают в виде беловатого твердого вещества таким же способом, как в Примере (28a), из 3-изопропоксианилина (605 мг) и 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,32 (1H, ушир.с), 7,20 (1H, т, J=8,0 Гц), 7,06-6,98 (2H, м), 7,03 (2H, с), 6,84 (1H, дд, J=7,8 и 1,6 Гц), 6,78 (1H, ушир.с), 6,65 (1H, дд, J=8,4 и 2,2 Гц), 4,58-4,52 (1H, м), 4,52 (2H, с), 3,62 (2H, т, J=5,3 Гц), 2,79 (2H, т, J=6,1 Гц), 1,50 (9H, с), 1,32 (6H, д, J=5,9 Гц).
(30b) гидрохлорид 1-(3-изопропоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,45 г, количественный выход) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-изопропоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,70 г), полученного в Примере (30a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,38 (1Н, с), 9,11 (1H, ушир.с), 8,21 (1H, с), 7,66 (1H, дд, J=8,0 и 1,4 Гц), 7,41 (1H, д, J=2,4 Гц), 7,31-7,27 (2H, м), 7,16-7,11 (2H, м), 7,07 (1H, дт, J=10,3 и 3,8 Гц), 4,19 (2H, с), 3,38-3,32 (2H, м), 3,24-3,18 (1H, м), 2,97 (2H, т, J=6,5 Гц), 1,19 (6H, д, J=6,6 Гц).
(30c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-изопропоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (493 мг, 94%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (241 мг), полученного в Примере (1d), и гидрохлорида 1-(3-изопропоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (361 мг), полученного в Примере (30b). Этот метиловый сложный эфир (493 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (424 мг, 89%) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 8,68 (2H, д, J=10,9 Гц), 7,32 (1H, с), 7,22 (1H, д, J=7,9 Гц), 7,18-7,16 (1H, м), 7,13 (1H, д, J=8,2 Гц), 7,08 (1H, д, J=8,3 Гц), 6,88 (1H, д, J=7,8 Гц), 6,52 (1H, дд, J=8,2 и 2,3 Гц), 4,58-4,52 (1H, м), 4,49-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,9 Гц), 2,12 (2H, д, J=7,0 Гц), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,31 (2H, м), 1,26 (6H, д, J=6,2 Гц), 1,11-1,02 (2H, м);
МС (ESI) m/z: 510 (M + H)+.
(Пример 31) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(31a) трет-бутиловый эфир 6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,67 г, 99%) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг) и 2,4,5-трифторфенилизоцианата (0,58 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,24-8,16 (1H, м), 7,45-7,25 (1H, м), 7,08 (1H, ушир.с), 6,98-6,91 (2H, м), 6,77 (1H, ушир.с), 6,57 (1H, ушир.с), 4,52 (2H, с), 3,64 (2H, т, J=6,0 Гц), 2,80 (2H, ушир.с), 1,52 (9H, с).
(31b) гидрохлорид 1-(2,4,5-трифторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,37 г, 96%) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,67 г), полученного в Примере (31a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,33 (1H, с), 8,86 (2H, ушир.с), 8,23-8,16 (1H, м), 7,69-7,61 (1H, м), 7,40 (1H, ушир.с), 7,27 (1H, дд, J=8,4 и 2,1 Гц), 7,14 (1H, д, J=8,6 Гц), 4,18 (2H, с), 3,36-3,32 (2H, м), 2,96 (2H, т, J=6,3 Гц).
(31c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (773 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(2,4,5-трифторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (536 мг), полученного в Примере (31b). Этот метиловый сложный эфир (773 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (653 мг, 87%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,12 (1H, с), 8,80 (1H, с), 8,24-8,16 (1H, м), 7,68-7,60 (1H, м), 7,32 (1H, с), 7,22 (1H, д, J=7,8 Гц), 7,11 (1H, д, J=8,2 Гц), 4,49-4,47 (3H, м), 3,57 (2H, т, J=5,8 Гц), 2,76 (2H, т, J=5,8 Гц), 2,11 (2H, д, J=7,0 Гц), 1,95-1,90 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,30 (2H, м), 1,12-1,03 (2H, м);
МС (ESI) m/z: 506 (M + H)+.
(Пример 32) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(32a) трет-бутиловый эфир 6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,64 г, 97%) получают в виде желтовато-белого твердого вещества таким же способом, как в Примере (28a), из 3,4,5-трифторанилина (1,22 мл) и 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,34-7,26 (4H, м), 7,14-7,10 (2H, м), 6,69 (1H, ушир.с), 4,54 (2H, с), 3,65 (2H, т, J=6,1 Гц), 2,82 (2H, т, J=6,1 Гц), 1,51 (9H, с).
(32b) гидрохлорид 1-(3,4,5-трифторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,38 г, 99%) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,64 г), полученного в Примере (32a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,59 (1H, с), 9,26 (1H, с), 9,13 (1H, ушир.с), 7,39-7,35 (3H, м), 7,29 (1H, дд, J=8,4 и 2,1 Гц), 7,15 (1H, д, J=8,2 Гц), 4,20 (2H, с), 3,38-3,36 (2H, м), 2,98 (2H, т, J=6,1 Гц).
(32c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4,5-трифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (779 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3,4,5-трифторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (536 мг), полученного в Примере (32b). Этот метиловый сложный эфир (779 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (678 мг, 89%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,22 (1H, с), 8,99 (1H, с), 7,40 (1Н, д, J=6,2 Гц), 7,38 (1H, д, J=6,3 Гц), 7,39 (1H, с), 7,23 (1H, д, J=8,2 Гц), 7,10 (1H, д, J=8,6 Гц), 4,48-4,46 (3H, м), 3,57 (2H, т, J=6,0 Гц), 2,75 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=6,6 Гц), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,69-1,63 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 506 (M + H)+.
(Пример 33) 4-диметилкарбамоилметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Указанное в заголовке соединение (100 мг, 35%) получают в виде беловатого твердого вещества таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (268 мг), полученного в Примере 2, и гидрохлорида диметиламина (51 мг).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,02 (1H, с), 8,54 (1H, д, J=2,4 Гц), 8,16 (1H, дд, J=8,2 и 8,2 Гц), 7,33 (1H, с), 7,26-7,22 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,51-4,47 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,95 (3H, с), 2,81 (3H, с), 2,76 (2H, т, J=5,9 Гц), 2,18 (2H, д, J=6,3 Гц), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,70-1,66 (1H, м), 1,38-1,29 (2H, м), 1,10-1,01 (2H, м);
МС (ESI) m/z: 497 (M + H)+.
(Пример 34) 4-метилкарбамоилметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Указанное в заголовке соединение (119 мг, 37%) получают в виде светло-коричневого твердого вещества таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (317 мг), полученного в Примере 2, и гидрохлорида метиламина (50 мг).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,02 (1Н, с), 8,53 (1H, д, J=2,7 Гц), 8,16 (1H, дд, J=8,4 и 8,4 Гц), 7,72 (1H, д, J=4,7 Гц), 7,33 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,52-4,47 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,8 Гц), 2,56 (3H, д, J=4,7 Гц), 1,96-1,90 (4H, м), 1,71-1,64 (2H, м), 1,53-1,47 (1H, м), 1,36-1,27 (2H, м), 1,06-1,01 (2H, м);
МС (ESI) m/z: 483 (M + H)+.
(Пример 35) 4-[(карбоксиметилкарбамоил)метил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (128 мг, 20%) получают таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (551 мг), полученного в Примере 2, и гидрохлорида метилового эфира глицина (162 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (51 мг, 41%) в виде бежевого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,12 (1H, с), 8,64 (1H, ушир.с), 8,14 (1H, дд, J=8,4 и 8,4 Гц), 7,92 (1H, ушир.с), 7,33 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,99 (1H, м), 4,48-4,47 (3H, м), 3,63 (2H, д, J=5,4 Гц), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,02 (2H, д, J=6,7 Гц), 1,94-1,90 (2H, м), 1,76-1,73 (2H, м), 1,68-1,63 (1H, м), 1,55-1,51 (1H, м), 1,37-1,25 (2H, м), 1,06-1,01 (2H, м);
МС (ESI) m/z: 527 (M + H)+.
(Пример 36) 4-[(1-карбоксиэтилкарбамоил)метил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (51 мг, 16%) получают таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (275 мг), полученного в Примере 2, и гидрохлорида метилового эфира аланина (рацемат, 90 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (25 мг, 50%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,74 (1Н, с), 9,23 (1H, ушир.с), 8,14 (1H, дд, J=7,7 и 7,7 Гц), 7,61 (1H, ушир.с), 7,46 (1H, с), 7,36-7,28 (2H, м), 7,23-7,16 (2H, м), 7,12-7,08 (1H, м), 4,59-4,55 (3H, м), 3,94 (1H, т, J=6,8 Гц), 3,65 (2H, т, J=6,0 Гц), 2,83 (2H, т, J=5,7 Гц), 2,13-1,98 (6H, м), 1,87-1,78 (2H, м), 1,75-1,60 (1H, м), 1,55-1,43 (1H, м), 1,25 (3H, д, J=7,0 Гц), 1,15-1,10 (2H, м);
МС (ESI) m/z: 541 (M + H)+.
(Пример 37) 4-[(1-карбоксициклопропилкарбамоил)метил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (98 мг, 35%) получают таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (235 мг), полученного в Примере 2, и гидрохлорида метилового эфира 1-аминоциклопропанкарбоновой кислоты (76 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (16 мг, 17%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,11 (1Н, ушир.с), 8,63 (1H, ушир.с), 8,30 (1H, с), 8,13 (1H, дд, J=7,7 и 7,7 Гц), 7,33 (1H, д, J=1,6 Гц), 7,26-7,21 (2H, м), 7,15-7,09 (2H, м), 7,03-6,98 (1H, м), 4,49-4,47 (3H, м), 3,57 (2H, т, J=6,2 Гц), 2,76 (2H, т, J=5,7 Гц), 1,94 (2H, д, J=7,0 Гц), 1,94-1,89 (2H, м), 1,78-1,74 (2H, м), 1,69-1,64 (1H, м), 1,36-1,25 (4H, м), 1,08-1,00 (2H, м), 0,92-0,89 (2H, м);
МС (ESI) m/z: 553 (M + H)+.
(Пример 38) 4-[2-(2-карбоксипирролидин-1-ил)-2-оксоэтил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (233 мг, 80%) получают таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (235 мг), полученного в Примере 2, и гидрохлорида метилового эфира пролина (рацемат, 83 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (209 мг, 92%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,4 (1H, ушир.с), 9,04 (1H, с), 8,56 (1H, с), 8,15 (1H, дд, J=8,4 и 8,5 Гц), 7,32 (1H, с), 7,26-7,21 (2H, м), 7,15-7,09 (2H, м), 7,03-6,98 (1H, м), 4,47-4,39 (3H, м), 4,21 (1H, дд, J=8,2 и 3,5 Гц), 3,57 (2H, т, J=5,9 Гц), 3,53-3,49 (2H, м), 2,76 (2H, т, J=5,0 Гц), 2,23-2,08 (3H, м), 1,94-1,88 (4H, м), 1,85-1,71 (4H, м), 1,38-1,28 (2H, м), 1,12-1,00 (2H, м);
МС (ESI) m/z: 567 (M + H)+.
(Пример 39) 4-(4-карбоксиоксазол-2-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(39a) 4-[(2-гидрокси-1-метоксикарбонилэтилкарбамоил)метил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (199 мг, 23%) получают в виде белого твердого вещества таким же способом, как в Примере 18, из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (268 мг), полученного в Примере 2, и гидрохлорида метилового эфира серина (рацемат, 51 мг).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,06 (1Н, с), 8,58 (1H, с), 8,17-8,11 (2H, м), 7,33 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-7,00 (1H, м), 5,01 (1H, т, J=5,6 Гц), 4,52-4,47 (3H, м), 4,36-4,31 (1H, м), 3,70-3,63 (1H, м), 3,62 (3H, с), 3,57 (2H, т, J=6,0 Гц), 2,76 (2H, т, J=5,8 Гц), 2,07 (2H, дд, J=6,9 и 3,0 Гц), 1,94-1,91 (2H, м), 1,77-1,65 (3H, м), 1,37-1,27 (2H, м), 1,10-1,00 (2H, м);
МС (ESI) m/z: 571 (M + H)+.
(39b) 4-(4-карбоксиоксазол-2-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К суспензии 4-[(2-гидрокси-1-метоксикарбонилэтилкарбамоил)метил]циклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (199 мг), полученного в Примере (39a), в дихлорметане (8 мл) добавляют при -10°C Дезоксо-фтор (Deoxo-Fluor) (0,071 мл). Через 30 минут реакционную смесь концентрируют, разбавляют этилацетатом, промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/этилацетат), получая оксазолин (55 мг). К смеси этого оксазолина (55 мг) в дихлорметане (0,5 мл) DBU (0,017 мл) и бромтрихлорметан (0,011 мл) добавляют при 0°C. Реакционную смесь нагревают до комнатной температуры, затем перемешивают на протяжении ночи и затем концентрируют. Остаток разбавляют этилацетатом, затем промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/этилацетат), получая оксазол (27 мг, 48%) в виде белого твердого вещества. Этот оксазол (27 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (22 мг, 84%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,03 (1H, с), 8,61 (1H, с), 8,54 (1H, д, J=2,7 Гц), 8,15 (1H, дд, J=8,2 и 8,2 Гц), 7,32 (1H, д, J=1,6 Гц), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,53-4,47 (3H, м), 3,57 (2H, т, J=6,0 Гц), 2,76 (2H, т, J=5,6 Гц), 2,70 (2H, д, J=6,6 Гц), 1,96-1,92 (2H, м), 1,80-1,71 (3H, м), 1,40-1,31 (2H, м), 1,19-1,09 (2H, м);
МС (ESI) m/z: 537 (M + H)+.
(Пример 40) 4-[(1H-тетразол-5-илкарбамоил)метил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Раствор в ДМФА (4 мл) 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (188 мг), полученного в Примере 2, 1H-тетразол-5-иламина (54 мг), BOP реагента (212 мг) и диизопропилэтиламина (0,10 мл) перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь разбавляют 1N хлористоводородной кислотой с последующей экстракцией этилацетатом. Органический слой концентрируют и энергично перемешивают в смеси вода/изопропиловый эфир. Полученное твердое вещество нагревают при кипячении с обратным холодильником в метаноле и собирают фильтрацией. Указанное в заголовке соединение (99 мг, 46%) получают в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 11,9 (1H, с), 9,00 (1H, с), 8,52 (1H, д, J=2,4 Гц), 8,15 (1H, дд, J=8,2 и 8,2 Гц), 7,32 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,54-4,47 (3H, м), 3,57 (2H, т, J=6,1 Гц), 2,76 (2H, т, J=5,9 Гц), 2,36 (2H, д, J=6,7 Гц), 1,97-1,93 (2H, м), 1,82-1,75 (3H, м), 1,41-1,31 (2H, м), 1,18-1,08 (2H, м);
МС (ESI) m/z: 537 (M + H)+.
(Пример 41) 4-(5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(41a) транс-(4-гидроксициклогексил)ацетонитрил
Указанное в заголовке соединение (1,69 г, 53%) получают в виде прозрачного бесцветного масла таким же способом, как в Примере (1d), из (4-оксоциклогексил)ацетонитрила (Tetrahedron 1995, 51, 10259.) (3,15 г).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,63-3,56 (1Н, м), 2,28 (2H, д, J=6,6 Гц), 2,04 (2H, дд, J=13,3 и 3,9 Гц), 1,90 (2H, дд, J=13,1 и 2,9 Гц), 1,72-1,63 (1H, м), 1,49 (1H, с), 1,37-1,27 (2H, м), 1,24-1,14 (2H, м).
(41b) 4-цианометилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (563 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (1e), из транс-(4-гидроксициклогексил)ацетонитрила (WO2006004200 A1) (243 мг), полученного в Примере (41a), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (403 мг).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,05 (1H, с), 8,57 (1H, с), 8,15 (1H, дд, J=8,2 и 8,2 Гц), 7,33 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-7,00 (1H, м), 4,52-4,47 (3H, м), 3,57 (2H, т, J=6,1 Гц), 2,76 (2H, т, J=5,9 Гц), 2,47 (2H, д, J=6,7 Гц), 1,98-1,94 (2H, м), 1,82-1,79 (2H, м), 1,74-1,61 (1H, м), 1,74-1,61 (2H, м), 1,22-1,12 (2H, м).
(41c) 4-(5-оксо-4,5-дигидро-[1,2,4]оксадиазол-3-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К раствору 4-цианометилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (563 мг), полученного в Примере (41b), в этаноле добавляют гидроксиламин (50% водный раствор, 0,5 мл). Реакционную смесь нагревают при температуре образования флегмы на протяжении ночи и затем концентрируют. Остаток разбавляют этилацетатом, промывают водой и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматографией (Chromatorex NH, смесь дихлорметан/метанол), получая белое твердое вещество (500 мг, 83%). К раствору этого белого твердого вещества (500 мг) в тетрагидрофуране (10 мл) добавляют пиридин (0,096 мл) и 2-этилциклогексилхлорформиат (0,20 мл) при 0°C. Через 2 часа реакционную смесь разбавляют этилацетатом, промывают водой и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматорафией (смесь дихлорметан/этилацетат), получая белое твердое вещество (391 мг, 59%). Смесь этого белого твердого вещества (391 мг) и o-ксилола (6 мл) нагревают при температуре образования флегмы в течение 1 часа и концентрируют. Остаток энергично перемешивают в смеси гексан/изопропиловый эфир (1:1) и собирают фильтрацией. Указанное в заголовке соединение (55 мг, 17%) получают в виде оранжевого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,2 (1Н, ушир.с), 9,00 (1H, с), 8,70 (1H, д, J=6,2 Гц), 8,15 (1H, дд, J=8,4 и 8,4 Гц), 7,32 (1H, с), 7,25 (1H, дд, J=8,2 и 1,6 Гц), 7,22 (1H, дд, J=8,2 и 1,2 Гц), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,53-4,47 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,39 (2H, д, J=7,1 Гц), 1,97-1,93 (2H, м), 1,76-1,72 (2H, м), 1,69-1,63 (1H, м), 1,38-1,24 (2H, м), 1,17-1,07 (2H, м);
МС (ESI) m/z: 510 (M + H)+.
(Пример 42) 4-(5-гидрокси-2H-пиразол-3-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(42a) 4-(3-этоксикарбонил-2-оксопропил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К суспензии 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (939 мг), полученного в Примере 2, в дихлорметане (10 мл) добавляют при 0°C кислоту Мелдрама (317 мг), диметиламинопиридин (293 мг) и EDCI (460 мг). Реакционную смесь разбавляют дихлорметаном, промывают 1N хлористоводородной кислотой и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Смесь остатка и этанола (10 мл) нагревают при кипячении с обратным холодильником в течение 4 часов и концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/этилацетат), получая указанное в заголовке соединение (820 мг, 76%) в виде желтовато-белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,04 (1Н, с), 8,56 (1H, с), 8,15 (1H, дд, J=8,9 и 8,9 Гц), 7,32 (1H, с), 7,27-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,50-4,45 (3H, м), 4,09 (2H, кв., J=7,2 Гц), 3,57 (2H, т, J=6,0 Гц), 3,57 (2H, с), 2,76 (2H, т, J=5,8 Гц), 2,44 (2H, д, J=6,3 Гц), 1,94-1,89 (2H, м), 1,75-1,67 (3H, м), 1,39-1,29 (2H, м), 1,18 (3H, т, J=7,1 Гц), 1,08-0,98 (2H, м);
МС (ESI) m/z: 540 (M + H)+.
(42b) 4-(5-гидрокси-2H-пиразол-3-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К смеси 4-(3-этоксикарбонил-2-оксопропил)циклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (189 мг), полученного в Примере (42a), и этанола (5 мл) добавляют при 0°C моногидрат гидразина (0,022 мл). Во время реакции в реакционную смесь добавляют дополнительно моногидрат гидразина и смесь перемешивают до тех пор, пока не израсходуется весь реакционный субстрат. Реакционную смесь концентрируют и очищают колоночной хроматографией (смесь дихлорметан/метанол), получая белое твердое вещество. Это белое твердое вещество энергично перемешивают в изопропиловом эфире и собирают фильтрацией, получая указанное в заголовке соединение (90 мг, 51%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 11,2 (1H, ушир.с), 9,28 (1H, ушир.с), 9,06 (1H, с), 8,58 (1H, д, J=2,3 Гц), 8,15 (1H, дд, J=8,4 и 8,4 Гц), 7,32 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,99 (1H, м), 5,22 (1H, с), 4,51-4,46 (3H, м), 3,56 (2H, т, J=6,0 Гц), 2,76 (2H, т, J=6,1 Гц), 2,34 (2H, д, J=7,4 Гц), 1,95-1,91 (2H, м), 1,72-1,68 (2H, м), 1,52-1,46 (1H, м), 1,36-1,26 (2H, м), 1,08-0,97 (2H, м);
МС (ESI) m/z: 508 (M + H)+.
(Пример 43) 4-(3-гидроксиизоксазол-5-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

К смеси 4-(3-этоксикарбонил-2-оксопропил)циклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (127 мг), полученного в Примере (42a), и этанола (3 мл) добавляют при комнатной температуре гидрохлорид гидроксиламина (164 мг) таким же способом, как в Примере (42b). Реакционную смесь нагревают при 80°C в течение 12 часов и концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/этилацетат). Полученное твердое вещество очищают ПТСХ (препаративная тонкослойная хроматография; смесь дихлорметан/этилацетат=1:1), получая указанное в заголовке соединение (34 мг, 28%) в виде оранжевого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,02 (1H, с), 8,54 (1H, д, J=2,4 Гц), 8,16 (1H, дд, J=8,0 и 8,0 Гц), 7,32 (1H, с), 7,27-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,51-4,46 (3H, м), 4,13 (1H, ушир.с), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,19-2,15 (2H, м), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,56-1,48 (1H, м), 1,37-1,27 (2H, м), 1,09-0,99 (2H, м);
МС (ESI) m/z: 509 (M + H)+.
(Пример 44) 4-(2H-тетразол-5-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(44a) 4-цианометилциклогексиловый эфир транс-бензойной кислоты
К смеси п-толуолсульфонилхлорида (4,71 г), бензойной кислоты (2,52 г), N-метилимидазола (4,9 мл) и ацетонитрила (50 мл) добавляют при 0°C раствор транс-(4-гидроксициклогексил)ацетонитрила (2,87 г), полученного в Примере (41a), в ацетонитриле (50 мл). Реакционную смесь нагревают до комнатной температуры, затем перемешивают на протяжении ночи и затем концентрируют. Остаток разбавляют этилацетатом, затем промывают водой и насыщенным раствором соли и затем концентрируют. Остаток очищают колоночной хроматографией (смесь гексан/этилацетат), получая указанное в заголовке соединение (4,42 г, 88%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,04 (2H, дд, J=8,2 и 1,1 Гц), 7,57 (1H, дд, J=7,2 и 7,2 Гц), 7,45 (2H, дд, J=7,6 и 7,6 Гц), 4,98-4,90 (1H, м), 2,32 (2H, д, J=7,0 Гц), 2,21-2,17 (2H, м), 2,02-1,98 (2H, м), 1,83-1,72 (1H, м), 1,61-1,50 (2H, м), 1,36-1,27 (2H, м).
(44b) 4-(2H-тетразол-5-илметил)циклогексиловый эфир транс-бензойной кислоты
Смесь 4-цианометилциклогексилового эфира транс-бензойной кислоты (3,42 г), полученного в Примере (44a), триметилсилилазида (3,7 мл), оксида ди-н-бутилолова (348 мг) и толуола (30 мл) нагревают при 110°C в течение 48 часов. Течение реакции останавливают, используя метанол, и реакционную смесь концентрируют. Остаток разбавляют этилацетатом с последующей экстракцией насыщенным водным раствором бикарбоната натрия. Водный слой подкисляют (pH 2), добавляя 1N хлористоводородную кислоту, с последующей экстракцией этилацетатом (×2). Органический слой промывают насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют, получая указанное в заголовке соединение (2,57 г, 64%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,05 (2H, д, J=7,0 Гц), 7,58 (1H, дд, J=7,4 и 7,4 Гц), 7,46 (2H, дд, J=7,6 и 7,6 Гц), 4,98-4,93 (1H, м), 2,98 (2H, д, J=7,1 Гц), 2,17-2,13 (2H, м), 2,02-1,96 (1H, м), 1,92-1,89 (2H, м), 1,63-1,51 (2H, м), 1,33-1,23 (2H, м).
(44c) 4-[2-(4-метоксибензил)-2H-тетразол-5-илметил]циклогексиловый эфир транс-бензойной кислоты
К суспензии 4-(2H-тетразол-5-илметил)циклогексилового эфира транс-бензойной кислоты (1,34 г), полученного в Примере (44b), в ацетонитриле (20 мл) добавляют при комнатной температуре триэтиламин (0, 68 мл) и 4-метоксибензилхлорид (0,70 мл). Реакционную смесь нагревают при температуре образования флегмы в течение 2 часов, охлаждают до комнатной температуры, концентрируют, затем разбавляют этилацетатом и фильтруют. Фильтрат промывают 1N хлористоводородной кислотой, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматографией (смесь гексан/этилацетат), получая указанное в заголовке соединение (610 мг, 32%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,03 (2H, д, J=7,1 Гц), 7,55 (1H, дд, J=7,4 и 7,4 Гц), 7,43 (2H, дд, J=7,7 и 7,7 Гц), 7,34 (2H, д, J=8,6 Гц), 6,90 (2H, д, J=9,0 Гц), 5,66 (2H, с), 4,96-4,89 (1H, м), 3,80 (3H, с), 2,80 (2H, д, J=6,6 Гц), 2,13-2,09 (2H, м), 1,86-1,83 (3H, м), 1,54-1,44 (2H, м), 1,28-1,18 (2H, м).
(44d) транс-4-[2-(4-метоксибензил)-2H-тетразол-5-илметил]циклогексанол
К раствору 4-[2-(4-метоксибензил)-2H-тетразол-5-илметил]-циклогексилового эфира транс-бензойной кислоты (610 мг), полученного в Примере (44c), в метаноле (10 мл), добавляют при комнатной температуре метоксид натрия (28% раствор в метаноле, 0,29 мл). Через 2 дня реакционную смесь концентрируют. Остаток очищают колоночной хроматографией (смесь гексан/этилацетат=5:1→1:1 и затем смесь дихлорметан/метанол=50:1), получая указанное в заголовке соединение (396 мг, 87%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,33 (2H, д, J=8,2 Гц), 6,90 (2H, д, J=8,6 Гц), 5,65 (2H, с), 3,80 (3H, с), 3,59-3,53 (1H, м), 3,50 (1H, д, J=5,0 Гц), 2,75 (2H, д, J=6,7 Гц), 1,98-1,94 (2H, м), 1,78-1,74 (3H, м), 1,30-1,20 (2H, м), 1,14-1,03 (2H, м).
(44e) 4-[2-(4-метоксибензил)-2H-тетразол-5-илметил]циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (613 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (1e), из транс-4-[2-(4-метоксибензил)-2H-тетразол-5-илметил]циклогексанола (396 мг), полученного в Примере (44d), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (321 мг).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,01 (1H, с), 8,53 (1H, д, J=2,4 Гц), 8,16 (1H, дд, J=8,2 и 8,2 Гц), 7,34-7,30 (1H, м), 7,32 (2H, д, J=8,6 Гц), 7,27-7,21 (2H, м), 7,16-7,09 (1H, м), 7,03-6,98 (1H, м), 6,97-6,93 (1H, м), 6,95 (2H, д, J=9,0 Гц), 5,79 (2H, с), 4,49-4,46 (3H, м), 3,74 (3H, с), 3,56 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=6,5 Гц), 2,73 (2H, д, J=6,7 Гц), 1,94-1,90 (2H, м), 1,72-1,68 (3H, м), 1,37-1,27 (2H, м), 1,18-1,10 (2H, м).
(44f) 4-(2H-тетразол-5-илметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Суспензию 4-[2-(4-метоксибензил)-2H-тетразол-5-илметил]циклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (333 мг), полученного в Примере (44e), и палладия-на-углероде (55 мг) в этаноле (6 мл), перемешивают при комнатной температуре в течение 3 дней в атмосфере водорода. Реакционную смесь фильтруют через целит и концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/этилацетат=5:1→1:1 и затем смесь дихлорметан/метанол=25:1→5:1), получая указанное в заголовке соединение (22 мг, 8%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,01 (1H, с), 8,53 (1H, д, J=2,7 Гц), 8,16 (1H, дд, J=8,2 и 8,2 Гц), 7,32 (1H, с), 7,26-7,21 (2H, м), 7,15-7,09 (2H, м), 7,03-6,98 (1H, м), 4,53-4,46 (3H, м), 3,56 (2H, т, J=6,0 Гц), 3,17 (1H, с), 2,77 (2H, т, J=5,9 Гц), 2,77-2,73 (m, 2H), 1,96-1,91 (2H, м), 1,70-1,66 (3H, м), 1,37-1,28 (2H, м), 1,18-1,07 (2H, м);
МС (ESI) m/z: 494 (M + H)+.
(Пример 45) 4-((S)-2,3-дигидроксипропоксикарбонилметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

К смеси 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (378 мг), полученного в Примере 2, и ацетонитрила (10 мл) добавляют п-толуолсульфонилхлорид (184 мг) и N-метилимидазол (0,19 мл) при 0°C. Через 30 минут туда добавляют (R)-(2,2-диметил-[1,3]диоксолан-4-ил)метанол (0,099 мл) и ацетонитрил (2 мл). Реакционную смесь перемешивают в течение 30 минут и затем концентрируют. Остаток разбавляют этилацетатом, промывают водой и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/метанол), получая сложный эфир (404 мг, 86%) в виде оранжевого масла. К смеси этого сложного эфира (404 мг) и метанола (6 мл) добавляют 1N хлористоводородную кислоту (1,8 мл). Реакционную смесь перемешивают на протяжении ночи и концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/метанол), получая желтое твердое вещество. Это желтое твердое вещество энергично перемешивают в изопропиловом эфире, затем собирают фильтрацией и затем сушат при пониженном давлении, получая указанное в заголовке соединение (193 мг, 51%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,03 (1Н, с), 8,54 (1H, с), 8,15 (1H, дд, J=8,2 и 8,2 Гц), 7,32 (1H, с), 7,25 (1H, дд, J=8,2 и 1,2 Гц), 7,22 (1H, дд, J=8,2 и 1,6 Гц), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,86 (1H, д, J=5,1 Гц), 4,62 (1H, т, J=5,9 Гц), 4,49-4,46 (3H, м), 4,05 (1H, дд, J=11,3 и 4,3 Гц), 3,91 (1H, дд, J=11,1 и 6,4 Гц), 3,65-3,62 (1H, м), 3,57 (2H, т, J=6,0 Гц), 3,38-3,31 (2H, м), 2,76 (2H, т, J=5,8 Гц), 2,22 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,57-1,50 (1H, м), 1,39-1,30 (2H, м), 1,14-1,05 (2H, м);
МС (ESI) m/z: 544 (M + H)+.
(Пример 46) 4-((R)-2,3-дигидроксипропоксикарбонилметил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Сложный эфир (427 мг, 92%) получают в виде оранжевого масла таким же способом, как в (Примере 45), из 4-карбоксиметилциклогексилового эфира транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (378 мг), полученного в Примере 2, и (S)-(2,2-диметил-[1,3]диоксолан-4-ил)метанола (0,099 мл). Из этого сложного эфира (427 мг) получают указанное в заголовке соединение (138 мг, 35%) в виде белого твердого вещества таким же способом, как в (Примере 45).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,05 (1Н, с), 8,56 (1H, с), 8,15 (1H, дд, J=8,4 и 8,4 Гц), 7,32 (1H, с), 7,26-7,21 (2H, м), 7,16-7,09 (2H, м), 7,03-6,98 (1H, м), 4,85 (1H, д, J=5,5 Гц), 4,61 (1H, т, J=5,6 Гц), 4,53-4,47 (3H, м), 4,07-4,04 (1H, м), 3,93-3,89 (1H, м), 3,66-3,62 (2H, м), 3,57 (2H, т, J=5,7 Гц), 3,37-3,32 (2H, м), 2,76 (2H, т, J=5,2 Гц), 2,23 (2H, д, J=6,7 Гц), 1,95-1,91 (2H, м), 1,77-1,67 (3H, м), 1,40-1,30 (2H, м), 1,15-1,03 (2H, м);
МС (ESI) m/z: 544 (M + H)+.
(Пример 47) 4-карбоксиметилциклогексиловый эфир транс-6-(6-хлорбензоксазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(47a) гидрохлорид (6-хлорбензоксазол-2-ил)-(1,2,3,4-тетрагидроизохинолин-6-ил)амина
Указанное в заголовке соединение (845 мг, 62%) получают в виде светло-коричневого твердого вещества таким же способом, как в Примере (25a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (1,00 г) и 2,6-дихлорбензоксазола (761 мг).
МС (ESI) m/z: 300 (M + H)+.
(47b) 4-карбоксиметилциклогексиловый эфир транс-6-(6-хлорбензоксазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (104 мг, 74%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (74 мг), полученного в Примере (1d), и гидрохлорида (6-хлорбензоксазол-2-ил)-(1,2,3,4-тетрагидроизохинолин-6-ил)амина (103 мг), полученного в примере (47a). Этот метиловый сложный эфир (79 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (43 мг, 56%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, ушир.с), 10,7 (1H, с), 7,74-7,17 (7H, м), 4,50 (2H, с), 3,65-3,55 (2H, м), 2,87-2,77 (2H, м), 2,12 (2H, д, J=6,6 Гц), 1,99-1,90 (2H, м), 1,84-1,60 (3H, м), 1,45-1,27 (2H, м), 1,20-1,02 (2H, м).
МС (ESI) m/z: 484 (M + H)+.
(Пример 48) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этокси-5-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(48a) трет-бутиловый эфир 6-[3-(2-этокси-5-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,70 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг) и 2-этокси-5-метиланилина (605 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,97 (1Н, д, J=1,6 Гц), 7,29-7,24 (3H, м), 7,06 (1H, д, J=7,1 Гц), 6,78 (1H, дд, J=8,6 и 2,0 Гц), 6,75 (1H, дд, J=9,3 и 9,3 Гц), 6,69 (1H, ушир.с), 4,54 (2H, с), 4,01 (2H, кв., J=6,8 Гц), 3,63 (2H, ушир.с), 2,81 (2H, т, J=5,9 Гц), 2,29 (3H, с), 1,50 (9H, с), 1,34 (3H, т, J=7,1 Гц).
(48b) гидрохлорид 1-(2-этокси-5-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,45 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2-этокси-5-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,70 г), полученного в Примере (48a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,64 (1H, с), 9,27 (1H, ушир.с), 8,13 (1H, с), 7,97 (1Н, д, J=2,0 Гц), 7,45 (1H, д, J=1,5 Гц), 7,28 (1H, дд, J=8,4 и 2,2 Гц), 7,13 (1H, д, J=8,6 Гц), 6,88 (1H, д, J=8,2 Гц), 6,73 (1H, дд, J=8,2 и 2,4 Гц), 4,19 (2H, ушир.с), 4,08 (2H, кв., J=7,0 Гц), 3,36-3,33 (2H, м), 2,98 (2H, т, J=6,1 Гц), 2,22 (3H, с), 1,39 (3H, т, J=7,0 Гц).
(48c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-этокси-5-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (731 мг, 94%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в примере (1d), и гидрохлорида 1-(2-этокси-5-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (542 мг), полученного в Примере (48b). Этот метиловый сложный эфир (731 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (602 мг, 85%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,34 (1H, с), 8,00 (2H, д, J=9,4 Гц), 7,37 (1H, с), 7,21 (1H, д, J=7,8 Гц), 7,09 (1H, д, J=8,6 Гц), 7,09 (1H, д, J=8,6 Гц), 6,72 (1H, дд, J=8,2 и 2,0 Гц), 4,51-4,46 (3H, м), 4,09 (2H, кв., J=7,1 Гц), 3,57 (2H, т, J=6,1 Гц), 2,76 (2H, т, J=5,7 Гц), 2,22 (3H, с), 2,11 (2H, д, J=7,1 Гц), 1,95-1,90 (2H, м), 1,77-1,73 (2H, м), 1,67-1,63 (1H, м), 1,39 (3H, т, J=6,8 Гц), 1,37-1,29 (2H, м), 1,12-1,01 (2H, м);
МС (ESI) m/z: 510 (M + H)+.
(Пример 49) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(49a) трет-бутиловый эфир 6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,59 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг) и 3-метоксифенилизоцианата (0,63 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,29-7,20 (2H, м), 7,24 (1H, дд, J=6,8 и 6,8 Гц), 7,10-6,94 (2H, м), 7,07 (1H, с), 6,85 (1H, д, J=9,0 Гц), 6,77 (1H, ушир.с), 6,66 (1H, дд, J=8,2 и 2,7 Гц), 4,52 (2H, с), 3,80 (3H, с), 3,61 (2H, т, J=5,2 Гц), 2,78 (2H, т, J=5,9 Гц), 1,50 (9H, с).
(49b) гидрохлорид 1-(3-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,34 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,59 г), полученного в Примере (49a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,10 (1H, ушир.с), 9,05 (2H, с), 7,40 (1H, д, J=1,9 Гц), 7,28 (1H, дд, J=8,4 и 2,1 Гц), 7,20 (1H, дд, J=2,2 и 2,2 Гц), 7,18 (1H, дд, J=8,2 и 8,2 Гц), 7,13 (1H, д, J=8,2 Гц), 6,92 (1H, дд, J=8,2 и 2,0 Гц), 6,55 (1H, дд, J=8,2 и 2,3 Гц), 4,19 (2H, с), 3,73 (3H, с), 3,36 (2H, т, J=6,2 Гц), 2,98 (2H, т, J=6,2 Гц).
(49c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (743 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (500 мг), полученного в Примере (49b). Этот метиловый сложный эфир (743 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (603 мг, 85%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,73 (1H, с), 8,66 (1H, с), 7,32 (1H, с), 7,23-7,19 (2H, м), 7,17 (1H, т, J=8,4 Гц), 7,08 (1H, д, J=8,3 Гц), 6,92 (1H, дд, J=7,7 и 1,3 Гц), 6,55 (1H, дд, J=7,8 и 2,4 Гц), 4,51-4,46 (3H, м), 3,73 (3H, с), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,7 Гц), 2,12 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,11-1,02 (2H, м);
МС (ESI) m/z: 482 (M + H)+.
(Пример 50) 4-карбоксиметилциклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(50a) трет-бутиловый эфир 6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (261 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (220 мг) и фенилизоцианата (0,12 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,37-7,32 (3H, м), 7,31-7,01 (5H, м), 6,78-6,67 (2H, м), 4,52 (2H, с), 3,62 (2H, т, J=5,2 Гц), 2,79 (2H, т, J=5,9 Гц), 1,50 (9H, с).
(50b) гидрохлорид 1-фенил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (215 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (261 мг), полученного в Примере (50a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 8,98 (2H, ушир.с), 8,96 (1H, с), 7,45 (2H, д, J=7,9 Гц), 7,40 (1H, д, J=2,0 Гц), 7,30-7,26 (3H, м), 7,13 (1H, д, J=8,6 Гц), 6,97 (1H, дд, J=7,4 и 7,4 Гц), 4,19 (2H, с), 3,37-3,31 (2H, м), 2,97 (2H, т, J=6,5 Гц).
(50c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (329 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (171 мг), полученного в Примере (1d), и гидрохлорида 1-фенил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (215 мг), полученного в Примере (50b). Этот метиловый сложный эфир (329 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (281 мг, 88%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,75 (1H, с), 8,71 (1H, с), 7,45 (2H, д, J=7,4 Гц), 7,32-7,22 (4H, м), 7,09 (1H, д, J=8,2 Гц), 6,96 (1H, дд, J=7,2 и 7,2 Гц), 4,51-4,46 (3H, м), 3,57 (2H, т, J=5,6 Гц), 2,75 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 452 (M + H)+.
(Пример 51) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-дифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
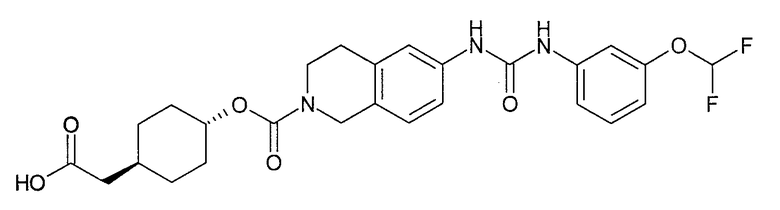
(51a) трет-бутиловый эфир 6-[3-(3-дифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,63 г, 94%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (992 мг) и 3-дифторметоксианилина (0,49 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,41-6,59 (7H, м), 7,16 (1H, д, J=9,0 Гц), 6,81 (1H, дд, J=8,0 и 2,2 Гц), 6,49 (1H, дд, J=74,1 и 74,1 Гц), 4,50 (2H, с), 3,61 (2H, т, J=6,1 Гц), 2,76 (2H, с), 1,51 (9H, с).
(51b) гидрохлорид 1-(3-дифторметоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,35 г, 98%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-дифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,63 г), полученного в Примере (51a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,25 (1H, с), 9,08 (1H, с), 9,03 (1H, ушир.с), 7,49 (1H, дд, J=2,1 и 2,1 Гц), 7,40 (1H, д, J=2,0 Гц), 7,21 (1H, дд, J=74,1 и 74,1 Гц), 7,32 (1H, дд, J=8,2 и 8,2 Гц), 7,29 (1H, дд, J=8,6 и 2,4 Гц), 7,19-7,16 (1H, м), 7,14 (1H, д, J=8,2 Гц), 6,78 (1H, дд, J=8,4 и 2,6 Гц), 4,20 (2H, с), 3,36 (2H, т, J=6,5 Гц), 2,98 (2H, т, J=6,1 Гц).
(51c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-дифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (797 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3-дифторметоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (555 мг), полученного в Примере (51b). Этот метиловый сложный эфир (797 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (619 мг, 80%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 9,08 (1H, ушир.с), 8,88 (1H, ушир.с), 7,49 (1H, д, J=2,3 Гц), 7,21 (1H, дд, J=74,1 и 74,1 Гц), 7,34-7,29 (2H, м), 7,25-7,18 (2H, м), 7,09 (1H, д, J=8,6 Гц), 6,76 (1H, д, J=10,2 Гц), 4,48-4,47 (3H, м), 3,57 (2H, т, J=5,8 Гц), 2,75 (2H, т, J=6,1 Гц), 2,11 (2H, д, J=7,5 Гц), 1,95-1,90 (2H, м), 1,78-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 518 (M + H)+.
(Пример 52) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(52a) трет-бутиловый эфир 6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,72 г, 95%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (992 мг) и 3-трифторметоксианилина (0,53 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,41 (1H, ушир.с), 7,35-6,55 (7H, м), 6,91 (1H, д, J=7,8 Гц), 4,51 (2H, с), 3,62 (2H, т, J=6,0 Гц), 2,77 (2H, ушир.с), 1,52 (9H, с).
(52b) гидрохлорид 1-(3-трифторметоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,47 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,72 г), полученного в Примере (52a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,36 (1Н, с), 9,10 (1H, с), 8,99 (1H, ушир.с), 7,72 (1H, с), 7,42-7,38 (2H, м), 7,30-7,26 (2H, м), 7,14 (1H, д, J=8,2 Гц), 6,96-6,93 (1H, м), 4,20 (2H, с), 3,36 (2H, т, J=6,4 Гц), 2,98 (2H, т, J=6,2 Гц).
(52c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (811 мг, 99%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3-трифторметоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (582 мг), полученного в Примере (52b). Этот метиловый сложный эфир (811 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (625 мг, 79%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,05 (1H, с), 8,77 (1H, с), 7,71 (1H, с), 7,40 (1H, дд, J=8,2 и 8,2 Гц), 7,33 (1H, с), 7,28 (1H, дд, J=7,8 и 1,5 Гц), 7,22 (1H, дд, J=8,2 и 0,8 Гц), 7,10 (1H, д, J=8,6 Гц), 6,94 (1H, д, J=8,2 Гц), 4,51-4,47 (3H, м), 3,57 (2H, т, J=5,8 Гц), 2,76 (2H, т, J=5,7 Гц), 2,12 (2H, д, J=7,1 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,67-1,62 (1H, м), 1,39-1,30 (2H, м), 1,11-1,03 (2H, м);
МС (ESI) m/z: 536 (M + H)+.
(Пример 53) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(53a) трет-бутиловый эфир 6-[3-(3-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,26 г, 78%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (943 мг) и 3-этокси-2-метиланилина (Европейский патент 1679308) (576 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,23-7,14 (2H, м), 7,19 (1H, дд, J=8,1 и 8,1 Гц), 7,06 (1H, д, J=8,3 Гц), 7,02 (1H, д, J=7,8 Гц), 6,78 (1H, д, J=8,3 Гц), 6,45 (1H, с), 6,18 (1H, с), 4,51 (2H, с), 4,06 (2H, кв., J=7,0 Гц), 3,61 (2H, т, J=4,9 Гц), 2,79 (2H, т, J=5,7 Гц), 2,17 (3H, с), 1,44 (3H, т, J=7,1 Гц), 1,49 (9H, с).
(53b) гидрохлорид 1-(3-этокси-2-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,08 г, количественный выход) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,26 г), полученного в Примере (53a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,28 (1H, с), 9,02 (1H, ушир.с), 8,11 (1H, с), 7,42 (1H, д, J=4,3 Гц), 7,40 (1H, с), 7,28 (1H, дд, J=8,2 и 2,3 Гц), 7,12 (1H, д, J=8,6 Гц), 7,07 (1H, дд, J=8,1 и 8,0 Гц), 6,67 (1H, д, J=7,8 Гц), 4,19 (2H, с), 4,01 (2H, кв., J=6,9 Гц), 3,37-3,34 (2H, м), 2,97 (2H, т, J=6,2 Гц), 2,09 (3H, с), 1,35 (3H, т, J=6,9 Гц).
(53c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (785 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3-этокси-2-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины, полученного в Примере (53b). Этот метиловый сложный эфир (785 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (665 мг, 87%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,98 (1H, с), 7,96 (1H, с), 7,42 (1H, д, J=7,8 Гц), 7,33 (1H, с), 7,22 (1H, д, J=8,2 Гц), 7,08 (1H, д, J=8,2 Гц), 7,06 (1H, д, J=8,3 Гц), 6,67 (1H, д, J=8,2 Гц), 4,51-4,46 (3H, м), 4,01 (2H, кв., J=7,0 Гц), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,7 Гц), 2,11 (2H, д, J=6,6 Гц), 2,08 (3H, с), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,67-1,63 (1H, м), 1,39-1,29 (2H, м), 1,35 (3H, т, J=6,9 Гц), 1,11-1,01 (2H, м);
МС (ESI) m/z: 510 (M + H)+.
(Пример 54) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этокси-4-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(54a) трет-бутиловый эфир 6-[3-(3-этокси-4-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,55 г, 96%) получают в виде розового твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (943 мг) и 3-этокси-4-метиланилина (Chemische Berichte 1906, 39, 3248.) (574 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,19-6,91 (3H, м), 7,07 (1H, д, J=7,8 Гц), 7,00 (1H, д, J=1,9 Гц), 6,69 (1H, ушир.с), 6,67 (1H, д, J=2,0 Гц), 6,62 (1H, ушир.с), 4,52 (2H, с), 4,01 (2H, кв., J=6,9 Гц), 3,61 (2H, ушир.с), 2,78 (2H, т, J=5,9 Гц), 2,19 (3H, с), 1,49 (9H, с), 1,41 (3H, т, J=6,9 Гц).
(54b) гидрохлорид 1-(3-этокси-4-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,28 г, 98%) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-этокси-4-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,55 г), полученного в Примере (54a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,09 (1H, с), 8,98 (1H, с), 8,92 (1H, с), 7,41 (1H, д, J=1,6 Гц), 7,27 (1H, дд, J=8,4 и 2,1 Гц), 7,22 (1H, д, J=2,0 Гц), 7,12 (1H, д, J=8,6 Гц), 7,01 (1H, д, J=8,6 Гц), 6,79 (1H, дд, J=8,0 и 2,1 Гц), 4,19 (2H, ушир.с), 3,99 (2H, кв., J=6,9 Гц), 3,47 (2H, ушир.с), 2,98 (2H, т, J=6,2 Гц), 2,08 (3H, с), 1,36 (3H, т, J=7,1 Гц).
(54c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этокси-4-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (785 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3-этокси-4-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (543 мг), полученного в Примере (54b). Этот метиловый сложный эфир (785 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (635 мг, 83%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 8,65 (1H, с), 8,64 (1H, с), 7,33 (1H, с), 7,22 (1H, д, J=2,0 Гц), 7,20 (1H, д, J=9,0 Гц), 7,08 (1H, д, J=8,2 Гц), 7,00 (1H, д, J=8,2 Гц), 6,79 (1H, дд, J=8,0 и 2,1 Гц), 4,49-4,46 (3H, м), 3,99 (2H, кв., J=6,9 Гц), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=6,0 Гц), 2,11 (2H, д, J=7,0 Гц), 2,07 (3H, с), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,63 (1H, м), 1,39-1,29 (2H, м), 1,35 (3H, т, J=7,1 Гц), 1,11-1,02 (2H, м);
МС (ESI) m/z: 510 (M + H)+.
(Пример 55) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(55a) трет-бутиловый эфир 6-[3-(5-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,60 г, 99%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (943 мг) и 5-этокси-2-метиланилина (Chemische Berichte 1959, 92, 674.) (581 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,18-6,98 (2H, м), 7,16 (1H, ушир.с), 7,13 (1H, д, J=8,6 Гц), 7,02 (1H, д, J=7,4 Гц), 6,71 (1H, дд, J=8,2 и 2,7 Гц), 6,54 (1H, ушир.с), 6,26 (1H, ушир.с), 4,52 (2H, с), 4,02 (2H, кв., J=7,1 Гц), 3,62 (2H, ушир.с), 2,79 (2H, т, J=5,9 Гц), 2,19 (3H, с), 1,49 (9H, с), 1,40 (3H, т, J=7,0 Гц).
(55b) гидрохлорид 1-(5-этокси-2-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,36 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,60 г), полученного в Примере (55a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,52 (1H, с), 9,11 (1H, ушир.с), 8,13 (1H, с), 7,59 (1Н, д, J=2,8 Гц), 7,43 (1H, д, J=1,9 Гц), 7,29 (1H, дд, J=8,4 и 2,2 Гц), 7,13 (1H, д, J=8,2 Гц), 7,04 (1H, д, J=8,2 Гц), 6,50 (1H, дд, J=8,2 и 2,8 Гц), 4,20 (2H, с), 3,96 (2H, кв., J=7,0 Гц), 3,38-3,34 (2H, м), 2,98 (2H, т, J=6,2 Гц), 2,18 (3H, с), 1,31 (3H, т, J=7,1 Гц).
(55c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-этокси-2-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (732 мг, 93%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(5-этокси-2-метилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (543 мг), полученного в Примере (55b). Этот метиловый сложный эфир (732 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (579 мг, 81%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,07 (1H, с), 7,89 (1H, с), 7,59 (1H, д, J=2,3 Гц), 7,35 (1H, с), 7,21 (1H, д, J=7,8 Гц), 7,09 (1H, д, J=8,6 Гц), 7,04 (1H, д, J=9,0 Гц), 6,50 (1H, дд, J=8,2 и 2,7 Гц), 4,51-4,46 (3H, м), 3,96 (2H, кв., J=6,8 Гц), 3,57 (2H, т, J=6,1 Гц), 2,76 (2H, т, J=5,6 Гц), 2,16 (3H, с), 2,11 (2H, д, J=7,0 Гц), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,31 (3H, т, J=7,0 Гц), 1,12-1,03 (2H, м);
МС (ESI) m/z: 510 (M + H)+.
(Пример 56) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(56a) трет-бутиловый эфир 6-[3-(3-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (938 мг, 57%) получают в виде белого твердого вещества таким же способом, как в Примере (22a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг) и 3-фтор-5-метоксибензойной кислоты (681 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,46-6,70 (4H, м), 7,21 (1H, ушир.с), 6,79 (1H, с), 6,57 (1H, ушир.с), 6,34-6,30 (1H, м), 4,49 (2H, с), 3,75 (3H, с), 3,60 (2H, т, J=6,0 Гц), 2,75 (2H, ушир.с), 1,51 (9H, с).
(56b) гидрохлорид 1-(3-фтор-5-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (742 мг, 94%) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (938 мг), полученного в примере (56a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,28 (1H, с), 9,10 (1H, с), 9,05 (1H, ушир.с), 7,39 (1H, д, J=1,9 Гц), 7,28 (1H, дд, J=8,4 и 2,1 Гц), 7,13 (1H, д, J=8,2 Гц), 6,99-6,96 (1H, м), 6,83 (1H, с), 6,46-6,42 (1H, м), 4,19 (2H, с), 3,74 (3H, с), 3,38-3,34 (2H, м), 2,97 (2H, т, J=6,4 Гц).
(56c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (770 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3-фтор-5-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины, полученного в Примере (56b). Этот метиловый сложный эфир (770 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (630 мг, 84%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,11 (1H, ушир.с), 8,91 (1H, ушир.с), 7,32 (1H, д, J=1,9 Гц), 7,23 (1H, дд, J=8,2 и 1,9 Гц), 7,09 (1H, д, J=8,6 Гц), 6,98 (1H, дт, J=11,6 и 2,0 Гц), 6,85 (1H, с), 6,42 (1H, дт, J=10,8 и 2,2 Гц), 4,48-4,46 (3H, м), 3,74 (3H, с), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=6,0 Гц), 2,11 (2H, д, J=6,7 Гц), 1,95-1,90 (2H, м), 1,77-1,74 (2H, м), 1,69-1,63 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 500 (M + H)+.
(Пример 57) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(57a) трет-бутиловый эфир 6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,49 г, 92%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг) и 3,4-дифторанилина (516 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,42 (1Н, ушир.с), 7,30-6,82 (6H, м), 6,56 (1H, ушир.с), 4,51 (2H, с), 3,62 (2H, т, J=6,0 Гц), 2,78 (2H, ушир.с), 1,51 (9H, с).
(57b) гидрохлорид 1-(3,4-дифторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,25 г, количественный выход) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,49 г), полученного в Примере (57a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,40 (1H, с), 9,18 (1H, с), 9,13 (1H, ушир.с), 7,71-7,65 (1H, м), 7,39-7,32 (2H, м), 7,29 (1H, дд, J=8,6 и 1,9 Гц), 7,14 (1H, д, J=8,6 Гц), 7,12-7,08 (1H, м), 4,20 (2H, с), 3,38-3,34 (2H, м), 2,98 (2H, т, J=6,0 Гц).
(57c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (752 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(3,4-дифторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (510 мг), полученного в Примере (57b). Этот метиловый сложный эфир (752 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (678 мг, 93%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,98 (1H, ушир.с), 8,79 (1H, ушир.с), 7,71-7,65 (1H, м), 7,38-7,31 (2H, м), 7,23 (1H, д, J=7,5 Гц), 7,14-7,08 (2H, м), 4,51-4,47 (3H, м), 3,57 (2H, т, J=5,8 Гц), 2,75 (2H, т, J=5,9 Гц), 2,12 (2H, д, J=7,1 Гц), 1,95-1,91 (2Н, м), 1,77-1,74 (2H, м), 1,68-1,63 (1H, м), 1,39-1,29 (2H, м), 1,11-1,03 (2H, м);
МС (ESI) m/z: 488 (M + H)+.
(Пример 58) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-фтор-3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(58a) трет-бутиловый эфир 6-[3-(4-фтор-3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (614 мг, 48%) получают в виде белого твердого вещества таким же способом, как в Примере (22a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (760 мг) и 4-фтор-3-метоксибензойной кислоты (521 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,31-6,82 (5H, м), 7,00 (1H, дд, J=9,8 и 9,8 Гц), 6,77 (1H, ушир.с), 6,68 (1H, ушир.с), 4,52 (2H, с), 3,88 (3H, с), 3,62 (2H, ушир.с), 2,79 (2H, ушир.с), 1,50 (9H, с).
(58b) гидрохлорид 1-(4-фтор-3-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (507 мг, 98%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(4-фтор-3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (614 мг), полученного в Примере (58a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,16 (1H, с), 9,13 (1H, ушир.с), 9,11 (1H, с), 7,43 (1H, дд, J=8,0 и 2,6 Гц), 7,40 (1H, д, J=1,9 Гц), 7,28 (1H, дд, J=8,4 и 2,1 Гц), 7,12 (1H, д, J=8,6 Гц), 7,10 (1H, д, J=8,6 Гц), 6,88-6,84 (1H, м), 4,19 (2H, с), 3,81 (3H, с), 3,36 (2H, т, J=6,5 Гц), 2,98 (2H, т, J=6,0 Гц).
(58c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-фтор-3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (616 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-(4-фтор-3-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (422 мг), полученного в Примере (58b). Этот метиловый сложный эфир (616 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (536 мг, 89%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 8,81 (1H, с), 8,71 (1H, с), 7,43 (1H, дд, J=7,8 и 2,8 Гц), 7,34 (1H, с), 7,21 (1H, д, J=8,6 Гц), 7,13-7,08 (1H, м), 7,09 (1H, д, J=7,1 Гц), 6,88-6,84 (1H, м), 4,51-4,46 (3H, м), 3,81 (3H, с), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,6 Гц), 2,11 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,38-1,30 (2H, м), 1,11-1,02 (2H, м);
МС (ESI) m/z: 500 (M + H)+.
(Пример 59) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этокси-4-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(59a) трет-бутиловый эфир 6-[3-(3-этокси-4-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (655 мг, 57%) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (672 мг) и 3-этокси-4-фторбензойной кислоты (J. Med. Chem. 2002, 45, 3112.) (499 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,32-6,56 (5H, м), 7,01 (1H, д, J=9,0 Гц), 6,99 (1H, д, J=8,6 Гц), 6,82 (1H, ушир.с), 4,53 (2H, с), 4,09 (2H, кв., J=7,0 Гц), 3,62 (2H, т, J=6,1 Гц), 2,79 (2H, т, J=5,7 Гц), 1,50 (9H, с), 1,44 (3H, т, J=7,1 Гц).
(59b) гидрохлорид 1-(3-этокси-4-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (538 мг, 97%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-этокси-4-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (654 мг), полученного в Примере (59a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,06-9,02 (3H, м), 7,42 (1H, д, J=2,3 Гц), 7,40 (1H, дд, J=2,6 и 2,6 Гц), 7,27 (1H, дд, J=8,3 и 2,4 Гц), 7,12 (1H, д, J=8,6 Гц), 7,09 (1H, д, J=8,6 Гц), 6,87-6,83 (1H, м), 4,19 (2H, с), 4,06 (2H, кв., J=7,0 Гц), 3,37-3,34 (2H, м), 2,98-2,97 (2H, м), 1,36 (3H, т, J=7,1 Гц).
(59c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этокси-4-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (633 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-(3-этокси-4-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины, полученного в Примере (59b). Этот метиловый сложный эфир (633 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (523 мг, 85%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,82 (1H, с), 8,73 (1H, с), 7,42 (1H, дд, J=8,0 и 2,5 Гц), 7,33 (1H, д, J=1,2 Гц), 7,21 (1H, дд, J=8,2 и 2,0 Гц), 7,11 (1H, д, J=9,0 Гц), 7,08 (1H, д, J=9,0 Гц), 6,87-6,83 (1H, м), 4,48-4,46 (3H, м), 4,06 (2H, кв., J=6,9 Гц), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=6,6 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,67-1,63 (1H, м), 1,36 (3H, т, J=6,9 Гц), 1,37-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 514 (M + H)+.
(Пример 60) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(60a) трет-бутиловый эфир 6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,27 г, 97%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (782 мг) и 2-фтор-5-метоксианилина (Европейский патент 950657) (445 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,83 (1Н, дд, J=6,7 и 3,2 Гц), 7,36-6,90 (3H, м), 6,98 (1H, д, J=9,0 Гц), 6,95 (1H, д, J=9,0 Гц), 6,86 (1H, ушир.с), 6,53-6,49 (1H, м), 4,53 (2H, с), 3,79 (3H, с), 3,64 (2H, т, J=6,1 Гц), 2,81 (2H, т, J=5,1 Гц), 1,51 (9H, с).
(60b) гидрохлорид 1-(2-фтор-5-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,08 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,27 г), полученного в Примере (60a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,26 (1H, с), 8,94 (1H, ушир.с), 8,64 (1H, д, J=2,4 Гц), 7,81 (1H, дд, J=7,0 и 3,1 Гц), 7,42 (1H, д, J=1,6 Гц), 7,27 (1H, дд, J=8,6 и 2,0 Гц), 7,19-7,13 (2H, м), 6,56-6,52 (1H, м), 4,20 (2H, с), 3,72 (3H, с), 3,37-3,34 (2H, м), 2,98 (2H, т, J=5,9 Гц).
(60c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (616 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-(2-фтор-5-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (422 мг), полученного в Примере (60b). Этот метиловый сложный эфир (616 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (507 мг, 85%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,09 (1H, с), 8,59 (1H, с), 7,83 (1H, дд, J=7,0 и 3,1 Гц), 7,34 (1H, с), 7,21 (1H, д, J=9,0 Гц), 7,18-7,09 (2H, м), 6,53 (1H, дт, J=9,0 и 3,3 Гц), 4,49-4,47 (3H, м), 3,72 (3H, с), 3,57 (2H, т, J=5,8 Гц), 2,76 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,0 Гц), 1,95-1,90 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,01 (2H, м);
МС (ESI) m/z: 500 (M + H)+.
(Пример 61) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-этокси-2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(61a) 4-этокси-1-фтор-2-нитробензол
К раствору 4-фтор-3-нитрофенола (628 мг) в ДМФА (10 мл) добавляют небольшими порциями при комнатной температуре гидрид натрия (чистота: 55% или выше, 209 мг). Через 30 минут туда при комнатной температуре добавляют этилиодид (0,38 мл). Через 2 часа реакционную смесь разбавляют этилацетатом, промывают насыщенным водным бикарбонатом натрия и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматографией (смесь гексан/этилацетат), получая указанное в заголовке соединение (685 мг, 93%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,52 (1Н, дд, J=5,9 и 3,1 Гц), 7,23-7,13 (2H, м), 4,07 (2H, кв., J=7,0 Гц), 1,45 (3H, т, J=7,0 Гц).
(61b) 5-этокси-2-фторфениламин
4-Этокси-1-фтор-2-нитробензол (685 мг), полученный в Примере (61a), восстанавливают таким же способом, как в Примере (1b), получая указанное в заголовке соединение (498 мг, 87%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 6,87 (1H, дд, J=10,8 и 8,8 Гц), 6,33 (1H, дд, J=7,7 и 3,0 Гц), 6,20 (1H, дт, J=8,7 и 3,3 Гц), 3,95 (2H, кв., J=7,0 Гц), 3,70 (2H, ушир.с), 1,38 (3H, т, J=7,1 Гц).
(61c) трет-бутиловый эфир 6-[3-(5-этокси-2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,37 г, количественный выход) получают в виде слегка фиолетового твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (795 мг) и 5-этокси-2-фторанилина (497 мг), полученного в Примере (61b).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,83-7,81 (1H, м), 7,37-6,81 (4H, м), 6,96 (1H, д, J=9,0 Гц), 6,93 (1H, д, J=9,0 Гц), 6,52-6,48 (1H, м), 4,52 (2H, с), 4,00 (2H, кв., J=7,0 Гц), 3,63 (2H, т, J=5,9 Гц), 2,79 (2H, ушир.с), 1,51 (9H, с), 1,37 (3H, т, J=7,0 Гц).
(61d) гидрохлорид 1-(5-этокси-2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,17 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-этокси-2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,37 г), полученного в Примере (61c).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,33 (1Н, с), 9,04 (1H, ушир.с), 8,65 (1H, д, J=2,7 Гц), 7,80 (1H, дд, J=6,8 и 2,9 Гц), 7,41 (1H, д, J=1,9 Гц), 7,27 (1H, дд, J=8,4 и 2,1 Гц), 7,15-7,10 (1H, м), 7,14 (1H, д, J=7,8 Гц), 6,54-6,50 (1H, м), 4,19 (2H, с), 3,97 (2H, кв., J=6,8 Гц), 3,36 (2H, т, J=6,5 Гц), 2,98 (2H, т, J=6,1 Гц), 1,32 (3H, т, J=7,1 Гц).
(61e) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-этокси-2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (633 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-(5-этокси-2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (438 мг), полученного в Примере (61d). Этот метиловый сложный эфир (633 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (507 мг, 82%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,09 (1H, с), 8,57 (1H, с), 7,82 (1H, дд, J=6,8 и 2,9 Гц), 7,33 (1H, с), 7,21 (1H, д, J=7,4 Гц), 7,15-7,09 (2H, м), 6,51 (1H, дт, J=9,0 и 3,5 Гц), 4,49-4,47 (3H, м), 3,97 (2H, кв., J=7,0 Гц), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=6,6 Гц), 2,12-2,10 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,29-1,39 (2H, м), 1,32 (3H, т, J=6,9 Гц), 1,12-1,02 (2H, м);
МС (ESI) m/z: 514 (M + H)+.
(Пример 62) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(62a) трет-бутиловый эфир 6-[3-(4-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,63 г, 98%) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (993 мг) и 4-метилсульфанилизоцианата (0,67 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,29-7,00 (7H, м), 7,00 (1H, ушир.с), 6,71 (1H, ушир.с), 4,50 (2H, с), 3,59 (2H, т, J=5,1 Гц), 2,74 (2H, т, J=5,7 Гц), 2,44 (3H, с), 1,50 (9H, с).
(62b) гидрохлорид 1-(4-метилсульфанилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,38 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(4-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,63 г), полученного в Примере (62a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,08 (1H, ушир.с), 9,05 (1H, д, J=4,7 Гц), 7,44-7,40 (1H, м), 7,43 (2H, д, J=8,6 Гц), 7,29 (1H, дд, J=8,4 и 2,2 Гц), 7,24-7,21 (1H, м), 7,22 (2H, д, J=8,6 Гц), 7,13 (1H, д, J=8,2 Гц), 4,20 (2H, с), 3,39-3,35 (2H, м), 2,98 (2H, т, J=6,0 Гц), 2,44 (3H, с).
(62c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (2,01 г, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (947 мг), полученного в Примере (1d), и гидрохлорида 1-(4-метилсульфанилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины, полученного в Примере (62b). Этот метиловый сложный эфир (789 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (456 мг, 60%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,75 (1H, с), 8,68 (1H, с), 7,42 (2H, д, J=8,6 Гц), 7,31 (1H, с), 7,22 (2H, д, J=8,6 Гц), 7,23-7,21 (1H, м), 7,08 (1H, д, J=8,6 Гц), 4,49-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,9 Гц), 2,44 (3H, с), 2,12 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,03 (2H, м);
МС (ESI) m/z: 498 (M + H)+.
(Пример 63) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(63a) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(4-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
К смеси 4-метоксикарбонилметилциклогексилового эфира транс-6-[3-(4-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,85 г), полученного в качестве промежуточного продукта в Примере (62c), и дихлорметана (20 мл) добавляют при 0°C mCPBA (623 мг). Реакционную смесь нагревают до комнатной температуры, разбавляют дихлорметаном, промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, затем сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматографией (смесь дихлорметан/метанол=3:1 и затем смесь дихлорметан/метанол=4:1), получая указанное в заголовке соединение (1,37 г, 72%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,14 (1Н, ушир.с), 8,87 (1H, ушир.с), 7,66 (2H, д, J=9,0 Гц), 7,60 (2H, д, J=8,7 Гц), 7,34 (1H, ушир.с), 7,25 (1H, д, J=8,2 Гц), 7,10 (1H, д, J=8,2 Гц), 4,49-4,47 (3H, м), 3,58 (3H, с), 3,57 (2H, т, J=6,0 Гц), 2,76 (2H, т, J=5,9 Гц), 2,71 (3H, с), 2,22 (2H, д, J=6,6 Гц), 1,95-1,91 (2H, м), 1,75-1,65 (3H, м), 1,40-1,30 (2H, м), 1,14-1,04 (2H, м).
(63b) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-[3-(4-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,37 г), полученный в Примере (63a), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (1,22 г, 92%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,09 (1H, с), 8,82 (1H, с), 7,65 (2H, д, J=8,6 Гц), 7,60 (2H, д, J=8,6 Гц), 7,34 (1H, ушир.с), 7,24 (1H, д, J=8,6 Гц), 7,10 (1H, д, J=8,2 Гц), 4,51-4,47 (3H, м), 3,57 (2H, т, J=6,1 Гц), 2,76 (2H, т, J=6,2 Гц), 2,71 (3H, с), 2,12 (2H, д, J=6,6 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,63 (1H, м), 1,39-1,30 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 514 (M + H)+.
(Пример 64) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(64a) трет-бутиловый эфир 6-[3-(3-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,43 г, 87%) получают в виде розового твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (983 мг) и 3-метилсульфанилфенилизоцианата (0,66 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,33-6,70 (5H, м), 7,31 (1H, ушир.с), 7,20 (1H, дд, J=7,8 и 7,9 Гц), 7,11 (1H, д, J=8,3 Гц), 6,96 (1H, д, J=7,8 Гц), 4,50 (2H, с), 3,59 (2H, т, J=5,3 Гц), 2,75 (2H, т, J=5,1 Гц), 2,45 (3H, с), 1,51 (9H, с).
(64b) гидрохлорид 1-(3-метилсульфанилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (566 мг, количественный выход) получают в виде серого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (670 мг), полученного в Примере (64a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,32 (1H, с), 9,29 (1H, с), 9,23 (1H, ушир.с), 7,49 (1H, дд, J=2,0 и 2,0 Гц), 7,39 (1H, д, J=2,0 Гц), 7,29 (1H, дд, J=8,6 и 2,3 Гц), 7,22 (1H, дд, J=7,8 и 7,8 Гц), 7,15-7,12 (2H, м), 6,87-6,84 (1H, м), 4,19 (2H, т, J=4,3 Гц), 3,38-3,34 (2H, м), 2,98 (2H, т, J=6,2 Гц), 2,46 (3H, с).
(64c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (818 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (390 мг), полученного в Примере (1d), и гидрохлорида 1-(3-метилсульфанилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (566 мг), полученного в Примере (64b). Этот метиловый сложный эфир (251 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (135 мг, 56%) в виде твердого вещества кремового цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 8,81 (1H, с), 8,73 (1H, с), 7,48 (1H, дд, J=1,9 и 1,9 Гц), 7,33 (1H, с), 7,23-7,19 (2H, м), 7,14 (1H, д, J=9,0 Гц), 7,09 (1H, д, J=8,2 Гц), 6,85 (1H, д, J=7,8 Гц), 4,51-4,46 (3H, м), 3,57 (2H, т, J=6,1 Гц), 2,75 (2H, т, J=5,9 Гц), 2,46 (3H, с), 2,11 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 498 (M + H)+.
(Пример 65) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(65a) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(3-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (559 мг, 77%) получают в виде бледно-розового твердого вещества таким же способом, как в Примере (63a), из 4-метоксикарбонилметилциклогексилового эфира транс-6-[3-(3-метилсульфанилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (700 мг), полученного в качестве промежуточного продукта в Примере (64c).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,13 (1H, ушир.с), 8,82 (1H, ушир.с), 7,90 (1H, дд, J=2,0 и 2,0 Гц), 7,52-7,45 (2H, м), 7,48 (1H, д, J=7,5 Гц), 7,36 (1H, с), 7,24 (1H, д, J=7,5 Гц), 7,10 (1H, д, J=8,6 Гц), 4,51-4,47 (3H, м), 3,59 (3H, с), 3,59-3,55 (2H, м), 2,76 (2H, т, J=5,7 Гц), 2,73 (3H, с), 2,23 (2H, д, J=6,7 Гц), 1,95-1,90 (2H, м), 1,75-1,65 (3H, м), 1,40-1,30 (2H, м), 1,14-1,03 (2H, м).
(65b) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-[3-(3-метансульфинилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (559 мг, полученный в Примере (65a), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (516 мг, 95%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 9,19 (1H, ушир.с), 8,89 (1H, ушир.с), 7,90 (1H, с), 7,52-7,45 (2H, м), 7,36 (1H, с), 7,26-7,23 (2H, м), 7,10 (1H, д, J=8,6 Гц), 4,51-4,47 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,73 (3H, с), 2,11 (2H, д, J=7,0 Гц), 1,94-1,91 (2H, м), 1,78-1,74 (2H, м), 1,69-1,53 (1H, м), 1,40-1,28 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 514 (M + H)+.
(Пример 66) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
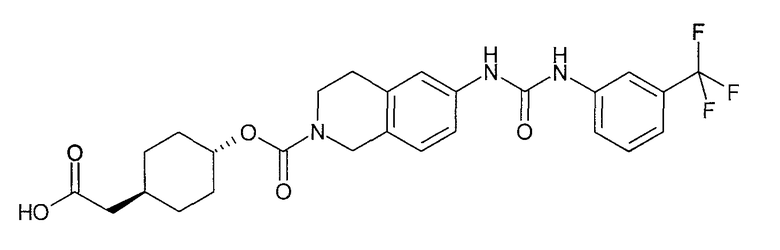
(66a) трет-бутиловый эфир 6-[3-(3-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,31 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и 3-трифторметилфенилизоцианата (0,50 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,68 (1H, ушир.с), 7,62 (1H, д, J=8,6 Гц), 7,42 (1H, дд, J=7,8 и 7,8 Гц), 7,31 (1H, д, J=7,5 Гц), 7,33-6,63 (5H, м), 4,53 (2H, с), 3,64 (2H, т, J=6,1 Гц), 2,80 (2H, ушир.с), 1,52 (9H, с).
(66b) гидрохлорид 1-(3-трифторметилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,12 г, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,31 г), полученного в Примере (66a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,51 (1H, с), 9,21 (1H, с), 9,03 (1H, ушир.с), 8,04 (1Н, с), 7,56 (1H, д, J=8,2 Гц), 7,52 (1H, дд, J=7,8 и 7,8 Гц), 7,42 (1H, д, J=1,9 Гц), 7,32 (1H, д, J=7,1 Гц), 7,29 (1H, дд, J=8,4 и 2,1 Гц), 7,14 (1H, д, J=8,2 Гц), 4,20 (2H, с), 3,36 (2H, т, J=6,4 Гц), 2,98 (2H, т, J=6,2 Гц).
(66c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (640 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-(3-трифторметилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (446 мг), полученного в Примере (66b). Этот метиловый сложный эфир (640 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (530 мг, 85%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,15 (1H, с), 8,85 (1H, с), 8,04 (1H, с), 7,57-7,49 (2H, м), 7,35 (1H, с), 7,31 (1H, д, J=7,4 Гц), 7,23 (1H, дд, J=8,2 и 1,6 Гц), 7,10 (1H, д, J=8,2 Гц), 4,51-4,47 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,76 (2H, т, J=5,9 Гц), 2,12 (2H, д, J=7,4 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,63 (1H, м), 1,40-1,29 (2H, м), 1,40-1,29 (2H, м);
МС (ESI) m/z: 520 (M + H)+.
(Пример 67) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(67a) трет-бутиловый эфир 6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,16 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и 3-фторфенилизоцианата (0,41 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,39-6,59 (5H, м), 7,24-7,19 (2H, м), 7,04 (1H, д, J=7,8 Гц), 6,76 (1H, дд, J=8,5 и 8,5 Гц), 4,50 (2H, с), 3,61 (2H, т, J=5,9 Гц), 2,76 (2Н, ушир.с), 1,51 (9H, с).
(67b) гидрохлорид 1-(3-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (965 мг, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,16 г), полученного в Примере (67a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,44 (1H, с), 9,24 (1H, с), 9,15 (1H, ушир.с), 7,52-7,49 (1H, м), 7,39 (1H, д, J=1,9 Гц), 7,33-7,28 (2H, м), 7,14 (1H, д, J=8,6 Гц), 7,10 (1H, дд, J=7,4 и 1,9 Гц), 6,80-6,76 (1H, м), 4,20 (2H, с), 3,36 (2H, т, J=6,5 Гц), 2,98 (2H, т, J=6,2 Гц).
(67c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (580 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-(3-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (386 мг), полученного в Примере (67b). Этот метиловый сложный эфир (580 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (500 мг, 89%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,97 (1H, с), 8,75 (1H, с), 7,50 (1H, дт, J=11,8 и 2,2 Гц), 7,33-7,27 (2H, м), 7,23 (1H, д, J=8,3 Гц), 7,11-7,08 (2H, м), 6,78 (1H, дт, J=12,0 и 4,3 Гц), 4,51-4,47 (3H, м), 3,57 (2H, т, J=6,0 Гц), 2,75 (2H, т, J=5,7 Гц), 2,12 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,30 (2H, м), 1,12-1,01 (2H, м);
МС (ESI) m/z: 470 (M + H)+.
(Пример 68) 4-карбоксиметилциклогексиловый эфир транс-6-(3-м-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
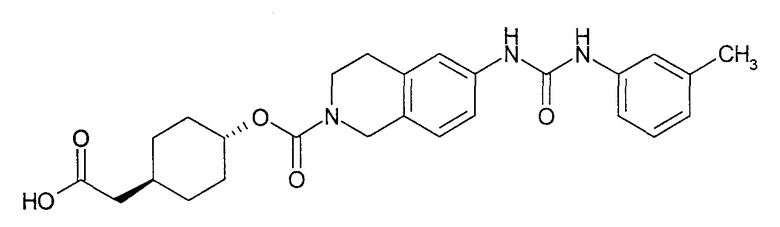
(68a) трет-бутиловый эфир 6-(3-м-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,13 г, 99%) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и м-толилизоцианата (0,45 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,36-6,74 (6H, м), 7,18 (1H, дд, J=7,7 и 7,6 Гц), 7,12 (1H, д, J=8,3 Гц), 6,90 (1H, д, J=7,4 Гц), 4,49 (2H, с), 3,58 (2H, ушир.с), 2,73 (2H, т, J=5,7 Гц), 2,30 (3H, с), 1,50 (9H, с).
(68b) гидрохлорид 1-(1,2,3,4-тетрагидроизохинолин-6-ил)-3-м-толилмочевины
Указанное в заголовке соединение (918 мг, 97%) получают в виде бледно-розового твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-м-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,13 г), полученного в Примере (68a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,10 (1H, ушир.с), 9,07 (1H, с), 8,97 (1H, с), 7,40 (1H, д, J=2,0 Гц), 7,30-7,27 (2H, м), 7,23 (1H, д, J=9,0 Гц), 7,15 (1H, дд, J=7,8 и 7,8 Гц), 7,12 (1H, д, J=8,2 Гц), 6,79 (1H, д, J=7,4 Гц), 4,19 (2H, с), 3,36 (2H, т, J=6,2 Гц), 2,97 (2H, т, J=6,1 Гц), 2,27 (3H, с).
(68c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-м-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (575 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-(1,2,3,4-тетрагидроизохинолин-6-ил)-3-м-толилмочевины (381 мг), полученного в Примере (68b). Этот метиловый сложный эфир (575 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (499 мг, 89%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,69 (1H, с), 8,67 (1H, с), 7,32 (2H, д, J=9,0 Гц), 7,22 (2H, д, J=8,6 Гц), 7,15 (1H, дд, J=7,6 и 7,7 Гц), 7,08 (1H, д, J=8,6 Гц), 6,78 (1H, д, J=7,4 Гц), 4,51-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=6,1 Гц), 2,27 (3H, с), 2,11 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,78-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,11-1,02 (2H, м);
МС (ESI) m/z: 466 (M + H)+.
(Пример 69) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(69a) трет-бутиловый эфир 6-[3-(4-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,00 г, 77%) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и 4-трифторметилфенилизоцианата (0,51 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,56-7,42 (5H, м), 7,33-6,55 (4H, м), 4,52 (2H, с), 3,63 (2H, т, J=6,1 Гц), 2,78 (2H, ушир.с), 1,52 (9H, с).
(69b) гидрохлорид 1-(4-трифторметилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (851 мг, 99%) получают в виде желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(4-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,00 г), полученного в Примере (69a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,62 (1H, с), 9,30 (1H, с), 9,13 (1H, ушир.с), 7,68-7,62 (4H, м), 7,40 (1H, д, J=1,9 Гц), 7,32 (1H, дд, J=8,4 и 2,1 Гц), 7,15 (1H, д, J=8,6 Гц), 4,20 (2H, с), 3,37-3,34 (2H, м), 3,00-2,99 (2H, м).
(69c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-трифторметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (800 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (362 мг), полученного в Примере (1d), и гидрохлорида 1-(4-трифторметилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (558 мг), полученного в Примере (69b). Этот метиловый сложный эфир (800 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (651 мг, 84%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 9,28 (1H, с), 8,94 (1H, с), 7,68-7,62 (4H, м), 7,34 (1H, д, J=1,2 Гц), 7,25 (1H, дд, J=8,6 и 1,6 Гц), 7,11 (1H, д, J=8,6 Гц), 4,51-4,47 (3H, м), 3,57 (2H, т, J=6,1 Гц), 2,76 (2H, т, J=5,6 Гц), 2,11 (2H, д, J=6,6 Гц), 1,95-1,91 (2H, м), 1,78-1,74 (2H, м), 1,68-1,63 (1H, м), 1,39-1,29 (2H, м), 1,12-1,03 (2H, м);
МС (ESI) m/z: 520 (M + H)+.
(Пример 70) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(70a) трет-бутиловый эфир 6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,19 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и 3-этилфенилизоцианата (0,51 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,37 (1H, ушир.с), 7,23 (1H, д, J=7,8 Гц), 7,21 (1H, д, J=7,5 Гц), 7,14 (1H, д, J=8,6 Гц), 7,10-6,89 (3H, м), 6,95 (1H, д, J=7,4 Гц), 6,75 (1H, ушир.с), 4,50 (2H, с), 3,59 (2H, ушир.с), 2,74 (2H, ушир.с), 2,61 (2H, кв., J=7,8 Гц), 1,50 (9H, с), 1,21 (3H, т, J=7,4 Гц).
(70b) гидрохлорид 1-(3-этилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (977 мг, 98%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,19 г), полученного в Примере (70a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,06 (1H, ушир.с), 8,99 (1H, с), 8,92 (1H, с), 7,41 (1H, д, J=1,6 Гц), 7,33 (1H, с), 7,29-7,23 (2H, м), 7,18 (1H, дд, J=7,8 и 7,8 Гц), 7,13 (1H, д, J=8,6 Гц), 6,83 (1H, д, J=7,0 Гц), 4,20 (2H, с), 3,39-3,35 (2H, м), 2,98 (2H, т, J=6,2 Гц), 2,57 (2H, кв., J=7,5 Гц), 1,17 (3H, т, J=7,6 Гц).
(70c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (740 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (362 мг), полученного в Примере (1d), и гидрохлорида 1-(3-этилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (498 мг), полученного в Примере (70b). Этот метиловый сложный эфир (740 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (677 мг, 94%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,63 (2H, с), 7,33 (2H, с), 7,24-7,15 (3H, м), 7,08 (1H, д, J=8,6 Гц), 6,82 (1H, д, J=7,4 Гц), 4,52-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,8 Гц), 2,57 (2H, кв., J=7,7 Гц), 2,12 (2H, д, J=7,1 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,17 (3H, т, J=7,4 Гц), 1,12-1,02 (2H, м);
МС (ESI) m/z: 480 (M + H)+.
(Пример 71) 4-карбоксиметилциклогексиловый эфир транс-6-(3-п-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(71a) трет-бутиловый эфир 6-(3-п-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,14 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и п-толилизоцианта (0,45 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,36-7,25 (1H, м), 7,23 (2H, д, J=8,2 Гц), 7,15 (2H, д, J=8,6 Гц), 7,06-6,85 (2H, м), 6,73-6,56 (2H, м), 4,51 (2H, с), 3,61 (2H, ушир.с), 2,78 (2H, т, J=5,9 Гц), 2,33 (3H, с), 1,49 (9H, с).
(71b) гидрохлорид 1-(1,2,3,4-тетрагидроизохинолин-6-ил)-3-п-толилмочевины
Указанное в заголовке соединение (921 мг, 97%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-п-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,14 г), полученного в Примере (71a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,07 (1Н, ушир.с), 9,02 (1H, с), 8,92 (1H, с), 7,39 (1H, д, J=2,0 Гц), 7,34 (2H, д, J=8,6 Гц), 7,28 (1H, дд, J=8,5 и 2,2 Гц), 7,11 (1H, д, J=8,2 Гц), 7,08 (2H, д, J=8,6 Гц), 4,18 (2H, с), 3,37-3,31 (2H, м), 2,97 (2H, т, J=6,1 Гц), 2,24 (3H, с).
(71c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-п-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (719 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (362 мг), полученного в Примере (1d), и гидрохлорида 1-(1,2,3,4-тетрагидроизохинолин-6-ил)-3-п-толилмочевины (477 мг), полученного в Примере (71b). Этот метиловый сложный эфир (719 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (635 мг, 91%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,61 (1H, с), 8,60 (1H, с), 7,34-7,31 (3H, м), 7,22-7,20 (1H, м), 7,09-7,07 (3H, м), 4,48-4,46 (3H, м), 3,56 (2H, т, J=4,3 Гц), 2,75 (2H, т, J=5,5 Гц), 2,24 (3H, с), 2,11 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 466 (M + H)+.
(Пример 72) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(72a) трет-бутиловый эфир 6-[3-(4-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,23 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и 4-изопропилфенилизоцианата (0,58 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,37-6,75 (5H, м), 7,25 (2H, д, J=7,8 Гц), 7,16 (2H, д, J=8,6 Гц), 4,49 (2H, с), 3,57 (2H, ушир.с), 2,90-2,83 (1H, м), 2,72 (2H, т, J=5,7 Гц), 1,50 (9H, с), 1,22 (6H, д, J=7,0 Гц).
(72b) гидрохлорид 1-(4-изопропилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,04 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,23 г), полученного в Примере (72a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,11 (1H, ушир.с), 9,00 (1H, с), 8,91 (1H, с), 7,39 (1H, д, J=2,0 Гц), 7,36 (2H, д, J=8,6 Гц), 7,28 (1H, дд, J=8,4 и 2,1 Гц), 7,15 (2H, д, J=8,6 Гц), 7,12 (1H, д, J=8,6 Гц), 4,19 (2H, с), 3,38-3,34 (2H, м), 2,97 (2H, т, J=6,2 Гц), 2,86-2,79 (1H, м), 1,18 (6H, д, J=7,0 Гц).
(72c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-изопропилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (761 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (362 мг), полученного в Примере (1d), и гидрохлорида 1-(4-изопропилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (519 мг), полученного в Примере (72b). Этот метиловый сложный эфир (761 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (640 мг, 87%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,63 (1H, с), 8,62 (1H, с), 7,36 (2H, д, J=8,6 Гц), 7,33 (1H, м), 7,21 (1H, д, J=8,3 Гц), 7,14 (2H, д, J=8,6 Гц), 7,08 (1H, д, J=8,2 Гц), 4,48-4,46 (3H, м), 3,56 (2H, т, J=5,9 Гц), 2,86-2,79 (1H, м), 2,75 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,18 (6H, д, J=6,6 Гц), 1,12-1,02 (2H, м);
МС (ESI) m/z: 494 (M + H)+.
(Пример 73) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(73a) трет-бутиловый эфир 6-[3-(4-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (635 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (372 мг) и 4-трет-бутилфенилизоцианата (0,32 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,36 (2H, д, J=8,6 Гц), 7,27 (2H, д, J=8,2 Гц), 7,29-6,67 (5H, м), 4,51 (2H, с), 3,60 (2H, ушир.с), 2,77 (2H, т, J=5,9 Гц), 1,50 (9H, с), 1,31 (9H, с).
(73b) гидрохлорид 1-(4-трет-бутилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (539 мг, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(4-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (635 мг), полученного в Примере (73a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,13 (1H, ушир.с), 9,02 (1H, с), 8,93 (1H, с), 7,40 (1H, д, J=1,6 Гц), 7,37 (2H, д, J=8,6 Гц), 7,29 (2H, д, J=8,7 Гц), 7,28 (1H, дд, J=8,6 и 2,7 Гц), 7,12 (1H, д, J=8,6 Гц), 4,19 (2H, ушир.с), 3,39-3,36 (2H, м), 2,98 (2H, т, J=6,0 Гц), 1,26 (9H, с).
(73c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (782 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (361 мг), полученного в Примере (1d), и гидрохлорида 1-(4-трет-бутилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (539 мг), полученного в Примере (73b). Этот метиловый сложный эфир (782 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (653 мг, 86%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,74 (2H, ушир.с), 7,37 (2H, д, J=9,0 Гц), 7,32 (1H, д, J=1,9 Гц), 7,29 (2H, д, J=9,0 Гц), 7,22 (1H, дд, J=8,2 и 2,0 Гц), 7,07 (1H, д, J=8,6 Гц), 4,51-4,46 (3H, м), 3,56 (2H, т, J=6,1 Гц), 2,75 (2H, т, J=6,0 Гц), 2,11 (2H, д, J=7,1 Гц), 1,95-1,90 (2H, м), 1,77-1,74 (2H, м), 1,68-1,63 (1H, м), 1,39-1,29 (2H, м), 1,26 (9H, с), 1,12-1,02 (2H, м);
МС (ESI) m/z: 508 (M + H)+.
(Пример 74) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-цианофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(74a) трет-бутиловый эфир 6-[3-(3-цианофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (785 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (497 мг) и 3-цианофенилизоцианата (346 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,75-6,50 (6H, м), 7,65 (1H, д, J=8,6 Гц), 7,39 (1H, дд, J=7,8 и 7,8 Гц), 7,33 (1H, д, J=7,5 Гц), 4,51 (2H, с), 3,63 (2H, т, J=6,1 Гц), 2,79 (2H, ушир.с), 1,53 (9H, с).
(74b) гидрохлорид 1-(3-цианофенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (657 мг, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-цианофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (785 мг), полученного в Примере (74a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,55 (1H, с), 9,27 (1H, с), 9,12 (1H, ушир.с), 8,00 (1H, дд, J=1,9 и 2,0 Гц), 7,66-7,63 (1H, м), 7,50 (1H, дд, J=8,0 и 8,0 Гц), 7,44-7,40 (2H, м), 7,30 (1H, дд, J=8,2 и 2,3 Гц), 7,15 (1H, д, J=8,2 Гц), 4,20 (2H, ушир.с), 3,39-3,36 (2H, м), 2,98 (2H, т, J=6,3 Гц).
(74c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-цианофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (498 мг, 81%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (301 мг), полученного в Примере (1d), и гидрохлорида 1-(3-цианофенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (411 мг), полученного в Примере (74b). Этот метиловый сложный эфир (498 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (393 мг, 81%) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 9,07 (1H, с), 8,85 (1H, с), 7,99 (1H, с), 7,67 (1H, д, J=8,6 Гц), 7,49 (1H, дд, J=8,0 и 8,0 Гц), 7,42 (1H, д, J=7,1 Гц), 7,33 (1H, с), 7,24 (1H, д, J=7,1 Гц), 7,11 (1H, д, J=8,6 Гц), 4,51-4,47 (3H, м), 3,57 (2H, т, J=5,7 Гц), 2,76 (2H, т, J=5,3 Гц), 2,12 (2H, д, J=7,1 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,03 (2H, м);
МС (ESI) m/z: 477 (M + H)+.
(Пример 75) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-диметиламинофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(75a) трет-бутиловый эфир 6-[3-(3-диметиламинофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,23 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и гидрохлорида 3-диметиламиноанилина (627 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,33-7,15 (2H, м), 7,03-6,77 (4H, м), 6,61-6,50 (3H, м), 4,52 (2H, с), 3,62 (2H, ушир.с), 2,96 (6H, с), 2,79 (2H, т, J=5,9 Гц), 1,49 (9H, с).
(75b) гидрохлорид 1-(3-диметиламинофенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,15 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-диметиламинофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,23 г), полученного в Примере (75a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,38 (1Н, ушир.с), 9,18 (2H, ушир.с), 7,40 (1H, д, J=5,8 Гц), 7,29 (1H, д, J=8,2 Гц), 7,23-6,65 (4H, м), 7,13 (1H, д, J=8,3 Гц), 4,19 (2H, ушир.с), 3,37 (2H, ушир.с), 2,98 (8H, ушир.с).
(75c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-диметиламинофенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (207 мг, 41%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (223 мг), полученного в Примере (1d), и гидрохлорида 1-(3-диметиламинофенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (383 мг), полученного в Примере (75b). Этот метиловый сложный эфир (207 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (136 мг, 68%) в виде твердого вещества серого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,03 (1H, ушир.с), 8,89 (1H, с), 7,38 (1H, ушир.с), 7,32 (1H, с), 7,26 (1H, ушир.с), 7,23 (1H, дд, J=8,5 и 1,8 Гц), 7,09 (1H, д, J=8,6 Гц), 7,04 (1H, ушир.с), 6,82 (1H, ушир.с), 4,52-4,45 (3H, м), 3,57 (2H, т, J=6,0 Гц), 3,01 (6H, с), 2,75 (2H, т, J=5,9 Гц), 2,12 (2H, д, J=7,1 Гц), 1,95-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,61 (1H, м), 1,39-1,30 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 495 (M + H)+.
(Пример 76) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(76a) трет-бутиловый эфир 6-[3-(3-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,24 г, 98%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и 3-трет-бутиланилина (448 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,36 (1Н, дд, J=1,9 и 2,0 Гц), 7,30-6,88 (7H, м), 6,75 (1H, ушир.с), 4,52 (2H, с), 3,62 (2H, ушир.с), 2,79 (2H, т, J=5,9 Гц), 1,50 (9H, с), 1,31 (9H, с).
(76b) гидрохлорид 1-(3-трет-бутилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (1,06 г, количественный выход) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,24 г), полученного в Примере (76a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,02 (1H, ушир.с), 8,96 (1H, с), 8,93 (1H, с), 7,49 (1H, дд, J=2,0 и 2,0 Гц), 7,41 (1H, д, J=1,5 Гц), 7,29-7,25 (2H, м), 7,20 (1H, дд, J=7,8 и 7,8 Гц), 7,12 (1H, д, J=8,6 Гц), 7,01 (1H, д, J=7,8 Гц), 4,19 (2H, с), 3,38-3,32 (2H, м), 2,98 (2H, т, J=6,0 Гц), 1,27 (9H, с).
(76c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трет-бутилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (521 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (223 мг), полученного в Примере (1d), и гидрохлорида 1-(3-трет-бутилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (359 мг), полученного в Примере (76b). Этот метиловый сложный эфир (521 мг) гидролизуют водным раствором гидроксида натрия таким же способом, как в Примере 2, получая указанное в заголовке соединение (395 мг, 78%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 8,82 (1H, ушир.с), 8,77 (1H, ушир.с), 7,48 (1H, с), 7,34 (1H, с), 7,28 (1H, д, J=9,4 Гц), 7,24-7,17 (2H, м), 7,08 (1H, д, J=8,2 Гц), 7,00 (1H, д, J=7,8 Гц), 4,51-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,1 Гц), 1,94-1,90 (2H, м), 1,78-1,74 (2H, м), 1,68-1,63 (1H, м), 1,40-1,29 (2H, м), 1,40 (9H, с), 1,12-1,01 (2H, м);
МС (ESI) m/z: 508 (M + H)+.
(Пример 77) 4-карбоксиметилциклогексиловый эфир транс-6-(3-o-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
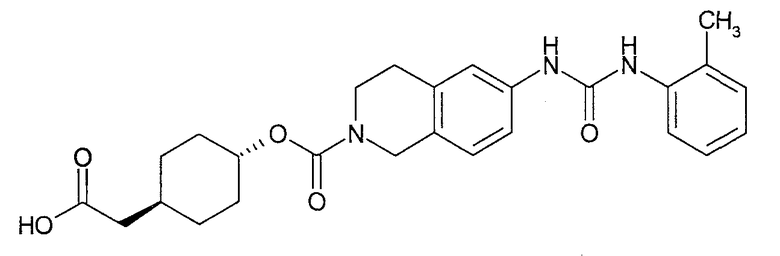
(77a) трет-бутиловый эфир 6-(3-o-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,13 г, 99%) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и о-толилизоцианата (0,45 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,52 (1Н, д, J=7,5 Гц), 7,30-7,15 (5H, м), 7,03 (1H, д, J=7,4 Гц), 6,47 (1H, ушир.с), 6,25 (1H, ушир.с), 4,52 (2H, с), 3,62 (2H, ушир.с), 2,79 (2H, т, J=5,9 Гц), 2,29 (3H, с), 1,49 (9H, с).
(77b) гидрохлорид 1-(1,2,3,4-тетрагидроизохинолин-6-ил)-3-o-толилмочевины
Указанное в заголовке соединение (938 мг, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-o-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,13 г), полученного в Примере (77a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,50 (1H, с), 9,12 (1H, ушир.с), 8,22 (1H, с), 7,84 (1H, д, J=7,8 Гц), 7,42 (1H, д, J=1,9 Гц), 7,30 (1H, дд, J=8,3 и 2,0 Гц), 7,18-7,12 (3H, м), 6,95 (1H, дд, J=7,2 и 7,2 Гц), 4,19 (2H, с), 3,38-3,31 (2H, м), 2,98 (2H, т, J=6,2 Гц), 2,26 (3H, с).
(77с) 4-карбоксиметилциклогексиловый эфир транс-6-(3-o-толилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (719 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (309 мг), полученного в Примере (1d), и гидрохлорида 1-(1,2,3,4-тетрагидроизохинолин-6-ил)-3-o-толилмочевины (476 мг), полученного в Примере (77b). Этот метиловый сложный эфир (719 мг) гидролизуют водным раствором гидроксида натрия таким же образом, как в Примере 2, получая указанное в заголовке соединение (638 мг, 91%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 9,03 (1H, с), 7,97 (1H, с), 7,83 (1H, д, J=7,8 Гц), 7,34 (1H, с), 7,23 (1H, д, J=7,5 Гц), 7,17 (1H, д, J=8,2 Гц), 7,13 (1H, д, J=7,8 Гц), 7,09 (1H, д, J=8,6 Гц), 6,94 (1H, дд, J=7,5 и 7,5 Гц), 4,51-4,46 (3H, м), 3,57 (2H, т, J=5,8 Гц), 2,76 (2H, т, J=5,7 Гц), 2,24 (3H, с), 2,11 (2H, д, J=6,6 Гц), 1,95-1,90 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,30 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 466 (M + H)+.
(Пример 78) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-диметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(78a) трет-бутиловый эфир 6-[3-(3,4-диметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,19 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и 3,4-диметилфенилизоцианата (0,50 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,33-6,74 (5H, м), 7,12 (1H, ушир.с), 7,08 (1H, дд, J=6,5 и 6,5 Гц), 6,84 (1H, ушир.с), 4,50 (2H, с), 3,59 (2H, ушир.с), 2,76 (2H, т, J=5,7 Гц), 2,22 (6H, с), 1,49 (9H, с).
(78b) гидрохлорид 1-(3,4-диметилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (993 мг, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(3,4-диметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,19 г), полученного в Примере (78a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,10 (1H, ушир.с), 9,03 (1H, с), 8,86 (1H, с), 7,40 (1H, д, J=1,9 Гц), 7,27 (1H, дд, J=8,4 и 2,1 Гц), 7,24 (1H, д, J=1,9 Гц), 7,17 (1H, дд, J=8,2 и 2,4 Гц), 7,11 (1H, д, J=8,6 Гц), 7,02 (1H, д, J=8,2 Гц), 4,19 (2H, с), 3,37-3,31 (2H, м), 2,97 (2H, т, J=6,2 Гц), 2,18 (3H, с), 2,15 (3H, с).
(78c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-диметилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (740 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (309 мг), полученного в Примере (1d), и гидрохлорида 1-(3,4-диметилфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (498 мг), полученного в Примере (78b). Этот метиловый сложный эфир (740 мг) гидролизуют водным раствором гидроксида натрия таким же способом, как в Примере 2, получая указанное в заголовке соединение (619 мг, 86%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, ушир.с), 8,64 (1H, с), 8,55 (1H, с), 7,33 (1H, с), 7,24 (1H, д, J=1,6 Гц), 7,21 (1H, д, J=8,6 Гц), 7,15 (1H, дд, J=8,4 и 2,2 Гц), 7,07 (1H, д, J=8,6 Гц), 7,02 (1H, д, J=8,2 Гц), 4,52-4,46 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,5 Гц), 2,18 (3H, с), 2,15 (3H, с), 2,11 (2H, д, J=6,6 Гц), 1,95-1,91 (2H, м), 1,78-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 480 (M + H)+.
(Пример 79) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(79a) трет-бутиловый эфир 6-[3-(4-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (747 мг, 94%) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (497 мг) и 4-метоксифенилизоцианата (0,31 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,29-7,15 (2H, м), 7,25 (2H, д, J=8,6 Гц), 7,00 (1H, д, J=6,7 Гц), 6,89 (2H, д, J=8,6 Гц), 6,62 (1H, ушир.с), 6,55 (1H, ушир.с), 4,51 (2H, с), 3,81 (3H, с), 3,61 (2H, ушир.с), 2,77 (2H, т, J=5,8 Гц), 1,49 (9H, с).
(79b) гидрохлорид 1-(4-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (621 мг, 99%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(4-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (747 мг), полученного в Примере (79a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,15 (1Н, ушир.с), 9,02 (1H, с), 8,87 (1H, с), 7,36-7,31 (1H, м), 7,33 (2H, д, J=9,0 Гц), 7,26 (1H, дд, J=8,4 и 2,1 Гц), 7,09 (1H, д, J=8,6 Гц), 6,85 (2H, д, J=9,0 Гц), 4,16 (2H, с), 3,69 (3H, с), 3,35-3,31 (2H, м), 2,95 (2H, т, J=6,2 Гц).
(79c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (407 мг, 82%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (206 мг), полученного в Примере (1d), и гидрохлорида 1-(4-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (333 мг), полученного в Примере (79b). Этот метиловый сложный эфир (407 мг) гидролизуют водным раствором гидроксида натрия таким же способом, как в Примере 2, получая указанное в заголовке соединение (378 мг, 96%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,57 (1H, с), 8,51 (1H, с), 7,35 (2H, д, J=9,0 Гц), 7,31 (1H, с), 7,21 (1H, д, J=8,6 Гц), 7,07 (1H, д, J=8,2 Гц), 6,87 (2H, д, J=9,0 Гц), 4,52-4,46 (3H, м), 3,72 (3H, с), 3,56 (2H, т, J=5,8 Гц), 2,74 (2H, т, J=5,9 Гц), 2,12 (2H, д, J=7,0 Гц), 1,95-1,91 (2H, м), 1,77-1,73 (2H, м), 1,69-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 482 (M + H)+.
(Пример 80) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
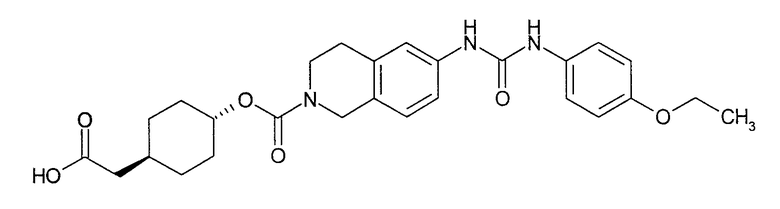
(80a) трет-бутиловый эфир 6-[3-(4-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (798 мг, 97%) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (497 мг) и 4-этоксифенилизоцианата (0,35 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,28-7,15 (2H, м), 7,24 (2H, д, J=8,6 Гц), 7,02 (1H, д, J=7,8 Гц), 6,89 (2H, д, J=8,6 Гц), 6,47 (1H, ушир.с), 6,37 (1H, ушир.с), 4,52 (2H, с), 4,03 (2H, кв., J=6,9 Гц), 3,61 (2H, т, J=5,5 Гц), 2,79 (2H, т, J=6,0 Гц), 1,49 (9H, с), 1,42 (3H, т, J=7,1 Гц).
(80b) гидрохлорид 1-(4-этоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (674 мг, количественный выход) получают в виде беловатого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(4-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (798 мг), полученного в Примере (80a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,17 (1H, ушир.с), 9,04 (1H, с), 8,89 (1H, с), 7,35 (1H, д, J=1,9 Гц), 7,32 (2H, д, J=9,0 Гц), 7,26 (1H, дд, J=8,2 и 1,9 Гц), 7,09 (1H, д, J=8,2 Гц), 6,83 (2H, д, J=9,0 Гц), 4,16 (2H, т, J=4,1 Гц), 3,95 (2H, кв., J=7,0 Гц), 3,41-3,31 (2H, м), 2,95 (2H, т, J=6,1 Гц), 1,28 (3H, т, J=6,8 Гц).
(80c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(4-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (488 мг, 96%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (206 мг), полученного в Примере (1d), и гидрохлорида 1-(4-этоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (347 мг), полученного в Примере (80b). Этот метиловый сложный эфир (488 мг) гидролизуют водным раствором гидроксида натрия таким же способом, как в Примере 2, получая указанное в заголовке соединение (410 мг, 87%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 8,59 (1H, с), 8,51 (1H, с), 7,36-7,30 (1H, м), 7,34 (2H, д, J=8,9 Гц), 7,21 (1H, дд, J=7,6 и 1,8 Гц), 7,07 (1H, д, J=8,6 Гц), 6,85 (2H, д, J=9,0 Гц), 4,51-4,45 (3H, м), 3,97 (2H, кв., J=7,0 Гц), 3,56 (2H, т, J=5,9 Гц), 2,74 (2H, т, J=5,6 Гц), 2,11 (2H, д, J=6,6 Гц), 1,94-1,91 (2H, м), 1,77-1,73 (2Н, м), 1,68-1,62 (1H, м), 1,39-1,31 (2H, м), 1,30 (3H, т, J=6,9 Гц), 1,12-1,01 (2H, м);
MS (ESI) m/z: 496 (M + H)+.
(Пример 81) 4-карбоксиметилциклогексиловый эфир транс-6-(3-изопропилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(81a) трет-бутиловый эфир 6-(3-изопропилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (604 мг, 91%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (496 мг) и изопропиламина (0,17 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,22-6,96 (4H, м), 6,08 (1H, с), 4,53 (2H, с), 4,04-3,95 (1H, м), 3,63 (2H, ушир.с), 2,80 (2H, т, J=6,1 Гц), 1,49 (9H, с), 1,18 (6H, д, J=6,6 Гц).
(81b) гидрохлорид 1-изопропил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (488 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-изопропилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (604 мг), полученного в Примере (81a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,27 (1H, ушир.с), 8,66 (1H, с), 7,32 (1H, д, J=2,0 Гц), 7,20 (1H, дд, J=8,4 и 2,1 Гц), 7,05 (1H, д, J=8,6 Гц), 4,77 (1H, ушир.с), 4,15 (2H, т, J=4,3 Гц), 3,76-3,70 (1H, м), 3,35-3,30 (2H, м), 2,93 (2H, т, J=6,2 Гц), 1,08 (6H, д, J=6,7 Гц).
(81c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-изопропилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (455 мг, 88%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (289 мг), полученного в Примере (1d), и гидрохлорида 1-изопропил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (324 мг), полученного в Примере (81b). Этот метиловый сложный эфир (455 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (383 мг, 87%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 8,23 (1H, с), 7,24 (1H, с), 7,13 (1H, д, J=7,8 Гц), 7,01 (1H, д, J=8,6 Гц), 5,99 (1H, д, J=7,5 Гц), 4,50-4,43 (3H, м), 3,76-3,71 (1H, м), 3,55 (2H, т, J=6,0 Гц), 2,71 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=6,6 Гц), 1,94-1,90 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,38-1,29 (2H, м), 1,11-1,01 (2H, м), 1,08 (6H, д, J=6,7 Гц);
МС (ESI) m/z: 418 (M + H)+.
(Пример 82) 4-карбоксиметилциклогексиловый эфир транс-6-(3-трет-бутилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(82a) трет-бутиловый эфир 6-(3-трет-бутилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (434 мг, 63%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (496 мг) и трет-бутиламина (0,21 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,22-6,89 (4H, м), 6,03 (1H, с), 4,51 (2H, с), 3,62 (2H, ушир.с), 2,80 (2H, т, J=5,8 Гц), 1,49 (9H, с), 1,37 (9H, с).
(82b) гидрохлорид 1-трет-бутил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (354 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из 6-(3-трет-бутилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (434 мг), полученного в Примере (82a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,13 (1H, ушир.с), 8,50 (1H, с), 7,34 (1H, д, J=1,9 Гц), 7,13 (1H, дд, J=8,4 и 2,1 Гц), 7,04 (1H, д, J=8,6 Гц), 6,17 (1H, ушир.с), 4,15 (2H, ушир.с), 3,36-3,31 (2H, м), 2,94 (2H, т, J=6,2 Гц), 1,28 (9H, с).
(82c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-трет-бутилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (557 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (301 мг), полученного в Примере (1d), и гидрохлорида 1-трет-бутил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (354 мг), полученного в Примере (82b). Этот метиловый сложный эфир (557 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (451 мг, 84%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, ушир.с), 8,18 (1H, с), 7,26-7,07 (1Н, м), 6,99 (2H, с), 5,97 (1H, с), 4,50-4,42 (3H, м), 3,54 (2H, т, J=5,9 Гц), 2,71 (2H, т, J=6,1 Гц), 2,11 (2H, д, J=6,6 Гц), 1,94-1,91 (2H, м), 1,77-1,73 (2H, м), 1,68-1,61 (1H, м), 1,38-1,24 (2H, м), 1,28 (9H, с), 1,11-1,01 (2H, м);
МС (ESI) m/z: 432 (M + H)+.
(Пример 83) 4-карбоксиметилциклогексиловый эфир транс-6-(3-циклопентилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
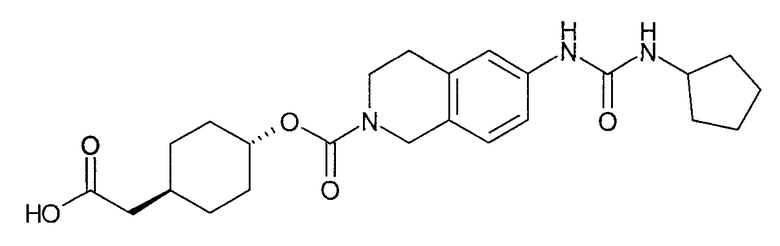
(83a) трет-бутиловый эфир 6-(3-циклопентилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (601 мг, 84%) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (496 мг) и аминоциклопентана (0,20 мл).
1H ЯМР (400 МГц, CDCl): δ (м.д.) = 7,22-6,95 (4H, м), 6,17 (1H, с), 4,52 (2H, с), 4,14-4,08 (1H, м), 3,62 (2H, ушир.с), 2,80 (2H, т, J=5,7 Гц), 2,02-1,97 (2H, м), 1,69-1,56 (4H, м), 1,49 (9H, с), 1,44-1,35 (2H, м).
(83b) гидрохлорид 1-циклопентил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (493 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-циклопентилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (600 мг), полученного в Примере (83a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,14 (1Н, ушир.с), 8,53 (1H, с), 7,32 (1H, д, J=2,0 Гц), 7,19 (1H, дд, J=8,4 и 2,1 Гц), 7,05 (1H, д, J=8,6 Гц), 6,36 (1H, ушир.с), 4,21-3,99 (1H, м), 3,91 (2H, т, J=7,2 Гц), 3,36-3,31 (2H, м), 2,93 (2H, т, J=6,2 Гц), 1,86-1,78 (2H, м), 1,66-1,61 (2H, м), 1,55-1,51 (2H, м), 1,39-1,31 (2H, м).
(83c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-циклопентилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (553 мг, 97%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (301 мг), полученного в Примере (1d), и гидрохлорида 1-циклопентил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (369 мг), полученного в Примере (83b). Этот метиловый сложный эфир (553 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (448 мг, 84%) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, ушир.с), 8,20 (1H, с), 7,24 (1H, с), 7,13 (1H, д, J=8,6 Гц), 7,01 (1H, д, J=8,3 Гц), 6,14 (1H, д, J=7,4 Гц), 4,50-4,43 (3H, м), 3,94-3,89 (1H, м), 3,54 (2H, т, J=5,9 Гц), 2,71 (2H, т, J=5,8 Гц), 2,11 (2H, д, J=7,0 Гц), 1,93-1,90 (2H, м), 1,84-1,80 (2H, м), 1,76-1,73 (2H, м), 1,66-1,61 (3H, м), 1,56-1,51 (2H, м), 1,38-1,32 (4H, м), 1,11-1,01 (2H, м);
МС (ESI) m/z: 444 (M + H)+.
(Пример 84) 4-карбоксиметилциклогексиловый эфир транс-6-(3-циклогексилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(84a) трет-бутиловый эфир 6-(3-циклогексилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (1,14 г, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (26a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (745 мг) и циклогексилизоцианата (0,46 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,33-6,96 (4H, м), 6,11 (1H, с), 4,53 (2H, с), 3,63 (2H, ушир.с), 2,80 (2H, т, J=5,7 Гц), 1,99-1,95 (2H, м), 1,72-1,10 (9H, м), 1,49 (9H, с).
(84b) гидрохлорид 1-циклогексил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (929 мг, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-циклогексилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (1,12 г), полученного в Примере (84a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,26 (1H, ушир.с), 8,69 (1H, с), 7,30 (1H, д, J=1,9 Гц), 7,20 (1H, дд, J=8,4 и 2,1 Гц), 7,05 (1H, д, J=8,6 Гц), 5,12 (1H, ушир.с), 4,14 (2H, с), 3,47-3,42 (2H, м), 3,35-3,30 (2H, м), 2,93 (2H, т, J=6,2 Гц), 1,79-1,76 (2H, м), 1,69-1,64 (2H, м), 1,54-1,51 (1H, м), 1,34-1,25 (2H, м), 1,22-1,11 (2H, м).
(84c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-циклогексилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (656 мг, 93%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (309 мг), полученного в Примере (1d), и гидрохлорида 1-циклогексил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (464 мг), полученного в Примере (84b). Этот метиловый сложный эфир (656 мг) гидролизуют водным раствором гидроксида натрия таким же способом, как в Примере 2, получая указанное в заголовке соединение (553 мг, 87%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,27 (1H, с), 7,23 (1H, с), 7,13 (1H, д, J=8,6 Гц), 7,01 (1H, д, J=8,6 Гц), 6,08 (1H, д, J=8,3 Гц), 4,50-4,43 (3H, м), 3,54 (2H, т, J=5,9 Гц), 3,45-3,40 (1H, м), 2,70 (2H, т, J=5,9 Гц), 2,10 (2H, д, J=7,0 Гц), 1,93-1,90 (2H, м), 1,80-1,73 (4H, м), 1,66-1,63 (3H, м), 1,56-1,51 (1H, м), 1,38-1,25 (4H, м), 1,21,-1,01 (5Н, м);
МС (ESI) m/z: 458 (M + H)+.
(Пример 85) 4-карбоксиметилциклогексиловый эфир транс-6-(3-циклогексилметилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(85a) трет-бутиловый эфир 6-(3-циклогексилметилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (774 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (28a), из 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (496 мг) и циклогексилметиламина (0,26 мл).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,22-6,97 (4H, м), 6,30 (1H, ушир.с), 4,82 (1H, ушир.с), 4,53 (2H, с), 3,63 (2H, ушир.с), 3,09 (2H, д, J=6,7 Гц), 2,80 (2H, т, J=5,7 Гц), 1,74-1,47 (4H, м), 1,49 (9H, с), 1,28-1,16 (4H, м), 0,96-0,91 (2H, м).
(85b) гидрохлорид 1-циклогексилметил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (540 мг, 83%) получают в виде розового твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-циклогексиметилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (774 мг), полученного в Примере (85a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,15 (1H, ушир.с), 8,68 (1H, с), 7,32 (1H, д, J=1,9 Гц), 7,20 (1H, дд, J=8,2 и 2,3 Гц), 7,05 (1H, д, J=8,6 Гц), 6,36 (1H, ушир.с), 4,15-4,40 (1H, м), 4,12 (2H, с), 3,36-3,31 (2H, м), 2,92 (2H, д, J=6,7 Гц), 1,69-1,61 (5H, м), 1,39-1,33 (1H, м), 1,23-1,10 (4H, м), 0,93-0,84 (2H, м).
(85c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-циклогексилметилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (679 мг, 84%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (344 мг), полученного в Примере (1d), и гидрохлорида 1-циклогексилметил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (539 мг), полученного в Примере (85b). Этот метиловый сложный эфир (679 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (634 мг, 96%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,32 (1H, с), 7,24 (1H, с), 7,14 (1H, д, J=8,3 Гц), 7,01 (1H, д, J=8,2 Гц), 6,16 (1H, дд, J=5,6 и 5,6 Гц), 4,51-4,43 (3H, м), 3,54 (2H, т, J=5,9 Гц), 2,92 (2H, т, J=6,2 Гц), 2,71 (2H, т, J=6,0 Гц), 2,11 (2H, д, J=7,1 Гц), 1,94-1,90 (2H, м), 1,77-1,61 (9H, м), 1,39-1,29 (3H, м), 1,24-1,01 (4H, м), 0,93-0,84 (2H, м);
МС (ESI) m/z: 472 (M + H)+.
(Пример 86) 4-карбоксиметилциклогексиловый эфир транс-6-(3-адамантан-1-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(86a) трет-бутиловый эфир 6-(3-адамантан-1-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (780 мг, 92%) получают в виде белого твердого вещества таким же способом, как в Примере (24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (827 мг), полученного в Примере (24a), и 1-аминоадамантана (303 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,25-6,90 (4H, м), 6,08 (1H, ушир.с), 4,51 (2H, с), 3,61 (2H, ушир.с), 2,79 (2H, т, J=5,6 Гц), 2,09 (2H, ушир.с), 2,00 (4H, ушир.с), 1,68 (5H, ушир.с), 1,58 (2H, ушир.с), 1,49 (2H, с).
(86b) гидрохлорид 1-адамантан-1-ил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (663 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-адамантан-1-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (780 мг), полученного в Примере (86a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,14 (1H, ушир.с), 8,52 (1H, с), 7,34 (1H, д, J=1,9 Гц), 7,11 (1H, дд, J=8,6 и 2,0 Гц), 7,04 (1H, д, J=8,6 Гц), 6,07 (1H, ушир.с), 4,15 (2H, с), 4,07 (4H, ушир.с), 3,35-3,31 (2H, м), 2,93 (2H, т, J=6,2 Гц), 2,02 (2H, ушир.с), 1,92 (3H, ушир.с), 1,92 (6H, ушир.с).
(86c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-адамантан-1-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (895 мг, 93%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (378 мг), полученного в Примере (1d), и гидрохлорида 1-адамантан-1-ил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (663 мг), полученного в Примере (86b). Этот метиловый сложный эфир (895 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (841 мг, 97%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, ушир.с), 8,20 (1H, с), 7,26 (1H, с), 7,05 (1H, д, J=8,6 Гц), 7,00 (1H, д, J=8,6 Гц), 5,86 (1H, с), 4,50-4,42 (3H, м), 3,54 (2H, т, J=5,9 Гц), 2,70 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=6,6 Гц), 2,02 (3H, ушир.с), 1,92 (8H, ушир.с), 1,77-1,73 (2H, м), 1,63 (7H, ушир.с), 1,38-1,28 (2H, м), 1,11-1,01 (2H, м);
МС (ESI) m/z: 510 (M + H)+.
(Пример 87) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиридин-3-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(87a) трет-бутиловый эфир 6-(3-пиридин-3-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (448 мг, количественный выход) получают в виде бледно-желтого твердого вещества таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (500 мг), полученного в Примере (24a), и 3-аминопиридина (150 мг).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 1,43 (9H, с), 2,74 (2H, т, J=5,67 Гц), 3,53 (2H, т, J=5,87 Гц), 4,43 (2H, ушир.с), 7,08 (1H, д, J=8,21 Гц), 7,22 (1H, д, J=7,43 Гц), 7,31 (2H, т, J=3,71 Гц), 7,93 (1H, ддд, J=8,41, 2,54, 1,56 Гц), 8,18 (1H, дд, J=4,69, 1,17 Гц), 8,59 (1H, д, J=1,95 Гц), 8,74 (1H, ушир.с), 8,82 (1H, ушир.с).
(87b) 4-метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиридин-3-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Амин получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-пиридин-3-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (450 мг), полученного в Примере (87a). Из этого амина (250 мг) и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (200 мг), полученного в Примере (1d), получают указанное в заголовке соединение (277 мг, 73%) в виде белого твердого вещества таким же способом, как в Примере (1e).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 1,02-1,14 (1H, м), 1,27-1,41 (1H, м), 1,71 (3H, ушир.с), 1,92 (2H, д, J=10,56 Гц), 2,22 (2H, д, J=6,65 Гц), 2,75 (2H, т, J=5,67 Гц), 3,50-3,60 (5H, м), 4,41-4,53 (3H, м), 7,09 (1H, д, J=8,21 Гц), 7,23 (1H, д, J=8,21 Гц), 7,32 (1H, д, J=4,30 Гц), 7,30 (1H, д, J=4,69 Гц), 7,89-7,99 (1H, м), 8,18 (1H, дд, J=4,69, 1,17 Гц), 8,59 (1H, д, J=2,35 Гц), 8,75 (1H, с), 8,82 (1H, с);
МС (FAB) m/z: 467 (M + H)+.
(87c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиридин-3-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиридин-3-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (280 мг), полученный в Примере (87b), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (186 мг, 67%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 1,00-1,14 (2H, м), 1,28-1,41 (2H, м), 1,59-1,70 (1H, м), 1,75 (2H, д, J=11,73 Гц), 1,88-1,97 (2H, м), 2,12 (2H, д, J=7,04 Гц), 2,75 (2H, т, J=5,47 Гц), 3,57 (2H, т, J=6,06 Гц), 4,42-4,53 (3H, м), 7,10 (1H, д, J=8,21 Гц), 7,23 (1H, д, J=7,82 Гц), 7,29-7,36 (2H, м), 7,91-7,98 (1H, м), 8,18 (1H, дд, J=4,69, 1,56 Гц), 8,60 (1H, д, J=2,74 Гц), 8,77 (1H, с), 8,85 (1H, с), 12,06 (1H, ушир.с);
МС (FAB) m/z: 453 (M + H)+.
(Пример 88) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиридин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(88a) трет-бутиловый эфир 6-(3-пиридин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соеднение (395 мг, 89%) получают в виде бледно-желтого твердого вещества таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (500 мг), полученного в Примере (24a), и 2-аминопиридина (150 мг).
1H ЯМР (ДМСО-d6, 400 МГц): δ (м.д.) = 10,55 (1H, ушир.с), 9,46 (1H, с), 8,28 (1H, дд, J=5,08, 1,96 Гц), 7,72-7,77 (1H, м), 7,45 (1H, д, J=8,21 Гц), 7,37 (1H, с), 7,32 (1H, д, J=7,43 Гц), 7,10 (1H, д, J=8,21 Гц), 7,01 (1H, дд, J=6,84, 5,67 Гц), 4,44 (2H, ушир.с), 3,54 (2H, т, J=5,87 Гц), 2,76 (2H, т, J=5,67 Гц), 1,43 (9H, с);
МС (FAB) m/z: 369 (M + H)+.
(88b) 4-метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиридин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Амин (408 мг, количественный выход) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-пиридин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (400 мг), полученного в Примере (88a). Из этого амина (280 мг) и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (200 мг), полученного в Примере (1d), получают указанное в заголовке соединение (168 мг, 39%) в виде белого твердого вещества таким же способом, как в Примере (1e).
1H ЯМР (ДМСО-d6, 400 МГц): δ (м.д.) = 10,54 (1H, ушир.с), 9,46 (1H, с), 8,24-8,32 (1H, м), 7,74 (1H, ддд, J=8,50, 7,14, 1,96 Гц), 7,45 (1H, д, J=8,21 Гц), 7,32 (1H, д, J=7,43 Гц), 7,38 (1H, д, J=1,17 Гц), 7,12 (1H, д, J=8,21 Гц), 7,01 (1H, ддд, J=7,23, 5,08, 0,98 Гц), 4,34-4,53 (3H, м), 3,40-3,60 (5H, м), 2,77 (2H, т, J=5,67 Гц), 2,22 (2H, д, J=7,04 Гц), 1,93 (2H, дд, J=11,93, 3,32 Гц), 1,62-1,81 (3H, м), 1,28-1,42 (2H, м), 1,01-1,15 (2H, м);
МС (FAB) m/z: 467 (M + H)+.
(88c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиридин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиридин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (170 мг), полученный в Примере (88b), гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (121 мг, 74%) в виде белого твердого вещества.
1H ЯМР (ДМСО-d6, 500 МГц): δ (м.д.) = 10,47 (1H, ушир.с), 9,67 (1H, ушир.с), 8,29 (1H, дд, J=4,88, 1,46 Гц), 7,74-7,85 (1H, м), 7,47 (1H, д, J=8,30 Гц), 7,37 (1H, д, J=1,95 Гц), 7,32 (1H, д, J=8,30 Гц), 7,13 (1H, д, J=8,30 Гц), 7,03-7,08 (1H, м), 4,40-4,54 (3H, м), 3,57 (2H, т, J=5,86 Гц), 3,12-3,22 (1H, м), 2,77 (1H, т, J=5,86 Гц), 2,12 (2H, д, J=6,84 Гц), 1,93 (2H, дд, J=11,23, 2,93 Гц), 1,75 (1H, д, J=13,18 Гц), 1,26-1,40 (2H, м), 0,99-1,14 (2H, м);
МС (FAB) m/z: 453 (M + H)+.
(Пример 89) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиридин-4-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(89a) трет-бутиловый эфир 6-(3-пиридин-4-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (380 мг, 85%) получают в виде бледно-желтого твердого вещества таким же способом, как Примере (24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (500 мг), полученного в Примере (24a), и 4-аминопиридина (150 мг).
1H ЯМР (ДМСО-d6, 500 МГц): δ (м.д.) = 9,07 (1H, с), 8,79 (1H, с), 8,35 (2H, дд, J=4,88, 1,47 Гц), 7,42 (2H, дд, J=4,64, 1,71 Гц), 7,31 (1H, ушир.с), 7,23 (1H, д, J=7,32 Гц), 7,09 (1H, д, J=8,79 Гц), 4,43 (2H, ушир.с), 3,53 (2H, т, J=5,86 Гц), 2,75 (2H, т, J=5,86 Гц), 1,43 (9H, с);
МС (FAB) m/z: 369 (M + H)+.
(89b) 4-метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиридин-4-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Амин (324 мг) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(3-пиридин-4-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (380 мг), полученного в Примере (89a). Из этого амина (324 мг) и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (180 мг), полученного в Примере (1d), получают указанное в заголовке соединение (346 мг, 72%, две стадии) таким же способом, как в Примере (1e).
1H ЯМР (ДМСО-d6, 400 МГц): δ (м.д.) = 9,08 (1H, с), 8,80 (1H, с), 8,35 (2H, дд, J=4,89, 1,37 Гц), 7,42 (2H, дд, J=4,69, 1,56 Гц), 7,31 (1H, с), 7,23 (1H, д, J=7,82 Гц), 7,10 (1H, д, J=8,21 Гц), 4,41-4,53 (3H, м), 3,34 (1H, с), 3,31 (4H, с), 2,76 (2H, т, J=5,87 Гц), 2,22 (2H, д, J=6,65 Гц), 1,92 (2H, д, J=11,73 Гц), 1,64-1,76 (3H, м), 1,28-1,42 (2H, м), 1,03-1,14 (2H, м);
МС (FAB) m/z: 467 (M + H)+.
(89c) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиридин-4-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиридин-4-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (346 мг), полученный в Примере (89b), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (323 мг, 96%) в виде белого твердого вещества.
1H ЯМР (ДМСО-d6, 500 МГц): δ (м.д.) = 9,83 (1H, ушир.с), 9,14 (1H, ушир.с), 8,47 (2H, д, J=6,35 Гц), 7,66 (2H, д, J=6,35 Гц), 7,32 (1H, с), 7,26 (1H, дд, J=8,30, 1,47 Гц), 7,13 (1H, д, J=8,30 Гц), 4,43-4,52 (3H, м), 3,57 (2H, т, J=5,86 Гц), 2,77 (2H, т, J=5,86 Гц), 2,12 (2H, д, J=6,84 Гц), 1,92 (2H, дд, J=11,96, 2,69 Гц), 1,75 (2H, д, J=12,70 Гц), 1,28-1,40 (2H, м), 1,01-1,12 (2H, м);
МС (FAB) m/z: 453 (M + H)+.
(Пример 90) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-метилпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(90a) трет-бутиловый эфир 6-[3-(5-метилпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (446 мг, 96%) получают таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (500 мг), полученного в Примере (24a), и 5-метилпиридин-3-иламина (130 мг).
1H ЯМР (ДМСО-d6, 400 МГц): δ (м.д.) = 8,75 (1H, с), 8,73 (1H, с), 8,38 (1H, д, J=2,35 Гц), 8,03 (1H, д, J=1,17 Гц), 7,79 (1H, с), 7,33 (1H, д, J=1,17 Гц), 7,21 (1H, д, J=7,04 Гц), 7,07 (1H, д, J=8,60 Гц), 4,43 (2H, ушир.с), 3,53 (2H, т, J=5,87 Гц), 2,74 (2H, т, J=5,87 Гц), 2,27 (3H, с), 1,43 (9H, с);
МС (FAB) m/z: 383 (M + H)+.
(90b) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(5-метилпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Амин (386 мг, 93%) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-метилпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинлин-2-карбоновой кислоты (450 мг), полученного в Примере (90a). Из этого амина (420 мг) и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (200 мг), полученного в Примере (1d), получают указанное в заголовке соединение (406 мг, 72%) в виде белого твердого вещества таким же способом, как в Примере (1e).
1H ЯМР (ДМСО-d6, 500 МГц): δ (м.д.) = 8,74 (1H, с), 8,72 (1H, с), 8,38 (1H, д, J=1,95 Гц), 8,03 (1H, с), 7,79 (1H, с), 7,33 (1H, ушир.с), 7,21 (1H, д, J=7,32 Гц), 7,09 (1H, д, J=8,30 Гц), 4,43-4,51 (3H, м), 3,58 (3H, с), 3,56 (2H, т, J=5,86 Гц), 2,75 (2H, т, J=5,62 Гц), 2,27 (3H, с), 2,22 (2H, д, J=6,84 Гц), 1,92 (2H, д, J=11,23 Гц), 1,62-1,77 (3H, м), 1,30-1,39 (2H, м), 1,08 (2H, кв., J=12,70 Гц);
МС (FAB) m/z: 481 (M + H)+.
(90c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-метилпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-[3-(5-метилпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (410 мг), полученный в Примере (90b), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (342 мг, 87%) в виде белого твердого вещества.
1H ЯМР (ДМСО-d6, 400 МГц): δ (м.д.) = 9,04 (1H, с), 8,90 (1H, с), 8,55 (1H, с), 8,14 (1H, с), 7,90 (1H, с), 7,33 (1H, с), 7,23 (1H, д, J=8,21 Гц), 7,07-7,14 (1H, м), 4,42-4,54 (3H, м), 3,57 (2H, т, J=5,87 Гц), 2,75 (2H, т, J=5,87 Гц), 2,33 (3H, с), 2,12 (2H, д, J=6,65 Гц), 1,92 (2H, д, J=10,95 Гц), 1,75 (2H, д, J=12,90 Гц), 1,34 (2H, кв., J=12,64 Гц), 1,00-1,13 (2H, м);
МС (FAB) m/z: 467 (M + H)+.
(Пример 91) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(91a) трет-бутиловый эфир 6-[3-(5-хлорпиридин-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (350 мг, 90%) получают таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (400 мг), полученного в Примере (24a), и 2-амино-5-хлорпиридина (124 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 11,17 (1H, с), 8,22 (1H, д, J=2,7 Гц), 8,13 (1H, д, J=9,0 Гц), 7,59 (1H, дд, J=8,6, 2,7 Гц), 7,36 (1H, дд, J=8,8, 2,5 Гц), 7,04 (1H, д, J=8,6 Гц), 6,88 (1H, д, J=9,0 Гц), 6,74 (1H, д, J=9,0 Гц), 4,51 (2H, с), 3,65-3,56 (2H, м), 2,84-2,74 (2H, м), 1,46 (9H, с).
(91b) гидрохлорид 1-(5-хлорпиридин-2-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (325 мг, количественный выход) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-хлорпиридин-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (350 мг), полученного в Примере (91a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,20-9,08 (1H, м), 8,46 (1H, д, J=2,7 Гц), 7,95-7,92 (1H, м), 7,44-7,22 (3H, м), 7,13-6,99 (2H, м), 4,17 (1H, с), 3,37-3,29 (2H, м), 2,98-2,90 (2H, м).
(91c) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (336 мг, 70%) получают в виде белого твердого вещества таким же способом, как в Примере (1e), из гидрохлорида 1-(5-хлорпиридин-2-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (325 мг), полученного в Примере (91b), и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (231 мг), полученного в Примере (1d).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 8,59 (1H, с), 8,22 (1H, д, J=2,7 Гц), 7,99 (1H, д, J=2,3 Гц), 7,62-7,58 (1H, м), 7,41-7,27 (1H, м), 7,11-6,97 (1H, м), 6,90-6,84 (1H, м), 6,44 (1H, д, J=8,6 Гц), 4,64-4,45 (3H, м), 3,65 (3H, с), 3,60-3,46 (2H, м), 2,87-2,74 (2H, м), 2,20-2,16 (2H, м), 2,06-1,91 (2H, м), 1,82-1,67 (3H, м), 1,52-1,23 (2H, м), 1,15-0,98 (2H, м).
(91d) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (371 мг), полученный в Примере (91c), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (38 мг, 10%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,08 (1H, с), 9,84 (1H, с), 9,52 (1H, с), 8,35 (1H, с), 7,92-7,87 (1H, м), 7,74-7,69 (1H, м), 7,37 (1H, с), 7,35-7,29 (1H, м), 7,18-7,13 (1H, м), 4,51 (3H, с), 3,63-3,58 (2H, м), 2,83-2,77 (2H, м), 2,15 (2H, д, J=6,8 Гц), 1,96 (2H, д, J=10,7 Гц), 1,78 (2H, д, J=12,2 Гц), 1,73-1,63 (1H, м), 1,37 (2H, кв., J=12,2 Гц), 1,10 (2H, кв., J=11,9 Гц).
МС (FAB) m/z: 509 (M + Na)+.
(Пример 92) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(6-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(92a) трет-бутиловый эфир 6-[3-(6-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (430 мг, количественный выход) получают таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (400 мг), полученного в Примере (24a), и 6-хлорпиридин-3-иламина (124 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,13 (1H, с), 8,03 (1H, дд, J=8,6, 2,7 Гц), 7,93 (1H, с), 7,83 (1H, д, J=3,1 Гц), 7,59 (1H, с), 7,21 (1H, д, J=8,6 Гц), 7,08 (1H, д, J=8,6 Гц), 6,98-6,93 (1H, м), 4,47 (2H, с), 3,59 (2H, т, J=6,1 Гц), 2,73 (2H, с), 1,49 (9H, с).
(92b) гидрохлорид 1-(6-хлорпиридин-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (287 мг, 87%) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(6-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (400 мг), полученного в Примере (92a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,97 (1H, с), 9,64 (1H, с), 8,47 (1H, д, J=2,7 Гц), 7,93 (1H, дд, J=8,8, 2,9 Гц), 7,43-7,39 (2H, м), 7,35-7,33 (1H, м), 7,31-7,27 (1H, м), 7,12 (1H, д, J=8,6 Гц), 4,18-4,12 (2H, м), 3,36-3,28 (2H, м), 2,97 (2H, т, J=6,3 Гц).
(92c) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(6-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (239 мг, 56%) получают в виде бесцветного масла таким же способом, как в Примере (1e), из гидрохлорида 1-(6-хлорпиридин-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (287 мг), полученного в Примере (92b), и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (172 мг), полученного в Примере (1d).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,14-8,04 (1H, м), 8,03-7,98 (1H, м), 7,86 (1H, с), 7,58 (1H, с), 7,31 (1H, с), 7,20 (1H, д, J=9,0 Гц), 7,03-6,95 (1H, м), 6,89-6,69 (1H, м), 4,61-4,56 (1H, м), 4,50 (2H, с), 3,65 (3H, с), 3,61 (2H, т, J=5,5 Гц), 2,72 (2H, с), 2,18 (2H, д, J=6,6 Гц), 2,02 (2H, т, J=8,2 Гц), 1,84-1,71 (3H, м), 1,47-1,34 (2H, м), 1,12-0,99 (2H, м).
(92d) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(6-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-[3-(6-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1-изохинолин-2-карбоновой кислоты (371 мг), полученный в Примере (92c), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (141 мг, 38%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,04 (1H, с), 8,96 (1H, с), 8,79 (1H, с), 8,44 (1H, д, J=2,7 Гц), 7,95 (1H, дд, J=8,6, 2,7 Гц), 7,40 (1H, д, J=8,6 Гц), 7,29 (1H, с), 7,23-7,17 (1H, м), 7,10-7,06 (1H, м), 4,44 (3H, с), 3,54 (2H, т, J=5,9 Гц), 2,73 (2H, т, J=5,7 Гц), 2,10 (2H, д, J=6,6 Гц), 1,94-1,86 (2H, м), 1,77-1,68 (2H, м), 1,68-1,57 (1H, м), 1,38-1,26 (2H, м), 1,11-0,98 (2H, м).
МС (FAB) m/z: 509 (M + Na)+.
(Пример 93) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
(93a) трет-бутиловый эфир 6-[3-(5-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (183 мг, 47%) получают таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (400 мг), полученного в Примере (24a), и 5-хлорпиридин-3-иламина (124 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,29-8,14 (3H, м), 8,10-7,81 (1H, м), 7,63-7,56 (1H, м), 7,42 (1H, ушир.с), 7,10-6,58 (1H, м), 6,41 (1H, ушир.с), 4,46 (2H, с), 3,59 (2H, т, J=5,9 Гц), 2,73 (2H, с), 1,50 (9H, с).
(93b) 4-метоксикарбонилметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Амин (167 мг, количественный выход) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (183 мг), полученного в Примере (93a). Из этого амина (167 мг) и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (121 мг), полученного в Примере (1d), получают указанное в заголовке соединение (220 мг, 88%) в виде белого твердого вещества таким же способом, как в Примере (1e).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,28-8,21 (3H, м), 7,84 (1H, ушир.с), 7,56-7,35 (1H, м), 7,26-7,13 (1H, м), 7,11-7,04 (1H, м), 7,02-6,86 (1H, м), 4,64-4,45 (3H, м), 3,65 (3H, с), 3,60-3,46 (2H, м), 2,87-2,74 (2H, м), 2,20-2,16 (2H, м), 2,06-1,91 (2H, м), 1,82-1,67 (3H, м), 1,52-1,23 (2H, м), 1,15-0,98 (2H, м).
(93c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-[3-(5-хлорпиридин-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (121 мг), полученный в Примере (93b), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (54 мг, 46%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,07 (1H, с), 8,86 (1H, с), 8,47-8,44 (1H, м), 8,21-8,19 (1H, м), 8,16-8,13 (1H, м), 7,30 (1H, с), 7,24-7,18 (1H, м), 7,11-7,06 (1H, м), 4,51-4,40 (3H, м), 3,54 (2H, т, J=5,9 Гц), 2,76-2,71 (2H, м), 2,10 (2H, д, J=6,6 Гц), 1,95-1,87 (2H, м), 1,77-1,68 (2H, м), 1,68-1,58 (1H, м), 1,38-1,26 (2H, м), 1,11-0,99 (2H, м);
МС (FAB) m/z: 525 (M + K)+.
(Пример 94) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиразин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
(94a) трет-бутиловый эфир 6-(3-пиразин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (125 мг, 35%) получают в виде белого твердого вещества таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксиарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (400 мг), полученного в Примере (24a), и пиразин-2-иламина (92 мг).
1H ЯМР (400 МГц, CDCl3) δ (м.д.) = 10,95 (1H, с), 8,30 (1H, с), 8,23-8,21 (1H, м), 8,20-8,18 (1H, м), 7,92 (1H, с), 7,49-7,31 (2H, м), 7,08 (1H, д, J=8,2 Гц), 4,53 (2H, с), 3,67-3,59 (2H, м), 2,87-2,80 (2H, м), 1,48 (9H, с).
(94b) гидрохлорид 1-пиразин-2-ил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (95 мг, 99%) получают таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-хлорпиридин-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (125 мг), полученного в Примере (94a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,98 (1H, с), 9,73 (1H, с), 9,21 (2H, с), 9,06 (1H, с), 8,30 (1H, т, J=2,0 Гц), 8,24 (1H, д, J=2,3 Гц), 7,42 (1H, с), 7,34 (1H, д, J=8,6 Гц), 7,15 (1H, д, J=8,6 Гц), 5,51 (1H, с), 4,19 (2H, с), 3,38-3,30 (2H, м), 2,98 (2H, т, J=5,9 Гц).
(94c) 4-метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиразин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (131 мг, 90%) получают в виде белого твердого вещества таким же способом, как в Примере (1e), из гидрохлорида 1-пиразин-2-ил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (95 мг), полученного в Примере (94b), и метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (75 мг), полученного в Примере (1d).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 10,99 (1H, с), 8,50 (1H, с), 8,35 (1H, с), 8,20 (2H, д, J=12,9 Гц), 7,28-7,47 (2H, м), 7,09 (1H, д, J=8,2 Гц), 4,64-4,50 (4H, м), 3,65 (3H, с), 3,58-3,45 (1H, м), 2,83 (1H, с), 2,25-2,15 (2H, м), 2,07-1,91 (2H, м), 1,83-1,70 (3H, м), 1,44-1,21 (2H, м), 1,16-0,97 (2H, м).
(94d) 4-карбоксиметилциклогексиловый эфир транс-6-(3-пиразин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-(3-пиразин-2-илуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (131 мг), полученный в Примере (94c), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (30 мг, 25%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 2,03 (1H, с), 9,59 (1H, с), 9,54 (1H, с), 9,00 (1H, с), 8,30-8,28 (1H, м), 8,24-8,22 (1H, м), 7,34 (1H, с), 7,29-7,24 (1H, м), 7,13-7,08 (1H, м), 3,55 (2H, дд, J=6,3, 5,5 Гц), 3,33 (3H, с), 2,75 (2H, т, J=5,7 Гц), 2,10 (2H, д, J=7,0 Гц), 1,94-1,86 (2H, м), 1,77-1,69 (2H, м), 1,68-1,57 (1H, м), 1,38-1,26 (2H, м), 1,11-0,98 (2H, м).
МС (FAB) m/z: 454 (M + H)+.
(Пример 95) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-метилтиазол-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(95a) трет-бутиловый эфир 6-[3-(5-метилтиазол-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (561 мг, 96%) получают в виде беловатого твердого вещества таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (620 мг), полученного в Примере (24a), и 5-метилтиазол-2-иламина (171 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,39 (1H, ушир.с), 7,29-7,22 (2H, м), 7,08 (1H, д, J=8,6 Гц), 7,01 (1H, с), 5,30 (1H, с), 4,55 (2H, с), 3,65 (2H, ушир.с), 2,84 (2H, т, J=5,4 Гц), 2,40 (3H, с), 1,50 (9H, с).
(95b) гидрохлорид 1-(5-метилтиазол-2-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (468 мг, количественный выход) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-метилтиазол-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (561 мг), полученного в Примере (95a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,74 (1Н, с), 9,30 (1H, ушир.с), 7,41 (1H, д, J=2,0 Гц), 7,33 (1H, дд, J=8,5 и 2,1 Гц), 7,16 (1H, д, J=8,6 Гц), 7,08 (1H, д, J=1,1 Гц), 5,23 (1H, ушир.с), 4,20 (2H, т, J=4,1 Гц), 3,38-3,33 (2H, м), 3,00 (2H, т, J=6,2 Гц), 2,32 (3H, с).
(95c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-метилтиазол-2-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (564 мг, 81%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (344 мг), полученного в Примере (1d), и гидрохлорида 1-(5-метилтиазол-2-ил)-3-(1,2,3,4-тетрагидроизо-хинолин-6-ил)мочевины (468 мг), полученного в Примере (95b). Этот метиловый сложный эфир (564 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (249 мг, 46%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 11,9 (1H, с), 8,98 (2H, ушир.с), 7,33 (1H, с), 7,25 (1H, д, J=9,0 Гц), 7,12 (1H, д, J=9,0 Гц), 7,03 (1H, с), 4,50-4,47 (3H, м), 3,57 (2H, т, J=5,8 Гц), 2,76 (2H, т, J=5,9 Гц), 2,31 (3H, с), 2,12 (2H, д, J=6,6 Гц), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,67-1,62 (1H, м), 1,40-1,29 (2H, м), 1,11-1,03 (2Н, м);
МС (ESI) m/z: 473 (M + H)+.
(Пример 96) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,5-диметил-2H-пиразол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(96a) трет-бутиловый эфир 6-[3-(2,5-диметил-2H-пиразол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (413 мг, 71%) получают в виде белого твердого вещества таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (620 мг), полученного в Примере (24a), и 2,5-диметил-2H-пиразол-3-иламина (166 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,17 (1Н, ушир.с), 7,04 (1H, д, J=7,5 Гц), 6,56 (1H, с), 6,12 (1H, ушир.с), 6,03 (1H, с), 5,31 (1H, с), 4,52 (2H, с), 3,74 (3H, с), 3,62 (2H, т, J=5,6 Гц), 2,80 (2H, т, J=5,9 Гц), 2,27 (3H, с), 1,49 (9H, с).
(96b) гидрохлорид 1-(2,5-диметил-2H-пиразол-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (343 мг, количественный выход) получают в виде желтого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(2,5-диметил-2H-пиразол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (412 мг), полученного в Примере (96a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,54 (1H, с), 9,36 (1H, с), 9,13 (1H, ушир.с), 7,38 (1H, д, J=1,9 Гц), 7,30 (1H, дд, J=8,3 и 2,0 Гц), 7,14 (1H, д, J=8,6 Гц), 6,08 (1H, с), 4,20 (2H, т, J=4,1 Гц), 3,66 (3H, с), 3,38-3,33 (2H, м), 2,98 (2H, т, J=6,0 Гц), 2,12 (3H, с).
(96c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,5-диметил-2H-пиразол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (514 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (256 мг), полученного в Примере (1d), и гидрохлорида 1-(2,5-диметил-2H-пиразол-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (342 мг), полученного в Примере (96b). Этот метиловый сложный эфир (514 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (360 мг, 72%) в виде бледно-розового твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,86 (1H, с), 8,59 (1H, с), 7,32 (1H, с), 7,22 (1H, д, J=8,2 Гц), 7,09 (1H, д, J=8,6 Гц), 5,96 (1H, с), 4,51-4,46 (3H, м), 3,56 (2H, т, J=5,1 Гц), 3,57 (3H, с), 2,75 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=7,0 Гц), 2,08 (3Н, с), 1,95-1,90 (2H, м), 1,77-1,73 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,02 (2H, м);
МС (ESI) m/z: 470 (M + H)+.
(Пример 97) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-метилизоксазол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(97a) трет-бутиловый эфир 6-[3-(5-метилизоксазол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (143 мг, 26%) получают в виде белого твердого вещества таким же способом, как в (Примере 24b), из трет-бутилового эфира 6-(4-нитрофеноксикарбониламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (620 мг), полученного в Примере (24a), и 5-метилизоксазол-3-иламина (147 мг).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 9,13 (1H, ушир.с), 7,88 (1H, ушир.с), 7,36 (1H, ушир.с), 7,32-7,23 (1H, м), 7,07 (1H, д, J=8,3 Гц), 5,94 (1H, с), 4,54 (2H, с), 3,64 (2H, ушир.с), 2,83 (2H, т, J=5,6 Гц), 2,41 (3H, с), 1,50 (9H, с).
(97b) гидрохлорид 1-(5-метилизоксазол-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины
Указанное в заголовке соединение (110 мг, 93%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-[3-(5-метилизоксазол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (143 мг), полученного в Примере (97a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,62 (1H, с), 9,14 (1H, с), 9,05 (1H, ушир.с), 7,37 (1H, с), 7,30 (1H, д, J=8,6 Гц), 7,15 (1H, д, J=8,6 Гц), 6,53 (1H, с), 4,20 (2H, с), 3,37-3,31 (2H, м), 2,97 (2H, т, J=6,3 Гц), 2,36 (3H, с).
(97c) 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-метилизоксазол-3-ил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Метиловый сложный эфир (167 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (86 мг), полученного в Примере (1d), и гидрохлорида 1-(5-метилизоксазол-3-ил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (110 мг), полученного в Примере (97b). Этот метиловый сложный эфир (167 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (143 мг, 88%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 9,54 (1H, с), 8,86 (1H, с), 7,30 (1H, с), 7,24 (1H, дд, J=8,4 и 1,7 Гц), 7,11 (1H, д, J=8,2 Гц), 6,53 (1H, с), 4,51-4,47 (3H, м), 3,57 (2H, т, J=5,9 Гц), 2,75 (2H, т, J=5,9 Гц), 2,36 (3H, с), 2,11 (2H, д, J=7,0 Гц), 1,94-1,91 (2H, м), 1,77-1,74 (2H, м), 1,68-1,62 (1H, м), 1,39-1,29 (2H, м), 1,12-1,01 (2H, м);
МС (ESI) m/z: 457 (M + H)+.
(Пример 98) 4-карбоксиметилциклогексиловый эфир транс-6-(бензотиазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(98a) трет-бутиловый эфир 6-(бензотиазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Толуольный раствор 6-амино-2N-Boc-1,2,3,4-тетрагидроизохинолина (248 мг), 2-хлорбензотиазола (186 мг), ацетата палладия (22 мг), карбоната цезия (651 мг) и Ксантфос (58 мг) перемешивают при 120°C в течение 1 часа в условиях микроволнового облучения. Реакционный раствор очищают колоночной хроматографией, получая указанное в заголовке соединение (381 мг, количественный выход).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 7,77 (1H, д, J=8,2 Гц), 7,69 (1H, д, J=7,8 Гц), 7,40-7,29 (3H, м), 7,25-7,19 (2H, м), 4,69 (2H, с), 3,70 (2H, т, J=5,3 Гц), 2,90 (2H, т, J=5,7 Гц), 1,50 (9H, с).
(98b) гидрохлорид бензотиазол-2-ил-(1,2,3,4-тетрагидроизохинолин-6-ил)амина
Указанное в заголовке соединение (124 мг, 66%) получают в виде белого твердого вещества таким же способом, как в Примере (22b), из трет-бутилового эфира 6-(бензотиазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (270 мг), полученного в Примере (98a).
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 9,25 (1H, с), 7,81-7,78 (1H, м), 7,67-7,56 (3H, м), 7,33-7,29 (1H, м), 7,20-7,13 (2H, м), 4,22-4,17 (2H, м), 3,39-3,32 (2H, м), 3,01 (2H, т, J=6,3 Гц).
(98c) 4-метоксикарбонилметилциклогексиловый эфир транс-6-(бензотиазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Указанное в заголовке соединение (168 мг, 80%) получают таким же способом, как в Примере (1e), из метилового эфира транс-(4-гидроксициклогексил)уксусной кислоты (74 мг), полученного в Примере (1d), и гидрохлорида бензотиазол-2-ил-(1,2,3,4-тетрагидроизохинолин-6-ил)амина (124 мг), полученного в Примере (98b).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 8,20-8,16 (1H, м), 7,50-7,44 (1H, м), 7,16-7,09 (2H, м), 7,09-7,02 (1H, м), 6,81 (1H, д, J=8,6 Гц), 6,74-6,69 (1H, м), 6,43 (1H, с), 4,66-4,52 (3H, м), 3,65 (3H, с), 3,57-3,50 (2H, м), 2,81 (2H, с), 2,23-2,16 (2H, м), 2,06-1,92 (2H, м), 1,82-1,69 (3H, м), 1,44-1,22 (2H, м), 1,16-0,99 (2H, м).
(98d) 4-карбоксиметилциклогексиловый эфир транс-6-(бензотиазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
4-Метоксикарбонилметилциклогексиловый эфир транс-6-(бензотиазол-2-иламино)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (168 мг), полученный в Примере (98c), гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (8 мг, 5%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 7,80-7,76 (1H, м), 7,60-7,55 (3H, м), 7,33-7,28 (1H, м), 7,17-7,11 (2H, м), 4,53-4,44 (3H, м), 3,69-3,54 (2H, м), 2,83-2,73 (2H, м), 2,14-2,07 (2H, м), 1,98-1,87 (2H, м), 1,82-1,58 (2H, м), 1,42-1,28 (2H, м), 1,17-1,00 (2H, м).
(Пример 99) t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (174 мг) получают таким же способом, как в Примере (1e), из метилового эфира (t-4-гидрокси-с-3-метилциклогексил)-r-1-уксусной кислоты (94 мг), полученного в Примере (16a), и гидрохлорида 1-(3-этоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (94 мг). Этот метиловый сложный эфир гидролизуют таким же способом, как в Примере 2, получая указанное в заголовке соединение (117 мг, 85%, две стадии) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1Н, с), 8,65 (1H, с), 8,60 (1H, с), 7,32 (1H, с), 7,22-7,07 (4H, м), 6,89 (1H, д, J=9,4 Гц), 6,53 (1H, дд, J=8,4 и 2,1 Гц), 4,49 (2H, с), 4,22-4,15 (1H, м), 3,99 (2H, кв., J=6,9 Гц), 3,62-3,55 (2H, м), 2,76 (2H, т, J=5,9 Гц), 2,11 (2H, д, J=6,3 Гц), 1,98-1,90 (1H, м), 1,79-1,70 (2H, м), 1,65-1,56 (1H, м), 1,32 (3H, т, J=7,1 Гц), 1,35-1,21 (2H, м), 1,11-1,01 (1H, м), 0,91-0,81 (4H, м).
МС (ESI) m/z: 510 (M + H)+.
(Пример 100) t-4-карбоксиметил-c-2-метил-r-1-циклогексиловый эфир 6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (155 мг, количественный выход) получают таким же способом, как в Примере (1e), из метилового эфира (t-4-гидрокси-t-3-метилциклогексил)-r-1-уксусной кислоты (83 мг), полученного в Примере (14g), и гидрохлорида 1-(3-этоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (119 мг). Этот метиловый сложный эфир гидролизуют таким же путем, как в Примере 2.
МС (ESI) m/z: 510 (M + H)+.
(Пример 101) t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (496 мг) получают таким же способом, как в Примере (1e), из метилового эфира (t-4-гидрокси-с-3-метилциклогексил)-r-1-уксусной кислоты (261 мг), полученного в Примере (16a), и гидрохлорида 1-(3-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (333 мг), полученного в Примере (49b). Этот метиловый сложный эфир гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (438 мг, 91%, две стадии) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 8,74 (1H, с), 8,67 (1H, с), 7,33 (1H, с), 7,23-7,19 (2H, м), 7,16 (1H, д, J=8,3 Гц), 7,09 (1H, д, J=8,2 Гц), 6,92 (1H, д, J=7,9 Гц), 6,55 (1H, дд, J=8,2 и 2,4 Гц), 4,49 (2H, ушир.с), 4,22-4,15 (1H, м), 3,73 (3H, с), 3,58 (2H, т, J=5,6 Гц), 2,76 (2H, т, J=6,0 Гц), 2,10 (2H, д, J=6,6 Гц), 1,96-1,91 (1H, м), 1,75-1,72 (3H, м), 1,64-1,57 (1H, м), 1,34-1,25 (1H, м), 1,10-1,04 (2H, м), 0,89-0,83 (3H, м);
МС (ESI) m/z: 496 (M + H)+.
(Пример 102) t-4-карбоксиметил-t-2-метил-r-1-циклогексиловый эфир 6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Метиловый сложный эфир (553 мг) получают таким же способом, как в Примере (1e), из метилового эфира (t-4-гидрокси-c-3-метилциклогексил)-r-1-уксусной кислоты (261 мг), полученного в Примере (16a), и гидрохлорида 1-(3-трифторметоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (387 мг), полученного в Примере (52b). Этот метиловый сложный эфир гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (477 мг, 88%, две стадии) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 9,05 (1H, с), 8,76 (1H, с), 7,71 (1H, с), 7,40 (1H, дд, J=8,2 и 8,2 Гц), 7,33 (1H, с), 7,28 (1H, д, J=9,4 Гц), 7,23 (1H, д, J=7,9 Гц), 7,11 (1H, д, J=8,2 Гц), 6,94 (1H, д, J=8,2 Гц), 4,49 (2H, ушир.с), 4,22-4,15 (1H, м), 3,61-3,57 (2H, м), 2,77 (2H, т, J=5,7 Гц), 2,10 (2H, д, J=6,6 Гц), 1,96-1,91 (1H, м), 1,74-1,72 (3H, м), 1,63-1,59 (1H, м), 1,34-1,24 (1H, м), 1,10-1,02 (2H, м), 0,89-0,80 (3H, м);
МС (ESI) m/z: 550 (M + H)+.
(Пример 103) 4-(1-карбоксиэтил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

(103a) этиловый эфир 2-(1,4-диоксаспиро[4.5]дец-8-илиден)пропионовой кислоты
Указанное в заголовке соединение (7,01 г, 86%) получают в виде бесцветного масла таким же способом, как в Примере (1a), из триэтил-2-фосфонопропионата (8,0 мл) и 1,4-циклогександионмоноэтиленкеталя (5,28 г).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,20 (2H, кв., J=7,2 Гц), 3,94 (4H, с), 2,61 (2H, т, J=6,0 Гц), 2,39 (2H, т, J=6,4 Гц), 1,89 (3H, с), 1,76-1,71 (4H, м), 1,30 (3H, т, J=7,1 Гц);
МС (FAB) m/z: 241 (M + H)+.
(103b) этиловый эфир 2-(1,4-диоксаспиро[4.5]дец-8-ил)пропионовой кислоты
Указанное в заголовке соединение (6,94 г, 98%) получают в виде бесцветного масла таким же способом, как в Примере (1b), из этилового эфира 2-(1,4-диоксаспиро[4.5]дец-8-илиден)пропионовой кислоты (7,01 г), полученного в Примере (103a).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,18-4,10 (2H, м), 3,94 (4H, с), 2,26-2,20 (1H, м), 1,80-1,71 (3Н, м), 1,64-1,49 (4H, м), 1,42-1,30 (2H, м), 1,26 (3H, т, J=7,0 Гц), 1,13 (3H, д, J=7,1 Гц);
МС (EI) m/z: 242 (M)+.
(103c) этиловый эфир 2-(4-оксоциклогексил)пропионовой кислоты
Указанное в заголовке соединение (5,99 г, количественный выход) получают в виде бесцветного масла таким же способом, как в Примере (1c), из этилового эфира 2-(1,4-диоксаспиро[4.5]дец-8-ил)пропионовой кислоты (6,94 г), полученного в Примере (103b).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,16 (2H, кв., J=6,9 Гц), 2,47-2,30 (5H, м), 2,13-1,94 (3H, м), 1,59-1,43 (2H, м), 1,28 (3H, т, J=7,2 Гц), 1,19 (3H, д, J=7,0 Гц);
МС (EI) m/z: 198 (M)+.
(103d) этиловый эфир транс-2-(4-гидроксициклогексил)пропионовой кислоты
Указанное в заголовке соединение (762 мг, 44%) получают в виде бесцветного масла таким же способом, как в Примере (1d), из этилового эфира 2-(4-оксоциклогексил)пропионовой кислоты (1,70 г), полученного в Примере (103c).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,17-4,10 (2H, м), 3,62-3,50 (1H, м), 2,26-2,20 (1H, м), 2,06-1,95 (2H, м), 1,84-1,77 (1H, м), 1,71-1,65 (1H, м), 1,57-1,47 (1H, м), 1,40 (1H, с), 1,32-1,24 (2H, м), 1,27 (3H, д, J=7,1 Гц), 1,17-0,99 (2H, м), 1,12 (3H, д, J=7,1 Гц);
МС (FAB) m/z: 201 (M + H)+.
(103e) 4-(1-карбоксиэтил)циклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
Этиловый сложный эфир (88 мг, 55%) получают таким же способом, как в Примере (1e), из этилового эфира транс-2-(4-гидроксициклогексил)пропионовой кислоты (81 мг), полученного в Примере (103d), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (100 мг). Этот этиловый сложный эфир (88 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (35 мг, 42%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 9,02 (1H, с), 8,54 (1H, с), 8,16 (1H, дд, J=8,2 и 8,2 Гц), 7,39-6,97 (6H, м), 4,55-4,40 (3H, м), 3,65-3,54 (2H, м), 2,85-2,73 (2H, м), 2,21-2,11 (1H, м), 2,04-1,91 (2H, м), 1,80-1,63 (1H, м), 1,57-1,41 (1H, м), 1,39-1,26 (2H, м), 1,19-0,99 (3H, м), 1,02 (3H, д, J=6,7 Гц);
МС (ESI) m/z: 484 (M + H)+.
(Пример (104) 4-(1-карбоксиэтил)циклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Этиловый сложный эфир (331 мг, 79%) получают таким же способом, как в Примере (1e), из этилового эфира транс-2-(4-гидроксициклогексил)пропионовой кислоты (180 мг), полученного в Примере (103d), и гидрохлорида 1-(3-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (267 мг), полученного в Примере (49b). Этот этиловый сложный эфир (331 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (249 мг, 79%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1H, с), 8,67 (1H, с), 8,60 (1H, с), 7,32 (1H, ушир.с), 7,22-7,15 (3H, м), 7,09 (1H, дд, J=8,3 и 4,3 Гц), 6,92 (1H, д, J=7,8 Гц), 6,55 (1H, дд, J=8,2 и 2,3 Гц), 4,51-4,43 (3H, м), 3,73 (3H, с), 3,56 (2H, т, J=5,5 Гц), 2,75 (2H, т, J=5,8 Гц), 2,15 (1H, т, J=7,1 Гц), 1,97-1,95 (1H, м), 1,83-1,64 (2H, м), 1,54-1,45 (2H, м), 1,37-1,27 (2H, м), 1,18-1,07 (2H, м), 1,04 (3H, д, J=5,9 Гц);
МС (ESI) m/z: 496 (M + H)+.
(Пример 105) 4-(1-карбоксиэтил)циклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты

Этиловый сложный эфир (338 мг, 86%) получают таким же способом, как в Примере (1e), из этилового эфира транс-2-(4-гидроксициклогексил)пропионовой кислоты (180 мг), полученного в Примере (103d), и гидрохлорида 1-фенил-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (243 мг), полученного в Примере (50b). Этот этиловый сложный эфир (338 мг) гидролизуют водным раствором гидроксида натрия таким же путем, как в Примере 2, получая указанное в заголовке соединение (204 мг, 64%) в виде беловатого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,1 (1Н, с), 8,64 (1H, с), 8,60 (1H, с), 7,45 (2H, д, J=8,6 Гц), 7,32 (1H, ушир.с), 7,28 (2H, дд, J=8,0 и 8,0 Гц), 7,22 (1H, д, J=8,6 Гц), 7,09 (1H, дд, J=8,4 и 4,5 Гц), 6,97 (1H, дд, J=7,4 и 7,5 Гц), 4,49-4,44 (3H, м), 3,56 (2H, т, J=5,5 Гц), 2,75 (2H, т, J=6,0 Гц), 2,15 (1H, т, J=7,0 Гц), 1,99-1,93 (1H, м), 1,84-1,64 (2H, м), 1,48-1,37 (2H, м), 1,30-1,18 (2H, м), 1,06-1,05 (2H, м), 1,04 (3H, д, J=5,9 Гц);
МС (ESI) m/z: 466 (M + H)+.
(Пример 106) [4-(2-{6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-ил}-1-метил-2-оксиэтил)циклогексил]уксусная кислота

(106a) этиловый эфир 2-(4-трет-бутоксикарбонилметилциклогексил)пропионовой кислоты
Олефин (6,16 г) получают таким же способом, как в Примере (1а), из этилового эфира 2-(4-оксоциклогексил)пропионовой кислоты (4,13 г), полученного в Примере (103c), и трет-бутилдиэтилфосфоноацетата (4,99 г). Этот олефин (6,16 г) восстанавливают таким же способом, как в Примере (1b), получая указанное в заголовке соединение (4,17 г, 49%, две стадии) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,23-4,08 (2H, м), 2,51-2,37 (1H, м), 2,32-2,18 (2H, м), 2,14-2,04 (2H, м), 1,88-1,59 (4H, м), 1,45 (9H, с), 1,39-1,23 (5H, м), 1,19-0,86 (5H, м);
МС (FAB) m/z: 299 (M + H)+.
(106b) 2-(4-трет-бутоксикарбонилметилциклогексил)пропионовая кислота
Этиловый эфир 2-(4-трет-бутоксикарбонилметилциклогексил)пропионовой кислоты (2,46 г), полученный в Примере (106a), гидролизуют 1N NaOH таким же путем, как в (Примере 2), получая указанное в заголовке соединение (1,72 г, 78%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 2,30-2,20 (1Н, м), 2,12-2,05 (2H, м), 1,84-1,65 (3H, м), 1,57-1,49 (3H, м), 1,44 (9H, с), 1,30-1,22 (1H, м), 1,19-0,97 (4H, м), 1,14 (3H, д, J=6,6 Гц).
(106c) [4-(2-{6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-ил}-1-метил-2-оксиэтил)циклогексил]уксусная кислота
трет-Бутиловый сложный эфир (340 мг, 49%) получают таким же способом, как в Примере 40, из 2-(4-трет-бутоксикарбонилметилциклогексил)пропионовой кислоты (343 мг), полученной в Примере (106b), и гидрохлорида 1-(3-метоксифенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (425 мг), полученного в Примере (49b). Этот трет-бутиловый сложный эфир (340 мг) обрабатывают таким же способом, как в Примере (22b), получая указанное в заголовке соединение (148 мг, 48%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, с), 8,68 (1H, с), 8,60 (1H, с), 7,42-7,08 (5H, м), 6,92 (1H, д, J=7,4 Гц), 6,56 (1H, д, J=8,2 Гц), 4,71-4,53 (2H, м), 3,81 (3H, с), 3,73-3,65 (2H, м), 2,86-2,63 (3H, м), 2,13-2,04 (2H, м), 1,85-1,51 (4H, м), 1,46-1,31 (4H, м), 1,04-0,86 (5H, м);
МС (ESI) m/z: 494 (M + H)+.
(Пример 107) 2-[4-(2-{6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-ил}-2-оксоэтил)циклогексил]пропионовая кислота

(107a) этиловый эфир 2-(4-карбонилметилциклогексил)пропионовой кислоты
Указанное в заголовке соединение (1,53 г, количественный выход) получают в виде бесцветного масла таким же способом, как в Примере (22b), из этилового эфира 2-(4-трет-бутоксикарбонилметил-циклогексил)пропионовой кислоты (1,68 г), полученного в Примере (106a).
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 4,18-4,07 (2H, м), 2,44-2,32 (1H, м), 2,28-2,20 (2H, м), 2,14-2,06 (1H, м), 1,90-1,62 (3H, м), 1,90-1,62 (3H, м), 1,26 (3H, т, J=7,1 Гц), 1,15-1,10 (4H, м), 1,12-0,99 (3H, м);
МС (EI) m/z: 242 (M)+.
(107b) [4-(2-{6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1H-изохинолин-2-ил}-1-метил-2-оксиэтил)циклогексил]уксусная кислота
Этиловый сложный эфир (304 мг, 82%) получают таким же способом, как в Примере 40, из этилового эфира 2-(4-карбонилметилциклогексил)пропионовой кислоты (177 мг), полученного в Примере (107a), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (236 мг). Этот этиловый сложный эфир (304 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (139 мг, 49%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, с), 9,01 (1H, с), 8,53 (1H, с), 8,16 (1H, дд, J=8,2 и 8,2 Гц), 7,35-6,98 (6H, м), 4,61-4,50 (2H, м), 3,65 (2H, т, J=6,0 Гц), 2,85-2,70 (2H, м), 2,27 (2H, д, J=6,2 Гц), 2,15-2,06 (1H, м), 1,79-1,57 (4H, м), 1,79-1,57 (4H, м), 1,79-1,57 (5H, м);
МС (ESI) m/z: 482 (M + H)+.
(Пример 108) [4-({6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбонил}метиламино)циклогексил]уксусная кислота

(108a) метиловый эфир (4-метиламиноциклогексил)уксусной кислоты
К раствору метилового эфира (4-оксоциклогексил)уксусной кислоты (2,14 г), полученного в Примере (1c), в тетрагидрофуране (60 мл) добавляют при комнатной температуре метиламин (2,0M раствор в тетрагидрофуране; 12,5 мл), уксусную кислоту (0,72 мл) и натрийтриацетоксиборгидрид (2,67 г). Через 4 часа реакционную смесь разбавляют насыщенным бикарбонатом натрия (100 мл). Органический растворитель удаляют при пониженном давлении. Водную смесь подвергают экстракции дихлорметаном (×3). Дихлорметановый слой сушат над сульфатом натрия и затем концентрируют. Остаток очищают колоночной хроматографией (NH силикагель, смесь дихлорметан/метанол), получая указанное в заголовке соединение (822 мг, 35%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3): δ (м.д.) = 3,67 (3H, с), 2,62-2,57 (1Н, м), 2,40 (3H, с), 2,28 (2H, д, J=7,4 Гц), 2,00-1,91 (1H, м), 1,83-1,75 (1H, м), 1,63-1,48 (4H, м), 1,45-1,35 (2H, м), 1,29-1,17 (1H, м), 1,15-1,01 (1H, м);
МС (EI) m/z: 185 (M)+.
(108b) [4-({6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбонил}метиламино)циклогексил]уксусная кислота
Метиловый сложный эфир (322 мг, 88%) получают таким же способом, как в Примере (1e), из метилового эфира (4-метиламиноциклогексил)уксусной кислоты (190 мг), полученного в Примере (108a), и гидрохлорида 1-(2-фторфенил)-3-(1,2,3,4-тетрагидроизохинолин-6-ил)мочевины (WO2006004200 A1) (238 мг). Этот метиловый сложный эфир (322 мг) гидролизуют таким же путем, как в Примере 2, получая указанное в заголовке соединение (149 мг, 48%) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) = 12,0 (1H, с), 9,00 (1H, с), 8,53 (1H, с), 8,16 (1H, дд, J=8,8 и 8,8 Гц), 7,33-6,98 (6H, м), 4,22 (2H, с), 3,53-3,42 (1H, м), 2,82 (2H, т, J=5,2 Гц), 2,72 (3H, с), 2,33 (2H, д, J=7,9 Гц), 2,10 (2H, д, J=7,0 Гц), 1,82-1,37 (6H, м), 1,11-0,97 (1H, м), 1,04 (2H, д, J=6,3 Гц);
МС (ESI) m/z: 483 (M + H)+.
(Тест-пример 1)
(1) Получение фермента DGAT1
Фермент DGAT1 получают и хранят в соответствии со способом, описанным в US2007/0249620.
(2) Тест на ингибирующую активность в отношении DGAT1
Реакционный раствор, имеющий нижеследующий состав, инкубируют при комнатной температуре (23°C) в течение 30 минут: 175 мМ Трис-HCl (pH 8,0), 8 мМ MgCl2, 1 мг/мл BSA (бычий сывороточный альбумин), 0,3 мМ 1,2-диолеоил-sn-глицерин (раствор в EtOH 10-кратной концентрации, добавляют 10%), 10 мкМ [14C]-олеоил-CoA (приблизительно 50 мКи/ммоль), 0,5% Тритон X-100, фермент DGAT1 (10 мкг), полученный в Тест-примере 1(1), и испытуемое соединение или наполнитель (ДМСО/MeOH, раствор 7:3, добавляют 5%), в общем 50 мкл. В реакционный раствор добавляют раствор, останавливающий протекание реакции (70 мкл), состоящий из смеси изопропанол/1-гептан/вода (80:20:2, об./об./об.), и перемешивают. Позже туда добавляют воду (30 мкл) и 1-гептан (100 мкл) и перемешивают. 1-гептановый слой (50 мкл) наносят на пластину ТСХ в виде пятна и проявляют, используя проявляющий растворитель, представляющий собой смесь 1-гексан/диэтиловый эфир/уксусная кислота (85:15:1, об./об./об.). Радиоактивность фракции триглицеридов определяют количественно, используя BAS2000 Bio Image анализатор (FUJIFILM), и сравнивают с контролем. Ингибирующую активность испытуемого соединения рассчитывают согласно формуле, представленной ниже. В этом контексте радиоактивность в отсутствие реакции (инкубация 0 мин) используют в качестве фоновой.
Степень ингибирования = 100-[(Радиоактивность образца, дополненного испытуемым соединением)-(Фоновая)]/[(Радиоактивность контроля)-(Фоновая)]×100
Соединения Примеров 2-3, 5-45, 47-62, 64-80, 82-86, 90-95, 97-107 и 108 демонстрируют 50% или более высокую степень ингибирования при концентрации испытуемого соединения 0,05 мкг/мл.
В этом контексте испытание на ингибирующую активность в отношении DGAT не ограничено способом, описанным выше. Например, в качестве фермента DGAT могут быть использованы микросомы, полученные из тонкой кишки, жировой ткани или печени животных (например, крыс или мышей). Кроме того, в качестве фермента DGAT могут быть также использованы микросомы, полученные из культивированных клеток (жировые клетки 3T3-L1, в основном, культивированные жировые клетки, клетки Caco2, клетки HepG2, и т.д.) или культивированных клеток, высокоэкспрессирующих DGAT. Кроме того, для эффективной оценки большого числа испытуемых соединений за короткое время могут быть использованы промывочные планшеты (PerkinElmer), которые не требуют процедур экстракции.
Как очевидно из этих результатов, соединения по данному изобретению обладают превосходной ингибирующей биоактивностью в отношении DGAT1.
(Тест-пример 2)
Фермент DGAT1 имеет важное значение для переваривания и абсорбции триглицеридов, и ингибирование DGAT1 в тонкой кишке подавляет абсорбцию триглицеридов. In vivo активность соединения в отношении подавления действия DGAT1 оценивают по подавлению абсорбции триглицеридов после нагрузки жиром в качестве индикатора. Мышей, самцов, линии C57BL/6N (возраст 7-12 недель, масса тела: 17-25 г, Charles River Laboratories Japan Inc.), подвергнутых голоданию на протяжении ночи, подразделяют на группу 1, обрабатываемую наполнителем, группу 2, обрабатываемую наполнителем, и группу, обрабатываемую каждым испытуемым соединением, и мышам этих групп перорально вводят (5 мл/кг) наполнитель (0,5% метилцеллюлозу) или каждое испытуемое соединение (от 1 до 10 мг/кг), суспендированное в наполнителе. По истечении заданного времени каждой группе интраперитонеально вводят (5 мл/кг) ингибитор липопротеинлипазы (Pluronic-F127: Sigma-Aldrich Corp., 1 г/кг, 20 мас.% растворенный в физиологическом растворе). Непосредственно после этого мышам вводят перорально (0,2 мл/мышь) дистиллированную воду в случае группы 1, обработанной наполнителем, или эмуляцию, содержащую 20% жира (Интралипид 20%: TERUMO CORP., Japan), в случае группы 2, обработанной наполнителем, и групп, обработанных соединением. По истечении заданного времени, от 1 до 4 часов после введения, отбирают кровь из хвостовой вены или правого желудочка и плазму сразу отделяют и собирают. Затем измеряют концентрацию глицеридов в плазме, используя коммерчески доступный набор (Triglyceride E-Test Wako: Wako Pure Chemical Industries, Ltd.). В этом способе введение ингибитора липопротеинлипазы подавляет гидролиз триглицеридов в крови так, что триглицериды аккумулируются в крови. Эти триглицериды имеют два происхождения: экзогенные триглицериды, абсорбируемые в желудочно-кишечном тракте, и эндогенные триглицериды, высвобождаемые из печени. Активность каждого испытуемого соединения в подавлении абсорбции триглицеридов рассчитывают исходя из нижеприведенного уравнения, исключая влияние эндогенных триглицеридов. В этом контексте каждое испытуемое соединение, как было подтверждено для каждого в отдельности, не оказывает влияния на концентрацию эндогенных триглицеридов.
Активность в отношении подавления абсорбции триглицеридов (%) = 100-[(Концентрация триглицеридов группы с каждым испытуемым соединением)-(Концентрация триглицеридов группы 1 с наполнителем)]/[(Концентрация триглицеридов группы 2 с наполнителем)-(концентрация триглицеридов группы 1 с наполнителем)]×100.
Соединения Примеров 2, 5, 7, 8, 10, 11, 12, 13, 15, 16, 17, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 41, 43-62, 64, 66-78, 80-86, 90-92, 95, 97, 99-105, 107 и 108 демонстрируют 60% или более высокую активность в подавлении абсорбции триглицеридов при дозе 10 мг/кг или ниже.
Как следует из этих результатов, соединения по данному изобретению обладают превосходной активностью в отношении подавления абсорбции триглицеридов.
(Тест-пример 3)
Мышей, мужские особи, линии C57BL/6N (возраст 7-12 недель, масса тела: 17-25 г, Charles River Laboratories Japan Inc.) размещают, по отдельности, по клеткам и выдерживают на рационе с высоким содержанием жиров (содержание жиров: 45 ккал%: Research Diets, Inc. D12451) в течение 1 недели или более продолжительного периода времени для акклиматизации. Учитывая потребление корма в течение вышеуказанного периода времени, животных распределяют по экспериментальным группам и подвергают голоданию на протяжении ночи. Затем каждой группе перорально вводят (10 мл/кг) наполнитель (0,5% метилцеллюлозу) или каждое испытуемое соединение (от 1 до 10 мг/кг), суспендированное в наполнителе. Через 30 минут после введения животных кормят, используя рацион с высоким содержанием жиров, и измеряют потребление корма через 6 часов после начала кормления. Активность каждого испытуемого соединения в отношении подавления потребления корма рассчитывают исходя из уравнения, представленного ниже.
Активность в отношении подавления потребления пищи (%) = [(Потребление корма группы с наполнителем)-(Потребление корма группы с каждым испытуемым соединением)]/[(Потребление корма группы с наполнителем)]×100.
Соединения Примеров 2 и 20 демонстрируют 25% или более высокую активность в отношении подавления потребления пищи при дозе 10 мг/кг или ниже.
Как следует из этих результатов, соединения по данному изобретению обладают превосходным действием, направленным на подавление потребления пищи.
Препаративный пример 1: Капсула
Порошок вышеприведенного состава смешивают и пропускают через сито 60 меш. Затем этот порошок в количестве 250 мг загружают в желатиновую капсулу, получая капсулу.
Препаративный пример 2: Таблетка
Порошок вышеприведенного состава смешивают, гранулируют, используя пасту кукурузного крахмала, затем сушат и затем прессуют с получением таблетки (200 мг/таблетка), используя таблетировочную машину. Эта таблетка, при необходимости, может быть покрыта сахарным покрытием.
Промышленная применимость
Соединение по данному изобретению, представленное общей формулой (I), или его фармакологически приемлемая соль обладает превосходным ингибирующим действием в отношении DGAT и превосходным подавляющим потребление пищи действием и поэтому его используют в качестве фармацевтического средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРРОЛО[2,3-c] ПИРИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2385320C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ РАЦЕМИЧЕСКОГО АМИНОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА ИЛИ РАЦЕМИЧЕСКОГО АМИНОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОИЗОХИНОЛИНА, СПОСОБЫ ИХ РАЗДЕЛЕНИЯ И РАЦЕМИЗАЦИИ, СПОСОБ ПОЛУЧЕНИЯ КЕТОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА ИЛИ КЕТОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОИЗОХИНОЛИНА, СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРА КОНДЕНСИРОВАННОГО БИЦИКЛИЧЕСКОГО КОЛЬЦА, ЗАМЕЩЕННОГО ПЕРВИЧНЫМ АМИНОМ, ПРОИЗВОДНЫЕ 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА | 2002 |
|
RU2308451C2 |
| АГОНИСТЫ РЕЦЕПТОРА СФИНГОЗИН-1-ФОСФАТА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ В КАЧЕСТВЕ АКТИВНОГО СРЕДСТВА | 2014 |
|
RU2654483C2 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ СРЕДСТВА ПРОТИВ ВИРУСОВ СЕМЕЙСТВА FLAVIVIRIDAE | 2004 |
|
RU2355687C2 |
| ПРОИЗВОДНОЕ КАРБОНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ АКТИВАЦИЕЙ DP-РЕЦЕПТОРА, ПРИМЕНЕНИЕ ПРОИЗВОДНОГО КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ПРОИЗВОДСТВА ТАКОГО СРЕДСТВА, СПОСОБ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ АКТИВАЦИЕЙ DP-РЕЦЕПТОРОВ | 2003 |
|
RU2329256C2 |
| ДИАМИНОВЫЕ ПРОИЗВОДНЫЕ | 2003 |
|
RU2333203C2 |
| НОВОЕ ПРОИЗВОДНОЕ БЕНЗОАЗЕПИНА И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2642783C2 |
| ПИПЕРАЗИН-ЗАМЕЩЕННЫЕ БЕНЗОТИОФЕНЫ ДЛЯ ЛЕЧЕНИЯ ПСИХИЧЕСКИХ РАССТРОЙСТВ | 2006 |
|
RU2402549C2 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
| АЗОТСОДЕРЖАЩИЕ АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, СПОСОБ ЛЕЧЕНИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2310651C2 |
Настоящее изобретение относится к области органической химии, а именно к новым производным тетрагидроизохинолина общей формулы (I) или к его фармакологически приемлемым солям, где R1 представляет собой фениламинокарбонильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы А, гетероариламинокарбонильную группу, где гетероарил представляет собой пиридин, пиразин, тиазол, пиразол или изоксазол, которые могут быть замещены 1 группой, выбранной из замещающей группы А, бензоксазол-2-ильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы А, бензотиазол-2-ильную группу, (C1-С6 алкил (который может быть монозамещен С3-С6 циклоалкильной группой)аминокарбонильную группу, (С3-С6 циклоалкил)аминокарбонильную группу или адамантиламинокарбонильную группу; R2 независимо представляет собой C1-С6 алкильную группу; R3 представляет собой гетероциклическую группу, где гетероцикл представляет оксазол, оксадиазол, пиразол, изоксазол или тетразол, которые могут быть замещены 1 группой, выбранной из замещающей группы А, группу, представленную формулой -C(=O)-O-R4, или группу, представленную формулой -C(=O)-N(R5)R6; R4 представляет собой атом водорода, C1-С6 алкильную группу, которая может быть замещена 1-2 группой(ами), независимо выбранными из замещающей группы В; R5 представляет собой атом водорода, C1-С6 алкильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы В, С3-С6 циклоалкильную группу, которая монозамещена карбоксильной группой, или гетероциклическую группу, где гетероцикл представляет тетразол, который может быть замещен 1 группой, выбранной из замещающей группы A; R6 представляет собой атом водорода или C1-C6 алкильную группу; в тех случаях, когда оба R5 и R6 представляют собой C1-C6 алкильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы В, их атомы углерода могут быть связаны друг с другом, образуя 5-членный насыщенный цикл; X представляет собой атом кислорода, метиленовую группу, группу, представленную формулой -NH-, метиленовую группу, монозамещенную C1-С6 алкильной группой, или группу, представленную формулой -N(R7)-; R7 представляет собой С1-С6 алкильную группу; L представляет собой простую связь, метиленовую группу, 1,1-диметилметиленовую группу, этиленовую группу, группу, представленную формулой - СН=, или метиленовую группу, монозамещенную C1-С6 алкильной группой; ..... представляет собой простую связь или двойную связь (однако, ..... представляет собой простую связь, когда L представляет собой группу, представленную формулой -СН=); m равно 1 или 2; n представляет собой целое число, равное от 0 до 1; замещающая группа А представляет собой группу заместителей, выбранных из атома галогена, C1-С6 алкильной группы, C1-С6 галогенированной алкильной группы, C1-С6 алкоксигруппы, С1-С6 галогенированной алкоксигруппы, C1-C6 алкилтиогруппы, карбоксильной группы, ди-(С1-С6 алкил)аминогруппы, цианогруппы, гидроксигруппы, C1-С6 алкилсульфинильной группы и оксогруппы; и замещающая группа В представляет собой группу заместителей, выбранных из карбоксильной группы и гидроксигруппы. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I), применению соединения формулы (I) и способу лечения и/или предотвращения заболевания. Технический результат: получены новые производные тетрагидроизохинолина, обладающие превосходным ингибирующим действием в отношении ацил-кофермента А: диацилглицерин-ацилтрансферазы и превосходным подавляющим потребление пищи действием. 6 н. и 25 з.п. формулы, 111 пр.
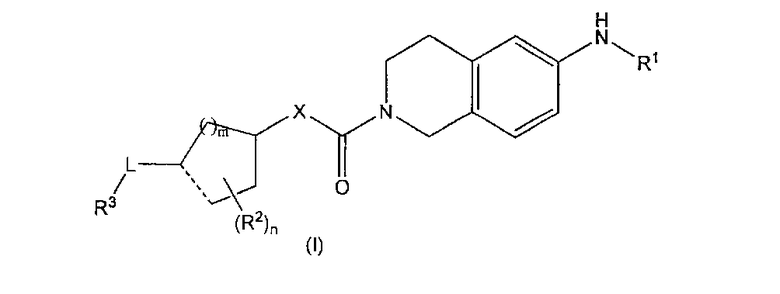
1. Соединение, представленное общей формулой (I)

в которой R1 представляет собой фениламинокарбонильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы А, гетероариламинокарбонильную группу, где гетероарил представляет собой пиридин, пиразин, тиазол, пиразол или изоксазол, которые могут быть замещены 1 группой, выбранной из замещающей группы А, бензоксазол-2-ильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы А, бензотиазол-2-ильную группу, (С1-С6 алкил, который может быть монозамещен С3-С6 циклоалкильной группой)аминокарбонильную группу, (С3-С6 циклоалкил)аминокарбонильную группу или адамантиламинокарбонильную группу;
R2 независимо представляет собой С1-С6 алкильную группу;
R3 представляет собой гетероциклическую группу, где гетероцикл представляет оксазол, оксадиазол, пиразол, изоксазол или тетразол, которые могут быть замещены 1 группой, выбранной из замещающей группы А, группу, представленную формулой -C(=O)-O-R4, или группу, представленную формулой -C(=O)-N(R5)R6;
R4 представляет собой атом водорода, С1-С6 алкильную группу, которая может быть замещена 1-2 группой(ами), независимо выбранными из замещающей группы В;
R5 представляет собой атом водорода, С1-С6 алкильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы В, С3-С6 циклоалкильную группу, которая монозамещена карбоксильной группой, или гетероциклическую группу, где гетероцикл представляет тетразол, который может быть замещена 1 группой, выбранной из замещающей группы А;
R6 представляет собой атом водорода или С1-С6 алкильную группу;
в тех случаях, когда оба R5 и R6 представляют собой С1-С6 алкильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы В, их атомы углерода могут быть связаны друг с другом, образуя 5-членный насыщенный цикл;
X представляет собой атом кислорода, метиленовую группу, группу, представленную формулой -NH-, метиленовую группу, монозамещенную С1-С6 алкильной группой, или группу, представленную формулой -N(R7)-;
R7 представляет собой С1-С6 алкильную группу;
L представляет собой простую связь, метиленовую группу, 1,1-диметилметиленовую группу, этиленовую группу, группу, представленную формулой -СН= или метиленовую группу, монозамещенную С1-С6 алкильной группой;
..... представляет собой простую связь или двойную связь (однако, .....представляет собой простую связь, когда L представляет собой группу, представленную формулой -СН=);
m равно 1 или 2;
n представляет собой целое число, равное от 0 до 1;
замещающая группа А представляет собой группу заместителей, выбранных из атома галогена, С1-С6 алкильной группы, С1-С6 галогенированной алкильной группы, С1-С6 алкоксигруппы, С1-С6 галогенированной алкоксигруппы, С1-С6 алкилтиогруппы, карбоксильной группы, ди-(С1-С6 алкил)аминогруппы, цианогруппы, гидроксигруппы, С1-С6 алкилсульфинильной группы и оксогруппы; и
замещающая группа В представляет собой группу заместителей, выбранных из карбоксильной группы и гидроксигруппы
или его фармакологически приемлемая соль.
2. Соединение или его фармакологически приемлемая соль по п.1, где R1 представляет собой фениламинокарбонильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы А, гетероариламинокарбонильную группу, где гетероарил представляет собой пиридин, пиразин, тиазол, пиразол или изоксазол, которые могут быть замещены 1 группой, выбранной из замещающей группы А, бензоксазол-2-ильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы А, бензотиазол-2-ильную группу; R5 представляет собой атом водорода, С1-С6 алкильную группу, которая может быть замещена 1 группой, выбранной из замещающей группы В, или С3-С6 циклоалкильную группу, которая монозамещена карбоксильной группой; X представляет собой атом кислорода, метиленовую группу или группу, представленную формулой -NH-; L представляет собой простую связь, метиленовую группу, 1,1-диметилметиленовую группу, этиленовую группу или группу, представленную формулой -СН=; и замещающая группа А представляет собой группу заместителей, выбранных из атома галогена, С1-С6 алкильной группы, С1-С6 галогенированной алкильной группы, С1-С6 алкоксигруппы, С1-С6 галогенированной алкоксигруппы, С1-С6 алкилтиогруппы, карбоксильной группы, ди-(С1-С6 алкил)аминогруппы, цианогруппы и гидроксигруппы.
3. Соединение или его фармакологически приемлемая соль по п.1, где общая формула (I) представляет собой общую формулу (II) или (III):

где R представляет собой фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы А, или С3-С6 циклоалкильную группу; и
R3, X и замещающая группа А такие, как определены в общей формуле (I).
4. Соединение или его фармакологически приемлемая соль по п.1, где общая формула (I) представляет собой общую формулу (II):

где R представляет собой фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из замещающей группы А, или С3-С6 циклоалкильную группу; и
R3, X и замещающая группа А такие, как определены в общей формуле (I).
5. Соединение или его фармакологически приемлемая соль по п.3, где R представляет собой фенильную группу, которая может быть замещена 1-3 группой(ами), независимо выбранными из атома галогена, С1-С6 алкильной группы, С1-С6 галогенированной алкильной группы, С1-С6 алкоксигруппы и С1-С6 галогенированной алкоксигруппы, или С3-С6 циклоалкильную группу.
6. Соединение или его фармакологически приемлемая соль по п.3, где R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 4-трифторметилфенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу, 2,4,5-трифторфенильную группу, 3,4,5-трифторфенильную группу или циклопентильную группу.
7. Соединение или его фармакологически приемлемая соль по п.3, где R представляет собой фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 3-метилфенильную группу, 3-этилфенильную группу, 3-метоксифенильную группу, 3-этоксифенильную группу, 3-трифторметоксифенильную группу, 3,4-дифторфенильную группу, 2-фтор-5-метоксифенильную группу или 2,4,5-трифторфенильную группу.
8. Соединение или его фармакологически приемлемая соль по любому из пп.1-7, где R3 представляет собой гетероциклическую группу, где гетероцикл представляет собой 4-карбоксиоксазол-2-ил, 5-окса-4,5-дигидро-[1,2,4]оксадиазол-3-ил, 5-гидрокси-2Н-пиразол-3-ил, 3-гидроксиизоксазол-5-ил или тетразол-5-ил, способную служить в качестве эквивалента карбоновой кислоты или карбоксильной группы.
9. Соединение или его фармакологически приемлемая соль по любому из пп.1-7, где R3 представляет собой карбоксильную группу.
10. Соединение или его фармакологически приемлемая соль по любому из пп.1-7, где X представляет собой атом кислорода или метиленовую группу.
11. Соединение или его фармакологически приемлемая соль по любому из пп.1-7, где X представляет собой атом кислорода.
12. Соединение или его фармакологически приемлемая соль по п.1, где соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-м-толилуреидо)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты или
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты.
13. Соединение по п.1, где соединение, представленное общей формулой (I), представляет собой
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2,4,5-трифторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-метоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-фенилуреидо)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-трифторметоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-дифторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-фтор-5-метоксифенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-фторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты,
4-карбоксиметилциклогексиловый эфир транс-6-(3-м-толилуреидо)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты или
4-карбоксиметилциклогексиловый эфир транс-6-[3-(3-этилфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты.
14. Соединение по п.1, где соединение, представленное общей формулой (I), представляет собой 4-карбоксиметилциклогексиловый эфир транс-6-[3-(2-метокси-5-метилфенил)уреидо]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты.
15. Соединение по п.1, где соединение, представленное общей формулой (I), представляет собой 4-карбоксиметилциклогексиловый эфир транс-6-[3-(5-этокси-2-фторфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты.
16. Соединение по п.1, где соединение, представленное общей
формулой (I), представляет собой 4-карбоксиметилциклогексиловый эфир транс-6-(3-п-толилуреидо)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты.
17. Соединение по п.1, где соединение, представленное общей формулой (I), представляет собой 4-карбоксиметилциклогексиловый эфир транс-6-(3-о-толилуреидо)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты.
18. Соединение по п.1, где соединение, представленное общей формулой (I), представляет собой 4-карбоксиметилциклогексиловый эфир транс-6-[3-(3,4-диметилфенил)уреидо]-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты.
19. Фармацевтическая композиция, обладающая DGAT ингибирующим действием или подавляющим потребление пищи действием, содержащая в качестве активного ингредиента соединение или его фармакологически приемлемую соль по любому из пп.1-18.
20. Соединение или его фармакологически приемлемая соль по п.1 для использования в качестве препарата для подавления потребления пищи и/или анорексигенного средства.
21. Соединение или его фармакологически приемлемая соль по п.1, пригодные для лечения и/или предотвращения болезни, симптомы проявления которой лечат, подвергают воздействию с положительной динамикой, смягчают и/или предотвращают путем ингибирования ацил-кофермента А: диацилглицерин-ацилтрансферазы так, что подавляется синтез триглицеридов.
22. Соединение или его фармакологически приемлемая соль по п.1, пригодные для лечения и/или предотвращения тучности, ожирения, гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета при беременности, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, ишемической болезни сердца или булимии.
23. Соединение или его фармакологически приемлемая соль по п.22, пригодные для использования в лечении и/или предотвращении тучности или ожирения.
24. Применение соединения или его фармакологически приемлемой соли, по любому из пп.1-18 для получения фармацевтической композиции для использования в качестве препарата для подавления потребления пищи и/или анорексигенного средства.
25. Применение соединения или его фармакологически приемлемой соли по любому из пп.1-18 для получения фармацевтической композиции для лечения и/или предотвращения болезни, симптомы проявления которой лечат, подвергают воздействию с положительной динамикой, смягчают и/или предотвращают путем ингибирования ацил-кофермента А: диацилглицерин-ацилтрансферазы так, что подавляется синтез триглицеридов.
26. Применение соединения или его фармакологически приемлемой соли по любому из пп.1-18 для получения фармацевтической композиции для лечения и/или предотвращения тучности, ожирения, гиперлипидемии, гипертриглицеридемии, липидоза, синдрома инсулинорезистентности, нарушения толерантности к глюкозе, диабета, диабетических осложнений (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракты, сахарного диабета при беременности, неалкогольного стеатогепатита, синдрома поликистоза яичников, артериосклероза, атеросклероза, диабетического атеросклероза, ишемической болезни сердца или булимии.
27. Применение по п.26, где фармацевтическая композиция предназначена для лечения и/или предотвращения тучности или ожирения.
28. Способ лечения и/или предотвращения заболевания, симптомы проявления которого лечат, подвергают воздействию с положительной динамикой, смягчают и/или предотвращают путем ингибирования ацил-кофермента А: диацилглицерин-ацилтрансферазы так, что подавляется синтез триглицеридов, включающий введение фармакологически эффективного количества соединения или его фармакологически приемлемой соли по любому из пп.1-18 теплокровному животному.
29. Способ по п.28, где заболевание представляет собой тучность, ожирение, гиперлипидемию, гипертриглицеридемию, липидоз, синдром инсулинорезистентности, нарушение толерантности к глюкозе, диабет, диабетические осложнения (включая диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическую ретинопатию и диабетическую макроангиопатию), катаракту, сахарный диабет у беременных, неалкогольный стеатогепатит, синдром поликистоза яичников, артериосклероз, атеросклероз, диабетический атеросклероз, ишемическую болезнь сердца или булимию.
30. Способ по п.28, где заболевание представляет собой тучность или ожирение.
31. Способ по любому из пп.28-30, где теплокровным животным является человек.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ИЗОХИНОЛИНКАРБОКСАМИДЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕАЗЫ ВИЧ | 2001 |
|
RU2265016C2 |
Авторы
Даты
2013-02-10—Публикация
2009-03-24—Подача