Изобретение относится к органической химии, точнее к получению кремнийорганических соединений, а именно алкинилсиланов, общей формулы R1 nSi(C≡CR')4-n, где n=1-3; R1=алкил; R'=алкил, арил, пропаргил, нашедших широкое применение в технологии тонкого органического синтеза.
Известен способ получения алкинилсиланов, основанный на взаимодействии галогенсиланов с алкинилидами меди (патент JP 09194485 А, МПК(6) C07F 7/08, B01J 23/06, B01J 27/138, B01J 31/02, B01J 31/24, C07B 61/00), требующих особой осторожности при обращении с ними и окисляющимися на воздухе, что вызывает необходимость использования инертной атмосферы.
Известен способ получения алкинилсиланов, основанный на взаимодействии галогенсиланов с 1-алкинами в присутствии металлического самария и соли цинка (патент JP 09194484 А, МПК(6) C07F 7/08, B01J 27/138, C07F 7/14 // C07B 61/00). Недостатками данного метода является использование дорогостоящего металлического самария и высокая длительность процесса.
Известен способ получения алкинилсиланов взаимодействием галогенсиланов с 1-алкинами в присутствии металлического цинка по схеме:
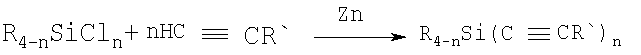
n=3, 2; R=R'=алкил, арил.
Реакция протекает в среде ацетонитрила при температуре 120°С при мольном соотношении 1-алкин: хлорсилан: цинк, равном 1:2:4, в течение 5 часов. Выходы алкинилсиланов достигают 60%, реакция осложняется образованием в качестве побочных продуктов значительных количеств алкенов [Sugita Н., Hatanaka Y., Hiyama Т./ Silylation of 1-alkynes with chlorosilanes promoted by zinc: preparation of alkynylsilanes in single step.// Tetrahedron Lett.-1995.-Vо1.36.-№16.-Р.2769-2772. Maeorg U., Viirlaid S., Hagu H., Verkruijsse H., Brandsma L./ On the in situ trimethylsilylation of zinc acetylides.// J. Organometall. Chem.-2000.-Vol 601.- P.341-342].
Известен способ электрохимического синтеза алкинилсиланов при электролизе смеси галогенсилана и 1-алкина с применением анода из алюминия или платины и электролита, состоящего из раствора тетрафенилбората тетрабутиламмония в 1,2-диметоксиэтане или пивалонитриле [Kunai A., Ohnishi О., Sakurai Т., Ishikawa M./ Electrolytic behavior of iodo- and chlorosilanes. The formation of Si-Si and Si-sp-C bonds.// Chem. Lett.- 1995.-P.1051-1052] по схеме:

a) R1=R2=Me,R3=Ph, X=Cl
б) R1=R2=Me,R3=Ph, X=J
в) R1=R2=R3=Et, X=Cl
г) R1=R2=R3=Et, X=J

а) R1=R2=Et, X=J
б) R1=Me, R2=Ph, Cl
Выходы алкинилтриорганосиланов достигают 91%, диалкинилдиорганосиланов 56%. Однако использование дорогостоящих электропроводящих солей и специфических растворителей делает этот способ малопригодным для широкого применения.
Наиболее близким аналогом является способ получения алкинилсиланов силилированием терминальных ацетиленов хлорсиланами в присутствии трифторметансульфоната цинка и триэтиламина. Реакция протекает в дихлорметане при 30°С в течение 15 часов и соотношении 1-алкин: трифлат цинка: хлорсилан: триэтиламин, равном 1,2:1,2:2:2 [Jiang H., Zhu S./ Silylation of 1-alkynes with chlorosilanes promoted by Zn(OTf)2: an efficient way to the preparation of alkynylsilanes.// Tetrahedron Lett.-2005.-vol.46.-P.517-519]. Использование малодоступного и дорогостоящего реагента - трифторметансульфоната цинка затрудняет широкое использование способа для практических целей, кроме того, отсутствуют сведения о возможности получения предлагаемым способом ди- и триалкинилсиланов.
Технической задачей заявляемого способа является разработка безопасного простого способа получения алкинилсиланов при одновременном снижении себестоимости получаемых продуктов путем использования более дешевых и доступных реагентов, а также расширение ассортимента получаемых продуктов.
Поставленная задача решается путем использования в реакции между галогенсиланом, общей формулы R1 nSiX4-n, и 1-алкином, общей формулы R'С≡СН эквимольных количеств галогенида цинка и третичного амина, при нагревании в среде органического растворителя при температуре его кипения в соответствии со схемой:
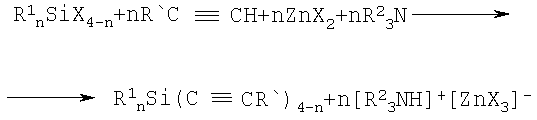
1) n=3; Х=Cl, Br, J; R1=СН3; R2=СН3СН2; R'=С6Н5 (1а).
2) n=3; Х=Br, J; R1=СН3; R2=СН3CH2; R'=С6Н5CH2ОCH2 (1б).
3) n=3; X=Br, J; R1=СН3; R2=СН3СН2; R'=СН3СН2СН2СН2 (1в).
4) n=2; X=Cl, J; R1=СН3; R2=СН3СН3; R'=С6Н5 (1г).
5) n=2; X=Cl, J; R1=СН3; R2=СН3СН2; R'=4-ВrС6Н4 (1д).
6) n=1; X=Cl, J; R1=СН3; R2=СН3СН2; R'=C6H5 (1e).
7) n=1; X=Cl, J; R1=СН3СН2; R2=СН3СН2; R'=С6Н5 (1ж).
Соотношении реагирующих веществ в случае использования моногалогенсилана - моногалогенсилан: 1-алкин: галогенид цинка: триэтиламин 1:1:1:1, при использовании дигалогенсиланов -дигалогенсилан: 1-алкин: галогенид цинка: триэтиламин 1:2:2:2, при использовании тригалогенсилана - тригалогенсилан: 1-алкин: галогенид цинка: триэтиламин 1:3:3:3. В качестве органического растворителя используют 1,4-диоксан, либо хлороформ, либо толуол.
Выход образующихся при этом алкинилсиланов общей формулы (1) составляет 56-98%, что обусловлено выбором галогенсилана и галогенида цинка.
Пример 1. Получение 1-триметилсилилфенилацетилена (1а).
В колбу, снабженную мешалкой и обратным холодильником, помещают 50 мл растворителя, в качестве которого используют абсолютный 1,4-диоксан, 0,1 моль (13,6 г) хлорида цинка 0,1 моль триметилхлорсилана и 0,1 моль (10,96 мл) фенилацетилена. Нагревают до 50°С и при перемешивании прибавляют 0,1 моль (14,3 мл) триэтиламина. Перемешивают при кипении растворителя 3 часа. После завершения реакции реакционную массу переносят в делительную воронку, содержащую 100 мл насыщенного раствора хлорида аммония. Органический слой отделяют, водный экстрагируют диэтиловым эфиром или хлороформом, объединенные органические фазы сушат над хлоридом кальция, растворитель упаривают на ротационном испарителе. Продукт выделяют перегонкой в вакууме.
Получен 1-триметилсилилфенилацетилен с выходом 72%, Ткип 65-66°С/3 мм рт.ст,
nD 201,5279.
ЯМР 1H (CDCl3, δ, м.д.):0,26 (с, 9Н); 7,27-7,32 (м, 3Н); 7,45-7,48 (м, 2Н). ЯМР 13С спектр (CDCl3): 0,08; 94,17; 105,21; 123,22; 128,29; 128,57; 132,06. Масс-спектр (ЭУ, 70эВ), m/z(Iотн(%)):174, (22) [М+]; 159, (100) [М+-15].
Пример 2. Получение 1-триметилсилилфенилацетилена (1a).
Получают аналогично примеру 1, используя 0,1 моль (10,86 г) триметилхлорсилана, 0,1 моль (22,52 г) бромида цинка, 0,1 моль фенилацетилена (10,2 г) и 0,1 моль (10,1 г) триэтиламина в 70 мл 1,4-диоксана. Выход 1-триметилсилилфенилацетилена 85% Ткип 65-66°С/3 мм рт.ст.
Пример 3. Получение 1-триметилсилилфенилацетилена (1а).
Получают аналогично примеру 1, используя 0,1 моль (15,3 г) триметилбромсилана, 0,1 моль (31,9 г) иодида цинка, 0,1 моль фенилацетилена (10,2 г) и 0,1 моль (10,1 г) триэтиламина в 70 мл 1,4-диоксана. Выход 1-триметилсилилфенилацетилена 92%. Ткип 65-66°С/3 мм рт.ст.
Пример 4. Получение 1-триметилсилилфенилацетилена (1а).
Получают аналогично примеру 1, используя 0,1 моль (20,0 г) триметилиодсилана, 0,1 моль (31,9 г) иодида цинка, 0,1 моль (10,2 г) фенилацетилена и 0,1 моль (10,1 г) триэтиламина в 70 мл 1,4-диоксана. Выход 1-триметилсилилфенилацетилена 98%. Ткип 65-66°С/3 мм рт.ст.
Пример 5. Получение бензилтриметилсилилпропаргилового эфира (16).
Получают аналогично примеру 1, используя 0,1 моль (15,3 г) триметилбромсилана, 0,1 моль (31,9 г) иодида цинка, 0,1 моль (14,6 г) бензилпропропаргилового эфира и 0,1 моль (10,1 г) триэтиламина в 70 мл 1,4-диоксана. Выход бензилтриметилсилилпропаргилового эфира 85%. Ткип 91-93°С/1 мм рт.ст., nD 201,4518, d4 20 0,9876.
ИК-спектр, см-1: 2959 (Csp-H), 2173 (C≡C), 1250 (Si-C).
ЯМР 1H (CDCl3, δ, м.д.): 0,10 (с, 9Н); 4,17 (с, 2Н); 4,60 (с,2Н); 7,28-7,37 (м, 5Н).
ЯМР 13С (СDСl3): -0,12; 57,81; 71,42; 91,45; 101,40; 127,67; 127,96; 128,24; 137,28.
Масс-спектр (ЭУ, 70эВ), m/z(Iотн(%)): 218, (14) [М+]; 203, (100) [М+-15];.
Пример 6. Получение 1-триметилсилилгексина (1в).
Получают аналогично примеру 1, используя 0,1 моль (15,3 г) триметилбромсилана, 0,1 моль (31,9 г) иодида цинка, 0,1 моль (8,2 г) гексина-1 и 0,1 моль (10,1 г) триэтиламина в 70 мл 1,4-диоксана. Выход 1-триметилсилилгексина 87%. Ткип 73-74°С/40 мм рт.ст., nD 201,4311.
ИК-спектр, см-1: 2960, 2935 (Csp3-H), 2177 (C≡C), 1249 (Si-C).
Масс-спектр (ЭУ, 70эВ), m/z(Iотн(%)): 154, (7) [М+], 139 (100) [М+-15].
Пример 7. Получение диметилдифенилэтинилсилана (1 г).
Получают аналогично примеру 1, используя 0,1 моль (12, 9 г) диметилдихлорсилана, 0,2 моль (63,8 г) иодида цинка, 0,2 моль (20, 4 г) фенилацетилена и 0,2 моль (20,2 г) триэтиламина в 150 мл 1,4-диоксана. Время нагревания 2 ч при температуре кипения растворителя. Выход диметилдифенилэтинилсилана 65%. Т. пл. 80°С (гексан).
ИК-спектр (КВr), ν/см-1: 2158 (С≡С); 1251 (Si-СН3).
ЯМР 1H (CDCl3, δ, м.д.): 0.50 (с, 6Н, Si(СН3)2); 7.29-7.54 (м., 10Н).
Масс-спектр (ЭУ, 70эВ), m/z(Iотн(%)): 260 [М+] (27), 245 [M+-Me] (98), 217 (10), 129 (31).
Пример 8. Получение диметилди(4-бромфенилэтинил)силана(1д).
Получают аналогично примеру 1, используя 0,1 моль 912,9 г) диметилдихлорсилана, 0,2 моль (63,8 г) иодида цинка, 0,2 моль (18,1 г) 4-бромфенилацетилена и 0,2 моль (20,2 г) триэтиламина в 150 мл 1,4-диоксана. Время нагревания 2 ч при температуре кипения растворителя. Выход диметилди(4-бромфенилэтинил)силана 67%. Т.пл. 170°С (гексан).
ИК-спектр (КВr), ν/см-1: 2158 (С≡С); 1249 (Si-СН3).
ЯМР 1Н (CDCl3, δ, м.д.):0.48 (с, 6Н, Si(СН3)2); 7.41 (д.д., 4Н).
ЯМР 13С (СDСl3): 0,46; 91,88; 104,90; 121,63; 123,42; 131,65; 133,63
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)):418 [М+] (8), 403 [М+-Ме] (98), 228 (7), 183 (9), 129 (8).
Пример 9. Получение метил-трис-фенилэтинилсилана (1e)
Получают аналогично примеру 1, используя 0,1 моль (14,94 г) метилтрихлорсилана, 0,3 моль (95,7 г) иодида цинка, 0,3 моль (30,6 г)фенилацетилена и 0,3 моль (30,3) триэтиламина в 250 мл 1,4-диоксана. Время нагревания 2 ч при температуре кипения растворителя. Выход метил-трис-фенилэтинилсилана 56%. Т.пл. 106°С (гексан).
ИК-спектр (КВr), ν/см-1: 2166 (С≡C); 1570,1485 (СAr-САr); 1223 (Si-СН3).
ЯМР 1H (СDСl3, δ, м.д.): 0,72 (с, 3Н); 7,29-7,37 (м, 3Н); 7,55-7,59 (м, 2Н).
ЯМР 13С (СDСl3): 1,64; 88,02,106,49; 122,33; 128,27; 129,24; 132,32.
Масс-спектр (ЭУ, 70 эВ), m/z (I отн (%)):346 [М+] (20), 331 [М+-Ме] (100), 319 (11), 241 (57), 199 (46).
Пример 10. Получение этил-трис-фенилэтинилсилана (1ж).
Получают аналогично примеру 1, используя 0,1 моль (16,35 г) этилтрихлорсилана, 0,3 моль (95,7 г) иодида цинка, 0,3 моль (30,6 г) фенилацетилена и 0,3 моль (30,3) триэтиламина в 250 мл 1,4-диоксана. Время нагревания 2 ч при температуре кипения растворителя. Выход этил-трис-фенилэтинилсилана 59%.
ИК-спектр (КВr), ν/см-1: 2166 (С≡С); 1570,1485 (CAr-СAr); 1223 (Si-СН3).
ЯМР 1H (CDCl3, δ, м.д., J Гц): 1,18 (кв, 7,65, 2Н); 1,37 (т, 7,26, 3Н); 7,41-7,44 (м, 9Н); 7,64-7,67 (м, 6Н)
ЯМР 13С (CDCl3): 7,00; 9,25; 87,13,106,86; 122,42; 128,31; 129,27; 132,39.
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 360 [М+] (21), 331 [M+-Et] (100), 244 (16), 230 (7).
Экспериментально было определено, что время реакции, необходимое для достижения максимального выхода целевого продукта, в каждом случае определяется природой и количеством атомов галогена в исходном галогенсилане и галогениде цинка. Влияние различных экспериментальных условий на выход целевого алкинилсилана представлено в таблице.
Влияние различных факторов на выход алкинилсиланов
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРИ- И ТЕТРАОРГАНИЛАЛКИНИЛОЛОВА | 2006 |
|
RU2317993C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДНОГО СОЕДИНЕНИЯ | 2008 |
|
RU2459820C2 |
| СПОСОБ ПОЛУЧЕНИЯ КАРБАМИДСОДЕРЖАЩИХ МЕРКАПТОСИЛАНОВ | 2015 |
|
RU2681218C2 |
| Карбамидсодержащие меркаптосиланы, способ их получения и их применение | 2015 |
|
RU2678701C2 |
| Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения | 2019 |
|
RU2716597C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛОНОВ, СПОСОБ ПОЛУЧЕНИЯ И БИОЛОГИЧЕСКИЕ ПРИМЕНЕНИЯ | 2008 |
|
RU2491283C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОНИЕВЫХ СОЛЕЙ С ТЕТРАФТОРБОРАТНЫМ АНИОНОМ, ИМЕЮЩИХ НИЗКОЕ СОДЕРЖАНИЕ ГАЛОГЕНИДОВ | 2005 |
|
RU2415843C2 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДНОГО СОЕДИНЕНИЯ | 2008 |
|
RU2451681C2 |
| ПОЛИЦИКЛИЧЕСКИЕ ТИАЗОЛИДИН-2-ИЛИДЕНОВЫЕ АМИНЫ, СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА И СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА | 1999 |
|
RU2236405C2 |
| Производные 2-(пирано[3,2-c]хромен-5-ил)уксусной кислоты и способ их получения | 2021 |
|
RU2775546C1 |
Изобретение относится к получению алкинилсиланов общей формулы
R1 nSi(C≡CR')4-n, где n=1-3; R1=алкил; R'=алкил, арил, оксиалкил, нашедших широкое применение в технологии тонкого органического синтеза. Техническая задача - разработка безопасного простого способа получения алкинилсиланов при одновременном снижении себестоимости получаемых продуктов путем использования более дешевых и доступных реагентов. Предложено в реакции между галогенсиланом, общей формулы R1 nSiX4-n, и 1-алкином, общей формулы R'C=CH, использовать эквимольные количества галогенида цинка и третичного амина и вести процесс при нагревании в среде органического растворителя при температуре его кипения в соответствии со схемой:
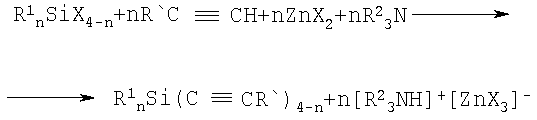
1) n=3; X=Cl, Br, J; R1=СН3; R2=СН3СН2; R'=С6Н5. 2) n=3; X=Br, J; R1=СН3; R2=СН3СН2; R'=C6H5CH2OCH2. 3) n=3; X=Br, J; R1=СН3; R2=СН3СН2; R'=СН3СН2СН2СН2. 4) n=2; X=Cl, J; R1=СН3; R2=СН3СН3; R'=С6Н5. 5) n=2; X=Cl, J; R1=СН3; R2=CH3CH2; R'=4-ВrС6Н4. 6) n=1; X=Cl, J; R1=СН3; R2=CH3CH2; R'=С6Н5. 7) n=1; X=Cl, J; Rl=CH3CH2; R2=CH3CH2; R'=С6Н5. 4 з.п. ф-лы, 1 табл.
1. Способ получения алкинилсиланов общей формулы
R1 nSi(C≡CR')4-n,
где R1 - низший алкил; R' - фенил, 4-бромфенил, н-бутил, бензилоксиметил, n=1-3, взаимодействием галогенсилана с 1-алкинами в присутствии третичного амина и соли цинка, отличающийся тем, что взаимодействие галогенсилана с 1-алкином проводят в присутствии третичного алифатического амина и галогенида цинка в среде органического растворителя при температуре его кипения в соответствии со схемой:
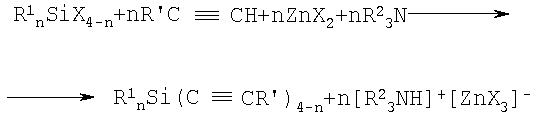
1) n=3; X=Cl, Br, J; R1=CH3; R2=CH3CH2; R'=С6Н5.
2) n=3; X=Br, J; R1=CH3; R2=CH3CH2; R'=C6H5CH2OCH2.
3) n=3; X=Br, J; R1=CH3; R2=CH3CH2; R'=СН3СН2СН2СН2.
4) n=2; X=Cl, J; R1=CH3; R2=CH3CH2; R'=С6Н5.
5) n=2; X=Cl, J; R1=СН3; R2=СН3CH2; R'=4-ВrС6Н4.
6) n=1; X=Cl, J; R1=СН3; R2=CH3CH2; R'=С6Н5.
7) n=1; X=Cl, J; Rl=CH3CH2; R2=CH3CH2; R'=С6Н5.
2. Способ по п.1, отличающийся тем, что в качестве галогенсилана используют триметилхлорсилан, или триметилбромсилан или триметилиодсилан, а в качестве галогенида цинка - хлорид цинка или бромид цинка, или иодид цинка при мольном соотношении реагирующих веществ галогенсилан : 1-алкин : галогенид цинка : третичный амин соответственно 1:1:1:1.
3. Способ по п.1, отличающийся тем, что в качестве галогенсилана используют диметилдихлорсилан, а в качестве галогенида цинка - хлорид цинка или бромид цинка, или иодид цинка при мольном соотношении реагирующих веществ галогенсилан : 1-алкин : галогенид цинка : третичный амин соответственно 1:2:2:2.
4. Способ по п.1, отличающийся тем, что в качестве галогенсилана используют метилтрихлорсилан, а в качестве галогенида цинка - хлорид цинка или бромид цинка, или иодид цинка при мольном соотношении реагирующих веществ галогенсилан : 1-алкин : галогенид цинка : третичный амин соответственно 1:3:3:3.
5. Способ по пп.1-4, отличающийся тем, что в качестве органического растворителя используют 1,4-диоксан, либо хлороформ, либо толуол.
| Huiling Jiang, Shizheng Zhu «Silylation of 1-alkynes with chlorosilanes promoted by Zn(OTf): an efficient way to the preparation of alkynylsilanes» | |||
| Tetrahedron Letters, 2005, vol.46, p.517-519 | |||
| Atsutaka Kunai et al | |||
| «Electrolytic behavior of iodo- and chlorosilanes | |||
| The formation of Si-Si and Si-sp-C bonds» | |||
| Chemistry |
Авторы
Даты
2009-09-27—Публикация
2008-07-28—Подача