Изобретение относится к полициклическим тиазолидин-2- илиденовым аминам, а также к их физиологически приемлемым солям и физиологически функциональным производным.
Из уровня техники известны производные тиазолидина с понижающим аппетит действием (австрийский патент №365181).
Задачей изобретения является создание соединений, оказывающие терапевтически применимое понижающее аппетит действие. В этой связи задача, в частности, состоит в том, чтобы получить соединения, понижающее аппетит, действие которых повышено по сравнению с соединениями из патента AT 365181.
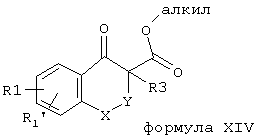
Данное изобретение таким образом относится к полициклическим тиазолидин-2- илиденовым аминам формулы I
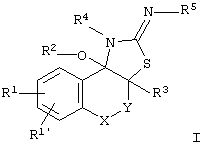
где означают
А)
Y - простая связь, -CH2-, -CH2-CH2-;
Х - СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 - CN, СООН, СОО(С1-С6)алкил, CONH2, CONH(C1-C6)-алкил, CON[(С1-С6)алкил]2, (C2-C6)-алкил; (С2-С6)-алкенил; (С2-С6)-алкинил; O-СН2СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2Ph, NH2 или N(COOCH2Ph)2;
S-(С1-С6)-алкил, S-(СН2)n-фенил, SO-(C1-C6)-алкил, SO-(СН2)n-фенил, SO2-(C1-C6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, Cl, Вr, ОН, СF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (С1-С6)-алкилом или NH2; NH2, NH-(C1-С6)-алкил, N((С1-С6)-алкил)2, NН(С1-С7)-ацил, фенил, бифенил, O-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, бифенильные, нафтильные, пиридильные, фуранильные или тиенильные циклы каждый может быть от одного до 3 раз замещен F, Cl, Br, J, ОН, СF3 NO2, CN, ОСF3, O-(С1-С6)-алкилом, (C1-C6)-алкилом, NH2, NH-(C1-С6)-алкилом, N((C1-C6)-алкилом)2, SO2-СН3, СООН, COO-(C1-С6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R1’ - Н, F, Cl, Br, J, СН3, СF3, О-(C1-С3)-алкил, NO2, SO2-NH2, SO2NH-(C1-C6)-алкил, SO2N[(C1-C6)-алкил]2 или R1;
R2 - Н, (С1-С6)-алкил, (С3-C6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, С(O)-(СН2)n-фенил, С(O)-(СН2)n-тиенил, С(О)-(СН2)n-пиридил, С(O)-(СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(С1-С6)-алкилом, С(О)-(C1-C6)-алкил, С(О)-(С3-С6)-циклоалкил;
R3 - Н, (C1-C6)-алкил, F, CN, N3, О-(C1-C6)-алкил, CH2-COO(C1-С6 алкил), СН2-СОО(С3-С8 циклоалкил), СН2-СООН, CH2-CONH2, СН2-СОNНСН3, СН2-СОN(СН3)2, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом, (С2-С6)-алкинил, (С2-С6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5 и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
R5 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
или
R4 и R5 вместе образуют группу - СН2-СН2-, - СН2-С(СН3)2, -СН2-СН2-СН2- или -СН2-СН2-СН2-СН2-;
или
В)
Y - простая связь, -СН2- или -СН2-СН2-;
Х - СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 и Rl’ независимо друг от друга
Н, F, Cl, Br, J, NO2, CN, COOH, COO(C1-C6) алкил, CONH2, СОNН(С1-С6)алкил, CON[(C1-C6)алкил]2, (C1-C6)-алкил; (С2-С6)-алкенил; (С2-С6)-алкинил; О-(C1-С6)-алкил, О-СH2СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(О)СН3, O-CH2Ph, NH2 или N(COOCH2Ph)2;
S-(C1-C6)-алкил, S-(СН2)n-фенил, SO-(C1-C6)-алкил, SO-(СН2)n-фенил, SO2-(C1-C6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, Сl, Вr, ОН, СF3, NO2, CN, ОСF3, О-(C1-С6)-алкилом, (С1-С6)-алкилом, NH2; SO2-NH2, SO2NH-(C1-С6)-алкил, SO2N[(C1-С6)-алкил]2, NH2, NH-(C1-С6)-алкил, N((C1-C6)-алкил)2, NН(С1-С7)-ацил, фенил, бифенил, О-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, бифенильные, нафтильные, пиридильные, фуранильные или тиенильные циклы каждый может быть от одного до 3 раз замещен F, Cl, Br, J, ОН, СF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (C1-C6)-алкилом, NH2, NH-(C1-C6)-алкилом, N((C1-C6)-алкилом)2, SО2-СН3, СООН, COO-(C1-C6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - Н, (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, С(O)-(СН2)n-фенил, С(О)-(СН2)n-тиенил, С(О)-(СН2)n-пиридил, С(O)-(СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(C1-C6)-алкилом, С(О)-(C1-C6)-алкил, С(О)-(С3-С6)-циклоалкил;
R3 - (С4-С6)-алкил, F, CN, N3, О-(C1-С6)-алкил, CH2-COO(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), CH2-COOH, CH2-CONH2, СН2-СONНСН3, СН2-СОN(СН3)2, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, O-(C1-С6)-алкилом, (С2-С6)-алкинил, (С2-С6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(O)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (С1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом;
R5 - (C1-C6) - алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом; или
R4 и R5 вместе образуют группу -СН2-СН2-, - СН2-С(СН3)2,
-СН2-СН2-СН2- или - СН2-СН2-СН2-СН2-;
или
С)
Y - простая связь, - СН2- или – СН2-СН2-;
Х - СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 и R1’ независимо друг от друга H, F, Cl, Br, J, NO2, CN, COOH, COO(C1-C6) алкил, CONH2, СОNН(С1-С6)алкил, CON[(C1-C6)алкил]2, (C2-C6)-алкил; (С1-С6)-алкенил; (C2-C6)-алкинил; O-(C1-C6)-алкил, О-СН2-СF3, O-CH2-CF2-CF3, O-(C4-C6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOCH2Ph)2;
S-(С1-С6)-алкил, S-(СН2)n-фенил, SO-(C1-С6)-алкил, SO-(СН2)n-фенил, SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, C1, Вr, ОН, CF3, NO2, CN, OCF3, O-(C1-C6)-алкилом, (С1-С6)-алкилом, NH2; SO2-NH2, SO2NH-(C1-C6)-алкил, SO2N[(С1-С6)-алкил]2, NH2, NH-(C1-C6)-алкил, N((C1-C7)алкил)2, NH(C1-C7)-ацил, фенил, бифенил, О-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, бифенильные, нафтильные, пиридильные, фуранильные или тиенильные циклы каждый может быть от одного до 3 раз замещен F, Cl, Br, J, ОН, СF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (C1-С6)-алкилом, NH2, NН-(С1-С6)-алкилом, N((C1-С6)-алкилом)2, SO2-СН3, СООН, СОО-(C1-С6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (C2-C8)-алкенил, (С2-С8)-алкинил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, С(O)-(СН2)n-фенил, С(O)-(СН2)n-тиенил, С(O)-(СН2)n-пиридил, С(O)-(СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, O-(С1-С6)-алкилом, С(О)-(C1-C6)-алкил, С(О)-(С3-С6)-циклоалкил;
R3 - Н, (C1-C6)-алкил, F, CN, N3, О-(C1-C6)-алкил, CH2-COO(C1-С6 алкил), СН2-СОО(С3-С8 циклоалкил), СН2-СООН, СН2-CONH2, СН2-СОNНСН3, CH2-CON(СН3)2, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом, (С2-С6)-алкинил, (С2-С6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом;
R5 - (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен C1, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом;
или
R4 и R5 вместе образуют группу – CH2-CH2-, - СН2-С(СН2)2, -CH2-CH2-CH2- или -СН2-СН2-СН2-СН2-;
или D)
Y - простая связь, -СН2- или -СН2-СН2-;
Х - СН(фенил), причем фенильный остаток может быть замещен F, C1, Вг или J,
О, S, SO, SO2 или N-R6;
R1 и R1’ независимо друг от друга
Н, F, Cl, Br, J, NO2, CN, СООН, СОО(С1-С6) алкил, CONH2, CONH(C1-C6) алкил, CON[(C1-C6)алкил]2, (C1-C6)-алкил; (С2-С6)-алкенил; (С2-С6)-алкинил; О-(C1-C6)-алкил, O-СН2-СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOCH2Ph)2;
S-(C1-C6)-алкил, S-(СН2)n-фенил, SO-(C1-C6)-алкил, SO-(СН2)n-фенил, SO2-(C1-С6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, C1, Br, ОН, СF3, NO2, CN, ОСF3, O-(C1-C6)-алкилом, (С1-С6)-алкилом, NH2; SO2-NH2, SO2NH-(C1-C6)-алкил, SO2N[(С1-С6)-алкил]2, NH2, NH-(C1-C6)-алкил, N((C1-С6)-алкил)2, NH(C1-C7)-ацил, фенил, бифенил, O-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, бифенильные, нафтильные, пиридильные, фуранильные или тиенильные циклы каждый может быть от одного до 3 раз замещен F, Cl, Br, J, ОН, СF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (C1-C6)-алкилом, NH2, NH-(С1-С6)-алкилом, N((С1-С6)-алкилом)2, СООН, COO-(C1-С6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - Н, (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, С(O)-(СН2)n-фенил, С(О)-(СН2)n-тиенил, С(О)-(СН2)n-пиридил, С(O)-(СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен С1, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(C1-C6)-алкилом, С(О)-(C1-С6)-алкил, С(О)-(С3-С6)-циклоалкил;
R3 - Н, (C1-C6)-алкил, F, CN, N3, О-(C1-C6)-алкил, CH2-COO(C1-С6 алкил), СН2-СОО(С3-С8 циклоалкил), СН2-СООН, CH2-CONH2, СН2-СОNНСН3, CH2-CON(СН3)2, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом, (С2-С6)-алкинил, (C2-C6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (С1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6) - алкилом;
R5 - (С1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, (СН2)n-фурил, причем n=0-5, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом;
или
R4 и R5 вместе образуют группу -СН2-СН2-, -СН2-С(СН3)2,
-СН2-СН2-СН2- или -СН2-СН2-СН2-СН2-;
R6 - SO2-(С6Н4-4-СН3);
или
Е)
Y - простая связь, -СН2- или -СН2-СН2-;
Х - СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 - Н, F, Cl, Br, J, СН3, СF3, О-(C1-С3)-алкил;
R1’ - Н, F, Cl, Br, J, NO2;
R2 - Н;
R3 - Н, (С1-С3)-алкил;
R4 - фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, Br, J, (C1-C6)-алкилом, (С3-С6)-циклоалкилом, О-(С1-С3)-алкилом, СF3, ОСF3, О-СН2-фенилом, СООН, СОО-(C1-C6)-алкилом, СОО(С3-С6)-циклоалкилом, CONH2;
R5 - фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, Br, J, (С1-С6)-алкилом, (С3-С6)-циклоалкилом, O-(С1-С3)-алкилом, СF3, ОСF3, O-СН2-фенилом, СООН, COO-(C1-C6)-алкилом, СОО(С3-С6)-циклоалкилом, CONH2;
а также их физиологически приемлемые соли и физиологически функциональные производные.
Предпочтительными являются соединения формулы I, где
означают:
А)
Y - простая связь, -CH2-;
Х - СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 - CN, СООН, СОО(С1-С6)алкил, CONH2, CONH(C1-C6)-алкил, CON[(С1-С6)алкил]2, (C2-C6)-алкил; (С2-С6)-алкенил; (С2-С6)-алкинил; O-СН2СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2Ph, NH2 или N(COOCH2Ph)2;
S-(С1-С6)-алкил, S-(СН2)n-фенил, причем фенильный остаток до двух раз может быть замещен F, Cl, Вr, ОН, СF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (С1-С6)-алкилом; NH-(C1-C6)-алкил, N((С1-С6)-алкил)2, NH(C1-C7)-ацил, фенил, О-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные циклы каждый может быть от одного до 3 раз замещен F, Cl, J, ОН, CF3, CN, ОСF3, О-(C1-С6)-алкилом, (C1-C6)-алкилом, NH2, NН-(С1-С6)-алкилом, N((C1-С6)-алкилом)2, СООН, СОО-(С1-С6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
Rl’ - Н, F, Cl, Br, J, СН3, СF3, О-(C1-С3)алкил, SO2-NH2, SO2NН-(С1-С6)-алкил, SO2N[(С1-С6)-алкил)2 или R1;
R2 - Н, (C1-C6)-алкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, С(O)-(СН2)n-фенил, С(О)-(СН2)n-тиенил, С(O)-(СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
R3 - Н, (C1-C6)-алкил, F, CN, O-(С1-С6)-алкил, CH2-COO(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), CH2-COOH, CH2-CONH2, CH2-CONHCH3, СН2-СОN(СН3)2, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом, (C2-C6)-алкинил, (С2-С6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, C(O)NH2, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(C1-С6)-алкилом;
R5 - (C1-С6)-алкил, (С3-C6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
или
R4 и R5 вместе образуют группу –СН2-СН2-, -СН2-С(СН3)2- или
-СН2-СН2-СН2-;
или
В)
Y - простая связь, - СН2-;
Х – СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 и Rl’ независимо друг от друга
Н, F, Cl, Br, J, CN, СООН, СОО(С1-С6) алкил, CONH2, CONH(C1-C6) алкил, CON[(С1-С6)алкил]2, (C1-C6)-алкил; (С2-С6)-алкенил; (C2-C6)-алкинил; О-(C1-С6)-алкил, О-СН2-СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOCH2Ph)2;
S-(C1-C6)-алкил, S-(СН2)n-фенил, SO-(C1-С6)-алкил, SO-(СН2)n-фенил, причем фенильный остаток до двух раз может быть замещен F, Сl, Вr, ОН, СF3, NO2, CN, ОСF3, О-(C1-C6)-алкилом, (C1-С6)-алкилом; SO2-NH2, SO2NH-(C1-С6)-алкил, SO2N[ (С1-С6)-алкил]2, NH-(С1-С6)-алкил, N((C1-С6)-алкил)2, NH(C1-C7)-ацил, фенил, О-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца каждое может быть от одного до 3 раз замещено F, Cl, J, ОН, СF3, CN, ОСF3, О-(C1-C6)-алкилом, (C1-C6)-алкилом, NH2, NH-(C1-C6)-алкилом, N((C1-C6) - алкилом)2, СООН, COO-(C1-C6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - Н, (C1-C6)-алкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, С(О)-(СН2)n-фенил, С (О)-(СН2)n-тиенил, С(O)-(СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, O-(C1-C6)-алкилом;
R3 - (С4-С6)-алкил, F, CN, N3, O-(C1-C6)-алкил, CH2-COO(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), СН3-СООН, CH2-CONH2, CH2-CONHCH2, СН2-СОN(СН3)2, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(С1-С6)-алкилом, (С2-С6)-алкинил, (С2-С6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(C1-C6) - алкилом;
R5 - (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
или
R4 и R5 вместе образуют группу - СН2-СН2-, - СН2-С(СН3)2- или
-СН2-СН2-СН2-;
или
С)
Y - простая связь или – CH2-;
Х - СН2, СН(СН3), СН(С2Н5), СН(С3Н7);
R1 и R1’ независимо друг от друга
H, F, Cl, Br, J, CN, COOH, COO (C1-C6) алкил, CONH2, CONH(C1-C6) алкил, CON[(С1-С6)алкил]2, (C1-C6)-алкил, (C2-С6)-алкенил, (С2-С6)-алкинил, O-(C1-C6) - алкил, O-СН2-СF3, O-CH2-CF2-CF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород (ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOСН2Рh)2;
S-(C1-С6)-алкил, S-(СН2)n-фенил, SO2-(C1-C6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, Cl, Вr, ОН, CF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (C1-C6)-алкилом; SO2-NH2, SO2NH-(C1-C6)-алкил, SO2Н[(С1-С6)-алкил]2, NH-(C1-C6)-алкил, N((С1-С6)алкил)2, NH(C1-C7)-ацил, фенил, O-(СН2)n-фенил, причем n=0-4, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца каждое может быть от одного до 3 раз замещено F, Cl, J, ОН, CF3, CN, OCF3, О-(C1-C6)-алкилом, (С1-С6)-алкилом, NH2, NH-(С1-С6)-алкилом, N((C1-C6)-алкилом)2, СООН, COO-(C1-C6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - (C1-C6)-алкил, (С2-С8)-алкенил, (С2-С8)-алкинил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, С(О)-(СН2)n-фенил, С(O)-(СН2)n-тиенил, С(O)(СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(С1-С6)-алкилом;
R3 - Н, (С1-С6)-алкил, F, CN, О-(C1-С6)-алкил, CH2-COO(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), СН2-СООН, CH2-CONH2, СН2-СОNНСН3, СН2-СОN(СН3)2, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен С1, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(C1-C6)-алкилом, (С2-С6)-алкинил, (С2-С6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, C(O)NH2, С(O)N(СН3)2, ОС(O)СН3;
R4 - (С1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Сl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом;
R5 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, CF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
или
R4 и R5 вместе образуют группу - СН2-СН2-, - СН2-С(СН3)2- или
-СН2-СН2-СН2-;
или
D)Y - простая связь, - СН2-;
X - СН(фенил), причем фенильный остаток может быть замещен F, Cl или Вr,
О, S, SO, SO2 или N-R6;
R1 и Rl’ независимо друг от друга
Н, F, Cl, Br, J, CN, COOH, COO (C1-C6) алкил, CONH2, CONH(C1-C6) алкил, CON[(C1-C6)алкил]2, (C1-C6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, О-(C1-С6)-алкил, О-СН2-СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N (COOCH2Ph)2;
S-(C1-C6)-алкил, S-(СН2)n-фенил, SO2-(C1-C6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, Cl, Br, ОН, CF3, NO2, CN, ОСF3, О-(С1-С6)-алкилом, (C1-C6)-алкил ом; SO2-NН2, SO2NH(C1-C6)-алкил, SO2N[(С1-С6)-алкил]2, NH2, NH-(C1-C6)-алкил, N((С1-С6 )-алкил)2, NH(C1-C7)-ацил, фенил, O-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца каждое может быть от одного до 3 раз замещено F, Cl, J, ОН, СF3, CN, ОСF3, O-(C1-C6)-алкилом, (C1-C6)-алкилом, NH2, NH-(C1-C6)-алкилом, N((С1-С6)-алкилом)2, COOH, COO-(C1-C6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - Н, (C1-С6)-алкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, С(O)-(СН2)n-фенил, С(O)-(СН2)n-тиенил, С(O)-(СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
R3 - Н, (C1-C6)-алкил, F, CN, О-(C1-C6)-алкил, CH2-COO(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), СН2-СООН, CH2-CONH2, СН2-СОNНСН3, СН2-СОN(СН3)2, (CH2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(C1-C6)-алкилом, (С2-С6)-алкинил, (С2-С6)-алкенил, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, С(O)NН2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
R5 - (C1-С6)-алкил, (С3-C6)-циклоалкил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
или
R4 и R5 вместе образуют группу –CH2-CH2-, - CH2-C(СН3)2- или -CH2-CH2-CH2-;
R6 - SO2-(С6Н4-4-СН3);
или
Е)
Y - простая связь или - СН2-;
Х - СН2, СН(СН3), СН(С2Н5), СН(С3Н7);
R1 - Н, F, Cl, Br, J, СН3, СF3, О-(C1-С3)-алкил;
R1’ - Н, F, Cl, Br, J;
R2 - Н;
R3 - Н, (C1-С3) - алкил;
R4 - фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, Br, J, (C1-C6)-алкилом, (С3-С6) – циклоалкилом, О-(C1-С3)-алкилом, СF3, ОСF3, O-СН2-фенилом,
СООН, СОО-(С1-С6)-алкилом, CONH2;
R5 - фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, Br, J, (C1-C6)-алкилом, (С3-С6)-циклоалкилом, О-(C1-С3)-алкилом, СF3, ОСF3, O-СН2-фенилом, СООН, СОО-(С1-С6)-алкилом, CONH2;
а также их физиологически приемлемые соли и физиологически функциональные производные.
Особенно предпочтительными являются соединения формулы I, где означают
А)
Y - простая связь;
Х - СН2, СН(СН3), СН(С2Н5), СН(С3Н7);
R1 - CN, СООН, СОО(С1-С6) алкил, CONH2, CON[(C1-C6)алкил]2, (C2-C6)-алкил; (С2-С6)-алкенил; (С2-С6)-алкинил; O-CH2-СF3, О-СН2-СF2-СF3, О-(С4-С6) - алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(СООСН2Рh)2;
S-(С3-С6) - алкил, S-(СН2)n-фенил, SO-(C1-C6)-алкил, SO-(СН2)n-фенил, причем фенильный остаток до двух раз может быть замещен F, Cl, Вr, ОН, CF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (С1-С6)-алкилом; NH-(C1-С6)-алкил, N((С1-С6)-алкил)2, NН(С3-С7)-ацил, фенил, О-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца каждое может быть от одного до 2 раз замещено F, C1, ОН, СF3, CN, ОСF3, O-(С1-С6)-алкилом, (C1-C6)-алкил ом, СООН, COO-(C1-C6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R1’ - Н, F, C1, СН3, СF3, O-(С1-С3)алкил, SO2NH2, SO2NH-(C1-С6)-алкил, SO2N[(C1-C6)-алкил]2 или Rl;
R2 - Н, (C1-C6)-алкил, (СН2)n-фенил, (СН2)n-пиридил, С(O)-(СН2)n-фенил, С(О)-(СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-C6)-алкилом;
С(О)-(C1-C6)-алкил;
R3 - Н, (C1-C6)-алкил, F, CN, О-(C1-C6)-алкил, CH2-COO(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), CH2-COOH, CH2-CONH2, СН2-СОNНСН3, СН2-СОN(СН3)2, (СН2)n-фенил, (СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, O-(C1-C6)-алкилом, (С2-С6)-алкинил, С(O)ОСН3, С(O)ОСН2СН3, С(O)ОН, C(O)NH2, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-С6)-алкилом;
R5 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (CH2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-C6)-алкилом;
или
R4 и R5 вместе образуют группу –СН2-СН2-, - СН2-С(СН3)2- или
-СН2-СН2-СН2-;
или
В)
Y - простая связь, -CH2-;
Х - CH2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 и Rl’ независимо друг от друга
Н, F, Cl, Br, J, CN, СООН, COO (C1-C6) алкил, CONH2, CON[(С1-С6)алкил]2, (C1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, O-(С1-С6)-алкил, O-СН2-СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOCH2Ph)2;
S-(C1-С6)-алкил, S-(СН2)n-фенил, SO-(C1-С6)-алкил, SO-(СН2)n-фенил, причем фенильный остаток до двух раз может быть замещен F, C1, ОН, СF3, ОСF3, O-(С1-С6)-алкилом, (C1-С6)-алкилом; SO2-NH2, SO2NH-(C1-С6)-алкил, SO2N[(С1-С6)-алкил]2, N((C1-C6)-алкил)2, NH(C1-C7)-ацил, фенил, О-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца каждое может быть от одного до 3 раз замещено F, Cl, J, ОН, СF3, CN, ОСF3, О-(C1-C6)-алкилом, (C1-С6)-алкилом, NH2, N((C1-C6)-алкилом)2, СООН, COO-(C1-C6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - Н, (C1-С6)-алкил, (СН2)n-фенил, (СН2)n-пиридил, С(O)-(СН2)n-фенил, С(О)-(СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (С1-С3)-алкилом, ОН, О-(C1-C6)-алкилом, С(О)-(C1-C6)-алкил;
R3 - (С4-С6)-алкил, F, CN, N3, О-(C1-C6)-алкил, СН2-СОО(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), СН2-СООН, CH2-CONH2, СН2-СОNНСН3, СН2-СОN(СН3)2, (СН2)n-фенил, (СН3)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, O-(C1-С6)-алкилом, (С2-С6)-алкинил, С(O)ОСН3, С(O)ОСН2СН3, С(O)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-С6)-алкилом;
R5 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-С6)-алкилом;
или R4 и R5 вместе образуют группу - СН2-СН2-, -СН2-С(СН3)2- или
-СН2-СН2-СН2-;
или
С)
Y - простая связь или -CH2-;
Х - СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 и R1’ независимо друг от друга
Н, F, Cl, Br, J, CN, СООН, COO (C1-C6) алкил, CONH2, СОNН[(С1-С6)алкил]2, (C1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, O-(С1-С6)-алкил, O-СН2-СF3, O-СН2-СF2-СF3, О-(С4-С6) - алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(СООСН2Ph)2;
и
S-(C1-C6)-алкил, S-(СН2)n-фенил, SO2-(C1-C6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, Cl, Вr, ОН, СF3, NO2, ОСF3, O-(С1-С6)-алкилом, (C1-C6)-алкилом; SO2-NH2, SO2NH-(C1-C6)-алкил, SO2N[(C1-С6)-алкил]2, N((С1-С6)алкил)2, NH(C1-C7)-ацил, фенил, О-(СН2)n-фенил, причем n=0-4, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца каждое может быть от одного до 3 раз замещено F, Cl, J, ОН, СF3, CN, ОСF3, О-(C1-C6)-алкилом, (C1-C6)-алкилом, NH2, NH-(C1-C6)-алкилом, N((C1-С6)-алкилом)2, СООН, СОО-(С1-С6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - (C1-C6) - алкил, (C2-C8)-алкенил, (С2-С8)-алкинил, (СН2)n-фенил, (СН2)n-тиенил, (СН2)n-пиридил, С (О)-(СН2)n-фенил, С(O)-(СН2)n-тиенил, С (O)-(СН2)n-пиридил, причем n=0-3, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-С6)-алкилом; С(O)-(С1-С6)-алкил;
R3 - Н, (C1-С6)-алкил, F, CN, О-(C1-C6)-алкил, CH2-COO(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), СН2-СООН, СН2-СОNН2, СН2-СОNНСН3, СН2-СОN(СН3)2, (СН2)n-фенил, (СН2)-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, O-(C1-С6)-алкилом, (С2-С6)-алкинил, С(O)ОСН3, С(O)ОСН2СН3, С(O)ОН, C(O)NH2, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (CH2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-C6)-алкилом;
R5 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (CH2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-С6)-алкилом;
или R4 и R5 вместе образуют группу - CH2-CH2-, - СН2-С(СН3)2- или
-СН2-СН2-СН2-;
или
D)
Y - простая связь или –СН2-;
Х - СН(фенил), причем фенильный остаток может быть замещен
F или С1,
О, S, SO2 или N-R6;
R1 и R1’ независимо друг от друга
Н, F, Cl, Br, J, CN, СООН, COO(C1-C6) алкил, CONH2, CON[(С1-С6)алкил]2, (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, O-(С1-С6)-алкил, O-СН2-СF3, O-CH2-CF2-CF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, О-СН2-Рh, NH2 или N(COOCH2Ph)2;
S - (C1-C6)-алкил, S-(СН2)n-фенил, SO2-(C1-C6)-алкил, SO2-(СН2)n-фенил, причем n=0-6, и фенильный остаток до двух раз может быть замещен F, Cl, Вr, ОН, CF3, NO2, CN, ОСF3, O-(С1-С6)-алкилом, (C1-C6)-алкилом; SO2-NH2, SO2NH(C1-C6)-алкил, SO2NH[(C1-С6)-алкил]2, NH2, N((C1-C6)-алкил)2, NН(С1-С7)-ацил, фенил, O-(СН2)n-фенил, причем n=0-6, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца каждое может быть от одного до 3 раз замещено F, Cl, J, ОН, CF3, CN, ОСF3, О-(C1-C6)-алкилом, (C1-С6)-алкилом, NH2, N((C1-С6)-алкилом)2, СООН, COO-(C1-C6)-алкилом, CONH2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензилом;
тетразол-5-ил, причем тетразольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 – Н, (С1-С6)-алкил, (СН2)n-фенил, (СН2)n-тиенил, (CH2)n-пиридил, С(O)-(СН2)n-фенил, С(О)-(СН2)n-тиенил, С(O)-(CH2)n-пиpидил, причем n=0-3, и где фенил, тиенил, пиридил, фурил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, ОН, О-(C1-C6)-алкилом;
С(О)-(C1-C6)-алкил;
R3 - Н, (C1-C6)-алкил, F, CN, О-(C1-С6)-алкил, СН2-СОО(C1-C6 алкил), СН2-СОО(С3-С8 циклоалкил), CH2-COOH, CH2-CONH2, CH2-CONHCH3, СН2-СОN(СН3)2, (СН2)n-фенил, (CH2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Сl, F, CN, СF3, (C1-С6)-алкилом, O-(C1-С6)-алкилом, (С2-С6)-алкинил, С(O)ОСН3, С(O)ОСН2СН3, С(O)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, ОС(O)СН3;
R4 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-C6)-алкилом;
R5 - (C1-С6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, (СН2)n-пиридил, причем n=0-3, и где фенил, пиридил каждый может быть до двух раз замещен Cl, F, CN, СF3, (C1-С3)-алкилом, О-(C1-С6)-алкилом;
или
R4 и R5 вместе образуют группу - CH2-CH2-, - CH2-C(CH3)2- или
-СН2-СН2-СН2-;
R6 - SO2-(С6Н4-4-СН3);
или
Е)
Y - простая связь или - СН2-;
Х - СН2, СН(СН3), CH(C2H5), СН(С3Н7);
R1 - Н, F, Cl, СНз, СF3, O-(С1-С3)-алкил;
R1’ - Н, F, C1;
R2 - Н;
R3 - Н, (С1-С3)-алкил;
R4 - фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, (C1-C6) - алкилом, (С3-С6)циклоалкилом, O-(C1-С3)-алкилом, СF3, ОСН2-фенилом, СООН, СОО-(С1-С6)-алкилом, CONH2;
R5 - фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, (C1-C6)-алкилом, (С3-С6) - циклоалкилом, O-(C1-С3)-алкилом, СF3, ОСН2-фенилом, СООН, COO-(C1-C6)-алкилом, CONH2;
а также их физиологически приемлемые соли и физиологически функциональные производные.
Особенно наиболее предпочтительными являются соединения формулы I, где означают
Y - простая связь;
Х – СН2;
R1 и R1’ независимо друг от друга
Н, F, C1, CN, СООН, CONH2, СОО (C1-С3) - алкил, (C1-С6)-алкил, (С2-С6)-алкенил, (C2-C6)-алкинил, причем в алкильных, алкенильных и алкинильных остатках водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOCH2Ph)2; OCF3, ОСН2СF3; О-(C1-C4)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOCH2Ph)2;
SO2-(C1-С6)-алкил, SO2-(СН2)n-фенил, причем n=0-3, и фенильный остаток может быть замещен F, Cl, ОН, СF3, O-(C1-C4)-алкилом;
NH-(СО)-(C1-С3)-алкил; (СН2)n-фенил, S-(СН2)n-фенил, O-(СН2)n-фенил, причем n=0-3, 1- или 2-нафтил, 2-, 3- или 4-пиридил, 2- или 3-фуранил или 2- или 3-тиенил, причем фенильные, нафтильные, пиридильные, фуранильные или тиенильные кольца всякий раз могут быть замещены F, Cl, СF3, (C1-С6) - алкилом, О-(C1-C6)-алкилом и причем в алкильных остатках водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(СООСН2Рh)2;
1,2,3-триазол-5-ил, причем триазольное кольцо в 1-, 2- или 3-положении может быть замещено метилом или бензолом;
тетразол-5-ил, причем тетраэольное кольцо в 1- или 2-положении может быть замещено метилом или бензилом;
R2 - Н, (C1-C4)-алкил, (С5-С6)-циклоалкил; (СН2)n-фенил, причем n=0-3, С(О)-(C1-C4)-алкил или С(О)-фенил;
R3 - F, (С4-С6)-алкил, СН2-фенил, причем фенил может быть замещен до двух раз F, Cl, СF3, О-(С1-С3)-алкилом, (C1-С3)-алкилом, СООН, СО-O-(C1-С3)-алкилом или CONH2;
R4 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, причем n=0-3, и фенильный остаток может быть до двух раз замещен F, Cl, О-(C1-C4)-алкилом или ОН;
R5 - (C1-C6)-алкил, (С3-С6)-циклоалкил, (СН2)n-фенил, причем n=0-3, и фенильный остаток может быть замещен до двух раз F, Cl, О-(C1-C4)-алкилом или ОН;
а также их физиологически приемлемые соли.
Особенно предпочтительными являются соединения формулы I следующей структуры:
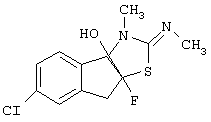
В частности, соединение:
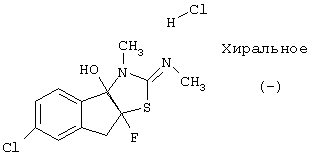
Данное изобретение относится также к соединениям формулы I в виде их рацематов, рацемических смесей и чистых энантиомеров, так же как к их диастереомерам и их смесям.
Фармацевтически приемлемые соли благодаря их высокой растворимости в воде по сравнению с исходными соединениями особенно пригодны для медицинского применения. Эти соли должны содержать фармацевтически приемлемый анион или катион. Пригодными фармацевтически приемлемыми аддитивными солями кислот предложенных соединений являются соли неорганических кислот, таких как соляная кислота, бромистоводородная, фосфорная, метафосфорная, азотная, сульфоновая и серная кислота, так же как и органические кислоты, как, например, уксусная кислота, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изетионовая, молочная, лактобионовая, малеиновая, яблочная, метансульфоновая, янтарная, п-толуолсульфоновая, винная и трифторуксусная кислота. Для медицинских целей особенно пригодна соль соляной кислоты. Подходящими фармацевтически приемлемыми основными солями являются соли аммония, соли щелочных металлов (такие как соли натрия и калия) и соли щелочноземельных металлов (такие как соли магния и кальция).
Особенно предпочтительными являются гидробромиды и гидрохлориды, в частности, гидрохлориды.
Соли с фармацевтически неприемлемыми анионами также относятся к данному изобретению в качестве необходимых промежуточных продуктов для получения или очистки фармацевтически приемлемых солей и/или для применения в нетерапевтических целях, например, при применении in vitro.
Использованный здесь термин "физиологически функциональное производное" означает каждое физиологически приемлемое производное соединения согласно изобретению, например, сложный эфир, которое при введении млекопитающему, например, человеку, способно (непосредственно или косвенно) образовывать такое соединение или его активный метаболит.
Объектом данного изобретения являются также пролекарства предложенных соединений. Такие пролекарства могут in vivo метаболизироваться в соединения согласно изобретению. Эти пролекарства сами могут быть или не быть активными.
Предложенные соединения могут находиться также в различных полиморфных формах, например, в виде аморфных и кристаллических полиморфных форм. Все полиморфные формы предложенных соединений относятся к данному изобретению и являются дополнительным аспектом изобретения.
Далее все ссылки на "соединение(я) согласно формуле (I)" относятся к соединению (ям) формулы (I). как описано выше, а также к их солям, сольватам и физиологически функциональным производным.
Количество соединения согласно формуле (I), которое требуется для достижения желаемого биологического эффекта, зависит от ряда факторов, например, выбранного специфического соединения, предполагаемого применения, вида введения и клинического состояния пациента. Обычно дневная доза находится в интервале от 0,3 мг до 100 мг (обычно от 3 мг до 50 мг) в день на килограмм веса тела, например, 3-10 мг/кг/день. Внутривенная доза может, например, находиться в интервале от 0,3 мг до 1,0 мг/кг, и может вводиться в виде вливания от 10 нг до 100 нг на килограмм в минуту. Пригодные для этой цели инфузионные растворы могут содержать от 0,1 нг до 10 мг, обычно от 1 нг до 10 мг на миллилитр. Разовая доза может содержать, например, от 1 мг до 10 г активного вещества. Таким образом, ампулы для инъекций могут содержать от 1 мг до 100 мг, и предназначенные для орального введения разовые дозы, как, например, таблетки или капсулы, могут содержать, например, от 1,0 до 1000 мг, обычно от 10 до 600 мг. В случае фармацевтически приемлемых солей рассчитываются вышеназванные весовые данные на вес соли высвобождаемых ионов тиазолидин-2- илидена. Для профилактики или терапии вышеназванных состояний могут применяться соединения согласно формуле (I) индивидуально в виде соединений, однако предпочтительно они находятся вместе с приемлемым носителем в виде фармацевтической композиции. Носитель должен быть фармацевтически приемлемым, в том смысле, что он является совместимым с другими ингредиентами композиции и не является вредным для здоровья пациентов. Носитель может быть твердым веществом или жидкостью или и тем, и другим и предпочтительно формируется с соединением в виде разовой дозы, например, в форме таблетки, которая может содержать от 0,05% до 95 вес.% активного вещества. Равным образом могут присутствовать другие фармацевтически активные вещества, включая другие соединения согласно формуле (I). Предложенные фармацевтические композиции могут быть получены известными фармацевтическими способами, которые в основном состоят в том, что ингредиенты перемешивают с фармакологически приемлемыми носителями и/или вспомогательными веществами.
Согласно изобретению фармацевтическими композициями являются таковые, которые пригодны для орального, ректального, местного, пероального (например, сублингвального) и парентерального (например, подкожного, внутримышечного, интрадермального или внутривенного) введения, хотя пригодный способ введения в каждом отдельном случае зависит от вида и тяжести излечиваемого состояния и от вида применяемого соединения согласно формуле (I). Дражированные препаративные формы и дражированные препаративные формы продленного действия также относятся к данному изобретению. Предпочтительными являются препаративные формы, устойчивые к кислотам и желудочному соку. Пригодные устойчивые к желудочному соку покрытия включают ацетатфталат целлюлозы, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы и анионные полимеры метакриловой кислоты и метилового эфира метакриловой кислоты.
Пригодные фармацевтические соединения для орального введения находятся в отдельных единицах, таких как капсулы, оболочки облатки, таблетки для сосания или таблетки, которые каждый раз содержат определенное количество соединения согласно формуле (I); в форме порошка или гранулята; в форме раствора или суспензии в водной или неводной жидкости; или в форме эмульсии масло-в-воде или вода-в-масле. Эти композиции, как уже упоминалось, могут быть получены любым подходящим фармацевтическим способом, которые включают стадию, на которой вводят в контакт активное вещество и носитель (который может состоять из одного или более дополнительных ингредиентов). Обычно композиции получают путем равномерного и гомогенного смешивания активного вещества с жидким и/или тонкодисперсным твердым носителем, после чего продукт в случае необходимости формуют. Так, например, может быть получена таблетка путем прессования или формования порошка или гранулята соединения, в случае необходимости, с одним или более дополнительным ингредиентами. Прессованные таблетки могут быть получены путем таблетирования соединения в свободно текучей форме, как, например, порошка или гранулята, в случае необходимости, смешанного со связующим, средством, придающим скользкость, инертным разбавителем и/или одним (несколькими) поверхностно-активным/диспергирующим средством на подходящем устройстве. Отформованные таблетки могут быть получены путем формования порошкообразного, увлажненного инертным жидким разбавителем соединения в подходящем устройстве.
Фармацевтические композиции, которые предназначены для перорального (сублингвального) введения, включают таблетки для сосания, которые содержат соединение согласно формуле (I) со вкусовым веществом, обычно сахарозой и гуммиарабиком или трагантом, и пастилки, которые содержат это соединение в инертной основе, такой как желатина и глицерин или сахароза и гуммиарабик.
Пригодные фармацевтические композиции для парентерального введения включают, предпочтительно, стерильные водные композиции соединения согласно формуле (I), которые предпочтительно изотоничны с кровью предназначенного реципиента. Эти препаративные формы, предпочтительно, вводят внутривенно, хотя введение может осуществляться также подкожно, внутримышечно или внутрикожно в виде инъекций. Эти препаративные формы, предпочтительно, могут быть приготовлены путем смешивания соединения с водой, и полученный раствор делают стерильным и изотоническим с кровью. Пригодные для инъекций предлагаемые композиции содержат в основном от 0,1 до 5 вес.% активного соединения.
Подходящие фармацевтические композиции для ректального введения представлены, предпочтительно, в виде свечей с разовой дозой. Они могут быть приготовлены путем смешивания соединения формулы (I) с одним или более подходящими твердыми носителями, предпочтительно маслом какао, и формования полученной смеси.
Подходящие фармацевтические композиции для местного нанесения на кожу представлены предпочтительно в виде мази, крема, лосьона, пасты, спрея, аэрозоля или масла. В качестве носителя могут быть использованы вазелин, ланолин, полиэтиленгликоль, спирт или комбинация двух или более таких веществ. Активное вещество обычно представлено в концентрации от 0,1 до 15 вес.% композиции, например, от 0, 5 до 2%.
Возможно также трансдермальное введение. Подходящие фармацевтические композиции для трансдермального введения могут быть представлены в виде отдельных пластырей, которые предназначены для долговременного контакта с эпидермисом пациента. Такой пластырь содержит активное вещество, в случае необходимости в забуферированном водном растворе, растворенном и/или диспергированном в адгезивном средстве или диспергированном в полимере. Подходящая концентрация активного вещества составляет примерно от 1% до 35%, предпочтительно, примерно от 3% до 15%. В качестве особой возможности активное вещество может, как, например, описано в Pharmaceutical Research, 2(6); 318 (1986), высвобождаться путем электротранспорта или ионофореза.
Предметом изобретения дополнительно является способ получения соединений общей формулы I (R2 = Н), отличающийся тем, что
А) соединения общей формулы II,
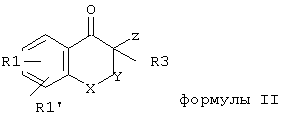
где R1, R1’, R3 и X и Y имеют указанные значения, и Z - остаток активного эфира неорганической или органической кислоты, подвергают взаимодействию с тиомочевинами общей формулы III, которые находятся в таутомерных формах IIIa и IIIb, и IIIс,
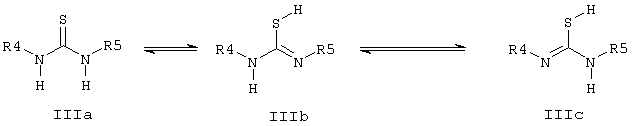 где R4 и R5 имеют указанные значения и
где R4 и R5 имеют указанные значения и
В) в случае необходимости соединения общей формулы I (R2 = Н) переводят с помощью органических или неорганических кислот в аддитивные соли кислот или полученные соли соединений общей формулы I (R2 = Н) с помощью органических или неорганических оснований в свободные основные соединения формулы I (R2 = Н).
В качестве неорганических кислот принимают во внимание галогеноводородные кислоты, такие как хлористоводородная кислота и бромистоводородная кислота, и серная кислота, фосфорная кислота и амидосульфоновая кислота. В качестве органических кислот должны быть названы: муравьиная кислота, уксусная кислота, бензойная кислота, п-толуолсульфокислота, бензолсульфокислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, лимонная кислота, L-аскорбиновая кислота, салициловая кислота, изетионовая кислота, метансульфокислота, трифторметансульфокислота, 1,2-бензизотиазол-3(2Н)-он, 2,2-диоксид 6-метил-1,2,3-оксатиазин-4(3Н)-она.
Соединения формулы I могут также находиться в их таутомерных формах:
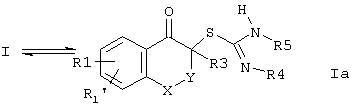
Предложенные соединения формулы I (R2 = Н), кроме того, могут находиться в их возможных геометрических изомерных структурах.
Алкильные, алкенильные и алкинильные остатки в заместителях Rl, R1’, R2, R3, R4 и R5 могут быть как линейными, так и разветвленными.
Наряду с таутомерной формой с открытой цепью Iа циклические соединения формулы I (R2 = Н) при различных R4 и R5 находятся в равновесии с изомерами положения соединений формулы Ib (R2 = Н) и их аддитивными солями с кислотами.

Какой из двух циклических изомеров I (R2 = Н) или Ib (R2 = Н) или их аддитивные соли кислот являются предпочтительными, зависит особенно от размеров различных пространственных размеров заместителей R4 или R5 таким образом, что меньший по объему заместитель находится в 3 положении тиа-золидиновой циклической системы.
Для предложенных соединений далее приведена только одна из возможных изомерных или таутомерных форм каждого вещества.
Описанный выше способ получения, предпочтительно, проводят таким образом, что соединения II взаимодействуют с тиомочевинами III в молярном соотношении от 1:1 до 1:1,5. Реакцию, предпочтительно, проводят в инертном растворителе, например, в полярных органических растворителях, таких как диметилсульфоксид, диметилформамид, диметилацетамид, N-метил-2-пирролидон, диоксан, тетрагидрофуран, ацетонитрил, нитрометан или диметиловый эфир диэтиленгликоля. В качестве особенно предпочтительных растворителей оказались метиловый эфир уксусной кислоты и этиловый эфир уксусной кислоты, короткоцепочечные спирты, такие как метанол, этанол, пропанол, изопропанол, так же как и низшие диалкилкетоны, как, например, ацетон, бутан-2-он или гексан-2-он. Могут также быть использованы смеси приведенных реакционных сред; так же как и смеси приведенных растворителей с растворителями, которые самостоятельно менее пригодны, как, например, смеси метанола с бензолом, этанола с толуолом, метанола с диэтиловым эфиром или с трет-бутилметиловым эфиром, этанола с тетрахлорметаном, ацетона с хлороформом, дихлорметаном или 1,2-дихлорэтаном, причем каждый раз полярный растворитель должен использоваться в избытке. Компоненты реакции могут быть суспендированы или растворены в какой-либо реакционной среде. В принципе компоненты реакции могут взаимодействовать также без растворителя, в частности, когда тиомочевина имеет возможно более низкую температуру плавления. Реакция протекает слабо экэотермично и может быть проведена между -10° С и 150° С, предпочтительно, между 0° С и 50° С. Особенно благоприятной оказывается, как правило, температурный интервал между 20° С и 40° С. Продолжительность реакции сильно зависит от температуры реакции и находится между 2 мин и 3 днями при более высокой или более низкой температурах. В благоприятном температурном интервале продолжительность реакции составляет обычно от 5 мин до 48 ч.
Поскольку часто соединения I (R2 = Н) осаждаются в форме их труднорастворимых аддитивных солей кислот, целесообразно дополнительно добавлять осадитель. В качестве такового применяют, например, углеводороды, такие как бензол, толуол, циклогексан или гептан или тетрахлорметан; в частности, в качестве особенно пригодных применимы алкиловые эфиры уксусной кислоты, такие как этиловый эфир уксусной кислоты или н-бутиловый эфир уксусной кислоты, или простые диалкиловые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, ди-н-бутиловый эфир или трет-бутилметиловый эфир. Если по окончании реакции реакционная смесь остается в растворе, то можно осадить соли соединений I (R2 = Н), в случае необходимости после концентрирования реакционного раствора, одним из названных осадителей. Дополнительно можно раствор реакционной смеси отфильтровать в раствор одного из названных осадителей при перемешивании. Поскольку реакция соединений II с тиомочевинами III протекает практически количественно, получаемые продукты являются уже в большинстве аналитически чистыми. Обработка реакционной смеси также может быть проведена таким образом, чтобы сделать щелочной реакционную смесь путем добавления органического основания, как, например, триэтиламина или диизобутиламина или аммиака или морфолина или пиперидина или 1,8-диазабицикло[5.4.0]-ундец-7-ена, и после концентрирования очистить продукт реакции хроматографически, например, на колонке с силикагелем. В качестве подходящих элюентов для этого оказались, например, смеси этилового эфира уксусной кислоты с метанолом, смеси дихлорметана с метанолом, смеси толуола с метанолом или этиловым эфиром уксусной кислоты или смеси этилового эфира уксусной кислоты с углеводородами, такими как гептан. Если очистку сырого продукта проводить описанным способом, можно из полученного чистого основания формулы I (R2 = Н) так получить продукт присоединения кислоты формулы I (R2 = Н), что основание растворяется или суспендируется в органическом протонном растворителе, таком как метанол, этанол, пропанол или изопропанол, или в органическом апротонном растворителе, таком как этиловый эфир уксусной кислоты, диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, диоксан, тетрагидрофуран, ацетон или бутан-2-он, и затем осаждают эту смесь, по меньшей мере, эквимолярным количеством неорганической кислоты, как, например, хлористоводородной кислоты, растворенной в инертном растворителе, как, например, диэтиловом эфире или этаноле, или другой из вышеперечисленных неорганических и органических кислот. Соединения формулы I (R2 = Н) могут быть перекристаллизованы из пригодного инертного растворителя, как, например, ацетон, бутан-2-он, ацетонитрил, нитрометан. Но особенно предпочтительным является осаждение из растворителя, как, например, диметилформамида, диметилацетамида, нитрометана, ацетонитрила, предпочтительно, метанолом или этанолом.
Соединения формулы I или Ib с R2 = (C1-С6)-алкил, (С3-С6)-циклоалкил или (СН2)n-арил, причем n=0-5, и арил имеет вышеуказанные значения, удается получить, если
аа) аддитивные соли кислот формулы I или Ib с R2 = Н вводят в реакцию в растворителе формулы R2-OH, причем R2 имеет описанные выше значения при температуре от -20° С до 120° С, предпочтительно, от -5° С до 50° С от 2 ч до 4 дней, предпочтительно, от 4 ч до 2 дней или
ab) свободные основания формулы I или Ib с R2 = Н вводят в реакцию в растворителе формулы R2-OH, причем R2 имеет описанные выше значения, с эквимолярным, избыточным или каталитическим количеством, предпочтительно, каталитическим количеством неорганической или органической кислоты, как они описаны выше, или с добавкой кислотного ионообменника при температуре от -20° С до 120° С, предпочтительно, от -5° С до 50° С от 2 ч до 4 дней, предпочтительно, от 4 ч до 2 дней
или
ac) взаимодействия по аа) и ab) проводят в инертном апротонном растворителе, таком как дихлорметан, хлороформ, 1,2-дихлорэтан, гептан, бензол, толуол, ацетонитрил, нитрометан, диоксан, тетрагидрофуран, диметиловый эфир этиленгликоля, диэтиловый эфир, диизопропиловый эфир, трет-бутил-метиловый эфир, ацетон, бутан-2-он или диалкиловый эфир уксусной кислоты, как, например, этиловый эфир уксусной кислоты, путем добавки от 1 до 5, предпочтительно, 1,5-2 эквивалентов соединения формулы R2-OH
или
ad) соединения формулы I или Ib с R2 = Н в инертном апротонном растворителе, как, например, тетрагидрофуран, диоксан, диметиловый эфир этиленгликоля, нитрометан, ацетонитрил или диметилформамид, ди-метилацетамид или N-метил-2-пирролидон, с помощью основания, как, например, гидрида натрия, диизопропиламида лития, КОН или карбоната калия, переводят в их алкоголяты и последние затем путем прибавления алкилирующего средства формулы R2-X, где Х обозначает хлор, бром, йод, O-С(O)СН3, O-С(O)-СF3, O-С(O)-С6Н4-4-NO2, O-SO2-СН3, O-SO2-CF3, O-SO2-С6Н4-4-СН3, O-SO2-С6Н4-4-NO2, подвергают реакции от -20° С до 150° С, предпочтительно, от -15° С до 50° С от 10 мин до 2 дней, предпочтительно, от 20 мин до 12 ч.
Соединения формулы I или Ib с R2 ≠ Н, которые получены вышеописанными способами от аа) до ad), либо осаждаются в виде труднорастворимой аддитивной соли кислоты - затем их отсасывают, промывают небольшим количеством подходящего растворителя и сушат - либо остаются в растворе. Очистка может быть осуществлена так, что реакционный состав после проведенного образования простого эфира формулы I или Ib с R2≠ Н нейтрализуют неорганическим или органическим основанием, например, триэтиламином, и полученную смесь концентрируют и затем хроматографируют на силикагеле. Полученное таким образом чистое основание формулы I или Ib с R2≠ Н может, как описано выше для соединений формулы I или Ib с R2 = Н, быть переведено в аддитивную соль кислоты.
Соединения формулы I или Ib с R2 = С(O) - (C1-С6)-алкил, С(О)-(С3-С6)-циклоалкил или С(О)-(СН2)n-арил, причем арил означает фенил, тиенил, пиридил или фурил, и n как определено выше, удается получить, если
ba) как описано в аа)-ас), с тем отличием, что вместо соединения R2-OH вводят соединение R2-COOH, причем R2 является (C1-C6)-алкилом, (С3-С6) - циклоалкилом или (СН2)n-арилом, и n и арил имеют описанные выше значения, и вводят от 1 до 2 эквивалентов соединения R2-COOH, предпочтительно, 1,5 эквивалента соединения R2-COOH, и отказываются от добавления описанных в аа)-ас) кислотных неорганических или органических катализаторов, однако, предпочтительно, вводят кислотный катионообменник
или
bb) соединение формулы I или Ib с R2 = Н (свободное основание) вводят в реакцию с соединением формулы R2-COOH, причем R2 означает С (О) - (C1-C6)-алкил, С(О)-(С3-С6)-циклоалкил или С(О)-(СН2)n-арил, и арил и n, как определены выше, например, по реакции Мицунобу (О. Mitsunobu, Synthesis 1981, 1) с образованием соединения формулы I или Ib с R2, не равным Н,
или
bс) соединение формулы R2-C(O)-C1 или R2-C(O)-Br или R2-C(O)-O-(O)-C-R2 вводят в реакцию с соединением формулы I или Ib с R2 = Н по реакции этерификации спирта (Houben-Weyl, Methoden der Organischen Chemie, Georg Thieme Verlag Stuttgart, том E5, стр. 656-715).
Соединения формулы I или Ib с R2 ≠ Н, которые получены согласно ba)-bc). как описано выше, либо осаждаются в виде труднорастворимой аддитивной соли кислоты - затем их отсасывают, промывают небольшим количеством подходящего растворителя и сушат - либо остаются в растворе. Очистка может быть осуществлена так, что реакционный состав после образования сложного эфира формулы I или Ib с R2, не равным Н, нейтрализуют неорганическим или органическим основанием, например, карбонатом калия или триэтиламином, и полученную смесь концентрируют и затем хроматографируют на силикагеле. Полученное таким образом чистое основание формулы I или Ib с R2, не равным Н, может, как описано выше для соединений формулы I или Ib с R2 = Н, быть переведено в аддитивную соль кислоты.
Исходные вещества формулы III в большинстве случаев описаны в литературе (ср. Houben-Weyl, Methoden der organischen Chemie, том 9, стр. 384; 4 Aufl.; 1955 или DOS 2640358 (16.03.1978)).
В соединениях формулы II в качестве остатка активированного сложного эфира Z рассматривают, например, Сl, Вr, J, O-С(O)-С6Н4-4-NO2, О-SО2-СН3, О-SО2-СF3, O-SO2-С6Н4-4-СН3, O-SO2-С6Н4. Они могут быть получены несколькими способами:
са) Диазокетоны общей формулы VIII
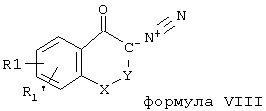
могут быть переведены с помощью галогенводородной кислоты в соединения общей формулы II (Z = С1, Br, J; R3 = Н). Этот способ так же, как и некоторые соединения формулы II, известны из литературы (например, J. Am. Chem. Soc. 80, 2255 (1958); J. Indian Chem. Soc. 42, 115 (1965)), другие соединения формулы II могут быть получены и превращены соответствующим образом. Диазокетоны общей формулы VIII далее могут быть по известным из литературы способам через гидроксисоединения общей формулы IX
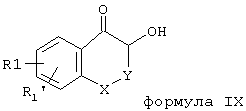
переведены в соответствующие соединения формулы II (R3 = Н).
cb) Поскольку обозначенный са) способ приводит только к соединениям общей формулы II, в которых R3 остается ограничен водородом, соединения формулы II, предпочтительно, получают таким образом, что соединения общей формулы Х
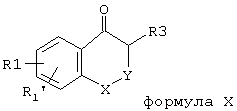
вводят в реакцию с подходящим галогенирующим средством, как, например, элементарные хлор или бром, хлористый сульфурил, монохлормочевина, N-хлорсукцинимид, бромид меди-II, комплекс брома с диоксаном, N-бромсукцинимид, в известных из литературы условиях. Исходные соединения формулы Х либо известны, либо могут быть получены по описанным в литературе способам.
В качестве галогенирующего средства рассматривают, например, элементарный хлор, хлористый сульфурил, монохлормочевину, N-хлорсукцинимид, комплекс брома с диоксаном, N-бром-сукцинимид, в частности, элементарный бром или бромид меди-II. При галогенировании, предпочтительно, прибавляют по каплям бром, в случае необходимости разбавленный инертным растворителем, к раствору или суспензии эквимолярного количества соединения формулы X в инертном растворителе. В качестве таковых речь идет, например, о галогенуглеводородах, таких как ди- или трихлорметан или 1,2-дихлорэтан, но, предпочтительно, об уксусной кислоте или низшем алкиловом эфире уксусной кислоты, или о смеси названных растворителей. Температура реакции находится между 0 и 50° С, предпочтительно, между 10 и 35° С. Галогенирование кетонов катализируют кислотами; при этом предпочтительно, если компоненты реакции смешивают с каталитическим количеством кислоты, например, бромистоводородной кислоты, или после прибавления по каплям небольшого количества брома реакционную смесь сначала нагревают до обесцвечивания галогена и затем бромируют дальше.
При бромировании соединений формулы Х бромидом меди-II можно действовать аналогично способу, описанному в J. Org. Chem. 29, 3459 (1964) или J. Оrg. Chem. 40, 1990 (1975).
В качестве хлорирующего средства пригоден, в частности, хлористый сульфурил, который обычно вводят в реакцию с раствором или суспензией соединения формулы Х в растворителе, как, например, три- или тетрахлорэтане или простом эфире, таком как диэтиловый эфир или трет-бутилметиловый эфир, в температурном интервале между 20 и 80° С. Затем смешивают с ледяной водой и обрабатывают, как обычно. При применении в качестве галогенирующего средства хлора в раствор соединения формулы Х в полярном растворителе, например, ледяной уксусной кислоте или диметилформамиде или N-метил-2-пирролидоне, сначала пропускают газообразный хлористый водород в качестве катализатора, а затем при температуре от 0 до 25° С - эквивалентное количество хлора. Время реакции составляет 2-24 ч. Затем смешивают с ледяной водой и обрабатывают, как обычно. Если в качестве хлорирующего средства в реакцию вводят N-хлорсукцинимид, то соединения формулы X, предпочтительно, в полярном растворителе, как, например, ледяная уксусная кислота, вводят в реакцию с 1-2 эквивалентами N-хлорсукцинимида, после прибавления каталитического количества соляной кислоты, при примерно 50° С в течение 2-12 ч. После этого смешивают с ледяной водой и обрабатывают, как обычно.
cc) Соединения формулы II можно, наконец, получать таким образом, что α -гидроксикетоны общей формулы XI,
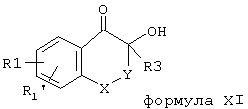
которые либо известны (Chem. Ber. 83, 390), либо могут быть получены подходящим способом, вводят в реакцию с активированными производными органических и неорганических кислот, таких как хлорангидрид метансульфокислоты, хлорангидрид трифторметансульфокислоты, хлорангидрид этансульфокислоты, хлорангидрид бензолсульфокислоты, хлорангидрид п-толуолсульфокислоты, тионилбромид, треххлористый фосфор, трехбромистый фосфор, хлорокись фосфора, п-нитробензоилхлорид.
Полученный таким способом раствор или суспензию соединения формулы II целесообразно упарить при пониженном давлении и очистить соединения формулы II путем кристаллизации из инертных растворителей, как, например, бензола, толуола, тетрахлорметана, дихлорметана, 1,2-дихлорэтана, циклогексана, гексана, гептана. Другой способ очистки состоит в том, что реакционную смесь хроматографируют на колонке с силикагелем, причем целесообразно использовать в качестве элюента гептан, диэтиловый эфир, трет-бутилметиловый эфир, толуол, этиловый эфир уксусной кислоты или их смесь.
Полученные соединения формулы II можно также использовать на следующих стадиях без дополнительной очистки.
Соединения формулы X,
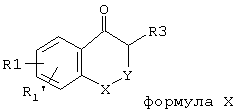
где R3 не равен водороду, доступны различными способами:
da) Соединения формулы X, где R3 = фтор, могут быть, например, получены путем взаимодействия соединений формулы X, где R3 = Н, с электрофильным фторирующим реагентом. В качестве электрофильного фторирующего реагента (смотри также: W.E.Ваrnette, J. Am. Chem. Soc. 106, 452-454 (1984)), например, трифлат 1-фтор-2,4,6-триметилпиридиния, трифлат 3,5-дихлор-1-фторпиридиния, трифлат 1-фторпиридиния, тетрафторборат 1-фторпиридиния, пиридингептафтордиборат 1-фторпиридиния, N-фтор-N-метил-п-толуолсульфонамид, N-фтор-N-пропил-п-толуолсульфонамид, N-фторбензолсульфонамид, N-фторбензолсульфонимид [NFSi], бис(тетрафторборат) 1-фтор-4-гидрокси-1,4-диазониабицикло-2.2.2]октана (NFTh). Реакцию фторирования проводят таким образом, что к раствору или суспензии соединения формулы X, где R3 = Н, в неполярном апротонном растворителе, таком как бензол, толуол, гексан или гептан, или в полярном апротонном растворителе, таком как тетрагидрофуран, диметилформамид, ацетонитрил, диэтиловый эфир или трет-бутилметиловый эфир, или в их смеси добавляют эквивалентное количество основания, с помощью которого соединение формулы Х (R3 = Н) переводят в енолят соединения формулы Х (R3 = Н). В качестве основания для этой реакции пригодны н-бутиллитий, гексаметилдисилазан калия или натрия, гидрид натрия, гидрид калия, трет-бутилат калия, метиллитий, гидроксид тетра-н-бутиламмония. Подходящей температурой реакции является температура от -78 до 25° С. К раствору или суспензии образованного таким образом енолята соединения формулы Х (R3 = Н) затем прибавляют по каплям при температуре от –78 до 100° С, предпочтительно, при температуре от -50 до 80° С, от 1 до 2, предпочтительно, 1,5 эквивалента одного из вышеназванных фторирующих реагентов, растворенного в одном из вышеперечисленных растворителей или смеси растворителей, предпочтительно, растворенного в толуоле или ди-хлорметане. Порядок прибавления компонент реакции может быть обратным, то есть раствор или суспензия енолята соединения формулы Х (R3 = Н) прибавляют по каплям к раствору фторирующего реагента при указанных температурах. В зависимости от выбранной температуры реакции реакция заканчивается в течение от 15 мин до 48 ч. Взаимодействие, особенно с N-фторбензолсульфонимидом, может быть проведено аналогично Е. Differding и Н. Ofner, Synlett 187-189 (1991) таким образом, что сначала получают простой триметилсилиленоловый эфир соединения формулы X, где R3 = Н (например, с триметилсилилбромидом или триметилсилиловым эфиром трифторметансульфокислоты в толуоле при температуре от -78 до 80° С с добавлением одного эквивалента основания, как, например, триэтиламина) и затем прибавляют фторирующий реагент, растворенный в дихлорметане или толуоле, при комнатной температуре, и примерно после 12 ч проведения реакции (при комнатной температуре) обрабатывают. Обработка реакционной смеси может проводиться таким образом, что после нейтрализации избытка введенного основания реакционную смесь упаривают и затем смешивают с растворителем, как, например, этиловым эфиром уксусной кислоты или гептаном, и встряхивают с полуконцентрированным раствором гидрокарбоната натрия. Органическую фазу после высушивания над сульфатом магния упаривают, и продукт реакции для дальнейшей очистки может быть либо перекристаллизован из растворителя, такого как гексан или гептан, либо подвергнут хроматографической очистке на колонке с силикагелем с вымыванием, например, смесями дихлорметана с гептаном или этилового эфира уксусной кислоты с гептаном.
Взаимодействие с бис(тетрафторборатом) 1-фтор-4-гидрокси-1,4-диазониабицикло[2.2.2]октана (NFTh) может быть проведено таким образом, что применяют кетон как таковой, без превращения в енолят или простой енолсилиловый эфир.
db) Соединения формулы X, где R3 = (C1-C6)-алкил или (СН2)n-арил, и причем n=1-5, и арил, как определен выше, могут быть, например, получены путем взаимодействия соединений формулы X, где R3 = Н, с сильным основанием и с алкилирующим агентом общей формулы R3-X, причем Х = Br, J, О-С(О)-С6Н4-4-NO2, О-SО2-СН3, О-SО2-СF3, O-SO2-С6Н4-4-СН3, O-SO2-С6Н4. Чтобы обеспечить при таком алкилировании только желаемое моноалкилирование, соединения формулы Х (R3 = Н), предпочтительно, превращают в соединения, например, формул XII, XIII или XIV.
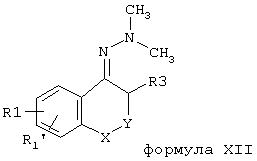

Соединения типа формулы XII (R3 = Н) могут быть получены по методике, описанной F. Henin и др. Tetrahedron, 50, 2849-2864 (1994). Таковые типа формулы XIII (R3 = Н), причем R’-R" = (СН2)4-, - (СН2)5-, - CH2-CH2-O-CH2-CH2-, удается получить, например, в соответствии Stork и др. J. Am. Chem. Soc. 85, 207 (1963). Соединения формулы XIV (R3 = Н) доступны согласно известному из литературы способу, например, P.W. Hickmott, Chem. Ind. (London), 731 (1974). Соединения типа формул XII и XIV (R3 = Н) после перевода их в анионы посредством сильного основания могут быть превращены алкилирующим средством общей формулы R3-X, где R3 и Х, как определены выше, в желаемые соединения формул XII и XIV (R3 = Н) и затем после кислотного гидролиза гидразонов (XII) или гидролиза и декарбоксилирования β -кетоэфиров (XIV) в соединения формулы X, где R3 = Н. Соединения формулы XIII (R3 = Н) могут в инертном растворителе, таком как трихлорметан или толуол, после прибавления основания, такого как триэтиламин, с помощью алкилирующего средства общей формулы R3-X после кислотного гидролиза α -алкилированного енамина формулы XIII (R3 = Н) быть превращены в соединения формулы X, где R3 = Н.
Соединения формулы X, где R3 = СООСН3, СООСН2СН3, СООН, CONH2, СОNНСН3, СОN(СН3)2, удается получить через соединения формулы XII и формулы XIII по известным из литературы способам путем взаимодействия, например, с Сl-С(O)-O-CH2-СН3.
dd) Соединения общей формулы X, где R3 = CN, могут быть получены по известным из литературы способам (М.Е. Kuehne, J. Org. Chem. 81, 5400-5404 (1959) путем реакции соединения формулы XIII с хлорцианом.
de) Соединения общей формулы X, где R3 = O-(C1-C6)-алкил, удается получить по известным из литературы способам (J. Chan Lee и др., Synth. Commun. 21, 4085-90 (1997)), исходя из соединений общей формулы X, где R3 = Н, таким образом, что соединение формулы Х (R3 = Н) кипятят с обратным холодильником с [гидрокси(п-нитробензолсульфонилокси)йод]бензолом [HNJB] в ацетонитриле 2-6 ч, и полученный промежуточный продукт вводят в реакцию непосредственно со спиртом общей формулы R3-ОН, где R3 имеет указанные выше значения, при повышенной температуре.
df) Аналогичным способом удается получить соединения общей формулы X, где R3 = O(O)ССН3. Причем описанный в de) промежуточный продукт превращают в уксусной кислоте путем прибавления каталитического количества карбоната серебра в соединение формулы X, где R3 = O(O)ССН3.
dg) Соединения общей формулы X, где R3 = N3, удается получить либо путем нуклеофильного обмена с азидом из соответствующих соединений формулы X, где R3 = Сl или Вr (К. Van Sant, M.S. South; Tetrahedron Lett. 28, 6019 (1987)), но лучше по аналогии с Т. Patonay и R.V. Hoffman, J. Org. Chem. 59, 2902-2905 (1994) из енолацетатов соединений X (R3 = Н) или из енаминов соединений Х (соединения формулы XIII (R3 = Н) через α -тозилкетоны и последующей реакцией с азидом натрия.
dh) Соединения формулы X, где R3 = (С2-С6)-алкинил, могут быть получены через 1,3-дикарбонильные соединения общей формулы XIV. По аналогии с известным из литературы способом (М.Ochiai, Т.Ito, Y.Takaoka, Y.Masaki, М.Kunishima, S.Tani, Y.Nagао;
J. Chem. Soc., Chem. Commun. 118-119 (1990), при этом соединения формулы XIV (R3 = Н) сначала под действием сильного основания, такого как трет-бутилат калия в трет-бутаноле или как трет-бутилат калия в тетрагидрофуране переводят в их енолят-анионы и затем вводят в реакцию с тетрафторборатом этинил(фенил)йодония с образованием соединений формулы XIV, где R3 = (C2-C6)-алкинил.
di) Соединения общей формулы X, где R3 = SO2-(C1-C6)-алкил, SO2-(СН2)n-фенил, SO-(С1-С6)-алкил, SO-(СН2)n-фенил, S-(C1-C6)-алкил, S-(СН2)n-фенил, причем n=0-3, могут быть получены по известным из литературы способам путем взаимодействия генерированного под действием сильного основания, такого как диизопропиламид лития, в смеси растворителей, такой как гексан/пиридин, енолят-аниона соединения формулы X, где R3 = Н, с соответствующим диалкил-, ди(аралкил)- или дифенилдисульфидом при низких температурах. Полученные таким образом соединения формулы X, где R3 = S-(C1-C6)-алкил или S-(СН2)n-фенил, и n=0-3, могут быть переработаны с надселеновой кислотой в соответствующие сульфоксиды (R3 = SO-(С1-С6)-алкил, SO-(СН2)n-фенил) (J. Drabowicz, M. Mikolajczyk; Synthesis 1978, 758) и с раствором 30%-ного пероксида водорода или путем реакции с мета-хлорпероксибензойной кислотой в дихлорметане в соответствующие сульфоны (R3 = SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил.
Соединения формулы Х (R3 = Н), которые являются исходными продуктами для получения соединений формулы II, где R3 = Н, F, CN, N3, O-(С1-С6)-алкил, (C1-C6)-алкил, (СН2)n-арил, причем n = 0-5, и арил может означать фенил, тиенил, пиридил или фурил, (С2-С6)-алкинил, SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил, SO-(С1-С6)-алкил; SO-(СН2)n-фенил, S-(C1-C6)-алкил, S-(СН2)n-фенил, причем n=0-3, С(O)ОСН3, С(O)ОСН2СН3, С(О)ОН, C(O)NH2, С(O)NНСН3, С(O)N(СН3)2, O(O)ССН3, и Z имеет указанные выше значения, могут быть приобретены или доступны по аналогии с различными известными из литературы способами (схема 1):
Схема 1
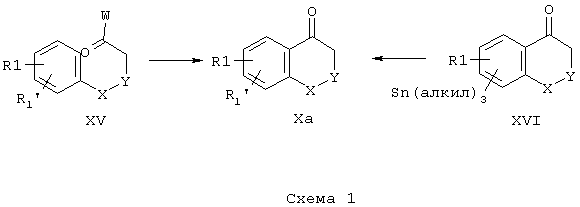
еа) Соединения общей формулы XV, где R1, R1’, Х и Y имеют указанные выше значения и где W представляет собой карбонилактивирующую группу, такую как галоген, например, С1 или Вr, или OR" или О-С(О)-R", причем R" = алкил, например, СН3, или арил, например, фенил, могут по известному из литературы способу, например, (Houben-Weyl, Methoden der Organischen Chemie, Thieme Verlag Штуттгарт, 1973, том VII/2a, стр. 111) замыкать кольцо под действием протоновых кислот или кислот Льюиса с образованием соответствующих соединений общей формулы Ха.
еb) Соединения общих формул Х и Ха, где R1 и/или R1’ означают S-(C1-C6)-алкил, S-фенил, SO-(C1-C6)-алкил, SO-фенил, SO2-(C1-С6)-алкил, SO2-фенил, S-(СН2)n-фенил, SO-(СН2)n-фенил, SO2-(СН2)n-фенил, причем n=0-6, SO2-NH2, SO2NH(C1-C6)-алкил, SO2N[(С1-С6)-алкил]2, могут быть получены по известным из литературы способам (Houben-Weyl, Methoden der Organischen Chemie, том XI/1, стр. 422 и 475, издательство Thieme, Штуттгарт) таким образом, чтобы осуществить восстановление соответственно замещенных соединений формулы Х или Ха, где R1 и/или R1’ = NO2, например, никелем Ренея и водородом в растворителе, таком как этанол или ледяная уксусная кислота, или цинком в ледяной уксусной кислоте или оловом или хлоридом олова-(II) в соляной кислоте до аминов формулы Х или Ха, где R1 и/или R1’ = NH2, и затем диазотирование путем прибавления нитрита натрия в соляной кислоте и далее превращение действием CuCl2 и SO2 в ледяной уксусной кислоте до соответственно замещенных хлорангидридов сульфокислот. Последние могут быть превращены в стандартных условиях восстановлением в щелочной среде в соответствующие сульфиновые кислоты, которые затем со своей стороны могут быть по известным из литературы способам переработаны в соединения формулы Х или Ха, где R1 и/или R1’ = S-(C1-C6)-алкил, S-фенил, SO-(C1-C6)-алкил, SO-фенил, SO2-(C1-C6)-алкил, SO2-фенил, S-(СН2)n-фенил, SO-(СН2)n-фенил, SO2-(СН2)n-фенил, причем n=0-6, SO2-NH2, SO2NH(C1-C6)-алкил, SO2N[(С1-С6)-алкил]2.
Соединения формулы Х или Ха, где R1 и/или R1’ = O-(С1-С6)-алкил, О-СН2-СF3, O-СН2-СF2-СF3, O-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или водород может быть заменен ОН, O-С(O)СН3, O-CH2-Ph, NH2 или N (СООСН2Рh)2, О-(СH2)n-фенил, причем n=0-6, S-(C1-C6)-алкил, S-фенил, S-(CH2)n-фенил, причем n=0-6, доступны путем нуклеофильного замещения соединений общей формулы Х или Ха, где R1 и R1’ = F или Вr, с соединениями общей формулы R1-M или R1’-M, где R1 и/или Rl’ имеют указанные выше значения, и М обозначает атом щелочного металла, как, например, Na, или четырехзамещенный атом азота, как, например, (н-Bu)4N. При этом вводят в реакцию, например, соединение формулы Х или Ха, где R1 и/или R1’ обозначает F, преимущественно в полярном апротонном растворителе, таком как диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон или диметилсульфоксид, с соединением формулы R1-H или R1’-H, причем R1 и R1’ - как определены выше, с добавлением основания, как, например, карбоната натрия или калия, гидрида натрия, гексаметилдисилазана калия, гидроксида калия или натрия, карбоната цезия или тетра-н-бутил-аммонийгидроксида, при температуре от 50 до 150° С и затем обычно обрабатывают.
Такие соединения доступны также, если соединения формулы Х или Ха, где R1 и/или R1’ = Вr, вводят в реакцию в условиях катализа переноса фаз (E.V. Dehmlow, S.S. Dehmlow, Phase Transfer Catalysis, 2-е изд, Verlag Chemie, Weinheim, 1983) с соединениями формулы R1-H и/или Rl’-H с, например, катализатором, таким как Aliquat 336, в смеси толуола с 50%-ным водным раствором гидроокиси натрия или с 15-крон-5 в толуоле с 50%-ным водным раствором гидроокиси натрия примерно за 2 ч и затем обрабатывают, как обычно (A.J. Serio Duggan, E.J.J. Grabowski, W.K. Russ: Synthesis 573-5 (1980); A. Ohta, Y. Iwasaki, Y. Akita: Synthesis 828-9 (1982); W. Chin-Hsien, L. Xiang-Te, C. Xiao-Hun: Synthesis 858-61 (1982); H. Alsaidi, R. Gallo, J. Metzger: Synthesis 921-4 (1980)).
После обычной обработки соединения общих формул Х или Ха, где R1 и/или R1’ = O-(C1-C6)-алкил, O-СН2-СF3, O-СН2-СF2-СF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором, или один водород может быть заменен ОН, ОС(O)СН3, O-CH2-Ph, NH2 или N(COOCH2Ph)2, O-(СН2)n-фенил, причем n=0-6, S-(C1-C6)-алкил, S-фенил, S-(СН2)n-фенил, причем n=0-6, могут быть выделены.
Соединения общих формул Х и Ха, где R1 и/или R1’ = CN, могут быть получены по стандартным способам (L. Friedman, H. Shechter, J. Org. Chem. 26, 2522-24 (1961)) из, например, соединений формул X и Ха, где R1 и/или R1’ = Сl или Вr, путем нуклеофильного замещения с цианидом металла, как, например, NaCN, KCN, Cu-(I)-CN. В качестве растворителя применяют для этого полярную апротонную среду, как, например, диметилформамид, диметилацетамид, N-метил-2-пирролидон или диметилсульфоксид. Подходящей температурой реакции является температура от 150 до 200° С.
ее) Соединения общих формул XV и Ха, где R1 и R1’ означают в случае необходимости замещенный арильный или гетероарильный остаток, могут быть получены по известным из литературы способам из соответствующих соединений формул XV и Ха, где R1 и/или R1’ - бром, йод или трифторметансульфонилокси. По аналогии с N. Miyaura и A. Suzuki, Chem. Rev. 95, 2457-83 (1995) или Т. Oh-e, N. Miyaura и A. Suzuki, J. Org. Chem. 58, 2201-08 (1993) такие соединения могут быть получены исходя из бром- или йод(гетеро)ариленов или (гетеро) арилтрифлатов формул XV или Ха, где R1 и/или R1’ - бром, йод, трифторметансульфонилокси, путем взаимодействия с арилбороновыми кислотами или их эфирами или арилборондиалкиленами общих формул R1-B или R1’-B, где R1 и/или R1’ может быть в случае необходимости замещенным арильным остатком, как, например, фенилом, тиенилом, пиридилом или фурилом, и В означает борсодержащий остаток, такой как В(ОН)2, В(ОСН3)2, В(О-(СН2)3-О), В(ОС(СН3)2-С(СН3)2-O) или В(СН2-СН3)2, таким образом, что реакцию сочетания проводят путем прибавления органического основания, как, например, триэтиламина, или неорганического основания, как, например, гидроксида натрия, карбоната натрия, гидрокарбоната натрия, карбоната калия, фосфата калия, гидроксида бария, фторида цезия или фторида тетрабутиламмония, в смеси растворителей, например, толуола и воды или ацетона и воды или диметоксиэтана и воды или в растворителях, таких как толуол, бензол, диметоксиэтан, тетрагидрофуран, диоксан, ацетон или диметилформамид с добавлением палладиевого катализатора при температуре от 20 до 150° С. В качестве палладиевых катализаторов используют, например, Pd(OAc)2, Рd(РРh3)4, PdCl2(РРh3)2, комплекс палладий(II)-[1,1’-бис(дифенилфосфино)-ферроцен]-хлорид-метиленхлорид, Pd[Р(2-метоксифенил)3]4 или d (DBA)2/[(МеО)3-С6Н2]PPh2 ([DBA= дибензилиденацетону]).
ed) Кроме того, соединения формул XV и Ха, где R1 и/или R1’ означает, в случае необходимости замещенный, арильный или гетероарильный остаток, могут также быть получены из соответствующих соединений формул XV и Ха, где R1 и/или R1’ представляет собой борсодержащий остаток, такой как В(ОСН3)2 или В(ОС(СН3)2-С(СН3)2-O). Последние получены по аналогии с Т. Ishiyama и др., J. Оrg. Chem. 60, 7508-10 (1995) или М. Murata и др., J. Оrg. Chem. 62, 6458-59 (1997) из соединений формул XV и Ха, где R1 и/или R1’ - бром или йод, путем взаимодействия пинаколинового эфира дибороновой кислоты [(Ме4С2O2)ВВ-(O2С2Ме4)] или путем взаимодействия с 4,4,5,5-тетра-метил-1,3,2-диокса-бороланом. В качестве растворителя предпочтительно применяют диметилсульфоксид, диметилформамид, диоксан или толуол или их смесь. Температура реакции составляет примерно от 80 до 100° С. В реакционную смесь затем прибавляют слабое основание, как, например, ацетат калия, и палладиевый катализатор, как, например, комплекс палладий(II)-[1,1’-бис-(дифенилфосфино)-ферроцен]-хлорид-метиленхлорид или PdCl2-(PPh3)2. Полученные таким способом соединения формул XV и Ха, где R1 и/или R1’ означает борсодержащий остаток, такой как В(ОСН3)2 или В(ОС(СН3)2-С(СН3)2-O), могут быть затем, как описано в еc), подвергнуты реакции сочетания с соединением R1-Br, R1-J, R1-OTf с образованием соединений формул XV и Ха, где R1 и/или R1' означает, в случае необходимости замещенный, арильный или гетероарильный остаток.
Соединения формул XV и Ха, где R1 и/или R1’ означает борсодержащий остаток, такой как В(ОН)2, В(ОСН3)2, В(O-(СН2)3-O), В(ОС(СН3)2-С(СН3)2-O) или В(СН2-СН3)2, удается также получить другим образом из соединений формул XV или Ха, где R1 и/или R1’ означает бром или йод. Для этого по известным из литературы способам (например, М. Ishikura и др., Chem. Pharm. Bull. 33, 4755-63 (1985)) арил- или гетероарилгалогениды формул XV или Ха, возможно после защиты присутствующих карбонильных функций в форме, например, ацеталя, переводят действием бутиллития или диизопропиламида лития в тетрагидрофуране при -78° С в соответствующее литиевое соединение, которое затем со своей стороны превращают действием эфира борной кислоты, как, например, триметилового эфира борной кислоты или алкоксидиалкилборана, как, например, метоксидиэтил-боран, в борсодержащее соединение формул XV или Ха.
ее) Другой способ получения соединений формулы Ха, где R1 и/или R1’ являются, в случае необходимости замещенными, арильным или гетероарильным остатком, состоит в том, что соединения формулы XVI, где R1 имеет указанные ранее значения, и Sn(алкил)3, например, обозначает Sn(н-бутил)3, по реакции сочетания Стилле в соответствии с известным из литературы способом, описанным J.K. Stille, Angewandte Chemie, 98, 504-519 (1986), у T.N. Mitchell, Synthesis 803-815 (1992) или у Т. Gan и др.. Tetrahedron Lett. 38, 8453-56 (1997), вводят в реакцию с соединением R1’-Br или R1’-J, причем R1’ является, в случае необходимости замещенным, арильным или гетероарильным остатком, с палладиевым катализом, с, например, Рd(РРh3)4, PdCl2(PPh3)2, PdCl2(PhCN)2 или PdCl2-(СН3СN)2, в растворителе, как, например, тетрагидрофуране, толуоле или диметилформамиде при температурах между 20 и 150° С.
Оловоорганические соединения формулы XVI, со своей стороны, являются доступными, например, из бромированных или иодированных в кольце предшественников путем взаимодействия с производными би-стриалкилолова, например, бистрибутилоловом (Bu3SnSnBu3) по известному из литературы способу (J.K. Stille, Angewandte Chemie, 98, 504-519 (1986); T. Gan и др., Tetragedron Lett. 38, 8453-56 (1997)). Причем добавляют палладиевый катализатор, как, например, Pd(PPh3)4. В качестве растворителя может служить, например, толуол; температуру реакции поддерживают между 20 и 110° С. Кроме того оловоорганические соединения формулы XVI, причем Sn(алкил)3 может быть, например, Sn(СН3)3, могут быть получены по аналогии с известными из литературы способами (М. Gielen и др. Rev. Silicon Germanium Tin Lead Compd. 3, 9 (1997); M. Gielen, Rev. Silicon Germanium Tin Lead Compd. 5, 6 (1981)) путем взаимодействия соответствующих бромированных в ядро предшественников с триметилстаннатом натрия при примерно 0° С.
ef) Равным образом соединения формулы Ха, где R1 и/или R1’ являются, в случае необходимости замещенным, арильным или гетероарильным остатком, могут быть получены тем, что соединения формулы Ха, где R1 и/или R1’ - бром или йод, вводят в реакцию с арил- или гетероарилоловотриалкиленом общей формулы R1-Sn(алкил)3 или R1’-Sn-(алкил)3 где R1 и R1’ являются, возможно замещенным, арильным или гетероарильным остатком, в условиях, описанных под еe).
еg) Соединения формулы Ха, где R1 и/или R1’ = (С2-С6)-алкинил или (С2-С6)-алкенил, могут быть получены по известным из литературы способам, как описано в еc) и ее), путем катализируемого палладием взаимодействия, например, триметилсилилацетилена или алкинов (К. Sonagashira и др.. Tetrahedron Lett. 4467 (1975); S. Takahashi и др.. Synthesis 627 (1980)), алкинилцинкбромидов (Е. Negishi и др., J. Org. Cliem. 62, 8957-60 (1997)) или триалкилоловоалкинов, триалкилолововинильных или аллильных соединений, 1-алкенилборных соединений или винильных соединений (A. Hassner и др., J. Org. Chem. 49, 2546 (1984)) с соединениями формулы Ха, где R1 и/или Rl’ равны бром, йод или OTf.
Полученный каждым из этих способов раствор или суспензию соединений формулы II целесообразно упарить при пониженном давлении и очистить соединения формулы II путем кристаллизации из инертных растворителей, как, например, бензола, толуола, тетрахлорметана, дихлорметана, 1,2-дихлорэтана, циклогексана, пентана, гептана. Предпочтительно также полученные таким образом соединения без дальнейшей очистки в подходящем инертном растворителе вводить во взаимодействие с от 1 до 1,5-кратным количеством тиомочевины формулы III способом, описанным выше под а).
Описанное в способе получения b) взаимодействие соединений формулы IV проводят в растворителе с известными соединениями формулы V. В качестве таких растворителей пригодны низшие спирты с 1 до 4 атомов углерода так же, как и низшие алкиловые эфиры уксусной кислоты с 1 до 4 атомов углерода в алкильной части, как, например, особенно пригодны метиловый эфир уксусной кислоты и этиловый эфир уксусной кислоты. Взаимодействие обычно проводят в температурном интервале между 0 и 60° С, предпочтительно, между 15 и 35° С, причем продолжительность реакции лежит между 5 и 60 ч.
Соединения формулы I могут быть перекристаллизованы из инертного пригодного растворителя, как, например, ацетон, метилэтилкетон, ацетонитрил, нитрометан. Однако особенно предпочтительно, осаждение из растворителя, как, например, диметилформамид, диметилацетамид, нитрометан, ацетонитрил, метанол, этанол, изопропанол. Свободные основания общей формулы I могут также с выгодой быть очищены хроматографически на силикагеле. В качестве элюентов пригодны смеси дихлорметана с метанолом, этилового эфира уксусной кислоты с гептаном, этилового эфира уксусной кислоты с метанолом.
Соединения формулы I в случае необходимости могут быть переведены с помощью кислоты формулы H-Z в их соли. Причем можно соединения формулы I вносить в чистые кислоты при температуре между 0 и 40° С, поскольку они являются жидкими или имеют температуру плавления немного выше, чем 40° С. Однако предпочтительно работать в растворителе, как, например, вода, или органический растворитель, как, например, диоксан, тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, низший алкиловый эфир уксусной кислоты с 1-4 атомами углерода в алкильной части, ацетонитрил, нитрометан, ацетон, метилэтилкетон или низший спирт с 1-4 атомами углерода. Причем на моль соединений I используют 1-1,5 моля кислоты H-Z; но можно использовать также большие количества кислоты. Обычно работают при температуре между 0 и 40° С, предпочтительно, между 10 и 25° С.
При работе в водном растворе после прибавления кислоты H-Z обычно происходит одновременное растворение соединений формулы I и только редко выпадение соответствующего аддитивного соединения кислоты. Целесообразно выделять предложенные соли при образовании раствора путем осторожного упаривания воды, предпочтительно, путем сушки вымораживанием. При работе в органических растворителях труднорастворимые аддитивные соли кислот осаждают многократно после прибавления соответствующей кислоты H-Z. В других случаях аддитивные соединения с кислотами выпадают, в случае необходимости. после предварительного концентрирования, с названным осадителем.
Аддитивные продукты кислот при очень высокой степени очистки выпадают иногда также в форме вязкого масла или аморфного стеклообразного продукта. Эти аморфные продукты могут быть закристаллизованы путем обработки органическим растворителем при температуре от 40 до 80° С. Для этого пригодны, в частности, диалкилкетоны, такие как ацетон или метилэтилкетон, низшие диалкиловые эфиры, также как и ацетонитрил, нитрометан и, в случае необходимости, так же низшие спирты.
Аддитивные продукты кислот могут быть депротонированы путем обработки основаниями в соединения общей формулы I. В качестве оснований рассматривают, например, растворы неорганических гидроксидов, такие как гидроксид лития, натрия, калия, кальция или бария, карбонаты или гидрокарбонататы, такие как карбонат натрия или калия, гидрокарбонат натрия или калия, аммиак и амины, такие как триэтиламин, диизопропиламин, дициклогексиламин, пиперидин, морфолин, метилдициклогексиламин.
При работе в водной среде свободные основные соединения I часто труднорастворимы, осаждаются и могут быть отделены путем фильтрования или экстрагирования органическим растворителем, предпочтительно, этиловым эфиром уксусной кислоты, и выделены. В качестве органических реакционных органических сред особенно пригодны низшие спирты с 1-4 атомами углерода, предпочтительно, метанол, этанол и изопропанол; могут также быть использованы этиловый эфир уксусной кислоты, диэтиловый эфир, тетрагидрофуран, диоксан, диметиловый эфир этиленгликоля, диметилформамид. Работают при температуре от -35 до 60° С, предпочтительно, между 0 и 25° С. Если используют растворитель, смешивающийся с водой, в случае необходимости после предварительного кон-центрирования реакционной смеси, свободные основания формулы I осаждают путем добавления воды. При использовании не смешивающегося с водой растворителя после окончания реакции реакционную смесь промывают водой, и органический растворитель упаривают.
Приведенные далее примеры поясняют изобретение, но не ограничивают его. Измеренные температуры плавления и разложения (т.пл.) не корректировались и в основном зависят от скорости нагревания.
Примеры приведены в табл. 1.
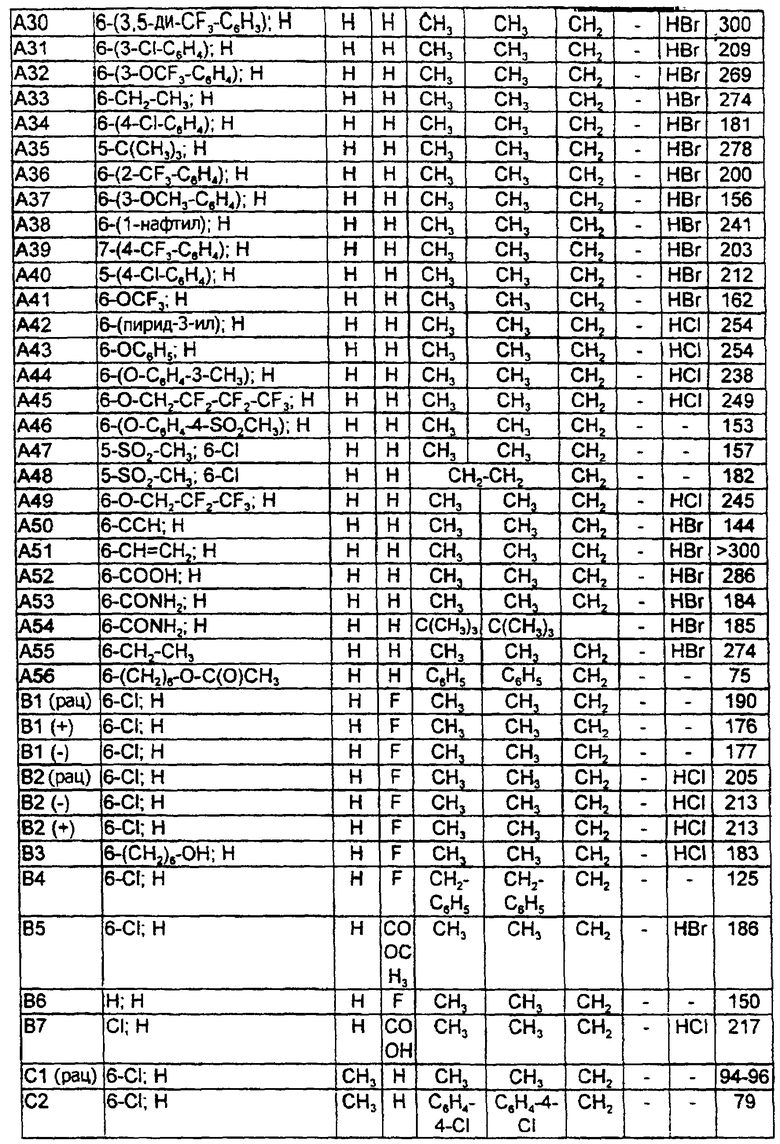
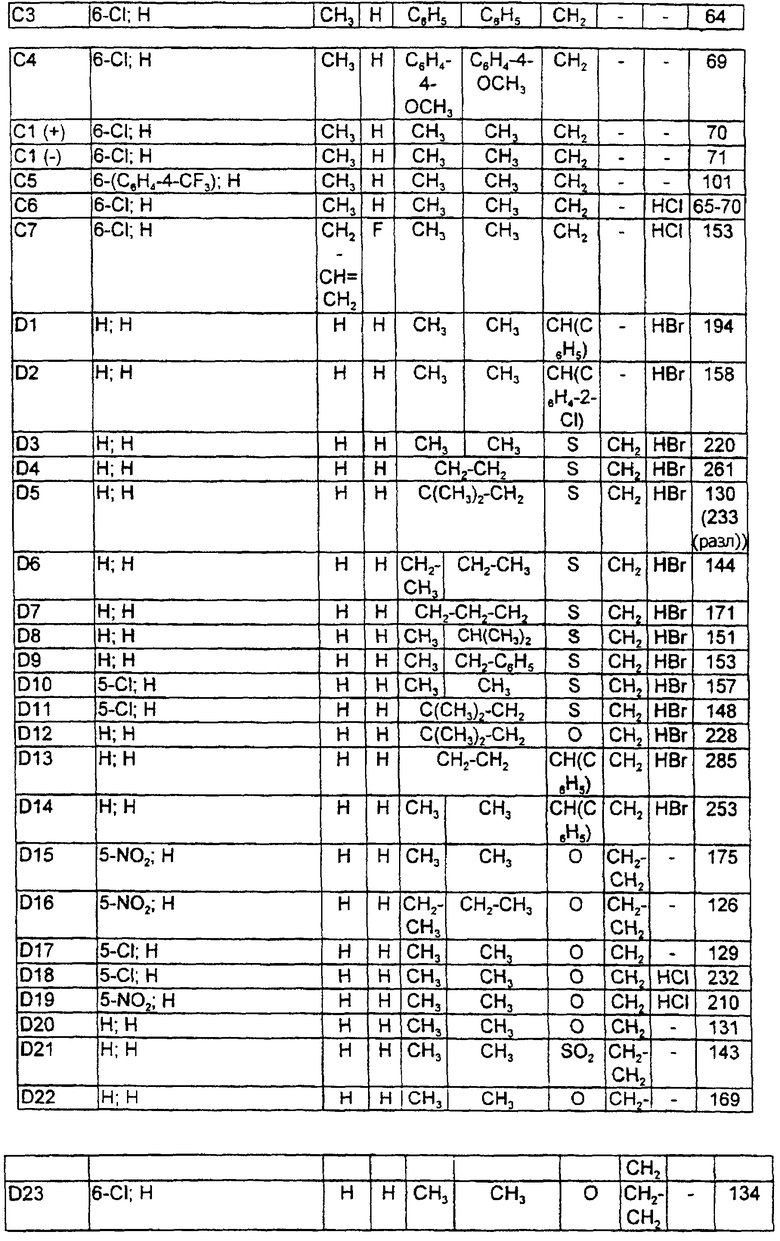
Соединения формулы I проявляют благоприятное действие на жировой обмен, в частности, они применимы в качестве средства, подавляющего аппетит/средства для похудания. Эти соединения могут быть использованы индивидуально или в комбинации с другими средствами для похудания (как они, например, описаны в части 01 Красного листа (Roten Liste). Эти соединения применимы далее для профилактики, а также для лечения диабета типа II.
Активность соединений испытана следующим образом:
Биологический способ испытания:
Испытание подавляющего аппетит действия осуществляли на самцах мышей NMRI. После 24-часовой отмены кормления через желудочный зонд был введен испытуемый препарат. По отдельности при свободном доступе к питьевой воде животным через 30 мин после дачи препарата предлагали сгущеное молоко. Расход сгущеного молока определяли каждые полч в течение 7 ч и наблюдали общее состояние животных. Измеренный расход молока сравнивали с необработанными контрольными животными (см. табл. 2).
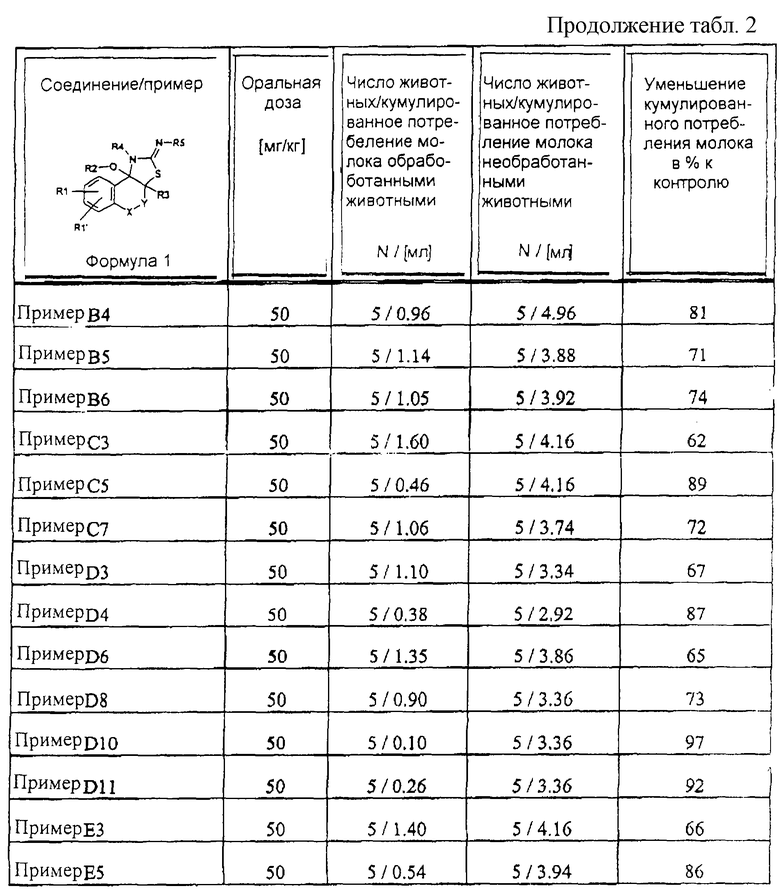
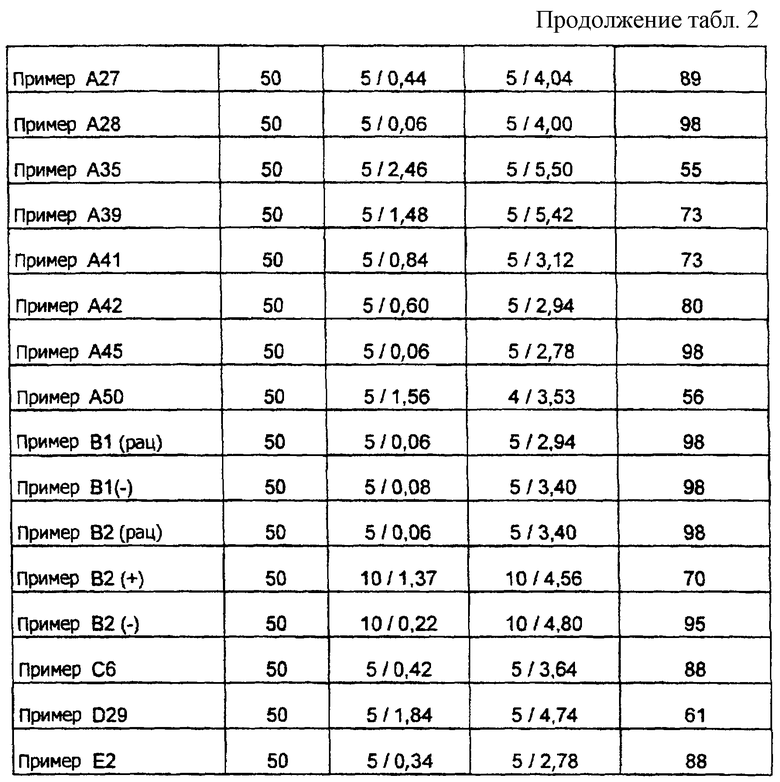
Из табл. 2 видно, что соединения формулы I проявляют очень хорошее снижающее аппетит действие. Снижающее аппетит действие значительно улучшено по сравнению со сравнительным примером.
Далее детально описано получение некоторых соединений, остальные соединения формулы I были получены аналогично:
Пример 1 (соединение А4):
5-Метансульфонил-3-фенил-2-фенилимино-2,3,8,8а-тетра-гидро-индено[1,2-d]тиазол-3а-ол:
a) Хлорангидрид индан-1-он-6-сульфоновой кислоты:
К суспензии 10,7 г имеющегося в продаже 6-аминоиндан-1-она в 100 мл полуконцентрированной соляной кислоты прибавляют по каплям при 0-5° С 5,2 г нитрита натрия в 11 мл воды и затем перемешивают 15 мин. Полученный раствор прибавляют по каплям к смеси 6,4 г CuCl2×2H2O в 20 мл воды и 195 мл насыщенного раствора SО2 в ледяной уксусной кислоте. После ослабления выделения азота перемешивают 1 ч при комнатной температуре. Путем добавления 400 мл воды достигают кристаллизации желаемого продукта (хлорангидрида индан-1-он-6-сульфоновой кислоты), который отсасывают и промывают небольшим количеством холодной воды. Продукт имеет температуру плавления 75° С.
b) Индан-1-он-6-сульфиновая кислота:
Растворяют 2,1 г твердого NaOH и 18,1 г NаНSО3 в 53 мл воды. Добавляют одновременно 2 н NaOH и порциями вносят 8 г хлорангидрида индан-1-он-6-сульфоновой кислоты так, чтобы рН оставался при 7-7,2. Температура при этом поднимается примерно до 35° С. Затем перемешивают 2 ч при комнатной температуре, осторожно подкисляют концентрированной соляной кислотой и упаривают досуха, остаток кипятят дважды примерно с 200 мл метанола, и фильтрат снова упаривают. Остаток растирают с небольшим количеством ацетона, отсасывают и сушат в вакууме. Получают индан-1-он-6-сульфиновую кислоту, которая разлагается при 275° С.
c) 6-Метансульфонил-индан-1-он:
0,75 г Натрия растворяют в 75 мл безводного метанола. Прибавляют порциями 5,9 г индан-1-он-6-сульфиновой кислоты и перемешивают 30 мин. при комнатной температуре. Затем прибавляют 7,5 мл йодистого метила и перемешивают 4 ч при кипячении с обратным холодильником. После стояния в течение ночи упаривают, остаток встряхивают с водой и CH2Cl2, органическую фазу сушат, упаривают, и остаток подвергают кристаллизации с диизо-пропиловым эфиром. После отсасывания и высушивания получают 6-метансульфонил-индан-1-он с температурой плавления 155° С.
d) 2-Бром-6-метансульфонил-индан-1-он:
3,15 г 6-Метансульфонил-индан-1-она суспендируют в 50 мл ледяной уксусной кислоты и смешивают с 0,4 мл 48%-ного раствора НВr. Прибавляют при комнатной температуре 0,92 мл брома в 10 мл ледяной уксусной кислоты и перемешивают 2 ч. Выливают на лед, отсасывают образовавшийся осадок и промывают холодной водой. Продукт очищают путем хроматографии на колонке с SiO2 с дихлорметаном. В качестве первой фракции получают немного дибромпроизводного и в качестве основного продукта 2-бром-6-метансульфонил-индан-1-он с температурой плавления 120° С.
е) 5-Метансульфонил-3-фенил-2-фенилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол:
1,45 г 2-Бром-6-метансульфонил-индан-1-она растворяют в 15 мл ацетона и смешивают при перемешивании с 1,25 г N,N’-дифенилтиомочевины в 25 мл ацетона. Из прозрачного раствора примерно через 2 ч выкристаллизовывается гидробромид 5-метансульфонил-3-фенил-2-фенилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола. После выдерживания в течение ночи отсасывают и промывают небольшим количеством ацетона. 1,7 г гидробромида (т.пл. 247° С) растворяют в 10 мл метанола и смешивают с 0,8 мл триэтиламина. Через 15 мин прибавляют 150 мл воды, перемешивают 30 мин при охлаждении льдом. Образовавшийся продукт отсасывают и промывают небольшим количеством холодной воды. Получают 5-метан-сульфонил-3-фенил-2-фенилимино-2,3,8,8а-тетрагидро-индено-[1,2-d]тиазол-3а-ол с температурой плавления 172° С.
Пример 2 (соединение А9):
3-Этил-2-этилимино-5-(пропан-1-сульфонил)-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол
а) 6-(Пропан-1-сульфонил)-индан-1-он:
0,25 г натрия растворяют в 50 мл безводного метанола. Прибавляют порциями 1,96 г индан-1-он-6-сульфиновой кислоты (смотри выше) и перемешивают 30 мин при комнатной температуре. Затем прибавляют 1,87 г 1-йод-пропана и перемешивают 4 ч при кипячении с обратным холодильником. Для завершения взаимодействия упаривают в вакууме, смешивают с 5 мл йодпропана и 10 мл толуола и нагревают 2 ч с обратным холодильником. Затем упаривают, остаток встряхивают с водой и CH2Cl2, органическую фазу сушат, упаривают, и остаток очищают посредством фильтрационной колонки (SiO2; циклогексан/этилацетат = 2/1). Получают 6-(пропан-1-сульфонил)-индан-1-он с температурой плавления 100° С.
b) 2-Бром-6-(пропан-1-сульфонил)-индан-1-он:
Превращение 6-(пропан-1-сульфонил)-индан-1-она до 2-бром-6-(пропан-1-сульфонил)-индан-1-она осуществляют аналогично получению 2-бром-6-метансульфонил-индан-1-она. Сырой продукт очищают путем кристаллизации и последующего промывания низко кипящим петролейным эфиром. Получают 2-бром-6-(пропан-1-сульфонил)-индан-1-он с температурой плавления 87-89° С.
c) 3-Этил-2-этилимино-5-(пропан-1-сульфонил)-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол:
951 мг 2-Бром-6-(пропан-1-сульфонил)-индан-1-она растворяют в 20 мл ацетона и смешивают при перемешивании с 528 мг N,N’-дифэтилмочевины в 10 мл ацетона. Примерно через 10 мин выкристаллизовывается гидробромид 3-этил-2-этил-имино-5-(пропан-1-сульфонил)-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола. Перемешивают еще 1 ч при комнатной температуре, отсасывают и промывают небольшим количеством ацетона. После высушивания получают гидробромид 3-этил-2-этил-имино-5-(пропан-1-сульфонил)-2,3,8,8а-тетрагидро-индено[1,2-а]тиазол-3а-ола с температурой плавления 146° С. Последний растворяют в 10 мл метанола и смешивают с 0,4 мл триэтиламина. Через 15 мин прибавляют 50 мл воды и перемешивают 1 ч на ледяной бане. Образовавшийся кристаллизат отсасывают, промывают водой и очищают на фильтрационной колонке (SiO2; этилацетат/метанол 3/1). Получают 3-этил-2-этилимино-5-(пропан-1-сульфонил-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол с температурой плавления 136° С.
Соединения примеров Al, A2 (использование имидазолидин-2-тиона), A3 (использование 5-амино-индан-1-она), А5, А6, А7, А8, А10, А17 (использование 4-амино-индан-1-она), А47, А48 (использование 5-хлор-6-нитро-индан-1-она) получены аналогично.
Пример 3 (соединение А21)
Гидробромид 3-этил-2-этилимино-6-фенил-2,3,8,8а-тетра-гидро-индено[1,2-d]тиазол-3а-ола:
а) 5-Фенил-индан-1-он:
4,22 г 5-Бром-индан-1-она, 2,44 г фенилбороновой кислоты и 4,24 г карбоната натрия суспендируют в смеси из 100 мл толуола с 20 мл этанола и 20 мл воды. После прибавления 450 мг ацетата палладия-II и 1,05 г трифенилфосфина смесь нагревают 5 ч с обратным холодильником. После этого этанольную часть реакционной смеси отгоняют в вакууме, реакционную смесь смешивают с 50 мл 0,5 н гидроокиси натрия и 15 мин перемешивают при комнатной температуре. Органическую фазу отделяют, а водную часть еще дважды встряхивают с толуолом. Объединенные органические фазы промывают водой, затем насыщенным раствором поваренной соли, сушат над сульфатом магния и упаривают в вакууме. Остаток перемешивают с н-гептаном, отсасывают, промывают н-пентаном и сушат в вакууме при комнатной температуре. Получают 5-фенил-индан-1-он с температурой плавления 75° С.
b) 2-Бром-5-фенил-индан-1-он:
3,19 г 5-Фенил-индан-1-она растворяют в 25 мл ледяной уксусной кислоты. Прибавляют 10 мкл 48%-ного раствора НВr в ледяной уксусной кислоте и прибавляют по каплям за 15 мин раствор 0,592 мл брома в 5 мл ледяной уксусной кислоты при перемешивании при комнатной температуре. Реакционную смесь следующие два ч перемешивают при комнатной температуре перед прибавлением 0,057 мл брома, перемешивают ч и затем реакционную смесь выливают на ледяную воду (15 г воды, 45 г льда, 150 мг гидрокарбоната натрия). Выпавший осадок отсасывают и хроматографируют на силикагеле с толуолом/этиловым эфиром уксусной кислоты 10/1. Получают 2-бром-5-фенил-индан-1-он с температурой плавления 99-100° С.
с) Гидробромид 3-этил-2-этилимино-6-фенил-2,3,8,8а-тетра-гидро-индено[1,2-d]тиазол-3а-ола:
718 мг 2-Бром-5-фенил-индан-1-она растворяют в 20 мл сухого ацетона. К этому раствору при 5° С прибавляют по каплям за 5 мин раствор 397 мг N,N’-диэтилтиомочевины в 10 мл сухого ацетона. Реакционную смесь перемешивают 2 ч при комнатной температуре, осадок затем отсасывают и промывают ацетоном. Получают гидробромид 3-этил-2-этилимино-6-фенил-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола с температурой плавления 140-141° С (разложение).
Исходя из 5-бром-индан-1-она аналогичным образом получены соединения А22, А24, А25, А26, А29, А30, А31, А32, А34, А36, А37, А38.
Пример 4 (соединение A39):
Гидробромид 3-метил-2-метилимино-7-(4-трифторметилфенил)-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
а) 4-(4-Трифторметилфенил)-индан-1-он:
6,33 г 4-Бром-индан-1-она, 5,7 г 4-(трифторметил)-фенилбороновой кислоты и 6,36 г карбоната натрия суспендируют в смеси из 100 мл толуола с 20 мл этанола и 20 мл воды при перемешивании. В атмосфере инертного газа (аргон) прибавляют 320 мг ацетата палладия-II и 787 мг трифенилфосфина и перемешивают смесь 3 ч с обратным холодильником. Через ч еще раз прибавляют 1,45 г 4-(трифторметил)-фенилбороновой кислоты и 320 мг ацетата палладия-II и кипятят следующие 2 ч. От охлажденной реакционной смеси отгоняют этанол в вакууме, и остаток смешивают с 50 мл 0,5 н гидроокиси натрия, перемешивают и фильтруют. Органическую фазу фильтрата многократно промывают по 50 мл воды и затем 50 мл насыщенного раствора поваренной соли, сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на силикагеле с помощью н-гептана/этилового эфира уксусной кислоты 3/1 и получают 4-(4-трифторметилфенил)-индан-1-он с температурой плавления 81° С.
b) 2-Бром-4-(4-трифторметилфенил)-индан-1-он:
2,76 г 4-(4-Трифторметилфенил)-индан-1-она растворяют в 20 мл ледяной уксусной кислоты. Прибавляют 10 мкл 48%-ного раствора бромистоводородной кислоты в ледяной уксусной кислоте и медленно прибавляют по каплям раствор 0,516 мл брома в 5 мл ледяной уксусной кислоты. Реакционную смесь перемешивают 3 ч при комнатной температуре и затем выливают в смесь 100 мл воды, 100 г льда и 100 мг гидрокарбоната натрия. Водную суспензию встряхивают с дихлорметаном, органическую фазу трижды промывают водой, сушат над сульфатом магния, упаривают и хроматографируют на силикагеле дихлорметаном/н-гептаном 3/1. Получают 2-бром-4-(4-трифторметил-фенил)-индан-1-он с температурой плавления 94-97° С.
с) Гидробромид 3-метил-2-метилимино-7-(4-трифторметил-фенил)-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола:
426 мг 2-Бром-4-(4-трифторметилфенил)-индан-1-она и 131 мг N,N’-диметилтиомочевины в 10 мл ацетона объединяют при комнатной температуре и перемешивают 4 ч. Выпавший осадок отсасывают, промывают ацетоном и сушат в вакууме. Получают гидробромид 3-метил-2-метилимино-7-(4-трифторме-тилфенил)-2,3,8,8а-тетрагидро-индено-[1,2-d]тиазол-3а-ола с температурой плавления 202-204° С.
Исходя из 4-бром-индан-1-она аналогичным образом получено соединение А40.
Пример 5 (соединение А42)
Гидрохлорид 3-метил-2-метилимино-6-пиридин-3-ил-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
а) 5-Пиридин-3-ил-индан-1-он:
13,26 г 3-Бромпиридина растворяют в 160 мл диэтилового эфира и охлаждают до -60° С. К этому раствору за 30 мин прибавляют по каплям 52 мл 1,6-молярного раствора н-бутиллития в н-гексане. Оставляют раствор нагреваться до -30° С и при этой температуре прибавляют по каплям при перемешивании 9,5 мл триметилового эфира борной кислоты. Реакционную смесь нагревают 3 ч с обратным холодильником, затем охлаждают до 0° С и прибавляют по каплям 6,1 мл 1,3-пропандиола. Эту смесь перемешивают 30 мин при 0° С, прежде чем прибавить по каплям 5,46 мл метансульфоновой кислоты, и перемешивают еще 30 мин. После этого прибавляют 20 г целита, нагревают смесь до комнатной температуры, фильтруют, фильтрат упаривают, остаток перемешивают с 700 мл толуола, снова фильтруют и отгоняют растворитель в вакууме. 4,1 г остатка (3-[1,3,2]диоксаборинан-2-ил-пиридина) без дальнейшей очистки вместе с 4,22 г 5-броминдан-1-она и 4,24 г карбоната натрия растворяют в смеси 100 мл толуола с 20 мл этанола и 20 мл воды. Раствор дегазируют аргоном и после этого прибавляют 112 мг ацетата палладия-II и 262 мг трифенилфосфина. Реакционную смесь кипятят 4 ч с обратным холодильником, и этанольную часть смеси отгоняют в вакууме. После этого прибавляют при перемешивании 50 мл 0,5 н гидроокиси натрия, органическую фазу отделяют, а водную фазу встряхивают с толуолом. Объединенные органические фазы последовательно встряхивают с водой и насыщенным раствором поваренной соли, сушат над сульфатом магния, упаривают в вакууме и очищают путем хроматографии на силикагеле этиловым эфиром уксусной кислоты/н-гептаном 1/1. Получают 5-пиридин-3-ил-индан-1-он с температурой плавления 103-106° С.
b) 2-Хлор-5-пиридин-3-ил-индан-1-он:
3,22 г 5-Пиридин-3-ил-индан-1-она растворяют в 160 мл дихлорметана и при 0° С за 15 мин смешивают по каплям с раствором 1,34 мл сульфурилхлорида в 40 мл дихлорметана. Затем перемешивают 30 мин при 0° С и 60 мин при комнатной температуре, перед тем как медленно прибавить 50 мл насыщенного раствора гидрокарбоната натрия. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния, упаривают в вакууме и очищают путем хроматографии на силикагеле дихлорметаном/метанолом 50/1. Получают (наряду с 2,2-дихлор-5-пиридин-3-ил-индан-1-оном с температурой плавления 109° С) 2-хлор-5-пиридин-3-ил-индан-1-он с температурой плавления 103-105° С.
c) Гидрохлорид 3-метил-2-метилимино-6-пиридин-3-ил-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола:
366 мг 2-Хлор-5-пиридин-3-ил-индан-1-она и 235 мг N,N’-диметилтиомочевины растворяют в 5 мл метанола и кипятят 7 ч с обратным холодильником. Реакционную смесь охлаждают и упаривают в вакууме. Остаток смешивают с 5 мл ацетона, 30 мин перемешивают в ультразвуковой бане и затем отсасывают. Остаток промывают ацетоном и сушат в вакууме. Получают гидрохлорид 3-метил-2-метилимино-6-пиридин-3-ил-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ола с температурой плавления 253-255° С.
Пример 6 (соединение А41):
Гидробромид 3-метил-2-метилимино-6-трифторметокси-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
a) Метиловый эфир 3-трифторметокси-коричной кислоты:
9,15 г 3-Трифторметоксикоричной кислоты растворяют в 90 мл метанола. Прибавляют 0,25 мл концентрированной серной кислоты, и смесь кипятят 5 ч с обратным холодильником. Охлажденный раствор осторожно смешивают с 0,9 г гидрокарбоната натрия, перемешивают 5 мин и затем упаривают в вакууме. Остаток вносят в 250 мл этилового эфира уксусной кислоты, дважды промывают, используя по 50 мл воды, и сушат над сульфатом магния. Раствор упаривают в вакууме, и оставшееся светлое масло используют без дальнейшей очистки.
b) Метиловый эфир 3-(3-трифторметоксифенил)пропионовой кислоты:
9,6 г Метилового эфира 3-трифторметоксикоричной кислоты растворяют в 200 мл метанола. Прибавляют 750 мг палладия на угле (10%-ного) и гидрируют при нормальном давлении. После обычной обработки получают метиловый эфир 3-(3-трифтор-метоксифенил)пропионовой кислоты в виде светлого масла.
с) 5-Трифторметокси-индан-1-он:
9,37 г Метилового эфира 3-(3-трифторметоксифенил)-пропионовой кислоты растворяют в 50 мл этанола с 25 мл воды. Добавляют 3,74 г гидроксида калия и кипятят 45 мин с обратным холодильником. Охлажденный раствор упаривают, остаток смешивают с 25 мл воды, и прибавляют при перемешивании концентрированную соляную кислоту до достижения рН 1. Водную реакционную смесь дважды встряхивают, используя по 75 мл дихлорметана. Органическую фазу промывают водой, сушат над сульфатом магния, упаривают и сушат в вакууме. Получают 3-(3-трифторметоксифенил)пропионовую кислоту в виде бесцветного масла. 6,24 г кислоты растворяют в 40 мл толуола, смешивают с 2,1 мл тионилхлорида и кипятят 1 ч с обратным холодильником. Охлажденную реакционную смесь упаривают, остаток вносят в 5 мл толуола и снова упаривают. Получают хлорангидрид 3-(3-трифторметоксифенил)пропионовой кислоты, которую без дальнейшей очистки растворяют в 30 мл дихлорметана и при 0-5° С прибавляют по каплям при перемешивании за 15 мин к суспензии 5,49 г безводного треххлористого алюминия в 40 мл дихлорметана. Реакционную смесь перемешивают один ч при 0° С и затем вносят в 40 мл ледяной воды. Органическую фазу отделяют, а водную фазу снова встряхивают с 40 мл дихлорметана. Объединенные органические фазы промывают 40 мл насыщенного раствора гидрокарбоната натрия и водой, сушат над сульфатом магния, упаривают в вакууме и очищают путем хроматографии на силикагеле толуолом/этиловым эфиром уксусной кислоты 20/1. Получают 5-три-фторметокси-индан-1-он в виде светло-желтого масла.
а) 2-Бром-5-трифторметокси-индан-1-он:
5,3 г 5-Трифторметокси-индан-1-она растворяют в 50 мл ледяной уксусной кислоты, смешивают со 110 мкл бромистоводородной кислоты (48%-ной в ледяной уксусной кислоте) и при комнатной температуре смешивают по каплям с раствором 1,305 мл брома в 12 мл ледяной уксусной кислоты. Реакционную смесь перемешивают 90 мин при комнатной температуре и затем смешивают с 70 мл воды и дважды встряхивают, используя по 100 мл дихлорметана. Органическую фазу промывают 50 мл воды, сушат над сульфатом магния, упаривают в вакууме и хроматографируют на силикагеле толуолом/этиловым эфиром уксусной кислоты 50/1. Получают 2-бром-5-трифторметокси-индан-1-он в виде воска.
е) Гидробромид 3-метил-2-метилимино-6-трифторметокси-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола:
0,197 мг 2-Бром-5-трифторметокси-индан-1-она с 0,104 г N,N’-диметилтиомочевины растворяют в 5 мл ацетона и кипятят 5 ч с обратным холодильником. Полученную суспензию перемешивают еще 1 ч при 0° С и затем отсасывают; остаток промывают ацетоном и упаривают в вакууме. Гидробромид 3-метил-2-метилимино-6 -трифторметокси-2,3,8,8а-тетрагидро-инено[1,2-d]тиазол-3а-ола плавится при 162° С с разложением.
Пример 7 (соединение A35):
Гидробромид 5-трет-бутил-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола:
a) Метиловый эфир 3-(4-трет-бутилфенил)акриловой кислоты:
3-(4-Трет-бутилфенил)акриловую кислоту в метаноле аналогично примеру 6а) подвергают взаимодействию с серной кислотой до метилового эфира 3-(4-третбутилфенил)акриловой кислоты. Эфир имеет воскообразную консистенцию с температурой плавления около 35° С.
b) Метиловый эфир 3-(4-трет-бутилфенил)пропионовой кислоты:
10,0 г Метилового эфира 3-(4-трет-бутилфенил)акриловой кислоты растворяют в 75 мл абсолютного метанола. Порциями в течение одного ч прибавляют 2,45 г магниевой стружки, и смесь три ч перемешивают при комнатной температуре. Затем добавляют 380 мл магниевой стружки и перемешивают еще один час. После охлаждения (ледяная баня) осторожно прибавляют по каплям при перемешивании 90 мл 2 н соляной кислоты. После этого метанол удаляют в вакууме, остаток дважды экстрагируют, используя по 200 мл дихлорметана, дихлорметановую фазу промывают водой до нейтральной реакции (2× 50 мл), сушат над сульфатом магния и упаривают. Получают метиловый эфир 3-(4-трет-бутилфенил)пропионовой кислоты в виде бесцветного воскообразного соединения.
c) 3-(4-Трет-бутилфенил)пропионовая кислота:
9,90 г Метилового эфира 3-(4-трет-бутилфенил)пропионовой кислоты растворяют в смеси из 30 мл этанола с 15 мл воды, смешивают с 4,46 г гидроксида калия, нагревают 45 мин с обратным холодильником, затем упаривают в вакууме, смешивают с 30 мл воды и при охлаждении на ледяной бане доводят рН до 1 концентрированной соляной кислотой. Водный раствор трижды встряхивают с по 100 мл дихлорметана, промывают водой до нейтральной реакции, сушат над сульфатом магния и упаривают в вакууме. Остаток перемешивают со 100 мл 25%-ной уксусной кислоты, охлаждают до 10° С и отсасывают, и сушат в вакууме. Получают 3-(4-трет-бутилфенил)пропионовую кислоту, которую подают на следующую стадию без дальнейшей очистки.
d) 3-(4-Трет-бутилфенил)пропионилхлорид:
Хлорангидрид кислоты получают аналогично примеру 6с) и без дальнейшей очистки вводят на следующую стадию.
e) 6-Трет-бутил-индан-1-он:
Из хлорангидрида кислоты 7d получают 6-трет-бутил-индан-1-он, как описано в 6с). 6-Трет-бутил-индан-1-он имеет температуру плавления 94-96° С.
f) 2-Бром-6-трет-бутил-индан-1-он:
По способу, описанному в 6d), 6-трет-бутил-индан-1-он превращают в 2-бром-6-трет-бутил-индан-1-он; он имеет температуру плавления 58-61° С.
д) Гидробромид 5-трет-бутил-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола:
Взаимодействие 267 мг 2-бром-6-трет-бутил-индан-1-она с 156 мг N,N’-диметилтиомочевины в 10 мл ацетона дает гидробромид 5-трет-бутил-3-метил-2-метилимино-2,3,8,8а-индено-[1,2-d]тиазол-3а-ола с температурой плавления 277-279° С.
Пример 8 (соединение А23):
Гидробромид 3а-гидрокси-3-метил-2-метилимино-3,3а,8,8а-тетрагидро-2Н-индено[1,2-d]тиазол-6-карбонитрила:
а) 1-Оксо-индан-5-карбонитрил:
9,5 г 5-Броминдан-1-она и 4,93 г CuCN суспендируют в 10 мл диметилформамида и 4 ч кипятят с обратным холодильником. К охлажденной, темно-коричневой вязкой суспензии при перемешивании прибавляют по каплям раствор 18 г хлорида железа-III в 5 мл концентрированной соляной кислоты с 30 мл воды и затем перемешивают 30 мин при 70° С. Реакционную смесь трижды встряхивают, используя по 50 мл толуола, и объединенные органические фазы встряхивают с 50 мл 2 н соляной кислоты и 50 мл 2 н гидроокиси натрия и затем с водой до нейтральной реакции. Толуольный экстракт сушат над сульфатом магния, упаривают в вакууме, и остаток перекристаллизовывают из н-гептана. Получают 1-оксо-индан-5-карбонитрил с температурой кипения 123-125° С.
b) 2-Бром-1-оксо-индан-5-карбонитрил:
Бромирование 1-оксо-индан-5-карбонитрила осуществляют аналогично примеру 6d) и получают 2-бром-1-оксо-индан-5-карбонитрил с температурой плавления 115-118° С.
c) Гидробромид 3а-гидрокси-3-метил-2-метилимино-3,3а,8,8а-тетрагидро-2Н-индено[1,2-d]тиазол-6-карбонитрила:
236 мг 2-Бром-1-оксо-индан-5-карбонитрила растворяют в 10 мл ацетона и при 0-5° С смешивают с 210 мг N,N’-диметилтиомочевины. Смесь перемешивают 3 ч при комнатной температуре и 1 ч при 0° С. Продукт реакции отсасывают, промывают ацетоном и сушат в вакууме. Получают гидробромид 3а-гидрокси-3-метил-2-метил-имино-3,3а,8,8а-тетрагидро-2Н-индено[1,2-d]тиазол-6-карбонитрила с температурой плавления 282-284° С (разложение).
Аналогичным способом получили соединение А12 из 6-бром-индан-1-она.
Пример 9 (соединение А18):
3-Метил-2-метилимино-5-метилсульфонил-6-фенилтио-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол
a) 6-Метилсульфонил-5-фенилтио-1-инданон:
К суспензии, полученной из 4,9 г 5-хлор-6-метилсульфонил-1-инданона, 1,4 г безводного размолотого карбоната калия и 50 мл ДМФА, прибавляют по каплям в атмосфере аргона при перемешивании 2,55 мл тиофенола и нагревают, продолжая перемешивание, примерно 10 ч при 80° С. После прибавления 500 мл воды при комнатной температуре кристаллы отфильтровывают и очищают путем растворения в ацетоне, обработки активированным углем и последующего осаждения водой. Светло-желтое кристаллическое вещество, температура плавления 211-212° С.
b) 2-Бром-6-метилсульфонил-5-фенилтио-1-инданон получают путем прибавления по каплям смеси из 0,39 мл брома в 10 мл ледяной уксусной кислоты к перемешиваемому раствору из 2,4 г 6-метилсульфонил-5-фенилтио-1-инданона, 0,2 мл концентрированной водной бромистоводородной кислоты и 30 мл ледяной уксусной кислоты, последующего выливания реакционной смеси в суспензию из воды и льда и последующего фильтрования кристаллического продукта. Слабо-желтое кристаллическое вещество, температура плавления 158-160° С.
c) Гидробромид 3-метил-2-метилимино-5-метилсульфонил-6-фенилтио-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
В раствор 2,7 г 2-бром-6-метилсульфонил-5-фенилтио-1-инданона в 30 мл ацетона вносят 0,72 г N,N’-диметилтиомочевины, перемешивают один ч при комнатной температуре, отфильтровывают кристаллическое соединение с температурой плавления 268-270° С с разложением.
а) 3-Метил-2-метилимино-5-метилсульфонил-6-фенилтио-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол
Гидробромид 3-метил-2-метилимино-5-метилсульфонил-6-фенилтио-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола суспендируют в метаноле и смешивают с 3-кратным молярным избытком триэтиламина. Полученный раствор фильтруют и вызывают кристаллизацию путем растирания стеклянной палочкой. Бесцветное кристаллическое соединение, температура плавления 142-143° С с разложением.
Пример 10 (соединение А48):
Гидробромид 8-хлор-5а-гидрокси-3,4-дигидро-7-метил-сульфонил-индано[2,1-b]имидазо[1,2-d]тиазолидина
а) 5-Хлор-6-нитро-1-инданон:
86 г 5-Хлор-1-инданона вносят при перемешивании и внешнем охлаждении в 540 мл дымящей азотной кислоты с плотностью 1,52 г/мл таким образом, чтобы внутренняя температура поддерживалась между -15 и -10° С. Реакционную смесь выливают в перемешиваемую суспензию воды со льдом и отфильтровывают кристаллическое желтое вещество. Очистка путем растворения в смеси из 2 частей ацетона и 5 частей этанола, обработки активированным углем и последующим удалением ацетоновой части путем перегонки при пониженном давлении. Температура плавления 126-128° С.
b) 6-Амино-5-хлор-1-инданон:
К кипящей суспензии из 30 г 5-хлор-6-нитро-1-инданона в 400 мл воды прибавляют по каплям в течение одного ч при поддерживании кипения раствор из 77,5 г гидросульфита натрия в 250 мл воды и кипятят еще 2 ч с обратным холодильником. Осторожно устанавливают концентрированной соляной кислотой рН 1-2 и нагревают еще один ч до кипения. После охлаждения кристаллы отфильтровывают, промывают водой и перекристаллизовывают из изопропанола. Кристаллическое вещество от бесцветного до коричневатого, температура плавления 210-212° С с разложением.
c) 5-Хлор-6-хлорсульфонил-1-инданон:
К суспензии 26,8 г 6-амино-5-хлор-1-инданона в 200 мл 20%-ной соляной кислоты прибавляют по каплям при хорошем перемешивании и охлаждении раствор 10,4 г нитрита натрия в 30 мл воды, причем температуру поддерживают между 0 и 5° С. При этом получают раствор, который после дальнейшего перемешивания при 0° С порциями при перемешивании вносят в раствор из 12,7 г дигидрата хлорида меди-II, 50 мл воды и 400 мл насыщенной диоксидом серы ледяной уксусной кислоты при 0-5° С. Перемешивают еще один ч без внешнего охлаждения, соединяют затем с 600 мл воды и отфильтровывают кристаллы, которые несколько раз промывают на фильтре холодной водой и затем сушат в вакууме. Бесцветное кристаллическое вещество; температура плавления 147-148° С.
d) 5-Хлор-1-инданон-6-сульфиновая кислота:
К раствору из 26 г гидросульфата натрия и 3 г NaOH в 75 мл воды порциями при перемешивании прибавляют 13,3 г 5-хлор-6-хлорсульфонил-1-инданона, причем одновременно из капельной воронки прибавляют по каплям 2 н гидроокиси натрия так, чтобы рН поддерживалось между 7 и 7,5. После этого устанавливают концентрированной соляной кислотой рН 1-2, охлаждают до 0° С, -5° С, кристаллы отфильтровывают и промывают водой. Температура плавления >300° С с почернением при 170° С.
e) 5-Хлор-6-метилсульфонил-1-инданон:
К раствору метилата натрия, который получен из 150 мл метанола и 1 г натрия, прибавляют сначала 9,2 г 5-хлор-1-инданон-6-сульфиновой кислоты и затем 15 г йодистого метила, и смесь нагревают с эффективным обратным холодильником 10 ч до кипения. После отгонки растворителя остаток смешивают с 200 мл воды, кристаллы отфильтровывают, и продукт тщательно промывают водой.
Бесцветное кристаллическое вещество из метанола после обработки активированным углем, температура плавления 197-198° С.
f) 2-Бром-5-хлор-6-метилсульфонил-1-инданон:
получают из 6,8 г 5-хлор-6-метилсульфонил-1-инданона и 1,45 г брома в ледяной уксусной кислоте. От бесцветного до светло-коричневого кристаллическое вещество, температура плавления 144° С.
д) Гидробромид 8-хлор-5а-гидрокси-3,4-дигидро-7-метилсульфонил-индано[2,1-b]имидазо[1,2-d]тиазолидина
К раствору из 3,24 г 2-бром-5-хлор-6-метилсульфонил-1-инданона в 50 мл ацетона добавляют при перемешивании теплый раствор из 1,02 г 2-имидазо-лидинтиона в 7,5 мл диметилацетамида и перемешивают следующие два ч при комнатной температуре. Бесцветное кристаллическое соединение отфильтровывают и несколько раз промывают ацетоном. Температура разложения 135° С.
h) 8-Хлор-5а-гидрокси-3,4-дигидро-7-метилсульфонил-индано[2,1-b]имидазо[1,2-d]тиазолидин получают аналогично примеру 9 из гидробромида 8-хлор-5а-гидрокси-3,4-дигидро-7-метилсульфонил-индано[2,1-b]имидазо[1,2-d]тиазолидина и триэтиламина в метаноле. Бесцветное кристаллическое вещество, температура разложения 192° С.
Пример 11 (соединение А27):
Гидрохлорид 6-(4-хлорфенокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
a) 5-(4-Хлорфенокси)-1-инданон:
2,82 г 4-Хлорфенола после растворения в 60 мл безводного диметилацетамида перемешивают с 8,2 г безводного и размолотого карбоната калия 1/2 ч при комнатной температуре. После прибавления 1,5 г 5-фторинданона перемешивают 10 ч при 120-130° С, и отгоняют после охлаждения растворитель при пониженном давлении. Остаток смешивают с водой и несколько раз экстрагируют этилацетатом. Органическую фазу промывают 2 н NaOH и затем водой, затем перемешивают 15 мин после добавления активированного угля, и растворитель после высушивания над безводным сульфатом магния отгоняют при пониженном давлении. Частично кристаллический темный остаток очищают путем хроматографии на колонке с силикагелем с элюентом, состоящим из равных частей этилацетата и толуола. Коричневые кристаллы, температура плавления 75-80° С.
b) 2-Бром-5-(4-хлорфенокси)-1-инданон:
К раствору 1,3 г 5-(4-хлорфенокси)-1-инданона в 30 мл этилового эфира уксусной кислоты прибавляют по каплям примерно 1/2 мл раствора из 0,25 мл брома в 5 мл этилового эфира уксусной кислоты и медленно нагревают до обесцвечивания брома или до начинающегося выделения НВr. После этого охлаждают и прибавляют по каплям при комнатной температуре остальное количество брома, оставляют перемешиваться еще 2 ч, и отгоняют растворитель при пониженном давлении. Остающееся темное масло используют без дальнейшей очистки.
c) Гидробромид 6-(4-хлорфенокси)-3-метил-2-метилимино-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ола получают путем взаимодействия 1,69 г 2-бром-5-(4-хлорфенокси)-1-инданона и 0,52 г N.N’-диметилтиомочевины в 25 мл этилацетата в виде от светло-желтого до бесцветного кристаллического осадка. Температура плавления 252-255° С.
d) 6-(4-Хлорфенокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол получают путем обработки раствора 1,5 г гидробромида 6-(4-хлорфенокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола в 40 мл метанола 2,3 мл триэтиламина. Растворитель отгоняют, и остаток отверждают под водой. Аморфное твердое вещество, температура плавления 85-90° С.
e) Гидрохлорид 6-(4-хлорфенокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола получают путем прибавления раствора HCl-газа в простом диэтиловом эфире к раствору 1,2 г 6-(4-хлорфенокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]-тиазол-3а-ола в 30 мл этилацетата до сильно кислой реакции в виде кристаллического бесцветного осадка. Температура плавления 247-250° С.
Пример 12 (соединение А28):
Гидробромид 6-{2,2,2-трифторэтокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
a) 5-(2,2,2-Трифторэтокси)-1-инданон:
2,2 мл 2,2,2-трифторэтанола прибавляют к перемешиваемой смеси из 3,5 г 5-фторинданона, 20 мл безводного диметилфомамида и 4,1 г безводного и размолотого карбоната калия и перемешивают 10 ч при 80° С. Растворитель отгоняют при пониженном давлении, остаток растворяют в этилацетате, и органическую фазу несколько раз промывают водой. Получают производное инданона в виде коричневатого кристаллического твердого вещества после хроматографии на силикагеле со смесью из равных частей этилацетата и толуола в качестве элюента. Температура плавления 93-97° С.
b) 2-Бром-5-(2,2,2-трифторметокси)-1-инданон получают путем взаимодействия 0,9 г 5-(2,2,2-трифторэтокси)-1-инданона с 0,2 мл брома в 25 мл ледяной уксусной кислоты. Соединение используют без дальнейшей очистки.
с) Гидробромид 6-(2,2,2-трифторэтокси)-3-метил-2-метил-имино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола получают путем взаимодействия 1,2 г 2-бром-5-[2,2,2-трифторэтокси)-1-инданона и 0,4 г N,N’-диметилтиомочевины в 25 мл этилацетата в виде от светло-желтого до бесцветного кристаллического осадка. Температура плавления 278-280° С.
d) 6-(2,2,2-Трифторэтокси)-3-метил-2-метилимино-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ол получают из гидробромида 6-(2,2,2-трифторэтокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола и триэтиламина. Бесцветное кристаллическое твердое вещество, температура плавления 138-140° С.
е) Гидрохлорид 6-(2,2,2-трифторэтокси)-3-метил-2-метил-имино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола получают из 6-(2,2,2-трифторэтокси)-3-метил-2-метил-имино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола и раствора HCl-газа в простом эфире. Бесцветные кристаллы, температура плавления 274-276° С.
Пример 13 (соединение А45):
Гидрохлорид 5-(2,2,3,3,4,4,4-гептафторбутокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
a) 5-(2,2,3,3,4,4,4-Гептафторбутокси)-1-инданон:
получают из 6,5 г 5-фторинданона и 35,6 г безводного и размолотого карбоната калия в 50 мл безводного диметилацетамида в виде масла цвета меда.
b) 2-Бром-5-(2,2,3,3,4,4,4-гептафторбутокси)-1-инданон
получают путем взаимодействия 4,16 г 5-(2,2,3,3,4,4,4-гептафторбутокси)-1-инданона с 0,69 мл брома в 110 мл этилацетата. Соединение выделено в виде коричневого масла и использовано без дальнейшей очистки.
c) Гидробромид 6-(2,2,3,3,4,4,4-гептафторбутокси)-3-метил-2-метилимино-индено[1,2-d]тиазол-3а-ола получают путем взаимодействия 1,4 г 2-бром-5-(2,2,3,3,4,4,4-гептафторбутокси)-1-инданона и 0,36 г N,N’-диметилтиомочевины в 40 мл этилацетата в виде от светло-желтого до бесцветного кристаллического осадка. Температура разложения 253° С.
d) 6-(2,2,3,3,4,4,4-Гептафторбутокси)-3-метил-2-метилимино-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ол получают из гидробромида 6-(2,2,3,3,4,4,4-гептафторбутокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено-[1,2-d]тиазол-3а-ола и триэтиламина. Бесцветное кристаллическое твердое вещество, температура плавления 138-140° С.
e) Гидрохлорид 6-(2,2,3,3,4,4,4-гептафторбутокси)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
получают из 6-(2,2,3,3,4,4,4-гептафторбутокси)-3-метил-2-метилимино-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ола и эфирной соляной кислоты. Бесцветные кристаллы, температура плавления 248-250° С.
Пример 14 (соединение В1):
6-Хлор-8а-фтор-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол:
а) 5-Хлор-2-фтор-индан-1-он:
К раствору 5,24 г диизопропиламина в 60 мл сухого тетрагидрофурана медленно прибавляют по каплям при температуре <-50° С 25 мл 1,6-молярного раствора н-бутиллития в н-гексане; смесь затем перемешивают еще 10 мин при -50° С. Затем медленно прибавляют раствор 6,33 г 5-хлор-индан-1-она в 60 мл сухого тетрагидрофурана, и смесь перемешивают следующие 20 мин при -50° С. Наконец, прибавляют по каплям 11,4 г N-фтор-дибензосульфимида, растворенного в 60 мл сухого тетрагидрофурана. При перемешивании оставляют смесь нагреваться в течение 2 ч до 0° С, прибавляют по каплям 120 мл насыщенного раствора гидрокарбоната натрия, отгоняют тетрагидрофуран в вакууме, и остаток дважды встряхивают со 150 мл этилового эфира уксусной кислоты. Органическую фазу промывают водой и насыщенным раствором поваренной соли, сушат над сульфатом магния, упаривают и очищают путем хроматографии на силикагеле с диизопропиловым эфиром/н-гептаном 1/1. Наряду с 5-хлор-2,2-дифтор-индан-1-оном получают 5-хлор-2-фтор-индан-1-он с температурой плавления 102-104° С.
b) 5-Хлор-2-бром-2-фтор-индан-1-он:
Бромирование 5-хлор-2-фтор-индан-1-она осуществляют аналогично 6d), и получают 5-хлор-2-бром-2-фтор-индан-1-он с температурой плавления 104-105° С.
c) 6-Хлор-8а-фтор-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол:
263 мг 5-Хлор-2-бром-2-фтор-индан-1-она и 156 мг N,N’-диметилтиомочевины растворяют в 5 мл ацетона и перемешивают первые 90 мин при комнатной температуре и затем 2 ч при 50° С. Реакционную смесь охлаждают и упаривают в вакууме. К остатку добавляют 5 мл толуола и смесь нагревают 2 ч с обратным холодильником, охлаждают, смешивают со 152 мг триэтиламина и перемешивают 2 ч при комнатной температуре. Остаток отсасывают, промывают небольшим количеством воды и сушат в вакууме. Получают 6-хлор-8а-фтор-3-метил-2-метилимино-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ол с температурой плавления 189-190° С.
Пример 15 (соединение В2):
Гидрохлорид 6-хлор-8а-фтор-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-она:
1 г (4,47 ммоля) 6-Хлор-8а-фтор-3-метил-2-метилимино-1,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола растворяют в 120 мл теплого изопропанола и смешивают с 1,2 г примерно 20%-ного эфирного раствора НСl. После 1 ч при комнатной температуре реакционную смесь упаривают, и остаток растирают с ацетоном, отсасывают, и остаток сушат в вакууме. Получают гидрохлорид 6-хлор-8а-фтор-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-а]тиазол-3а-ола с температурой плавления 205° С (разл.).
Пример 16 (соединения B1(-) и В1(+):
100 мг рацемической смеси соединения В1 разделяют на колонке высокоэффективной жидкостной хроматографии (CSP Chiralpak AD 250× 4,6) с н-гексаном/этанолом 10+1 на энантиомеры. Получают (-)-вращающий энантиомер В1(-) с временем удержания 7,9 мин с температурой плавления 175-79° С (разл.) и (+)-вращающий энантиомер В1 (+) с временем удержания 8,84 мин с температурой плавления 172-77° С (разл).
Пример 17 (соединения С1 и С6):
(6-Хлор-3а-метокси-3-метил-3,3а,8,8а-тетрагидро-индено[1,2-d]тиазол-2- илиден)метиламин (гидрохлорид):
5 г Гидрохлорида 6-хлор-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола растворяют в 200 мл метанола и нагревают три дня с обратным холодильником. Охлажденную реакционную смесь упаривают в вакууме, остаток растирают с 50 мл ацетона и фильтруют. Фильтрат упаривают, суспендируют в 100 мл этилового эфира уксусной кислоты и смешивают со 100 мл насыщенного раствора гидрокарбоната натрия. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния, упаривают и хроматографируют на силикагеле этиловым эфиром уксусной кислоты/метанолом 9/1. Получают 6-хлор-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ол с температурой плавления 94-96° С.
Гидрохлорид этого соединения (соединение С6) получают таким образом: свободное основание растворяют в метил-трет-бутиловом эфире и при перемешивании и охлаждении на ледяной бане добавляют эфирную соляную кислоту до достижения рН около 1. После этого реакционную смесь перемешивают еще 3 ч при комнатной температуре, растворитель отгоняют, остаток смешивают с ацетоном и фильтруют. Фильтрат упаривают в вакууме, остаток сушат в вакууме. Получают гидрохлорид 6-хлор-3-метил-2-метилимино-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ола с температурой плавления 65-70° С.
Соединения С2-С5 получают аналогичным образом.
Пример 18а и b (соединение С1(+) и С1(-)):
100 мг рацемической смеси соединения С1 (свободного основания) разделяют путем высокоэффективной жидкостной хроматографии (CSP Chiralpak AD 250х4,6) н-гексаном/2-пропанолом 25/1 с 0,1% диэтиламина на энантиомеры. Получают (+)-вращающий энантиомер С1(+) с временем удержания 7,38 мин и значением удельного вращения 237,5° (с = 10,3 мг/2 мл в трихлорметане) с температурой плавления 70-71° С и (-) - вращающий энантиомер С1(-) с временем удержания 8,06 мин и значением удельного вращения -229,1° (с = 9,9 мг/2 мл в трихлорметане) с температурой плавления 71-72° С.
Пример 19 (соединение D2):
Гидробромид 8-(2-хлорфенил)-3-метил-2-метилимино-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола
a) 2,3-Дибром-3-(2-хлорфенил)пропионовую кислоту
получают путем прибавления по каплям раствора 7,8 г брома к суспензии 9 г 2-хлоркоричной кислоты в 250 мл хлороформа при облучении 500-ваттной лампой дневного света и последующего упаривания растворителя. Температура плавления 183-185° С.
b) Хлорангидрид 2,3-дибром-3-(2-хлорфенил)пропионовой кислоты получают путем кипячения 10 г 2,3-дибром-3-(2-хлорфенил)пропионовой кислоты в 70 мл тионилхлорида при перемешивании и отгонки жидкости в виде маслянисто-аморфного остатка.
с) 2-Бром-3-(2-хлорфенил)-1-инданон
В смесь из 4,1 г безводного бензола и 30 мл сероуглерода вносят под атмосферой аргона 6,6 г безводного активного хлорида алюминия и затем охлаждают до -20° С. При поддерживании охлаждения в эту суспензию прибавляют по каплям раствор 15 г хлорангидрида 2,3-дибром-3-(2-хлорфенил)пропионовой кислоты в 50 мл сероуглерода, выдерживают 5 ч при 0° С и оставляют на следующие 16 ч в холодильнике при температуре 4-8° С. Реакционную смесь при перемешивании выливают на смесь льда и воды, сильно подкисляют концентрированной НСl, экстрагируют хлороформом, органическую фазу промывают водой и, наконец, сушат над сульфатом магния. После отгонки растворителя вязкий аморфный остаток вносят в диэтиловый эфир, несколько ч перемешивают с водным щелочным раствором бикарбоната натрия и после высушивания над сульфатом магния отгоняют растворитель. Вязкое аморфное вещество.
а) Гидробромид 8-(2-хлорфенил)-3-метил-2-метилимино-2,3,8,8a-тетрагидро-индено[1,2-d]тиазол-3а-ола
4 г 2-Бром-3-(2-хлорфенил)-1-инданона в уксусном эфире смешивают с 1,2 г N,N’-диметилтиомочевины и перемешивают 2 дня при комнатной температуре. Бледно-желтое кристаллическое вещество, температура плавления 163° С.
Пример 20 (соединение D14):
Гидробромид 3а-гидрокси-3-метил-2-метилимино-8-фенил-3а,8,9,9а-тетрагидронафто[2,1-b]тиазолидина
a) 2-Бром-4-фенил-1-тетралон
получают путем реакции 4,43 г 4-фенил-1-тетралона и 3,2 г брома в содержащем НВr этилацетате в виде вязкого аморфного продукта.
b) Гидробромид 3а-гидрокси-3-метил-2-метилимино-8-фенил-3а,8,9,9а-тетрагидронафто[2,1-b]тиазолидина
получают путем взаимодействия 26 г 2-бром-4-фенил-1-тетралона и 5 г N,N’-диметилтиомочевины в 60 мл этилацетата в виде от светло-желтого до бесцветного кристаллического осадка. Температура плавления 229-231° С (с разложением).
Соединение D1 получено аналогичным образом.
Пример 21 (соединение D16):
1-Этил-2-этилимино-9-нитро-1,2,4,5-тетрагидро-3аН-6-окса-3-тиа-1-азабензо[е]азулен-10b-ол:
а) Хлорангидрид 4-феноксимасляной кислоты:
504,6 г 4-Феноксимасляной кислоты кипятят с 308 мл тионилхлорида и 1,8 мл диметилформамида 3 ч с обратным холодильником. Затем смесь перегоняют в вакууме и получают хлорангидрид 4-феноксимасляной кислоты с температурой кипения 145-147° С при давлении 10-12 мм рт.ст.
b) 6,7,8,9-Тетрагидробензоциклогептен-5-он:
Суспендируют 192 г хлорида алюминия-III в 1,6 л сухого 1,2-дихлорэтана и медленно прибавляют по каплям под защитной атмосферой аргона при перемешивании раствор 238 г хлорангидрида 4-феноксимасляной кислоты в 300 мл 1,2-дихлорэтана в течение 5,5 ч при температуре -5° С. Продукт реакции подвергают гидролизу путем выливания в смесь 2 л воды и 2 л концентрированной соляной кислоты. Перемешивают 30 мин, осаждают и отсасывают. Органическую фазу отделяют, а водную фазу трижды встряхивают с 1,2-дихлорэтаном. Органический экстракт промывают водой, разбавленным раствором гидрокарбоната и, наконец, насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток перегоняют в вакууме. Получают 6,7,8,9-тетрагидробензоциклогептен-5-он с температурой кипения 79-84° С при давлении 0,001 мм рт.ст. в виде прозрачной жидкости.
c) 7-Нитро-3,4-дигидро-2Н-бензо[b]оксепин-5-он:
25 г 6,7,8,9-Тетрагидробензоциклогептен-5-она растворяют в 280 мл концентрированной серной кислоты при -10° С. При сильном перемешивании при -10° С вносят порциями 16,75 г нитрата натрия. Темную реакционную смесь перемешивают 45 мин при 0° С; при этом остаток нитрата натрия медленно переходит в раствор. Затем реакционную смесь при перемешивании выливают на лед и перемешивают 30 мин. Осадок отсасывают и нейтрализуют водой. Высушенный на воздухе остаток для очистки перекристаллизовывают из изопропанола. Получают 7-нитро-3,4-дигидро-2Н-бензо[b]оксепин-5-он, который подвергают дальнейшей переработке.
d) 4-Бром-7-нитро-3,4-дигидро-2Н-бензо[b]оксепин-5-он:
2,07 г 7-Нитро-3,4-дигидро-2Н-бензо[b]оксепин-5-она растворяют в 10 мл дихлорметана и при охлаждении на ледяной бане при перемешивании смешивают с 1,7 г брома, растворенного в 10 мл дихлорметана (добавление в течение 3 ч). Реакционную смесь вносят в 30 мл насыщенного раствора гидрокарбоната натрия, органическую фазу отделяют, и водную фазу неоднократно экстрагируют дихлорметаном. Объединенные органические экстракты промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия, упаривают и остаток перекристаллизовывают из бутилового эфира уксусной кислоты и получают 4-бром-7-нитро-3,4-дигидро-2Н-бензо[b]-оксепин-5-он с температурой плавления 115-118° С.
e) 1-Этил-2-этилимино-9-нитро-1,2,4,5-тетрагидро-3аН-6-окса-3-тиа-1-азабензо[е]азулен-10b-ол:
5 г 4-Бром-7-нитро-3,4-дигидро-2Н-бензо[b]оксепин-5-она нагревают с 2,4 г N,N’-диэтилтиомочевины в 30 мл бутан-2-она 30 мин с обратным холодильником. Осадок отсасывают, перемешивают с насыщенным раствором гидрокарбоната калия и экстрагируют этиловым эфиром уксусной кислоты. Органическую фазу промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия, упаривают и остаток перекристаллизовывают из метанола/воды. Получают 1-этил-2-этилимино-9-нитро-1,2,4,5-тетрагидро-3аН-6-окса-3-тиа-1-азабензо[е]азулен-10b-ол с температурой плавления 125-127° С. Аналогичным образом получены соединения D12, D15, D17-D20, D22-D23, D26-D31 исходя из соответствующих производных бензоциклогексанона или бензоциклогептанона.
Пример 22 (соединение D21):
1-Метил-2-метилимино-6,6-диоксо-1,2,3а,4,5,6-гексагидродитиа-1-аза-бензо[е]азулен-10b-ол:
а) Хлорангидрид 4-фенилсульфанилмасляной кислоты:
54,9 г 4-Фенилсульфанилмасляной кислоты растворяют с 0,5 мл диметилформамида в 280 мл толуола. Прибавляют по каплям 36,5 мл оксалилхлорида и перемешивают реакционную смесь 2 ч при комнатной температуре и еще один ч при 65-70° С. Затем отгоняют в вакууме толуол и избыток оксалилхлорида. Коричневый маслянистый остаток перегоняют в высоком вакууме и получают хлорангидрид 4-фенилсульфанилмасляной кислоты с температурой кипения 116-119° С при давлении 0,008 мм рт.ст.
b) 3,4-Дигидро-2Н-бензо[b]тиепин-5-он:
38,2 г Безводного хлорида алюминия-III суспендируют в 260 мл дихлорметана. При 0° С при перемешивании медленно прибавляют раствор 51,1 г хлорангидрида 4-фенилсульфанилмасляной кислоты в 70 мл дихлорметана (2 ч). Реакционную смесь перемешивают в течение ночи и получают коричнево-желтый раствор. Этот раствор при сильном перемешивании вносят в ледяную смесь 1 л воды и 1 л концентрированной соляной кислоты. После этого перемешивают 30 мин, смесь трижды экстрагируют по 200 мл диэтилового эфира. Объединенные органические фазы встряхивают с водой и с насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают в вакууме. Полученное масло перегоняют и получают 3,4-дигидро-2Н-бензо[b]тиепин-5-он с температурой кипения 93-94° С при давлении 0,002 мм рт. ст.
c) 1,1-Диоксо-1,2,3,4-тетрагидробензо[b]тиепин-5-он:
10 г 3,4-Дигидро-2Н-бензо[b]тиепин-5-он растворяют в 125 мл ледяной уксусной кислоты. При комнатной температуре при перемешивании медленно прибавляют по каплям 11,2 мл 35%-ного пероксида водорода. После перемешивания в течение 2 ч при комнатной температуре прибавляют по каплям еще 11 мл 35%-ного пероксида водорода. Реакционную смесь затем перемешивают в течение ночи. Осторожно удаляют растворитель в вакууме, и остаток смешивают со льдом и при перемешивании осторожно смешивают с 1 н гидрокарбонатом калия. Водную суспензию осторожно насыщают поваренной солью, отсасывают, промывают водой и сушат в вакууме. Получают 1,1-диоксо-1,2,3,4-тетрагидробензо[b]тиепин-5-он с температурой плавления 142-146° С.
d) 4-Бром-1,1-диоксо-1,2,3,4-тетрагидро-бензо[b]тиепин-5-он:
9,45 г 1,1-Диоксо-1,2,3,4-тетрагидробензо[b]тиепин-5-она растворяют при перемешивании в 200 мл ледяной уксусной кислоты. Добавляют 8,9 г N-бромсукцинимида и нагревают смесь 8 ч при 75-80° С. После окончания реакции растворитель упаривают в вакууме, и маслянистый остаток смешивают при перемешивании с ледяным раствором гидрокарбоната натрия. После 30-минутного перемешивания отсасывают, и остаток промывают водой. После высушивания в вакууме получают 4-бром-1,1-диоксо-1,2,3,4-тетрагидробензо[b]тиепин-5-он с температурой плавления 132-136° С.
е) 1-Метил-2-метилимино-6,6-диоксо-1,2,3а,4,5,6-гексагидро-дитиа-1-азабензо[е]азулен-10b-ол:
4,34 г 4-Бром-1,1-диоксо-1,2,3,4-тетрагидробензо[b]-тиепин-5-она суспендируют 15 мл бутан-2-она. Смесь нагревают до 60-70° С и порциями прибавляют 1,8 г N,N’-диметилтиомочевины. Раствор кипятят 2 ч с обратным холодильником, затем охлаждают, и осадок отсасывают и промывают бутан-2-оном. Остаток перемешивают со 100 мл насыщенного раствора гидрокарбоната натрия и экстрагируют этиловым эфиром уксусной кислоты. Объединенные органические фазы промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают в вакууме. Соединяют с небольшим количеством этилового эфира уксусной кислоты, отсасывают и сушат в вакууме. Получают 1-метил-2-метилимино-6,6-диоксо-1,2,3а,4,5,6-гексагидро-дитиа-1-азабензо[е]азулен-10b-ол с температурой плавления 142-144° С (разложение).
Пример 23 (соединение D25):
Гидрохлорид N-(10b-гидрокси-1-метил-2-метилимино-1,2,3а,4,5,10b-гексагидро-6-окса-3-тиа-1-азабензо[е]азулен-9-ил)-ацетамида:
а) N-(5-оксо-2,3,4,5-тетрагидро-бензо[b]оксепин-7-ил)-ацетамид:
16 г 7-Нитро-3,4-дигидро-2Н-бензо[b]оксепин-5-она растворяют в 400 мл метанола, смешивают с 270 мл палладия на активном угле (10%-ный) и гидрируют при нормальном давлении. После фильтрования и удаления растворителя в вакууме получают склонный к окислению 7-амино-3,4-дигидро-2Н-бензо[b]оксепин-5-он в виде желтого масла. Это масло растворяют в 150 мл дихлорметана; добавляют 8 г триэтиламина и затем при охлаждении льдом медленно прибавляют по каплям при сильном перемешивании 8,1 г уксусного ангидрида. Реакционную смесь перемешивают еще один ч при комнатной температуре. Раствор упаривают в вакууме, и остаток вносят в этиловый эфир уксусной кислоты, промывают водой и насыщенным раствором поваренной соли, сушат над сульфатом натрия и снова упаривают. После кристаллизации из этилового эфира уксусной кислоты N-(5-оксо-2,3,4,5-тетрагидробензо[b]-оксепин-7-ил)-ацетамид плавится при 130-132° С.
b) N-(4-бром-5-оксо-2,3,4,5-тетрагидробензо[b]оксепин-7-ил)-ацетамид:
1 г N-(5-оксо-2,3,4,5-тетрагидробензо[b]оксепин-7-ил)-ацетамида растворяют в 6 мл дихлорметана. При 0° С при перемешивании медленно прибавляют по каплям 0,8075 г брома, растворенного в 5 мл дихлорметана. Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем выливают на ледяной насыщенный раствор гидрокарбоната натрия и несколько раз экстрагируют дихлорметаном. Органические фазы промывают водой и насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток перекристаллизовывают из изопропанола и получают N-(4-бром-5-оксо-2,3,4,5-тетрагидробензо[b]оксепин-7-ил)-ацетамид с температурой плавления 157-160° С.
с) Гидрохлорид N-(10b-гидрокси-1-метил-2-метилимино-1,2,3а,4,5,10b-гексагидро-6-окса-3-тиа-1-азабензо[е]азулен-9-ил)ацетамида:
7 г N-(4-бром-5-оксо-2,3,4,5-тетрагидробензо[b]-оксепин-7-ил)ацетамида и 2,5 г N,N’-диметилтиомочевины в 60 мл бутан-2-она кипятят 4 ч с обратным холодильником. Охлажденную суспензию фильтруют, и остаток перемешивают с 200 мл насыщенного раствора гидрокарбоната калия. Прибавляют немного этилового эфира уксусной кислоты, отсасывают, остаток промывают водой и получают N-(10b-гидрокси-1-метил-2-метил-имино-1,2,3а,4,5,10b-гексагидро-6-окса-3-тиа-1-азабензо[е]-азулен-9-ил)ацетамид с температурой плавления 186-188° С. Свободное основание растворяют в 30 мл 2 н соляной кислоты. После примерно 10-минутного перемешивания выпадает гидрохлорид N-(10b-гидрокси-1-метил-2-метилимино-1,2,3а,4,5,10b-гексагидро-6-окса-3-тиа-1-азабензо[е]азулен-9-ил)ацетамида. Он плавится с разложением при 270° С.
Пример 24 (соединение Е2):
Гидробромид 6-хлор-3-(4-метокси-фенил)-2-(4-метокси-фенилимино)-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола:
1 г 2-Бром-5-хлор-индан-1-она и 1,17 г 1,3-бис-(4-метоксифенил)тиомочевины суспендируют в 50 мл сухого дихлорметана, 4 ч перемешивают при комнатной температуре и один ч при температуре ледяной бани. Осадок отсасывают, промывают дихлорметаном и сушат в вакууме. Получают гидробромид 6-хлор-3-(4-метокси-фенил)-2-(4-метокси-фенилимино)-2,3,8,8а-тетрагидро-индено[1,2-d]тиазол-3а-ола, который плавится с разложением при 230-235° С.
Соединения E1 и Е3-Е5 получены аналогичным образом.
Описываются полициклические тиазолидин-2-илиденовые амины формулы I, а также их физиологически приемлемые соли
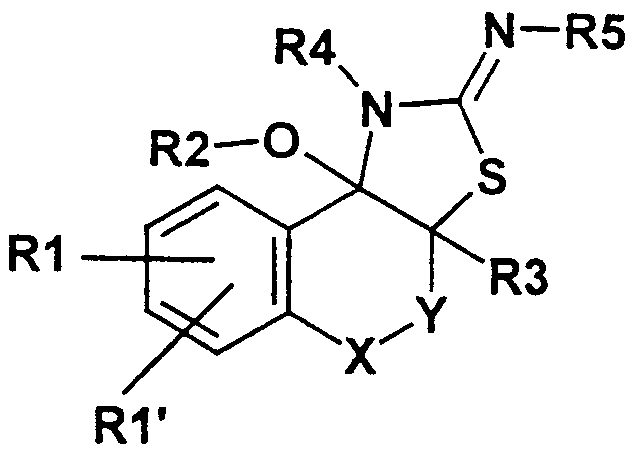
где означают А) Y – простая связь, Х – СН2, R1 – (С2-С6)-алкил, у которого один водород может быть заменен ОС(О)СН3; (С2-С6)-алкенил; (С2-С6)-алкинил; О-CF3, О-СН2-CF3, О-СН2-CF2-CF3, О-СН2-CF2-CF2-CF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором; S-(С1-С6)-алкил, S-(СН2)n-фенил, SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил, причем n = 0-1, и фенильный остаток до двух раз может быть замещен (С1-С6)-алкилом; фенил, О-(СН2)n-фенил, причем n = 0-1, 1- или 2-нафтил, 2-, 3- или 4-пиридил, причем фенильные циклы могут быть от одного до трех раз замещены F, Cl, CF3, OCF3, (С1-С6)-алкилом, SO2-СН3, О-(С1-С6)-алкилом; R1’ – H, R2 – Н, R3 – Н,
R4 – (С1-С6)-алкил, R5 – (С1-С6)-алкил, или В) Y – простая связь,
Х – CH2, R1 и R1’ независимо друг от друга Н, Cl, (С1-С6)алкил, в котором один водород замещен на ОН, R2 – Н, R3 – F, С(О)ОСН3, С(О)ОН, R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1, R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1, или С) Y – простая связь, Х – CH2, R1 и R1’ независимо друг от друга Н, Cl, фенил, замещенный CF3, R2 – (С1-С6)-алкил, (С2-С8)-алкенил, R3 – Н, F, R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и фенил может быть замещен Cl, О-(С1-С6)-алкилом; R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и фенил может быть замещен Cl, О-(С1-С6)-алкилом; или D) Y – простая связь, -СН2- или -СН2-СН2-; Х – СН(фенил), причем фенильный остаток может быть замещен Cl; О, S, SO2,
R1 и R1’ независимо друг от друга Н, Cl, NO2, CN, SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил, причем n = 0, R2 – Н, R3 – Н, R4 – (С1-С6)-алкил, R5 – (С1-С6)-алкил, или R4 и R5 вместе могут означать -СН2-СН2- или -СН2-С(СН3)2-группу или Е) Y – простая связь, Х – СН2, R1 – Cl, R1’ – Н, R2 – Н;
R3 – Н, R4 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, О-(С1-С3)-алкилом, (С1-С6)-алкилом, R5 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, (С1-С6)-алкилом, О-(С1-С3)-алкилом. Соединения пригодны для лечения ожирения, для профилактики или лечения диабета типа II. Описываются также лекарственное средство для подавления аппетита и/или похудания и лекарственное средство для профилактики и для лечения диабета типа II, а также способ получения лекарственного средства путем смешивания активного вещества с фармацевтически приемлемым носителем и эту смесь приводят в пригодную для применения форму. 4 н. и 7 з.п. ф-лы, 2 табл.
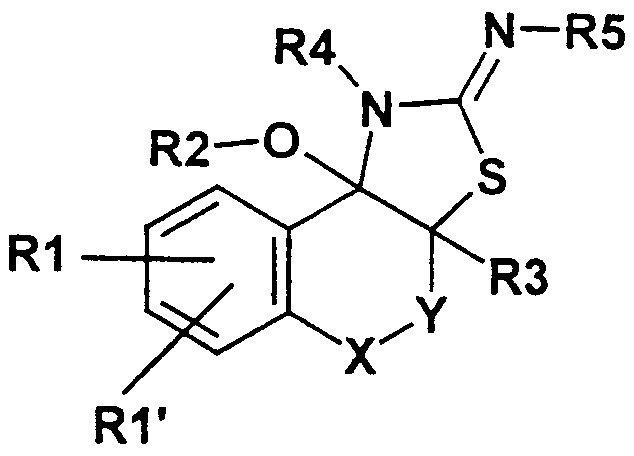
где означают:
А)
Y – простая связь;
Х – СН2;
R1 – (С2-С6)-алкил, у которого один водород может быть заменен ОС(О)СН3; (С2-С6)-алкенил; (С2-С6)-алкинил; О-CF3, О-СН2-CF3, О-СН2-CF2-CF3, О-СН2-CF2-CF2-CF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором;
S - (С1-С6)-алкил, S-(СН2)n-фенил, SО2-(С1-С6)-алкил, SО2-(СН2)n-фенил,
причем n = 0-1, и фенильный остаток до двух раз может быть замещен (С1-С6)-алкилом; фенил, О-(СН2)n-фенил,
причем n = 0-1, 1- или 2-нафтил, 2-, 3- или 4-пиридил, причем фенильные циклы могут быть от одного до трех раз замещены F, Cl, CF3, OCF3, (С1-С6)-алкилом, SО2-СН3, О-(С1-С6)-алкилом;
R1’ – H;
R2 – Н;
R3 – Н;
R4 – (С1-С6)-алкил;
R5 – (С1-С6)-алкил;
или
В)
Y – простая связь;
Х – CH2;
R1 и R1’ независимо друг от друга Н, Cl, (С1-С6)алкил, в котором один водород замещен на ОН,
R2 – Н;
R3 – F, С(О)ОСН3, С(О)ОН;
R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1;
R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1;
или
С)
Y – простая связь;
Х – CH2;
R1 и R1’ независимо друг от друга Н, Cl, фенил, замещенный CF3;
R2 – (С1-С6)-алкил, (С2-С8)-алкенил;
R3 – Н, F;
R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и фенил может быть замещен Cl, О-(С1-С6)-алкилом;
R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и фенил может быть замещен Cl, О-(С1-С6)-алкилом;
или
D)
Y – простая связь, -СН2- или -СН2-СН2-;
Х – СН(фенил), причем фенильный остаток может быть замещен Cl;
О, S, SO2,
R1 и R1’ независимо друг от друга Н, Cl, NO2, CN, SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил, причем n = 0;
2 – Н;
R3 – Н;
R4 – (С1-С6)-алкил;
R5 – (С1-С6)-алкил;
или R4 и R5 вместе могут означать -СН2-СН2- или -СН2-С(СН3)2-группу
или
Е)
Y – простая связь;
Х – СН2;
R1 – Cl;
R1’ – Н;
R2 – Н;
R3 – Н;
R4 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, О-(С1-С3)-алкилом, (С1-С6)-алкилом;
R5 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, (С1-С6)-алкилом, О-(С1-С3)-алкилом,
а также их физиологически приемлемые соли.
А)
Y – простая связь;
X – CH2;
R1 – (С2-С6)-алкил, у которого один водород может быть заменен ОС(О)СН3; (С2-С6)-алкенил; (С2-С6)-алкинил; О-CF3, О-СН2-CF3, О-СН2-CF2-CF3, О-СН2-CF2-CF2-CF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором;
S-(С1-С6)-алкил, S-(СН2)n-фенил, причем n = 0-1, и фенильный остаток до двух раз может быть замещен (С1-С6)-алкилом;
фенил, О-(СН2)n-фенил, причем n = 0-1, 1- или 2-нафтил, 2-, 3- или 4-пиридил, причем фенильные циклы могут быть от одного до трех раз замещены F, Cl, CF3, OCF3, (С1-С6)-алкилом, О-(С1-С6)-алкилом;
R1’ – H;
R2 – Н;
R3 – Н;
R4 – (С1-С6)-алкил;
R5 – (С1-С6)-алкил;
или
В)
Y – простая связь;
Х – CH2;
R1 и R1’ независимо друг от друга Н, Cl, (С1-С6)алкил, в котором один водород замещен на ОН;
R2 – Н;
R3 – F, С(О)ОСН3, С(О)ОН;
R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1;
R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1;
или
С)
Y – простая связь;
Х – CH2;
R1 и R1’ независимо друг от друга
Н, Cl, фенил, замещенный CF3;
R2 – (С1-С6)-алкил, (С2-С8)-алкенил;
R3 – Н, F;
R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и
фенил может быть замещен Cl, О-(С1-С6)-алкилом;
R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и
фенил может быть замещен Cl, О-(С1-С6)-алкилом;
или
D)
Y – простая связь или -СН2-;
Х – СН(фенил), причем фенильный остаток может быть замещен Cl;
О, S, SO2,
R1 и R1’ независимо друг от друга Н, Cl, CN, SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил, n = 0,
R2 – Н;
R3 – Н;
R4 – (С1-С6)-алкил;
R5 – (С1-С6)-алкил;
или
Е)
Y – простая связь;
Х – СН2;
R1 – Cl;
R1’ – Н;
R2 – Н;
R3 – Н;
R4 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, О-(С1-С3)-алкилом, (С1-С6)-алкилом;
R5 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, (С1-С6)-алкилом, О-(С1-С3)-алкилом,
а также их физиологически приемлемые соли.
А)
Y – простая связь;
Х – СН2;
R1 – (С2-С6)-алкил, у которого один водород может быть заменен ОС(О)СН3; (С2-С6)-алкенил; (С2-С6)-алкинил; О-СН2-CF3, О-СН2-CF2-CF3, О-(С4-С6)-алкил, причем в алкильных остатках один, более или все водород(ы) могут быть заменены фтором; S-(С1-С6)-алкил, S-(СН2)n-фенил, причем n = 0-1, и фенильный остаток до двух раз может быть замещен (С1-С6)-алкилом; фенил, О-(СН2)n-фенил, причем n = 0-1, 1- или 2-нафтил, 2-, 3- или 4-пиридил, причем фенильные циклы могут быть от одного до двух раз замещены F, Cl, CF3, OCF3, (С1-С6)-алкилом, О-(С1-С6)-алкилом;
R1’ – H;
R2 – Н;
R3 – Н;
R4 – (С1-С6)-алкил;
R5 – (С1-С6)-алкил;
или
В)
Y – простая связь;
Х – CH2;
R1 и R1’ независимо друг от друга Н, Cl, (С1-С6)алкил, в котором один водород замещен на ОН;
R2 – Н;
R3 – F, С(О)ОСН3, С(О)ОН;
R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1;
R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 1;
или
С)
Y – простая связь;
Х – CH2;
R1 и R1’ независимо друг от друга
Н, Cl, фенил, замещенный CF3;
R2 – (С1-С6)-алкил, (С2-С8)-алкенил;
R3 – Н, F;
R4 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и
фенил может быть замещен Cl, О-(С1-С6)-алкилом;
R5 – (С1-С6)-алкил, (СН2)n-фенил, причем n = 0 и
фенил может быть замещен Cl, О-(С1-С6)-алкилом;
или
D)
Y – простая связь или -СН2-;
Х – СН(фенил), причем фенильный остаток может быть замещен Cl;
О, S, SO2,
R1 и R1’ независимо друг от друга Н, Cl, CN, SO2-(С1-С6)-алкил, SO2-(СН2)n-фенил, причем n = 0;
R2 – Н;
R3 – Н;
R4 – (С1-С6)-алкил;
R5 – (С1-С6)-алкил;
или
Е)
Y – простая связь;
Х – СН2;
R1 – Cl;
R1’ – Н;
R2 – Н;
R3 – Н;
R4 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, О-(С1-С3)-алкилом, (С1-С6)-алкилом;
R5 – фенил, причем фенильный остаток может быть до двух раз замещен F, Cl, (С1-С6)-алкилом, О-(С1-С3)-алкилом,
а также их физиологически приемлемые соли.
| КОРОТКАЯ (НЕПОДВИЖНАЯ) ОПРАВКА ДЛЯ ВОЛОЧЕНИЯ | 0 |
|
SU365181A1 |
| ВЫПУСКНОЙ ФИТИНГ, БАЗОВЫЙ ЭЛЕМЕНТ И ВЫПУСКНОЙ ЭЛЕМЕНТ ТАКОГО ФИТИНГА | 2013 |
|
RU2640358C2 |
| US 3507868, 21.04.1971 | |||
| Способ получения производных тиазола или их аддитивных солей с неорганическими или органическими кислотами | 1988 |
|
SU1604157A3 |
| Машковский М.Д | |||
| Лекарственное средство | |||
| Т.II | |||
| - Харьков, Торсинг, 1998, с | |||
| Канальная печь-сушильня | 1920 |
|
SU230A1 |
Авторы
Даты
2004-09-20—Публикация
1999-07-03—Подача