Область техники
Данное изобретение относится к способу и устройству, предназначенным для введения двух компонентов в сосковый канал млекопитающего, не являющегося человеком.
Коровий мастит представляет собой тяжелое, с возможностью летального исхода, воспалительное заболевание вымени, которое вызывается многочисленными возбудителями инфекции, но в особенности различными грамположительными бактериями из рода стафилококковых и стрептококковых, а также грамотрицательными видами коли-бациллярной инфекции Escherichia. Данная инфекция обычно проникает в вымя через сосковый или проточный канал. Лечение мастита обычно осуществляют различными цератами с антибиотиками, которые вводят в вымя через сосковый или проточный канал. В тяжелых случаях также посредством инъекции вводят большие дозы антибиотика. Большая часть инфекций, вызывающих мастит, подхватывается во время «сухого» периода, предшествующего отелу. А затем данные инфекции могут стать клинически значимыми либо во время сухого периода, либо после отела при возобновлении лактации.
Известным является лечение мастита с использованием упаковки сдвоенных инъекторов, причем один инъектор содержит антибактериальный состав, а второй инъектор содержит изолирующий или барьерный состав. Сначала в сосковый канал вводят антибактериальный состав, после которого осуществляют введение изолирующего состава, создающего в сосковом канале физический барьер, препятствующий вторжению бактерий в вымя. Эти упаковки сдвоенных инъекторов продаются под названием Teat Seal™. Указанные сдвоенные инъекторы подробно описаны в патентных публикациях WO 04/13261 и WO 95/31180, которые включены в данный документ посредством ссылки.
Несмотря на то, что система сдвоенных инъекторов обеспечивает эффективный способ снижения числа случаев клинического мастита, введение лекарства данными инъекторами является весьма продолжительным процессом, удваивая опасность введения бактерий извне, а также удваивая риск повреждения эпителия соскового канала. Использование двух инъекторов также увеличивает стоимость лечения и создает дополнительный неразлагающийся остаточный продукт.
Таким образом, существует потребность в улучшении способа и устройства, предназначенных для предотвращения интрамаммарных заболеваний и устраняющих по меньшей мере некоторые из этих проблем.
Сущность изобретения
В соответствии с изобретением предлагается инъекционное устройство для введения компонентов в сосковый канал млекопитающего, не являющегося человеком, содержащее:
цилиндр, предназначенный для размещения первого компонента;
выходную насадку, предназначенную для введения в сосковый канал и расположенную на одном конце цилиндра;
внутренний резервуар, расположенный в цилиндре и предназначенный для размещения второго компонента;
клапан, предназначенный для отделения первого компонента от второго компонента;
приводное приспособление, предназначенное для открытия клапана для обеспечения возможности выхода второго компонента из внутреннего резервуара; и
средство доставки, предназначенное для введения первого компонента из цилиндра и последующего введения второго компонента из внутреннего резервуара, производимого после входа клапана во взаимодействие с приводным приспособлением для открытия клапана, через выходную насадку.
В одном варианте выполнения клапан содержит по меньшей мере один проход.
В другом варианте выполнения указанный по меньшей мере один проход открывается при открытии клапана для введения второго компонента через указанный проход.
В другом варианте выполнения приводное приспособление содержит по меньшей мере один выступающий элемент.
В дополнительном варианте выполнения приводное приспособление расположено в цилиндре.
В одном варианте выполнения приводное приспособление расположено смежно с выходной насадкой.
В другом варианте выполнения приводное приспособление содержит по меньшей мере один проход.
В дополнительном варианте выполнения приводное приспособление выполнено с возможностью взаимодействия с внутренним резервуаром с обеспечением создания непосредственного прохода для введения второго компонента из внутреннего резервуара в выходную насадку.
В одном варианте выполнения средство доставки содержит поршень для цилиндра.
В дополнительном варианте выполнения внутренний резервуар содержит внутренний цилиндр, расположенный внутри наружного цилиндра, ограниченного цилиндром инъектора.
В одном варианте выполнения внутренний цилиндр расположен с плотной пригонкой внутри наружного цилиндра.
В другом варианте выполнения средство доставки содержит внутренний цилиндр.
В дополнительном варианте выполнения внутренний цилиндр ограничивает поршень для наружного цилиндра.
В одном варианте выполнения средство доставки содержит поршень для внутреннего цилиндра.
В другом варианте выполнения внутренний цилиндр содержит средство взаимодействия, предназначенное для взаимодействия с наружным цилиндром при сборке.
В дополнительном варианте выполнения средство взаимодействия содержит наружное уплотнение.
В одном варианте выполнения наружный цилиндр содержит средство взаимодействия, предназначенное для взаимодействия с внутренним цилиндром.
В другом варианте выполнения наружный цилиндр содержит запирающее кольцо для взаимодействия с внутренним цилиндром.
В дополнительном варианте выполнения внутренний цилиндр содержит средство взаимодействия, предназначенное для взаимодействия с поршнем.
В одном варианте выполнения внутренний цилиндр содержит запирающее кольцо для взаимодействия с поршнем.
В другом варианте выполнения цилиндр содержит первый компонент.
В дополнительном варианте выполнения первый компонент содержит антибактериальный состав.
В одном варианте выполнения внутренний резервуар содержит второй компонент.
В другом варианте выполнения второй компонент содержит изолирующий состав.
В дополнительном варианте выполнения первый компонент вводится из цилиндра, а второй компонент вслед за этим вводится из внутреннего резервуара без существенного смешивания компонентов.
В одном варианте выполнения изолирующий состав содержит нетоксичную соль тяжелых металлов.
В другом варианте выполнения изолирующий состав содержит более 40% по весу соли тяжелых металлов.
В дополнительном варианте выполнения изолирующий состав содержит от 50% до 75% по весу соли тяжелых металлов.
В одном варианте выполнения изолирующий состав содержит около 65% по весу соли тяжелых металлов.
В другом варианте выполнения тяжелый металл представляет собой висмут.
В дополнительном варианте выполнения соль представляет собой нитратную соль основную.
В одном варианте выполнения изолирующий состав содержит гелевую основу.
В другом варианте выполнения гелевая основа представляет собой гель на основе стеарата алюминия.
В дополнительном варианте выполнения гелевая основа содержит жидкий парафин в качестве носителя.
В одном варианте выполнения первый компонент содержит антибактериальный состав.
В другом варианте выполнения антибактериальный состав выбирают из любого по меньшей мере одного вещества: антибиотиков, содержащих беталактам, полимиксинов, гликопептидов, аминоглюкозидов, линкозамидов, макролидных антибиотиков, плевромутилинов, «фениколов», таких как хлорамфеникол и флорфеникол, тетрациклинов, сульфонамидов и потенцированных сульфонамидов, таких как смесь триметоприма и одного или более сульфонамида, хинолонов и фторохинолонов, ионофоров, курмаринов, таких как новобиоцин, натуральных или синтетических пептидов, аминогликозидов, антибактериальных пептидов или антибактериальных составов, лантибиотиков, или других продуктов, содержащих бактерии или микроорганизмы.
В дополнительном варианте выполнения беталактам выбирают из любого по меньшей мере одного вещества: пенициллина, модифицированного пенициллина, такого как клоксасилин, амоксилин, ампицилин, цефалоспоринов или антибиотиков, содержащих беталактам, потенцированных ингибиторами беталактама, такими как клавулановая кислота.
В одном варианте выполнения аминогликозид выбирают из любого по меньшей мере одного вещества: стрептомицина, дигидрострептомицина, неомицина, гентамицина, фрамицитина, апарамицина или канамицина.
В другом варианте выполнения антибактериальный состав выбирают из любого по меньшей мере одного вещества: макролидного антибиотика, линкозамида или плевромутилина, эритромицина, спирамицина, тилозина, спирамицина, тилмикозина, линкомицина, спектиномизина, прилимицина или тиамулина.
В дополнительном варианте выполнения антибактериальный состав выбирают из любого по меньшей мере одного вещества: смесей потенцированных сульфонамидов, триметоприма плюс сульфадиазин, сульфадимидина, сульфадоксина, сульфадиметоксина или других сульфонамидных препаратов, окситетрациклина, миноциклина или доксициклина, фторохинолонов, энрофлоксацина, ципрофлоксацина, норфлоксацина, данофлоксацина, дифлоксацина или марбофлоксацина.
В одном варианте выполнения первый компонент содержит противовоспалительный состав.
В другом варианте выполнения противовоспалительный состав выбирают из любого по меньшей мере одного вещества: стероидных препаратов, таких как преднизолон, бетаметазон, дексаметазон, фенилбутзан, или нестероидных препаратов, таких как флюниксин, кетопрофен, карпрофен, ведапрофен, мелоксикам, тепоксалин, элтенак, нимесулид или толфенамовая кислота.
Краткое описание чертежей
Данное изобретение будет более понятно из последующего описания, приведенного только путем примера, со ссылкой на прилагаемые чертежи, на которых:
Фиг.1 представляет собой схематический поперечный разрез инъекционного устройства;
Фиг.2 представляет собой разрез внутреннего цилиндра данного устройства;
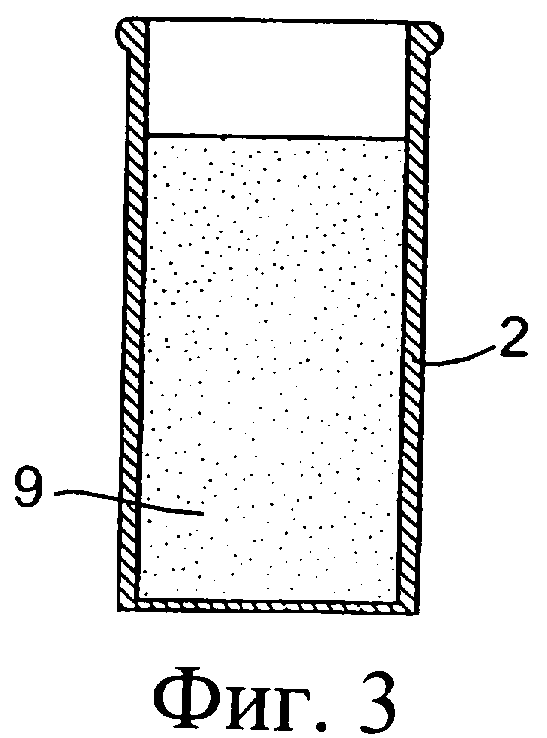
Фиг.3 представляет собой разрез внутреннего цилиндра, показанного на фиг.2, с помещенным в него изолирующим компонентом;
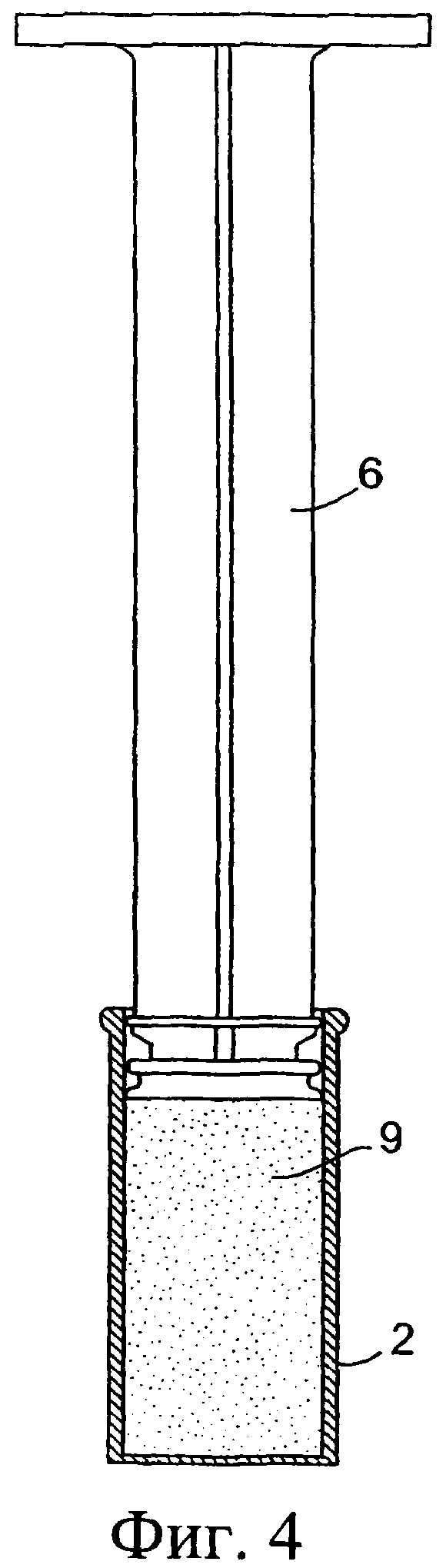
Фиг.4 представляет собой разрез внутреннего цилиндра, показанного на фиг.3, со вставленным поршнем;
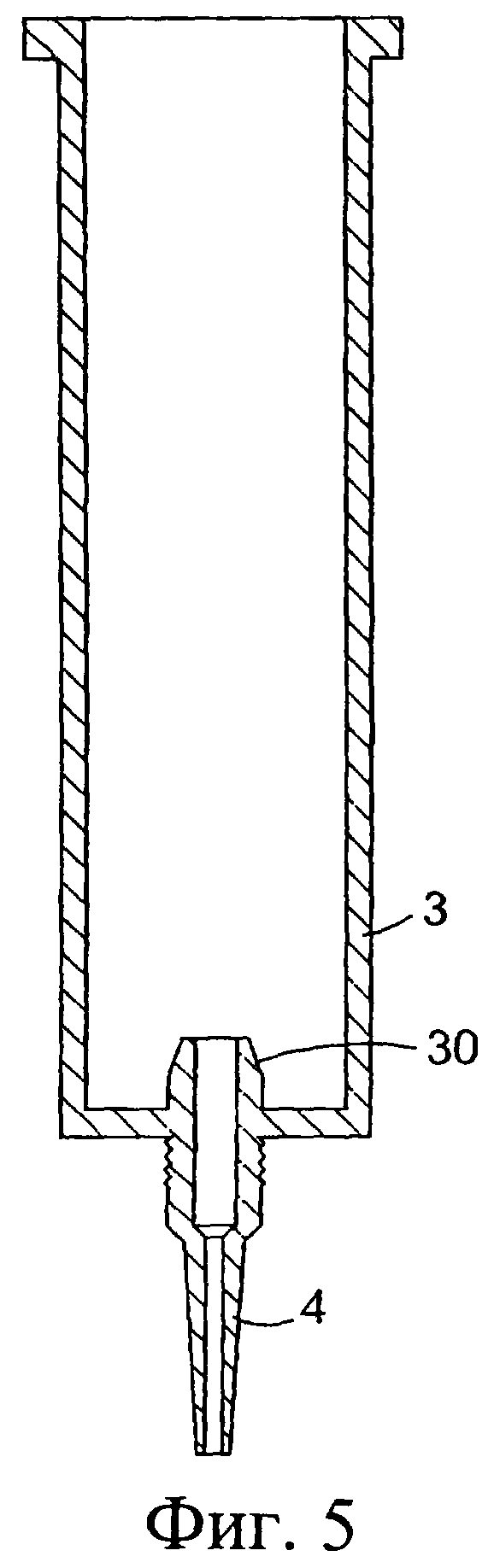
Фиг.5 представляет собой разрез наружного цилиндра указанного устройства;
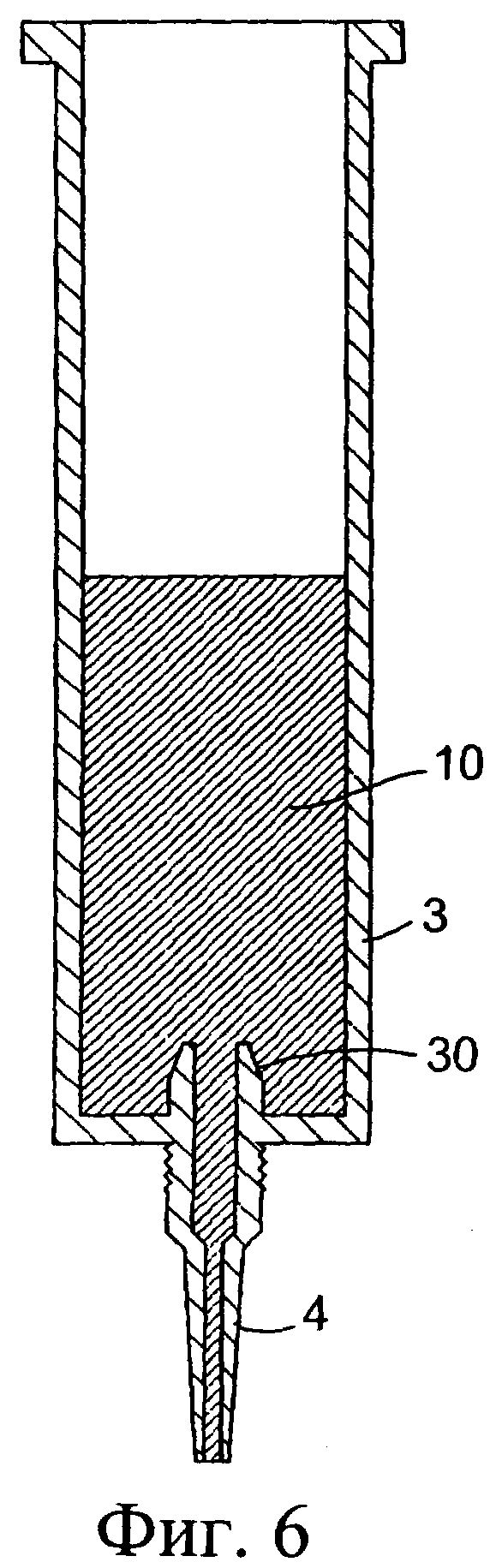
Фиг.6 представляет собой разрез наружного цилиндра, показанного на фиг.5, с размещенным в нем антибактериальным компонентом;
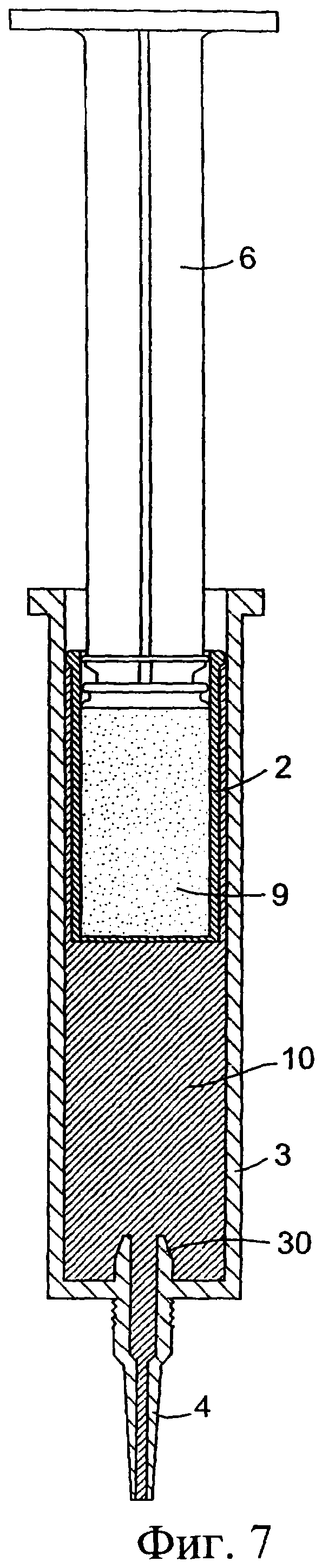
Фиг.7 представляет собой разрез собранного инъекционного устройства;
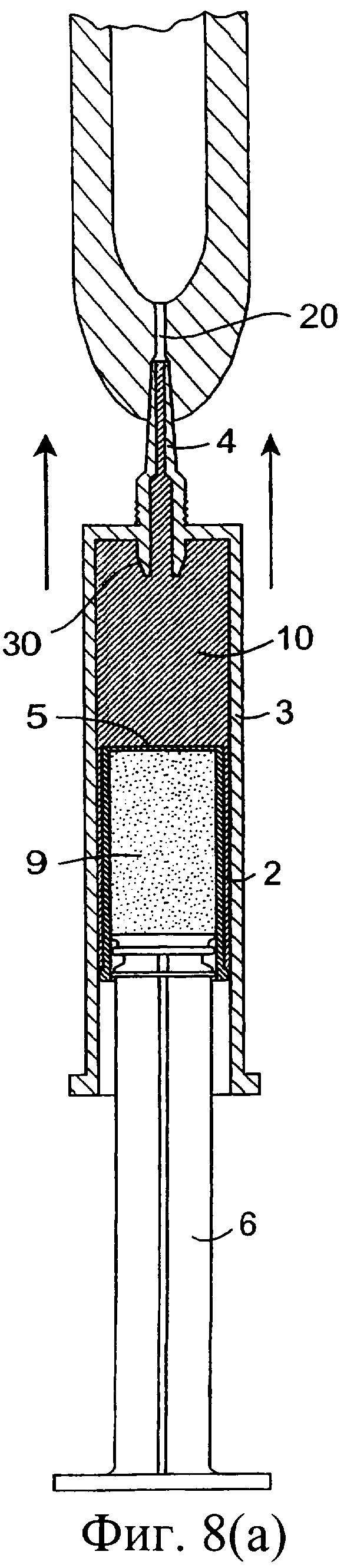
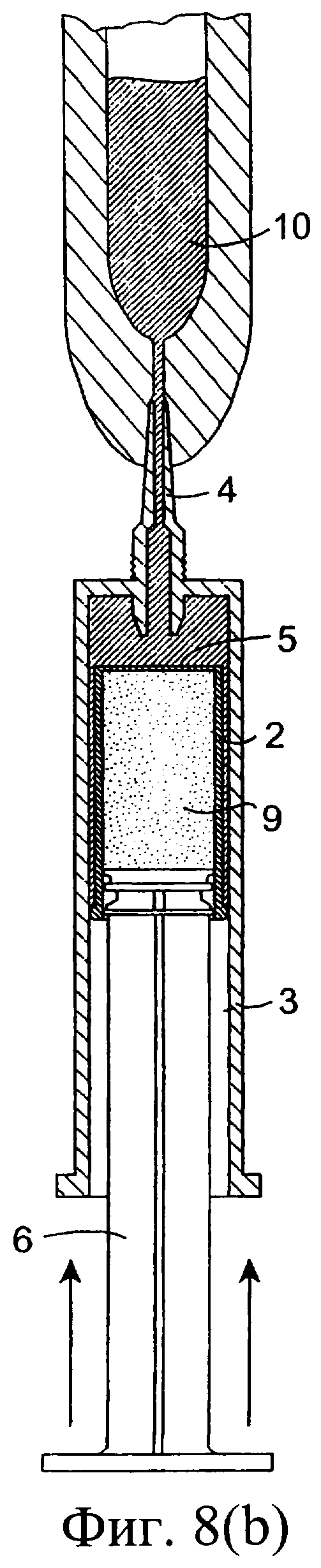
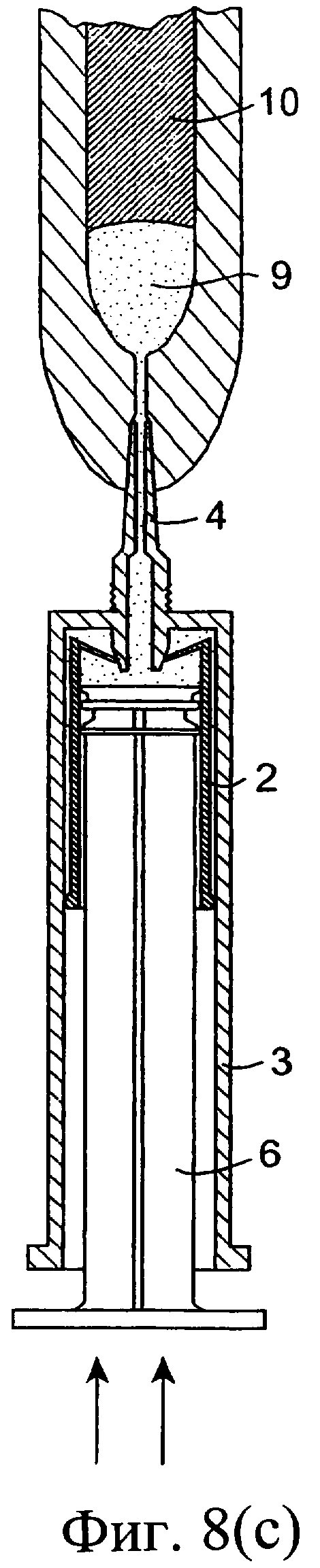
Фиг.8(а)-8(с) представляют собой разрезы инъекционного устройства при его использовании;
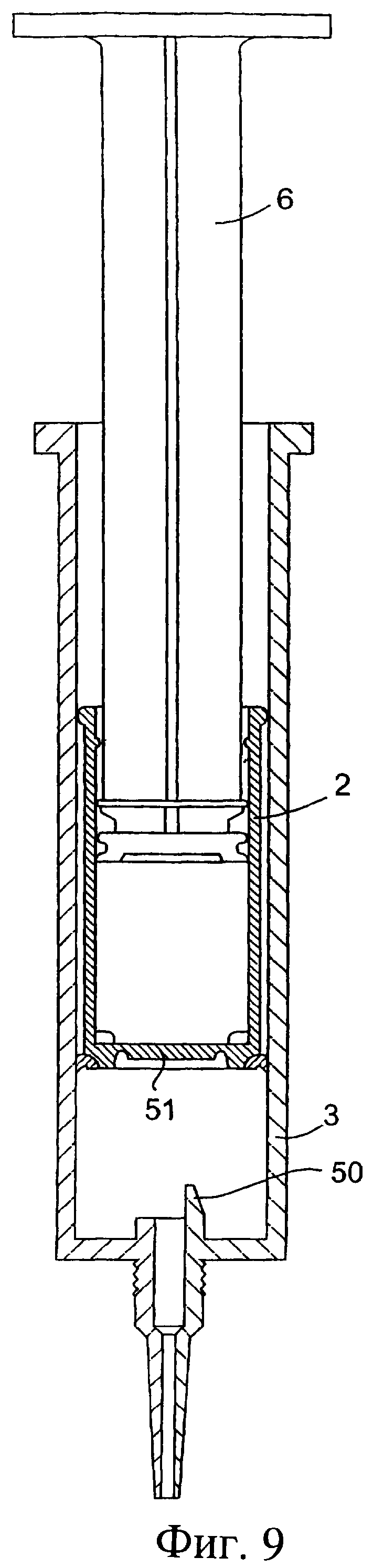
Фиг.9 представляет собой разрез другого инъектора;
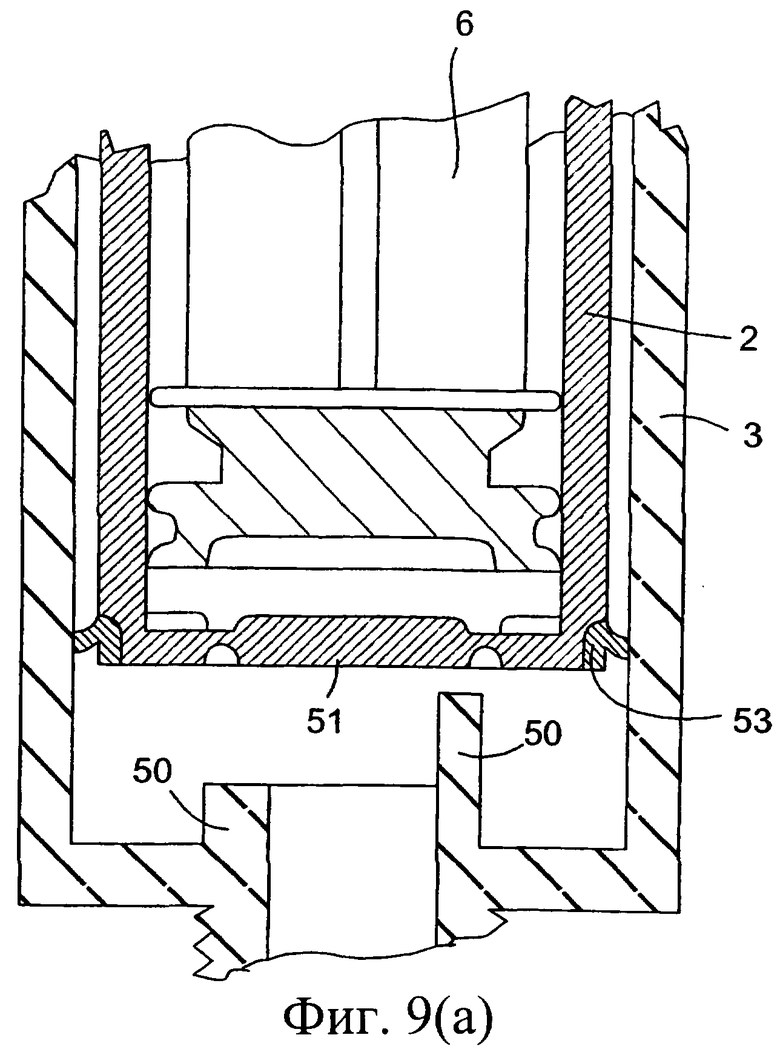
Фиг.9а представляет собой часть инъектора, показанного на фиг.9, в увеличенном масштабе;
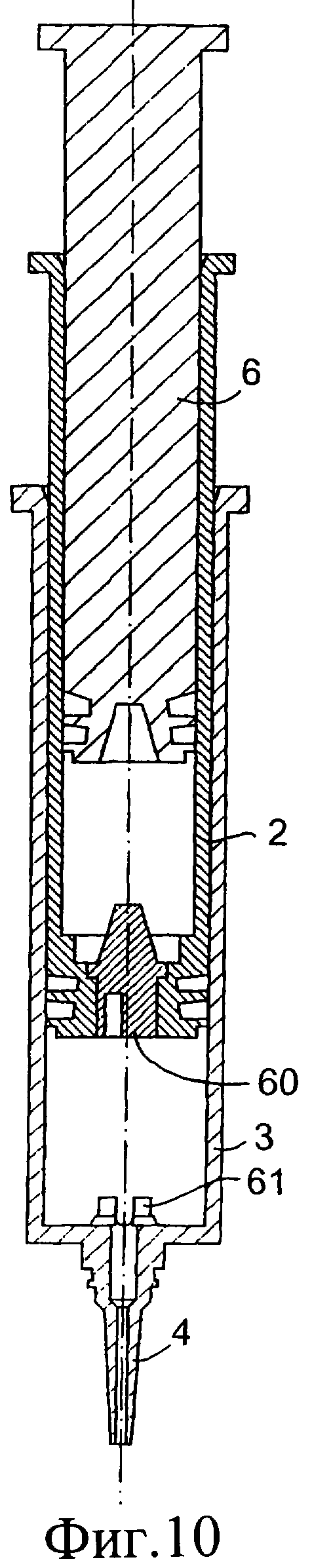
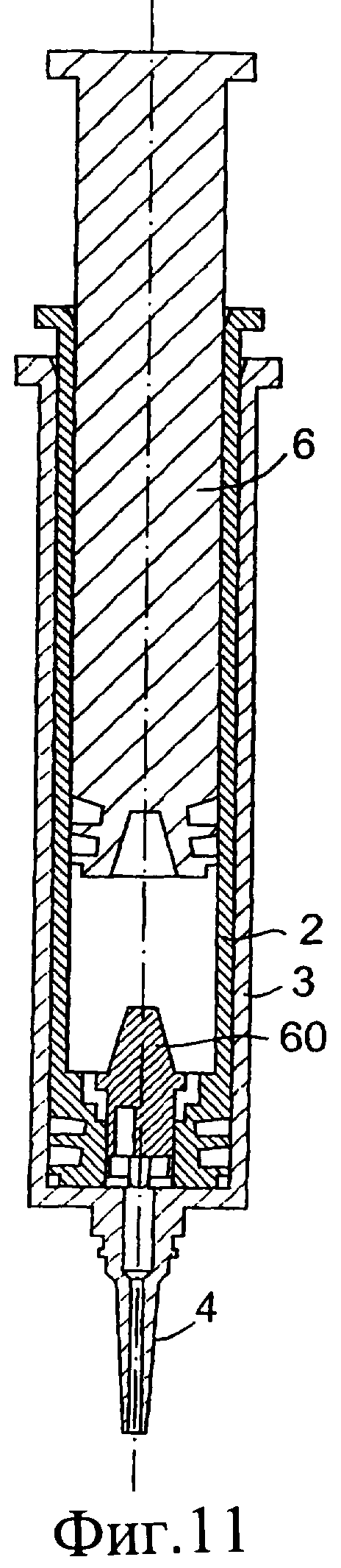
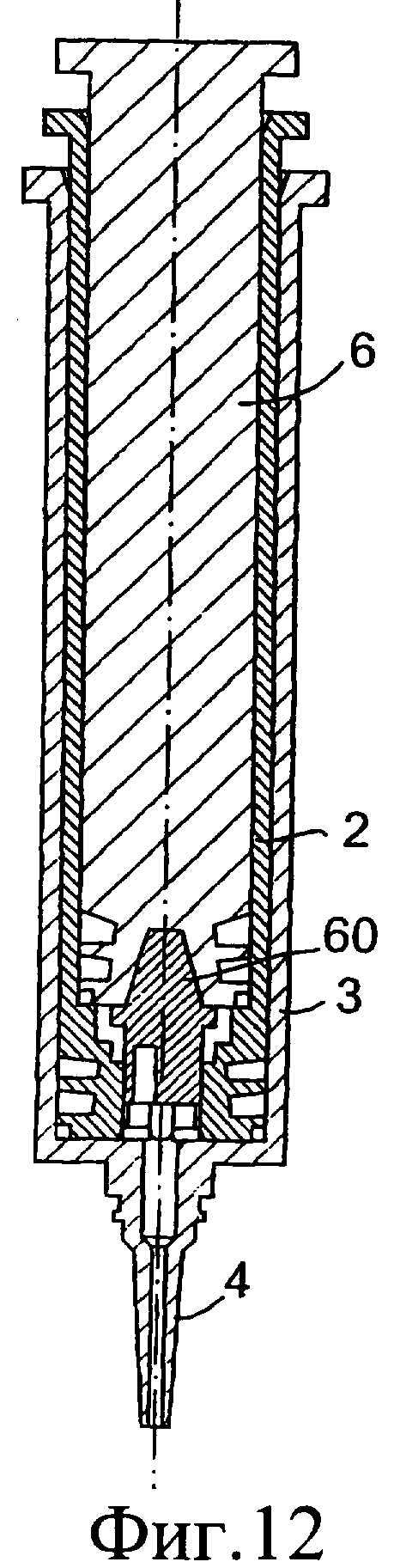
Фиг.10-12 представляют собой разрезы инъекционного устройства в соответствии с данным изобретением в различных положениях во время использования;
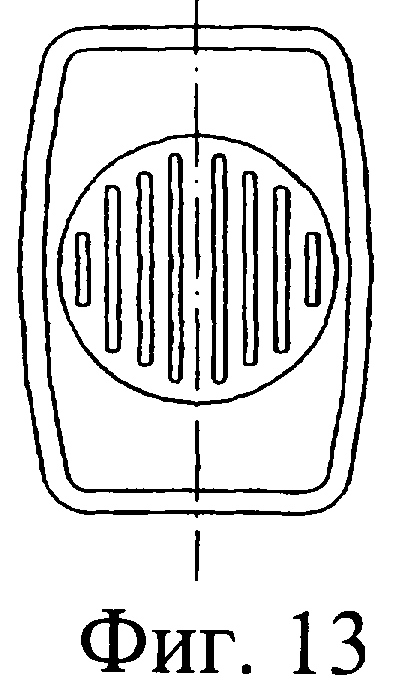
Фиг.13 представляет собой вид сверху устройства, показанного на фиг.10;
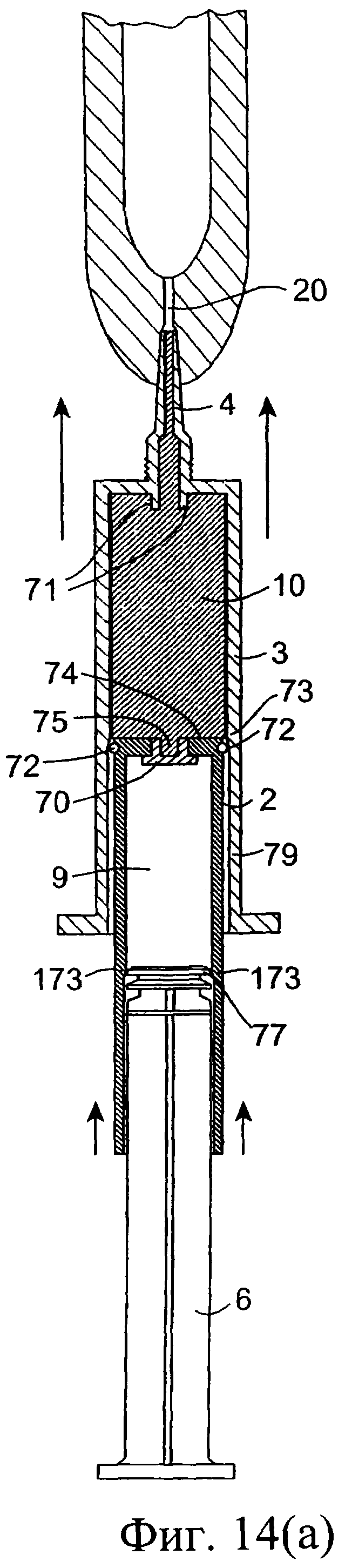
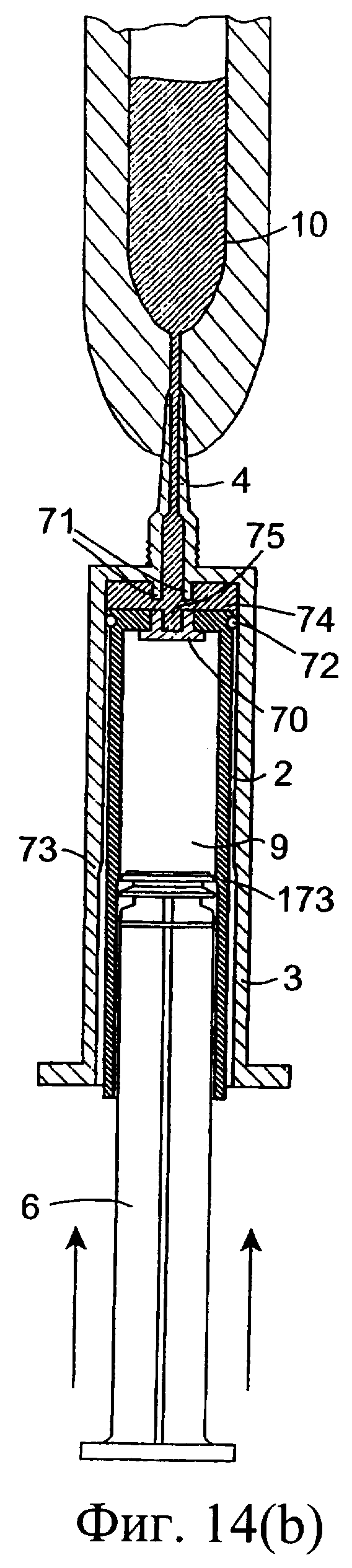
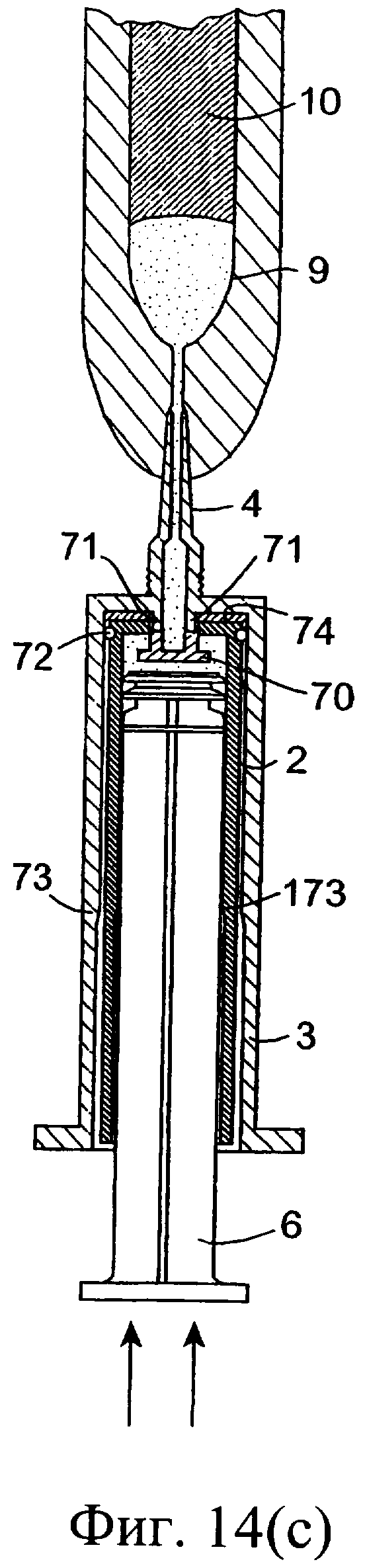
Фиг.14(а)-14(с) представляют собой разрезы еще одного инъекционного устройства, в соответствии с данным изобретением, в различных положениях во время использования;
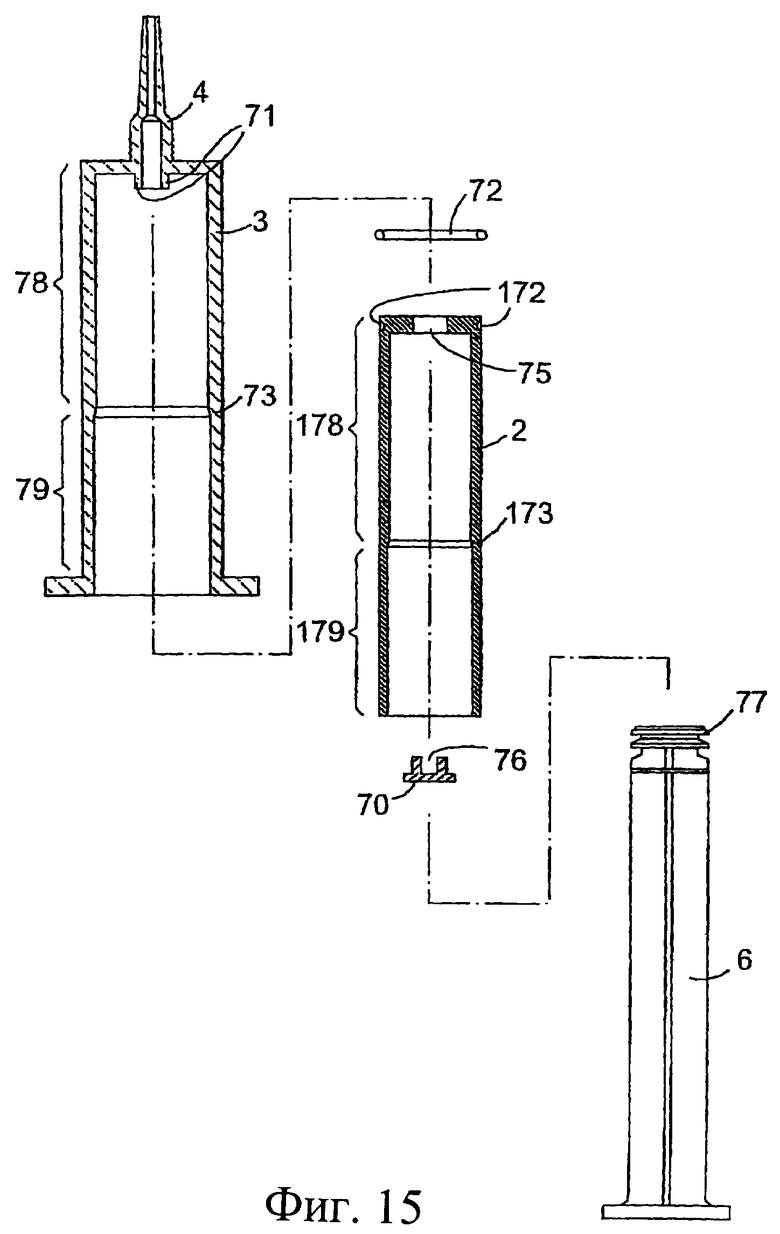
Фиг.15 представляет собой разрез деталей инъектора, показанного на фиг.14, в разобранном состоянии;
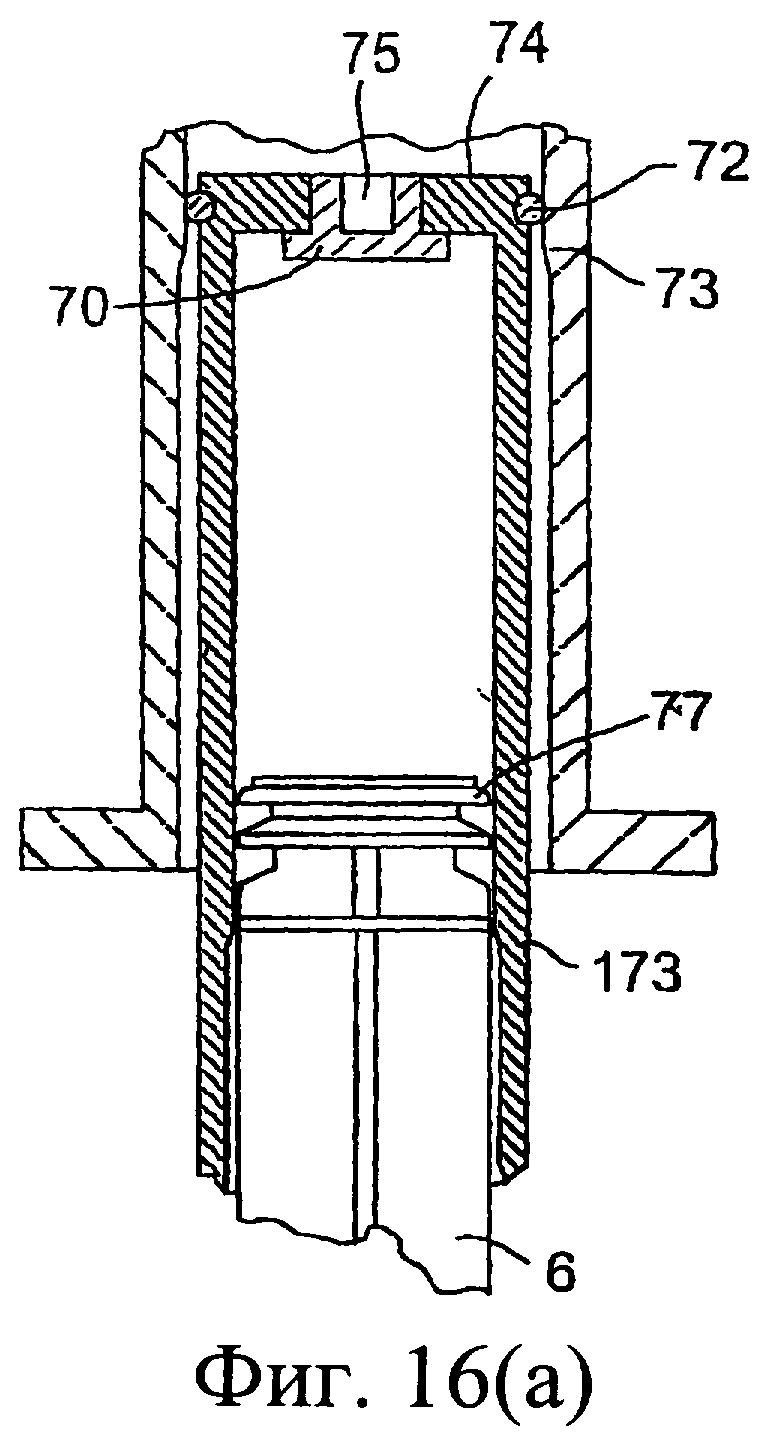
Фиг.16(а) представляет собой подробный разрез части инъектора, показанного на фиг.14, а фиг.16(b) и 16(с) представляют собой подробные аксонометрические виды части данного устройства в положениях, показанных соответственно на фиг.14(b) и (с).
Фиг.17 представляет собой схематический разрез другого инъекционного устройства;
Фиг.18(a)-18(d) представляют собой разрезы устройства, показанного на фиг.17, при его использовании;
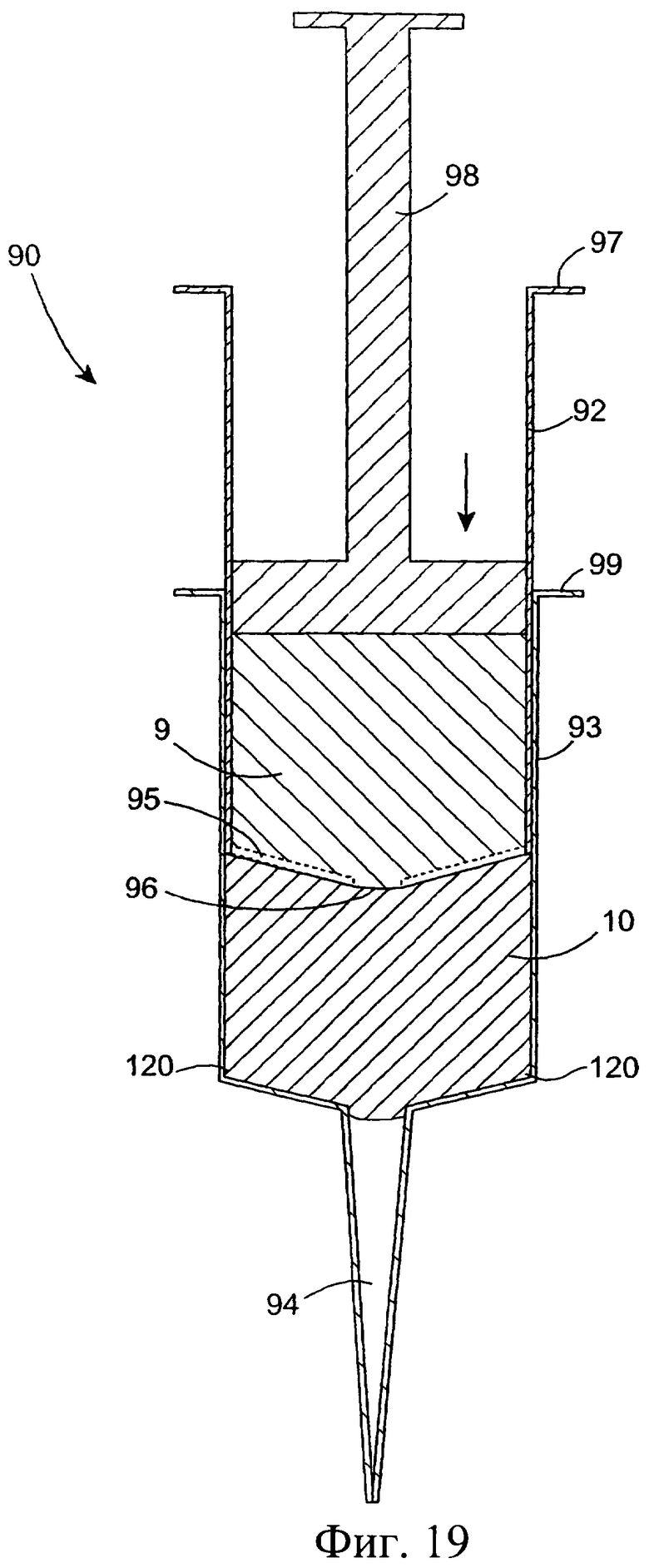
Фиг.19 представляет собой схематический разрез другого инъекционного устройства; и
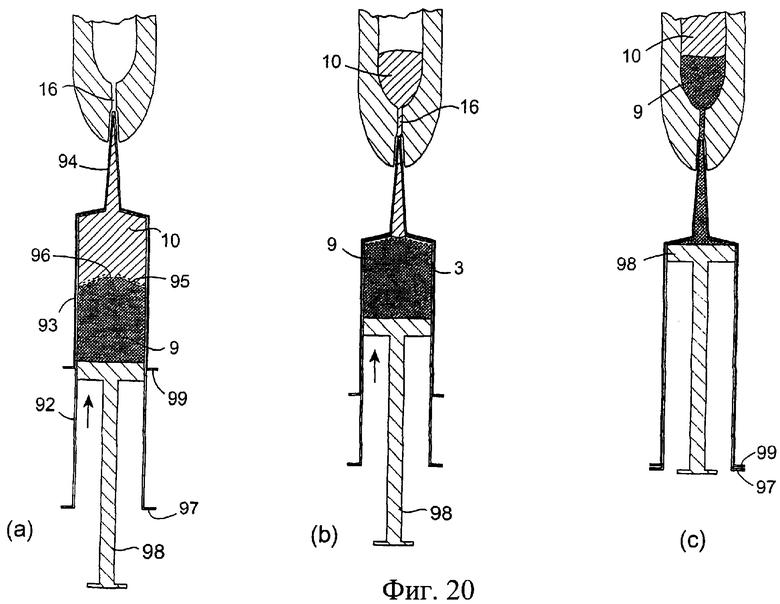
Фиг.20(а)-20(с) представляют собой разрезы инъекционного устройства, показанного на фиг.19, при его использовании.
Подробное описание изобретения
В данном изобретении предлагается инъекционное устройство, которое позволяет осуществлять последовательное введение двух несмешиваемых компонентов, например антибактериального состава и изолирующего состава, в сосковый канал млекопитающего, не являющегося человеком. Изолирующий состав и антибактериальный состав содержатся раздельно внутри одинарного инъекционного устройства. Такое выполнение позволяет хранить данный продукт без нарушения стабильности каждого компонента. Данное устройство также предусматривает введение антибактериального состава перед введением изолирующего состава, который эффективно создает физический барьер в сосковом канале с предотвращением любого дальнейшего проникновения в этот канал. Изолирующий состав также предотвращает возможность просачивания антибактериальной фазы или выжимания ее из соска за счет силы тяжести или гидростатических сил.
Изолирующий состав может содержать вязкий церат на масляной основе, содержащий высокий процент соли тяжелого металла, нитрата висмута основного. Подробное описание продукции Teat Seal (товарный знак компании Cross Vetpharm Group), которая содержит нетоксичную соль тяжелых металлов в гелевой основе, приведено в патентной публикации WO 98/26759. Данная основа представляет собой гель на основе стеарата алюминия. Данный гель предпочтительно содержит носитель, такой как жидкий парафин. Данный гель может также содержать гель на основе полиэтилена. Данный гель может быть создан на основе полиэтилена низкой или высокой плотности. В предпочтительном случае содержание соли тяжелых металлов превышает 40%, предпочтительно 50-75% по весу, наиболее предпочтительно - около 65% по весу.
Изолирующий состав предотвращает вторжение инфекции в вымя через сосковый или проточный канал благодаря сочетанию его свойств вязкости, плотности и адгезионной способности.
Антибактериальный или противовоспалительный состав может быть выбран из любого по меньшей мере одного вещества: широкого спектра составов, известных своей эффективностью для лечения, предупреждения или устранения маститов или организмов, вызывающих мастит, включая, в числе прочего, грамположительные и грамотрицательные бактерии, дрожжевые культуры, грибки и риккетсии. Антибактериальные и противовоспалительные вещества могут включать, в числе прочего, антибиотики, содержащие беталактам, например пенициллины и цефалоспорины, антибиотики, содержащие беталактам, потенцированные ингибиторами беталактама, такими как клавулановая кислота, полимиксины, гликопептиды, аминоглюкозиды, линкозамиды, макролидные антибиотики, плевромутилины, «фениколы», такие как хлорамфеникол и флорфеникол, тетрациклины, сульфонамиды и потенцированные сульфонамиды, такие как смеси триметоприма и одного или более сульфонамида, хинолоны и фторохинолоны, ионофоры, кумарины, такие как новобиоцин, натуральные или синтетические пептиды, лантибиотики и другие антибактериальных препараты, содержащие бактерии или другие микроорганизмы.
Другие антибактериальные составы могут быть выбраны из любого одного или более: макролидного антибиотика, линкозамида или плевромутилина, эритромицина, спирамицина, тилозина, спирамицина, тилмикозина, линкомицина, спектиномизина, пирлимицина, тиамулина, смеси потенцированных сульфонамидов, триметоприма плюс сульфадиазин, сульфадимидина, сульфадоксина, сульфадиметоксина или другого сульфонамида, окситетрациклина, миноциклина или доксициклина, фторохинолонов, энрофлоксацина, ципрофлоксацина, норфлоксацина, данофлоксацина, дифлоксацина или марбофлоксацина.
Второй компонент может быть выбран из одного или более: противовоспалительных составов, стероидных препаратов, таких как преднизолон, бетаметазон, дексаметазон, фенилбутазон, или нестероидных препаратов, таких как флюниксин, кетопрофен, карпрофен, ведапрофен, мелоксикам, тепоксалин, элтенак, нимесулид или толфенамовая кислота.
Также возможно использование других антибактериальных составов или противовоспалительных составов, применяемых при лечении интрамаммарных инфекций у млекопитающих.
Эти антибактериальные и противовоспалительные вещества могут быть составлены или отдельно, или в сочетании из двух или более составов как, например, жидких сред, цератов, растворов, суспензий, эмульсий или сыпучих порошков в воде, масле (животном, растительном, минеральном или другого происхождения) или других органических носителей. Другие связующие, такие как растворяющие, образующие взвеси или эмульсии агенты, модификаторы вязкости, поверхностно-активные вещества, инкапсулирующие агенты и другие средства для регулирования скорости, при которой составляющие высвобождаются из состава, буферы и подобные агенты для поддержания рН состава, противовоспалительные агенты, такие как различные стероидные и нестероидные составы, обычно используются для этой цели, а также различные консервирующие вещества, обычно используемые в фармацевтических препаратах.
Обратимся сначала к фиг.1-8, на которых изображено инъекционное устройство 1. В этом случае устройство 1 содержит внутренний цилиндр 2 и наружный цилиндр 3. Наружный цилиндр 3 содержит насадку 4. Внутренний цилиндр 2 содержит первый компонент, содержащий изолирующий состав 9. Цилиндр 2 у своего дистального конца содержит перегородку или мембрану 5. В проксимальный конец внутреннего цилиндра 2 выше изолирующего компонента 9 вставлен поршень 6. Внутри наружного цилиндра 3, расположенного ниже внутреннего цилиндра 2, содержится антибактериальный или противовоспалительный компонент 10. При использовании насадка 4 вводится в сосковый канал 20 млекопитающего, не являющегося человеком, например коровы. Через наружный цилиндр 3 посредством поршня 6 проталкивается внутренний цилиндр 2 для вытеснения антибактериального или противовоспалительного компонента 10 (фиг.8(а)). После вытеснения антибактериального или противовоспалительного компонента 10 (фиг.8(b)) на поршень 6, находящийся во внутреннем цилиндре 2, оказывается дополнительное давление для вытеснения изолирующего компонента 9 из внутреннего цилиндра 2. Давление поршня 6 может быть достаточным для высвобождения или разрыва перегородки/мембраны 5 на внутреннем цилиндре 2 с возможностью вытеснения изолирующего компонента 9 из инъекционного устройства через насадку 4 в сосковый канал (фиг.8(с)). Разрывное средство, например зубец 30, расположенный внутри наружного цилиндра 3 вблизи выходной насадки 4, может быть использовано для высвобождения, или разрыва, или вскрытия перегородки/мембраны 5.
Обратимся к фиг.9 и 9(а), на которых изображен другой инъектор, аналогичный инъектору, показанному на фиг.1-8, при этом одинаковые элементы обозначены одинаковыми номерами позиций.
Инъекционное устройство 1 содержит внутренний цилиндр 2 и наружный цилиндр 3. Наружный цилиндр 3 содержит насадку 4. В этом случае высвобождение перегородки осуществляется приводным приспособлением, состоящим из ряда острых выступов 50, выступающих вверх на различную длину. Мембрана/перегородка имеет участок 51, который выбивается острыми выступами 50 с возможностью вытеснения изолирующего компонента. Дистальный конец внутреннего цилиндра 2 содержит уплотнение, или складку 53, которая изолирует внутреннюю стенку наружного цилиндра 3.
Обратимся к фиг.10-13, на которых изображено предложенное инъекционное устройство, при этом одинаковые элементы обозначены одинаковыми номерами позиций. Инъекционное устройство 1 содержит внутренний цилиндр 2 и наружный цилиндр 3. Наружный цилиндр 3 содержит насадку 4. В этом случае перегородка у дистального конца внутреннего цилиндра 2 содержит клапан 60. Вверх от нижней стенки наружного цилиндра выступает приводное приспособление 61. При использовании, когда внутренний цилиндр 2 расположен, как показано на фиг.11, подъем клапана 60 осуществляется посредством взаимодействия с приспособлением 61 с возможностью прохождения изолирующего компонента 9 во внутреннем цилиндре через насадку 4 инъектора.
При проталкивании поршня 6 вниз внутренний цилиндр 2 также перемещается вниз через наружный цилиндр 3. Наружная сторона внутреннего цилиндра 2 с плотной пригонкой вставлена во внутренний цилиндр 3 так, что внутренний цилиндр 2 сам действует как подающее устройство или поршень для введения первого компонента из наружного цилиндра 3 через насадку 4.
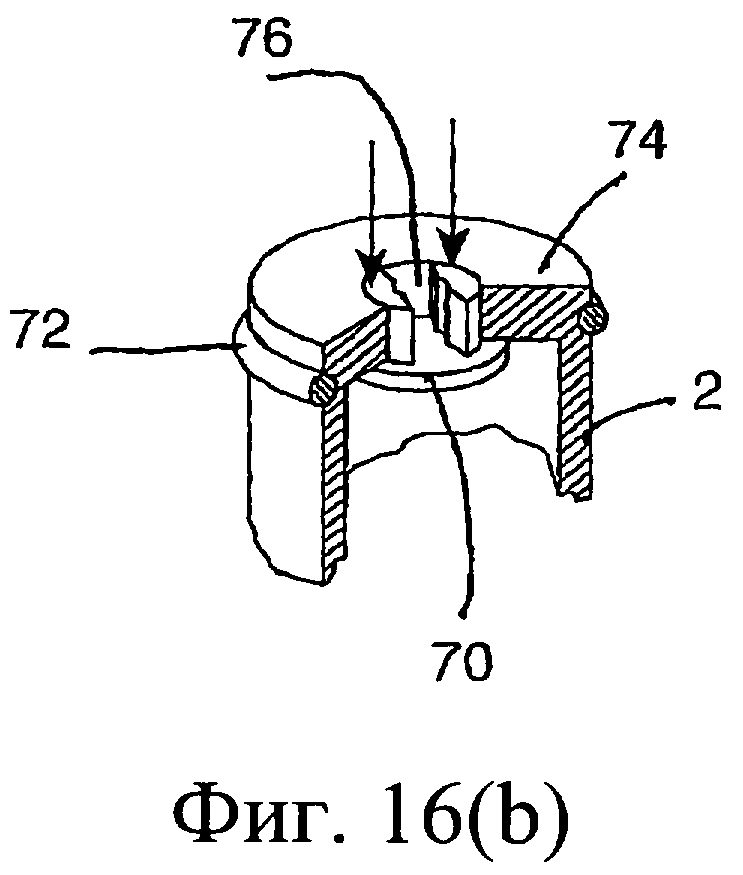
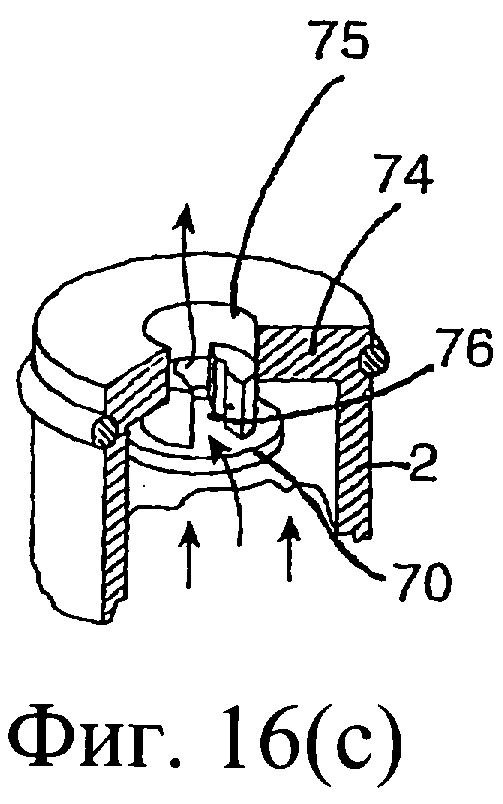
Обратимся к фиг.14-16, на которых изображено другое предложенное инъекционное устройство, и одинаковые элементы обозначены одинаковыми номерами позиций. Инъекционное устройство содержит внутренний цилиндр 2 и наружный цилиндр 3. Наружный цилиндр 3 содержит насадку 4. Внутренний цилиндр 2 содержит изолирующий компонент 9. В проксимальный конец внутреннего цилиндра 2 выше изолирующего компонента 9 вставлен поршень 6. Внутри наружного цилиндра 3 содержится антибактериальный компонент 10. При использовании насадку 4 вводят в сосковый канал 20. Внутренний цилиндр 2 имеет дистальный конец 74 с выходным отверстием 75, а перегородка содержит клапан 70, который вставлен в выходное отверстие 75. Во время введения первого компонента из наружного цилиндра 3 клапан 70 в обычном состоянии закрыт (фиг.14(а), (b)). От нижней стенки наружного цилиндра 3 выступает вверх приводное приспособление 71. При использовании после введения всего первого компонента внутренний цилиндр 2 расположен, как показано на фиг.14(с), клапан 70 высвобождается посредством взаимодействия с приспособлением 71, а изолирующий компонент 9 во внутреннем цилиндре может проходить через боковые проходы 76 в клапане через выходное отверстие 75 в насадку 4 инъектора.
Внутренняя стенка внутреннего цилиндра 2 выполнена для взаимодействия с поршнем 6 и содержит между его проксимальным и дистальным концами запирающее кольцо 173. Внутренний цилиндр 2 содержит дистальный участок 178 и проксимальный участок 179, причем внутренний диаметр дистального участка 178 меньше внутреннего диаметра проксимального участка 179. Поршень 6 содержит уплотнение 77, которое проходит поверх запирающего кольца 173 внутреннего цилиндра при сборке, а поршень 6, таким образом, с возможностью уплотнения взаимодействует с внутренним цилиндром 2.
Внутренний цилиндр 2 дополнительно содержит наружное уплотнение 72 для взаимодействия с внутренней стенкой наружного цилиндра 3. Уплотнение 72 может, например, состоять из выполненного за одно целое уплотнения или уплотнительного кольца, размещенного в выемке 172 в наружной боковой стенке внутреннего цилиндра 2. Наружное уплотнение 72 расположено около дистального конца 74 внутреннего цилиндра.
Внутренняя стенка цилиндра 3 выполнена для взаимодействия с цилиндром 2 и содержит запирающее кольцо 73 между его проксимальным и дистальным концами для взаимодействия с уплотнением 72 цилиндра 2. Наружный цилиндр 3 содержит дистальный участок 78 и проксимальный участок 79. Внутренний диаметр участка 78 меньше внутреннего диаметра участка 79. При сборке уплотнение 72 проходит поверх кольца 73 цилиндра 3 и взаимодействует с возможностью уплотнения с наружным цилиндром. Таким образом, создается препятствие для прохождения антибактериального состава или противовоспалительного состава 10 между данными цилиндрами при нажатии на поршень 6.
Клапан 70 содержит множество каналов 76, которые открываются, когда клапан 70 высвобождается, для возможности прохождения изолирующего компонента через клапан. Таким образом, при высвобождении клапана каналы 76, которые ограничивают проход для изолирующего компонента, открываются.
Приспособление 71 по существу цилиндрической формы определяет форму прохода и соответствует по форме выходному отверстию 75 с возможностью размещения в части этого выходного отверстия. Приспособление 71 вставлено с плотной пригонкой в выходное отверстие 75.
При использовании внутренний цилиндр 2 проталкивают поршнем 6 через наружный цилиндр 3 для вытеснения состава 10 (фиг.14(а)). Наружная сторона цилиндра 2 соответствует геометрии поршня 6 с возможностью функционирования самого цилиндра 2 в качестве поршня. После вытеснения состава 10 (фиг.14(b)) на поршень 6, расположенный во внутреннем цилиндре 2, нажимают еще для вытеснения из него изолирующего компонента 9. Благодаря взаимодействию внутреннего цилиндра с приспособлением 71 осуществляется высвобождение клапана 70, при этом компонент 9 во внутреннем цилиндре 2 получает возможность продвижения через проходы клапана в насадку 4 с вытеснением в сосковый канал (фиг.14(с)).
Более подробное описание работы клапана приведено со ссылкой на фиг.14-16 и в, частности, на фиг.16(b) и (с).
В закрытом состоянии клапан 70, плотно пригнанный к выходному отверстию 75, находится в данном выходном отверстии и предотвращает любое смешивание компонентов в наружном и внутреннем цилиндрах (фиг.14(b) и 16(b)).
При размещении приспособления 71 в выходном отверстии 75 (фиг.14(с) и 16(с)) клапан высвобождается, при этом в данном клапане открываются проходы 76, создавая возможность прохождения изолирующего компонента в проходы 76 клапана через проход, ограниченный приспособлением 71, в насадку 4 инъектора.
Взаимодействие приспособления 71 с выходным отверстием цилиндра 2 обеспечивает совмещение соответствующих проходов 76 клапана и указанного приспособления перед высвобождением клапана, что позволяет осуществить выход изолирующего компонента из внутреннего цилиндра. Соответствующие проходы 76 и приводного приспособления создают закрытый и изолированный проход для изолирующего компонента с возможностью прохождения из внутреннего цилиндра 2 непосредственно в насадку 4.
Одним преимуществом перегородки клапанного типа данного варианта выполнения является отсутствие опасности возникновения подвижности любой части перегородки. Данная перегородка удерживается инъектором.
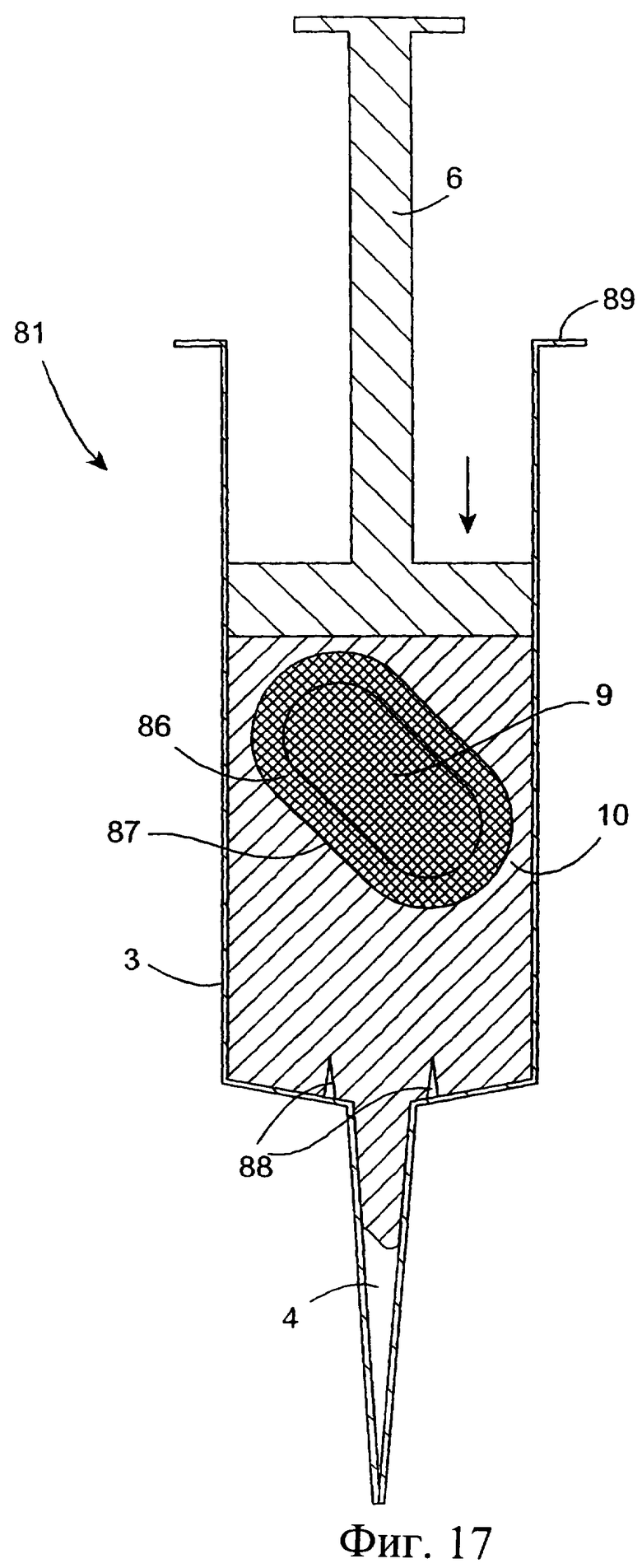
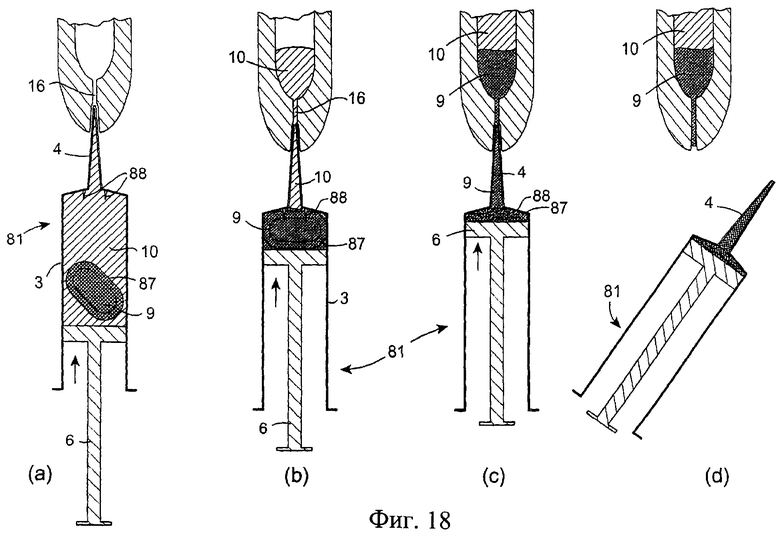
Обратимся к фиг.17-18, на которых изображено инъекционное устройство 81, аналогичное инъектору, показанному на фиг.1-9, при этом одинаковым деталям присвоены одинаковые номера позиций. Устройство 81 содержит цилиндр 3, наружную насадку 4 и поршень 6. Внутри цилиндра 3 устройства 81 размещены два несмешивающихся компонента 9 и 10. Эти два компонента, например, антибактериальный компонент 10 и изолирующий компонент 9, отделены друг от друга перегородкой/мембраной. Компонент 10 помещен в цилиндр 3, а компонент 9 помещен в резервуар 86, такой как мешок, который ограничен наружной мембраной 87, создающей перегородку.
Резервуар 86 может состоять из капсулы, которая заполняется изолирующим компонентом на производстве. Данная капсула затем может быть легко опущена в цилиндр 3 инъектора перед введением поршня 6.
После введения насадки 4 устройства 81 в сосковый канал 16 пользователь нажимает на поршень 6 для введения компонента 10 из инъекционного устройства в сосковый канал (фиг.17(а)). После вытеснения компонента 10 из инъекционного устройства приложение дополнительного давления к поршню приводит к прокалыванию или разрыву резервуара 86 с возможностью выхода компонента 9, который вводится в сосковый канал (фиг.17(b)). Фиг.17(d) показывает положение изолирующего состава 9 и антибактериального состава 8 при введении в сосок млекопитающего, не являющегося человеком.
Инъекционное устройство может содержать разрывное средство, такое как острые зубцы 88, расположенные у дистального конца цилиндра 3, способствующие прокалыванию или разрыву резервуара 86.
Следует понимать, что для удобства производства и использования резервуар 86 может быть прикреплен к поршню 6. В этом случае резервуар не может находиться в контакте с разрывным устройством по существу до тех пор, пока весь первый компонент не будет вытеснен из данного устройства.
При введении изолирующего состава 9 и антибактериального или противовоспалительного состава 10 в сосковый канал инъекционное устройство обычно расположено вертикально ниже соска с нагнетательной насадкой в самом верхнем положении. Изолирующий состав 9 по сравнению с антибактериальным или противовоспалительным составом 10 обладает значительно более высокой удельной плотностью, поэтому резервуар, содержащий изолирующий состав, остается у нижнего конца цилиндра 3, содержащего антибактериальный или противовоспалительный состав, во время введения антибактериального или противовоспалительного состава в сосок. В этом случае резервуар входит в контакт с разрывным устройством только тогда, когда по существу весь антибактериальный или противовоспалительный состав уже введен в сосок.
Обратимся к фиг.19 и 20, на которых изображено другое инъекционное устройство 90. Устройство 90 содержит внутренний цилиндр 92 и наружный цилиндр 93. Цилиндр 93 содержит насадку 94. Цилиндр 92 у дистального конца содержит разрушаемую/разрываемую перегородку или мембрану, а у проксимального конца - поршень 98. Внутри цилиндра 93 содержится антибактериальный состав 10. При использовании насадку 94 вводят в сосковый канал 16. Для вытеснения состава 10 внутренний цилиндр продвигают через наружный цилиндр 93 (фиг.20(b)). Эта процедура может быть облегчена путем использования фланца 97, расположенного вокруг проксимального конца цилиндра 92, и фланца 99, расположенного вокруг проксимального конца цилиндра 93. После вытеснения состава 10 (фиг.20(с)) нажимают на поршень 98, находящийся в цилиндре 92, для вытеснения изолирующего состава 9 из внутреннего цилиндра 91. Давления поршня 98 достаточно для разрыва или вскрытия перегородки/мембраны 96 на внутреннем цилиндре 92, создавая возможность для вытеснения изолирующего состава 9 из инъекционного устройства через насадку 94 в сосковый канал (фиг.20(с)). Как вариант, разрывное средство, такое как острые зубцы, расположенные внутри наружного цилиндра 93 у его отверстия в насадке, разрывают перегородку/мембрану 96.
У переднего конца цилиндра 92 внутреннего инъектора может быть выполнено уплотнение 96 для создания надежного уплотнения. Внутренний инъектор может быть отформован вместе с непрочной разрушаемой перегородкой/мембраной 95, расположенной поперек выходного отверстия.
Следует понимать, что изолирующая часть состава может быть произведена в одном месте с последующей компоновкой с антибактериальной частью состава на более позднем этапе, в этом же или другом месте.
Данное изобретение не ограничивается вышеописанными вариантами выполнения, которые могут быть изменены в деталях.
| название | год | авторы | номер документа |
|---|---|---|---|
| Состав гидрогеля с умеренной адгезией | 2016 |
|
RU2693041C2 |
| МНОГОФЛЮИДНАЯ СИСТЕМА ДОСТАВКИ С МНОГОРАЗОВЫМ РАСХОДНЫМ КОМПЛЕКТОМ И ЕЕ КОНСТРУКЦИОННЫЕ ОСОБЕННОСТИ | 2016 |
|
RU2824350C2 |
| МНОГОФЛЮИДНАЯ СИСТЕМА ДОСТАВКИ С МНОГОРАЗОВЫМ РАСХОДНЫМ КОМПЛЕКТОМ И ЕЕ КОНСТРУКЦИОННЫЕ ОСОБЕННОСТИ | 2016 |
|
RU2714926C2 |
| ПОЛУАВТОМАТИЧЕСКИЙ ВЕТЕРИНАРНЫЙ ИНЪЕКТОР НОВИКОВА В.Г. | 1993 |
|
RU2074671C1 |
| УСОВЕРШЕНСТВОВАННЫЕ БЕЗЫГОЛЬНЫЕ ИНЪЕКТОРЫ | 2012 |
|
RU2587011C2 |
| Пробка с низким усилием для использования в инъекторе | 2019 |
|
RU2784650C2 |
| АВТОМАТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ИНЪЕКЦИЙ С ИНЪЕКЦИОННЫМ КАРТРИДЖЕМ И ПРИВОДНОЙ МЕХАНИЗМ ТАКОГО УСТРОЙСТВА | 2013 |
|
RU2649473C2 |
| КЛАПАННОЕ УСТРОЙСТВО ДЛЯ ЛИНЗЫ С ПЕРЕМЕННЫМ ФОКУСНЫМ РАССТОЯНИЕМ | 2009 |
|
RU2489739C2 |
| МЕДИЦИНСКОЕ ИНЪЕКЦИОННОЕ УСТРОЙСТВО С ИНДИКАТОРОМ ВРЕМЕННОЙ ЗАДЕРЖКИ | 2009 |
|
RU2508922C2 |
| БЕЗЫГОЛЬНЫЙ ИНЪЕКТОР С ДВОЙНЫМ ОГРАНИЧИТЕЛЕМ И ПОНИЖЕННЫМИ ПРОФИЛЯМИ ДАВЛЕНИЯ | 2007 |
|
RU2437684C2 |
Изобретение относится к устройствам, предназначенным для лечения, предотвращения или подавления заболевания или болезненного состояния у млекопитающего, не являющегося человеком. Инъекционное устройство содержит цилиндр, предназначенный для размещения первого компонента, выходную насадку, предназначенную для введения в сосковый канал и расположенную на одном конце цилиндра, внутренний резервуар, расположенный в цилиндре и предназначенный для размещения второго компонента, клапан, предназначенный для отделения первого компонента от второго компонента, приводное приспособление, предназначенное для открытия клапана для обеспечения возможности выхода второго компонента из внутреннего резервуара и средство доставки, предназначенное для введения первого компонента из цилиндра и последующего введения второго компонента из внутреннего резервуара, производимого после входа клапана во взаимодействие с приводным приспособлением для открытия клапана, через выходную насадку. Использование изобретения позволит повысить эффективность лечения млекопитающего, не являющегося человеком. 36 з.п. ф-лы, 20 ил.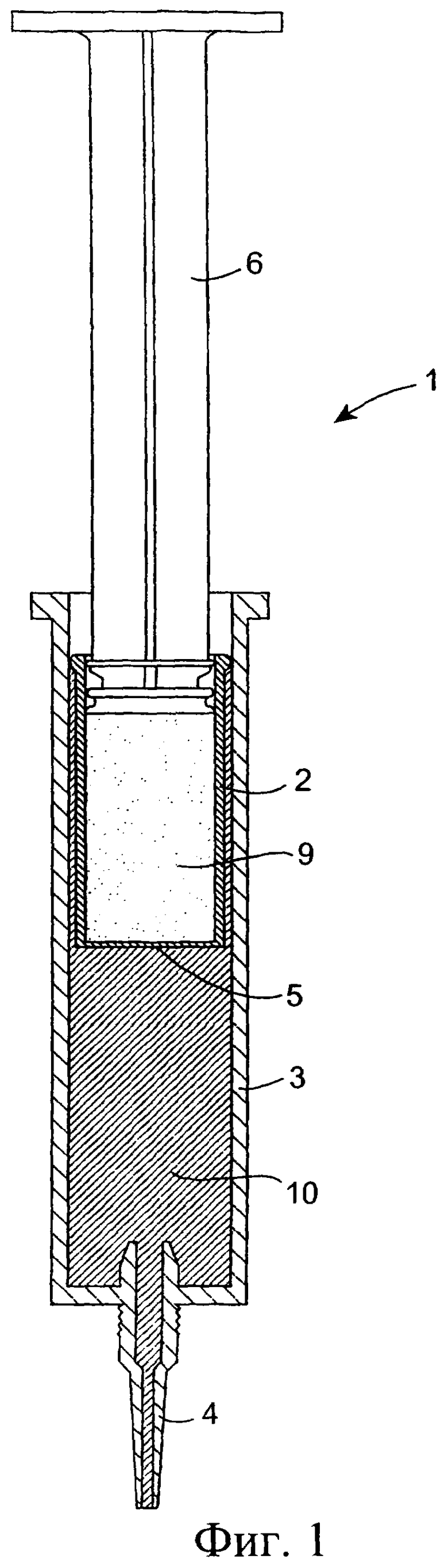
1. Инъекционное устройство для введения компонентов в сосковый канал млекопитающего, не являющегося человеком, содержащее цилиндр, предназначенный для размещения первого компонента, выходную насадку, предназначенную для введения в сосковый канал и расположенную на одном конце цилиндра, внутренний резервуар, расположенный в цилиндре и предназначенный для размещения второго компонента, клапан, предназначенный для отделения первого компонента от второго компонента, приводное приспособление, предназначенное для открытия клапана для обеспечения возможности выхода второго компонента из внутреннего резервуара, и средство доставки, предназначенное для введения первого компонента из цилиндра и последующего введения второго компонента из внутреннего резервуара, производимого после входа клапана во взаимодействие с приводным приспособлением для открытия клапана, через выходную насадку.
2. Инъекционное устройство по п.1, в котором клапан содержит, по меньшей мере, один проход.
3. Инъекционное устройство по п.2, в котором указанный, по меньшей мере, один проход открывается при открытии клапана для введения второго компонента через указанный, по меньшей мере, один проход.
4. Инъекционное устройство по п.1, в котором приводное приспособление содержит, по меньшей мере, один выступающий элемент.
5. Инъекционное устройство по п.1, в котором приводное приспособление расположено в цилиндре.
6. Инъекционное устройство по п.1, в котором приводное приспособление расположено смежно с выходной насадкой.
7. Инъекционное устройство по п.1, в котором приводное приспособление содержит, по меньшей мере, один проход.
8. Инъекционное устройство по п.1, в котором приводное приспособление выполнено с возможностью взаимодействия с внутренним резервуаром с обеспечением создания непосредственного прохода для введения второго компонента из внутреннего резервуара в выходную насадку.
9. Инъекционное устройство по п.1, в котором средство доставки содержит поршень для цилиндра.
10. Инъекционное устройство по п.1, в котором внутренний резервуар содержит внутренний цилиндр, расположенный внутри наружного цилиндра инъектора.
11. Инъекционное устройство по п.10, в котором внутренний цилиндр установлен с плотной пригонкой внутри наружного цилиндра.
12. Инъекционное устройство по п.1, в котором средство доставки содержит внутренний цилиндр.
13. Инъекционное устройство по п.10, в котором внутренний цилиндр ограничивает поршень для наружного цилиндра.
14. Инъекционное устройство по. п.10, в котором средство доставки содержит поршень для внутреннего цилиндра.
15. Инъекционное устройство по п.10, в котором внутренний цилиндр содержит средство взаимодействия, предназначенное для взаимодействия с наружным цилиндром при сборке.
16. Инъекционное устройство по п.15, в котором средство взаимодействия содержит наружное уплотнение.
17. Инъекционное устройство по п.15, в котором наружный цилиндр содержит средство взаимодействия, предназначенное для взаимодействия с внутренним цилиндром.
18. Инъекционное устройство по п.17, в котором наружный цилиндр содержит запирающее кольцо для взаимодействия с внутренним цилиндром.
19. Инъекционное устройство по п.10, в котором внутренний цилиндр содержит средство взаимодействия, предназначенное для взаимодействия с поршнем.
20. Инъекционное устройство по п.19, в котором внутренний цилиндр содержит запирающее кольцо для взаимодействия с поршнем.
21. Инъекционное устройство по п.1, в котором цилиндр содержит первый компонент.
22. Инъекционное устройство по п.21, в котором первый компонент содержит антибактериальный состав.
23. Инъекционное устройство по п.1, в котором внутренний резервуар содержит второй компонент.
24. Инъекционное устройство по п.23, в котором второй компонент содержит изолирующий состав.
25. Инъекционное устройство по п.24, в котором изолирующий состав содержит нетоксичную соль тяжелых металлов.
26. Инъекционное устройство по п.25, в котором изолирующий состав содержит более 40% по весу соли тяжелых металлов.
27. Инъекционное устройство по п.25, в котором изолирующий состав содержит от 50 до 75% по весу соли тяжелых металлов.
28. Инъекционное устройство по п.25, в котором изолирующий состав содержит около 65% по весу соли тяжелых металлов.
29. Инъекционное устройство по п.25, в котором тяжелый металл представляет собой висмут.
30. Инъекционное устройство по п.25, в котором изолирующий состав содержит гелевую основу.
31. Инъекционное устройство по п.30, в котором гелевая основа представляет собой гель на основе стеарата алюминия.
32. Инъекционное устройство по п.30, в котором гелевая основа содержит жидкий парафин в качестве носителя.
33. Инъекционное устройство по п.22, в котором антибактериальный состав выбирают из любого, по меньшей мере, одного вещества: антибиотиков, содержащих беталактам, полимиксинов, гликопептидов, аминоглюкозидов, линкозамидов, макролидных антибиотиков, плевромутилинов, «фениколов» таких, как хлорамфеникол и флорфеникол, тетрациклинов, сульфонамидов и потенцированных сульфонамидов таких, как смесь триметоприма и одного или более сульфонамида, хинолонов и фторохинолонов, ионофоров, курмаринов таких, как новобиоцин, натуральных или синтетических пептидов, аминогликозидов, антибактериальных пептидов или антибактериальных препаратов, лантибиотиков, или других продуктов, содержащих бактерии или другие микроорганизмы.
34. Инъекционное устройство по п.33, в котором беталактам выбирают из любого, по меньшей мере, одного вещества: пенициллина, модифицированного пенициллина такого, как клоксасилин, амоксилин, ампицилин, цефалоспоринов или антибиотиков, содержащих беталактам, потенцированных ингибиторами беталактама такими, как клавулановая кислота.
35. Инъекционное устройство по п.33, в котором аминогликозид выбирают из любого, по меньшей мере, одного вещества: стрептомицина, дигидрострептомицина, неомицина, гентамицина, фрамицитина, апарамицина или канамицина.
36. Инъекционное устройство по п.22, в котором антибактериальный состав выбирается из любого, по меньшей мере, одного вещества: макролидного антибиотика, линкозамида или плевромутилина, эритромицина, спирамицина, тилозина, спирамицина, тилмикозина, линкомицина, спектиномизина, прилимицина или тиамулина.
37. Инъекционное устройство по пп.1-36, в котором первый компонент вводится из цилиндра, а затем второй компонент вводится из внутреннего резервуара без существенного смешивания данных компонентов.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 2003167041, 04.09.2003 | |||
| УСТРОЙСТВО ДЛЯ ИЗГОТОВЛЕНИЯ НЕТКАНОГО МАТЕРИАЛА | 1994 |
|
RU2076534C1 |
| Автоматический безыгольный инъектор | 1980 |
|
SU889005A1 |
Авторы
Даты
2009-10-10—Публикация
2005-02-02—Подача