Настоящее изобретение относится к производным 5- или 6-замещенных бензимидазолов, обладающим противовирусной активностью, в частности, обладающим ингибиторной активностью в отношении репликации респираторного синцитиального вируса (RSV). Оно относится также к способу их получения и к содержащим их композициям.
Человеческий RSV или респираторный синцитиальный вирус представляет собой крупный РНК вирус, член семейства Paramyxoviridae, подсемейства pneumoviridae наряду с коровьим RSV вирусом. Человеческий RSV ответственен за ряд заболеваний дыхательных путей у людей всех возрастов во всем мире. Он является основной причиной заболеваний нижних дыхательных путей у младенцев и детей. Более половины младенцев заражаются RSV в свой первый год жизни и почти все в свои первые два года жизни. Инфицирование маленьких детей может вызвать повреждение легких, которое сохраняется годами и может привести к хроническим заболеваниям легких в дальнейшей жизни (хронические хрипы, астма). Старшие дети и взрослые часто заболевают обычной простудой после RSV инфекции. В пожилом возрасте такая предрасположенность снова повышается, и RSV влечет за собой ряд вспышек пневмонии, которые в старческом возрасте приводят к значительной смертности.
Инфицирование вирусом данной подгруппы не защищает от последующего инфицирования RSV изолятом из той же самой подгруппы в следующем зимнем сезоне. Таким образом, повторное инфицирование RSV является обычным, несмотря на то, что существует всего два подтипа, A и B.
В настоящее время только три лекарственных средства рекомендованы к применению против RSV инфекции. Первым является рибофлавин, аналог нуклеозида, обеспечивающий аэрозольное лечение при тяжелой RSV инфекции для госпитализированных детей. Аэрозольный способ введения, токсичность (риск тератогенности), стоимость и значительные колебания эффективности ограничивают его применение. Два других лекарственных средства, RespiGam® и palivizumab, иммуностимуляторы поликлональных и моноклональных антител, предназначены для превентивного использования.
Другие попытки создания безопасной и эффективной RSV вакцины до сих пор терпели неудачу. Инактивированные вакцины не могут защитить от заболевания и на практике в некоторых случаях лишь усиливают заболевание при последующем инфицировании. С ограниченным успехом использовались ослабленные вакцины. Очевидно, что существует необходимость в эффективном, не токсичном и простом в применении лекарстве против репликации RSV.
Ранее бензимидазолы и имидазопиридины в качестве ингибиторов репликации RSV были раскрыты в WO 01/00611, WO 01/00612 и WO 01/00615.
Несколько серий бензимидазолильных и имидазопиридинильных пиперидинов были раскрыты в патентах, патентных заявках и публикациях Janssen Pharmaceutica N.V. как соединения, обладающие антигистаминовыми свойствами. См., например, EP-A-5318, EP-A-99139, EP-A-145037, WO-92/01687, Janssens F. et al. в Journal of Medicinal Chemistry, Am. Chem. Soc, Vol. 28, no. 12, pp. 1934-1943 (1985).
Настоящее изобретение относится к ингибиторам репликации RSV, которые можно представить формулой (I):
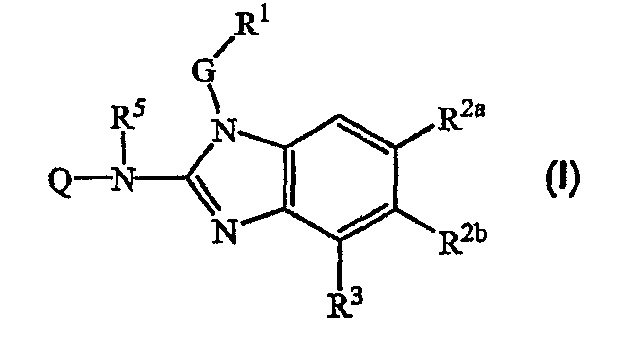
к их пролекарственным формам, N-оксидам, солям присоединения, четвертичным аминам, комплексам металлов и стереохимически изомерным формам, где
Q представляет Ar2, R6a, пирролидинил, замещенный R6, пиперидинил, замещенный R6, или гомопиперидинил, замещенный R6;
G представляет простую связь или C1-10алкандиил, необязательно замещенный одним или более заместителями, индивидуально выбранными из группы, состоящей из гидрокси, С1-6алкилокси, Ar1С1-6алкилокси, С1-6алкилтио, Ar1С1-6алкилтио, HO(-CH2-CH2-O)n-, С1-6алкилокси(-CH2-CH2-O)n- и Ar1С1-6алкилокси(-CH2-CH2-O)n-;
R1 представляет Ar1 или моноциклический или бициклический гетероцикл, выбранный из пиперидинила, пиперазинила, пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тетрагидрофуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, хинолинила, хиноксалинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензтиазолила, пиридопиридила, нафтиридинила, 1Н-имидазо[4,5-b]пиридинила, 3Н-имидазо[4,5-b]пиридинила, имидазо[1,2-a]пиридинила, 2,3-дигидро-1,4-диоксино[2,3-b]пиридила или радикала формулы
где каждый из указанных моноциклических или бициклических гетероциклов может быть необязательно замещен 1 или, там где это возможно, более, например 2, 3, 4 или 5 заместителями, индивидуально выбранными из группы заместителей, состоящей из галогена, гидрокси, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилтио, С1-6алкилоксиС1-6алкила, Ar1, Ar1С1-6алкила, Ar1С1-6алкилокси, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалогенС1-6алкила, С1-6алкилкарбониламино, С1-6алкил-SO2-NR4a-, Ar1-SO2-NR4а-, С1-6алкилоксикарбонила, -C(=О)-NR4аR4b, HO(-CH2-CH2-O)n-, галоген(-CH2-CH2-O)n-, С1-6алкилокси(-CH2-CH2-O)n-, Ar1С1-6алкилокси(-CH2-CH2-O)n- и моно- и ди(С1-6алкил)амино(-CH2-CH2-O)n;
один из R2a и R2b представляет цианоС1-6алкил, цианоC2-6алкенил, Ar3С1-6алкил, Ar3(OH)С1-6алкил, Het-С1-6алкил, N(R8aR8b)С1-6алкил, Ar3C2-6алкенил, Het-C2-6алкенил, Ar3аминоС1-6алкил, Het-аминоС1-6алкил, Het-С1-6алкиламиноС1-6алкил, Ar3тиоС1-6алкил, Het-тиоС1-6алкил, Ar3сульфонилС1-6алкил, Het-сульфонилС1-6алкил, Ar3аминокарбонил, Het-аминокарбонил, Ar3(CH2)nаминокарбонил, Het-(CH2)nаминокарбонил, Ar3карбониламино, Het-карбониламино, Ar3(CH2)nкарбониламино, Het-(CH2)nкарбониламино или Ar3(CH2)nамино; и
другой из R2а и R2b представляет водород;
в том случае, если R2a представляет водород, тогда R3 представляет водород;
в том случае, если R2b представляет водород, тогда R3 представляет водород или С1-6алкил;
R4a и R4b могут быть одинаковы или могут отличаться друг от друга, и каждый независимо представляет водород или С1-6алкил; или
R4a и R4b, взятые вместе, могут образовывать двухвалентный радикал формулы -(CH2)s где s представляет 4 или 5;
R5 представляет водород или С1-6алкил;
R6 представляет водород или С1-6алкил, необязательно замещенный одним или более заместителями, причем каждый независимо выбран из группы, состоящей из трифторметила, NR7аR7b, C3-7циклоалкила, Ar2, гидрокси, C1-4алкокси, C1-4алкилтио, Ar2-окси-, Ar2-тио-, Ar2(CH2)nокси, Ar2(CH2)nтио, гидроксикарбонила, аминокарбонила, С1-4алкилкарбонила, Ar2карбонила, C1-4алкоксикарбонила, Ar2(CH2)nкарбонила, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, Ar2(CH2)nкарбонилокси, C1-4алкоксикарбонил(CH2)nокси, моно- или ди(С1-4алкил)аминокарбонила, моно- или ди(С1-4алкил)аминокарбонилокси, аминосульфонила, моно- или ди(C1-4алкил)аминосульфонила или гетероцикла, выбранного из группы, состоящей из пирролидинила, пирролила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила, пиридила и тетрагидропиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила;
R6a представляет С1-6алкил, замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, NR7аR7b, C3-7циклоалкила, Ar2, гидрокси, C1-4алкокси, C1-4алкилтио, Ar2-окси-, Ar2-тио-, Ar2(CH2)nокси, Ar2(CH2)nтио, гидроксикарбонила, аминокарбонила, C1-4алкилкарбонила, Ar2карбонила, C1-4алкоксикарбонила, Ar2(CH2)nкарбонила, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, Ar2(CH2)nкарбонилокси, C1-4алкоксикарбонил(CH2)nокси, моно- или ди(C1-4алкил)аминокарбонила, моно- или ди(C1-4алкил)аминокарбонилокси, аминосульфонила, моно- или ди(C1-4алкил)аминосульфонила или гетероцикла, выбранного из группы, состоящей из пирролидинила, пирролила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила, пиридила и тетрагидропиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила;
R7a представляет водород, С1-6алкил, формил или С1-6алкилкарбонил;
R7b представляет водород, С1-6алкил, формил или С1-6алкилкарбонил;
R8a представляет Ar3, С1-6алкил, гидроксиС1-6алкил, С1-6алкоксиС1-6алкил, цианоС1-6алкил, аминоС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, Ar3С1-6алкил, Het-С1-6алкил, аминокарбонил-С1-6алкил, карбоксилС1-6алкил;
R8b представляет Ar3, С1-6алкил, гидроксиС1-6алкил, С1-6алкоксиС1-6алкил, цианоС1-6алкил, аминоС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, Ar3С1-6алкил, Het-С1-6алкил;
каждый n независимо представляет 1, 2, 3 или 4;
каждый m независимо представляет 1 или 2;
каждый p независимо представляет 1 или 2;
Ar1 представляет фенил или фенил, замещенный 1 или более, например, 2, 3 или 4 заместителями, выбранными из галогена, гидрокси, С1-6алкила, гидроксиС1-6алкила, полигалогенС1-6алкила, и С1-6алкилокси;
Ar2 представляет фенил или фенил, замещенный 1 или более, например, 2, 3 или 4 заместителями, выбранными из группы, состоящей из галогена, гидрокси, амино, циано, С1-6алкила, гидроксиС1-6алкила, полигалогенС1-6алкила, аминоС1-6алкила, С1-6алкилокси, аминосульфонила, аминокарбонила, гидроксикарбонила, С1-4алкилкарбонила, моно- или ди(С1-4алкил)амино, моно- или ди(С1-4алкил)аминокарбонила, моно- или ди(С1-4алкил)аминосульфонила, моно- или ди(С1-4алкил)аминоС1-4алкила и С1-4алкоксикарбонила;
Ar3 представляет фенил, нафталинил, 1,2,3,4-тетрагидронафталинил или инданил, где указанный фенил, нафтил, 1,2,3,4-тетрагидронафталинил или инданил могут необязательно и каждый индивидуально быть замещены одним или более, например, 2, 3 или 4 заместителями, выбранными из группы, состоящей из галогена, гидрокси, меркапто, амино, циано, С1-6алкила, C2-6алкенила, C2-6алкинила, Ar1, гидроксиС1-6алкила, полигалогенС1-6алкила, аминоС1-6алкила, цианоС1-6алкила, аминокарбонила, С1-6алкилокси, С1-6алкилтио, Ar1-окси, Ar1-тио, Ar1-амино, аминосульфонила, аминокарбонилС1-6алкила, гидроксикарбонилС1-6алкила, гидроксикарбонила, C1-4алкилкарбонила, моно- или ди(C1-4алкил)амино, моно- или ди(C1-4алкил)аминокарбонила, моно- или ди(C1-4алкил)аминосульфонила, моно- или ди(C1-4алкил)аминоС1-6алкила, С1-4алкилкарбониламино и C1-4алкоксикарбонила;
Het представляет гетероцикл, выбранный из тетрагидрофуранила, тетрагидротиенила, диоксанила, диоксоланила, пирролидинила, пирролидинонила, фуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, тиадиазолила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, пиридила, пиразинила, пиридазинила, пиримидинила, тетрагидрохинолинила, хинолинила, изохинолинила, бензодиоксанила, бензодиоксолила, индолинила, индолила, причем каждый из указанных гетероциклов может быть необязательно замещен оксо, амино, Ar1, C1-4алкилом, аминоC1-4алкилом, гидроксиС1-6алкилом, Ar1C1-4алкилом, моно- или ди(С1-6алкил)аминоС1-6алкилом, моно- или ди(С1-6алкил)амино или двумя C1-4алкильными радикалами.
Настоящее изобретение также относится к применению соединения формулы (I), или его пролекарственной формы, N-оксида, соли присоединения, четвертичного амина, комплекса металла и его стереохимически изомерных форм, для приготовления лекарственного средства для ингибирования репликации RSV. Или настоящее изобретение относится к способу ингибирования репликации RSV у теплокровных животных, причем указанный способ включает введение эффективного количества соединения формулы (I), или его пролекарственной формы, N-оксида, соли присоединения, четвертичного амина, комплекса металла и стереохимически изомерной формы.
В следующем аспекте, настоящее изобретение относится к новым соединениям формулы (I), также как к способам получения этих соединений.
В настоящем описании и формуле изобретения термин “пролекарственная форма” означает фармакологически приемлемые производные, например, сложные эфиры и амиды, такие, которые, являясь результатом биотрансформации производного, представляют собой активное лекарственное средство, как определено для соединений формулы (I). Ссылка на Goodman and Gilman (The Pharmacological Basis of Therapeutics, 8th ed, McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15), в которой речь идет вообще о пролекарственных формах, включена в качестве ссылки. Пролекарственные формы характеризуются хорошей растворимостью в воде и биоусвояемостью и легко превращаются в активные ингибиторы in vivo.
Подразумевается, что термины “C1-10алкандиил, необязательно замещенный одним или более заместителями” и “C1-6алкил, необязательно замещенный одним или более заместителями”, например, как использовано в определении G и, соответственно, R6 или R6a, включают C1-10алкандиильные или C1-6алкильные радикалы, содержащие два или более заместителей, например, два, три, четыре, пять или шесть заместителей, в частности, два или три заместителя, особенно два заместителя. Верхний предел числа заместителей определяется числом атомов водорода, которые можно заменить, также как общими свойствами заместителей, например, их объемом, причем эти характеристики позволяют специалистам определять указанные верхние пределы.
Как использован в описании термин ”полигалогенC1-6алкил” как группа или часть группы, например, в полигалогенC1-6алкилокси, подразумевает моно- или полигалогеном замещенный C1-6алкил, в частности, C1-6алкил, замещенный одним, двумя, тремя, четырьмя, пятью, шестью или более атомами галогенов, такой как метил или этил с одним или более атомами фтора, например, дифторметил, трифторметил, трифторэтил. Включены также перфторC1-6алкильные группы, которые представляют C1-6алкильные группы, в которых все атомы водорода заменены атомами фтора, например, пентафторэтил. В том случае, если более чем один атом галогена присоединен к алкильной группе в определении полигалогенC1-4алкила, атомы галогенов могут быть одинаковы или различны.
Каждый из моноциклических или бициклических гетероциклов в определении R1 может быть необязательно замещен 1 или, если это возможно, более заместителями, например, 2, 3, 4 или 5 заместителями. В частности, указанные гетероциклы могут быть необязательно замещены не более чем 4, не более чем 3, не более чем 2 заместителями, или 1 заместителем.
Каждый Ar1 или Ar2 может представлять незамещенный фенил или фенил, замещенный 1 или более заместителями, например, 5 или 4 заместителями, или, что предпочтительно, не более чем 3 заместителями, или не более чем 2 заместителями, или одним заместителем. Ar3 представляет фенил, нафталинил, 1,2,3,4-тетрагидронафталинил или инданил, причем каждый из них может необязательно быть замещен одним или более заместителями, например, 5 или 4 заместителями или, что предпочтительно, не более чем 3 заместителями, или не более чем двумя заместителями или одним заместителем.
Предпочтительно, чтобы гидроксиC1-6алкильная группа, когда она является заместителем у атома кислорода или атома азота, представляла гидроксиС2-6алкильную группу, в которой гидроксильная группа и атомы кислорода или азота были разделены, по меньшей мере, двумя атомами углерода.
R6 или R6а могут представлять С1-6алкил, замещенный одним или более заместителями, выбранными из NR7аR7b, гидрокси, С1-4алкокси, C1-4алкилтио, Ar2-окси-, Ar2-тио-, Ar2(CH2)nокси, Ar2(CH2)nтио, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, Ar2(CH2)nкарбонилокси, C1-4алкоксикарбонил(CH2)nокси, моно- и ди(С1-4алкил)аминокарбонилокси. В этом случае, С1-6алкил предпочтительно содержит, по меньшей мере, два атома углерода (т.е. представляет С2-6алкил) и указанные заместители не замещены у атома углерода, связанного с азотом в Q.
Термин «C1-4алкил» как группа или часть группы, используемый в описании, определяет неразветвленные или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, такие как метил, этил, пропил, 1-метилэтил, бутил и т.п.; C2-4алкил как группа, или часть группы определяет неразветвленные или разветвленные насыщенные углеводородные радикалы, содержащие от 2 до 4 атомов углерода, такие как этил, пропил, 1-метилэтил, бутил и т.п.; C1-6алкил как группа, или часть группы определяет неразветвленные или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 6 атомов углерода, такие как группы, определенные для C1-4алкила и пентила, гексил, 2-метилбутил и т.п.
Термин «C2-6алкенил» как группа или часть группы, используемый в описании, определяет неразветвленные или разветвленные насыщенные углеводородные радикалы, содержащие, по меньшей мере, одну двойную связь и предпочтительно содержащие одну двойную связь, и далее содержащие от 2 до 6 атомов углерода, например, этенил, пропенил, бутен-1-ил, бутен-2-ил, пентен-1-ил, пентен-2-ил, гексен-1-ил, гексен-2-ил, гексен-3-ил, 2-метилбутен-1-ил и т.п.
C3-7циклоалкил представляет циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
C2-5алкандиил представляет двухвалентные неразветвленные или разветвленные насыщенные углеводородные радикалы, содержащие от 2 до 5 атомов углерода, например, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил, 1,5-пентандиил и т.п.; C1-4алкандиил представляет двухвалентные неразветвленные или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил и т.п.; C1-6алкандиил включает C1-4алкандиил и его высшие гомологи, содержащие от 5 до 6 атомов углерода, такие как, например, 1,5-пентандиил, 1,6-гександиил и т.п.; C1-10алкандиил включает C1-6алкандиил и его высшие гомологи, содержащие от 7 до 10 атомов углерода, такие как, например, 1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10-декандиил и т.п.
Используемый в описании фрагмент (=O) образует карбонильный фрагмент, если присоединен к атому углерода, сульфоксидный фрагмент, если присоединен к атому серы, и сульфонильный фрагмент, если два из указанных фрагментов присоединены к атому серы. Группа (=N-OH) образует гидроксииминный фрагмент, если присоединен к атому углерода.
Термин «галоген» объединяет фтор, хлор, бром и йод.
Следует отметить, что положения радикалов на любом фрагменте молекул, использованные в указанных определениях, могут располагаться на таком фрагменте где угодно, если только он химически стабилен.
Радикалы, использованные в определениях переменных, включают все возможные изомеры, если нет других указаний. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3-пентил.
Если любая из переменных встречается более одного раза в любой составной части, каждая определяется независимо.
Термины “соединения формулы (I)” или “соединения настоящего изобретения” или аналогичный термин, используемый в описании, подразумевают, что они включают соединения общей формулы (I), их пролекарственные формы, N-оксиды, соли присоединения, четвертичные амины, комплексы металлов и стереохимически изомерные формы. Интересной подгруппой соединений формулы (I) или любой ее подгруппы являются N-оксиды, соли и все стереоизомерные формы соединений формулы (I).
Следует учесть, что некоторые из соединений формулы (I) могут содержать один или более из центров хиральности и существовать как стереохимически изомерные формы.
Термин "стереохимически изомерные формы", как указано в описании, определяет все возможные соединения, состоящие из тех же самых атомов, связанных в той же последовательности связями, но имеющие различные трехмерные структуры, которые не являются взаимозаменяемыми, которыми соединения формулы (I) могут обладать.
Если нет других указаний или упоминаний, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которыми может обладать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений настоящего изобретения как в чистом виде, так и в смеси друг с другом включены в объем настоящего изобретения.
Чистые стереоизомерные формы соединений и промежуточных соединений, как указано в описании, определены как изомеры, практически не содержащие других энантиомерных или диастереомерных форм той же самой основной молекулярной структуры указанного соединения или промежуточных соединений. В частности, термин ”стереоизомерно чистый” относится к соединениям или промежуточным соединениям, характеризующимся стереоизомерным избытком, по меньшей мере, 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) не более чем до стереоизомерного избытка 100% (т.е. 100% одного изомера и никаких других изомеров), более предпочтительно, к соединениям или промежуточным соединениям, характеризующимся стереоизомерным избытком от 90% не более чем до 100%, еще более предпочтительно со стереоизомерным избытком от 94% не более чем до 100% и наиболее предпочтительно со стереоизомерным избытком от 97% не более чем до 100%. Термины “энантиомерно чистый” и “диастереомерно чистый” следует понимать аналогичным образом, но при этом рассматривать энантиомерный избыток и диастереомерный избыток, соответственно.
Чистые стереоизомерные формы соединений и промежуточных соединений настоящего изобретения можно получить, используя известные специалистам процедуры. Например, энантиомеры можно отделить друг от друга, используя селективную кристаллизацию их диастереомерных солей с оптически активными кислотами или основаниями. Примерами служат винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфосульфоновая кислота. В другом варианте, энантиомеры можно разделить, используя хроматографические методики с хиральными стационарными фазами. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, при условии, что реакция протекает стереоспецифически. Предпочтительно, если нужно получить конкретный стереоизомер, синтезировать указанное соединение, используя стереоспецифический способ получения. Указанные способы выгодно использовать с энантиомерно чистыми исходными материалами.
Диастереомерные рацематы формулы (I) можно получить раздельно обычными способами. Выгодно использовать соответствующие физические способы разделения, такие как селективная кристаллизация и хроматография, например, колоночная хроматография.
Для некоторых соединений формулы (I), их пролекарственных форм, N-оксидов, солей, четвертичных аминов, или комплексов металлов и промежуточных соединений, использованных для их получения, экспериментально не определена их абсолютная стереохимическая конфигурация. Специалисты могут определить абсолютную конфигурацию таких соединений, используя известные специалистам методы, например, дифракцию рентгеновских лучей.
Настоящее изобретение включает также все изотопы атомов, входящих в состав рассматриваемых соединений. Изотопы включают такие атомы, у которых одинаковый атомный номер, но различные массовые числа. В качестве примера (но без ограничений) можно указать изотопы водорода, которые включают тритий и дейтерий.
Изотопы углерода включают 13C и 14C.
Для терапевтического использования пригодны соли соединений формулы (I), в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые представляют фармацевтически неприемлемые соли, также могут найти применение, например, при получении или очистке фармацевтически приемлемых соединений. Все соли, независимо от того, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения.
Подразумевают, что фармацевтически приемлемые соли присоединения кислот и оснований, как указано в описании, включают терапевтически активные нетоксичные формы солей присоединения кислот и оснований, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые соли присоединения кислот можно получить, обрабатывая основание соответствующей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородную или бромистоводородную кислоту, серную, азотную, фосфорную и т.п. кислоты; или органические кислоты, например, уксусную, пропановую, гидроксиуксусную, молочную, пировиноградную, щавелевую (т.е. этандикислоту), малоновую, янтарную (т.е. бутандикислоту), малеиновую, фумаровую, яблочную (т.е. гидроксибутандикислоту), винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфоновую, п-толуолсульфоновую, цикламовую, салициловую, п-аминосалициловую, памовую и т.п. кислоты.
И наоборот, указанные солевые формы можно превратить, обрабатывая соответствующим основанием, в форму свободного основания.
Соединения формулы (I), содержащие кислотные протоны, можно также превратить в формы их нетоксичных солей присоединения металлов или аминов, обрабатывая соответствующими органическими и неорганическими основаниями. Соответствующие формы солей оснований включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли органических оснований, например, соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли аминокислот, например, аргинина, лизина и т.п.
Термин «соли присоединения», используемый в описании, также включает сольваты, которые могут образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты, алкоголяты и т.п.
Термин "четвертичный амин", используемый в описании, определяет четвертичные соли аммония, которые могут образовывать соединения формулы (I), в результате реакции основного азота соединения формулы (I) и соответствующего кватернизующего агента, например, необязательно замещенного алкилгалогенида, арилгалогенида или арилалкилгалогенида, например, метилиодида или бензилиодида. Можно использовать и другие реагенты с легко отщепляемыми группами, например, алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. У четвертичного амина азот положительно заряжен. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат и ацетат. Выбранный противоион можно ввести, используя ионообменные смолы.
Подразумевается, что N-оксидные формы соединений настоящего изобретения включают соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида.
Следует учитывать, что соединения формулы (I) могут обладать свойствами связывания металлов, хелатирования, комплексообразования и поэтому могут существовать в виде комплексов с металлами или металлхелатов. Такие металлированные производные соединений формулы (I) должны быть включены в объем настоящего изобретения.
Некоторые из соединений формулы (I) могут существовать в своей таутомерной форме. Хотя такие формы подробно не указаны в вышеприведенных формулах, они также включены в объем настоящего изобретения.
Подразумевается, что любая указанная в описании подгруппа соединений формулы (I) включает также пролекарственные формы, N-оксиды, соли присоединения, четвертичные амины, комплексы металлов и стереохимически изомерные формы этих подгрупп соединений формулы (I).
Один из вариантов настоящего изобретения относится к соединениям формулы (I-a):
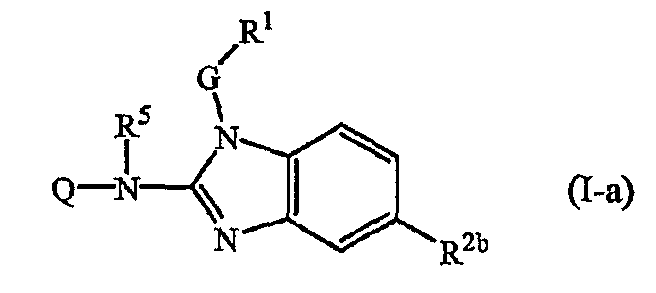
где Q, R5, G, R1 и R2b имеют значения, указанные выше в определениях формулы (I), или для любой из подгрупп, указанных в описании соединений.
Другой вариант настоящего изобретения относится к соединениям формулы (I-b):
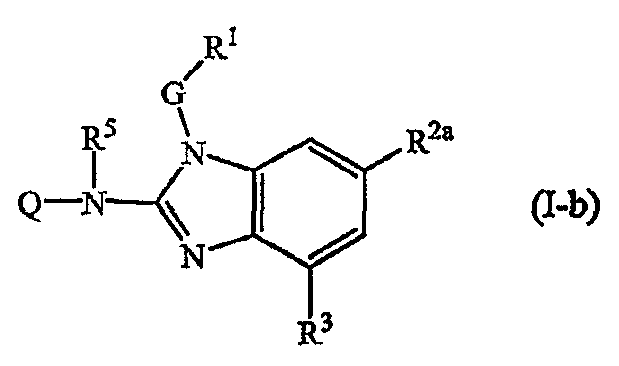
где Q, R5, G, R1, R2а и R3 имеют значения, указанные выше в определениях для соединений формулы (I), или значения, указанные для любых подгрупп, определенных в описании соединений.
Один из конкретных вариантов настоящего изобретения относится к соединениям формулы (I-a-1):
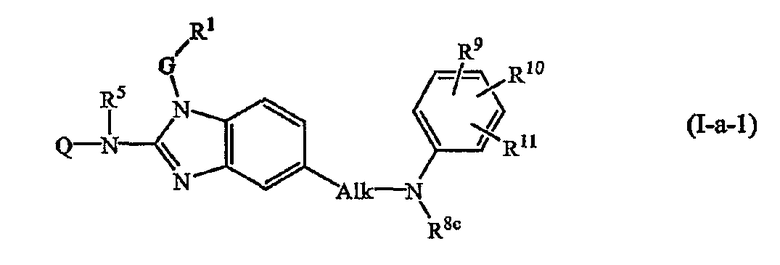
где Q, R5, G и R1 имеют значения, указанные выше в определениях для соединений формулы (I), или значения, указанные для любых подгрупп, определенных в описании соединений; и
Alk представляет С1-6алкандиил;
R8c имеет указанные для R8a значения и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют такие же значения, что определены для заместителей у Ar3, которые указаны в определениях для соединений формулы (I) или для любых подгрупп, определенных в описании соединений.
Другой конкретный вариант настоящего изобретения относится к соединениям формулы (I-b-1):
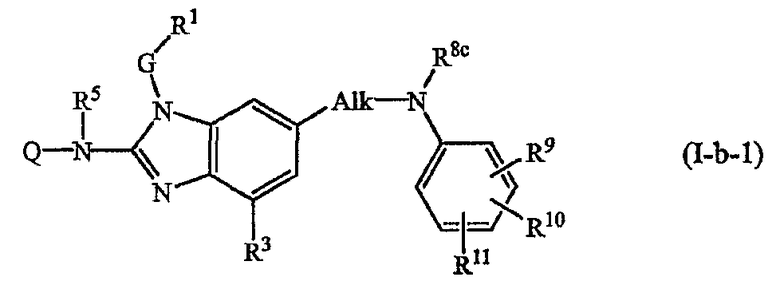
где Q, R5, G, R1 и R3 имеют значения, указанные выше в определениях для соединений формулы (I), или значения, указанные для любых подгрупп, определенных в описании соединений формулы (I); и
Alk представляет С1-6алкандиил;
R8c имеет указанные для R8a значения и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют такие же значения, что определены для заместителей у Ar3, которые указаны в определениях для соединений формулы (I) или для любых подгрупп, определенных в описании соединений.
Другой вариант настоящего изобретения относится к соединениям формулы (I-c):
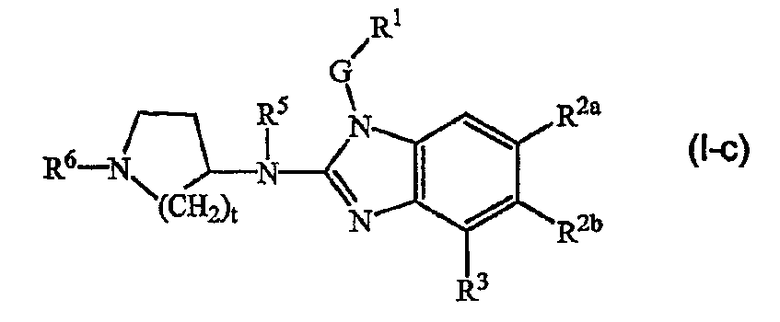
где t, G, R1, R2a, R2b, R3, R5 и R6 имеют значения, указанные выше в определениях для соединений формулы (I), или значения, указанные для любых подгрупп, определенных в описании соединений.
Другой вариант настоящего изобретения относится к соединениям формулы (I-d):
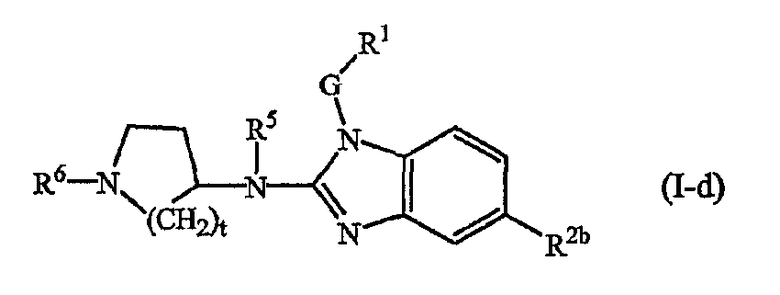
где t, R5, R6, G, R1 и R2b имеют указанные выше значения или значения, указанные для любых подгрупп, определенных в описании соединений.
Другой вариант настоящего изобретения относится к соединениям формулы (I-e):
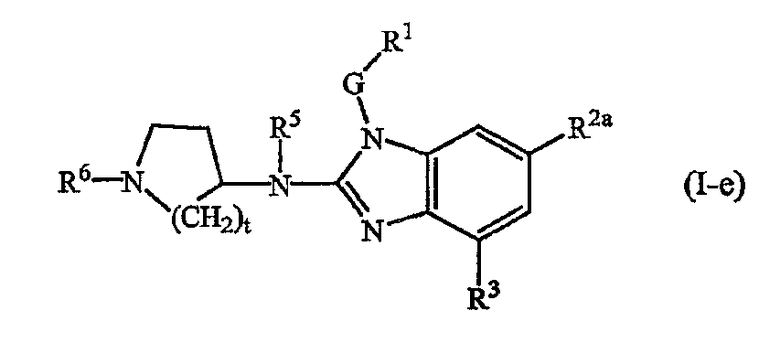
где t, R5, R6, G, R1, R2а и R3 имеют указанные выше значения или значения, указанные для любых подгрупп, определенных в описании соединений.
Другие варианты включают соединения формул (I-c), (I-d) или (I-e), где t представляет 2, т.е. соединения формул
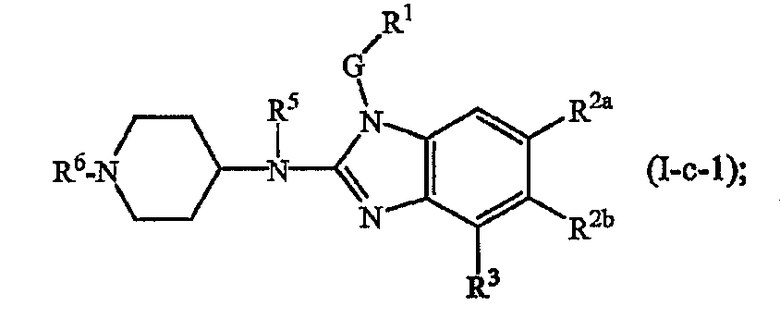
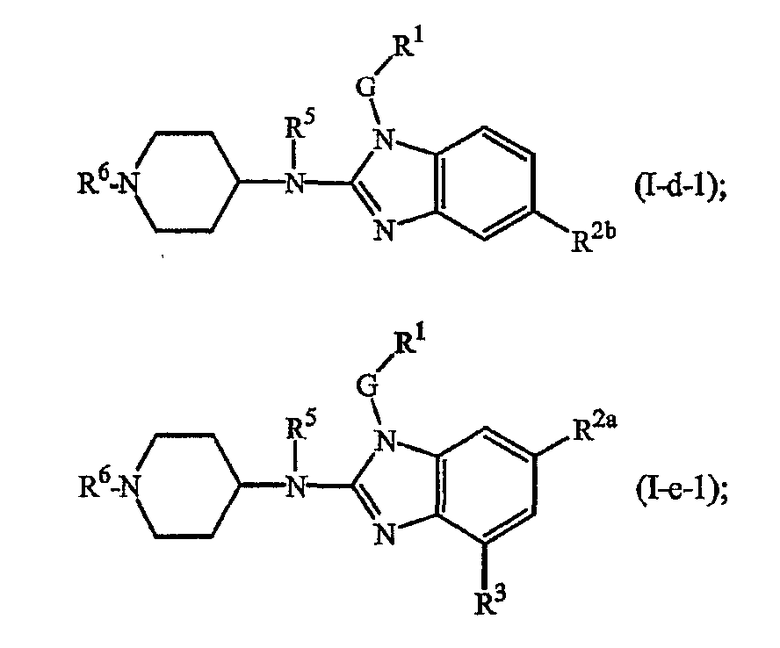
где Q, t, R5, G, R1, R2а, R2b, R3 имеют указанные выше значения или значения, указанные для любых подгрупп, определенных в описании соединений.
Другой вариант настоящего изобретения относится к соединениям формулы (I-d-2):
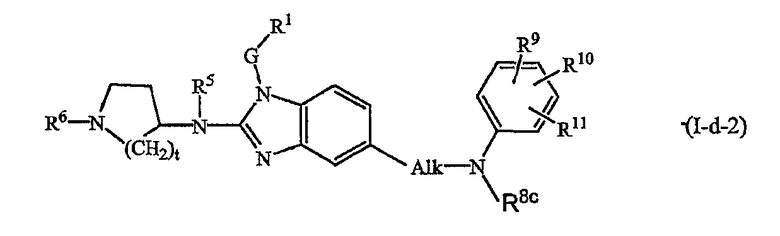
где R5, R6, G и R1 имеют указанные выше значения или значения, указанные для любых подгрупп, определенных в описании соединений; и
t представляет 1, 2 или 3; предпочтительно t представляет 2;
Alk представляет С1-6алкандиил;
R8c имеет указанные для R8a значения и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют такие же значения, что определены для заместителей у Ar3, которые указаны в определениях для соединений формулы (I) или для любых подгрупп, определенных в описании соединений.
Другой вариант настоящего изобретения относится к соединениям формулы (I-e):
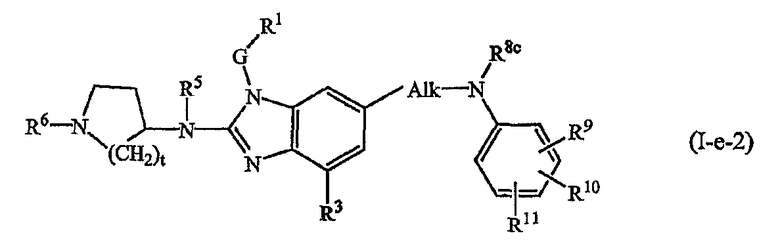
где R5, R6, G, R1 и R3 имеют указанные выше значения, или значения, указанные для любых подгрупп, определенных в описании соединений; и
t представляет 1, 2 или 3; предпочтительно t представляет 2;
R8c имеет указанные для R8a значения и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют такие же значения, что определены для заместителей у Ar3, которые указаны в определениях для соединений формулы (I) или для любых подгрупп, определенных в описании соединений.
Другими предпочтительными подгруппами являются те, в которых Alk представляет этилен или метилен, более предпочтительно в которых Alk представляет метилен.
В (I-a-1), (I-b-1), (I-d-2) или (I-e-2) R8c предпочтительно представляет водород, гидроксиС1-6алкил, аминокарбонилС1-6алкил.
В (I-a-1), (I-b-1), (I-d-2) или (I-e-2):
(a) R9, R10, R11 предпочтительно и независимо друг от друга представляют водород, галоген, гидрокси, меркапто, амино, циано, С1-6алкил, C2-6алкенил, C2-6алкинил, Ar1, гидроксиС1-6алкил, CF3, аминоС1-6алкил, цианоС1-6алкил, аминокарбонил, С1-6алкилокси, С1-6алкилтио, Ar1-окси, Ar1-тио, Ar1-амино, аминосульфонил, аминокарбонилС1-6алкил, гидроксикарбонилС1-6алкил, гидроксикарбонил, C1-4алкилкарбонил, С1-4алкилкарбониламино или С1-4алкоксикарбонил; или
(b) R9, R10, R11 более предпочтительно и независимо друг от друга представляют водород, галоген, гидрокси, меркапто, циано, С1-6алкил, C2-6алкенил, C2-6алкинил, Ar1, гидроксиС1-6алкил, CF3, аминоС1-6алкил, цианоС1-6алкил, аминокарбонил, С1-6алкилокси, С1-6алкилтио, Ar1-окси, Ar1-тио, Ar1-амино, аминосульфонил, аминокарбонилС1-6алкил, гидроксикарбонилС1-6алкил, С1-4алкилкарбонил, С1-4алкилкарбониламино или C1-4алкоксикарбонил; или
(c) R9, R10, R11 более предпочтительно и независимо друг от друга представляют галоген, С1-6алкил или гидроксиС1-6алкил; или
(d) R9, R10 более предпочтительно представляют указанные в (a), (b) или (c) значения, и R11 представляет водород; или
(e) R9, R10 более предпочтительно и независимо друг от друга представляют С1-6алкил или гидроксиС1-6алкил; и R11 представляет водород; или
(f) R9, R10 еще более предпочтительно представляют С1-6алкил и R11 представляет водород; или
(g) R9 представляет С1-6алкил, R10 представляет гидроксиС1-6алкил и R11 представляет водород.
Следует понимать, что подразумевают, что определенные выше подгруппы соединений формул (I-a), (I-b), и т.д., также как и любые другие определенные в описании подгруппы, включают также любые пролекарственные формы, N-оксиды, соли присоединения, четвертичные амины, комплексы металлов и стереохимически изомерные формы таких соединений.
Конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I), или любые подгруппы определенных в описании соединений формулы (I), в которых G представляет C1-10алкандиил, особенно, где G представляет метилен.
Другими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где
(a) R1 отличается от Ar1; или где
(b) R1 представляет Ar1 или моноциклический гетероцикл, который указан в определениях для соединений формулы (I) или в любой из их подгрупп.
Другими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или соединения любой из определенных в описании подгрупп соединений формулы (I), где
(c) R1 представляет пиридил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, гидрокси, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилтио, С1-6алкилоксиС1-6алкила, Ar1, Ar1С1-6алкила, Ar1С1-6алкилокси, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалогенС1-6алкила, С1-6алкилкарбониламино, С1-6алкил-SO2-NR4a-, Ar1-SO2-NR4a-, С1-6алкилоксикарбонила, -C(=O)-NR4aR4b, HO(-CH2-CH2-O)n-, галоген(-CH2-CH2-O)n-, С1-6алкилокси(-CH2-CH2-O)n-, Ar1С1-6алкилокси(-CH2-CH2-O)n- и моно- или ди(С1-6алкил)амино(-CH2-CH2-O)n-; или особенно
(d) R1 представляет пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, С1-6алкила, галогена, С1-6алкилокси, Ar1С1-6алкилокси и (С1-6алкилокси)С1-6алкилокси; предпочтительно, где
(e) R1 представляет пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, С1-6алкила, галогена и С1-6алкилокси; или где
(f) R1 представляет пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси и С1-6алкила; более предпочтительно, где
(g) R1 представляет пиридил, замещенный гидрокси и С1-6алкилом; или более предпочтительно, где
(h) R1 представляет пиридил, замещенный гидрокси и метилом; или где
(i) R1 представляет 3-гидрокси-6-метилпирид-2-ил.
Дальнейшие варианты включают такие соединения формулы (I) или любые подгруппы соединений формулы (I), где
(j) R1 представляет Ar1, хинолинил, бензимидазолил, радикал формулы
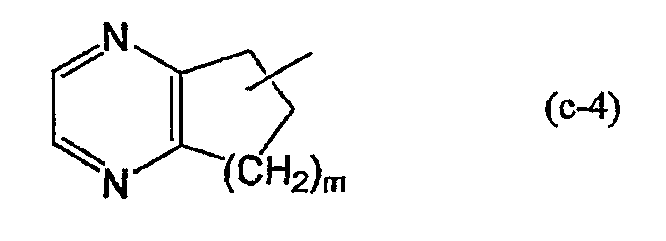
пиразинил, или пиридил; или где
(k) R1 представляет Ar1, хинолинил, бензимидазолил или радикал формулы (c-4), где m представляет 2, пиразинил или пиридил;
где каждый из радикалов в (j) и (k) может быть необязательно замещен заместителями, указанными в определениях для соединений формулы (I), и, в частности, пиридил может быть замещен, как указано выше в (a)-(i); или более конкретно, где
(l) R1 представляет Ar1, хинолинил, бензимидазолил или радикал формулы (c-4), где m представляет 2, пиразинил или пиридил, где каждый из этих радикалов может быть необязательно замещен одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидрокси, С1-6алкила, С1-6алкилокси, Ar1С1-6алкилокси, (С1-6алкилокси)С1-6алкилокси; или, более конкретно, где
(m) R1 представляет Ar1, хинолинил, бензимидазолил или радикал формулы (c-4), где m представляет 2, пиразинил или пиридил, где каждый из этих радикалов может быть необязательно замещен одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидрокси, С1-6алкила, С1-6алкилокси, бензилокси; или более конкретно, где
(n) R1 представляет фенил, необязательно замещенный одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидрокси, С1-6алкила, С1-6алкилокси; хинолинил; радикал (c-4), где m представляет 2, необязательно замещенный не более чем двумя радикалами, выбранными из С1-6алкила; бензимидазолил, необязательно замещенный С1-6алкилом; пиридил, необязательно замещенный одним или двумя радикалами, выбранными из гидрокси, галогена, С1-6алкила, бензилокси и С1-6алкилокси; пиразинил, необязательно замещенный не более чем тремя радикалами, выбранными из С1-6алкила; или пиридил, замещенный или необязательно замещенный, как указано в (a)-(i); или где
(o) R1 представляет фенил, необязательно замещенный одним или двумя радикалами, выбранными из группы, состоящей из галогена, гидрокси, С1-6алкила, С1-6алкилокси;
(p) R1 представляет хинолинил;
(q) R1 представляет радикал (c-4), где m представляет 2, необязательно замещенный не более чем двумя радикалами, выбранными из С1-6алкила;
(r) R1 представляет бензимидазолил, необязательно замещенный C1-6алкилом; пиридил, необязательно замещенный одним или двумя радикалами, выбранными из гидрокси, галогена, бензйлокси и C1-6алкилокси,
(s) R1 представляет пиразинил, необязательно замещенный не более чем тремя радикалами, выбранными из C1-6алкила.
Предпочтительными подгруппами соединений формулы (I), или любой из подгрупп соединений формулы (I), являются те, в которых G представляет простую связь или метилен и R1 имеет указанные в (a)-(s) значения. Далее предпочтительными являются соединения формулы (I) или любые из определенных в описании подгрупп, где G представляет простую связь и R1 представляет радикал (с-4), в частности, где m представляет 2, необязательно замещенный не более чем двумя радикалами, выбранными из C1-6алкила. Далее, предпочтительными являются соединения формулы (I), или любые из определенных в описании подгрупп, где или G представляет метилен и R1 имеет указанные в (a)-(s) значения, но отличается от радикала (с-4).
Конкретный вариант настоящего изобретения относится к соединениям формулы (I) или любым из определенных в описании подгрупп соединений формулы (I), где
(а) один из R2a и R2b выбирают из цианоС1-6алкила, цианоС1-6алкенила, Аr3C1-6алкила, (Аr3)(ОН)C1-6алкила, Het-C1-6алкила, N(R8aR8b) C1-6алкила, Аr3C2-6алкенила, Het-С2-6алкенила, Аr3аминоС1-6алкила, Het-аминоС1-6алкила, Het-С1-6алкиламиноС1-6алкила, Аr3тиоС1-6алкила, Het-тиоС1-6алкила, Ar3сульфонилС1-6алкила, Het-сульфонилС1-6алкила, Аr3аминокарбонила, Het-аминокарбонила, Аr3(CH2)nаминокарбонила, Het-(CH2)nаминокарбонила, Аr3карбониламино, Ar3(СН2)nамино; и другой из R2a и R2b представляет водород; или
(b) один из R2a и R2b выбирают из цианоС1-6алкила, цианоС2-6алкенила, Аr3C1-6алкила, (Ar3)(ОН)C1-6алкила, Het-C1-6алкила, N(R8aR8b)C1-6алкила, Аr3C2-6алкенила, Ar3aминoC1-6aлкилa, Het-аминоС1-6алкила, Het-С1-6алкиламиноС1-6алкила, Ar3тиoC1-6aлкилa, Аr3минокарбонила, Het-аминокарбонила, Ar3(CH2)nаминокарбонила, Het-(СН2)nаминокарбонила, Ar3карбониламино, Ar3(СН2)nамино; и другой из R2a и R2b представляет водород; или
(c) один из R2a и R2b выбирают из цианоС1-6алкила, Ar3С1-6алкила, Het-C1-6алкила, N(R8aR8b)C1-6алкила, Ar3C2-6aлкeнилa, Ar3aминoC1-6aлкилa, Het-аминоС1-6алкила, Het-С1-6алкиламиноС1-6алкила, Ar3тиоС1-6алкила, Ar3минокарбонила, Het-аминокарбонила, Ar3(CH2)nаминокарбонила,
Het-(CH2)nаминокарбонила; и другой из R2a и R2b представляет водород; или
(d) один из R2a и R2b выбирают из цианоС1-6алкила, Ar3C1-6aлкилa, Het-C1-6алкила, N(R8aR8b)C1-6алкила, Ar3С2-6алкенила, Ar3аминоС1-6алкила, Het-аминоС1-6алкила, Ar3аминокарбонила; и другой из R2a и R2b представляет водород; или
(e) один из R2a и R2b выбирают из Ar3C1-6алкила, N(R8aR8b)C1-6aлкeнилa, Ar3аминоС1-6алкила; и другой из R2a и R2b представляет водород; или
(f) один из R2a и R2b выбирают из N(R8aR8b)C1-6алкила, Ar3aминoC1-6aлкилa; и другой из R2a и R2b представляет водород; и для любого из (a)-(f)
в том случае, если R2a представляет водород, тогда R3 представляет водород;
в том случае, если R2b представляет водород, тогда R3 представляет водород или С1-6алкил; или предпочтительно тогда R3 представляет водород.
Другими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где R5 представляет водород.
Другими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где Q представляет Ar2.
Другими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где Q представляет R6a.
Другими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где Q представляет пирролидинил, замещенный R6, пиперидинил, замещенный R6, или гомопиперидинил, замещенный R6; в частности, где Q представляет пиперидинил, замещенный R6. Предпочтительно, чтобы группа R6 была замещена у атома азота указанного пирролидинила, пиперидинила или гомопиперидинила. Более предпочтительно, чтобы указанный пирролидинил, пиперидинил или гомопиперидинил был связан с -N(R5)-фрагментом через 3-ильную связь, или, в частности, через 4-ильную связь.
Интересными подгруппами соединений являются такие соединения формулы (I) или любые определенные в описании подгруппы, где Q представляет R6a, где
(a) R6a представляет С1-6алкил, замещенный двумя заместителями или, предпочтительно, одним заместителем, каждый из которых независимо выбран из группы, состоящей из трифторметила, NR7аR7b, Ar2, гидрокси, С1-6алкокси, Ar2(CH2)nокси, гидроксикарбонила, аминокарбонила, C1-4алкилкарбонила, C1-4алкоксикарбонила, Ar2(CH2)nкарбонила, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила или гетероцикла, выбранного из группы, состоящей из пирролидинила, имидазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила и пиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила; или в частности, где
(b) R6a представляет С1-6алкил, замещенный одним и, необязательно, другим заместителем, который представляет гидрокси, где указанным заместителем является трифторметил, NR7аR7b, Ar2, гидрокси, C1-4алкокси, Ar2(CH2)nокси, гидроксикарбонил, аминокарбонил, С1-4алкилкарбонил, C1-4алкоксикарбонил, Ar2(CH2)nкарбонил, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, моно- или ди(С1-4алкил)аминокарбонил, аминосульфонил, моно- или ди(С1-4алкил)аминосульфонил или гетероцикл, выбранный из группы, состоящей из пирролидинила, имидазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила и пиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила; или далее, в частности,
(c) R6a представляет С1-6алкил, замещенный NR7аR7b, Ar2, гидрокси, C1-4алкокси, гидрокси-карбонилом, аминокарбонилом, аминосульфонилC1-4алкилкарбонилом, Ar2карбонилом, C1-4алкоксикарбонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранными из диоксоланила, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен оксо или одним или двумя С1-6алкильными радикалами; или далее, в частности,
(d) R6a представляет С1-6алкил, замещенный NR7аR7b, Ar2, гидрокси, гидроксикарбонилом, аминокарбонилом, аминосульфонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранными из диоксоланила, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен оксо или одним или двумя С1-6алкильными радикалами; или далее, в частности,
(e) R6a представляет С1-6алкил, замещенный Ar2 или гидрокси, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранным из диоксоланила, пирролидинила, пиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя С1-6алкильными радикалами; или предпочтительно
(f) R6a представляет С1-6алкил, замещенный Ar2 или гидрокси, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный диС1-6алкилдиоксоланилом, пирролидинилом, пиперидинилом, пиперазинилом, 4-С1-6алкилпиперазинилом; или предпочтительно
(g) R6a представляет С1-6алкил, замещенный Ar2 или гидрокси, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный пиперидинилом или пиперазинилом; или более предпочтительно
(h) R6a представляет С1-6алкил, замещенный Ar2, или С1-6алкил, замещенный пиперидинилом или пиперазинилом.
Предпочтительно, чтобы в (a)-(h) в предыдущем разделе радикалы пирролидинил, пиперидинил, гомопиперидинил или пиперазинил были связаны своим атомом азота с С1-6алкилом, у которого они являются заместителями.
Другими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I), или любые определенные в описании подгруппы соединений формулы (I), где Q представляет пирролидинил, замещенный R6, пиперидинил, замещенный R6 или гомопиперидинил, замещенный R6; где
(a) R6 представляет водород или С1-6алкил, необязательно замещенный двумя заместителями или, предпочтительно, одним заместителем, каждый из которых независимо выбран из группы, состоящей из трифторметила, NR7аR7b, Ar2, гидрокси, C1-6алкокси, Ar2(CH2)nокси, гидроксикарбонила, аминокарбонила, С1-6алкилкарбонила, С1-6алкоксикарбонила, Ar2(CH2)nкарбонила, аминокарбонилокси, С1-4алкилкарбонилокси, Ar2карбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила или гетероцикла, выбранного из группы, состоящей из пирролидинила, имидазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила и пиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила; или, в частности,
(b) R6 представляет водород или С1-6алкил, необязательно замещенный одним заместителем и необязательно с другим заместителем, который представляет гидрокси, где указанным заместителем является трифторметил, NR7аR7b, Ar2, гидрокси, C1-4алкокси, Ar2(CH2)nокси, гидрокси-карбонил, аминокарбонил, С1-4алкилкарбонил, C1-4алкоксикарбонил, Ar2(CH2)nкарбонил, аминокарбонилокси, С1-4алкилкарбонилокси, Ar2карбонилокси, моно- или ди(C1-4алкил)аминокарбонил, аминосульфонил, моно- или ди(С1-4алкил)аминосульфонил или гетероцикл, выбранный из группы, состоящей из пирролидинила, имидазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила и пиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила; или далее, в частности,
(c) R6 представляет водород или С1-6алкил, необязательно замещенный NR7аR7b, Ar2, гидрокси, C1-4алкокси, гидроксикарбонилом, аминокарбонилом, аминосульфонилом, C1-4алкоксикарбонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранными из диоксоланила, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен оксо или одним или двумя С1-6алкильными радикалами; или далее, в частности,
(d) R6 представляет водород или С1-6алкил, необязательно замещенный NR7аR7b, Ar2, гидрокси, гидроксикарбонилом, аминокарбонилом, аминосульфонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранным из диоксоланила, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен оксо или одним или двумя С1-6алкильными радикалами; или далее, в частности, где
(e) R6 представляет водород или С1-6алкил, необязательно замещенный Ar2, гидрокси, аминокарбонилом или аминосульфонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранным из диоксоланила, пирролидинила, пиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя С1-6алкильными радикалами; или предпочтительно
(f) R6 представляет водород или С1-6алкил, необязательно замещенный Ar2, гидрокси, амино-карбонилом, аминосульфонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный пирролидинилом, пиперидинилом, пиперазинилом, 4-С1-6алкилпиперазинилом; или предпочтительно
(g) R6 представляет водород или С1-6алкил, необязательно замещенный Ar2, гидрокси, аминокарбонилом или аминосульфонилом; или предпочтительно
(h) R6 представляет водород или С1-6алкил, замещенный Ar2 или С1-6алкил, замещенный пиперидинилом или пиперазинилом; или
(i) R6 представляет С1-6алкил.
Предпочтительно, чтобы в (a)-(h) в предыдущем разделе радикалы пирролидинил, пиперидинил, гомопиперидинил или пиперазинил были связаны своим атомом азота с С1-6алкилом, у которого они являются заместителями.
Следующими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где R7a и R7b представляют водород или С1-6алкил, или, предпочтительно, где R7a и R7b представляют водород.
Следующими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где
(a) R8a представляет Ar3, С1-6алкил, гидроксиС1-6алкил, C1-6алкоксиС1-6алкил, цианоС1-6алкил, аминоС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, Ar3С1-6алкил, Het-С1-6алкил, аминокарбонилС1-6алкил, карбоксилС1-6алкил; и R8b представляет Ar3; или
(b) R8a представляет Ar3, С1-6алкил, гидроксиС1-6алкил, Ar3С1-6алкил, Het-С1-6алкил, аминокарбонилС1-6алкил; и R8b представляет Ar3; или
(c) R8a представляет гидроксиС1-6алкил, аминокарбонилС1-6алкил; и R8b представляет Ar3; или
(d) R8a представляет Ar3 и R8b представляет Ar3; или
(e) R8a представляет С1-6алкил, гидроксиС1-6алкил, Ar3С1-6алкил, Het-С1-6алкил, аминокарбонилС1-6алкил; и R8b представляет С1-6алкил, гидроксиС1-6алкил, Ar3С1-6алкил, Het-С1-6алкил.
В частности, Ar1 представляет фенил или фенил, замещенный 1, 2, 3 заместителями или 1, 2 заместителями, выбранными из тех, которые указаны в определении для соединений формулы (I) или любой из их подгрупп.
В группе соединений формулы (I) или в любой из подгрупп соединений формулы (I):
(a) Ar1 предпочтительно представляет фенил или фенил, замещенный не более чем 3 заместителями, или не более чем 2 заместителями, или одним заместителем, выбранными из галогена, гидрокси, С1-6алкила, гидроксиС1-6алкила, трифторметила и С1-6алкилокси;
(b) Ar1 более предпочтительно представляет фенил или фенил, замещенный не более чем 3 заместителями, или не более чем 2 заместителями, или одним заместителем, выбранными из галогена, гидрокси, С1-6алкила и С1-6алкилокси;
(c) Ar1 более предпочтительно представляет фенил или фенил, замещенный не более чем 3 заместителями, или не более чем 2 заместителями, или одним заместителем, выбранными из галогена и С1-6алкила.
В частности, Ar2 представляет фенил или фенил, замещенный 1, 2, 3 заместителями или 1, 2 заместителями, выбранными из группы, состоящей из тех, которые указаны в определении для соединений формулы (I) или любой из их подгрупп.
Следующими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I), или любые определенные в описании подгруппы соединений формулы (I), где Ar2 имеет указанные для Ar1 значения.
Следующими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I) или любые определенные в описании подгруппы соединений формулы (I), где Ar3 представляет фенил, нафталинил, 1,2,3,4-тетрагидронафталинил или инданил, или, предпочтительно, где Ar3 представляет фенил, нафталинил или инданил; где указанный фенил может необязательно, и каждый индивидуально, быть замещен одним или более, например, 2, 3 или 4 заместителями, выбранными из группы, состоящей из заместителей у Ar3 в определениях соединений (I).
Следующими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I), или любые определенные в описании подгруппы соединений формулы (I), где
(a) Ar3 представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, выбранными из галогена, гидрокси, меркапто, амино, циано, С1-6алкила, C2-6алкенила, C2-6алкинила, Ar1, гидроксиС1-6алкила, CF3, аминоС1-6алкила, цианоС1-6алкила, аминокарбонила, С1-6алкилокси, С1-6алкилтио, Ar1-окси, Ar1-тио, Ar1-амино, аминосульфонила, аминокарбонилС1-6алкила, гидроксикарбонилС1-6алкила, гидроксикарбонила, С1-4алкилкарбонила, С1-4алкилкарбониламино или C1-4алкоксикарбонила; или где
(b) Ar3 представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, выбранными из галогена, гидрокси, меркапто, циано, С1-6алкила, C2-6алкенила, C2-6алкинила, Ar1, гидроксиС1-6алкила, CF3, аминоС1-6алкила, цианоС1-6алкила, аминокарбонила, С1-6алкилокси, С1-6алкилтио, Ar1-окси, Ar1-тио, Ar1-амино, аминосульфонила, аминокарбонилС1-6алкила, гидроксикарбонилС1-6алкила, С1-4алкилкарбонила, C1-4алкилкарбониламино или C1-4алкоксикарбонила; или где
(c) Ar3 представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, выбранными из галогена, С1-6алкила или гидроксиС1-6алкила; или
(d) Ar3 представляет фенил, замещенный одним, двумя или тремя заместителями, выбранными из галогена, С1-6алкила или гидроксиС1-6алкила; или
(e) Ar3 представляет фенил, необязательно замещенный одним, двумя или тремя заместителями, выбранными из галогена, С1-6алкила или гидроксиС1-6алкила; или
(f) Ar3 представляет фенил, замещенный одним, двумя или тремя заместителями, выбранными из галогена, С1-6алкила или гидроксиС1-6алкила; или
(g) Ar3 представляет фенил, замещенный одним или двумя заместителями, выбранными из галогена, С1-6алкила или гидроксиС1-6алкила; или
(h) Ar3 представляет фенил, необязательно замещенный одним или двумя заместителями, выбранными из С1-6алкила или гидроксиС1-6алкила.
В частности, Ar3 имеет указанные для Ar2 значения, более предпочтительно Ar3 имеет указанные для Ar1 значения.
Следующими конкретными подгруппами соединений формулы (I) являются такие соединения формулы (I), или любые определенные в описании подгруппы соединений формулы (I), где
(a) Het представляет тетрагидрофуранил, фуранил, тиенил, тиазолил, оксазолил, имидазолил, изотиазолил, пиразолил, изоксазолил, пиперидинил, гомопиперидинил, пиперазинил, морфолинил, пиридил, пиразинил, пиримидинил, тетрагидрохинолинил, хинолинил, изохинолинил, бензодиоксанил, бензодиоксолил, индолинил, индолил, которые могут необязательно быть замещены оксо, амино, Ar1, C1-4алкилом, аминоC1-4алкилом, гидроксиС1-6алкилом, Ar1С1-4алкилом, моно- или ди(С1-6алкил)аминоС1-6алкилом, моно- или ди(С1-6алкил)амино, (гидроксиС1-6алкил)амино, и, необязательно, далее одним или двумя С1-4алкильными радикалами; или
(b) Het представляет тетрагидрофуранил, фуранил, тиенил, тиазолил, оксазолил, имидазолил, пиразолил, изоксазолил, пиперидинил, гомопиперидинил, пиперазинил, морфолинил, пиридил, пиразинил, пиримидинил, тетрагидрохинолинил, хинолинил, изохинолинил, бензодиоксанил, бензодиоксолил, индолинил, индолил, которые могут быть необязательно замещены оксо, амино, Ar1, С1-4алкилом, аминоС1-4алкилом, гидроксиС1-6алкилом, и, необязательно, далее, одним или двумя С1-4алкильными радикалами; или
(c) Het представляет фуранил, тиенил, имидазолил, пиразолил, изоксазолил, морфолинил, пиримидинил, бензодиоксолил, хинолинил, индолинил, которые могут быть необязательно замещены гидроксиС1-6алкилом или одним или двумя С1-4алкильными радикалами; или
(d) Het представляет фуранил, тиенил, имидазолил, пиразолил, изоксазолил, морфолинил, пиримидинил, бензодиоксолил, хинолинил, индолинил, которые могут быть необязательно замещены гидроксиС1-6алкилом или одним или двумя С1-4алкильными радикалами; или
(e) Het представляет фуранил, имидазолил, морфолинил, бензодиоксолил, хинолинил, индолинил, которые могут быть необязательно замещены гидроксиС1-6алкилом или одним или двумя С1-4алкильными радикалами; или
(f) Het представляет морфолинил, который может быть необязательно замещен одним или двумя С1-4алкильными радикалами; или
(д) Het представляет морфолинил.
Предпочтительными соединениями являются соединения, перечисленные в таблицах 1-5, особенно соединения под номерами 1-77, 138, 143-165 и 171-177.
Соединения формулы (I) или любые их подгруппы можно получить в соответствии со следующими схемами реакций
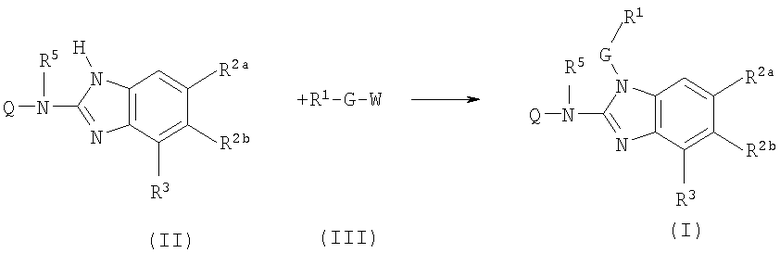
На этих схемах Q, G, R1, R2a, R2b, R3 и R5 имеют значения, определенные выше для соединений формулы (I) или для любых их подгрупп. W представляет соответствующую отщепляемую группу, предпочтительно хлор или бром. Реакцию, представленную на этой схеме, обычно ведут в подходящем растворителе, например, в эфире, например, в ТГФ, в галогенированном углеводороде, например, в дихлорметане, СНСl3, толуоле, в полярном апротонном растворителе, таком как ДМФ, ДМСО, DMA и т.п.
Соединения формулы (I), где Q представляет пирролинильную, пиперидинильную или гомопиперидинильную группу, замещенную R6, который отличается от водорода, т.е. R6а, которые представлены формулой (I-c-1), можно получить в соответствии со следующей схемой реакции.
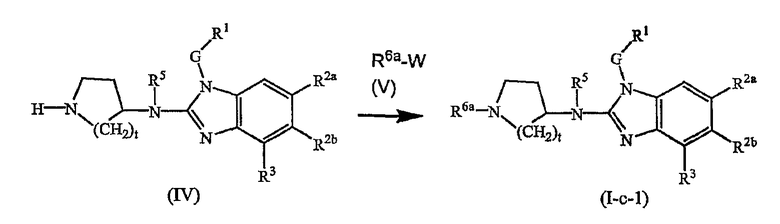
На этой схеме G, t, R1, R2a, R2b, R3, R5 имеют значения, определенные выше для соединений формулы (I) или для любых их подгрупп. W представляет соответствующую отщепляемую группу, предпочтительно хлор или бром. Реакцию, представленную на этой схеме, можно вести в подходящем растворителе, например, в эфире, например, в ТГФ, в галогенированном углеводороде, например, в дихлорметане, CHCl3, толуоле, в полярном апротонном растворителе, таком как ДМФ, ДМСО, DMA и т.п. Можно добавить основание, чтобы связать кислоту, которая выделяется в ходе реакции. При желании можно добавить определенные катализаторы, например, соли йода (например, KI). Промежуточные соединения (IV) можно также превратить в соединения (I-c-1), используя реакцию восстановительного N-алкилирования, исходя из альдегида или кетона R6b=O(V-a), где R6b имеет те же значения, что R6а, при условии, что у него меньше на один водород. Такую реакцию восстановительного алкилирования осуществляют в подходящем растворителе, например, в спирте, используя водород, в присутствии металлического катализатора, например, Pd или NaBН3CN.
Некоторые из соединений формулы (I) можно также получить, исходя из предшественников соединений формулы (I), используя реакции превращения соответствующих функциональных групп.
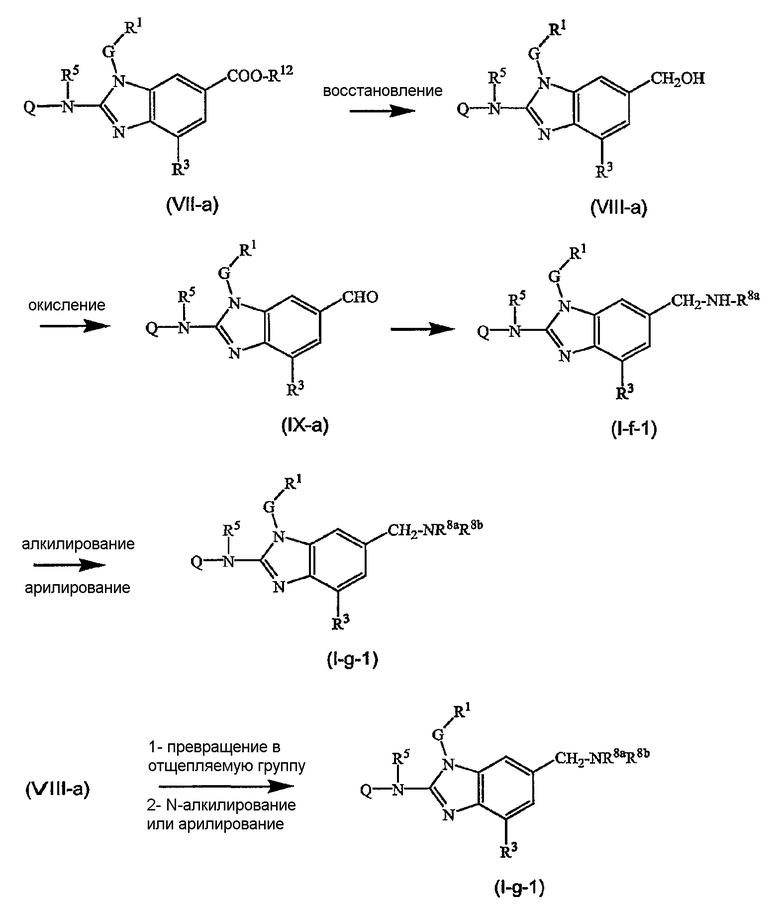
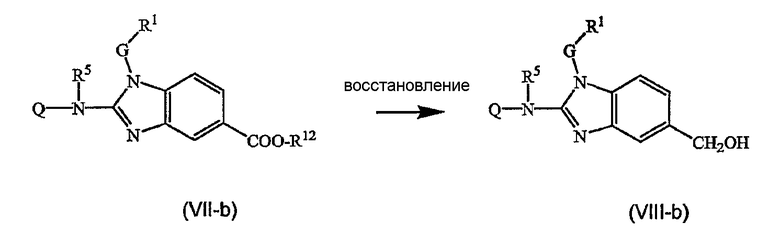
Предшественниками соединений формулы (I), например, являются те, где R2a или R2b представляют C1-6алкоксикарбонил или С1-6алкил, замещенный C1-6алкоксикарбонилом, который можно восстановить, например, используя LiAlН4, до соответствующего соединения формулы (I), где R2a или R2b представляют гидроксиС1-6алкил. Последнюю группу можно окислить, используя мягкий окислитель, до альдегидной группы, например, используя MnО2, от которой впоследствии можно получить производные, используя амины, например, в процессе восстановительного аминирования, до соответствующих моно(производное С1-6алкила)аминов. Последние можно алкилировать или арилировать до алкиламинов, где R2а или R2b соответствуют формуле -Alk-NR8аR8b. Альтернативно предшественники соединений формулы (I), где R2а или R2b представляют гидроксиС1-6алкил, можно превратить в соответствующие галогенС1-6алкильные соединения, например, обрабатывая подходящим галогенирующим агентом, таким как SOCl2, причем полученные соединения затем подвергают взаимодействию с амином или производным амина. Эта последовательность реакций проиллюстрирована следующими схемами, в которых R12 представляет С1-6алкильный радикал, предпочтительно метил или этил. Такую последовательность реакций можно осуществить, исходя из (VII-a) или (VII-b) отдельно, но можно также осуществить, используя смесь (VII-a) и (VII-b), и затем разделить продукты реакции или в конце последовательности реакций, или на промежуточной стадии.
Или исходя из (VII-b)
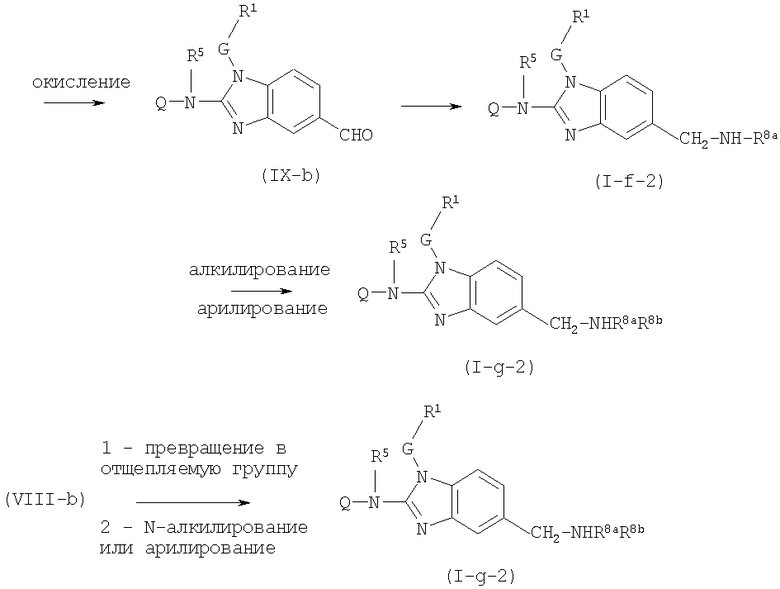
Предшественники соединений формулы (I), где R2a или R2b представляют альдегид, можно превратить в соответствующие соединения, где R2a или R2b представляют замещенный С2-6алкенил (I-g-1) или (I-g-2), используя реакцию Виттига или реакцию Виттига-Хорнера. В первом случае используют реагент типа реагента Виттига, такой как трифенилфосфонийилид в подходящем реакционно инертном растворителе, таком как эфир, исходя из трифенилфосфина и производного галогена. Реакцию Виттига-Хорнера осуществляют, используя фосфонат, например, реагент формулы ди(C1-6алкилокси)-Р(=O)-CH2-CH2-CN в присутствии основания, предпочтительно сильного основания, в апротонном органическом растворителе. Соединения, где R2a или R2b представляют замещенный С2-6алкенил, можно восстановить в соответствующие соединения, где R2a или R2b представляют замещенный С2-6алкил (I-i-1) или (I-i-2), например, используя водород в присутствии катализатора благородного металла, такого как Pd/C. Цианогруппу, в свою очередь, можно восстановить до соответствующей метиленаминогруппы (-CH2-NH2), используя водород в присутствии катализатора, например, никеля Ренея, в подходящем растворителе, например, в смеси метанол/аммиак. В результате указанной реакции получают соединения (I-j-1) и (I-j-2), которые можно моноалкилировать или диалкилировать, получая соединения (I-k-1), (I-k-2) и (I-l-1), (I-1-2). Указанные реакции алкилирования можно осуществить, используя реакцию восстановительного алкилирования, используя альдегид или кетон в присутствии водорода и катализатора (получая моноалкильные производные) или используя соответствующим образом замещенные алкилгалогениды (получая моно- или диалкильные производные). Указанные реакции представлены на следующих схемах реакций. На этих схемах R2а-1 представляет CN, Ar3 или Het, Alk1 представляет С4-6алкандиильные радикалы (которые такие же, как C1-6алкандиил, но содержат 4-6 атомов углерода), R8a и R8b имеют значения, указанные в описании и формуле изобретения, но предпочтительно они отличаются от Ar3.
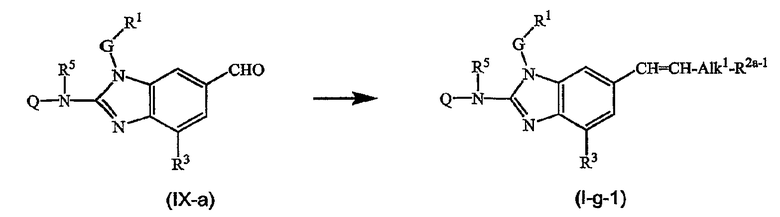
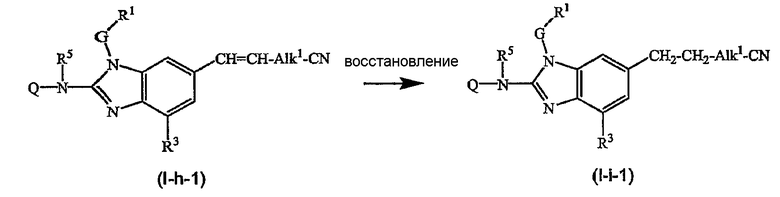
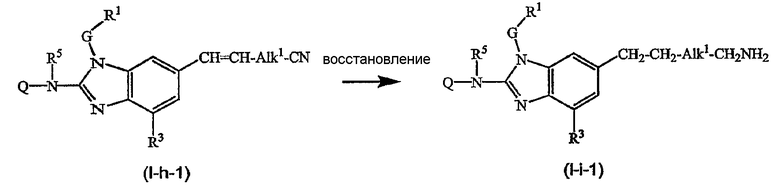
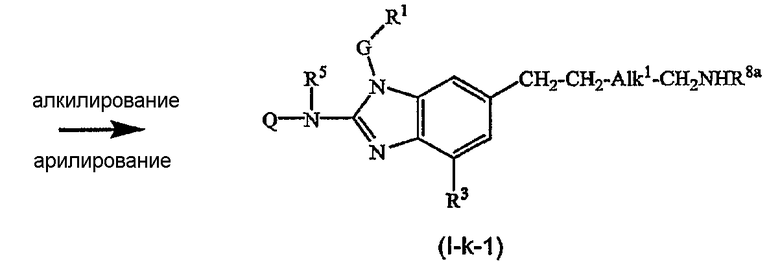
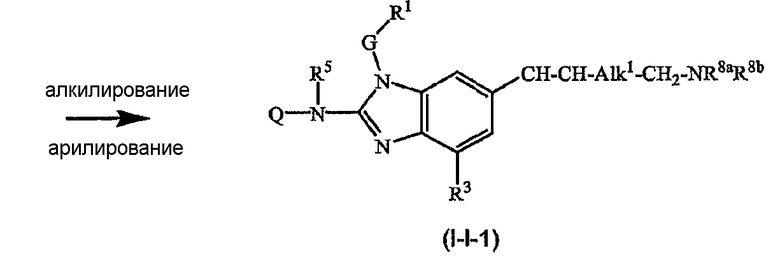
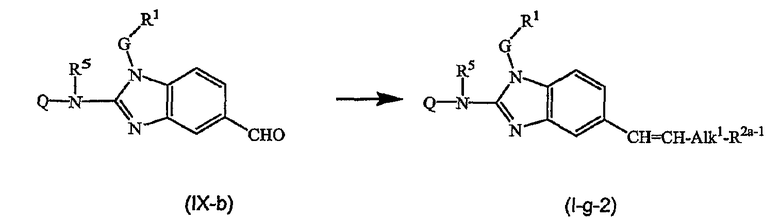
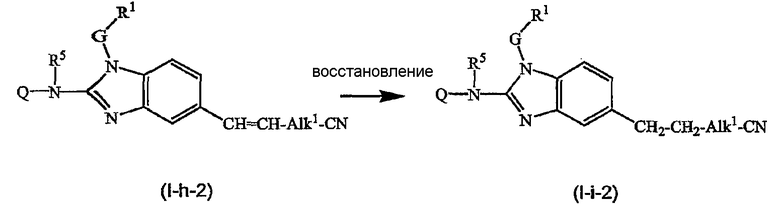
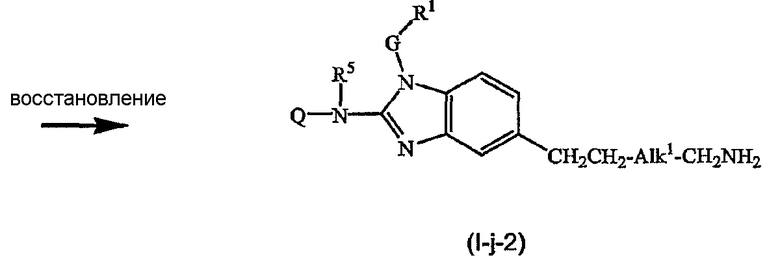
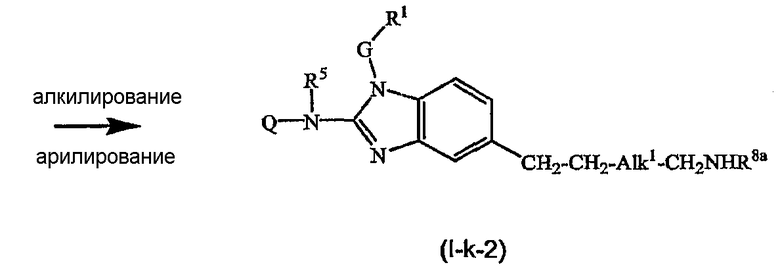
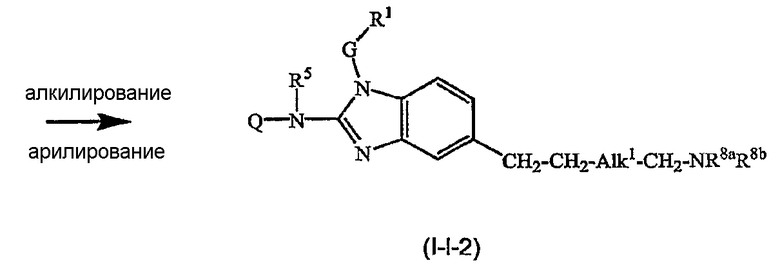
Можно также получить производное соединения формулы (I), где R2a или R2b представляют альдегид или С1-6алкил, замещенный кето или альдегидом, используя реакцию типа Гриньяра, для введения арильных или алкильных групп.
Дополнительный аспект настоящего изобретения относится к тому факту, что некоторые из соединений, идентифицированные как предшественники соединений формулы (I), являются новыми соединениями.
В частности, соединения формул (VII-a), (VII-b), (VIII-a), (VIII-b), (IX-a), (IX-b), (I-f-1), (I-f-2), (I-g-1), (I-g-2), где G, R1, R2a, R2b, R3, R5, R8a, R8b, R12 имеют значения, определенные выше для соединений формулы (I) или для любых их подгрупп, и где Q представляет пирролидинил, пиперидинил или гомопиперидинил, замещенный у своего атома азота радикалом R6, который представляет С1-6алкил, необязательно замещенный одним или более, предпочтительно одним или двумя, заместителями, каждый из которых независимо выбран из группы, состоящей из трифторметила, C3-7циклоалкила, Ar2, гидрокси, C1-4алкокси, C1-4алкилтио, Ar2-окси, Ar2-тио-, Ar2(CH2)nокси, Ar2(CH2)nтио, гидроксикарбонила, аминокарбонила, C1-4алкилкарбонила, Ar2карбонила, C1-4алкоксикарбонила, Ar2(CH2)nкарбонила, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, Ar2(CH2)nкарбонилокси, C1-4алкоксикарбонил(CH2)nокси, моно- или ди(C1-4алкил)аминокарбонила, моно- или ди(C1-4алкил)аминокарбонилокси, аминосульфонила, моно- или ди(C1-4алкил)аминосульфонила или гетероцикла, выбранного из группы, состоящей из пирролидинила, пирролила, дигидропирролила, имидазолила, триазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила, пиридила и тетрагидропиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из оксо или С1-6алкила; и где указанный R6 может быть представлен R6b, также как формы их фармацевтически приемлемых солей и их возможные стереоизомерные формы являются новыми соединениями.
Особый интерес представляют любые группы новых соединений, определенные в предыдущем разделе, где
(a) R6b представляет С1-6алкил, необязательно замещенный двумя заместителями или, предпочтительно, одним заместителем, каждый из которых независимо выбран из группы, состоящей из трифторметила, Ar2, гидрокси, С1-4алкокси, Ar2(CH2)nокси, гидроксикарбонила, аминокарбонила, C1-4алкилкарбонила, C1-4алкоксикарбонила, Ar2(CH2)nкарбонила, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, моно- или ди(С1-4алкил)аминокарбонила, аминосульфонила, моно- или ди(С1-4алкил)аминосульфонила или гетероцикла, выбранного из группы, состоящей из пирролидинила, имидазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила и пиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила; или, в частности, где
(b) R6b представляет С1-6алкил, необязательно замещенный одним заместителем и, необязательно, другим заместителем, который представляет гидрокси, где указанным заместителем является трифторметил, Ar2, гидрокси, C1-4алкокси, Ar2(CH2)nокси, гидроксикарбонил, аминокарбонил, С1-4алкилкарбонил, C1-4алкоксикарбонил, Ar2(CH2)nкарбонил, аминокарбонилокси, C1-4алкилкарбонилокси, Ar2карбонилокси, моно- или ди(С1-4алкил)аминокарбонил, аминосульфонил, моно- или ди(С1-4алкил)аминосульфонил или гетероцикл, выбранный из группы, состоящей из пирролидинила, имидазолила, пиперидинила, гомопиперидинила, пиперазинила, диоксоланила, диоксанила и пиридила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя радикалами, выбранными из оксо и С1-6алкила; или далее, в частности,
(c) R6b представляет С1-6алкил, необязательно замещенный Ar2, гидрокси, C1-4алкокси, гидрокси-карбонилом, аминокарбонилом, аминосульфонилом, C1-4алкоксикарбонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранным из диоксоланила, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен оксо или одним или двумя С1-6алкильными радикалами; или далее, в частности,
(d) R6b представляет С1-6алкил, необязательно замещенный Ar2, гидрокси, гидроксикарбонилом, аминокарбонилом, аминосульфонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранным из диоксоланила, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен оксо или одним или двумя С1-6алкильными радикалами; или далее, в частности,
(e) R6b представляет С1-6алкил, необязательно замещенный Ar2, гидрокси, аминокарбонилом или аминосульфонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный гетероциклом, выбранным из диоксоланила, пирролидинила, пиперидинила, пиперазинила, где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя С1-6алкильными радикалами; или предпочтительно
(f) R6b представляет С1-6алкил, необязательно замещенный Ar2, гидрокси, аминокарбонилом, аминосульфонилом, или С1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный пирролидинилом, пиперидинилом, пиперазинилом, 4-С1-6алкилпиперазинилом; или предпочтительно
(g) R6b представляет С1-6алкил, необязательно замещенный Ar2, гидрокси, аминокарбонилом или аминосульфонилом; или предпочтительно
(h) R6b представляет С1-6алкил.
Предпочтительно, чтобы в (a)-(h) в предыдущем разделе радикалы пирролидинил, пиперидинил, гомопиперидинил или пиперазинил были связаны своими атомами азота с С1-6алкилом, заместителями у которого они являются.
Кроме того, было обнаружено, что указанные соединения обладают противовирусными свойствами, в частности, обладают ингибирующей активностью в отношении RSV. Особый интерес представляют соединения формул (VII-a), (VII-b), (VIII-a) и (VIII-b), где Q представляет 4-пиперидинил, в котором азот кольца замещен радикалом R6, который представляет С1-6алкил, а также их формы фармацевтически приемлемых солей и их возможные стереоизомерные формы. Термины “формы фармацевтически приемлемых солей” и “стереоизомерные формы”, используемые в описании, имеют значения, указанные в описании.
Кроме того, соединения формул (VII-a), (VII-b), (VIII-a), (VIII-b), (IX-a), (IX-b), (I-f-1), (I-f-2), (I-g-1), (I-g-2), где G, R1, R2a, R2b, R3, R5, R8a, R8b и R12 имеют значения, указанные в определениях для соединений формулы (I) или любых их подгрупп, и где Q представляет R6b, который имеет значения, указанные в предыдущем разделе, а также их формы фармацевтически приемлемых солей и их возможные стереоизомерные формы, являются новыми соединениями. Кроме того, было обнаружено, что соединения обладают противовирусными свойствами, в частности, обладают ингибирующей активностью в отношении RSV.
Особый интерес представляют такие соединения, указанные в предыдущем разделе, где G, R1, R2а, R2b, R3, R5, R8a и R8b являются такими, которые определены в любой из подгрупп, указанных в рассматриваемом описании и в формуле изобретения. Предпочтительными являются те новые соединения, указанные в предыдущем разделе, где G представляет C1-6алкандиил, более предпочтительно где G представляет метилен; и/или где R2а, R2b, R3, R5 - все представляют водород; и/или R1 представляет пиридил, замещенный, как определено в рассматриваемом описании и в формуле изобретения, в частности, R1 представляет пиридил, замещенный одним или двумя заместителями, выбранными из С1-6алкила и гидрокси.
Соединения формулы (I) можно превратить друг в друга, используя известные специалистам реакции превращения функциональных групп, включая те, что раскрыты в описании.
Нитрогруппы можно восстановить до аминогрупп, которые затем можно алкилировать до моно- или диалкиламиногрупп, или ацилировать до арилкарбониламино или алкилкарбониламино и т.п. групп. Цианогруппы можно восстановить до аминометиленовых групп, которые можно затем модифицировать.
Ряд промежуточных соединений, которые использовали для получения соединений формулы (I), являются известными соединениями или являются аналогами известных соединений, которые можно получить в соответствии с модификациями известных специалистам способов, которые легко могут осуществить специалисты. Ряд способов получения промежуточных соединений представлен в описании более подробно.
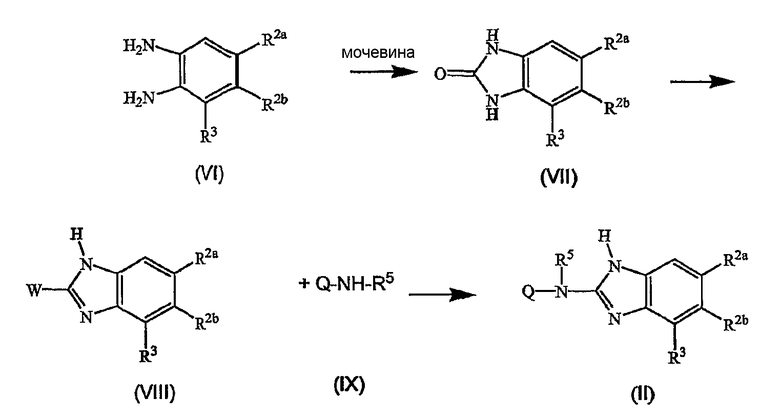
На первой стадии диаминобензол (VI) циклизуют, используя мочевину, в подходящем растворителе, например, ксилоле, получая бензимидазолон (VII). Последний превращают в производное бензимидазола (VIII), где W представляет отщепляемую группу, как определено выше, в частности, используя реакцию (VII) с соответствующим галогенирующим агентом, например POCl3, и полученное промежуточное соединение (VIII) подвергают взаимодействию с производным амина (IX) с получением промежуточного соединения (II).
Такую же последовательность реакций можно использовать для получения других промежуточных соединений. Например, промежуточные соединения формулы (IV) можно получить, осуществляя взаимодействие промежуточных соединений (IX) с амином (X), где Q представляет пирролинильную, пиперидинильную или гомопиперидинильную группу, где азот замещен защитной группой, получая предшественники (IV), которые можно превратить в промежуточные соединения (IV), удаляя защитную группу. Подходящие для этой цели защитные группы включают алкилоксикарбонильные группы, такие как метокси- или этоксикарбонил, которые можно удалить, используя основание, или бензильные или бензилоксикарбонильные группы, которые можно удалить, используя водород в присутствии катализатора.
Соединения формулы (I) можно превратить в соответствующие N-оксидные формы, используя известные специалистам процедуры для превращения трехвалентного азота в его N-оксидную форму. Указанную реакцию N-окисления можно осуществить взаимодействием исходного материала формулы (I) с соответствующим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, перекись водорода, пероксиды щелочного металла или щелочноземельного металла, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, пероксибензойную кислоту или галогензамещенную пероксибензойную кислоту, например, 3-хлорпероксибензойную кислоту, пероксиалкановые кислоты, например, пероксиуксусную кислоту, алкилгидропероксиды, например, гидропероксид трет-бутила. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и т.п., углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей.
Чистые стереохимически изомерные формы соединений формулы (I) можно получить, применяя известные специалистам процедуры. Диастереомеры можно разделить, используя физические методы, например, селективную кристаллизацию и хроматографические методики, например, распределение в противотоке, жидкостную хроматографию и т.п.
Соединения формулы (I), полученные раскрытыми выше способами, обычно представляют собой рацемические смеси энантиомеров, которые можно разделить, используя известные специалистам способы. Рацемические соединения формулы (I), которые являются в достаточной мере основными или кислотными, можно превратить в форму соответствующих диастереомерных солей, используя реакции с подходящими хиральными кислотами, соответственно хиральными основаниями. Указанную форму диастереомерной соли затем выделяют, например, используя селективную или фракционную кристаллизацию, и выделяют из нее энантиомеры, используя щелочь или кислоту. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов при условии, что реакция протекает стереоспецифически. Предпочтительно, если нужно получить конкретный стереоизомер, синтезировать указанное соединение, используя стереоспецифические методы получения. В указанных способах выгодно использовать энантиомерно чистые исходные материалы.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения формулы (I), как определено в описании, или соединения любой из подгрупп соединений формулы (I), как определено в описании, и фармацевтически приемлемый носитель. Терапевтически эффективным количеством в указанном контексте является такое количество, которого достаточно для профилактического действия против, или для стабилизации, или для ослабления вирусной инфекции и, в частности, RSV вирусной инфекции, у инфицированного субъекта, или у субъекта, который подвергается риску быть инфицированным. В еще одном аспекте настоящее изобретение относится к способу получения фармацевтической композиции, как определено в описании, который включает тщательное перемешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы (I), как определено в описании, или соединения любой из подгрупп соединений формулы (I), как определено в описании.
Поэтому соединения настоящего изобретения или любую их подгруппу можно приготовить в различных фармацевтических формах в соответствии с целями введения. В качестве подходящих композиций можно указать все композиции, обычно используемые для систематического введения лекарств. Для приготовления фармацевтической композиции настоящего изобретения эффективное количество конкретного соединения, необязательно в форме соли присоединения или в форме комплекса металла, в качестве активного ингредиента объединяют в однородной смеси с фармацевтически приемлемым носителем, причем указанный носитель может иметь различные формы в зависимости от нужной для приема формы препарата. Желательно, чтобы эти фармацевтические композиции были в единичной дозовой форме, пригодной, в частности, для перорального, ректального, чрескожного введения или для парентеральных инъекций. Например, при приготовлении композиций в дозовой форме для перорального введения можно использовать любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п. в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, например, крахмалы, сахара, каолин, смазывающие агенты, связующие, разрыхлители и т.п. в случае порошков, пилюль, капсул и таблеток. Благодаря простоте введения таблетки и капсулы представляют собой наиболее удобные формы для единичных доз для перорального введения, причем в этих случаях, очевидно, используют твердые фармацевтические носители. Для композиций для парентерального введения носитель обычно включает стерильную воду, по меньшей мере, в большей части, хотя могут быть включены другие ингредиенты, например, агенты, способствующие растворимости. Можно, например, приготовить растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно также приготовить суспензии для инъекций, и в этом случае можно использовать жидкие носители, суспендирующие агенты и т.п. Включены также твердые формы препаратов, которые необходимо превратить непосредственно перед введением в препараты в жидкой форме. В композициях, предназначенных для чрескожного введения, носитель необязательно включает повышающий проницаемость агент и/или подходящий смачивающий агент, необязательно объединенный с подходящими добавками любой природы в небольших пропорциях, причем эти добавки не должны оказывать вредного воздействия на кожу.
Соединения настоящего изобретения можно также вводить с помощью пероральной ингаляции или вдувания, используя способы и композиции, которые специалисты используют для таких целей. Так, обычно соединения настоящего изобретения можно вводить в легкие в форме растворов, суспензий или сухих порошков, причем предпочтительны растворы. Любая система, предназначенная для доставки растворов, суспензий или сухих порошков с помощью пероральной ингаляции или вдувания, пригодна для введения соединений настоящего изобретения.
Так, настоящее изобретение также предлагает фармацевтические композиции, адаптированные для введения с помощью ингаляции или вдувания через рот, которые включают соединение формулы (I) и фармацевтически приемлемый носитель. Предпочтительно вводить соединения настоящего изобретения с помощью ингаляций растворов в дозах распылителей или аэрозолей.
Особенно удобно создавать указанные выше фармацевтические композиции в единичной дозовой форме для простоты введения и однородности дозировки. В том смысле, как он использован в описании, термин «единичная дозовая форма» относится к физически дискретным единицам, пригодным в качестве единичных доз, причем каждая единица содержит определенное количество активного ингредиента, рассчитанное для достижения желательного терапевтического эффекта, вместе с необходимым фармацевтическим носителем. Примерами таких единичных дозовых форм являются таблетки (включая таблетки с насечкой и таблетки в оболочке), капсулы, пилюли, суппозитории, пакетики порошков, облатки, растворы или суспензии для инъекций и т.п., и их отдельные части.
Соединения формулы (I) демонстрируют противовирусные свойства. Вирусные инфекции, которые можно лечить, используя соединения и способы настоящего изобретения, включают такие инфекции, которые возбуждаются орто- и парамиксовирусами и, в частности, человеческим и коровьим респираторным синцитиальным вирусом (RSV). Ряд соединений настоящего изобретения более чем активны против мутированных штаммов RSV. Кроме того, многие соединения настоящего изобретения демонстрируют благоприятный фармакокинетический профиль и обладают привлекательными свойствами, с точки зрения биодоступности, включая приемлемое время полураспада, AUC и пиковые значения, и отсутствие неблагоприятных явлений, например, недостаточно быстрое проявление и задержка в тканях.
In vitro противовирусную активность против RSV соединений настоящего изобретения тестируют, используя тест, как раскрыто в экспериментальной части описания, и ее можно также продемонстрировать, используя анализ восстановления вируса. In vivo противовирусную активность против RSV соединений настоящего изобретения можно продемонстрировать в тестовой модели, используя хлопковых крыс, как раскрыто Wyde et al. (Antiviral Research (1998), 38, 31-42).
Благодаря противовирусным свойствам, особенно анти-RSV характеристикам соединений формулы (I) или любой их подгруппы, их пролекарственные формы, N-оксиды, соли присоединения, четвертичные амины, комплексы металлов и стереохимически изомерные формы, можно использовать для лечения индивидуумов с вирусной инфекцией, особенно с RSV инфекцией, а также для профилактики указанных инфекций. Вообще соединения настоящего изобретения можно использовать для лечения теплокровных животных, инфицированных вирусами, особенно респираторным синцитиальным вирусом.
Соединения настоящего изобретения или любые их подгруппы можно поэтому использовать в качестве лекарств. Указанное использование в качестве лекарств или способ лечения включает системное введение инфицированному вирусом субъекту, или субъекту, подверженному вирусным инфекциям, количества, эффективного для борьбы с состояниями, связанными с вирусной инфекцией, особенно RSV инфекцией.
Настоящее изобретение также относится к применению соединений настоящего изобретения или любой их подгруппы для приготовления лекарств для лечения или профилактики вирусных инфекций, особенно RSV инфекции.
Кроме того, настоящее изобретение относится к способу лечения теплокровных животных, инфицированных вирусом или подвергающихся риску инфицирования вирусом, особенно RSV, причем указанный способ включает введение противовирусно эффективного количества соединения формулы (I), как определено в описании, или соединения любой подгруппы соединений формулы (I), как определено в описании.
Обычно предполагается, что противовирусно эффективное дневное количество должно составлять от 0,01 мг/кг до 500 мг/кг веса тела, более предпочтительно от 0,1 мг/кг до 50 мг/кг веса тела. Может оказаться удобным вводить необходимую дозу в виде двух, трех, четырех или более долей дозы с соответствующими интервалами в течение дня. Указанные доли дозы можно приготовить в виде единичных дозовых форм, например, содержащих от 1 до 1000 мг, и, в частности, от 5 до 200 мг активного ингредиента на единичную дозовую форму.
Точный размер дозы и частота введения зависят от конкретно используемого соединения формулы (I), подлежащего лечению конкретного состояния, тяжести подлежащего лечению состояния, возраста, веса, пола, степени расстройства и общего физического состояния конкретного пациента, также как других лекарств, которые пациент может принимать, что хорошо известно специалистам. Кроме того, очевидно, что указанное эффективное дневное количество можно уменьшить или увеличить в зависимости от реакции подвергающегося лечению субъекта и/или в зависимости от оценки врача, прописывающего соединение настоящего изобретения. Поэтому интервалы эффективного дневного количества, указанные выше, являются лишь рекомендательными.
Кроме того, можно использовать, как это принято в медицине, комбинацию другого противовирусного агента и соединения формулы (I). Поэтому настоящее изобретение относится также к продукту, содержащему (a) соединение формулы (I), и (b) другое противовирусное соединение, в виде комбинированного препарата для одновременного, раздельного или последовательного использования при лечении вирусной инфекции. Различные лекарственные средства можно комбинировать в одном препарате вместе с фармацевтически приемлемыми носителями. Например, соединения настоящего изобретения можно комбинировать с бета-интерфероном или альфа-фактором некроза опухоли для лечения или профилактики RSV инфекций.
ПРИМЕРЫ
Приводимые далее примеры предназначены для иллюстрации настоящего изобретения, но ими изобретение не ограничивается. Термины «соединение 1», «соединение 2» и т.д., используемые в этих примерах, соответствуют тем же номерам соединений в таблицах.
Соединения идентифицировали, используя LC/MS в следующей комплектации:
LCT: ионизация электроспреем в позитивном режиме, сканирование со 100-900 ат. ед. массы; Xterra MS C18 (Waters, Milford, MA) 5 мкм, 3,9×150 мм); скорость потока 1 мл/мин. Используют две подвижные фазы (подвижная фаза A: 85% 6,5 мM ацетат аммония + 15% ацетонитрил; подвижная фаза B: 20% 6,5 мM ацетат аммония + 80% ацетонитрил) для осуществления градиентного элюирования от 100% A в течение 3 мин до 100% B за 5 мин, 100% B в течение 6 мин до 100% A за 3 мин, и уравновешивают снова 100% A в течение 3 мин).
ZQ: ионизация электроспреем как в позитивном, так и в негативном (импульсном) режиме, сканирование со 100-1000 ат. ед. массы; Xterra RP C18 (Waters, Milford, MA) 5 мкм, 3,9×150 мм); скорость потока 1 мл/мин. Используют две подвижные фазы (подвижная фаза A: 85% 6,5 мM ацетат аммония + 15% ацетонитрил; подвижная фаза B: 20% 6,5 мM ацетат аммония + 80% ацетонитрил) для осуществления градиентного элюирования со 100% A в течение 3 мин до 100% B за 5 мин, 100% B в течение 6 мин до 100% A за 3 мин, и уравновешивают снова 100% A в течение 3 мин).
Пример 1
Схема A
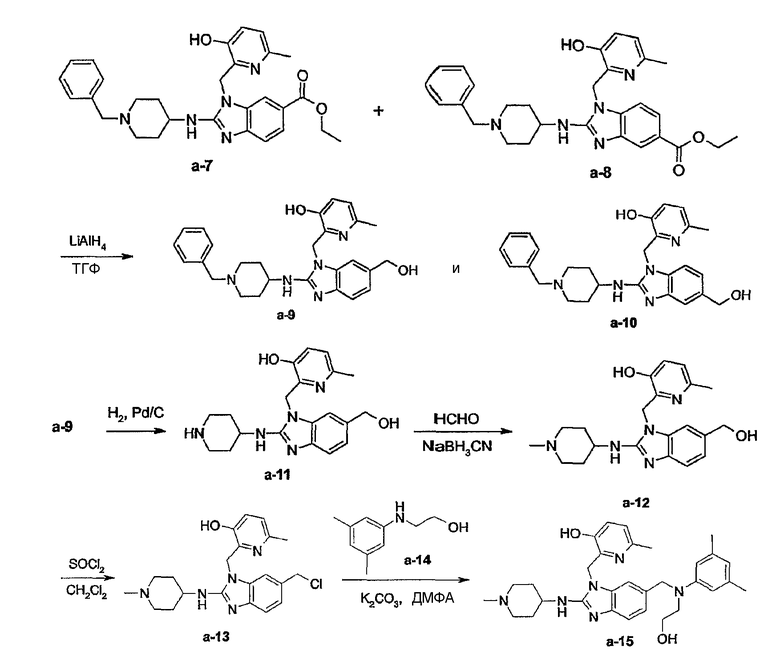
Смесь a-1 (0,166 моль) и мочевины (0,199 моль) в ксилоле (300 мл) перемешивают при кипении с обратным холодильником в течение 12 час. Реакционную смесь охлаждают до комнатной температуры. Осадок отфильтровывают, промывают ксилолом и диизопропиловым эфиром и затем сушат, получая 32 г промежуточного соединения a-2 (93%, т.плавления: >260°C).
Смесь a-2 (0,073 моль) в POCl3 (150 мл) перемешивают при 100°C. Концентрированную HCl (около 1,5 мл) очень осторожно добавляют по каплям до растворения a-2. Смесь перемешивают при 120°C в течение 6 час. Растворитель выпаривают досуха. Остаток помещают в смесь Н2О/лед, подщелачивают K2CO3 (порошок) и экстрагируют смесью этилацетат + 10% метанол. Органический слой выделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха, получая 13,5 г промежуточного соединения a-3 (83%, Т.плавления: 178°C).
Смесь a-3 (0,051 ммоль) и a-4 (0,056 моль) перемешивают при 160°C в течение 2 час. Остаток помещают в смесь СН2Cl3/H2O и подщелачивают 10% раствором K2CO3 в воде. Органический слой выделяют, сушат (над MgSO4), фильтруют и растворитель выпаривают досуха. Остаток очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/метанол/NH4OH 95/5/0,5). Чистые фракции собирают и растворитель выпаривают, получая 15,3 г промежуточного соединения a-5 (79%).
Смесь a-5 (0,0396 моль), a-6 (0,059 моль) и K2CO3 (0,1584 моль) в CH3CN (180 мл) перемешивают и кипятят с обратным холодильником в течение 12 час. Растворитель выпаривают досуха. Остаток помещают в CH2Cl2. Органический слой промывают H2O, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (20 г) очищают, используя хроматографическую колонку с силикагелем (элюент: толуол/2-пропанол/NH4ОH 85/15/1; 20-45 мкм). Две фракции собирают и растворитель выпаривают, получая 5,3 г фракции 1 (27%) и 6,3 г фракции 2 (32%). Фракцию 1 дважды кристаллизуют из смеси 2-пропанон/CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 4,9 г промежуточного соединения a-7 (25%, т.плавления: 179°C). Фракцию 2 кристаллизуют из смеси 2-пропанон/CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 5,5 г промежуточного соединения a-8 (28%, т.плавления: 238°C).
LiAlH4 (0,009 моль) добавляют порциями к смеси a-7 (0,003 моль) в тетрагидрофуране (60 мл) при 5°C в токе N2. Реакционную смесь перемешивают при 5°C в течение 1 часа и затем при комнатной температуре в течение 12 час. Осторожно добавляют этилацетат и H2O, и водный слой насыщают K2CO3 (порошок). Органический слой выделяют, сушат (над MgSO4) и затем фильтруют на целите. Полученный фильтрат выпаривают досуха, получая 1,3 г промежуточного соединения a-9 (97%). Неочищенный продукт используют непосредственно на следующей стадии реакции.
Промежуточное соединение a-10 получают аналогично способу, раскрытому для промежуточного соединения a-9.
Смесь a-9 (0,0028 моль) и Pd/C 10% (2,5 г) в CH3OH (40 мл) гидрируют при 40°C в течение 12 час при давлении 8 бар, затем фильтруют на целите. Целит промывают раствором смеси CH3OH/тетрагидрофуран (50/50). Полученный фильтрат выпаривают досуха, получая 1,8 г промежуточного соединения a-11 (95%, т.плавления: 260°C).
HCHO 37% в воде (0,0098 моль), NaBH3CN (0,0059 моль), затем CH3CO2H (2 мл) добавляют при комнатной температуре к смеси a-11 (0,0049 моль) в CH3CN (50 мл). Полученную смесь перемешивают при комнатной температуре в течение 12 час. Растворитель выпаривают досуха. Остаток помещают в этанол (30 мл) и добавляют 5 н. раствор HCl в 2-пропаноле (4 мл). Смесь перемешивают при 80°C в течение 8 час. Растворитель выпаривают досуха. Остаток помещают в CH2Cl2/K2CO3 10%. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток кристаллизуют из смеси CH3OH/2-пропанон/CH3CN. Осадок отфильтровывают и сушат, получая 1,65 г a-12 (88%). Часть этой фракции (0,15 г) кристаллизуют из смеси CH3OH/2-пропанон. Осадок отфильтровывают и сушат (т.плавления: 165°C).
SOCl2 (2,1 мл) добавляют по каплям к смеси a-12 (0,0018 моль) в CH2Cl2 (20 мл) при 5°C. Смесь перемешивают при 5°C в течение 1 часа, затем при комнатной температуре в течение 12 час. Растворитель выпаривают досуха, получая 0,93 г промежуточного соединения a-13 (100%). Неочищенный продукт используют непосредственно на следующей стадии реакции.
Смесь a-13 (0,0003 моль), a-14 (0,0005 моль) и K2CO3 (0,0019 моль) в диметилформамиде (30 мл) перемешивают при 80°C в течение 4 час и выливают в H2O. Водный слой насыщают K2CO3 и экстрагируют смесью CH2Cl2/CH3OH. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,25 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 90/10/1; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,05 г, 24%) кристаллизуют из смеси 2-пропанон/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,042 г соединения a-15 (20%, соединение 1, т.плавления 201°C).
Пример 2
Схема B
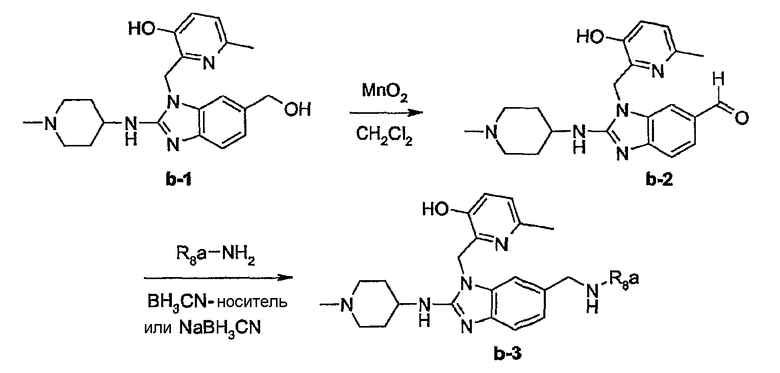
Смесь b-1 (0,0028 моль) и MnO2 (2,5 г) в CH2Cl2 (40 мл) перемешивают при комнатной температуре в течение 12 час и затем фильтруют на целите. Целит промывают CH2Cl2. Полученный фильтрат выпаривают досуха. Остаток помещают в 2-пропанон.
Осадок отфильтровывают и сушат, получая 0,75 г промежуточного соединения b-2 (69%, т.плавления: 250°C).
Вариант 1: Смесь b-2 (0,0001 моль), 3,5-дихлоранилина (0,0001 моль), BH3CN на твердом носителе (0,0001 моль) и CH3CO2H (2 капли) в CH3OH (4 мл) перемешивают при комнатной температуре в течение 24 час. Раствор фильтруют. Полученный фильтрат выпаривают досуха. Остаток очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 87/12/1,5; 5 мкм). Чистые фракции собирают и растворитель выпаривают, получая 0,026 г 2-[6-[(3,5-дихлорфениламино)метил]-2-(1-метилпиперидин-4-иламино)бензоимидазол-1-илметил]-6-метил-3-ола (38%, соединение 2).
Вариант 2: b-2 (0,0005 моль), NaBH3CN (0,0006 моль) и затем CH3CO2H (0,2 мл) добавляют при комнатной температуре к смеси 3-метиланилина (0,0006 моль) в CH3CN (20 мл). Смесь перемешивают при комнатной температуре в течение 12 час. Добавляют Н2О. Смесь насыщают K2CO3 (порошок) и экстрагируют CH2Cl2/CH3OН. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,3 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/триэтиламин; 90/10/0,1; 5 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,17 г, 68%) кристаллизуют из смеси CH3OH/2-пропанон/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,13 г 2-[6-[(1-этилиден-3-метилпента-2,4-диениламино)метил]-2-(1-метилпиперидин-4-иламино)бензоимидазол-1-илметил]-6-метилпиридин-3-ола (52%, соединение 9, т.плавления 141°C).
Пример 3
Схема C
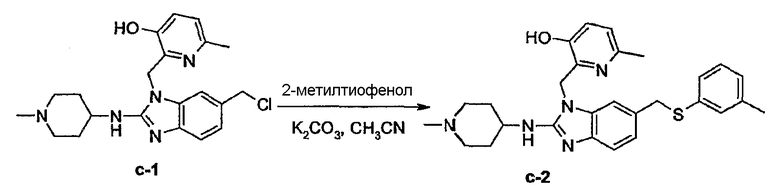
Смесь c-1 (0,0018 моль), 2-метилтиофенола (0,002 моль) и K2CO3 (0,0077 моль) в CH3CN (70 мл) перемешивают при 50°C в течение 12 час. Растворитель выпаривают досуха. Остаток помещают в H2O. Смесь экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,55 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 88/12/2; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,35 г, 39%) кристаллизуют из смеси CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,32 г 6-метил-2-[2-(1-метилпиперидин-4-иламино)-6-м-толилсульфанилметилбензоимидазол-1-илметил]пиридин-3-ола (соединение 93, т.плавления: 202°C).
Пример 4
Схема D
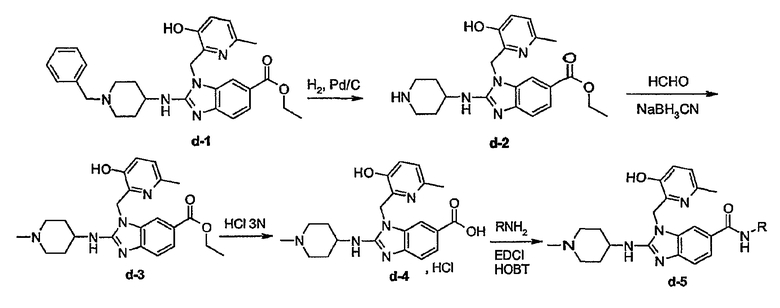
На схеме D R определен как Ar3, Het1, Het1(CH2)n или Het1(CH2)n.
Промежуточное соединение d-2 (т.плавления: 262°C) получают аналогично способу, раскрытому для промежуточного соединения a-11. Промежуточное соединение d-3 получают аналогично способу, раскрытому для промежуточного соединения a-12.
Смесь d-3 (0,0003 моль) в 3 н. растворе HCl в воде (30 мл) перемешивают при 80°C в течение 12 час. Растворитель выпаривают. Остаток сушат, получая 0,18 г промежуточного соединения d-4. Неочищенный продукт используют непосредственно на следующей стадии реакции.
Смесь d-4 (0,0003 моль), 2-метиланилина (0,0005 моль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,0005 моль) и 1-гидроксибензотриазола (0,0005 моль) в CH2Cl2 (20 мл) перемешивают при комнатной температуре в течение 24 час. Добавляют 10% раствор K2CO3 в воде. Водный слой насыщают K2CO3 (порошок). Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,2 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 80/20/1; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Получают 0,29 г (14%). Эту фракцию помещают в диизопропиловый эфир, затем в смесь CH3OH/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,007 г м-толиламида 3-(3-гидрокси-6-метилпиридин-2-илметил)-2-(1-метилпиперидин-4-иламино)-3H-бензоимидазол-5-карбоновой кислоты (4%, соединение 116, т.плавления: 172°C).
Пример 5
Схема E
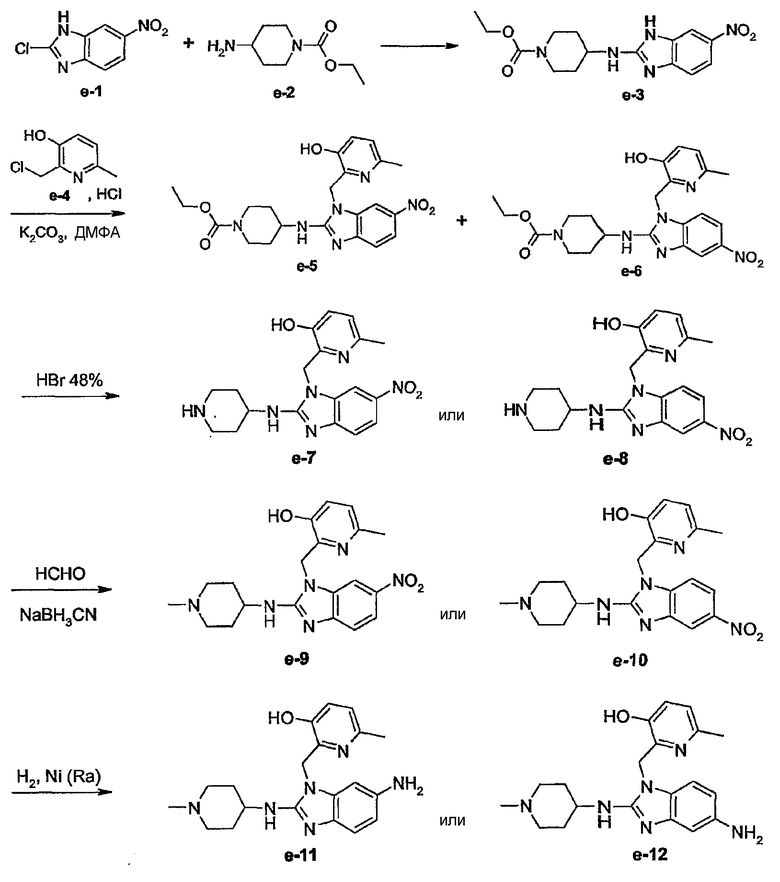

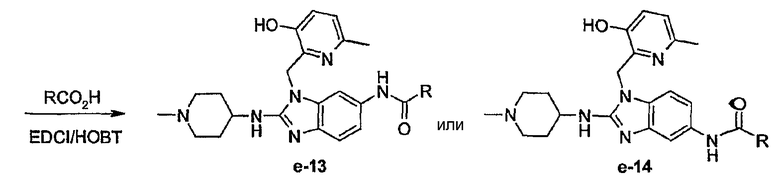
Смесь e-1 (0,0524 моль) и e-2 (0,1048 моль) перемешивают при 120°C в аппарате Парра в течение 10 час, затем помещают в H2O и экстрагируют этилацетатом. Выделенный органический слой очищают на короткой открытой хроматографической колонке с силикагелем (элюент: CH2Cl2/метанол 96/4). Фракции, содержащие продукт, собирают и растворитель выпаривают досуха, получая 7,7 г промежуточного соединения e-3 (44%).
Смесь e-3 (0,0312 моль), е-4 (0,0343 моль) и K2CO3 (0,1092 моль) в диметилформамиде (100 мл) перемешивают при 70°C в течение 24 час. Затем добавляют H2O. Смесь экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (12,2 г) очищают, используя хроматографическую колонку с силикагелем (элюент: толуол/изопропанол/NH4OH 90/10/0,5; 15-40 мкм). Две фракции собирают и растворитель выпаривают, получая 4 г промежуточного соединения е-5 (28%) и 5,4 г промежуточного соединения e-6 (38%).
e-5 (0,0088 моль) добавляют порциями к 48% раствору HBr в воде (40 мл). Смесь медленно доводят до 70°C и затем перемешивают в течение 12 час. Осадок фильтруют, промывают CH3CN и сушат. Остаток (4,6 г, 80%) помещают в H2O и подщелачивают K2CO3 (порошок). Осадок фильтруют и затем промывают этанолом. Полученный фильтрат выпаривают, получая 3 г промежуточного соединения e-7 (52%). Аналогичным способом, получают e-8.
HCHO 37% в H2O (0,0152 моль), затем NaBH3CN (0,0091 моль) добавляют при комнатной температуре к смеси e-7 (0,0075 моль) в CH3CN (100 мл). Уксусную кислоту (3,5 мл) медленно добавляют при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 12 час и выливают в H2O. Водный слой насыщают K2CO3 (порошок). Смесь экстрагируют смесью этилацетат/CH3OH. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха, получая 2,6 г промежуточного соединения e-9 (87%). Аналогичным способом получают e-10.
Смесь e-9 (0,0065 моль) и никеля Ренея (2,6 г) в CH3OH (100 мл) гидрируют при комнатной температуре в течение 1 часа при давлении 3 бара и затем фильтруют на целите. Целит промывают CH3OH. Полученный фильтрат выпаривают. Остаток (2,2 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 85/14/1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают, получая 0,85 г промежуточного соединения е-11 (35%). Аналогичным способом получают e-12.
Смесь e-11 (0,000125 моль) и 3-метилбензойной кислоты (0,00025 моль) в CH2Cl2 (4 мл) перемешивают при комнатной температуре. Добавляют 1-гидроксибензотриазол (0,00025 моль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,00025 моль). Реакционную смесь перемешивают при комнатной температуре в течение 12 час. Раствор концентрируют и добавляют 10% раствор NaHCО3 в воде (2 мл) и CH3OH (2 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 4 час. Затем CH3OH удаляют при пониженном давлении и полученный раствор экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 90/10/0,5; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают, получая 0,04 г N-[3-(3-гидрокси-6-метилпиридин-2-илметил)-2-(1-метилпиперидин-4-иламино)-3H-бензоимидазол-5-ил]-3-метилбензамида (60%, соединение 65). Аналогичным способом получают N-[1-(3-гидрокси-6-метилпиридин-2-илметил)-2-(1-метилпиперидин-4-иламино)-1H-бензоимидазол-5-ил]-3-метилбензамид (0,028 г или 42% выход, соединение 78).
Пример 6
Схема F
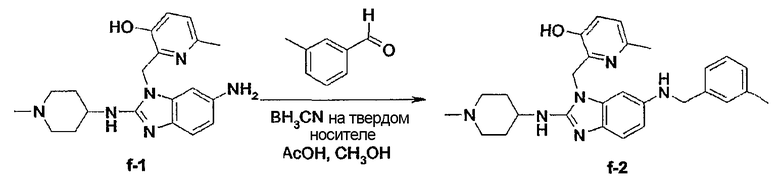
Смесь f-1 (0,0005 моль), 3-метилбензальдегида (0,0006 моль), BH3CN на твердом носителе (0,0006 моль) и уксусной кислоты (8 капель) в CH3OH (10 мл) перемешивают при комнатной температуре в течение 24 час. Твердый носитель отфильтровывают и промывают CH3OH. Полученный фильтрат выпаривают. Остаток (0,53 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 92/8/0,5 до 89/10/1; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,11 г) кристаллизуют из смеси CH3OH/диизопропиловый эфир. Осадок выделяют и сушат, получая 0,072 г соединения f-2, т.е. 6-метил-2-[6-(3-метилбензиламино)-2-(1-метилпиперидин-4-иламино)бензoимидазол-1-илметил]пиридин-3-ола (28%, соединение 28, т.плавления: 240°C).
Пример 7
Схема G
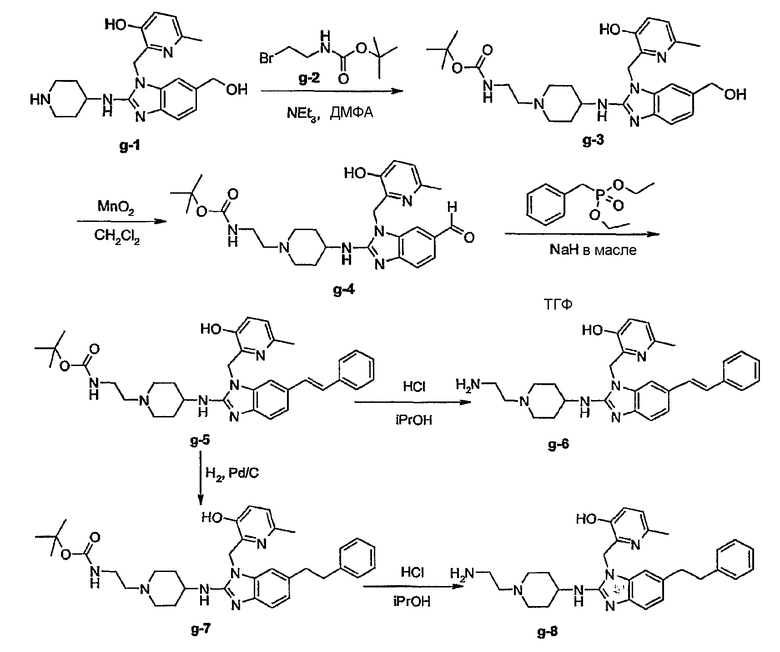
Смесь g-1 (0,0079 моль), g-2 (0,0095 моль) и триэтиламина (0,0118 моль) в диметилформамиде (60 мл) перемешивают при 80°C в течение 12 час. Растворитель выпаривают досуха. Остаток помещают в смесь CH2Cl2/H2O. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (7 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 90/10/0,5; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают, получая 1,2 г промежуточного соединения g-3 (30%).
Смесь g-3 (0,0023 моль) и MnО2 (2,4 г) в CH2Cl2 (80 мл) перемешивают при комнатной температуре в течение 12 час и затем фильтруют на целите. Целит промывают Н2O. Полученный фильтрат выпаривают досуха. Остаток (1,2 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 35-70 мкм).
Чистые фракции собирают и растворитель выпаривают, получая 0,8 г промежуточного соединения g-4 (67%).
Диэтилбензилфосфонат (0,0023 моль) добавляют к смеси NaH (0,0047 моль) в тетрагидрофуране (20 мл) при 5°C в токе N2. Смесь перемешивают при 5°C в течение 30 мин. По каплям добавляют раствор g-4 (0,0007 моль) в тетрагидрофуране (10 мл). Смесь перемешивают при 5°C в течение 1 часа и затем перемешивают при комнатной температуре в течение 12 час. Добавляют Н2О. Смесь экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток кристаллизуют из смеси CH3OH/2-пропанон. Осадок отфильтровывают и сушат, получая 0,24 г промежуточного соединения g-5 (52%).
Смесь g-5 (0,0001 моль) в 5 н. растворе HCl в 2-пропаноле (0,5 мл) и 2-пропанола (5 мл) перемешивают при 60°C в течение 4 час и затем охлаждают до комнатной температуры. Осадок фильтруют, промывают смесью 2-пропанол/диизопропиловый эфир и сушат, получая 0,058 г гидрохлоридной соли 2-{2-[1-(2-аминоэтил)пиперидин-4-иламино]-6-стирилбензоимидазол-1-илметил}-6-метилпиридин-3-ола, (g-6; соединение 143, 63%, 3,69 HCl + 3,03 H2O, Т.плавления: >260°C).
Смесь g-5 (0,0002 моль) и Pd/C 10% (0,03 г) в CH3OH (10 мл) и тетрагидрофуране (10 мл) гидрируют при комнатной температуре в течение 4 час при давлении 2 бара и затем фильтруют на целите. Целит промывают H2O. Полученный фильтрат выпаривают досуха, получая 0,14 г промежуточного соединения g-7 (100%). Этот продукт используют непосредственно на следующей стадии реакции.
Смесь g-7 (0,0002 моль) в 5 н. растворе HCl в 2-пропаноле (1,4 мл) и 2-пропанола (15 мл) перемешивают при 60°C в течение 4 час и затем охлаждают до комнатной температуры. Осадок фильтруют, промывают смесью 2-пропанол/диизопропиловый эфир и сушат, получая 0,138 г g-8, гидрохлоридной соли 2-{2-[1-(2-аминоэтил)пиперидин-4-иламино]-6-фенетилбензоимидазол-1-илметил}-6-метилпиридин-3-ола (87%, 3,62 HCl + 2,41 H2O, соединение 140, т.плавления: 181°C).
Пример 8
Схема Н
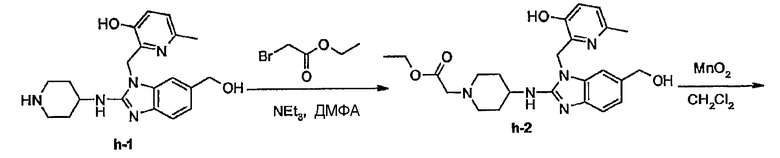
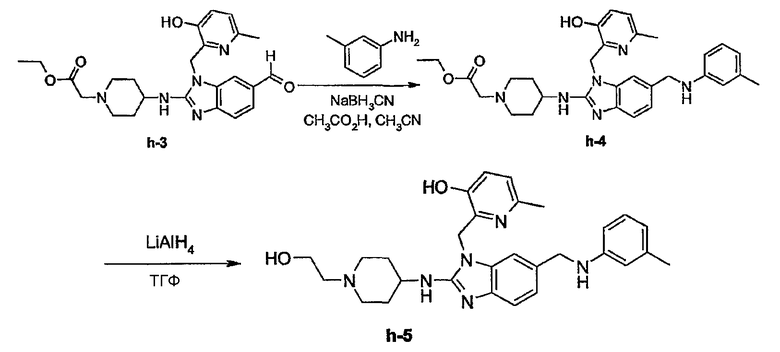
Смесь h-1 (0,0027 моль), этилбромацетата (0,0032 моль) и триэтиламина (0,004 моль) в диметилформамиде (40 мл) перемешивают при 50°C в течение 1 часа, выливают в ледяную воду и трижды экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток помещают в смесь 2-пропанон/диизопропиловый эфир. Осадок фильтруют, промывают H2O и сушат, получая 1 г промежуточного соединения h-2 (82%).
Промежуточное соединение h-3 получают аналогично способу, раскрытому для получения g-4.
CH3CO2H (0,2 мл) добавляют при комнатной температуре к смеси h-3 (0,0004 моль), 3-метиланилина (0,0005 моль) и NaBH3CN (0,0005 моль) в CH3CN (20 мл). Полученную смесь перемешивают при комнатной температуре в течение 6 час. Добавляют CH3CO2H (0,2 мл). Смесь перемешивают при комнатной температуре в течение 12 час. Растворитель выпаривают досуха. Остаток помещают в смесь CH2Cl2/K2CO3 10%. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха, получая 0,22 г промежуточного соединения h-4 (100%). Указанный продукт используют непосредственно на следующей стадии реакции.
LiAlH4 (0,0008 моль) добавляют к смеси h-4 (0,0004 моль) в тетрагидрофуране (20 мл) при 5°C в токе N2. Смесь перемешивают при 5°C в течение 1 часа, затем доводят до комнатной температуры и перемешивают в течение 4 час. Добавляют минимальное количество H2O и затем CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,22 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 85/15/1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,1 г, 50%) кристаллизуют из смеси CH3OH/CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,08 г 2-[2-[1-(2-гидроксиэтил)пиперидин-4-иламино]-6-(м-толиламинометил)бензоимидазол-1-илметил]-6-метилпиридин-3-ола (40%, соединение 145, т.плавления: 137°C).
Пример 9
Схема I
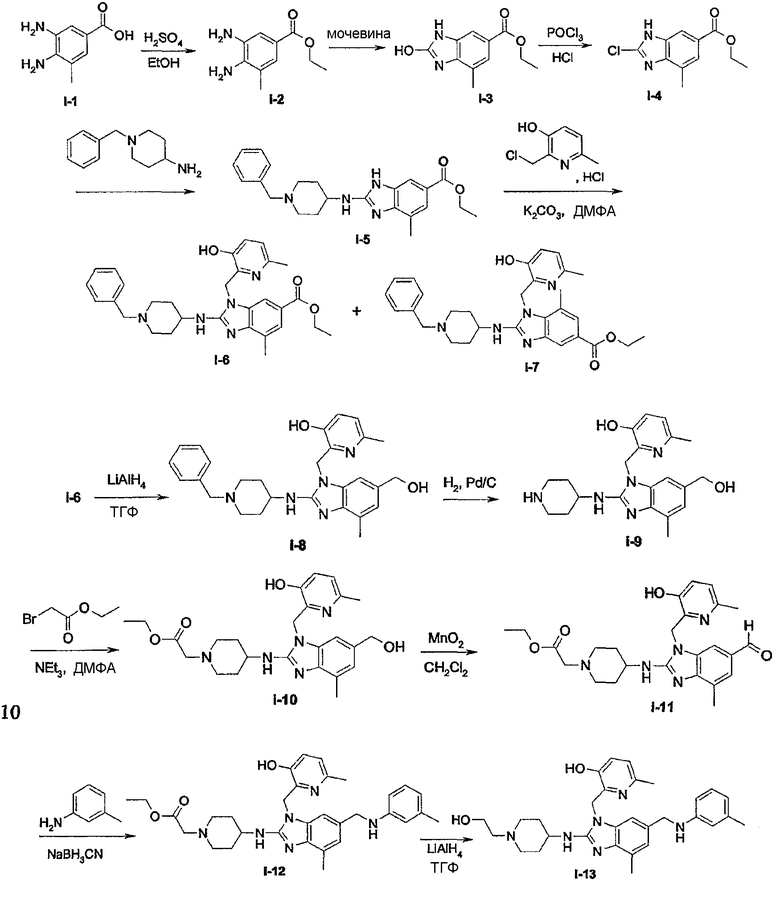

Смесь i-1 (0,0185 моль) в этаноле (60 мл) и H2SO4 36 н. (5 мл) перемешивают и кипятят с обратным холодильником в течение 24 час. Растворитель выпаривают досуха. Остаток помещают в CH2Cl2. Органический слой промывают 10% раствором K2CO3 в воде, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха, получая 3,2 г промежуточного соединения i-2 (89%).
Промежуточное соединение i-3 получают способом, аналогичным способу, раскрытому для промежуточного соединения a-2. Промежуточное соединение i-4 получают способом, аналогичным способу, раскрытому для промежуточного соединения a-3. Промежуточное соединение i-5 получают способом, аналогичным способу получения промежуточного соединения a-5.
Смесь i-5 (0,0048 моль), 2-хлорметил-6-метил-3-пиридинoла (0,0058 моль) и K2CO3 (0,0192 моль) в диметилформамиде (20 мл) перемешивают при комнатной температуре в течение 12 час, выливают в ледяную воду и экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (3,4 г) очищают, используя хроматографическую колонку с силикагелем (элюент: толуол/2-пропанол/NH4OH 83/16/1; 15-35 мкм). Две фракции собирают и растворитель выпаривают, получая 0,9 г промежуточного соединения i-6 (37%) и 0,78 г промежуточного соединения i-7 (32%).
Промежуточное соединение i-8 получают способом, аналогичным способу, раскрытому для промежуточного соединения a-9. Промежуточное соединение i-9 получают способом, аналогичным способу, раскрытому для промежуточного соединения a-11. Промежуточное соединение i-10 (т.плавления: 221°C) получают способом, аналогичным способу, раскрытому для промежуточного соединения h-2. Промежуточное соединение i-11 получают способом, аналогичным способу, раскрытому для промежуточного соединения h-3. Промежуточное соединение i-12 (т.плавления: 143°C) получают способом, аналогичным способу, раскрытому для промежуточного соединения h-4.
2-[2-[1-(2-гидроксиэтил)пиперидин-4-иламино]-4-метил-6-(м-толиламинометил)бензоимидазол-1-илметил]-6-метилпиридин-3-ол (i-13, соединение 168, т.плавления: 123°C) получают способом, аналогичным способу, раскрытому для соединения h-5.
Пример 10
Схема J
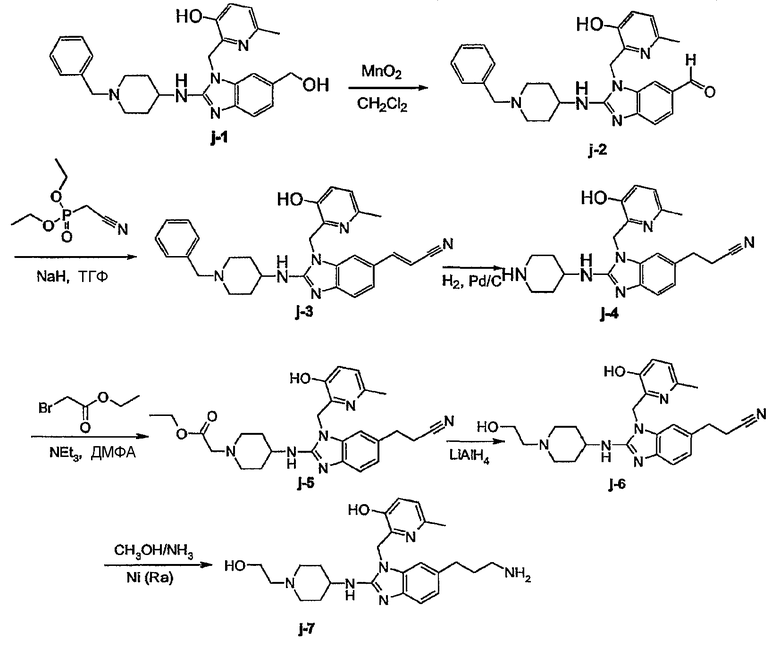
Промежуточное соединение j-2 получают способом, аналогичным способу, раскрытому для промежуточного соединения h-3.
Диэтилцианометилфосфонат (0,0052 моль) добавляют к смеси NaH (0,0105 моль) в тетрагидрофуране (30 мл) при 5°C в токе N2. Смесь перемешивают при 5°C в течение 30 мин. Затем добавляют раствор j-2 (0,0017 моль) в тетрагидрофуране (20 мл). Смесь перемешивают при 5°C в течение 1 час и затем перемешивают при комнатной температуре в течение 12 час. Добавляют Н2О. Смесь экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 70-200 мкм). Чистые фракции собирают и растворитель выпаривают, получая 0,7 г промежуточного соединения j-3 (84%).
Смесь j-3 (0,0014 моль) и Pd/C 10% (0,25 г) в CH3OH (35 мл) гидрируют при 40°C в течение 6 час при давлении 8 бар, затем охлаждают до комнатной температуры и фильтруют на целите. Полученный фильтрат выпаривают досуха, получая 0,3 г промежуточного соединения j-4 (52%).
Промежуточное соединение j-5 получают способом, аналогичным способу, раскрытому для промежуточного соединения h-2. Промежуточное соединение j-6 (т.плавления: 207°C) получают способом, аналогичным способу, раскрытому для промежуточного соединения i-13.
Смесь j-6 (0,0003 моль) и никеля Ренея (0,2 г) в насыщенном растворе NH3 в CH3OH (25 мл) гидрируют при комнатной температуре в течение 1 часа и затем фильтруют на целите. Полученный фильтрат выпаривают досуха. Остаток (0,22 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 80/20/2; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,083 г, 49%) растворяют в смеси этанол/2-пропанон и превращают в соль хлористоводородной кислоты. Осадок отфильтровывают и сушат. Остаток кристаллизуют из диизопропилового эфира. Осадок отфильтровывают и сушат, получая 0,08 г гидрохлорида 2-{6-(3-аминопропил)-2-[1-(2-гидроксиэтил)пиперидин-4-иламино]бензоимидазол-1-илметил}-6-метилпиридин-3-ола (соль). (36%, 3,6 HCl, соединение 157, т.плавления: 185°C).
Пример 11
Схема K
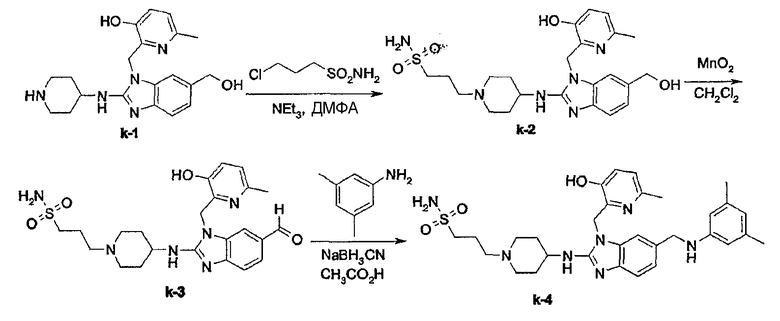
Смесь k-1 (0,0019 моль), 3-хлорпропилсульфонамида (0,0022 моль) и триэтиламина (0,0028 моль) в диметилформамиде (50 мл) перемешивают при 70°C в течение 48 час, выливают в ледяную воду, насыщают K2CO3 (порошок) и экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (1,5 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 85/15/2; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают, получая 0,336 г промежуточного соединения k-2 (36%).
Смесь k-2 (0,0007 моль) и MnO2 (1 г) в CH2Cl2 (30 мл) перемешивают при комнатной температуре в течение 6 час и затем фильтруют на целите. Целит промывают H2O. Растворитель из полученного фильтрата выпаривают досуха, получая 0,33 г промежуточного соединения k-3 (100%). Полученный продукт используют непосредственно на следующей стадии реакции.
CH3CO2H (0,2 мл) добавляют при комнатной температуре к смеси k-3 (0,0004 моль), 3,5-диметиланилина (0,0005 моль) и NaBH3CN (0,0005 моль) в CH3CN (20 мл). Смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют CH3CO2H (0,2 мл). Смесь перемешивают при комнатной температуре в течение 12 час. Растворитель выпаривают досуха. Остаток помещают в CH2Cl2. Органический слой промывают 10% раствором K2CO3 в воде, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,26 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 90/10/1; 5 мкм). Чистые фракции собирают и растворитель выпаривают, получая 0,09 г (32%). Эту фракцию кристаллизуют из смеси CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,083 г амида 2-{4-[6-[(3,5-диметилфениламино)метил]-1-(3-гидрокси-6-метилпиридин-2-илметил)-1H-бензоимидазол-2-иламино]пиперидин-1-ил}этансульфоновой кислоты (30%, соединение 147, т.плавления: 142°C).
Пример 12
Схема L
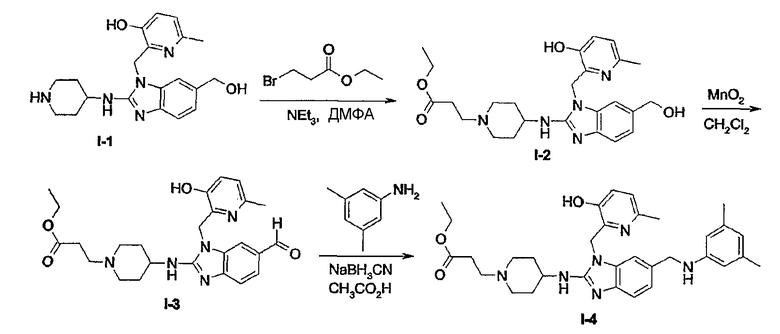
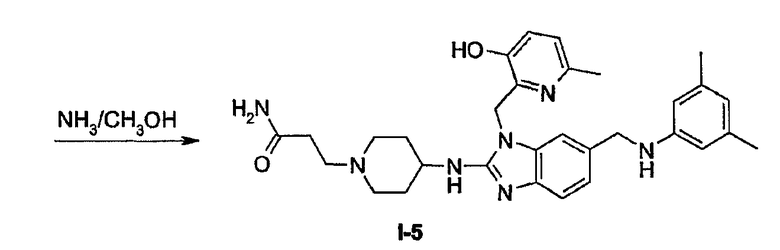
Промежуточное соединение l-2 (т.плавления: 210°C) получают способом, аналогичным способу, раскрытому для промежуточного соединения k-2. Промежуточное соединение l-3 получают способом, аналогичным способу, раскрытому для промежуточного соединения k-3. Промежуточное соединение l-4 получают способом, аналогичным способу, раскрытому для соединения k-4.
Смесь l-4 (0,0003 моль) в 7 н. растворе NH3 в CH3OH (15 мл) перемешивают при 80°C в течение 12 час. Растворитель выпаривают досуха. Остаток (0,21 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 85/14/1; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,057 г, 30%) кристаллизуют из смеси 2-пропанон/CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,05 г 2-{4-[6-[(3,5-диметилфениламино)метил]-1-(3-гидрокси-6-метилпиридин-2-илметил)-1H-бензоимидазол-2-иламино]пиперидин-1-ил}ацетамида (26%, соединение 148, т.плавления: 206°C).
Пример 13
Схема M
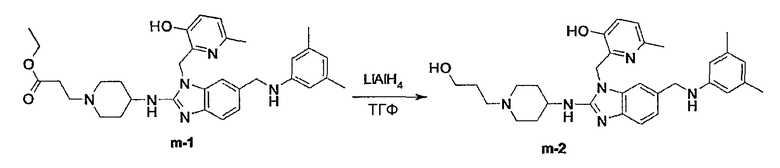
Смесь m-1 (0,0002 моль) в тетрагидрофуране (30 мл) охлаждают до 5°C в токе N2. Добавляют LiAlH4 (0,0007 моль). Смесь перемешивают при 5°C в течение 1 часа и затем перемешивают при комнатной температуре в течение 1 часа. Добавляют минимальное количество Н2О. Добавляют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,16 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 85/15/1; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,073 г, 53%) кристаллизуют из смеси 2-пропанон/CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,064 г 2-{6-[(3,5-диметилфениламино)метил]-2-[1-(2-гидроксиэтил)пиперидин-4-иламино]бензоимидазол-1-илметил}-6-метилпиридин-3-ола (m-2, 46%, соединение 149, т.плавления: 144°C).
Пример 14
Схема N
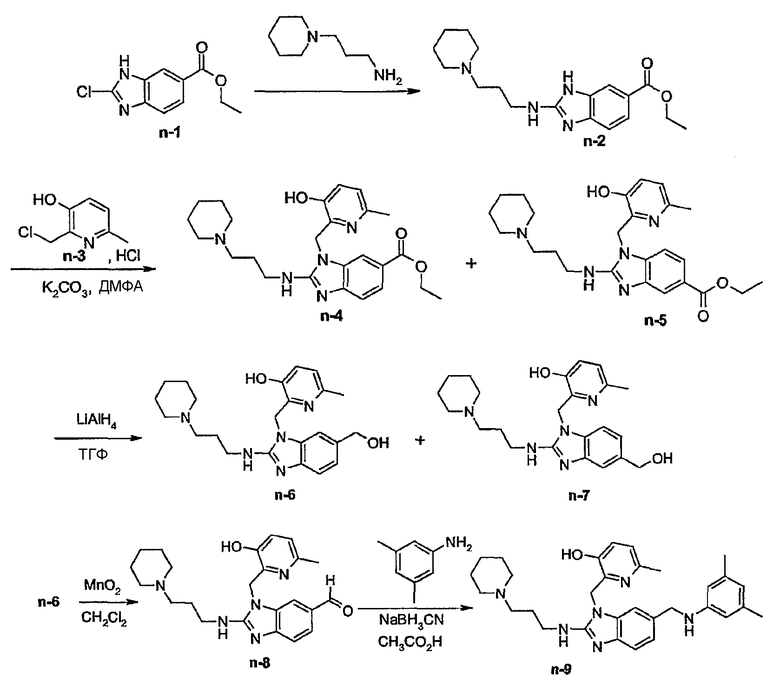
Смесь n-1 (0,022 моль) и N-(пропиламино)пиперидина (0,0207 моль) перемешивают при 140°C в течение 1 часа и затем помещают в смесь CH2Cl2/CH3OH. Органический слой промывают K2CO3 10%, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 92/8/1; 70-200 мкм). Чистые фракции собирают и растворитель выпаривают, получая 2,2 г промежуточного соединения n-2 (30%).
Смесь n-2 (0,0066 моль), n-3 (0,0073 моль) и K2CO3 (0,02 моль) в диметилформамиде (25 мл) перемешивают при комнатной температуре в течение 24 час, выливают в H2O и экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток помещают в смесь CH3CN/диизопропиловый эфир. Осадок фильтруют, промывают H2O и сушат, получая 1,8 г смеси промежуточных соединений n-4 и n-5 (61%).
LiAlH4 (0,012 моль) добавляют порциями к смеси n-4 (0,002 моль) и n-5 (0,002 моль) в тетрагидрофуране (60 мл) при 5°C в токе N2. Смесь перемешивают при 5°C в течение 1 часа, затем при комнатной температуре в течение 12 час. Добавляют минимальное количество Н2О. Добавляют раствор CH2Cl2/CH3OH (90/10). Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (1,65 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 80/20/3; 15-40 мкм). Две фракции собирают и растворитель выпаривают, получая 0,35 г фракции 1 и 0,049 г фракции 2. Фракцию 1 кристаллизуют из смеси 2-пропанон/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая O,33 г промежуточного соединения n-6 (19%, т.плавления: 220°C). Фракцию 2 кристаллизуют из смеси 2-пропанон/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,43 г промежуточного соединения n-7 (26%, т.плавления: 146°C).
Смесь n-6 (0,0006 моль) и MnO2 (0,5 г) в CH2Cl2 (30 мл) перемешивают при комнатной температуре в течение 12 час и затем фильтруют на целите. Целит промывают H2O. Полученный фильтрат выпаривают досуха, получая 0,26 г промежуточного соединения n-8 (100%). Полученное соединение используют непосредственно на следующей стадии реакции.
CH3CO2H (0,3 мл) добавляют к смеси n-8 (0,0006 моль), 3,5-диметиланилина (0,0007 моль) и NaBH3CN (0,0007 моль) в CH3CN (30 мл). Смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют CH3CO2H (0,3 мл). Смесь перемешивают при комнатной температуре в течение 24 час. Растворитель выпаривают досуха. Остаток помещают в смесь 2-пропанон/HCl 5 н/этанол. Смесь перемешивают при 80°C в течение 12 час. Растворитель выпаривают досуха. Смесь экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,39 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 90/10/0,5; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,119 г, 59%) помещают в смесь CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,17 г 2-[6-[(3,5-диметилфениламино)метил]-2-(3-пиперидин-1-илпропиламино)бензoимидазол-1-илметил]-6-метилпиридин-3-ола (n-9, 53%, соединение 170, т.плавления: 161°C).
Пример 15
Схема О
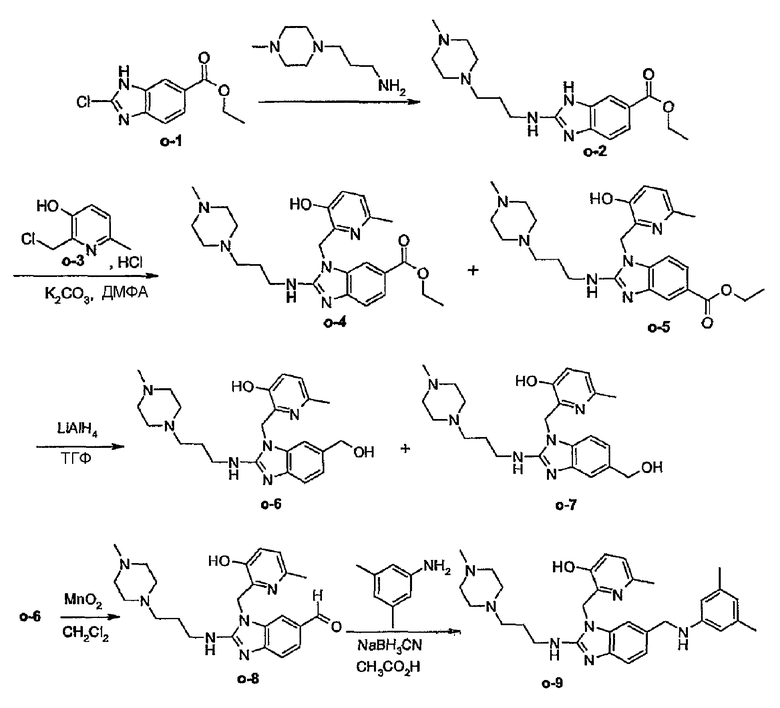
2-{6-[(3,5-диметилфениламино)метил]-2-[3-(4-метилпиперидин-1-ил)пропиламино]бензоимидазол-1-илметил}-6-метилпиридин-3-ол (соединение 171, т.плавления: 150°C) и его промежуточные соединения получают способом, аналогичным способу, раскрытому для получения соединения n-9.
Пример 16
Схема P
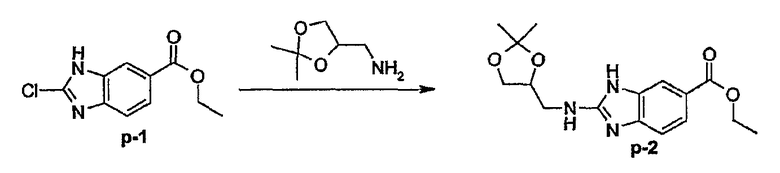
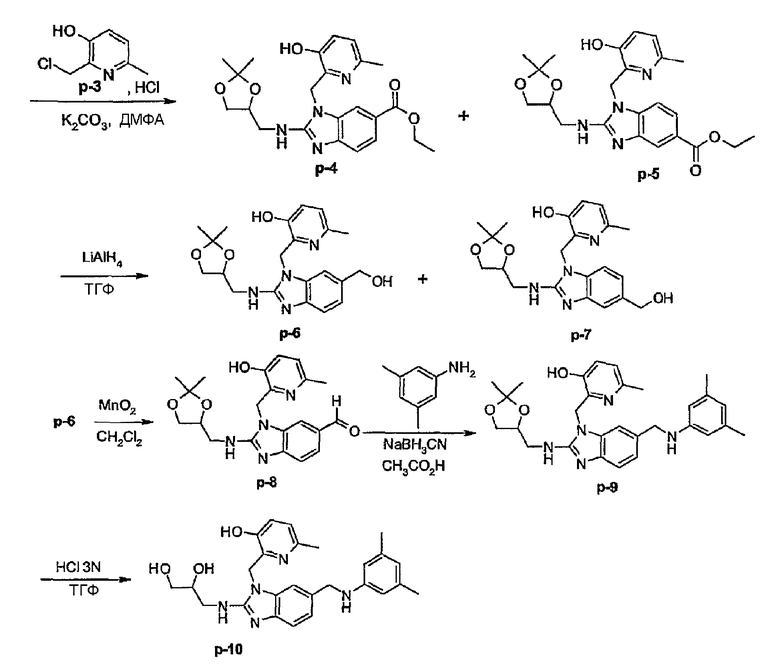
Промежуточное соединение p-9 (т.плавления: 212°C) получают способом, аналогичным способу, раскрытому для соединения n-9.
Смесь p-9 (0,0004 моль) в 3 н. растворе HCl в воде (20 мл) и тетрагидрофурана (20 мл) перемешивают при комнатной температуре в течение 6 час, подщелачивают K2CO3 (порошок) и экстрагируют CH2Cl2. Органический слой выделяют, сушат (над MgSО4), фильтруют и растворитель выпаривают досуха. Остаток (0,25 г) очищают, используя хроматографическую колонку с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH 92/8/0,5; 10 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,17 г, 92%) кристаллизуют из смеси CH3CN/диизопропиловый эфир. Осадок отфильтровывают и сушат, получая 0,127 г 3-[6-[(3,5-диметилфениламино)метил]-1-(3-гидрокси-6-метилпиридин-2-илметил)-1H-бензоимидазол-2-иламино]пропан-1,2-диола (p-10, 69%, соединение 172, т.плавления: 128°C).
Пример 17
Схема Q
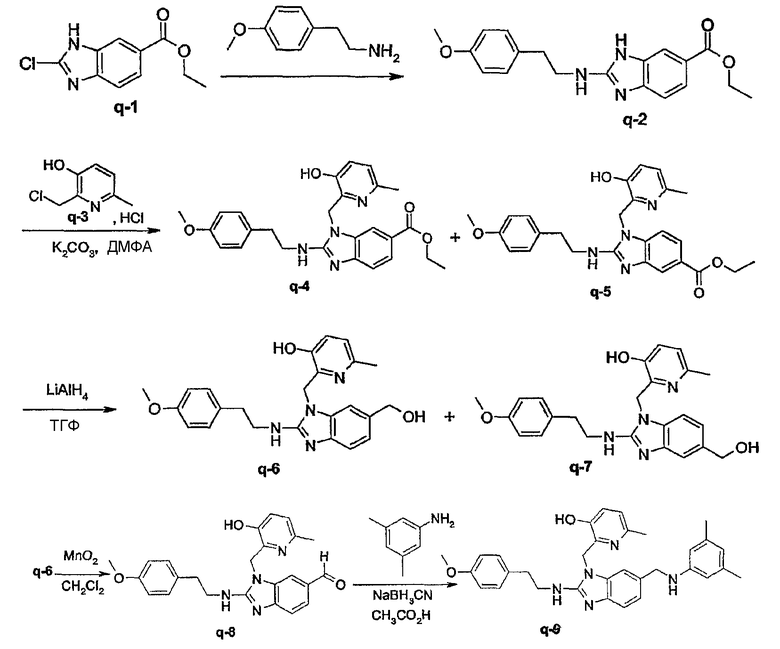
2-{6-[(3,5-диметилфениламино)метил]-2-[2-(4-метоксифенил)этиламино]бензоимидазол-1-илметил}-6-метилпиридин-3-ол (соединение 187, т.плавления: 178°C) и его промежуточные соединения получают способом, аналогичным способу, раскрытому для получения соединения n-9.
В следующих таблицах перечислены соединения, которые получают в соответствии с любым из приведенных выше примеров.
Таблица 1
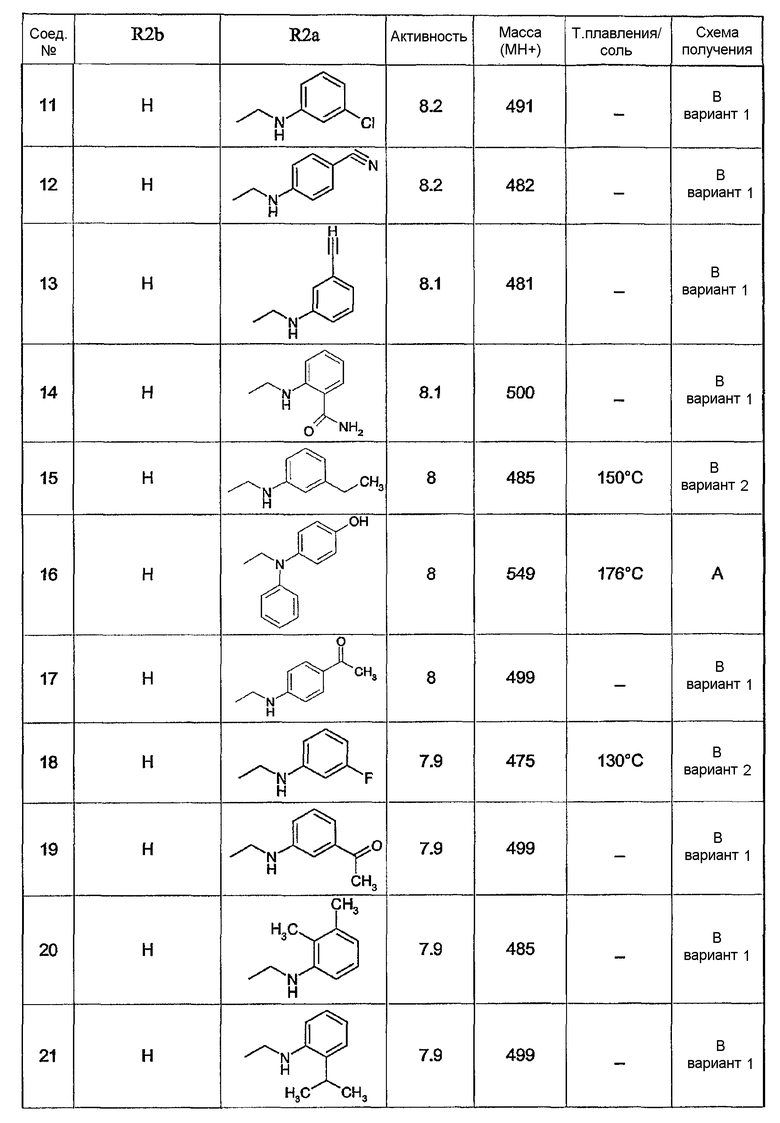
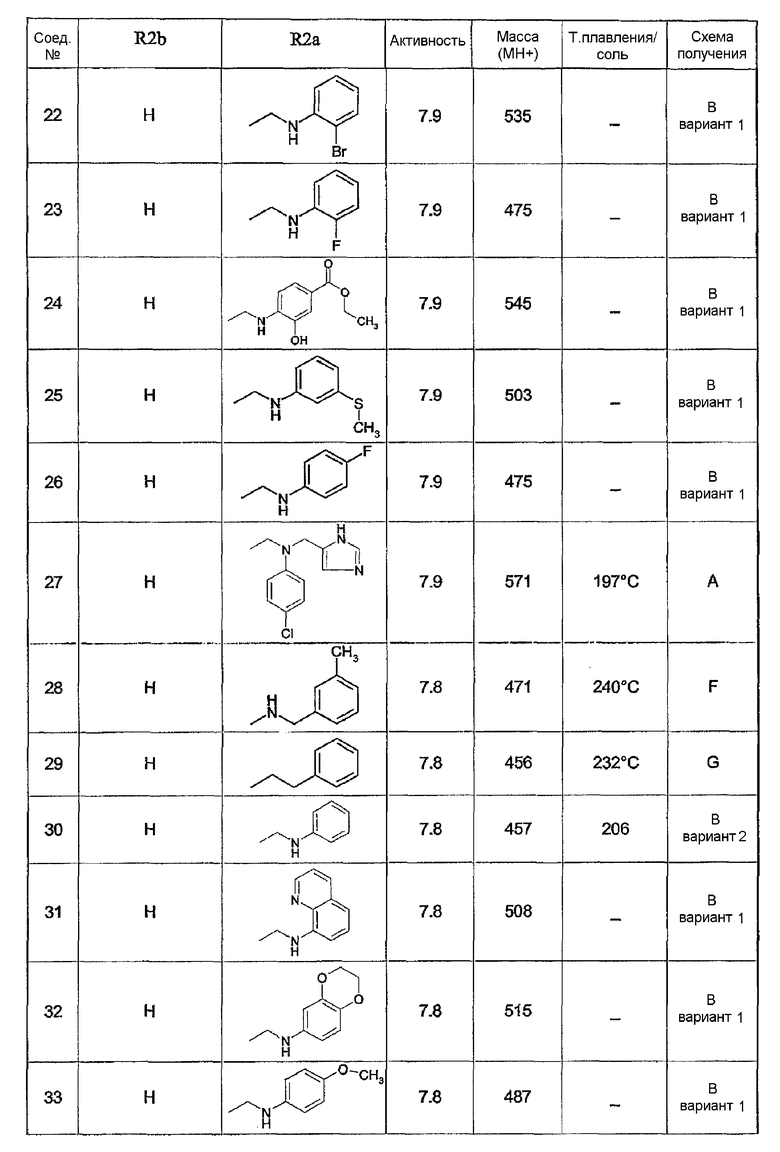
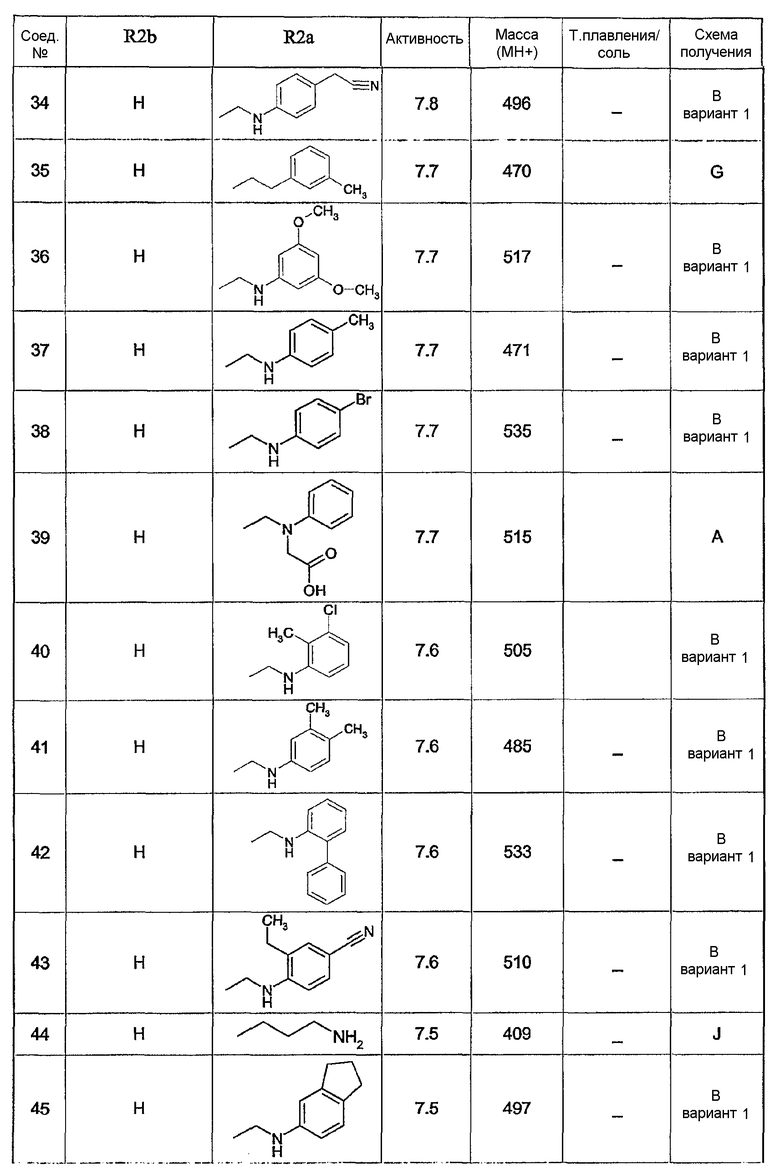
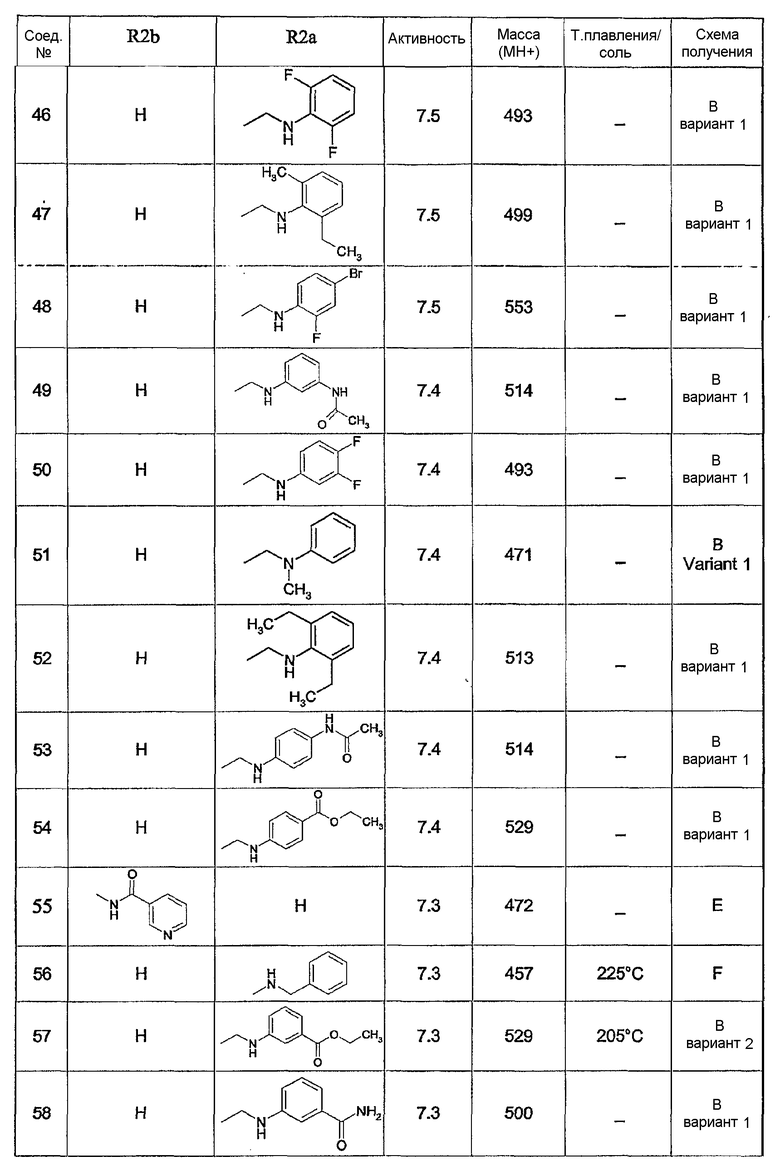
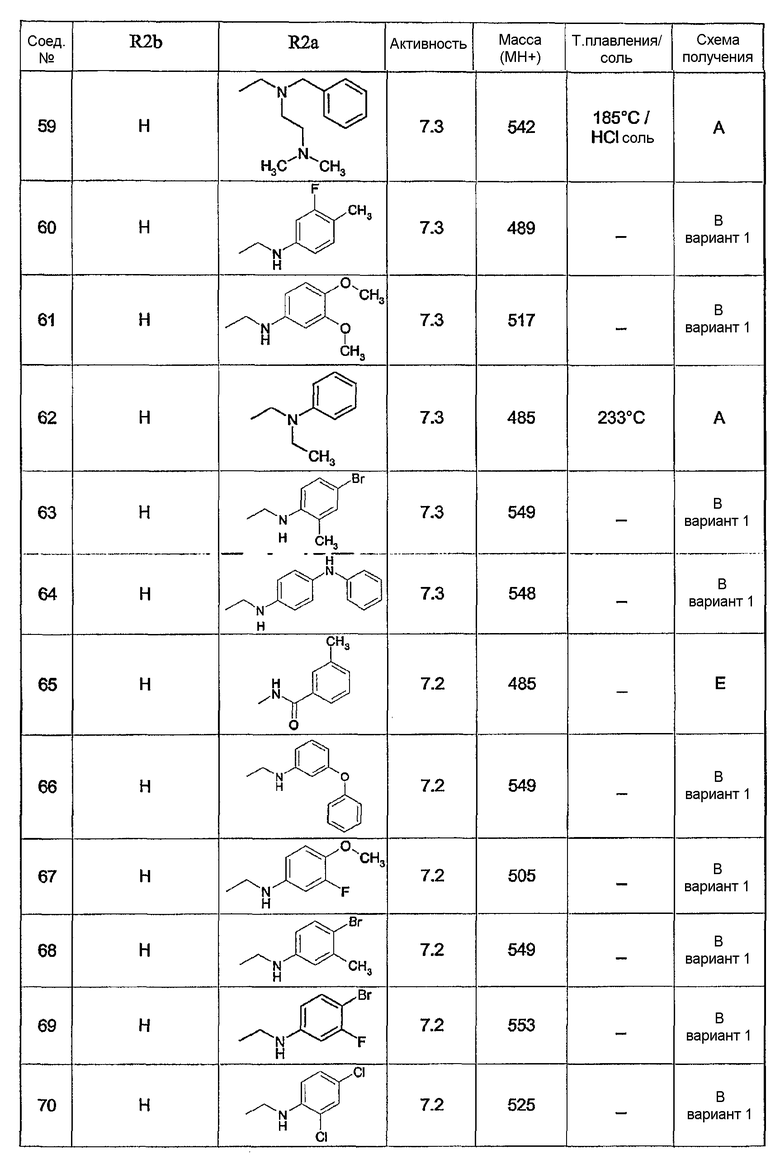
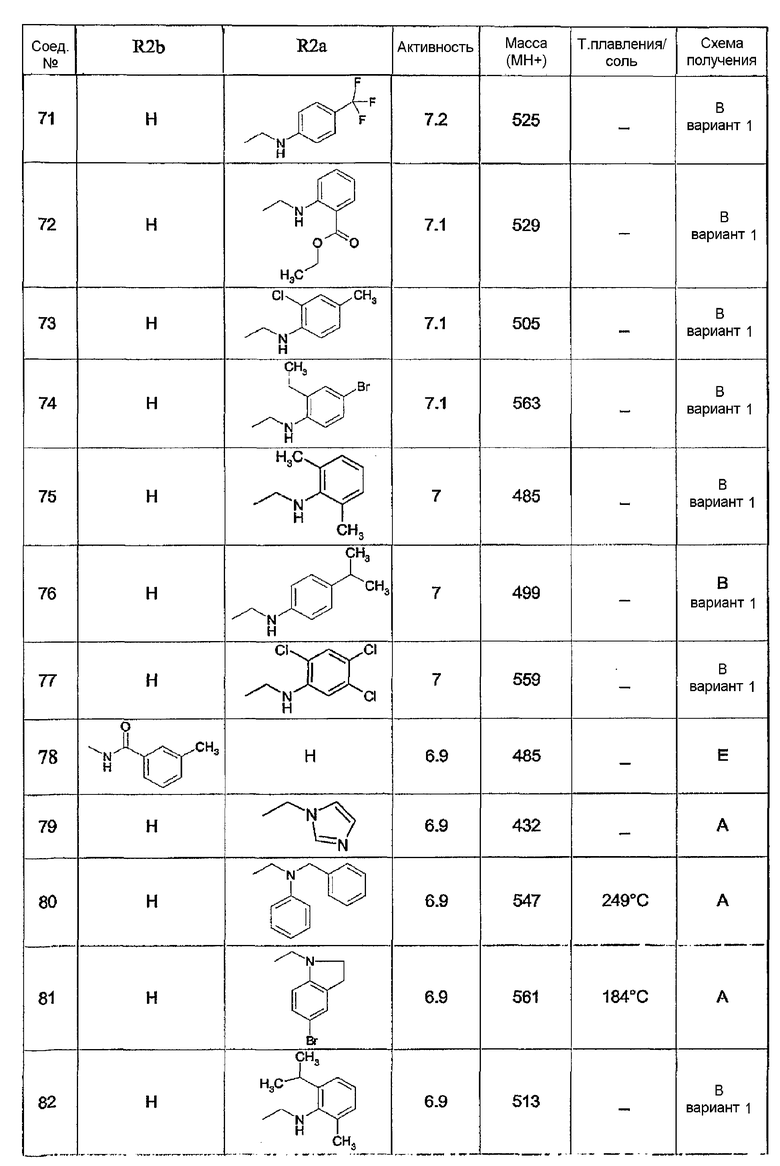
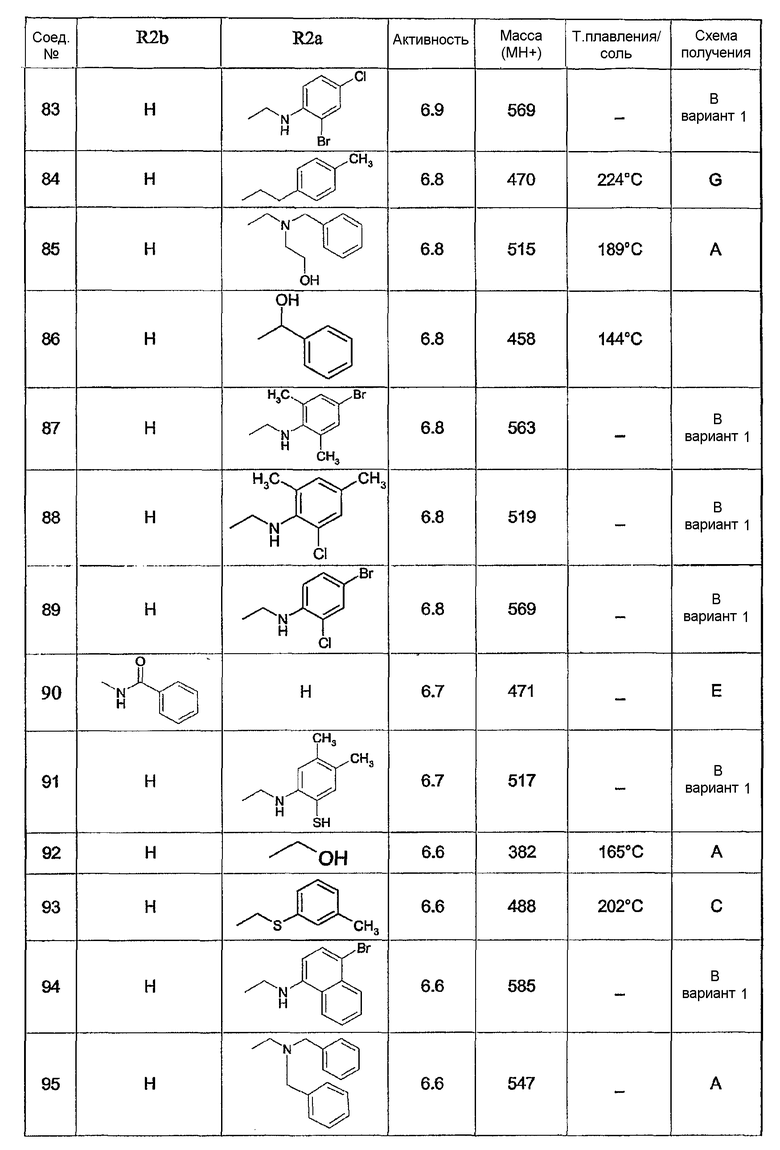
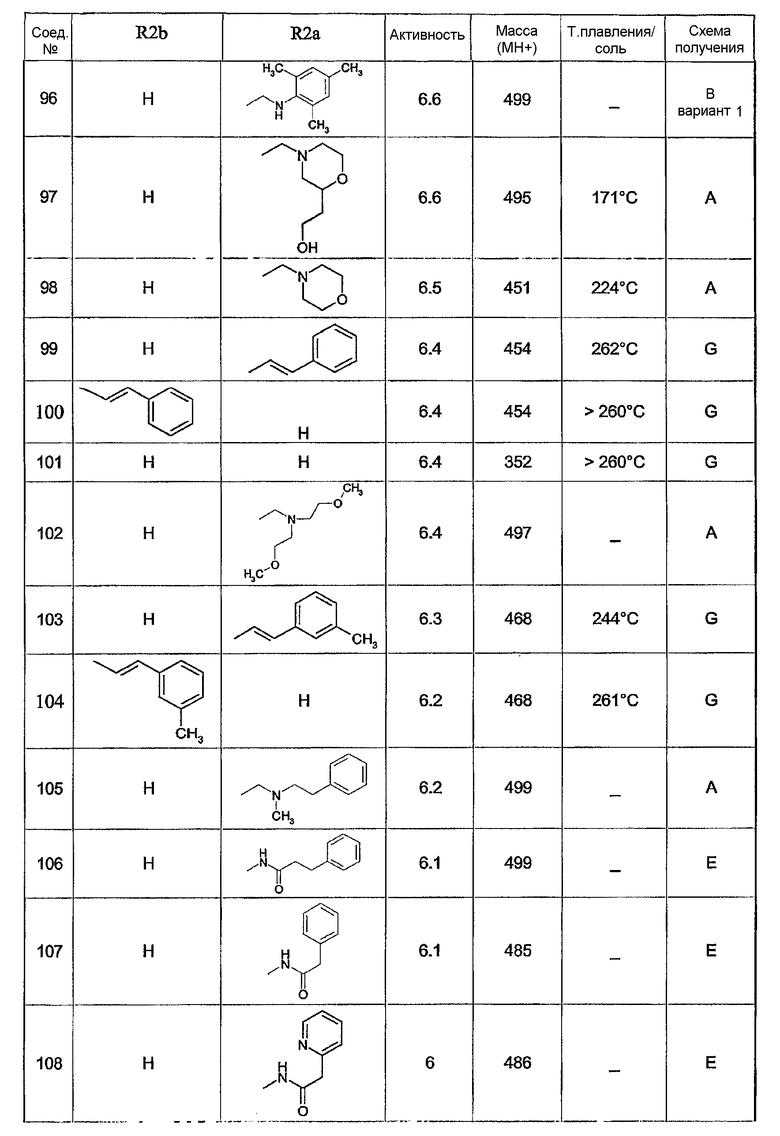
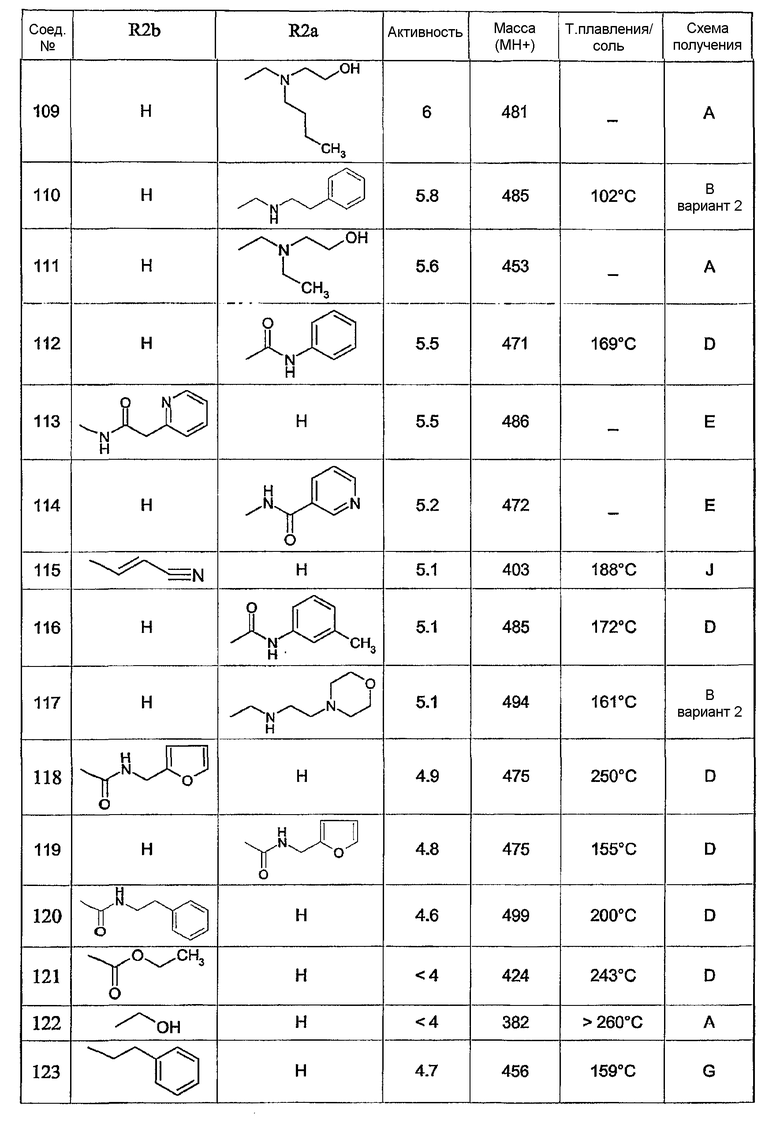
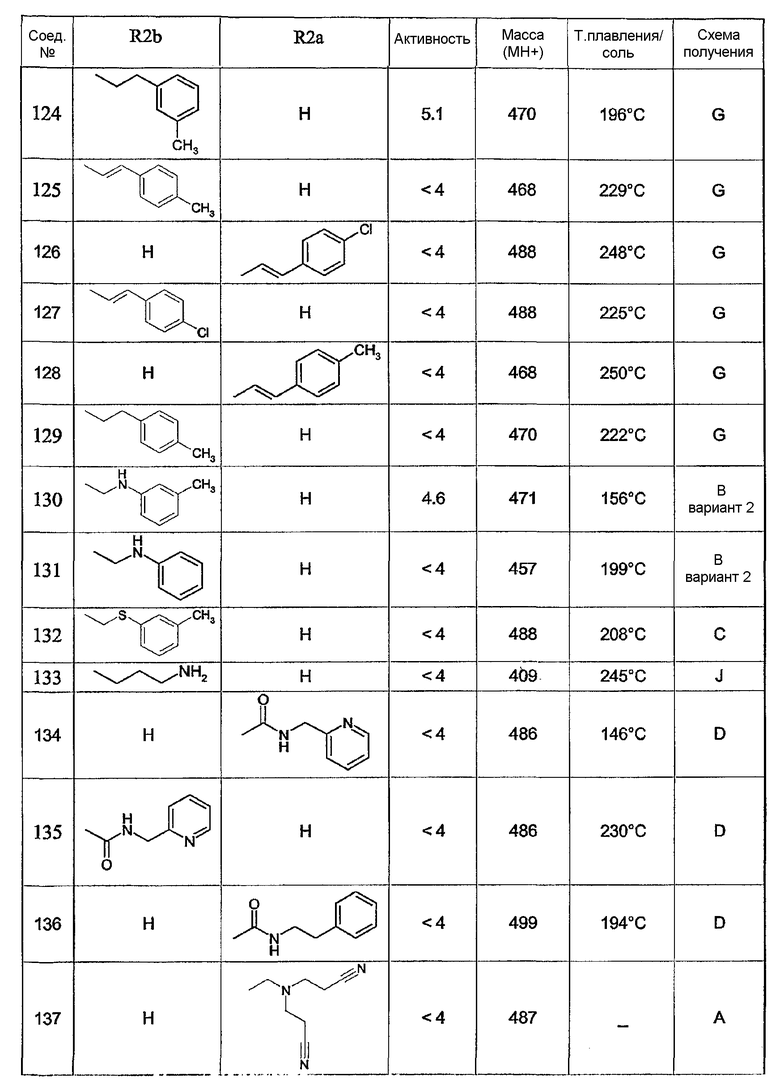
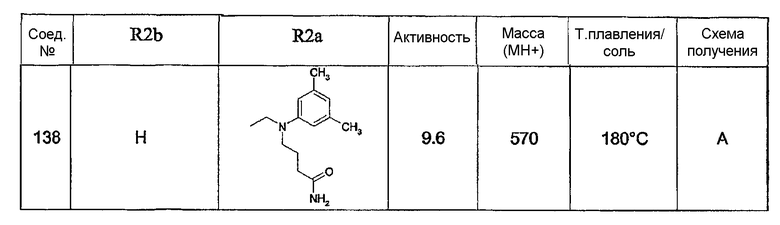
Таблица 2а
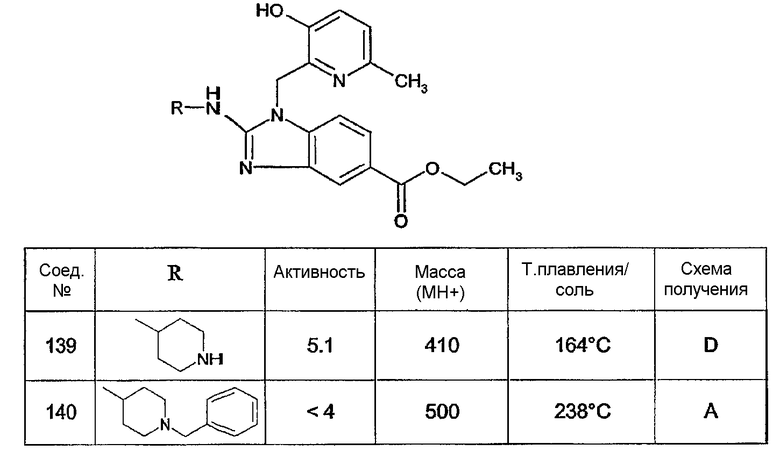
Таблица 2b

Таблица 3
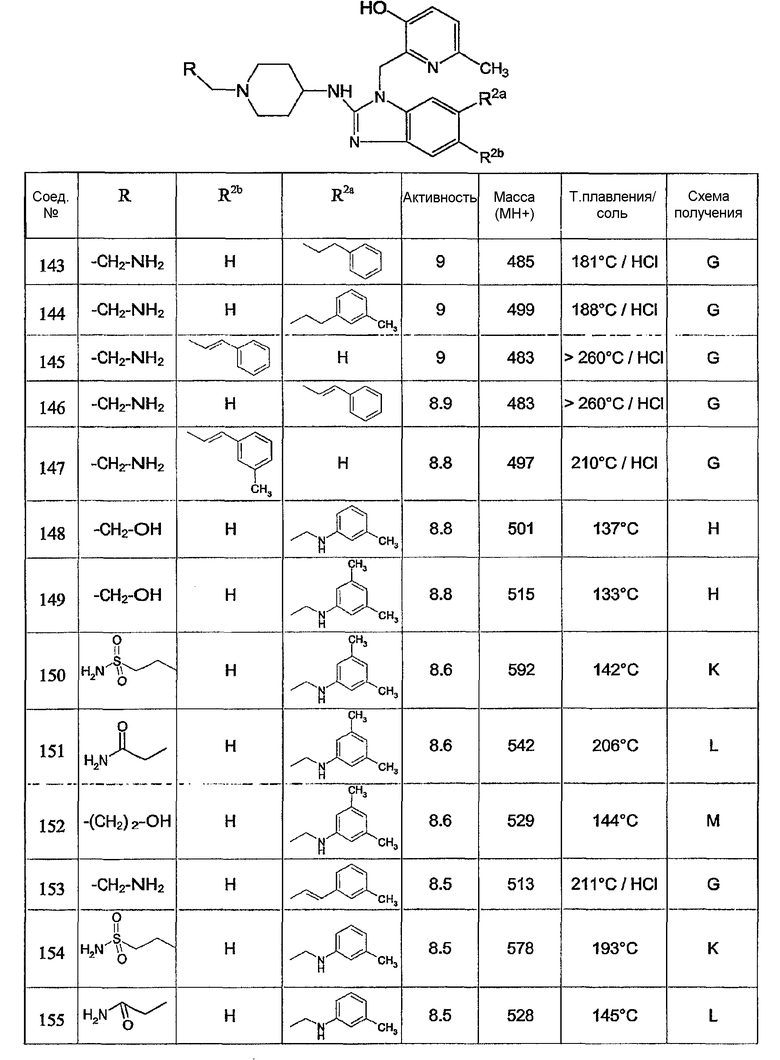
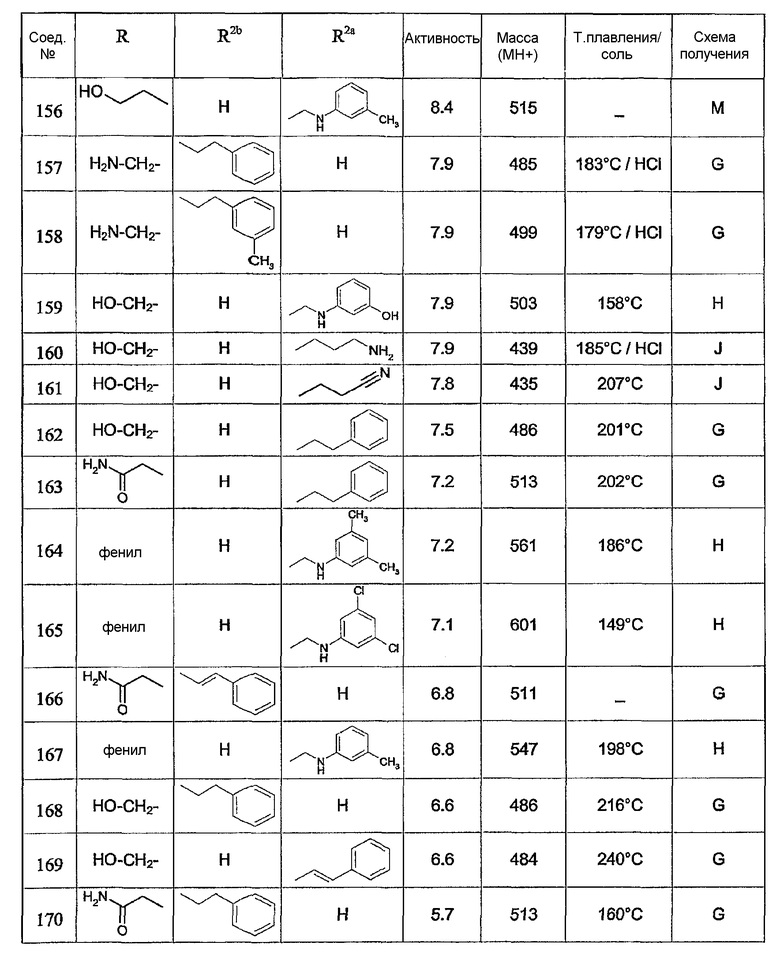
Таблица 4
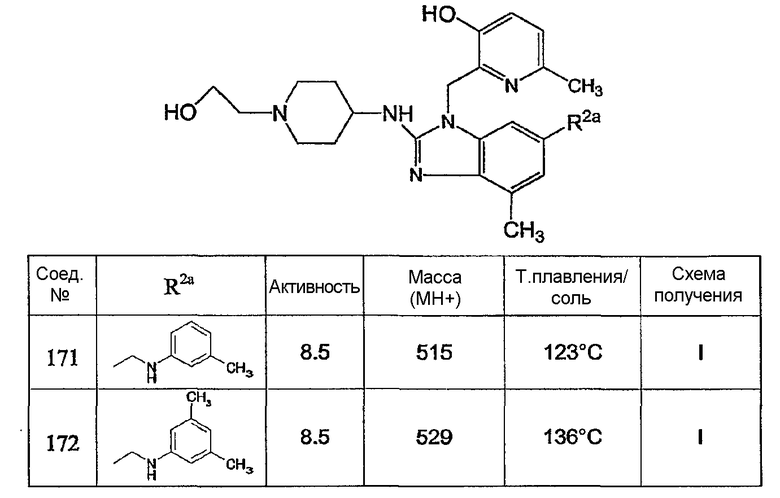
Таблица 5
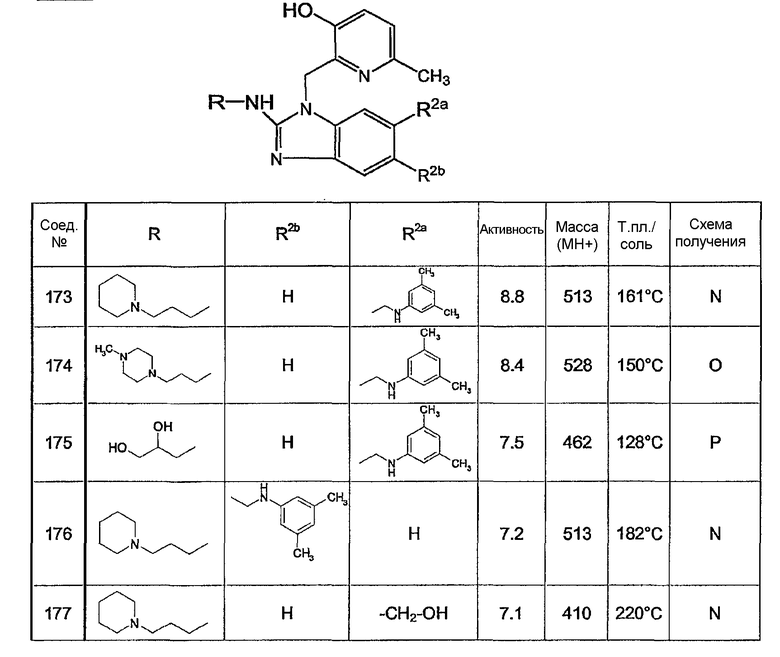
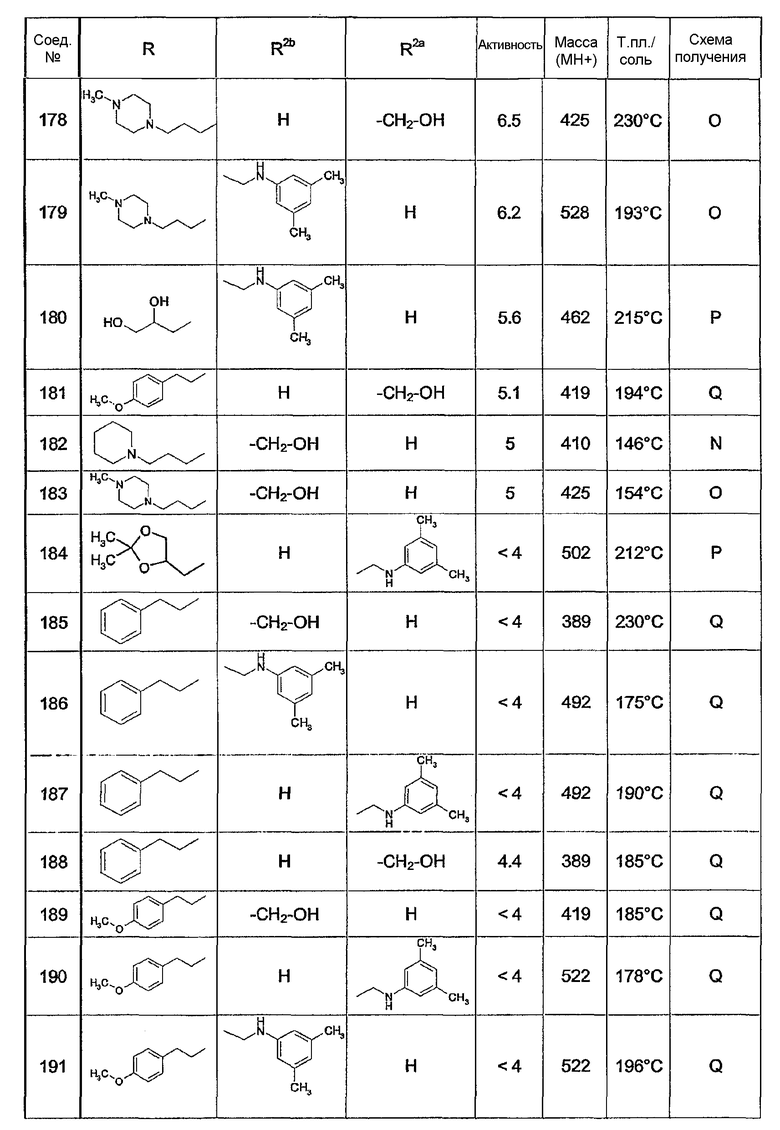
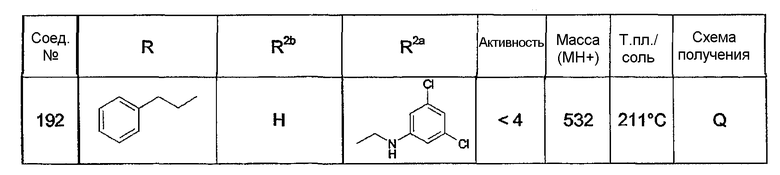
Пример 18: In vitro скринирование в отношении активности против респираторного синцитиального вируса
Процент защиты против цитопатологии, вызываемой вирусами (противовирусная активность или EC50), достигаемый тестовыми соединениями, и их цитотоксичность (CC50), оба, рассчитываются на основании кривых доза-реакции. Селективность противовирусного действия представлена коэффициентом селективности (SI), рассчитанным путем деления CC50 (доза цитотоксичности для 50% клеток) на EC50 (противовирусная активность для 50% клеток). В таблицах в вышеуказанной экспериментальной части перечислены категории, к которым принадлежит каждое из полученных соединений: соединения, принадлежащие к категории активности "A", имеют значение pEC50 (-log EC50, если выразить в молярных единицах), равное или больше, чем 7. Соединения, принадлежащие к категории активности "B", имеют величину pEC50 между 6 и 7. Соединения, принадлежащие к категории активности "С", имеют величину pEC50, равную или меньше 6.
Автоматизированные колориметрические анализы на основе тетразолия используют для определения значений EC50 и CC50 для тестовых соединений. Плоскодонные 96-луночные пластиковые микротитровальные планшеты заполняют 180 мкл минимальной среды Игла, дополненной 5% FCS (0% для FLU) и 20 мM Hepes буфера. Затем исходные растворы (7,8 × конечная тестовая концентрация) соединений добавляют объемами по 45 мкл к серии лунок (по три одинаковых) с тем, чтобы обеспечить одновременную оценку их действия на инфицированные вирусом клетки и на имитационно инфицированные клетки. Осуществляют пять пятикратных разбавлений непосредственно в микротитровальных планшетах, используя робот-систему. Не обработанные вирусом контроли и контрольные HeLa клетки включены в каждый тест. Приблизительно 100 TCID50 респираторного синцитиального вируса добавляют в два из трех рядов в объеме 50 мкл. Такой же объем среды добавляют в третий ряд для определения цитотоксичности соединений при тех же концентрациях, что и были использованы для определения противовирусной активности. После двух часов инкубирования во все лунки добавляют суспензию HeLa клеток (4×105 клеток/мл) в объеме 50 мкл. Культуры инкубируют при 37°C в атмосфере 5% CO2. Через 7 дней после инфицирования спектрофотометрически определяют цитотоксичность и противовирусную активность. В каждую лунку микротитровального планшета добавляют 25 мкл раствора MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид). Планшеты инкубируют далее при 37°C в течение 2 час, после чего среду удаляют из каждой чашки. Солюбилизацию кристаллов формазана обеспечивают, добавляя 100 мкл 2-пропанола. Полного растворения кристаллов формазана достигают после того, как планшеты помещают на планшетный шейкер на 10 минут. И, наконец, считывают поглощение, используя восьмиканальный управляемый компьютером фотометр (Multiskan MCC, Flow Laboratories) на двух длинах волн (540 и 690 нм). Поглощение, измеряемое на 690 нм, автоматически вычитают из поглощения на 540 нм с тем, чтобы исключить эффекты неспецифического поглощения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АМИНОБЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2332414C2 |
| АМИНОБЕНЗИМИДАЗОЛЫ И БЕНЗИМИДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2379302C2 |
| 2-ЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЫ | 2006 |
|
RU2441866C2 |
| ПИПЕРИДИНАМИНОБЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2381224C2 |
| ГЕТЕРОЦИКЛИЛАМИНОАЛКИЛЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЫ | 2006 |
|
RU2419613C2 |
| 1-(2-АМИНО-3-(ЗАМЕЩЕННЫЙ АЛКИЛ)-3Н-БЕНЗИМИДАЗОИЛМЕТИЛ)-3-ЗАМЕЩЕННЫЕ-1,3-ДИГИДРОБЕНЗОИМИДАЗОЛ-2-ОНЫ С АКТИВНОСТЬЮ В ОТНОШЕНИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2006 |
|
RU2434000C2 |
| ВИЧ-ИНГИБИРУЮЩИЕ 5-КАРБО- ИЛИ ГЕТЕРОЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ | 2005 |
|
RU2403244C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА/ПИПЕРАЗИНА | 2008 |
|
RU2478628C2 |
| 5-АМИДО-ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2007 |
|
RU2480464C2 |
| 5-ГЕТЕРОЦИКЛИЛПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2405778C2 |
Настоящее изобретение относится к 5- или 6-замещенным производным бензимидазола, обладающим ингибиторной активностью в отношении репликации респираторных синцитиальных вирусов и имеющим формулу (I), где Q представляет R6a, пиперидинил, замещенный R6; G представляет метилен; R1 представляет пиридил, замещенный 2 заместителями, выбранными из гидрокси, C1-6алкила; один из R2a и R2b представляет цианоС2-6алкенил, Аr3C1-6алкил, Het-C1-6алкил, N(R8aR8b)С1-6алкил, Ar3C2-6алкенил, Аr3аминоС1-6алкил, Het-аминоС1-6алкил, Het-С1-6алкиламиноС1-6алкил, Аr3тиоС1-6алкил, Ar3аминокарбонил, Het-аминокарбонил, Ar3(СН2)nкарбониламино, Het-(СН2)nкарбониламино; и другой из R2a и R2b представляет водород; R3 представляет водород или C1-6алкил; в том случае, если R2a представляет водород, тогда R3 представляет водород; в том случае, если R2b представляет водород, тогда R3 представляет водород или C1-6алкил; R5 представляет водород; R6 представляет C1-6алкил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из NR7aR7b, Ar2, гидрокси, аминокарбонила, аминосульфонила; R6a представляет C1-6алкил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из Ar2, гидрокси или гетероцикла, выбранного из группы, состоящей из пиперидинила, пиперазинила; R7a представляет водород; R7b представляет водород; R8a представляет Ar3, C1-6алкил, гидроксиС1-6алкил, C1-6алкокси C1-6алкил, цианоС1-6алкил, ди(С1-6алкил)аминоС1-6алкил, Аr3C1-6алкил, HetC1-6алкил, аминокарбонилС1-6алкил, карбоксилС1-6алкил; R8b представляет Ar3, C1-6алкил, гидроксиС1-6алкил, Аr3С1-6алкил, HetC1-6алкил; каждый n независимо представляет 1; Ar1 представляет фенил; Ar2 представляет фенил или фенил, замещенный одним C1-6алкилокси; Ar3 представляет фенил, нафталинил, 1,2,3,4-тетрагидронафталинил или инданил, где указанный фенил, нафтил, 1,2,3,4-тетрагидронафталинил или инданил могут необязательно и каждый индивидуально быть замещены одним или более, например, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси, меркапто, циано, C1-6алкила, С2-6алкинила, Ar1, гидроксиС1-6алкила, СF3, цианоС1-6алкила, аминокарбонила, C1-6алкилокси, C1-6алкилтио, Ar1-окси, Аr1-амино, аминосульфонила, аминокарбонилС1-6алкила, С1-4алкилкарбонила, С1-4алкилкарбониламино и С1-4алкоксикарбонила; Het представляет гетероцикл, выбранный из фуранила, имидазолила, морфолинила, пиридила, хинолинила, изохинолинила, причем каждый из указанных гетероциклов может быть необязательно замещен гидроксиС1-6алкилом, а также к его солям присоединения и стереохимически изомерным формам. Кроме того, изобретение относится к фармацевтической композиции на основе соединения формулы I и применению соединения формулы I для получения лекарственного средства. Технический результат: получены новые производные бензимидазола, обладающие полезными биологическими свойствами. 3 н. и 19 з.п. ф-лы, 6 табл.
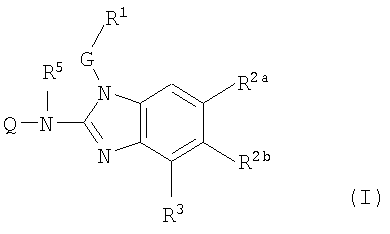
1. Соединение формулы (I):
соль присоединения и стереохимически изомерные формы,
где Q представляет R6a, пиперидинил, замещенный R6;
G представляет метилен;
R1 представляет пиридил, замещенный 2 заместителями, выбранными из гидрокси, C1-6алкила;
один из R2a и R2b представляет цианоС2-6алкенил, Аr3C1-6алкил, Het-C1-6алкил, N(R8aR8b)С1-6алкил, Аr3С1-6алкенил, Аr3аминоС1-6алкил, Het-аминоС1-6алкил, Het-С1-6алкиламиноС1-6алкил, Ar3тиoC1-6aлкил, Ar3aминoкapбoнил, Het-аминокарбонил, Аr3(СH2)nкарбониламино, Het-(СН2)nкарбониламино; и другой из R2a и R2b представляет водород;
R3 представляет водород или C1-6алкил;
в том случае, если R2a представляет водород, тогда R3 представляет водород;
в том случае, если R2b представляет водород, тогда R3 представляет водород или С1-6алкил;
R5 представляет водород;
R6 представляет C1-6алкил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из NR7aR7b, Ar2, гидрокси, аминокарбонила, аминосульфонила;
R6a представляет C1-6алкил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из Ar2, гидрокси или гетероцикла, выбранного из группы, состоящей из пиперидинила, пиперазинила;
R7a представляет водород;
R7b представляет водород;
R8a представляет Ar3, С1-6алкил, гидроксиС1-6алкил, C1-6алкокси C1-6алкил, цианоС1-6алкил, ди(С1-6алкил)аминоС1-6алкил, Аr3C1-6алкил, HetC1-6алкил, аминокарбонилС1-6алкил, карбоксилС1-6алкил;
R8b представляет Ar3, C1-6алкил, гидроксиС1-6алкил, Ar3C1-6алкил, HetC1-6алкил;
каждый n независимо представляет 1;
Ar1 представляет фенил;
Аr2 представляет фенил или фенил, замещенный одним C1-6алкилокси;
Ar3 представляет фенил, нафталинил, 1,2,3,4-тетрагидронафталинил или инданил, где указанный фенил, нафтил, 1,2,3,4-тетрагидронафталинил или инданил могут необязательно и каждый индивидуально быть замещены одним или более, например, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси, меркапто, циано, C1-6алкила, С2-6алкинила, Ar1, гидроксиС1-6алкила, СF3, цианоС1-6алкила, аминокарбонила, C1-6алкилокси, C1-6алкилтио, Аr1-окси, Аr1-амино, аминосульфонила, аминокарбонилС1-6алкила, С1-4алкилкарбонила, С1-4алкилкарбониламино и С1-4алкоксикарбонила;
Het представляет гетероцикл, выбранный из фуранила, имидазолила, морфолинила, пиридила, хинолинила, изохинолинила, причем каждый из указанных гетероциклов может быть необязательно замещен гидроксиС1-6алкилом.
2. Соединение по п.1, где соединение имеет формулу (I-а-1):
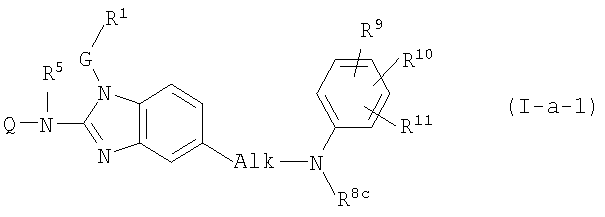
где Q, R5, G и R1 имеют заявленные в п.1 значения; и
Alk представляет C1-6алкандиил;
R8c имеет те же значения, что указаны для R8а, как заявлено в п.1, и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют те же значения, что указаны для заместителей у Аr3, как заявлено в п.1.
3. Соединение по п.1, где соединение имеет формулу (I-b-1):
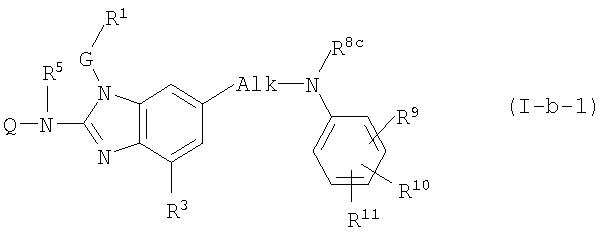
где Q, R5, G и R1 имеют заявленные в п.1 значения; и
Alk представляет C1-6алкандиил;
R8c имеет те же значения, что указаны для R8a, как заявлено в п.1, и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют те же значения, что указаны для заместителей у Аr3, как заявлено в п.1.
4. Соединение по п.1, где соединение имеет формулу (I-c):
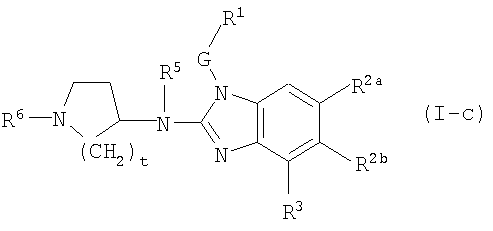
где t=2, G, R1, R2a R2b, R3, R5 и R6 имеют заявленные в п.1 значения.
5. Соединение по п.1, где соединение имеет формулу (I-d-2):
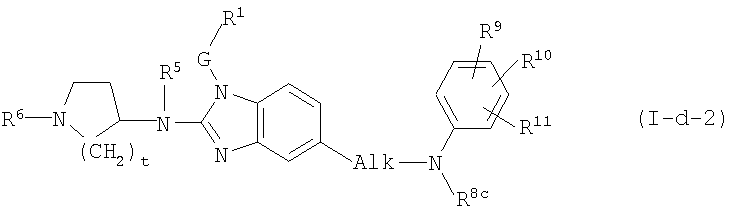
где t=2, R5, R6, G и R1 имеют заявленные в п.1 значения; и
Alk представляет C1-6алкандиил;
R8c имеет те же значения, что указаны для R8a, как заявлено в п.1, и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют те же значения, что указаны для заместителей у Аr3, как заявлено в п.1.
6. Соединение по п.1, где соединение имеет формулу (I-е-2):
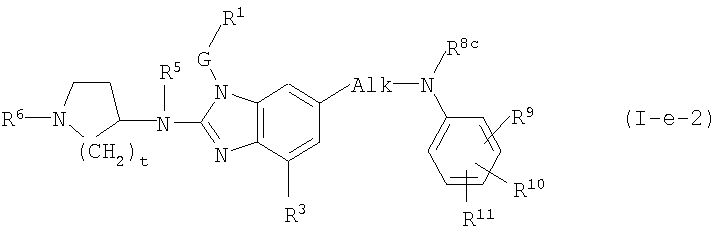
где t=2, R5, R6, G и R1 имеют заявленные в п.1 значения; и
Alk представляет C1-6алкандиил;
R8c имеет те же значения, что указаны для R8а, как заявлено в п.1, и также может представлять водород;
R9, R10, R11 независимо друг от друга имеют те же значения, что указаны для заместителей у Аr3, как заявлено в п.1.
7. Соединение по п.1, где один из R2a и R2b выбирают из цианоС2-6алкенила, Аr3C1-6алкила, Het-C1-6алкила, N(R8aR8b)C1-6алкил, Аr3C2-6алкенила, Аr3аминоС1-6алкила, Het-аминоС1-6алкила, Het-C1-6алкиламиноС1-6алкила, Аr3тиоС1-6алкила, Ar3аминокарбонила, Het-аминокарбонила, Ar3(CH2)nаминокарбонила, Het-(СН2)nаминокарбонила, Ar3кapбoнилaминo; и другой из R2a и R2b представляет водород.
8. Соединение по п.1, где один из R2a и R2b выбирают из Ar3C1-6алкила, Het-C1-6алкила, N(R8aR8b)C1-6алкила, Аr3C2-6алкенила, Ar3аминоС1-6алкила, Het-аминоС1-6алкила, Het-C1-6алкиламиноС1-6алкила, Ar3тиoC1-6алкила, Ar3аминокарбонила, Het-аминокарбонила, Аr3(СН2)nаминокарбонила, Het-(СН2)nаминокарбонила; и другой из R2a и R2b представляет водород.
9. Соединение по п.1, где один из R2a и R2b выбирают из N(R8aR8b)C1-6алкила, Ar3aминoC1-6aлкилa; и другой из R2a и R2b представляет водород.
10. Соединение по п.1, где
в том случае, если R2a представляет водород, тогда R3 представляет водород;
в том случае, если R2b представляет водород, тогда R3 представляет водород или C1-6алкил.
11. Соединение по п.1, где Q представляет R6a, где R6a представляет C1-6алкил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из Аr2, гидрокси или гетероцикла, выбранного из пиперидинила и пиперазинила.
12. Соединение по п.1, где Q представляет R6a, где R6a представляет С1-6алкил, замещенный Ar2 или гидрокси, или C1-6алкил, замещенный двумя гидроксирадикалами, или С1-6алкил, замещенный пиперидинилом, пиперазинилом.
13. Соединение по п.1, где Q представляет пиперидинил, замещенный R6, где R6 представляет C1-6алкил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из NR7aR7b, Ar2, гидрокси, аминокарбонила, аминосульфонила.
14. Соединение по п.1, где Q представляет пиперидинил, замещенный R6, где R6 представляет С1-6алкил, необязательно замещенный NR7aR7b, Ar2, гидрокси, аминокарбонилом, аминосульфонилом, или C1-6алкил, замещенный двумя гидроксирадикалами.
15. Соединение по п.1, где Q представляет пиперидинил, замещенный R6, где R6 представляет C1-6алкил, замещенный Аr2.
16. Соединение по п.13, где Q представляет пиперидинил, замещенный R6.
17. Соединение по п.1, где R8a представляет Аr3, C1-6алкил, гидроксиС1-6алкил, С1-6алкоксиС1-6алкил, цианоС1-6алкил, ди(С1-6алкил)амино-С1-6алкил, Ar3C1-6алкил, Het-C1-6алкил, аминокарбонилС1-6алкил, карбоксилС1-6алкил; и R8b представляет Аr3.
18. Соединение по п.1, где R8a представляет C1-6алкил, гидроксиС1-6алкил, Аr3C1-6алкил, Het-C1-6алкил, аминокарбонил-C1-6алкил; и R8b представляет C1-6алкил, гидроксиС1-6алкил, Ar3C1-6aлкил, Het-C1-6алкил.
19. Соединение по п.1, где Аr3 представляет фенил, необязательно замещенный двумя или тремя заместителями, выбранными из галогена, гидрокси, меркапто, циано, С1-6алкила, С2-6алкинила, Аr1, гидроксиС1-6алкила, СF3, цианоС1-6алкила, аминокарбонила, C1-6алкилокси, C1-6алкилтио, Аr1-окси, Аr1-амино, аминосульфонила, аминокарбонилС1-6алкила, C1-6алкилкарбонила, С1-4алкилкарбониламино или C1-4алкоксикарбонила.
20. Соединение по п.1, где Аr3 представляет фенил, замещенный двумя или тремя заместителями, выбранными из галогена, C1-6алкила или гидроксиС1-6алкила.
21. Фармацевтическая композиция, предназначенная для лечения инфекции, вызванной респираторным синцитиальным вирусом (RSV), включающая фармацевтически приемлемый носитель, и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-20.
22. Применение соединения по любому из пп.1-20 для получения лекарственного средства для ингибирования репликации RSV.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ получения производных 1-алкилзамещенных бензимидазолов | 1988 |
|
SU1637663A3 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2009-10-10—Публикация
2004-12-20—Подача