Настоящее изобретение касается аминобензимидазолов и бензимидазолов, обладающих антивирусной активностью, в частности, обладающих ингибирующей активностью в отношении репликации респираторно-синцитиального вируса (РСВ). Также их получение и композиции, содержащие эти соединения.
Человеческий РСВ или Респираторный Синцитиальный Вирус, совместно с бычьим РСВ, представляет собой огромный РНК-содержащий вирус, член семейства Paramyxoviridae, подсемейства pneumoviridae. Человеческий РСВ является возбудителем спектра заболеваний респираторного тракта у людей всех возрастных категорий по всему миру. Он является основной причиной заболеваний нижнего отдела респираторного тракта в младенчестве и детстве. Более половины всех младенцев имеют контакт с вирусом в свой первый год жизни, и почти все из них в течение первых двух лет жизни. Инфекция у маленьких детей может вызвать повреждение легких, которое сохраняется в течение лет и может позднее влиять на развитие хронического заболевания легких (хроническое свистящее дыхание, астма). Подростки и взрослые часто страдают от (плохой) простуды после инфицирования РСВ. В старости подверженность заболеванию опять возрастает и последствиями РСВ становится ряд вспышек пневмонии, приводящих в старости к значительной смертности.
Инфицирование вирусом данной подгруппы не защищает от последующего инфицирования РСВ-изолятом из этой же подгруппы в следующий зимний период. Реинфицирование РСВ является, таким образом, обычным, несмотря на существование только двух подтипов, А и В.
На сегодняшний день только три лекарства были одобрены для применения против РСВ-инфекции. Первым является рибавирин, аналог нуклеозидов, обеспечивает лечение с помощью аэрозоля выраженной РСВ-инфекции у госпитализированных детей. Аэрозольный путь введения, токсичность (риск тератогенности), стоимость и в высокой степени варьирующая эффективность ограничивают его применение. Два других лекарства, RespiGam® и паливизумаб, иммуностимуляторы в виде поликлональных и моноклональных антител, предназначены для использования в качестве профилактических средств.
Другие попытки разработать безопасную и эффективную РСВ-вакцину в настоящее время претерпели неудачу. Инактивированные вакцины не могли защитить от заболевания, и, в действительности, в некоторых случаях усиливали заболевание во время последующего инфицирования. Живые аттенуированные вакцины применялись с ограниченным успехом. Очевидно, существует потребность в эффективном и простом в применении лекарстве против репликации РСВ.
Ранее бензимидазолы и имидазопиридины в качестве ингибиторов репликации РСВ были описаны в WO 01/00611, WO 01/00612 и WO 01/00615.
Настоящее изобретение относится к ингибиторам репликации РСВ, которые представлены формулой (I)

их пролекарствам, N-оксидам, аддитивным солям, четвертичным аминам, комплексам с металлами и стереохимически изомерным формам, где
G представляет собой прямую связь или С1-10алкандиил, необязательно замещенный одним или более заместителями, независимо выбранными из группы заместителей, состоящих из гидрокси, С1-6алкилокси, Ar1С1-6алкилокси, С1-6алкилтио, Ar1С1-6алкилтио, НО(-СН2-СН2-О)n-, С1-6алкилокси(-СН2-СН2-О)n- или Ar1С1-6алкилокси(-СН2-СН2-О)n-;
каждый n независимо равен 1, 2, 3 или 4;
R1 представляет собой Ar1 или моноциклический или бициклический геторицикл, выбранный из пиперидинила, пиперазинила, пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тетрагидрофуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, хинолинила, хиноксалинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензтиазолила, пиридопиридила, нафтиридинила, 1H-имидазо[4,5-b]пиридинила, 3H-имидазо[4,5-b]пиридинила, имидазо[1,2-а]пиридинила, 2,3-дигидро-1,4-диоксино[2,3-b]пиридила или радикала формулы

где каждый из указанных моноциклических или бициклических гетероциклов может быть необязательно замещен одним или, где возможно, большим количеством заместителей, например, 2, 3, 4 или 5, независимо выбранными из группы заместителей, состоящих из гало, гидрокси, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилтио, С1-6алкилоксиС1-6алкила, Ar1, Ar1С1-6алкила, Ar1С1-6алкилокси, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалоС1-6алкила, С1-6алкилкарбониламино, С1-6алкил-SO2-NR5c, Ar1-SO2-NR5c-, С1-6алкилоксикарбонила, -С(=0)-NR5cR5d, НО(-СН2-СН2-О)n-, гало(-СН2-СН2-О)n-, С1-6алкилокси(-СН2-СН2-О)n-, Ar1С1-6алкилокси(-СН2-СН2-О)n- и моно- или ди(С1-6алкил)амино(-СН2-СН2-О)n-;
каждый m независимо равен 1 или 2;
каждый p независимо равен 1 или 2;
каждый t независимо равен 0, 1 или 2;
Q представляет собой водород, амино или моно- или ди(С1-4алкил)амино;
один из R2а и R3а выбирают из гало, необязательно моно- или полинасыщенного С1-6алкила, необязательно моно- или полинасыщенного С2-6алкенила, нитро, гидрокси, Ar2, N(R4аR4b), N(R4аR4b)сульфонила, N(R4аR4b)карбонила, С1-6алкилокси,
Ar2окси, Ar2С1-6алкилокси, карбоксила, С1-6алкилоксикарбонила, или -С(=Z)Ar2; и другой из R2а и R3а является водородом;
где
- =Z представляет собой =О, =СН-С(=0)-NR5аR5b, =СН2, =СН-С1-6алкил, =N-OH или =N-O-С1-6алкил; и
- необязательные заместители С1-6алкила и С2-6алкенила могут быть одинаковыми или отличаться один относительно другого, и каждый независимо выбран из группы заместителей, состоящих из гидрокси, циано, гало, нитро, N(R4аR4b), N(R4аR4b)сульфонила, Het, Ar2, С1-6алкилокси, С1-6алкил-S-(=O)t, Ar2окси, Ar2-S-(=O)t, Ar2С1-6алкилокси, Ar2С1-6алкил-S-(=O)t, Het-окси, Het-S-(=O)t, HetС1-6алкилокси, HetС1-6алкил-S-(=O)t, карбоксила, С1-6алкилоксикарбонила и -С(=Z)Ar2;
в случае, когда R2а отличается от водорода, тогда R2b представляет собой водород, С1-6алкил или галоген и R3b представляют собой водород;
в случае, когда R3а отличается от водорода, тогда R3b представляет собой водород, С1-6алкил или галоген и R2b представляют собой водород;
R4а и R4b могут быть одинаковыми или отличаться один относительно другого, и каждый независимо выбран из группы заместителей, состоящих из водорода, С1-6алкила, Ar2С1-6алкила, (Ar2)(гидрокси)С1-6алкила, Het-С1-6алкила, гидроксиС1-6алкила моно- и ди(С1-6алкилокси)С1-6алкила,
(гидроксиС1-6алкил)оксиС1-6алкила, Ar1С1-6алкилоксиС1-6алкила, дигидроксиС1-6алкила, (С1-6алкилокси)(гидрокси)С1-6алкила, (Ar1С1-6алкилокси)(гидрокси)С1-6алкила, Ar1окси-С1-6алкила, (Ar1окси)(гидрокси)С1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)аминоС1-6алкила, карбоксилС1-6алкила, С1-6алкилоксикарбонилС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила, С1-6алкилкарбонилС1-6алкила, (С1-4алкилокси)2-Р(=О)-С1-6алкила, (С1-4алкилокси)2-Р(=О)-О-С1-6алкила, аминосульфонилС1-6алкила, моно- и ди(С1-6алкил)аминосульфонилС1-6алкила, С1-6алкилкарбонила, Ar2карбонила, Het-карбонила, Ar2С1-6алкилкарбонила, Het-С1-6алкилкарбонила, С1-6алкилсульфонила, аминосульфонила, моно- и ди(С1-6алкил)аминосульфонила, Ar2сульфонила, Ar2С1-6алкилсульфонила, Ar2, Het, Het-сульфонила, HetС1-6алкилсульфонила;
R5а и R5b могут быть одинаковыми или отличаться один относительно другого, и каждый независимо представляет собой водород или С1-6алкил; или
R5а и R5b вместе могут образовывать двухвалентный радикал формулы -(СН2)s-, где s равен 4 или 5;
R5с и R5d могут быть одинаковыми или отличаться один относительно другого, и каждый независимо представляет собой водород или С1-6алкил; или
R5c и R5d вместе могут образовывать двухвалентный радикал формулы -(СН2)s-, где s равен 4 или 5;
R6а представляет собой водород, С1-6алкил, Ar1, Ar1С1-6алкил, С1-6алкилкарбонил, Ar1карбонил, Ar1С1-6алкилкарбонил, С1-6алкилсульфонил, Ar1сульфонил, Ar1С1-6алкилсульфонил, С1-6алкилоксиС1-6алкил, аминоС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, гидроксиС1-6алкил, (карбоксил)С1-6алкил, (С1-6алкилоксикарбонил)С1-6алкил, аминокарбонилС1-6алкил, моно- и ди(С1-6алкил)аминокарбонилС1-6алкил, аминосульфонилС1-6алкил, моно- и ди(С1-6алкил)аминосульфонил-С1-6алкил, Het, Het-С1-6алкил, Het-карбонил, Het-сульфонил, Het-С1-6алкилкарбонил;
R6b представляет собой водород, С1-6алкил, Ar1 или Ar1С1-6алкил;
R6с представляет собой С1-6алкил, Ar1 или Ar1С1-6алкил;
Ar1 представляет собой фенил или фенил, замещенный одним или более, например, 2, 3 или 4 заместителями, выбранными из гало, гидрокси, гидроксиС1-6алкила, полигалоС1-6алкила, и С1-6алкилокси;
Ar2 представляет собой фенил, фенил аннелированный с С5-7циклоалкилом, или фенил, замещенный одним или более, например, 2, 3, 4 или 5, заместителями, выбранными из гало, циано, С1-6алкила, Het-С1-6алкила, Ar1С1-6алкила, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, R6b-О-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-О-С3-6алкинила, Ar1, Het, R6b-О-, R6b-S-, R6с-SO-, R6с-SO2-, R6b-О-С1-6алкил-SO2-, N(R6аR6b), полигалоС1-6алкила, полигалоС1-6алкилокси, полигалоС1-6алкилтио, R6с-С(=О)-, R6b-О-С(=О)-, N(R6аR6b)-С(=О)-, R6b-О-С1-10алкила, R6b-S-С1-6алкила, R6с-S(=О)2-С1-6алкила, N(R6аR6b)-С1-6алкила, R6с-С(=О)-С1-6алкила, R6b-О-С(=О)-С1-6алкила, N(R6аR6b)-С(=О)-С1-6алкила, R6с-С(=О)-NR6b-, R6с-С(=О)-О-, R6с-С(=О)-NR6b-С1-6алкила, R6с-С(=О)-О-С1-6алкила, N(R6аR6b)-S(=О)2-, H2N-C(=NH)-;
Het представляет собой гетероцикл, выбранный из тетрагидрофуранила, тетрагидротиенила, пирролидинила, пирролидинонила, фуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, тиадиазолила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, пиридила, пиразинила, пиридазинила, пиримидинила, тетрагидрохинолинила, хинолинила, изохинолинила, бензодиоксанила, бензодиоксолила, индолинила, индолила, каждый из указанных гетероциклов может быть необязательно замещен оксо, амино, Ar1, С1-4алкилом, аминоС1-4алкилом, Ar1С1-4алкилом, моно- или ди(С1-6алкил)аминоС1-6алкилом, моно-, или ди(С1-6алкил)амино, (гидроксиС1-6алкил)амино, и необязательно дополнительно одним или двумя С1-4алкильными радикалами.
Кроме того, изобретение касается применения соединения формулы (I), или пролекарства, N-оксида, аддитивной соли, четвертичного амина, комплекса с металлом и его стереохимически изомерной формы для получения лекарственного средства для ингибирования репликации РСВ. Также данное изобретение касается способа ингибирования репликации РСВ у теплокровного животного, включающий введение эффективного количества соединения формулы (I) или пролекарства, N-оксида, аддитивной соли, четвертичного амина, комплекса с металлом и их стереохимически изомерной формы.
В дополнительном аспекте данное изобретение относится к новым соединениям формулы (I), а также к способам их получения.
Термин «пролекарство», используемый в данном описании, подразумевает фармакологически приемлемые производные, например сложные эфиры и амиды, так что получаемый в результате биотрансформации продукт производных представляет собой активное лекарство, как определено в соединениях формулы (I). Работа авторов Goodman и Gilman (The Pharmacological Basis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, «Biotransformation of Drugs», p. 13-15) описывает в основном, пролекарства, которые включены в данный документ. Пролекарства характеризуются растворимостью в воде и биодоступностью, и легко метаболизируются в активные ингибиторы in vivo.
Термины «полизамещенный С1-6алкил» и «полизамещенный С2-6алкенил», используемые, например, в определении R2а и R3а, подразумевают включение С1-6алкильных радикалов, имеющих два или более заместителя, например два, три, четыре, пять или шесть заместителей, в частности, два или три заместителя, дополнительно, в частности, два заместителя. Верхний предел числа заместителей определяется числом атомов водорода, которые могут быть замещены, также как и основными свойствами заместителей, например их объемностью, эти свойства позволяют квалифицированному специалисту определить указанный верхний предел.
Термин «С1-10алкандиил, необязательно замещенный одним или более заместителями», используемый в определении G, подразумевает то, что он включает
С1-10алкандиильные радикалы, не имеющие, имеющие один, два или более заместителей, например 0, один, два, три, четыре, пять или шесть заместителей, в частности 0, один, два или три заместителя, дополнительно, в частности 0, один или два заместителя. Также здесь верхний предел числа заместителей определяется факторами, указанными выше.
Ранее здесь и далее используется термин «полигалоС1-6алкил» в качестве группы или части группы, например, в полигалоС1-6алкилокси, определено как моно- или полигало, замещенный С1-6алкил, в частности С1-6алкил, замещенный атомами в количестве до одного, двух, трех, четырех, пяти, шести или более атомов галогена, например метил или этил одним или более атомами фтора, например дифторметил, трифторметил, трифторэтил. Также включены перфторС1-6алкильные группы, которые являются С1-6алкильными группами, в которых все водородные атомы замещены атомами фтора, например пентафторэтил. В случае более одного атома галогена, связанного с алкильной группой в пределах определения полигалоС1-4алкила, атомы галогена могут быть одинаковыми или отличаться.
Каждый из моноциклических или бициклических гетероциклов в определении R1 может необязательно быть замещен одним или, где возможно, большим количеством заместителей, например 2, 3, 4, или 5. В частности, указанные гетероциклы могут необязательно быть замещенными заместителями в количестве до 4, 3, 2 или 1.
Каждый из Ar1 или Ar2 может быть незамещенным фенилом или фенилом, замещенным 1 или более заместителями, например 5 или 4 заместителями или, что предпочтительно, заместителями в количестве до 3-х, или до двух, или одним заместителем.
Радикалы «R6b-О-С3-6алкенил» или «R6b-О-С3-6алкинил», например, упомянутые среди заместителей Ar2, в частности, имеют R6b-О-группу на насыщенном атоме углерода.
Группа гидроксиС1-6алкил при замещении атомом кислорода или атомом азота, предпочтительно, является гидроксиС1-6алкильной группой, где гидроксигруппа и кислород или азот разделены, по меньшей мере, двумя атомами углерода.
ДигидроксиС1-6алкильная группа, как упомянуто, например, в определении R4а и
R4b, представляет собой С1-6алкильную группу, имеющую два гидроксизаместителя, которая, в частности, замещена по разным атомам углерода. Термины (С1-6алкилокси)(гидрокси)С1-6алкил, ди(С1-6алкилокси)С1-6алкил, (Ar1С1-6алкилокси)(гидрокси)С1-6алкил относятся к С1-6алкилу, замещенному также
С1-6алкилоксигруппой и гидроксигруппой, двумя С1-6алкилоксигруппами и Ar1С1-6алкилокси и гидроксигруппой, соответственно. Предпочтительно, в этих радикалах заместители в С1-6алкильной группе по углеродному атому отличны от углерода, связанного с азотом, с которым связаны R4а и/или R4b.
Используемый здесь термин С1-3алкил в качестве группы или части группы подразумевает прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 1 до 3 атомов углерода, например метил, этил, пропил, 1-метилэтил и тому подобные; С1-4алкил в качестве группы или части группы подразумевает прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 1 до 4 атомов углерода, например группа, определенная для
С1-3алкила и бутила, и тому подобные; С2-4алкил в качестве группы или части группы подразумевает прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 2 до 4 атомов углерода, например, этил, пропил, 1-метилэтил, бутил и тому подобные; С1-6алкил в качестве группы или части группы подразумевает прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 1 до 6 атомов углерода, например группы, определенные для С1-4алкила и пентил, гексил, 2-метилбутил и подобные; С1-9алкил в качестве группы или части группы подразумевает прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 1 до 9 атомов углерода, например те группы, что определены для С1-6алкила, и гептил, октил, нонил, 2-метилгексил, 2-метилгептил и подобные;
С1-10алкил в качестве группы или части группы подразумевает прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 1 до 10 атомов углерода, например, те группы, что определены для С1-9алкила и децила, 2-метилнонил и подобные.
Подразумевается, что используемый здесь термин «С3-6алкенил» в качестве группы или части группы, включает прямую или разветвленную цепь ненасыщенных углеводородных радикалов, имеющих, по крайней мере, одну двойную связь, и предпочтительно имеющих одну двойную связь, и от 3 до 6 атомов углерода, например, пропенил, бутен-1-ил, бутен-2-ил, пентен-1-ил, пентен-2-ил, гексен-1-ил, гексен-2-ил, гексен-3-ил, 2-метилбутен-1-ил и тому подобные. Подразумевается, что используемый здесь термин «С2-6алкенил» в качестве группы или части группы, включает С3-6алкенильные группы и этилен. Термин «С3-6алкинил» подразумевает прямую или разветвленную цепь ненасыщенных углеводородных радикалов, имеющих одну тройную связь, и от 3 до 6 атомов углерода, например, пропенил, бутин-1-ил, бутин-2-ил, пентин-1-ил, пентин-2-ил, гексин-1-ил, гексин-2-ил, гексин-3-ил, 2-метилбутин-1-ил и тому подобные. Подразумевается, что используемый здесь термин «С2-6алкинил» в качестве группы или части группы, включает С3-6алкинильные группы и этинил.
Когда С2-6алкенильная группа связана с гетероатомом, она предпочтительно связана посредством насыщенного углеродного атома. Когда С3-6алкенильная группа замещена гидрокси, гидрокси располагается на насыщенном углеродном атоме.
Термин С3-7циклоалкил является общим для циклопропила, циклобутила, циклопентила, циклогексила или циклогептила. Термин С5-7циклоалкил является общим для циклопентила, циклогексила или циклогептила.
С2-5алкандиил подразумевает двухвалентную прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 2 до 5 атомов углерода, например, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил, 1,5-пентандиил и подобные; С1-4алкандиил подразумевает двухвалентную прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 1 до 4 атомов углерода, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил и подобные; подразумевается, что С1-6алкандиил включает С1-4алкандиил и его высшие гомологи, имеющие от 5 до 6 атомов углерода, например, 1,5-пентандиил, 1,6-гександиил, и подобные; подразумевается, что С1-10алкандиил включает С1-6алкандиил и его высшие гомологи, имеющие от 7 до 10 атомов углерода, например 1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10-декандиил и подобные.
Используемый в данном документе ранее термин (=О) образует карбонильный фрагмент при связи с атомом углерода, сульфоксидный фрагмент при связи с атомом серы и сульфонильный фрагмент, когда два указанных фрагмента связаны с атомом серы. Термин (=N-ОН) образует гидроксииминовый фрагмент при связи с атомом углерода.
Термин гало является общим для фтора, хлора, брома или иода.
Следует заметить, что расположение радикалов на каком-либо молекулярном фрагменте, используемом в определениях, может быть в любом месте такого фрагмента, при условии его химической стабильности.
Радикалы, используемые в определениях заместителей, включают все возможные изомеры, если другого не указано. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3-пентил.
Термин полинасыщенный определен как насыщенный более чем одним заместителем.
Когда любой заместитель встречается более одного раза в каком-либо определении, то каждое определение является независимым.
При употреблении здесь и далее терминов «соединения формулы (I)», или «настоящие соединения», или похожего термина подразумевается, что они включают соединения общей формулы (I), их пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы. Интересующая подгруппа соединений формулы (I) или какая-либо их подгруппа представляет собой N-оксиды, соли и все стереоизомерные формы соединений формулы (I).
Ясно, что некоторые соединения формулы (I) могут содержать один или более центров хиральности и существовать в виде стереохимически изомерных форм.
Термин «стереохимически изомерные формы», используемый здесь и ранее, подразумевает все возможные соединения, составленные из тех же атомов, связанных между собой связями в той же последовательности, но имеющие различные трехмерные структуры, не являющимися взаимозаменяемыми, которые могут образовать соединения формулы (I).
Если иначе не определено или не указано, химическое определение охватывает смесь всех возможных стереохимически изомерных форм, которые указанное соединение может образовать. Указанная смесь может содержать диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений настоящего изобретения как в чистом виде, так и в смеси друг с другом намеренно охвачены областью настоящего изобретения.
Чистые стереоизомерные формы соединений и промежуточных соединений, указанные здесь, определены как изомеры, в значительной мере свободные от других энантиомерных и диастереомерных форм этой же основной молекулярной структуры указанных соединений и промежуточных соединений. В частности, термин «стереоизомерно чистый» касается соединений или промежуточных соединений, имеющих энантиомерный избыток, равный, по меньшей мере, 80% (а именно, минимум 90% одного изомера и максимум 10% других возможных изомеров) до стереоизомерного избытка 100% (а именно 100% одного изомера и ни одного другого изомера), более конкретно, соединения или промежуточные соединения, имеющие стереоизомерный избыток от 90% до 100%, даже более конкретно, имеющих стереоизомерный избыток от 94% до 100%, и наиболее конкретно, имеющих стереоизомерный избыток от 97% до 100%. Термины «энантиомерно чистый» и «диастереомерно чистый» должны пониматься таким же образом, но относительно энантиомерного избытка, диастереомерного избытка в случае смеси, соответственно.
Чистые стереоизомерные формы соединений и промежуточных соединений данного изобретения могут быть получены применением известных в данной области методик. Например, энантиомеры могут быть отделены один от другого селективной кристаллизацией их диастереомерных солей с оптически активными кислотами или основаниями. Их примерами являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфосульфоновая кислота. Альтернативно энантиомеры могут быть разделены хроматографически, используя хиральную неподвижную фазу. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов, обеспечивая стереоспецифическое прохождение реакции. Предпочтительно, если требуется специфический стереоизомер, указанное соединение синтезируется стереоспецифическими способами. Эти способы преимущественно используют энантиомерно чистые исходные материалы.
Диастереомерные рацематы формулы (I) могут быть получены раздельно с помощью традиционных способов. Подходящие способы физического разделения, которые могут быть преимущественно применены, являются, например, селективной кристаллизацией и хроматографией, например колоночной хроматографией.
Для некоторых соединений формулы (I), их пролекарств, N-оксидов, солей, сольватов, четвертичных аминов, или комплексов с металлами и промежуточных соединений, используемых в их получении, абсолютная стереохимическая конфигурация экспериментально определена не была. Квалифицированный специалист в этой области способен определить абсолютную конфигурацию таких соединений, используя известные в данной области способы, например дифракцию рентгеновских лучей.
Настоящее изобретение имеет своей целью включить все изотопы атомов данного изобретения. Изотопы включают те атомы, что имеют тот же атомный номер, но различные значения масс. С помощью общего примера и без ограничения, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14.
Для терапевтического применения соли соединений формулы (I) представлены солями, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, в приготовлении или очистке фармацевтически приемлемого соединения. Все соли, фармацевтически приемлемые или фармацевтически неприемлемые, включены в объем данного изобретения.
Подразумевается, что аддитивные соли фармацевтически приемлемой кислоты или основания, упомянутые здесь и выше, включают терапевтически активные нетоксичные формы кислотно-аддитивных и основно-аддитивных солей, которые способны образовать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены обработкой основной формы соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, например, галогенводородные кислоты, например, хлористоводородную или бромистоводородную кислоту, серную, азотную, фосфорную и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (то есть этандиовая), малоновая, янтарная (бутандиовая), малеиновая, фумаровая, яблочная (то есть гидроксибутандиовая кислота), виннокаменная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты.
Наоборот, указанные солевые формы могут быть переведены обработкой соответствующим основанием в форму свободного основания.
Соединения формулы (I), содержащие кислотный протон, могут также быть переведены в формы аддитивных солей нетоксичного металла или амина обработкой соответствующими органическими и неорганическими основаниями. Подходящие основные солевые формы могут включать, например, соли аммония, соли щелочных и щелочноземельных металлов, например лития, натрия, калия, магния, кальция и подобные, соли органических оснований, например бензатин, N-метил-D-глюкамин, соли hydrabamine, и соли с аминокислотами, такими как, например, аргинин, лизин и подобными.
Термин «аддитивные соли», используемый здесь и выше, также включает сольваты, которые так же, как и их соли, способны образовать соединения формулы (I). Такие сольваты представляют собой, например, гидраты, алкоголяты и подобные.
Термин «четвертичный амин», используемый здесь и ранее, подразумевает четвертичные аммониевые соли, которые способны образовывать соединения формулы (I) за счет взаимодействия между основным азотом соединения формулы (I) и соответствующим четвертичным агентом, таким как, например, необязательно замещенный алкилгалид, арилгалид или арилалкилгалид, например, метилиодид или бензилиодид. Другие реагенты с легко уходящими группами могут быть также использованы, например алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, иод, трифторацетат и ацетат. Противоион выбора может быть введен с помощью ионообменных смол.
Формы N-оксидов настоящих соединений, как подразумевается, включают соединения формулы (I), где один или несколько атомов азота окислены до, так называемого, N-оксида.
Ясно, что соединения формулы (I) могут быть связаны с металлом, быть хелатированы, иметь комплексообразующие свойства и, следовательно, могут существовать в виде комплексов с металлами или хелатов металлов. Такие металлированные производные соединений формулы (I), как подразумевается, включены в объем настоящего изобретения.
Некоторые из соединений формулы (I) могут также существовать в таутомерной форме. Такие формы, несмотря на то, что точно не определено в указанной выше формуле, как подразумевается, включены в объем настоящего изобретения.
Одно воплощение настоящего изобретения касается соединений формулы (I-a):

где Q, G, R1, R2а, R2b обозначены в определениях соединений формулы (I) или любых из подгрупп соединений формулы (I), определенных в данном документе.
Другое воплощение настоящего изобретения касается соединений формулы (I-b):

где Q, G, R1, R3а, R3b обозначены в определениях соединений формулы (I) или любых из подгрупп соединений формулы (I), определенных в данном документе.
Одно частное воплощение настоящего изобретения касается соединений формулы (I-a-1):

где Q, G, R1, R4а и R2b обозначены в определениях соединений формулы (I) или любых из подгрупп соединений формулы (I), определенных в данном документе; и Alk является С1-6алкандиилом;
R9, R10, R11 независимо один от другого имеют такие же значения, как и заместители на Ar2, как обозначено в определениях соединений формулы (I) или любых из их подгрупп, и R10 и/или R11 могут быть также водородом.
Другое частное воплощение настоящего изобретения касается соединений формулы (I-b-1):

где Q, G, R1, R4а и R3b обозначены в определениях соединений формулы (I) или любых из подгрупп соединений формулы (I), определенных в данном документе; и Alk является С1-6алкандиилом;
R9, R10, R11 независимо один от другого имеют такие же значения, как и заместители на Ar2, как обозначено в определениях соединений формулы (I) или любых из их подгрупп, и R10 и/или R11 могут быть также водородом.
Интересующие подгруппы являются теми, что включают соединения формул:
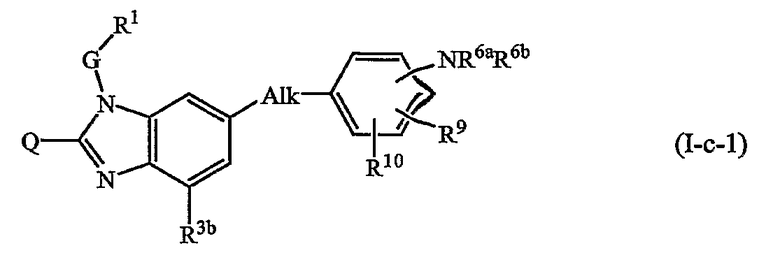
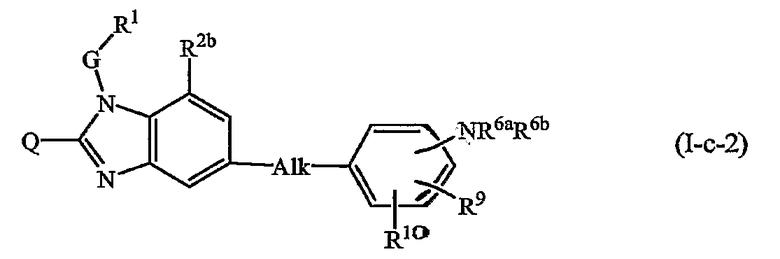
где в (I-с-1) и (I-с-2) радикалы Q, G, R1, R2b, R3b обозначены в определениях соединений формулы (I) или любых из подгрупп соединений формулы (I), определенных в данном документе; радикалы Alk, R9, R10, R11 обозначены выше или в любых из подгрупп соединений формулы (I), определенных в данном документе; и радикалы R6а и R6b обозначены в определениях соединений формулы (I) или любых из подгрупп соединений формулы (I), определенных в данном документе.
Предпочтительными подгруппами являются те, в которых Alk является этиленом или метиленом, более предпочтительно, где Alk представляет собой метилен.
В (I-а-1) или (I-b-1) R4а предпочтительно является водородом, гидроксиС1-6алкилом, аминокарбонилС1-6алкилом.
В (I-а-1), (I-b-1), (I-с-1) или (I-с-2) радикалы R9, R10, R11 предпочтительно независимо один от другого представляют собой С1-6алкил или R6b-О-С1-6алкил; и R10 и/или R11 могут быть также водородом; или
R9, R10 более предпочтительно и независимо один от другого представляют собой
С1-6алкил или R6b-О-С1-6алкил; и R11 является водородом; или
R9, R10 еще более предпочтительно представляют собой С1-6алкил и R11 является водородом; или
R9 представляет собой С1-6алкил, R10 представляет собой -О-С1-6алкил и R11 является водородом.
Следует понимать, что определенные выше подгруппы соединений формул (I-а), (I-b) и т.д., так же, как и любая из подгрупп, определенная в этом документе, как подразумевается, включает любые пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы таких соединений.
Интересующими соединениями являются те соединения формулы (I) или любой их подгруппы, где G является С1-10алкандиилом; более конкретно, где G является метиленом.
Одно воплощение включает соединения формулы (I), как определено выше или как в любых из подгрупп, обозначенных в данном документе, где Q является водородом. Другое воплощение включает соединения формулы (I), как определено выше или как в любых из подгрупп, обозначенных в данном документе, где Q является амино; или где Q отлично от водорода, то есть где Q является амино, моно- или ди(С1-6алкиламино).
Частными подгруппами соединений формулы (I) являются те соединения формулы (I) или любая из подгрупп, обозначенных в данном документе, где G является С1-10алкандиилом; более конкретно, где G является метиленом.
Другие определенные группы соединений формулы (I) являются теми соединениями формулы (I) или любой подгруппой соединений формулы (I), что определены в данном документе, где
(а) R1 отличен от Ar1; или где
(b) R1 представляет собой Ar1 или моноциклический гетероцикл, который определен в определениях соединений формулы (I) или любых из их подгрупп.
Дополнительные конкретные подгруппы соединений формулы (I) являются теми соединениями формулы (I) или любой подгруппой соединений формулы (I), что определены в данном документе, где
(с) R1 представляет собой пиридил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гало, гидрокси, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилтио,
С1-6алкилоксиС1-6алкила, Ar1, Ar1С1-6алкила, Ar1С1-6алкилокси, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалоС1-6алкила, С1-6алкилкарбониламино, С1-6алкил-SO2-NR4a-, Ar1-SO2-NR4a-, С1-6алкилоксикарбонила, -С(=О)-NR4aR4b, НО(-СН2-СН2-О)n-,
гало(-СН2-СН2-О)n-, С1-6алкилокси(-СН2-СН2-О)n-, Ar1С1-6алкилокси(-СН2-СН2-О)n- и моно- или ди(С1-6алкил)амино(-СН2-СН2-О)n-; или более конкретно
(d) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, С1-6алкила, гало, С1-6алкилокси,
Ar1С1-6алкилокси, (С1-6алкилокси)С1-6алкилокси; предпочтительно, где
(е) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, С1-6алкила, гало и С1-6алкилокси; или где
(f) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, и С1-6алкила; более предпочтительно, где
(g) R1 представляет собой пиридил, замещенный гидрокси и С1-6алкилом; или более предпочтительно, где
(h) R1 представляет собой пиридил, замещенный гидрокси и метилом; или где
(i) R1 представляет собой 3-гидрокси-6-метилпирид-2-ил.
Дополнительные воплощения включают те соединения формулы (I) или любые подгруппы соединений формулы (I), где
(j) R1 представляет собой Ar1, хинолинил, бензимидазолил, радикал формулы

пиразинил, или пиридил; или где
(k) R1 представляет собой Ar1, хинолинил, бензимидазолил, радикал формулы (с-4), где m равно 2, пиразинил или пиридил;
где каждый из радикалов в (j) и (k) могут необязательно быть замещены заместителями, обозначенными в определении соединений формулы (I) и, в частности, пиридил может быть замещен, как указано выше в (а)-(i).
Дополнительные воплощения включают те соединения формулы (I) или любые подгруппы соединений формулы (I), где
(l) R1 представляет собой Ar1, хинолинил, бензимидазолил, или радикал формулы (с-4), где m равно 2, пиразинил или пиридил; где каждый из этих радикалов может быть необязательно замещен одним, двумя или тремя радикалами, выбранными из группы, состоящей из гало, гидрокси, С1-6алкила, С1-6алкилокси, Ar1С1-6алкилокси,
(С1-6алкилокси)С1-6алкилокси; или более конкретно где
(m) R1 представляет собой Ar1, хинолинил, бензимидазолил, радикал формулы (с-4), где m равно 2, пиразинил или пиридил; где каждый из этих радикалов может необязательно быть замещен одним, двумя или тремя радикалами, выбранными из группы, состоящей из гало, гидрокси, С1-6алкила, С1-6алкилокси, бензилокси; или, более конкретно, где
(n) R1 представляет собой фенил, необязательно замещенный одним, двумя или тремя радикалами, выбранными из группы, состоящей из гало, гидрокси, С1-6алкила,
С1-6алкилокси, хинолинила; радикала (с-4), где m равно 2, необязательно замещенным радикалами в количестве до двух, выбранными из С1-6алкила, бензимидазолила, необязательно замещенного С1-6алкилом; пиридила, необязательно замещенного одним или двумя радикалами, выбранными из гидрокси, гало, С1-6алкила, бензилокси и С1-6алкилокси, пиразинила, необязательно замещенного радикалами в количестве до трех, выбранными из С1-6алкила; или пиридила, замещенного или необязательно замещенного, как указано выше в (а)-(i); или где
(о) R1 представляет собой фенил, необязательно замещенный одним или двумя радикалами, выбранными из группы, состоящей из гало, гидрокси, С1-6алкила, С1-6алкилокси;
(р) R1 представляет хинолинил;
(q) R1 представляет собой радикал (с-4), где m равно 2, необязательно замещенный радикалами в количестве до двух, выбранными из С1-6алкила;
(r) R1 представляет собой бензимидазолил, необязательно замещенный С1-6алкилом; пиридил, необязательно замещенный одним или двумя радикалами, выбранными из гидрокси, гало, С1-6алкила, бензилокси и С1-6алкилокси,
(s) R1 представляет собой пиразинил, необязательно замещенный радикалами в количестве до трех, выбранными из С1-6алкила.
Предпочтительные подгруппы соединений формулы (I) или любые из подгрупп соединений формулы (I) являются теми, где G представляет собой прямую связь или метилен и R1 является таким, как определено выше в (а)-(s). Дополнительно предпочтительными являются соединения формулы (I) или любые из подгрупп, определенных в данном документе, где G представляет собой прямую связь и R1 представляет собой радикал (с-4), в частности, где m равно 2, необязательно замещенный радикалами в количестве до двух, выбранными из С1-6алкила. Дополнительно предпочтительными являются соединения формулы (I) или любые из подгрупп, определенных в данном документе, где G представляет собой метилен и R1 является таким, как определено выше в (а)-(s), но отличен от радикала (с-4).
Другие подгруппы соединений формулы (I) являются теми соединениями формулы (I) или любыми подгруппами соединений формулы (I), определенными в данном документе, где
(а) R4а и R4b являются, каждый, независимо выбранными из водорода, С1-6алкила, Ar2С1-6алкила, (Ar2)(гидрокси)С1-6алкила, HetС1-6алкила, гидроксиС1-6алкила, моно- и ди(С1-6алкилокси)С1-6алкила, (гидроксиС1-6алкил)оксиС1-6алкила, Ar1С1-6алкилоксиС1-6алкила, дигидроксиС1-6алкила, (С1-6алкилокси)(гидрокси)С1-6алкила, (Ar1С1-6алкилокси)(гидрокси)С1-6алкила, Ar1оксиС1-6алкила, (Ar1окси)(гидрокси)С1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)амино-С1-6алкила, карбоксил-С1-6алкила, С1-6алкилоксикарбонилС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила, С1-6алкилкарбонилС1-6алкила, (С1-4алкилокси)2-Р(=О)-С1-6алкила, (С1-4алкилокси)2-Р(=О)-О-С1-6алкила, аминосульфонилС1-6алкила, моно- и ди(С1-6алкил)аминосульфонилС1-6алкила, С1-6алкилкарбонила, Ar2карбонила, Het-карбонила, Ar2С1-6алкилкарбонила, Het-С1-6алкилкарбонила, Ar2 и Het, или где
(b) R4а и R4b являются независимо выбранными из водорода, С1-6алкила, Ar2С1-6алкила, (Ar2)(гидрокси)С1-6алкила, HetС1-6алкила, гидроксиС1-6алкила, моно- и ди(С1-6алкилокси)С1-6алкила, (гидроксиС1-6алкил)оксиС1-6алкила, Ar1С1-6алкилоксиС1-6алкила, дигидроксиС1-6алкила, (С1-6алкилокси)(гидрокси)С1-6алкила, (Ar1С1-6алкилокси)(гидрокси)С1-6алкила, Ar1оксиС1-6алкила, (Ar1окси)(гидрокси)С1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)аминоС1-6алкила, карбоксилС1-6алкила, С1-6алкилоксикарбонилС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила, С1-6алкилкарбонилС1-6алкила, (С1-4алкилокси)2-Р(=О)-С1-6алкила, (С1-4алкилокси)2-Р(=О)-О-С1-6алкила, аминосульфонилС1-6алкила, моно- и ди(С1-6алкил)аминосульфонил-С1-6алкила, Ar2 и Het, или где
(с) R4а и R4b являются независимо выбранными из водорода, С1-6алкила, Ar2С1-6алкила, (Ar2)(гидрокси)С1-6алкила, HetС1-6алкила, гидроксиС1-6алкила, (С1-6алкилокси)С1-6алкила, (гидроксиС1-6алкил)оксиС1-6алкила, Ar1С1-6алкилоксиС1-6алкила, Ar1окси-С1-6алкила, (Ar1окси)(гидрокси)С1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)аминоС1-6алкила, карбоксилС1-6алкила, С1-6алкилоксикарбонилС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила, (С1-4алкилокси)2Р(=О)-С1-6алкила, (С1-4алкилокси)2Р(=О)-О-С1-6алкила, аминосульфонилС1-6алкила, моно- и ди(С1-6алкил)аминосульфонилС1-6алкила, и Ar1; или где
(d) R4а и R4b являются независимо выбранными из водорода, С1-6алкила, (Ar2)(гидрокси)С1-6алкила, HetС1-6алкила, гидроксиС1-6алкила, (С1-6алкилокси)С1-6алкила, (гидроксиС1-6алкил)оксиС1-6алкила, Ar1С1-6алкилоксиС1-6алкила, Ar1оксиС1-6алкила, (Ar1окси)(гидрокси)С1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)аминоС1-6алкила, карбоксилС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила, (С1-4алкилокси)2-Р(=О)-С1-6алкила, (С1-4алкилокси)2-Р(=О)-О-С1-6алкила, аминосульфонилС1-6алкила, моно- и ди(С1-6алкил)аминосульфонилС1-6алкила и Ar1.
Интересующие подгруппы соединений формулы (I) являются теми соединениями формулы (I) или любыми подгруппами соединений формулы (I), определенных в данном документе, где
(е) R4а и R4b являются независимо выбранными из водорода, морфолинил-С1-6алкила, гидроксиС1-6алкила, (С1-6алкилокси)С1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)аминоС1-6алкила, карбоксилС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила, аминосульфонилС1-6алкила, моно- и ди(С1-6алкил)аминосульфонилС1-6алкила и Ar1; или где
(f) R4а и R4b являются независимо выбранными из водорода, гидроксиС1-6алкила,
(С1-6алкилокси)С1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)аминоС1-6алкила, карбоксилС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила; или где
(g) R4а и R4b являются независимо выбранными из водорода, гидроксиС1-6алкила, аминокарбонилС1-6алкила, моно- и ди(С1-6алкил)аминокарбонилС1-6алкила; или где
(h) R4а и R4b являются независимо выбранными из водорода, гидроксиС1-6алкила и аминокарбонилС1-6алкила.
Другие интересующие подгруппы соединений формулы (I) являются теми соединениями формулы (I) или любой подгруппой соединений формулы (I), определенных в данном документе, где R4а представляет собой водород и R4b является таким, как определено выше и ограничено определениями c (а) по (h).
Другие подгруппы соединений формулы (I) являются теми соединениями формулы (I) или любой подгруппой соединений формулы (I), что определены в данном документе, где
(а) Ar2 представляет собой фенил, фенил, аннелированный с С5-7циклоалкилом, или фенил, замещенный 1, 2 или 3 заместителями, выбранными из гало, циано, С1-6алкила, Het-С1-6алкила, Ar1С1-6алкила, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, R6b-О-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-О-С3-6алкинила, Ar1, Het,
R6b-О-, R6b-S-, R6с-SO-, R6с-SO2-, R6b-О-С1-6алкил-SO2-, N(R6аR6b), СF3, СF3-окси, СF3-тио, R6с-С(=О)-, R6b-О-С(=О)-, N(R6аR6b)-С(=О)-, R6b-О-С1-6алкила, R6b-S-С1-6алкила, R6с-S(=О)2-С1-6алкила, N(R6аR6b)-С1-6алкила, R6с-С(=О)-С1-6алкила, R6b-О-С(=О)-С1-6алкила, N(R6аR6b)-С(=О)-С1-6алкила, R6с-С(=О)-NR6b-, R6с-С(=О)-О-, R6с-С(=О)-NR6b-С1-6алкила, R6с-С(=О)-О-С1-6алкила, N(R6аR6b)-S(=О)2-, H2N-C(=NH)-;
(b) Ar2 представляет собой фенил, фенил, аннелированный с С5-7циклоалкилом, или фенил, замещенный 1, 2 или 3 заместителями, или 1 или 2 заместителями, выбранными из гало, циано, С1-6алкила, Het-С1-6алкила, Ar1С1-6алкила, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, R6b-О-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-О-С3-6алкинила, Ar1, Het, R6b-О-, R6b-S-, R6с-SO-, R6с-SO2-, R6b-О-С1-6алкил-SO2-, N(R6аR6b), СF3, R6с-С(=О)-, R6b-О-С(=О)-, N(R6аR6b)-С(=О)-, R6b-О-С1-10алкила, R6b-S-С1-6алкила, R6с-S(=О)2-С1-6алкила, N(R6аR6b)-С1-6алкила, R6с-С(=О)-С1-6алкила, R6b-О-С(=О)-С1-6алкила, N(R6аR6b)-С(=О)-С1-6алкила, R6с-С(=О)-NR6b-, H2N-C(=NH)-;
(с) Ar2 представляет собой фенил, фенил, аннелированный с С5-7циклоалкилом, или фенил, замещенный 1, 2 или 3 заместителями, или 1 или 2 заместителями, выбранными из гало, циано, С1-6алкила, Het-С1-6алкила, Ar1С1-6алкила, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, R6b-О-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-О-С3-6алкинила, Ar1, Het, R6b-О-, R6b-S-, R6с-SO2-, N(R6аR6b), СF3, R6b-О-С(=О)-, N(R6аR6b)-С(=О)-, R6b-О-С1-6алкила, R6b-S-С1-6алкила,
R6с-S(=О)2-С1-6алкила, N(R6аR6b)-С1-6алкила, R6с-С(=О)-С1-6алкила, R6b-О-С(=О)-С1-6алкила, N(R6аR6b)-С(=О)-С1-6алкила, R6с-С(=О)-NR6b-;
(d) Ar2 представляет собой фенил, фенил, аннелированный с С5-7циклоалкилом, или фенил, замещенный 1, 2 или 3 заместителями, или 1 или 2 заместителями, выбранными из С1-6алкила, Het-С1-6алкила, Ar1С1-6алкила, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, R6b-О-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-О-С3-6алкинила, R6b-О-С1-6алкила, R6b-S-С1-6алкила, R6с-S(=О)2-С1-6алкила, N(R6аR6b)-С1-6алкила, R6b-О-С(=О)-С1-6алкила, N(R6аR6b)-С(=О)-С1-6алкила;
(е) Ar2 представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, или 1 или 2 заместителями, выбранными из С1-6алкила, Het-С1-6алкила, Ar1С1-6алкил, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, гидрокси-С3-6алкенила, С2-6алкинила, цианоС2-6алкинила, гидрокси-С3-6алкинила, R6b-О-С1-6алкила, амино-S(=О)2-С1-6алкила, N(R6аR6b)-С1-6алкила, R6b-О-С(=О)-С1-6алкила, амино-С(=О)-С1-6алкила, моно- и ди-С1-6алкиламино-С(=О)-С1-6алкила;
(f) Ar2 представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, или 1 или 2 заместителями, выбранными из С1-6алкила, Het-С1-6алкила, Ar1С1-6алкил, цианоС1-6алкила, С2-6алкенила, цианоС2-6алкенила, С2-6алкинила, цианоС2-6алкинила, R6b-О-С1-6алкила, амино-S(=О)2-С1-6алкила, R6b-О-С(=О)-С1-6алкила, амино-С(=О)-С1-6алкила, моно- и ди-С1-6алкиламино-С(=О)-С1-6алкила;
(g) Ar2 представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, или 1 или 2 заместителями, выбранными из С1-6алкила, R6b-О-С1-6алкила и амино-С(=О)-С1-6алкила, или выбранными из С1-6алкила, гидрокси-С1-6алкила и амино-С(=О)-С1-6алкила.
Ограничения в заместителях Ar2, как определено выше в (а)-(g), предпочтительно применимы к любому из Ar2, являющемуся частью радикала R2а или R3а, являясь С1-6алкилом, замещенным -NR4aR4b, где R4а и/или R4b является или являются радикалом Ar2.
Другие подгруппы соединений формулы (I) являются теми соединениями формулы (I) или любой подгруппой соединений формулы (I), что определены в данном документе, где
(h) Ar2 представляет собой фенил, замещенный С1-6алкилом, Het-С1-6алкилом,
Ar1С1-6алкилом, цианоС1-6алкилом, С2-6алкенилом, цианоС2-6алкенилом, С2-6алкинилом, цианоС2-6алкинилом, R6b-О-С1-6алкилом, амино-S(=О)2-С1-6алкилом, R6b-О-С(=О)-С1-6алкилом, амино-С(=О)-С1-6алкилом, моно- и ди-С1-6алкиламино-С(=О)-С1-6алкилом; и необязательно дополнительно замещенный одним или двумя заместителями упомянутого выше Ar2 в ограничениях от (а) до (g); или
(i) Ar2 представляет собой фенил, замещенный R6b-О-С1-6алкилом, амино-С(=О)-С1-6алкилом; или фенил, замещенный гидрокси-С1-6алкилом, амино-С(=О)-С1-6алкилом; и необязательно дополнительно замещенный одним или двумя заместителями на Ar2, упомянутыми выше в ограничениях от (а) до (g).
Ограничения в заместителях Ar2, как определено выше в (h)-(i), предпочтительно применимы к любому из Ar2, являющемуся частью радикала R2а или R3а, являясь С1-6алкилом, замещенным радикалом Ar2.
Дополнительные подгруппы являются соединениями формулы (I) или любыми из подгрупп соединений формулы (I) где
(а) R6а, в частности, представляет собой водород, С1-6алкил, Ar1, Ar1С1-6алкил, С1-6алкилкарбонил, Ar1карбонил, Ar1С1-6алкилкарбонил, С1-6алкилоксиС1-6алкил, аминоС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, гидроксиС1-6алкил, (карбоксил)-С1-6алкил, (С1-6алкилоксикарбонил)С1-6алкил, аминокарбонилС1-6алкил, моно- и ди(С1-6алкил)аминокарбонилС1-6алкил, аминосульфонилС1-6алкил, моно- и ди(С1-6алкил)аминосульфонилС1-6алкил, Het, Het-С1-6алкил, Het-карбонил, Het-С1-6алкилкарбонил;
(b) R6а, более конкретно, представляет собой водород, С1-6алкил, Ar1, Ar1С1-6алкил, С1-6алкилоксиС1-6алкил, аминоС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, гидроксиС1-6алкил, (карбоксил)С1-6алкил, (С1-6алкилоксикарбонил)С1-6алкил, аминокарбонилС1-6алкил, моно- и ди(С1-6алкил)аминокарбонилС1-6алкил, аминосульфонилС1-6алкил, моно- и ди(С1-6алкил)аминосульфонилС1-6алкил, Het, Het-С1-6алкил;
(с) R6а, дополнительно, в частности, представляет собой водород, С1-6алкил, Ar1С1-6алкил, С1-6алкилоксиС1-6алкил, аминоС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, гидроксиС1-6алкил, (карбоксил)С1-6алкил, (С1-6алкилоксикарбонил)С1-6алкил, аминокарбонилС1-6алкил, моно- и ди(С1-6алкил)аминокарбонилС1-6алкил, аминосульфонилС1-6алкил, моно- и ди(С1-6алкил)аминосульфонил-С1-6алкил, Het-С1-6алкил;
(d) R6а, дополнительно, в частности, представляет собой водород, С1-6алкил, Ar1С1-6алкил, аминоС1-6алкил, гидроксиС1-6алкил, (карбоксил)С1-6алкил, аминокарбонилС1-6алкил, аминосульфонилС1-6алкил, морфолинил-С1-6алкил;
(е) R6а, дополнительно, в частности, представляет собой водород, гидроксиС1-6алкил, аминокарбонилС1-6алкил, аминосульфонилС1-6алкил; или где R6а представляет собой водород, С1-6алкил, Ar1 или Ar1С1-6алкил; или R6а представляет собой водород или С1-6алкил; или R6а представляет собой водород.
Дополнительные подгруппы являются соединениями формулы (I) или любыми из подгрупп соединений формулы (I), где
(f) R6b, предпочтительно, представляет собой водород или С1-6алкил; или более предпочтительно водород;
(g) R6с, предпочтительно, представляет собой С1-6алкил.
В группе соединений формулы (I) или в любых из подгрупп соединений формулы (I)
(а) Ar1, предпочтительно, представляет собой фенил или фенил, замещенный заместителями в количестве до 3, или до 2, или одним заместителем, выбранным из гало, гидрокси, С1-6алкила, гидроксиС1-6алкила, трифторметила и С1-6алкилокси;
(b) Ar1, более предпочтительно, представляет собой фенил или фенил, замещенный заместителями в количестве до 3, или до 2, или одним заместителем, выбранным из гало, гидрокси, С1-6алкила и С1-6алкилокси;
(с) Ar1, более предпочтительно, представляет собой фенил или фенил, замещенный заместителями в количестве до 3, или до 2, или одним заместителем, выбранным из гало и С1-6алкила.
Другие подгруппы соединений формулы (I) являются теми соединениями формулы (I) или любой подгруппой соединений формулы (I), что определены в данном документе, где
(а) Het представляет собой тетрагидрофуранил, фуранил, тиенил, тиазолил, оксазолил, имидазолил, изотиазолил, пиразолил, изоксазолил, пиперидинил, гомопиперидинил, пиперазинил, морфолинил, пиридил, пиразинил, пиримидинил, тетрагидрохинолинил, хинолинил, изохинолинил, бензодиоксанил, бензодиоксолил, индолинил, индолил, который может быть необязательно замещен оксо, амино, Ar1,
С1-4алкилом, аминоС1-4алкилом, Ar1С1-4алкилом, моно- или ди(С1-6алкил)аминоС1-6алкилом, моно- или ди(С1-6алкил)амино, (гидроксиС1-6алкил)амино, и необязательно дополнительно одним или двумя С1-4алкильными радикалами; или
(b) Het представляет собой тетрагидрофуранил, фуранил, тиенил, тиазолил, оксазолил, имидазолил, пиразолил, изоксазолил, пиперидинил, гомопиперидинил, пиперазинил, морфолинил, пиридил, пиразинил, пиримидинил, тетрагидрохинолинил, хинолинил, изохинолинил, бензодиоксанил, бензодиоксолил, индолинил, индолил, который может быть необязательно замещен оксо, амино, Ar1, С1-4алкилом, аминоС1-4алкилом и необязательно дополнительно одним или двумя С1-4алкильными радикалами; или
(с) Het представляет собой фуранил, тиенил, пиразолил, изоксазолил, морфолинил, пиримидинил, хинолинил, индолинил, который может быть необязательно замещен одним или двумя С1-4алкильными радикалами; или
(d) Het представляет собой морфолинил, который может быть необязательно замещен одним или двумя С1-4алкильными радикалами; или
(d) Het представляет собой морфолинил.
Частное воплощение настоящего изобретения касается соединений формулы (I), где Q, G, R1 и R5 являются такими, как указано выше в определении формулы (I) или в любых из подгрупп соединений формулы (I), что определены в данном документе; и где
(а) один из R2а и R3а выбран из N(R4аR4b), (R4аR4b)N-CO-, С1-6алкила, замещенного одним или двумя заместителями, выбранными из гидрокси, циано, Ar2, Het или
-N(R4аR4b) и С2-6алкенила, замещенного циано или Ar2; и другой из R2а и R3а является водородом; или
(b) один из R2а и R3а выбран из N(R4аR4b), (R4аR4b)N-CO-, С1-6алкила, необязательно замещенного гидрокси, циано, Ar2, Het или -N(R4аR4b); С1-6алкила, замещенного гидрокси и Ar2; и С2-6алкенила, замещенного циано или Ar2; и другой из R2а и R3а является водородом; или
(с) один из R2а и R3а выбран из (R4аR4b)N-CO-; С1-6алкила, необязательно замещенного гидрокси, Ar2, Het или -N(R4аR4b); и С2-6алкенила, замещенного Ar2; и другой из R2а и R3а является водородом; и
в случае, когда R2а отличается от водорода, тогда R2b является водородом, С1-6алкилом или галогеном и R3b является водородом;
в случае, когда R3а отличается от водорода, тогда R3b является водородом, С1-6алкилом или галогеном и R2b является водородом;
Ar2, Het, R4а и R4b являются такими, как в определениях соединений формулы (I) или как в любой из подгрупп, определенных в данном документе.
Другое частное воплощение настоящего изобретения касается соединений формулы (I), где Q, G, R1 и R5 являются такими, как указано выше в определении формулы (I) или любых из подгрупп соединений формулы (I), что определены в данном документе; и где
(d) один из R2а и R3а выбран из (R4аR4b)N-CO-; С1-6алкила, необязательно замещенного гидрокси, Ar2, Het или -N(R4аR4b); и С2-6алкенила, замещенного Ar1; и другой из R2а и R3а является водородом; или
(e) один из R2а и R3а выбран из (R4а)HN-CO-; С1-6алкила, необязательно замещенного гидрокси, Ar2, Het, -NH(R4а) или -N(R4а)Ar2; и С2-6алкенила, замещенного Ar1; и другой из R2а и R3а является водородом; или
(f) один из R2а и R3а является С1-6алкилом, необязательно замещенным гидрокси,
Ar2, Het, -NH(R4а) или -N(R4а)Ar2; и другой из R2а и R3а является водородом; или
(g) один из R2а и R3а является С1-6алкилом, необязательно замещенным гидрокси,
Ar2, -NH(R4а) или -N(R4а)Ar2; и другой из R2а и R3а является водородом;
(h) один из R2а и R3а является С1-6алкилом, необязательно замещенным -NH(R4а) или -N(R4а)Ar2; и другой из R2а и R3а является водородом;
(i) один из R2а и R3а является С1-6алкилом, необязательно замещенным -NH(R4а); и другой из R2а и R3а является водородом;
(j) один из R2а и R3а является С1-6алкилом, необязательно замещенным -N(R4а)Ar2; и другой из R2а и R3а является водородом;
в случае, когда R2а отличается от водорода, тогда R2b является водородом или С1-6алкилом и R3b является водородом;
в случае, когда R3а отличается от водорода, тогда R3b является водородом или С1-6алкилом и R2b является водородом;
Ar2, Het, R4а и R4b являются такими, как в определениях соединений формулы (I) или как в любой из подгрупп, определенных в данном документе.
Другое частное воплощение настоящего изобретения касается соединений формулы (I), где Q, G, R1 и R5 являются такими, как указано выше в определении формулы (I) или в любых из подгрупп соединений формулы (I), что определены в данном документе; где
R2а и R3а являются такими, как определено в (а)-(j) выше, и R2b и R3b, оба, являются водородом.
Другое частное воплощение настоящего изобретения касается соединений формулы (I), где Q, G, R1 и R5 являются такими, как указано выше в определении формулы (I) или в любых из подгрупп соединений формулы (I), что определены в данном документе; где
(k) один из R2а и R3а является С1-6алкилом; и другой из R2а и R3а является водородом; в случае, когда R2а отличается от водорода, тогда R2b является С1-6алкилом и R3b является водородом; в случае, когда R3а отличается от водорода, тогда R3b является С1-6алкилом и R2b является водородом.
Еще одно воплощение настоящего изобретения касается соединений формулы (I), где Q, G, R1 и R5 являются такими, как указано выше в определении формулы (I) или в любых из подгрупп соединений формулы (I), что определены в данном документе; где
один из R2а и R3а выбран из С1-6алкила, замещенного N(R4аR4b); где R4b является водородом;
и другой из R2а и R3а является водородом; и
в случае, когда R2а отличается от водорода, тогда R2b является водородом и R3b является водородом; в случае, когда R3а отличается от водорода, тогда R3b является водородом и R2b является водородом.
Еще другое воплощение настоящего изобретения касается соединений формулы (I), где Q, G, R1 и R5 являются такими, как указано выше или как в любых из подгрупп соединений формулы обозначенных в данном документе; и
один из R2а и R3а выбран из С1-6алкила, замещенного N(R4аR4b); и другой из R2а и
R3а является водородом; и
в случае, когда R2а отличается от водорода, тогда R2b является водородом и R3b является водородом; в случае, когда R3а отличается от водорода, тогда R3b является водородом и R2b является водородом; и
дополнительно, где
R4а является Ar2 и
R4b является С1-6алкилом, Ar2С1-6алкилом, (С1-6алкилокси)С1-6алкилом,
гидроксиС1-6алкилоксиС1-6алкилом, Ar1(С1-6алкилокси)С1-6алкилом, (С1-6алкилокси)(гидрокси)С1-6алкилом, (Ar1С1-6алкилокси)(гидрокси)С1-6алкилом, амино-С1-6алкилом, моно- и ди(С1-6алкил)амино-С1-6алкилом, гидрокси-С1-6алкилом, аминокарбонилС1-6алкилом, моно- и ди(С1-6алкил)аминокарбонилС1-6алкилом, С1-4алкилоксикарбонилС1-6алкилом, гидроксикарбонилС1-6алкилом, Het или Het-С1-6алкилом.
Предпочтительными соединениями являются те соединения, что приведены в таблицах с 1 по 6, более конкретно номера соединений с 1 по 75, с 81 по 116, с 129 по 165, с 167 по 183, с 191 по 192, с 194 по 197, с 205 по 214 и с 238 по 239.
Наиболее предпочтительным является соединение 90 в таблице 1, наименование которого 2-(2-амино-6{[2-(3-гидроксипропил)-5-метилфениламино]метил}бензимидазол-1-илметил)-6-метилпиридин-3-ол, так же, как и пролекарства, N-оксиды, аддитивные соли, четвертичные амины, и их комплексы с металлами, в частности, указанное соединение и их кислотно-аддитивные соли.
Соединения формулы (I) или любых из их подгрупп могут быть получены по следующим схемам реакций.

В этой схеме G, R1, R2а, R2b, R3а, R3b имеют значения, определенные выше для соединений формулы (I) или любых их подгрупп. W является подходящей уходящей группой, предпочтительно представленной хлором или бромом. Реакция по этой схеме может быть обычно проведена в подходящем растворителе, таком как эфир, например тетрагидрофуран (ТГФ), галогенированном углеводороде, например дихлорметане, СНCl3, толуоле, полярном апротонном растворителе, таком как ДМФ, ДМСО, ДМА и тому подобном. Основание может быть добавлено для нейтрализации кислоты, выделяющейся в процессе взаимодействия. Если требуется, могут быть добавлены определенные катализаторы, такие как соли иода (например KI).
В превращении (II) в (I) при условии, что радикалом Q является амино, указанный радикал Q может быть защищен соответствующей защитной группой, такой как алкилоксикарбонильная группа, например метоксикарбонил, этоксикарбонил, трет-бутилоксикарбонил, который далее удаляется, например, обработкой основанием. Когда радикалом Q является метоксикарбониламино, указанный радикал Q может быть трансформирован в метиламиногруппу обработкой исходного метоксикарбониламинобензимидазола сложным металлгидридом, таким как LiAlH4.
Соединения формулы (I), где Q является амино, указанные соединения, представленные формулой (I-d), могут быть получены как показано в следующих схемах реакций.
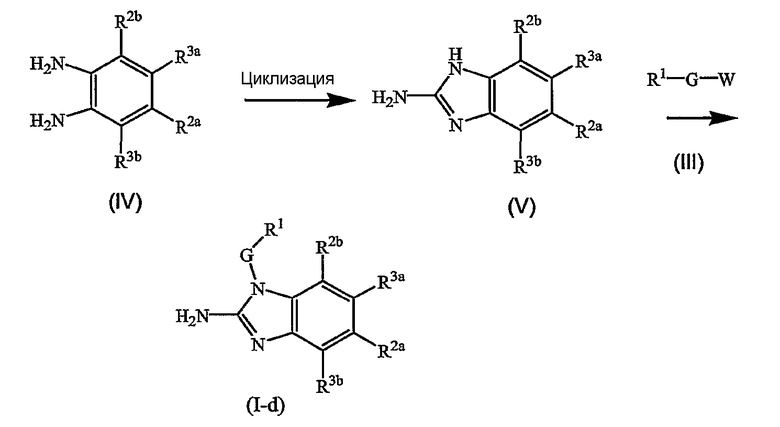
На первом этапе диаминобензол (IV) циклизуется с подходящим реагентом, например с цианогенбромидом, предпочтительно в подходящем растворителе, например спирте, таком как этанол, с получением аминобензимидазола (V). Последнее промежуточное соединение (V) подвергают взаимодействию с реагентом (III) в реакции N-алкилирования для получения промежуточного соединения (II). Одна из аминогрупп в исходном материале (IV) может быть замещена радикалом -G-R1 и это производное (IV) может быть циклизовано с цианогенбромидом, как описано выше для непосредственного получения (I-d). Альтернативно, промежуточное соединение (IV) может быть подвергнуто взаимодействию с мочевиной в реакции конденсации с получением бензимидазол-2-она, в подходящем растворителе, таком как ксилен. Полученный продукт переводят в соответствующее производное 2-замещенного бензимидазола, где группа в положении 2 является уходящей группой, предпочтительно, гало, например хлор или бром, за счет взаимодействия с галогенирующим агентом, таким как POCl3. Полученный продукт может быть дополнительно подвергнут взаимодействию с аммиаком с получением (V).
Указанные выше реакции N-алкилирования проводят в подходящем растворителе и, если требуется, в присутствии основания.
Соединения формулы (I) могут быть превращены одно в другое, следуя реакциям трансформации функциональных групп, известных в данной области, включая те, что описаны здесь и далее.
Соединения формулы (I), где R2а и R3а представляют собой С1-6алкилоксикарбонил или С1-6алкил, замещенный С1-6алкилоксикарбонилом, могут быть восстановлены, например, с помощью LiAlH4 до соответствующих соединений, где R2а или R3а представляет собой гидроксиС1-6алкил. Последняя группа может быть окислена до альдегидной группы, например, с помощью MnO2, которая затем может быть модифицирована с помощью аминов, например, с помощью восстановительного аминирования, до соответствующих С1-6алкиламинов или аминопроизводных. Альтернативно, соединения формулы (I), где R2а или R3а представляют собой гидроксиС1-6алкил, могут быть переведены в соответствующие галоС1-6алкил-соединения, например, обработкой подходящим галогенирующим агентом, таким как SOCl2, соединения которого далее подвергают взаимодействию с амином или производным амина.
Соединения формулы (I) где R2а и R3а представляет собой альдегид, могут быть переведены в соответствующие соединения, где R2а или R3а представляет собой С2-6алкенил или замещенный С2-6алкенил с помощью реакции Виттига или Виттига-Хорнера. В первом случае используется реагент Виттига, такой как трифенилфосфонийилид в подходящем реакционно-инертном растворителе, таком как эфир, полученный из трифенилфосфина и гало-производного. Реакция Виттига-Хорнера осуществляется с применением фосфоната, такого как, например, реагент формулы ди(С1-6алкилокси)-Р(=О)-CH2-CH2-CN в присутствии основания, предпочтительно, сильного основания, в апротонном органическом растворителе. Соединения, где R2а и R3а представляют собой С2-6алкенил или замещенный С2-6алкенил, могут быть восстановлены до соответствующих насыщенных алкилов, например, водородом в присутствии подходящего катализатора, такого как никель Ренея.
Соединения формулы (I), где R2а и R3а представляет собой альдегид, могут быть модифицированы реакцией Гриньяра для введения арильных или алкильных групп.
Нитрогруппы могут быть восстановлены до аминогрупп, которые далее могут быть алкилированы до моно- или диалкиламиногрупп, или ацилированы до арилкарбониламино или алкилкарбониламино и подобных групп. Цианогруппы могут быть восстановлены до аминометиленовых групп, которые сходным образом могут быть модифицированы.
Ряд промежуточных соединений, используемых для получения соединений формулы (I), представлен известными соединениями или аналогами известных соединений, которые могут быть получены следуя модификациям известных в данной области методик, легко доступных для квалифицированного специалиста. Ряд препаратов промежуточных соединений приведен здесь и далее довольно подробно.
Промежуточные соединения формулы (VII) могут быть получены из соответствующих спиртов с помощью превращения подходящего спирта в уходящую группу, например, взаимодействием спирта с SOCl2. Промежуточные соединения формулы (VII), где G представляет собой простую связь и R1 представляет собой радикал (с-4) или похожий радикал, могут быть получены реакцией галогенирования промежуточного соединения R1-Н, например, N-бромсукцинимидом.
Соединения формулы (I) могут быть переведены в соответствующие формы N-оксидов, следуя известным в данной области методикам для превращения трехвалентного азота в его N-оксидную форму. Указанная реакция N-окисления может быть, в основном, осуществлена взаимодействием исходного материала формулы (I) с соответствующим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочноземельных металлов, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, например бензолпероксикарбоновую кислоту или галозамещенная бензолпероксикарбоновую кислоту, например, 3-хлорбензолпероксикарбоновую кислоту, пероксиалкановые кислоты, например пероксиуксусную кислоту, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящие растворители являются, например, водой, низшими спиртами, например этанолом и подобными, углеводородами, например толуолом, кетонами, например, 2-бутаноном, галогенированными углеводородами, например дихлорметаном, и смесями таких растворителей.
Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены применением известных в этой области методик. Диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизация и хроматографические методики, противотоковое распределение, жидкостная хроматография и подобными методами.
Соединения формулы (I), полученные способами, описанными выше, представляют собой рацемические смеси энантиомеров, которые могут быть разделены друг от друга с помощью следующих действий. Рацемические соединения формулы (I), являющиеся в достаточной мере основными или кислотными, могут быть превращены в соответствующие формы диастереомерных солей взаимодействием с подходящей хиральной кислотой, соответственно, хиральным основанием. Указанные диастереомерные солевые формы далее разделяют, например, селективной или фракционной кристаллизацией и энантиомеры выделяют с помощью щелочи или кислоты. Альтернативный подход к разделению энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности жидкостную хроматографию с применением хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, обеспечивая стереоспецифичность реакции. Предпочтительно, если требуется специфический стереоизомер, указанное соединение синтезируют стереоспецифическими способами. Эти способы предпочтительно используют энантиомерно чистые исходные материалы.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), как обозначено в данной заявке, или соединение любой из подгрупп соединений формулы (I), обозначенных в данной заявке, и фармацевтически приемлемый носитель. Терапевтически эффективным количеством в этом контексте является количество, достаточное для профилактического действия, для стабилизации или снижения вирусного инфицирования, и конкретно вирусной инфекции, вызванной РСВ, у инфицированных субъектов или субъектов с риском инфицирования. В еще одном аспекте изобретение касается способа получения фармацевтической композиции, как описано в данной заявке, который включает непосредственное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединений формулы (I) или соединения любой из подгрупп соединений формулы (I).
Следовательно, соединения настоящего изобретения или любой из их подгрупп могут быть преобразованы в различные фармацевтические формы для введения. В качестве подходящих композиций могут быть указаны все композиции, обычно применяемые для систематического введения лекарств. Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения, необязательно в форме аддитивной соли или комплекса с металлом, в качестве активного ингредиента комбинируют непосредственно в смеси с фармацевтически приемлемым носителем, носитель может принимать ряд форм в зависимости от формы препарата, необходимой для введения. Данные фармацевтические композиции желательны в виде однократных лекарственных форм, подходящих, особенно, для перорального, ректального, подкожного или парентерального введения. Например, в приготовлении композиций в пероральной лекарственной форме любые из обычных фармацевтических сред могут быть применены, такие как, например, вода, гликоли, масла, спирты и подобные в случае оральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, разрыхлители и подобные в случае порошков, пилюль, капсул и таблеток. Ввиду простоты применения таблетки и капсулы представляют собой большинство предпочтительных пероральных лекарственных форм, в которых, очевидно, применяются твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере, в большей части, хотя могут быть включены другие ингредиенты, например, для достижения растворимости. Инъецируемые суспензии могут быть также приготовлены, в случае которых могут быть применены физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть приготовлены инъецируемые суспензии, в случае которых могут быть применены подходящие жидкие носители, суспендирующие агенты и подобные. Также включены твердые лекарственные формы, которые нужно перевести незадолго до применения в жидкие лекарственные формы. В композициях, подходящих для подкожного введения, носитель необязательно включает агент, повышающий проникновение и/или подходящий увлажняющий агент, необязательно комбинированный с подходящими добавками любой природы в малых количествах, при этом добавки не оказывают значительный разрушающий эффект на кожу.
Соединения настоящего изобретения могут быть также введены посредством пероральной ингаляции или вдувания с помощью способов и препаратов, применяемых в данной области для введения этим путем. Таким образом, соединения настоящего изобретения могут быть введены в легкие в форме раствора, суспензии или сухого порошка, раствор является предпочтительным. Любая система, разработанная для доставки растворов, суспензий или сухих порошков посредством оральной ингаляции или вдувания, является подходящей для введения настоящих соединений.
Таким образом, настоящее изобретение также обеспечивает фармацевтическую композицию, адаптированную для введения ингаляцией или вдуванием через рот, включающую соединение формулы (I) и фармацевтически приемлемый носитель. Предпочтительно, соединения настоящего изобретения вводят ингаляцией раствора в небулайзерных или аэрозольных дозах.
Особенно предпочтительно преобразовывать указанные выше фармацевтические композиции в однократные лекарственные формы для простоты введения и универсальности дозирования. Однократная лекарственная форма, применяемая здесь, относится к физически отдельным формам, подходящим в качестве разовых форм, каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное для создания терапевтического эффекта вместе с требуемым фармацевтическим носителем. Примерами таких однократных лекарственных форм являются таблетки (включая таблетки с насечкой или покрытые оболочкой), капсулы, пилюли, суппозитории, пакетики с порошками, облатки, инъекционные растворы или суспензии и подобные, и их многочисленные варианты.
Соединения формулы (I) проявляют антивирусные свойства. Вирусные инфекции, вылечиваемые с применением соединений и способов настоящего изобретения, включают инфекции, переносимые орто- и парамиксовирусами и, в частности, человеческим респираторно-синцитиальным вирусом и респираторно-синцитиальным вирусом крупного рогатого скота (РСВ). Ряд соединений этого изобретения, более того, активен против мутировавших штаммов РСВ. Кроме того, многие соединения этого изобретения демонстрируют предпочтительный фармакокинетический профиль и имеют желательные свойства в терминах биодоступности, включая приемлемый период полувыведения, AUC и пиковые значения и отсутствие нежелательных явлений, таких как недостаточно быстрое начало действия и удерживание в ткани.
Антивирусная активность против РСВ in vitro настоящих соединений была проверена в тесте, как это описано в экспериментальной части описания, и может также быть продемонстрирована в анализе снижения репликации вируса. Антивирусная активность против РСВ in vivo настоящих соединений может быть продемонстрирована в тест-модели, используя хлопковых хомяков, как это описано у Wyde и др. (Antiviral Research (1998), 38, 31-42).
Ввиду их антивирусных свойств, особенно, их анти-РСВ свойств, соединения формулы (I) или их любая подгруппа, их пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы с металлами и стереохимически изомерные формы применимы в лечении пациентов с вирусной инфекцией, особенно, РСВ-инфекции, и для профилактики этих инфекций. В основном, соединения настоящего изобретения могут быть применимы в лечении теплокровных животных, инфицированных вирусами, особенно, респираторно-синцитиальным вирусом.
Соединения настоящего изобретения или любая их подгруппа могут, следовательно, быть применены в качестве лекарств. Указанное применение в качестве лекарства или способа лечения включает системное введение вирусно-инфицированным субъектам или субъектам, подверженным вирусным инфекциям, в количестве, эффективном для борьбы с состояниями, связанными с вирусной инфекцией, в частности РСВ-инфекцией.
Настоящее изобретение также касается применения настоящих соединений или любой из их подгрупп в производстве препарата для лечения или профилактики вирусных инфекций, в частности РСВ-инфекции.
Настоящее изобретение, кроме того, касается способа лечения теплокровных животных, инфицированных вирусом, или рискующих быть инфицированными вирусом, в частности РСВ, указанный способ включает введение антивирусно эффективного количества соединений формулы (I), как определено в этом документе, или соединения любых из подгрупп соединений формулы (I), как определено в данном документе.
В общем, рассматривается то, что антивирусно эффективное количество на сутки будет составлять от 0,01 мг/кг до 500 мг/кг массы тела, более предпочтительно, от 0,1 мг/кг до 50 мг/кг массы тела. Может быть предпочтительным вводить требуемую дозу в виде двух, трех, четырех или более микродоз с соответствующими интервалами на протяжении суток. Указанные микродозы могут быть созданы в виде однократных лекарственных форм, например, содержащих 1-1000 мг, и, в частности, 5-200 мг активного ингредиента на однократную лекарственную форму.
Точная дозировка и частота введения зависит от конкретного применяемого соединения формулы (I), конкретного излечиваемого состояния, выраженности излечиваемого состояния, возраста, веса, пола, степени нарушения и общего физического состояния конкретного пациента, так же, как от другого препарата, который пациент может принимать, как это хорошо известно квалифицированному специалисту в этой области. Более того, очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от реакции излечиваемого субъекта и/или в зависимости от оценки лечащего врача, назначающего применение соединений настоящего изобретения. Интервалы эффективных суточных доз, указанные выше, являются лишь рекомендательными.
Также комбинация другого антивирусного агента и соединения формулы (I) может быть использована в качестве лекарственного препарата. Таким образом, настоящее изобретение также касается продукта, содержащего (а) соединение формулы (I), и (b) другое антивирусное соединение, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в противовирусной терапии. Различные лекарства могут быть также объединены вместе в едином лекарственном препарате с фармацевтически приемлемыми носителями. Например, соединения настоящего изобретения могут быть объединены вместе с интерфероном-бета или альфа-фактором некроза опухоли для лечения или профилактики РСВ-инфекций.
ПРИМЕРЫ
Следующие примеры предназначены для иллюстрации настоящего изобретения, а не для ограничения его. Термины соединение 1, соединение 4, и т.д., применяемые в этих примерах, касаются этих же соединений в таблицах.
Данные соединения были проанализированы с помощью ЖХ/МС с применением одного из следующих способов:
LCT: ионизация электрораспылением в положительном режиме, сканирующем режиме от 100 до 900 единиц атомной массы; Xterra MS C18 (Waters, Milford, MA) 5 мкм, 3,9×150 мм); скорость потока 1 мл/мин. Две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетата аммония + 15% ацетонитрила; подвижная фаза В: 20% 6,5 мМ ацетата аммония + 80% ацетонитрила) применялись для прохождения градиента от 100% А за 3 мин до 100% В за 5 мин, 100% В за 6 мин до 100% А за 3 мин, и уравновешивали опять с помощью 100% А за 3 мин).
ZQ: ионизация электрораспылением как в положительном, так и отрицательном (пульсационном) сканирующих режимах от 100 до 1000 единиц атомной массы; Xterra RP C18 (Waters, Milford, MA) 5 мкм, 3,9×150 мм); скорость потока 1 мл/мин. Две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетата аммония + 15% ацетонитрила; подвижная фаза В: 20% 6,5 мМ ацетата аммония + 80% ацетонитрила) применялись для прохождения градиента от 100% А за 3 мин до 100% В за 5 мин, 100% В за 6 мин до 100% А за 3 мин, и уравновешивали опять с помощью 100% А за 3 мин).
Пример 1
Получение диметилбензимидазол-2-аминов
Схема А

Получение промежуточных соединений а-3 и а-4:
Смесь а-1(0,0268 моль), а-2 (0,0321 моль) и карбоната калия (0,0938 моль) в диметилформамиде (100 мл) перемешивали при 70°С в течение 12 часов. Растворитель выпаривали. Остаток экстрагировали 2-пропаноном. Осадок отфильтровывали. Растворитель маточного слоя выпаривали. Остаток (13,6 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 92/8/0,5; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали с получением 6,2 г смеси а-3 и а-4 (50/50) (общий выход 71%).
Получение промежуточных соединений а-5 и а-6:
Гидрид алюминия-лития (0,0367 моль) добавляли порционно при 0°С к смеси а-3 и а-4 (0,0184 моль) в тетрагидрофуране (ТГФ) (100 мл) в потоке азота. Смесь перемешивали при 5°С в течение 30 минут, затем при комнатной температуре в течение 2 часов. По каплям добавляли этилацетат (5 мл), затем Н2О (5 мл) при 0°С. Смесь фильтровали через целит. Целит промывали ТГФ и затем водой. Фильтрат экстрагировали раствором СН2Cl2 c 10% метанолом. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали. Остаток (5 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 92/8/0,5; 15-40 мкм). Две фракции собирали и растворитель выпаривали с получением 1,45 г а-5 (28%, температура плавления: >250°С) и 1,4 г а-6 (27%, температура плавления: 222°С).
Получение промежуточного соединения а-7:
MnO2 (10г) добавляли к смеси а-5 (0,0035 моль) в СН2Сl2/ТГФ (50 мл, 50/50) и метаноле (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и затем фильтровали через целит. Целит промывали смесью СН2Сl2/метанол (90/10). Фильтрат упаривали с получением 0,6 г а-7 (60%). Этот продукт был непосредственно использован на следующей стадии.
Получение промежуточного соединения а-8:
Это промежуточное соединение получали аналогично процедуре получения промежуточного соединения а-7.
Получение промежуточных соединений а-9 и а-10:
Вариант 1: Мета-метиланилин (0,0017 моль) добавляли при комнатной температуре к смеси а-7 (0,0017 моль) и СН2Сl2 (15 мл). Смесь перемешивали при комнатной температуре в течение 30 минут. При комнатной температуре добавляли уксусную кислоту (0,5 мл) и NaBH3CN (0,0017 моль). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов, выливали в воду, насыщенную К2СО3, и экстрагировали СН2Сl2. Органический слой промывали Н2О, высушивали над сульфатом магния, фильтровали и растворитель выпаривали. Остаток (0,45 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 90/10/0,5; 15-35 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,26 г, 40%) кристаллизовали из смеси 2-пропанон/диэтиловый эфир. Осадок фильтровали и высушивали с получением 0,195 г (30%, соединение 1, температура плавления: 234°С) 2-[2-амино-6-(м-толиламинометил)бензоимидазол-1-илметил]-6-метилпиридин-3-ола.
Вариант 2: Смесь а-7 (0,001 моль), мета-(ОСF3)-анилина (0,0015 моль), цианоборгидрида на твердой подложке (0,0021 моль) и уксусной кислоты (6 капель) в метаноле перемешивали при комнатной температуре в течение 48 часов, и затем фильтровали. Фильтрат упаривали. Остаток экстрагировали смесью СН2Сl2/метанол. Органический слой промывали 10%-ным раствором К2СО3, высушивали над сульфатом магния, фильтровали и растворитель выпаривали. Остаток (0,42 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 93/7/0,5; 15-35 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,15 г, 32%) кристаллизовали из смеси СН3СN/метанол. Осадок фильтровали и высушивали с получением 0,085 г (18%, соединение 4, температура плавления: 156°С) 2-{2-амино-6[(3-трифторметоксифениламино)метил]бензоимидазол-1-илметил}-6-метилпиридин-3-ола.
Вариант 3: Орто-метиланилин (0,000265 моль) добавляли к раствору а-7 (0,000177 моль) в метаноле (7 мл). Затем добавляли уксусную кислоту (3 капли) и цианоборгидрид на твердой подложке (0,000265 моль). Реакционную смесь оставляли при комнатной температуре в течение 48 часов. Реагент на твердой подложке отфильтровывали. К фильтрату добавляли триэтиламин (0,2 мл). Растворитель выпаривали. Остаток очищали колоночной хроматографией на селикагеле (элюент: СН2Cl2/CH3OH/NH4OH 90/10/0,5; 10 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,050 г, 65%) кристаллизовали из диизопропилового эфира. Осадок отфильтровали и высушивали с получением 0,027 г (35%, соединение 8, температура плавления: 120°С) уксуснокислой соли 2-[2-амино-6-(о-толиламинометил)бензоимидазол-1-илметил]-6-метилпиридин-3-ола.
Пример 2
Получение 6-аминометил-замещенных бензимидазол-2-аминов
Схема В

Получение промежуточного соединения b-2:
По каплям добавляли SOСl2 (0,0021 моль) при 5°С к раствору b-1 (0,0014 моль) в СН2Сl2 (10 мл). Смесь перемешивали при комнатной температуре в течение 4 часов. Осадок отфильтровывали, промывали СН2Сl2, затем диизопропиловым эфиром и высушивали с получением 0,49 г b-2 (100%).
Получение соединений формулы b-3:
Вариант 1: Смесь b-2 (0,0008 моль), (N-этанол)мета-метиланилина (0,0013 моль) и карбоната калия (0,003 моль) в диметилформамиде (5 мл) перемешивали при 80°С в течение 12 часов, выливали в воду и экстрагировали СН2Сl2. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и растворитель выпаривали. Остаток (0,4 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 93/7/0,5; 15-35 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,13 г, 35%) кристаллизовали из метанола. Осадок фильтровали и высушивали с получением 0,06 г (16%, соединение 129, температура плавления: 210°С) 2-(2-амино-6-{[(2-гидроксиэтил)-м-толиламино]метил}бензоимидазол-1-илметил)-6-метилпиридин-3-ола.
Вариант 2:
а) этиловый эфир 3-броммасляной кислоты (0,029 моль) и триэтиламина (0,0436 моль) добавляли к раствору 3-броманилина (0,029 моль) в толуоле (50 мл). Реакционную смесь перемешивали в колбе с обратным холодильником в течение 12 часов, и затем охлаждали до комнатной температуры. Осадок отфильтровывали. Растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: циклогексан: AcOEt 80/20; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали с получением 5 г этилового эфира 4-(3-бромфениламино)бутировой кислоты (60%, температура плавления: 65°С).
b) этиловый эфир 4-(3-бромфениламино)бутировой кислоты (0,00524 моль) в тетрагидрофуране (15 мл) добавляли по каплям к взвеси LiAlH4 (0,00786 моль) в тетрагидрофуране (15 мл) при 5°С в потоке N2. Реакционную смесь перемешивали при 5°С в течение 1 часа. Осторожно добавляли этилацетат и воду. Реакционную смесь экстрагировали смесью СН2Сl2/метанол (90/10). Органический слой разделяли, высушивали (над MgSO4) и фильтровали. Растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 96/4/0,3; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,76 г 4-(3-бромфениламино)бутан-1-ола (60%).
с) 2-(2-амино-6-{[(3-бромфенил)-(4-гидроксибутил)амино]метил}бензоимидазол-1-илметил)-6-метилпиридин-3-ол (соединение 139, температура плавления смолы: 120°С) синтезировали из 4-(3-бромфениламино)бутан-1-ола путем аналогичной процедуры, описанной в варианте 1 для синтеза соединений b-3.
Вариант 3:
а) Смесь этилового эфира 3-(3-броманилин)пропионовой кислоты (0,0037 моль) и насыщенный раствор NH3 в метаноле (15 мл) нагревали при 80°С в аппарате PARR в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: циклогексан:этилацетат 80/20; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,75 г 3-(3-бромфениламино)пропионамида (83%).
b) 3-[[2-амино-3-(3-гидрокси-6-метилпиридин-2-илметил)-3Н-бензоимидазол-5-илметил]-(3-бромфенил)амино]пропионамид (соединение 137, температура плавления смолы: 245°С) синтезировали из 3-(3-бромфениламино)пропионамида путем аналогичной процедуры, описанной в варианте 1 для синтеза соединений b-3.
Вариант 4:
а) К2СО3 (0,0109 моль) и 4-(2-хлорэтил)морфолин (1 HCl) (0,0036 моль) добавляли к раствору 2-этаноланилина (0,0036 моль) в СH3CN (15 мл). Реакционную смесь перемешивали при 80°С в течение 24 часов и затем охлаждали до комнатной температуры. Осадок отфильтровывали и промывали СH3CN. Раствор концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 98/2/0,1; 35-70 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,7 г 2-[2-(2-морфолин-4-илэтиламино)фенил]этанола (77%).
b) 2-(2-амино-6-{[[2-(2-гидроксиэтил)фенил-(2-морфолин-4-илэтил)амино]метил}бензоимидазол-1-илметил)-6-метилпиридин-3-ол (соединение 160, температура плавления: 184°С) синтезировали из 2-[-2-(2-морфолин-4-илэтиламино)фенил]этанола путем аналогичной процедуры, описанной в варианте 1 для синтеза соединений b-3.
Вариант 5:
а) Гидрат гидроксида лития (0,00093 моль) добавляли к раствору этилового эфира 3-{[2-амино-3-(3-гидрокси-6-метилпиридин-2-илметил)-3Н-бензоимидазол-5-илметил]-м-толиламино}пропионовой кислоты (0,000464 моль) в смеси с водой (10 мл) и тетрагидрофураном (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Тетрагидрофуран удаляли при пониженном давлении, и раствор подкисляли до pH 4 с помощью 1н раствора HCl в воде. Осадок отфильтровывали, промывали водой, затем диэтиловым эфиром и высушивали с получением 0,157 г 3-{[2-амино-3-(3-гидрокси-6-метилпиридин-2-илметил)-3Н-бензоимидазол-5-илметил]-м-толиламино}пропионовой кислоты (76%, соединение 161, температура плавления: 165°С).
Вариант 6:
а) Смесь b-2 (0,0016 моль), N-(этиламино-Вос)-мета-метиланилина (0,0016 моль) и К2СО3 (0,0048 моль) в диметилформамиде (10 мл) перемешивали при 80°С в течение 12 часов. Реакционную смесь вливали в воду и экстрагировали смесью СН2Сl2/метанол. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и растворитель выпаривали. Остаток (4 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 95/5/0,5; 10 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,11 г (13%) 2-{2-амино-6-[(пропил-м-толиламино]метил]бензоимидазол-1-илметил}-6-метилпиридин-3-ола (b-4).
b) Раствор HCl 5-6н в 2-пропаноле (0,5 мл) добавляли при комнатной температуре к смеси b-4 (0,0002 моль) в 2-пропаноле (15 мл). Реакционную смесь перемешивали при 60°С в течение 2 часов и затем охлаждали до комнатной температуры. Осадок отфильтровывали, промывали диэтиловым эфиром и высушивали с получением 0,075 г (65%, соединение 131, температура плавления: 200ºС) HCl соли 2-(2-амино-6-{[(2-аминоэтил)-м-толиламино]метил}бензоимидазол-1-илметил}-6-метилпиридин-3-ола.
Пример 3
Синтез 5- и 6-формилзамещенных бензимидазол-2-аминов
Схема С

Получение промежуточных соединений с-3 и с-4:
Промежуточное соединение с-2 (0,051 моль) добавляли при комнатной температуре к смеси промежуточного соединения с-1 (0,051 моль) и К2СО3 (0,053 моль) в ДМФ (150 мл). Смесь перемешивали при комнатной температуре в течение 24 часов. Растворитель выпаривали. Остаток экстрагировали СН2Сl2. Органический слой промывали Н2О, насыщенным раствором NaCl, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Остаток (24 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 96/4/0,1; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали с получением 13,4 г промежуточных соединений с-3 + с-4 (63%).
Получение промежуточных соединений с-5 и с-6:
LiAlH4 (0,0619 моль) добавляли порционно при 5°С к смеси с-3 + с-4 (0,031 моль) в ТГФ (150 мл) в потоке N2. Смесь перемешивали при 5°С в течение 30 минут, затем при комнатной температуре в течение 2 часов. По каплям медленно при 0°С добавляли Н2О (10 мл). Добавляли EtOAc (100 мл). Смесь фильтровали через целит. Целит промывали EtOAc, затем СН2Сl2/CH3OH. Фильтрат выпаривали. Остаток экстрагировали смесью СН2Сl2/CH3OH. Органический слой промывали Н2О, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Остаток (10,2 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 94/6/0,5; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали с получением 3 г промежуточного соединения с-5 (26%, температура плавления: 216°С) и промежуточного соединения с-6 (20%).
Получение промежуточного соединения с-7:
MnO2 (10 г) добавляли порционно при комнатной температуре к смеси с-5 (0,008 моль) в СН2Сl2 (200 мл). Смесь перемешивали при комнатной температуре в течение 4 часов и затем фильтровали через целит. Целит промывали смесью СН2Сl2/CH3OH (70/30). Фильтрат упаривали. Выход: 2,65 г промежуточного соединения с-7 (89%, температура плавления: 199°С).
Получение промежуточного соединения с-8:
Это промежуточное соединение получали в соответствии с процедурой, описанной для промежуточного соединения с-7.
Пример 4
Синтез гидроксиметилензамещенных бензимидазол-2-аминов
Схема D
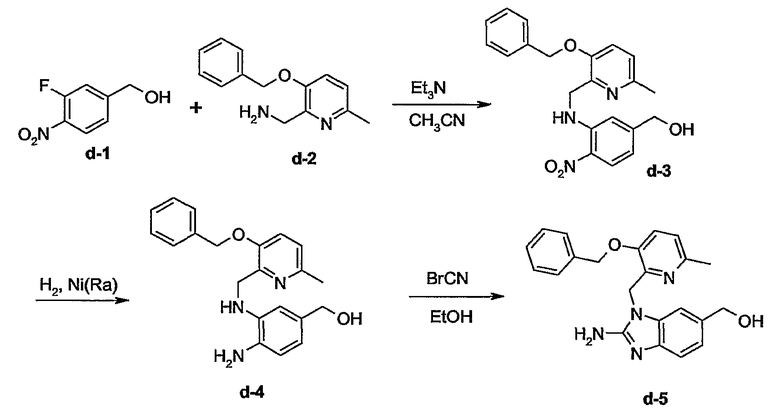
Получение промежуточного соединения d-3:
Смесь d-1 (0,0292 моль), d-2 (0,0438 моль) и NEt3 (0,0584 моль) в СН3СN (150 мл) перемешивали и нагревали в колбе с обратным холодильником в течение 12 часов, затем охлаждали до комнатной температуры и растворитель выпаривали. Смесь вливали в воду и экстрагировали EtOAc. Органический слой отделяли, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Остаток (12,5 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/EtOAc 96/4; 20-45 мкм). Выход: 2 г промежуточного соединения d-3 (45%, температура плавления: 140°С).
Получение промежуточного соединения d-4:
Cмесь d-3 (0,0081 моль) и никеля Ренея (3 г) в CH3OH (100 мл) гидрогенизировали при комнатной температуре в течение 2 часов, затем фильтровали через целит. Целит промывали CH3OH. Фильтрат концентрировали с получением 2,9 г промежуточного соединения d-4 (100%).
Получение промежуточного соединения d-5:
Cмесь b-4 (0,0083 моль) и BrСN (0,0091 моль) в EtOH (50 мл) перемешивали и нагревали в колбе с обратным холодильником в течение 1 часа, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток экстрагировали СН2Сl2. Органический слой промывали 10%-ным раствором К2СО3, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Остаток (3 г) представлял собой кристаллическую форму СН3СN. Осадок отфильтровывали и высушивали с получением 2,2 г промежуточного соединения d-5 (71%).
Пример 5
Синтез ариламинозамещенных бензимидазол-2-аминов
Схема Е


Получение 3-(4-метил-2-нитрофенил)-проп-2-ен-1-ола, промежуточного соединения (е-2):
Dibal-H (0,0255 моль) добавляли при -35°С к смеси этилового эфира 3-(4-метил-2-нитрофенил)акриловой кислоты (0,0085 моль) в ТГФ (80 мл) в потоке N2. Смесь перемешивали при -35°С в течение 15 минут. Н2О (20 мл) добавляли по каплям при -35°С в потоке N2. Смесь выпаривали наполовину. Добавляли СН2Сl2. Смесь фильтровали через целит. Целит промывали СН2Сl2. Фильтрат промывали Н2О. Органический слой отделяли, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Выход: 2 г 3-(4-метил-2-нитрофенил)проп-2-ен-1-ола (е-2) (100%).
Получение 3-(2-амино-4-метилфенил)пропан-1-ола, промежуточного соединения (е-3):
Смесь 3-(4-метил-2-нитрофенил)проп-2-ен-1-ола (е-2) (0,0085 моль) и никеля Ренея (1,6 г) в МеOH (30 мл) гидрогенизировали при комнатной температуре в течение 2 часов при давлении в 3 бара, затем фильтровали через целит. Целит промывали CH3OH. Фильтрат выпаривали. Выход: 1,7 г 3-(2-амино-4-метилфенил)пропан-1-ола (е-3) (86%, температура плавления: 65°С).
Получение промежуточного соединения е-5:
AcOH (10 капель), затем ВН3СN на твердой подложке (0,007 моль) добавляли при комнатной температуре к смеси е-4 (0,0035 моль) и 3-(2-амино-4-метилфенил)пропан-1-ола (е-3) (0,0052 моль) в МеОН (50 мл). Смесь фильтровали и затем промывали CH3OH. Фильтрат выпаривали. Остаток экстрагировали смесью СН2Сl2/CH3OH. Органический слой промывали 10%-ным раствором К2СО3, высушивали (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (2,7 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 95/5/0,1). Чистые фракции собирали и растворитель выпаривали. Выход: 1,3 г (71%). Эту фракция кристаллизовали из смеси 2-пропанон/диэтиловый эфир. Осадок отфильтровывали и высушивали. Выход: 0,026 г промежуточного соединения е-5 (соединение 128, температура плавления: 129°С).
Получение конечного соединения е-6:
Смесь е-5 (0,0024 моль) и Pd/C (0,3 г) в CH3OH (60 мл) гидрогенизировали при комнатной температуре в течение 1 часа и 30 минут при давлении в 1 бар и затем фильтровали через целит. Целит промывали CH3OH. Фильтрат выпаривали. Остаток (1,1 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 90/10/0,1; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,88 г) кристаллизовали из смеси 2-пропанон/диэтиловый эфир. Осадок отфильтровывали и высушивали. Выход: 0,735 г конечного соединения е-6 (68%, соединение 90, температура плавления: 248°С).
Пример 6
Синтез ариламинозамещенных бензимидазол-2-аминов
Схема F


Получение промежуточного соединения 2-(4-бром-2-нитрофенил)этанола (f-2):
Смесь 4-бром-1-метил-2-нитробензола (f-1) (0,01134 моль) и параформальдегида (0,009 моль) в ДМСО (5 мл) и Тритона В (0,35 мл) перемешивали при 50°С в течение 2 часов, затем охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH 98,5/1,5; 35-70 мкм). Чистые фракции собирали и растворитель выпаривали. Выход: 1,18 г 2-(4-бром-2-нитрофенил)этанола (f-2) (42%).
Получение промежуточного соединения 2-(2-амино-4-бромфенил)этанола (f-3):
Смесь 2-(4-бром-2-нитрофенил)этанола (f-2) (0,00203 моль) и никеля Ренея (0,5 г) в МеOH (20 мл) и тиофене (0,5 мл) гидрогенизировали при комнатной температуре в течение 2 часов при давлении в 3 бара, затем фильтровали через целит. Целит промывали CH3OH. Фильтрат концентрировали. Выход: 1,7 г 2-(2-амино-4-бромфенил)этанола (f-3) (91%).
Получение конечного соединения f-5 (соединение 93):
Это соединение получали в соответствии с процедурой, описанной для соединения е-5.
Пример 7
Синтез этинилфениламинозамещенных бензимидазол-2-аминов
Схема G
Получение промежуточного соединения g-2:
Диизопропилэтиламин (23,5 мл) добавляли по каплям к смеси g-1 (0,0047 моль), Pd(PPh3)2Cl2 (0,0002 моль) и CuI (0,0002 моль) в ТГФ (50 мл) в потоке N2. Этинилтриметилсилан (0,0095 моль) добавляли по каплям при комнатной температуре. Смесь перемешивали при 50°С в течение 12 часов в потоке N2, вливали в Н2О и экстрагировали EtOAc. Органический слой промывали Н2О и высушивали (над MgSO4), фильтровали и растворитель выпаривали. Остаток (3,1 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH 99/1). Чистые фракции собирали и растворитель выпаривали. Выход: 1 г промежуточного соединения е-2 (80%).
Получение промежуточного соединения g-3:
TiCl3 (0,0334 моль) добавляли по каплям при 0°С к смеси g-2 (0,0041 моль) в ТГФ (50 мл). Смесь перемешивали при комнатной температуре в течение 12 часов. Добавляли EtOAc. Смесь несколько раз промывали Н2О, 10%-ным раствором К2СО3 и в конечном итоге Н2О. Органический слой отделяли, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Выход: 0,82 г промежуточного соединения g-3 (84%).
Получение промежуточного соединения g-4:
Смесь g-3 (0,0022 моль), и К2СО3 (0,0066 моль) в CH3OH (20 мл) и Н2О (4 мл) перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали досуха. Остаток экстрагировали смесью СН2Сl2/H2O. Органический слой промывали Н2О, высушивали (над MgSO4), фильтровали и растворитель выпаривали с получением : 0,29 г промежуточного соединения g-4 (81%).
Получение конечного соединения g-6:
Это соединение получали в соответствии с процедурой, описанной для соединения с-5 (выход: 33%, соединение 92, температура плавления: 252°С).
Пример 8
Синтез алкилсульфониламинозамещенных бензимидазол-2-аминов
Схема H

Получение промежуточного соединения h-2:
Смесь h-1 (0,0092 моль), 2-меркаптоэтанола (0,0102 моль) и К2СО3 (0,0139 моль) в СН3СN (50 мл) перемешивали и нагревали в колбе с обратным холодильником в течение 6 часов, вливали в Н2О, экстрагировали EtOAc. Органический слой промывали Н2О, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Выход: 2,1 г промежуточного соединения h-2 (100%). Эту фракцию использовали непосредственно на следующей стадии.
Получение промежуточного соединения h-3:
Смесь h-2 (0,0098 моль) и никеля Ренея (2 г) в СН3ОН (50 мл) гидрогенизировали при комнатной температуре в течение 1 часа при давлении в 3 бара, затем фильтровали через целит. Целит промывали CH3OH. Фильтрат выпаривали. Выход: 1,5 г промежуточного соединения h-3 (83%).
Получение промежуточного соединения h-4:
Перборат натрия (NaBO3, 0,005 моль) добавляли по каплям при 0°С к смеси h-3 (0,0025 моль) в AcOH (5 мл). Смесь перемешивали при комнатной температуре в течение 12 часов, вливали в лед, подщелачивали К2СО3 и экстрагировали EtOAc. Органический слой отделяли, высушивали (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (0,46 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH 98/2; 10 мкм). Чистые фракции собирали и растворитель выпаривали. Выход: 0,16 г промежуточного соединения h-4 (30%).
Получение конечного соединения h-6
(соединение 100, температура плавления >260°С):
Это соединение получали в соответствии с процедурой, описанной для соединения е-6.
Пример 9
Синтез фениламинозамещенных бензимидазол-2-аминов
Схема I

Получение промежуточного соединения i-2:
Смесь i-1 (0,0185 моль) в этаноле (60 мл) и H2SO4 36н (5 мл) перемешивали и нагревали в колбе с обратным холодильником в течение 24 часов. Растворитель выпаривали. Остаток экстрагировали СН2Сl2. Органический слой промывали 10%-ным раствором К2СО3 в воде, высушивали (над MgSO4), фильтровали и растворитель выпаривали с получением 3,2 г i-2 (89%). Эту неочищенную фракцию непосредственно использовали на следующей стадии.
Получение промежуточного соединения i-3:
Смесь i-2 (0,0144 моль) и BrСN (0,0158 моль) в этаноле (30 мл) перемешивали и нагревали в колбе с обратным холодильником в течение 2 часов. Растворитель выпаривали. Остаток поглощали 10%-ным раствором К2СО3 в воде, экстрагировали смесью СН2Сl2/метанол. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и растворитель выпаривали с получением 2,3 г i-3 (73%). Эту неочищенную фракцию непосредственно использовали на следующей стадии.
Получение промежуточного соединения i-5:
Смесь с-3 (0,0095 моль), i-4 (0,0115 моль) и К2СО3 (0,0335 моль) в диметилформамиде (50 мл) перемешивали при 70°С в течение 12 часов, затем охлаждали до комнатной температуры и поглощали 2-пропаноном. Осадок фильтровали и промывали 2-пропаноном. Фильтрат выпаривали. Остаток (4,5 г) кристаллизовали из смеси СН2Сl2/метанол. Осадок отфильтровывали и высушивали с получением 2,4 г с-5 (74%, температура плавления: >250°С).
Получение промежуточного соединения i-6:
LiAlH4 (0,0106 моль) добавляли порционно при 5°С к смеси i-5 (0,0052 моль) в ТГФ (50 мл) в потоке азота. Реакционную смесь перемешивали при 5°С в течение 30 минут, затем при комнатной температуре в течение 6 часов. Осторожно добавляли воду. Смесь фильтровали через прокладку из целита. Прокладку промывали водой, затем ТГФ. Фильтрат выпаривали. Остаток поглощали смесью СН2Сl2/метанол. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и растворитель выпаривали с получением 1,7 г i-6 (100%).
Получение промежуточного соединения i-7:
MnO2 (4 г) добавляли порционно при комнатной температуре к смеси i-6 (0,0013 моль) в СН2Сl2 (20 мл) и метаноле (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем фильтровали через прокладку из целита. Прокладку промывали СН2Сl2/CH3OH. Фильтрат выпаривали с получением 0,5 г i-7 (69%).
Получение промежуточного соединения i-8:
Смесь i-7 (0,0006 моль), м-метиланилина (0,0008 моль), цианборгидрида на твердой подложке (0,001 моль) и уксусной кислоты (6 капель) в метаноле (20 мл) перемешивали при комнатной температуре в течение 48 часов, затем фильтровали и промывали смесью СН2Сl2/метанол. Фильтрат выпаривали. Остаток (0,32 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/метанол/NH4OH 90/10/0,5; 10 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,054 г, 31%) кристаллизовали из диэтилового эфира. Осадок отфильтровывали и высушивали с получением 0,036 г (21%) 2-[2-амино-4-метил-6-(м-толиламинометил)бензоимидазол-1-илметил]-6-метилпиридин-3-ола.
Пример 10
Синтез аминоалкилзамещенных бензимидазол-2-аминов
Схема J

Получение промежуточного соединения j-2:
Диэтилцианометилфосфонат (0,0021 моль) добавляли по каплям при 5°С к раствору NaH (0,0043 моль) в ТГФ (10 мл) в потоке азота. Смесь перемешивали при 5°С в течение 30 минут в потоке азота. Порционно добавляли j-1 (0,0007 моль). Смесь перемешивали при 5°С в течение 1 часа и затем при комнатной температуре в течение 12 часов и вливали в лед. Водный слой насыщали К2СО3 и экстрагировали смесью СН2Сl2/метанол. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и растворитель выпаривали с получением 0,5 г j-2 (100%). Этот неочищенный продукт непосредственно использовали на следующей стадии.
Получение промежуточного соединения j-3:
Смесь j-2 (0,0007 моль) и Pd/C (0,1 г) в метаноле (20 мл) гидрогенизировали при комнатной температуре в течение 12 часов при давлении в 3 бара, затем фильтровали через прокладку из целита. Прокладку промывали метанолом. Фильтрат выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/метанол/NH4OH 90/10/0,5; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,25 г, 100%) кристаллизовали из смеси СН3СN/диизопропиловый эфир. Осадок отфильтровывали и высушивали с получением 0,055 г j-3 (25%, соединение 198, температура плавления: 242°С).
Получение соединения j-4:
Смесь j-3 (0,0006 моль) и никеля Ренея (0,2 г) в смеси метанол/NН3 7н (30 мл) гидрогенизировали при комнатной температуре в течение 12 часов при давлении в 3 бара, затем фильтровали через прокладку из целита. Прокладку промывали метанолом. Фильтрат выпаривали. Остаток растворяли в смеси изопропанол/HCl и переводили в соль хлористоводородной кислоты. Осадок отфильтровывали и высушивали с получением 0,058 г j-4 (22%, соединение 196, температура плавления: 195°С).
Пример 11
Синтез диметилзамещенных бензимидазол-2-аминов
Схема К
Смесь k-1 (0,031 моль), k-2 (0,0372 моль) и К2СО3 (0,0183 моль) в диметилформамиде (150 мл) перемешивали при 70°С в течение 24 часов. Растворитель выпаривали. Остаток поглощали СН2Сl2. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и растворитель выпаривали. Остаток (12 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/метанол/NH4OH 90/10/0,5; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (6,8 г, 78%) кристаллизовали из смеси СН3СN/диизопропиловый эфир. Осадок отфильтровывали и высушивали с получением 0,506 г k-3 (соединение 199, температура плавления: >260°С).
Пример 12
Синтез фенил(гидроксиметил)замещенных бензимидазол-2-аминов
Схема L
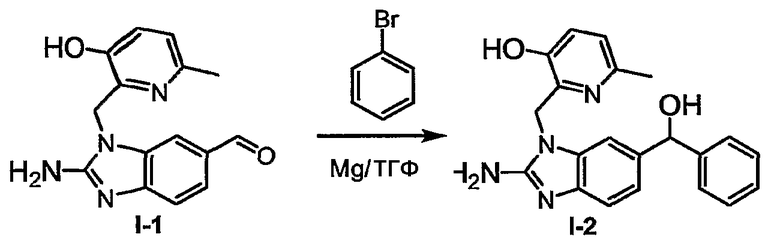
Бромбензол (0,0026 моль) добавляли по каплям к смеси магнезии (0,0026 моль) в ТГФ (10 мл) в потоке азота. Смесь перемешивали при комнатной температуре в потоке азота до исчезновения магнезии. Порционно добавляли I-1 (0,0002 моль). Смесь перемешивали при комнатной температуре в течение 2 часов. По каплям добавляли 10%-ный раствор NH4Cl в воде (3 мл) при 0°С. Смесь экстрагировали смесью СН2Сl2. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и растворитель выпаривали. Остаток (0,2 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/метанол/NH4OH 90/10/0,5; 5 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,035 г I-2 (соединение 197, 36%).
Пример 13
Синтез 1-(пиридинилметил)-6-бензоиламидобензимидазолов
Схема М

Получение смеси промежуточных соединений m-3 и m-4:
m-2 (0,0368 моль) добавляли к смеси m-1 (0,03 моль) и К2СО3 (0,107 моль) в СН3СN (200 мл). Реакционную смесь перемешивали и нагревали с обратным холодильником 12 часов. Растворитель выпаривали. Остаток поглощали СН2Сl2. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и растворитель выпаривали, с 15,5 г смеси m-3 и m-4 (100%).
Получение промежуточных соединений m-5 и m-6:
Смесь m-3 и m-4 (0,03 моль) и никеля Ренея (11 г) в метаноле (200 мл) гидрогенизировали при комнатной температуре в течение 1 часа при давлении в 3 бара, затем фильтровали через прокладку из целита. Прокладку промывали метанолом. Фильтрат выпаривали. Остаток (12 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/метанол/NH4OH 97/3/0,1; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали с получением 5 г m-5 (48%) и 4,8 г m-6 (45%).
Получение промежуточного соединения m-7:
Добавляли бензойную кислоту (0,0005 моль) при комнатной температуре к смеси m-5 (0,0005 моль) и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,0006 моль) в СН2Сl2 (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и вливали в воду. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и растворитель выпаривали с получением 0,27 г m-7 (100%). Данное неочищенное соединение использовали на следующей стадии.
Получение соединения m-8:
Смесь m-7 (0,0005 моль) и Pd/C (0,05 г) в метаноле (30 мл) гидрогенизировали при комнатной температуре в течение 8 часов при давлении в 5 бар, и затем фильтровали через прокладку из целита. Прокладку промывали метанолом. Фильтрат выпаривали. Остаток (0,42 г) очищали колоночной хроматографией (элюент: СН2Сl2/метанол/NH4OH 95/5/0,5; 10 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,09 г, 43%) кристаллизовали из этанола. Осадок отфильтровывали и высушивали с получением 0,057 г m-8 (27%, соединение 198, температура плавления: >250°С).
Пример 14
Синтез 1-(пиридилметил)5- и 6-формилбензимидазолов
Схема N

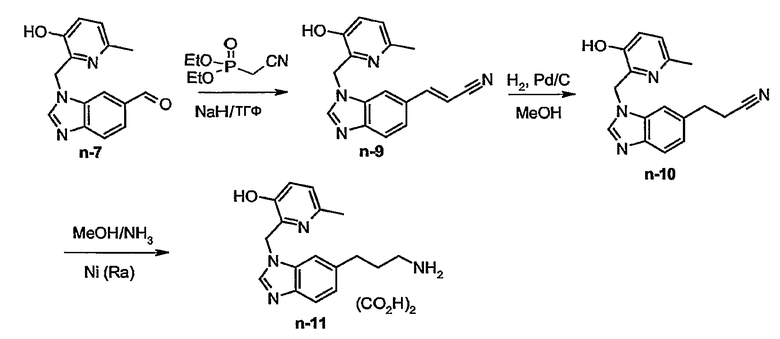
Получение промежуточных соединений n-3 и n-4:
Смесь n-1 (0,0708 моль), n-2 (0,077 моль) и К2СО3 (0,02455 моль) в диметилформамиде (130 мл) перемешивали при 70°С в течение 24 часов. Растворитель выпаривали. Остаток поглощали СН2Сl2. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и растворитель выпаривали. Остаток поглощали ацетоном. Осадок отфильтровывали и высушивали с получением 16,2 г смеси n-3 и n-4 (74%).
Получение промежуточных соединений n-5 и n-6:
LiAlH4 (0,052 моль) добавляли порционно при 5°С к смеси n-5 и n-6 (0,026 моль) в ТГФ (160 мл) в потоке азота. Реакционную смесь перемешивали при 5°С в течение 2 часов. Осторожно добавляли этилацетат и воду. Смесь фильтровали через прокладку из целита. Прокладку промывали водой, затем ТГФ. Фильтрат выпаривали. Остаток поглощали смесью СН2Сl2/метанол. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и растворитель выпаривали с получением 13 г смеси n-5 и n-6 (92%). Два соединения разделяли колоночной хроматографией на силикагеле (элюент: СН2Сl2/метанол/NH4OH 90/10/0,5; 10 мкм).
Получение промежуточного соединения n-7:
MnO2 (36 г) добавляли порционно к смеси n-5 (0,014 моль) в СН2Сl2/ТГФ (400 мл) и метаноле (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и затем фильтровали через прокладку из целита. Прокладку промывали смесью СН2Сl2/метанол. Фильтрат выпаривали с получением 3,5 г n-7 (93%). Этот продукт непосредственно использовался в следующей стадии.
Получение промежуточного соединения n-9:
Диэтилцианометилфосфонат (0,0033 моль) добавляли по каплям при 5°С к смеси NaH (0,0011 моль) в ТГФ (15 мл) в потоке азота. Смесь перемешивали при 5°С в течение 30 минут в потоке азота. Раствор n-7 (0,0011 моль) в ТГФ (15 мл) добавляли по каплям при 5°С. Реакционную смесь перемешивали при 5°С в течение 1 часа и затем при комнатной температуре в течение 2 часов и вливали в воду. Водный слой насыщали К2СО3 и экстрагировали смесью этилацетат/метанол. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и растворитель выпаривали с получением 1 г n-9 (100%, соединение 189, температура плавления: >250°С, смесь E/Z (90/10)).
Получение промежуточного соединения n-10:
Смесь n-9 (0,0007 моль) и Pd/C (0,1 г) в метаноле (15 мл) гидрогенизировали при комнатной температуре в течение 12 часов при давлении в 3 бар и затем фильтровали через прокладку из целита. Прокладку промывали метанолом. Фильтрат выпаривали с получением 0,2 г n-10 (91%). Этот неочищенный продукт непосредственно использовался в следующей стадии.
Получение соединения n-11:
Смесь n-10 (0,0006 моль) и никеля Ренея (0,2 г) в смеси метанол/NH3 7н (20 мл) гидрогенизировали при комнатной температуре в течение 4 часов при давлении в 3 бара, затем фильтровали через прокладку из целита. Прокладку промывали метанолом. Фильтрат выпаривали. Остаток (0,33 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/метанол/NH4OH 85/14/1; 15-35 мкм) с получением 0,128 г свободного основания n-11 (72%). Данное соединение растворяли в СН3СN и переводили в форму соли этандиовой кислоты. Фильтрат отфильтровывали и высушивали с получением 0,031 г n-11 (10%, соединение 188, температура плавления: 205°С).
Пример 15
Синтез 1-(пиридилметил)-6-аминометилбензимидазолов
Схема О
Мета-хлоранилин (0,000224 моль) добавляли к раствору о-1 (0,187 моль) в метаноле (5 мл). Затем добавляли уксусную кислоту (1 каплю) и цианоборгидрид на твердой подложке (0,224 ммоль). Реакционную смесь оставляли при комнатной температуре в течение 48 часов. Реагент на твердой подложке отфильтровывали. Растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/СН3ОН/NH4OH 90/10/0,5; 10 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,044 г (62%, соединение 186) 2-{6-[(3-хлорфениламино)метил]бензоимидазол-1-илметил}-6-метилпиридин-3-ола.
Пример 16
Синтез 1-(пиридилметил)-6-аминометилбензимидазол-2-аминов
Схема Р
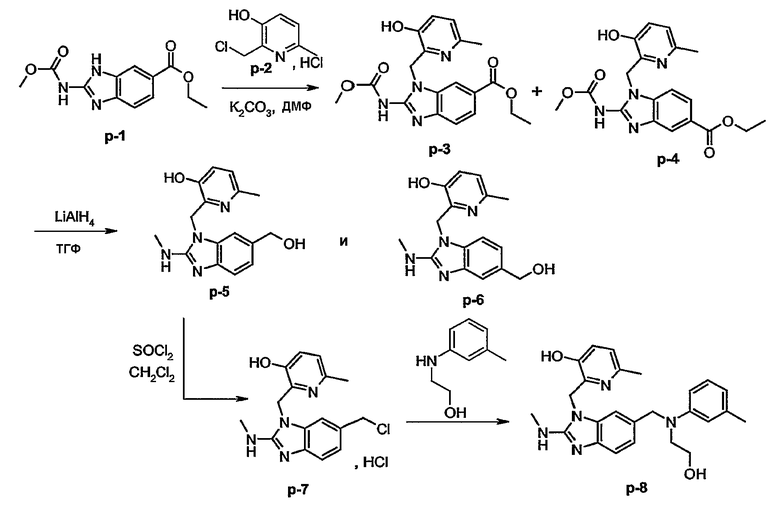
Получение промежуточных соединений р-3:
Промежуточное соединение р-3 получали из р-1 и р-2 (которые идентичны k-2) с помощью тех же методик, что использовались для получения k-3.
Получение промежуточных соединений р-5 и р-6:
LiAlH4 (0,0198 моль) добавляли порционно к раствору р-3 и р-4 (0,00494 моль; промежуточные соединения получали аналогично соединениям с-3 и с-4) в тетрагидрофуране (50 мл) при 5°С в потоке азота. Реакционную смесь перемешивали при 5°С в течение 0,5 часа и затем при 40°С в течение 12 часов. Реакционную смесь охлаждали до 5°С и очень осторожно по каплям добавляли этилацетат и воду. Раствор фильтровали через целит. Прокладку промывали водой и тетрагидрофураном. Раствор насыщали порошком К2СО3 и экстрагировали смесью СН2Сl2/метанол (90/10). Органический слой отделяли, высушивали (над MgSO4) и выпаривали досуха. Два изомера разделяли колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 90/10/1; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,21 г р-5 (14%, температура плавления: >260°С) и 0,35 г р-6 (24%, температура плавления: >260°С).
Получение промежуточных соединений р-7 и р-8:
Хлористоводородную соль 2-(6-хлорметил-2-метиламинобензоимидазол-1-илметил)-6-метилпиридин-3-ола (полученную аналогично промежуточному соединению b-2) использовали в качестве исходного материала для получения 2-(6-{[(2-гидроксиэтил)-м-толиламино]метил}-2-метиламинобензоимидазол-1-илметил)-6-метилпиридин-3-ола (соединение 188, температура плавления: 204°С) аналогично получению соединений формулы b-3.
Пример 17
Синтез 1-хинолилметил-6-аминометилбензимидазол-2-аминов
Схема Q

Синтез промежуточных соединений q-5 и q-6:
Промежуточные соединения синтезировали аналогично методике, описанной для промежуточных соединений с-5 и с-6. Два изомера разделяли колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 92/8/0,5; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,43 г (2-амино-3-хинолин-8-илметил-3Н-бензоимидазол-5-ил)-метанола (q-5, 18%, соединение 222, температура плавления: 230°С) и 0,24 г (2-амино-3-хинолин-8-илметил-1Н-бензоимидазол-5-ил)метанола (q-6, соединение 224, 10%, температура плавления: >260°С).
Получение промежуточных соединений q-7 и q-8:
Хлористоводородную соль 6-хлорметил-1-хинолин-8-илметил-1Н-бензоимидазол-2-иламина (полученную аналогично промежуточному соединению d-2) использовали в качестве исходного материала для получения 3-2-[(2-амино-3-хинолин-8-илметил-3Н-бензоимидазол-5-илметил)-м-толиламино]пропан-1-ола (соединение 222, температура плавления: 191°С), аналогично получению соединений формулы d-3.
Пример 18
Синтез бициклических промежуточных соединений R 1 -G-W
Схема R

Смесь 2,3-диметил-5,6,7,8-тетрагидрохиноксалина (0,0198 моль), N-бромсукцинимида (0,0198 моль) и бензоилпероксида (0,0017 моль) в CCl4 (237 мл) перемешивали и нагревали с обратным холодильником в течение 30 минут и затем фильтровали. Фильтрат выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH 100/0 и 95/5; 35-70 мкм). Чистые фракции собирали и растворитель выпаривали. Выход: 2,61 г промежуточного соединения r-2 (55%).
Пример 19
Синтез промежуточных соединений R 1 -G-W
Схема S

Синтез промежуточного соединения s-2:
NaH (0,054 моль) добавляли порционно к смеси этилового эфира 1Н-бензоимидазол-4-карбоновой кислоты (0,045 моль) в ДМФ (50 мл) при 5°С в потоке N2. Смесь перемешивали при 0°С в течение 1 часа в потоке N2. По каплям при 0°С в потоке N2 добавляли CH3I (0,045 моль). Смесь перемешивали при комнатной температуре в потоке N2 в течение 2 часов, гидролизовали ледяной водой и экстрагировали смесью СН2Сl2. Органический слой отделяли, промывали несколько раз H2O, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Остаток (10,5 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH 97/13; 20-45 мкм). Две чистые фракции собирали и их растворители выпаривали. Выход: 7 г промежуточного соединения s-2 (76%, температура плавления: 86°С).
Синтез промежуточного соединения s-3:
LiAlH4 (0,0342 моль) суспендировали порционно в ТГФ (100 мл) при 0°С в потоке N2. Раствор s-2 (0,0342 моль) в небольшом количестве ТГФ добавляли по каплям при 0°С в потоке N2. Смесь перемешивали при 0°С в течение 2 часов, гидролизовали EtOAc и Н2О, декантировали и экстрагировали EtOAc. Органический слой отделяли, промывали Н2О, высушивали (над MgSO4), фильтровали, и растворитель выпаривали. Остаток (4,3 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 97/3/0,1; 15-40 мкм). Желаемые фракции собирали и растворитель выпаривали. Выход: 2,6 г промежуточного соединения s-3 (47%, температура плавления: 116°С).
Синтез промежуточного соединения s-4:
SOCl2 (0,0222 моль) добавляли порционно при 5°С к раствору s-3 (0,0148 моль) в
СН2Сl2 (70мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, вливали в лед, подщелачивали 10%-ным раствором К2СО3 и экстрагировали
СН2Сl2. Органический слой отделяли, промывали Н2О, высушивали (над MgSO4), фильтровали и растворитель выпаривали. Выход: 2,8 г промежуточного соединения s-4 (100%). Данный продукт использовали без дополнительной очистки.
Пример 20
Синтез 1-замещенных бензимидазол-2-аминов
Схема Т
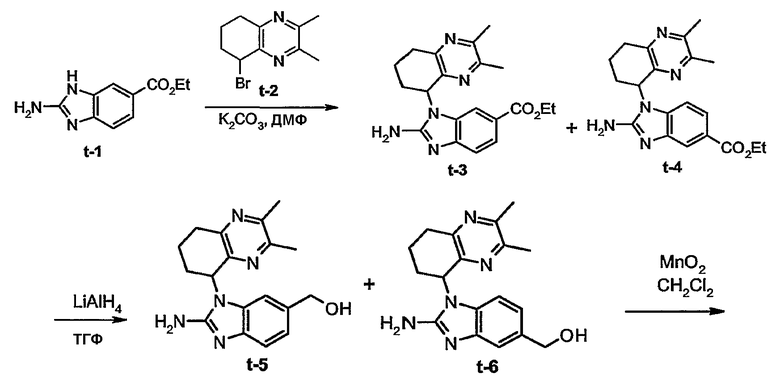

Смесь t-1 (0,005 моль), t-2 (0,0059 моль) и К2СО3 (0,0074 моль) в ДМФ (25 мл) перемешивали при комнатной температуре в течение 24 часов, вливали в лед, насыщали К2СО3 (порошок) и экстрагировали СН2Сl2. Органический слой отделяли, высушивали (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (2 г) очищали колоночной хроматографией на силикагеле
(элюент: СН2Сl2/CH3OH/NH4OH 89/10/0,1; 15-40 мкм). Чистые фракции собирали и растворитель выпаривали. Выход: 1,285 г смеси t-3 + t-4 (50/50, 70%).
LiAlH4 (0,007 моль) добавляли порционно к смеси t-3 + t-4 в ТГФ (30 мл) в потоке N2. Смесь перемешивали при 5°С в течение 30 минут и затем при комнатной температуре в течение 2 часов. Добавляли Н2О (10 мл). Смесь фильтровали через целит. Целит промывали смесью СН2Сl2/CH3OH (50/50). Фильтрат выпаривали. Остаток (1,1 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 88/12/1; 15-40 мкм). Две фракции собирали и растворитель выпаривали. Выход: 0,15 г t-5 (13%) и 0,115 г t-6 (10%).
Смесь t-5 (0,0004 моль) и MnO2 (1,5 г) в СН2Сl2 (40 мл) перемешивали при комнатной температуре в течение 4 часов, затем фильтровали через целит. Целит промывали СН2Сl2. Фильтрат выпаривали. Остаток (0,16 г) очищали колоночной хроматографией на силикагеле (элюент: СН2Сl2/CH3OH/NH4OH 94/6/0,5; 10 мкм). Чистые фракции собирали и растворитель выпаривали с получением 0,059 г t-7 (40%).
Пример 21
Синтез 1-бициклил-6-замещенных бензимидазол-2-аминов
Схема U

Смесь u-1 (0,0001 моль), u-2 (0,0002 моль), BН3СN на твердой подложке (0,0002 моль) и CH3CO2H (3 капли) в CH3OH (10 мл) перемешивали при комнатной температуре в течение 12 часов. Растворитель выпаривали досуха. Остаток поглощали смесью СН2Сl2/CH3OH. Смесь подщелачивали 10%-ным раствором К2СО3, насыщенным К2СО3 (порошок) и экстрагировали СН2Сl2. Органический слой отделяли, высушивали (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток кристаллизовали из смеси 2-пропанон/диизопропиловый эфир. Осадок отфильтровывали и высушивали с получением 0,042 г u-3 (49%, соединение 206, температура плавления: 165°С).
Пример 22
Синтез 1-[(4-бензимидазолил)метил-5-формилбензимидазол-2-аминов
Схема V
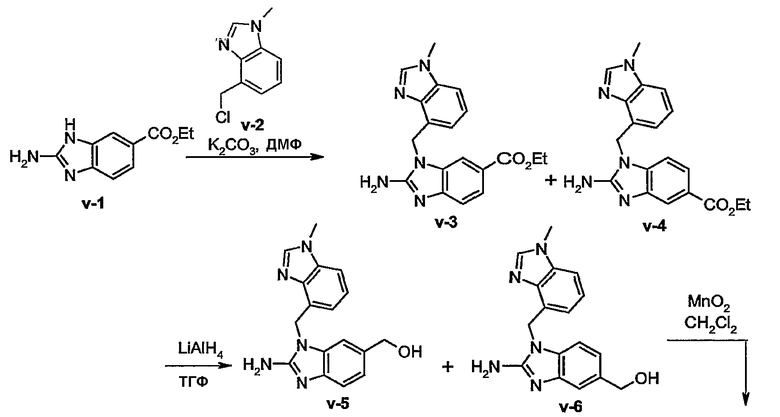

Смесь промежуточных соединений v-3 + v-4 (50/50, 93%, температура плавления: 144°С) синтезировали в соответствии с методикой, описанной для смеси промежуточных соединений t-3 + t-4.
Соединения v-5 (33%, соединение 223, температура плавления: 258°С) и v-6 (35%, температура плавления: 260°С) синтезировали в соответствии с методикой, описанной для промежуточных соединений t-5 и t-6.
Соединение v-7 (81%) синтезировали в соответствии с методикой, описанной для промежуточного соединения t-7.
Конечное соединение v-9 (28%, соединение 211, температура плавления: 174°С) синтезировали в соответствии с методикой, описанной для конечного соединения u-3.
Пример 23
Синтез 1-хинолонилметилбензимидазол-2-аминов
Схема W


Промежуточное соединение w-2 идентично промежуточному соединению q-2.
Смесь промежуточных соединений w-3 + w-4 (50/50, 32%) синтезировали в соответствии с методикой, описанной для смеси промежуточных соединений t-3 + t-4.
Промежуточные соединения w-5 (18%, температура плавления: 230°С) и w-6 (10%, температура плавления: >260°С) синтезировали в соответствии с методикой, описанной для промежуточных соединений t-5 и t-6.
Промежуточное соединение w-7 (81%) синтезировали в соответствии с методикой, описанной для промежуточного соединения t-7.
Пример 24
Синтез 1-хинолонилметил-6-фениламинометилбензимидазол-2-аминов
Схема Х

Конечное соединение х-2 (26%, соединение 214, температура плавления: 194°С) синтезировали в соответствии с методикой, описанной для конечного соединения u-3.
Пример 25
Синтез 1-пиридилметил-6-фениламинометилбензимидазол-2-аминов
Схема Y

Смесь промежуточных соединений y-3 и y-4 (50/50, 57%) синтезировали в соответствии с методикой, описанной для смеси промежуточных соединений t-3 и t-4.
Промежуточные соединения y-5 (12%) и y-6 (9%) синтезировали в соответствии с методикой, описанной для промежуточных соединений t-5 и t-6.
Промежуточное соединение y-7 (91%) синтезировали в соответствии с методикой, описанной для промежуточного соединения t-7.
Конечное соединение y-9 (30%, соединение 209, температура плавления: 212°С) синтезировали в соответствии с методикой, описанной для конечных соединений u-3.
Пример 26
Синтез (6-бром-1-пиридил)метил 5- и 6-аминометилбензимидазол-2-аминов
Схема Z

Смесь промежуточных соединений z-3 + z-4 (50/50, 40%) синтезировали в соответствии с методикой, описанной для смеси промежуточных соединений t-3 + t-4.
Промежуточные соединения z-5 (18%, соединение 226, температура плавления 221°С) и z-6 (16%, соединение 227, температура плавления: 230°С) синтезировали в соответствии с методикой, описанной для промежуточных соединений t-5 и t-6.
Промежуточное соединение z-7 (80%) синтезировали в соответствии с методикой, описанной для промежуточного соединения t-7.
Конечное соединение z-10 (48%, соединение 212, температура плавления: 158°С) синтезировали в соответствии с методикой, описанной для конечных соединений u-3.
Пример 27
Схема AA
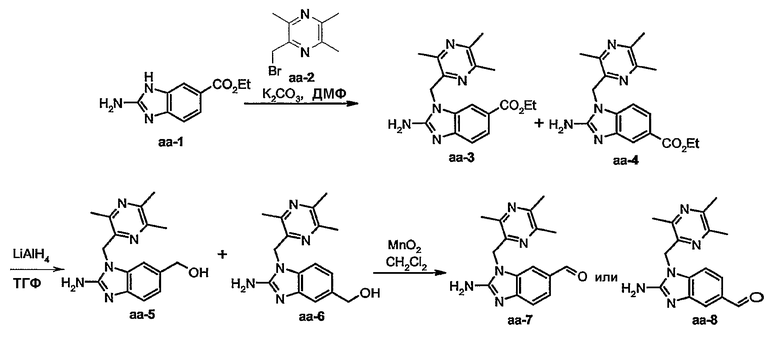
Смесь промежуточных соединений аа-3 + аа-4 (50/50, 35%) синтезировали в соответствии с методикой, описанной для смеси промежуточных соединений t-3 + t-4.
Промежуточные соединения аа-5 (24%) и аа-6 (18%) синтезировали в соответствии с методикой, описанной для промежуточных соединений t-5 и t-6.
Промежуточное соединение аа-7 (100%) синтезировали в соответствии с методикой, описанной для промежуточного соединения t-7.
Пример 28
Схема АВ

Конечное соединение аb-3 (43%, соединение 217, температура плавления: 175°С) синтезировали в соответствии с методикой, описанной для конечных соединений u-3.
Пример 29
Схема АС

Смесь промежуточных соединений ас-3 + ас-4 (50/50, 46%, температура плавления 193°С) синтезировали в соответствии с методикой, описанной для смеси промежуточных соединений t-3 + t-4.
Промежуточные соединения ас-5 (33%, соединение 236, температура плавления 202°С) и ас-6 (21%, соединение 237, температура плавления: >260°С) синтезировали в соответствии с методикой, описанной для промежуточных соединений t-5 и t-6.
Промежуточное соединение ас-7 (100%) синтезировали в соответствии с методикой, описанной для промежуточного соединения t-7.
Пример 30
Схема AD

Конечное соединение ad-2 (46%, соединение 219, температура плавления: 179°С) синтезировали в соответствии с методикой, описанной для конечных соединений o-5.
Соединения, приведенные в следующих таблицах, получали аналогично одной из приведенных выше схем синтеза. Данные таблицы включают физико-химические данные, такие как данные масс-спектров (МН+) и/или точку плавления. Любой радикал, приведенный в этих таблицах, связан с остатком молекулы с помощью «открытой» связи, то есть связи, которая с одной стороны не имеет радикала.
Таблица 1
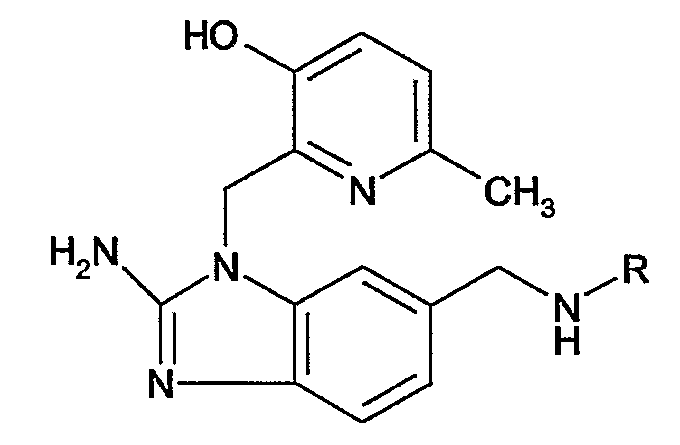

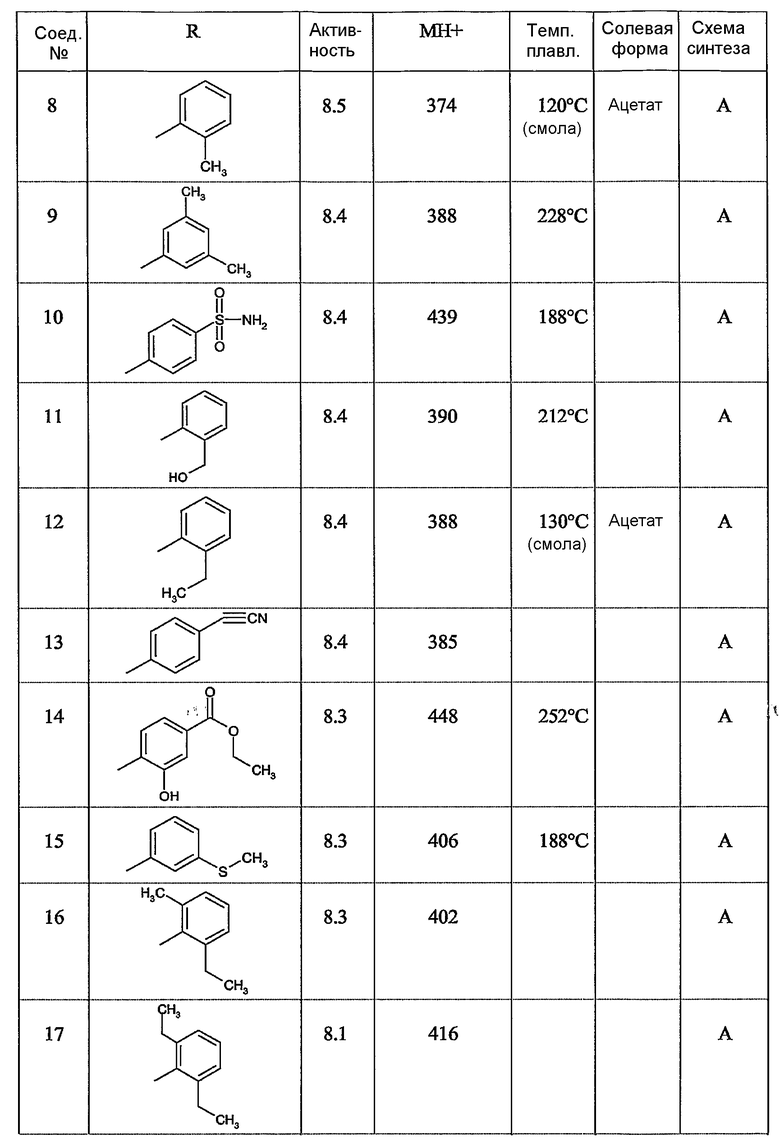





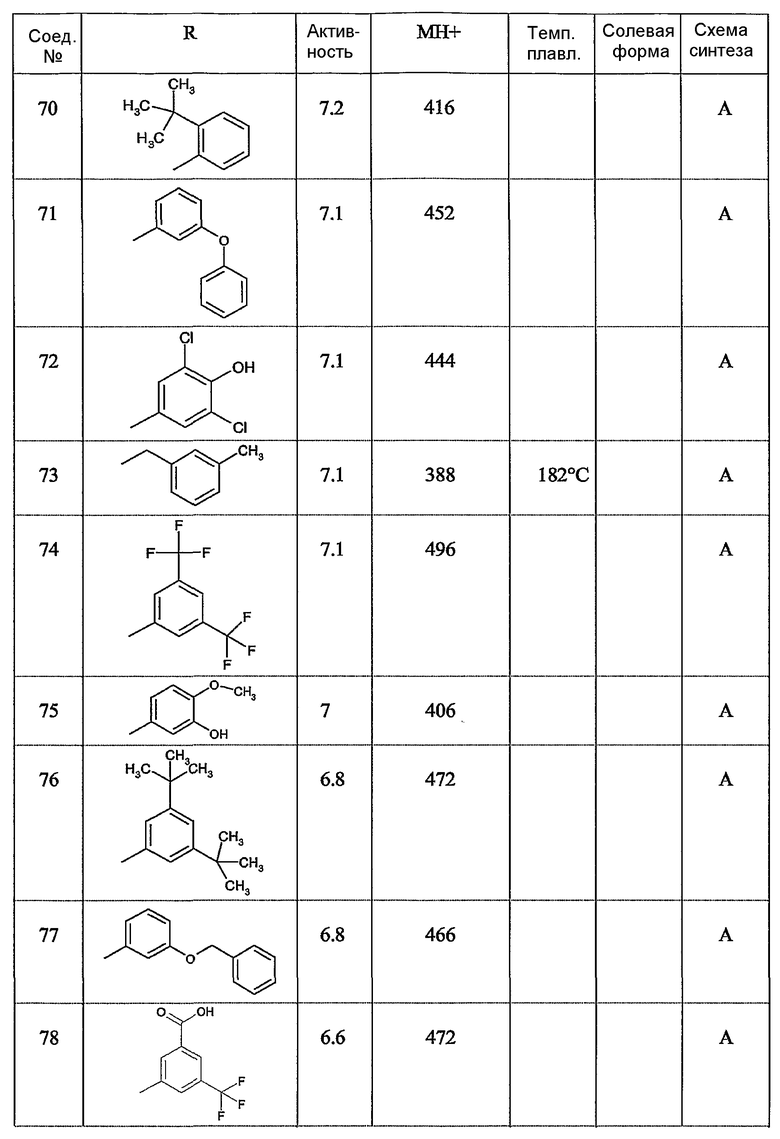
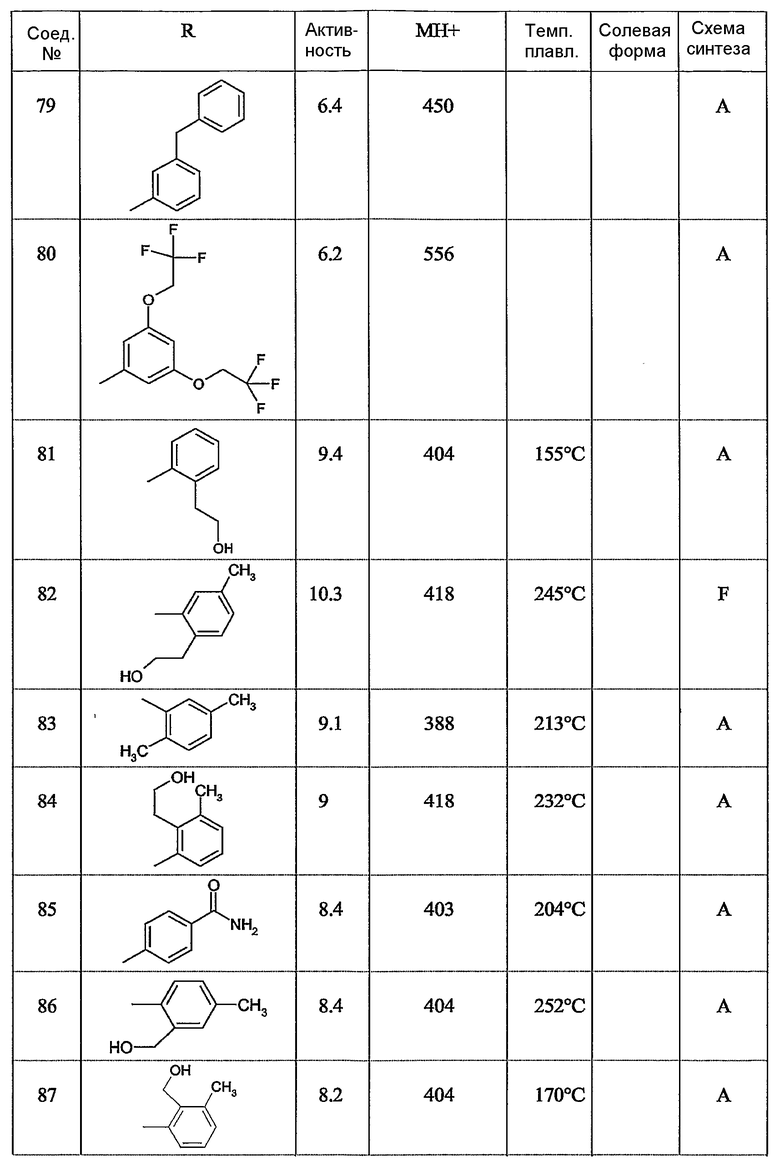



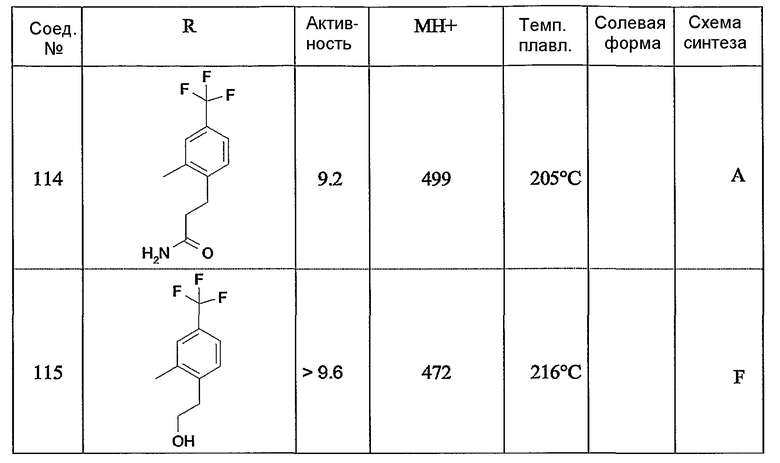
Таблица 2



Соединение, полученное в соответствии со схемой Е
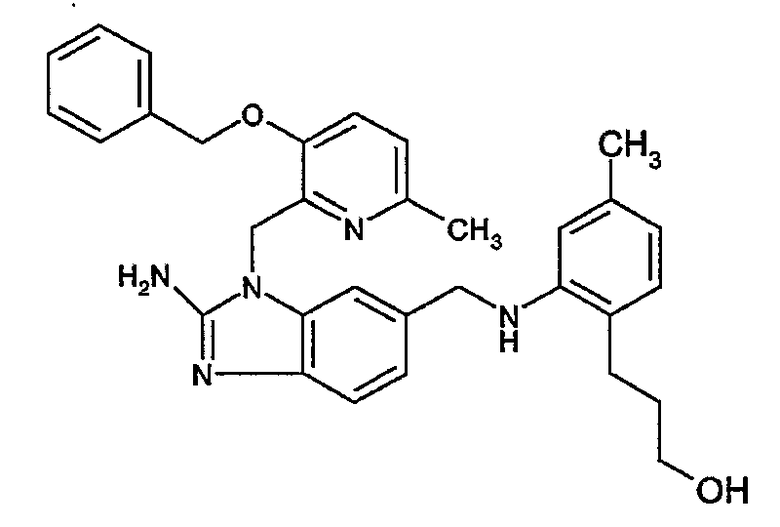
Таблица 3
Соединения, полученные в соответствии со схемой В




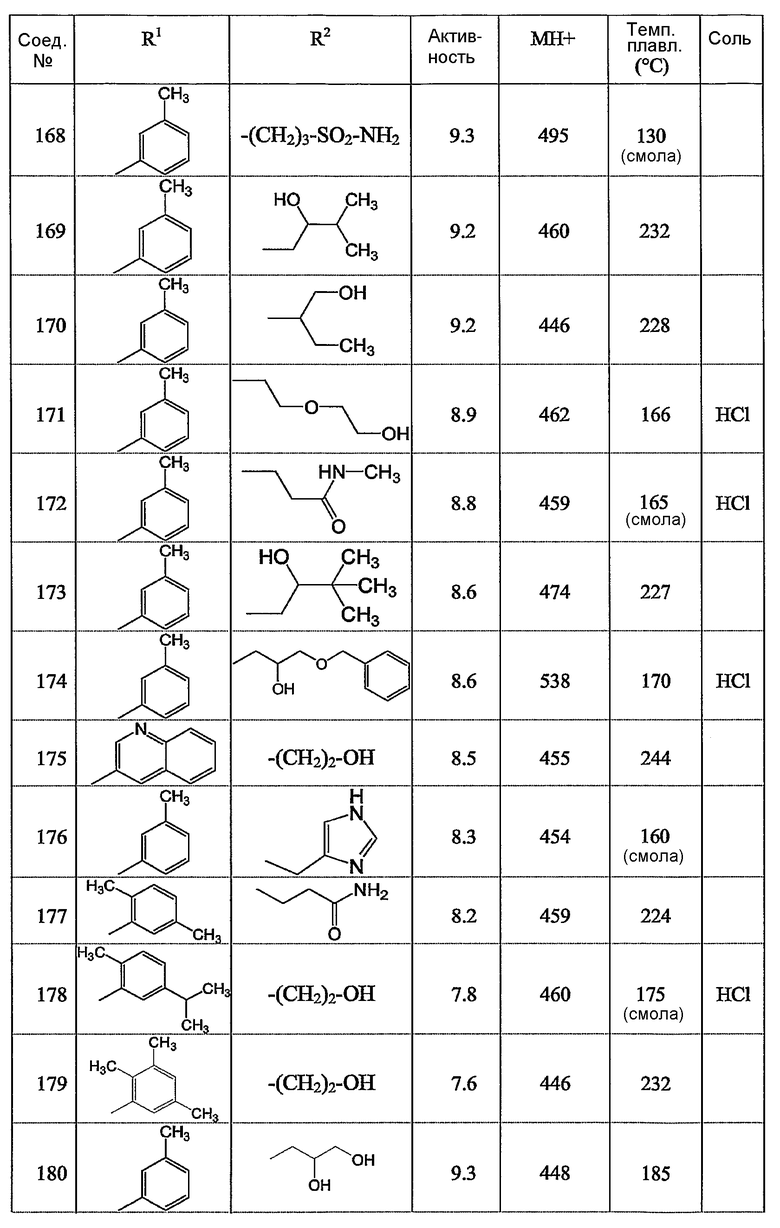

Таблица 3b


Таблица 4


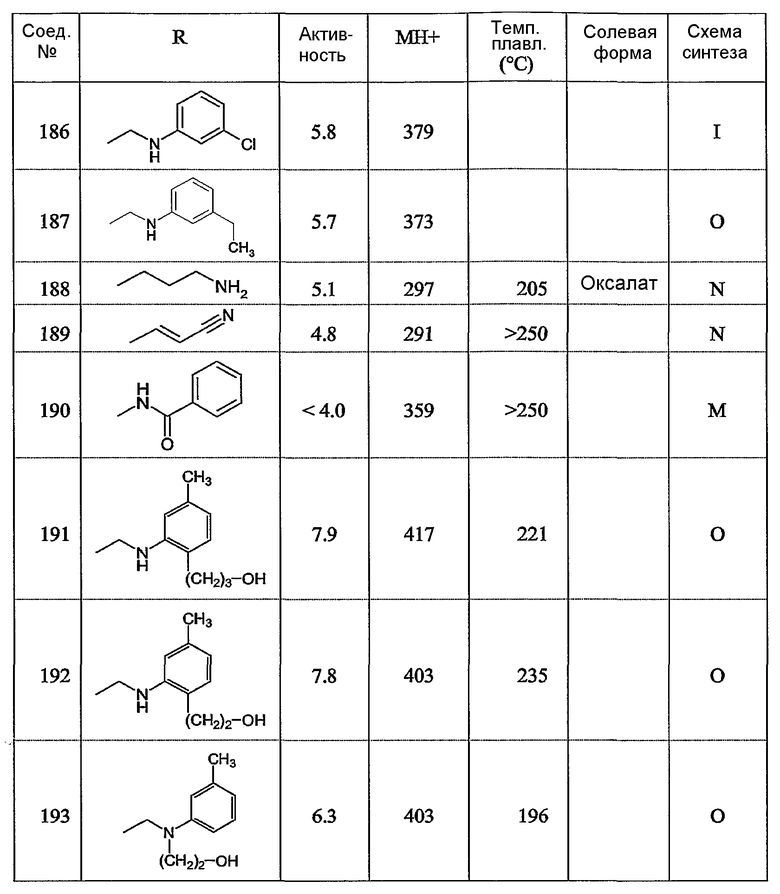
Таблица 5а


Таблица 5b
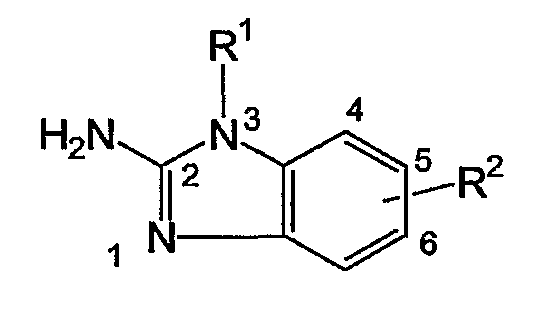

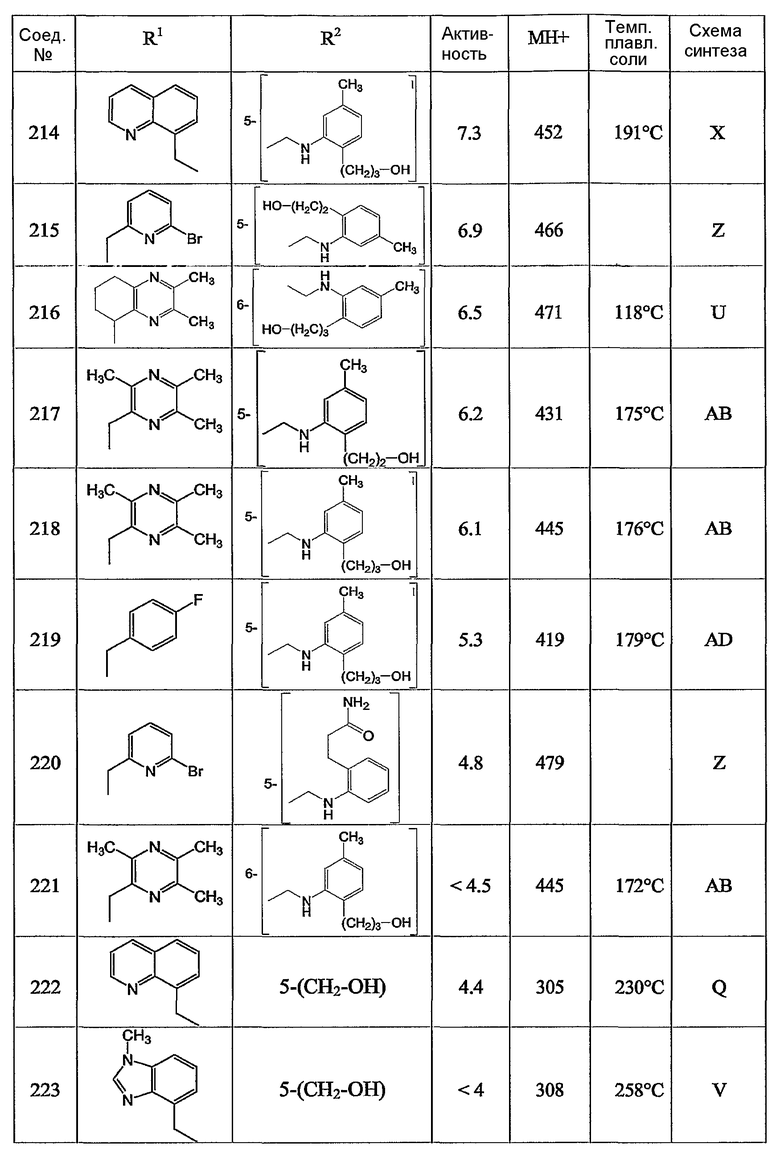
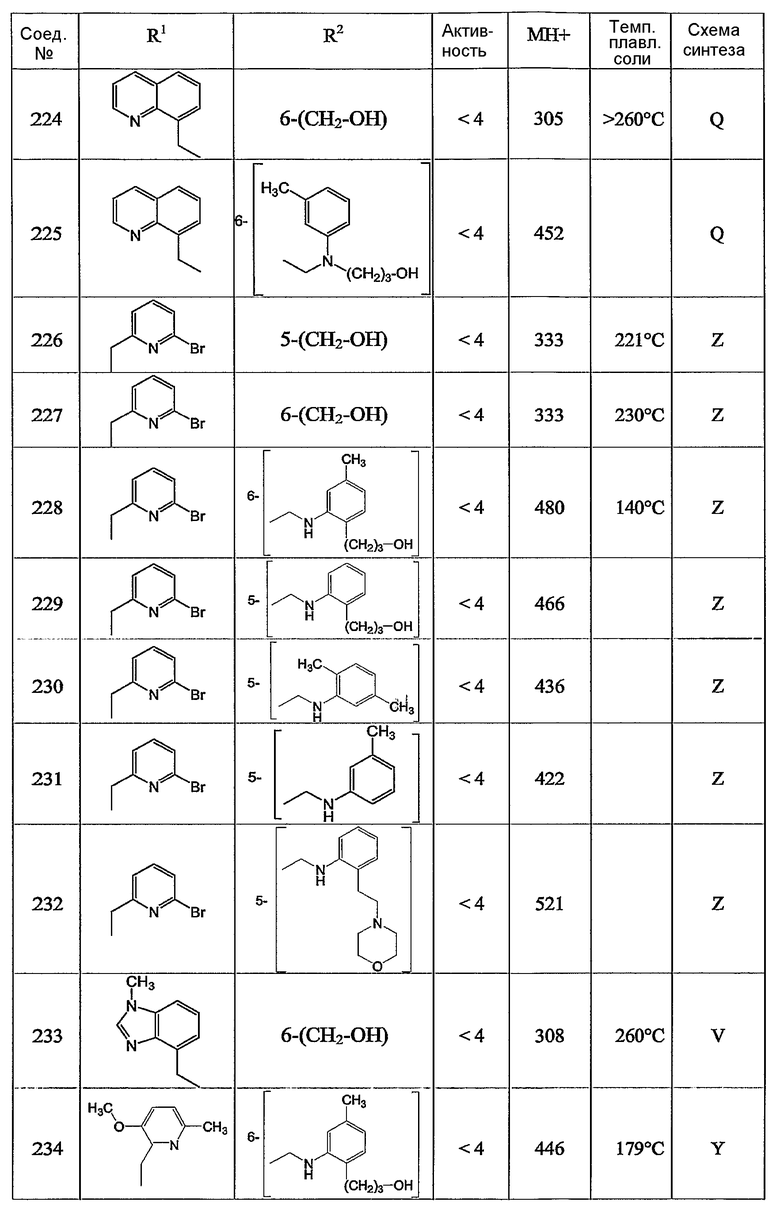

Таблица 6
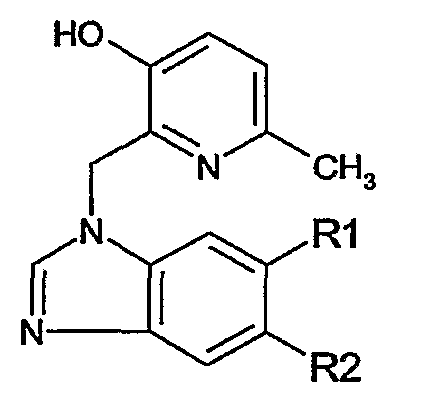



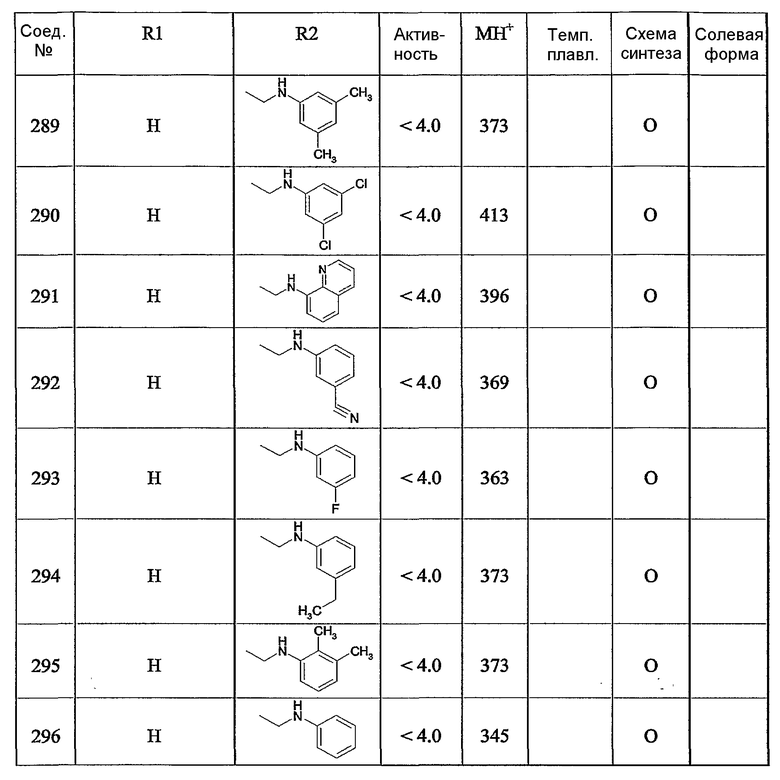
Пример 31
Скрининг активности соединений формулы (I) против РСВ in vitro
Защита от цитопатологии, вызванной вирусами, выраженная в процентах (антивирусная активность или ЕС50), достигаемая тестируемыми соединениями, и их цитотоксичность (СС50) определены исходя из кривых доза-ответ. Селективность антивирусного эффекта представлена индексом селективности (SI), рассчитанным делением СС50 (цитотоксическая доза для 50% клеток) на ЕС50 (антивирусная активность для 50% клеток). Таблицы в указанной выше экспериментальной части отражают категорию, к которой каждое из полученных соединений относится: соединения, относящиеся к категории «А», имеют значение показателя
рЕС50 (-log ЕС50 при выражении в единицах молярности), равное или больше чем 7. Соединения, относящиеся к категории активности «В», имеют значение показателя рЕС50 между 6 и 7. Соединения, относящиеся к категории активности «С», имеют значение показателя рЕС50, равное или меньше 6.
Для определения ЕС50 и СС50 тестируемых соединений использовали автоматизированные колориметрические анализы на основе тетразолия. Плоскодонные 96-луночные пластиковые микротитрационные планшеты наполняли 180 мкл минимальной среды Игла, дополненной 5% фетальной телячьей сывороткой (ФТС) (0% для FLU) и 20 мМ Hepes-буфером. Последовательно исходные растворы (7,8 × конечная тестовая концентрация) соединений добавляли в объеме по 45 мкл к сериям тройных лунок для одновременной оценки их эффектов на вирус- и ложно-инфицированные клетки. Непосредственно в микротитрационных планшетах были сделаны пять пятикратных разбавлений с применением робот-системы. Необработанные вирус-контроли и НеLa-клеточные контроли были включены в каждый тест. Приблизительно 100 TCID50 респираторно-синцитиального вируса было добавлено к двум из трех рядов в объеме 50 мкл. Такой же объем среды был добавлен к третьему ряду для измерения цитотоксичности соединений в тех же концентрациях, что и концентрации, использованные для измерения антивирусной активности. После двух часов инкубации суспензию (4×105 клеток/мл) НеLa-клеток добавляли во все лунки в объеме 50 мкл. Культуры инкубировали при 37°С в атмосфере 5% СО2. Семь дней спустя после инфицирования спектрофотометрически определяли цитотоксичность и антивирусную активность. К каждой лунке микротитрационного планшета добавляли 25 мкл раствора МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид). Далее планшеты инкубировали при 37°С в течение 2 часов, после чего среду удаляли из каждой лунки. Солюбилизации кристаллов формазана достигали добавлением 100 мкл 2-пропанола. Полное растворение получали после того, как планшеты помещали в шейкер на 10 мин. В конечном итоге значения поглощения определяли с помощью восьмиканального управляемого компьютером фотометра (Multiskan MCC, Flow Laboratories) при двух длинах волн (540 и 690 нм). Поглощение, измеренное при 690 нм, автоматически вычиталось из поглощения при 540 нм для устранения эффектов неспецифического поглощения.
Защита от цитопатологии, вызванной вирусами, выраженная в процентах (антивирусная активность или ЕС50), достигаемая тестируемыми соединениями, и их цитотоксичность (СС50) определены исходя из кривых доза-ответ. Селективность антивирусного эффекта представлена индексом селективности (SI), рассчитанным делением СС50 (цитотоксическая доза для 50% клеток) на ЕС50 (антивирусная активность для 50% клеток).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 5- ИЛИ 6-ЗАМЕЩЕННЫХ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2369606C2 |
| 2-ЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЫ | 2006 |
|
RU2441866C2 |
| ПРОИЗВОДНЫЕ АМИНОБЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2332414C2 |
| ПИПЕРИДИНАМИНОБЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2381224C2 |
| ГЕТЕРОЦИКЛИЛАМИНОАЛКИЛЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЫ | 2006 |
|
RU2419613C2 |
| ВИЧ-ИНГИБИРУЮЩИЕ 5-КАРБО- ИЛИ ГЕТЕРОЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ | 2005 |
|
RU2403244C2 |
| 5-АМИДО-ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2007 |
|
RU2480464C2 |
| ПРОИЗВОДНЫЕ 1, 2, 4-ТРИАЗИН-6-ОНА, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2401833C2 |
| 1-(2-АМИНО-3-(ЗАМЕЩЕННЫЙ АЛКИЛ)-3Н-БЕНЗИМИДАЗОИЛМЕТИЛ)-3-ЗАМЕЩЕННЫЕ-1,3-ДИГИДРОБЕНЗОИМИДАЗОЛ-2-ОНЫ С АКТИВНОСТЬЮ В ОТНОШЕНИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2006 |
|
RU2434000C2 |
| 5-ГЕТЕРОЦИКЛИЛПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2405778C2 |
Настоящее изобретение относится к новым производным аминобензимидазола и бензимидазола общей формулы (I-b-1), его аддитивной соли или стереохимически изомерной формы, где G представляет собой прямую связь или С1-10алкандиил; R1 представляет собой галогенфенил, пиридил, пиразинил, хинолинил, бензимидазолил или радикал формулы (с-4), где каждый из указанных моноциклических или бициклических гетероциклов может быть необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы заместителей, состоящих из галогена, гидрокси, С1-6алкила,
C1-6алкилокси, Ar1C1-6алкилокси, С1-6алкилокси-СН2-СН2-О-; m равен 2; Q представляет собой водород, амино или
моно(С1-4алкил)амино; R3b представляет собой водород или C1-6алкил; R4a выбирают из группы заместителей, состоящей из водорода,
Ar2C1-6алкила, Het-C1-6алкила, гидроксиС1-6алкила,
(гидроксиС1-6алкил)оксиС1-6алкила, дигидроксиС1-6алкила, (Ar1C1-6алкилокси)(гидрокси)C1-6алкила, аминоС1-6алкила, моно- и ди(С1-6алкил)амино-С1-6алкила, карбоксил-С1-6алкила, С1-6алкилоксикарбонилС1-6алкила, аминокарбонилС1-6алкила, (С1-4алкилокси)2-Р(=O)-С1-6алкила, аминосульфонилС1-6алкила; R6b представляет собой водород или C1-6алкил; R6b представляет собой водород, C1-6алкил, Ar1 или Ar1C1-6алкил; R6c представляет собой C1-6алкил; Alk является C1-6алкандиилом;
R9, R10, R11, каждый независимо, выбирают из галогена, циано, C1-6алкила, Het-C1-6алкила, Ar1С1-6алкила, цианоС1-6алкила, С2-6алкенила, R6b-О-С3-6алкенила, С2-6элкинила, Ar1, R6b-O- R6b-S-, R6b-O-C1-6aлкил-SO2-, полигалоС1-6алкила, полигалоС1-6алкилокси, полигалоС1-6алкилтио, R6c-C(=O)-, R6b-O-C(=O)-, N(R6aR6b)-C(=O)-, R6b-O-C1-6aлкилa, R6b-О-С(=O)-С1-6алкила, N(R6aR6b)-C(=O)-C1-6aлкилa, R6c-C(=O)-NR6b-, N(R6aR6b)-S(=O)2-, H2N-C(=NH)-, и R10 и/или R11 также могут быть водородом; Ar1 представляет собой фенил; Ar2 представляет собой фенил; Het представляет собой гетероцикл, выбранный из имидазолила или морфолинила. А также изобретение относится к фармацевтической композиции на основе соединения формулы (I-b-1), применению соединения формулы (I-b-1) для получения лекарственного средства и способу получения соединения формулы (I-b-1). Технический результат: получены новые производные аминобензимидазола и бензимидазола, обладающие антивирусной активностью. 4 н. и 11 з.п. ф-лы, 8 табл.
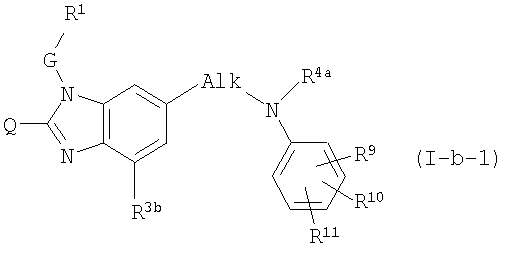
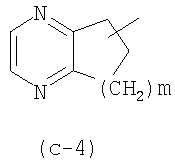
1. Соединение, имеющее формулу

его аддитивная соль или стереохимически изомерная форма;
где G представляет собой прямую связь или C1-10алкандиил;
R1 представляет собой галогенфенил, пиридил, пиразинил, хинолинил, бензимидазолил или радикал формулы
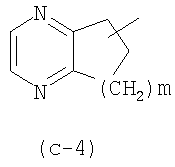
где каждый из указанных моноциклических или бициклических гетероциклов может быть необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы заместителей, состоящих из галогена, гидрокси, С1-6алкила, С1-6алкилокси, Ar1C1-6алкилокси, С1-6алкилокси-СН2-СН2-O-;
m равен 2;
Q представляет собой водород, амино или моно(С1-4алкил)амино;
R3b представляет собой водород или C1-6алкил;
R4a выбирают из группы заместителей, состоящей из водорода, Ar2C1-6алкила, Het-C1-6алкила, гидроксиС1-6алкила, (гидроксиС1-6алкил)оксиС1-6алкила, дигидроксиС1-6алкила, (ArlC1-6алкилoкси)(гидрокси)C1-6aлкилa, аминоС1-6алкила, моно- и ди(С1-6алкил)амино-С1-6алкила, карбоксил-C1-6алкила, С1-6алкилоксикарбонилС1-6алкила, аминокарбонилС1-6алкила, (C1-4алкилокси)2-Р(=O)-С1-6алкила, аминосульфонилС1-6алкила;
R6a представляет собой водород или C1-6алкил;
R6b представляет собой водород, C1-6алкил, Ar1 или Ar1C1-6алкил;
R6c представляет собой C1-6алкил;
Alk является C1-6алкандиилом;
R9, R10, R11, каждый независимо, выбирают из галогена, циано, C1-6алкила, Het-C1-6алкила, Ar1C1-6алкила, цианоС1-6алкила, С2-6алкенила, R6b-O-С3-6алкенила, С2-6алкинила, Ar1, R6b-O-, R6b-S-, R6b-O-C1-6aлкил-SO2-, полигало-С1-6алкила, полигалоС1-6алкилокси, полигалоС1-6алкилтио, R6c-С(=O)-, R6b-O-C(=O)-, N(R6aR6b)-C(=O)-, R6b-О-С1-6алкила, R6b-O-C(=O)-С1-6алкила, N(R6aR6b)-C(=O)-C1-6aлкилa, R6c-C(=O)-NR6b-, N(R6aR6b)-S(=O)2-, H2N-C(=NH)-, и R10 и/или R11 также могут быть водородом;
Ar1 представляет собой фенил;
Ar2 представляет собой фенил;
Het представляет собой гетероцикл, выбранный из имидазолила или морфолинила.
2. Соединение по п.1, где Alk является метиленом.
3. Соединение по п.1 или 2, где R9, R10, R11 выбирают из С1-6алкила, Het-C1-6алкила, Ar1C1-6алкила, цианоС1-6алкила, С2-6алкенила, R6b-О-С3-6алкенила, С2-6алкинила, R6b-О-С1-6алкила, R6b-О-C(=O)-С1-6алкила и N(R6aR6b)-C(=O)-C1-6aлкилa, и R10 и/или R11 также могут быть водородом.
4. Соединение по п.1 или 2, где R9, R10, R11 выбирают из С1-6алкила, Het-C1-6алкила, Ar1C1-6алкила, цианоС1-6алкила, С2-6алкенила, С2-6алкинила, R6b-О-С1-6алкила, R6b-О-С(=O)-С1-6алкила и N(R6aR6b)-С(=О)-С1-6алкила, и R10 и/или R11 также могут быть водородом.
5. Соединение по п.1 или 2, где R9, R10, R11 выбирают из C1-6алкила или R6b-О-С1-6алкила, и R10 и/или R11 также могут быть водородом.
6. Соединение по п.1 или 2, где G является C1-10алкандиилом.
7. Соединение по п.1 или 2, где G является метиленом.
8. Соединение по п.1 или 2, где R1 представляет собой пиридил, необязательно замещенный одним или двумя заместителями, выбранными из гидрокси, C1-6алкила и
C1-6алкилокси.
9. Соединение по п.1 или 2, где R1 представляет собой пиридил, замещенный гидрокси и метилом.
10. Соединение по п.1 или 2, где R1 представляет собой 3-гидрокси-6-метилпиридин-2-ил.
11. Соединение по п.1, где соединение представляет собой 2-(2-амино-6{[2-(3-гидроксипропил)-5-метилфениламино]метил}бензоимидазол-1-илметил)-6-метилпиридин-3-ол.
12. Соединение по п.1, где соединение представляет собой 2-(2-амино-6{[2-(3-гидроксипропил)-5-метилфениламино]метил}бензоимидазол-1-илметил)-6-метилпиридин-3-ол и его кислотно-аддитивные соли.
13. Фармацевтическая композиция, обладающая антивирусной активностью, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-12.
14. Применение соединения по любому из пп.1-12 для получения лекарственного средства для ингибирования репликации РСВ.
15. Способ получения соединения по любому из пп.1-12, включающий
(а) взаимодействие промежуточного соединения формулы (II-2) с реагентом (III), как указано в схеме реакции:

(b) взаимодействие промежуточного соединения формулы (V-2) с реагентом (III) с получением, таким образом, соединения формулы (I-d); где необязательно промежуточное соединение (V-2) может быть получено реакцией циклизации промежуточного соединения (IV-2); как указано в схеме реакции;


и необязательное превращение полученных таким образом соединений формулы (I-d-2) в их фармацевтически приемлемую основно-аддитивную соль или кислотно-аддитивную соль обработкой приемлемым основанием или кислотой и, наоборот, обработкой основно-аддитивной соли или кислотно-аддитивной соли кислотой или основанием для получения свободной формы соединения формулы (I-d-2).
| Способ получения производных 5-/4-диарилметил/-1-пиперазинилалкилбензимидазола или их солей | 1978 |
|
SU986297A3 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Воронка для направления опускаемых в проем штучных грузов | 1957 |
|
SU111993A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| XUE C-B et al | |||
| Design, synthesis and in vitro activities of a series of benzimidazole/benzoxazole glycoprotein IIB/IIA inhibitors | |||
| BIOORGANIC & MEDICINAL CHEMISTRY LETTERS | |||
| OXFORD, GB, vol.6, no.3, 1996, pages 339-344 | |||
| Способ получения производных бензимидазола | 1968 |
|
SU540569A3 |
Авторы
Даты
2010-01-20—Публикация
2004-12-20—Подача