Настоящее изобретение относится к 1-[2-амино-3-(замещенный алкил)-3Н-бензимидазолилметил]-3-замещенный-1,3-дигидробензоимидазол-2-онам и структурным аналогам, обладающим ингибирующей активностью в отношении репликации респираторно-синцитиального вируса (RSV). В дополнение настоящее изобретение относится к композициям, содержащим указанные соединения в качестве активного ингредиента, а также к способам получения указанных соединений и композиций.
Человеческий RSV, или респираторно-синцитиальный вирус, представляет собой многочисленный РНК вирус, член семейства парамиксовирусов, подсемейства пневмовирусов вместе с коровьим RSV вирусом. Человеческий RSV ответственен за разнообразие заболеваний дыхательных путей у людей всех возрастов во всем мире. Он является главной причиной заболеваемости нижних дыхательных путей у новорожденных и у подростков. Свыше половины всех младенцев сталкиваются с RSV в первый год жизни и почти все - в первые два года жизни. Инфекция у ребенка младшего возраста может вызывать легочное повреждение, которое устойчиво в течение нескольких лет и может способствовать развитию хронического легочного заболевания в более поздний период жизни (хроническое стерторозное дыхание, астма). Дети более старшего возраста и взрослые часто страдают от (плохого самочувствия) насморка при инфекции RSV. В пожилом возрасте восприимчивость снова увеличивается, и RSV вовлекается в ряд вспышек пневмонии в старости, приводящих к повышенной смертности.
Инфицированность вирусом из данной подгруппы не защищает против последующей инфекции RSV, выделенным из той же подгруппы, в следующем зимнем сезоне. Таким образом, повторное заражение RSV является общеизвестным, несмотря на существование только двух подтипов, А и В.
В настоящее время только три лекарственных средства разрешены для применения против инфекции RSV. Первым средством является рибавирин, нуклеозидный аналог, который предусматривает аэрозольное лечение для тяжелой инфекции RSV у госпитализированных детей. Аэрозольный путь введения, токсичность (риск тератогенности), цена и сильно изменяющаяся эффективность ограничивают его применение. Два других лекарственных средства, RespiGam® и паливизамаб, иммуностимуляторы поликлональных и моноклональных антител, предназначены для применения в целях профилактики.
До сих пор все другие попытки разработать безопасную и эффективную RSV вакцину заканчивались неудачей. Инактивированные вакцины потерпели неудачу в защите против заболевания и, в действительности, в некоторых случаях, усиливали заболевание во время последующей инфекции. Живые ослабленные вакцины испытывали с ограниченным успехом. Очевидно, что имеется необходимость в эффективном нетоксичном и легком для введения лекарственном средстве против репликации RSV.
Группы бензимидазолов и имидазопиридинов описаны в WO-01/00611, WO-01/00612 и WO-01/00615 в качестве ингибиторов репликации RSV. Соединения настоящего изобретения отличаются от соединений предшествующего уровня техники как в смысле химической структуры, так и профиля активности.
Настоящее изобретение касается ингибиторов репликации RSV, которые можно представить формулой (I),
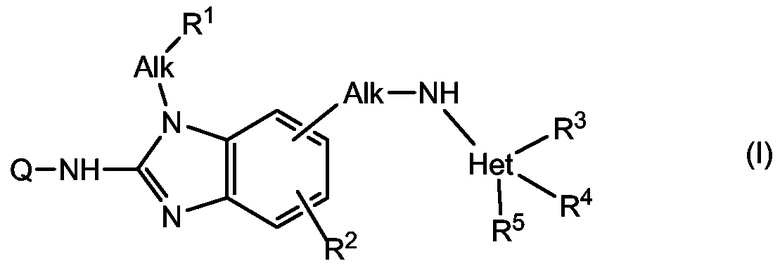
их соли и стереохимические изомерные формы, где
Q представляет собой водород, С1-6алкил, необязательно замещенный гетероциклом, или Q представляет собой С1-6алкил, замещенный как радикалом -OR6, так и гетероциклом; где указанный гетероцикл выбирают из группы, состоящей из оксазолидина, тиазолидина, 1-оксотиазолидина, 1,1-диоксотиазолидина, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, гексагидрооксазепина, гексагидротиазепина, 1-оксогексагидротиазепина, 1,1-диоксогексагидротиазепина, пирролидина, пиперидина, гомопиперидина, пиперазина; где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из С1-6алкила, гидроксиС1-6алкила, аминокарбонилС1-6алкила, гидрокси, карбоксила, С1-6алкилоксикарбонила, аминокарбонила, моно- или ди(С1-6алкил)аминокарбонила, С1-6алкилкарбониламино, аминосульфонила и моно- или ди(С1-6алкил)аминосульфонила; каждый Alk независимо представляет собой С1-6алкандиил;
R1 представляет собой Ar или гетероцикл, выбранный из пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тетрагидрофуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, хинолинила, хиноксалинила, бензофуранила, бензотиенила, бензимидазолила, бензоксазолила, бензотиазолила, пиридопиридила, нафтиридинила, 1Н-имидазо[4,5-b]пиридинила, 3Н-имидазо[4,5-b]пиридинила, имидазо[1,2-a]пиридинила и 2,3-дигидро-1,4-диоксино[2,3-b]пиридила; где каждый из указанных гетероциклов может быть необязательно замещен 1, 2 или 3 заместителями, каждый независимо выбранный из группы, состоящей из галогена, гидрокси, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, гидроксиС1-6алкилокси, (С1-6алкилокси)С1-6алкилокси, С1-6алкилтио, С1-6алкилоксиС1-6алкила, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалогенС1-6алкила, С1-6алкилкарбониламино, С1-6алкилоксикарбонила, аминокарбонила, моно- и диС1-6алкиламинокарбонила;
R2 представляет собой водород или С1-6алкил;
R3 представляет собой гидроксиС1-6алкил, С1-6алкоксиС1-6алкил, цианоС1-6алкил, аминокарбонилС1-6алкил, моно- или ди(С1-6алкил)аминокарбонилС1-6алкил, карбоксиС1-6алкил, С1-6алкоксикарбонилС1-6алкил;
R4 представляет собой водород или С1-6алкил;
R5 представляет собой водород или С1-6алкил;
Ar представляет собой фенил или фенил, замещенный 1-5, например, 1, 2, 3 или 4 заместителями, выбранными из галогена, гидрокси, амино, моно- или ди(С1-6алкил)амино, С1-6алкилкарбониламино, С1-6алкилсульфониламино, циано, С1-6алкила, С2-6алкенила, С2-6алкинила, фенила, гидроксиС1-6алкила, полигалогенС1-6алкила, аминоС1-6алкила, моно- или ди(С1-6алкил)аминоС1-6алкила, С1-6алкилокси, полигалогенС1-6алкилокси, фенокси, аминокарбонила, моно- или ди(С1-6алкил)аминокарбонила, гидроксикарбонила, С1-6алкоксикарбонила, С1-6алкилкарбонила, аминосульфонила, моно- и ди(С1-6алкил)аминосульфонила;
Het представляет собой гетероцикл, выбранный из группы, состоящей из пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тетрагидрофуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, оксадиазолила, хинолинила, хиноксалинила, бензофуранила, бензотиенила, банзимидазолила, бензоксазолила, бензотиазолила, пиридопиридила, нафтиридинила, 1Н-имидазо[4,5-b]пиридинила, 3Н-имидазо[4,5-b]пиридинила, имидазо[1,2-a]пиридинила и 2,3-дигидро-1,4-диоксино[2,3-b]пиридила.
Изобретение также относится к применению соединения формулы (I) или его аддитивной соли и стереохимической изомерной формы для изготовления лекарственного средства для ингибирования репликации RSV. Изобретение также относится к способу ингибирования репликации RSV в организме теплокровного животного, причем указанный способ включает введение эффективного количества соединения формулы (I) или его аддитивной соли и стереохимической изомерной формы.
Используемый выше и ниже термин «полигалогенС1-6алкил», как группа или часть группы, например, в полигалогенС1-6алкилокси, означает моно- или полигалогензамещенный С1-6алкил, в частности, С1-6алкил, имеющий вплоть до одного, двух, трех, четырех, пяти, шести или более атомов галогена, такой как метил или этил, с одним или более атомами фтора, например, дифторметил, трифторметил, трифторэтил. Предпочтительным является трифторметил. Также включенными являются перфторС1-6алкильные группы, которые представляют собой С1-6алкильные группы, в которых все атомы водорода заменены атомами фтора, например, пентафторэтил. В определении полигалогенС1-4алкила, в случае, когда более одного атома галогена присоединены к алкильной группе, атомы галогена могут быть одинаковыми или различными.
Каждый Ar может быть незамещенным фенилом или фенилом, замещенным 1-5 заместителями, например, 5 или 4 заместителями, или, что является предпочтительным, имеет до 3 заместителей, или до 2 заместителей, или один заместитель.
ГидроксиС1-6алкильная группа, в том случае, когда она замещена у атома кислорода или атома азота, предпочтительно, представляет собой гидроксиС2-6алкильную группу, где гидроксигруппа и атом кислорода или азота разделены по меньшей мере двумя атомами углерода.
Используемый в данном описании термин «С1-4алкил», как группа или часть группы, означает насыщенные углеводородные радикалы с неразветвленной и разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил; «С1-6алкил» включает С1-4алкильные радикалы и их высшие гомологи, имеющие 5 или 6 атомов углерода, такие как например, 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 2-метил-1-бутил, 2-метил-1-пентил, 2-этил-1-бутил, 3-метил-2-пентил и тому подобное. Среди С1-6алкилов представляет интерес С1-4алкил.
Термин «С2-6алкенил», как группа или часть группы, означает углеводородные радикалы с неразветвленной и разветвленной цепью, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну двойную связь, и имеющие от 2 до 6 углеродных атомов, такие как например, этенил (или винил), 1-пропенил, 2-пропенил (или аллил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-2-пропенил, 2-пентенил, 3-пентенил, 2-гексенил, 3-гексенил, 4-гексенил, 2-метил-2-бутенил, 2-метил-2-пентенил и тому подобное. Среди С2-6алкенилов представляет интерес С2-4алкенил.
Термин «С2-6алкинил», как группа или часть группы, означает углеводородные радикалы с неразветвленной и разветвленной цепью, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну тройную связь, и имеющие от 2 до 6 углеродных атомов, такие как например, этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 2-пентинил, 3-пентинил, 2-гексинил, 3-гексинил и тому подобное. Среди С2-6алкинилов представляет интерес С2-4алкинил.
Термин С3-7циклоалкил является общим для циклопропила, циклобутила, циклопентила, циклогексила и циклогептила.
С1-6алкандиил означает двухвалентные насыщенные углеводородные радикалы с неразветвленной и разветвленной цепью, имеющие от 1 до 6 углеродных атомов, такие как например, метилен, этилен, 1,3-пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил, 1,5-пентандиил, 1,6-гександиил и тому подобное. Среди С1-6алкандиилов представляет интерес С1-4алкандиил.
Как использовано в данном описании, группа (=О) образует карбонильную часть, когда она присоединена к атому углерода, сульфоксидную часть, когда она присоединена к атому серы, и сульфонильную часть, когда две из указанных групп присоединены к атому серы.
Термин галоген является общим для фтора, хлора, брома и йода.
Следует отметить, что положения радикалов любой части молекулы, используемых в определениях, могут находиться в любом месте такой части, пока она является химически стабильной.
Радикалы, используемые в определениях символов, включают все возможные изомеры, если не указано иное. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3-пентил.
В том случае, когда любой символ встречается более чем один раз в любой составной части, каждое определение является независимым.
Используемый выше и далее термин «соединения формулы (I)» или «настоящие соединения» или подобный термин, означает включение соединений формулы (I), их аддитивных солей и стереохимических изомерных форм.
Некоторые из соединений формулы (I) могут содержать один или несколько центров хиральности и существовать как стереохимические изомерные формы. Используемый в данном описании термин «стереохимические изомерные формы», означает все возможные соединения, составленные из таких же атомов, связанных такой же последовательностью связей, но имеющие различные трехмерные структуры, которые не являются взаимозаменяемыми и которыми могут обладать соединения формулы (I).
Если не приведено или не указано иное, химическое название соединения включает смесь всех возможных стереохимических изомерных форм, которыми может обладать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры базовой молекулярной структуры указанного соединения. Все стереохимические изомерные формы соединений настоящего изобретения как в чистой форме, так и смешанные одно с другим, предназначены для включения в объем настоящего изобретения.
Чистые стереоизомерные формы соединений и промежуточных продуктов, как указано в данном описании, определены как изомеры, по существу свободные от других энантиомерных или стереоизомерных форм такой же базовой молекулярной структуры указанных соединений или промежуточных продуктов. В частности, термин «стереоизомерная чистота» относится к соединениям или промежуточным продуктам, имеющим стереоизомерный избыток по меньшей мере от 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) до стереоизомерного избытка 100% (т.е. 100% одного изомера и нисколько другого), более конкретно, соединения или промежуточные продукты, имеющие стереоизомерный избыток от 90% до 100%, еще более конкретно, имеющие стереоизомерный избыток от 94% до 100% и наиболее конкретно, имеющие стереоизомерный избыток от 97% до 100%. Термины «энантиомерно чистый» и «диастереомерно чистый» следует понимать в аналогичном смысле, но дополнительно, термины имеют отношение к энантиомерному избытку, соответственно, диастереомерному избытку рассматриваемой смеси.
Чистые стереоизомерные формы соединений и промежуточных продуктов данного изобретения могут быть получены, используя способы, известные в данной области. Например, энантиомеры можно отделить один от другого селективной кристаллизацией их диастереомерных солей с оптически активными кислотами или основаниями. Примерами таких являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфосульфоновая кислота. Альтернативно, энантиомеры можно разделить хроматографическими методами с использованием хиральных стационарных фаз. Указанные чистые стереохимические изомерные формы можно также получать из соответствующих чистых стереохимических изомерных форм соответствующих исходных веществ, при условии, что реакция происходит стереоспецифически. Предпочтительно, если требуется специфический стереоизомер, то указанное соединение будет синтезировано стереоспецифическими способами получения. В этих способах преимущественно будут использоваться энантиомерно чистые исходные вещества.
Диастереомерные рацематы формулы (I) могут быть получены раздельно общепринятыми способами. Соответствующими физическими методами разделения, которые можно преимущественно использовать, являются, например, селективная кристаллизация и хроматография, например, колоночная хроматография.
Для некоторых соединений формулы (I), их солей и сольватов и промежуточных продуктов, используемых для получения соединений, абсолютную стереохимическую конфигурацию экспериментально не определяли. Специалист в данной области сможет определить абсолютную конфигурацию таких соединений с использованием методов, известных в данной области, таких как например, рентгенография.
Настоящее изобретение также предусматривает включение всех изотопов атомов, имеющихся в данных соединениях. Изотопы включают такие атомы, которые имеют один и тот же атомный номер, но различаются массовыми числами. В качестве общего примера и без ограничения, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14.
Термин «соединения формулы (I)» или любые подобные термины, такие как «соединения изобретения» и тому подобное, означает также включение любых пролекарств, которые могут образовать соединения формулы (I). Используемый в данном описании термин «пролекарство» означает включение любых фармакологически приемлемых производных, таких как сложные эфиры, амиды и фосфаты, таким образом, что образующийся in vivo продукт биотрансформации производного представляет собой активное лекарственное средство, как определено в соединениях формулы (I). Таким образом, ссылка на Goodman и Gilman (The Pharmacological Basis of Therapeutics, 8th ed, McGraw-Hill, Int. Ed. 1992, “Biotransformation of Drugs”, p 13-15), описывающая в основном пролекарства, включена в данное описание. Пролекарства предпочтительно обладают отличной растворимостью в воде, повышенной биодоступностью и легкостью метаболизма в активные ингибиторы in vivo. Пролекарства соединения настоящего изобретения могут быть получены модифицированием функциональных групп, присутствующих в соединении, таким образом, чтобы модификации расщеплялись либо общепринятой обработкой, либо in vivo, с образованием исходного соединения.
Предпочтительными являются фармацевтически приемлемые сложноэфирные пролекарства, которые гидролизуются in vivo и получаются из таких соединений формулы (I), которые имеют гидрокси или карбоксильную группу. Гидролизуемый in vivo сложный эфир представляет собой сложный эфир, который гидролизуется в организме человека или животного с образованием исходной кислоты или спирта. Подходящие фармацевтически приемлемые сложные эфиры карбоксильные группы включают С1-6алкоксиметиловые сложные эфиры, например, метоксиметиловые, С1-6алканоилоксиметиловые сложные эфиры, например, пивалоилоксиметиловые, фталидиловые сложные эфиры, С3-7циклоалкоксикарбонилоксиС1-6алкиловые сложные эфиры, например, 1-циклогексилкарбонилоксиэтиловый; 1,3-диоксолен-2-онилметиловые сложные эфиры, например, 5-метил-1,3-диоксолен-2-онилметиловый; и С1-6алкоксикарбонилоксиэтиловые сложные эфиры, например, 1-метоксикарбонилоксиэтиловый, которые можно образовать у любой карбоксильные группы в соединениях данного изобретения.
Гидролизуемый in vivo сложный эфир соединения формулы (I), содержащий гидроксигруппу, включает неорганические сложные эфиры, такие как фосфатные сложные эфиры и α-ацилоксиалкиловые простые эфиры, и аналогичные соединения, которые в результате гидролиза in vivo сложного эфира разрушаются с образованием исходной гидроксигруппы. Примеры α-ацилоксиалкиловых простых эфиров включают ацетоксиметокси и 2,2-диметилпропионилоксиметокси. Выбор гидролизуемых in vivo групп для гидрокси, образующих сложный эфир, включает алканоил, бензоил, фенилацетил и замещенный бензоил, и фенилацетил, алкоксикарбонил (чтобы образовать алкилкарбонатные сложные эфиры), диалкилкарбамоил и N-(диалкиламиноэтил)-N-алкилкарбамоил (чтобы образовать карбаматы), диалкиламиноацетил и карбоксиацетил. Примеры заместителей на бензоиле включают морфолино и пиперазино, присоединенные у атома азота ядра через метиленовую группу в положении 3 или 4 бензоильного кольца. Алканоильными сложными эфирами являются, например, любые С1-30алканоиловые сложные эфиры, в частности, С8-30алканоиловые сложные эфиры, более конкретно, С10-24алканоиловые сложные эфиры, еще более конкретно, С16-20алканоиловые сложные эфиры, в которых алкильная часть может иметь одну или две двойные связи. Примерами алканоиловых сложных эфиров являются деканоат, пальмитат и стеарат.
Термин «соединения формулы (I)» или любые аналогичные термины, такие как «соединения изобретения» и тому подобное, также означает включение любых метаболитов, которые образуются in vivo после введения лекарственного средства. Некоторые примеры метаболитов, согласно изобретению, включают, но не ограничиваются ими: (а) где соединение формулы (I) содержит метильную группу, ее гидроксиметильное производное; (b) где соединение формулы (I) содержит алкоксигруппу, ее гидроксипроизводное; (с) где соединение формулы (I) содержит третичную аминогруппу, ее производное вторичного амина; (d) где соединение формулы (I) содержит группу вторичного амина, ее первичное производное; (е) где соединение формулы (I) содержит фенильную часть, ее фенольное производное; и (f) где соединение формулы (I) содержит амидную группу, ее производное карбоновой кислоты.
Термин «соединения формулы (I)» или любые аналогичные термины, такие как «соединения изобретения» и тому подобное, также означает включение любых N-оксидных форм соединений формулы (I), которые представляют собой соединения формулы (I), где один или несколько атомов азота окислены в N-оксидную форму.
Термин «соединения формулы (I)» или любые аналогичные термины, такие как «соединения изобретения» и тому подобное, также означает включение четвертичных аминов, которые являются солями четвертичного аммония, которые соединения формулы (I) способны образовывать взаимодействием между азотом основного характера соединения формулы (I) и соответствующим кватернизирующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например, метилиодид или бензилиодид. Можно также использовать другие реагенты с легко удаляемыми группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный атом азота. Фармацевтически приемлемый противоион включает хлор, бром, йод, трифторацетат и ацетат. Выбранный противоион можно вводить с использованием ионообменных смол.
Термин «соединения формулы (I)» или любые аналогичные термины, такие как «соединения изобретения» и тому подобное, также означают включение их металлических комплексов или хелатов металла, где комплекс или хелат является производным физиологически приемлемых ионов металлов, таких как ионы Ca, Zn, Mg или Fe. Такие комплексы металлов или хелатные производные соединений формулы (I) могут быть получены взаимодействием соединения формулы (I) с солью металла.
Соли соединений формулы (I) для терапевтического применения представляют собой соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут находить применение, например, для получения или очистки фармацевтически приемлемого соединения. Все соли, независимо от того, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения.
Аддитивные соли фармацевтически приемлемых кислот или оснований, как указано выше, означают включение терапевтически активных форм аддитивных солей нетоксичной кислоты и основания, которые способны образовывать соединения формулы (I). Аддитивные соли фармацевтически приемлемой кислоты могут быть получены общепринятым способом обработки соединения в форме основания такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородную или бромистоводородную кислоту, серную, азотную, фосфорную и подобные кислоты, или органические кислоты, такие как, например, уксусную, пропионовую, гидроксиуксусную, молочную, пировиноградную, щавелевую (т.е. этандиовую), малоновую, янтарную (т.е. бутандиовую кислоту), малеиновую, фумаровую, яблочную (т.е. гидроксибутандиовую кислоту), винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфоновую, п-толуолсульфоновую, цикламовую, салициловую, п-аминосалициловую, памовую и тому подобные кислоты.
С другой стороны, указанные солевые формы можно превратить в форму свободного основания обработкой подходящим основанием.
Соединения формулы (I), содержащие кислотный протон, также можно превратить в их нетоксичные формы аддитивных солей металла или амина обработкой подходящими органическими и неорганическими основаниями. Подходящие солевые формы основания включают, например, соли аммония, соли щелочных или щелочноземельных металлов, например, соли лития, натрия, калия, магния, кальция и тому подобные; соли с органическими основаниями, например, бензатиновые, N-метил-D-глюкаминовые, гидроабаминовые соли и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное.
Используемый в данном описании термин «аддитивная соль» включает сольваты, которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты, алкоголяты и тому подобное.
Некоторые из соединений формулы (I) также могут существовать в их таутомерной форме. Такие формы, хотя и не указаны непосредственно в вышеприведенной формуле, предназначены для включения в объем настоящего изобретения.
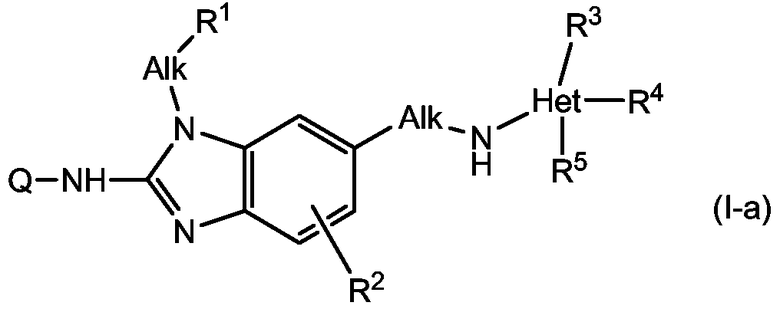
В одном варианте осуществления настоящего изобретения обеспечиваются соединения формулы (I-a):
В другом варианте осуществления настоящего изобретения обеспечиваются соединения формулы (I-b):
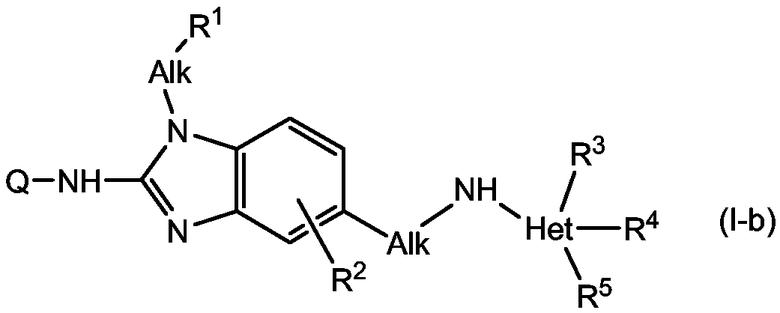
В формулах (I-a) и (I-b) Q, Alk, R1, R2, R3, R4, R5 являются такими, как описано для соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных в данном описании.
Понятно, что описанные выше подгруппы соединений формул (I-a) или (I-b), а также любая другая описанная в данном описании подгруппа, также означают включение любых аддитивных солей и стереохимических изомерных форм таких соединений.
Ряд подгрупп соединений формулы (I) описаны выше сокращенными обозначениями различных радикалов в соединениях формулы (I). Однако такие подгруппы также означают включение соединений с любой перестановкой сокращенных обозначений, указанных выше.
Подгруппой I соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, где один или оба из радикалов Alk представляют собой этилен или метилен, более конкретно, где один или оба из радикалов Alk являются метиленом.
Подгруппой II соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, как например, приведенная выше подгруппа I, где
(а) R1 представляет собой Ar или гетероцикл, выбранный из пиридила, пиразинила, пиридазинила, пиримидинила, фуранила, тиенила, пирролила, тиазолила, оксазолила, имидазолила, изотиазолила, пиразолила, изоксазолила, хинолинила, бензофуранила, бензимидазолила, бензоксазолила, бензотиазолила; где каждый из указанных гетероциклов может быть необязательно замещен 1, 2 или 3 заместителями, каждый независимо выбранный из группы, состоящей из галогена, гидрокси, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилоксиС1-6алкила, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалогенС1-6алкила, С1-6алкилоксикарбонила, аминокарбонила, моно- или диС1-6алкиламинокарбонила;
(b) R1 представляет собой Ar или гетероцикл, выбранный из хинолинила, бензимидазолила, пиразинила или пиридила; где каждый указанный гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, каждый независимо выбранный из группы, состоящей из галогена, гидрокси, амино, циано, карбоксила, С1-6алкила, С1-6алкилокси, С1-6алкилоксиС1-6алкила, гидроксиС1-6алкила, моно- или ди(С1-6алкил)амино, моно- или ди(С1-6алкил)аминоС1-6алкила, полигалогенС1-6алкила, С1-6алкилоксикарбонила, аминокарбонила, моно- и ди-С1-6алкиламинокарбонила;
(с) R1 представляет собой Ar, хинолинил, бензимидазолил, пиразинил или пиридил, где каждый из таких радикалов может быть необязательно замещен одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидрокси, С1-6алкила, С1-6алкилокси;
(d) R1 представляет собой фенил, необязательно замещенный одним, двумя или тремя радикалами, выбранными из группы, состоящей из галогена, гидрокси, С1-6алкила, С1-6алкилокси, хинолинила, бензимидазолила, необязательно замещенного С1-6алкилом; пиридила, необязательно замещенного одним или двумя радикалами, выбранными из гидрокси, галогена, С1-6алкила, бензилокси и С1-6алкилокси, пиразинила, необязательно замещенного вплоть до трех радикалов, выбранными из С1-6алкила; или пиридила, замещенного или необязательно замещенного, как описано выше в (а)-(i); или где
(е) R1 представляет собой фенил, необязательно замещенный одним или двумя радикалами, выбранными из группы, состоящей из галогена, гидрокси, С1-6алкила, С1-6алкилокси;
(f) R1 представляет собой пиразинил, необязательно замещенный вплоть до трех радикалов, выбранными из С1-6алкила.
(g) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, С1-6алкила, галогена, С1-6алкилокси, Ar1C1-6алкилокси и (С1-6алкилокси)С1-6алкилокси;
(h) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, С1-6алкила, галогена и С1-6алкилокси;
(i) R1 представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси и С1-6алкила; или
(j) R1 представляет собой пиридил, замещенный гидрокси и С1-6алкилом.
Вариантами осуществления изобретения являются соединения формулы (I) или любая из подгрупп соединений формулы (I), где Alk представляет собой метилен, и R1 является таким, как описано выше в (а)-(j).
Подгруппой III соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, как, например, приведенные выше подгруппы I и II, где R2 представляет собой водород.
Следующими вариантами осуществления изобретения являются соединения формулы (I) или любая из подгрупп соединений формулы (I), где
(а) R3 представляет собой гидроксиС1-6алкил, С1-6алкоксиС1-6алкил или цианоС1-6алкил; или
(b) R3 представляет собой гидроксиС1-6алкил.
Подгруппой IV соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, как, например, приведенные выше подгруппы I, II и III, где R4 представляет собой водород.
Подгруппой V соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, как например, приведенные выше подгруппы I, II, III и IV, где R5 представляет собой водород.
Подгруппой VI соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, как, например, приведенные выше подгруппы I, II, III, IV и V, где
(а) Q представляет собой водород или С1-6алкил, необязательно замещенный гетероциклом, или Q представляет собой С1-6алкил, замещенный как радикалом -OR6, так и гетероциклом; где указанный гетероцикл выбирают из группы, состоящей из оксазолидина, тиазолидина, 1-оксотиазолидина, 1,1-диоксотиазолидина, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинил, гексагидрооксазепина, гексагидротиазепина, 1-оксогексагидротиазепина, 1,1-диоксогексагидротиазепина; где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из С1-6алкила, гидроксиС1-6алкила, гидрокси, карбоксила, С1-6алкилоксикарбонила, аминокарбонила;
(b) Q представляет собой водород или С1-6алкил, необязательно замещенный гетероциклом, или Q представляет собой С1-6алкил, замещенный как радикалом -OR6, так и гетероциклом; где указанный гетероцикл выбирают из группы, состоящей из оксазолидина, тиазолидина, 1-оксотиазолидина, 1,1-диоксотиазолидина, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила; где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из С1-6алкила, гидроксиС1-6алкила, гидрокси;
(с) Q представляет собой водород или С1-6алкил, необязательно замещенный гетероциклом, или Q представляет собой С1-6алкил, замещенный как радикалом -OR4, так и гетероциклом; где указанный гетероцикл выбирают из группы, состоящей из оксазолидина, тиазолидина, морфолинила, тиоморфолинила; где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя С1-6алкильными радикалами;
(d) Q представляет собой С1-6алкил, замещенный морфолинилом или тиоморфолинилом.
Предпочтительно, в (а)-(d) предшествующего раздела, гетероциклы, такие как оксазолидин, тиазолидин, 1-оксотиазолидин, 1,1-диоксотиазолидин, морфолинил, тиоморфолинил и т.д., связаны своим атомом азота с С1-6алкилом, на котором они замещены.
Вариантами осуществления изобретения являются такие соединения формулы (I) или соединения, которые принадлежат к любой из описанных в данном описании подгрупп соединений формулы (I), где Ar представляет собой фенил или фенил, замещенный 1, 2, 3 заместителями или 1, 2 заместителями, выбранными из указанных в определении соединений формулы (I) или любой их подгруппы.
Подгруппой VII соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, как например, приведенные выше подгруппы I, II, III, IV, V и VI, где:
(а) Ar представляет собой фенил или фенил, замещенный вплоть до трех заместителями, или вплоть до двух заместителями, или одним заместителем, выбранным из группы, состоящей из галогена, гидрокси, амино, циано, С1-6алкила, гидроксиС1-6алкила, полигалогенС1-6алкила, аминоС1-6алкила, С1-6алкилокси, аминосульфонила, аминокарбонила, гидроксикарбонила, С1-4алкилкарбонила, моно- или ди(С1-4алкил)амино и С1-4алкоксикарбонила; или
(b) Ar представляет собой фенил или фенил, замещенный вплоть до трех заместителями, или вплоть до двух заместителями, или одним заместителем, выбранным из группы, состоящей из галогена, гидрокси, амино, циано, С1-6алкила, трифторметила, С1-6алкилокси, моно- и ди(С1-4алкил)амино; или
(с) Ar представляет собой фенил или фенил, замещенный вплоть до тремя заместителями, или, вплоть до двумя заместителями, или одним заместителем, выбранным из галогена, гидрокси, С1-6алкила, гидроксиС1-6алкила, трифторметила и С1-6алкилокси; или
(d) Ar представляет собой фенил или фенил, замещенный вплоть до тремя заместителями, или, вплоть до двумя заместителями, или одним заместителем, выбранным из группы, состоящей из галогена, гидрокси, С1-6алкила, трифторметила и С1-6алкилокси; или
(е) Ar представляет собой фенил или фенил, замещенный вплоть до тремя заместителями, или вплоть до двумя заместителями, или одним заместителем, выбранным из галогена, гидрокси, С1-6алкила и С1-6алкилокси; или
(f) Ar представляет собой фенил или фенил, замещенный, вплоть до тремя заместителями, или вплоть до двумя заместителями, или одним заместителем, выбранным из галогена и С1-6алкила.
Подгруппой VIII соединений формулы (I) являются такие соединения формулы (I) или любая подгруппа соединений формулы (I), как описано в данном описании, как например, приведенные выше подгруппы I, II, III, IV, V, VI и VII, где
(а) Het представляет собой пиридил, пиразинил, пиримидинил, фуранил, тиенил, пирролил, тиазолил, оксазолил, имидазолил, изотиазолил, пиразолил, изоксазолил, оксадиазолил, хинолинил, хиноксалинил, бензимидазолил, бензоксазолил, бензотиазолил;
(b) Het представляет собой пиридил, пиразинил, пиримидинил, фуранил, тиенил, тиазолил, оксазолил;
(с) Het представляет собой пиридил, пиразинил, пиримидинил, фуранил, тиенил;
(d) Het представляет собой пиридил, пиразинил, пиримидинил;
(е) Het представляет собой пиридил.
Соединения формулы (I) или любая из подгрупп соединений могут быть получены согласно следующим схемам реакции.
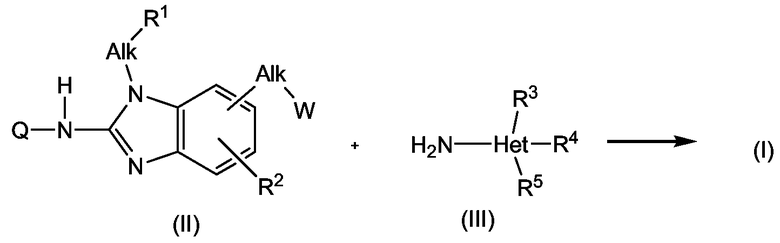
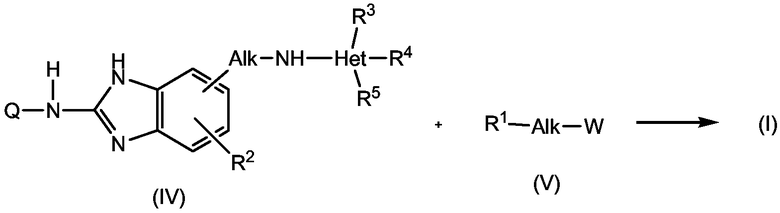
На приведенных схемах Q, каждый Alk, R1, R2, R3, R4, R5 имеет значения, указанные выше для соединений формулы (I) или любой из подгрупп соединений. W представляет собой подходящую удаляемую группу, такую как тозилат, мезилат или галоген, предпочтительно, она представляет собой хлор или бром. Реакции, приведенные на схемах, можно проводить в подходящем растворителе в присутствии основания, такого как карбонат или гидроксид щелочного металла, например, карбонат натрия, калия или цезия, или органического основания, такого как триалкиламин, например, триэтиламин. Подходящими растворителями для данной реакции являются, например, простые эфиры, например, ТГФ, диоксан, галогенированные углеводороды, например, дихлорметан, CHCl3, толуол, полярные апротонные растворители, такие как ДМФА, ДМСО, DMA и тому подобные.
Соединения формулы (I) также могут быть получены способом восстановительного аминирования исходя из альдегида или кетона формулы (IV), где Alk' имеет значения, аналогично радикалу Alk, но отсутствует один атом водорода. Промежуточный продукт (VI) подвергают взаимодействию с гетероциклиламином (III) в присутствии восстанавливающего агента, такого как водород, в присутствии катализатора благородного металла или гидрида, такого как борогидрид, например, цианоборогидрид натрия. Реакцию восстановительного аминирования предпочтительно проводят в подходящем растворителе, таком как спирт, например, метанол или этанол, или простой эфир, например, ТГФ или диоксан.
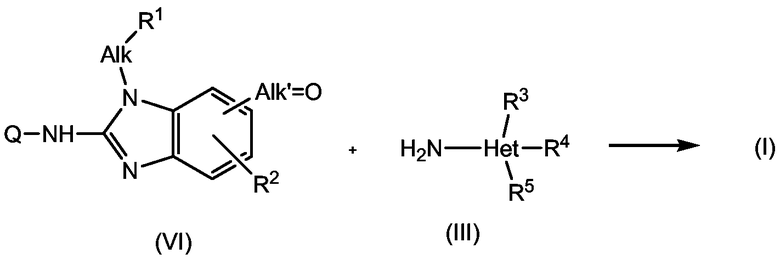
Соединения формулы (I) можно превратить друг в друга последующими известными в данной области реакциями преобразования функциональной группы, включающими реакции, описанные ниже.
Цианогруппы можно восстановить до аминометиленовых групп, которые могут быть алкилированы. Гидроксикарбонильные группы можно этерифицировать до С1-4алкилоксикарбонильных групп или наоборот, последние можно гидролизовать с получением первой из двух.
Ряд промежуточных продуктов, используемых для получения соединений формулы (I), представляет собой известные соединения или аналоги известных соединений, которые могут быть получены последующими модификациями известных в данной области способов, легко доступных специалисту в данной области. Ряд препаратов промежуточных продуктов представлен ниже более подробно.
Промежуточные продукты формулы (II-a), которые представляют собой промежуточные продукты формулы (II), где группа Alk, замещенная на фенильной части бензимидазольной группы, представляет собой метилен, могут быть получены из соответствующих замещенных гидроксиметиленом бензимидазолов формулы (VII) взаимодействием последнего с подходящим агентом введения удаляемой группы, таким как галогенирующий агент, например, SOCl2, превращая, таким образом, гидроксиметиленовую группу в соответствующую галогенметиленовую группу. Промежуточный продукт (VII) может быть получен из соответствующих сложных эфиров (VIII) реакцией восстановления, например, LiAlH4. Такая последовательность реакций проиллюстрирована на следующих схемах, где Ra представляет собой С1-6алкильный радикал, в частности, С1-4алкильную группу, которая, предпочтительно, представляет собой метил или этил. Промежуточные продукты формулы (II), где Alk, замещенный на фенильной части бензимидазольной группы, представляет собой другой, чем метилен, могут быть получены подобным образом из соответствующих промежуточных продуктов (VIII), имеющих группу С2-6алкил-COORa.
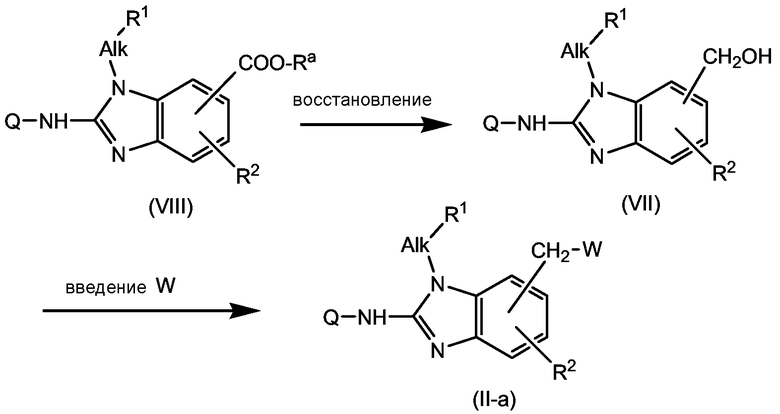
Промежуточные продукты (IV) могут быть получены, как представлено в следующей последовательности реакций.
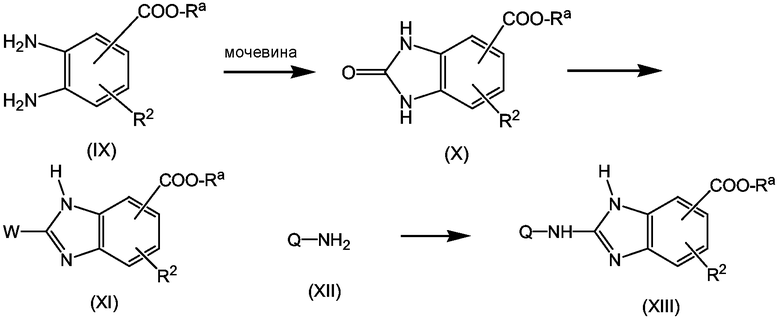
На первой стадии диаминобензол (IX) циклизуют с мочевиной в подходящем растворителе, например, ксилоле, с получением бензимидазолона (Х). Последний превращают в бензимидазольное производное (XI), где W является удаляемой группой, как описано выше, в частности, взаимодействием соединения (Х) с подходящим галогенирующим агентом, например, POCl3, и образующийся промежуточный продукт (XI) подвергают взаимодействию с аминным производным (XII) с получением промежуточного продукта (XIII). Последний превращают в промежуточные продукты (IV) реакцией восстановления с последующей реакцией введения W-группы, следуя аналогичным методикам, как описано выше для превращения (VIII) в (II-а). На конечной стадии полученные таким образом продукты подвергают взаимодействию с промежуточным продуктом (III), получая, таким образом, требуемые промежуточные продукты (IV).
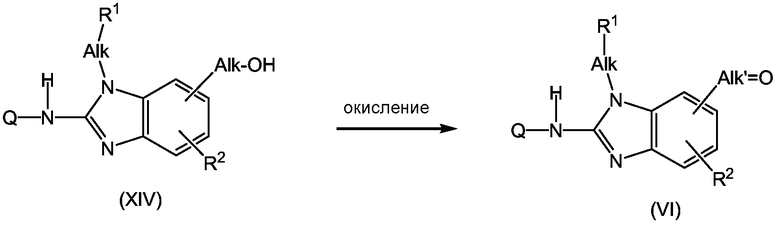
Промежуточные продукты формулы (VI) могут быть получены из спиртов формулы (XIV) реакцией окисления мягким окислителем, например, MnO2.
Соединения формулы (I) можно превратить в соответствующие N-оксидные формы, следуя известным в данной области методикам преобразования трехвалентного азота в его N-оксидную форму. Указанную реакцию N-окисления, как правило, можно проводить взаимодействием исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочного металла или щелочноземельного металла, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как например, бензолкарбоперкарбоновая кислота или галогензамещенная бензолкарбоперкарбоновая кислота, например, 3-хлорбензолкарбоперкарбоновая кислота, пероксоалкановые кислоты, например, перуксусная кислота, алкилгидропероксиды, например, трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и тому подобное, углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей.
Чистые стереохимические изомерные формы соединений формулы (I) могут быть получены, используя методики, известные в данной области. Диастереомеры можно разделять физическими методами, такими как селективная кристаллизация, и хроматографическими методами, например, противоточной распределительной, жидкостной хроматографией и тому подобное.
Соединения формулы (I), полученные в описанных выше способах, обычно, представляют собой рацемические смеси энантиомеров, которые можно отделить один от другого следующими известными в данной области методами разделения. Рацемические соединения формулы (I), которые имеют достаточную основность или кислотность, можно превратить в соответствующие диастереомерные солевые формы взаимодействием с подходящей хиральной кислотой, или с хиральным основанием, соответственно. Указанные диастереомерные солевые формы затем разделяют, например, селективной или фракционной кристаллизацией, и энантиомеры выделяют щелочью или кислотой. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности жидкостную хроматографию с хиральной стационарной фазой. Указанные чистые стереохимические изомерные формы также могут быть получены из соответствующих чистых стереохимических изомерных форм подходящих исходных веществ, при условии, что реакция протекает стереоспецифически. Предпочтительно, если требуется специфический стереоизомер, указанное соединение должно быть синтезировано стереоспецифическими способами получения. В таких способах следует использовать преимущественно энантиомерно чистые исходные вещества.
В следующем аспекте настоящее изобретение касается фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), как описано в данном описании, или соединения любой из подгрупп соединений формулы (I), как описано в данном описании, и фармацевтически приемлемый носитель. Терапевтически эффективным количеством в данном контексте является количество, достаточное для профилактического противодействия, для стабилизации или для ослабления вирусной инфекции, в частности, вирусной инфекции RSV, в организме инфицированных субъектов или субъектов, подвергающихся риску инфицирования. В еще одном аспекте данное изобретение относится к способу получения фармацевтической композиции, как описано в данном описании, который включает тщательное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы (I), как описано в данном описании, или соединения любой из подгрупп соединений формулы (I), как описано в данном описании.
Следовательно, соединения настоящего изобретения или любой его подгруппы можно формулировать в различные фармацевтические формы для целей введения. В качестве подходящих композиций можно сослаться на все композиции, обычно применяемые для системно вводимых лекарственных средств. Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения, необязательно в форме аддитивной соли или комплекса металла, в качестве активного ингредиента, объединяют в однородной смеси с фармацевтически приемлемым носителем, причем носитель может принимать широкое разнообразие форм, в зависимости от формы препарата, требуемого для введения. Такие фармацевтические композиции требуются в подходящей единичной дозированной форме, в частности, подходящей для введения перорально, ректально, чрескожно или парентеральной инъекцией. Например, для получения композиций в пероральной дозированной форме, можно использовать любую из обычных фармацевтических сред, такую как, например, вода, гликоли, масла, спирты и тому подобное, в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие, дезинтегрирующие агенты и тому подобное, в случае порошков, пилюль, капсул и таблеток. Вследствие легкости их введения, таблетки и капсулы представляют собой наиболее удобные пероральные единичные дозированные формы, в каждом случае обычно используют твердые фармацевтические носители. Для парентеральных композиций носитель будет, как правило, включать стерильную воду по меньшей мере в большей части, хотя могут быть включены другие ингредиенты, например, для обеспечения растворимости. Можно, например, получать инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно также получать инъецируемые суспензии, в каждом случае можно использовать подходящие жидкие носители, суспендирующие агенты и тому подобное. Также включены препараты в твердой форме, которые предназначены для превращения в препараты в жидкой форме, непосредственно перед применением. В композициях, подходящих для чрескожного введения, носитель необязательно включает агент для усиления проникания и/или подходящий увлажняющий агент, необязательно объединенный с подходящими добавками любой природы в незначительных количественных соотношениях, которые не оказывают существенного ухудшающего действия на кожу.
Соединения настоящего изобретения можно также вводить путем пероральной ингаляции или вдувания с помощью методов и препаратов, применяемых в данной области для введения таким путем. Поэтому, как правило, соединения настоящего изобретения можно вводить в легкие в форме раствора, суспензии или сухого порошка, причем предпочтительным является раствор. Любая система, разработанная для доставки растворов, суспензий или сухих порошков путем пероральной ингаляции или вдувания, является подходящей для введения настоящих соединений.
Таким образом, настоящее изобретение также предлагает фармацевтическую композицию, адаптированную для введения путем ингаляции или вдувания через рот, содержащую соединение формулы (I) и фармацевтически приемлемый носитель. Предпочтительно, соединения настоящего изобретения вводят путем ингаляции раствора в распыляемых или аэрозольных дозах.
Особенно удобными для формулирования являются вышеуказанные фармацевтические композиции в единичной дозированной форме для облегчения введения и равномерности дозировки. Термин «единичная дозированная форма», как использовано в данном описании, означает физически дискретные единицы, подходящие в качестве однократных доз, причем каждая единица содержит заранее заданное количество активного ингредиента, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включающие таблетки с бороздками или покрытиями), капсулы, пилюли, суппозитории, пакетики порошка, облатки, инъецируемые растворы или суспензии и тому подобное, и их отдельные многократные повторения.
Соединения формулы (I) проявляют антивирусные свойства. Вирусные инфекции, подвергаемые лечению с применением соединений и способов данного изобретения, включают инфекции, вызванные орто- и парамиксовирусами, в частности, респираторно-синцитиальным вирусом (RSV) человека и коровы. Кроме того, ряд соединений данного изобретения является активным против мутированных штаммов RSV. В дополнение, многие из соединений данного изобретения демонстрируют благоприятный фармакокинетический профиль и привлекательные свойства исходя из биодоступности, включая приемлемый период полувыведения, AUC и максимальное значение, и отсутствие неблагоприятных событий, таких как недостаточно быстрое начало действия и удерживание в ткани.
Антивирусную активность данных соединений in vitro против RSV испытывали в тесте, как описано в экспериментальной части описания, и также можно продемонстрировать в анализе уменьшения выхода вируса. Антивирусную активность данных соединений in vivo против RSV можно продемонстрировать на тест-модели с использованием хлопковых хомяков, как описано Wyde et al. (Antiviral Research (1998), 38, 31-42).
Вследствие их антивирусных свойств, в частности, свойств против RSV, соединения формулы (I) или любая их подгруппа, их аддитивные соли и стереохимические изомерные формы применяют при лечении индивидуумов, страдающих вирусной инфекцией, в частности инфекцией RSV, и для профилактики таких инфекций. Как правило, соединения настоящего изобретения можно применять при лечении теплокровных животных, инфицированных вирусами, в частности, респираторно-синцитиальным вирусом.
Соединения данного изобретения или любую их подгруппу, поэтому можно применять в качестве лекарственных средств. Указанное применение в качестве лекарственного средства или способ лечения включает системное введение субъектам, инфицированным вирусом, или субъектам, восприимчивым к вирусным инфекциям, количества, эффективного для подавления состояний, связанных с вирусной инфекцией, в частности инфекцией RSV.
Настоящее изобретение также относится к применению данных соединений или любой их подгруппы для получения лекарственного препарата для лечения или профилактики вирусных инфекций, в частности инфекции RSV.
Кроме того, настоящее изобретение относится к способу лечения теплокровного животного, инфицированного вирусом или подвергающегося риску инфицирования вирусом, в частности RSV, причем указанный способ включает введение эффективного против вируса количества соединения формулы (I), как описано в данном описании, или соединения любой из подгрупп соединений формулы (I), как описано в данном описании.
Как правило, предполагается, что эффективное антивирусное суточное количество может составлять от 0,01 мг/кг до 500 мг/кг массы тела, более предпочтительно, от 0,1 мг/кг до 50 мг/кг массы тела. Это может соответствовать введению требуемой дозы в виде двух, трех, четырех или более субдоз в соответствующие интервалы в течение суток. Указанные субдозы можно формулировать в виде единичных дозированных форм, например, содержащих 1-1000 мг и, в частности, 5-200 мг активного ингредиента на единичную дозированную форму.
Точная доза и частота введения зависит от конкретного применяемого соединения формулы (I), конкретного состояния, подвергаемого лечению, тяжести состояния, подвергаемого лечению, возраста, массы, пола, степени нарушения и общего физического состояния конкретного пациента, а также другого, возможно принимаемого индивидуумом лекарственного лечения, как хорошо известно специалисту в данной области. Кроме того, очевидно, что указанное эффективное суточное количество можно снижать или увеличивать в зависимости от реакции подвергаемого лечению субъекта и/или в зависимости от оценки врача-терапевта, прописывающего соединения данного изобретения. Интервалы эффективного суточного количества, приведенные выше, являются поэтому только рекомендациями.
В качестве лекарственного средства также можно применять комбинацию другого антивирусного агента и соединения формулы (I). Поэтому настоящее изобретение также относится к продукту, содержащему (а) соединение формулы (I), и (b) другое антивирусное соединение, в виде объединенного препарата для одновременного, раздельного или последовательного применения при антивирусном лечении. Различные лекарственные средства можно объединять в одном препарате вместе с фармацевтически приемлемыми носителями. Например, соединения настоящего изобретения можно объединять с бета-интерфероном или альфа-фактором некроза опухоли для того, чтобы лечить или предупреждать инфекции RSV.
Примеры
Следующие примеры предназначены для иллюстрации настоящего изобретения и не ограничиваются ими. Термины «соединение е-1», «соединение с-3» и т.д., используемые в указанных примерах, соответствуют таким же соединениям в таблицах.
Соединения идентифицировали методом ЖХ/МС с использованием следующих приборов.
LCT: ионизация в электроспрее в режиме положительных ионов, сканирование от 100 до 900 a.е.м.; Xterra MS C18 (Waters, Milford, MA) 5 мкм, 3,9×150 мм); скорость потока 1 мл/мин. Использовали две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетата аммония+80% ацетонитрила) для обеспечения градиента от 100% А в течение 3 мин до 100% В через 5 мин, 100% В в течение 6 мин до 100% А через 3 мин, и снова для приведения в равновесие 100% А в течение 3 мин).
ZQ: ионизация в электроспрее как в положительном, так и в отрицательном (импульсном) режиме, сканирование от 100 до 1000 a.е.м.; Xterra RP C18 (Waters, Milford, MA) 5 мкм, 3,9×150 мм); скорость потока 1 мл/мин. Использовали две подвижные фазы (подвижная фаза А: 85% 6,5 мМ ацетата аммония+15% ацетонитрила; подвижная фаза В: 20% 6,5 мМ ацетата аммония+80% ацетонитрила) для обеспечения условия градиента от 100% А в течение 3 мин до 100% В через 5 мин, 100% В в течение 6 мин до 100% А через 3 мин и для приведения в равновесие 100% А в течение 3 мин).
Пример 1
Схема А
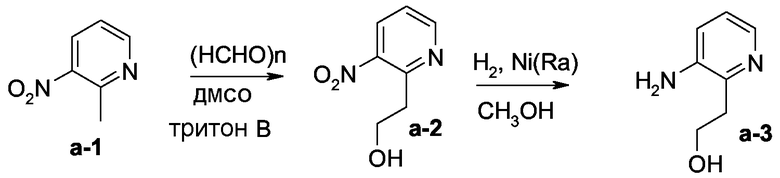
Смесь соединения а-1 (0,0072 моль) и параформальдегида (0,0058 моль) в ДМСО (3,5 мл) и тритона В (0,27 мл) перемешивали при 90°С в течение 4 ч, затем охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2, затем CH2Cl2/CH3OH/NH4OH (99/1/0,1); 15 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,3 г промежуточного продукта а-2 (20%).
Смесь промежуточного продукта а-2 (0,0017 моль) и никеля Ренея (0,3 г) в СН3ОН (30 мл) гидрировали при комнатной температуре в течение 1 ч при давлении 3 бар, затем фильтровали через целит. Целит промывали СН3ОН. Фильтрат упаривали досуха, получая 0,23 г промежуточного продукта а-3 (93%, точка плавления 168°С).
Пример 2
Схема В
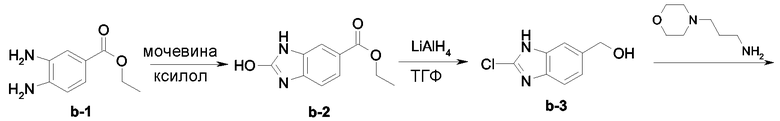

Смесь соединения b-1 (0,166 моль) и мочевины (0,199 моль) в ксилоле (300 мл) перемешивали при кипячении с обратным холодильником в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры. Осадок отфильтровывали, промывали ксилолом и простым диизопропиловым эфиром и затем сушили, получая 32 г промежуточного продукта b-2 (93%, точка плавления >260°С).
LiAlH4 (0,146 моль) добавляли расчетными порциями к раствору тетрагидрофурана (200 мл) при 5°С в токе N2. Затем добавляли по каплям раствор промежуточного продукта b-2 (0,073 моль) в тетрагидрофуране (200 мл). Смесь перемешивали при 5°С в течение 3 часов. Затем добавляли минимальное количество Н2О, с последующим добавлением раствора CH2Cl2/CH3OH (90/10). Полученную смесь сушили (над MgSO4), фильтровали и растворитель выпаривали досуха, получая 12,6 г промежуточного продукта b-3 (95%, точка плавления 179°С).
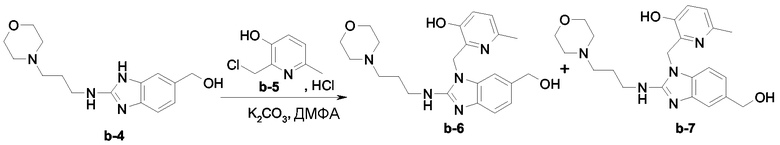
Смесь промежуточного продукта b-3 (0,069 моль) и N-пропиламиноморфолина (0,207 моль) перемешивали при 125°С в течение 4 часов и затем переносили в CH2Cl2/CH3OH. Органический слой промывали 10% раствором К2СО3 в воде, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (37 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 90/10/0,5; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали, получая 16,5 г промежуточного продукта b-4 (82%).
Смесь промежуточного продукта b-4 (0,0396 моль), промежуточного продукта b-5 (0,0475 моль) и К2СО3 (0,1188 моль) в диметилформамиде (110 мл) перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь выливали в смесь лед/вода. Водный слой насыщали К2СО3 (порошок) и экстрагировали раствором CH2Cl2/CH3OH (95/5). Остаток очищали хроматографией на силикагеле (элюент CH2Cl2/CH3OH/NH4OH 90/10/1; 20-45 мкм). Чистые фракции собирали и растворитель выпаривали, получая 5,4 г промежуточного продукта b-6 (33%, точка плавления 192°С) и 5 г промежуточного продукта b-7 (31%, точка плавления 134°С).
Смесь промежуточного продукта b-6 (0,0024 моль) и MnO2 (2 г) в CH2Cl2 (50 мл) перемешивали при комнатной температуре в течение 12 часов и затем фильтровали через целит. Целит промывали H2O. Растворитель из фильтрата выпаривали досуха, получая 0,9 г промежуточного продукта b-8 (90%, точка плавления 206°С).
Пример 3
Схема С
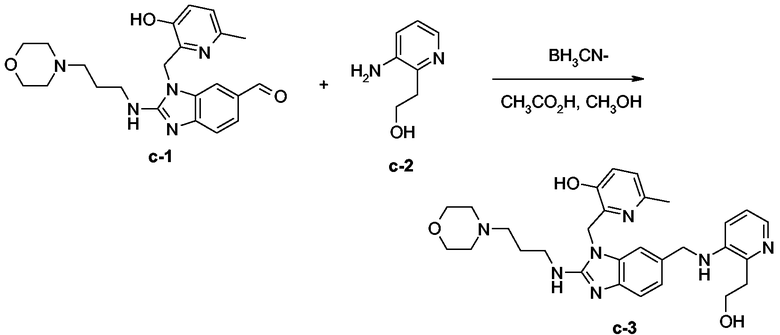
Смесь соединения с-1 (0,0003 моль), соединения с-2 (0,0004 моль) и BH3CN- на твердом носителе (0,0005 моль) в СН3ОН (15 мл) и СН3СО2Н (0,15 мл) перемешивали при комнатной температуре в течение 48 часов, затем фильтровали, промывали СН3ОН и упаривали досуха. Остаток переносили в CH2Cl2 и СН3ОН (немного). Органический слой промывали 10% К2СО3 в воде, сушили (над MgSO4), фильтровали и растворитель выпаривали. Остаток (0,19 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH (97/3/0,3); 3,5 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,114 г, 59%) кристаллизовали из 2-пропанона. Осадок отфильтровывали, промывали простым диизопропиловым эфиром и сушили. Выход: 0,1 г конечного соединения с-3 (51%, точка плавления: 211°С).
Пример 4
Схема D
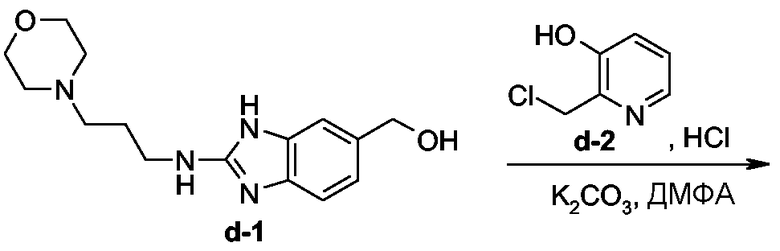
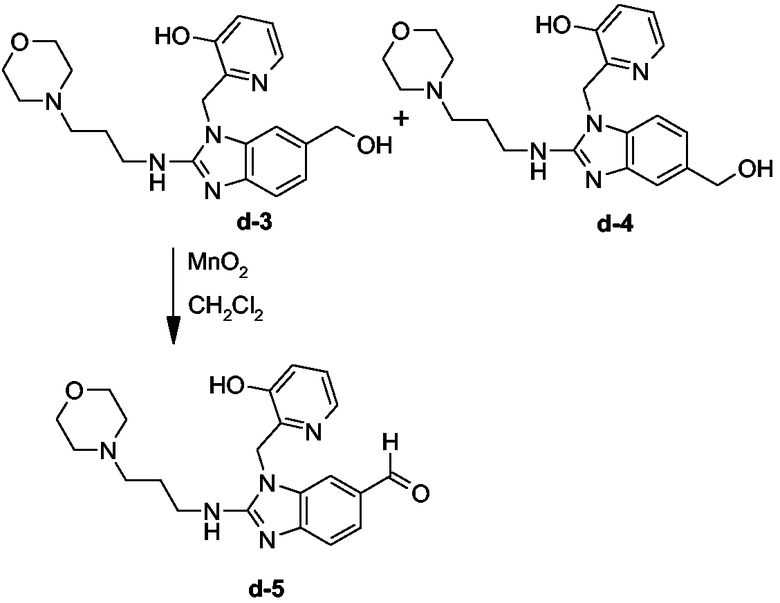
Промежуточные продукты d-3 (24%, точка плавления: 254°С) и d-4 (17%, точка плавления: 242°С) синтезировали согласно методике, описанной для промежуточных продуктов b-6 и b-7.
Промежуточный продукт d-5 (80%, точка плавления: 208°С) синтезировали согласно методике, описанной для промежуточного продукта b-8.
Пример 5
Схема Е

Смесь соединения d-5 (0,0002 моль), соединения а-3 (0,0003 моль) и BH3CN- на твердом носителе (0,0003 моль) в СН3ОН (15 мл) и СН3СО2Н (0,15 мл) перемешивали при комнатной температуре в течение 48 часов, затем фильтровали, промывали СН3ОН и упаривали досуха. Остаток переносили в CH2Cl2 и СН3ОН (немного). Органический слой промывали 10% К2СО3 в воде, сушили (над MgSO4), фильтровали и растворитель выпаривали. Остаток (0,14 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH (96/4/0,4); 3,5 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,08 г, 62%) кристаллизовали из 2-пропанона. Осадок отфильтровывали, промывали простым диизопропиловым эфиром и сушили. Выход: 0,07 г конечного соединения е-1 (54%, точка плавления: 233°С).
Пример 6
Схема F
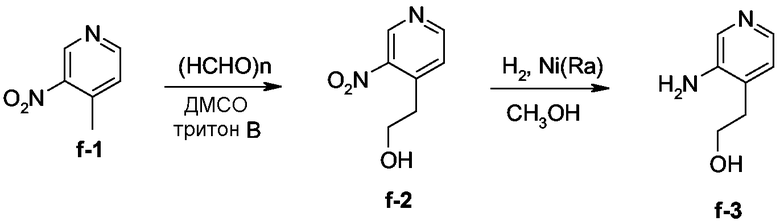
Смесь соединения f-1 (0,0094 моль) и параформальдегида (0,0075 моль) в ДМСО (4,5 мл) и тритон В (0,35 мл) перемешивали при 90°С в течение 4 часов и затем очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2; 15 мкм). Чистые фракции собирали и растворитель выпаривали, получая 0,15 г промежуточного продукта f-2 (10%).
Смесь промежуточного продукта f-2 (0,0008 моль) и никеля Ренея (0,2 г) в СН3ОН (30 мл) гидрировали при комнатной температуре в течение 1 часа при давлении 3 бар, затем фильтровали через целит. Фильтрат упаривали досуха. Выход: 0,1 г промежуточного продукта f-3 (82%).
Пример 7
Схема G
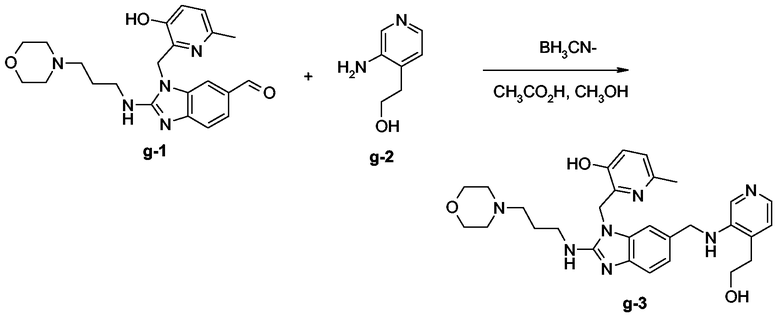
Смесь соединения g-1 (0,0003 моль), соединения g-2 (0,0003 моль) и BH3CN- на твердом носителе (0,0004 моль) в СН3ОН (20 мл) и СН3СО2Н (0,15 мл) перемешивали при комнатной температуре в течение 48 часов, затем фильтровали, промывали СН3ОН и упаривали досуха. Остаток переносили в CH2Cl2 и СН3ОН (немного). Органический слой промывали 10% К2СО3 в воде, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (0,22 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH (96/4/0,4); 3,5 мкм). Чистые фракции собирали и растворитель выпаривали. Остаток (0,05 г, 31%) кристаллизовали из смеси 2-пропанон/простой диизопропиловый эфир. Осадок отфильтровывали и сушили. Выход: 0,043 г конечного соединения g-3 (27%, точка плавления: 207°С.
Пример 8
Схема Н
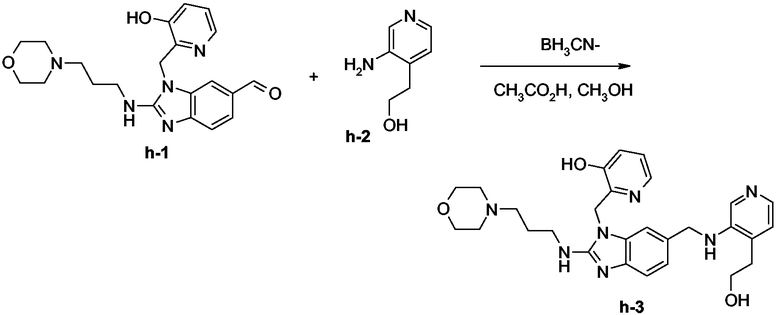
Смесь соединения h-1 (0,0003 моль), соединения h-2 (0,0003 моль) и BH3CN- на твердом носителе (0,0004 моль) в СН3ОН (20 мл) и СН3СО2Н (0,15 мл) перемешивали при комнатной температуре в течение 48 часов, затем фильтровали, промывали СН3ОН и упаривали досуха. Остаток переносили в CH2Cl2 и СН3ОН (немного). Органический слой промывали 10% водным К2СО3, сушили (над MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (0,16 г) очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 95/5/0,5; 3,5 мкм). Чистые фракции собирали и растворитель выпаривали. Выход: 0,081 г (52%). Полученную фракцию кристаллизовали из смеси 2-пропанон/простой диизопропиловый эфир. Осадок отфильтровывали и сушили. Выход: 0,049 г конечного соединения h-3 (32%, точка плавления: 142°С).
Пример 9
Схема I
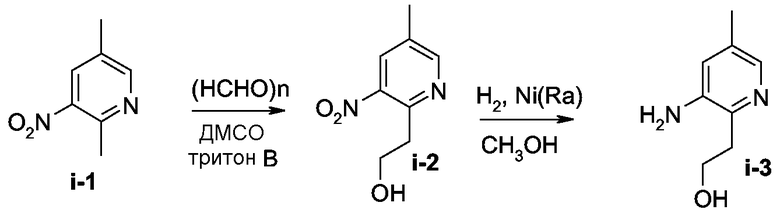
Промежуточный продукт i-2 (40%) синтезировали согласно методике, описанной для промежуточного продукта а-2.
Промежуточный продукт i-3 (57%, точка плавления: 152°С) синтезировали согласно методике, описанной для промежуточного продукта а-3.
Пример 10
Схема J
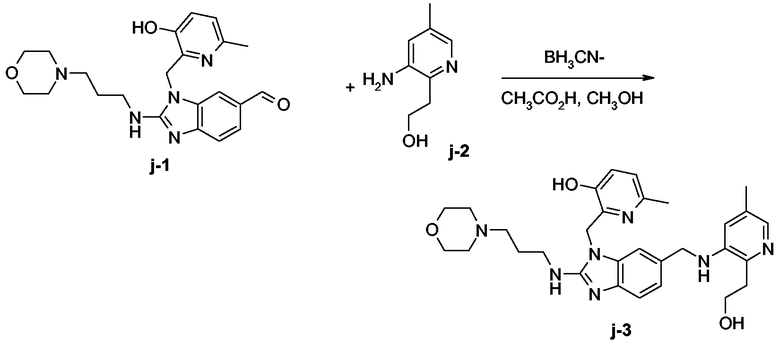
Конечное соединение j-3 (36%, точка плавления: 212°С) синтезировали согласно методике, описанной для промежуточного продукта с-3.
Пример 11
Схема К
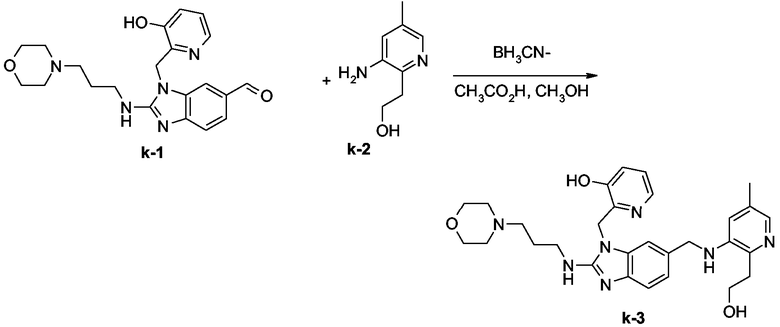
Конечное соединение k-3 (30%, точка плавления: 254°С) синтезировали согласно методике, описанной для промежуточного продукта е-3.
В следующих таблицах перечислены соединения, которые получали согласно любому одному из вышеописанных примеров.
№
Пунктирная линия в приведенной выше таблице представляет собой связь, с помощью которой радикал связан с остатком молекулы.
№
Пунктирная линия в приведенной выше таблице представляет собой связь, с помощью которой радикал связан с остатком молекулы.
Пример 12
In vitro скрининг активности против респираторно-синцитиального вируса.
Процент защиты против цитопатологии, вызванной вирусами (антивирусная активность или ЕС50), достигаемый тестируемыми соединениями, и их цитотоксичность (СС50), оба показателя, вычисляли из зависимости доза-ответ. Селективность антивирусного действия представлена индексом селективности (SI), вычисленным делением СС50 (цитотоксичная доза для 50% клеток) на ЕС50 (антивирусная активность для 50% клеток).
Автоматизированные, основанные на тетразолии, колориметрические анализы применяли для определения ЕС50 и СС50 тестируемых соединений. 96-луночные пластмассовые титрационные микропланшеты с плоским днем наполняли 180 мкл модифицированной среды Игла, дополняли 5% FCS (фетальная телячья сыворотка) (0% FLU) и 20 мМ буфера Hepes. Затем исходные растворы (7,8×конечная тестируемая концентрация) соединений добавляли в объемах 45 мкл к рядам тройных лунок таким образом, чтобы обеспечить возможность одновременной оценки их действия на инфицированные вирусом и псевдозараженные клетки. Пять пятикратных разведений делали непосредственно в титрационных микропланшетах с использованием робот-системы. Необработанные вирусные контроли и клеточные контроли HeLa включали в каждый тест. Приблизительно 100 TCID50 респираторно-синцитиального вируса добавляли к двум из трех рядов в объеме 50 мкл. Такой же объем среды добавляли к третьему ряду для измерения цитотоксичности соединений при таких же концентрациях, как концентрации, применяемые для измерения антивирусной активности. Через два часа инкубирования суспензию (4×105 клетки/мл) клеток HeLa добавляли ко всем лункам в объеме 50 мкл. Культуры инкубировали при 37°С в атмосфере 5% СО2. Через семь дней после инфицирования цитотоксичность и антивирусную активность исследовали спектрофотометрически. К каждой лунке титрационного микропланшета добавляли 25 мкл раствора МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида). Затем планшеты инкубировали при 37°С в течение 2 часов, затем среду удаляли из каждой лунки (чаши). Солюбилизации кристаллов формазана достигали добавлением 100 мкл 2-пропанола. Полное растворение кристаллов формазана получали после того, как планшеты помещали на планшетный шейкер на 10 мин. В заключение, показания поглощения снимали на восьмиканальном, контролируемом компьютером фотометре (Multiskan MCC, Flow Laboratories) при двух длинах волн (540 и 690 нм). Поглощение, измеренное при 690 нм, автоматически вычитали из поглощения при 540 нм таким образом, чтобы устранить влияние неспецифического поглощения. Результаты данного теста приведены в представленных выше таблицах.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1-(2-АМИНО-3-(ЗАМЕЩЕННЫЙ АЛКИЛ)-3Н-БЕНЗИМИДАЗОИЛМЕТИЛ)-3-ЗАМЕЩЕННЫЕ-1,3-ДИГИДРОБЕНЗОИМИДАЗОЛ-2-ОНЫ С АКТИВНОСТЬЮ В ОТНОШЕНИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2006 |
|
RU2434000C2 |
| ПРОИЗВОДНЫЕ 5- ИЛИ 6-ЗАМЕЩЕННЫХ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2369606C2 |
| 2-ЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЫ | 2006 |
|
RU2441866C2 |
| ПИПЕРИДИНАМИНОБЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2381224C2 |
| АМИНОБЕНЗИМИДАЗОЛЫ И БЕНЗИМИДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2379302C2 |
| ПРОИЗВОДНЫЕ АМИНОБЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2332414C2 |
| ВИЧ-ИНГИБИРУЮЩИЕ 5-КАРБО- ИЛИ ГЕТЕРОЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ | 2005 |
|
RU2403244C2 |
| 1, 3-ДИГИДРОБЕНЗИМИДАЗОЛ-2-ИЛИДЕНОВЫЕ АМИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2006 |
|
RU2410382C2 |
| ПРОИЗВОДНЫЕ 1, 2, 4-ТРИАЗИН-6-ОНА, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2401833C2 |
| 5-АМИДО-ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2007 |
|
RU2480464C2 |
Настоящее изобретение относится к соединениям формулы (I):
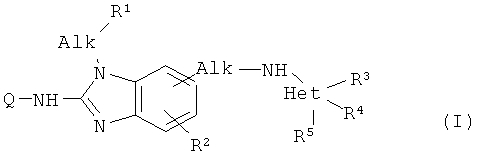 ,
,
где Q представляет собой С1-6алкил, замещенный гетероциклом, выбранным из оксазолидина, морфолинила или гексагидрооксазепина; где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя С1-6алкилами; каждый Alk независимо представляет собой С1-6алкандиил; R1 представляет собой пиридил, пиразинил, пиридазинил, пиримидинил или пирролил, где каждый из указанных гетероциклов может быть необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из гидрокси, С1-6алкила и гидрокси С1-6алкила; R2 представляет собой водород; R3 представляет собой гидрокси С1-6алкил; R4 представляет собой водород или С1-6алкил; R5 представляет собой водород или С1-6алкил; и Het представляет собой пиридил, пиразинил, пиридазинил, пиримидинил или пирролил. Такие соединения, а также композиции на их основе обладают способностью ингибировать репликацию респираторно-синтициального вируса (RSV). Кроме того, настоящее изобретение относится также и к способу получения соединений формулы (I). 3 н. и 8 з.п. ф-лы, 2 табл.
1. Соединение формулы (I)

его соль или стереохимическая изомерная форма, где Q представляет собой С1-6алкил, замещенный гетероциклом, где указанный гетероцикл выбирают из группы, состоящей из оксазолидина, морфолинила и гексагидрооксазепина; где каждый из указанных гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из С1-6алкила, каждый Alk независимо представляет собой С1-6алкандиил;
R1 представляет собой гетероцикл, выбранный из пиридила, пиразинила, пиридазинила, пиримидинила и пирролила, где каждый из указанных гетероциклов может быть необязательно замещен 1, 2 или 3 заместителями, каждый независимо выбранный из группы, состоящей из гидрокси, С1-6алкила и гидрокси С1-6алкила;
R2 представляет собой водород;
R3 представляет собой гидрокси С1-6алкил;
R4 представляет собой водород или С1-6алкил;
R5 представляет собой водород или С1-6алкил;
Het представляет собой гетероцикл, выбранный из группы, состоящей из пиридила, пиразинила, пиридазинила, пиримидинила и пирролила.
2. Соединение по п.1, где соединение имеет формулу (I-а):

где Q, R1, каждый Alk, R2, R3, R4 и R5 являются такими, как определено в п.1.
3. Соединение по п.1, где R' представляет собой пиридил, замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из гидрокси, C1-6алкила.
4. Соединение по п.1, где каждый Alk представляет собой метилен.
5. Соединение по п.1, где R4 представляет собой водород.
6. Соединение по п.1, где R5 представляет собой водород.
7. Соединение по п.1, где Het представляет собой пиридил.
8. Соединение по п.1, где Q представляет собой С1-6алкил, замещенный морфолинилом.
9. Соединение по любому из пп.1-8 для применения в качестве лекарственного средства.
10. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении репликации респираторно-синтициального вируса (RSV), содержащая носитель и, в качестве активного ингредиента, соединение по любому из пп.1-8.
11. Способ получения соединения по любому из пп.1-8, где (а) производное бензимидазола (II) подвергают взаимодействию с гетероциклическим амином (III) или производное бензимидазола (IV) подвергают взаимодействию с промежуточным продуктом (V):
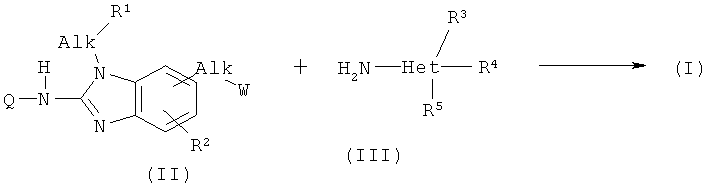
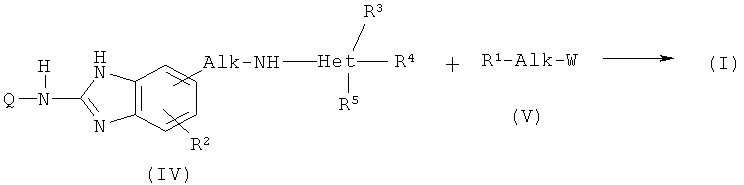
где Q, каждый Alk, R1, R2, R3, R4, R5 имеют значения, указанные выше, W представляет собой подходящую удаляемую группу; или альтернативно
(b) альдегид или кетон формулы (VI), где Alk' имеет значение, аналогично радикалу Alk, но отсутствует один атом водорода, подвергают реакции восстановительного аминирования с гетероциклиламином (III):
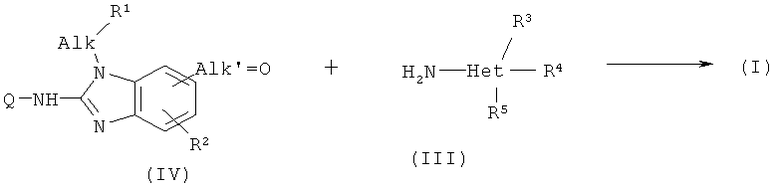
и
(c) солевую форму соединений формулы (I) получают обработкой кислотой или основанием, или наоборот, солевую форму соединений формулы (I) превращают в свободную форму обработкой основанием или кислотой.
| СПОСОБ ЭКСПЛУАТАЦИИ ЭЛЕКТРОПЕЧИ ДЛЯ ВЫПЛАВКИ СИНТЕТИЧЕСКОГО ШЛАКА | 1995 |
|
RU2092575C1 |
| ТОРМОЗНОЕ УСТРОЙСТВО ДЛЯ АВТОМОБИЛЯ | 1953 |
|
SU100611A1 |
| Кипоразрыхлитель-смеситель | 1953 |
|
SU100615A1 |
| Способ изготовления изделий из продуктов конденсации фенолов с альдегидами | 1920 |
|
SU5027A1 |
Авторы
Даты
2011-05-27—Публикация
2006-06-20—Подача