ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к борьбе с вирусной инфекцией у рыб.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
По существующим оценкам болезни рыб отнимают от двадцати до тридцати центов с каждого доллара, затрачиваемого на разведение рыб в США. Хотя микроорганизмы, патогенные для рыб, включают грибки, простейшие и бактериальные микроорганизмы, наибольшее беспокойство у владельцев рыбоводных заводов вызывают вирусы, так как с ними почти невозможно бороться. Практически не существует эффективных антибиотиков или других противовирусных средств, которые эффективно действуют на вирусы рыб.
Массовая смертность вида Cyprinus carpio наблюдалась во многих странах на рыбоводческих фермах, где разводили рыб для употребления в пищу и декоративных рыбок, что приводило к значительным финансовым потерям. Хотя летальное заболевание является очень контагиозным (инфекционным) и исключительно вирулентным, заболеваемость и смертность ограничены популяциями японского карпа-кои и карпа обыкновенного. Было обнаружено, что несколько близкородственных видов, включая других карповых рыб, например - золотую рыбку, абсолютно не проявляют симптомов болезни, даже после длительного совместного обитания с зараженной рыбой в одном и том же бассейне.
Интенсивное разведение японского карпа-кои, обыкновенного карпа и других карповых рыб в прудах или в садках приводит к частому возникновению вирусных болезней в этих популяциях. Предполагалось, что коронавирус (Miyazaki, 2000), рабдовирус (Kirn, 1999), иридовирус (Shchelkunov, 1990) и вирусы герпеса (Sano, 1985; Hedrick, 1990, 2000; Calle, 1999) могут быть агентами, вызывающими тяжелые болезни у карповых рыб. Вирус герпеса был обнаружен в папилломатозных кожных выростах японского карпа-кои в Северной Америке (Hedrick, 1990; Calle, 1999). Этот вирус герпеса карпов (CHV, carp herpesvirus) соответствует вирусу герпеса карповых рыб, обнаруженному в популяции карпов-кои в Японии (Sano, 1985, 1991). Летальное заболевание, наблюдавшееся у карповых рыб в Израиле, также наблюдали в Северной Америке, Европе и Корее (Hedrick, 2000; Walster, 1999; Oh, 2001).
Предполагалось, что болезнь, которая привела к массовой смертности рыб вида Cyprinus carpio, вызвана кои-герпесвирусом (KHV, koi herpesvirus). Однако в действительности, вирус KHV был охарактеризован лишь частично (Hedrick, 2000; Gray, 2002; Body, 2000). Независимо от идентичности вируса болезнь обнаруживает определенную картину развития. Пораженные рыбы обнаруживают вялое поведение с последующей гибелью. В период, предшествующий смерти, на жабрах появляются белые пятна. Они обусловлены некротизацией (омертвением) ткани жабр и обильной продукцией слизи и могут сопровождаться кровотечением (Dawes, 2002).
В настоящее время не существует других способов борьбы с этой болезнью, кроме уничтожения инфицированного поголовья и обеззараживания оборудования рыбоводных заводов. Хотя смертность может достигать 100%, некоторые рыбы могут выжить и действительно выживают, и иногда выживаемость превышает 20%. Такие рыбы затем становятся устойчивыми к последующим экспозициям вируса и остаются здоровыми, несмотря на попытки их реинфицировать.
На основании этих и других сходных наблюдений фермеры Израиля разработали семистадийный протокол, предназначенный для получения рыб с естественным иммунитетом, которых можно считать безопасными, чистыми и пригодными для продажи (Dawes, 2002).
Этот семистадийный протокол включает в себя метание рыбами икры и получение мальков в марте и их выращивание без сортировки до июля, когда их сортируют на различные категории качества. Рассортированных рыб затем подвергают действию вируса в течение четырех дней посредством помещения в резервуар больной рыбы, а затем обеспечивают трехмесячный период восстановления. Затем рыбам дают выдержать оптимальное для развития инфекции окно, которое возникает при снижении температуры в начале октября, после чего их тестируют на иммунность примерно в январе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предусматривает изолированный каузативный агент болезни, поражающей Cyprinus carpio. Согласно настоящему изобретению было обнаружено, что этот агент является еще не классифицированным ДНК-содержащим вирусом.
Было обнаружено, что изолированный ДНК-содержащий вирус карпов (далее обозначаемый как «CV DNA вирус») согласно настоящему изобретению является крупным двухцепочечным ДНК-содержащим вирусом с капсидом, имеющим икосаэдрическую морфологию, при этом капсид по данным электронной микроскопии имеет размер около 90-110 нм. Было обнаружено, что ДНК вируса карпов содержит примерно 250000-300000 пар оснований, что определено с помощью гель-электрофореза в пульсирующем поле и посредством анализа продуктов, полученных при расщеплении рестрикционными ферментами. ДНК вирус карпов отчетливо отличается от KHV вируса, описанного в литературе.
Вирус карпов согласно настоящему изобретению может иметь одну или несколько следующих характеристик (обнаруженных у специфического изолята, описанного ниже):
(а) он высоко контагиозен;
(б) он способен передаваться через воду;
(в) он вызывает болезнь в диапазоне температур от 18 до 25°С, что наблюдалось в открытых водоемах и в лабораторных условиях; и
(г) он имеет узкий спектр хозяев, так как даже очень близкородственные карповые рыбы устойчивы к этому вирусу, который не мог размножаться в культурах папилломатозной эпителиомы карповых рыб (ЕРС, Epithelioma papillosum cyprini).
В одном из аспектов настоящее изобретение предусматривает изолированный CV DNA вирус, вызывающий вирусные болезни у рыб, более конкретно - у рыб, относящихся к виду Cyprinus carpio.
В одном из примеров осуществления изобретения изолированный вирус согласно настоящему изобретению является оболочечным, крупным, двухцепочечным ДНК-содержащим вирусом с капсидом, имеющим икосаэдрическую морфологию, при этом капсид по данным электронной микроскопии имеет размер около 90-110 нм, а ДНК вируса содержит примерно 250000-300000 пар оснований.
В соответствии с другим примером осуществления изобретения выделенный вирус является оболочечным, крупным, двухцепочечным ДНК-содержащим вирусом с капсидом, имеющим икосаэдрическую морфологию, при этом капсид по данным электронной микроскопии имеет размер около 90-110 нм, а ДНК вируса содержит примерно 260000-285000 пар оснований.
В соответствии с еще одним примером осуществления изобретения выделенный вирус является оболочечным, крупным, двухцепочечным ДНК-содержащим вирусом с капсидом, имеющим икосаэдрическую морфологию, при этом капсид по данным электронной микроскопии имеет размер около 90-110 нм, а ДНК вируса содержит примерно 277000 пар оснований.
CV DNA вирус согласно настоящему изобретению может быть получен в чистом виде, а именно - без других вирусов или микробного материала.
Изобретение также предусматривает в соответствии с другим его аспектом способ выделения вышеуказанного CV DNA вируса, который включает в себя идентификацию рыбы, страдающей симптомами, связанными с CV-вирусом, получение тканей от инфицированной рыбы, сокультивирование зараженной ткани с клетками рыб до проявления цитопатического эффекта в указанных клетках рыб, получение среды от сокультивирования и выделение вирусных частиц. Клетками рыб предпочтительно являются культивируемые клетки плавников. Если рыбы являются карпами, клетки являются клетками карпов, предпочтительно - клетками плавников карпов (CFC, carp fin cell). Если рыбы являются карпами-кои, клетки являются клетками плавников карпов-кои.
Вирулентный вирус в типичном случае может быть выделен из тканей больной рыбы, предпочтительно - из тканей почек и печени или из крови. В случае карпа сокультивирование с CFC в типичном случае длится 5-6 дней, после чего можно наблюдать цитопатический эффект.
Изобретение также относится к вирулентному CV DNA вирусу, имеющему депозитарный регистрационный номер CNCM 1-3145, депонированному 12 декабря 2003 г. в Национальной коллекции культур микроорганизмов (CNCM), Институт Пастера, Париж, Франция.
Одним из применений выделенного CV DNA вируса согласно настоящему изобретению является его применение для получения авирулентной формы вируса, которая может быть использована в соответствии с настоящим изобретением для вакцинации рыб против инфекции, вызываемой CV DNA вирусом. Авирулентная форма CV DNA вируса может быть, например, ослабленной формой вируса, инактивированной формой вируса, генетически модифицированной формой вируса, лишенным оболочки ДНК-содержащим вирусом и т.п.
Таким образом, предусмотрена авирулентная форма ДНК-содержащего вируса карпов, который вызывает смертельное вирусное заболевание у рыб, причем ДНК-содержащий вирус является крупным двухцепочечным ДНК-содержащим вирусом с капсидом, имеющим икосаэдрическую морфологию; при этом капсид имеет размер, по данным электронной микроскопии примерно равный 90-110 нм, а ДНК вируса содержит примерно 250000-300000 пар оснований.
Также предусмотрена авирулентная форма ДНК-содержащего вируса карпов, который вызывает смертельное вирусное заболевание у рыб, причем ДНК-содержащий вирус является крупным двухцепочечным ДНК-содержащим вирусом с капсидом, имеющим икосаэдрическую морфологию; при этом капсид имеет размер, по данным электронной микроскопии примерно равный 90-110 нм, а ДНК вируса содержит примерно 260000-285000 пар оснований.
Кроме того, предусмотрена авирулентная форма ДНК-содержащего вируса карпов, который вызывает смертельное вирусное заболевание у рыб, причем ДНК-содержащий вирус является крупным двухцепочечным ДНК-содержащим вирусом с капсидом, имеющим икосаэдрическую морфологию; при этом капсид имеет размер, по данным электронной микроскопии примерно равный 90-110 нм, а ДНК вируса содержит примерно 277000 пар оснований.
В специфическом примере осуществления изобретения изолированный CV DNA вирус использован для получения живой ослабленной формы вируса, которую можно применить для вакцинации рыб против инфекции, вызываемой CV DNA вирусом.
Настоящее изобретение также предусматривает способ выделения живого ослабленного вируса. В соответствии с этим способом производят посев вирулентной формы вируса, которую можно выделить так, как описано выше, на CFC, идентифицируют бляшки, образованные вирусом со сниженной вирулентностью, и выделяют вирус из этих бляшек. Если это желательно, затем вирус можно очистить. Предпочтительно выделенные вирусы снова высевают на культуру клеток рыб, полученных от обыкновенного карпа или от различных других видов рыб, например, но не ограничиваясь этим, от толстолобика (Hypophthalmichthys molitrix), золотой рыбки (Carassius aurata) или белого амура (Ctenopharyngodon idella). Этот процесс можно затем повторить несколько раз до получения значительно ослабленного живого вируса.
Изобретение также относится к живой ослабленной форме CV-вируса, имеющей депозитарный регистрационный номер CNCM I-3146 и депонированной 12 декабря 2003 г. в Национальной Коллекции Культур Микроорганизмов (CNCM) Института Пастера, Париж, Франция.
В следующем предпочтительном примере осуществления изобретения выделенный CN DNA вирус используется для получения инактивированной формы вируса, которую можно применить для вакцинации рыб против инфекции, вызываемой CV DNA вирусом.
Способ инактивации CN DNA вируса, обсуждавшийся выше в этой работе, также предусматривается настоящим изобретением. Способ включает в себя выделение вирулентного вируса, проведение его химической или физической обработки и получение инактивированного CV-вируса. Химическими и физическими обработками могут быть любые обработки, известные в данной области техники. Химическая обработка может, например, не ограничивая изобретение, включать в себя воздействие на вирус органических растворителей, таких как формалин, ацетон, метанол, этанол и т.п., в соответствии с процедурами, известными из литературы специалисту в данной области техники. Физическая обработка может включать в себя, например, облучение УФ-излучением или воздействие высоких или низких температур.
Инактивированный вирус, полученный так, как обсуждается в данной заявке на патент, или с помощью любого другого способа, известного в данной области техники, может не образовывать бляшки даже при высоких титрах или может образовывать бляшки лишь при очень высоких концентрациях, в отличие от живого ослабленного вируса, который образует бляшки даже при минимальных концентрациях.
В следующем примере осуществления изобретения выделенный CV DNA вирус используется для получения генетически модифицированной формы вируса, которую можно применить для вакцинации рыб против инфекции, вызываемой CV DNA вирусом.
В соответствии со следующим аспектом настоящее изобретение предусматривает живую ослабленную форму CN DNA вируса, который вызывает болезнь у рыб вида Cyprinus carpio, как описано выше. Как указано выше, живую ослабленную форму вируса можно использовать для вакцинации.
Также предусмотрена инактивированная форма CV DNA вируса, который вызывает болезнь у рыб вида Cyprinus carpio, как описано выше. Эту инактивированную форму вируса также можно использовать для вакцинации.
Согласно следующему аспекту изобретение предусматривает вакцинный препарат для иммунизации рыб против инфекции, вызываемой указанным CV DNA вирусом. Вакцинный препарат содержит в качестве активного ингредиента авирулентную форму указанного вируса. Такой авирулентной формой может быть, в качестве примера и без ограничений, живой ослабленный вирус, инактивированный вирус или их комбинация. Согласно этому аспекту изобретение предусматривает также применение авирулентного вируса, например - живого ослабленного вируса, инактивированного вируса или их комбинации, для производства вакцинного препарата.
Инактивированный вирус может быть использован в качестве однокомпонентной вакцины или может быть использован в качестве поликомпонентной вакцины в комбинации с живым ослабленным вирусом, описанным в данной работе, или, по меньшей мере, в комбинации с одной другой вакциной, которая может быть известна специалисту в данной области техники. Инактивированный вирус можно вводить одновременно с, по меньшей мере, одной другой вакциной или в различное время. Например, инактивированный вирус может быть введен за несколько дней до введения живого ослабленного вируса.
В одном из предпочтительных примеров осуществления изобретения вакцинный препарат, содержащий авирулентную форму вируса, находится в сухой форме, например - в форме порошка, в лиофилизированной форме, в форме прессованных гранул или таблеток и т.д.
В другом примере осуществления настоящего изобретения вирус может находиться в форме жидкости, полученной из культуры тканей. Указанную жидкость можно хранить при температуре окружающей среды, предпочтительно - при -70°С, наиболее предпочтительно - в виде раствора, содержащего глицерин. В специфическом примере осуществления изобретения жидкость, полученная из культуры тканей, содержит 20% глицерина.
В следующем аспекте настоящее изобретение предусматривает вакцинный препарат для пассивной иммунизации рыб против инфекции, вызываемой вышеуказанным CV-вирусом, при этом вакцинный препарат содержит сыворотку иммунизированного животного, а сыворотку получают от животных, например - рыб, лошадей, свиней, коров, мышей, кроликов и т.п., иммунизированных живой ослабленной формой указанного CV-вируса. В предпочтительном случае животными являются рыбы.
Изобретение согласно этому аспекту предусматривает также способ обработки рыб для борьбы с инфекцией, вызываемой вышеуказанным CV DNA вирусом. Способ включает в себя стадии иммунизации животного авирулентным CV-вирусом согласно настоящему изобретению, получения сыворотки от иммунизированных животных и обработки рыб сывороткой, за счет чего обеспечивается иммунизация рыб.
Различные формы вируса, открытые в настоящем изобретении, могут быть переведены в сухую форму с использованием многочисленных способов. Особо предпочтительной формой сушки является лиофилизация. Перед сушкой, например - перед процессом лиофилизации, к среде могут быть добавлены различные ингредиенты, например - консерванты, антиоксиданты или восстановители, разнообразные наполнители и т.п. Эти наполнители могут быть также добавлены к сухому, например - лиофилизированному, живому ослабленному вирусу уже после стадии сушки.
Иммунизацию в типичном случае выполняют посредством добавления авирулентной формы вируса, например - живого ослабленного вируса, или инактивированного вируса, или их комбинации, в воду, в которой находятся рыбы, подлежащие иммунизации. Также можно инъецировать препарат вакцины непосредственно в рыбу. Для стимуляции иммунных процессов препарат может также включать различные адъюванты, цитокины или другие иммуностимуляторы, в частности - в случае препаратов, предназначенных для инъекций. Препарат вакцины, в частности - в том случае, когда он добавляется в воду, в которой находятся рыбы, может также содержать разнообразные стабилизаторы, антибиотики и т.п.
В следующем аспекте настоящего изобретения предусмотрено антитело, которое избирательно связывается с CV-вирусом согласно настоящему изобретению или с его компонентом. В одном из примеров осуществления настоящего изобретения антитело специфически связывается с ДНК-содержащим вирусом рыб или с его компонентом.
В следующем аспекте настоящее изобретение относится к способу диагностики болезни, вызываемой CV-вирусом, описанным выше, причем способ включает в себя получение ткани от подозрительной рыбы и определение наличия вирусных маркеров, связанных с CV DNA вирусом, присутствие которых свидетельствует о том, что исследуемая рыба инфицирована вирусом.
Изобретение далее относится к набору, содержащему авирулентную форму CN DNA
вируса, например - живой ослабленный вирус согласно настоящему изобретению, для лечения вируса карпов у рыб и инструкции по его применению.
Кроме того, изобретение относится к диагностическому набору, включающему в себя, по меньшей мере, одно антитело или, по меньшей мере, одно конъюгированное антитело, для диагностики болезни, вызываемой CV-вирусом, и инструкции по его применению. Набор может также включать, по меньшей мере, один контрольный антиген или образец контрольной ткани, содержащей контрольный антиген.
Диагностический набор согласно настоящему изобретению может быть использован для диагностики присутствия вируса согласно настоящему изобретению у живых или мертвых рыб.
СОКРАЩЕНИЯ
CFC - Клетка плавников рыб;
CHV - Герпесвирус карпа;
CNGV - Вирус нефрита и некроза жабр карпа;
СРЕ - Цитопатологический эффект;
CV - Вирус карпа;
ЕРС - Папилломатозная эпителиома карповых рыб;
HSV - Вирус простого герпеса;
KHV - Вирус герпеса карпов-кои;
KFC - Клетки плавников карпов-кои;
PBS - Фосфатный буферный раствор;
PFU - Бляшкообразующая единица (БОЕ);
РТА - Фосфорновольфрамовая кислота;
SDS - Додецилсульфат натрия;
TCI - Общее количество ДНК, экстрагированное из инфицированных CFC;
TCU - Общее количество ДНК, экстрагированное из неинфицированных CFC.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Для того чтобы лучше понять содержание изобретения и увидеть, как оно может быть реализовано на практике, далее будет описан предпочтительный пример осуществления с использованием неограничивающих примеров и со ссылкой на прилагаемые чертежи, на которых изображено следующее:
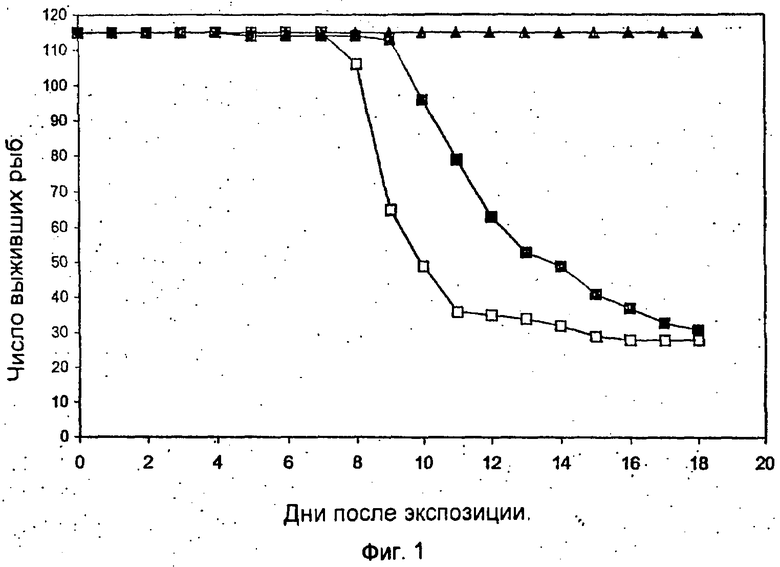
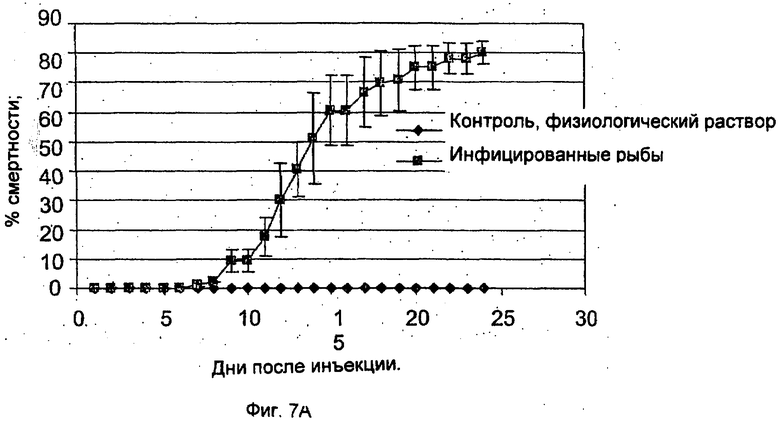
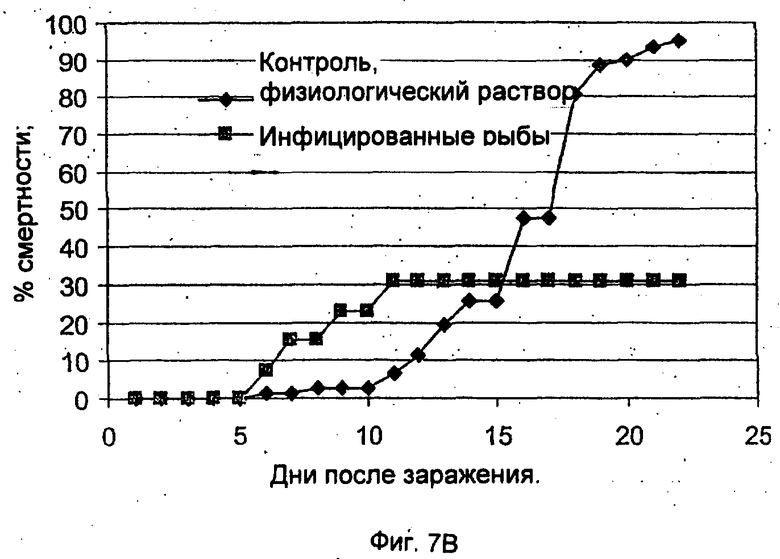
Фиг.1 демонстрирует кинетику смертности карпов-кои после вирусной нагрузки посредством совместного пребывания с источником заражения. Взрослых рыб разделили на три группы, состоявшие из 114, 114 и 115 рыб. На группу 1 (□) и группу 2 (■) действовали зараженным образцом, а группу 3 (▲) использовали в качестве неинфицированного контроля. Число выживших рыб контролировали ежедневно.
Фиг.2 демонстрирует электронные микрофотографии CV вируса, полученного из клеток плавников инфицированных карпов (CFC). Очищенный вирус был контрастирован 2% раствором фосфорновольфрамовой кислоты (РТА). Размер частиц лежал в диапазоне 96-105 нм при среднем значении, равном 103 нм.
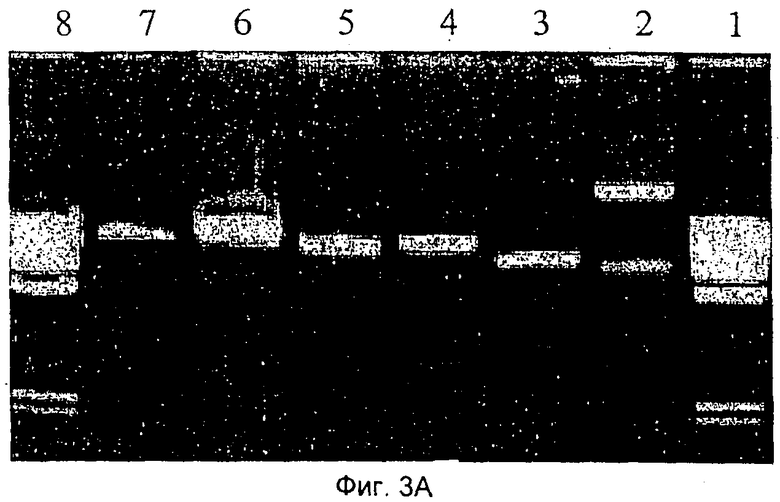
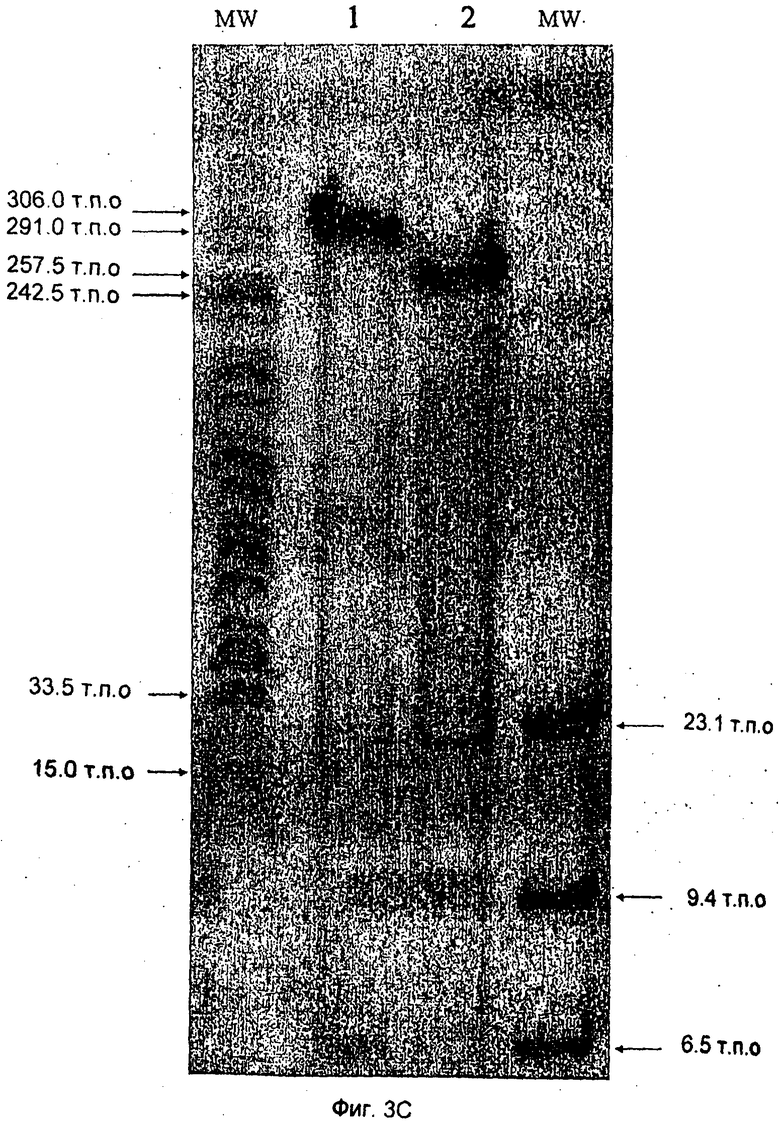
Фиг.3 отражает анализ ДНК CV-вируса посредством электрофореза в агарозном геле. На Фиг.3А геном вирусной ДНК был получен из очищенных вирусов посредством экстракции фенолом. Каждая линия отображает различный протокол: инкубацию с протеиназой К и SDS (линия 2), инкубацию только с SDS (линия 3), обработку проназой и SDS (линия 4) и отсутствие предварительной обработки (линия 5). В качестве маркеров была использована линейная аденовирусная плазмидная ДНК (pAdEasy 1), расщепленная Cla I (линия 6) и не расщепленная (линия 7). Анализ был выполнен в 0,8%-ном агарозном геле, где в линии 1 и 8 была загружена маркерная ДНК фага λ. На Фиг.3В показан анализ ДНК CV-вируса посредством гель-электрофореза в пульсирующем электрическом поле (PFGE). Те же препараты ДНК, которые описаны на Фиг.3А, были загружены в линии 2-7, а в линию 8 был загружен дополнительный образец ДНК CV, очищенной с помощью протеиназы К. Использованными маркерами молекулярной массы были ДНК фага λ, расщепленная Hind III (линия 9) и лэддеры (существенно более крупные элементы ДНК фага λ, содержавшие 50-1000 тысяч пар оснований) лигированной ДНК фага λ (линия 1). Фиг.3С демонстрирует результаты, полученные при расщеплении CV ДНК рестрикционными ферментами. Вирусную ДНК инкубировали с рестрикционным ферментом Swa I в реакционном буфере (100 мМ NaCl, 50 мМ Трис-HCl, 10 мМ MgCl2, 1 мМ дитиотреитола, с добавлением 100 мкг/мл бычьего сывороточного альбумина (BSA)) при 25°С в течение 3 часов. С помощью PFGE с гомогенным электрическим полем с фиксированной постоянной составляющей (CHEF) продукты реакции разделяли на 1%-ном агарозном геле при следующих условиях: 6 В/см, 14°С, в течение 14 часов. Время переключения изменялось линейно от 5 до 35 секунд. Линия 1 - нерасщепленная вирусная ДНК; линия 2 - вирусная ДНК, расщепленная рестрикционным ферментом Swa I.
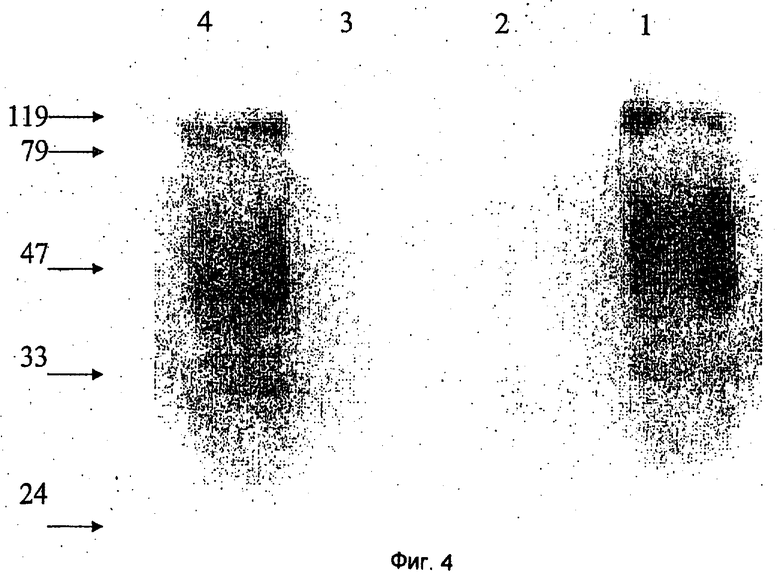
Фиг.4 иллюстрирует анализ вирусного белка CV-вируса. Из среды, в которой культивировали ткани, с использованием градиентов сахарозы были выделены аденовирус, HSV-1 и вирус карпа. Вирусные частицы кипятили в буфере Лемели и разделяли посредством электрофореза на двух параллельных 10%-ных акриламидных гелях. Один гель окрашивали красителем Кумасси синим (Coomassie blue), и он показан на панели А. Второй гель переносили на PVDF-мембрану и окрашивали антисывороткой кролика к вирусу карпов, как показано на панели В. Сыворотка реагирует с белками вируса карпов (правая линия), но не реагирует с белками вируса герпеса или аденовируса.
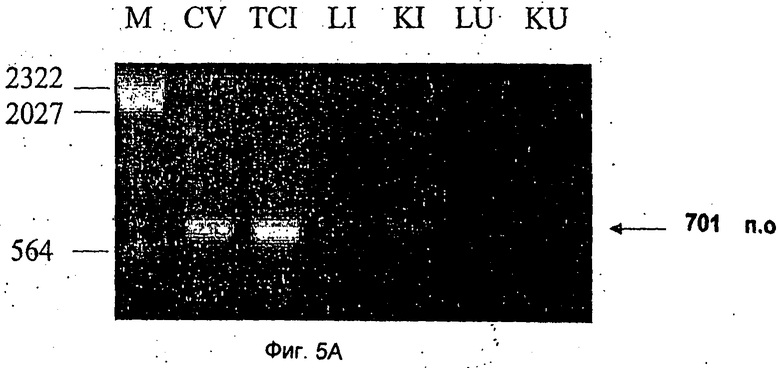
Фиг.5 иллюстрирует идентификацию фрагментов генома вируса карпа из ДНК CFC и органов рыб, амплифицированных с помощью ПЦР. Исследована общая ДНК, экстрагированная из инфицированных CFC (TCI) и неинфицированных CFC (TCU), вирусная ДНК (вирус карпа) и ДНК, выделенная из печени больных и здоровых рыб (LI и LU соответственно) и из почек больных и здоровых рыб (KI и KU соответственно). М = молекулярная масса ДНК-маркера. Праймеры, использованные для амплификации ДНК, были получены из клона D: AP1-АР2 и АР1-АР3 праймеры были использованы в ПЦР (панель А и панель В соответственно).
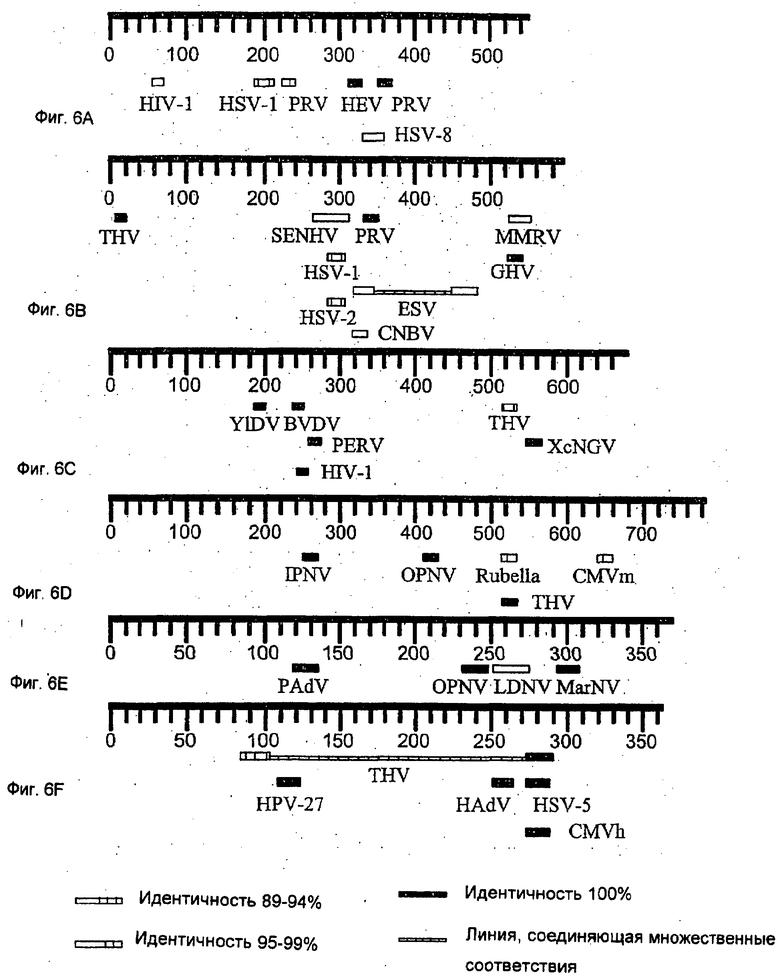
Фиг.6A-F иллюстрируют гомологию последовательностей в геноме вируса карпа и в других вирусных последовательностях. Клоны вирусной ДНК были секвенированы и проанализированы с использованием программы BLAST PubMed (NIH). На этой фигуре использованы следующие сокращения: вирусы Herpes simplex 1, 2, 5 и 8 (HSV-1, HSV-2, HSV-5 и HSV-8 соответственно); вирус псевдобешенства (PRV); вирус герпеса кур (GHV); радиновирус Масаса mulata (MMRV); вирус герпеса тупайи (THV); цитомегаловирус мыши (CMVm); цитомегаловирус человека (CMVh); вирус герпеса мармозеток (MarHV). Все перечисленные выше вирусы принадлежат к семейству Herpesviridae. Нуклеополиэдровирус Spodoptera exigua (SENHV), грануловирус Xestia c-nigrum (XcNGV), нуклеополиэдровирус Lymatria dispar (LDNV), нуклеополигэровирус Orgyia pseudosugata (OPNV) и бакуловирус Culex nidripapus (CNBV) являются представителями семейства Baculoviridae; вирус Ectocarpus siliculosus (ESV) является представителем вирусов водорослей. Вирус болезни Ябы (YIDV) - это вирус оспы. Вирус иммунодефицита человека типа 1 (ВИЧ-1, HIV-1), эндогенный вирус человека (HEV) и эндогенный ретровирус свиней (PERV) - представители семейства Retroviridea. Аденовирус свиней (PAdV) и аденовирус человека (HAdV) - представители группы аденовирусов. Вирус вирусной диареи коров (BVDV) - флавивирус. Вирус инфекционного некроза поджелудочной железы (BVDV) - бирнавирус. Вирус краснухи (Rubella) - тогавирус. Папилломавирус человека тип 27 (HPV-27).
Фиг.7А-В демонстрирует результаты заражения рыб вирулентным вирусом. На Фиг.7А показана общая смертность в группе из 50 здоровых рыб, инфицированных вирулентным вирусом. На Фиг.7В показана смертность рыб, которые выжили после первоначального заражения и которые получили вирусную нагрузку посредством совместного обитания с зараженной рыбой.
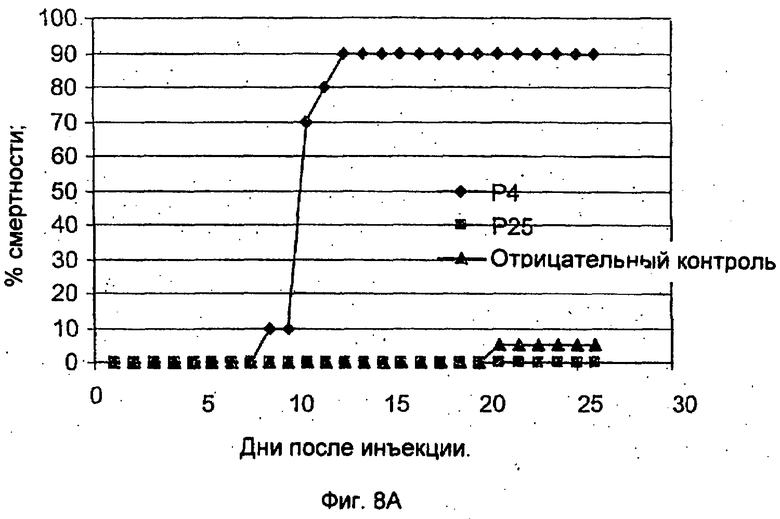
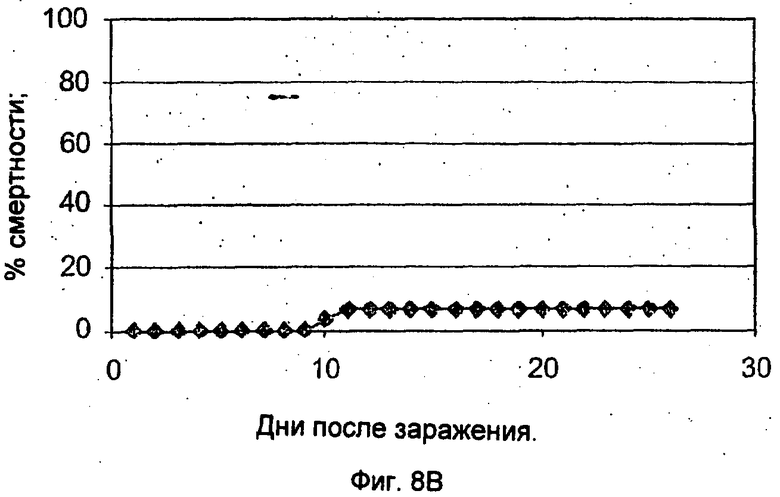
Фиг.8А-В демонстрирует результаты, полученные после заражения рыб живым ослабленным вирусом. На Фиг.8А показана смертность рыб после инъекции (внутрибрюшинной) живого ослабленного вируса в концентрации 6×103 БОЕ/мл. На Фиг.8В показана смертность рыб, выживших после начального заражения ослабленным вирусом и получивших вирусную нагрузку посредством совместного обитания с зараженной рыбой.
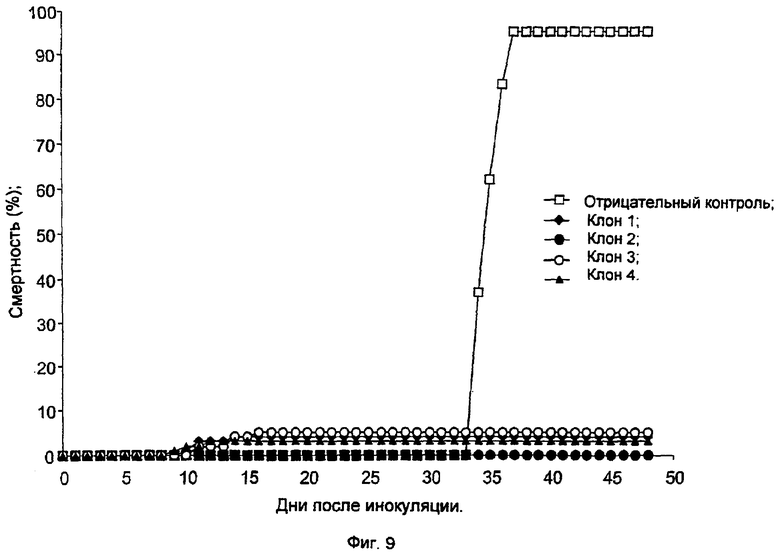
Фиг.9 демонстрирует долю вакцинированных рыб, погибших после нагрузочного заражения. Рыб (в каждой группе число рыб равно n=100, средняя масса 50 г) вакцинировали посредством внутрибрюшинной инъекции 4 клонированных вирусов, полученных от CV-вируса карпа из пассажа Р26. Рыб, которым вводили PBS (раствор фосфатного буфера), использовали в качестве отрицательного контроля (NC). Через 25 дней после заражения пять рыб были подвергнуты повторной вирусной нагрузке посредством совместного обитания с зараженной рыбой.
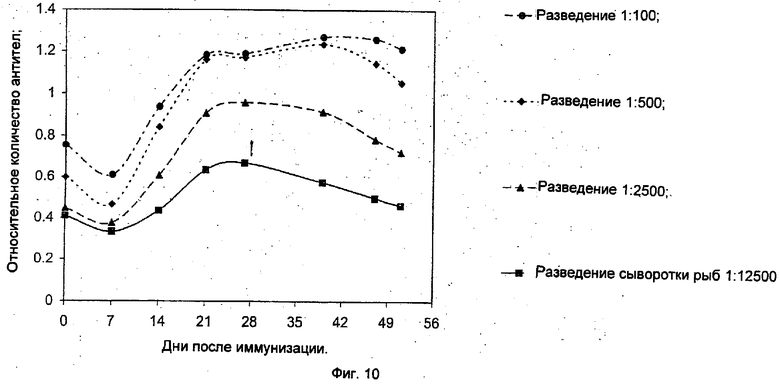
Фиг.10 демонстрирует кинетику образования антител к CV-вирусу у карпов, иммунизированных ослабленным вирусом.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее изобретение будет проиллюстрировано на примере нескольких неограничивающих его конкретных способов осуществления.
Термины «ДНК-содержащий вирус карпов» (CV DNA вирус или CV-вирус) или «вирус нефрита и некроза плавников карпов» (CNGV) при использовании в контексте данного изобретения представляют собой альтернативные и синонимичные выражения, используемые для обозначения нового вируса согласно настоящему изобретению, имеющего характеристики, указанные выше и ниже. Следует понимать, что эти термины, а именно - CV или CNGV, не ограничивают изобретение каким-либо конкретным изолятом вышеуказанного вируса. Любой вирус, имеющий новые характеристики, описанные в данной заявке, входит в объем настоящего изобретения.
Термин «вирус» в контексте данной заявки относится, без ограничения, к близкородственным штаммам специфического изолята, описанного ниже, более конкретно - к любому штамму, который обладает сходными генотипическими и/или фенотипическими характеристиками с этим изолированным штаммом. Сюда относятся незначительно модифицированные формы или варианты вируса, которые сохраняют те же функциональные свойства, а именно - содержащие вставки, делеции или изменения аминокислоты или нуклеотида.
Термин «авирулентная форма вируса» в контексте настоящего изобретения относится, без ограничений, к вирусу, у которого полностью отсутствует способность вызывать болезнь. Такими авирулентными вирусами могут быть ослабленные вирусы, инактивированные вирусы и т.п., которые используются в любых типах иммунизации, включая активные и пассивные иммунизации. Также в объем изобретения входят любые природные авирулентные эквиваленты, у которых снижена способность вызывать вышеописанную болезнь.
Термин «рыба» относится к любой рыбе аквакультурного происхождения, поражаемой CV-вирусом, в том числе - к пищевым и декоративным рыбам, предназначенным для продажи, на любой стадии их развития, включая личинок, мальков и взрослых рыб. Также этот термин охватывает любые другие живые существа аквакультурного происхождения, которые могут быть поражены CV-вирусом, или зараженных вирусом животных, не проявляющих и не обнаруживающих характерного поведения больных карпов, инфицированных CV-вирусом.
Фиг.1 демонстрирует воздействие на восприимчивых здоровых карпов инфицированных образцов, взятых из зараженного садка. Воздействие зараженного образца на рыб приводит к высокой смертности. В среднем, 74% рыб (87 и 84 рыбы соответственно) погибли через 8-13 дней после воздействия. Тем не менее все рыбы контрольной группы выжили в течение всего 21-дневного периода экспериментов.
За три-четыре дня до гибели рыбы прекращали принимать пищу и обнаруживали аномальное поведение, например - вялость и движение у поверхности воды с попытками заглатывания воздуха. Кроме того, рыбы совершали некоординированные движения и плавали хаотично, что характерно для неврологических нарушений. У нескольких рыб наблюдались такие неврологические симптомы, как уменьшение частоты движений хвоста и потеря равновесия. Сходные симптомы были ранее описаны у карпов-кои и обыкновенных карпов в США (Hedrick, 2000). После этих признаков появлялись сильный некроз ткани жабр, поверхностные кровоизлияния и повышенная секреция слизи кожей. Вскрытие больных рыб выявило петехиальные кровоизлияния в печени и другие нестойкие патологические изменения - предположительные симптомы вторичной инфекции (не показаны).
В сходных экспериментах, проведенных в резервуарах, где рыб содержали при температуре 29°С, все подвергнутые воздействию рыбы выжили в течение 22-дневного периода (данные не показаны). Эти результаты четко показывают, что вирус, вызывающий болезнь, легко передается через воду и является высоко контагиозным. Вирус приводит к высокой смертности, но возникновение болезни ограничено температурой воды 18-25°С.
Согласно настоящему изобретению предусмотрен способ выделения CV-вируса, охарактеризованного выше; способ включает в себя идентификацию рыбы, страдающей симптомами, связанными с CV-вирусом, совместное культивирование пораженных тканей с клетками плавников карпов до проявления цитопатического эффекта, получение среды от совместного культивирования CFC с пораженными тканями и выделение вирусных частиц.
В конкретном примере осуществления изобретения вирус был выделен из инфицированных образцов с использованием следующей процедуры. Сокультивирование клеток, полученных из почек (11 образцов) и печени (5 образцов) инфицированной рыбы, с CFC привело к появлению цитопатических эффектов (ЦПЭ) через 5-6 дней после инокуляции, тогда как сокультивирование с клетками крови или сывороткой, взятой от больного карпа, не привело к ЦПЭ. Через десять дней сокультивирования клетки культуры теряли сцепление с дном колбы и погибали. Среду, полученную от CFC, сокультивированных с клетками почек или печени (5-7 дней после заражения), вначале очищали от клеток и продуктов клеточного распада посредством центрифугирования, а затем использовали для титрования вируса в колбах со свежими CFC.
Среду, полученную от инфицированных культур CFC, осветляли посредством центрифугирования и очищали в градиентах сахарозы. Из градиентов выделяли прозрачный слой при 37-39% сахарозы, разводили в 10 раз фосфатным буферным раствором (PBS) и выделяли осадок посредством центрифугирования. Осадки суспендировали в 500 мкл PBS и брали пробы для титрования на CFC и для электронно-микроскопического анализа. Титр препарата очищенного вируса в среде был равен 106-107 БОЕ/мл. Фиг.2 демонстрирует две вирусные частицы из этого препарата, абсолютно не содержащего продуктов клеточного распада. Частицы были негативно окрашены, и была выявлена их симметричная икосаэдрическая морфология с ядром, средний диаметр которого был равен 103 нм, и которое напоминало ядро герпесвируса (Riozman et al., Exp. Med. Biol., Vol.278, 285-291, 1990).
Таблица 1А демонстрирует, что у здоровой рыбы, инокулированной осветленной культуральной средой от неинфицированных CFC, не возникало симптомов. Однако 75% и 82% рыб, инокулированных экстрактами инфицированных клеток или осветленной средой, полученной из инфицированных культур, погибали в течение 15 дней после интраперитонеальной инъекции. У этих рыб развивались типичные патологические симптомы, идентичные симптомам, наблюдавшимся у инфицированных рыб, выращенных в прудах.
Клетки почек, взятые из инокулированных образцов, обнаруживавших симптомы болезни, сокультивировали с CFC. Титр вируса, выделенного из сокультивированных культур, был равен 1,5×102-1,8×102 БОЕ/мл в случае CFC, по результатам анализа с бляшкообразованием, как показано в Таблице 1В. Среду, полученную от этих инфицированных CFC, использовали для повторного инфицирования здоровых молодых рыб. Четыре из десяти рыб погибли от болезни через 9-14 дней после заражения (Таблица 1С).
Этот эксперимент типа «пинг-понг», который был серийно повторен три раза, однозначно подтверждает тот факт, что вирус, выделенный из инфицированной рыбы и размноженный в CFC, действительно является этиологическим агентом болезни.
На Фиг.3А представлено сравнение геномов вирусной ДНК, полученной из очищенных вирусов посредством экстракции фенолом, после выполнения следующих различных протоколов: инкубации с протеиназой К и SDS (Фиг.3А, линия 2), инкубации только с SDS (линия 3), обработки проназой и SDS (линия 4) и без предварительной обработки (линия 5). Препараты ДНК были проанализированы с использованием электрофореза в агарозном геле (0,8%). Геномная ДНК CV-вируса мигрирует в агарозном геле как ДНК, содержащая 25-35 тысяч пар оснований, согласно маркерной ДНК фага λ. Линейная плазмидная ДНК аденовируса (pAdEasy-1), расщепленная Cla I (линия 6) и использованная в качестве маркера, мигрировала примерно на такое же расстояние.
Для определения массы геномной ДНК CV-вируса те же препараты ДНК, которые показаны на Фиг.3А, анализировали посредством гель-электрофореза в пульсирующем поле (PFGE), как показано на Фиг.3В. Все четыре препарата ДНК CV-вируса очень медленно мигрировали в геле до маркерной ДНК фага λ, содержавшей 250-300 тысяч пар оснований. Циркулярная, а не линейная, плазмидная ДНК pAdEasy-1 также медленно мигрировала в геле, как маркерная ДНК фага λ, содержавшая 150-200 тысяч пар оснований.
Дополнительное подтверждение того, что CV-вирус является крупным ДНК-содержащим вирусом, в котором содержится примерно 275 тысяч пар оснований, было получено с помощью расщепления ДНК CV-вируса рестрикционным ферментом и показано на Фиг.3С. Линия 1 на Фиг.3С показывает, что размер нерасщепленной ДНК CV-вируса равен примерно 275 парам оснований. Расщепление с помощью Swa I дает две линии, соответствующие 20 и 255 тысячам пар (линия 2).
Анализ вирусного белка CV-вируса с помощью окрашивания Кумасси синим показал, что CV-вирус несомненно отличается от аденовируса и HSV-1 вируса. Кроме того, как показано на Фиг.4, окрашивание антителами кролика к вируса карпа показало, что сыворотка реагирует только с CV-белками и не реагирует с белками герпес- и аденовирусов.
Таким образом, в следующем аспекте изобретения предусмотрено изолированное антитело, которое избирательно связывается с CV-вирусом согласно настоящему изобретению или с его компонентом. В одном из способов осуществления изобретения антитело находится в иммобилизированной форме.
Фрагменты вирусной ДНК, полученные с помощью BamHI-EcoRI, были клонированы в плазмиды Bluescript (Alting-Mees et al., Nucl. Acids Res., Vol.17, 9494, 1989), и клоны вирусной ДНК были секвенированы и проанализированы с помощью программы BLAST (Altchul et al., Nucl. Acids Res., Vol.25, 3389-3402, 1997 и Short et al., Nucl. Acids Res., Vol.16, 7583-7600, 1988). С использованием внутренних праймеров, полученных из последовательностей клонов A-D, было доказано, что эти клоны представляют собой вирусную ДНК. Фиг.5 иллюстрирует, например, что праймеры, полученные из клона D, эффективны при амплификации соответствующих фрагментов вирусной ДНК, ДНК культивированных инфицированных клеток и ДНК больных рыб, но не ДНК из неинфицированных CFC и здоровых рыб. Сходные результаты были получены также для клонов А-С (результаты не показаны). Анализ более чем 3.500 пар оснований, выделенных из генома CV-вируса, не выявил фрагментов, длина которых превышает 45 пар оснований, которые были бы гомологичны вирусным геномам, описанным в GeneBank (Фиг.6). Хотя клоны CV-вируса содержат лишь небольшие фрагменты, гомологичные другим вирусам, многие из этих отрезков получены от членов семейств Herpesviridae и Baculoviridae.
В одном из аспектов настоящее изобретение относится к способу диагностики болезни, связанной с CV-вирусом; указанный способ включает в себя выделение ткани из подозрительной рыбы и определение присутствия вирусных маркеров, связанных с CV DNA вирусом, присутствие которых указывает на то, что исследованная рыба инфицирована вирусом согласно настоящему изобретению.
Термин «ткань» относится к любой ткани, полученной из специфического органа, к тканям, полученным из нескольких органов, к целой рыбе или к крови. Кроме того, этот термин охватывает любой орган или его часть, использованные для диагностики болезни. Предпочтительно тканями являются ткани, полученные из жабр, почек, селезенки, печени или брюшины.
Согласно диагностическому способу болезнь может быть диагностирована, без ограничения этими методами, с помощью ПЦР, как описано выше, с помощью иммуногистохимии, как описано ниже, и/или посредством анализа антивирусной сыворотки рыб с помощью ELISA (твердофазного иммуноферментного анализа), как описано ниже.
Такие способы, как использование АР (щелочной фосфатазы), HRP (пероксидазы хрена) и FITC (конъюгированного флюоресцеина изотиоцианата), также используются в различных диагностических протоколах (см. Примеры в экспериментальном разделе).
Согласно другому аспекту настоящее изобретение предусматривает живую ослабленную форму CV DNA вируса. Термины «живая ослабленная форма» или «ослабление» относятся к таким формам вируса, которые потеряли свою вирулентность, или к процессу, в котором вирусы теряют свою способность вызывать болезнь. Существуют различные подходы для получения живых ослабленных вирусов. Ослабление может быть достигнуто за счет ограничения инфекции такой областью тела, в которой болезнь не развивается (Virology, 2nd ed., Raven Press, NY, 1990), или посредством серийных пассажей вируса в культурах клеток, полученных из неестественного хозяина, причем в ходе этих пассажей мутации вируса сохраняются.
Существует несколько преимуществ использования ослабленных живых вирусных вакцин, таких как вакцины согласно настоящему изобретению. В целом, живые вирусные вакцины активируют все фазы иммунной системы, вызывая сбалансированный ответ - системный и местный, через иммуноглобулины и опосредованный клетками. Живые вирусные вакцины стимулируют также иммунный ответ на все защитные антигены вируса, что позволяет преодолеть трудности, возникающие из-за избирательной деструкции одного из защитных антигенов, которая может происходить во время приготовления инактивированной вакцины. Кроме того, иммунитет, созданный живыми вирусными вакцинами, обычно является более длительным, более эффективным и более перекрестно-реактивным, чем иммунитет, созданный инактивированной вакциной, кроме того, эта вакцина дешевле, и ее легче вводить (Virology, 2nd ed., Raven Press, NY, 1990).
В следующем аспекте настоящее изобретение предусматривает способ выделения живого ослабленного вируса, включающий в себя посев вирулентного вируса на культуру клеток рыбы, предпочтительно полученных из каудальных и дорзальных плавников карпов-кои или обыкновенных карпов, идентификацию бляшек, образованных вирусом со сниженной вирулентностью, и выделение вторичных вирусных частиц из этих бляшек.
Изолированный вирус можно вновь посеять на культуру клеток рыб, полученных от обыкновенного карпа или различных других видов рыб, таких как, но не ограничиваясь этими видами, толстолобик (Hypophthalmichthys molitrix), золотая рыбка (Carassius aurata) или белый амур (Ctenopharyngodon idella). Предпочтительно другим видом рыб является золотая рыбка (Carassius aurata), a процесс повторяют несколько раз до тех пор, пока не будет получен значительно ослабленный живой вирус.
Способ может также включать в себя стадию очистки изолированного вируса.
В одном из конкретных примеров осуществления изобретения вирусы из 4-го пассажа (Р4) были признаны вирулентными, тогда как вирусы из 20-го пассажа (Р20 и более) обнаружили сниженную вирулентность и были признаны ослабленными. Начиная с 25-го пассажа (Р25), вирусы полностью потеряли свою способность вызывать болезнь. Клоны невирулентного вируса были выделены, и был оценен их непатогенный характер и способность к вакцинации.
Среда и экстракты клеток, полученных из Р4-вируса в клеточной культуре, были использованы для вызова болезни посредством внутрибрюшинной инъекции и погружения в среду молодых здоровых карпов.
В предпочтительном примере осуществления изобретения способ выделения живого ослабленного вируса может дополнительно включать стадию сушки, предпочтительно - посредством лиофилизации среды, содержащей живой ослабленный вирус, с получением сухого препарата живого ослабленного вируса.
Согласно другому примеру осуществления изобретения способ может дополнительно включать в себя стадию добавления к среде и/или к сухому порошку консервантов, и/или восстановителей, и/или сахаров.
Для стабилизации ослабленного вируса и для предотвращения возвращения к фенотипу дикого типа в вирусный геном можно ввести случайные мутации, например - посредством химической или физической обработки. Для химической обработки может быть использован ряд различных мутагенов, таких как 5-бромдезоксиуридин или 5-азацитидин, а для физической обработки может быть использовано ультрафиолетовое излучение (260 нм, 5-30 сек, с расстояния 10 см от образца). Клетки, инфицированные вирусом, можно обработать мутагенами с целью определения кривой «доза-ответ» для каждого агента. Для того чтобы максимизировать вероятность выделения мутантов, следует использовать полулетальные дозы, а бляшки удалять. Мутированные вирусы размножают в CFC или KFC, испытывают в качестве вакцин посредством инъекции рыбе весом 10 г и нагружают Р4-вирусом, как описано выше. Той же самой процедуре с необходимыми изменениями можно следовать в случае физической обработки.
Что касается способов выделения вируса карпов и выделения живого ослабленного вируса, то настоящее изобретение далее охватывает вирус карпов, полученный в любом из указанных процессов.
Настоящее изобретение далее охватывает применение живого ослабленного вируса для приготовления вакцинной композиции для иммунизации рыб против инфекции, вызываемой CV-вирусом, описанным выше. Композиция включает в себя в качестве активного ингредиента живой ослабленный вирус, полученный так, как описано выше.
Термин «вакцина» в контексте настоящего изобретения относится к веществу, способному вызывать иммунный ответ против инфекции, вызванной вирусом согласно настоящему изобретению. Такая вакцина может создавать иммунитет с профилактической или терапевтической целью. Вакцины могут содержать живой или инактивированный («мертвый») вирус или их комбинации.
Термины «иммунизация» или «иммунный ответ» в контексте настоящего изобретения относятся к иммунитету, который может давать гуморальные и/или опосредованные клетками иммунные ответы на вирусную инфекцию или неблагоприятно влиять на активность, распространение или размножение вируса. Рыбы, иммунизированные вакциной согласно настоящему изобретению, могут обнаруживать ограниченное размножение и распространение инфекционного вируса или полное отсутствие этого размножения и распространения.
В одном из примеров осуществления настоящего изобретения композиция также содержит иммуномодулирующий адъювант, стабилизатор, антибиотики, иммуностимуляторы или другие вещества.
Адъюванты обладают эффектом депо и действуют медленно, стимулируя иммунитет в течение длительного периода времени. У рыб слабые антигены могут быть эффективными и обеспечивать длительную защиту только в том случае, если вакцины содержат адъюванты. Эти адъюванты выбирают из адъювантов, уже используемых в медицине человека и в ветеринарной медицине. Адъювантами могут быть гидрофильные адъюванты, например - гидроксид алюминия или фосфат алюминия, или гидрофобные адъюванты, например - адъюванты на основе минеральных масел.
Стабилизаторы, такие как лактозы, могут быть добавлены для стабилизации вакцинной композиции против действия различных условий, таких как колебания температуры и процесс лиофилизации. Антибиотики, такие как неомицин и стрептомицин, могут быть добавлены для предотвращения потенциального роста микроорганизмов. Иммуностимуляторы могут усиливать защиту, обеспечиваемую вакцинами, и обеспечивать неспецифическую защиту от ряда болезней. Сообщалось, что многие химические и прочие вещества обладают иммуностимулирующими свойствами для рыб, например - химические вещества и глюканы, экстракты из водорослей - альгины (силиловые эфиры альгиновой кислоты) - и цитокины.
Живой ослабленный вирус при использовании в вакцине в сухой форме может также содержать жидкость для восстановления содержания влаги, предпочтительно - стерильную воду, солевой раствор или физиологический раствор. Он может также содержать небольшие количества остаточных материалов из производственного процесса, например - клеточные или бактериальные белки, яичные белки, ДНК, РНК и т.п. Хотя эти материалы сами по себе не являются добавками, тем не менее, они могут присутствовать в вакцинной композиции.
В следующем аспекте настоящее изобретение предусматривает вакцинную композицию для иммунизации рыб против CV-вируса; вакцинная композиция содержит живой ослабленный вирус, охарактеризованный выше. В предпочтительном примере осуществления изобретения вакцинная композиция дополнительно содержит иммуномодулирующий адъювант, стабилизатор, антибиотики, иммуностимуляторы или другие вещества, как описано выше.
В конкретном примере осуществления изобретения композиция содержит живой ослабленный вирус в сухой форме. В другом примере осуществления композиция содержит жидкость из культуры тканей или солевой раствор, содержащий живой ослабленный вирус; указанную жидкость предпочтительно хранят при -70°С, наиболее предпочтительно эта жидкость содержит глицерин.
В следующем примере осуществления изобретения композиция содержит измельченнную инфицированную рыбу или измельченные органы рыб, предпочтительно - в сухой форме. Измельченная инфицированная рыба или измельченные органы рыб могут быть приготовлены в процессе, включающем заражение рыбы ослабленным вирусом и измельчение инфицированной рыбы или любого ее органа через 5-6 дней после заражения.
В одном из примеров осуществления изобретения указанный выше процесс также включает в себя сушку измельченной рыбы или органов рыбы, предпочтительно - посредством лиофилизации. В другом примере осуществления изобретения процесс включает в себя добавление к измельченной рыбе, или к измельченным органам рыбы, и/или к сухому порошку консервантов, и/или восстановителей, и/или сахаров.
В предпочтительном примере осуществления композицию вакцины приготавливают посредством растворения или суспендирования сухого живого ослабленного вируса, по меньшей мере, в одной жидкости для восстановления содержания влаги без добавления адъювантов или иммуностимуляторов.
Изобретение далее относится к способу иммунизации рыб против вирусной инфекции, вызываемой CV-вирусом, описанным выше. Этот способ включает в себя введение восприимчивой рыбе вакцинной композиции, содержащей живой ослабленный CV-вирус, описанный выше. Вакцина вводится в количестве, достаточном для того, чтобы создать иммунитет к последующему заражению CV-вирусом.
Живой ослабленный вирус можно вводить рыбам, выращенным в аквакультуре, индивидуально - перорально, то есть с кормом или путем принудительного перорального введения, или посредством инъекции. Альтернативно, живой ослабленный вирус можно вводить одновременно всей популяции рыб, содержащейся в определенном объеме воды, посредством распыления, растворения и/или погружения вируса в указанный объем воды. Эти способы пригодны для вакцинации любых рыб, то есть предназначенных в пищу и декоративных, и в различных средах, например, но не ограничиваясь этим, в прудах, в аквариумах, в естественной среде обитания и в резервуарах с пресной водой.
В другом аспекте вакцину вводят однодневным личинкам, малькам рыб примерно во время первого приема пищи или взрослым рыбам.
Изобретение далее предусматривает вакцинный препарат для пассивной иммунизации рыб против инфекции, вызываемой CV-вирусом; этот вакцинный препарат содержит сыворотку иммунизированного животного, причем сыворотку получают от животных, например - от рыб, лошадей, свиней, коров, мышей, кроликов и т.д., иммунизированных живой ослабленной формой CV-вируса. В предпочтительном случае животными являются рыбы.
Пассивную иммунизацию можно использовать для профилактики до и после экспозиции вирусом. В прудах и в аквакультуре, однако, она наиболее полезна, если рыбы уже подверглись экспозиции вирусу. Вакцину можно вводить рыбам с использованием одного или нескольких способов, описанных выше, предпочтительно - перорально, более предпочтительно - путем инъекции.
Изобретение в связи с этим аспектом также предусматривает способ лечения рыб от инфекционной болезни, вызываемой CV-вирусом. Способ включает в себя стадии иммунизации животного ослабленным CV-вирусом согласно настоящему изобретению, получения сыворотки от иммунизированного животного и обработки рыб указанной сывороткой с обеспечением пассивной иммунизации рыб.
Настоящее изобретение далее предусматривает генетическую конструкцию, содержащую последовательность нуклеотидов, полученную, по меньшей мере, из одной части CV-вируса. Генетическая конструкция может охватывать весь природный геном вируса карпов, эквивалентные кДНК и/или рекомбинантные конструкции, содержащие последовательности нуклеотидов, полученные, по меньшей мере, из одной части генома CV-вируса.
В специфическом примере осуществления изобретения предусмотрена вакцинная композиция для вызова иммунного ответа у рыб, предпочтительно - у карпов-кои или обыкновенных карпов, содержащая вектор экспрессии, который включает в себя последовательности нуклеотидов, которые могут индуцировать экспрессию вирусных белков, более конкретно - белков оболочки CV-вируса согласно настоящему изобретению. Вектор экспрессии можно вводить отдельно или в комбинации, по меньшей мере, с одной другой последовательностью нуклеотидов в том же или в другом векторе экспрессии для одновременной иммунизации против, по меньшей мере, одной дополнительной болезни. Экспрессия белков в клетках-мишенях рыб будет вызывать иммунный ответ. Если вектор экспрессии кодирует белки или полипептиды, связанные с различными болезнями, результирующий иммунный ответ может обеспечить иммунитет и к CV-вирусу согласно настоящему изобретению, и к другой болезни.
В другом аспекте настоящего изобретения предусмотрен вектор, включающий в себя последовательность нуклеотидов, которая может индуцировать экспрессию вирусных белков, более конкретно - белков оболочки CV-вируса согласно настоящему изобретению.
Одним из применений указанного выше вектора является индуцирование иммунного ответа у рыбы, происходящей из аквакультуры, включающее введение рыбе вакцинной композиции для вызова иммунного ответа. Указанная композиция содержит вектор экспрессии, содержащий последовательность нуклеотидов, кодирующую один или несколько белков вируса карпов, и контрольную последовательность для экспрессии последовательности нуклеотидов в клетках карпа.
Изобретение далее относится к набору для лечения вируса карпов у рыб, содержащему живой ослабленный вирус, и инструкции по его применению. Живой ослабленный вирус может находиться в сухой форме или в восстановленном состоянии в растворе, в форме жидкости, полученной от культуры клеток и хранящейся при температуре окружающей среды, предпочтительно - при -70°С, или в виде раствора, содержащего глицерин. Набор также может включать в себя живой ослабленный вирус в форме измельченной рыбы или измельченных органов рыб, предпочтительно - в сухой форме. В том случае, когда вирус находится в сухой форме, набор может также содержать жидкость для восстановления содержания влаги. В предпочтительном примере осуществления живой ослабленный вирус является сухим. В другом примере осуществления изобретения живой ослабленный вирус хранят при температуре -70°С.
Набор можно хранить в условиях окружающей среды, предпочтительно - под вакуумом.
Изобретение далее предусматривает антитело, которое избирательно или специфически связывается с CV DNA вирусом согласно настоящему изобретению или с его фрагментом. Термин «антитело» относится к антителам IgG, IgM, IgD, IgA и IgG. Определение включает в себя поликлональные антитела и моноклональные антитела. Этот термин относится также к целым антителам или к фрагментам антител, содержащим антигенсвязывающий домен антител к CLH, например - к антителам без Fc-фрагмента, одноцепочечным антителам, фрагментам, состоящим, по существу, из одного вариабельного антигенсвязывающего домена антитела и т.д. Термин «избирательно» в контексте настоящего изобретения относится к антителам, определенным выше, которые с бóльшим сродством связываются с CV DNA вирусом, чем с другими ДНК-содержащими вирусами, и это можно признать достоверным согласно статистическим тестам.
Изобретение далее относится к диагностическому набору для диагностики болезни, связанной с CV-вирусом, содержащему, по меньшей мере, одно антитело или, по меньшей мере, одно конъюгированное антитело и инструкции по его применению. Набор может дополнительно содержать, по меньшей мере, один контрольный антиген или контрольный образец ткани, содержащей указанный контрольный антиген. По меньшей мере, одно антитело или, по меньшей мере, одно конъюгированное антитело могут находиться в растворе или в сухой форме. В том случае, если, по меньшей мере, одно антитело или, по меньшей мере, одно конъюгированное антитело находятся в сухой форме, набор может дополнительно содержать соответствующие растворы для проведения реакций. В одном из примеров осуществления настоящего изобретения, по меньшей мере, одним конъюгатом является фермент; в этом случае набор может дополнительно содержать, по меньшей мере, один субстрат, необходимый для реакции обнаружения.
Диагностический набор согласно настоящему изобретению может быть использован для диагностики живой или мертвой рыбы на присутствие в ней вируса согласно настоящему изобретению. В соответствии с одним из примеров осуществления изобретения диагностический набор может быть использован для оценки уровня иммунизации рыб после обработки вакциной согласно настоящему изобретению или любой другой вакциной, известной специалисту в данной области техники. В этом случае от живой рыбы может быть получена кровь, а диагностический набор может быть использован для оценки степени иммунизации, то есть того, больна ли исследованная рыба, и для оценки степени ее заражения. В том случае, если будет выяснено, что рыба не заражена, ее можно вернуть в аквакультуру.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Общая информация
Рыбы: Карпов-кои или обыкновенных карпов массой 42 грамма выращивали в резервуарах объемом 500 л при температуре воды, поддерживавшейся на уровне 22-24°С, с притоком свежей воды со скоростью 0,9 л/мин.
Электронная микроскопия: Препараты очищенного вируса контрастировали 2%-ным раствором фосфорновольфрамовой кислоты. Структуры исследовали с помощью электронного микроскопа Philips 120 при напряжении 80 кВ.
Пример 1
Приготовление культур клеток
Каудальные плавники карпов-кои или обыкновенных карпов массой 50 г удаляли у анестезированных рыб, погружали их в 1%-ный раствор гипохлорида натрия на 1 минуту, затем промывали в 70%-ном этаноле в течение нескольких секунд. После этого плавники промывали три раза по 0,5 минут в растворе фосфатного буфера (PBS), содержащем пенициллин и стрептомицин. Плавники переносили в чашки Петри, мелко рубили ножницами и полусухие мелкие кусочки ткани, размером примерно 1 мм3, помещали в сухие колбы для культивирования тканей объемом 50 мл. После инкубации в течение 60 минут при комнатной температуре комки, прилипшие к колбам, покрывали культуральной средой, содержавшей 60% первичной среды, модифицированной по Далбеко (DMEM), 20% среды L-15 по Лейбовичу (производства Biological Industries, Kibbutz Belt Haemek, Израиль), 10% фетальной сыворотки телят (FCS) (Biological Industries, Kibbutz Beit Haemek, Израиль), 10% фосфата триптозы, с добавлением 1% HEPES и антибиотиков. Во время инкубации в течение 10-14 дней при 22°С клетки разрастались от ткани с образованием монослоя вокруг каждого комка. Монослойные культуры обрабатывали трипсином и переносили в новые колбы со свежей средой. Комки плавниковой ткани можно переносить в новые колбы для получения новой монослойной культуры первичных клеток.
Пример 2
Выделение вируса из культуральной среды
Среду, полученную от инфицированных CFC клеток, очищали от клеток и продуктов клеточного распада посредством центрифугирования в течение 10 минут при 10000 g. Затем вирус осаждали посредством центрифугирования в роторной центрифуге Beckman Ti-60 в течение 50 минут при 100000 g. Осадки суспендировали в PBS, помещали в 15-65% (масса/объем) градиент сахарозы, приготовленный на PBS, и центрифугировали в течение 60 минут при 100000 g в роторной центрифуге Beckman SW28. Слои отсасывали из пробирок, разводили в десять раз PBS и повторно осаждали. Осадки суспендировали в PBS и замораживали при -75°С для дальнейшего исследования.
Пример 3
Очистка вирусной ДНК и плазмидной конструкции
Очищенные осадки, содержавшие вирус, суспендировали в TNE-буфере (10 мМ Трис рН 7,8, 100 нМ NaCl и 1 нМ ЭДТА), содержавшем 0,5% додецилсульфата натрия (SDS). Препарат вируса обрабатывали протеиназой К (50 мкг/мл) в течение 3 часов. Вирусную ДНК экстрагировали фенолом, осаждали этанолом и осадки ДНК суспендировали в TNE.
Вирусную ДНК расщепляли с помощью BamHI и EcoRI и фрагменты клонировали в плазмиду Bluescript II KS (Alting et al., Nucl. Acids Res., Vol.17, 9494, 1989). Вставленные фрагменты вирусной ДНК секвенировали с помощью ПЦР с использованием праймеров Т7 и Т3, и их последовательности анализировали с помощью стандартной программы BLAST (Altschul et al., Nucl. Acids Res., Vol.25, 3389-3402, 1997 и Short et al., Nucl. Acids Res., Vol.16, 7583-7600, 1988).
Пример 4
Диагностика болезни посредством ПЦР-анализа
Препараты клеточной ДНК экстрагировали из клеток фенолом и осаждали этанолом, как описано выше в Примере 3. Осадки ДНК суспендировали в ТЕ-буфере (Трис-ЭДТА) при рН 7,4, как описано в книге Sambrook and Russel, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 2001, pp.6.7-6.10). Праймеры АР1, AP2 и АРЗ, а именно:
5'-CCCATGAGGCTGAGGAACGCCG-3′, 5′-GCACCCCCGTGATGGTCTTGC-3′ и 5′-GGAAGATGAGGGCCAGTATGTG-3′ соответственно, полученные из клона D вирусной ДНК (см. Фиг.6), были использованы для амплификации фрагментов вирусной ДНК посредством ПЦР. ДНК амплифицировали посредством 30 циклов при 94°С в течение 45 с, 55°С в течение 30 с и 72°С в течение 45 с. Продукты ПЦР разделяли на 1%-ном агарозном геле (масса/объем) и 0,5×ТАЕ и анализировали.
Пример 5
Диагностика болезни посредством непрямой иммунофлуоресцентной микроскопии
Для выработки антител против вируса карпов (CV) кролика иммунизировали 0,1 мг очищенного CV-вируса, эмульгированного в соотношении 1:1 в полном адъюванте Фрейнда. Иммунитет кролика поддерживали три раза с 10-дневными интервалами 0,05 мг очищенного CV-вируса, смешанного в соотношении 1:1 с неполным адъювантом Фрейнда, и брали у него кровь три раза в течение 7-10 недель после первой иммунизации. Сыворотку, содержавшую антитела, отделяли от сгустка крови и абсорбировали на сухой порошок, приготовленный из тканей нормальных рыб, для исключения неспецифических и невирусных клеточных антител.
Почки, селезенку, печень и мозг удаляли у нормальных и больных рыб и использовали для приготовления срезов. Срезы фиксировали в 3%-ном формальдегиде, промывали PBS и блокировали посредством инкубации в течение 60 минут в обезжиренном молоке, содержавшем 50% FCS (фетальной сыворотки телят). Затем слайды инкубировали в течение 1 часа с антителами кролика к CV-вирусу, промывали PBS, инкубировали в течение 1 часа с антителами свиньи к антигенам кролика, конъюгированными с флюоресцеина изотиоцианатом, промывали PBS и анализировали с помощью микроскопа Nikon Microphot-FX, оборудованного планапохроматным объективом с увеличением х 40 в ультрафиолетовом свете.
Использование антисыворотки кролика к CV-вирусу позволило определить локализацию вируса в зараженной рыбе. Срезы почек, полученные от инфицированной рыбы, но не от здоровой рыбы, позитивно маркировались антисывороткой кролика к CV-вирусу, показывая, что вирус распространен в почках. Эти результаты согласуются с ПЦР-экспериментами и другими экспериментами, показавшими, что почки накапливают большое количество инфекционного вируса. Как показали эти эксперименты, количество вируса в мозге и в печени больной рыбы было значительным, но меньшим, чем в почках. Контрольные срезы эквивалентных органов, полученных от здоровых или больных рыб, обработанные сывороткой неиммунизированного кролика, не обнаружили окрашивания антисывороткой поросят к антигенам кролика, конъюгированной с флуоресцентной меткой. Вирусный антиген не обнаруживался в срезах селезенки и в мазках крови, полученных от больных рыб.
Пример 6
Диагностика болезни посредством исследования антивирусных сывороток рыб
На планшеты для ELISA наносили очищенный препарат вируса и блокировали молоком и/или желатином. После трех промывок PBS ячейки покрывали исследуемыми сыворотками рыб и инкубировали при комнатной температуре в течение 1 часа. Планшеты снова промывали, обрабатывали IgB кролика к антигенам рыбы в течение 1 часа и снова промывали. Титр антивирусных сывороток рыб определяли с использованием сывороток козы к антигенам кролика, конъюгированных с щелочной фосфатазой, инкубации с субстратом ELISA и считывания показаний с помощью устройства для считывания ELISA.
Пример 7
Определение возраста рыбы, оптимального для иммунизации
Группу из 200 однодневных личинок инфицировали Р4 посредством погружения на 50 минут в резервуар емкостью 5 л, в который было добавлено 10 мл раствора Р4. В течение 20 дней после заражения личинок содержали при температуре воды, равной 23°С, что обеспечивало возможность развития болезни. Личинки, которые были заражены, обнаруживали меньшую выживаемость по сравнению с незараженными. Личинок, которые выжили после заражения, выращивали до 45-дневного возраста. На этой стадии мальков повторно инфицировали раствором Р4 в ходе процедуры, идентичной процедуре, описанной выше для личинок.
Кроме мальков, инфицированных так, как это описано, в это же время экспозиции вирусу в первый раз подвергали вторую группу 45-дневных рыб из того же рыбоводческого хозяйства. Мальки, которые выжили после заражения в возрасте одного дня, обнаруживали значительную устойчивость к болезни в возрасте 45 дней, по сравнению с рыбами такого же возраста, которые были впервые подвергнуты экспозиции вирусу.
Эти эксперименты показали, что рыбы в возрасте 45 дней (массой 7 г) и старше очень хорошо иммунизируются. Рыбы с меньшей массой, а именно - 2,5-3 г, также иммунизировались, но у них наблюдалась более высокая смертность, равная примерно 20%.
Пример 8
Заражение рыб вирулентным вирусом
Несколько групп, в каждой из которых было по 50 рыб массой 10 г, инфицировали патогенным вирусом Р4 посредством инъекции каждой рыбе 0,2 мл вируса (внутрибрюшинно). Контрольные группы состояли из рыб, которым был инъецирован физиологический раствор (PBS). Как показывает Фиг.7А, 80% рыб погибли в течение 10-25 дней после инъекции.
Рыб, которые пережили инфекцию, то есть 20 рыб из зараженной группы и 50 рыб из контрольной группы, повторно инфицировали через 35 дней. Повторное заражение обеспечивалось совместным обитанием с больной рыбой. Как показывает Фиг.7В, рыбы, которые выжили после первоначальной инфекции, были иммунными к вирусу, при этом всего 30% рыб погибло от болезни. Однако у рыб, подвергнутых действию вируса в первый раз, наблюдалась высокая смертность, равная примерно 100%.
Пример 9а
Заражение рыб живым ослабленным вирусом
Двум группам рыб, каждая из которых состояла из 25 рыб массой 10 г, инъецировали (внутрибрюшинно) по 0,3 мл ослабленного вируса Р25 в концентрации 6×103 БОЕ/мл. 25 рыбам, использованным в качестве отрицательной контрольной группы, инъецировали солевой раствор, а 25 рыбам, использованным в качестве положительной контрольной группы, инъецировали вирулентный Р4 вирус в концентрации 0,3×103 БОЕ/мл. После инъекции рыб содержали в условиях, обеспечивающих развитие болезни, в течение 30 дней.
Как можно видеть из Фиг.8А, почти у всех рыб, которым был инъецирован ослабленный вирус, болезнь не развилась, в отличие от тех рыб, которым была инъецирована вирулентная форма.
Рыбам, которым был инъецирован ослабленный вирус и которые выжили, была обеспечена вирусная нагрузка посредством повторной экспозиции вируса через 30 дней после первоначальной экспозиции посредством совместного обитания с больной рыбой. Как показывает Фиг.8В, у рыб был обнаружен высокий уровень резистентности к болезни. Только примерно у 5% рыб, первоначально зараженных ослабленным вирусом посредством инъекции, развилась инфекция.
Этот эксперимент демонстрирует способность ослабленного живого вируса иммунизировать рыб против вируса карпов. Этот тип эксперимента был повторен 3 раза со сходными результатами.
Пример 9b
Эффективность ослабленного вируса
Клетки плавников карпов-кои (KFC) заражали разбавленным CV-вирусом из пассажа Р26 и затем заливали агаром. Вирусы из четырех отдельных бляшек были выделены, оттитрованы и внутрибрюшинно инъецированы здоровым рыбам. Контрольной группе рыб инъецировали PBS. Смертность рыб контролировали в течение 25 дней, в течение которых погибло очень мало рыб. На 25 день рыб повторно заразили посредством совместного обитания с больной рыбой для оценки их устойчивости к болезни. Как можно заключить из Фиг.9, 95% неинфицированной контрольной группы погибло вскоре после совместного обитания. Ни у одной из рыб, которым были инъецированы клонированные вирусы, не обнаружилось симптомов болезни, и у них не наблюдалось смертности. Эти результаты ясно показывают, что клоны, полученные из пассажа Р26, создают иммунитет к инфекции, вызываемой CV-вирусом.
Пример 10
Получение сухого живого ослабленного вируса
Вирус, выделенный так, как подробно описано в Примере 1, пассажировали, по меньшей мере, 30 раз в серии клеточных линий карпа, а затем переносили в ограниченные условия в больших разведениях. Обнаружилось, что полученные бляшки морфологически отличались от бляшек, образованных вирулентным вирусом. Вирусы из 4-го пассажа, Р4, были признаны вирулентными. Начиная с 20-го пассажа (Р20), способность вируса вызывать болезнь ослаблялась. Вирусы, начиная с 25 пассажа (Р25), и их клоны и субклоны полностью теряли способность вызывать болезнь.
Культуральную среду из инфицированных пассажем Р25 клеточных культур собирали и разделяли на две различные пробирки. Одну из двух пробирок хранили при -70°С. Вторую пробирку замораживали и лиофилизировали, в результате чего был получен желтый порошок, который инкубировали при комнатной температуре в течение двух часов. Не добавляли консервантов, таких как восстановители, или сахаров. Сухой вирус можно хранить в условиях окружающей среды, предпочтительно - во флаконах под вакуумом.
Для определения вирулентности лиофилизированного вируса восстанавливали содержание влаги в пробе сухого вируса и титровали его на свежих CFC. Параллельно оттаивали замороженный образец из первой пробирки и использовали для заражения свежих культур в качестве контроля. Подсчитали число бляшек и определили, что титр сухого вируса был в 5-10 раз ниже по сравнению с контролем.
Восстановление содержания влаги в сухом вирусе проводили с использованием очищенной, стерильной воды.
Пример 11
Кинетика образования антител к CV-вирусу после иммунизации ослабленным вирусом
Группе из пяти рыб инъецировали ослабленный вирус в день 0. Затем у рыб в определенные дни после заражения брали кровь и оценивали уровень антител к CV-вирусу в сыворотке с помощью следующей процедуры. Ячейки планшетов для ELISA покрывали CV-вирусом и блокировали молоком перед добавлением сыворотки рыб. Для точности сыворотку рыб разводили в следующих соотношениях: 1:100, 1:500, 1:2.500 и 1:12.500. После интенсивных промывок всех ячеек их покрывали Fc кролика к антителам рыбы, как описано ранее, и инкубировали в течение 60 минут при комнатной температуре. Далее проводилась дополнительная обработка конъюгированными со щелочной фосфатазой IgG козы к антигенам кролика.
Как ясно показывает Фиг.10, сыворотка рыб содержит высокие уровни антител к CV-вирусу. Антитела появляются в промежутке между 7 и 14 днями после заражения. Их титр повышается, достигает высокого уровня на 21-ый день и остается на этом уровне в течение, по меньшей мере, 51 дней после заражения. Это исследование четко показывает, что ослабленный вирус индуцирует образование CV-антител в высокой концентрации.
Пример 12
Приготовление вакцины для пассивной иммунизации
Группе из 15 рыб три раза вводили ослабленный вирус согласно настоящему изобретению в концентрации 200-2000 БОЕ/мл с интервалами в 15 дней. Через 15-20 дней после последней инокуляции у рыб брали кровь, выделяли анти-CNGV сыворотку с использованием одного из способов, известных специалисту в данной области техники, и хранили ее при -70°С. Альтернативно, образцы сыворотки лиофилизировали и хранили до употребления.
Группа из 50 рыб была экспонирована CV-вирусу в течение 2-4-дневного периода посредством совместного обитания с больной рыбой. Затем каждой из 50 рыб инъецировали анти-СNGV-сыворотку и контролировали развитие болезни.
Было обнаружено, что у рыб, которым была инъецирована анти-CNGV-сыворотка, болезнь не развилась, тогда как у неиммунизированных рыб развилась болезнь, и они погибли в течение 18 дней после совместного обитания с больными рыбами.
Пример 13
Приготовление инактивированного вируса
Вирулентный вирус помещали под УФ-лампу на расстоянии 10 см от нее и облучали светом с длиной волны 260 нм в течение примерно 2 минут. В конце 2-минутного периода облучение прекращали и затем вводили вирус рыбам, как описано в предыдущих примерах.
После прекращения облучения вирус исследовали на способность к образованию бляшек, как описано выше. Пробы, которые не давали бляшек, 20 считали инактивированными и использовали для иммунизации рыб.
Многократно повторенные эксперименты показали, что облучение проб вирулентного вируса в течение периодов времени, равных всего нескольким секундам, приводило к образованию инактивированного вируса, который подвергался случайным мутациям.
Пример 14
Иммунизация рыб посредством комбинированной обработки инактивированным вирусом и последующей обработки живым ослабленным вирусом
Группе из 32 здоровых рыб инъецировали инактивированный вирус. Через 5 дней рыбам инъецировали живой ослабленный вирус в соответствии с процедурой, подробно описанной выше. Рыб экспонировали вирусу посредством совместного обитания с больной рыбой в течение 10-дневного периода. Ни у одной из иммунизированных рыб не были обнаружены особенности поведения, характерные для инфекционного заболевания (результаты не показаны).
ССЫЛКИ
Ссылки, приведенные ниже, представлены здесь для лучшего понимания изобретения, и их не следует связывать с патентоспособностью изобретения.
- Body A., Lieffring F., Charlier G., Collard A., Bull. Europ. Assoc. Fish Path., 20, 87-88, 2000.
- Calle P.P., McNamara Т., Kress Y., J.Zoo and Wild Med., 30, 165-169, 1999.
- Dawes J., OFI Journal, 39, 2002.
- Gray W.L., Mullis L, LaPatra S.E., Groff J.M., Goodwin A., J.Fish Dis., 25, 171-178, 2002.
- Hedrick R.P., Groff J.M., Okihiro M.S., McDowell T.S., J.Wild. Dis., 26, 578-581, 1990.
- Hedrick R.P., Gilad O., Yun S., Spangenberg J., Marty G., Nordhausen R., Kebus M., Bercovier H., Eldar A., J.Aqua Animal Health 12, 44-55, 2000.
- Kim C.H., Dummer D.M., Chiou P.P., Leong J.A., J.Virol., 73, 843-849, 1999.
- Miyazaki Т., Okamoto H., Kageyama Т., Kobayashi Т., Dis. Of Aqua Organ., 39, 183-192, 2000.
- Oh M.J., Jung S.J., Choi T.J., Kim H.R., Rajendran K., Kim Y.J., Park M.A., Chun S.K., Fish Path., 36, 147-151, 2001.
- Sano Т., Fukuda H., Furukawa M., Fish and Shel. Path., 32, 307-311, 1985.
- Sano Т., Morita N.. Shima N. Akimoto M., J. Fish. Dis., 14, 533-543, 1991.
- Shchelkunov I., Shchelkunov Т., J. Fish. Dis., 13, 475-484, 1990.
- Walster С., Fish Vet., 3, 54-58, 1999.


Изобретение относится к области вирусологии. Описан живой ослабленный штамм ДНК-содержащего вируса карпов (CV DNA вируса) и способ его получения. Штамм обладает способностью индуцировать иммунный ответ против ДНК-содержащего вируса карпов у рыб без проявления вирулентности. Также раскрывается вакцинная композиция, содержащая такой вирус, способ иммунизации и набор для его проведения. Изобретение может быть использовано в области промышленного рыбоводства. 6 н. и 9 з.п. ф-лы, 10 ил., 3 табл.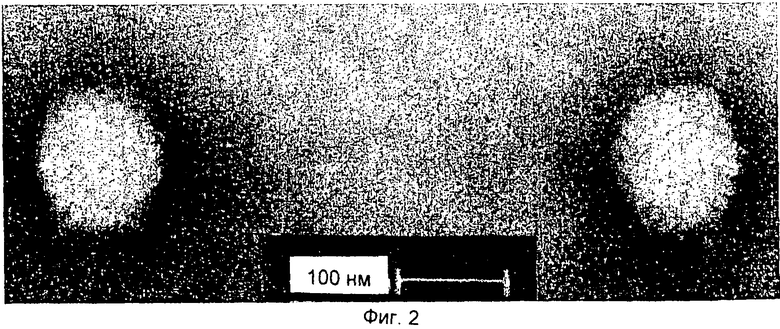
1. Способ выделения живого ослабленного вируса карпов, представляющего собой авирулентную форму ДНК-содержащего вируса карпов, который вызывает смертельное вирусное заболевание у рыб, включающий посев вирулентного изолированного ДНК-содержащего вируса карпов в культуру клеток рыб, идентификацию бляшек, образованных вирусом со сниженной вирулентностью, и выделение вторичных вирусных частиц из этих бляшек, причем указанный ДНК-содержащий вирус является крупным двухцепочечным ДНК-содержащим вирусом, имеющим капсид с икосаэдрической морфологией, капсид имеет размер, примерно равный 90-110 нм по данным электронной микроскопии, а ДНК вируса содержит примерно 250000-300000 пар оснований.
2. Способ по п.1, отличающийся тем, что ДНК вируса содержит примерно от 260000 до 285000 пар оснований, предпочтительно примерно 277000 пар оснований.
3. Способ по п.1, отличающийся тем, что рыбы относятся к виду Cyprinus carpio.
4. Способ по п.1, отличающийся тем, что выделенные вирусы снова высевают на культуру клеток рыб и процесс повторяют несколько раз до получения существенно ослабленного живого вируса.
5. Способ по п.4, отличающийся тем, что культура клеток является культурой линии клеток карпов-кои или обыкновенного карпа.
6. Способ по п.1, отличающийся тем, что он дополнительно включает стадию очистки изолированного живого ослабленного вируса.
7. Способ по п.1, отличающийся тем, что он включает стадию сушки среды, содержащей живой ослабленный вирус, с получением сухого живого ослабленного вируса.
8. Живой ослабленный штамм ДНК-содержащего вируса карпов (CV DNA вируса), который вызывает смертельное заболевание у рыб, обладающий способностью индуцировать иммунный ответ против ДНК-содержащего вируса карпов у рыб без проявления вирулентности, связанной с указанным ДНК-содержащим вирусом карпов, представляющий собой штамм, депонированный в Национальной Коллекции Культур Микроорганизмов (CNCM), Института Пастера, Париж 12 декабря 2003 года под регистрационным номером CNCM 1-3146.
9. Вакцинная композиция для иммунизации рыб против инфекции, вызываемой ДНК-содержащим вирусом карпов, который вызывает вирусное заболевание у рыб и является двухцепочечным ДНК-содержащим вирусом, имеющим капсид с икосаэдрической морфологией, причем капсид имеет размер, примерно равный 90-110 нм по данным электронной микроскопии, а ДНК вируса содержит примерно 250000-300000 пар оснований, отличающаяся тем, что она содержит в качестве активного ингредиента эффективное количество живого ослабленного вируса, полученного из указанного вируса способом согласно любому из пп.1-7, или живого ослабленного штамма вируса по п.8.
10. Способ иммунизации рыб против вирусной инфекции, вызывающей вирусную болезнь у рыб, характеризующийся тем, что инфекция вызывается ДНК-содержащим вирусом, имеющим двухцепочечную ДНК, имеющим капсид икосаэдрической морфологии, причем капсид имеет размер, примерно равный 90-110 нм по данным электронной микроскопии, а ДНК вируса содержит примерно 250000 - 300000 пар оснований, при этом способ включает в себя введение восприимчивой рыбе вакцинной композиции, содержащей живой ослабленный вирус, полученный из указанного вируса способом согласно любому из пп.1-7, или живой ослабленный штамм вируса по п.8 в количестве, достаточном для того, чтобы вызывать иммунитет к последующему инфицированию вирусом карпов.
11. Способ по п.10, отличающийся тем, что вакцину вводят в аквакультуру.
12. Способ по п.10, отличающийся тем, что стадия введения включает в себя инъекцию отдельной рыбе, или распыление, или погружение композиции в аквакультуру.
13. Способ по п.10, отличающийся тем, что вакцину вводят рыбе перорально через корм.
14. Набор для обработки против вируса карпов у рыб, отличающийся тем, что он содержит живой ослабленный вирус, полученный способом согласно любому из пп.1-7, или живой ослабленный штамм вируса по п.8 и инструкции по его применению.
15. Вакцинная композиция для иммунизации рыб против инфекции, вызываемой ДНК-содержащим вирусом карпов, который вызывает вирусную болезнь у рыб и является двухцепочечным ДНК-содержащим вирусом, имеющим капсид икосаэдрической морфологии, причем капсид имеет размер, примерно равный 90-110 нм по данным электронной микроскопии, а ДНК вируса содержит примерно 250000-300000 пар оснований, отличающаяся тем, что указанная вакцинная композиция содержит сыворотку животных, иммунизированных живым ослабленным вирусом, полученным из указанного вируса способом согласно любому из пп.1-7, или живым ослабленным штаммом вируса по п.8.
| GILAD О | |||
| et al., "Initial characteristics of koi herpesvims and development of a polymerase chain reaction assay to detect the vims in koi, Cyprinus carpio koi", Dis Aquat Organ | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| et al.: "Genome sequences of three koi herpesvirus isolates representing the | |||
Авторы
Даты
2009-10-10—Публикация
2003-12-22—Подача