Изобретение относится к медицине, биологии, фармакологии.
В настоящее время в арсенале экспериментальной и практической медицины имеются препараты, часто белковой природы, которые имеют доказанную высокую эффективность в отношении многих патологических состояний (далее - биологически активные вещества, БАВ). Механизм их действия реализуется как на рецепторном аппарате клетки, так и посредством прямого действия на патологические субстраты, такие как тромбы, белковый детрит, остатки клеточных мембран.
При высокой эффективности данные БАВ имеют ряд нежелательных свойств. Белковые препараты могут вызывать аллергическую реакцию. Некоторые БАВ быстро разрушаются в кровяном русле или при хранении. Однако перспектива их использования настолько привлекательна для врачей-клиницистов, что становится очевидной необходимость модификации молекул данных БАВ таким образом, чтобы обеспечить безопасность препарата, не утратив при этом его фармакологической эффективности.
Для решения этой задачи, как правило, используется иммобилизация БАВ на водорастворимом полимере-носителе (полиэтиленоксиде, полиакриламиде, декстране и т.п.). При этом увеличивается время жизни препарата в кровотоке, следовательно, увеличивается длительность его воздействия; снижается иммуногенность препарата; обеспечивается полноценная активность в лекарственной форме при длительном сроке хранения.
Существуют различные способы иммобилизации БАВ на полимере.
Известны способы иммобилизации БАВ на полимере химическим путем. Например, в патенте WO 0044785 описан конъюгат гранулоцит-колониестимулирующего фактора (Г-КСФ, gCSF) с полиэтиленоксидом молекулярной массы 5000-30000 Да, полученный способом синтеза пептидной связи с использованием активных эфиров. Подобным способом получены конъюгаты, описанные в патенте CN1966528, но в качестве носителя используются связанные между собой две молекулы полиэтиленоксида молекулярной массой 5000-30000 Да. Препарат используется для инъекционного введения.
Способ обеспечивает ковалентную связь БАВ с полимером, однако вследствие использования довольно агрессивных химических веществ, высокий процент БАВ разрушается в процессе иммобилизации. Данная методика включает серию последовательных химических реакций, что значительно усложняет синтез конечного соединения и требует дополнительных технологических операций по очистке препарата, так как используемые в технологическом процессе реактивы токсичны для организма. В итоге это приводит к значительному удорожанию фармакологической субстанции.
Известен способ ферментативной иммобилизации БАВ на полимере. Например, в патенте WO 2005055946 описан конъюгат gCSF с полиэтиленоксидом (полипропиленоксидом), связь между которыми осуществлена через сиаловую кислоту. Для синтеза таких конъюгатов используется трансфераза.
Данный способ также обеспечивает ковалентную связь БАВ с полимером, но тоже является многостадийным, что существенно усложняет синтез конечного соединения и требует дополнительных технологических операций по очистке препарата.
Кроме указанных выше химического и ферментативного способов, для получения конъюгатов БАВ с полимером используют электронно-лучевые технологии.
Известен способ иммобилизации амфотерицина В на водорастворимом полимере декстране, при котором потоком ускоренных электронов или γ-излучением в дозе 1-5 Мрад облучают декстран, достигая его активации (RU 2297246). Затем в активированный полимер вносят БАВ. Используют декстран с ММ 30-60 кДа и концентрацией 1-10%. Соотношение амфотерицина В и декстрана в реакционной смеси составляет 1 : 800. Выход терапевтической композиции составляет 99%.
При таком способе иммобилизации нестойкие биологически активные вещества не подвергаются деструкции, однако данным способом не удается добиться ковалентной сшивки БАВ с полимером, следовательно, ослабляются позитивные эффекты иммобилизации.
Известен способ иммобилизации протосубтилина на полиэтиленоксиде, при котором протосубтилин в растворе полиэтиленоксида с молекулярной массой 1500-4000 Да подвергают облучению тормозным γ-излучением в дозе 0,5-1 Мрад (RU 2270861, прототип). Полиэтиленоксид добавляют к раствору протосубтилина до концентрации по массе 5-10% в соотношении (3-8):1. Выход готового продукта составляет 95-98%. Препарат может быть применен парэнтерально.
Недостатком данного способа является то, что ряд БАВ (полипептиды, проинсулин, инсулин, соматотропный гормон, интерферон-альфа и др.), как показали наши исследования, при иммобилизации данным способом под действием ионизирующего излучения в дозе 0,5-1 Мрад разрушаются практически полностью. Меньшие дозы облучения не приводят к иммобилизации БАВ и получению конъюгата.
Раскрытие изобретения
Сущность первого варианта способа иммобилизации биологически активного вещества (БАВ) на фармакологически приемлемом полимерном носителе заключается в том, что БАВ растворяют в водном растворе полимерного носителя, имеющего концентрацию выше 10% до насыщенного раствора, затем реакционную смесь облучают ионизирующим излучением.
Для увеличения сохранности БАВ от разрушения ионизирующим излучением перед облучением реакционная смесь может быть заморожена при температуре (-20)-(-140°)С.
В качестве ионизирующего излучения используют поток ускоренных электронов или тормозное γ-излучение в дозе 0,5-5 Мрад.
Данным способом могут быть иммобилизированы на полимерный носитель, в частности, алкалаза, инсулин, тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат, гранулоцитарный колониестимулирующий фактор (Г-КСФ), гиалуронидаза, проинсулин, соматотропин и другие БАВ.
В качестве водорастворимого полимерного носителя могут быть использованы, в частности, полиэтиленоксиды, декстраны, поливинилпирролидон, акриламид, некоторые полимерные поверхностно-активные вещества (ПАВ, например плюроник (Pluronic) и др.) и др.
Далее в тексте приведены примеры осуществления данного способа и получения конъюгатов алкалазы с полиэтиленоксидом, инсулина с полиэтиленоксидом, тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата с поливинилпирролидоном, Г-КСФ с полиэтиленоксидом, гиалуронидазы с декстраном, инсулина с плюроником.
При иммобилизации предлагаемым способом БАВ ковалентно связывается с полимером.
Техническим результатом предлагаемого способа по варианту №1 является возможность иммобилизации на полимерном носителе тех водорастворимых БАВ, которые являются нестабильными, т.е. разрушаются при иммобилизации их другими способами, в частности, в условиях способа-прототипа при использовании ионизирующего излучения в дозе 0,5-1 Мрад и концентрации полимера 5-10%, а также увеличение доли сохраненного БАВ в тех случаях, когда при иммобилизации БАВ разрушается не полностью.
Технический результат обеспечивается в условиях предлагаемого способа концентрацией полимера выше 10% до насыщенного раствора.
Сущность второго варианта способа иммобилизации БАВ на фармакологически приемлемом полимерном носителе заключается в том, что БАВ растворяют в водном растворе полимерного носителя, затем смесь замораживают до температуры (-20)-(-140°)С, после чего облучают ионизирующим излучением.
Водорастворимый фармакологически приемлемый полимерный носитель используют в концентрации выше 0% до насыщенного раствора.
В качестве ионизирующего излучения используют поток ускоренных электронов или тормозное γ-излучение в дозе 0,5-5 Мрад.
Данным способом могут быть иммобилизированы на полимерный носитель, в частности, алкалаза, инсулин, тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат, гранулоцитарный колониестимулирующий фактор (Г-КСФ), гиалуронидаза, проинсулин, соматотропин и другие БАВ.
В качестве водорастворимого полимерного носителя могут быть использованы, в частности, полиэтиленоксиды, декстраны, поливинилпирролидон, акриламид, некоторые полимерные поверхностно-активные вещества (ПАВ, например плюроник Pluronic и др.) и др.
Далее в тексте приведены примеры осуществления данного способа и получения конъюгатов тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата с поливинилпирролидоном, инсулина с полиэтиленоксидом, соматотропина с декстраном, Г-КСФ с полиэтиленоксидом, гиалуронидазы с декстраном, инсулина с плюроником.
При иммобилизации данным способом БАВ ковалентно связывается с полимером.
Техническим результатом предлагаемого способа по варианту №2 является тот же, что указан выше для способа по варианту 1: возможность иммобилизации на полимерном носителе тех водорастворимых БАВ, которые являются нестабильными, т.е. разрушаются при иммобилизации их другими способами, в частности, в условиях способа-прототипа при использовании ионизирующего излучения в дозе 0,5-1 Мрад и концентрации полимера 5-10%, а также увеличение доли сохраненного БАВ в тех случаях, когда при иммобилизации БАВ разрушается не полностью.
Технический результат обеспечивается в условиях предлагаемого способа замораживанием реакционной смеси при температуре (-20)-(-140°)С перед ее облучением.
Как указывалось выше, оба варианта предлагаемого способа предназначены для иммобилизации водорастворимого БАВ. В тех случаях, когда конкретное БАВ слабо растворяется в нейтральной водной среде, рН раствора доводят до необходимого значения с помощью фармакологически приемлемого вещества, например уксусной кислоты.
Конъюгат БАВ - носитель, получаемый вышеописанными способами, характеризуется тем, что БАВ выбран из группы: проинсулин, тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат, алкалаза, гиалуронидаза, соматотропин, а носитель представляет собой фармакологически приемлемый водорастворимый полимер, выбранный из группы: полиэтиленоксид, поливинилпирролидон, декстран, плюроник, акриламид, причем молекула БАВ соединена ковалентно, по меньшей мере, с одной молекулой полимера,
в частности, следующие:
- конъюгат тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат - поливинилпирролидон (Plasdone К-17) (пример 4, фиг.7,8,9; пример 5, фиг.10,9; пример 12, фиг.21,8);
- конъюгат алкалаза - полиэтиленоксид-300 (полиэтиленоксид с молекулярной массой 300 Да) (пример 2, таблица);
- конъюгат гиалуронидаза - декстран 70 (декстран с молекулярной массой 70 кДа) (пример 8, фиг.13,14);
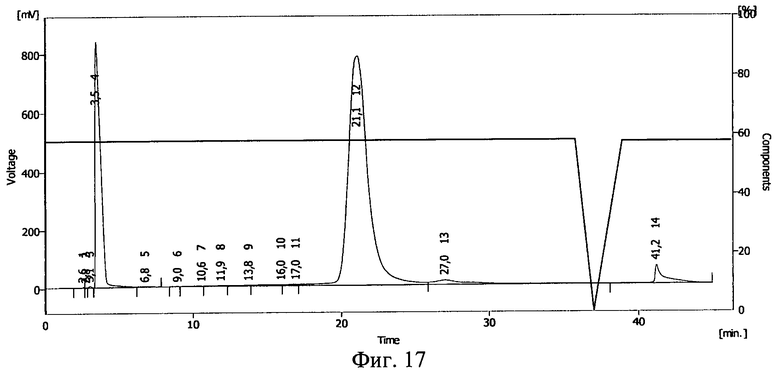
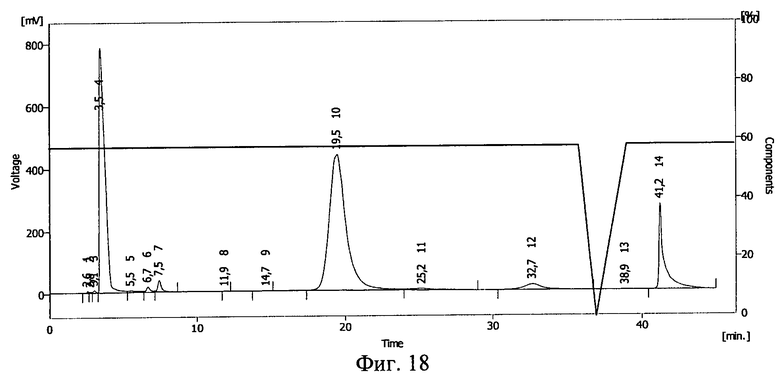
- конъюгат проинсулин - плюроник (Pluronic F-68) (пример 9, фиг.15,16; пример 10, фиг.17,18);
- конъюгат соматотропин - декстран с молекулярной массой 40-60 кДа (пример 14, фиг.22, 23).
Перечень чертежей иллюстративного материала
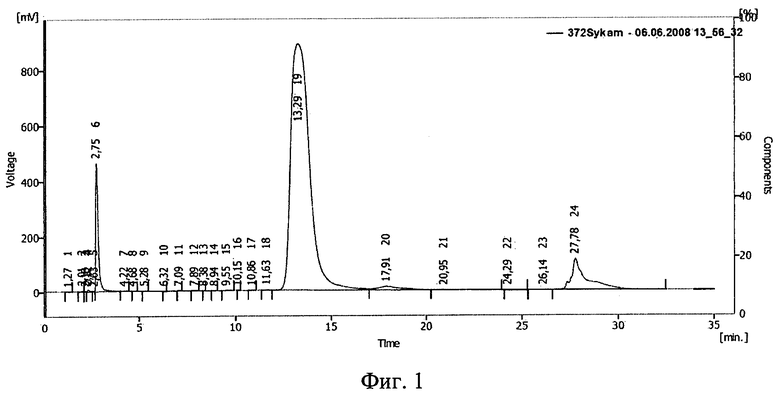
Фиг.1. ВЭЖХ раствора инсулина в 10%-ном полиэтиленоксиде-1500.
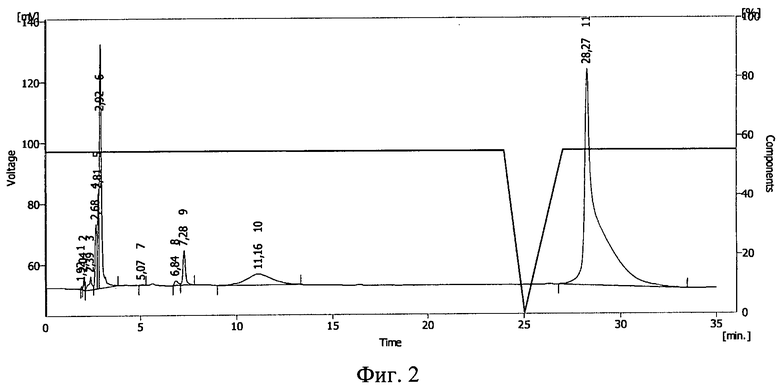
Фиг.2. ВЭЖХ раствора инсулина в 10%-ном полиэтиленоксиде-1500 после облучения его ионизирующим излучением в дозе 0,5 Мрад.
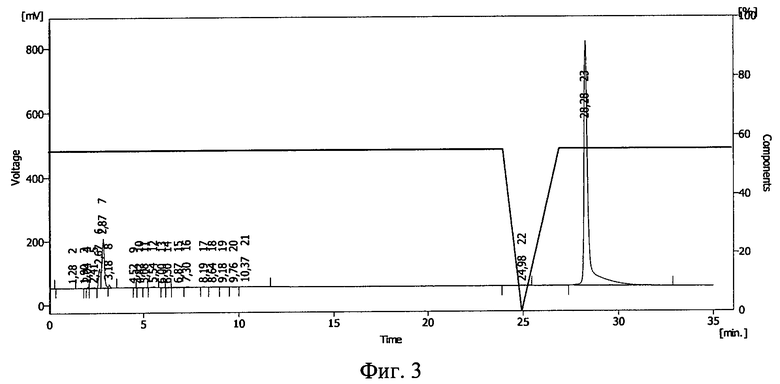
Фиг.3. ВЭЖХ раствора инсулина в 10%-ном полиэтиленоксиде-1500 после облучения его ионизирующим излучением в дозе 1,5 Мрад.
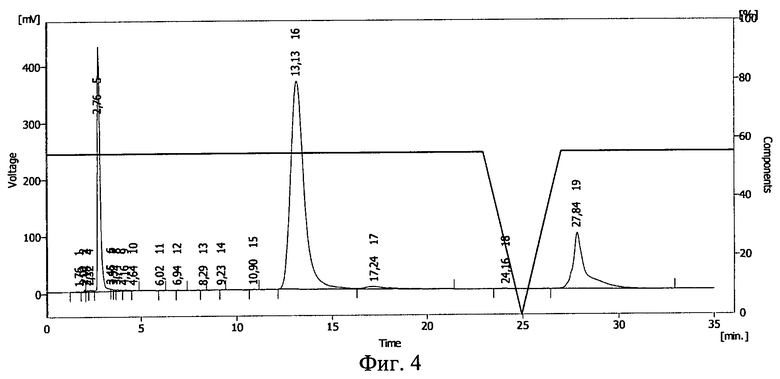
Фиг.4. ВЭЖХ раствора инсулина в 20%-ном растворе полиэтиленоксида-1500.
Фиг.5. ВЭЖХ раствора инсулина в 20%-ном полиэтиленоксиде-1500 после облучения его потоком ускоренных электронов в дозе 1,0 Мрад.
Фиг.6. ВЭЖХ раствора инсулина в 75%-ном полиэтиленоксиде-1500 после облучения потоком ускоренных электронов в дозе 1,0 Мрад.
Фиг.7. ВЭЖХ водного раствора тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата.
Фиг.8. ВЭЖХ раствора тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата в 11%-ном растворе Plasdone К-17 после облучения потоком ускоренных электронов в дозе 1,0 Мрад.
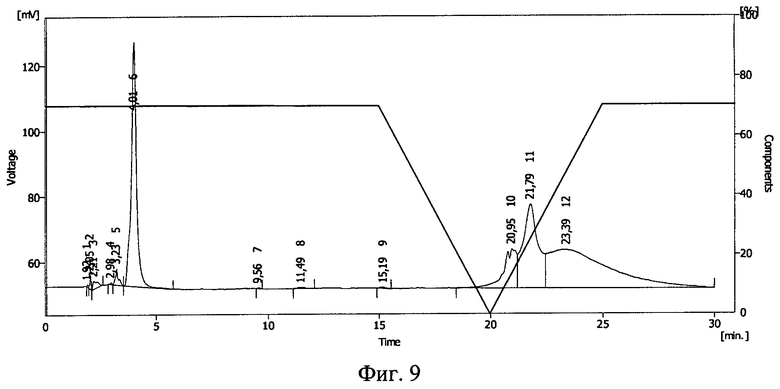
Фиг.9. ВЭЖХ раствора тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата в 50%-ном растворе Plasdone К-17 после облучения потоком ускоренных электронов в дозе 1,0 Мрад.
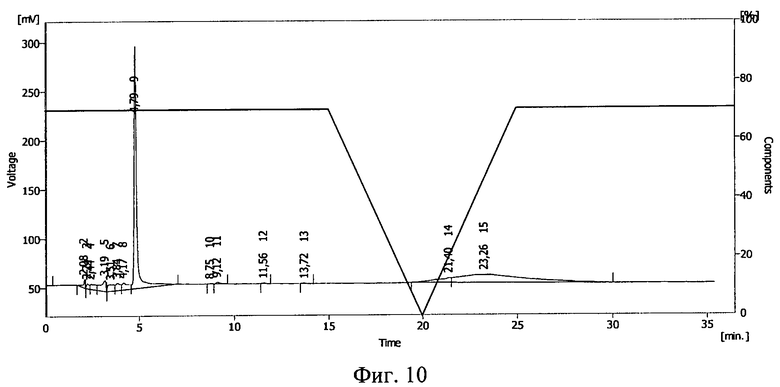
Фиг.10. ВЭЖХ раствора тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата в 50%-ном растворе Plasdone К-17 после замораживания до -20°С и облучения потоком ускоренных электронов в дозе 1,0 Мрад.
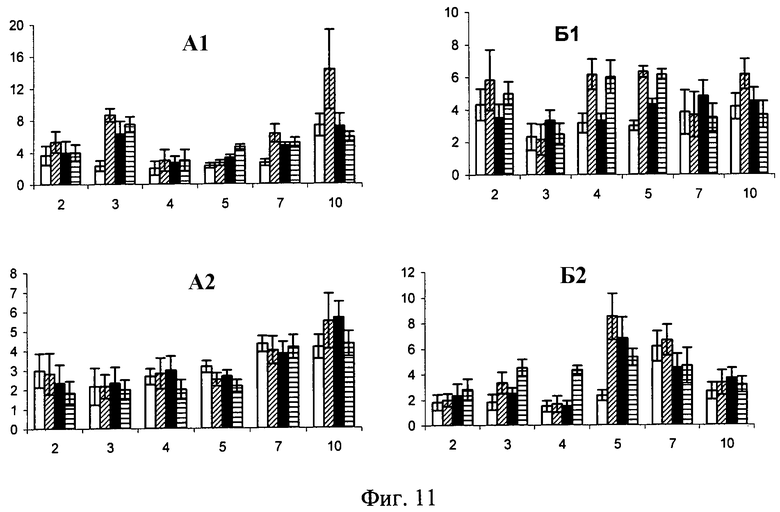
Фиг.11. Содержание КОЕ-ГМ (А) и КОЕ-Э (Б) в костном мозге (индекс-1) и в периферической крови (индекс-2) у мышей линии CBA/Calac при введении физиологического раствора (белые столбики), подкожного введения иммобилизированного Г-КСФ (столбики с косой штриховкой), энтерального введения иммобилизированного Г-КСФ (черные столбики) и при подкожном введении неконъюгированного Г-КСФ (столбики с горизонтальной штриховкой). По оси абсцисс - сроки исследования (сутки), по оси ординат - значения показателя: А - на 105 миелокариоцитов; Б - на 105 мононуклеаров. Доверительные интервалы при р<0,05.
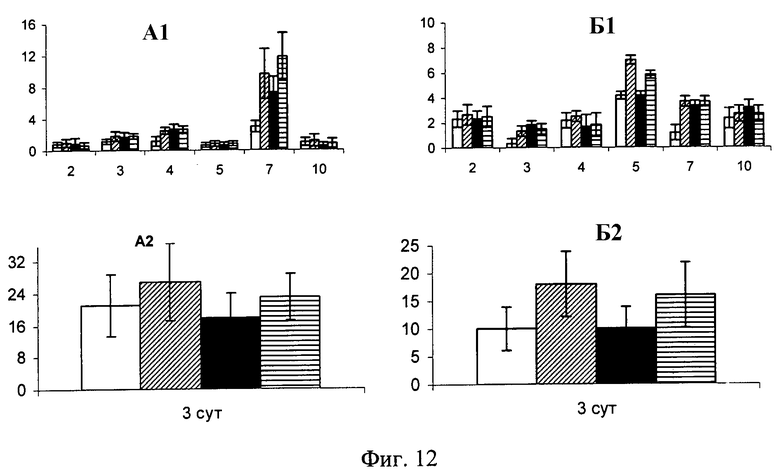
Фиг.12. Содержание КОЕ-Ф (А) и МСК (Б) в костном мозге (индекс-1) и в периферической крови (индекс-2) у мышей линии CBA/Calac при введении физиологического раствора (белые столбики), подкожного введения иммобилизированного Г-КСФ (столбики с косой штриховкой), энтерального введения иммобилизированного Г-КСФ (черные столбики) и при подкожном введении неконъюгированного Г-КСФ (столбики с горизонтальной штриховкой). По оси абсцисс - сроки исследования (сутки), по оси ординат - значения показателя: А1 - на 2,5×105 миелокариоцитов; А2 - на 2,5×105 мононуклеаров; Б1 - на 106 миелокариоцитов; Б2 - на 106 мононуклеаров. Доверительные интервалы при р<0,05.
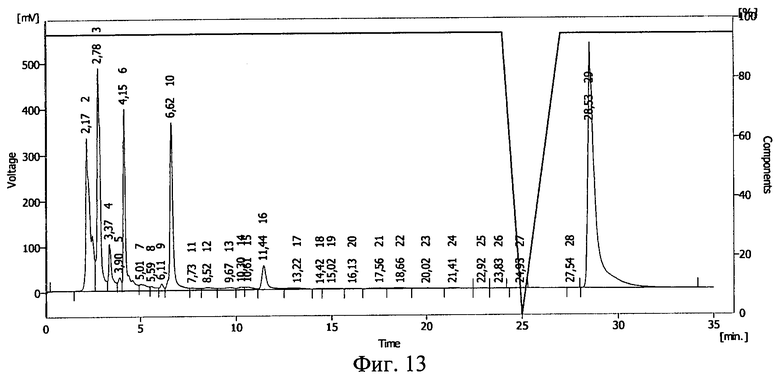
Фиг.13. Результаты ВЭЖХ раствора гиалуронидазы в 25%-ном растворе декстрана 70 (декстрана с молекулярной массой 70 кДа).
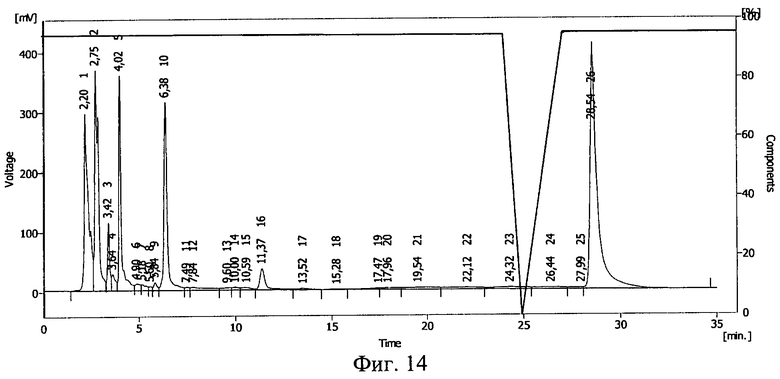
Фиг.14. Результаты ВЭЖХ раствора гиалуронидазы в 25%-ном растворе декстрана 70 после облучения его тормозным γ-излучением в дозе 0,5 Мрад.
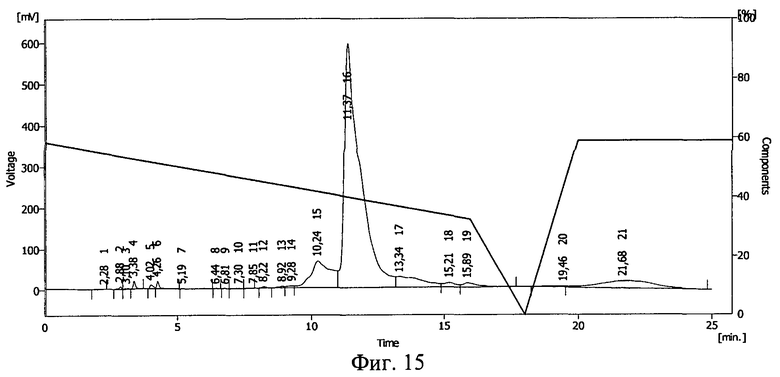
Фиг.15. Результаты ВЭЖХ раствора проинсулина в 20%-ном растворе Pluronic F-68.
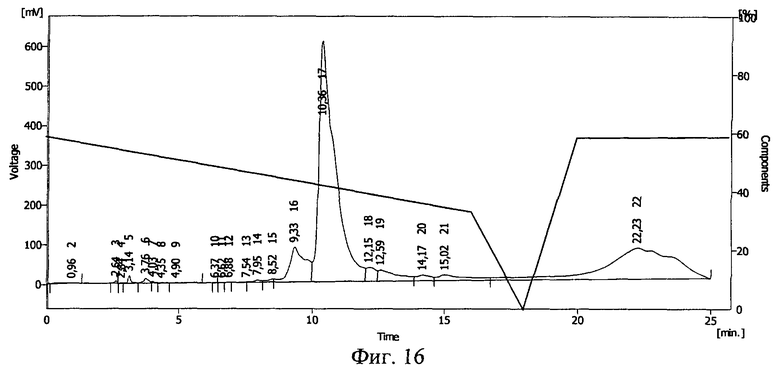
Фиг.16. Результаты ВЭЖХ раствора проинсулина в 20%-ном растворе Pluronic F-68 после замораживания до -70°С и облучения потоком ускоренных электронов 1,0 Мрад.
Фиг.17. Результаты ВЭЖХ раствора инсулина в 20%-ном растворе Pluronic F-68.
Фиг.18. Результаты ВЭЖХ раствора инсулина в 20%-ном растворе Pluronic F-68 после замораживания до -20°С и облучения потоком ускоренных электронов в дозе 1,5 Мрад.
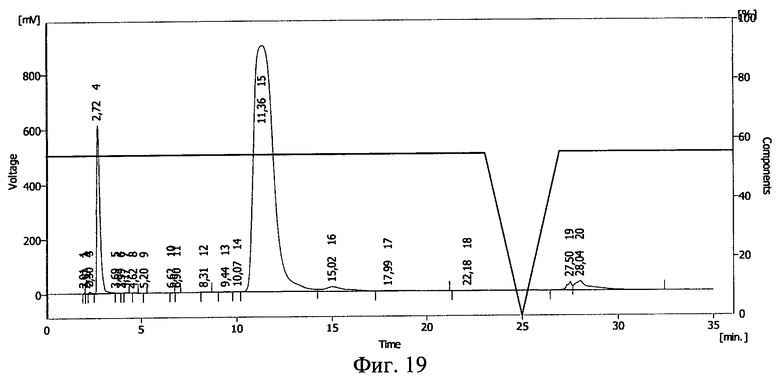
Фиг.19. Результаты ВЭЖХ раствора инсулина в 20%-ном растворе поли-этиленоксида-1500.
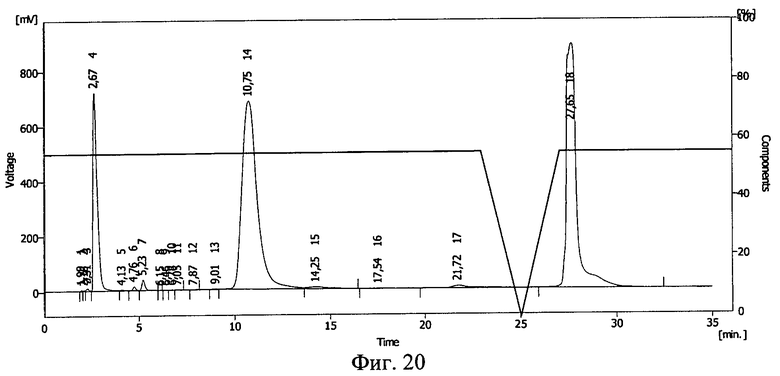
Фиг.20. Результаты ВЭЖХ раствора инсулина в 20%-ном растворе поли-этиленоксида-1500 после замораживания до -140°С и облучения потоком ускоренных электронов в дозе 5 Мрад.
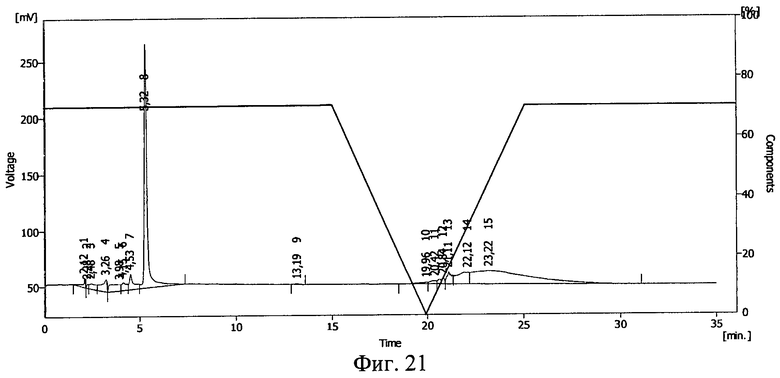
Фиг.21. ВЭЖХ раствора тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата в 10%-ном растворе Plasdone К-17 после замораживания до -70°С и облучения потоком ускоренных электронов в дозе 1,0 Мрад.
Фиг.22. Результаты ВЭЖХ раствора соматотропина в 10%-ном декстране.
Фиг.23. Результаты ВЭЖХ раствора соматотропина в 10%-ном декстране после замораживания до -20°С и облучения тормозным γ-излучением в дозе 0,5 Мрад.
Фиг.24. Результаты ВЭЖХ раствора инсулина в 10%-ном растворе полиэтиленоксида-1500.
Фиг.25. Результаты ВЭЖХ раствора инсулина в 10%-ном растворе полиэтиленоксида-1500 после замораживания до -20°С и облучения потоком ускоренных электронов в дозе 1 Мрад.
Фиг.26. Результаты ВЭЖХ раствора инсулина в 10%-ном растворе полиэтиленоксида-1500 после замораживания до -70°С и облучения потоком ускоренных электронов в дозе 1,5 Мрад.
Фиг.27. Результаты ВЭЖХ раствора инсулина в 10%-ном растворе полиэтиленоксида-1500 после замораживания до -140°С и облучения потоком ускоренных электронов в дозе 5 Мрад.
На чертежах с ВЭЖХ по оси абсцисс отложено время в минутах, по оси ординат - напряжение в милливольтах. Время по оси Х отложено в одном и том же масштабе, напряжение по оси Y отложено в разном масштабе. Числа на вершинах пиков означают: нижнее число - время в минутах, соответствующее вершине пика (выходу максимального количества вещества, соответствующего данному пику), верхнее число - номер пика.
Пример 1. При иммобилизации способом-прототипом нестабильное БАВ (инсулин) разрушается полностью или почти полностью.
В 5 мл 10%-ного раствора полиэтиленоксида-1500 растворялась навеска 10 мг человеческого рекомбинантного инсулина. Отбиралась проба для проведения высокоэффективной жидкостной хроматографии (ВЭЖХ).
Далее раствор переносился в два полиэтиленовых пакета, герметично запаивался и облучался ионизирующим излучением. Доза облучения для первого пакета была 0,5 Мрад, для второго 1,5 Мрад. Из облученных пакетов повторно отбирались пробы для проведения ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германии) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 55%, фаза В 45%, где фаза А: 90% 0,1М раствор Na2SO4 pH=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 214 нм.
Результаты ВЭЖХ представлены на фиг.1 (исходный раствор), фиг.2 (раствор после облучения дозой 0,5 Мрад) и фиг.3 (раствор после облучения дозой 1,5 Мрад). Пик 18 на фиг.1 (время 10,77 мин), пик 10 на фиг.2 (время 11,16 мин) соответствуют инсулину. На фиг.3 соответствующий инсулину пик отсутствует.
По соотношению площадей пиков, относящихся к инсулину, было подсчитано, что в растворе после облучения дозой 0,5 Мрад сохранилось 2,3% исходного количества инсулина (фиг.2). При дозе 1,5 Мрад инсулин разрушен полностью (фиг.3).
Таким образом, при иммобилизации его в условиях способа-прототипа нестабильное БАВ (инсулин) разрушается почти полностью.
Пример 2.
Готовили две пробы. В пробе №1 5 мл концентрированной алкалазы (производство «Novozymes A/S») растворяли в 45 мл 50%-ного раствора полиэтиленоксида-300 (полиэтиленоксид с молекулярной массой, равной 300 Да), в пробе №2 - 5 мл концентрированной алкалазы растворяли в 45 мл 20%-ного раствора полиэтиленоксида-300. Контролем служил раствор 5 мл концентрированной алкалазы в 45 мл воды. Измеряли исходную протеолитическую активность алкалазы в полученных растворах по гидролизу 1%-ного раствора казеината натрия.
Реакционные смеси запаивали в полиэтиленовые пакеты и облучали на ускорителе электронов ИЛУ-6 дозой облучения 1,5 Мрад для иммобилизации алкалазы на полиэтиленоксиде-300.
После облучения растворов повторно измеряли протеолитическую активность алкалазы в пробах. Результаты представлены в табл.1.
Результаты измерения протеолитической активности алкалазы (Ед/мл)
Из данных, представленных в табл.1, видно, что активность иммобилизированной алкалазы значительно снизилась в пробе с 20%-ным полиэтиленоксидом-300 в отличие от пробы с 50%-ным полиэтиленоксидом.
Таким образом, концентрация полимера оказывает существенное влияние на сохранение нестабильного БАВ: при более высокой концентрации полимера сохраняется большее количество алкалазы.
Пример 3.
Готовили две пробы. В пробе №1 навеска 10 мг человеческого рекомбинантного инсулина растворялась в 5 мл 20%-ного раствора полиэтиленоксида-1500, в пробе №2 навеска 10 мг человеческого рекомбинантного инсулина растворялась в 5 мл 75%-ного раствора полиэтиленоксида-1500.
Из пробы №1 отбиралась проба для проведения ВЭЖХ.
Растворы переносились в полиэтиленовые пакеты, герметично запаивались и облучались на ускорителе электронов ИЛУ-6 дозой облучения 1,0 Мрад.
Из обоих пакетов отбирались пробы для проведения повторной ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германии) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 55%, фаза В 45%, где фаза А: 90% 0,1М раствор Na2SO4 рН=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 pH=2,3+50% ацетонитрил, детекция на 214 нм.
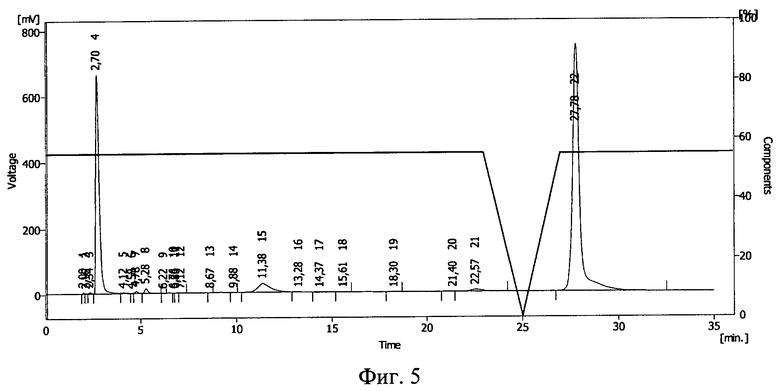
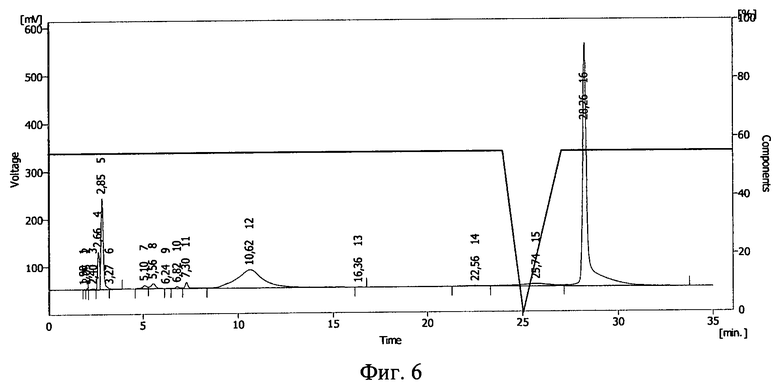
Результаты ВЭЖХ необлученного раствора инсулина в 20%-ном растворе полиэтиленоксида-1500 представлены на фиг.4. Инсулину соответствует пик 16.
Результаты ВЭЖХ облученных растворов представлены на фиг.5 (проба №1) и фиг.6 (проба №2). Инсулину соответствует пик 15 на фиг.5 и пик 12 на фиг.6.
В 20%-ном растворе полиэтиленоксида (проба №2) после облучения дозой 1,0 Мрад сохранилось 9% от исходного количества инсулина, в 75%-ном растворе полиэтиленоксида (проба №3) - около 25%. Таким образом, повышение концентрации полимера в растворе приводит к большей сохранности иммобилизированных белковых молекул при действии ионизирующего излучения. Смещение пика инсулина указывает на иммобилизацию БАВ на полимере и получение конъюгата инсулин - полиэтиленоксид-1500.
Пример 4.
Готовили три пробы. В пробе №1 2 мг тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата растворяли в 1 мл воды (контроль).
В пробе №2 2 мг тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата смешивали с 1 мл 11%-ного раствора пласдона К-17 (Plasdone К-17, поливинипирролидон с ММ 17000 Да), в пробе №3 2 мг тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата смешивали с 1 мл 50%-ного раствора Plasdone К-17.
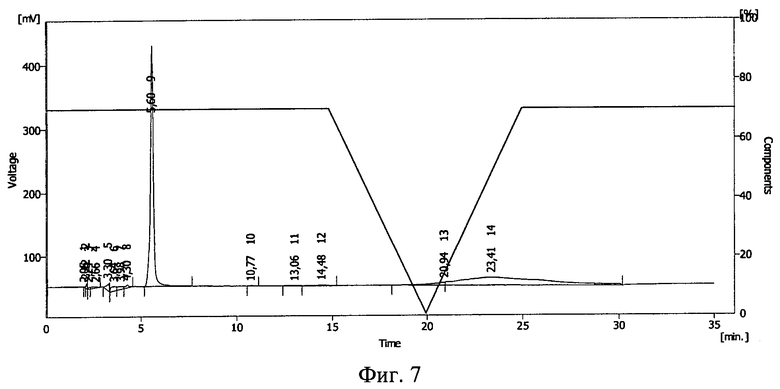
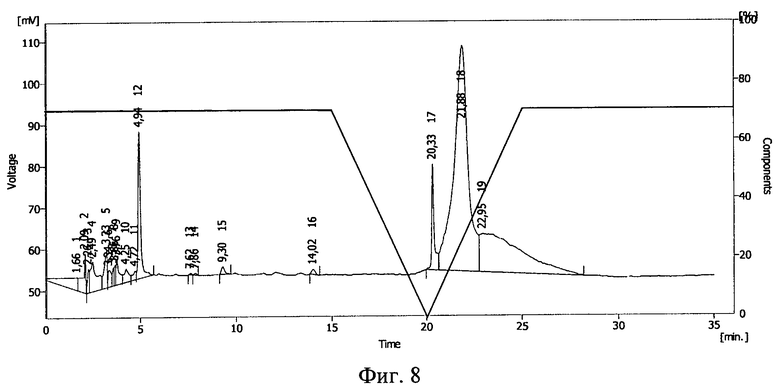
Растворы запаивались в герметичные полиэтиленовые пакеты, пробы облучали на ускорителе электронов ИЛУ-6 дозой облучения 1,0 Мрад. После этого проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 55%, фаза В 45%, где фаза А: 90% 0,1М раствор Na2SO4 pH=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 230 нм.
Результаты ВЭЖХ представлены на фиг.7 (контроль), фиг.8 (проба №2), фиг.9 (проба №3). Тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетату соответствует пик 9 на фиг.7, пик 12 на фиг.8 и пик 6 на фиг.9.
В пробе №2 сохранилось около 10% от исходного количества тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата, в пробе №3 - около 30%. Повышение концентрации полимера в растворе привело к большей сохранности БАВ. Смещение пика тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата указывает на иммобилизацию БАВ на полимере и получение конъюгата тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат - поливинилпирролидон (пласдон К-17).
Пример 5.
Готовили пробу: 2 мг тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата смешивали с 1 мл 50%-ного раствора пласдон К-17 (Plasdone К-17). Раствор запаивали в герметичный полиэтиленовый пакет.
Пробу в полиэтиленовом пакете помещали в морозильную камеру при температуре -70°С на 16 часов, после чего пробу облучали на ускорителе электронов ИЛУ-6 дозой облучения 1,0 Мрад. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 55%, фаза В 45%, где фаза А: 90% 0,1М раствор Na2SO4 рН=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 230 нм. Результаты ВЭЖХ представлены на фиг.10. Тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетату соответствует пик 9.
По соотношению площадей пиков, относящихся к тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетату, было подсчитано, что в сравнении с аналогичной пробой, которая подвергалась воздействию ионизирующего излучения в жидком виде (пример 4, фиг.9), количество сохранившегося иммобилизированного тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата в пробе, облученной в замороженном виде, больше почти в 2 раза. Смещение пика тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата указывает на иммобилизацию БАВ на полимере и образование конъюгата тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат - поливинилпирролидон (пласдон К-17).
Итак, замораживание растворов перед облучением увеличивает сохранность иммобилизированного на полимере БАВ.
Пример 6.
В 5 мл 20%-ного раствора полиэтиленоксида-1500 добавлялась навеска 50 мг человеческого рекомбинантного инсулина (ОАО «Национальные биотехнологии», г.Оболенск). Поскольку данная марка инсулина растворяется в кислой среде и не растворяется в нейтральной, какой является раствор полиэтиленоксида, то под контролем рН-метра в смесь добавлялась ледяная уксусная кислота до значения рН 2,5-2,8. В результате кислотного титрования инсулин растворяется в полиэтиленоксиде-1500, и смесь инсулина с полиэтиленоксидом в воде становится прозрачной. Если взять пробу полученного раствора и сдвигать его рН в сторону рН 7,0, инсулин выпадает в осадок.
Раствор переносился в полиэтиленовый пакет и герметично запаивался. Пакет помещался в морозильную камеру при -70°С на 12 часов. После этого пакет облучался на ускорителе электронов ИЛУ-6 дозой облучения 1,0 Мрад.
После облучения иммобилизированный инсулин не выпадал в осадок при ощелачивании раствора до рН=9. Таким образом, подтверждается возникновение ковалентных связей между БАВ и полимерным носителем и образование конъюгата инсулин - полиэтиленоксид-1500.
Пример 7.
Иммобилизация Г-КСФ на полиэтиленоксиде-1500 осуществлялась следующим образом. 2,5 мл субстанции Г-КСФ производства ОАО «Национальные биотехнологии» (0,4 мг/мл в ацетатном буфере) смешивалось с 2,5 мл 20%-ного полиэтиленоксида-1500. Смесь заливалась в полиэтиленовый пакет и замораживалась при -70°С в течение 16 часов. После этого пакет облучался на ускорителе электронов ИЛУ-6 дозой облучения 1,5 Мрад, в результате чего получали иммобилизированный Г-КСФ.
Эксперименты были выполнены на 250 мышах линии CBA/CaLac в возрасте 2 месяцев. Неиммобилизированный Г-КСФ вводили подкожно в дозе по 100 мкг/кг в течение 5 дней. Иммобилизированный Г-КСФ (конъюгат Г-КСФ - полиэтиленоксид-1500) вводили также в дозе активного вещества 100 мкг/кг подкожно в течение 5 дней, и per os в течение 10 дней. Контрольным мышам в аналогичных режимах в эквивалентном объеме (0,2 мл) вводили физиологический раствор.
На 2, 3, 4, 5, 7, 10-е сут. эксперимента в костном мозге и периферической крови животных опытных и экспериментальных групп методом клонирования в полувязкой культуральной среде определяли содержание грануломоноцитарных (ГМ), эритроидных (Э) и фибробластных (Ф) колониеобразующих единиц (КОЕ). С помощью метода лимитирующих разведений на 3-и сут. опыта в костном мозге и периферической крови изучали количество мезенхимальных стволовых клеток (МСК).
Введение препаратов выявило их значительное влияние на состояние пула родоначальных клеток. Г-КСФ, как активное вещество исследуемых средств, во всех случаях закономерно приводил к увеличению содержания грануломоноцитарных прекурсоров в гемопоэтической ткани. Так, при использовании неконъюгированного Г-КСФ и при внутрижелудочном применении иммобилизированного Г-КСФ отмечалось возрастание количества КОЕ-ГМ на 3, 5, 7-е сутки исследования (фиг.11, А1). Вместе с тем введение иммобилизированного Г-КСФ подкожно приводило к более длительному (3, 7, 10-е сут.) и максимально выраженному (до 372,1% на 3-и сут. опыта от аналогичного параметра у контрольных мышей) увеличению числа кроветворных клеток в костном мозге (фиг.11).
Введение иммобилизированного Г-КСФ подкожно приводит на 5-е сутки к достоверному превышению КОЕ-Э в периферической крови по сравнению с неконъюгированным Г-КСФ (фиг.11, Б2).
Результаты эксперимента доказывают, что сохраняется биологическая активность, увеличивается биодоступность (можно применять перорально) и увеличивается продолжительность действия Г-КСФ.
Схожие изменения имели место со стороны пула фибробластных коло-ниеобразующих единиц, содержащих в своем составе как коммитированные стромальные элементы, так и мультипотентные стволовые клетки. Введение неконъюгированного и иммобилизированного препаратов Г-КСФ (в обоих режимах) приводило к увеличению числа КОЕ-Ф в гемопоэтической ткани на 3, 4, 7-е и 4, 7-е сут. опыта соответственно. При этом прием иммобилизированного с помощью нанотехнологии препарата внутрь оказывал менее выраженный эффект (7-е сут.) по сравнению с парентеральным путем назначения стандартного Г-КСФ. Указанные изменения функциональной активности КОЕ-Ф костного мозга сопровождались усилением их выхода в периферическую кровь. Причем наиболее существенной данная реакция была в группе животных, получавших иммобилизированный Г-КСФ подкожно, а менее значимая у мышей при внутрижелудочном применении иммобилизированной формы цитокина (фиг.12).
Введение подкожно конъюгированного Г-КСФ приводило на 5-е сутки к достоверному повышению содержания МСК в костном мозге по сравнению с неконъюгированным Г-КСФ (фиг.12, Б2).
Из представленных чертежей видно, что иммобилизированный предложенным способом Г-КСФ обладает выраженным биологическим эффектом, превосходящим неиммобилизированный Г-КСФ.
Пример 8.
В 3 мл 25%-ного раствора декстрана 70 (декстран с молекулярной массой 70 кДа) растворяли навеску 100 мг гиалуронидазы. Отбиралась проба для проведения ВЭЖХ. Далее раствор переносился в полиэтиленовый пакет, герметично запаивался и замораживался при -20°С в течение 16 часов. После этого пакет облучался тормозным γ-излучением в дозе 0,5 Мрад. Из облученного пакета повторно отбиралась проба для проведения ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германии) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 95%, фаза В 5%, где фаза А: 90% 0,1М раствор Na2SO4 рН=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствора Na2SO4 рН=2,3+50% ацетонитрил, детекция на 214 нм.
Результаты ВЭЖХ представлены на фиг.13 и фиг.14. Гиалуронидазе соответствует пик 10 на фиг.13, 14.
После действия ионизирующего излучения сохранилось около 85% гиалуронидазы. Сдвиг пика на ВЭЖХ свидетельствует о ковалентной связи между БАВ и полимерным носителем после действия ионизирующего излучения и образования конъюгата галуронидаза - декстран 70.
Пример 9.
В 5 мл 20%-ного раствора плюроника (Pluronic F-68) растворялась навеска 10 мг рекомбинантного проинсулина (ОАО «Национальные биотехнологии», г.Оболенск). Отбиралась проба для проведения ВЭЖХ. Далее раствор переносился в полиэтиленовый пакет, герметично запаивался и замораживался при -70°С в течение 16 часов. После этого пакет облучался на ускорителе электронов ИЛУ-6 дозой облучения 1,0 Мрад. Из облученного пакета повторно отбиралась проба для проведения ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Градиентный режим: фаза А 58,8%, к 16 минуте 32,5%, к 18 минуте 0%, фаза В 41,2%, к 16 минуте 67,5%, к 18 минуте 100%, где фаза А: 90% 0,1М раствор Na2SO4 рН=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 214 нм.
Результаты ВЭЖХ представлены на фиг.15 и фиг.16. Проинсулину соответствует пик 16 на фиг.15 и пик 17 на фиг.16.
После действия ионизирующего излучения сохранилось 96% проинсулина. Сдвиг пика на ВЭЖХ свидетельствует о ковалентной связи между БАВ и полимерным носителем, возникшей после действия ионизирующего излучения, и образовании конъюгата проинсулин - плюроник F-68.
Пример 10.
В 5 мл 20%-ного раствора плюроника (Pluronic F-68) (концентрация, близкая к насыщению) растворялась навеска 50 мг человеческого рекомбинантного инсулина. Отбиралась проба для проведения ВЭЖХ. Далее раствор переносился в полиэтиленовый пакет, герметично запаивался и помещался в морозильную камеру при температуре -70°С на 16 часов. После этого пакет облучался на ускорителе электронов ИЛУ-6 дозой облучения 1,5 Мрад. Из облученного пакета повторно отбиралась проба для проведения ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 57,6%, фаза В 42,4%, где фаза А: 90% 0,1М раствор Na2SO4 рН=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 214 нм.
Результаты ВЭЖХ представлены на фиг.17 и фиг.18. Инсулину соответствует пик 12 на фиг.17 и пик 10 на фиг.18.
После действия ионизирующего излучения сохранилось около 50% инсулина. Сдвиг пика на ВЭЖХ свидетельствует о ковалентной связи между БАВ и полимерным носителем после действия ионизирующего излучения и получения конъюгата проинсулин - плюроник F-68.
Пример 11.
В 5 мл 20%-ного раствора полиэтиленоксида-1500 растворялась навеска 50 мг человеческого рекомбинантного инсулина. Отбиралась проба для проведения ВЭЖХ. Далее раствор переносился в полиэтиленовый пакет, герметично запаивался и помещался в морозильную камеру при температуре -70°С на 16 часов. Непосредственно перед облучением пакет помещался в емкость с жидким азотом до достижения температуры -140°С. Сразу же после этого пакет облучался на ускорителе электронов ИЛУ-6 дозой облучения 5 Мрад. Из облученного пакета повторно отбиралась проба для проведения ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 57,6%, фаза В 42,4%, где фаза А: 90% 0,1М раствор Na2SO4 pH=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 214 нм.
Результаты ВЭЖХ представлены на фиг.19 и фиг.20. Инсулину соответствует пик 15 на фиг.19 и пик 14 на фиг.20.
После действия ионизирующего излучения сохранилось 59% инсулина. Сдвиг пика на ВЭЖХ свидетельствует о ковалентной связи между БАВ и полимерным носителем после действия ионизирующего излучения и образовании конъюгата инсулин - полиэтиленоксид-1500.
Пример 12.
Готовили пробу: 2 мг тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата смешивали с 1 мл 10% раствора пласдона К-17 (Plasdone К-17). Раствор запаивали в герметичный полиэтиленовый пакет.
Пробу в полиэтиленовом пакете помещали в морозильную камеру при температуре -70°С на 16 часов, после чего пробу облучали на ускорителе электронов ИЛУ-6 дозой облучения 1,0 Мрад. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 55%, фаза В 45%, где фаза А: 90% 0,1М раствор Na2SO4 рН=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 230 нм.
Результаты ВЭЖХ представлены на фиг.21. Тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетату соответствует пик 8.
В сравнении с пробой, которая подвергалась воздействию ионизирующего излучения в жидком виде (фиг.8), количество сохранившегося иммобилизированного тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата почти в 7 раз больше. Смещение пика тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетата указывает на иммобилизацию БАВ на полимере и получение конъюгата тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат - поливинилпирролидон (пласдон К-17).
Таким образом, замораживание растворов перед облучением увеличивало сохранность иммобилизированного на полимере БАВ.
Пример 13.
В 5 мл 10%-ного раствора полиэтиленоксида-1500 добавлялась навеска 50 мг человеческого рекомбинантного инсулина (ОАО «Национальные биотехнологии», г.Оболенск). Поскольку данная марка инсулина растворяется в кислой среде и не растворяется в нейтральной среде, какой является раствор полиэтиленоксида, то под контролем рН-метра в смесь добавлялась ледяная уксусная кислота до значения рН 2,5-2,8. В результате кислотного титрования инсулин растворяется в полиэтиленоксиде-1500 и смесь инсулина с полиэтиленоксидом в воде становится прозрачной. Далее раствор переносился в полиэтиленовый пакет и герметично запаивался. Пакет помещался в морозильную камеру при -70°С на 12 часов. После этого пакет облучался на ускорителе электронов ИЛУ-6 дозой облучения 1,0 Мрад.
После облучения иммобилизированный инсулин не выпадал в осадок при ощелачивании раствора до рН=9. Таким образом, подтверждается возникновение ковалентных связей между БАВ и полимерным носителем и образование конъюгата инсулин - полиэтиленоксид-1500.
Пример 14.
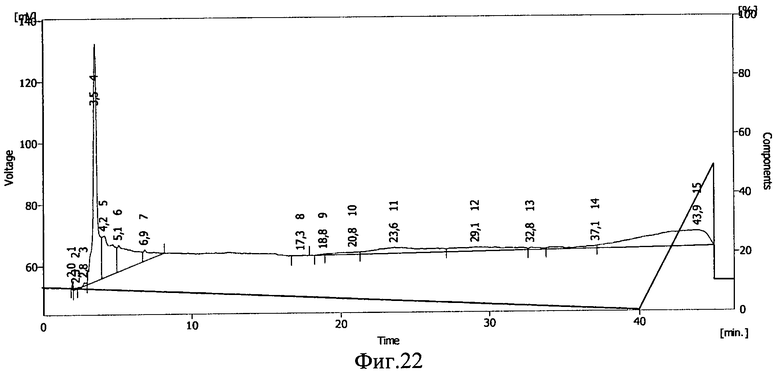
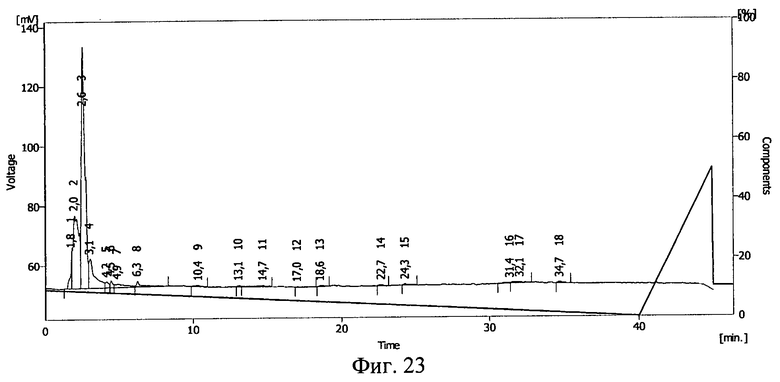
В 5 мл 10%-ного раствора декстрана с молекулярной массой 40-60 кДа растворялась навеска 2,5 мг соматотропина. Отбиралась проба для проведения ВЭЖХ. Далее раствор переносился в полиэтиленовый пакет, герметично запаивался и замораживался при -20°С в течение 16 часов. После этого пакет облучался тормозным γ-излучением в дозе 0,5 Мрад. Из облученного пакета повторно отбиралась проба для проведения ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Градиентный режим: фаза А 10%, к 40 минуте 0%, фаза В 90%, к 40 минуте 100%, где фаза А: 90% 0,1М раствор Na2SO4 pH=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 220 нм.
Результаты ВЭЖХ представлены на фиг.22 и 23. Соматотропину соответствует пик 4 на фиг.22 и пик 3 на фиг.23.
Сохранность соматотропина после действия ионизирующего излучения составила 93,5%. Сдвиг пика на ВЭЖХ свидетельствует о ковалентной связи между БАВ и полимерным носителем после действия ионизирующего излучения и образовании конъюгата соматотропин - декстран с молекулярной массой 40-60 кДа.
Пример 15.
В 10 мл 10%-ного раствора полиэтиленоксида-1500 растворялась навеска 100 мг человеческого рекомбинантного инсулина. Отбиралась проба для проведения ВЭЖХ. Далее раствор разделялся на 3 пробы, пробы переносили в полиэтиленовые пакеты и герметично запаивали.
Проба №1 помещалась в морозильную камеру при температуре -20°С на 16 часов. Пробы №2 и №3 помещалась в морозильную камеру при температуре -70°С на 16 часов.
После замораживания пробу №1 облучали на ускорителе электронов ИЛУ-6 дозой облучения 1 Мрад. Пробу №2 облучали на ускорителе электронов ИЛУ-6 дозой облучения 1,5 Мрад. Непосредственно перед облучением пакет с пробой №3 помещали в емкость с жидким азотом до достижения температуры -140°С. Сразу же после этого пакет облучался на ускорителе электронов ИЛУ-6 дозой облучения 5 Мрад.
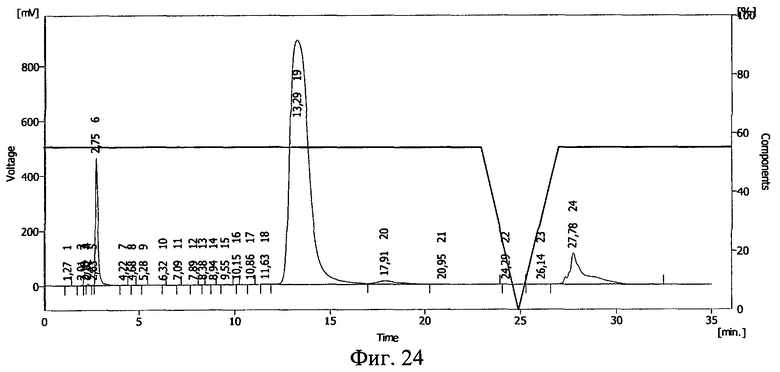
Из облученных пакетов повторно отбирались пробы для проведения ВЭЖХ. Проводилась обращенно-фазовая ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex Luna С 18 5 мкм 100А (производство США). Изократический режим: фаза А 57,6%, фаза В 42,4%, где фаза А: 90% 0,1М раствор Na2SO4 рН-2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 рН=2,3+50% ацетонитрил, детекция на 214 нм.
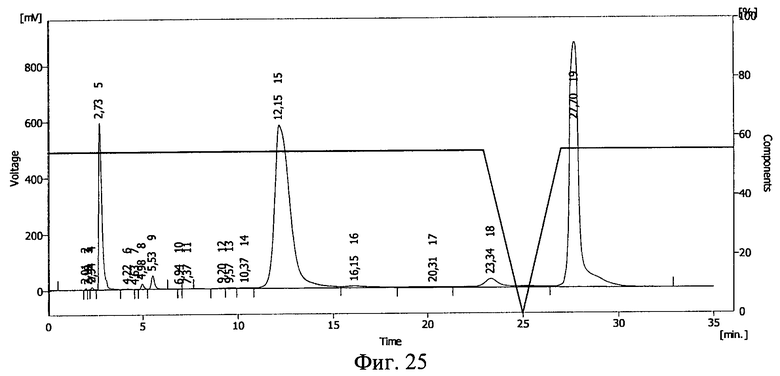
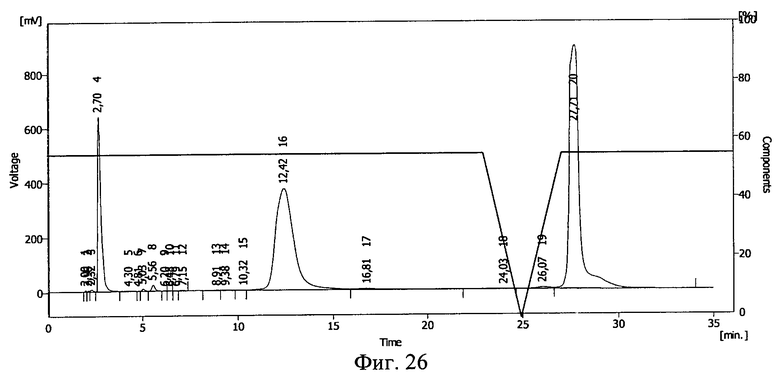
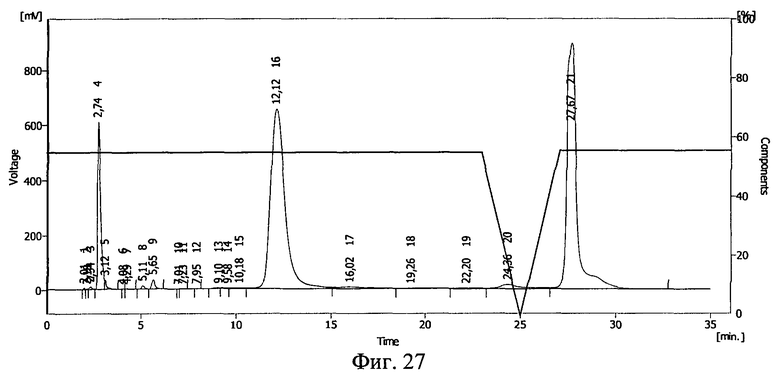
Результаты ВЭЖХ представлены на фиг.24, фиг.25, фиг.26 и фиг.27. Инсулину соответствует пик 19 на фиг.24, пик 15 на фиг.25, пик 16 на фиг.26 и фиг.27.
В пробе №1 сохранилось 54% инсулина, в пробе №2 41%, в пробе №3 57%. Сдвиг пиков на ВЭЖХ свидетельствует о возникновении ковалентной связи между БАВ и полимерным носителем после действия ионизирующего излучения и образования конъюгата инсулин - полиэтиленоксид-1500.
Пример 16 (продолжена нумерация примеров, чертежей и таблиц, начатая в первоначальном описании изобретения).
В 25 мл дистиллированной воды растворяли 1 мг (точная навеска) рибонуклеазы производства ООО «Самсон-Мед», Санкт-Петербург.1 мл полученного раствора вносили в 9 мл инфузионного раствора рефортан производства Berlin-Chemie AG/Menarini Group, Германия (10% раствор гидроксиэтилированного крахмала). Далее раствор разделяли на 3 пробы, пробы переносили в полиэтиленовые пакеты и герметично запаивали. Пробу №2 помещали в морозильную камеру при температуре -70°С на 16 часов. Пробы №2 и №3 облучали на ускорителе электронов ИЛУ-6 дозой облучения 1,5 Мрад, пробу №1 замораживанию и облучению не подвергали.
Далее определяли активность рибонуклеазы в каждой пробе. Для этого в контрольную и 2 опытные пробирки вносили по 0,25 мл субстрата, содержащего 1% раствор стандартного раствора РНК производства Sigma (кат.№R-6750). Пробирки помещали в водяную баню при 37±0,5°С. Через 5 мин в опытные пробирки прибавляли по 0,25 мл раствора рибонуклеазы из исследуемой пробы. Все пробирки выдерживают при 37±0,5°С в течение 30 мин, после чего в каждую пробирку вносили по 2,5 мл охлажденного на льду раствора бария хлорнокислого (5 мл 83,5% раствор бария хлорнокислого (ТУ 6-09-3604-74), смешивали с 10 мл спирта изопропилового и доводили объем до 100 мл спиртом этиловым). В контрольную пробирку прибавляли 0,25 мл раствора рибонуклеазы. Пробирки сильно встряхивали и выдерживали во льду в течение 30 мин, образовавшиеся осадки отделяли центрифугированием в течение 10 мин при 6000 оборотах в минуту. Из надосадочного слоя отбирали по 0,5 мл раствора, прибавляли по 2,5 мл воды и измеряли оптическую плотность растворов на спектрофотометре при длине волны 260 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали контрольную пробу.
Активность рибонуклеазы в пробе №1 составила 5715 ЕА, в пробе №2 5683 ЕА, в пробе №3 106,2 ЕА.
Таким образом, в растворе рибонуклеазы, который подвергали облучению после замораживания, активность фермента снизилась незначительно. В пробе, подвергшейся облучению без замораживания, активность фермента значительно уменьшилась.
Оценивали пирогенность проб рибонуклеазы, приготовленных по способу, описанному в примере 16. Для оценки пирогенности на кроликах использовался способ, описанный в п.9 «Методических указаний МУК 4.1/4.2.588-96 "Методы контроля медицинских иммунобиологических препаратов, вводимых людям"». Пробы №1, №2 и №3 стерилизовали путем фильтрации через фильтр Minisart с диаметром 0,2 мкм (производство «Sartorius stedim», США) непосредственно перед инъекцией в ушную вену кролика.
Введение пробы №1 вызвало пирогенную реакцию у животных, пробы №2 и №3 пирогенной реакции не вызвали, что доказывает факт иммобилизации рибонуклеазы на 10% растворе гидроксиэтилированного крахмала.
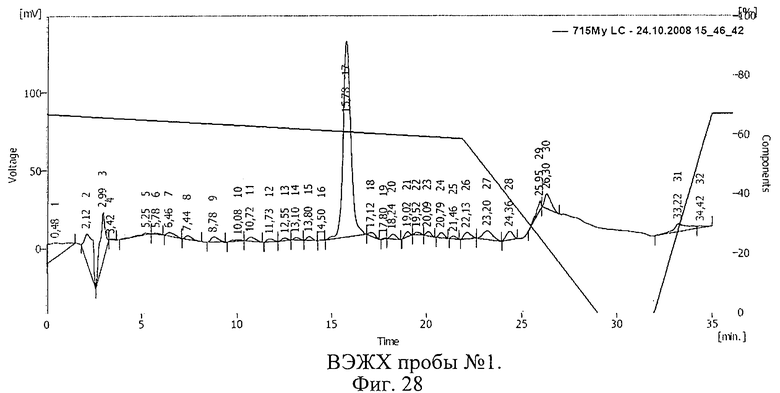
Проводили ВЭЖХ проб рибонуклеазы, приготовленных по способу, описанному в примере 16.
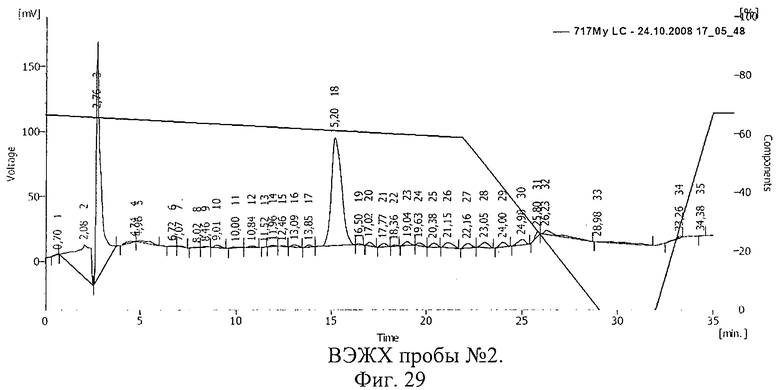
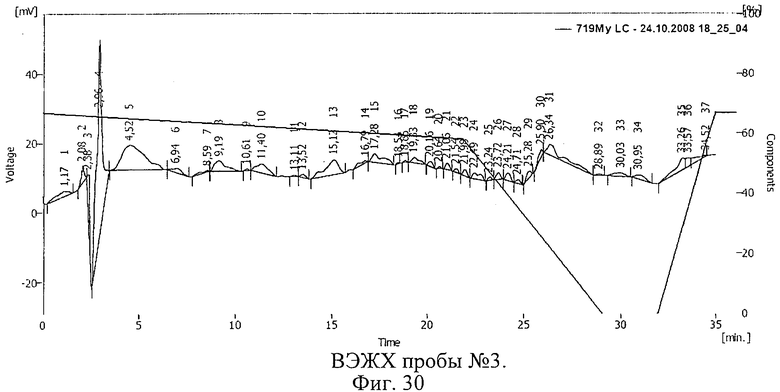
Результаты ВЭЖХ представлены на фиг.28-30. Пик 17 на фиг.28 (время 15,78 мин), пик 18 на фиг.29 (время 15,20 мин), пик 13 на фиг.30 (время 15,12 мин) соответствуют рибонуклеазе.
Таким образом, в растворе рибонуклеазы, который подвергался облучению после замораживания (проба 2, фиг.29), активность фермента снизилась незначительно. В пробе, подвергшейся облучению без замораживания, активность фермента уменьшилась значительно. Смещение пика рибонуклеазы указывает на иммобилизацию БАВ на полимере и образование конъюгата.
Пример 17.
В 10 мл 10%-ного раствора полиэтиленоксида с молекулярной массой 1500 Да растворяли 10 мг рекомбинантного человеческого С-пептида. Далее раствор разделяли на 2 пробы, пробы переносили в полиэтиленовые пакеты и герметично запаивали. Пробу №2 помещалась в морозильную камеру при температуре -70°С на 16 часов, после чего облучали на ускорителе электронов ИЛУ-6 дозой облучения 1,5 Мрад, пробу №1 замораживанию и облучению не подвергали.
Исследование фармакокинетики С-пептида в полученных пробах проводили на 13 крысах-самцах Вистар массой 430-540 г. Пробы вводили подкожно в дозе 5 мг/кг (в пересчете на С-пептид). Пробы крови (0,3 мл) забирали из хвостовой вены бодрствующих животных в гепаринизированные капилляры, отделяли плазму центрифугированием и до момента анализа плазму хранили при температуре 3-5°С не более 3 сут. Для количественного определения содержания в плазме С-пептида использовали иммуноферментный тест Mercodia C-peptide ELISA specific. Забор проб крови проводили до и через 0,25; 0,5; 1; 2; 3; 4 и 6 ч после введения препарата. Фармакокинетические параметры С-пептида в 1 и 2 пробе представлены в табл.2.
Фармакокинетические параметры С-пептида в 1 и 2 пробе существенно различаются между собой, что свидетельствует об иммобилизации и одновременном сохранении БАВ в пробе, подвергшейся облучению после замораживания.
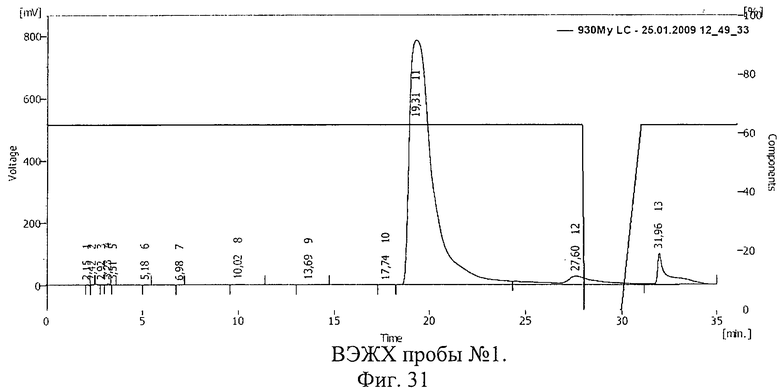
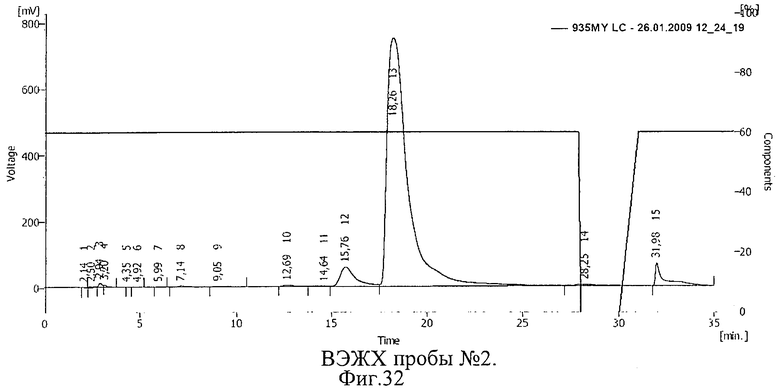
Проводили ВЭЖХ проб С-пептида, приготовленных по способу, описанному в примере 17. Результаты ВЭЖХ представлены на фиг.31 и 32. Пик 11 на фиг.31 (время 19,31 мин), пик 13 на фиг.32 (время 15,20 мин) соответствуют С-пептиду.
Сдвиг пика на ВЭЖХ, соответствующего С-пептиду, свидетельствует о ковалентной связи между БАВ и полимерным носителем, возникшей после действия ионизирующего излучения, и образовании конъюгата С-пептид-полиэтиленоксид. Площадь пика 13 на фиг.32 незначительно меньше площади пика 11 на фиг.31, что свидетельствует о сохранности БАВ, подвергнутого ионизирующему облучению в замороженном виде.
Пример 18.
Готовили три пробы. Пробы №1 и №3 содержали 1% раствор ДНК, выделенной из молок лососевых рыб. Проба №2 содержала 1% раствор ДНК, выделенной из молок лососевых рыб, в 10% растворе полиэтиленоксида-6000. Пробы №1 и №2 помещали в морозильную камеру при температуре -20°С на 16 часов. Все пробы подвергали облучению на ускорителе электронов ИЛУ-6 дозой облучения 1,5 Мрад. После этого проводили электрофорез проб в 1% агарозном геле с последующей окраской бромистым этидием. Результаты электрофореза представлены на фиг 33. Слева показаны маркеры молекулярных весов.
Как видно из фиг.33, замороженная ДНК (проба №1) под действием облучения не разрушилась; ДНК, замороженная с ПЭГ (проба №2), увеличила свою молекулярную массу за счет иммобилизации; незамороженная ДНК (проба №3) под действием облучения подверглась деградации.
Пример 19.
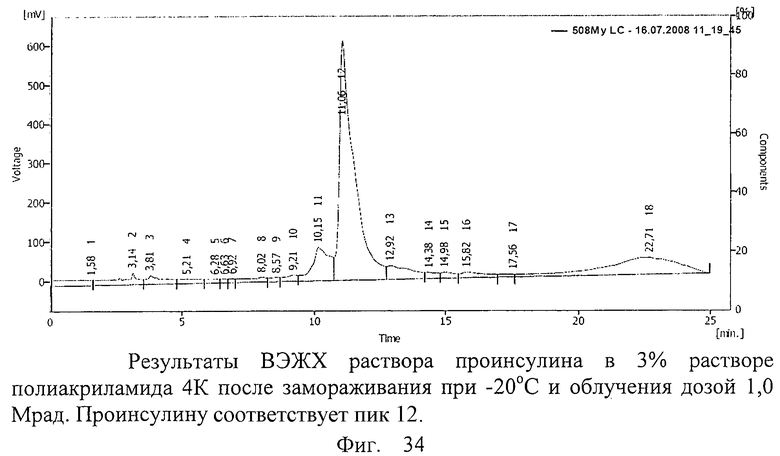
В 5 мл 3%-ного раствора полиакриламида 4К растворяли навеску 10 мг рекомбинантного проинсулина (ОАО «Национальные биотехнологии», г.Оболенск). Отбирали пробу для проведения ВЭЖХ. Далее раствор переносили в полиэтиленовый пакет, герметично запаивали и замораживали при -20°С в течение 16 часов. После этого пакет облучали на ускорителе электронов ИЛУ-10 дозой облучения 1,0 Мрад. Из облученного пакета повторно отбирали пробу для проведения ВЭЖХ. Проводили обращенно-фазовую ВЭЖХ на хроматографической системе Sykam (производства Германия) на колонке Phenomenex C18 5 мкм 100А (производство США). Градиентный режим: фаза А 58,8%, к 16 минуте 32,5%, к 18 минуте 0%, фаза В 41,2%, к 16 минуте 67,5%, к 18 минуте 100%, где фаза А: 90% 0,1М раствор Na2SO4 pH=2,3+10% ацетонитрил, фаза В: 50% 0,1М раствор Na2SO4 pH=:2,3+50% ацетонитрил, детекция на 214 нм.
Результаты ВЭЖХ представлены на фиг.34. После облучения предварительно замороженной пробы проинсулина в 3%-ном растворе полиакриламида 4К сохранилось 97% проинсулина.
Пример 20.
Готовили 2 серии проб. В первой серии по 5 мл концентрированной алкалазы 2,4Л ФГ (производство «Novozymes A/S») добавляли в емкости, содержащие по 45 мл следующих растворов: 20%-ный раствор полиэтиленоксида с молекулярной массой 300 Да, 20%-ный раствор Pluronic F-68, 10%-ный раствор декстрана с молекулярной массой 70 кДа, 20%-ный раствор Plasdone K-17.
Во второй серии по 5 грамм протосубтилина Г20Х добавляли в 45 мл таких же растворов (20%-ный раствор полиэтиленоксида с молекулярной массой 300 Да, 20%-ный раствор Pluronic F-68, 10%-ный раствор декстрана с молекулярной массой 70 кДа, 20%-ный раствор Plasdone К-17).
Измеряли протеолитическую активность ферментов в полученных смесях по гидролизу 1% раствора казеината натрия (табл.3).
После этого проводили иммобилизацию ферментов на полимерных носителях путем облучения растворов ионизирующим облучением в дозе 1,5 Мрад. Измеряли протеолитическую активность иммобилизированных ферментов по гидролизу 1% раствора казеината натрия. Результаты измерений представлены в табл.3. Как видно из данной таблицы, после иммобилизации на различных полимерах ферменты сохраняют протеолитическую активность.
В данном примере было получено 5 новых конъюгатов.
Таким образом, заявителем в первоначальных материалах заявки и в настоящем ответе приведены примеры получения 23 конъюгатов. Способом по независимому п.1 с использованием семи частных форм БАВ и четырех частных форм ФПВП получено двенадцать конъюгатов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММОБИЛИЗИРОВАННЫЙ ПРОДУЦИРУЕМЫЙ БАКТЕРИЯМИ BACILLUS LICHENIFORMIS СУБТИЛИЗИН, ОБЛАДАЮЩИЙ ТРОМБОЛИТИЧЕСКИМ И АНТИКОАГУЛЯНТНЫМ СВОЙСТВАМИ | 2008 |
|
RU2416643C2 |
| ПРОТИВОЭНТЕРОВИРУСНОЕ И ИММУНОСТИМУЛИРУЮЩЕЕ СРЕДСТВО | 2014 |
|
RU2554761C1 |
| КОМПОЗИЦИЯ НА ОСНОВЕ СИНТЕТИЧЕСКИХ ПЕПТИДОВ И ЛИПИДОВ ДЛЯ ВАКЦИНЫ ПРОТИВ ГЕПАТИТА С | 2015 |
|
RU2675108C2 |
| Способ получения -сульфоната в-цепи инсулина человека | 1977 |
|
SU696011A1 |
| Способ мезотерапевтического омоложения кожи пациента с применением композиции для омоложения кожи на основе тирозил-D-аланил-глицил-фенилаланил-лейцил-аргинина | 2024 |
|
RU2835298C1 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ДЕСУЛЬФАТИРОВАНИЯ И ПОВЫШЕНИЯ БИОДОСТУПНОСТИ БИОЛОГИЧЕСКИ АКТИВНЫХ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ ПРИ ИХ ПЕРОРАЛЬНОМ ПРИМЕНЕНИИ | 2009 |
|
RU2421230C2 |
| Противовирусное иммунотропное средство для лечения ОРВИ | 2018 |
|
RU2672888C1 |
| Гексапептид,обладающий антипанкреонекротической активностью | 1984 |
|
SU1348343A1 |
| ПОЛИМЕРНЫЙ КОНЪЮГАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2130462C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ИНСУЛИНА ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ | 2006 |
|
RU2316339C1 |

Изобретение относится к биотехнологии, медицине, биологии, фармакологии. Биологически активное вещество (БАВ) растворяют в водном растворе полимера, имеющего концентрацию выше 10%, до концентрации насыщенного раствора. Полученную реакционную смесь облучают ионизирующим излучением. Второй вариант осуществления способа заключается в том, что БАВ растворяют в водном растворе полимера, затем смесь замораживают до температуры
(-20)-(-140°)С, после чего облучают ионизирующим излучением. Конъюгат БАВ - носитель, полученный предложенными способами, характеризуется тем, что БАВ выбран из группы: проинсулин, тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат, алкалаза, гиалуронидаза, соматотропин, а носитель, выбран из группы: полиэтиленоксид, поливинилпирролидон, декстран, плюроник, акриламид. Молекула БАВ соединена ковалентно, по меньшей мере, с одной молекулой полимера. Изобретение обеспечивает возможность иммобилизации на полимерном носителе тех водорастворимых БАВ, которые являются нестабильными, т.е. разрушаются при иммобилизации их другими способами полностью или почти полностью, а также увеличение доли сохраненного БАВ в тех случаях, когда при иммобилизации БАВ разрушается не полностью. 3 н. и 20 з.п. ф-лы, 34 ил., 3 табл.
1. Способ иммобилизации биологически активного вещества (БАВ) на носитель, представляющий собой водорастворимый фармакологически приемлемый полимер, включающий растворение БАВ в растворе указанного полимера, облучение реакционной смеси ионизирующим излучением, отличающийся тем, что полимер используют в концентрации выше 10% до концентрации насыщенного раствора.
2. Способ по п.1, отличающийся тем, что в качестве ионизирующего излучения используют поток ускоренных электронов или тормозное γ-излучение в дозе 0,5-5 Мрад.
3. Способ по п.1, отличающийся тем, что в качестве БАВ используют вещество, выбранное из группы: инсулин, проинсулин, Г-КСФ, гиалуронидаза, тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат, алкалаза.
4. Способ по п.1, отличающийся тем, что в качестве полимерного носителя используют полимер, выбранный из группы: полиэтиленоксид, плюроник, декстран, поливинилпирролидон.
5. Способ по п.1, отличающийся тем, что иммобилизируют алкалазу на полиэтиленоксиде.
6. Способ по п.1, отличающийся тем, что иммобилизируют инсулин на полиэтиленоксиде.
7. Способ по п.1, отличающийся тем, что иммобилизируют тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат на поливинилпирролидоне.
8. Способ по п.1, отличающийся тем, что иммобилизируют гранулоцитарный колониестимулирующий фактор на полиэтиленоксиде.
9. Способ по п.1, отличающийся тем, что иммобилизируют гиалуронидазу на декстране.
10. Способ по п.1, отличающийся тем, что иммобилизируют проинсулин на плюронике.
11. Способ по п.1, отличающийся тем, что иммобилизируют инсулин на плюронике.
12. Способ иммобилизации биологически активного вещества (БАВ) на носитель, представляющий собой водорастворимый фармакологически приемлемый полимер, включающий растворение БАВ в растворе указанного полимера, облучение реакционной смеси ионизирующим излучением, отличающийся тем, что перед облучением смесь замораживают до температуры (-20°)-(-140°)С.
13. Способ по п.12, отличающийся тем, что в качестве ионизирующего излучения используют поток ускоренных электронов или тормозное γ-излучение в дозе 0,5-5 Мрад.
14. Способ по п.12, отличающийся тем, что в качестве БАВ используют вещество, выбранное из группы: инсулин, проинсулин, Г-КСФ, гиалуронидаза, тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат, соматотропин.
15. Способ по п.12, отличающийся тем, что в качестве полимерного носителя используют полимер, выбранный из группы: полиэтиленоксид, плюроник, декстран, поливинилпирролидон, акриламид.
16. Способ по п.12, отличающийся тем, что иммобилизируют тирозил-2-аланил-глицил-фенилаланил-лейцил-аргинина диацетат на поливинилпирролидоне.
17. Способ по п.12, отличающийся тем, что иммобилизируют инсулин на полиэтиленоксиде.
18. Способ по п.12, отличающийся тем, что иммобилизируют соматотропин на декстране.
19. Способ по п.12, отличающийся тем, что иммобилизируют проинсулин на акриламиде.
20. Способ по п.12, отличающийся тем, что иммобилизируют гранулоцитарный колониестимулирующий фактор на полиэтиленоксиде.
21. Способ по п.12, отличающийся тем, что иммобилизируют гиалуронидазу на декстране.
22. Способ по п.12, отличающийся тем, что иммобилизируют инсулин на плюронике.
23. Конъюгат БАВ-носитель, характеризующийся тем, что он получен способом по пп.1-11 или по пп.12-22.
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМОГО ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА | 1998 |
|
RU2137835C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМОГО ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА ПРОТЕАЗ | 2004 |
|
RU2270861C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОЛОНГИРОВАННЫМ ПРОТИВОТУБЕРКУЛЕЗНЫМ ДЕЙСТВИЕМ | 1999 |
|
RU2169565C1 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ | 1997 |
|
RU2112542C1 |
| СПОСОБ СНИЖЕНИЯ ТОКСИЧНОСТИ АМФОТЕРИЦИНА В | 2005 |
|
RU2297246C1 |
| Приспособление для сшивания бумаг в папках | 1926 |
|
SU8505A1 |
| Способ изготовления рентгеновских экранов из вольфрамата кальция | 1935 |
|
SU44785A1 |
| WO 2004083234 А2, 30.09.2004. | |||
Авторы
Даты
2011-01-20—Публикация
2008-08-18—Подача