Данное изобретение имеет отношение к фармацевтическому продукту, содержащему аллерген, и, в частности, к быстродиспергируемым твердым лекарственным формам, содержащим аллерген, и способу приготовления таких лекарственных форм.
Уровень техники изобретения
Аллергия является значимой проблемой здравоохранения в странах, где придерживаются западного образа жизни. Кроме того, в упомянутых странах распространение аллергических заболеваний возрастает. Хотя аллергия вообще не может рассматриваться как заболевание, угрожающее жизни, астма является причиной значительного количества смертей ежегодно. Исключительное распространение приблизительно у 30% подростков выражается значительным ухудшением качества жизни, потерей работоспособности и денег и оправдывает классификацию аллергии в числе главных проблем здравоохранения в западном мире.
Аллергия представляет собой комплексное заболевание. Многие факторы способствуют процессу сенсибилизации. Из их числа восприимчивость индивидуума обусловлена все еще недостаточно изученным взаимодействием нескольких генов. Другим важным фактором является воздействие аллергена в дозе свыше определенных порогов. Некоторые факторы окружающей среды могут быть важными для процесса сенсибилизации, включая загрязнение, детские инфекции, паразитарные инфекции, кишечные микроорганизмы и так далее. Как только индивидуум оказывается сенсибилизированным и развивается аллергическая иммунная реакция, присутствие исключительно незначительных количеств аллергена эффективно трансформируется в симптомы.
Естественное течение аллергического заболевания сопровождается ухудшением в две стадии. Сначала происходит прогрессирование симптомов и тяжести заболевания. Например, имеет место прогрессирование от поллиноза до астмы. Во-вторых, происходит диссеминация специфических аллергенов, что довольно часто приводит к аллергической мультиреактивности. Хроническое воспаление ведет к общему ослаблению защитных механизмов слизистой оболочки, приводя к неспецифической, болезненной чувствительности и, в конце концов, к деструкции слизистой ткани. У младенцев может развиваться повышенная чувствительность сначала к пище, то есть к молоку, приводя в результате к экземе или желудочно-кишечным нарушениям; однако довольно часто упомянутые симптомы у них появляются спонтанно. Такие младенцы представляют собой группу повышенного риска развития позднее в их жизни ингаляционной аллергии.
Наиболее важные источники аллергенов обнаружены среди многочисленных распространенных частиц определенного размера во вдыхаемом воздухе. Эти источники являются в высшей степени универсальными и включают в себя пыльцу трав и экскременты клещей, живущих в домашней пыли, которые вместе ответственны приблизительно за 50% всех аллергий. Также важное значение придают перхоти животных, то есть перхоти кошек и собак, другим видам пыльцы, таким как пыльца полыни, и микрогрибы, такие как Alternaria. В зависимости от местных условий могут доминировать разные виды пыльцы, такие как пыльца березы в Северной и Центральной Европе, амброзии в Восточных и Центральных Соединенных Штатах и пыльца японского кедра в Японии. Насекомые, то есть пчелиный и осиный яды, и пищевые продукты составляют приблизительно по 2% всех аллергенов, каждый в отдельности.
Причиной аллергии, то есть повышенной чувствительности, является несоответствующая иммунная реакция на чужеродные непатогенные вещества. Важные клинические проявления аллергии включают в себя астму, поллиноз, экзему и желудочно-кишечные нарушения. Аллергическая реакция возникает и спадает в течение 20 минут при контакте со специфическим аллергеном. Кроме того, аллергическая реакция является специфической в том смысле, что определенный индивидуум сенсибилизируется определенным аллергеном(ами), в то время как у индивидуума не возникает непременно аллергическая реакция на другие вещества, которые, как известно, вызывают аллергическое заболевание. Аллергический фенотип определяют по резко выраженному воспалению слизистой органа-мишени и по присутствию аллергенспецифических антител класса IgE в кровообращении и на поверхности тучных клеток и базофилов.
Аллергический приступ инициируется реакцией чужеродного аллергена с аллергенспецифическими IgE-антителами, когда антитела связывают с высоким сродством IgE-рецепторы на поверхности тучных клеток и базофилов. Тучные клетки и базофилы содержат преформированные медиаторы, то есть гистамин, триптазу и другие вещества, которые высвобождаются при перекрестном связывании двух и более связанных с рецептором IgE-антител. IgE-антитела оказываются перекрестно связанными в результате одновременного связывания одной молекулой аллергена. Перекрестное сшивание связанного с рецептором IgE на поверхности тучных клеток также приводит к высвобождению передающих сигнал молекул, ответственных за аттракцию эозинофилов, аллергенспецифических Т-клеток и других типов клеток в участок аллергической реакции. Названные клетки при взаимодействии с аллергеном, IgE и эффекторными клетками приводят к возобновленной вспышке симптомов, происходящей через 12-24 часа после столкновения с аллергеном (реакция поздней фазы).
Устранение аллергического заболевания включает в себя распознавание заболевания и лечение, включая профилактические мероприятия. Диагностика аллергии сопряжена с выявлением аллергенспецифических IgE и идентификацией источника аллергена. В большинстве случаев тщательный анамнез может быть достаточным для установления аллергии и для идентификации источника специфического аллергена. Однако наиболее часто диагноз подтверждают объективными исследованиями, такими как инъекционная кожная проба/ анализ крови или провокационная проба.
Терапевтический подход базируется на трех основных категориях возможностей. Первая благоприятная возможность представляет собой устранение аллергена или уменьшение воздействия. В одних случаях устранение аллергена является очевидным, например, в случае пищевых аллергенов, в других устранение может оказаться трудным или дорогостоящим, когда это касается экскрементов клещей, живущих в домашней пыли, или это может быть невыполнимым, как в отношении пыльцевых аллергенов. Второй и наиболее широко используемый терапевтический подход заключается в назначении классических симптоматических лекарственных средств, подобных антигистаминным препаратам и стероидам. Симптоматические лекарственные средства являются безопасными и эффективными; однако они не воздействуют на естественную причину заболевания и они не подавляют распространение заболевания. Третьей терапевтической альтернативой является специфическая вакцинация против аллергии, которая в большинстве случаев уменьшает или облегчает симптомы аллергии, вызванные аллергеном, о котором идет речь.
Общепринятая специфическая вакцинация против аллергии является этиологической терапией для аллергического заболевания. Она препятствует основным иммунным механизмам, приводя к стойкому улучшению иммунного статуса пациентов. Таким образом, в отличие от симптоматической лекарственной терапии защитное действие специфической вакцинации против аллергии распространяется за пределы периода лечения. Некоторых пациентов, получавших лечение, вылечивают, а большинство пациентов испытывает ослабление тяжести заболевания и имеющихся симптомов или, по крайней мере, замедление прогрессирования заболевания. Так, специфическая вакцинация против аллергии оказывает защитное действие, снижая риск превращения поллиноза в астму и снижая риск развития новых реакций повышенной чувствительности.
Иммунный механизм, лежащий в основе успешной вакцинации против аллергии, в деталях не установлен. Специфический иммунный ответ, такой как образование антител против определенного патогенного фактора, известен как адаптивный иммунный ответ. Такой ответ отличается от врожденного иммунного ответа, который является неспецифической реакцией против патогенных факторов. Вакцина против аллергии направлена на адаптивный иммунный ответ, который вовлекает клетки и молекулы с антигенной специфичностью, такие как Т-клетки и продуцирующие антитела В-клетки. В-клетки не могут созревать в клетки, продуцирующие антитела, без помощи Т-клеток с соответствующей специфичностью. Т-клетки, которые участвуют в стимуляции аллергических иммунных ответов, представляют собой, главным образом, клетки типа Th2. Полагают, что установление нового баланса между клетками Тh1 и Th2 является благоприятным и главным в иммунологическом механизме специфической вакцинации против аллергии. Осуществляется ли это посредством снижения клеток Th2, сдвига от клеток Th2 к клеткам Th1 или активацией клеток Th1, представляет собой спорный вопрос. В последнее время высказывают предположение, что регуляторные Т-клетки являются важными для механизма вакцинации против аллергии. В соответствии с этой моделью регуляторные Т-клетки, то есть клетки Th3 или Tr1, подавляют как клетки Th1, так и клетки Th2 с соответствующей антигенной специфичностью. Несмотря на упомянутую двусмысленность вообще полагают, что активная вакцина должна обладать способностью стимулировать аллергенспецифические Т-клетки, предпочтительно Thl-клетки.
Несмотря на ее достоинства, специфическая вакцинация против аллергии не имеет широкого применения главным образом по двум причинам. Одной причиной являются неудобства, связанные с традиционной программой вакцинации, которая включает в себя повторные вакцинации, такие как инъекции в течение нескольких месяцев. Другой причиной, более важной, является риск появления аллергических побочных реакций. Обычные вакцинации против инфекционных возбудителей эффективно проводят, используя иммунизации однократной дозой или несколькими высокими дозами. Такую стратегию, однако, нельзя использовать для вакцинации против аллергии, так как патологический иммунный ответ уже является образом жизни.
Поэтому общепринятую специфическую вакцинацию против аллергии проводят, используя множественные подкожные иммунизации, осуществляемые в течение продолжительного периода времени. Курс разделяют на две фазы, фазу «повышения» дозы и фазу стабилизации. В фазе повышения дозы применяют возрастающие дозы, обычно в течение 16-недельного периода, начиная с незначительных доз. Когда достигают рекомендованной стабилизирующей дозы, такую дозу применяют в фазе стабилизации обычно в виде инъекций каждые шесть недель. После каждой инъекции пациент должен оставаться под медицинским наблюдением в течение 30 минут из-за риска возникновения анафилактических побочных реакций, которые в принципе, хотя крайне редко, могут угрожать жизни. Кроме того, клиника должна быть оборудована так, чтобы можно было оказывать неотложную терапию. Нет никаких сомнений, что вакцина, разработанная для другого способа введения, будет устранять или снижать риск аллергических побочных реакций, свойственных общераспространенной подкожной вакцине, а также будет способствовать более широкому ее применению, возможно, даже позволит проводить саму вакцинацию дома.
Попытки улучшить вакцины для специфической вакцинации против аллергии предпринимают в течение более 30 лет, и они включают в себя разнообразные подходы. Некоторые подходы направлены на сам аллерген через модификацию реактивности IgE. Другие направлены на способ введения.
Доступ к иммунной системе возможен через полость рта и слизистую оболочку полости рта, например, сублингвальное введение аллергенов является известным способом введения.
Обычно вакцинация против аллергии с использованием способа введения через слизистую полости рта состоит из периодического введения определенных доз раствора аллергена с интервалами протяженностью, по крайней мере, один день. Для сравнения, терапевтические (суммарные) поддерживающие дозы превышают потребность в сравнимой подкожной дозе в 5-500 раз. Явным недостатком такой лекарственной формы и способа введения являются проблемы, связанные с достоверным и единообразным самим введением точной дозы пациенту (может быть назначено по несколько капель, однородность индивидуальных капель, достоверность участка применения и так далее). Кроме того, существует необходимость охлаждать лекарственное средство и включать в препарат консерванты.
Netien et al. ("Galenica 16 - Medicaments homeopathiques" ed. 2, 1986, стр.77-99) описывают жидкий раствор, импрегнированный в твердые частицы (гранулы), или обычные прессованные таблетки из лактозы, сахарозы или их смесей для сублингвального введения лекарственных средств, таких как аллерген.
В DD-A.0107208 описывают способ приготовления обычной прессованной таблетки, содержащей аллерген. При введении таблетка растворяется в слюне, а аллерген затем всасывается через слизистую полости рта. Препарат содержит нерастворимый в воде наполнитель, называемый тальком, а также парафин и жирные кислоты, которые являются нежелательными, так как они оставляют неприятный вкус во рту пациента. Кроме того, растирание, производимое в ходе процесса таблетирования, может быть вредным для физической стабильности аллергенов.
В ЕР 278877 обсуждают фармацевтическую композицию для сублингвального применения, в которой твердую основу покрывают раствором аллергена при распылении раствора на твердые шарики основы. Утверждают, что полученный препарат дезинтегрирует быстро, но не мгновенно. Однако не приводят никакого объяснения, как достигают цели. Кроме того, препарат содержит восстанавливающие сахара в виде лактозы, которые склонны взаимодействовать с аллергенами.
Для того, чтобы гарантировать, что столько вводимой дозы определенного аллергена, сколько возможно, присутствует на слизистой полости рта и что, кроме того, время контакта дезинтегрированного продукта со слизистой увеличено до предела, оказывается очень важным, чтобы лекарственная форма дезинтегрировала бы мгновенно при контакте со слюной полости рта. Быстродиспергируемые твердые лекарственные формы, которые быстро высвобождают активный ингредиент в полость рта, известны в данной области.
В патенте США №4371516 представляют фармацевтические лекарственные формы, содержащие активные ингредиенты, которые быстро дезинтегрируют в воде. Фармацевтические лекарственные формы содержат непокрытую матриксную сетку из материала носителя, которая дезинтегрирует в течение 10 секунд.
Носитель на основе высушенного вымораживанием рыбьего желатина, который описывают в WO 00/61117, сконструирован для того, чтобы мгновенно высвобождать активный ингредиент при контакте со слюной при введении в полость рта.
Носитель из высушенного вымораживанием модифицированного крахмала, который описывают в WO 00/44351, предназначен для мгновенного высвобождения активного ингредиента при контакте со слюной при введении в полость рта.
В WO 99/21579 описывают быстродиспергируемую лекарственную форму, содержащую вакцину и адъювант для перорального применения.
В WO 02/13858 представляют быстро растворяющуюся фармацевтическую композицию, содержащую вакцины в виде быстро растворяющейся «лепешки» для перорального применения. Оказалось, что цель WO 02/13858 заключается в обеспечении вирусными и бактериальными вакцинами, которые будут оставаться интактными в желудочно-кишечном тракте. Этого достигают защитой антигена от кислого содержимого желудка введением в лепешку антацидов, таких как карбонат кальция.
В WO 00/51568 описывают быстродезинтегрирующую прессованную таблетку с низкой хрупкостью, которую предназначают для растворения во рту при контакте со слюной менее чем за 30 секунд с образованием «легко проглатываемой» суспензии.
В патенте США №4371516 утверждают, что препарат является полезным для пероральных вакцин. В случае патентов WO 00/61117, WO 00/44351, WO 99/21579 и WO 02/13858 также утверждают, что изобретения направлены на неинфекционные иммуномодулирующие состояния, такие как системные аллергические состояния, например, поллиноз. Однако не существует никаких описаний в каком-либо из упомянутых сообщений по технической информации или в примерах, как можно производить быстродиспергируемую вакцинную твердую лекарственную форму, содержащую аллерген. Например, нет никаких указаний относительно соответствующей дозировки определенного аллергена в каком-либо из описанных препаратов. Очень важно вводить точную дозу аллергена пациенту, так как избыточная доза может вызвать анафилактический шок у пациента. Кроме того, не приводят никакого описания соответствующих критериев или указаний на такие критерии в отношении стабильности или хрупкости таких препаратов.
Краткое изложение изобретения
Данное изобретение относится к фармацевтическому продукту, подходящему для введения аллергена через слизистую оболочку полости рта, содержащему, по крайней мере, один аллерген и матрикс, в виде быстродиспергируемой твердой лекарственной формы, характеризующееся тем, что содержащая аллерген лекарственная форма является стабильной, достаточно прочной и не высвобождает опасных количеств остатков аллергена при использовании пациентом.
Кроме того, быстродиспергируемая непрессованная твердая лекарственная форма, подходящая для введения через слизистую оболочку полости рта, содержит вещество, образующее матрикс, и аллерген, в которой аллерген стабилен, а лекарственная форма имеет низкую хрупкость с учетом высвобождения аллергена, лекарственная форма быстро растворяется и не требует присутствия адъюванта.
В частности, изобретение относится к фармацевтическому продукту, который подходит для введения аллергена, содержащему:
быстродиспергируемую непрессованную твердую лекарственную форму, подходящую для введения через слизистую полости рта, которая заключает в себе:
(a) матрикс, образованный, по крайней мере, одним образующим матрикс веществом, и
(b) эффективную дозу аллергена для десенсибилизации индивидуума относительно названного аллергена, в которой
(c) потеря содержания аллергена в названной лекарственной форме составляет менее 50% от исходного содержания аллергена после хранения в течение 3 месяцев при 25°С и 60% относительной влажности, и
(d) потеря аллергена из названной твердой лекарственной формы составляет приблизительно менее 0,5 мкг экстракта аллергена или приблизительно менее 0,05 мкг основного аллергена при испытании на хрупкость.
В одном предпочтительном воплощении изобретения твердая лекарственная форма содержит рыбий желатин и маннит в качестве веществ, образующих матрикс.
В другом предпочтительном воплощении изобретения твердая лекарственная форма содержит крахмал и маннит в качестве веществ, образующих матрикс.
В данном изобретении также представляют способы получения рассматриваемых твердых лекарственных форм и способы лечения аллергии введением названных твердых лекарственных форм.
Подробное описание изобретения
Данное изобретение базируется на ряде удивительных результатов, ни один из которых исходно не мог обоснованно ожидаться. Во-первых, оно базируется на выводе, что оказывается возможным применять быстродиспергируемую непрессованную лекарственную форму для введения аллергена и что оказывается возможным достижение эффективного лечения аллергии в результате применения такого препарата. В частности, показано, что действительно возможно осуществлять доставку достаточного количества аллергена в иммунную систему пациента через слизистую оболочку полости рта, используя быстродиспергируемую непрессованную твердую лекарственную форму, не вызывая нежелательного уровня побочных эффектов. Кроме того, в данном изобретении предусматривают подходящие уровни доз для получения терапевтического эффекта без неприемлемых побочных эффектов.
Во-вторых, изобретение базируется на данных, что эффективное лечение может быть достигнуто при использовании быстродиспергируемой непрессованной лекарственной формы без применения адъюванта.
В-третьих, изобретение базируется на данных, что оказывается возможным приготовление аллергена в виде быстродиспергируемой непрессованной лекарственной формы, хотя аллерген требует ряд специальных условий для его стабильности и низкой хрупкости. В частности, показано, что возможно сбалансировать противоположные требования, чтобы лекарственная форма, с одной стороны, была быстродиспергируемой и, с другой стороны, как стабильной, так и характеризовалась низкой хрупкостью с тем, чтобы получить лекарственную форму, которая является в достаточной степени быстродиспергируемой, стабильной и обладает низкой хрупкостью.
Аллергенные белки чувствительны к деградации, на которую оказывает влияние ряд факторов окружающей среды, где они встречаются. Утверждают, что это имеет отношение к лечению аллергии и, в частности, вакцинации против аллергии, чтобы аллерген доставлялся интактным в иммунную систему в терапевтически подходящих дозах. Так, аллерген должен оставаться стабильным во время получения, хранения и применения. В данной работе показано, что действительно возможно вводить аллергенные белки в состав быстродиспергируемой непрессованной лекарственной формы, которая стабильна в отношении доз аллергена и активности аллергена. Кроме того, неожиданно было установлено, что описанные препараты действительно стабильны при комнатной температуре. Этот результат имеет существенное значение для способов обработки конечного продукта. Охлаждение в производственном оборудовании, во время транспортировки или во время хранения в аптеке часто связано с высокой стоимостью, так как охлаждающее оборудование необходимо внимательно контролировать, а вложение денег в надежное охлаждающее оборудование оказывается очень дорогостоящем. Кроме того, для удобства пациентов также предпочтительно, чтобы лекарственную форму можно было хранить при комнатной температуре.
Таким образом, в данной работе показано, что действительно возможно вводить аллергенные белки в состав быстродиспергируемой непрессованной лекарственной формы, которая терапевтически эффективна, без потребности в адъюванте. Такие содержащие аллерген твердые лекарственные формы, кроме того, стабильны при благоприятных условиях.
Когда аллергенные белки производят в виде быстродиспергируемой непрессованной лекарственной формы, преимуществом оказывается еще то, что полученная лекарственная форма по существу не высвобождает аллергены в окружающую среду или на субъекта, прикасающегося к лекарственной форме, при непосредственном контакте. Предшествующие непрессованные быстродиспергируемые твердые лекарственные формы характеризовались низкой механической прочностью по сравнению с прессованными таблетками, что обусловлено природой непрессованного матрикса, который является хрупким и ломким, почти подобно вафле. Во время, например, упаковки, хранения, транспортировки дозированной формы и манипуляций с ней пациентом оставшиеся частицы, содержащие аллерген, могут высвобождаться в окружающую среду и на пациента. Это оказывается особенно опасным, когда активный ингредиент представляет собой аллерген, так как аллерген может вызвать аллергическую реакцию у манипулирующего субъекта или индуцировать аллергическую реакцию, такую как сенсибилизация, или аллергический ответ в зависимости от дозы. Полагают, что максимально допустимые уровни для загрязнения окружающей среды в виде, например, аллергена в пыли зависят от рассматриваемого аллергена и должны составлять до 2 микрограммов основного аллергена на грамм домашней пыли (Allergy. Principles and practice (1993, 4 ed.), Mosby-Year book. Vol.I, стр.520).
Непрессованные быстродиспергируемые лекарственные формы, которые получают удалением жидкости из затвердевающей системы, содержащей вещества, образующие матрикс, активный ингредиент и другие возможные вещества, предпочтительно производят in situ. Способ производства in situ в основном включает в себя удаление растворителя из затвердевающей системы, состоящей из активного ингредиента и образующих матрикс наполнителей, в конечном контейнере, таком как блистер-упаковка. Способ in situ, используемый для коммерческих целей, не предусматривает общепринятого покрытия лекарственной формы. Применение покрытия лекарственной формы в большинстве случаев может оказывать влияние на диспергирование твердой лекарственной формы, таким образом, подвергая риску свойства лекарственной формы мгновенного высвобождения.
Поэтому, несмотря на противоположную природу упомянутых требований, в данной работе показано, что действительно возможно приготовить эффективные дозировки аллергенных белков в быстродиспергируемой непрессованной лекарственной форме, при достижении в то же время низкой хрупкости и поддержании способности быстро диспергировать.
Все из приведенных выше результатов подтверждены экспериментальной лабораторной работой или предклиническими экспериментами с использованием опытных животных, когда это требовалось, или клинических испытаний при необходимости.
Термин «быстродиспергируемая лекарственная форма» имеет отношение к лекарственным формам, которые дезинтегрируют приблизительно менее чем за 90 секунд, предпочтительно приблизительно менее чем за 60 секунд, предпочтительно менее чем за 30 секунд, более предпочтительно менее чем за 20, даже более предпочтительно приблизительно менее чем за 10 секунд в полости рта, еще более предпочтительно менее чем за 5 секунд и наиболее предпочтительно приблизительно менее чем за 2 секунды после введения в полость рта. Твердая лекарственная форма изобретения может быть в виде таблеток, капсул, лепешек или таблеток в форме капсулы.
Термин «непрессованный» относится к твердой лекарственной форме, которую готовят удалением жидкости из затвердевающей системы, содержащей вещества, образующие матрикс, активный ингредиент и другие подходящие ингредиенты, получая в результате содержащий аллерген твердый матрикс.
Термин «твердая лекарственная форма» относится к стандартной лекарственной форме, которая не является жидкостью или порошком, когда вводят в ротовую полость, таким образом, термин «твердые лекарственные формы» имеет отношение, например, к таблеткам, содержащим стандартную дозу активного ингредиента.
Термины «таблетки», «твердая лекарственная и вакцинная форма» используют взаимозаменяемо.
Термин «вещество, образующее матрикс» имеет отношение к любому фармацевтически подходящему растворимому в воде или диспергируемому в воде наполнителю, который будет служить в качестве носителя для активного ингредиента в твердой лекарственной форме.
Термин «наполнитель» имеет отношение к любому ингредиенту, который можно добавлять в препарат, помимо активного ингредиента.
Термин «потеря содержания аллергена в названной лекарственной форме» подразумевает, например, деградацию или инактивацию аллергена в лекарственной форме во время, например, хранения, транспортировки и применения. Потеря может быть установлена или как потеря в биологической активности/эффективности, или как утрата фактического содержания аллергена. Предпочтительно, потерю содержания аллергена определяют как потерю, по крайней мере, одного основного аллергена. Потерю, например, можно оценивать с помощью метода ELISA, описанного Obispo et al. (Allergy, 1997, 52, стр.806-813), используя аллергенспецифические реагенты.
Термин «потеря содержания аллергена из названной лекарственной формы» подразумевает, например, высвобождение аллергена в лекарственной форме во время, например, хранения, транспортировки и применения. Потеря может быть установлена или как потеря в биологической активности/эффективности, или как утрата фактического содержания аллергена. Предпочтительно, потерю содержания аллергена определяют как потерю, по крайней мере, одного основного аллергена. Потерю, например, можно оценивать с помощью метода ELISA, описанного Obispo et al. (Allergy, 1997, 52, стр.806-813), используя аллергенспецифические реагенты.
Термин «стабильная» имеет отношение к лекарственным формам, в которых снижение в содержании аллергена составляет менее 50% от исходного содержания после хранения в течение 3 месяцев при 25°С и 60% относительной влажности в конечном контейнере или в которых установлено снижение биологической активности/эффективности, или как потеря в содержании, по крайней мере, одного основного аллергена. Потерю, например, можно оценивать методом ELISA, как описано выше.
Термин «низкая хрупкость» относится к количеству аллергенсодержащего материала, которое утрачивается из лекарственной формы при воздействии на нее внешней силы. Твердая лекарственная форма обладает достаточной хрупкостью и прочностью, чтобы ее можно было транспортировать, хранить и перекладывать, если утраченный материал, содержащий аллерген, содержит менее 0,5 мкг экстракта аллергена или 0,05 мкг основного аллергена на твердую лекарственную форму. Для цели данного изобретения хрупкость можно оценивать по способу согласно данному изобретению.
«Прочность на разрыв 5» рассчитывают согласно следующему уравнению:
δ=3Wa×9,8Нмм-2/2d2b
где W - максимальная нагрузка на разрыв (кгс),
а - расстояние между носителями,
d - толщина быстродиспергируемой твердой лекарственной формы (мм),
b - диаметр быстродиспергируемой твердой лекарственной формы (мм).
«Максимальная нагрузка на разрыв» означает максимальную силу, требуемую для разрыва целой формы при испытании на трехточечный изгиб с использованием соответствующего инструмента (например, СТ5, Engineering Systems, I Loach Court, Radford Bridge Road, Nottingham NG8 1NA, UK).
Выражение «введение через слизистую оболочку полости рта» относится к способу введения, при котором лекарственную форму помещают под язык или куда-нибудь еще в полости рта, что позволяет активному ингредиенту контактировать со слизистой полости рта или глотки пациента для достижения местного или системного действия активного ингредиента. Примером способа введения через слизистую полости рта является сублингвальное введение.
Выражение «сублингвальное введение» подразумевает способ введения, при котором лекарственную форму помещают вниз под язык для достижения местного или системного действия активного ингредиента.
Термин «аллерген» имеет отношение к любому встречающемуся в природе белку или смесям белков, которые, как описывают, индуцируют аллергические, то есть опосредованные IgE, реакции при их повторном воздействии на индивидуума. Примеры встречающихся в природе аллергенов включают в себя пыльцевые аллергены (аллергены пыльцы дерева, сорняка, растений и трав), клещевые аллергены (например, клещей, живущих в домашней пыли, и клещей, живущих в хранилище), инсектицидные аллергены (летучие и происходящие из слюны и яда аллергены), животные аллергены из, например, слюны, волос и перхоти, например, собаки, кошки, лошади, крысы, мыши и так далее, грибковые аллергены и пищевые аллергены. Аллергены можно использовать в виде экстракта аллергена, очищенного аллергена, модифицированного аллергена, или рекомбинантного аллергена, или рекомбинантного мутантного аллергена, любого фрагмента аллергена, содержащего свыше 30 аминокислот, или любых их комбинаций.
Используемое в описании выражение «экстракт аллергена» имеет отношение к экстракту, полученному при экстракции биологического материала источника аллергена, как в основном описывают в "Allergenic extracts", H.Ipsen et al., chapter 20 in Allergy, principle and practise (Ed. S.Manning) 1993, Mosby-Year Book, St. Louis. Такой экстракт можно получать водной экстракцией растворимого в воде материала с последующими стадиями очистки, подобными фильтрации, чтобы получить раствор, то есть экстракт. Затем экстракт можно подвергать дальнейшей очистке и/или обработке, такой как сушка вымораживанием, при которой удаляют по существу всю воду. Вообще, экстракт аллергена содержит смесь белков и других молекул. Аллергенные белки часто классифицируют как основной аллерген, промежуточный аллерген, минорный аллерген или неклассифицируемый. Экстракт аллергена обычно содержит как основной, так и минорный аллергены. Основные аллергены обычно составляют приблизительно 5-15% среднего экстракта аллергена, чаще приблизительно 10%. Классификация аллергенов базируется на оценке клинического значения отдельного аллергена и представлена ниже. Примеры важных основных аллергенов, обнаруживаемых в экстракте, включают в себя аллергены травяной группы 1 и 5 и 6 (например. Phi p 1, 5 и 6), аллергены группы пылевых клещей 1 и 2 (например, Der p 1, Der p 2), аллерген пыльцы дерева 1 (Bet v 1), аллерген кедровой пыльцы 1 и 2 (например. Cry j 1, Cry j 2), аллерген пыльцы амброзии 1 и 2 (Amb a 1, Amb a 2), кошачий аллерген 1 (то есть Fel d 1). Средний аллергический субъект может сенсибилизироваться одним или более основными аллергенами и реагировать на один или более основных аллергенов, а в дальнейшем также может сенсибилизироваться минорными аллергенами и реагировать на них.
Количества экстракта аллергена, упоминаемые в описании, относятся к содержанию сухого вещества таких экстрактов аллергена.
Предпочтительно, содержание воды сухого вещества не превышает 10%, более предпочтительно 5% от массы.
Используемое в описании выражение «биологический материал источника аллергена» относится к любому биологическому материалу, содержащему один или более аллергенов. Примерами таких материалов являются клещевые РМВ (чистое туловище клеща) или WMC (культура целого клеща), обезжиренная или необезжиренная пыльца, например, трав, растений, сорняка и деревьев, волос и перхоти животных, кожа, грибницы и споры грибов, тела, яд или слюна насекомых и пищевые продукты.
Биологические материалы источника аллергена могут содержать загрязняющие материалы, такие как чужеродная пыльца и обрывки растений и цветов на материале источника аллергенной пыльцы.
Степень загрязнения следует минимизировать. Предпочтительно, содержание примесей не должно превышать 10% (мас./мас.) массы биологического материала источника.
Обычно экстракт аллергена содержит, по крайней мере, 10% белка от содержания сухого вещества экстракта аллергена, который определяют по стандартному методу исследования белка, такому как ВСА или метод Лоури, а остаток состоит из другого «небелкового материала», который может представлять собой компоненты, такие как липиды, углеводороды или связанная вода, которые происходят из биологического источника аллергена.
Экстракт аллергена можно приготовить и хранить в виде высушенного вымораживанием материала, полученного при сушке вымораживанием жидкого экстракта аллергена при давлении ниже 800 микробар и в течение периода до 100 часов удаления воды.
В области экстрактов аллергенов не существует никакого международного признанного способа стандартизации. Существует ряд единиц активности экстракта, то есть биоактивности. Применяемые способы и используемые единицы обычно оценивают содержание аллергена и биологическую активность. Примерами этого являются SQ-единицы (стандартизированные единицы качества), BAU (биологические единицы аллергена), BU (биологические единицы), UM (единицы массы), IU (международные единицы) и IR (показатель реактивности). Следовательно, если использовали экстракты источников, помимо тех, которые рассматривают в описании, их необходимо стандартизовать относительно рассматриваемого в описании экстракта для того, чтобы определить его активность в единицах SQ или любых упомянутых выше единицах. Предмет обсуждения рассматривают в "Allergenic extracts", H.Ipsen et al., chapter 20 in Allergy, principle and practise (Ed. S. Manning) 1993, Mosby-Year Book, St. Louis and Lowenstein H. (1980) Arb Paul Ehrlich Inst 75:122.
Биоактивность, то есть аллергенная активность in vivo, данного экстракта зависит от ряда факторов, наиболее важным фактором является содержание основных аллергенов в экстракте, которое изменяется в зависимости от состава биологического материала источника.
Количество экстракта аллергена в граммах, которое следует использовать для получения требуемой биоактивности, изменяется в зависимости от типа рассматриваемого экстракта, а для данного типа экстракта количество экстракта аллергена изменяется от одной партии к другой в зависимости от фактической биоактивности экстракта.
Для данной партии экстракта количество экстракта аллергена в граммах, которое следует использовать для получения требуемой биоактивности, можно установить, используя следующую процедуру:
а) Биоактивность различных количеств контрольного экстракта определяют, используя один или более иммунных тестов in vivo, чтобы установить зависимость между биоактивностью и количеством контрольного экстракта. Примерами названных иммунных тестов in vivo являются инъекционная кожная проба (SPT), конъюнктивальная провокационная проба (СРТ), бронхиальная провокационная проба аллергеном (ВСА) и различные клинические испытания, при которых следят за одним или более симптомами аллергии, смотрите, например, Haugaard et al., J Allergy Clin Immunol, Vol.91, No 3, pp. 709-722, March 1993.
b) На основании установленной зависимости между биоактивностью и количеством контрольного экстракта биоактивность одной или более соответствующих доз для применения в лекарственных формах изобретения выбирают при надлежащем рассмотрении баланса факторов: i) результат лечения или облегчения симптомов аллергии, ii) побочные эффекты, зарегистрированные в иммунных испытаниях in vivo, и iii) изменчивость i) и ii) от одного индивидуума к другому. Уравновешивают факторы, чтобы получить максимально адекватный терапевтический эффект без проявления неприемлемого уровня побочного действия. Способ установления равновесия факторов хорошо известен специалистам в данной области.
Биоактивность одной или более установленных соответствующих доз можно выражать в любых подходящих единицах биоактивности, таких как единицы SQ, BAU, IR и IU, сравните выше.
c) На основании контрольного экстракта готовят один или более биоактивных контрольных стандартных экстрактов и, если используют, величины единиц биоактивности контрольных стандартных экстрактов рассчитывают на основании величин единиц биоактивности, предназначенных для одной или более соответствующих доз, например, такой стандарт для BAU можно получить из FDA, что иллюстрируют ниже.
о.) На основании контрольных стандартных экстрактов каждого типа экстракта выбирают ряд параметров для оценки биоактивности экстрактов. Примерами таких оценочных параметров являются общая аллергенная активность, количество установленных основных аллергенов и полный молекулярный состав экстракта. Полную аллергенную активность можно оценивать, используя конкурентный иммуноанализ in vitro, такой как ELISA и иммунолюминесцентный анализ MagicLite® (LIA) с применением стандартизированной смеси антител, полученной против экстракта, полученного при использовании стандартных способов, например, антител, выращенных у мыши или кролика, или пула сыворотки аллергических пациентов. Содержание основных аллергенов можно, например, количественно определять с помощью ракетного иммуноэлектрофореза (RIE) и сравнивать с контрольными стандартами. Полный молекулярный состав можно исследовать, используя, например, перекрестный иммуноэлектрофорез (CIE) и электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE).
е) Что касается данной партии экстракта с неизвестной биоактивностью (тестируемый экстракт), количество экстракта, которое должно быть использовано для получения желаемого уровня биоактивности (эффективная доза для применения в твердой лекарственной форме согласно данному изобретению), можно установить следующим образом: по каждому выбранному оценочному параметру тестируемый экстракт сравнивают с контрольными стандартными экстрактами, используя соответствующие способы измерения, которые описаны выше, и на основании результатов измерения рассчитывают количество экстракта с желаемой биоактивностью.
SQ-единица: SQ-единицу определяют в соответствии со способом стандартизации "SQ-биоактивности" ALK-Abello A/S, по которому 100000 единиц SQ эквивалентны стандартной подкожной поддерживающей дозе. Обычно 1 мг экстракта содержит от 100000 до 1000000 единиц SQ в зависимости от источника аллергенов, из которого они происходят, и использованного способа производства. Точное количество аллергена можно установить с помощью иммуноанализа, то есть общее содержание основных аллергенов и общую аллергенную активность.
BAU (единицы биологического аллергена) представляет собой единицы биологической активности, которые определяют в соответствии с требованиями FDA для аллергенного продукта, изложенными в "Quantitative determination of relative potency of allergenic extracts" ("Methods of the allergen products testing Laboratory" "ELISA competition assay". Стр. 15, #49N-0012, FDA, October 1993). Доза 100000 единиц SQ, содержащаяся в травяном экстракте, соответствует содержанию 2600-4700 BAD согласно вышеприведенному способу. Аналогично, другие экстракты можно оценивать в соответствии с вышеприведенным способом.
Выражение «эффективная доза аллергена для десенсибилизации» будет означать дозу, которая, когда применяют один раз или неоднократно в монодозе или с возрастающими дозами, приводит, например, к адаптивному иммунному ответу и, таким образом, служит средством для гипосенсибилизации аллергических пациентов. Предпочтительно, выражение должно означать количество аллергена в каждой лекарственной форме, необходимое, чтобы индуцировать адаптивный иммунный ответ после неоднократного введения названных твердых лекарственных форм в соответствии со схемой лечения (в течение периода, колеблющегося от нескольких применений до, по крайней мере, одного ежедневного применения в течение нескольких месяцев). Предпочтительно, десенсибилизация включает в себя ослабление симптомов аллергии при введении дозы. Клинические симптомы аллергии включают в себя ринит, конъюнктивит, астму, крапивницу, экзему, которые охватывают реакции на коже, глазах, в носу, верхних и нижних дыхательных путях, с общими симптомами, такими как покраснение и зуд глаз и носа, зуд и выделения из носа, сопутствующая ноющая боль, затруднение дыхания, одышка, зуд и припухлость ткани.
Используемое в описании выражение «однородность содержания» относится к изменчивости доз от установленной дозы.
Используемое выражение «содержание воды» относится к содержанию оставшейся воды в твердой стандартной лекарственной дозированной форме, которую количественно определяют, используя принцип титрования Карла Фишера. Названный способ основан на принципе, что данное количество Is приводит к трансформации эквивалентного количества воды (Европейская фармакопея (ЕР), 3-е издание, 2.5.12).
Используемый термин «активность воды aw» относится к действующей воде в образце. Измерения активности воды проводят, применяя способы, известные специалистам в данной области, например, определением точки конденсации на поверхности охлажденного зеркала, определением с помощью детекторов относительной влажности, которая изменяет электрическую резистентность или емкостное сопротивление, или используя электрод с хлоридом лития:
aw можно рассчитывать в соответствии со следующим уравнением:
aw=p/ps=ERH(%)/100
где
р - парциальное давление водяного пара на поверхности продукта,
ps - давление насыщения или парциальное давление водяного пара вокруг чистой воды при температуре продукта,
ERH - равновесная относительная влажность.
Термин «около» или «приблизительно» означает в пределах подходящего диапазона для определенной величины, установленного любым специалистом в данной области, который будет зависеть отчасти от того, как величину измеряют или определяют, например, от ограничений системы измерения. Например, «около» может означать диапазон вплоть до 20%, предпочтительно вплоть до 10%, более предпочтительно вплоть до 5% и еще более предпочтительно вплоть до 1% данной величины.
В настоящее время показано, что твердая лекарственная форма согласно изобретению представляет собой фармацевтическое аллергенное изделие, вводимое через слизистую полости рта, которое обеспечивает эффективные дозы аллергена, вызывающие аллергенспецифический иммунный ответ в зависимости от дозы и проявляющие допустимые побочные эффекты.
Кроме того, обнаружено, что действительно возможно производить непрессованную быстродиспергируемую твердую лекарственную форму с низкой хрупкостью, содержащую аллергены, которая является достаточно прочной и не высвобождает вредные количества остатка при использовании пациентом.
Кроме того, установлено, что названные препараты стабильны при комнатной температуре.
Аллергены в различной степени особенно чувствительны к деградации в водной среде, такой как водный раствор аллергена, или в продукте с высоким содержанием воды и/или высокой активностью воды.
В монографии Европейской фармакопеи, касающейся продуктов аллергенов и в "Note for guidance on allergen products", CPMP (Лондон, 13 марта 1996 г.) заявляют, что уровни влаги не должны превышать 5% для высушенных вымораживанием продуктов (то есть экстрактов аллергенов в ампулах), а продукты следует хранить в замороженном виде (-20°С). Хранение в охлажденном состоянии (2-8°С) также является требованием для жидких сублингвальных препаратов, которые, кроме того, имеют ограниченный срок хранения. Обнаружено, что аллергены, включая неустойчивые аллергены, стабильны в условиях комнатной температуры. Даже лекарственные формы согласно изобретению, имеющие содержание воды свыше предписанного максимального уровня 5%, стабильны при комнатной температуре. Не обращаясь к теории, этот факт можно объяснить тем, что наполнители быстродиспергируемой твердой лекарственной формы связывают оставшуюся воду в лекарственной форме и снижают активность воды твердой лекарственной формы, содержащей аллерген. Следовательно, при снижении активности воды препарата оказывается возможным получить стабильный препарат без деградации аллергена, даже если содержание воды выше, чем максимальный уровень 5%, который установлен для экстрактов аллергенов в ампулах.
Активность воды представляет собой важный фактор, способствующий хранению продукта. Хорошо известно, что активность воды продукта оказывает влияние на рост бактерий, а также на стабильность, эффективность и консистенцию фармацевтического препарата. Также на стабильность белка оказывает значительное влияние активность воды, вследствие относительно хрупкой природы белков. Большинство белков должно поддерживать конформацию, чтобы сохранить активность. Поддержание низких уровней активности воды помогает предотвратить конформационные изменения или способствовать конформационным изменениям, которые впоследствии оказываются важными для обеспечения того, что белок в виде аллергена стабилен. Также на гидролитическую деградацию белков, или вызванную ферментами, или нет, влияет активность воды.
Кроме того, полагают, что содержание воды будет оказывать влияние на механическую прочность твердых лекарственных форм. Вообще, высокие величины будут увеличивать риск, что твердая лекарственная форма станет более разжиженной, тогда как более низкая величина будет влиять на прочность твердой лекарственной формы, например, твердая лекарственная форма станет более хрупкой и ломкой.
Измерения активности воды проводят, используя способы, известные специалистам в данной области, например, определением точки конденсации на поверхности охлажденного зеркала, определением с помощью детекторов относительной влажности, которая изменяет электрическую резистентность или емкостное сопротивление, или используя электрод с хлоридом лития.
Активность воды твердой лекарственной формы предпочтительно не превышает 0,70 и предпочтительно составляет от 0,1 до 0,7, более предпочтительно составляет от 0,2 до 0,6, более предпочтительно от 0,3 до 0,5 и наиболее предпочтительно составляет от 0,4 до 0,5.
Содержание воды твердой лекарственной формы, определенное согласно способу, описанному в примере 1, предпочтительно не превышает 25% и предпочтительно составляет 0,1-20%, более предпочтительно составляет от 0,5 до 15%, более предпочтительно составляет 2-8%, более предпочтительно составляет 4-7%, наиболее предпочтительно составляет от 4,5 до 6% воды.
Согласно одному воплощению изобретения аллергенное фармацевтическое изделие обеспечивают в виде быстродиспергируемой твердой лекарственной формы, которая быстро растворяется в полости рта при контакте со слюной, следовательно, приводя аллерген в тесный контакт с соответствующей иммунной тканью, слизистой оболочкой, и позволяя аллергену направляться к ней. Примеры встречающихся в природе аллергенов включают в себя пыльцевые аллергены (аллергены пыльцы дерева, растения, сорняка и травы), аллергены насекомых (летучие аллергены, аллергены слюны и яда, например, аллергены клещей, аллергены тараканов и мелких двукрылых насекомых, аллергены яда перепончатокрылых), аллергены волос и перхоти животных (например, собаки, кошки, лошади, крысы, мыши и так далее) и пищевые аллергены. Важными пыльцевыми аллергенами деревьев, трав и растений являются аллергены, происходящие от таксономических отрядов Fagales, Oleales, Finales и Platanaceae, включая, например, березу (Betula), ольху (Ainus), лещину (Corylus), граб (Carpinus) и маслину (Olea), кедр (Cryptomena и juniperus), платановое дерево (Platanus), отряда Poales, включая, например, травы рода Lolium, Phleum, Poa, Cynodon, Dactylis, Holcus, Phalaris, Secale и Sorghum, отрядов Asterales и Urtlcales, включая, например, растения рода Ambrosia, Artemisia и Parietaria. Другими важными вдыхаемыми аллергенами являются аллергены клещей, живущих в домашней пыли, рода Dermatophagoides и Euroglyphus, клещей хранилищ, например, Lepidoglyphys, Glycyphagus и Tyrophagus, аллергены тараканов, мелких двукрылых насекомых и блох, например, Blatella, Periplaneta, Chironomus и Ctenocepphalides, и аллергены млекопитающих, таких как кошка (род Felis), собака (род Canis), корова (род Bos) и лошадь (род Equus), аллергены ядов, включая аллергены, происходящие от жгущих и жалящих насекомых, таких как представители таксономического отряда Hymenoptera, включая пчел (суперсемейство Apidae), ос (суперсемейство Vespidea) и муравьев (суперсемейство Formicoidae). Важными вдыхаемыми аллергенами грибов являются, например, аллергены, происходящие от рода Alternaria и Cladosporium.
В более предпочтительном воплощении изобретения аллергенами являются Bet v 1, Ain g 1, Cor а 1 и Car b 1, Que a 1, Cry j 1, Cry j 2, Cup a 1, Cup s 1, Jun a 1, Jun a 2, jun a 3, Ole e 1, Lig v 1, Pla I 1, Pla a 2, Amb a 1, Amb a 2, Amb t 5, Art v 1, Art v 2, Par j 1, Par j 2, Par j 3, Sal k 1, Ave e 1, Cyn d 1, Cyn d 7, Dac g 1, Fes p 1, Hol I 1, Lol p 1 и 5, Pha a 1, Pas n 1, Phl p 1, Phl p 5, Phl p 6, Poa p 1, Poa p 5, Sec с 1, Sec с 5, Sor h 1, Der f 1, Der f 2, Der p 1, Der p 2, Der p 7, Der m 1. Eur m 2, Gly d 1, Lep d 2, Blo t 1, Tyr р 2, Bla g 1, Bla g 2. Per a 1, Fel d 1, Can f 1, Can f 2, Bos d 2, Equ с 1, Equ с 1. Equ с 3, Mus m 1, Rat n 1, Apis m 1, Api m 2, Ves v 1, Ves v 2. Ves v 5, Dol m 1, Dol m 2, Dol m 5, Pol a 1, Pol a 2, Pol a 5, Sol i 1, Sol i 2, Sol i 3 и Sol I 4, Alt a 1, Cla h 1, Asp f 1. Bos d 4, Mal d 1, Gly m 1, Gly m 2, Gly m 3, Ara h 1, Ara h 2. Ara h 3, Ara h 4, Ara h 5 или смешанные гибриды любых из перечисленных аллергенов от Molecular Breeding (Maxygen, Inc.).
В наиболее предпочтительном воплощении изобретения аллерген представляет собой аллерген пыльцы трав, или аллерген клеща, живущего в пыли, или аллерген амброзии, или аллерген кедровой пыльцы, или кошачий аллерген, или березовый аллерген.
В еще одном воплощении изобретения быстродиспергируемая твердая лекарственная форма содержит, по крайней мере, два разных типа аллергенов, или происходящих из одного и того же источника аллергенов, или происходящих из различных источников аллергенов. Например, быстродиспергируемая твердая лекарственная форма содержит аллергены травяной группы 1, травяной группы 2/3, травяной группы 5 и травяной группы 6 и клещевые аллергены группы 1 и группы 2 различных видов клещей и трав, соответственно, аллергены сорняков, подобные аллергенам низкой и гигантской амброзии, аллергены различных грибов, подобных Alternaria и Cladosporium, аллергены деревьев, такие как аллергены березы, лещины, граба, дуба и ольхи, пищевые аллергены, такие как аллергены арахиса, бобов сои и молока.
Аллерген, включенный в быстродиспергируемую твердую лекарственную форму, может быть в виде экстракта, очищенного аллергена, модифицированного аллергена, рекомбинантного аллергена или мутанта рекомбинантного аллергена. Экстракт аллергена, по природе, может содержать одну или более изоформ того же самого аллергена, тогда как рекомбинантный аллерген обычно представляет собой исключительно одну изоформу аллергена. В предпочтительном аспекте аллерген представляет собой экстракт. В другом предпочтительном воплощении аллергеном является рекомбинантный аллерген. В следующем предпочтительном воплощении аллергеном является встречающийся в природе небольшой IgE-связывающий мутант или рекомбинантный небольшой IgE-связывающий мутант.
Аллергены могут присутствовать в эквимолярных количествах, или соотношение присутствующих аллергенов предпочтительно можно изменять вплоть до 1:20.
В следующем воплощении изобретения небольшой IgE-связывающий аллерген является аллергеном согласно WO 99/47680, или WO 02/40676, или PCT/DK 03/00322 ("Allergen mutants").
Существует несколько лабораторных методик для характеристики аллергена. Наиболее широко используемыми способами являются электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), изоэлектрическое фокусирование (IEF), перекрестный иммуноэлектрофорез (CIE) и ракетный иммуноэлектрофорез (RIE). Количественное определение индивидуальных аллергенов можно проводить с помощью целого ряда способов количественного иммуноэлектрофореза (QIE), радиальной иммунодиффузии (RIE) или твердофазного иммуноферментного анализа (ELISA). Определение общей аллергенной активности наиболее часто осуществляют с помощью радиоаллергосорбентного теста (RAST), анализа Magic Lite (LIA) или родственных способов. Также можно использовать способы на основе анализа ELISA.
Руководство по обычно применяемым подходящим способам определения биоактивности имеется, например, в Note for Guidance on Allergen Product; The European Agency for the Evaluation of Medicinal Product, CPMP_BWP_243_96, London, 1996.
Классификацию аллергена как основного аллергена можно осуществить по некоторым тестам. Аллерген обычно классифицируют как основной аллерген, если, по крайней мере, 25% пациентов демонстрируют сильное IgE-связывание (показатель 3) и, по крайней мере, умеренное связывание (показатель 2) из 50% пациентов, связывание определяют с помощью CRIE (перекрестный радиоиммуноэлектрофорез). (Сильное связывание при CRIE, то есть видимое IgE-связывание на рентгеновской пленке через день; умеренное связывание при CRIE, то есть связывание через 3 дня; слабое связывание при CRIE, то есть связывание через 10 дней). При сильном IgE-связывании, по крайней мере, у 10% пациентов аллерген классифицируют как промежуточный аллерген, и при несомненно специфическом связывании у менее 10% пациентов аллерген классифицируют как минорный аллерген. Другие способы также можно использовать для определения связывания IgE, например, IgE-блот.
При классической с возрастающей дозой десенсибилизации, при которой дозу аллергена в виде быстродиспергируемой твердой лекарственной формы увеличивают до определенного максимума, предпочтительная активность стандартной дозы лекарственной формы составляет 150-1000000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 500-500000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 500-375000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 2500-375000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 2500-250000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 25000-250000 SQ-ед./лекарственную форму, более предпочтительно 25000-125000 SQ-ед./лекарственную форму, более предпочтительно 25000-100000 SQ-ед./лекарственную форму и наиболее предпочтительная активность составляет 25000-75000 SQ-ед./лекарственную форму.
В другом воплощении изобретения твердая лекарственная форма представляет собой неоднократно вводимую монодозу, предпочтительно в диапазоне 2500-375000 SQ-ед./лекарственную форму, более предпочтительно 2500-250000 SQ-ед./лекарственную форму, более предпочтительно 25000-250000 SQ-ед./лекарственную форму, более предпочтительно 25000-125000 SQ-ед./лекарственную форму, еще более предпочтительно 25000-100000 SQ-ед./лекарственную форму и наиболее предпочтительно 25000-75000 SQ-ед./лекарственную форму.
В особо предпочтительном воплощении твердая лекарственная форма содержит экстракт травяного аллергена, в которой активность составляет 150-1000000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 500-500000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 500-375000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 2500-375000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 2500-250000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 25000-250000 SQ-ед./лекарственную форму, более предпочтительная активность составляет 25000-125000 SQ-ед./лекарственную форму, еще более предпочтительная активность составляет 25000-100000 SQ-ед./лекарственную форму и наиболее предпочтительная активность составляет 25000-75000 SQ-ед./лекарственную форму.
В еще одном воплощении активность твердой лекарственной формы согласно изобретению составляет приблизительно 5-50000 BAU/лекарственную форму, более предпочтительная активность составляет 15-25000 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 15-17600 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 65-17600 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 65-15000 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 650-15000 BAU/лекарственную форму, более предпочтительная активность составляет 650-6000 BAU/лекарственную форму, еще более предпочтительная активность составляет 650-4700 BAU/лекарственную форму и наиболее предпочтительная активность составляет 650-3500 BAU/лекарственную форму.
В другом воплощении изобретения твердая лекарственная форма представляет собой неоднократно вводимую монодозу предпочтительно в диапазоне приблизительно 65-17600 BAU/лекарственную форму, более предпочтительно приблизительно 65-15000 BAU/лекарственную форму, более предпочтительно приблизительно 650-15000 BAU/лекарственную форму, более предпочтительно 650-6000 BAU/лекарственную форму, даже более предпочтительно 650-4700 BAU/лекарственную форму, наиболее предпочтительно 650-3500 BAU/лекарственную форму.
В особо предпочтительном воплощении твердая лекарственная форма содержит экстракт травяного аллергена, активность которого составляет приблизительно 5-50000 BAU/лекарственную форму, более предпочтительно активность составляет 15-25000 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 15-17600 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 65-17600 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 65-15000 BAU/лекарственную форму, более предпочтительно активность составляет приблизительно 650-15000 BAU/лекарственную форму, более предпочтительно 650-6000 BAU/лекарственную форму, более предпочтительно 650-4700 BAU/лекарственную форму, наиболее предпочтительно 650-3500 BAU/лекарственную форму.
Обычно 1 мг экстракта аллергена содержит от 100000 до 1000000 SQ-единиц. Это означает, что 1000000 SQ содержатся в от 1 мг экстракта до 10 мг экстракта аллергена и что 100000 SQ содержатся в от 0,1 мг экстракта до 1 мг экстракта аллергена. Аналогичным образом, любую SQ-дозу можно перевести в диапазон доз экстракта аллергена. На этом основании, вышеприведенные диапазоны доз, представленных в SQ, можно пересчитать в диапазоны доз в мг или мкг экстракта аллергена, причем для более низкого предела SQ диапазона используют более низкий предел соответствующего диапазона экстракта аллергена, а для верхнего предела SQ диапазона используют верхний предел соответствующего диапазона экстракта аллергена.
Таким образом, в следующем воплощении твердая лекарственная форма согласно изобретению имеет содержание экстракта аллергена приблизительно 0,15 мкг - 10 мг/лекарственную форму, более предпочтительно содержание экстракта аллергена составляет приблизительно 0,5 мкг - 5 мг/лекарственную форму, более предпочтительно содержание экстракта аллергена приблизительно 0,5 мкг - 3,75 мг/лекарственную форму, более предпочтительно содержание экстракта аллергена приблизительно 2,5 мкг - 3,75 мг/лекарственную форму, более предпочтительно содержание экстракта аллергена приблизительно 2,5 мкг - 2,5 мг/лекарственную форму, более предпочтительно содержание экстракта аллергена приблизительно 25 мкг - 2,5 мг/лекарственную форму, более предпочтительно приблизительно 25 мкг - 1,25 мг/лекарственную форму, даже более предпочтительно приблизительно 25 мкг - 1 мг/лекарственную форму, наиболее предпочтительно приблизительно 25 мкг - 0,75 мг/лекарственную форму.
В другом воплощении изобретения твердая лекарственная форма представляет собой неоднократно вводимую монодозу предпочтительно в пределах диапазона приблизительно 2,5 мкг - 3,75 мг/лекарственную, более предпочтительно 2,5 мкг - 2,5 мг/лекарственную форму, более предпочтительно приблизительно 25 мкг - 2,5 мг/лекарственную форму, более предпочтительно приблизительно 1,5 мкг - 1,25 мг/лекарственную форму, еще более предпочтительно приблизительно 25 мкг - 1 мг/лекарственную форму, наиболее предпочтительно приблизительно 25 мкг - 0,75 мг/лекарственную форму.
В следующем воплощении в твердой лекарственной форме согласно изобретению содержание основного аллергена составляет приблизительно 0,015 мкг - 1 мг/лекарственную форму, более предпочтительно приблизительно 0,05 мкг - 500 мкг/лекарственную форму, более предпочтительно приблизительно 0,05 мкг - 375 мкг/лекарственную форму, более предпочтительно приблизительно 0,25 мкг - 375 мкг/лекарственную форму, более предпочтительно приблизительно 0,25 мкг - 250 мкг/лекарственную форму, более предпочтительно приблизительно 2,5 мкг - 250 мкг/лекарственную форму, более предпочтительно 2,5 мкг - 125 мкг/лекарственную форму, еще более предпочтительно приблизительно 2,5 мкг - 100 мкг/лекарственную форму, наиболее предпочтительно приблизительно 2,5 мкг - 75 мкг/лекарственную форму.
В другом воплощении изобретения твердая лекарственная форма представляет собой неоднократно вводимую монодозу предпочтительно в пределах диапазона 0,25 мкг - 375 мкг/лекарственную форму, более предпочтительно приблизительно 0,25 мкг - 250 мкг/лекарственную форму, более предпочтительно приблизительно 2,5 мкг - 250 мкг/лекарственную форму, более предпочтительно приблизительно 2,5 мкг - 125 мкг/лекарственную форму, даже более предпочтительно приблизительно 2,5 мкг - 100 мкг/лекарственную форму, наиболее предпочтительно приблизительно 2,5 мкг - 75 мкг/лекарственную форму.
Содержание основных аллергенов может быть составлено несколькими основными аллергенами в зависимости от источника рассматриваемых аллергенов. Обычно количество основных аллергенов соответствует диапазону 1-10, большей частью 1-5.
Основной аллерген может содержаться в экстракте аллергена или быть получен рекомбинантно. Рекомбинантные основные аллергены можно применять в тех же количествах, как в экстрактах аллергенов, содержащих такой основной аллерген, или в более высоких дозах. Считают, что более высокие дозы являются более эффективными, но, как полагают, они связаны с риском возможно более частых или более тяжелых побочных эффектов.
В следующем предпочтительном воплощении основные аллергены включают в себя травяной аллерген группы 1, например, phi p 1, lol p 1, sor h 1, dac g 1, суп d 1, hoi 1 1, pha a 1, травяной аллерген группы 2/3, например, phi p 2/3, lol p 2/3, травяной аллерген группы 5, например, phi p 5, lol p 5, dac g 5, poa p 5, травяной аллерген группы 6, например, phi p 6, poa p 6, аллерген пыльцы дерева группы 1, например, bet v I, ain g 1, cor a 1, car b 1, клещевой аллерген группы 1, например, der p 1, der f 1, eur m 1, клещевой аллерген группы 2, например, der p 2, der f 2, eur m 2, кошачий аллерген, например, fel d 1, кедровые аллергены группы 1 и группы 2, например, cry j 1, cry j 2, аллерген пыльцы низкой и гигантской амброзии, например, amb a I, amb a 2, amb 1, amb t 2.
Эффект доза-ответ установлен, сравните с примером 6, для твердых лекарственных форм, содержащих аллергены, которые вводят через слизистую полости рта. Когда индивидуумы с повышенной чувствительностью представляют собой неоднородную группу субъектов, проявляющих различные симптомы и разную степень тяжести их симптомов при воздействии даже того же самого аллергена, эффективные дозы могут отличаться. Некоторые пациенты могут переносить более высокие дозы, не испытывая неприемлемые подобные эффекты, тогда как другие проявляют повышенную чувствительность. В некоторых случаях можно назначать возрастающие дозы для достижения высоких уровней доз, так как обычно считают, что более высокие дозы являются более эффективными. Предполагают, что для большинства из средней аллергической популяции эффективная доза аллергена согласно данному изобретению предпочтительно будет составлять от 65 BAU/лекарственную форму до 17600 BAU/лекарственную форму, однако дозу до 4 и вплоть до 47000 BAU можно применять для других пациентов с аллергией. В равной степени доза экстракта аллергена 0,5 мкг - 3,75 мг/лекарственную форму или доза с содержанием основного аллергена 0,05 мкг - 375 мкг/лекарственную форму может быть подходящей для среднего аллергического индивидуума.
Для гипоаллергенных вариантов основных аллергенов, то есть аллергенов со сниженной способностью вызывать немедленную или позднюю фазу аллергических реакций, лекарственная форма согласно изобретению предпочтительно содержит в 10-100 раз больше основного аллергена на лекарственную форму. Такие гипоаллергенные варианты могут быть рекомбинантного или естественного происхождения.
Содержание аллергена твердой лекарственной формы согласно изобретению можно определять с помощью обычных иммунных анализов, таких как CIE (перекрестный иммунный электрофорез), RIE (радиоимммуноэлектрофорез) и SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) и с помощью иммуноанализов, таких как ELISA и специфического IgE-анализ Magic Lite (LIA), против компонентов экстракта, таких как основные аллергены.
Для того, чтобы обеспечить достаточный срок хранения конечного продукта, предпочтительными являются лекарственные формы, которые значительно не изменяются после изготовления в отношении физических и химических свойств, например, активности и содержания аллергена, механической прочности и органолептических свойств.
Для цели данного изобретения стабильность активного ингредиента, то есть аллергена, оценивают по содержанию основного аллергена. Кроме того, стабильность также предпочтительно оценивают посредством определений активности аллергена, такой как общая аллергенная активность.
Выражения «исходная аллергенная активность» или «исходное содержание, по крайней мере, одного основного аллергена» твердой лекарственной формы означают величину «аллергенной активности» или «содержание, по крайней мере, одного основного аллергена в конечной лекарственной форме после окончания процесса производства.
Выражения «теоретическая аллергенная активность» или «теоретическое содержание, по крайней мере, одного основного аллергена» твердой лекарственной формы означают величину «аллергенной активности» или «содержание, по крайней мере, одного основного аллергена» дозы добавленного аллергена, например, в виде экстракта, перед тем как приготовить в виде твердой лекарственной формы.
Потеря в содержании аллергена, по крайней мере, одного основного аллергена предпочтительно составляет менее 50% общего исходного содержания, более предпочтительно менее 30% общего исходного содержания, более предпочтительно менее 20% общего исходного содержания, более предпочтительно менее 15% исходного содержания, более предпочтительно менее 10% первоначального содержания, более предпочтительно менее 5% исходного содержания, еще более предпочтительно менее 2% исходного содержания.
Кроме того, потеря в общей аллергенной активности согласно изобретению, описанная в примере 1, предпочтительно должна быть менее 50% общей исходной активности, более предпочтительно менее 30% общей исходной активности, более предпочтительно менее 20% общей исходной активности, более предпочтительно менее 15% общей исходной активности.
Обычно тестирование стабильности проводят в соответствии с соответствующими руководствами ICH (например, общий курс ICH ICQ/Q1AR2 (адаптированный СРМР, март 2003 г., изданный как CPMP/ICH/2736/99)) и FDA. Условия тестирования стабильности часто упоминают как условия зон 1-4. Зона 1 и 2 представляет климатические условия в ЕС, Японии и США. Обычно твердые лекарственные формы согласно данному изобретению в конечном контейнере должны быть стабильны предпочтительно, по крайней мере, в течение 3 месяцев, более предпочтительно, по крайней мере, в течение 6 месяцев, более предпочтительно, по крайней мере, в течение 12 месяцев, даже более предпочтительно, по крайней мере, в течение 18 месяцев, наиболее предпочтительно, по крайней мере, в течение 2 лет при «долгосрочных» условиях 25°С/60 относительной влажности, более предпочтительно при промежуточном условии 30°С/65 относительной влажности, даже более предпочтительно при «ускоренных условиях» 40°С/75 относительной влажности.
Чтобы гарантировать, что твердая лекарственная форма будет достаточно прочной во время хранения и при использовании пациентом, лекарственная форма должна обладать определенной резистентностью к внешней силе, но в то же время твердая лекарственная форма должна быстро дезинтегрировать во рту.
Таким образом, чтобы подтвердить стабильность активного ингредиента, то есть твердые лекарственные формы, содержащие аллерген, также можно производить оценку по дополнительным параметрам, таким как механическая прочность, такой как хрупкость, прочность на разрыв и максимальная нагрузка на разрыв. Кроме того, стабильность твердых лекарственных форм можно оценивать по физическим свойствам, таким как время дисперсии и органолептические свойства, такие как внешний вид лекарственной формы.
Названные параметры можно оценивать, например, по определению максимальной нагрузки на разрыв или прочности на разрыв твердых лекарственных форм данного изобретения. Из уравнения, по которому можно рассчитывать прочность на разрыв, очевидно, что полученная величина прочности на разрыв зависит от ряда параметров, которые подвержены изменениям. Например, толщина или диаметр твердой лекарственной формы будут содействовать изменению величины. Поэтому полагают, что максимальная нагрузка на разрыв является даже более точным параметром для оценки прочности твердых лекарственных дозированных стандартных форм данного изобретения.
В одном воплощении твердая лекарственная форма имеет максимальную нагрузку на разрыв не менее 0,05 кгс и ниже 0,9 кгс. Предпочтительными являются лекарственные формы, которые имеют максимальную нагрузку на разрыв, которая составляет 0,05-0,9 кгс, более предпочтительно 0,1-0,8 кгс, наиболее предпочтительно 0,1-0,6 кгс.
В следующем воплощении данного изобретения твердая лекарственная форма имеет прочность на разрыв менее 1,0 Н/мм2, более предпочтительно ниже 0,9 Н/мм2.
Предпочтительно быстродиспергируемая лекарственная форма дезинтегрирует мгновенно или быстро в полости рта при контакте со слюной для того, чтобы обеспечить максимальное воздействие аллергена на иммунокомпетентную ткань слизистой до проглатывания. В предпочтительном воплощении твердая лекарственная форма дезинтегрирует приблизительно менее чем за 90 секунд, предпочтительно менее чем за 60 секунд, предпочтительно менее чем за 30 секунд, более предпочтительно приблизительно менее чем за 20, более предпочтительно приблизительно менее чем за 15 секунд, даже более предпочтительно приблизительно менее чем за 10 секунд в полости рта, даже более предпочтительно приблизительно менее чем за 5 секунд, наиболее предпочтительно приблизительно менее чем за 2 секунды в полости рта.
В предпочтительном воплощении изобретения композиции изобретения представляют собой быстродиспергируемые твердые лекарственные формы, заключающие в себе сетчатый полимер из аллергена и любого растворимого в воде или диспергируемого в воде матрикса. Сетку получают сублимацией растворителя из смеси в твердом состоянии, смесь содержит раствор аллергена и матрикса. Более предпочтительно сетку получают при лиофилизации.
Фармацевтически подходящие наполнители, образующие часть матрикса в быстродиспергируемой твердой лекарственной форме согласно изобретению, являются образующими матрикс веществами и, кроме того, другими подходящими наполнителями, такими как антациды, разбавители, мукоадгезивные вещества, вкусовые вещества, маскирующие вкус вещества, консерванты, антиоксиданты, поверхностно-активные вещества, усилители вязкости, красители, модификаторы рН, подсластители и так далее. Все перечисленные наполнители выбирают в соответствии с общепринятой фармацевтической практикой по принципу, понятному специалистам в области приготовления терапевтических средств, содержащих аллерген.
Образующие матрикс вещества, подходящие для применения согласно данному изобретению, включают в себя наполнители, полученные из животных или растительных белков, таких как желатины/декстрины и соя, белков семян пшеницы и листоблошки; смолы, такие как аравийская камедь, гуар, агар и ксантан; полисахариды; крахмал и модифицированный крахмал, алигнаты; карбоксиметилцеллюлозу; карагены; декстраны; пектины; синтетические полимеры, такие как поливинилпирролидон; и полипептид/белковые или полисахаридные комплексы, такие как комплексы желатин-аравийская камедь. Желатины представляют собой гетерогенную смесь растворимых в воде коллоидных макромолекул. Такие гетерогенные смеси среднего молекулярно-массового распределения можно получать при гидролитическом действии на богатый коллагеном материал животного происхождения, такой как кость, кожа, сухожилия, связки и так далее. Желатины можно получать из млекопитающих, например, крупного рогатого скота, свиньи, или не млекопитающих, например, тепловодных или холодноводных рыб. Желатины могут быть гидролизованными или негидролизованными, поперечносшитыми или непоперечносшитыми. Кроме того, они могут быть загущающего или незагущающего типа, желатины незагущающего типа обычно получают из холодноводных рыб. В другом особом воплощении используют крахмал. Крахмалы представляют собой сложные смеси углеводородных полимеров.
Другие образующие матрикс вещества, подходящие для применения согласно данному изобретению, включают в себя сахара, такие как маннит, декстроза, лактоза, галактоза и трегалоза;
циклические сахара, такие как циклодекстрин; неорганические соли, такие как фосфат натрия, хлорид натрия и силикат алюминия;
и аминокислоты, содержащие от 2 до 12 атомов углерода, такие как глицин, L-аланин, L-аспарагиновая кислота, L-глутаминовая кислота, L-гидроксипролин, L-изолейцин, L-лейцин и L-фенилаланин.
Твердая лекарственная форма предпочтительно содержит, по крайней мере, приблизительно 50% мас./мас., по крайней мере, одного образующего матрикс вещества дозированного раствора. Термин «дозированный раствор», используемый в данном контексте, означает нетвердый объем препарата веществ, образующих матрикс, аллергена и других возможных наполнителей, который получают перед стадией затвердевания.
В одном воплощении изобретения дозированный раствор для образования твердой лекарственной формы содержит приблизительно 5-30% мас./мас., более предпочтительно приблизительно 5-20% мас./мас., даже более предпочтительно приблизительно 5-12% мас./мас., по крайней мере, одного образующего матрикс вещества.
Потребность в количестве сухого вещества дозированного раствора также зависит от размеров таблетки. Предпочтительно твердые лекарственные формы согласно данному изобретению имеют диаметр от приблизительно 3 до приблизительно 30 мм, более предпочтительно от приблизительно 5 до приблизительно 20 мм. Предпочтительно твердые лекарственные формы согласно данному изобретению имеют массу от приблизительно 1 до приблизительно 100 мг, более предпочтительно от приблизительно 10 до приблизительно 50 мг, наиболее предпочтительно от приблизительно 25 до приблизительно 35 мг. Предпочтительно твердые лекарственные формы согласно данному изобретению имеют высоту от приблизительно 0,5 до приблизительно 7,5 мм, более предпочтительно от приблизительно 1 до приблизительно 5 мм.
Установлено, что быстродиспергируемая твердая лекарственная форма, содержащая рыбий желатин и маннит в качестве образующих матрикс наполнителей, имеет преимущество в отношении стабильности, внешнего вида, низкой хрупкости, прочности на разрыв, максимальной нагрузки на разрыв и вкуса во рту. В предпочтительном воплощении быстродиспергируемые твердые лекарственные формы содержат сетчатый полимер из аллергена и веществ, образующих матрикс, таких как рыбий желатин и маннит. Для того чтобы получить сетчатый полимер, следует регулировать соотношение рыбьего желатина к манниту. В предпочтительном воплощении соотношение рыбьего желатина к манниту составляет от приблизительно 2:20 до приблизительно 20:1, более предпочтительно от приблизительно 2:10 до приблизительно 10:1, наиболее предпочтительно от приблизительно 3:5,5 до приблизительно 6,5:3.
В еще одном воплощении соотношение рыбьего желатина к манниту составляет 4:3.
В другом воплощении соотношение рыбьего желатина к манниту составляет 6,5:5,5.
В следующем воплощении соотношение рыбьего желатина к манниту составляет 6,0:5,08.
Твердую лекарственную форму согласно данному изобретению можно делать из дозированного раствора, который сначала замораживают, а затем высушивают вымораживанием. В предпочтительном воплощении содержание рыбьего желатина составляет приблизительно 2-20% мас./мас. Дозированного раствора, а содержание маннита составляет приблизительно 1-20% мас./мас. дозированного раствора. В другом предпочтительном воплощении содержание рыбьего желатина составляет приблизительно 2-10% мас./мас. дозированного раствора, а содержание маннита составляет приблизительно 1-10% мас./мас. дозированного раствора. В следующем предпочтительном воплощении содержание рыбьего желатина составляет приблизительно 3-6,5% мас./мас. дозированного раствора, а содержание маннита составляет приблизительно 3-3,5% мас./мас. дозированного раствора.
В еще одном воплощении матрикс содержит приблизительно 4% мас./мас. рыбьего желатина дозированного раствора и приблизительно 3% мас./мас. маннита дозированного раствора.
В другом воплощении матрикс содержит приблизительно 6,5% мас./мас. рыбьего желатина дозированного раствора и приблизительно 5,5% мас./мас. маннита дозированного раствора.
В следующем воплощении матрикс содержит 6,0% мас./мас. рыбьего желатина дозированного раствора и 5,08% мас./мас. маннита дозированного раствора.
Установлено, что быстродиспергируемая твердая лекарственная форма, содержащая крахмал и маннит в качестве образующих матрикс наполнителей, имеет особое преимущество в отношении стабильности, внешнего вида, низкой хрупкости, прочности на разрыв, максимальной нагрузки на разрыв и вкуса во рту. В предпочтительном воплощении быстродиспергируемые твердые лекарственные формы содержат сетчатый полимер из аллергена и веществ, образующих матрикс, предпочтительно в виде предварительно желатинизированного крахмала, например, из картофеля, пшеницы, маиса, кукурузы или риса и маннита. Для получения сетчатого полимера соотношение крахмала к манниту следует регулировать. В предпочтительном воплощении соотношение крахмал к манниту составляет от приблизительно 2:20 до приблизительно 20:1, более предпочтительно от приблизительно 2:10 до приблизительно 10:1, наиболее предпочтительно от приблизительно 3:5,5 до приблизительно 6,5:3.
В еще одном воплощении соотношение крахмала к манниту составляет 1:1.
Твердую лекарственную форму согласно данному изобретению готовят из дозированного раствора, который сначала замораживают, а затем высушивают вымораживанием. В предпочтительном воплощении содержание крахмала составляет приблизительно 2-20% мас./мас. дозированного раствора, содержание маннита составляет приблизительно 1-20% мас./мас. дозированного раствора. В другом предпочтительном воплощении содержание крахмала составляет приблизительно 2-10% мас./мас. дозированного раствора, а содержание маннита составляет приблизительно 1-10% мас./мас. дозированного раствора. В еще одном воплощении содержание крахмала составляет приблизительно 3-6,5% мас./мас. дозированного раствора, а содержание маннита составляет приблизительно 3-5,5% мас./мас. дозированного раствора.
В другом воплощении матрикс содержит приблизительно 4,4% мас./мас. крахмала дозированного раствора и приблизительно 4,4% мас./мас. маннита дозированного раствора.
Предпочтительно рН корректируют до затвердевания раствора, содержащего аллерген и матрикс, чтобы избежать денатурации аллергена, преципитации и обеспечить стабильный продукт. Оптимум рН для различных аллергенов в растворе перекрывает почти всю шкалу рН, что соответствует их изоэлекрическим точкам (pi). Смеси аллергенов, такие как экстракты, в равной степени имеют оптимум рН растворимости и стабильности, определенный по показателям, таким как концентрация индивидуальных аллергенов в экстракте. Поэтому можно рассматривать индивидуальное определение области рН для препарата согласно данному изобретению. Оптимум рН для рассматриваемого аллергена определяют при проведении ускоренных исследований стабильности с препаратами с различньми значениями рН. Схема проведения таких исследований известна специалистам в данной области.
Предпочтительно матриксные композиции, содержащие экстракт аллергена, следует приводить к рН 3,5-10, более предпочтительно к рН 4-9, наиболее предпочтительно к рН 6-9.
Кроме того, в данной области хорошо известно, что ионная сила может быть показателем воздействия на стабильность высушенной вымораживанием твердой лекарственной формы, главным образом, через ее влияние на процессы, происходящие при сушке вымораживанием. Также известно, что высокая ионная сила оказывает влияние на преципитацию. Соответственно, оптимальная ионная сила должна быть установлена с помощью процедур, хорошо известных специалистам в данной области. Предпочтительно ионная сила экстракта 10 мкг/мл составляет 1-1500 мкСм/см (См=сименс), более предпочтительно 300-800 мкСм/см, наиболее предпочтительно приблизительно 500 мкСм/см, для системы, содержащей матрикс и аллерген, предпочтительно ионная сила составляет 1-2000 мкСм/см, более предпочтительно приблизительно 500-1500 мкСм/см.
Твердые лекарственные формы согласно изобретению, кроме того, могут содержать красители, вкусовые вещества, модификаторы рН или вещества, маскирующие вкус. Подходящие красители включают в себя красный, черный и желтый железооксидный пигмент и краски FD & С, такие как FD & С голубой №2 и FD & С красный №40. Подходящие вкусовые вещества включают в себя экстракты мяты, малины, солодкового корня, апельсина, лимона, грейпфрута, жженый сахар, ваниль, экстракт вишни и винограда и их комбинации. Подходящие модификаторы рН включают в себя лимонную кислоту, винную кислоту, фосфорную кислоту, хлористоводородную кислоту и малеиновую кислоту. Подходящие подсластители включают в себя аспартам, ацесульфам К и тауматик. Подходящие вещества, маскирующие вкус, включают в себя бикарбонат натрия, ионообменные смолы, соединения с включением циклодекстрина, аскорбаты или микрокапсулированные активные вещества.
Адъюванты обычно используют, чтобы повысить всасывание аллергена, а также увеличить иммуностимулирующие свойства аллергена.
В другом предпочтительном воплощении изобретения быстродиспергируемая твердая лекарственная форма согласно изобретению не содержит адъювант.
Также неожиданно было установлено, что нет необходимости вводить адъювант в быстродиспергируемую твердую лекарственную форму для того, чтобы повысить иммуностимулирующие свойства рассматриваемого аллергена. То есть твердая лекарственная форма, рассматриваемая в описании, может повышать специфический иммунный ответ, что продемонстрировано в примере 6.
В одном воплощении изобретения, по крайней мере, один адъювант вводят в лекарственную форму согласно изобретению. Примерами подходящих адъювантов являются соли алюминия, гидроксид алюминия, такой как Альгидрогель®, нетоксичные фрагменты бактерий, цитокины, холерный токсин (и его детоксифицированные фракции), субъединица b холерного токсина, хитозан, гомологичные термолабильные фрагменты Е.coli (и их детоксифицированные фракции), сапонины, бактериальные продукты, такие как липополисахариды (LPS) и мурамиловый дипептид (MDP), липосомы, CpG (иммуностимулирующие последовательности ДНК), гомолактид/гликолид ± сополимеры в виде полимеров из микрочастиц и так далее. Применение адъювантов в фармацевтическом изделии, содержащем аллерген, например, вакцинах, часто объясняют фактом, что рассматриваемые аллергены не способны пенетрировать барьер для прохождения. Адъюванты, таким образом, могут служить усилителями всасывания, или они могут действовать как иммуностимуляторы. Применение адъювантов, однако, может быть связано с серьезными недостатками, такими как не предполагаемая стимуляция различных механизмов иммунного ответа, системная красная волчанка или воздействие на барьерные свойства слизистых мембран и, таким образом, которые делают возможным прохождение вредных веществ. Кроме того, с промышленной точки зрения добавление адъюванта составит другое производство и другую стоимость материала, помимо больших требований к документации в отношении регистрации лекарственного средства.
Непрессованная быстродиспергируемая твердая лекарственная форма может быть до некоторой степени мукоадгезивной. Однако в предпочтительном воплощении изобретения может оказаться необходимым добавление еще мукоадгезивных наполнителей к названной лекарственной форме для того, чтобы увеличить время контакта лекарственной формы со слизистой полости рта. Подходящие мукоадгезивные наполнители представляют собой полиакриловые полимеры, такие как карбомер и производные карбомера; производные целлюлозы, такие как гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и натрийкарбоксиметилцеллюлоза; природные полимеры, такие как желатин, альгинат натрия, пектин и глицерин.
В другом воплощении изобретения аллергенную лекарственную форму, растворенную в слюне, не следует проглатывать раньше чем через 3 минуты после введения формы для того, чтобы иметь достаточное время контакта, например, для всасывания через слизистую мембрану в полости рта.
В еще одном предпочтительном воплощении лекарственную форму, содержащую аллерген, не разбавляют в полости рта, например, при потреблении жидкости, такой как вода, раньше чем через 5 минут.
Известно, что вредные явления или побочные эффекты встречаются в связи с лечением аллергии. При определенном лечении, направленном на изменение действующего ответа у сенсибилизированного индивидуума, может возникать риск индукции побочного действия при применении аллергена. Обычно побочные эффекты, наблюдаемые при введении препарата через слизистые полости рта, обнаруживают в глазах, носу, полости рта, верхних и нижних дыхательных путях и в зависимости от степени установленной переносимости. Самым общим симптомом является зуд. Вредные реакции, такие как анафилактический шок, отек верхних и нижних дыхательных путей, затрудненное дыхание, падение кровяного давления, остановка сердца, должны быть неприемлемыми.
Быстродиспергируемую твердую лекарственную форму согласно изобретению можно производить и упаковывать в имеющиеся в распоряжении контейнеры, содержащие многочисленные твердые лекарственные формы, то есть мультидозовые контейнеры. Способы и материалы, которые описывают в патентах США №5729958 и №5343762, являются особенно полезными. Примерами подходящих мультидозовых контейнеров являются блистер-упаковки целиком из алюминия, блистерные упаковки из полимеров, например, полипропилена, блистер-упаковки из PVC и блистер-упаковки, образованные листовым PVC/PVdC и герметически закрытые, например, алюминием, расплющенным до каландрованной крафт-бумаги, аклар® или триплекс®.
В одном воплощении быстродиспергируемую лекарственную форму изготавливают и упаковывают в блистер-упаковки, образованные из листового PVC/PVdC и герметически закрытые алюминием, расплющенным до каландрованной крафт-бумаги. В другом воплощении блистер-упаковку заключают в алюминиевое саше подходящего размера, составленного из алюминия, расплющенного до каландрованной крафт-бумаги.
В еще одном воплощении быстродиспергируемую лекарственную форму упаковывают в блистер-упаковки, образованные алюминием и герметически закрытые алюминием, расплющенным до каландрованной крафт-бумаги.
В следующем воплощении быстродиспергируемую лекарственную форму упаковывают в многослойные блистер-упаковки, сделанные, например, из пяти листов листового алюминия и герметически закрытые алюминием, расплющенным до каландрованной крафт-бумаги.
В еще одном воплощении быстродиспергируемую лекарственную форму упаковывают в блистер-упаковки, сделанные из листового алюминия и герметически закрытые алюминием, расплющенным до каландрованной крафт-бумаги с тем, чтобы детям было трудно открывать блистер-упаковку, например, упаковки, слишком прочные для детей.
Твердая лекарственная форма рассматриваемого типа обычно может характеризоваться низкой механической прочностью по сравнению с прессованными таблетками, вследствие собственной природы такой непрессованной лекарственной формы. Это может приводить к высвобождению остаточных частиц, содержащих аллерген, при удалении из блистерного кармана и во время манипулирования пациентом лекарственной формой. В большинстве ситуаций это не имеет никакого значения или имеет, главным образом, косметическое значение. Однако это оказывается особенно вредным, когда активный ингредиент является аллергеном, так как низкие количества аллергена могут вызывать аллергическую реакцию у предрасположенного к ней субъекта или сенсибилизировать ранее несенсибилизированного индивидуума. Обычно экспозиция соответствует диапазону 10 мкг/год для аллергенного белка, аккумулированного, например, из пыльцевых аллергенов или аллергенов клещей, живущих в пыли, которая является достаточной, чтобы вызвать сенсибилизацию или симптомы.
При манипулировании с твердыми лекарственными формами аллергены могут прийти в контакт с органами-мишенями, такими как дыхательные пути или глаз, и вызвать ответ у аллергического субъекта. Одна лекарственная форма может содержать так много аллергена, что субъект подвергается действию в течение года или более в зависимости от природы воздействия. Оказывается возможным индуцировать глазные симптомы у аллергических пациентов, используя конъюнктивальную провокацию аллергеном. На основании исследований такой стимуляции можно определить, сколько экстракта аллергена требуется, чтобы индуцировать конъюнктивальные симптомы. Полагают, что у популяции пациентов с тяжелым поллинозом, индуцированным пыльцой трав, наименьшая доза экстракта травяной пыльцы, вызывающая конънктивальные симптомы, составляет 3000 SQ-ед./мл × 0,05 мл=150 SQ-ед. (срединное значение) (S.R.Durham, S.M.Walker, E.M.Varga, M.R.Jacobson, F.O'Brien, W.Noble, S.J.Till, Q.A.Hamid и К.Т.Nouri-Aria. Long-term clinical efficacy of grass-pollen immunotherapy. N.Engl. J.Med. 341 (7):468-475, 1999).
Чтобы гарантировать, что содержащие аллерген остатки твердой лекарственной формы не высвобождаются в окружающую среду при открытии мультидозового контейнера, важно, чтобы хрупкость лекарственной формы была насколько возможно низкой без риска высвобождения аллергена из лекарственной формы после перорального применения.
Таким образом, в одном воплощении приблизительно менее 500 SQ-ед. может высвобождаться из каждой твердой лекарственной формы во время манипуляций, более предпочтительно менее 250 SQ-ед., более предпочтительно приблизительно менее 150 SQ-ед., более предпочтительно приблизительно менее 75 SQ-ед., более предпочтительно приблизительно менее 25 SQ-ед., наиболее предпочтительно приблизительно менее 10 SQ-ед.
В другом воплощении приблизительно менее 13 BAU может высвобождаться из каждой твердой лекарственной формы во время манипуляций, более предпочтительно приблизительно менее 7 BAU, наиболее предпочтительно приблизительно менее 5 BAU, более предпочтительно приблизительно менее 1,95 BAU, более предпочтительно приблизительно менее 0,65 BAU и наиболее предпочтительно приблизительно менее 0,26 BAU.
В следующем воплощении приблизительно менее 0,5 мкг экстракта аллергена может высвобождаться из каждой твердой лекарственной формы во время манипулирования ею, более предпочтительно приблизительно менее 0,25 мкг экстракта аллергена, наиболее предпочтительно приблизительно менее 0,15 мкг экстракта аллергена, более предпочтительно приблизительно менее 0,075 мкг экстракта аллергена, более предпочтительно приблизительно менее 0,025 мкг экстракта аллергена и наиболее предпочтительно приблизительно менее 0,01 мкг экстракта аллергена.
В еще одном воплощении приблизительно менее 0,05 мкг основного аллергена может высвобождаться из каждой твердой лекарственной формы во время прикосновения к ней, более предпочтительно приблизительно менее 0,025 мкг основного аллергена, наиболее предпочтительно приблизительно менее 0,015 мкг основного аллергена, более предпочтительно приблизительно менее 0,0075 мкг основного аллергена, более предпочтительно приблизительно менее 0,0025 мкг основного аллергена, наиболее предпочтительно приблизительно менее 0,001 мкг основного аллергена.
В предпочтительном воплощении данного изобретения остаточное содержание пыльцы в мультидозовом контейнере после удаления лекарственной формы не превышает приблизительно 2% общего содержания аллергена, более предпочтительно приблизительно 0,5% общего содержания аллергена твердой лекарственной формы и более предпочтительно приблизительно 0,2% общего содержания аллергена твердой лекарственной формы и наиболее предпочтительно приблизительно 0,1% общего содержания аллергена твердой лекарственной формы и более предпочтительно приблизительно 0,01%, более предпочтительно приблизительно 0,005%, более предпочтительно приблизительно 0,003% общего содержания аллергена твердой лекарственной формы, наиболее предпочтительно приблизительно 0,001% общего содержания аллергена твердой лекарственной формы.
Используемое в описании выражение «тест на хрупкость» относится к любому подходящему тесту, с помощью которого оценивают легкость, с которой твердая лекарственная форма крошится, распадается на кусочки, измельчается до порошка. Подходящий тест на хрупкость для применения в данном изобретении приводят ниже, и он включен в Европейскую фармакопею, 3-е издание (ЕР 3-rd ed.), фармацевтические технические методики 2.9.7. Обычно тестирование хрупкости таблетки проводят, как указано в ЕР 3-rd ed. 2.9.7. и USP <1216>, причем потерю массы оценивают как показатель интактной лекарственной формы. В тесте на хрупкость ЕР 3-rd ed. 2.9.7. используют барабан, имеющий в диаметре 286 мм, и глубину приблизительно 39 мм. Образец таблеток помещают на сито №100 и любые свободные остатки удаляют при использовании давления воздуха или мягкой щетки. Таблетки взвешивают и согласно этому помещают в барабан. Таблетки вращают в барабане в течение 100 периодов. Свободные остатки затем удаляют, как только что описано, а таблетки снова взвешивают. Результат затем выражают как потерю массы и рассчитывают как процент от исходной массы. Согласно USP <1216> можно использовать барабан с диаметром между 283 и 291 и глубиной между 36 и 40 мм и вращение 25±1 оборотов в минуту. Соответственно, целостность данной лекарственной формы можно оценивать при визуальном осмотре и измерении веса таблеток после того, как подвергали действию такого способа. Альтернативно, вследствие низкой массы лекарственных форм согласно данному изобретению взвешивание можно заменить иммунноанализом, специфичным в отношении рассматриваемого аллергена.
Установлено, что применение модифицированного теста на хрупкость является полезным инструментом при оценке того, что композиции являются наиболее стабильными в отношении плотности и механической прочности.
В одном воплощении хрупкость названной твердой лекарственной формы, оцениваемая как количество высвобожденного аллергена, составляет приблизительно менее 500 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 250 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 150 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 75 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 50 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 25 SQ-ед. на твердую лекарственную форму, наиболее предпочтительно приблизительно менее 10 SQ-ед. на твердую лекарственную форму в любом подходящем тесте на хрупкость, при котором оказывают достаточную внешнюю силу на тестируемые композиции.
В более предпочтительном воплощении хрупкость, измеренная как количество высвобожденного аллергена, составляет приблизительно менее 500 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 250 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 150 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 75 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 50 SQ-ед. на твердую лекарственную форму и более предпочтительно приблизительно менее 25 SQ-ед. на твердую лекарственную форму, наиболее предпочтительно приблизительно менее 10 SQ-ед. на твердую лекарственную форму в тесте на хрупкость, проводимом в соответствии с Европейской фармакопеей Pharmacopoeia EP 3-rd.
В еще более предпочтительном воплощении хрупкость, измеренная как количество высвобожденного аллергена, составляет менее 500 SQ-ед. на твердую лекарственную форму, более предпочтительно менее 250 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 150 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 75 SQ-ед. на твердую лекарственную форму, более предпочтительно приблизительно менее 50 SQ-ед. на твердую лекарственную форму и более предпочтительно приблизительно менее 25 SQ-ед. на твердую лекарственную форму, наиболее предпочтительно приблизительно менее 10 SQ-ед. на твердую лекарственную форму в способе, включающем в себя следующие стадии:
a) размещения индивидуальных герметически закрытых блистеров, каждый из которых содержит твердую лекарственную форму, в устройство, подходящее для измерений хрупкости;
b) вращения герметически закрытого блистера, содержащего твердую лекарственную форму, в течение соответствующего периода времени и с подходящей скоростью;
c) удаления герметически закрытого блистера, содержащего твердую лекарственную форму;
d) вскрытия блистера и переноса твердой лекарственной формы и любых остатков в контейнер;
e) удаления целой твердой лекарственной формы из контейнера, оставляя свободные остатки в названном контейнере;
f) проведения аллергенспецифического анализа названных остатков с определением содержания аллергена в названных остатках; и
q) возможно, вычисления процентного содержания аллергена в названных остатках от общего содержания аллергена целой твердой лекарственной формы.
В другом воплощении хрупкость названной твердой лекарственной формы, измеренная как количество высвобожденного аллергена, составляет приблизительно менее 0,5 мкг экстракта аллергена на твердую лекарственную форму во время манипулирования ею, более предпочтительно приблизительно менее 0,25 мкг экстракта аллергена на твердую лекарственную форму, более предпочтительно приблизительно менее 0,15 мкг экстракта аллергена на твердую лекарственную форму, более предпочтительно приблизительно менее 0,075 мкг экстракта аллергена на твердую лекарственную форму, более предпочтительно приблизительно менее 0,025 мкг экстракта аллергена на твердую лекарственную форму, наиболее предпочтительно приблизительно менее 0,01 мкг экстракта аллергена на твердую лекарственную форму по способу, включающему в себя следующие стадии:
a) размещения индивидуальных герметически закрытых блистеров, каждый из которых содержит твердую лекарственную форму, в устройство, подходящее для измерения хрупкости;
b) вращения герметически закрытого блистера, содержащего твердую лекарственную форму, в течение соответствующего периода времени и с подходящей скоростью;
c) удаления герметически закрытого блистера, содержащего твердую лекарственную форму;
d) вскрытия блистера и переноса твердой лекарственной формы и любых остатков в контейнер;
е) удаления целой твердой лекарственной формы из контейнера, оставляя свободные остатки в названном контейнере;
f) проведения аллергенспецифического анализа названных остатков с определением содержания аллергена в названных остатках; и
q) возможно, вычисления процентного содержания экстракта аллергена в названных остатках от общего содержания экстракта аллергена целой твердой лекарственной формы.
Еще в одном воплощении хрупкость, измеренная как количество высвобожденного аллергена, составляет приблизительно менее 0,05 мкг основного аллергена, более предпочтительно приблизительно менее 0,025 мкг основного аллергена, более предпочтительно приблизительно менее 0,015 мкг основного аллергена на твердую лекарственную форму, более предпочтительно приблизительно менее 0,0075 мкг основного аллергена на твердую лекарственную форму, более предпочтительно приблизительно менее 0,0025 мкг основного аллергена на твердую лекарственную форму, наиболее предпочтительно приблизительно менее 0,001 мкг основного аллергена на твердую лекарственную форму по способу, включающему в себя следующие стадии:
a) размещения индивидуальных герметически закрытых блистеров, каждый из которых содержит твердую лекарственную форму, в устройство, подходящее для измерения хрупкости;
b) вращения герметически закрытого блистера, содержащего твердую лекарственную форму, в течение соответствующего периода времени и с подходящей скоростью;
c) удаления герметически закрытого блистера, содержащего твердую лекарственную форму;
d) вскрытия блистера и переноса твердой лекарственной формы и любых остатков в контейнер;
e) удаления целой твердой лекарственной формы из контейнера, оставляя свободные остатки в названном контейнере;
f) проведения аллергенспецифического анализа названных остатков, определяя содержание основного аллергена, по крайней мере, одного основного аллергена в названных остатках; и
q) возможно, вычисления процента, по крайней мере, упомянутого основного аллергена в названных остатках от общего содержания основного аллергена целой твердой лекарственной формы.
В другом предпочтительном воплощении способа от 1 до 100 блистеров, содержащих твердую лекарственную форму, на аппаратуре для измерения рыхлости, как описывают в Европейской фармакопее European Pharmacopoeia V.2.9.7, используют на стадии а), твердые лекарственные формы вращают в течение 100 циклов при 25±1 оборотах в минуту на стадии b) и аллергенспецифический анализ представляет собой иммунохимический аллергенспецифический анализ на стадии f).
В следующем предпочтительном воплощении способа измерения хрупкости содержание аллергена определяют с помощью ELISA-анализа.
Далее, пероральная лекарственная форма должна иметь привлекательный вид. Следовательно, в виде составной части контроля качества быстродиспергируемые твердые лекарственные формы согласно изобретению предпочтительно подвергают визуальному осмотру, например, в отношении цвета, формы, неровностей и дефектов.
Для того, чтобы обеспечить оптимальное соблюдение приема лекарства пациентом, лекарственную форму также можно проверять на вкус во рту. Например, воспринимают ли пациенты лекарственную форму как приятную, когда помещают ее в рот и оставляют для дезинтегрирования.
Когда аллергены обладают высокой биоактивностью в отношении аллергического субъекта, то есть даже небольшое количество может запускать ответ, однородность содержания является важным параметром во время лечения, чтобы гарантировать, например, что характер ощущений, испытываемых пациентом, является воспроизводимым при приеме той же самой дозы. Предпочтительно изменчивость содержания аллергена форм в мультидозовом контейнере соответствует пределу ±10%, предпочтительно пределу ±7%, наиболее предпочтителен предел ±5% по сравнению с установленной дозой.
Мультидозовый контейнер может содержать любое возможное количество быстродиспергируемых твердых лекарственных форм. Предпочтительно твердые лекарственные формы, содержащие аллерген, упаковывают и используют в виде «групп». Индивидуальные твердые лекарственные формы упаковывают, распределяя в виде жидкой смеси в индивидуальные контейнеры с последующим удалением воды. Составленные блистеры можно располагать в более крупные пластины, а составленные пластины можно упаковывать и продавать вместе. Например, контейнер, такой как блистер-упаковка, может содержать множество твердых лекарственных форм, предпочтительно 1-100 твердых лекарственных форм, более предпочтительно 1-35 и наиболее предпочтительно 1-10 твердых лекарственных форм на блистер-упаковку. В другом воплощении предусматривают структуру производства, распространения и хранения посредством использования составленных блистер-упаковок, которые, например, могут обеспечить 2, 3, 4, 5, 6 или более однократных предполагаемых курсов лечения. Описанные отдельные упакованные структуры особенно полезны для монодозовой терапии и делают выполнимыми схемы лечения, рассматриваемые в описании, в которых отсутствует стадия повышения дозы.
В другом воплощении представляют медикаментозный пакет для лечения аллергии или облегчения симптомов аллергии. Медикаментозный пакет содержит герметически закрытую упаковку многочисленных твердых лекарственных форм, каждая из которых содержит эффективное количество аллергена. Медикаментозный пакет может содержать, например, по крайней мере, 2, 4, 6, 7, 10, 14, 30, 60, 90, 100, 120, 200, 240 или более твердых лекарственных форм. Медикаментозный пакет может содержать достаточное количество лекарственных форм для полного курса лечения или достаточное для части курса лечения. Благоприятно, медикаментозный пакет содержит, по крайней мере, запас на один месяц стандартных доз.
В другом предпочтительном воплощении изобретения все твердые лекарственные формы медикаментозного пакета содержат одинаковые дозировки аллергена, таким образом устраняя необходимость для производства, распространения и хранения многочисленных стандартных лекарственных дозированных форм для лечения однократной аллергии у индивидуума.
Набор, содержащий медикаментозный пакет, кроме того, может включать в себя инструкции, касающиеся применения твердой лекарственной формы. Инструкции могут содержать предостережение, инструкцию по схеме приема лекарственного средства или другую информацию, ценную для пользователя. Инструкции могут содержать, например, отдельную информационную брошюру, статью, плакат и/или одно или более уведомлений, напечатанных на контейнере, таком как коробка, в которой держат стандартные лекарственные формы. Инструкции также можно поставлять в виде компакт-диска или другого считываемого на компьютере средства, или видеокассеты.
Желательно, многочисленные твердые лекарственные формы медикаментозного пакета готовят из жидкой смеси по способу in situ, удаляя суспензионную и/или сольватационную жидкость, которая может содержать воду и/или другие органические растворители, которые быстро диспергируют.
В другом воплощении каждую из твердых лекарственных форм медикаментозного пакета помещают в индивидуальные герметически закрытые блистеры в составленную блистерную пачку.
В следующем воплощении твердые лекарственные формы медикаментозного пакета содержат желатин, более предпочтительно рыбий желатин.
В еще одном воплощении твердые лекарственные формы медикаментозного пакета содержат еще маннит.
В другом воплощении, касающемся медикаментозного пакета, эффективное количество твердой лекарственной формы составляет приблизительно 2,5 мкг - приблизительно 3,75 мг экстракта/твердую лекарственную форму.
Клинические проявления и симптомы аллергии являются индивидуальными и могут изменяться в зависимости от сенсибилизированного индувидуума и возникшей аллергии. Общими являются симптомы, такие как отек, зуд, покраснение и выделение из глаз и носа (ринит и конъюнктивит), и симптомы, связанные с верхними и нижними дыхательными путями, такие как стерторозное дыхание, приступы кашля, одышка, состояние кожи, такое как экзема, крапивница и зуд. Также проявляются другие симптомы, такие как утомление. Симптоматическое лечение направлено на снижение тяжести симптомов или воздействие на тяжесть симптомов или снижение потребности в других лекарственных средствах, назначаемых параллельно. Симптоматические лекарственные средства включают в себя антигистаминные препараты, такие как антагонисты рецепторов H1 и H2, интраназальные или системные кортикостероиды, нестероидные противовоспалительные лекарственные средства, назальные противоотечные средства, такие как агонисты адренорецепторов. Лечение или ослабление одного или более аллергических симптомов или снижение потребности в других медикаментах представляет собой другую цель данного изобретения.
Аллергия является широко распространенным заболеванием млекопитающих, включая человека и животных, таких как собаки и лошади. Так, другой целью изобретения является предоставление способа лечения аллергии или облегчения симптомов аллергии у млекопитающих, включающего в себя введение через слизистую полости рта эффективного количества аллергенной вакцинной лекарственной формы, заключающей в себе (а) матрикс и (b), по крайней мере, один аллерген по любому из вышеприведенных воплощений.
Лечение, в частности, сезонной аллергии, такой как поллиноз, обычно связано с определенным временем года, когда происходит или повышается воздействие специфического аллергена. Аллергенный сезон изменяется с источником аллергена, например, пыльцой и климатическими условиями для источника аллергена на определенной территории. Таким образом, сезон для аллергена будет отличаться в одной части света от другой части света в зависимости от климата, но обычно приходится на тот же самый период года для одной и той же территории, изменяясь с фактическими условиями года (смотрите, например, «Aerobiology and inhalant allergies», Chapter 19, T.A.E.Platts-Mills & W.R.Solomon (Ed. S.Manning) 1993, Mosby-Year Book, St. Louis). Специалистам хорошо известно, когда обычно ожидают начало сезона для определенного аллергена в определенном регионе.
В одном воплощении изобретения предусматривают способы лечения, включающие в себя предсезонное лечение, то есть введение твердых лекарственных форм согласно изобретению перед аллергенным сезоном. В особо предпочтительном воплощении предсезонный период лечения включает в себя введение твердой лекарственной формы согласно изобретению в течение периода более 2 недель до аллергенного сезона, более предпочтительно между 4-20 неделями, наиболее предпочтительно между 8-12 неделями.
Другая цель изобретения заключается в обеспечении способом лечения аллергии или симптомов аллергии, включающим в себя введение эффективного количества аллергенной вакцинной лекарственной формы, содержащей (а) матрикс и (b), по крайней мере, один аллерген и, кроме того, содержащей, по крайней мере, одно противоаллергическое лекарственое средство, например, антигистаминное средство, и ингибиторы синтеза гистамина по любому из описанных выше воплощений. Предпочтительно такие противоаллергические лекарственные средства включают в себя бромафенирамил, цетиризин, фексофенадин, ципрогептадин, дексхлорфенирамин, гидроксизин, кетофен, меквитазин, оксотомид, мизоластин, эбастин, астемизол, карбиноксамид, алимемазин, буклизин, циклизин, гидрохлорат, доксиламин, тритоквалин.
Изобретение также включает в себя применение фармацевтического изделия, содержащего непрессованную быстродиспергируемую твердую лекарственную форму, заключающую в себе аллерген и, по крайней мере, одно образующее матрикс вещество, для лечения аллергии или облегчения симптомов аллергии посредством введения через слизистую полости рта.
В еще одном воплощении изобретения фармацевтическое изделие, содержащее стабильную быстродиспергируемую непрессованную твердую аллергенную лекарственную форму с низкой хрупкостью, заключающую в себе (а) матрикс и (b), по крайней мере, один аллерген и заключающую в себе еще антигистаминное средство, используют для лечения аллергии или симптомов аллергии введением лекарственной формы через слизистую полости рта.
В другом воплощении представляют способ лечения аллергии или облегчения симптомов аллергии, включающий в себя обеспечение а) медикаментозным пакетом и b) неоднократного введения через слизистую полости рта одной или более лекарственных форм из медикаментозного пакета до тех пор, пока симптомы не станут легче.
В следующем воплощении также предлагают схему лечения, в которой используют разовую дозу для завершения полного лечения сенсибилизации без применения возрастающей дозы, то есть увеличения различного уровня(ей) аллергена до достижения определенной дозы. Указанное воплощение является полезным, так как оно упрощает и делает более экономичным производство, распространение и хранение лекарственных форм, не требуя многочисленных количеств доз для одного лечения. Кроме того, при упрощении курса лечения улучшается соблюдение больным схемы лечения, что непосредственно приводит к большей клинической эффективности.
В другом воплощении изобретения представляют фармацевтическое изделие, содержащее перорально вводимую твердую лекарственную форму, заключающую в себе матрикс, образованный, по крайней мере, одним фармацевтически подходящим веществом, эффективное количество аллергена для десенсибилизации человека к названному аллергену, в рассматриваемой лекарственной форме содержание аллергена составляет, по крайней мере, приблизительно 50% исходного содержания аллергена после хранения в течение 3 месяцев при 25°С и 60% относительной влажности. Предпочтительно названное фармацевтическое изделие готовят в виде лепешки, таблетки, капсулы или таблетки в форме капсулы.
Быстродиспергируемую твердую лекарственную форму согласно изобретению можно получать сублимацией в соответствии со способом, описанным в патенте США №4371516. Соответственно, затвердевший раствор аллергена и наполнителей, образующих матрикс, подвергают сублимации. Процесс сублимации предпочтительно проводят сушкой раствора вымораживанием раствора. Во время стадии сушки вымораживанием раствор находится в углублении мультидозового контейнера, чтобы получить твердую форму в любом желательном виде. Мультидозовый контейнер можно охлаждать, используя жидкий азот или твердую двуокись углерода. После стадии замораживания замороженный раствор в мультидозовом контейнере подвергают действию пониженного давления и, если требуется, контролируемому применению нагревания, чтобы способствовать сублимации растворителя.
Изобретение, кроме того, включает в себя применение аллергена для производства стабильной быстродиспергируемой непрессованной аллергенной вакцинной твердой лекарственной формы с низкой хрупкостью, заключающей в себе (а) матрикс и (b), по крайней мере, одну аллергенную форму для применения при лечении аллергии или облегчения симптомов аллергии.
В другом воплощении способа обеспечивают получение быстродиспергируемой непрессованной твердой и стабильной лекарственной формы, подходящей для введения через слизистую полости рта, имеющей низкую хрупкость, заключающей в себе, по крайней мере, одно образующее матрикс вещество и эффективную дозу для десенсибилизации индивидуума, по крайней мере, к одному аллергену, включающее в себя стадии
а) приготовления водного раствора, содержащего, по крайней мере, один названный аллерген и, по крайней мере, одно вещество, образующее матрикс,
b) внесения раствора в одно или более углублений в форме,
c) замораживания и сушки вымораживанием заполненной пластины, используя стандартные условия постоянной температуры и барокамеру, чтобы получить названную твердую лекарственную форму в каждом углублении.
В следующих воплощениях способ обеспечивает получение быстродиспергируемой непрессованной твердой и стабильной лекарственной формы, подходящей для введения через слизистую оболочку полости рта, имеющей низкую хрупкость, заключающую в себе, по крайней мере, одно вещество, образующее матрикс, и эффективную дозу для десенсибилизации индивидуума, по крайней мере, к одному аллергену, включающее в себя стадии
a) приготовления водного раствора, содержащего, по крайней мере, один названный аллерген и, по крайней мере, одно вещество, образующее матрикс,
b) внесения раствора в углубления в форме,
c) замораживания и сушки вымораживанием заполненной пластины, используя стандартные условия - постоянную температуру и барокамеру, чтобы получить названную твердую лекарственную форму в каждом углублении.
В предпочтительном воплощении способа блистерная пластина представляет собой алюминиевую блистерную пластину. В особо предпочтительном воплощении способа блистерная пластина представляет собой многослойную, всю из алюминия блистерную пластину.
В еще одном воплощении способ обеспечивает получение фармацевтического изделия, содержащего быстро диспергируемую непрессованную твердую и стабильную лекарственную форму, подходящую для введения через слизистую полости рта, заключающую в себе, по крайней мере, одно вещество, образующее матрикс, и эффективную дозу для десенсибилизации индивидуума, по крайней мере, к одному аллергену, имеющую низкую хрупкость, включающее в себя
1) получение стабильной быстродиспергируемой непрессованной твердой лекарственной формы,
2) измерение хрупкости названной лекарственной формы по способу, включающему в себя стадии
a) размещения индивидуальных герметически закрытых блистеров, каждый из которых содержит твердую лекарственную форму, в аппарат, подходящий для измерений хрупкости;
b) вращения герметически закрытого блистера, содержащего твердую лекарственную форму, в течение соответствующего периода времени и с подходящей скоростью;
c) удаления герметически закрытого блистера, содержащего твердую лекарственную форму;
d) вскрытия блистера и переноса твердой лекарственной формы и любых остатков в контейнер;
e) удаления целой твердой лекарственной формы из контейнера, оставляя свободные остатки в названном контейнере;
f) проведения аллергенспецифического анализа названных остатков, определяя содержание основного аллергена, по крайней мере, одного основного аллергена в названных остатках; и
q) вычисления процента, по крайней мере, упомянутого основного аллергена в названных остатках от общего содержания основного аллергена целой твердой лекарственной формы,
устанавливая, удовлетворяет ли лекарственная форма требованиям в отношении низкой хрупкости, и
3) повторения 1) и 2) до тех пор, пока требования к лекарственной форме не будут выполнены.
Иммунотерапию с введением через слизистую полости рта можно рассматривать как средство индукции толерантности и индукции вакцинации через слизистую. Слизистая оболочка полости рта богата дендритными клетками с сильным потенциалом для представления антигена. Полагают, что дендритные клетки процессируют аллергены, а затем мигрируют в локальные лимфатические узлы, где они представляют пептиды, происходящие из аллергена, аллергенспецифическим Т-клеткам. Полагают, что во время сублингвальной иммунотерапии описанное взаимодействие дендритная клетка-Т-клетка стимулирует Т-клетки с регуляторным потенциалом или увеличивает соотношение аллергенспецифических клеток Тh1 к аллергенспецифическим клеткам Th2. Ряд иммунных параметров, регистрируемых во время вакцинации против аллергии, могут быть подходящими маркерами воздействия и эффективности лечения, отдельно или в комбинации соответственно. Упомянутые маркеры включают в себя системный антителогенез и антителогенез в слизистой, например, специфических антител IgA, IgG и IgE; уровни цитокинов, например, гамма-INF, IL-2, IL-4, IL-5, IL-10, IL-12 и TNF-альфа в крови или слизистых секретах; активацию, хемотаксис, пролиферацию, передачу сигнала, образование цитокинов и другие ответы регуляторных Т-клеток, клеток Th1, клеток Th2, CDS-клеток, других субпопуляций Т-клеток, или В-клеток, или NK-клеток, и экспрессию маркеров клеточной поверхности, таких как CD-маркеры (кластеры дифференцировки), например, CD4, CDS, CD23, CD25, CD62L, CLA, бета7, CCR9, CD69, CD45RO, CCR3, CXCR5, функции эффекторных клеток, такие как общее содержание гистамина (в базофилах) базофилов; количество эозинофилов, базофилов, лимфоцитов, моноцитов в крови, ткани и секретах; высвобождение медиаторов эозинофилов, базофилов, лимфоцитов, моноцитов, продукцию цитокинов, активацию, хемотаксис, пролиферацию, передачу сигнала и другие ответы.
В предпочтительном воплощении вакцина согласно данному изобретению характеризуется профилем, по которому можно установить одно или более из следующих иммунных изменений; повышенный ответ аллергенспецифических IgG, повышенный ответ аллергенспецифических IgA, сниженный ответ аллергенспецифических IgE, небольшое количество локальных побочных эффектов; сниженные аллергенспецифические эффекторные ответы эозинофилов, базофилов, лимфоцитов и/или моноцитов; индукцию регуляторных Т-клеток, повышенное соотношение аллергенспецифических клеток Th1 к аллергенспецифическим клеткам Th2, индукцию других клеток с регуляторным потенциалом, сниженный ответ аллергенспецифических клеток Th2.
Аллергия также известна как заболевание животных, особенно домашних животных и корабельных животных-попутчиков. В данной области известно, что у них развиваются аллергии в отношении многочисленных источников аллергенов, включая траву, клещей домашней пыли и паразитов. Кровепаразиты, то есть инвазия кровососущих насекомых, как известно, приводят к аллергической реакции, называемой блошиный аллергический дерматит (FAD). В предпочтительном воплощении аллергены для животных вакцин включают в себя аллергены, происходящие или переносимые паразитами, такими как эктопаразиты (например, блохи, иксодовые клещи, комары, мухи), яд паразитических червей (таких как гельминт, паразитирующий в сердце, например, Dirofilaria, или онхоцеркоз, например, Onchocerca], и клещ, живущий в домашней пыли. Более предпочтительными являются аллергены слюны блох, таких как Ctenocephalldes, например, С.canis и С.fells, жесткие иксодовые клещи, такие как Ixodes, Arnblyomma, мягкие иксодовые клещи, такие как Ornithodoros, и мелких двукрылых насекомых, таких как Culicoldes.
ПРИМЕРЫ
Сокращения:
API: активный белковый ингредиент
ELISA: твердофазный иммуноферментный анализ
DDT: дитиотрейтол
HRP: пероксидаза из хрена
LIA: анализ специфических IgE Magic Lite
LITE-реагент: Люминесцентно меченные анти-IgE
РМР: парамагнитные частицы
SDS-PAGE: электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
ТМВ: тетраметилбензидин
Пример 1. Аллергенная вакцина, содержащая экстракт пыльцы травы Phleum prafcense и рыбий желатин Состав
до 250 мг
Экстракт травы
Экстракт пыльцы травы готовили в соответствии со способом, описанным Ipsen and Lowensten (1983) Jour. Allergy. Clin. Immunol. 72:2, стр.150-159. Пыльцу низкорослой травы экстрагировали в бикарбонат аммония в течение 20 часов при 5°С. Вещество в виде макрочастиц удаляли центрифугированием, а супернатант диализовали против воды (3 раза), лиофилизировали и хранили на холоде до реконструкции.
Твердая лекарственная форма
Процесс изготовления
1. Маннит добавляли к аликвоте очищенной воды (не менее 50% общей загрузочной потребности) и оставляли для растворения.
2. Желатин добавляли к раствору маннита и раствор перемешивали на магнитной мешалке до тех пор, пока желатин не растворялся полностью.
3. Вторую аликвоту очищенной воды (не более 35% общего количества) использовали для реконструкции экстракта аллергена в ампулах. Реконструированный экстракт аллергена добавляли к раствору маннита-желатина.
4. рН композиции основной массы приводили к рН 7,5, используя свежеприготовленный раствор гидроксида натрия (3% мас./мас.).
5. Дополнительное количество очищенной воды, требуемое для завершения приготовления формы, рассчитывали и вносили в основную смесь.
6. Раствор вносили определенными дозами в предварительно приготовленные блистер-упаковки. Растворы дозировали при температурных условиях окружающей среды.
7. После дозирования заполненные блистер-упаковки пропускали через охлажденную жидким азотом трубку. Все замороженные изделия немедленно помещали на хранение на холоде до сушки вымораживанием. Блоки высушивали вымораживанием, используя стандартные условия - постоянную температуру и барокамеру.
8. Высушенные вымораживанием блоки герметически закрывали закрывающей тонкой фольгой и, наконец, упаковывали в саше.
Твердая лекарственная форма имела среднюю массу 18 мг и средний диаметр 11 мм.
Краткое описание аналитических способов
Идентичность (ID), белковый профиль. Белковый профиль определяли с помощью SDS-PAGE на системе Novex Mini Cell Xcell II (Invitrogen) в соответствии с инструкциями производителей. Кратко, образцы разбавляли буфером для образца с добавленным восстанавливающим агентом (0,5 М DDT) и выдерживали при 70°С в течение 10 минут и охлаждали в течение 5 минут. Образец, внутренний контроль и стандартный низкомолекулярный маркер (В 10-RAD) на лунку наносили на 4-12% бис-трисградиентный гель NuPAGE. Электрофорез проводили при 200 В приблизительно в течение 35 минут. Впоследствии гель окрашивали серебром. Белковая картина должна быть подобной картине внутреннего контроля.
Визуальный осмотр
Все блоки подвергали визуальному осмотру, например, относительно цвета, формы, неровностей и дефектов, чтобы гарантировать соответствующий вид.
Дезинтегрирование. Тест проводили, как описано в Европейской фармакопее (3-е издание) или в современной USP (Американской фармакопее).
Содержание воды. Остаточную воду определяли, используя принцип титрования Карла Фишера. Способ обеспечивает количественную оценку содержания воды в образце на основании принципа, что определенное количество I2 приводит к трансформации эквивалентного количества Н2О.
Вкратце, 1-3 твердые лекарственные формы на ампулу тестировали в трех повторах в титраторе Карла Фишера в соответствии с инструкцией производителя вместе с неизвестными образцами (4 на опыт), a KF стандартных образцов смотрите в примере 10.
Общая аллергенная активность. Тест проводили, используя LIA (описанный Eiken et al., Allergy 1992, 47:495-497), который представляет собой конкурентный иммуноанализ. 100 мкл моноклональных анти-IqE-антител человека, связанных с парамагнитными частицами (РМР) (ADVIA Centaur PMP, ALK-Abello A/S, Denmark), промывали × 3 и добавляли 100 мкл пула сыворотки пациента с IgE-антителами, специфичными к Phleum pratense, и инкубировали на вибраторе в течение 2 часов при 2-8°С, при этом специфические IgE связывали РМР. РМР промывали 3 раза буфером, содержащим желатин, чтобы удалить IgG-антитела. Десять твердых лекарственных форм растворяли в желатиновом буфере и готовили разведения с 625 SQ-ед. или 1250 SQ-ед. на таблетку. Образцы или контроли с известным содержанием биотинилированного API Phleum pratense наносили и инкубировали в течение ночи при встряхивании при 2-8°С. Образцы и биотинилированные API конкурировали за IgE-связывающие участки, когда концентрация аллергена в образце увеличивалась, количество связанного биотинилированного API падало. После инкубации образцы промывали × 3 в буфере, содержащем желатин, и применяли LITE-реагент, например, хемилюминисцентное соединение сложного эфира акридиния, связанного со стрептавидином (ADVIA Centaur Lite Reagents, ALK-Abello A/S). Образцы инкубировали в течение 2 часов на вибраторе при 2-8°С, промывали в желатиновом буфере × 3 и считывали в люминометре. Ответ обратно пропорционален концентрации аллергена в образце.
Содержание основного аллергена. Тестирование проводили, используя анализ ELISA согласно Obispo et al., Allergy, 1997, 52, pp.806-813. С помощью ELISA-анализа определяли концентрацию основного аллергена 5 Phleum pratense (Phi p 5). Два моноклональных антитела (ALK-Abello A/S, DK), взаимодействующих с различными эпитопами на молекуле Phi p 5, наслаивали в микротитрационный планшет в течение ночи при 4°С. После промывания (4 раза промывающим буфером, 0,1 М PBS, 0,05% Твин-20) и блокирования планшета блокирующим буфером (2% казеиновый буфер) наносили образцы/контроли, которые затем связывались с антителами. После промывания еще раз (4 раза промывающим буфером) в лунки наносили биотинилированные кроличьи поликлональные антитела (ALK-Abello A/S, DK) против антигенов Phleum pratense и оставляли для взаимодействия.
После 4-кратного промывания промывающим буфером в лунки вносили стрептавидин, связанный с HRP (пероксидаза хрена) (DAKO, Denmark), и оставляли для взаимодействия в течение 1 часа при комнатной температуре (встряхивание). После промывания 4 раза промывающим буфером вносили субстрат (ТМВ, КЕМ EN ТЕС) фермента HRP и оставляли для взаимодействия в течение 20 минут, затем реакцию останавливали 0,5 н. серной кислотой. Образовавшееся окрашивание измеряли при 450 нм в спектрофотометре, например, счетчике Multi-label counter Victor 2.
Хрупкость
Хрупкость быстродиспергируемых лекарственных форм оценивали, используя следующий способ.
Герметически закрытую блистерную пластину, содержащую 10 блистеров, каждый из блистеров содержал твердую лекарственную форму, разрезали отдельно на 10 индивидуальных блистеров и каждый блистер помещали в аппарат для измерения хрупкости, как описано в ЕР 3-rd ed. V.2.9.7 и блистеры вращали 100 циклов при 25±1 оборотов в минуту. Индивидуальные блистеры удаляли, открывали и твердую лекарственную форму переносили в подходящий контейнер. Затем твердую лекарственную форму удаляли из контейнера, оставляя свободные остатки в названном контейнере. Иммунохимический аллергенспецифический анализ (ELISA) проводили, чтобы установить содержание аллергена в остатках (смотрите выше).
Результаты исследования стабильности
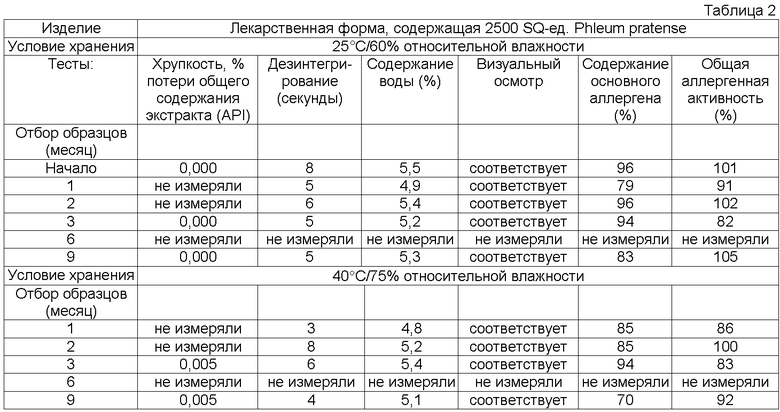
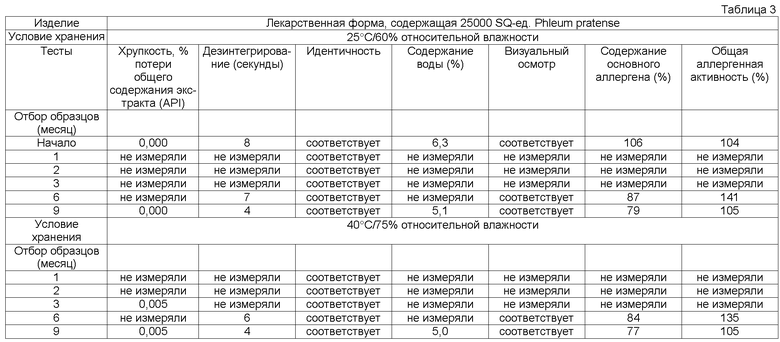
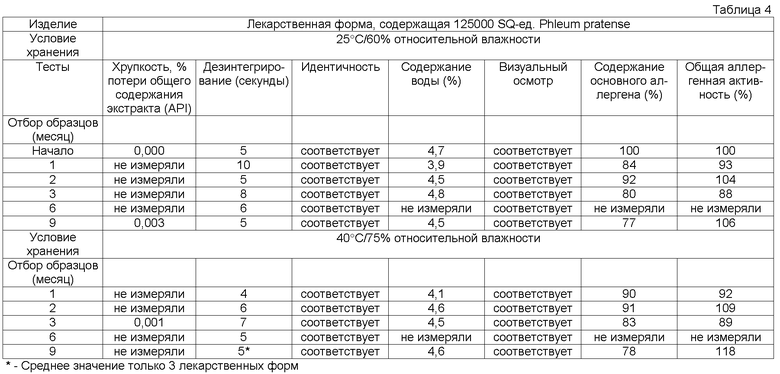
Пример 2. Аллергенная вакцина, содержащая экстракт пыльцы травы Phleum pra tense и крахмал
Состав
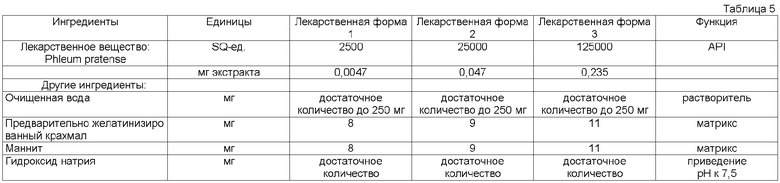
Способ приготовления
Осуществляли так же, как в примере 1, за исключением того, что предварительно желатинизированный крахмал добавляли вместо желатина (источник - рыбы). Твердая лекарственная форма имела среднюю массу 19 мг и средний диаметр 11 мм.
Краткое описание аналитических способов
Те же, что в примере 1.
Результаты исследования стабильности
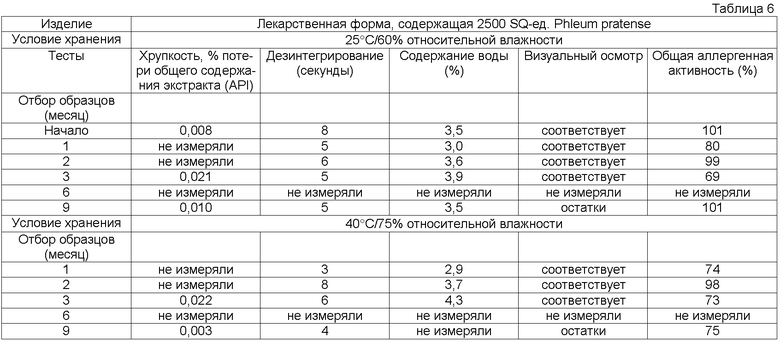

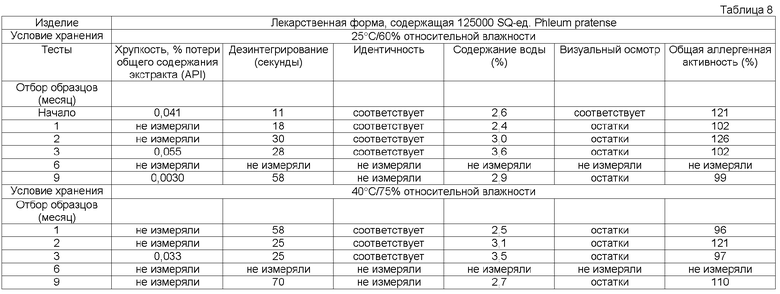
Пример 3. Аллергенная вакцина, содержащая экстракт трав и рыбий желатин
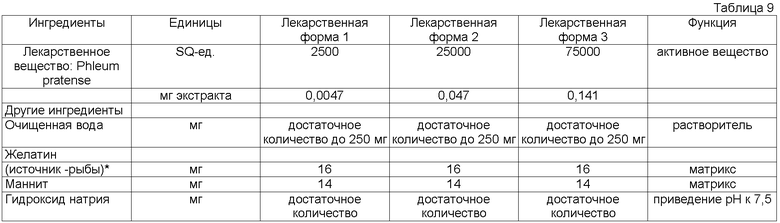
Способ приготовления
Такой же, как в примере 1.
Твердая лекарственная форма имела среднюю массу 30 мг и средний диаметр 12 мм.
Краткое описание аналитических способов
Те же, что в примере 1, за исключением того, что хрупкость и стабильность не определяли.
Результаты исследований
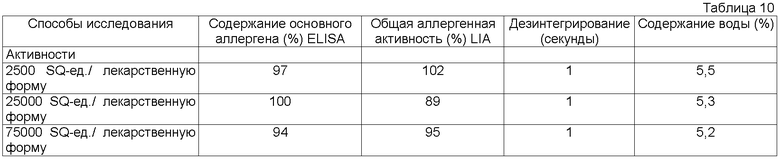
Результаты дают представление о воплощении твердой лекарственной формы, содержащей аллерген в трех разных дозах экстракта травяного аллергена в веществе, образующем матрикс, состоящем из 6,5% рыбьего желатина и 5,5% маннита. После производства содержание аллергена и активность аллергена в лекарственных формах были в пределах допустимых границ (смотрите ниже). Кроме того, результаты показывают, что все лекарственные формы имеют содержание воды в пределах предпочтительного диапазона 4-7%.
Результаты
Как видно из примеров 1, 2 и 3, возможно производить быстродиспергируемые твердые вакцинные лекарственные формы, содержащие аллерген, которые дезинтегрируют мгновенно. Обнаружено, что потеря общего содержания экстракта является допустимой, даже визуальный осмотр позволил обнаружить остатки в некоторых из блистер-упаковок (преимущественно в большей степени для матриксов, содержащих крахмал), количество остатка, то есть потеря содержания аллергена была в пределах допустимых границ, то есть менее 0,5 мкг экстракта. Таким образом, возможно производить непрессованные быстродиспергируемые твердые лекарственные формы с низкой хрупкостью, содержащие аллергены.
Результаты исследования стабильности показали, что композиции стабильны при комнатной температуре и при повышенной температуре и влажности в течение девяти месяцев. Содержание аллергена и общая аллергенная активность оставались без изменений (в пределах колебаний исследований и в соответствии с ЕР (3-е издание) по аллергенным продуктам; общая аллергенная активность составляла 50-200% теоретической величины, содержание основного аллергена составляло 65-135% теоретического значения).
Все произведенные партии подвергали визуальному осмотру и, как было обнаружено, соответствовали допустимому диапазону.
Пример 4. Вакцинные композиции, содержащие аллерген
Получали твердые вакцинные лекарственные формы, содержащие аллерген, с различным соотношением веществ, образующих матрикс.
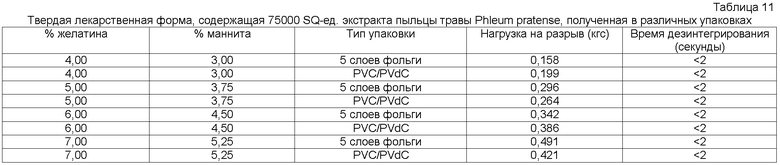
Все лекарственные формы, имеющие унифицированный диаметр 12 мм, получали в блистер-упаковке, как описано ранее. Все лекарственные формы быстро дезинтегрировали и были прочными, когда оценивали по внешнему виду, прочности на разрыв и максимальной нагрузке на разрыв.
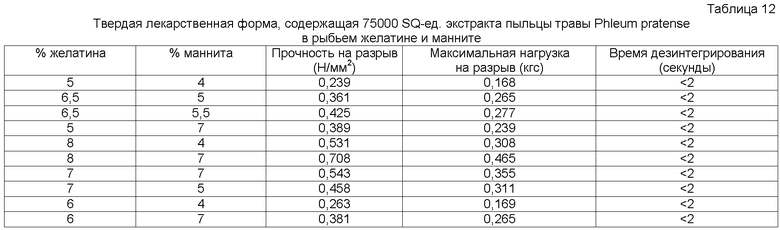
Все лекарственные формы, имеющие унифицированный диаметр 12 мм, получали в блистер-упаковке, как описано ранее.
Все лекарственные формы быстро дезинтегрировали и были прочными, когда оценивали по внешнему виду и максимальной нагрузке на разрыв.
Пример 5. Однородность
Лекарственные формы в соответствии с составом и производством, которые описаны в примере 1, тестировали относительно однородности содержания аллергена. Содержание аллергена определяли как однородность активности пыльцы травы Phleum p 5 с помощью анализа ELISA, как описано в примере 1, для лекарственной формы, содержащей 25000 и 125000 SQ-ед. соответственно. Сравнивали 10 индивидуальных элементов из блистер-упаковки, результаты представлены в таблице 13 и 14.
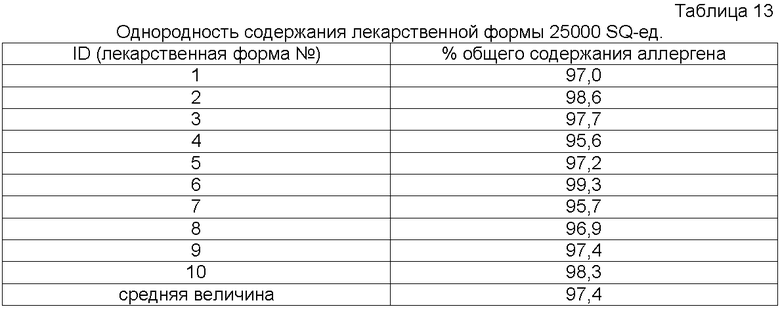
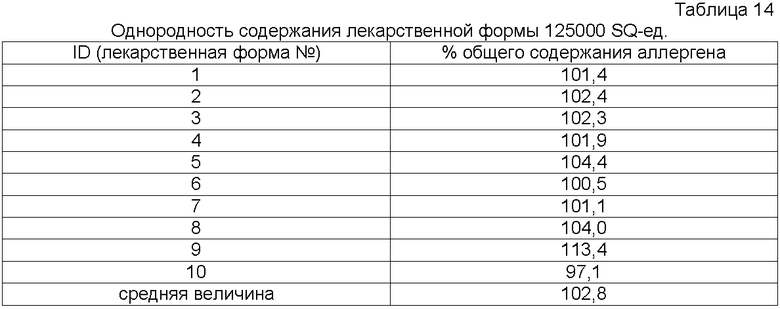
Все колебания были в пределах допустимого диапазона, и установлена хорошая однородность содержания аллергена.
Пример 6. Введение вакцины пыльцы травы Phleum pratense собакам
Собак распределяли одинаково в отношении пола в каждую исследуемую группу и им давали определенные дозы в соответствии с таблицей 15.

Собакам сублингвально вводили дозы, которые указаны в таблице 15. Лекарственную форму помещали под язык и пасть собаки держали закрытой, чтобы произошло растворение лекарственной формы. Животные получали препарат один раз в день в течение периода 4 последовательных недель. Образцы крови брали у всех собак в каждой группе после завершения периода лечения. 4 собаки в группе, получавшей плацебо и получавшей высокую дозу, соответственно, поправлялись в течение периода 4 недель, после чего брали другой образец крови.
Способ
Определяли IgG, специфичные к Phleum pratense (Phi p), или в сыворотке, или в плазме следующим образом: ELISA-планшеты (Costar) покрывали 10 мкг/мл экстракта Phi p в течение ночи при 4°С. Планшеты промывали 4 раза с 1-минутным впитыванием между ними и блокировали против неспецифического связывания 2% казеиновым буфером в течение одного часа при комнатной температуре. Индивидуальные образцы сыворотки или плазмы разводили в полипропиленовых планшетах, переносили в планшеты для ELISA и инкубировали в течение двух часов при комнатной температуре. После промывания HRP-меченные анти-IgG собаки (ICN) добавляли в ELISA-планшеты и инкубировали в течение одного часа при комнатной температуре. После другого промывания ТМВ добавляли в ELISA-планшеты, закрывали и инкубировали в течение 20 минут при комнатной температуре. Реакцию останавливали 0,5 М серной кислотой. Оптическую плотность (OD) измеряли в спектрофотометре при 450 нм.
Значения OD при разведении 1:200 сравнивали для собак трех групп: плацебо, 25000 SQ/доза и 500000 SQ/доза. Статистическое различие между тремя группами рассчитывали по критерию ранжированного ряда Манна-Уитни, который представляет собой непараметрический тест, который сравнивает две непарные группы. Собаки, получавшие 500000 SQ-единиц, имели более высокое среднее значение, чем собаки, получавшие как 25000, так и плацебо, что указывает на специфический ответ антител.
Результаты
Значения Р по критерию Манна-Уитни представлены в таблице 16.
Р - уровень ≤0,05 - значимость с 95% достоверности.
Имеются четко значимые различия между группами, получавшими плацебо и 500000 SQ-ед./дозу, указывая, что сублингвальное лечение с 500000 SQ-ед./дозу в течение 4 недель дает более высокий гуморальный уровень специфических IgG. Имеется пограничное значимое различие между группами, получавшими плацебо и 25000 SQ-ед./дозу, также указывающее, что такое лечение с 25000 SQ-ед./дозу дает гуморальный уровень специфических IgG, хотя более слабый, чем лечение 500000 SQ-ед./дозу.
Пример 7. Введение вакцины пыльцы травы Phleum pratense субъектам с аллергией
Пациентам с аллергией, как женщинам, так и мужчинам в возрасте 18-65 лет, с диагнозом аллергия к травяной пыльце, вводили сублингвальные дозы в виде одной, двух или трех однократных доз и/или в виде многократных доз в твердой лекарственной форме, содержащей экстракт пыльцы травы, в соответствии с примером 1, в рандомизированном двойном слепом плацебо-контролируемом соответствующем исследовании.
Безопасность/толерантность оценивали с повышающимися разовыми дозами. Разовые дозы плацебо 2500, 25000, 75000, 125000 и 375000 SQ-ед. вводили ступенчато по способу «возрастания дозы», используя комбинации плацебо и активных таблеток (12 мм в диаметре и приблизительно 18 мг сухого веса), чтобы получить требуемую дозу. Лечили сорок семь пациентов с аллергией к травяной пыльце. Лекарственные формы помещали под язык и держали в течение 1 минуты перед проглатыванием. Принятие пищи и питья запрещали в течение 5 минут после применения твердой лекарственной формы. За пациентами наблюдали в течение 2 часов в отношении появления симптомов. Все побочные эффекты регистрировали и после каждой дозы у пациентов определяли толерантность по шкале «визуального сходства». Установлено, что лекарственная форма, содержащая дозы, хорошо переносилась вплоть до и включая 125000 SQ-ед., так как побочные явления были преимущественно слабыми по тяжести и ограничивались симптомом «зуда» в полости рта и горла. Побочные явления также отмечали в группе плацебо. «Зуд в полости рта» отмечали часто при повышенной дозе, например, прогрессирование побочных явлений коррелировало с возрастанием доз.
Кроме того, безопасность/толерантность повторных доз тестировали в отношении трех выбранных дозировок, 2500, 25000 и 75000 SQ-ед. и плацебо. Сорока семи пациентам с аллергией к травяной пыльце, распределенным в четыре группы сопоставимого размера, давали ежедневно сублингвальные лекарственные формы в течение 8 недель. Комбинации трех таблеток, содержащих плацебо, 2500 и/или 25000 SQ-ед. (12 мм в диаметре и приблизительно 18 мг сухого веса), применяли, чтобы получить требуемые дозы. Регистрировали побочные явления, а симптомы записывали в дневники пациентов. Установлено, что дозы, содержавшиеся в лекарственной форме, хорошо переносились всеми тремя группами активного лечения. Побочные явления и симптомы чаще отмечали при повышенной дозе.
Таким образом, тестируемые твердые лекарственные формы подходят для клинического применения как в терапии с возрастающей дозой, так и в терапии с разовой неоднократно вводимой дозой.
Пример 8. Аллергенная вакцина, содержащая экстракт пыльцы травы Phleum pratense и рыбий желатин
Твердые лекарственные формы, которые описаны в таблице 1 примера 1 и получены согласно примеру 1, хранили в течение 12 месяцев при 25°С/60% относительной влажности и оценивали при исследовании внешнего вида, дезинтегрирования, содержания воды, однородности массы, идентичности (белкового профиля), содержания основного аллергена и общей аллергенной активности. Все исследования проводили, как описано в примере 1. Представлены средние значения определений, произведенных в двух экземплярах на пуле из 10 таблеток, если не указано особо.
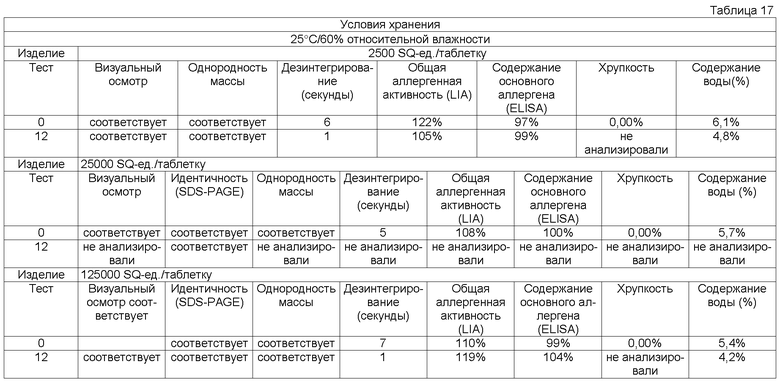
Визуальный осмотр
Никаких изменений во внешнем виде таблеток не наблюдали во время исследования.
Дезинтегрирование
Никаких заметных изменений во времени дезинтегрирования не наблюдали в ходе исследования. Все исследуемые образцы дезинтегрировали незамедлительно.
Однородность массы
Никаких значительных изменений в однородности массы не отмечено во время исследования (оценка 20 таблеток).
Содержание воды
Никаких значительных изменений в содержании воды не отмечено во время исследования.
Идентичность при SDS-PAGE
Никаких драматических изменений в белковом профиле не наблюдали в ходе исследования; образцы были подобны контролю во всех исследуемых периодах времени.
Общая аллергенная активность
Никакой значительной потери общей аллергенной активности не определяли для таблеток (изменялась на 105-119% теоретического содержания для различных активностей за 12 месяцев, величины, которые соответствуют пределу отклонения проводимого исследования).
Содержание основного аллергена
Никакой значительной потери содержания аллергена, которую определяли по содержанию основного аллергена, не обнаруживали для таблеток (изменялось на 99-104% теоретического содержания для различных активностей за 12 месяцев хранения, величины, которые находятся в пределе отклонения проводимого исследования).
Пример 9. Аллергенная вакцина, содержащая экстракт пыльцы травы Phleum pratense и рыбий желатин
Композиция является такой, как композиция, описанная в примере 1, таблице 1.
Твердые лекарственные формы, полученные согласно примеру 1, хранили в течение 18 месяцев при 25°С/60% относительной влажности и оценивали по внешнему виду лекарственной формы, то есть таблеток, и при исследовании времени дезинтегрирования, содержания воды, однородности массы, идентичности (белкового профиля), содержания основного аллергена и общей аллергенной активности. Все исследования проводили, как описано в примере 1. Представлены средние значения определений, произведенных в двух экземплярах на пуле из 10 таблеток, если не указано особо.
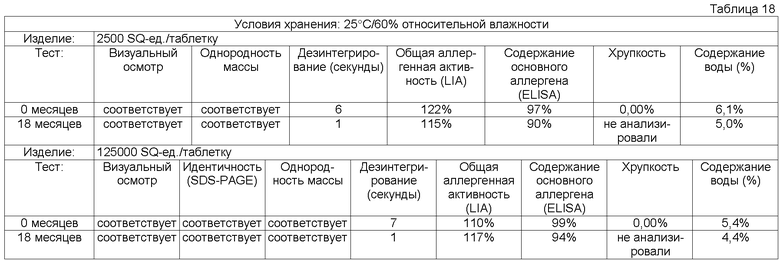
Для твердой лекарственной формы, содержащей 25000 SQ-единиц/твердую лекарственную форму, проводили только исследования ID (идентичности). Аналогичный характер ID установлен после хранения в течение 18 месяцев по сравнению с 0 месяцев (данные не представлены).
Обнаружено, что твердая лекарственная форма стабильна, то есть содержание аллергена и общая аллергенная активность остаются неизмененными (в пределах разброса анализа и согласно ЕР, 3-е издание, монография. Продукты аллергенов; общая аллергенная активность составляет 50-200% теоретической величены, содержание основного аллергена - 65-135% теоретической величины) после хранения в течение 18 месяцев при 25°С/60% относительной влажности. Кроме того, в ходе исследования не наблюдали никаких изменений внешнего вида твердых лекарственных форм для всех исследуемых доз аллергена. Кроме того, при исследовании не наблюдали никаких изменений в однородности масс тестированных лекарственных форм. Что касается содержания воды, не наблюдали никаких достойных внимания изменений, а содержание воды соответствовало предпочтительному диапазону 4-7%.
Пример 10. Аллергенная вакцина, содержащая экстракт пыльцы травы Phlevm pratense и рыбий желатин
Состав твердых лекарственных форм представлен в таблице 9 примера 1.
Твердые лекарственные формы получали согласно примеру 1, а исследование стабильности представлено на рассмотрение.
Все испытания проводили согласно примеру 1.
Результаты исследования стабильности
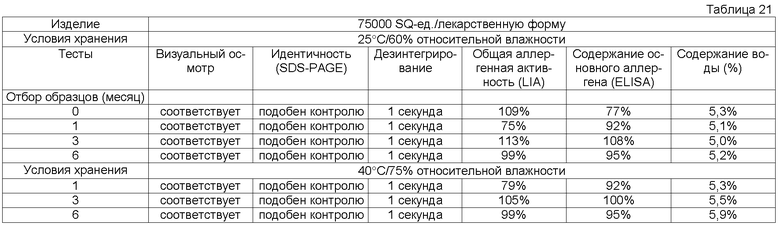
О качестве лекарственных, форм судили по результатам внешнего осмотра лекарственной формы (то есть таблеток), определения времени дезинтегрирования, содержания воды, однородности массы, идентичности (белкового профиля), содержания основного аллергена и общей аллергенной активности (не все данные представлены).
Установлено, что твердая лекарственная форма для всех доз стабильна, то есть содержание аллергена и общая аллергенная активность оставались неизмененными (в пределах колебаний (разброса) исследования и согласно ЕМЕА, 3-е издание, монография. Продукты аллергенов: общая аллергенная активность - 50-200% теоретической величины, содержание основного аллергена - 65-135% теоретической величины) после хранения в течение 6 месяцев при 25°С/60% относительной влажности и 40°С/75% относительной влажности. Кроме того, во время исследования не наблюдали никаких изменений во внешнем виде твердых лекарственных форм для всех тестированных доз аллергена. Далее, во время исследования не отмечали никаких изменений в однородности массы для всех тестированных лекарственных форм. Что касается содержания воды, в ходе исследования не обнаруживали никаких достойных внимания изменений. Наблюдали небольшую тенденцию к увеличению содержания воды во время хранения при 40°С/75% относительной влажности для всех доз, хотя содержание воды во всех тестированных образцах было в пределах предпочтительного диапазона 4-7%.
Пример 11. Определение содержания воды и активности воды в аллергенных лекарственных формах, содержащих экстракт пыльцы травы Phleum prateense и рыбий желатин
Состав
Твердые лекарственные формы получали в соответствии с примером 1.
Активность воды различных твердых лекарственных форм измеряли на гигроскопе Rotronic Hygroskop BT-RS1 (Rotronic ag, Switzerland). 10 таблеток использовали для каждого измерения. Устойчивое считывание сигнала означало, что достигли равновесия, а относительную влажность впоследствии конвертировали в активность воды, используя следующую зависимость:
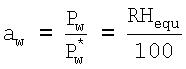
где
aw означает активность воды образца,
Pw означает парциальное давление водяного пара вышеупомянутого образца,
Pw* - давление водяного пара вышеупомянутой чистой воды и
RHequ (ERH: равновесие относительной влажности) означает относительную влажность образца.
Использовали кулонометр 756 Карла Фишера с термостатом Oven Sample Processor 774 (Metrohm, Herisau, Switzerland) для определения содержания воды в таблетках. 1-3 таблетки помещали в стеклянные ампулы и герметически закрывали крышками, покрытыми PTFE (Metrohm, Herisau, Switzerland). Опытные ампулы затем помещали в термостат Oven Sample Processor 774 (Metrohm, Herisau, Switzerland) и любую влагу, присутствующую в образцах, выпаривали при температуре 130°С. Выпаренную влагу переносили в реакционную кювету, содержащую реагент Hydranal®-Coulomat Oven (Riedel-de-Haen), в атмосфере азота и последующее количественное определение количества высвобожденной воды осуществляли по способу титрования Карла Фишера в соответствии с инструкциями производителя. Результаты представлены в таблице 24.
Активность воды и содержание воды различных аллергенных лекарственных форм, содержащих экстракт пыльцы травы Phleum pratense и рыбий желатин
Все твердые лекарственные формы имели среднюю активность воды между 0,41-0,46, хотя содержание воды некоторых форм было свыше 5%.
Пример 12. Аллергенная вакцина, содержащая экстракт пыльцы Phleum pratense
Состав
25000
Композицию получали, как описано в примере 1, за исключением того, что использовали рыбий желатин из северного района Канады. Твердая лекарственная форма имела средний диаметр 13 мм.
Результаты дают представление о следующем воплощении содержащей аллерген твердой лекарственной форме, заключающей в себе две разные дозы экстракта травяного аллергена в веществе, образующем матрикс, и образующее матрикс вещество, состоящее из 6,0% рыбьего желатина и 5,08% маннита. Лекарственные формы тестировали на хрупкость по способам, описанным в примере 1. Результаты показали, что композиции стабильны в отношении хрупкости, определяемой как высвобождение аллергена.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЛЛЕРГОТРОПИН ДЛЯ ЛЕЧЕНИЯ ПОЛИНОЗОВ И СПОСОБ ЛЕЧЕНИЯ ПОЛИНОЗОВ | 2001 |
|
RU2205661C2 |
| ДЕСМОПРЕССИН В ЛЕКАРСТВЕННОЙ ФОРМЕ, ДИСПЕРГИРУЕМОЙ ВО РТУ | 2003 |
|
RU2292903C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2587061C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКСТРАКТА АЛЛЕРГЕНА | 2011 |
|
RU2572230C2 |
| Способ получения экстракта аллергена | 2011 |
|
RU2706685C2 |
| Способ сублингвальной аллерген-специфической иммунотерапии (СЛИТ) поллинозов гипосенсибилизирующим средством | 2019 |
|
RU2725633C1 |
| СПОСОБЫ ОЧИСТКИ ЭКСТРАКТА АЛЛЕРГЕНА | 2019 |
|
RU2809823C2 |
| КОМПОЗИЦИЯ, СТИМУЛИРУЮЩАЯ ИММУННЫЙ ОТВЕТ, СОДЕРЖАЩАЯ НАНОЧАСТИЦЫ НА ОСНОВЕ СОПОЛИМЕРА МЕТИЛВИНИЛОВОГО ЭФИРА МАЛЕИНОВОГО АНГИДРИДА | 2005 |
|
RU2379028C2 |
| ТОЗИЛАТНАЯ СОЛЬ ТЕРАПЕВТИЧЕСКОГО СОЕДИНЕНИЯ И ЕЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2008 |
|
RU2430099C2 |
| БЫСТРОРАСТВОРИМАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2566270C2 |
Настоящее изобретение относится к области лекарственных средств, в частности к фармацевтическому продукту для введения аллергена, включающему быстродиспергируемую твердую лекарственную форму для введения через слизистую оболочку полости рта, включающую матрикс, полученный сушкой вымораживанием из раствора, содержащего 3-6,5% мас./мас. предварительно желатинизированного крахмала и 3-5,5% мас./мас. Маннита, или из раствора, содержащего 2-10% мас./мас. рыбьего желатина и 1-10% мас./мас. маннита; и аллерген. Кроме того, изобретение относится к способу получения указанного продукта, мультидозовому контейнеру, набору для лечения аллергии, способу лечения и применению указанного продукта. Технический результат заключается в приготовлении аллергена в виде быстродиспергируемой непрессованной лекарственной формы, которая является в достаточной степени быстродиспергируемой, стабильной и обладает низкой хрупкостью. 6 н. и 93 з.п. ф-лы, 25 табл.
1. Фармацевтический продукт, подходящий для введения аллергена, включающий:
быстродиспергируемую твердую лекарственную форму, подходящую для введения через слизистую оболочку полости рта, заключающую в себе:
(a) матрикс, полученный сушкой вымораживанием из раствора, содержащего 3-6,5% мас./мас. предварительно желатинизированного крахмала и 3-5,5% мас./мас. маннита или из раствора содержащего 2-10% мас./мас. рыбьего желатина и 1-10% мас./мас. маннита и
(b) эффективную дозу аллергена для гипосенсибилизации индивидуума к названному аллергену,
где указанная твердая лекарственная форма содержит экстракт аллергена в количестве приблизительно от 0,5 мкг до 5 мг экстракта на твердую лекарственную форму или где указанная твердая лекарственная форма содержит экстракт основного аллергена в количестве приблизительно от 0,05 мкг до 500 мкг экстракта на твердую лекарственную форму.
2. Фармацевтический продукт по п.1, который находится в виде непрессованной твердой лекарственной формы.
3. Фармацевтический продукт по п.1, где
(c) потеря содержания аллергена в названной лекарственной форме составляет менее 50% исходного содержания аллергена после хранения в течение 3 мес при 25°С и 60% относительной влажности, и
(d) потеря содержания аллергена из названной лекарственной формы составляет приблизительно менее 0,25 мкг экстракта аллергена при исследовании с помощью теста на хрупкость.
4. Фармацевтический продукт по п.1, где
(c) потеря содержания аллергена в названной лекарственной форме составляет менее 50% исходного содержания аллергена после хранения в течение 3 мес при 25°С и 60% относительной влажности, и
(d) потеря содержания аллергена из названной лекарственной формы составляет приблизительно менее 0,025 мкг основного аллергена при исследовании с помощью теста на хрупкость.
5. Фармацевтический продукт по любому из пп.3 или 4, хрупкость которого измеряли с помощью теста на хрупкость, включающего следующие стадии
(a) размещения индивидуальных герметически закрытых блистеров, каждый из которых содержит твердую лекарственную форму, в аппарате, подходящем для измерений хрупкости;
(b) вращения герметически закрытого блистера, содержащего твердую лекарственную форму, в течение соответствующего периода времени и с подходящей скоростью;
(c) удаления герметически закрытого блистера, содержащего твердую лекарственную форму;
(d) вскрытия блистера и переноса твердой лекарственной формы и любых остатков в контейнер;
(e) удаления твердой лекарственной формы из контейнера, оставляя любые свободные остатки в названном контейнере;
(f) осуществления аллергенспецифического анализа в названных остатках, определяя содержание аллергена в названных остатках; и возможно, вычисление процентного содержания аллергена в названных остатках от общего содержания аллергена целой твердой лекарственной формы.
6. Фармацевтический продукт по п.5, в котором
(a) используют от 1 до 100 блистеров, содержащих твердую лекарственную форму,
(b) используют аппарат для измерений хрупкости, который описан в Европейской фармакопее 2.9.7,
(c) твердые лекарственные формы вращают в течение 100 циклов при 25±1 оборотах в минуту, и
(d) аллергенспецифический анализ представляет собой иммунохимический аллергенспецифический анализ.
7. Фармацевтический продукт по п.6, причем аллергенспецифический анализ представляет собой твердофазный иммуноферментный анализ.
8. Фармацевтический продукт по п.1, который содержит от приблизительно 2,5 мкг до приблизительно 3,75 мкг экстракта аллергена.
9. Фармацевтический продукт по п.8, который содержит от приблизительно 2,5 мкг до приблизительно 2,5 мг экстракта аллергена.
10. Фармацевтический продукт по п.9, который содержит от приблизительно 25 мкг до приблизительно 2,5 мг экстракта аллергена.
11. Фармацевтический продукт по п.10, который содержит от приблизительно 25 мкг до приблизительно 1,25 мг экстракта аллергена.
12. Фармацевтический продукт по п.11, который содержит от приблизительно 25 мкг до приблизительно 1 мг экстракта аллергена.
13. Фармацевтический продукт по п.12, который содержит от приблизительно 25 мкг до приблизительно 750 мкг экстракта аллергена.
14. Фармацевтический продукт по п.1, который содержит от приблизительно 0,25 мкг до приблизительно 0,25 мг основного аллергена.
15. Фармацевтический продукт по п.14, который содержит от приблизительно 2,5 мкг до приблизительно 0,25 мг основного аллергена.
16. Фармацевтический продукт по п.15, который содержит от приблизительно 2,5 мкг до приблизительно 0,125 мг основного аллергена.
17. Фармацевтический продукт по п.16, который содержит от приблизительно 2,5 мкг до приблизительно 0,1 мг основного аллергена.
18. Фармацевтический продукт по п.17, который содержит от приблизительно 2,5 мкг до приблизительно 75 мкг основного аллергена.
19. Фармацевтический продукт по п.1, который содержит дозу от приблизительно 65 до приблизительно 15000 BAU.
20. Фармацевтический продукт по п.19, который содержит дозу от приблизительно 650 до приблизительно 15000 BAU.
21. Фармацевтический продукт по п.20, который содержит дозу от приблизительно 650 до приблизительно 6000 BAU.
22. Фармацевтический продукт по п.15, содержащий основной аллерген пыльцы травы, выбранный из группы, состоящей из аллергена травы группы 1, аллергена травы групп 2/3, аллергена травы группы 5 и аллергена травы группы 6.
23. Фармацевтический продукт по п.15, содержащий основной клещевой аллерген, выбранный из группы, состоящей из клещевого аллергена группы 1 и клещевого аллергена группы 2.
24. Фармацевтический продукт по п.21, который содержит дозу от приблизительно 650 до приблизительно 4700 BAU.
25. Фармацевтический продукт по п.24, который содержит дозу от приблизительно 650 до приблизительно 3500 BAU.
26. Фармацевтический продукт по п.19, в котором аллергеном является аллерген пыльцы травы.
27. Фармацевтический продукт по п.1, в котором потеря содержания аллергена составляет приблизительно менее 30% первоначального содержания после хранения в течение 3 мес при 25°С и 60% относительной влажности.
28. Фармацевтический продукт по п.27, в котором потеря содержания аллергена составляет приблизительно менее 20% первоначального содержания после хранения в течение 3 мес при 25°С и 60% относительной влажности.
29. Фармацевтический продукт по п.28, в котором потеря содержания аллергена составляет приблизительно менее 15% первоначального содержания после хранения в течение 3 мес при 25°С и 60% относительной влажности.
30. Фармацевтический продукт по п.29, в котором потеря содержания аллергена составляет приблизительно менее 10% первоначального содержания после хранения в течение 3 мес при 25°С и 60% относительной влажности.
31. Фармацевтический продукт по п.30, в котором потеря содержания аллергена составляет приблизительно менее 5% первоначального содержания после хранения в течение 3 мес при 25°С и 60% относительной влажности.
32. Фармацевтический продукт по п.31, в котором потеря содержания аллергена составляет приблизительно менее 2% первоначального содержания после хранения в течение 3 мес при 25°С и 60% относительной влажности.
33. Фармацевтический продукт по п.3, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,15 мкг экстракта аллергена.
34. Фармацевтический продукт по п.33, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,075 мкг экстракта аллергена.
35. Фармацевтический продукт по п.34, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,025 мкг экстракта аллергена.
36. Фармацевтический продукт по п.35, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,01 мкг экстракта аллергена.
37. Фармацевтический продукт по п.4, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,015 мкг основного аллергена.
38. Фармацевтический продукт по п.37, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,0075 мкг основного аллергена.
39. Фармацевтический продукт по п.38, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,0025 мкг основного аллергена.
40. Фармацевтический продукт по п.39, в котором потеря из каждой твердой лекарственной формы составляет приблизительно менее 0,001 мкг основного аллергена.
41. Фармацевтический продукт по п.1, в котором матрикс образуют сублимированием раствора, содержащего названный аллерген.
42. Фармацевтический продукт по п.41, в котором содержание воды лекарственной формы составляет между приблизительно 2% и приблизительно 8% по массе.
43. Фармацевтический продукт по любому из пп.1-3, в котором одним образующим матрикс веществом является рыбий желатин.
44. Фармацевтический продукт по п.43, в котором соотношение рыбьего желатина к манниту составляет от приблизительно 3:5,5 до приблизительно 6,5:3.
45. Фармацевтический продукт по п.44, в котором соотношение рыбьего желатина к манниту составляет 4:3.
46. Фармацевтический продукт по п.44, в котором соотношение рыбьего желатина к манниту составляет 6,5:5,5.
47. Фармацевтический продукт по п.44, в котором соотношение рыбьего желатина к манниту составляет 6,0:5,08.
48. Фармацевтический продукт по п.43, в котором раствор содержит от приблизительно 3 до приблизительно 6,5% мас./мас. рыбьего желатина и от приблизительно 3 до приблизительно 5,5% мас./мас. маннита.
49. Фармацевтический продукт по п.48, в котором раствор содержит приблизительно 6,5% мас./мас. рыбьего желатина и приблизительно 5,5% мас./мас. маннита.
50. Фармацевтический продукт по п.48, в котором раствор содержит приблизительно 6,0% мас./мас. рыбьего желатина и приблизительно 5,08% мас./мас. маннита.
51. Фармацевтический продукт по любому из пп.1-3, в котором одним образующим матрикс веществом является предварительно желатинизированный крахмал.
52. Фармацевтический продукт по любому из пп.1-42 или 44-50, который дезинтегрируется в слюне человека приблизительно в течение 60 с.
53. Фармацевтический продукт по п.52, который дезинтегрируется в слюне человека приблизительно в течение 2 с.
54. Фармацевтический продукт по любому из пп.1-42 и 44-50, для которого аллерген выбирают из группы, состоящей из аллергенов пыльцы деревьев, аллергенов пыльцы сорняков, аллергенов пыльцы лекарственных растений, аллергенов амброзии, кошачьих аллергенов, березовых аллергенов, аллергенов травяной пыльцы, клещевых аллергенов, инсектицидных аллергенов, аллергенов ядов, аллергенов волос животных, аллергенов перхоти и пищевых аллергенов.
55. Фармацевтический продукт по п.54, в котором аллерген присутствует в виде экстракта, очищенного аллергена, модифицированного аллергена, или рекомбинантного аллергена, или мутанта рекомбинантного аллергена, или любых их комбинаций.
56. Фармацевтический продукт по п.54, в котором аллерген представляет собой аллерген травяной пыльцы.
57. Фармацевтический продукт по п.56, содержащий основной аллерген пыльцы травы, выбранный из группы, состоящей из аллергена травы группы 1, аллергена травы групп 2/3, аллергена травы группы 5 и аллергена травы группы 6.
58. Фармацевтический продукт по п.57, в котором аллерген присутствует в виде травяного экстракта.
59. Фармацевтический продукт по п.54, в котором аллерген представляет собой аллерген клеща, живущего в пыли.
60. Фармацевтический продукт по п.59, содержащий основной клещевой аллерген, выбранный из группы, состоящей из клещевого аллергена группы 1 и клещевого аллергена группы 2.
61. Фармацевтический продукт по п.59, в котором аллерген присутствует в виде экстракта клеща, живущего в пыли.
62. Фармацевтический продукт по п.54, в котором аллергеном является аллерген амброзии.
63. Фармацевтический продукт по п.54, в котором аллерген представлен в виде экстракта амброзии.
64. Фармацевтический продукт по п.54, включающий основной amb a 1 аллерген.
65. Фармацевтический продукт по п.54, в котором аллергеном является кошачий аллерген.
66. Фармацевтический продукт по п.54, в котором аллерген представлен в виде экстракта кошачьего аллергена.
67. Фармацевтический продукт по п.54, включающий основной fel d 1 аллерген.
68. Фармацевтический продукт по п.54, в котором аллергеном является березовый аллерген.
69. Фармацевтический продукт по п.54, в котором аллерген представлен в виде экстракта березового аллергена.
70. Фармацевтический продукт по п.54, включающий основной bet v 1 аллерген.
71. Фармацевтический продукт по любому из пп.1-42, 44-50 и 55-70, который содержит, по крайней мере, два разных аллергена.
72. Фармацевтический продукт по любому из пп.1-42, 44-50 и 55-70, в котором лекарственная форма содержит один или более наполнителей.
73. Фармацевтический продукт по п.72, который содержит наполнитель, выбранный из группы, состоящей из антацидов, разбавителей, мукоадгезивных веществ, усилителя, ароматизирующих веществ, вкусовых веществ, веществ, маскирующих вкус, консервантов, антиоксидантов, поверхностно-активных веществ, повышающих вязкость веществ, красителей, модификаторов рН и подсластителей.
74. Фармацевтический продукт по любому из пп.1-42, 44-50, 55-70 и 73, который содержит еще адъювант.
75. Фармацевтический продукт по п.74, для которого адъювант выбирают из группы, состоящей из солей алюминия, нетоксичных бактериальных фрагментов, цитокинов, холерного токсина, обезвреженных фракций холерного токсина, хитозана, термолабильных фрагментов Е. coli, обезвреженных фракций термолабильных фрагментов Е. coli, сапонинов, липополисахаридов, мурамил-дипептида, липосом, иммунных регуляторных последовательностей ДНК и полимеров микрочастиц лактид/гликолид.
76. Фармацевтический продукт по любому из пп.1-42, 44-50 и 55-70, 73 и 75, который содержит еще противоаллергическое лекарственное средство.
77. Фармацевтический продукт по п.76, в котором противоаллергическим лекарственным средством является антигистаминное средство.
78. Фармацевтический продукт по п.1, причем фармацевтический продукт имеет активность воды 0,4-0,5.
79. Фармацевтический продукт, который содержит перорально вводимую твердую лекарственную форму по п.1, где названная лекарственная форма имеет содержание, по крайней мере, приблизительно 50% первоначального содержания аллергена после хранения в течение 3 мес при 25°С и 60% относительной влажности.
80. Фармацевтический продукт по любому из пп.1-42, 44-50 и 55-70, 73, 75, 77 или 79, причем изделие выбирают из группы, состоящей из лепешки, таблетки, капсулы и таблетки в форме капсулы.
81. Фармацевтический продукт по любому из пп.1-42, 44-50 и 55-70, 73, 75, 77 или 79 для лечения аллергии или облегчения симптомов аллергии введением препарата через слизистую оболочку рта.
82. Мультидозовый контейнер, который содержит множество твердых лекарственных форм по любому из пп.1-81.
83. Мультидозовый контейнер по п.82, который представляет собой блистер-упаковку.
84. Мультидозовый контейнер по п.82, в котором каждая из твердых лекарственных форм содержит одинаковое количество аллергена.
85. Способ лечения аллергии или облегчения симптомов аллергии, который включает введение через слизистую оболочку рта фармацевтического продукта по любому из пп.1-81.
86. Способ получения быстродиспергируемого непрессованного твердого и стабильного фармацевтического продукта по п.1, имеющего низкую хрупкость, содержащего, по крайней мере, одно образующее матрикс вещество и подходящего для введения через слизистую оболочку полости рта, заключающего в себе эффективную дозу для десенсибилизации индувидуума, по крайней мере, к одному аллергену, который включает стадии
(a) приготовления водного раствора, содержащего, по крайней мере, один названный аллерген и, по крайней мере, одно названное образующее матрикс вещество;
(b) внесения раствора в одно или более углублений в форме;
(c) замораживания и сушки вымораживанием заполненной формы, используя стандартные условия - постоянную температуру и барокамеру, чтобы получить указанный твердый фармацевтический продукт в каждом углублении.
87. Способ по п.86, при котором стадия (b) включает в себя внесение раствора в углубления в многослойной листовой блистерной пластинке.
88. Набор для лечения аллергии или облегчения симптомов аллергии, который включает в себя
a) множество твердых пероральных лекарственных форм согласно п.1 в герметически закрытом контейнере, каждая из названных твердых пероральных форм находится в герметически закрытом огороженном месте и содержит эффективное количество аллергена, подходящего для введения через слизистую полости рта; и
b) каждая из названных твердых лекарственных форм содержит то же самое количество аллергена.
89. Набор по п.88, в котором твердая пероральная лекарственная форма дезинтегрирует в течение приблизительно 60 с.
90. Набор по п.88, в котором твердая пероральная лекарственная форма дезинтегрирует в течение приблизительно 30 с.
91. Набор по п.88, в котором твердая пероральная лекарственная форма дезинтегрирует в течение приблизительно 10 с.
92. Набор по п.88, в котором твердая пероральная лекарственная форма дезинтегрирует в течение приблизительно 5 с.
93. Набор по п.88, который содержит еще инструкции для применения многочисленных твердых лекарственных форм.
94. Набор по п.88, в котором лекарственная форма представляет собой быстродиспергируемую лекарственную форму.
95. Набор по п.88, в котором каждую из твердых лекарственных форм помещают в индивидуальные герметически закрытые блистеры в составной блистер-упаковке.
96. Набор по п.88, в котором твердые лекарственные формы содержат желатин.
97. Набор по п.96, в котором матрикс образующий агент представляет собой рыбий желатин.
98. Набор по любому из пп.88-97, в котором эффективное количество аллергена составляет приблизительно 2,5 мкг - приблизительно 3,75 мг экстракта/твердую лекарственную форму.
99. Применение твердой лекарственной формы, которая охарактеризована в любом из пп.1-42, 44-50 и 55-70, 73, 75, 77 или 79, для лечения аллергии или облегчения симптомов аллергии введением лекарственной формы через слизистую полости рта.
| Способ получения искусственных губок | 1935 |
|
SU44351A1 |
| Автоматические седиментационные весы | 1940 |
|
SU61117A1 |
| ЕР 0346622 А2, 20.10.1989. | |||
Авторы
Даты
2009-11-10—Публикация
2003-11-26—Подача