ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения очищенного экстракта аллергена и фармацевтических композиций и вакцин для применения в диагностике и лечении аллергии.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Аллергия является приобретенным расстройством гиперчувствительности иммунной системы и запускается от воздействия безвредных веществ окружающей среды, известных как аллергены. Реакция гиперчувствительности типа I является характеристикой аллергических реакций и приводит к производству чрезмерных количеств антител IgE, которые в свою очередь активируют базофилы и тучные клетки, вызывая воспалительную реакцию. Эффекты могут быть системными, такими как вазодилатация, секреция слизи, стимуляция нервов и сокращение гладких мышц, вызывая реакцию анафилаксии, или ограниченными определенной областью тела, например, дыхательной системой.
Пищевая аллергия является развивающейся крупной проблемой здравоохранения, которая затрагивает около 6% школьников и приблизительно 4% взрослых и может иметь серьезные последствия, включая фатальные анафилактические реакции(1). Аллергия, следовательно, может иметь значительное влияние на психосоциальные аспекты качества жизни, выходя за рамки непосредственных клинических эффектов аллергического состояния пациента и форм повседневной деятельности семей (2). В настоящее время стандарт медицинского наблюдения этого типа аллергии включает строгое избежание специфических аллергенов и лечение эпинефрином.
Аллергия на арахис является иммунным ответом по типу гиперчувствительности типа I (опосредованной IgE) на пищевые вещества из арахиса, вызывая чрезмерную реакцию иммунной системы. Американский фонд астмы и аллергии (The Asthma and Allergy Foundation of America) считает, что аллергия на арахис является наиболее частой причиной смерти, связанной с пищевыми продуктами в США и подсчитал, что она затрагивает 0,4-0,6% населения. Древесные орехи, такие как пекан, фисташки, кедровые орехи и грецкий орех, также являются распространенными ореховыми аллергенами.
К настоящему времени одиннадцать аллергенов (от Ara h 1 до Ara h 11) из арахиса были идентифицированы (Arachis hypogea) и многие из них секвенированы и клонированы. На основании номенклатуры Международного союза иммунологических обществ (МСИО) (International Union of Immunological Societies, IUIS), эти аллергены включают: Ara h 1, купин (вициллин-тип, 7S глобулин) массой 64 кДа; Ara h 2, конглютин (2S альбумин) массой 17 кДа; Ara h 3, купин (легумин-тип, 11S глобулин, глицинии) массой 60 кДа; Ara h 4, купин (легумин-тип, 11S, глицинии) массой 37 кДа; Ara h 5, профилин массой 15 кДа; Ara h 6, конглютин (2S альбумин) массой 15 кДа; Ara h 7, конглютин (2S альбумин) массой 15 кДа; Ara h 8, связанный с патогенезом белок, PR-10 массой 17 кДа; Ara h 9, неспецифический липид-переносящий белок 1 массой 9,8 кДа; Ara h 10, 16 кДа олеозин, и Ara h 11, 14 кДа олеозин.
Аллергия на кошек является чрезвычайно распространенной, встречаясь у до 25% индивидуумов с аллергиями. Аллергия на кошек является более распространенной, чем аллергия на перхоть собак, что может быть связано с активностью кошачьей шерсти и перхоти как аллергена, а так же с фактом, что кошек обычно не купают. Кошачий аллерген производится в больших количествах, в частности некастрированными котами мужского пола, поскольку аллерген частично находится под гормональным контролем. Перхоть является постоянно переносимой по воздуху, липкой и находится в общественных местах, даже там, где нет кошек. Это связано с тем, что перхоть переносится на одежде людей, у которых есть кошки, затем сбрасывается в общественных местах. Следовательно, кошачий аллерген является компонентом домашней пыли, даже в домах, где никогда не жила кошка. Размер частиц кошачьей перхоти крайне мал и вдыхается глубоко в легкие. Кошачья перхоть, следовательно, является распространенной причиной аллергической астмы, и владельцы кошек, которые имеют аллергию на кошек, являются более склонными к развитию симптомов астмы (8, 9).
Основные кошачьи и собачьи аллергены могут находиться в экстрактах шерсти/перхоти и слюне и поэтому рассматриваются как эпителиальные аллергены. Восемь различных аллергенов были идентифицированы у кошки, и многие из них секвенированы и клонированы. На основании веб-сайта МСИО (IUIS) эти алергены включают: Fel d 1 утероглобин массой 14 и 4 кДа; Fel d 2 альбумин массой 69 кДа; Fel d 3 цистатин массой 11 кДа; Fel d 4, липокалин массой 22 кДа; Fel d 5, иммуноглобулин А массой 400 кДа; Fel d 6, иммуноглобулин М массой 800-1000 кДа; Fel d 7, белок железы фон Эбнера массой 17,5 кДа; Fel d 8 лазерин-подобный белок массой 24 кДа. Основной кошачий аллерген, Fel d 1, был подробно охарактеризован с использованием белковых и иммунохимических техник и недавно был экспрессирован как рекомбинантный аллерген. Fel d 1 представляет димер массой приблизительно 36 кДа, который состоит из двух 17 кд субъединиц(10).
Аллергия на травы является одним из наиболее распространенных и преобладающих форм аллергии, которая влияет на людей со своими историями в течение определенного сезона. Это присутствует в воздухе поздней весной и ранними летними месяцами, что может вызвать аллергические риниты, аллергические конъюнктивиты и астму. Прямой контакт кожи с травой, от сидения на травах или движения по газону, может вызвать зуд кожи, крапивницу, атопические дерматиты. Одним из самых представительных видов является вид тимофеевка луговая Phleum pratense, выбранный в качестве лидера группы трав. Девять различных аллергенов были идентифицированы из вида Phleum pratense. На основании вебсайта Allergen1 эти аллергены включают: Phl р 1, бета-экспанзин массой 27 кДа; Phl p 2, группу трав II/III массой 10-12 кДа; Phl p 4, белок массой 55 кДа, Phl p 5 массой 32 кДа, Phl p 6 массой 11 кДа, Phl p 7, кальций-связывающий белок массой 6 кДа, Phl p 11, Ole е 1-связанный белок массой 20 кДа, Phl p 12 профилин массой 14 кДа и Phl p 13, полигалактуроназа массой 55 кДа.
Тростник (Phragmites) является родом, принадлежащим к группе трав. Было описано несколько видов, включая P. australis, или P. communis. Как сообщается, пыльца Phragmites communis является аллергенной в разных местностях. Опыление происходит между летом и осенью, в зависимости от широты и высоты над уровнем моря.
Пять различных белков со способностью связывания IgE были идентифицированы в роде Phragmites. На основании веб-сайта Allergome эти аллергены включают: экспанзин массой 30 кДа; белок, принадлежащий к группе 4 трав массой 60 кДа; рибонуклеазу массой 35 кДа, профилин массой 14 кДа и, наконец, полигалактуроназу.
Виды рода Амброзия (Ambrosia) являются сорными травами, которые растут главным образом в Центральной Европе. Растение живет только сезон, но одно растение производит до тысячи пыльцевых зерен. Тепло, влажность и ветер после восхода солнца помогают высвободить пыльцевые зерна. До сих пор три различных вида были связаны с симптомами аллергии {Amborsia artemisiifolia (амброзия полыннолистная), A. psilostachya (амброзия голометельчатая), and A. trifida (амброзия трехраздельная)). Десять различных аллергенов были идентифицированы в амброзии полыннолистной и многие из них были секвенированы и клонированы. В случае Amborsia artemisiifolia, таковые называют от Amb а 1 до Amb а 10 согласно международной номенклатуре для аллергенов. На основании веб-сайта IUIS эти аллергены включают: Amb а 1 а пектатлиазу массой 38 кДа; Amb а 2 пектатлиазу массой 38 кДа; Amb а 3 а пластоцианин массой 11 кДа; Amb а 4, дефензин-подобный белок массой 30 кДа; Amb а 5, массой 5 кДа; Amb а 6, липид-переносящий белок массой 10 кДа; Amb а 7 пластоцианин массой 12 кДа; Amb а 8 профилин массой 14 кДа; Amb а 9 полканцин массой 10 кДа и Amb а 10 полканцин-подобный белок массой 18 кДа. Для A. psilostachya был описан только аллерген Amb р 5 с неизвестной биологической функцией. Только один аллерген массой 5 кДа был также описан в A. trifida.
Сорные травы могут быть разделены на гомологичные группы в соответствии с их классифицированными аллергенными экстрактами. Амброзия была выбрана в качестве одного из лидеров этой группы растений. По этой причине, результаты, полученные с этим экстрактом пыльцы, можно экстраполировать на другие сорные травы1.
Аллергию можно лечить рядом известных способов, включая иммунотерапию аллергенами, специфическую иммунотерапию (SIT) или специфическую аллерговакцинацию (SAV), которая является одной из форм иммунотерапии аллергических расстройств, при которой пациента вакцинируют все большими дозами экстракта аллергена с целью индуцирования иммунологической толерантности. Иммунотерапия аллергенами модулирует иммунный ответ на аллерген, а не улучшение симптомов, вызванных аллергической реакцией, и может либо уменьшить потребность в лечении, уменьшить тяжесть симптомов или устранить гиперчувствительность в целом.
Хотя имеется достаточное доказательство того, что иммунотерапия аллергенами является единственным средством, за исключением избежания аллергена, для причинного лечения IgE-опосредованных аллергических расстройств, вызванных ингаляционными аллергенами и жалящими насекомыми из группы Hymenoptera, иммунотерапия экстрактами аллергенов обычно не применяется для лечения пищевой аллергии. Только два недавних исследования показали умеренную клиническую эффективность применения сублингвальной иммунотерапии у индивидуумов, сенсибилизированных на грецкий орех и персик соответственно(3, 4).
В предыдущих исследованиях предпринимались попытки индуцировать толерантность низкой дозы, путем кормления детей незначительными следами арахиса, которые постепенно становятся все больше и больше с целью построить иммунную систему (4, 6). Хотя данные ранних клинических испытаний показывают, что аллергия на арахис может быть смягчена применением иммунотерапии (7), в настоящее время отсутствует подтвержденное лечение для предотвращения или излечения аллергических реакций на арахис, с единственным эффективным вариантом для атопических индивидуумов в том, чтобы избегать пищевых продуктов, которые содержат или загрязнены целыми орехами арахиса, частицами арахиса и арахисовыми маслами и обеспечение оперативного доступа к самостоятельно вводимому эпинефрину.
Одним из рисков иммунотерапии является тот, что введение аллергена сенсибилизированному пациенту может вызвать тяжелую аллергическую реакцию или анафилактический шок. Со времени ее первого применения в начале 20-го века, много усилий было предпринято для дальнейшего улучшения безопасности и эффективности иммунотерапии аллергенами. Одним из подходов является использование аллерговакцин с уменьшенной аллергенностью, но с поддержанием иммуногенности.
Патенты США 5770698 и EP 0662080 раскрывают способ удаления веществ и других материалов низкомолекулярного веса с целью очистки экстракта аллергена и увеличения окончательного содержания аллерген/белок. Способ включает разрыв электростатических, гидрофобных или других физических сил в таких условиях, чтобы отделить не вызывающие аллергию вещества от аллергически активных белков. Способ может включать мягкую кислотную обработку путем снижения pH ниже pI соответствующих белков аллергенов.
Один из разнообразных способов уменьшения аллергенности включает химическое модифицирование нативных экстрактов аллергенов с альдегидом, главным образом, формальдегидом и глутаральдегидом, для производства аллергоидов. Эта обработка альдегидом приводит к продуктам реакции (главным образом полимерам), которые потеряли часть своей аллергенности (т.е. проявляют уменьшение IgE-реактивных В-клеточных эпитопов), уменьшая аллергические побочные эффекты. В то же время, нативная иммуногенность аллергена сохраняется благодаря неизмененным Т-клеточным эпитопам. Этот путь модификации аллергена был выбран некоторыми производителями аллерговакцин для разработки коммерчески доступных продуктов, основанных на этом принципе. В целом, существует тенденция к дальнейшей очистке экстрактов аллергенов, тщательной селекции наиболее важных и клинически значимых аллергенов.
Патенты EP 1834649 и EP 1834648 раскрывают способы получения экстрактов аллергенов, однако такие способы не достаточно удаляют загрязняющие белки низкомолекулярного веса.
Существует необходимость дальнейшего улучшения безопасности и эффективности лекарственных средств для применения в иммунотерапии аллергических расстройств путем оптимизации способа очистки аллергенов, чтобы гарантировать, что загрязняющие белки низкомолекулярного веса, раздражающие вещества и токсичные компоненты устранены.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения разработали промежуточный этап, предшествующий полимеризации для дальнейшего улучшения способа полимеризации и уменьшения аллергенности некоторых экстрактов, таких как клещи, пыльцевые зерна, в том числе трав, сорных трав и деревьев, эпителиальные аллергены и пищевые аллергены, предшествующий обработке глутаральдегидом.
Целью настоящего изобретения является обеспечение способа получения экстрактов, содержащих аллергены и фармацевтических композиций и вакцин для лечения аллергии. Дальнейшей целью является обеспечить оптимально эффективный экстракт аллергена со сниженной IgE - связывающей способностью, но который сохраняет свою иммуногенную способность.
В соответствии с первым аспектом настоящего изобретения, обеспечивается способ производства экстракта аллергена, включающий:
a) исходный материал, содержащий аллерген, контактирует с жидким экстракционным агентом для получения смеси, содержащей липиды растворенные в жидкой фазе и твердой фазы, содержащей остаток исходного материала, включающего аллергены и белки.
b) смесь подвергают первому этапу разделения для выделения остатка исходного материала,
c) остаток исходного материала контактирует со средством экстракции аллергенов с получением смеси аллергенов, растворенной в жидкой фазе, и твердой фазы, содержащей неаллергенный остаток.
d) смесь подвергают второму этапу разделения для выделения аллергенов, растворенных в жидкой фазе, для получения сырого экстракта аллергена,
e) сырой экстракт аллергена подвергают этапу удаления низкомолекулярной фракции для удаления молекул с молекулярным размером менее 3,5 кДа и
f) проводят этап е), пока экстракт аллергена не будет иметь проводимость ниже 1000 мкСм/см при 3-5°C для получения очищенного нативного экстракта аллергена.
Следующий этап обработки может включать
g) подкисление нативного экстракта аллергена, удаление молекул с молекулярным размером менее 3,5 кДа и нейтрализация pH для получения депигментированного экстракта аллергена.
Способ может в дальнейшем включать этап полимеризации, включающий:
h) контакт нативного экстракта аллергена или депигментированного экстракта аллергена с альдегидом и
i) удаление молекул с молекулярным размером менее 100 кДа.
Согласно второму аспекту настоящего изобретения, обеспечивается экстракт аллергена, доступный в соответствии со способом первого аспекта настоящего изобретения.
Согласно третьему аспекту настоящего изобретения, обеспечивается очищенный экстракт аллергена для применения в качестве активного терапевтического вещества для лечения аллергии.
ОПРЕДЕЛЕНИЯ
"Аллерген" может быть определен как молекула, способная индуцировать IgE-ответ и/или аллергическую реакцию I типа.
Термин "депигментированный", относящийся к данному документу, может быть определен как полуочищенный экстракт аллергена, полученный из нативного экстракта путем удаления посторонних веществ, включая адсорбированные пигменты, которые он может содержать.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Аллергенные экстракты настоящего изобретения могут быть произведены из любого исходного материала, содержащего природные аллергены, как известно, вызывающие IgE-опосредованную иммунную реакцию у человека. Такие аллергены могут включать пищевые аллергены (например, арахис), переносимые по воздуху аллергены (например, пыльца трав, дерева, злака и сорных трав, пылевые клещи, грибы и плесени), аллергены насекомых (например, таракана, блох, пчелиный и осиный яд) и эпителиальные аллергены (шерсть животных, перхоть животных, например перхоть кошек и собак).
Пыльцевые аллергены из деревьев, трав и сорных трав происходят из таксономической группы порядков Fagales (например, Alnus и Betula), Lamiales (например, Olea и Plantago), Poales (например, Phleum pratense), Asterales (например, Ambrosia и Artemisia), Cayophyllales (например, Chenopodium и Salsola), Rosales (например, Parietaria), Proteales (например, Platanus), и т.д. Пылевые клещи относятся к группе отрядов Astigmata (например, Dermatophagoides и Euroglyphus). Переносимые по воздуху аллергены, произведенные от плесеней и грибов, относятся к отряду Pleosporales (например, Alternarid), Capnodiales (например, Cladosporium) и т.д.
Исходный материал согласно настоящему изобретению может быть любым аллергеном, включая пищевые аллергены, арахис, все виды земляных орехов, переносимые по воздуху аллергены (например, пыльца (древесная пыльца, пыльца сорных трав, пыльца трав, пыльца зерновых), пылевые клещи, грибы, плесени)), аллергены клещей, трав, деревьев и сорных трав, эпителиальные аллергены (шерсть животных, перхоть животных, например, кошачья шерсть и перхоть и собачья шерсть и перхоть) и аллергены насекомых (например, тараканов, блох, пчелиный и осиный яд).
Предпочтительно пищевым аллергеном является арахис.Более предпочтительно, арахисовым аллергеном является Arachis hypogeal.
Аллергены, переносимые по воздуху, могут выбирать/могут выбирать из групп: Древесная пыльца (Alnus glutinosa, Betula alba, Corylus avellana, Cupressus arizonica,, Olea europea, Platanus sp), пыльца трав (Cynodon dactylon, Dactylis glomerata, Festuca elatior, Holcus lanatus, Lolium perenne, Phleum pratense, Phragmites communis, Poa pratensis), пыльца сорных трав (Ambrosia elatior, Artemisia vulgaris, Chenopodium album, Parietaria judaica, Plantago lanceolata, Salsola kali) и пыльца зерновых (Avena sativa, Hordeum vulgare, Secale cereal, Triticum aestivum, Zea mays), пылевые клещи (Acarus siro, Blomia tropicalis, Dermatophagoides farinae, Dermatophagoides microceras, Dermatophagoidespteronyssinus, Euroglyphus maynei, lepidoglyphus destructor, Tyrophagus putrescentiae), грибы и плесени (Alternaria alternate, Cladosporium herbarum, Aspergillusfumigatus)
Эпителиальные Аллергены можно выбирать из любого животного, включая кошачью шерсть и перхоть, собачью шерсть и перхоть, лошадиную шерсть и перхоть, человеческие волосы и перхоть, кроличью шерсть и перхоть и перья.
Аллергены насекомых можно выбирать из муравья, блохи, клещей (Acarus siro, Blomia tropicalis, Dermatophagoides farinae, Dermatophagoides microceras,
Dermatophagoidespteronyssinus, Euroglyphus maynei, lepidoglyphus destructor, Tyrophagus putrescentiae), таракана, осиного яда и пчелиного яда.
Предпочтительно, исходный материал выбирают из пищевых аллергенов (Arachis hypogeal), пыльцы (Alnus glutinosa, Betula alba, Corylus avellana, Cupressus arizonica,, Olea europea, Platanus sp, Cynodon dactylon, Dactylis glomerata, Festuca elatior, Holcus lanatus, Lolium perenne, Phleum pratense, Phragmites communis, Poa pratensis, Ambrosia elatior, Artemisia vulgaris, Chenopodium album, Parietaria judaica, Plantago lanceolata, Salsola kali, Avena sativa, Hordeum vulgare, Secale cereal, Triticum aestivum, Zea mays), пылевых клещей (Acarus siro, Blomia tropicalis, Dermatophagoides farinae, Dermatophagoides microceras, Dermatophagoidespteronyssinus, Euroglyphus maynei, lepidoglyphus destructor, Tyrophagus putrescentiae), грибов и плесеней (Alternaria alternate, Cladosporium herbarum, Aspergillusfumigatus), эпителиальных аллергенов (кошачья шерсть и перхоть, собачья шерсть и перхоть, лошадиная шерсть и перхоть, человеческие волосы и перхоть, кроличья шерсть и перхоть и перья), аллергенов насекомых (муравья, блох, клещей таракана, осиного и пчелиного яда).
Более предпочтительно исходный материал выбирают из арахиса (Arachis hypogea), пыльцы (Olea europaea, Parietaria judaica, Phragmites communis и Phleum pratense), клещей (Dermatophagoides pteronyssinus) и эпителиального (кошачья перхоть).
В предпочтительном варианте осуществления настоящего изобретения исходный материал выбирают из Arachis hypogeal, Olea europaea, Parietaria judaica, Phleum pratense, Dermatophagoides pteronyssinus, Phragmites communis, Parietaria judaica и кошачьей перхоти.
В еще более предпочтительном варианте осуществления настоящего изобретения исходный материал выбирают из Arachis hypogea, Phleum pratense, Phragmites communis, Parietaria judaica и кошачьей перхоти.
В более предпочтительном варианте осуществления настоящего изобретения аллергеном является Arachis hypogeal.
Когда исходным материалом является арахис, предпочтительно шкурки удаляют, или материал может быть давленным или молотым. Арахис может быть жареным, обжаренным, запеченным или сырым.
Исходный материал могут обрабатывать для создания максимальной площади поверхности для контакта с жидким экстракционным средством. Исходный материал можно гомогенизировать, перемешивать, давить или молоть для получения гомогенной суспензии для жидкостной экстракции. Этап жидкостной экстракции является этапом "обезжиривания" для удаления липофильных соединений, таких как липиды и жирные кислоты, из исходного материала.
Жидкий экстракционный агент может быть ацетоном, который может быть холодным. Этап жидкостной экстракции могут осуществлять в соотношении 1:1 (вес исходного материала/вес жидкого экстракционного средства), или любом отношении, где вес жидкого экстракционного средства превышает вес исходного материала, например, 1:2, 1:3, 1:5, 1:10. Этап жидкостной экстракции предпочтительно осуществляют в соотношении 1 кг исходного материала к 2 л жидкого экстракционного средства. Этап жидкостной экстракции предпочтительно осуществляют в течение достаточного времени для того, чтобы липиды в исходном материале растворились в жидком экстракционном средстве, что может быть более 1 минуты, предпочтительно в течение 5 мин, более предпочтительно в течение 30 минут и наиболее предпочтительно в течение 1 часа или больше. Этап жидкостной экстракции можно осуществлять при температуре от 20 до 25°C, но предпочтительно осуществляют холодным при температуре от 2 до 6°C, а наиболее предпочтительно от 3 до 5°C. В течение этапа жидкостной экстракции, исходный материал предпочтительно размешивают и взбалтывают с жидким экстракционным средством.
Первым этапом разделения может быть фильтрация.
После первого этапа разделения, остаток исходного материала можно промывать с жидким экстракционным средством. Факультативно, остаток исходного материала можно в дальнейшем экстрагировать жидким экстракционным средством, затем разделять. Предпочтительно, осуществляются один, два или более дополнительных этапов жидкостной экстракции. Жидкостная экстракция остатка исходного материала предпочтительно продолжается до тех пор, пока жидкое экстракционное средство не будет оставаться прозрачным после контакта с остатком исходного материала.
После жидкостной экстракции, остаток исходного материала можно высушивать. Остаток исходного материала можно высушивать при температуре от 2 до 25°C, и предпочтительно сушат при комнатной температуре. Этап сушки предпочтительно продолжают в течение достаточного времени для удаления жидкого экстракционного средства из остатка исходного материала, которое может составлять от 1 до 24 часов, от 6 до 18 часов, от 10 до 14 часов, предпочтительно около 12 часов.
Аллергены можно получать из "обезжиренного" остатка исходного материала путем экстракции со средством экстракции аллергена для получения сырого экстракта аллергена, содержащего аллергены, растворенные в жидкой фазе и твердой фазы, включающей "нежелательный", неаллергенный остаток. Средство экстракции аллергена может быть водным раствором и предпочтительно включать буферное средство. Средство экстракции аллергена может включать PBS и/или NaCl, например, раствор 0,01 М PBS/0,15 М NaCl. Остаток исходного материала могут экстрагировать в средстве экстракции аллергена в любом соотношении, где вес средства экстракции аллергена превышает вес остатка исходного материала, например, 1:2, 1:3, 1:5, 1:10, 1:20, 1:50. Предпочтительно, остаток исходного материал экстрагируют в средстве экстракции аллергена в соотношении 1:10 остаток исходного материала: средство экстракции аллергена (вес/вес). Соотношение остатка исходного материала к средству экстракции аллергена на этапе экстракции может варьировать, но должно быть таким, чтобы аллергены в остатке исходного материала могли растворяться в средстве экстракции аллергена. Экстракцию остатка исходного материала со средством экстракции аллергена предпочтительно осуществляют в течение достаточного времени для того, чтобы аллергены в остатке исходного материала растворились в средстве экстракции аллергена, которое может быть от 30 минут до 12 часов, предпочтительно от 1 до 6 часов, более предпочтительно от 2 до 5 часов и наиболее предпочтительно около 4 часов. Этап экстракции аллергена могут осуществлять при температуре от 20 до 25°C, но предпочтительно осуществляют холодным при температуре от 2 до 6°C, а наиболее предпочтительно от 3 до 5°C. На этапе экстракции аллергена, остаток исходного материала предпочтительно перемешивают или взбалтывают со средством экстракции аллергена. После этапа экстракции аллергена, аллергены, растворенные в жидкой фазе, можно отделять от неаллергенного остатка, для получения сырого экстракта аллергена. Этап разделения представляет собой предпочтительно центрифугирование, хотя многие техники для отделения твердого вещества от жидкости применимы, что хорошо известны специалистам в данной области. Предпочтительно, аллергены, растворенные в жидкой фазе, центрифугируют при температуре от 2 до 6°C, предпочтительно от 3 до 5°C, в течение достаточного времени, чтобы осадить неаллергенный остаток в виде гранул, например, от 1 минуты до 1 часа или более 1 часа. Сырой экстракт аллергена (например, супернатант, содержащий растворенные аллергены), можно хранить при температуре при температуре от 2 до 6°C. Гранулу неаллергенного остатка можно дополнительно экстрагировать со средством экстракции аллергена, применяя те же условия, что на первом этапе экстракции аллергена, и желательно на более длительный период экстракции, такой как 4-8 часов, 8-12 часов или более 12 часов. После второго этапа экстракции аллергена, аллергены, растворенные в жидкой фазе, можно отделять от неаллергенного остатка для получения сырого экстракта аллергена. Сырые экстракты аллергена из первого и второго этапов экстракции аллергена предпочтительно объединяют для дальнейшей обработки. Сырой экстракт аллергена могут фильтровать, например, с использованием 0,45 мкм размер пор. Сырой экстракт аллергена могут подвергать этапу удаления низкомолекулярной фракции для удаления молекул, имеющих низкий молекулярный размер, такие как соли и другие неаллергенные соединения. Заявителем экспериментально установлено, что композиция белков и аллергенов экстрактов арахиса является от 8 до 150 кДа, и эти аллергены должны быть сохранены на этапе удаления молекулярной фракции. Например, белок, переносящий липиды (LTP) арахиса - важный аллерген - 8кДа и который необходимо сохранить на протяжении этапа удаления низкомолекулярной фракции. На этапе е) молекулы, имеющие молекулярный размер менее 8 кДа, или 7 кДа, или 6 кДа, или 5 кДа, 4 кДа или 3,5 кДа можно удалять. Этап удаления низкомолекулярной фракции предпочтительно продолжают до тех пор, пока проводимость экстракта аллергена при 3-5°C не будет менее 900 мкСм/см, или менее 800 мкСм/см, или менее 700 мкСм/см, или менее 600 мкСм/см или более предпочтительно менее 500 мкСм/см. Этап удаления низкомолекулярной фракции предпочтительно продолжают до тех пор, пока проводимость экстракта аллергена при 3-5°C не будет от 200 до 1000 мкСм/см, или от 300 до 900 мкСм/см и наиболее предпочтительно от 400 до 800 мкСм/см.
Полученный в результате очищенный нативный экстракт аллергена можно фильтровать, например, с применением 0,45 и/или 0,22 мкм размеров пор.
Нативный экстракт аллергена можно применять в получении фармацевтической композиции или вакцины для целей стандартизации, диагностики, синтеза и вакцинации.
Способ может в дальнейшем включать дальнейший этап обработки, где неаллергенные соединения, адгезирующие к белку аллергена, удаляют с применением средств, которые разрушают электростатические, гидрофобные или других физические силы, которые ответственны за адгезию неаллергенных соединений к белкам. Средства для разрушения электростатических, гидрофобных или других физических сил можно выбирать из группы химических средств, включающей кислотные и щелочные материалы, в том числе анионо- и катионообменные материалы, соли и электрического тока. Кислотные и щелочные химические средства можно применять в количестве, вызывающем превышение изоэлектрической точки белков. Экстракт аллергена, полученный в результате дальнейшего этапа обработки далее по тексту именуется депигментированным экстрактом аллергена.
Дальнейший этап обработки может включать
g) подкисление нативного экстракта аллергена, удаление молекул с молекулярным размером менее 3,5 кДа и нейтрализацию pH для получения депигментированного экстракта аллергена.
Дальнейший этап обработки предпочтительно включает мягкую кислотную обработку. При мягкой кислотной обработке pH аллергенных белков может быть понижен до менее чем pH 3, например, значение pH от 2,0 до 2,5. РН аллергенных белков может быть от 2,0 до 6,0. Заявителем экспериментально установлено, что оптимум pH для отсоединения неаллергенных соединений, адгезирующих к аллергенным белкам, является pH от 2,0 до 2,1. Значение pH ниже 2,0 приводит к неполноте белкового профиля депигментированного экстракта аллергена, а недостаточно низкий pH, например, выше 3,0, приводит к неполному удалению неаллергенных соединений в полученном в результате депигментированном экстракте аллергена.
РН нативного экстракта аллергена можно снижать с применением подходящей кислоты, например HCl. Подкисленный экстракт можно хранить при низких pH 1-60 минут, предпочтительно 5-30 минут, более предпочтительно 10-20 минут и наиболее предпочтительно около 15 минут. Молекулы, имеющие молекулярный размер менее 3,5 кДа можно удалять на этапах удаления низкомолекулярной фракции.
После дальнейшего этапа обработки, полученный в результате депигментированный экстракт можно собирать и pH экстракта аллергена можно нейтрализовать с применением подходящих щелочей, например NaOH. РН могут доводить до значения, где избегается осаждение белков, например, выше pH 7,0, предпочтительно pH от 7,0 до 8,0, более предпочтительно pH от 7,0 до 7,5 и наиболее предпочтительно pH от 7,3 до 7,4. Дальнейший этап обработки может включать:
g) подкисление нативного экстракта аллергена до pH 2-2,1 и сохранение подкисленного экстракта в течение 5-30 минут, затем подвержение экстракта этапу удаления низкомолекулярной фракции для удаления молекул с молекулярным размером менее 3,5 кДа и доведение pH до 7,3-7,4 для получения депигментированного экстракта аллергена.
Дальнейший этап обработки может включать подкисление нативного экстракта аллергена до pH от 2,0 до 4,0.
Средства для разрушения электростатических сил могут включать электрический ток в форме электрофореза. Неаллергенные соединения могут иметь молекулярную массу менее 8000 Да, 5000 Да и предпочтительно менее чем 3500 и могут включать флавоноиды и/или их гликозиды.
Этап удаления низкомолекулярной фракции может быть этапом диализа, где экстракт диализируют против диализата, такого как очищенная вода или буфер. Этап удаления низкомолекулярной фракции можно осуществлять при температуре от 20 до 25°C, но предпочтительно проводят холодным от 2 до 6°C, а наиболее предпочтительно от 3 до 5°C. Этап удаления низкомолекулярной фракции можно осуществлять в течение 12-24 часов, где растворитель, или в случае диализа, диализат, регулярно меняют для поддержания реакции.
Полученный в результате депигментированный экстракт аллергена можно фильтровать, например, с применением 0,45 мкм и/или 0,22 мкм размера пор, и могут замораживать или лиофилизировать для хранения.
Каждый экстракт, полученный с применением способа настоящего изобретения можно в дальнейшем обрабатывать. Способ может дополнительно включать этап полимеризации, включающий:
h) контакт нативного экстракта аллергена или депигментированного экстракта аллергена с альдегидом и
i) удаление молекул с молекулярным размером менее 100 кДа.
Альдегидом может быть любой подходящий альдегид, к примеру, глутаральдегид или формальдегид.
Этап полимеризации может включать:
h) контакт нативного экстракта аллергена или депигментированного экстракта аллергена с глутаральдегидом или формальдегидом,
i) подвержение экстракта этапу удаления молекулярной фракции для удаления молекул с молекулярным размером менее 100 кДа и
j) проведение этапа i) до тех пор, пока экстракт аллергена не будет иметь проводимость ниже 210 мкСм/см при 3-5°C и/или будет отсутствовать глутаральдегид для получения полимеризованного экстракта аллергена или депигментированного полимеризованного экстракта аллергена.
Если экстракт полимеризации лиофилизируют, его могут восстанавливать в буфере, например, 0,01М PBS/0,15M NaCl, до конечной концентрации 0,1-500 мг/мл, предпочтительно 1-100 мг/мл и наиболее предпочтительно 10-50 мг/мл.
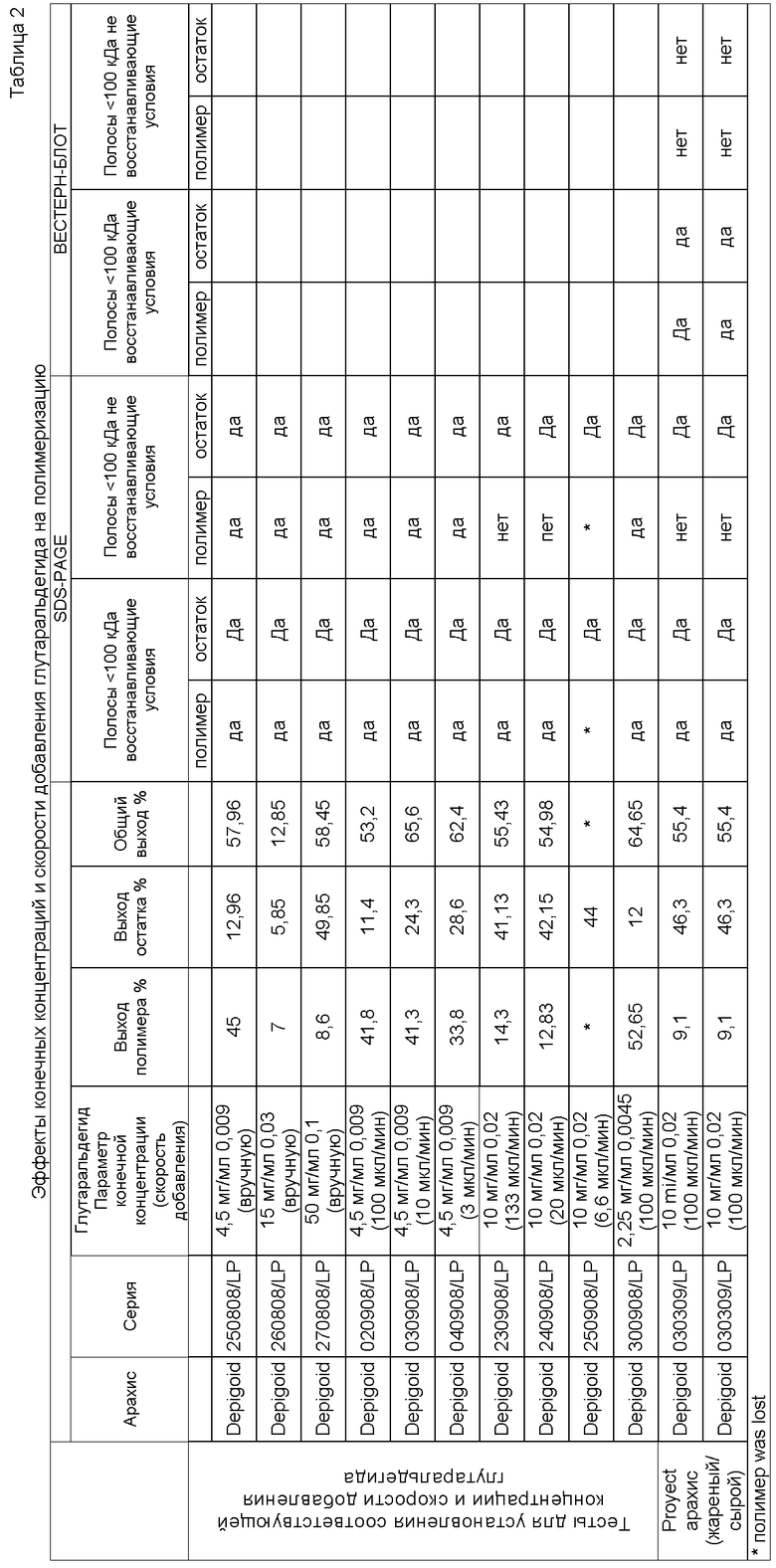
Реакцию полимеризации предпочтительно осуществляют до завершения, так что полосы белка <100 кДа (например, 14-25 кДа) не обнаруживаются невосстанавливающим SDS-PAGE в полимеризованном экстракте. Заявителем экспериментально определено (см. таблицу 2), что два параметра влияют на оптимальные условия для полимеризации.
Во-первых, важна конечная концентрация глутаральдегида, при которой возрастающие концентрации глутаральдегида снижают выход полимера и увеличивают выход остатка, полученного путем центрифугирования перед диализом. В отличие от ранее известных условий полимеризации, применение концентрации глутаральдегида около 5 мг/мл (т.е., 0,009 мл глутаральдегида на мл экстракта аллергена), оптимальная концентрация глутаральдегида, как было экспериментально установлено, является примерно вдвое большей, чем известные количества, т.е. 10 мг/мл (0,02 мл глутаральдегида на мл экстракта аллергена). Альдегид могут добавлять в диапазоне 1-20 мг/мл. Несмотря на то, что использование ранее известных количеств конечной концентрации глутаральдегида может привести к некоторой полимеризации аллергенов, предпочтительно, когда альдегид добавляют до конечной концентрации 10 мг/мл или в соотношении 0,02 мл глутаральдегида на мл экстракта для достижения оптимальной полимеризации.
Во-вторых, заявителем установлено, что снижение скорости добавки глутаральдегида уменьшает выход полимера и увеличивает выход остатка. Альдегид можно добавлять к экстракту с постоянной скоростью, например, от 0,001 до 0,5 мл в минуту (1-500 мкл/мин, 60-3000 мкл/час).
Реакцию полимеризации можно поддерживать на срок от 1-12 ч, предпочтительно 7 часов при комнатной температуре. Реакцию полимеризации можно останавливать с использованием глицина в количестве 40 мг на мл полимеризованного раствора экстракта. Остановленную реакцию можно поддерживать в течение ночи при 3-5°C, предпочтительно при перемешивании. Полимеризованные аллергены в жидкой фазе можно отделять от нерастворимого остатка для получения полимеризованного экстракта аллергена или депигментированного полимеризованного экстракта аллергена. Этапом разделения является предпочтительно центрифугирование, хотя применимы многие способы разделения, при этом таковые хорошо известны специалистам в этой области. Предпочтительно, экстракт центрифугируют при температуре от 2 до 6°C, предпочтительно от 3 до 5°C, в течение достаточного времени для того, чтобы осадить нерастворимый остаток, в виде гранулы, например, от 1 минуты до 1 часа или в течение 1 часа. Супернатант (содержащий растворимые аллергены) можно собирать и подвергать этапу удаления молекулярной фракции (i).
На этапе i) молекулы, имеющие молекулярный размер менее 150 кДа, можно удалять. Молекулы с молекулярным весом более 3 мДа, как обнаружено, осаждаются, и также могут быть удалены во время этапа полимеризации.
Предпочтительно, этапом удаления молекулярной фракции является этап диализа, на котором экстракт диализируют против диализата, такого, как очищенная вода или буфер, при 3-5°C. Этап удаления молекулярной фракции можно продолжать до тех пор, пока проводимость, измеренная при 3-5°C не будет менее 200 мкСм/см, более предпочтительно менее 175 мкСм/см, более предпочтительно менее 150 мкСм/см, более предпочтительно менее 125 мкСм/см, более предпочтительно менее 100 мкСм/см, более предпочтительно от 50 до 200 мкСм/см и наиболее предпочтительно от 100 до 150 мкСм/см.
Полученный в результате экстракт аллергена можно фильтровать, например, с применением 0,45 мкм и/или 0,22 мкм размера пор, и могут замораживать или лиофилизировать для хранения.
Любой из этапов удаления низкомолекулярной фракции с), е) или g) может включать этап ультрафильтрации, этап диафильтрации, этап диализа или фильтрования.
В своей простейшей форме способ настоящего изобретения может включать получение нативного растворимого экстракта аллергена, факультативно дальнейшую обработку экстрактом, например, с помощью мягкой кислотной обработки для удаления неаллергенных соединений, имеющих низкий молекулярный размер и полимеризацию экстракта с применением альдегида. Нативным растворимым экстрактом аллергена могут быть аллергены арахиса, пыльцы, злака, эпителиальные, плесени, гриба, насекомого и клеща. Способ настоящего изобретения обеспечивает экстракт аллергена, который демонстрирует уменьшенную способность к связыванию IgE, но который сохраняет свою иммуногенную способность.
Настоящее изобретение также включает лечение аллергии и диагностический препарат для аллергии, оба включающие экстракты аллергенов, полученные способами настоящего изобретения в качестве активного ингредиента. Аллергия может быть связанной с воздействием различных аллергенов, которые вызывают IgE-опосредованные аллергические реакции, как описано в данном документе.
Согласно второму аспекту настоящего изобретения обеспечивается экстракт аллергена, получаемый согласно способу первого аспекта настоящего изобретения. Обеспечивается очищенный экстракт аллергена для применения в качестве активного терапевтического вещества. Обеспечивается нативный экстракт аллергена, полимеризованный нативный экстракт аллергена, депигментированный экстракт аллергена, депигментированный полимеризованный экстракт аллергена, получаемые согласно способу первого аспекта настоящего изобретения. Предпочтительно, экстрактом является полимеризованный нативный экстракт аллергена и более предпочтительно депигментированный полимеризованный экстракт аллергена.
Экстракт аллергена могут выбирать из арахиса (Arachis hypogeal), пыльцы (Olea europaea, Parietaria judaica, Phragmites communis, Parietaria judaica и Phleum pratense), клещей (Dermatophagoides pteronyssinus) и эпителиальных (кошачья шерсть).
Экстракт аллергена может быть предназначен для использования в лечении аллергии. В предпочтительном варианте осуществления экстракт аллергена Arachis hypogeal может быть предназначен для применения в лечении аллергии на арахис.
Депигментированный полимеризованный экстракт аллергена может быть охарактеризован следующими физико-химическими и биологическими свойствами:
i. Растворимость в воде,
ii Отсутствие неполимеризованных аллергенов/белков с молекулярной массой ниже 100 кДа (определяются в виде полос на SDS-PAGE в невосстанавливающих условиях)
iii Отсутствие полос IgE-распознавания с молекулярной массой ниже 100 кДа (определяется путем иммуноблота в невосстанавливающих условиях)
iv Отсутствие полимеризованных молекул с молекулярной массой ниже 100 кДа (определяется гель-хроматографией с ВЭЖХ (HPLC)).
v 75% уменьшение свободных аминогрупп по отношению к нативному экстракту (определяется способом fluram).
vi Уменьшение биологической активности (95%) по отношению к нативному экстракту аллергена (определяется ELISA экспериментами IgE ингибирования с использованием специфического пула сывороток от сенсибилизированных индивидуумов) и
vii Отсутствие аномальной токсичности у мышей.
Экстракты аллергенов настоящего изобретения можно применять в качестве активного компонента лекарства для лечения индивидуумов с аллергией, с целью индуцирования устойчивости к определенным аллергенам.
Обеспечивается применение экстракта аллергена согласно настоящему изобретению в диагностике иммунологических расстройств, предпочтительно для выявления аллергических заболеваний. Обеспечивается применение экстракта аллергена согласно настоящему изобретению для лечения аллергии или в производстве лекарственного средства для лечения аллергии. Возможно применение для иммунотерапии. Возможно применение для целей стандартизации, диагностики, вакцинации и синтеза. Возможно применение в терапевтическом лечении больных, предпочтительно в иммунотерапии. Возможно применение в мониторинге больных в течении иммунотерапии.
Согласно дальнейшему аспекту настоящего изобретения обеспечивается фармацевтическая композиция, включающая экстракт аллергена согласно настоящему изобретению. Обеспечивается фармацевтическая композиция для лечения аллергии, которая включает в качестве активного ингредиента фармацевтически эффективное количество экстракта аллергена согласно настоящему изобретению и по крайней мере один фармацевтически приемлемый носитель или разбавитель. Обеспечивается диагностическая композиция для аллергии, которая включает в качестве активного ингредиента диагностически эффективное количество экстракта аллергена согласно настоящему изобретению.
Согласно дальнейшему аспекту настоящего изобретения обеспечивается вакцина, содержащая экстракт аллергена согласно настоящему изобретению. Фармацевтическая композиция и вакцина могут в дальнейшем включать одно или несколько вспомогательных веществ, растворителей, консервантов или их смеси. Фармацевтическая композиция или вакцина могут включать физиологически приемлемый носитель. Используемое здесь выражение "фармацевтически приемлемый" предпочтительно означает - утвержденный контрольным органом правительства, или перечисленный в Европейской Фармакопее или Фармакопее США или другой общепризнанной фармакопее для использования у людей.
Такими фармацевтически приемлемыми носителями могут быть стерильные жидкости, такие как вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные. Солевые растворы и водные растворы декстрозы и глицерина также можно использовать в качестве жидких носителей, особенно для инъекционых растворов. Подходящие фармацевтические наполнители включают маннитол, человеческий сывороточный альбумин (HSA), крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, карбонат магния, стеарат магния, стеарат натрия, глицерина моностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и тому подобное.
Согласно дальнейшему аспекту настоящего изобретения обеспечивается способ получения аллерговакцины, включающий составление экстракта аллергена согласно настоящему изобретению с одним или более вспомогательными веществами, разбавителями, консервантами или их смесями.
Обеспечивается вакцина, получаемая согласно способу дальнейшего аспекта настоящего изобретения. Вакцина может быть для подкожного или подъязычного применения.
Обеспечивается применение вакцины согласно настоящему изобретению в лечении аллергии или в производстве лекарственного средства для лечения аллергии.
Согласно дальнейшему аспекту настоящего изобретения обеспечивается способ предотвращения чувствительности к аллергену, включающий этап: подвержение индивидуума действию эффективного количества экстракта аллергена, фармацевтической композиции или вакцины настоящего изобретения.
Согласно дальнейшему аспекту настоящего изобретения обеспечивается способ лечения аллергии у чувствительного индивидуума, включающий введение индивидууму эффективного количества экстракта аллергена, фармацевтической композиции или вакцины настоящего изобретения. Экстракт аллергена, фармацевтическую композицию или вакцину можно вводить подкожно или подъязычно и можно вводить в виде постоянной или возрастающей дозировки.
Индивидуум может быть человеком или животным, предпочтительно человеком.
Краткое описание фигур.
Фигура 1: Кратко излагает способ производства экстрактов аллергена.
Фигура 2: ВЭЖХ (HPLC) анализ нативного экстракта аллергена арахиса: BioRad стандарт низкого диапазона (полоса 1), нативный экстракт (полоса 2), осадок (полоса 3), фракция 20 (полоса 4), фракция 21 (полоса 5), фракция 40 (полоса 6), фракция 78 (полоса 7), фракция 96 (полоса 8), фракция 111 (полоса 9);
Фигура 3: ВЭЖХ (HPLC) анализ депигментированного полимеризованного экстракта аллергена арахиса;
Фигура 4: ВЭЖХ (HPLC) анализ депигментированного полимеризованного остатка экстракта аллергена арахиса: BioRad стандарт низкого диапазона (полоса 1), депигментированный полимеризованный остаток экстракта (полоса 2), осадок (полоса 3), фракция 21 (полоса 4), фракция 51 (полоса 5), фракция 74 (полоса 6), фракция 75 (полоса 7), фракция 120 (полоса 8);
Фигура 5: SDS PAGE анализ 40 мкг экстракта аллергена арахиса: STD (BioRad стандарт низкого диапазона), полосы 1-4 в восстанавливающих условиях, полосы 5-8 в невосстанавливающих условиях, арахис 230209/LN нативный (полоса 1), арахис 230209/LD депигментированный (полоса 2), арахис 030309/LP депигментированный/полимеризованный (полоса 3), арахиса 030309/LP депигментированный/полимеризованный остаток (полоса 4), арахис 230209/LN нативный (полоса 5), арахис 230209/LD депигментированный (полоса 6), арахис 030309/LP депигментированный/полимеризованный (полоса 7), а также арахиса 030309/LP депигментированный/полимеризованный остаток (полоса 8);
Фигура 6: ИЭФ анализ 40 мкг экстракта аллергена арахиса; стандартные Bio-Rad ИЭФ маркеры, pl 4,45-9,6 (полосы 1 и 2), арахис 230209/LN нативный (полоса 3), арахис 230209/LD депигментированный (полоса 4), арахис 030309/LP депигментированный/ полимеризованный (полоса 5), арахиса 030309/LP депигментированный/полимеризованный остаток (полоса 6);
Фигура 7: Иммуноблот-анализ 40 мкг экстракта аллергена арахиса в восстанавливающих условиях (фиг.7а) и невосстанавливающих условиях (фиг.7b) с использованием пула сывороток арахис-аллергических доноров (разбав. 1/20) и α-IgE-PO (120705, разбав. 1/500), где в каждой фигуре: Арахис 230209/LN нативный (полоса 1), арахис 230209/LD депигментированный (полоса 2), арахис 030309/LP депигментированный/полимеризованный (полоса 3), арахиса 030309/LP депигментированный/полимеризованный остаток (полоса 4);
Фигура 8: Иммуноблот анализ ингибирования экстрактов аллергена арахиса в восстанавливающих условиях с использованием пула сывороток от арахис-аллергических доноров (разбавл. 1/20) и α-IgE-PO (120705, разбавл. 1/500.), где полоса 1 является контролем (только сыворотка) и полосы 2-4 используют сыворотку, объединенную вместе с 800 мкг депигментированного/полимеризованного экстракта аллергена арахиса, 400 мкг экстракта (полоса 3) и 200 мкг экстракта (полоса 4);
Figure 9: Анализ экстрактов аллергена арахиса на ингибирование IgE, основанный на ELISA;
Настоящее изобретение иллюстрируется следующими ниже примерами, которые раскрывают способы получения, очистки, дальнейшей обработки и полимеризации экстрактов, включающих аллергены.
Способы A-D раскрывают процессы, примененные для изготовления экстрактов аллергена и примеры 1-8 описывают экспериментальную характеристику депигментированных полимеризованных или депигментированных экстрактов аллергена.
Способы
А. Способы обезжиривания сырого материала аллергена
Обезжиренный экстракт получали различными способами в зависимости от природы сырого материала. Способы для каждого аллергена определены в каждом примере.
В целом, гомогенизированный материал обезжиривают в ацетоне при 3-5°C и фильтруют. Этот этап повторяют, пока ацетон не станет прозрачным. Обезжиренный материал восстанавливают и высушивают при комнатной температуре до тех пор, пока весь ацетон не будет удален.
B. Приготовление нативного экстракта аллергена.
Высушенный и обезжиренный материал взвешивали и экстрагировали в 0,01 М PBS/0,15М NaCl в пропорции 1:10 в течение 4 часов при 3-5°C в магнитной мешалке. Впоследствии раствор центрифугировали в течение 30 минут при температуре 4°C при 10000 об/мин. Получившийся в результате супернатант собирали и сохраняли при 3-5°C, а гранулу восстанавливали в 0,01 M/NaCl 0,15М (1:10) и экстрагировали в течение ночи при 3-5°C в магнитной мешалке. Раствор центрифугировали в течение 30 минут при 10000 об/мин, супернатант собирали и смешивали с полученной ранее фракцией. Комбинированный экстракт фильтровали через поры диаметром 0,45 мкм и тщательно диализировали через мембраны, отсекающие молекулы размером более 3 кДа до тех пор, пока проводимость не становилась ниже 1000 мкСм/см. Получившийся экстракт стерилизовали путем фильтрации через поры размером 0,22 мкм.
C. Приготовление депигментированного экстракта аллергенов
Нативный экстракт в водном растворе поддерживаемый при температуре от 3 до 5°C в дальнейшем обрабатывали с использованием следующей процедуры. Под магнитной мешалкой pH раствора доводили до 2-2,1 добавлением 0,1М HCl и поддерживали в таких условиях в течение 15 минут. После этого экстракт диализровали через мембраны, отсекающие молекулы размером более 3,5 кДа с очищенной водой в течение 17 часов против 10 объемов очищенной воды при температуре от 3 до 5°C. Очищенную воду заменяли 4 раза в течение этого периода. После обработки слабой кислотой экстракт собирали и доводили pH до 7,3-7,4 с использованием 0,1М NaOH. В конце экстракт стерилизовали путем фильтрации через поры размером 0,22 мкм и высушивали способом лиофилизации.
D. Приготовление полимеризованного депигментированного экстракта аллергена
Лиофилизированный депигментированный экстракт восстанавливали в 0,01М PBS/0,15М NaCl до конечной концентрации 15 мг/мл в магнитной мешалке до полного растворения. Способ полимеризации включал добавление 0,02 мл глутаральдегида на миллилитр депигментированного экстракта. Глутаральдегид добавляли к депигментированному экстракту с постоянной скоростью (36 мл/час) с использованием автоматического инъектора. Реакцию полимеризации поддерживали в течение 7 часов при комнатной температуре. Реакцию останавливали добавлением глицина в пропорции 40 мг глицерина на мл раствора. Реакцию поддерживали в течение ночи при температуре от 3 до 5°C в постоянно работающей магнитной мешалке. После этого раствор центрифугировали при 10000 об/мин в течение 30 минут при температуре от 3 до 5°C. Гранулу удаляли, собирали супернатант и тщательно и диализировали через мембраны, отсекающие молекулы размером более 100 кДа с очищенной водой (16,67 мл воды на мл. экстракта) в условиях заморозки. Данный процесс считается законченным, когда проводимость составляла менее 210 мкСм/см и отсутствие глутаральдегида подтверждалось сканированием в УФ/видимом спектре. В конце экстракт стерилизовали путем фильтрации через поры размером 0,22 мкм и лиофилизировали.
Конечный продукт включает высушенный способом лиофилизации депигментированный и полимеризованный экстракт, который сохраняют при температуре 4°C в лиофилизированных условиях.
ИММУНОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
Содержание белка
Содержание белка в нативных, депигментированных, депигментированных/полимеризованных экстрактах и депигментированном/полимеризованном остатке измеряли по способу Лаури Биурета в соответствии с инструкциями производителя. Результаты одной опытной партии для примера 1 показаны в таблице 1.
Гель-хроматография (HPLC)
Лиофилизированный образец экстракта ресуспендировали в воде высокой степени очистки до конечной концентрации 1 мг/мл и перемешивали в течение 10-15 минут. Образец центрифугировали при 13000 об/мин в течение 10 минут и супернатант переносили во флакон для автоматической инъекции. Колонками для ВЭЖХ (HPLC)-анализа являлись PL-аквагель-OH 60 8 мкм (PolymerLabs), предварительно уравновешенные с водой, где фракционирование основано на различиях в размерах. Образцы содержали с расходом 1 мл/мин (в соответствии с рекомендациями производителя). УФ-сигналы измеряли при 254 нм и 280 нм в целях получения хроматограммы. На фигурах 2-4 представлены результаты анализа ВЭЖХ (HPLC).
Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) анализ использовали для определения белкового/антигенного профиля экстрактов. Пробы содержали в SDS-PAGE гелях с 2,67% С, 15% Т акриламидом в нативных или денатурированных условиях (буферный раствор содержит β-меркаптоэтанол и подогревали 10 минут при 95°C). Сорок мкг лиофилизированного материала каждого экстракта загружали на гели. Эталонные маркеры с известными значениями молекулярного веса (BioRad Laboratories, Hercules, Калифорния, США) содержали в том же геле. Гели окрашивали Кумасси синим Coomassie Brilliant Blue R-250 (BioRad Laboratories). Антигенный профиль изучали с помощью сканера (Sharp JX-330, Sharp Electronics Corp, Mahwah, Нью-Джерси) и анализировали с помощью Image Master 1-D Elite V 4.00 (Pharmacia Biotech, Упсала, Швеция). Фигура 5 показывает окрашенный Кумасси синим гель, где депигментированный/полимеризованный экстракт аллергена, в не восстанавливающих условиях (полоса 7) показывает отсутствие неполимеризованных аллергенов/белков с молекулярной массой ниже 100 кДа.
Изоэлектрическое фокусирование
Анализ изоэлектрического фокусирования (ИЭФ) применяли для определения белкового/антигенного профиля экстрактов согласно изоэлектрической точке белков. Пробы содержали в полиакриламидных гелях для электрофореза в нативных условиях. Сорок мкг лиофилизированного материала каждого экстракта загружали на гели. Эталонные маркеры с известными изоэлектрическими точками (BioRad Laboratories, Hercules, Калифорния, США) содержали в том же геле. Гели окрашивали Кумасси синим Coomassie Brilliant Blue R-250 (BioRad Laboratories) и антигенный профиль изучали с помощью сканера (Sharp JX-330, Sharp Electronics Corp, Mahwah, Нью-Джерси) и анализировали с помощью Image Master 1-D Elite V 4.00 (Pharmacia Biotech, Упсала, Швеция). Полосы 3-6 фигуры 6 показывают результаты для нативного (полоса 3), депигментированного (полоса 4), депигментированного/полимеризованного (полоса 5) и депигментированного/ полимеризованного остатка (полоса 6).
Иммуноблоттинг
Электрофоретически отделенные белки переносили на мембраны P-Immobilon. (Millipore, Bedford, MA). После переноса, мембраны высушивали при комнатной температуре в течении 4 часов. Мембраны инкубировали в течение ночи с пулом сыворотки, разведенной в 0,01 М фосфатном буферном солевом растворе Tween 2%. Специфическое связывание IgE, измеряли с применением конъюгированных с пероксидазой моноклональных антител к IgE человека (Ingenasa, Мадрид) в течение 2 часов. Аллергенный профиль изучали с помощью Sharp JX-330 и анализировали с помощью Image Master 1-D Elite V 4.00. Полосы 1-4 Фигуры 7b показывают результаты для нативного (полоса 1), депигментированного (полоса 2), депигментированного/полимеризованного (полоса 3) и депигментированного/полимеризованного остатка (полоса 4) в невосстанавливающих условиях.
Депигментированный/полимеризованный экстракт аллергена не демонстрирует полос IgE распознавания до 100 кДа. На фигуре 8, ингибирование IgE наблюдают с использованием разведений полимеризованных экстрактов аллергена арахиса по сравнению с объединенной сывороткой доноров с аллергией на арахис.
Ингибирование IgE
In vitro аллергенную активность экстрактов (нативного, депигментированного и полимеризованного) тестировали при помощи ELISA ингибирования, с обеспечением 50% точки ингибирования, с использованием нативного экстракта в качестве контроля. На пластиковые титрационные микропланшеты (Immulon IV; Dynex Technologies, Chantilly, VA) наносили нативный экстракт (10 мкг белка/мл) в течение ночи. Несколько разведений изготавливали из нативного депигментированного и полимеризованного экстрактов. Каждое разведение инкубировали с пулом сыворотки в течение 2 часов при комнатной температуре. После этого разведения экстракты переносили на пластины с нативным покрытием и инкубировали в течение 2 часов. После промывания, добавляли 100 мкл антитела к IgE человека с пероксидазой и выдерживали в течение 30 минут при комнатной температуре. После промывания пластины проявляли в течение 30 минут и останавливали с помощью серной кислоты (1N). Наибольшее ингибировани связывания IgE наблюдали с использованием депигментированных/полимеризованных экстрактов аллерггена (фиг.9).
Ингибирование IgG
In vitro аллергенную активность экстрактов (нативного, депигментированного и полимеризованного) тестировали при помощи ELISA ингибирования, с обеспечением 50% точки ингибирования, с использованием нативного экстракта в качестве контроля. Пластиковые титрационные микропланшеты (Immulon II; Dynex Technologies, Chantilly, VA) покрывали нативным экстрактом (10 мкг белка/мл) в течение ночи. Несколько разведений изготавливали из нативного депигментированного и полимеризованного экстрактов. Каждое разведение инкубировали с пулом сыворотки в течение 2 часов при комнатной температуре. После этого разведения экстрактов переносили на пластины с нативным покрытием и инкубировали в течение 2 часов. После промывания, добавляли 100 мкл антитела к IgG человека с пероксидазой и выдерживали в течение 30 минут при комнатной температуре. После промывания пластины проявляли в течение 30 минут и останавливали с помощью серной кислоты (1N).
Fluram
Нахождение свободных аминогрупп измеряли в нативных, депигментированных и депигментированных полимеризованных экстрактах. Полимеризация уменьшает количество свободных аминогрупп, потому что поперечное сшивание между аллергенами опосредовано этой реактивной группой. Нативные и депигментированные экстракты готовят в 25 мкг/мл и депигментированные полимеризованные экстракты 1000 мкг/мл.
6-аминокапроновую кислоту на 2-10 мг/мл используют в качестве стандарта. Реактив Эванса добавляют ко всем образцам. Аминогруппы разводят в этом буфере. После этого натрий-боратный буфер (0,2 М) добавляют ко всем пробам и гомогенизируют. В заключение, кофлуорескамин, предварительно разбавленный в ацетоне, добавляют к смеси и раствор измеряютв флуориметре, с возбуждением 390 нм и 480 нм излучения.
УФ/видимая сканирующая спектрофотометрия
Нативные, депигментированные и депигментированные полимеризованные экстракты аллергена разводят в концентрации 1 мг/мл в 0,01 М PBS. После разбавления образцы анализируют при λ от 200 до 600 нм.
Биологическая активность в HEP
Биологическую активность экстрактов (нативных и депигментированных) измеряют на основании REINA конкуренции. На пластиковые титрационные микропланшеты наносят антитело к IgE. Пул сывороток от индивидуумов, страдающих аллергией, добавляют в микропланшеты и инкубируют в течение 30 минут. Образцы и самостоятельно полученные контроли (IHR) предварительно разбавляют и инкубируют с IHR, меченными пероксидазой. Затем планшеты промывают и инкубируемые образцы добавляют в микропланшеты и инкубируют в течение 30 минут. В заключение, планшеты тщательно промывают и инкубируют с кромогеном (cromogen). Пластины считывают при 450 нм.
Аномальная токсичность у мышей
Следуя рекомендациям Европейской фармакопеи, самкам мышей (штамм NMRI) вводили 1 мл депигментированных и полимеризованных экстрактов арахиса в концентрациях 0,1 мг/мл и 1 мг/мл. Внутрибрюшинные инъекции применяли для введения. Период наблюдения составлял 7 дней, после чего наблюдали незначительные колебания веса или поведения у животных.
ПРИМЕРЫ
Пример 1 - экстракт аллергена арахиса
Этап А. Способ обезжиривания сырого материала арахиса
Очищенные орехи гомогенизировали в блендере для получения гомогенизированной суспензии. Гомогенизированный материал обезжиривали холодным ацетоном в пропорции 1 кг суспензии: 2 л ацетона в течение 1 часа при 3-5°C при непрерывном магнитном перемешивании для экстракции липидов, жирных кислот и свободных флавоноидов. Полученный раствор фильтровали в воронке Бюхнера. Ацетон удаляли, и собирали экстракт на фильтр, и дважды промывали свежим ацетоном. Процесс полностью повторяли еще два раза, пока собранный ацетон не становился прозрачным. После окончания процесса, обезжиренный экстракт арахиса собирали и сушили при комнатной температуре под вытяжкой с ламинарным потоком в течение 12 часов, пока материал не становился полностью сухим и весь ацетон не был удален.
Депигментированный полимеризованный экстракт аллергена арахиса получили в соответствии с этапами B-D способа.
Характеристика экстрактов аллергена арахиса
Депигментированный полимеризованный экстракт аллергена арахиса должен удовлетворять следующим требованиям:
a. Растворимый в воде продукт
b. Отсутствие неполимеризованных аллергенов/белков с молекулярной массой ниже 100 кДа (определяется в виде полос с помощью SDS-PAGE в невосстанавливающих условиях)
c. Отсутствие полос IgE-распознавания с молекулярной массой ниже 100 кДа (определяется с помощью иммуноблоттинга в невосстанавливающих условиях)
d. Отсутствие полимеризованных молекул с молекулярной массой ниже 100 кДа (определяется с помощью гель-хроматографии с ВЭЖХ)
e. Уменьшение свободных аминогрупп (75%) по отношению к нативному экстракту (определяется способом fluram)
f. Уменьшение биологической активности (95%) относительно нативного экстракта (определяется с помощью экспериментов ELISA IgE ингибирования с применением специфического пула сывороток от сенсибилизированных индивидуумов)
g. Отсутствие аномальной токсичности на мышах
Гранулу, включающую депигментированный/полимеризованный остаток, использовали в качестве контроля в характеристике нативных, депигментированных и депигментированных/полимеризованных экстрактов (см. Таблицы 1 и 2).
Пример 2 - Экстракт аллергена амброзии (Ambrosia artemisii folia)
Этап А. Способ обезжиривания сырого материала аллергена
Пыльцу амброзии, собранную с растения после опыления, обезжиривали холодным ацетоном в соотношении 1:4 (вес/объем) при непрерывном перемешивании в течение 3 часов при 3-5°C. Полученный в результате раствор фильтровали в воронке Бюхнера и промывали по крайней мере три раза со свежим ацетоном. После окончания процесса, обезжиренный экстракт собирали и сушили при комнатной температуре под вытяжкой с ламинарным потоком в течение 12 часов, пока материал не становился совершенно сухим и весь ацетон не был удален.
Депигментированную полимеризованную амброзию (Ambrosia artemisiifolia) получали в соответствии с этапами B-D способа. РН раствора доводили до 4-4,1 добавлением 0,1 М HCl на этапе 3.
Конечный продукт включает лиофилизированный депигментированный и полимеризованный экстракт амброзии, для хранения при 4°C в лиофилизированных условиях. Полученный в результате продукт должен удовлетворять следующим требованиям:
а. Растворимый в воде продукт
b. Отсутствие неполимеризованных аллергенов/белков с молекулярной массой ниже 100 кДа (определяется в виде полос с помощью SDS-PAGE в невосстанавливающих условиях)
c. Отсутствие полос IgE-распознавания с молекулярной массой ниже 100 кДа (определяется с помощью иммуноблоттинга в невосстанавливающих условиях)
d. Отсутствие полимеризованных молекул с молекулярной массой ниже 100 кДа (определяется с помощью гель-хроматографии с HPLC)
e. Уменьшение свободных аминогрупп (75%) по отношению к нативному экстракту (определяется способом fluram)
f. Уменьшение биологической активности (95%) относительно нативного экстракта (определяется с помощью экспериментов ELISA IgE ингибирования с использованием специфического пула сывороток от сенсибилизированных индивидуумов)
g. Выявление моноклональных антител к основному аллергену Amb а 1.
h. Отсутствие аномальной токсичности на мышах
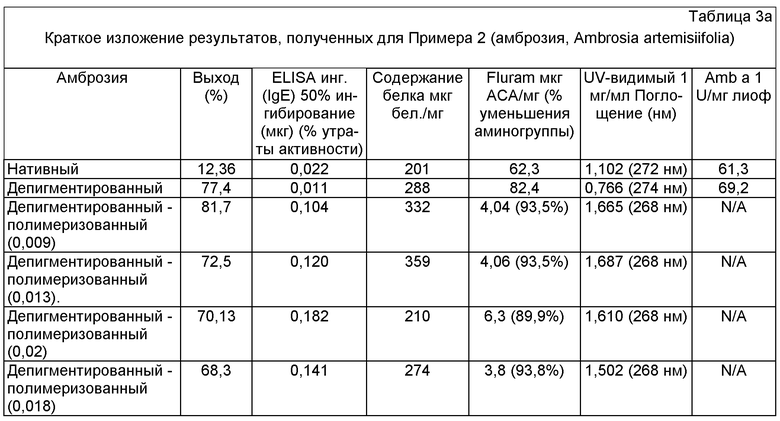
Содержание основного аллергена
Содержание основного аллергена Amb а 1 измеряли с помощью устанавливаемого в помещении комплекта Biotech (Indoor Biotech kit) (INDOOR Biotechnologies Inc. Charlottesville, Virginia, USA). Наносили поликлональное антитело IgG к Amb a 1 (1:1000 из флакона подготовленного в дозе 1 мг/мл). Стандартную кривую подготавливают с применением определенного количественно и стандартизированного по отношению к US FDA (радиальная иммунодиффузия, контроль для Amb а 1, C14-RAS, который содержит 30 U Amb а 1/мл) экстракта амброзии, содержащего активность 2,5 Ед/мл Amb а 1. Вторичное антитело представляет собой биотинилированное поликлональное антитело к IgG кролика, чей уровень растет в ответ на действие короткого аллергена амброзии. Нативные и депигментированные образцы разбавляют до 500 нг/мл. Содержание основных аллергенов рассчитывают для полимеризованных экстрактов с использованием этих значений.
Гранулу, включающую депигментированный/ полимеризованный остаток, использовали в качестве контроля при характеристике нативных, депигментированных и депигментированных/полимеризованных экстрактов (согласно Таблице 3а и 3б).
Пример 3 - Экстракт аллергена пыльцы (Olea euopaea)
Пыльцу Olea euopaea, собранную с дерева после опыления, обезжиривали холодным ацетоном в соотношении 1:4 (вес/объем) при непрерывном перемешивании в течение 3 часов при 3-5°C. Полученный в результате раствор фильтровали в воронке Бюхнера и промывали по крайней мере три раза со свежим ацетоном. После окончания процесса, обезжиренный экстракт собирали и высушивали при комнатной температуре под вытяжкой с ламинарным потоком в течение 12 часов, пока материал не становился полностью сухим и весь ацетон не был удален.
Депигментированный экстракт пыльцы аллергена получали в соответствии с этапами В-С способа.
Конечный продукт включает лиофилизированный депигментированный экстракт, для хранения при 4°C в лиофилизированных условиях. Полученный в результате продукт должен удовлетворять следующим требованиям:
a. Растворимый в воде продукт
b. Белковый профиль подобный таковому нативного экстракта, определенный с помощью SDS-PAGE и 2-D
c. Аллергенный профиль подобный таковому нативного экстракта, определенный иммуноблотом
d. Содержание белков подобное таковому нативного экстракта
e. Содержание аллергенов подобное таковому нативного экстракта
f. Биологическая активность подобная таковой нативного экстракта
Пример 4 - Экстракт аллергена пыльцы (Parietaria judaica)
Пыльцу Parietaria judaica, собранную с дерева после опыления, обезжиривали холодным ацетоном в соотношении 1:4 (вес/объем) при непрерывном перемешивании в течение 3 часов при 3-5°C. Полученный в результате раствор фильтровали в воронке Бюхнера и промывали по крайней мере три раза со свежим ацетоном. После окончания процесса, обезжиренный экстракт собирали и высушивали при комнатной температуре под вытяжкой с ламинарным потоком в течение 12 часов, пока материал не становился полностью сухим и весь ацетон не был удален.
Депигментированный экстракт пыльцы аллергена получали в соответствии с этапом В способа.
Конечный продукт включает лиофилизированный депигментированный экстракт, для хранения при 4°C в лиофилизированных условиях. Полученный в результате продукт должен удовлетворять следующим требованиям:
a. Растворимый в воде продукт
b. Белковый профиль подобный таковому нативного экстракта, определенный с помощью SDS-PAGE и 2-D
c. Аллергенный профиль подобный таковому нативного экстракта, определенный иммуноблотом
d. Содержание белков подобное таковому нативного экстракта
e. Содержание аллергенов подобное таковому нативного экстракта
f. Биологическая активность подобная таковой нативного экстракта
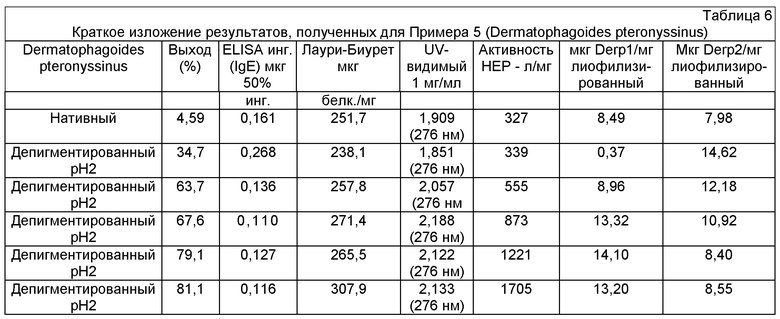
Пример 5 - Экстракт аллергена клеща (Dermatophasoides pteronyssinus)
Экстракт аллергена клеща получали после этапа В способа от взрослой культуры Dermatophagoides pteronyssinus.
Конечный продукт состоит из лиофилизированного депигментированного экстракта, для хранения при 4°C в лиофилизированных условиях. Полученный в результате продукт должен удовлетворять следующим требованиям:
a. Растворимый в воде продукт
b. Белковый профиль подобный таковому нативного экстракта, определенный с помощью SDS-PAGE и 2-D
c. Аллергенный профиль подобный таковому нативного экстракта, определенный иммуноблотом
d. Содержание белков подобное таковому нативного экстракта
e. Содержание аллергенов подобное таковому нативного экстракта
f. Биологическая активность подобная таковой нативного экстракта
Содержание основных аллергенов
Содержание основных аллергенов ((Der p 1 и Der p 2)) измеряли с помощью устанавливаемых в помещении комплектов Biotech Indoor Biotech kits для D. pteronyssinus. Моноклональные антитела IgG к Der p 1 или Der p 2 наносили (1:1000 из флакона, подготовленного в дозе 1 мг/мл для Der p 1 и 2 мг/мл для Der p 2) в лунки полистирольного микропланшета (Nunc Maxisorp). Стандартную кривую получали с применением выраженного количественно и стандартизированного универсального стандарта (суб-стандартизированного против WHO/IUIS D. pteronyssinus контроля, содержащего 2500 нг/мл Der p 1 до 1000 нг/мл Der p 2): разведения контрольной кривой 250-0,49 нг/мл для Der р. 1 и 100-0,2 нг/мл для Der р. 2. Образцы клещей обычно разбавляли в два раза. После промывания пластины, добавляли 100 мкл разбавленного стандарта аллергенов и образцы и инкубировали в течение 1 часа при комнатной температуре. После промывания пластины, 100 мкл вторичного антитела (моноклональное биотинилированное антитело к IgG) разбавленного 1/1000 добавляли и выдерживали в течение 1 часа при комнатной температуре. После промывания пластины, 100 мкл стрептавидин-пероксидазы, разбавленной 1/1000 добавляли и инкубировали 30 минут при комнатной температуре. Наконец, пластину промывали, проявляли добавлением 100 мкл 1 мМ ABTS в 70 цитрат-фосфатном буфере, pH 4,2 содержащем 1/1000 разбавление 30% H2O2 (т.е. 10 мкл/10 мл ABTS) и считывали, когда оптическая плотность при 405 нм достигает 2,0-2,4.
Пример 6- Экстракт аллергена тростника (Phragmites communis)
Пыльцу Phragmites communis, собранную с дерева после опыления, обезжиривают холодным ацетоном в соотношении 1:4 (вес/объем) при непрерывном перемешивании в течение 3 часов при 3-5°C. Полученный в результате раствор фильтровали в воронке Бюхнера и промывали по крайней мере, три раза со свежим ацетоном. После окончания процесса, обезжиренный экстракт собирали и высушивали при комнатной температуре под вытяжкой с ламинарным потоком в течение 12 часов, пока материал не становился полностью сухим и весь ацетон не был удален.
Депигментированный экстракт пыльцы аллергена получали в соответствии с этапами B-D способа.
На этапе D способ полимеризации состоит из добавления глутаральдегида с использованием параметра 0,015 мл глутаральдегида/мл экстракта.
Конечный продукт состоит из лиофилизированного депигментированного экстракта Phragmites, для хранения при 4°C в лиофилизированных условиях. Полученный в результате продукт должен удовлетворять следующим требованиям:
а. Растворимый в воде продукт
b. Отсутствие неполимеризованных аллергенов/белков с молекулярной массой ниже 100 кДа (определяется в виде полос с помощью SDS-PAGE в невосстанавливающих условиях)
c. Отсутствие полос IgE-распознавания с молекулярной массой ниже 100 кДа (определяется с помощью иммуноблоттинга в невосстанавливающих условиях)
d. Отсутствие полимеризованных молекул с молекулярной массой ниже 100 кДа (определяется с помощью гель-хроматографии с HPLC)
e. Уменьшение свободных аминогрупп (75%) по отношению к нативному экстракту (определяется способом fluram)
f. Значительное уменьшение биологической активности (95%) относительно нативного экстракта (определяется с помощью экспериментов ELISA IgE ингибирования с использованием специфического пула сывороток от сенсибилизированных индивидуумов)
h. Отсутствие аномальной токсичности на мышах
Гранулу, включающую депигментированный/полимеризованный остаток, использовали качестве контроля при характеристике нативных, депигментированных депигментированных/полимеризованных экстрактов (согласно Таблице 7а и 7b).
Пример 7 Экстракт аллергена эпителия кошки
Кошачью шерсть обезжиривали холодным ацетоном в отношении 1:40 (вес/объем) после пяти минут перемешивания каждый час в течение 7 часов при 3-5°C. Обезжиривание продолжали в течение по меньшей мере 16 часов без перемешивания. Полученный в результате раствор фильтровали в воронке Бюхнера и сохраняли чешуйки. Кошачью шерсть снова обезжиривали таким же количеством ацетона в течение 1 часа при комнатной температуре и процедуру повторяли два раза. Полученные хлопья собирали и высушивали при комнатной температуре под вытяжкой с ламинарным потоком в течение 15 часов, пока материал полностью не высыхал и весь ацетон не был удален.
На этапе В высушенный обезжиренный материал чешуек кожи, полученный из кошачьей шерсти взвешивали и экстрагировали в PBS 0,01 M/NaCl 0,15М в соотношении 1:40 в течение 4 часов при 3-5°C и с магнитным перемешиванием.
Депигментированный полимеризованный экстракт аллергена кошки получали в соответствии с этапами B-D способа.
Конечный продукт состоит из лиофилизированного депигментированного экстракта кошачьего эпителия, для хранения при 4°C в лиофилизированных условиях. Полученный в результате продукт должен удовлетворять следующим требованиям:
а. Растворимый в воде продукт
b. Уменьшение свободных аминогрупп (75%) по отношению к нативному экстракту (определяется способом fluram)
c. Значительное уменьшение биологической активности (95%) относительно нативного экстракта (определяется с помощью экспериментов IgE REINA конкуренции с использованием специфического пула сывороток от сенсибилизированных индивидуумов)
d. Определение моноклональных антител к основному аллергену Fel d 1.
h. Отсутствие аномальной токсичности на мышах
Содержание основного аллергена
Содержание основного аллергена Fel d 1 измеряют с помощью устанавливаемого в помещении комплекта Biotech (Indoor Biotech kit) Наносят IgGl моноклональное антитело к Amb а 1 (1:1000 из флакона подготовленного в дозе 1 мг/мл). Стандартную кривую получали с применением Универсального Стандарта Аллергена, который содержит 1000 нм Fel d 1/мл. Вторичное антитело представляет собой биотинилированное моноклональное антитело к IgGl, возникающее в ответ на действие аллергена кошачьего эпителия. Нативные и депигментированные образцы разбавляли до 250 нг/мл. Содержание основных аллергенов рассчитывали для полимеризованных экстрактов с применением этих значений.
Гранулу, включающую депигментированный/ полимеризованный остаток, использовали в качестве контроля при характеристике нативных, депигментированных и депигментированных/полимеризованных экстрактов (согласно Таблице 8).
Пример 8 Экстракт аллергена Phleum pratense
Пыльцу Phleum pratense, собранную с растения после опыления обезжиривали холодным ацетоном в соотношении 1:4 (вес/объем) при непрерывном перемешивании в течение 3 часов при 3-5°C. Полученный в результате раствор фильтровали в воронке Бюхнера и промывали по крайней мере три раза со свежим ацетоном. После окончания процесса, обезжиренный экстракт арахиса собирали и высушивали при комнатной температуре под вытяжкой с ламинарным потоком в течение 12 часов, пока материал не становился полностью сухим и весь ацетон не был удален.
Депигментированный экстракт аллергена Phleum pratense получали в соответствии с этапами B-D способа.
На этапе D способ полимеризации состоит из добавления глутаральдегида с применением коэффициента 0,09 мл глутаральдегида/мл экстракта.
Конечный продукт содержит лиофилизированный депигментированный экстракт Phleum pratense, для хранения при 4°C в лиофилизированных условиях. Полученный в результате продукт должен удовлетворять следующим требованиям:
a. Растворимый в воде продукт
b. Отсутствие неполимеризованных аллергенов/белков с молекулярной массой ниже 100 кДа (определяется в виде полос с помощью SDS-PAGE в невосстанавливающих условиях)
c. Отсутствие полос IgE-распознавания с молекулярной массой ниже 100 кДа (определяется с помощью иммуноблоттинга в невосстанавливающих условиях)
d. Отсутствие полимеризованных молекул с молекулярной массой ниже 100 кДа (определяется с помощью гель-хроматографии с HPLC)
e. Уменьшение свободных аминогрупп (75%) по отношению к нативному экстракту (определяется способом fluram)
f. Значительное уменьшение биологической активности (95%) относительно нативного экстракта (определяется с помощью экспериментов ELISA IgE ингибирования с использованием специфического пула сывороток от сенсибилизированных индивидуумов)
h. Отсутствие аномальной токсичности на мышах
Содержание основного аллергена
Содержание основного аллергена РЫ p 5 измеряли с помощью устанавливаемого в помещении комплекта Biotech (Indoor Biotech kit) Наносили моноклональное антитело IgGl к Phl p 5 (1:1000 из флакона подготовленного в дозе 2 мг/мл). Стандартную кривую получали с применением рекомбинантного Phi p 5а. Вторичное антитело представляет собой биотинилированное моноклональное антитело к IgGl, возникающее в ответ на действие аллергена Phleum pratense. Нативные и депигментированные образцы разбавляют до 250 нг/мл. Содержание основных аллергенов рассчитывают для полимеризованных экстрактов с использованием этих значений.
Гранулу, включающую депигментированный/полимеризованный остаток, использовали в качестве контроля при характеристике нативных, депигментированных и депигментированных/полимеризованных экстрактов (согласно Таблице 9).
Ссылки на литературу
1. Vickery, В., Burks, W. Immunotherapy in the treatment of food allergy: focus oral tolerance. Curr. Opin. Allergy Clin. Irnmunol. 2009; 9: 364-370.
2. King, R.M., Knibb, R.C., and Hourihane, J.O.B. Impact of peanut allergy on quality of life, stress and anxiety in the family. Allergy 2009; 64: 461-468.
3. Enrique, E., Pineda, F., Malek, Т., Bartra, J., Basagana, M, Telia, R., Castello, J.V., Alonso, R., de Mateo, J.A., Cerda-Trias, Т., San Miguel-Moncin Mdel, M., Monzon, S., Garcia, M., Palacios, R., Cistero-Bahima, A. Sublingual immunotherapy for hazelnut food allergy: a randomized, double-blind, placebo-controlled study with a standardized hazelnut extract. J. Allergy Clin. Immunol. 2005; 116 (5): 1073-9.
4. Fernandez-Rivas, M., Garrido Fernandez, S., Nadal, J.A., Diaz de Durana, M.D., Garcia, B.E., Gonzalez-Mancebo, E., Martin, S., Barber, D., Rico, P., Tabar, A.I. Randomized double-blind, placebo-controlled trial of sublingual immunotherapy with a Pru p 3 quantified peach extract. Allergy. 2009; 64 (6): 876-83.
5. Hofmann, A.M., Scurlock, A.M., Jones, S.M., Palmer, K.P., Lokhnygina, Y., Steele, P.H., Kamilaris, J., Burks, A.W. Safety of a peanut oral immunotherapy protocol in children with peanut allergy. J. Allergy Clin. Immunol. 2009 May 26.
6. Jones, S.M., Pons, L., Roberts, J.L., Scurlock, A.M., Perry, T.T., Kulis, M., Shreffler, W.G., Steele, P., Henry, K.A., Adair, M., Francis, J.M., Durham, S., Vickery, B.P., Zhong, X., Burks, A.W. Clinical efficacy and immune regulation with peanut oral immunotherapy. J. Allergy. Clin. Immunol. 2009 Aug; 124 (2): 292-300, 300.
7. Clark, A.T., Islam, S., King, Y. Successful oral tolerance induction in severe peanut allergy. Allergy 2009 Aug; 64 (8): 1218-20.
8. Wallace DV. Pet dander and perennial allergic rhinitis: therapeutic options. Allergy Asthma Proc. 2009 Nov-Dec; 30 (6):573-83.
9. Ling M, Long AA Pet dander and diffwult-to-control asthma: Therapeutic options. Allergy Asthma Proc. 2010 Sep; 31(5):385-91.
10. Gronlund H, Saarne T, Gafvelin G, van Hage M. The major cat allergen, Fel d 1, in diagnosis and therapy. Int Arch Allergy Immunol. 2010;151(4):265-74. Epub 2009 Oct 22. Review.
Ссылки на веб-сайты
1 Allergen nomenclature. International Union of Immunological Societies Allergen Nomenclature Sub-Committee. List last update 21 of July 2009.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения экстракта аллергена | 2011 |
|
RU2706685C2 |
| СПОСОБЫ ОЧИСТКИ ЭКСТРАКТА АЛЛЕРГЕНА | 2019 |
|
RU2809823C2 |
| АЛЛЕРГЕНЫ, ПОЛУЧЕННЫЕ РЕКОМБИНАНТНЫМИ СПОСОБАМИ | 2010 |
|
RU2592674C2 |
| НОВЫЙ АЛЛЕРГЕН | 2011 |
|
RU2608494C2 |
| АЛЛЕРГОИДЫ, ПОЛУЧЕННЫЕ ИЗ АЛЛЕРГЕНОВ | 2009 |
|
RU2522490C2 |
| Ветеринарный продукт | 2018 |
|
RU2819906C2 |
| НОВЫЙ АЛЛЕРГЕН-ПРОСТАТИЧЕСКИЙ КАЛЛИКРЕИН | 2007 |
|
RU2502074C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА, СОДЕРЖАЩАЯ АЛЛЕРГЕН | 2003 |
|
RU2372074C2 |
| АЛЛЕРГЕНЫ И АЛЛЕРГОИДЫ ИЗ ПЧЕЛИНОГО ЯДА | 2008 |
|
RU2481122C2 |
| МИКРОЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ УГЛЕВОДНЫЕ СФЕРЫ, КОВАЛЕНТНО СВЯЗАННЫЕ С АЛЛЕРГЕНОМ | 2003 |
|
RU2329830C2 |
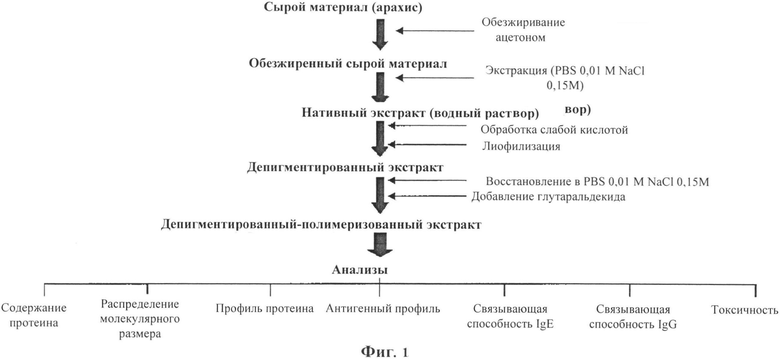
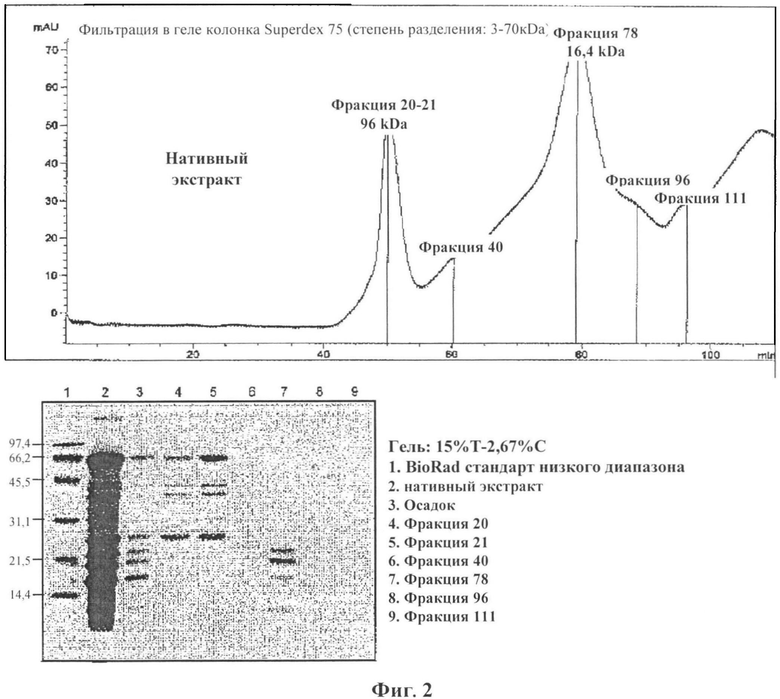
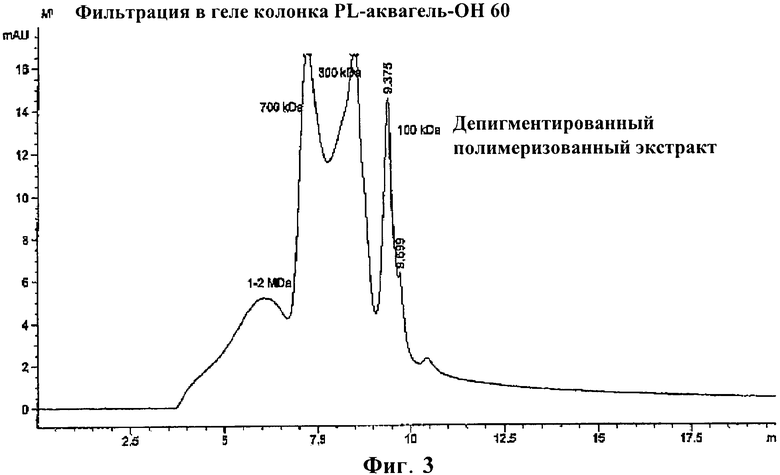
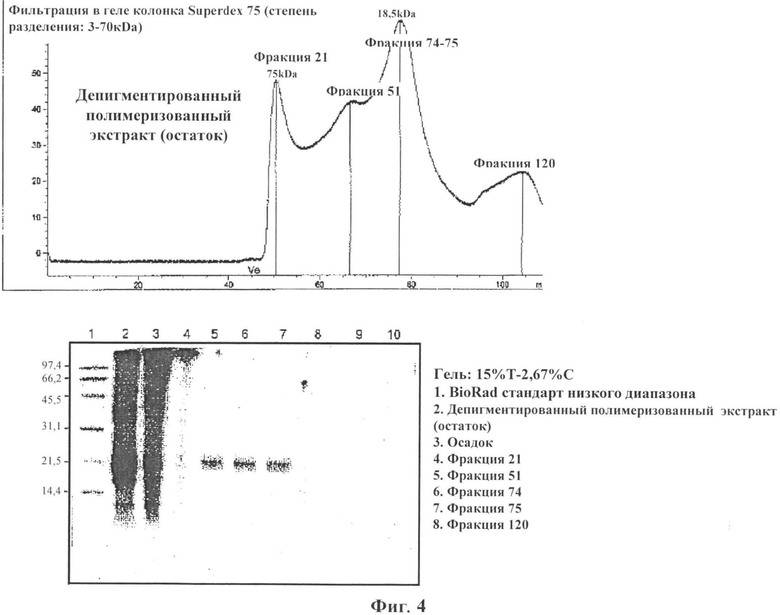
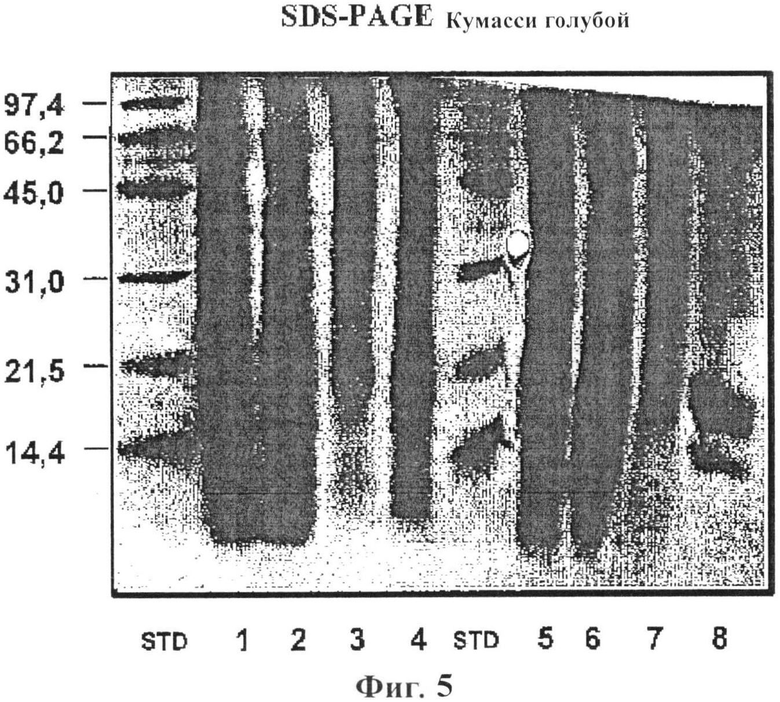
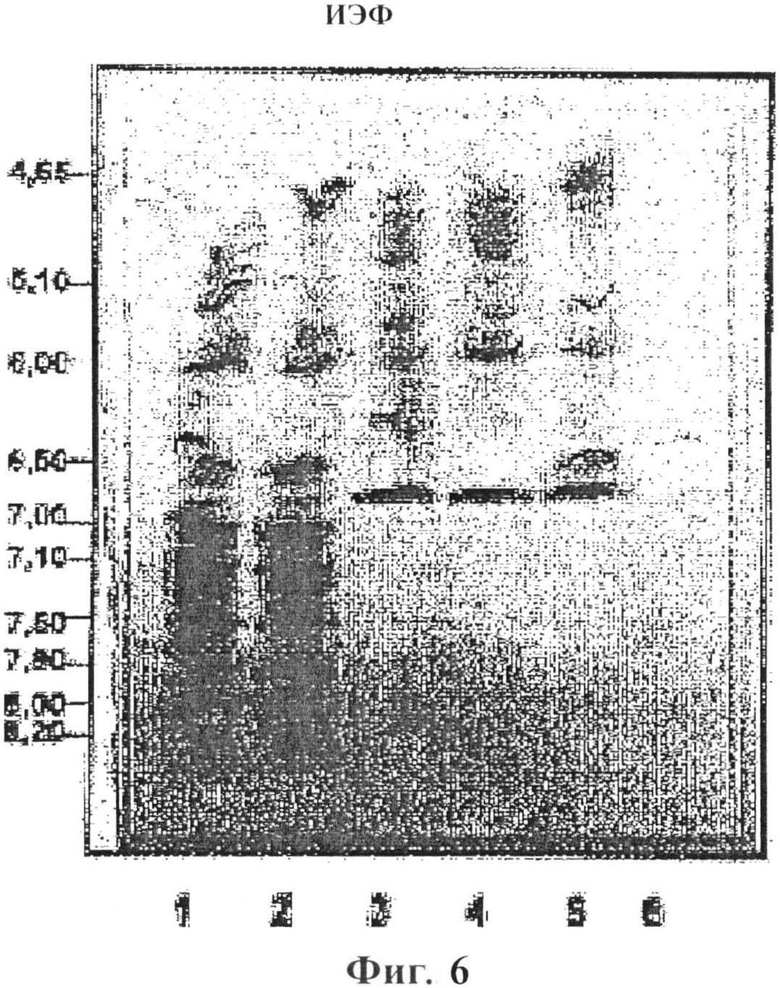
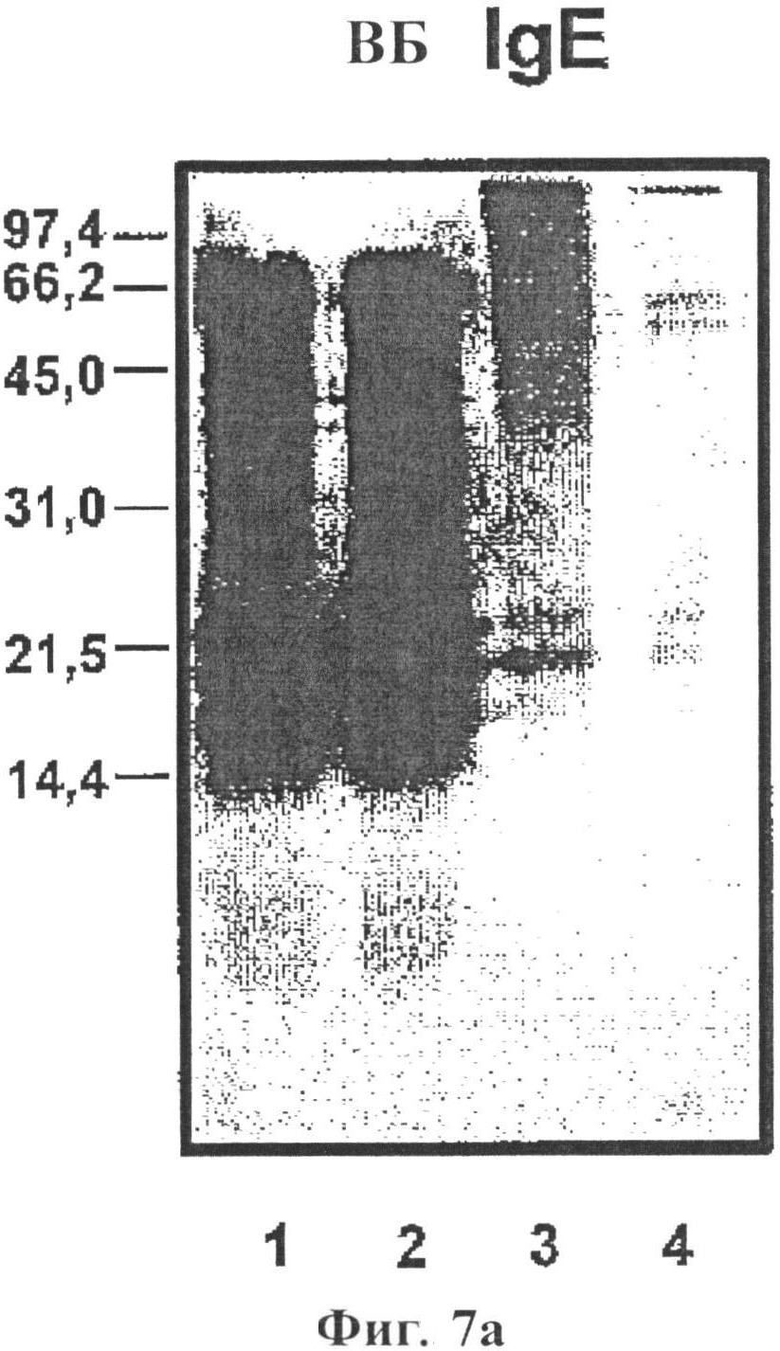
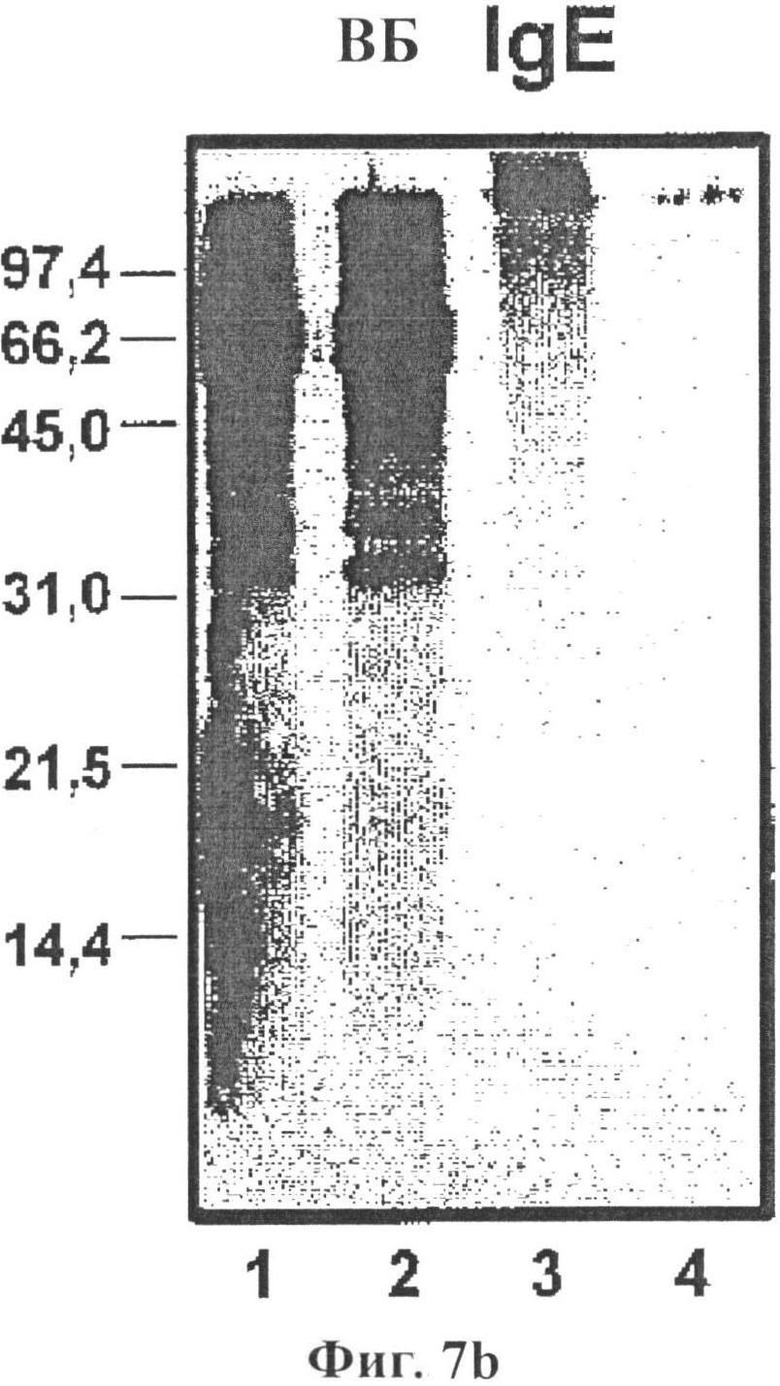
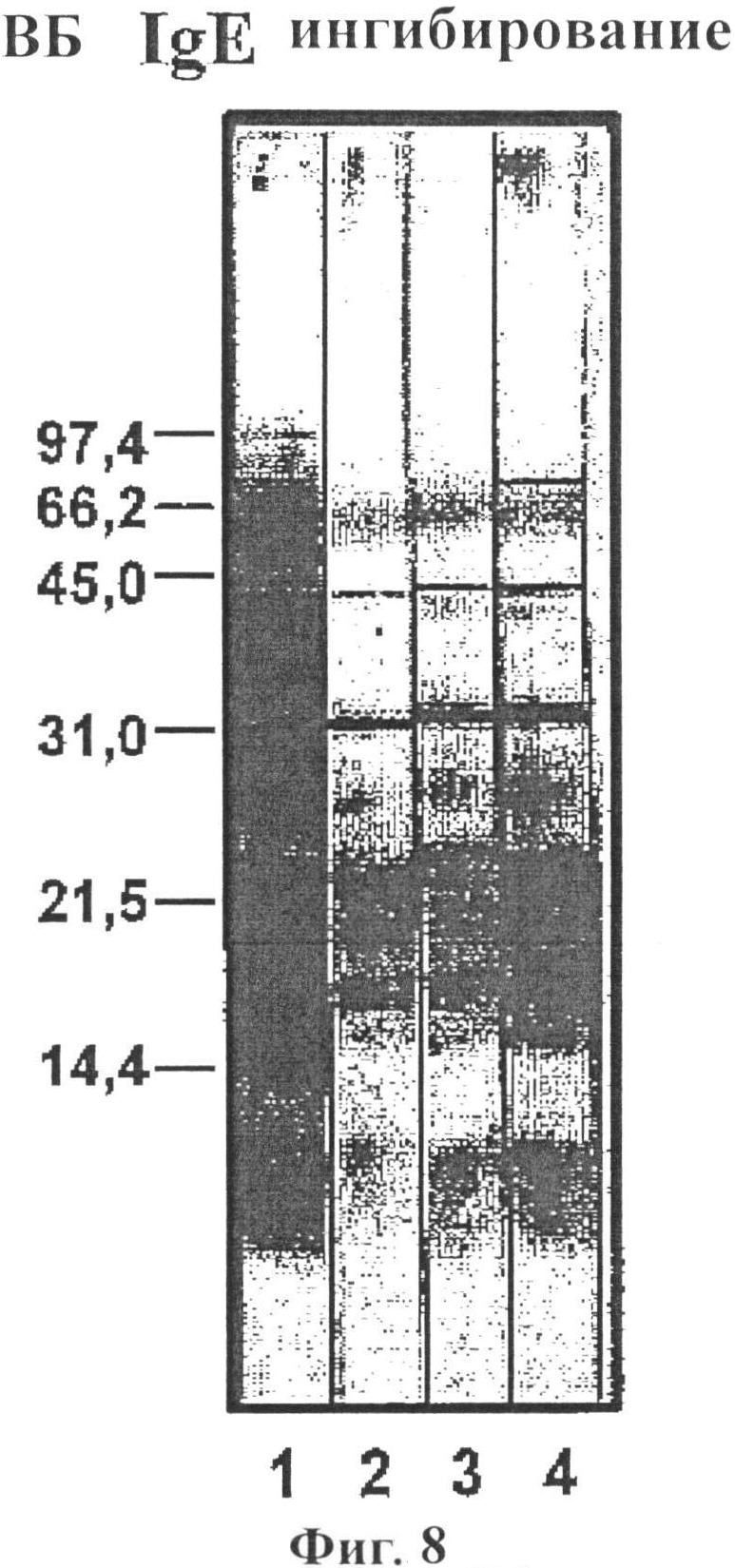
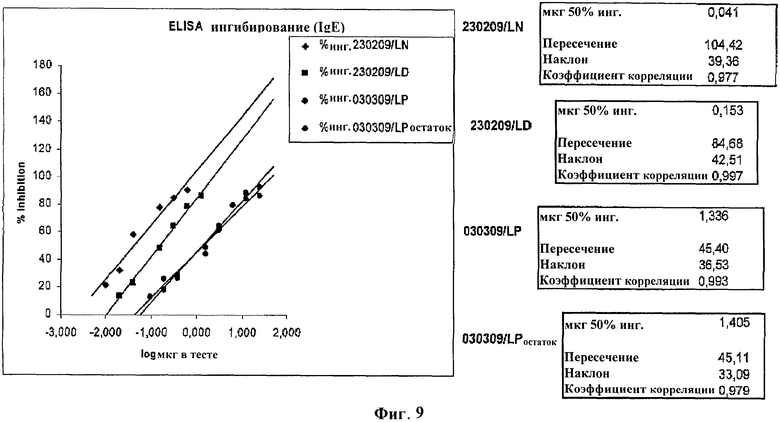
Группа изобретений относится к медицине и предназначена для лечения аллергии. Для получения экстракта аллергена выполняют контакт исходного материала с жидким экстракционным средством с получением смеси. Подвергают смесь первому этапу разделения. Выполняют контакт остатка исходного материала со средством экстракции аллергенов. Подвергают смесь второму этапу разделения с получением сырого экстракта аллергена, из которого удаляют низкомолекулярную фракцию. Повторяют, пока экстракт аллергена не будет иметь проводимость ниже 1000 мкСм/см при 3-5°C с получением очищенного нативного экстракта аллергена. Подкисляют до pH 2-4. Затем удаляют низкомолекулярную фракцию и доводят pH до 7-8 с получением депигментированного экстракта аллергена. Приводят в контакт с глутаральдегидом. Удаляют молекулы с молекулярным размером менее 100 кДа. Повторяют, пока экстракт аллергена не будет иметь проводимость ниже 210 мкСм/см при 3-5°C и/или будет отсутствовать глутаральдегид. Экстракт аллергена входит в состав композиции и вакцины для лечения аллергии. Использование группы изобретений позволяет получить аллерген, обладающий сниженной способностью связывать IgE и пригодный для иммунотерапии. 4 н. и 22 з.п. ф-лы, 10 ил., 11 табл., 8 пр.
1. Способ получения экстракта аллергена, включающий:
a) контакт исходного материала, включающего аллерген, с жидким экстракционным средством для получения смеси, содержащей липиды, растворенные в жидкой фазе, и твердой фазы, содержащей остаток исходного материала, включающего аллергены и белки,
b) подвержение смеси первому этапу разделения для выделения остатка исходного материала,
c) контакт остатка исходного материала со средством экстракции аллергенов с получением смеси аллергенов, растворенной в жидкой фазе, и твердой фазы, содержащей неаллергенный остаток,
d) подвержение смеси второму этапу разделения для выделения аллергенов, растворенных в жидкой фазе, с получением сырого экстракта аллергена,
e) подвержение сырого экстракта аллергена этапу удаления низкомолекулярной фракции для удаления молекул с молекулярным размером менее 3,5 кДа, и
f) проведение этапа е) до тех пор, пока экстракт аллергена не будет иметь проводимость ниже 1000 мкСм/см при 3-5°C для получения очищенного нативного экстракта аллергена,
g) подкисление нативного экстракта аллергена до pH от 2 до 4,0 и сохранение подкисленного экстракта в течение 5-30 минут, затем подвержение экстракта этапу удаления низкомолекулярной фракции для удаления молекул с молекулярным размером менее 3,5 кДа и доведение pH до 7,0 -8,0 с получением депигментированного экстракта аллергена,
h) контакт депигментированного экстракта аллергена с глутаральдегидом или формальдегидом,
i) подвержение депигментированного экстракта аллергена этапу удаления молекулярной фракции для удаления молекул с молекулярным размером менее 100 кДа и
j) проведение этапа i) до тех пор, пока экстракт аллергена не будет иметь проводимость ниже 210 мкСм/см при 3-5°C и/или будет отсутствовать глутаральдегид, что определяется УФ (UV) или видимым сканированием, для получения депигментированного полимеризованного экстракта аллергена.
2. Способ по п. 1, где этап удаления низкомолекулярной фракции продолжают до тех пор, пока проводимость не будет менее 500 мкСм/см при 3-5°C.
3. Способ по п. 1, где нативный экстракт аллергена подкисляют до pH от 2 до 2,1.
4. Способ по п. 1, где нативный экстракт аллергена подкисляют до pH от 2,0 до 3,0.
5. Способ по любому из пп. 1-4, где альдегид добавляют к экстракту со скоростью добавления от 0,001 до 0,5 мл в минуту.
6. Способ по любому из пп. 1-4, где этап удаления молекулярной фракции продолжают до тех пор, пока проводимость не будет от 50 до 200 мкСм/см при 3-5°C.
7. Способ по любому из пп. 1-4, где этапы удаления низкомолекулярной фракции е) или g) включают этап ультрафильтрации, этап диафильтрации, этап диализа или фильтрования.
8. Депигментированный полимеризованный экстракт аллергена, получаемый согласно способу по любому из пп. 1-7.
9. Экстракт аллергена по п. 8, где исходный материал выбран из пищевых аллергенов, переносимых по воздуху аллергенов, грибов, аллергенов клещей, эпителиальных аллергенов и аллергенов насекомых.
10. Экстракт аллергена по п. 9, где пищевой аллерген представляет собой арахис.
11. Экстракт аллергена по п. 9, где переносимый по воздуху аллерген представляет собой пыльцу.
12. Экстракт аллергена по п. 9, где клещи представляют собой пылевые клещи.
13. Экстракт аллергена по п. 9, где эпителиальные аллергены представляют собой шерсть животных или перхоть животных.
14. Экстракт аллергена по п. 9, где грибы представляют собой плесень.
15. Экстракт аллергена по п. 9, где аллергены насекомых выбраны из аллергена таракана, аллергена блох, яда пчелы и яда осы.
16. Экстракт аллергена по п. 11, где пыльца выбрана из древесной пыльцы, пыльцы травы и пыльцы зерновых.
17. Экстракт аллергена по п. 16, где пыльца травы представляет собой пыльцу сорных трав.
18. Экстракт аллергена по п. 13, где шерсть животных представляет собой кошачью шерсть или собачью шерсть, перхоть животных представляет собой кошачью перхоть или собачью перхоть.
19. Экстракт аллергена по п. 11, где пыльца представляет собой пыльцу Olea europaea, пыльцу Parietaria judaica, пыльцу Phragmites communis и пыльцу Phleum pratense.
20. Экстракт аллергена по п. 9, где клещи представляют собой Dermatophagoides pteronyssinus.
21. Экстракт аллергена по любому из пп. 8-20 для применения в лечении аллергии.
22. Экстракт аллергена по любому из пп. 8-10 для применения в лечении аллергии на арахис.
23. Фармацевтическая композиция для лечения аллергии, включающая экстракт аллергена по любому из пп. 8-20.
24. Фармацевтическая композиция по п. 23, дополнительно включающая одно или более чем одно вспомогательное вещество, разбавитель, консервант или их смесь.
25. Вакцина для лечения аллергии, включающая экстракт аллергена по любому из пп. 8-20.
26. Вакцина по п. 25, дополнительно включающая одно или более чем одно вспомогательное вещество, разбавитель, консервант или их смесь.
| Фильтр и способ его изготовления | 1990 |
|
SU1834648A3 |
| WO 9406821 A1, 31.03.1994 | |||
| Устройство согласования скоростей цифровых потоков при передаче сигналов цифрового радиовещания | 1985 |
|
SU1283989A1 |
| US 2006099215 A1, 11.05.2006. | |||
Авторы
Даты
2015-12-27—Публикация
2011-02-11—Подача