ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к клетке-хозяину, содержащей экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор. Кроме того, изобретение относится к способу получения белка, требующего гамма-карбоксилирования, с высоким выходом продукта.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Кровотечение представляет собой общую клиническую проблему. Оно является следствием заболевания, травмы, хирургического вмешательства и медикаментозного лечения. Крайне важно механически остановить это кровотечение. Это может оказаться трудным или даже невозможным из-за местоположения кровотечения или из-за того, что оно происходит из многочисленных (мелких) сосудов. Поэтому пациентам с кровотечением может потребоваться лечение агентами, которые поддерживают гемостаз. Эти агенты могут представлять собой продукты, происходящие из крови (гемотерапия), агенты, которые вызывают высвобождение эндогенных гемостатических агентов, рекомбинантные факторы свертывания крови (F) или агенты, которые замедляют растворение сгустков крови.
Происходящие из крови продукты первой линии обработки, часто получаемые из местной больницы, представляют собой цельную кровь для замещения объема крови и поддержки гемостаза, эритроцитарную массу для улучшения способности транспортировать кислород, концентраты тромбоцитов для увеличения количества тромбоцитов (если их мало или они дефектные) и свежезамороженную плазму для поддержки гемостаза (свертывания крови и агрегации тромбоцитов). Происходящие из плазмы продукты второй линии, которые поддерживают гемостаз, представляют собой криопреципитат плазмы, концентраты протромбинового комплекса, концентраты активированного протромбинового комплекса и очищенные факторы свертывания крови. В настоящее время имеется несколько факторов свертывания крови в виде рекомбинантных белков человека, неактивных (факторы свертывания крови VIII и IX) и активированных (фактор свертывания крови Vila).
Гемофилия представляет собой наследственное или приобретенное нарушение кровотечения, характеризующееся либо аномальным фактором свертывания крови, либо дефицитом фактора свертывания крови, либо антителами против фактора свертывания крови, который ингибирует прокоагулирующую функцию. Большинство часто встречающихся гемофилий представляют собой гемофилию А (дефицит фактора свертывания крови VIII) и гемофилию В (дефицит фактора IX). Очищенные или рекомбинантные одиночные факторы свертывания крови представляют собой основной способ лечения пациентов с гемофилией. Пациенты с ингибиторными антителами имеют проблемы в лечении, так как эти антитела могут нейтрализовать также фактор свертывания крови, который вводят такому пациенту. Активная форма белка С (АРС) представляет собой ингибитор коагуляции плазмы путем деградации активированных факторов свертывания крови Va и VIlla. Показано, что рекомбинантный АРС представляет собой эффективный способ лечения чрезмерной коагуляции плазмы у пациентов с сепсисом.
Факторы свертывания крови для терапевтического применения могут быть получены из плазмы человека, хотя процесс очистки не является простым и требует многих стадий, из которых некоторые направлены на элиминацию контаминирующих вирусов. Но даже при расширенных мерах безопасности и тестировании продуктов, происходящих из крови, контаминация инфекционными вирусами или прионами не может быть исключена. Из-за этого риска крайне желательно получать терапевтические белки человека из рекомбинантных клеток, выращенных в среде, не содержащей компонентов животного происхождения. Это не всегда является эффективным, так как для многих белков необходим хозяин-млекопитающее для того, чтобы продуцироваться в полностью функциональной форме, то есть правильно посттрансляционно модифицироваться. К факторам свертывания крови, получаемым в рекомбинантных клетках в промышленных масштабах, относятся FVII (NovoSeven), FVIII (Kogenate, Recombinate, Refacto) и FIX (BeneFix) (Roddie and Ludlam. Blood Rev. 11: 169-177,1997), и активный белок С (Xigris). Одно из основных препятствий при получении больших количеств полностью функциональных рекомбинантных факторов свертывания крови человека заключается в Gla-домене, присутствующем в FII, FVII, FIX, FX и белке С. Этот домен содержит остатки глутаминовой кислоты, которые подвергаются посттрансляционной модификации путем присоединения карбоксильных групп. Получению этих факторов препятствует тот факт, что их сверхэкспрессия приводит к недокарбоксилированному и, следовательно, неактивному белку. Модификации Gla являются результатом действия витамин К-зависимого фермента, известного как γ-глутамилкарбоксилаза (GGCX). Этот фермент подробно изучали многие исследователи, в частности те, которые занимались изучением факторов свертывания крови (WO-A-8803926; Wu et al., Science 254 (5038): 1634-1636, 1991; Rehemtulla et al., Proc NatI Acad Sci USA 90: 4611-4615, 1993; Stanley J. Biol. Chem. 274 (24): 16940-16944, 1999; Vo et al., FEBS letters 445: 256-260, 1999; Begley et al., The Journal of Biological Chemistry 275 (46): 36245-36249, 2000; Walker et al., The Journal of Biological Chemistry 276 (11): 7769-7774, 2001; Bandyopadhyay et al., Proc Natl Acad Sci USA 99 (3): 1264-1269, 2002; Czerwiec et al., Eur J Biochem 289: 6162-6172, 2002; Hallgren et al., Biochemistry 41 (50): 15045-15055, 2002; Harvey et al., The Journal of Biological Chemistry 278 (10): 8363-8369, 2003). По меньшей мере двумя научными группами предприняты попытки увеличить выход продукции путем совместной экспрессии GGCX и фактора коагуляции FIX, но они оказались безуспешными (Rehemtulla et al., 1993, там же; Hallgren et al., 2002, там же). Принимая во внимание большой интерес к γ-карбоксилированым белкам, можно предположить, что гораздо больше попыток совместной экспрессии окончились неудачей и поэтому не были описаны.
В случае человеческого FII (протромбина), по меньшей мере 8 из 10 Glu-остатков должны быть правильно модифицированы для получения полностью функционального протромбина (Malhotra et al., J. Biol. Chem. 260: 279-287, 1985; Seegers and Walz 'Prothrombin and other vitamin К proteins', CRC Press, 1986). Для получения высоких уровней выхода rhFII были предприняты экстенсивные попытки с использованием нескольких различных систем, таких как клетки СНО, клетки ВНК, клетки 293, и системы экспрессии на основе вируса осповакцины, но все они закончились неудачей или имели результатом недокарбоксилированный продукт, и соответственно функционально неактивный протромбин (Jorgensen et al., J. Biol. Chem. 262: 6729-6734, 1987; Russo et al., Biotechnol AppI Biochem 14 (2): 222-233, 1991; Fischer et al., J Biotechnol 38 (2): 129-136, 1995; Herlitschka et al., Protein Expr. Purif. 8 (3): 358-364, 1996; Russo et al., Protein Expr. Purif. 10: 214-225, 1997; Vo et al., 1999, там же; Wu and Suttie Thromb Res 96 (2): 91-98, 1999). Ранее описанные продуктивности карбоксилированного рекомбинантного протромбина человека являются низкими; 20 мг/л - для мутантного протромбина (Côte et al., J. Biol. Chem 269: 11374-11380, 1994), 0,55 мг/л - для протромбина человека, экспрессированного в клетках СНО (полностью карбоксилированного, Jorgensen et al., 1987, там же), 25 мг/л - в клетках СНО (степень карбоксилирования не показана, Russo et al., 1997, там же).
В WO 92/19636 раскрыто клонирование и идентификация последовательности витамин К-зависимой карбоксилазы человека и крупного рогатого скота. В этой заявке для получения витамин К-зависимого белка предложена совместная экспрессия витамин К-зависимой карбоксилазы и витамин К-зависимого белка в подходящей клетке-хозяине. Никаких примеров совместной экспрессии карбоксилазы и витамин К-зависимого белка не приведено.
Существует необходимость в улучшенных способах получения активированных факторов свертывания крови с высоким выходом продукта. Настоящее изобретение направлено на решение этой потребности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно первому аспекту изобретения предложена клетка-хозяин, содержащая экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор, где первый промотор значительно сильнее второго промотора, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1.
Согласно другому аспекту изобретения предложена клетка, которая создана для экспрессии (1) белка, который требует гамма-карбоксилирования, и (2) γ-глутамилкарбоксилазы, где белки (1) и (2) экспрессируются в соотношении от 10:1 до 500:1.
Согласно другому аспекту изобретения предложена генетически модифицированная эукариотическая клетка-хозяин, содержащая:
(1) полинуклеотидную последовательность, кодирующую белок γ-глутамилкарбоксилазу, где указанная последовательность, кодирующая белок γ-глутамилкарбоксилазу, функциональным образом связана с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экспрессировать белок γ-глутамилкарбоксилазу; и
(2) полинуклеотид, кодирующий белок, требующий карбоксилирования белком γ-глутамилкарбоксилазой, функциональным образом связанным с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экспрессировать указанный белок, требующий карбоксилирования;
где данная клетка способна экспрессировать белок γ-глутамилкарбоксилазу и белок, требующий карбоксилирования, в соотношении 1:10.
Согласно другому аспекту изобретения предложен вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор, где первый промотор значительно сильнее второго промотора, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1.
Согласно еще одному аспекту изобретения предложен способ получения гамма-карбоксилированного белка, включающий: (1) культивирование клетки, адаптированной для экспрессии белка, который требует гамма-карбоксилирования, и γ-глутамилкарбоксилазы в соотношении по меньшей мере 10:1, при условиях, подходящих для экспрессии обоих белков, и (2) выделение гамма-карбоксилированного белка. В одном воплощении данный способ используют для получения гамма-карбоксилированного фактора IX человека, а в другом воплощении данный способ используют для получения гамма-карбоксилированного протромбина человека. В другом воплощении полученный гамма-карбоксилированный белок представляет собой гамма-карбоксилированный фактор Х человека.
Согласно другому аспекту изобретения предложен способ получения гамма-карбоксилированного белка в линии клеток млекопитающих, включающий этап совместной экспрессии указанного белка, требующего гамма-карбоксилирования, и γ-глутамилкарбоксилазы в линии клеток млекопитающих, где количество экспрессирующегося белка, требующего гамма-карбоксилирования, по меньшей мере в 10 раз выше, чем количество экспрессирующейся γ-глутамилкарбоксилазы, и (2) выделение гамма-карбоксилированного белка. В одном воплощении данный способ используют для получения гамма-карбоксилированного фактора IX человека, а в другом воплощении данный способ используют для получения гамма-карбоксилированного протромбина человека. В другом воплощении полученный гамма-карбоксилированный белок представляет собой гамма-карбоксилированный фактор Х человека.
Согласно другому аспекту изобретения предложен выделенный гамма-карбоксилированный белок, получаемый согласно вышеизложенным способам, и применение выделенного гамма-карбоксилированного белка, получаемого согласно вышеизложенным способам, в коагулянтной терапии или применение выделенного гамма-карбоксилированного белка, получаемого согласно вышеизложенным способам, для изготовления лекарства для применения в коагулянтной терапии.
Согласно еще одному аспекту изобретения предложен способ получения фармацевтической композиции, подходящей для индукции свертывания крови или стимуляции повышенной или пониженной коагуляции, включающий очистку активного карбоксилированного белка, экспрессирующегося в клетке-хозяине, адаптированной для экспрессии белка, требующего гамма-карбоксилирования, и γ-глутамилкарбоксилазы в соотношении от 10:1 до 500:1, и смешивание очищенного карбоксилированного белка с одним или более фармацевтически приемлемыми носителями или эксципиентами, и фармацевтическая композиция, получаемая этим способом. В одном воплощении активный карбоксилированный белок представляет собой гамма-карбоксилированный фактор IX человека, а в другом воплощении активный карбоксилированный белок представляет собой гамма-карбоксилированный протромбин человека. В другом воплощении активный карбоксилированный белок представляет собой гамма-карбоксилированный фактор Х человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1а приведена плазмидная карта вектора PN32 для совместной экспрессии (протромбин + GGCX).
На Фиг.1б представлена плазмидная карта экспрессирующего вектора Ptext5 (протромбин).
На Фиг.2 представлена плазмидная карта вектора РР6 для совместной экспрессии (протромбин + GGCX).
На Фиг.3а представлена плазмидная карта вектора F9NopA для совместной экспрессии (фактор IX+GGCX).
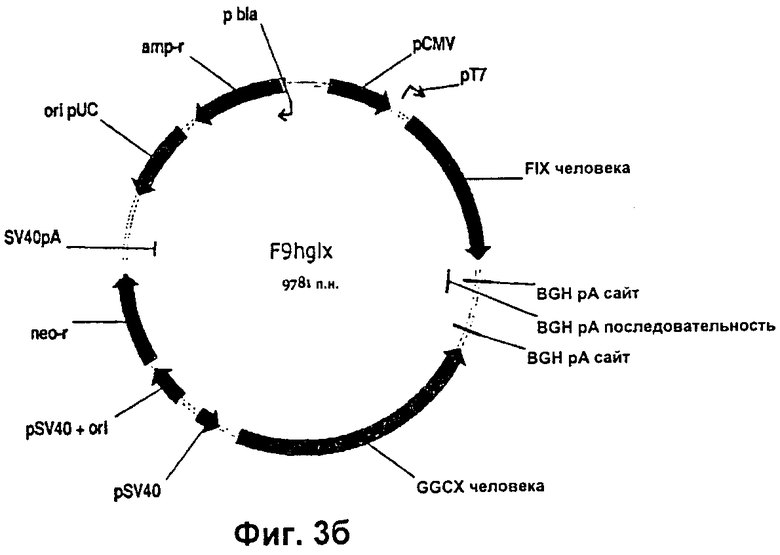
На Фиг.3б представлена плазмидная карта вектора F9hglx для совместной экспрессии (фактор IX+GGCX).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения разработали другой подход к экспрессии соответствующим образом карбоксилированных рекомбинантных витамин К-зависимых факторов свертывания крови, который включает совместную экспрессию витамин К-зависимого фактора свертывания крови и γ-глутамилкарбоксилазы (GGCX) в различных соотношениях. В качестве примера авторы изобретения экспрессировали протромбин человека (rhFII) и GGCX человека. Вместо использования сильных промоторов как для rhFII, так и для GGCX, как это уже пытались делать другие (Rehemtulla et al., 1993, там же; Hallgren et al., 2002, там же), авторы изобретения использовали стратегию, направленную на сильную экспрессию FII в комбинации со слабой или очень слабой экспрессией GGCX, при которой количество экспрессирующейся GGCX составляло менее 1/10 от экспрессирующегося rhFII. Неожиданно эта стратегия привела к высоким уровням секретируемого правильно модифицированного rhFII и хорошей жизнеспособности клеток-хозяев даже в том случае, когда эти клетки выращивали в среде с установленным химическим составом, не содержащей компонентов животного происхождения.
Авторы изобретения клонировали GGCX и протромбин человека в экспрессирующем векторе таким образом, что уровень мРНК протромбина превышает уровень мРНК GGCX по меньшей мере в 10 раз. Это приводит к большому избытку в продукции протромбинового белка по сравнению с GGCX-белком.
В качестве другого примера авторы изобретения экспрессировали rhFIX, используя те же самые векторы для совместной экспрессии с GGCX. Это привело к тому, что в одном случае клеточные линии продуцировали мРНК фактора IX на уровнях, превышающих уровни мРНК GGCX по меньшей мере в 10 раз. В другой клеточной линии соотношение мРНК фактора IX и мРНК GGCX составляло приблизительно 4-5:1. Существенно возросшую продуктивность rhFIX показала только клеточная линия, дающая соотношение по меньшей мере 10:1 (Таблица 1).
мый белок
ванный белок :GGCX,
приблизит. соотношение мРНК
¤ Данные из Rehemtulla 1993 и патента США №5460950.
Можно ожидать, что витамин К-зависимые факторы свертывания крови (FII, FVII, FIX, FX и их активированные формы FIIa или тромбин, FVIIa, FIXa, FXa), полученные настоящим способом совместной экспрессии с GGCX, окажутся полезными в предупреждении и лечении кровотечения, являющегося следствием травмы, хирургического вмешательства или заболеваний печени, почек, тромбоцитов или факторов свертывания крови (гемофилии). Аналогично можно ожидать, что фактор свертывания крови белок С и его активированная форма АРС окажутся полезными в предупреждении и лечении расстройств, связанных с повышенной коагуляцией с уменьшением или без уменьшения уровней белка С. Данный способ является подходящим также для других белков, которые требуют посттрансляционного карбоксилирования.
Согласно первому аспекту изобретения предложена клетка-хозяин, содержащая зкспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор, где первый промотор значительно сильнее второго промотора, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1.
В предпочтительном воплощении соотношение данных экспрессирующихся белков находится в диапазоне от 10:1 до 1000:1, более предпочтительно в диапазоне от 10:1 до 500:1 и еще более предпочтительно в диапазоне от 25:1 до 250:1. Особенно подходящее соотношение составляет приблизительно 200:1.
В отдельных воплощениях соотношение этих двух экспрессирующихся белков может составлять по меньшей мере 10:1, 30:1, 45:1, 50:1, 100:1, 200:1, 250:1, 300:1, 400:1, 500:1 и 1000:1.
В одном конкретном воплощении как молекула нуклеиновой кислоты, кодирующая белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, так и молекула нуклеиновой кислоты, кодирующая γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, расположены в одном и том же экспрессирующем векторе. В другом воплощении эти две молекулы нуклеиновой кислоты расположены в отдельных экспрессирующих векторах.
Согласно другому аспекту изобретения предложена нуклеиновая кислота, соответствующая SEQ ID NO:14 и SEQ ID NO:15.
Согласно другому аспекту изобретения предложена клетка-хозяин, трансфицированная или трансформированная вектором, содержащим последовательность SEQ ID NO:14 или SEQ ID NO:15 для экспрессии фактора IX человека.
Согласно другому аспекту изобретения предложена клетка-хозяин, способная экспрессировать ферменты фактор свертывания крови IX человека и γ-глутамилкарбоксилазу человека, где нуклеиновая кислота, кодирующая фактор свертывания крови IX человека, и нуклеиновая кислота, кодирующая γ-глутамилкарбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена эукариотическая клетка-хозяин из организма, не являющегося человеком, адаптированная для экспрессии ферментов фактора свертывания крови IX человека и γ-глутамилкарбоксилазы человека в соотношении по меньшей мере 10:1. В конкретном воплощении нуклеиновая кислота, кодирующая фактор свертывания крови IX человека, и нуклеиновая кислота, кодирующая γ-глутамилкарбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена клетка-хозяин, содержащая экзогенную нуклеиновую кислоту, содержащую нуклеиновую кислоту, кодирующую фактор свертывания крови IX человека, под контролем промотора hCMV, и нуклеиновую кислоту, кодирующую карбоксилазу человека, под контролем промотора SV40.
Согласно другому аспекту изобретения предложена нуклеиновая кислота, соответствующая SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3.
Согласно другому аспекту изобретения предложены клетки-хозяева, трансфицированные или трансформированные вектором, содержащим последовательность SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3 для экспрессии протромбина человека.
Согласно другому аспекту изобретения предложены клетки-хозяева, способные экспрессировать ферменты протромбин человека и гамма-карбоксилазу человека, где нуклеиновая кислота, кодирующая протромбин человека, и нуклеиновая кислота, кодирующая гамма-карбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена эукариотическая клетка-хозяин из организма, не являющегося человеком, адаптированная для экспрессии ферментов протромбина человека и гамма-карбоксилазы человека в соотношении по меньшей мере 10:1. В конкретном воплощении нуклеиновая кислота, кодирующая протромбин человека, и нуклеиновая кислота, кодирующая гамма-карбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена клетка-хозяин, содержащая экзогенную нуклеиновую кислоту, содержащую нуклеиновую кислоту, кодирующую протромбин человека, под контролем промотора hCMV и нуклеиновую кислоту, кодирующую карбоксилазу человека, под контролем промотора SV40.
Данное изобретение подтверждено примером, где в качестве белков, требующих карбоксилирования, использованы протромбин и фактор свертывания крови IX. Однако и у некоторых других белков, отличных от протромбина и фактора IX, полная биологическая активность зависит от правильного γ-карбоксилирования. К этим известным специалисту белкам принадлежит фактор свертывания крови FVII, который в настоящее время в промышленном масштабе получают только в рекомбинантных клетках млекопитающих с относительно низкими уровнями (приблизительно 10 мг/л или менее). Настоящее изобретение можно использовать для улучшения продуктивности любого белка, который зависит от γ-карбоксилирования, такие белки включают, но не ограничены ими, протромбин, фактор свертывания крови II (FII), фактор свертывания крови VII (FVII), фактор свертывания крови IX (FIX), фактор свертывания крови Х (FX), белок С, белок S, белок Z, костный Gla-белок (также известный как BGP или остеокальцин), Gla-белок матрикса (MGP), пролин-обогащенный Gla-полипептид 1 (PRRG1), пролин-обогащенный Gla-полипептид 2 (PRRG2), белок 6, специфический в отношении остановки роста (Gas 6). Другие подходящие белки представляют собой FXa-подобный белок из яда змей элапид (подсемейство Acanthophiina) и яда улиток-конусов (Conus textile).
Каждый из этих белков, включая их нуклеотидные и аминокислотные последовательности, хорошо известен. В таблице 2 идентифицированы типичные последовательности различных белков дикого типа и мутантных форм, которые могут быть использованы по настоящему изобретению.
Следует принимать во внимание, что данное изобретение не ограничено конкретным белком или белок-кодирующей последовательностью одного из тех белков, которые должны быть совместно экспрессированы. Более того, и в особенности это касается факторов свертывания крови, в данной области раскрыты многочисленные мутантные формы этих белков. Настоящее изобретение применимо в равной степени и к этим мутантным формам, включая природные аллельные варианты, данных белков, а также к последовательности дикого типа. В одном воплощении изобретение можно применять к любому белку дикого типа или белку, который по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентичен последовательности белка дикого типа.
Идентичность двух последовательностей может быть определена путем анализа попарного выравнивания с использованием таких компьютерных программ, как BestFit, PILEUP, Gap или FrameAlign. Предпочтительная программа выравнивания представляет собой BestFit. На практике при поиске сходных/идентичных последовательностей на запрос о поиске в базе данных обычно необходимо выполнить первичную идентификацию сходных последовательностей, используя подходящие алгоритмы, такие как Blast, Blast2, NCBI Blast2, WashU Blast2, FastA или Fasta3, и матрицу весовых коэффициентов, такую как Blosum 62. Такие алгоритмы стремятся к близкой аппроксимации алгоритма выравнивания "золотого стандарта" по Смиту-Уотерману (Smith-Waterman). Таким образом, предпочтительное программное обеспечение/программа реализации поиска для использования при определении схожести, то есть насколько две исходные полипептидные последовательности выровнены, представляет собой алгоритм Смита-Уотермана. Идентичность относится к прямым совпадениям, сходство допускает консервативные замены.
Термин "γ-глутамилкарбоксилаза", или "GGCX", в контексте данного описания относится к витамин К-зависимому ферменту, который катализирует карбоксилирование остатков глутаминовой кислоты.
GGCX-ферменты широко распространены и клонированы из многих разных видов, таких как кит белуха Delphinapterus leucas, рыба-жаба Opsanus tau, курица (Gallus gallus), миксина (Myxine glutinosa), мечехвост (Limulus polyphemus) и улитка-конус Conus textile (Begley et al., 2000, там же; Bandyopadhyay et al., 2002, там же). Карбоксилаза улитки-конуса сходна с карбоксилазой крупного рогатого скота и экспрессировалась в клетках COS (Czerwiec et al., 2002, там же). Дополнительные белки, сходные с GGCX, можно обнаружить у насекомых и прокариот, таких как Anopheles gambiae, Drosophila melanogaster и Leptospira (регистрационные номера NCBI: gi 31217234, gi 21298685, gi 24216281, gi 24197548 и (Bandyopadhyay et al., 2002, там же) соответственно). Фермент карбоксилаза проявляет значительную эволюционную консервативность. Показано или может быть прогнозировано, что некоторые ферменты из организма, не являющегося человеком, проявляют активность, сходную с активностью GGCX человека, которую использовали авторы изобретения, и поэтому могут быть использованы в качестве альтернативы данному человеческому ферменту.
В таблице 3 идентифицированы типичные последовательности предсказанных белков, гомологичных GGCX человека (сортированы по видовому происхождению), которые могут быть использованы по настоящему изобретению.
Каждый из GGCX-белков, идентифицированных выше, и GGCX-белков из других видов можно применять в качестве фермента карбоксилазы в настоящем изобретении.
Один из способов осуществить дифференциальную экспрессию двух совместно экспрессирующихся белков состоит в том, чтобы использовать разные промоторы в качестве части соответствующих последовательностей, контролирующих экспрессию. Данная область техники изобилует примерами разных промоторов и других последовательностей, контролирующих экспрессию, которые способны экспрессировать гетерологичные белки на различающихся уровнях и в разной степени. Рекомбинантная технология экспрессии достаточно развита, чтобы специалист в области экспрессии белков был способен выбрать промоторы и другие регуляторные последовательности для осуществления совместной экспрессии белка, требующего карбоксилирования, и карбоксилазы в желательном соотношении. Выбор того, какие конкретные промоторы и другие последовательности, контролирующие экспрессию, должны быть использованы, зависит от личного предпочтения.
В одном воплощении регуляторные последовательности, ассоциированные с белком, требующим гамма-карбоксилирования, включают сильный промотор. В одном воплощении этот промотор представляет собой предранний промотор цитомегаловируса человека (hCMV). Сильный промотор в данном контексте определен как промотор, приводящий к образованию более 1000 транскриптов/клетку. Слабый промотор в данном контексте определен как промотор, приводящий к образованию менее 1000 транскриптов/клетку.
В другом воплощении регуляторные последовательности, ассоциированные с γ-глутамилкарбоксилазой, включают слабый промотор. В одном воплощении этот промотор представляет собой ранний промотор SV40. В другом воплощении белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза находятся под контролем разных промоторных элементов, при этом промотор, контролирующий экспрессию γ-глутамилкарбоксилазы, является более слабым, чем промотор, контролирующий экспрессию белка, требующего гамма-карбоксилирования.
В другом воплощении γ-глутамилкарбоксилаза находится под контролем раннего промотора SV40, а белок, требующий гамма-карбоксилирования, находится под контролем предраннего промотора цитомегаловируса человека (hCMV). В одном воплощении в соответствии с данным конкретным аспектом изобретения белок, требующий гамма-карбоксилирования, представляет собой фактора Х человека. В другом воплощении белок, требующий гамма-карбоксилирования, представляет собой протромбин человека. В другом воплощении белок, требующий гамма-карбоксилирования, представляет собой фактор IX человека.
Данное изобретение подтверждено примером, в котором для сверхэкспресии фактора IX или протромбина используют сильный промотор CMV (Boshart et al., Cell 41: 521-530, 1985), а для контроля экспрессии GGCX более слабый промотор SV40 (Wenger et al., Anal Biochem 221: 416-418, 1994). Другие сильные промоторы, которые можно было бы использовать по настоящему изобретению, включают pEF-1α (ген субъединицы фактора-1α элонгации человека) (Mizushima and Nagata, Nuc Acids Res 18: 5322, 1990; Goldman et al., BioTechniques 21: 1013-1015, 1996), pRSV [вирус саркомы Рауса (German et al., Proc Natl Acad Sci USA 79: 6777-6781, 1982)] и pUbC [убиквитин человека (Schorpp et al., Nuc Acids Res 24: 1787-1788, 1996)], но не ограничены ими.
Важно обеспечить, чтобы белок, который должен быть получен (белок, требующий карбоксилирования), находился в избытке по сравнению с ферментом модификации с получением соотношения по меньшей мере 10:1. Способы достижения низкого уровня экспрессии фермента модификации (γ-глутамилкарбоксилазы) включают:
1) Использование слабого промотора для контроля экспрессии фермента модификации, включая, но не ограничиваясь ими, предранний промотор SV40, минимизированный промотор FIX (Rouet et al., The Journal of Biological Chemistry 267: 20765-20773, 1992) или промотор тимидинкиназы HSV (вируса простого герпеса) (Wenger et al., 1994, там же).
2) Мутирование промоторных или энхансерных последовательностей сильного промотора для уменьшения силы промотора.
3) Удаление или изменение последовательности Козака (Kozak) (сигнала инициации трансляции) для уменьшения эффективности трансляции (Kozak, Nuc Acids Res 15: 8125-8148, 1987; Kozak, Proc Natl Acad Sci USA 87: 8301-8305, 1987, 1990).
4) Клонирование нуклеиновой кислоты, кодирующей белок, который должен быть получен (белок, требующий карбоксилирования), и нуклеиновой кислоты, кодирующей GGCX, в отдельных векторах и трансфекцию большим избытком конструкции, содержащей белок, который должен быть получен, с тем чтобы получить клетку с множественными копиями конструкции, содержащей белок, который должен быть получен.
5) Клонирование ДНК, кодирующей белок, который должен быть получен, и ДНК, кодирующей GGCX-модификацию, в отдельных векторах, котрансфекцию или независимую трансфекцию и использование системы амплификации для усиления экспрессии белка, который должен быть получен.
6) Выделение стабильной клеточной линии с низкими уровнями экспрессии рекомбинантной GGCX (но превышающими эндогенные уровни) и использование ее в качестве линии клеток-хозяев для экспрессии белков, требующих γ-карбоксилирования.
7) Введение мутации(й) в GGCX для уменьшения сродства GGCX к субстрату.
Наряду с этими способами специалисту в области экспрессии рекомбинантных белков известны другие способы, которые можно было бы использовать для получения клетки-хозяина, которая экспрессирует белок, требующий карбоксилирования, и белок карбоксилазу в соотношении по меньшей мере 10:1.
Согласно другому аспекту изобретения предложена клетка, которая создана или адаптирована для экспрессии (1) белка, который требует гамма-карбоксилирования, и (2) γ-гпутамилкарбоксилазы, где белки (1) и (2) экспрессируются в соотношении от 10:1 до 500:1. В конкретном воплощении γ-глутамилкарбоксилаза экспрессируется в диапазоне, превышающем эндогенные уровни (то есть уровни γ-глутамилкарбоксилазы в нерекомбинантной или неадаптированной клетке) от 2 до 5 раз.
Согласно другому аспекту изобретения предложена рекомбинантная клетка, адаптированная для экспрессии (1) белка γ-глутамилкарбоксилазы, превышающей конститутивные уровни, обнаруженные в эквивалентной неадаптированной клетке, и (2) белка, требующего карбоксилирования, где количество экспрессирующегося белка γ-глутамилкарбоксилазы и белка, требующего карбоксилирования, находится в соотношении по меньшей мере 1:10.
Согласно другому аспекту изобретения предложена генетически модифицированная эукариотическая клетка-хозяин, содержащая:
(1) полинуклеотидную последовательность, кодирующую белок γ-глутамилкарбоксилазу, где указанная последовательность, кодирующая белок γ-глутамилкарбоксилазу, функциональным образом связана с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экспрессировать белок γ-глутамилкарбоксилазу; и
(2) полинуклеотид, кодирующий белок, требующий карбоксилирования белком γ-глутамилкарбоксилазой, функциональным образом связанный с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экспрессировать указанный белок, требующий карбоксилирования;
где данная клетка способна экспрессировать белок γ-глутамилкарбоксилазу и белок, требующий карбоксилирования, в соотношении по меньшей мере 1:10.
Согласно другому аспекту изобретения предложена клетка, адаптированная для экспрессии белка, который требует гамма-карбоксилирования, и γ-глутамилкарбоксилазы, где нуклеиновая кислота, кодирующая белок, который требует гамма-карбоксилирования, и нуклеиновая кислота, кодирующая γ-глутамилкарбоксилазу, находятся под контролем регуляторных последовательностей, подходящих для того, чтобы обеспечить по меньшей мере 10-кратное превышение количества экспрессирующегося белка, который требует гамма-карбоксилирования, по отношению к количеству белка γ-глутамилкарбоксилазы.
В одном воплощении по меньшей мере один из белка, который требует гамма-карбоксилирования, и γ-глутамилкарбоксилазы экспрессируется из нуклеиновой кислоты, которая введена в клетку с помощью технологии рекомбинантных ДНК. Альтернативный способ работы данного изобретения представляет собой экспрессию эндогенного белка (белка, требующего карбоксилирования, или карбоксилазы), но с заменой эндогенных регуляторных последовательностей (промотора и так далее) гетерологичными последовательностями для осуществления желаемого уровня экспрессии.
Предпочтительно клетка-хозяин представляет собой эукариотическую клетку. Типичные клетки-хозяева включают, но не ограничиваются ими, клетки насекомых, клетки дрожжей и клетки млекопитающих. Особенно предпочтительными являются клетки млекопитающих. Подходящие линии клеток млекопитающих включают, но не ограничиваются ими, клетки СНО, НЕК, NSO, 293, Per С.6, ВНК и COS и их производные. В одном воплощении клетка-хозяин представляет собой линию клеток млекопитающих CHO-S.
Раньше сверхэкспрессия белков, зависимых от карбоксилирования, обычно приводила к недокарбоксилированным продуктам. Это обусловлено тем, что эндогенная карбоксилирующая способность клетки-хозяина ограничивается. С другой стороны, огромная (16-70-кратная) сверхэкспрессия активности GGCX не улучшает выход продукта (Rehemtulla et al., Proc Natl Acad Sci USA 90: 4611-4615, 1993), (Berkner and Pudota, Proc Natl Acad Sci USA. 95:446-471, 1998), (Hallgren et al., Biochemistry 41 (50): 15045-15055, 2002). Причина этого не вполне понятна. Согласно настоящему изобретению требуется умеренная сверхэкспресия GGCX. Это обеспечивает экспрессию в клетке более высоких по сравнению с эндогенными уровней GGCX, например таких, где уровень активности GGCX повышается только в 1,5-5 раз. Как показано в примере 1, при этом умеренно повышенном уровне неожиданно были получены высокие уровни полностью карбоксилированного rhFII.
Поэтому необходимо принимать во внимание, что то соотношение в экспрессии белка, требующего карбоксилирования, и карбоксилазы, которое отличает данное изобретение от предшествующего уровня техники, исключает эндогенно продуцируемые уровни GGCX. Чтобы отвечать требованиям высокой продуктивности, карбоксилазу и белок, требующий карбоксилирования, необходимо экспрессировать на уровнях, превышающих уровни экспрессии, обнаруживаемые в обычных клетках.
В предпочтительном воплощении используют клетку или клеточную линию, которая обладает незначительной конститутивной экспрессией или в которой отсутствует конститутивная экспрессия карбоксилазы и/или белка, требующего карбоксилирования.
В одном воплощении γ-глутамилкарбоксилазу экспрессируют на уровне, меньшем или равном 10% от количества белка, который требует гамма-карбоксилирования. В альтернативных дополнительных воплощениях γ-глутамилкарбоксилазу экспрессируют на уровнях, меньших или равных 5%, 2%, 1%, 0,5%, 0,25%, 0.1%, 0,05% или 0,01% от количества белка, который требует гамма-карбоксилирования.
Степень экспрессии этих двух белков может быть измерена путем использования методик, хорошо известных специалисту в данной области. Эти методики включают прямые измерения, например измерение биологической активности белка или количества белка (например с использованием антител), и косвенные измерения, например через измерение уровней транскрипции мРНК (например путем Taqman-анализа, как в примере 3). Следующие ссылки раскрывают способы измерения ферментативной активности GGCX (Lingenfelter et al., Biochemistry 35: 8234-8243, 1996; Berkner et al., Proc Natl Acad Sci USA 95: 446-471, 1998; Hallgren et at., Biochemistry 41 (50): 15045-15055, 2002; и Berkner et al., Proc Natl Acad Sci USA 89: 6242-6246, 1992).
Для целей данного изобретения соотношение в экспрессии этих двух белков определяют косвенно через уровень транскрипции мРНК (например путем Taqman-анализа).
В одном воплощении белок, который требует гамма-карбоксилирования, представляет собой витамин К-зависимый фактор свертывания крови. В другом воплощении белок, который требует гамма-карбоксилирования, предпочтительно выбран из группы, состоящей из протромбина, фактора свертывания крови II, коагуляционного FII, фактора свертывания крови VII, коагуляционного FVII, фактора свертывания крови IX, коагуляционного FIX, фактора свертывания крови X, коагуляционного FX, белка С, белка S, белка Z, костного Gla-белка, Gla-белка матрикса, белка 6, специфического в отношении остановки роста, и FXa-подобного белка из Acanthophiinae.
В одном из конкретных воплощений белок, который требует гамма-карбоксилирования, представляет собой фактор IX. В другом конкретном воплощении белок, который требует гамма-карбоксилирования, представляет собой протромбин. В другом воплощении белок, который требует гамма-карбоксилирования, представляет собой фактор X.
Настоящее изобретение в общем случае применимо к белкам, которые требуют карбоксилирования, любого происхождения. Однако для использования экспрессирующегося белка в терапевтических целях человеком особенно предпочтительными являются человеческие белки.
В одном воплощении источником происхождения γ-глутамилкарбоксилазы является мышь, крыса, крупный рогатый скот или улитка-конус. В другом воплощении γ-глутамилкарбоксилаза является человеческим белком.
Согласно другому аспекту изобретения предложен способ получения гамма-карбоксилированного белка, включающий: (1) культивирование клетки, адаптированной для экспрессии белка, который требует гамма-карбоксилирования, и γ-глутамилкарбоксилазы в соотношении по меньшей мере 10:1, при условиях, подходящих для экспрессии обоих белков, и (2) выделение гамма-карбоксилированного белка.
Согласно другому аспекту изобретения предложен способ получения гамма-карбоксилированного белка в линии клеток млекопитающих, включающий этап совместной экспрессии γ-глутамилкарбоксилазы с указанным белком, требующим гамма-карбоксилирования, в линии клеток млекопитающих, где количество экспрессирующегося белка, требующего гамма-карбоксилирования, по меньшей мере в 10 раз выше, чем количество экспрессирующейся γ-глутамилкарбоксилазы, и (2) выделение гамма-карбоксилированного белка.
Способ получения гамма-карбоксилированного белка, включающий:
а) генетическую модификацию эукариотической клетки с введением первого полинуклеотида, кодирующего белок, который требует карбоксилирования, и сопровождающих последовательностей, контролирующих экспрессию, и второго полинукпеотида, кодирующего γ-глутамилкарбоксилазу, и сопровождающих последовательностей, контролирующих экспрессию, с получением эукариотической клетки-хозяина, способной совместно репрессировать белок, который требует карбоксилирования, и белок γ-глутамилкарбоксилазу в соотношении по меньшей мере 10:1;
б) культивирование данной клетки в подходящей культуральной среде при условиях, которые позволяют экспрессироваться первой и второй полинуклеотидным последовательностям; и в) выделение карбоксилированного белка из среды или из клеток-хозяев.
Экспрессирующие векторы обычно включают точку инициации репликации, промотор, сайт инициации трансляции, возможно, сигнальный пептид, сайт полиаденилироавания и сайт терминации транскрипции. Для селекции эти векторы обычно также содержат один или более маркерных генов устойчивости к антибиотикам. Подходящими экспрессирующими векторами могут быть плазмиды, космиды или вирусы, такие как фаг или ретровирус. Кодирующую последовательность полипептида помещают под контроль соответствующего промотора (то есть HSV, CMV, TK, RSV, SV40 и так далее), регуляторных элементов и терминатора транскрипции (они представляют собой ассоциированные последовательности, контролирующие экспрессию), с тем чтобы последовательность нуклеиновой кислоты, кодирующая данный полипептид, транскрибировалась в РНК в клетке-хозяине, трансформированной или трансфицированной экспрессирующей векторной конструкцией. Кодирующая последовательность может содержать или не содержать сигнальный пептид или лидерную последовательность для секреции данного полипептида из клетки-хозяина. Предпочтительные векторы обычно содержат по меньшей мере один множественный сайт клонирования. В некоторых воплощениях обычно имеется сайт клонирования или множественный сайт клонирования, расположенный между промотором и геном, который должен быть экспрессирован. Такие сайты клонирования могут быть использованы для создания N-концевых слитых белков путем клонирования второй последовательности нуклеиновой кислоты в этот сайт клонирования таким образом, чтобы она прилегала к последовательности данного гена и находилась с ней в рамке. В других воплощениях может существовать сайт клонирования или множественный сайт клонирования, расположенный непосредственно ниже гена для облегчения создания С-концевых гибридов способом, сходным с описанным выше способом для N-концевых гибридов.
Клетка-хозяин может быть генетически модифицирована (иметь введенные дополнительные нуклеиновые кислоты) многочисленными способами, хорошо известными специалисту в данной области, такими как трансфекция, трансформация и электропорация.
Данное изобретение также распространяется на очищенный гамма-карбоксилированный белок, получаемый способами по настоящему изобретению, и на его применение в коагулянтной терапии.
Согласно еще одному аспекту изобретения предложен способ стимуляции повышенной или пониженной коагуляции у субъекта, включающий введение фармакологически эффективного количества выделенного гамма-карбоксилированного белка, полученного вышеописанными способами, пациенту, нуждающемуся в этом.
Согласно другому аспекту изобретения предложен способ получения фармацевтической композиции, подходящей для индукции свертывания крови, включающий очистку активного карбоксилированного белка, экспрессирующегося в клетке-хозяине, адаптированной для экспрессии белка, требующего гамма-карбоксилирования, и γ-глутамилкарбоксилазы в соотношении по меньшей мере 10:1, и смешивание очищенного карбоксилированного белка с одним или более фармацевтически приемлемыми носителями или эксципиентами.
Терапевтические препараты на основе белков обычно хранят замороженными, охлажденными, при комнатной температуре и/или в лиофилизированном состоянии.
Композиции по данному изобретению могут быть получены с помощью общепринятых методик с использованием общепринятых фармацевтических эксципиентов, хорошо известных в данной области, но чаще всего существуют в форме, подходящей для инъекции, либо парентеральной, либо прямо в место ранения.
Водные суспензии обычно содержат активный ингредиент в тонкоизмельченной форме вместе с одним или более суспендирующими агентами, такими как натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующими или увлажняющими агентами, такими как лецитин или продукты конденсации алкиленоксида с жирными кислотами (например полиоксэтиленстеарат), или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, происходящими из жирных кислот и гексита, такие как полиоксиэтиленсорбитмоноолеат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, происходящими из жирных кислот и гексита, такие как полиоксиэтиленсорбитмоноолеат, или продукты конденсации этиленоксида с неполными эфирами, происходящими из жирных кислот и ангидридов гексита, например полиэтиленсорбитанмоноолеат. Эти водные суспензии также могут содержать один или более консервантов (таких как этил- или пропил-пара-гидроксибензоат), антиоксидантов (таких как аскорбиновая кислота), окрашивающих агентов, корригентов и/или подслащивающих агентов (таких как сахароза, сахарин или аспартам).
Масляные суспензии могут быть приготовлены в виде препарата путем суспендирования активного ингредиента в растительном масле (таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло) или в минеральном масле (таком как вазелиновое масло). Эти масляные суспензии могут также содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Для обеспечения приятного вкуса перорального препарата могут быть добавлены подслащивающие агенты, такие как агенты, указанные выше, и корригенты. Эти композиции могут быть сохранены путем добавления антиоксиданта, такого как аскорбиновая кислота.
Порошки, подходящие для приготовления водного препарата, предназначенного для инъекции, путем добавления подходящего разбавителя. обычно содержат активный ингредиент вместе с подходящими носителями и эксципиентами, суспендирующим агентом и одним или более стабилизаторами или консервантами. Разбавитель может содержать другие подходящие эксципиенты, такие как консерванты, модификаторы тоничности и стабилизаторы.
Фармацевтические композиции по данному изобретению также могут находиться в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как оливковое масло или арахисовое масло, или минеральное масло, такое, как, например, вазелиновое масло, или смесь любых из этих масел. Подходящими эмульгирующими агентами могут быть, например, природные камеди, такие как аравийская камедь или трагакантовая камедь, природные фосфатиды, такие как соя, лецитин, сложные эфиры или неполные эфиры, происходящие из жирных кислот и ангидридов гексита (например сорбитанмоноолеат) и продукты конденсации указанных неполных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитанмоноолеат.
Фармацевтические композиции по настоящему изобретению могут находиться также в форме стерильного раствора или суспензии в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, которые могут быть приготовлены в виде препарата по известным методикам с использованием одного или более подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов, которые упомянуты выше. Стерильный инъецируемый препарат может представлять собой также стерильный инъецируемый раствор или суспензию в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, например раствор в 1,3-бутандиоле.
За дополнительной информацией по препаратам читателя отсылают к Главе 25.2, Том 5 в Comprehensive Medicinal Chemistry (Corwin Hansch; Chairman of Editorial Board, Pergamon Press 1990); или к Тому 99 в Drugs and the pharmaceutical sciences; Protein formulation and delivery (Eugen J. McNally, executive editor), Marcel Dekker Inc 2000.
Количество активного ингредиента, который объединяют с одним или более эксципиентами для получения стандартной лекарственной формы, обычно необходимо варьировать в зависимости от организма, который лечат, и конкретного пути введения. Например, препарат, предназначенный для инъекции людям, обычно содержит, например, от 0,5 мг до 2 г активного агента, смешанного с соответствующим и пригодным количеством эксципиентов, которое может варьировать от приблизительно 5 до приблизительно 98 процентов по массе от всей композиции. Стандартные лекарственные формы обычно содержат от приблизительно 1 мг до приблизительно 500 мг активного ингредиента. Белковые терапевтические препараты обычно хранят в замороженном или лиофилизованном виде. За дополнительной информацией по путям введения и режимам дозирования читателя отсылают к Главе 25.3, Том 5 в Comprehensive Medicinal Chemistry (Corwin Hansch; Chairman of Editorial Board), Pergamon Press 1990.
Величина дозы соединения для терапевтических и профилактических целей, конечно, варьирует в зависимости от природы и тяжести состояний, возраста и пола животного или пациента и пути введения, в соответствии с общеизвестными принципами медицины. При использовании соединения в терапевтических или профилактических целях его обычно вводят таким образом, чтобы полученная суточная доза находилась в диапазоне, например, от 0,5 мг до 75 мг на кг массы тела, причем, если требуется, давалась дробными дозами. Более низкие дозы обычно вводят тогда, когда используют парентеральный путь. Так, например, при внутривенном ведении обычно используют дозу в диапазоне от 0,5 мг до 30 мг на кг массы тела. Аналогично при введении путем ингаляции обычно используют дозу в диапазоне, например, от 0,5 мг до 25 мг на кг массы тела.
Изобретение будет дополнительно описано с помощью нижеследующих неограничивающих примеров.
Если не указано иначе, в практике по настоящему изобретению используют общепринятые методы молекулярной биологии и методы рекомбинантных ДНК в пределах компетентности специалиста в данной области. В литературе дано полное объяснение этих методов. Смотри, например, Sambrook et al., eds., Molecular Cloning: A Laboratory Manual (3th ed.) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (2001); Ausubel et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY (2002); Glover & Hames, eds., DNA Cloning 3: A Practical Approach, Vols. I, II & III, IRL Press, Oxford (1995); Colowick & Kaplan, eds., Methods in Enzymology, Academic Press; Weir et al., eds., Handbook of Experimental Immunology, 5th ed., Blackwell Scientific Publications, Ltd., Edinburgh, (1997).
Пример 1
Амплификация кДНК, кодирующей человеческий FII (hPT) и человеческую GGCX
мРНК из печени человека получали от Clontech, а синтез кДНК осуществляли, используя систему Superscript от Invitrogen. Полученную кДНК использовали в качестве матрицы для амплификации человеческого FII, используя:
праймер PTF0 5'-ATTCCTCAGTGACCCAGGAGCTGACA-3' (SEQ ID NO:3) и
праймер РТЕХТ 5'-CTACTCTCCAAACTGATCAATGACCTTCTGTATCCACTTCTT-3' (SEQ ID NO:4).
Человеческую GGCX амплифицировали, используя
праймер hglx5 5'-TCCGCAGAGCAATGGCGGTGTCT-3', (SEQ ID NO:5) и
hglx3 5'-CCAACATCTGGCCCCTTCAGAACT-3', (SEQ ID NO:6).
ПЦР-продукт, кодирющий FII, клонировали непосредственно в ТА-ТОРО-обработанный вектор pCDNA3.1V5/His (Invitrogen). В результате селекции клона с кДНК hFII, встроенной в соответствующем направлении, получали контрольную конструкцию Ptext5 (Фиг.1б). кДНК, кодирующую GGCX, под контролем промотора SV40 получали путем переноса фрагмента, кодирующего GGCX, из pCDNA3.1V5/His ТА-ТОРО в вектор pZeoSV2+(Invitrogen) с использованием рестриктаз BamHI и Notl. Рестрикционные сайты EcoRV-Notl, расположенные ниже GGCX-вставки, удаляли. Затем ClaI-BclI-фрагмент с тупыми концами из полученной плазмиды pZeoSV2-GGCX (содержащей промотор SV40 и GGCX-содержащую вставку, но не сайт полиаденилирования и сигнал для полиаденилирования ниже последовательности, кодирующей GGCX) клонировали в рестрикционный сайт DraIII с тупыми концами плазмиды pCDNA3.1+(Invitrogen). Клон с pSV40-GGCX-фрагментом, встроенным в тандеме (то же самое направление транскрипции) относительно промотора CMV, а Kpnl-Notl-фрагмет с тупыми концами, кодирующий FII, из Ptext5 клонировали в EcoRV-сайт с получением конструкции PN32 (Фиг.1а). Последовательности ДНК PN32 и Ptext5 приведены в Приложении 2. Все методы клонирования соответствовали стандартным методам и/или методикам, рекомендованным производителями.
Конструкция PN32 содержит следующие ключевые признаки:
- Предранний промотор цитомегаловируса человека (hCMV), контролирующий трансксипцию кДНК протромбина человека, за которой следует сигнал полиаденилирования гормона роста крупного рогатого скота (BGH) для эффективной терминации транскрипции и полиаденилирования мРНК.
- Ранний промотор SV40, контролирующий транскрипцию кДНК γ-карбоксилазы человека (GGCX) без выраженного сайта или сигнала полиаденилирования.
- Другие признаки, показанные на Фиг.1а.
Для сравнения использовали конструкцию PText5 без GGCX (Фиг.1б). Нуклеотидная последовательность PTEXT5 приведена в SEQ ID NO:1. Нуклеотидная последовательность PN32 приведена в SEQ ID NO:2.
Получение клеточных линий, продуцирующих протромбин
Две конструкции, приведенные на Фиг.1, трансфицировали в клетки CHO-S (Invitrogen). Стабильные трансфектанты подвергали селекции и проводили их скрининг для идентификации высокопродуктивных клонов, используя имеющийся в продаже набор для анализа активности протромбина (Chromogenix). В этом анализе пробы, содержащие протромбин, сначала обрабатывали токсином из змеиного яда (Экарин - доступен в Sigma) для того, чтобы вызвать образование тромбина. Активность тромбина затем анализировали путем добавления хромогенного субстрата (S-2238), который при обработке тромбином дает окрашивание. Трансфекцию и селекцию клонов осуществляли параллельно с обеими конструкциями. Культивирование клеток проводили в среде DMEM (среде Игла в модификации Дульбекко), содержащей 9% сыворотки эмбрионов крупного рогатого скота, инактивированной нагреванием. Затем полученные клоны адаптировали к росту в среде, не содержащей компонентов животного происхождения. Наилучший продуцирующий клон, который давал до 400 мг/л рекомбинантного протромбина человека (в большом избытке по сравнению с любым из опубликованных уровней) при выращивании в среде установленного химического состава, не содержащей компонентов животного происхождения, был получен в результате трансфекции с PN32 (FII+GGCX). Рекомбинантно продуцируемый rhFII очищали (согласно способу, раскрытому в Josic et al., Journal of Chromatography B, 790: 183-197, 2003) и фракционировали с помощью ионообменной хроматографии, используя колонку с Q-сефарозой в соответствии со стандартными методами, с получением чистого полностью карбоксилированного rhFII. rhFII, продуцируемый в ферментере вплоть до уровня 78 мг/л, являлся полностью карбоксилированным и обладал такой же биологической активностью, что и протромбин, очищенный из человеческой плазмы. Карбоксилирование анализировали путем секвенирования N-конца белка и с помощью анализа протромбиназы (Мао et al., JBC, 273: 30086-30091, 1998). Образование тромбина инициировали в плазме человека с низким уровнем тромбоцитов путем добавления тканевого фактора и потенциал эндогенного тромбина измеряли по существу так, как описано у Stig с соавт. (Blood Coagulation and Fibrinolysis, 14: 457-462, 2003).
Продуктивность лучшего клона, полученного с PTextS-конструкцией, в среде установленного химического состава, не содержащей компонентов животного происхождения, не превышала 10 мг/л, что находится в том же самом диапазоне, который приводится в литературе. По приблизительным оценкам доля полностью карбоксилированного протромбина, полученного из PTextS-клона, составляла около 50%. Таким образом, конечный выход полностью ативного rhFII был по меньшей мере в 10 раз выше в том случае, когда использовали РМ32-конструкцию, содержащую структуру с низким уровнем экспрессии γ-карбоксилазы. Для каждой из этих конструкций было идентифицировано несколько клонов со сходными уровнями экспрессии.
Пример 2
Измерение ggcx-активности в клеточных линиях СНО
Две rhFII-продуцирующие клеточные линии CHO-S, полученные путем трансфекции соответственно РМ32-конструкцией (совместная экспрессия с GGCX человека) и РТЕХТ5 (отсутствует совместная экспрессия с GGCX), выращивали во вращающихся колбах, используя среду без белка с добавлением 5 мкг/мл витамина К. Одну десятую часть данной ростовой среды ежедневно меняли. Через 7 дней культивирования клетки собирали и микросомы готовили, как описано у Berkner с соавт. (Рrос Natl Acad Sci USA 89: 6242-6246, 1992). Рекомбинантный человеческий FII очищали из культурального супернатанта от собранных клеток. GGCX-активность измеряли, как описано у Berkner и Pudota (Proc Natl Acad Sci USA 95: 446-471, 1998) и Lingenfelter и Berkner (Biochemistry 35: 8234-8243, 1996). Измерения авторов изобретения показали, что при использовании одинаковых условий роста GGCX-активность в клеточной линии СНО, совместно экспрессирующей GGCX человека, в 1,5 раза выше по сравнению с клеточной линией СНО, экспрессирующей только rhFII.
Пример 3
Анализ экспрессии мРНК γ-карбоксилазы и протромбина в клеточной линии CHO-S с помощью полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР) в режиме реального времени
Две клеточные линии CHO-S, полученные путем стабильной трансфекции соответственно конструкциями PN32 (FII+GGCX) и РТЕХТ5 (только FII), выращивали во вращающихся колбах, используя среду без белка с добавлением витамина К. Чтобы охватить установленные максимальные уровни в продуцировании мРНК, пробы культур отбирали через 4, 5 и 6 дней культивирования. РНК выделяли с помощью Trizol™ в соответствии с протоколом Invitrogen, прилагаемым производителем. Выделенную РНК обрабатывали ДНКазой I, используя набор DNA-free™ от Ambion. Синтез кДНК осуществляли, используя случайные гексамерные праймеры и содержимое набора Superscript™ First-Strand Synthesis System для ОТ-ПЦР, Invitrogen.
Праймеры и Vic-меченые пробы для ОТ-ПЦР в режиме реального времени выбирали, используя программу Primer Express™, Applied Biosystems.
Олигонуклеотиды для γ-карбоксилазы человека
5' ACACCTCTGGTTCAGACCTTTCTT 3' Прямой праймер (SEQ ID NO:7)
5' AATCGCTCATGGAAAGGAGTATTT 3' Обратный праймер (SEQ ID NO:8)
5' CAACAAAGGCTCCAGGAGATTGAACGC 3' Проба (SEQ ID NO:9)
Длина ампликона 86 п.н. (пар нуклеотидов)
Олигонуклеотиды для протромбина человека
5' TGGAGGACAAAACCGAAAGAGA 3' Прямой праймер (SEQ ID NO:10)
5' CATCCGAGCCCTCCACAA 3' Обратный праймер (SEQ ID NO:11)
5' CTCCTGGAATCCTACATCGACGGGC 3' Проба (SEQ ID NO:12)
Длина ампликона 69 п.н.
Праймеры были изготовлены Operon/Qiagen, а пробы заказывали в Applied Biosystems. Также использовали контрольные праймеры и пробу GAPDH (глицеральдегид-3-фосфатдегидрогеназы) грызунов (Applied Biosystems; ABI # 4308318 TaqMan® Rodent GAPDH Control Reagents Protocol), длина ампликона 177 п.н. Реакции ОТ-ПЦР в реальном режиме времени осуществляли на детекторе ABI Prism™ 7700 Sequence. Ожидаемую длину амплифицированных ПЦР-продуктов подтверждали на агарозных гелях. Для исследования эффективности ПЦР-реакций для всех трех генов осуществляли серии разведений. Уровни экспрессии γ-карбоксилазы и протромбина представлены относительно экспрессии контрольного гена, GAPDH грызунов.
день 4
день 5
день 6
день 4
день 5
Из детектированных относительных уровней экспрессии rhFII:GGCX вычисляли соотношения приблизительно 74-232:1 в зависимости от дня сбора пробы. Для клеточной линии, трансфицированной PN32, совместная экспрессия rhFII и GGCX, количество транскриптов на клетку составляло приблизительно 8 для мРНК GGCX и приблизительно 2000 для мРНК rhFII, таким образом, полученное соотношение rhFII:GGCX составляло приблизительно 250:1. Количество транскриптов контрольной мРНК GAPDH на клетку для той же самой пробы составляло приблизительно 4000.
Пример 4
Получение человеческого FII
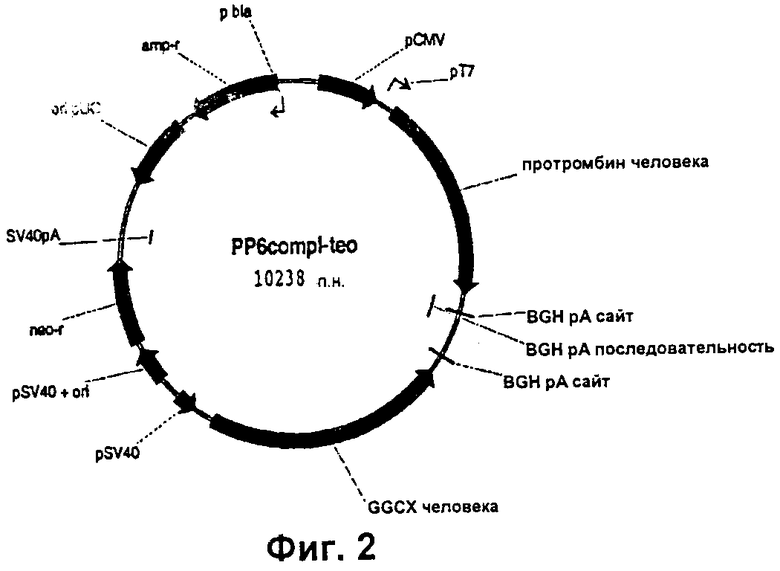
кДНК FII и GGCX человека, клонированную в примере 1, встраивали в pCDNA3.1 подобно тому, как описано в примере 1. Для получения более высоких уровней GGCX сигнал полиаденилирования из pZeoSV2+ включали в pSV40-GGСХ-рА-фрагмент, клонированный в DraIII-сайт с тупыми концами pCDNA3.1. Клон с GGCX-содержащим фрагментом в противоположной ориентации по сравнению с примером 1, подвергали селекции. Затем тем же самым способом, что и в примере 1, осуществляли клонирование FII-фрагмента. Конечная конструкция РР6 показана на Фиг.2, а нуклеотидная последовательность РР6 приведена в SEQ ID NO:13.
Две клеточные линии, продуцирующие протромбин, B2F4 и Н3В10, получали путем трансфекции CHO-S, как описано в примере 1. Протромбин из этих двух клеточных линий очищали и характеризовали его, как в примере 1. Полученная продуктивность культур B2F4 находилась в диапазоне от 30 до 70 мг/л, и доля полностью карбоксилированного белка составляла от 55 до 87% (чем больше rhFII, тем меньше доля полностью карбоксилированного белка). Добавление бутирата давало некоторое увеличение продуктивности, но уменьшало долю полностью карбоксилированного rhFII и не считалось выгодным. Н3В10 является медленно растущей, и ее продуктивность составляла приблизительно 50 мг/л, что являлось высоким относительно количества клеток в культуре, а доля полностью карбоксилированного rhFII составляла приблизительно 60%. По сравнению с клеточной линией, полученной в примере 1, при использовании конструкции РР6 для клеточной линии СНО получали меньше полностью карбоксилированного rhFII. Однако продукция полностью активного рекомбинантного протромбина является все же намного выше ранее опубликованных уровней.
Пример 5
ОТ-ПЦР-анализы в режиме реального времени экспрессии γ-каобоксилазы и протромбина в клеточных линиях CHO-S путем измерения количества мРНК
Клеточные линии B2F4 и Н3В10 из примера 4 исследовали путем ПЦР-анализов в режиме реального времени с помощью тех же самых способов и таких же праймеров, что и в примере 3. Пробы культур объемом 10 мл собирали при достижении ими максимальной продуктивности, чтобы они были эквивалентны пробам в примере 3. Для клона НЗВ10 пробы были 10-дневными вследствие медленного роста этого клона, а для клона B2F4 пробы были 6-дневными.
Вычисленное соотношение мРНК rhFII:мРНК GGCX составляло приблизительно 30: для клона Н3В10, приблизительно 50:1 для клона B2F4 и приблизительно 250:1 для клона Р1Е2.
Пример 6
Получение фактора свертывания крови IX (FIX) человека
кДНК фактора свертывания крови IX человека амплифицировали из пула кДНК генов печени человека, приобретенного у Invitrogen. Одигонуклеотидные праймеры представляли собой
F9f.ampl.: 5'-CACCATGCAGCGCGTGAACATGAT-3' (SEQ ID NO:16), для 5'-конца, и
F9r.ampl.: 5'-CCTTGGAAATCCATCTTTCATTA-3' (SEQ ID NO:17), для 3'-конца.
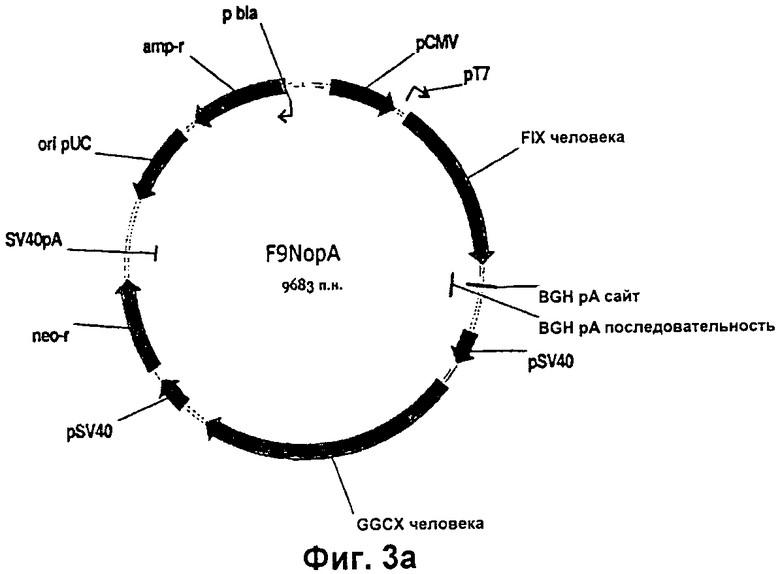
Клонирование правильной последовательности подтверждали путем секвенирования ДНК. FIX-фрагмент человека амплифицировали с помощью ПЦР, используя полимеразу Pfx (Invitrogen) и клонирующие праймеры, с получением фрагмента с тупыми концами. Данный фрагмент, имеющий тупые концы, фосфорилировали, используя Т4-полинуклеотидкиназу, и клонировали в EcoRV-расщепленные и дефосфорилированные векторы pCDNA-GGCX из примера 1 и примера 4. Таким путем были получены конструкции для совместной экспрессии FIX и GGCX человека, аналогичные конструкциям для совместной экспрессии, применяемым для получения протромбина человека (примеры 1 и 4). Клонирование правильных последовательностей подтверждали путем секвенирования ДНК и кратковременной экспрессии в клетках COS-7. Векторную конструкцию F9NopA можно видеть на Фиг.3а, а векторная конструкция F9hglx показана на Фиг.3б. Различие между векторами F9NopA и F9hglx заключается в направлении транскрипции гена GGCX. Последовательность нуклеотидов F9NopA приведена в SEQ ID NO:14, а последовательность нуклеотидов F9hglx приведена в SEQ ID NO:15.
Создание клеточных линий, продуцирующих rhFIX
rhFIX-конструкции трансфицировали в клетки CHO-S, используя методику, описанную в примере 1. Для каждой FIX-конструкции осуществляли скрининг приблизительно 3000 клонов для обнаружения экспрессии rhFIX с помощью ELISA (твердофазного иммуноферментного анализа) клеточных супернатантов. Использованные антитела получали от Haemathology Technology Inc. и DakoCytomation. Клоны селектировали и адаптировали к росту в среде СНО установленного химического состава, не содержащей белков. Клетки выращивали либо в Т-флаконах при температуре 37°С, либо во вращающихся колбах при 32-37°С. Концентрация СО2 для обоих типов культур составляла 5%. Продуцируемый rhFIX очищали до гомогенности с помощью анионообменной хроматографии на Q-сефарозе при рН 7,0. Активность рекомбинантного ППХ определяли путем анализа свертывания крови, используя дефицитную по FIX плазму крови (Precision Biologic). Лучшим полученным клоном, продуцирующим rhFIX, являлся N4D5, который был получен при использовании конструкции F9NopA и продуцировал до 4 мкг/мл активного rhFIX при выращивании в Т-флаконе в среде установленного химического состава, не содержащей белка. При выращивании во вращающейся колбе тот же самый клон продуцировал до 7,1 мкг/мл rhFIX. Общую продуктивность, включая также неполностью карбоксилированный неактивный rhFIX, оцененная с помощью вестерн-блоттинга, составляла по меньшей мере 30 мкг/мл. Лучшим продуцирующим клоном, полученным с rhFIX-конструкцией F9hglx, являлся P1G9, который продуцировал 0,7 (Т-флакон) - 1,3 (вращение) мкг/мл rhFIX при сходных условиях. Эти результаты указывают на то, что продуктивность rhFIX улучшалась в результате совместной экспрессии GGCX на низком уровне при использовании конструкции F9NopA, но при использовании конструкции F9hglx совместная экспрессия GGCX являлась менее полезной. Также было отмечено, что F9NорА-конструкция, давшая в результате клон N4D5, обычно давала более сильные ELISA-сигналы, чем F9hglx-конструкция, давшая начало клону P1G9, при одновременном скрининге на продуктивность во время процедуры создания клеточных линий.
Продуктивность клеточной линии N4D5 приблизительно в 4-6 раз лучше ранее опубликованных уровней при сравнимых условиях, где IC4, IG8, r-FIX ВНК и r-FIX 293 представляют собой названия клонов, упоминаемых в ссылках (Таблица 5).
Пример 7
ОТ-ПЦР-анализы в режиме реального времени экспрессии γ-карбоксилазы и фактора FIX в клеточных линиях CHO-S путем измерения количества мРНК
Рекомбинантные hFIX-продуцирующие клоны выращивали при 32-37°С во вращающихся колбах в 100 мл среды с химически установленным составом, не содержащей белка, с добавлением витамина К. При достижении максимальной концентрации rhFIX отбирали пробы объемом 5-10 мл и анализировали в них содержание транскриптов FIX и GGCX человека, а также транскриптов контрольного гена GAPDH (гена "домашнего хозяйства"). Методика была такой же, как в примере 3. Праймеры для rhFIX были следующими:
Праймеры для фактора IX человека
5' AATAGTGCTGATAACAAGGTGGTTTG 3' Прямой праймер (SEQ ID NO:18)
5' CACTGCTGGTTCACAGGACTTCT 3' Обратный праймер (SEQ ID NO:19)
5' TCCTGTACTGAGGGATATCGACTTGCAGAAAAC 3' Проба (SEQ ID NO:20)
Длина ампликона 84 п.н.
Было обнаружено, что уровни матричной РНК достигают максимума в различные дни в зависимости от температуры культивирования и объема инокулированной культуры. Было обнаружено, что максимальные уровни мРНК находятся в хорошем соответствии с максимальной концентрацией rhFIX в культуральной среде.
Из ОТ-ПЦР-анализов в режиме реального времени авторы обнаружили, что, хотя 2^-delta Ct-значения изменяются в зависимости от времени и условий культивирования, соотношения мРНК FIX:GGCX являлись приблизительно одинаковыми для каждого клона. Для лучшего rhFIX-продуцирующего клона N4D5 это соотношение составляло приблизительно 45:1. Анализы другого клона PIG9 дали более низкое соотношение, составляющее приблизительно 4,5:1. Клон PIG9 продуцировал только 20% от количества rhFIX, продуцируемого N4D5.


































Изобретение относится к области биотехнологии, конкретно к получению гамма-карбоксилированного белка, и может быть использовано в медицине. Витамин К-зависимый белок получают путем выделения после культивирования эукариотической клетки, содержащей экспрессирующий вектор, который содержит молекулу нуклеиновой кислоты, кодирующую витамин К-зависимый белок и ассоциированные последовательности, контролирующие экспрессию. Ассоциированные последовательности содержат первый промотор и молекулу нуклеиновой кислоты, кодирующую гамма-глутамилкарбоксилазу, и второй промотор. В качестве первого промотора используют предранний промотор цитомегаловируса человека (hCMV), а в качестве второго промотора - предранний промотор SV40. При этом соотношение экспрессии витамин К-зависимого белка и гамма-глутамилкарбоксилазы составляет от 10:1 до 250:1. Изобретение позволяет получить гамма-карбоксилированный витамин К-зависимый белок в промышленных масштабах. 4 н. и 25 з.п. ф-лы, 3 ил., 6 табл.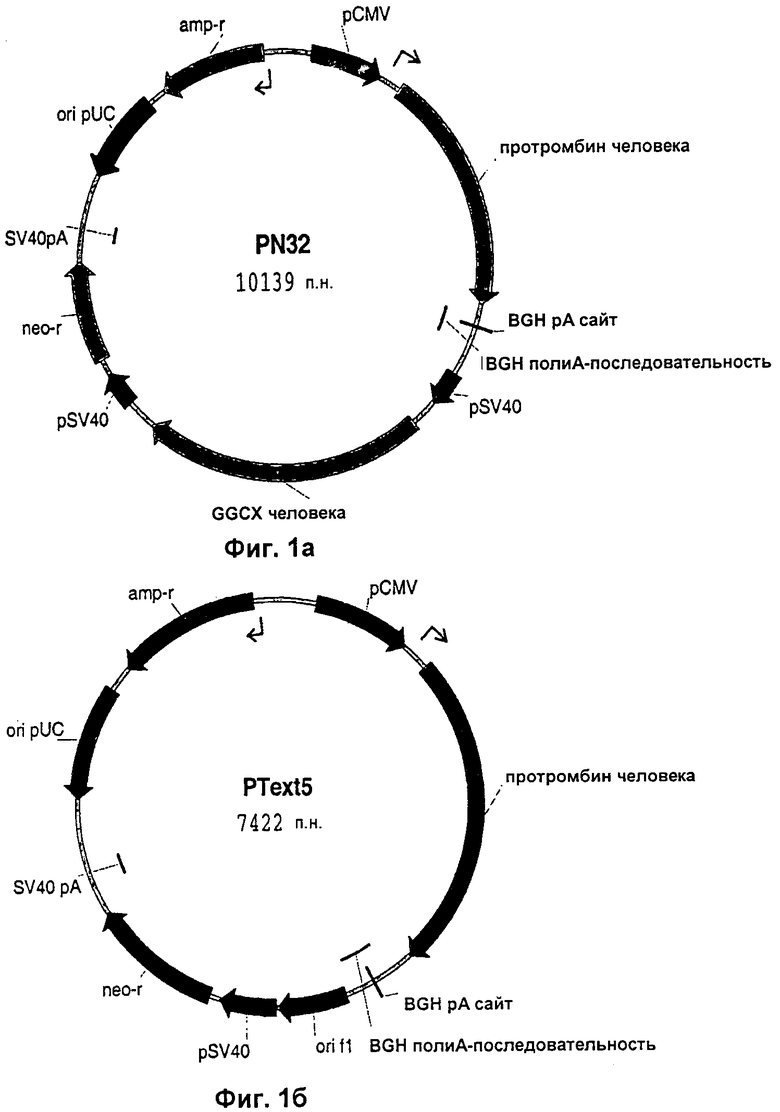
1. Эукариотическая клетка-хозяин для экспрессии витамин К-зависимого белка, содержащая по меньшей мере один экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую витамин К-зависимый белок, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор,
где первый промотор представляет собой предранний промотор цитомегаловируса человека (hCMV) и
второй промотор представляет собой предранний промотор SV40 и где соотношение экспрессии витамин К-зависимого белка и γ-глутамилкарбоксилазы составляет от 10:1 до 250:1.
2. Клетка-хозяин по п.1, где молекулы нуклеиновой кислоты находятся в одном экспрессирующем векторе.
3. Клетка по п.1, где витамин К-зависимый белок выбран из группы, состоящей из: фактора свертывания крови VII, фактора свертывания крови IX, протромбина (фактора свертывания крови II), фактора свертывания крови X, белка С, белка S, белка Z, костного Gla-белка, Gla-белка матрикса, белка 6, специфического в отношении остановки роста, и FXa-подобного белка из Acanthophiinae.
4. Клетка по п.1, где витамин К-зависимый белок представляет собой витамин К-зависимый фактор свертывания крови.
5. Клетка по п.1, где витамин К-зависимый белок представляет собой фактор IX.
6. Клетка по п.1, где витамин К-зависимый белок представляет собой фактор X.
7. Клетка по п.1, где витамин К-зависимый белок представляет собой протромбин.
8. Клетка по п.1, где витамин К-зависимый белок представляет собой белок С.
9. Клетка по п.1, где витамин К-зависимый белок представляет собой фактор VII.
10. Клетка по п.1, где витамин К-зависимый белок представляет собой белок человека.
11. Клетка по п.1, где γ-глутамилкарбоксилаза представляет собой белок человека.
12. Клетка по любому из пп.1-11, где данная клетка выбрана из группы, состоящей из клетки млекопитающих, дрожжевой клетки или клетки насекомых.
13. Клетка по п.12, где данная клетка представляет собой клетку млекопитающих.
14. Вектор экспрессии в эукариотических клетках, содержащий молекулу нуклеиновой кислоты, кодирующую витамин К-зависимый белок и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор,
где первый промотор представляет собой предранний промотор цитомегаловируса человека (hCMV) и
второй промотор представляет собой предранний промотор SV40 и
где соотношение экспресии витамин К-зависимого белка и γ-глутамилкарбоксилазы составляет от 10:1 до 250:1.
15. Вектор по п.14, где витамин К-зависимый белок выбран из группы, состоящей из: фактора свертывания крови VII, фактора свертывания крови IX, протромбина (фактора свертывания крови II), фактора свертывания крови X, белка С, белка S, белка Z, костного Gla-белка, Gla-белка матрикса, белка 6, специфического в отношении остановки роста, и FXa-подобного белка из Acanthophiinae.
16. Вектор по любому из пп.14 и 15, где витамин К-зависимый белок представляет собой фактор IX.
17. Вектор по любому из пп.14 и 15, где витамин К-зависимый белок представляет собой фактор X.
18. Вектор по любому из пп.14 и 15, где витамин К-зависимый белок представляет собой протромбин.
19. Вектор по любому из пп.14 и 15, где витамин К-зависимый белок представляет собой белок С.
20. Вектор по любому из пп.14 и 15, где витамин К-зависимый белок представляет собой фактор VII.
21. Способ получения витамин К-зависимого белка, включающий: (1) культивирование эукариотической клетки, содержащей по меньшей мере один экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую витамин К-зависимый белок и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор, где первый промотор представляет собой предранний промотор цитомегаловируса человека (hCMV) и
второй промотор представляет собой предранний промотор SV40 и
где соотношение экспресии витамин К-зависимого белка и γ-глутамилкарбоксилазы составляет от 10:1 до 250:1, и
(2) выделение гамма-карбоксилированного белка.
22. Способ по п.21, где гамма-карбоксилированный белок выбран из группы, состоящей из: фактора свертывания крови VII, фактора свертывания крови IX, протромбина (фактора свертывания крови II), фактора свертывания крови X, белка С, белка S, белка Z, костного Gla-белка, Gla-белка матрикса, белка 6, специфического в отношении остановки роста, и FXa-подобного белка из Acanthophiinae.
23. Способ по п.21, где витамин К-зависимый белок представляет собой витамин К-зависимый фактор свертывания крови или его активированную форму.
24. Способ по п.21 или 23, где витамин К-зависимый белок представляет собой фактор IX или его активированную форму.
25. Способ по п.21 или 23, где витамин К-зависимый белок представляет собой фактор Х или его активированную форму.
26. Способ по п.21 или 23, где витамин К-зависимый белок представляет собой протромбин или его активированную форму.
27. Способ по п.21 или 23, где витамин К-зависимый белок представляет собой белок С или его активированную форму.
28. Способ по п.21 или 23, где витамин К-зависимый белок представляет собой фактор VII или его активированную форму.
29. Способ получения фармацевтической композиции, пригодной для индукции свертывания крови или стимулирования повышения или понижения коагуляции, включающий очистку активного карбоксилированного белка, экспрессирующегося в эукариотической клетке-хозяине, содержащей по меньшей мере один экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую витамин К-зависимый белок и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор,
где первый промотор представляет собой предранний промотор цитомегаловируса человека (hCMV) и
второй промотор представляет собой предранний промотор SV40 и
где соотношение экспресии витамин К-зависимого белка и γ-глутамилкарбоксилазы составляет от 10:1 до 250:1, и
и смешивание очищенного карбоксилированного белка с одним или более фармацевтически приемлемыми носителями или эксципиентами.
| WO 0229045 A3, 11.04.2002 | |||
| HALLGREN K.W | |||
| et al | |||
| Carboxylase overexpression effects full carboxylation but poor release and secretion of factor IX: implications for the release of vitamin K-dependent proteins, Biochemistry, 2002, v.41, n.50, p.15045-15055 | |||
| LUCAS B.K | |||
| et al | |||
| High-level production of recombinant proteins in CHO cells using a |
Авторы
Даты
2009-11-10—Публикация
2004-10-12—Подача