Область применения
Изобретение относится к области биотехнологии, а именно к технологии получения биологически активных веществ (БАВ) методами генной инженерии, точнее к методам получения фактора свертываемости крови IX человека.
Актуальность
Фактор IX (FIX) - это элемент каскада свертывания крови, профермент сериновой протеазы, которая в присутствии Са2+ и мембранных фосфолипидов гидролизует связь аргинин-изолейцин в молекуле фактора Х с образованием активированного фактора Х (FXa). Каталитическая эффективность активированного фактора IX (FIXa) сильно возрастает при связывании кофактора активированного фактора свертывания крови VIII (FVIIIa). Нековалентный комплекс FIXa, FVIIIa и FX, связанных с фосфолипидной мембраной, называется «Х-аза» или «теназа» и представляет собой основной элемент петли положительной обратной связи в каскаде свертывания крови.
FIX синтезируется в печени в виде неактивного белка-предшественника, который процессируется в эндоплазматическом ретикулуме и аппарате Гольджи, где подвергается множественным посттрансляционным модификациям различных типов и секретируется в кровоток после протеолитического отщепления пропептида от N-конца молекулы. Циркулирующий зрелый FIX имеет молекулярную массу около 57 кДа и среднюю концентрацию в плазме крови около 90 нМ. В каскаде свертывания крови FIX активируется после протеолитического расщепления активированным фактором XI (внутренний путь) или активированным фактором VII (внешний путь) с образованием двух полипептидных цепей, связанных дисульфидной связью. Активированный FIX постепенно инактивируется, в основном путем медленного связывания с антитромбином III, нексином-2, белок Z зависимым ингибитором протеаз и рецепторами эндоцитоза гепатоцитов, а также подвергается расщеплению эластазой нейтрофилов.
FIX состоит из четырех структурных доменов - Gla-домена, двух ЭФР-подобных доменов (ЭФР - эпидермальный фактор роста) и С-концевого домена сериновой протеазы. N-концевой лидерный пептид FIX отделяется при транслокации полипептида в эндоплазматический ретикулум, пропептид, непосредственно предшествующий домену Gla, отделяется при секреции зрелого белка. Активационный пептид, расположенный между вторым ЭФР-подобным доменом и доменом сериновой протеазы, специфически отделяется факторами XIa или VIIa при активации FIX.
Gla-домен, расположенный N-конце молекулы зрелого FIX, обеспечивает связывание FIX и FIXa с поверхностью эндотелиальных клеток, причем такое взаимодействие полностью нарушается при блокировании γ-карбоксилирования остатков Asp в составе домена. Первый ЭФР-подобный домен FIX содержит высокоаффинный сайт связывания иона кальция, а также обуславливает взаимодействие FIX с фактором Villa и с тканевым фактором (фактором III). Второй ЭФР-подобный домен FIX принимает участие в образовании комплекса FIXa-FVIIIa-FX. Он соединяется с доменом сериновой протеазы при помощи активационного пептида и единственной дисульфидной связи. Активационный пептид FIX содержит большую часть сайтов посттрансляционных модификаций, влияющих на свойства FIX. Домен сериновой протеазы составляет около половины общей массы FIX, содержащийся в нем активный сайт скрыт активационным пептидом и экспонируется после его отделения. Из всех посттрансляционных модификаций только γ-карбоксилирование в домене Gla непосредственно определяет прокоагуляционную активность FIX. Влияние остальных модификаций на функции FIX выражено в меньшей степени, в ряде случаев оно отсутствует или остается неизвестным.
Врожденное отсутствие функционального фактора IX или его низкий уровень приводят к развитию гемофилии В, Х-связанному рецессивному генетическому заболеванию, требующему проведения постоянной заместительной терапии препаратами фактора IX. Гемофилия В проявляется у одного из 30 тысяч человек. Первоначально терапия гемофилии В ограничивалась периодическими переливаниями плазмы крови, впоследствии замененными на более эффективные концентраты протромбинового комплекса - смеси витамин К-зависимых факторов свертывания крови IX, II, VII и X. Основным ограничением такой терапии был существенный риск развития тромботических эпизодов. Лекарственные препараты FIX с большей степенью чистоты были получены из фракций плазмы крови, разделяемой методом Кона, при помощи дополнительной очистки ионообменной хроматографией. Безопасность плазменных концентратов FIX также лимитируется существенным уровнем примеси активированного FIX (FIXa) и остаточных количеств других факторов свертывания, достаточных для увеличения риска возникновения тромботических эпизодов. Дополнительная очистка FIX при помощи иммуноаффинной хроматографии позволяет полностью удалить эти примеси, однако, как и в случае других продуктов переработки плазмы крови, риск вирусного или: прионного инфицирования больных не может быть полностью устранен.
В настоящий момент зарегистрирован один лекарственный препарат рекомбинантного FIX - нонаког альфа (торговое название Бенефикс), одобренный для применения в США и странах ЕС в 1997 г. Нонаког альфа получают в клетках СНО, культивируемых в питательной среде, не содержащей сыворотки или других продуктов животного происхождения. Выделение и очистку рекомбинантного FIX проводят при помощи четырех хроматографических стадий, не используя иммуноаффинную хроматографию, потенциально присутствующие вирусы удаляют при помощи нанофильтрации на фильтре с порогом отсечения 70 кДа. В готовой лекарственной форме нонакога альфа не используется альбумин человека. Таким образом, в процессе получения лекарственного препарата исключено использование веществ животного происхождения и компонентов донорской плазмы.
Предшествующий уровень техники
В исходных работах, описывающих экспрессию FIX в клетках СНО, обнаружено, что секретируемый FIX содержит значительную долю неактивных молекул с непроцессированным пропептидом. Полное или почти полное отщепление пропептида достигается только при коэкспрессии субтилизин/кексин-подобной конвертазы PACE/furin или гомологичной ей конвертазы РС5. Прокоагулянтная активность FIX зависит от уровня γ-карбоксилирования домена Gla - в полностью активном FIX первые 10 остатков Glu должны быть конвертированы в остатки Gla, при этом уровень конверсии двух последних остатков Glu не влияет на свойства FIX. В молекуле природного FIX все 12 остатков Glu в домене Gla полностью γ-карбоксилированы, в то время как в рекомбинантном FIX, получаемом в клетках СНО, уровень модификации двух последних остатков Glu несколько снижен. Общее число остатков Gla в рекомбинантном FIX из клеток СНО достигает 11,5 на одну молекулу белка. Удельная Прокоагулянтная активность такого FIX составляет не менее 200 МЕ/мг и не отличается от удельной активности природного FIX.
Основной методический подход к созданию эукариотических продуцентов рекомбинантного фактора IX человека в клетках млекопитающих описан в патенте США 4,770,999. Продуценты рекомбинантного фактора IX на основе клеток СНО были получены при помощи экспрессионного вектора р91023-IX, содержащего энхансер вируса SV40, область открытой рамки считывания фактора IX под контролем промоторного участка поздних генов аденовируса AdMLP, гены аденовируса VA и область ОРС дигидрофолатредуктазы мыши. При препаративной трансфекции плазмида р91023-1Х было ко-трансфицирована вместе с вспомогательной плазмидой pAd26SVpA3, кодирующей ген дигидрофолатредуктазы под контролем промотора MLP и ориджин репликации SV40. Популяцию стабильно трансфицированных клеток культивировали в присутствии возрастающих концентраций метотрексата (до 20 мкМ), при этом концентрация секретируемого фактора IX, измеренная при помощи ИФА, увеличилась от 0,015 мг/л до 43,4 мг/л. При добавлении в ростовую среду витамина К1 до 10 мкг/мл и последующем культивировании в ней клеток наиболее продуктивной популяции скорость секреции активного фактора IX составила 0,268 МЕ/мл/день, таким образом, удельная активность секретируемого фактора IX составила около 9% от нормальной.
Основной причиной недостаточности удельной активности рекомбинантного фактора IX, секретируемого клетками СНО, являлся низкий уровень процессинга пропептида протеазами семейства PACE/furin в аппарате Гольджи клеток СНО. При ко-экспрессии РАСЕ человека клетками-продуцентами фактора IX наблюдалось увеличение активности секретируемого фактора IX с 0,17 до 0,33 МЕ/мл (концентрация всех форм фактора IX - 30 мг/л, удельная активность 11 МЕ/мг), при этом по данным иммунопреципитации молекулы фактора IX с неотщепленным пропептидом практически не обнаруживались (Wasley L.C., Rehemtulla A., Bristol J.A., Kaufman R.J. // J. Biol. Chem. 1993. V.268. №12. P.8458-8465.). Аналогичные данные были получены для растворимого укороченного варианта РАСЕ человека (РАСЕ) с удаленным трансмембранным доменом.
Молекулы рекомбинантного фактора IX с неудаленным пропептидом могут быть специфически отделены от молекул зрелого белка при помощи анионообменной хроматографии, как описано в Европейской патентной заявке ЕР 0705901 А2, однако степень разделения этих двух форм фактора IX не превышает 10.
Другие известные клональные линии-продуценты рекомбинантного фактора IX следующие:
1. Описанный в Европейском патенте ЕР 0430930 В1 клон С6, полученный путем трансфекции линии клеток почки собаки MDCK плазмидой pIJ5/9, включающей область ОРС кДНК фактора IX человека под контролем промотора SV40 и маркер устойчивости к действию неомицина. Клон С6 обладает максимальной продуктивностью 0,375 мг/л фактора IX на 8 днях культивирования (данные ИФА, удельная активность после очистки 91% от нормальной, предположительный уровень секреции активного фактора IX 0,094 МЕ/мл).
2. Описанный в Европейской патентной заявке ЕР 2164971 А2 клон GFSC- 15, полученный путем ко-трансфекции клеток линии СНО DG-44 плазмидой pMSG-FIXI, содержащей область ОРС и укороченный первый интрон из кДНК фактора IX человека под контролем промотора SV40 и области ассоциации с ядерным матриксом (MAR) из гена бета-глобина человека, а также плазмидой, кодирующей дигидрофолатредуктазу мыши, с последующей трансфекцией полученной линии-продуцента аналогичными по структуре плазмидами, кодирующими вспомогательные гены фурина человека и гамма-карбоксилазы человека. Удельная продуктивность лучшей клональнальной линии-продуцента GFSC-15 составила 4,4 мкг/млн клеток/день (данные ИФА), максимальная активность секретированного фактора IX в культуральной среде - около 2,3 МЕ/мл на 10 днях культивирования с дополнительным внесением питательных веществ на 5-й день.
3. Поликлональная популяция Hek293/FIXD359VLXIN, описанная в патентной заявке РСТ WO 2011011841 А1 и полученная инфицированием клеток линии почки человека НЕК 293 дефектными по репликации ретровирусными частицами, полученными при помощи вектора pLXIN. Описанный максимальный уровень секреции мутеина фактора IX - 11,8 МЕ/мл. Мутация фактора IX B359V приводит к многократному увеличению уровня секреции фактора IX клетками, однако применение мутеина в качестве лекарственного средства для терапии гемофилии В представляется затруднительным из-за риска увеличения числа больных, вырабатывающих нейтрализующие антитела.
4. Моноклональная линия Huh7-CD4, описанная в Европейской патентной заявке ЕР 2496252 А1 и полученная трансфекцией линии иммортализованных гепатоцитов человека Huh7 плазмидой pcDNAFIXwt, кодирующей ОРС фактора IX человека под контролем немедленного раннего промотора цитомегаловируса (CMV), селективный маркер - ген устойчивости к неомицину. При культивации линии-продуцента в бессывороточной среде в роллерных бутылях достигнута удельная продуктивность около 0,8 мкг/2 млн клеток/день, удельная активность секретируемого продукта превышала удельную активность стандарта фактора IX приблизительно в полтора раза.
5. Клон #6, описанный в патенте США US 7375084 В2, полученный трансфекцией линии НЕК 293 плазмидой pCMV-FIX-neo, кодирующей фактор IX под контролем промотора CMV и содержащей ген устойчивости к неомицину, с последующей трансфекцией вспомогательной плазмиды pCMV-VKORC I - EDHpro, кодирующей ОРС кофактора 1 витамин-К-оксиредуктазы человека. Удельная продуктивность клона #6 составила 3,3 МЕ/млн клеток/день (26 мкг/млн клеток/день по данным ИФА). Несмотря на относительно высокий уровень секреции, полученный для линий-продуцентов на основе клеток человека НЕК 293, применимость данной системы экспрессии для получения лекарственных средств рекомбинантного фактора IX ограничена, поскольку культивируемые клетки человека с большей вероятностью могут содержать опасные для человека вирусы и онкогены человека, остаточные количества которых могут контаминировать целевой продукт.
Наиболее близкий по технической реализации аналог настоящего изобретения -это описанный в Европейской патентной заявке ЕР 1969127 А2 клон 130-17 и его аналоги, полученные путем последовательной трансфекции клеток линии СНО плазмидой, кодирующей ОРС фактора IX человека под контролем промотора гена фактора элонгации 1 альфа китайского хомячка (промотор CHEF-I или EEF1A), селекции популяции стабильно трансфицированных клеток, последующей трансфекции плазмид, кодирующих вспомогательные гены витамин-К зависимой гамма-карбоксилазы (VKGC) и витамин-К эпоксиредуктазы (VKOR или VKORC1), отбора наиболее продуктивных клонов стабильно трансфицированных клеток, повторной трансфекции плазмидой, кодирующей VKOR и окончательного отбора клонов продуцентов. При культивировании полученного таким образом клона 130-17 в перемешиваемых колбах без смены среды в течение 18 дней конечная активность секретированного фактора IX составила 7,75 МЕ/мл (31 мг/л "активного фактора IX", доля активного фактора IX - 64%).
Описанная в патентной заявке ЕР 1969127 А2 система экспрессии фактора IX человека в клетках СНО позволяет получать целевой белок в достаточно больших количествах при очень длинном периоде культивирования - 18 дней, однако целевой продукт может быть загрязнен существенными количествами фактора IX с непроцессированным пропептидом вследствие того, что при получении клона 130-17 и родственных клонов не была проведена трансфекция клеток геном сигнальной протеазы PACE/furin человека. Данные о конкретном уровне процессинга пропептида в секретированном факторе IX в патентной заявке ЕР 1969127 А2 не приведены.
Краткое описание настоящего изобретения
Технической задачей, решаемой авторами, являлось создание высокопродуктивной технологии получения рекомбинантного фактора свертываемости крови IX человека для биофармацевтического производства.
Технический результат достигался путем создания новой экспрессионной плазмидной ДНК p1.1-F9, кодирующей открытую рамку считывания белка фактора свертываемости крови IX человека и создания на ее основе клональной клеточной линии-продуцента.
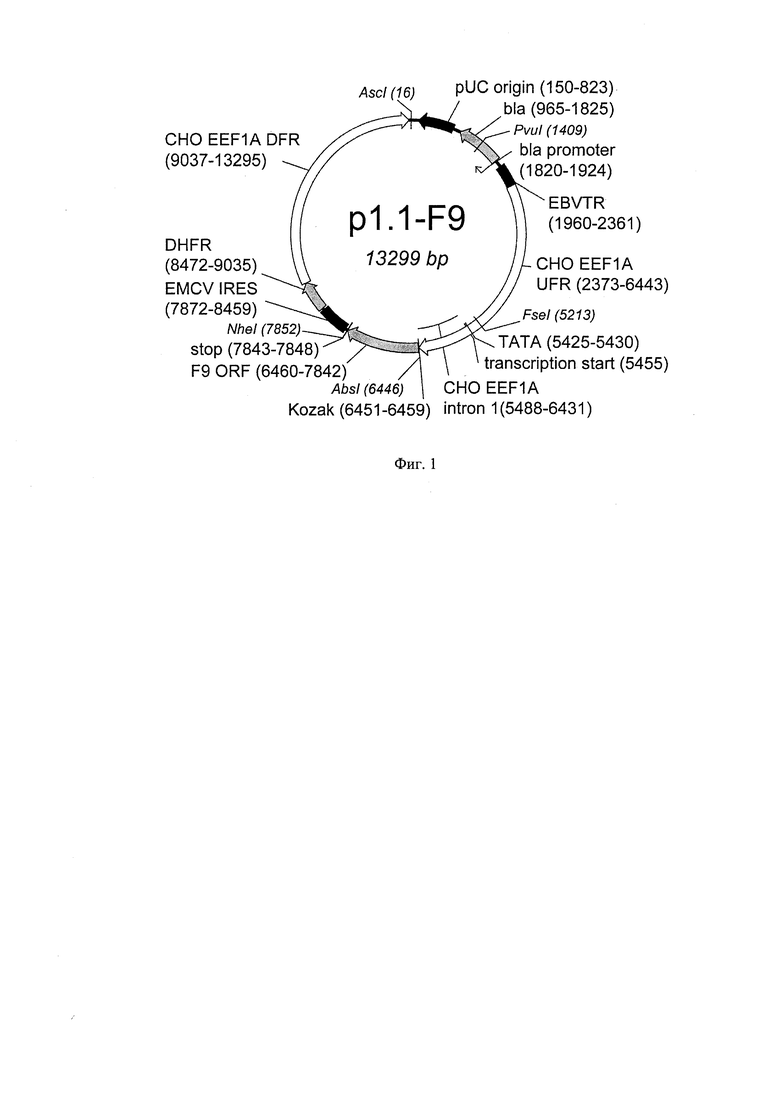
В основе данной технологии лежит разработанная плазмидная ДНК p1.1-F9 длиной 13299 п.о. (SEQ ID NO:1, Фиг.1), состоящая из:
- фрагмента ДНК, длиной 1406 п.о., содержащего синтетическую последовательность Козак (сайт связывания рибосом, SEQ ID NO:1 6451 - 6459), обеспечивающую инициацию трансляции мРНК, последовательность 1383 п.о. (SEQ ID NO:1 6460-842), кодирующую ОРС фактора свертываемости крови IX человека и блок стоп-кодонов (SEQ ID NO:1 7843-7848)
- фрагмента 11893 п.о. плазмиды p1.1 (SEQ ID NO:1 7852-6445), содержащего регуляторные элементы, обеспечивающие экспрессию целевого белка:
- 5′ и 3′ нетранслируемые области (НТО) гена фактора элонгации 1 альфа китайского хомячка включающие соответственно функциональный промотор (5′ НТО) и терминатор и сигнал полиаденилирования (3′НТО) этого гена, а также фланкирующие нетранскрибируемые области этого гена, обеспечиваюющие эухроматинизацию сайтов инсерции и транскрипционную активность генетической кассеты в геноме СНО;
- последовательность фактора устойчивости трансфецированных клеток к воздействию метотрексата - дигидрофолатредуктазы (DHFR) и регуляторные элементы для экспрессии DHFR - последовательность IRES вируса энцефаломиокардита. (EMCV), обеспечивающая бицистронную экспрессию в животных клетках и сигнал полиаденилирования.
- область начала репликации плазмиды pUC, открытую рамку считывания бета-лактамазы (bla) и прокариотический промотер гена bla, обеспечивающей устойчивость бактерий к антибиотику ампициллину, позволяющие проводить препаративную наработку плазмиды в Е. coli.
Плазмида p1.1-F9 содержит уникальные сайты узнавания эндонуклеазами рестрикции AscI (16), PvuI (1409), FseI (5213), AbsI (6446), NheI (7852).
Плазмида была введена в клетки СНО DG-44 методом липосомальной трансфекции (Straus S.E. et al, J. Virol., 1981, Jul; 39(1):290-4). При помощи культивирования в безбелковой среде, не содержащей гипоксантин и тимидин, и дополнительно содержащей 200 нМ ингибитора DHFR метотрексата (МТХ) были получены олигоклональные линии стабильно трансфицированных клеток. Для отобранной олигоклональной линии с высокой продуктивностью была проведена амплификация кассеты в геноме путем последовательных культивировании в присутствии возрастающих концентраций метотрексата. Была получена поликлональная линия клеток, устойчивых к высокой концентрации метотрексата и продуцирующая увеличенные количества целевого белка, и использована для клонирования методом предельного разведения. Полученные клоны клеток-продуцентов были проанализированы методами иммуноферментного анализа и коагулометрии и были отобраны клоны, дающие максимальный уровень экспрессии целевого белка. Амплификация векторной вставки была произведена при действии метотрексата в максимальной концентрации 4 мкМ. В выбранный клон методом электротрансфекции (Straus S.E. et al, J. Virol., 1981, Jul; 39(1):290-4) были последовательно введены дополнительные плазмиды p1.2-Zeo-CHO-VKORC1 и р1.2-Hygro-FurVQ, кодирующие гены укороченного растворимого варианта сигнальной протеазы PACE/furin человека и витамин-К эпоксиредуктазы (VKOR или VKORC1) китайского хомячка, соответственно, и обеспечивающие высокий уровень посттрансляционного процессинга молекул синтезируемого клетками фактора IX до биологически активной формы. Трансфицированные плазмидой p1.2-Zeo-CHO-VKORC1 клетки культивировали в присутствии 1 мг/мл зеоцина до восстановления жизнеспособности клеток более 85%. Клетки данной популяции трансфицировали плазмидой p1.2-Hygro-FurVQ и культивировали в присутствии 750 мкг/мл гигромицина до восстановления жизнеспособности клеток более 90%. Была получена популяция клеток, секретирующих более 1,5 МЕ/млн клеток/день активного фактора IX с долей молекул фактора IX с непроцессированным пропептидом менее 75%. Клетки данной популяции подвергли клонированию методом предельных разведении. Полученные клоны клеток-продуцентов были проанализированы методами иммуноферментного анализа и коагулометрии. Были отобраны клоны, дающие максимальный уровень секреции биологически активного фактора IX.
Среди них был выбран клон P1.1-F9/3B12-86, при культивировании которого в суспензионной культуре в бессывороточной среде в отсутствии селекционных агентов (метотрексата и антибиотиков) конечная активность фактора IX составляла 3,5 МЕ/мл (удельная активность 190 МЕ/мг) при концентрации клеток 1,25 млн клеток/мл, время культивации 3 дня. Полученная клеточная линия P1.1-F9/3B 12-86 депонирована в Специализированную Коллекцию Культур Клеток позвоночных Института Цитологии РАН, Российской Коллекции Клеточных культур 05.02.2013 под номером РККК (П) 755Д.
Целью настоящего изобретения является предоставление плазмиды для экспрессии рекомбинантного фактора свертываемости крови IX человека, в частности плазмиды p1.1-F9. Также целью настоящего изобретения является предоставление моноклональной линии клеток млекопитающего, в частности клеток яичника китайского хомячка, P1.1-F9/3B 12-86 - продуцентов рекомбинантного фактора свертываемости крови IX человека, содержащей в геноме множественные копии экспрессионной кассеты, соответствующей линеаризованной экспрессионной плазмиде, в частности плазмиды p1.1-F9. Иллюстративным примером указанной моноклональной линии клеток являются клетки яичника китайского хомячка клона P1.1-F9/3B 12-86.
Также целью настоящего изобретения является предоставление способа получения рекомбинантного фактора свертываемости крови IX человека с использованием указанных клеток.
Подробное описание настоящего изобретения
Для реализации настоящего изобретения главной технической задачей явилось создание технологии высокопродуктивного получения рекомбинантного фактора свертываемости крови IX для биофармацевтического производства с использованием культивируемых клеток яичника китайского хомячка, адаптированных к суспезионному культивированию в безбелковой среде, содержащих в геноме множественные копии генетической кассеты, представляющей собой линеаризованную экспрессионную плазмиду, содержащую фрагмент ДНК, кодирующий фактор свертываемости крови IX под контролем промотора и регуляторных элементов, функционирующих в эукариотической клетке.
Термин «экспрессионная плазмида» («экспрессионная плазмидная ДНК») означает плазмидную ДНК, содержащую все необходимые генетические элементы для экспрессии внедренного в него гена, например, такие как промотор, терминатор, сигнал полиаденилирования. Конкретным примером генетических элементов, необходимых для экспрессии рекомбинантного фактора свертываемости крови IX в составе экспрессионной кассеты согласно настоящему изобретению, является, но не ограничивается им, промотор гена фактора элонгации 1 альфа китайского хомячка.
Фрагментом ДНК, кодирующим рекомбинантный фактор свертываемости крови IX согласно настоящему изобретению, является ген, кодирующий ОРС полипептида фактора IX, который может быть получен, например, как указано в Примере 1. Также указанный фрагмент ДНК может быть получен, например, с использованием технологии клонирования фирмы Sloning BioTechnology, описанной в заявке РСТ WO 2005071077.
Последовательность гена, кодирующего ОРС рекомбинантного фактора свертываемости крови IX человека согласно настоящему изобретению, представлена в Перечне последовательностей под номером SEQ ID NO:1 (нуклеотиды 6460-7842).
Аминокислотная последовательность секретируемого фактора свертываемости крови IX человека согласно настоящему изобретению представлена в Перечне последовательностей под номером SEQ ID NO:2, и представляет собой продукт трансляции нуклеотидов 6460 - 7842 последовательности ОРС SEQ ID NO:1 без 18 первых аминокислот секреционного лидерного пептида и пропептида.
Чтобы обеспечить эффективную трансляцию гена в клетках китайского хомячка, предпочтительно, чтобы ОРС предварялась последовательностью для кэп-зависимой инициации трансляции (последовательность Козак), например, синтетической.
Фрагменты ДНК, которые кодируют по существу тот же белок, могут быть получены, например, путем модификации нуклеотидной последовательности фрагмента ДНК (SEQ ID NO:1 нуклеотиды 6460 - 7842), например, посредством метода сайт-направленного мутагенеза, так, что один или несколько аминокислотных остатков в определенном сайте будут делегированы, заменены, вставлены или добавлены. Фрагменты ДНК, модифицированные, как описано выше, могут быть получены с помощью традиционных методов обработки с целью получения мутации. Фрагменты ДНК, которые кодируют по существу такой же функциональный белок, могут быть выявлены путем экспрессии фрагментов ДНК, имеющих мутацию, описанную выше, в соответствующей клетке и установления активности экспрессируемого продукта.
Фактор IX свертывания крови (FIX) - это профермент сериновой протеазы, которая в присутствии Са2+ и мембранных фосфолипидов гидролизует связь аргинин-изолейцин в молекуле фактора Х с образованием активированного фактора Х (FXa).
Природный фактор свертываемости крови IX человека в кровотоке преимущественно представляет собой гликопротеин с молекулярной массой около 57 кДа. Рекомбинантный фактор свертываемости крови IX полностью сохраняет прокоагулянтную (биологическую) активность, при этом его удельная прокоагулянтная активность, выраженная в международных единицах на один миллиграмм чистого белка составляет 200-250 МЕ/мг.
Показатели функциональной активности, при которой считается, что полученный белок обладает свойствами рекомбинантного фактора свертываемости крови IX человека, определяются по его способности уменьшать время свертывания (коагуляции) плазмы крови человека с удаленным фактором IX в тесте активированного частичного тромбопластинового времени (АЧТВ). Так, например, активность рекомбинантного фактора свертываемости крови IX человека можно детектировать по уменьшению времени образования сгустка в плазмы крови с удаленным фактором IX после смешивания исследуемого раствора фактора IX, плазмы крови с удаленным фактором IX, контактного активатора свертывания эллаговой кислоты, кислых фосфолипидных мицелл и раствора хлорида кальция. Определяют время свертывания плазмы, смешанной с несколькими разведениями исследуемого раствора и сопоставляют измеренные времена образования сгустка с временами образования сгустка, полученными для нескольких разведении стандарта активности фактора IX - нормальной плазмы крови или раствора изолированного фактора IX. Концентрацию фактора IX человека определяют при помощи иммуноферментного анализа в сравнении со стандартом - плазмой крови или раствором очищенного фактора IX с известным содержанием. Удельную активность фактора IX определяют как отношение прокоагулянтной активности и концентрации фактора IX и выражают в МЕ/мг. Считается, что вариант белка обладает свойствами рекомбинантного фактора IX свертываемости крови человека при условии, что удельная активность указанного варианта составляет не ниже 10% от удельной активности природного фактора IX человека, то есть не менее 20 МЕ/мг.
Экспрессионная плазмида согласно настоящему изобретению содержит фрагмент ДНК, кодирующий фактор свертываемости крови IX под контролем промотора и регуляторных элементов, функционирующих в эукариотической клетке. В качестве рекомбинантной плазмиды согласно настоящему изобретению могут использоваться различные плазмиды, обладающие способностью к экспрессии в клетке-реципиенте, такие как плазмиды pcDNA3.1, pCMV-Myc, pDEF38 и подобные им, но список плазмид не ограничивается ими.
Конкретным вариантом реализации настоящего изобретения является плазмида p1.1-F9 длиной 13299 п.о. (SEQ ID NO 1), которая содержит следующие функциональные элементы, перечисленные в порядке их расположения:
1. область начала репликации плазмиды pUC (150-283), открытую рамку считывания бета-лактамазы (Ыа) и прокариотический промотер гена bla (965 - 1924) -позволяющие проводить препаративную наработку плазмиды в Е.coli.
2. фрагмент конкатемера терминальных повторов вируса Эпштейна-Барр (1960-2361) - обеспечивающей увеличение частоты интеграции генетической кассеты в геном клеток СНО и увеличение скорости амплификации кассеты в геноме.
3. фрагмент последовательности, фланкирующей ген фактора элонгации 1 альфа китайского хомячка «выше по течению» (2373-6443), включающий нетранскрибируемые области этого гена, промотор этого гена, первый интрон этого гена, обеспечивающий конститутивную экспрессию гена фактора IX человека в геноме клеток СНО;
4. синтетическую последовательность Козак (сайт связывания рибосом) (6451-6459), обеспечивающую кэп-зависмую инициацию трансляции мРНК в животных клетках;
5. последовательность, кодирующую открытую рамку считывания фактора свертываемости крови IX человека (6460-7842) и блок стоп-кодонов (7843-7848)
6. последовательность внутреннего сайта связывания рибосом вируса энцефаломиокардита EMCV (7872-8459), обеспечивающая кэп-независимую инициацию трансляции второго цистрона бицистронной РНК в животных клетках;
7. последовательность, кодирующую открытую рамку считывания дигидрофолатредуктазы (8472-9035) - фактора устойчивости трансфецированных клеток к воздействию метотрексата;
8. фрагмент последовательности, фланкирующей ген фактора элонгации 1 альфа китайского хомячка «ниже по течению» (9037 - 13295), включающий терминатор и сигнал полиаденилирования, а также нетранскрибируемые области этого гена, обеспечивающий конститутивную экспрессию гена фактора IX человека в геноме клеток СНО.
Плазмида p1.1-F9 содержит уникальные сайты узнавания эндонуклеазами рестрикции Asci (16), Pvul (1409), Fsel (5213), Absl (6446), Nhel (7852). Структура плазмиды p1.1-F9 приведена на Фигуре 1.
Плазмида p1.1-F9 сконструирована на базе экспрессионной плазмиды p1.1, разработанной авторами настоящего изобретения ранее и подробно описанной в патентной заявке РФ 2011146243, целиком включенной в настоящее описание посредством ссылки. Плазмида p1.1 содержит функциональные промотор и терминатор гена фактора элонгации 1 альфа китайского хомячка, обеспечивающие конститутивную экспрессию целевого гена в клетках СНО, фланкированные 5′ и 3′ НТО этого гена, обеспечивающими эухроматинизацию сайтов интеграции экспрессионной кассеты в геном СНО; участок для клонирования открытых рамок считывания целевых белков; внутренний сайт связывания рибосом вируса энцефаломиокардита (EMCV IRES), обеспечивающий реинициацию трансляции на бицистронной мРНК в клетках млекопитающих и полное генетическое сцепление уровней продукции целевого белка и DHFR; ОРС DHFR мыши, экспрессирующуюся в составе бицистронной мРНК вместе с целевым геном (IRES DHFR) и обеспечивающую устойчивость стабильно трансфицированных клеток к отсутствию в среде тимидина и дозозависимую устойчивость к воздействию метотрексата (МТХ), что позволяет вести направленную селекцию высокопродуктивных клонов с множественными копиями экспрессионной кассеты в геноме СНО; участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), обеспечивающий повышенный уровень интеграции кассет в геном клеток СНО и ускорение процесса амплификации амплификации целевого гена в геноме под действием МТХ. Использование плазмиды p1.1 позволяет осуществлять высокочастотную интеграцию и ускоренную амплификацию экспрессионной кассеты в клетках млекопитающих, а также получать линии-продуценты с высоким уровнем продукции целевого белка и высокой стабильностью.
При помощи созданной плазмиды согласно настоящему изобретению, в частности плазмиды p1.1-F9, можно трансформировать эукариотическую клетку, предпочтительно иммортализованную клетку китайского хомячка. Выбор конкретной линии клеток не является критическим, поскольку методология и приемы трансформации хорошо известны специалисту в данной области техники. После проведения одного или нескольких раундов селекции и клонирования популяции трансформированных клеток могут быть получены клональные линии-продуценты рекомбинантного фактора свертываемости крови IX человека. Методология и приемы селекции и клонирования клеток известны специалисту в данной области техники. И хотя в зависимости от вида клетки и условий культивирования и селекции трансформантов уровень экспрессии фактора свертываемости крови IX человека может варьироваться, факт транзиентной экспрессии целевого белка будет иметь место при условии успешной трансформации клетки - реципиента, факт стабильной экспрессии целевого белка будет иметь место при успешном проведении раунда селекции популяции клеток-трансформантов.
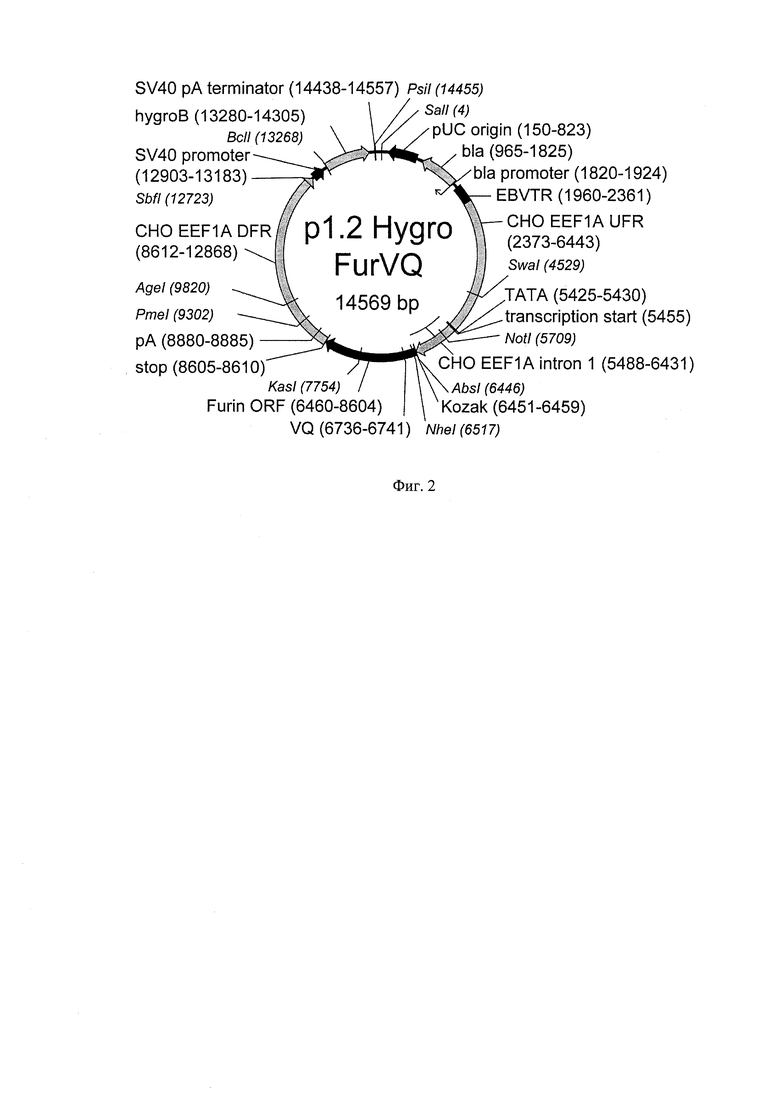
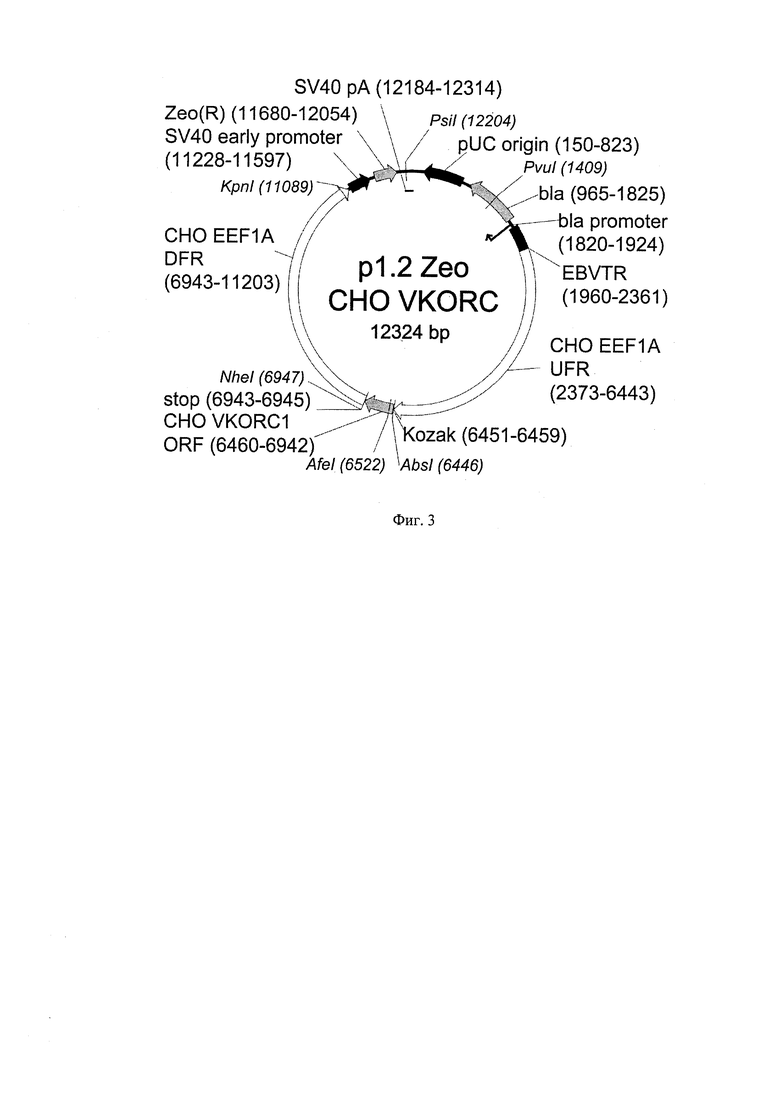
Прокоагуянтная активность рекомбинантного FIX зависит от степени гамма карбоксилирования его Gla-домена, и соответствует природной при карбоксилировании первых 10 из 12 остатков глутаминовой кислоты Gla-домена [McGraf D.M., Walsh G. Directory of therapeutic enzymes. NY 2005. 312pp.]. Удельная активность рекомбинантного FIX может быть увеличена при коэкспресии в линиях продуцентах фермента витамин-К-эпоксид-редуктазы (VKORC1), восстанавливающей витамин К (донор электронов для ферментативной гамма-карбоксилирования до его активной формы [Wajih N. Et al. Increased production of functional recombinant human clotting factor IX by baby hamster kidney cells engineered to overexpress VKORC1, the vitamin К 2,3-epoxide-reducing enzyme of the vitamin К cycle. Journal of Biological Chemistry 2005 280 (280), 31603-31607]. Иллюстративным вариантом плазмиды для интеграции в геном клеток дополнительных копий гена vkorcl является экспрессионная плазмида p1.2-Zeo-CHO-VK.ORC (SEQ ID NO:20, Фиг.3), содержащая ген vkorcl китайского хомячка, находящихся под контролем сильного конститутивного промотора.
Активность рекомбинантного FIX также зависит от наличия или отсутствия в его составе пропептида. Для повышения активности целевого белка предпочтительно проводить коэкспрессию рекомбинантного FIX и растворимого укороченного варианта протеазы РАСЕ/фурин. Иллюстративным вариантом плазмиды для экспрессии протеазы РАСЕ/фурин является плазмида p1.2-Hygro-FurVQ (SEQ ID NO:18, Фиг.2).
«Трансформация клетки плазмидой» означает введение плазмиды в клетку с помощью методов, хорошо известных специалисту в данной области техники. Методы трансформации включают любые стандартные методы, известные специалисту в данной области техники, например электропорацию, использование трансфекционных агентов, например метод, описанный в техническом документе компании Invitrogen, Inc. "Lipofectamine® 2000 Reagent" Pub. No.MAN0000995 Rev. Date 20 July 2012.
Согласно настоящему изобретению, «клеточная линия - продуцент фактора свертывания крови IX человека» означает клональную линию клеток млекопитающих, обладающую способностью к продукции и секреции фактора свертывания крови IX человека, когда она согласно настоящему изобретению выращивается в указанной питательной среде. Используемый здесь термин «клеточная линия - продуцент фактора свертывания крови IX человека» также означает линию клеток, которые способна секретировать функционально активный фактор свертывания крови IX человека с продуктивностью не менее 0,1 МЕ/млн клеток/день при культивировании в суспензионной культуре в бессывороточной среде. Указанный фактор свертывания крови IX человека секретируется указанными клетками в культивационную среду.
Среди клеток млекопитающих предпочтительно использование клеток китайского хомячка (Cricetulus griseus), предпочтительно клеток яичника (СНО). В качестве примера предпочтительных клеток яичника китайского хомячка может быть приведена линия СНО DG44 (Invitrogen cGMP banked, США; Mol Cell Biol 5, 1750-1759 Kaufman RJ et al. 1985). Круг сублиний СНО не ограничен каким-либо образом, например, могут быть использованы сублинии СНО CHOZN DHFR, СНО DUKX B11 и подобные им.
Конкретным примером линии для получения продуцента фактора свртывания крови IX человека согласно настоящему изобретению является линия СНО DG44, но спектр линий клеток не ограничиваются ей.
Линия СНО DG44 характеризуется следующими культурально-морфологическими, физиолого-биохимическими признаками и генетическими признаками:
- Данные по видовой принадлежности: китайский хомячок Cricetulus griseus, яичник.
- Контроль видовой идентичности: кариологический, изоферментный (ЛДГ и Г6ФДГ).
- Маркерные признаки и методы их оценки: иммунологические, цитогенетические, биохимические, физиологические:
- Морфология: эпителиоподобная.
- Кариология: 2n=22, пределы изменчивости по числу хромосом 10-28, модальное число хромосом 22, псевдодиплоид, имеются микрохромосомы, количество полиплоидов 9,0%.
- Биохимия: Дигидрофолатредуктазная активность по резистентности к метотрексату.
- Условия выращивания: среда - бессывороточная, определенного химического состава, CD Opti CHO (Invitrogen, США), температура -+37°С, концентрация СО2 - 8%, скорость перемешивания - 120-130 об/мин.
- Культуральные свойства: способ культивирования - суспензионный, посевная доза - 300 ООО на мл., кратность рассева - 1:2 - 1:6, процедура пересева -центрифугирование суспензии на скорости 1200 об/мин, 5 мин, ресуспендирование в новой ростовой среде. Оптимальная плотность 1,0-1,2×106 клеток/мл. Трансформация клеток линии CHO DG44 плазмидой p1.1-F9 с последующей селекцией и клонированием приводит к получению клеточных линий-продуцентов рекомбинантного фактора IX человека. Последующая трансформация полученных линий клеток плазмидами p1.2-Zeo-CHO-VKORC и p1.2-Hygro-FurVQ с последующей селекцией и клонированием приводит к получению клеточных линий - эффективных продуцентов высокоактивного рекомбинантного фактора IX человека. Примером клеточной линии -эффективного продуцента высокоактивного рекомбинантного фактора IX человека является линия-продуцент P1.1-F9/3B 12-86.
Линия-продуцент P1.1-F9/3B12-86 обеспечивает синтез и секрецию рекомбинантного фактора IX человека в количестве 3,5 ME конечной активности фактора свертываемости крови IX на 1 мл среды при концентрации клеток 1,25 млн клеток/мл при культивировании в суспензионной культуре в бессывороточной среде. Линия-продуцент P1.1-F9/3B12-86 депонирована в Российской Коллекции Культур Клеток позвоночных Института Цитологии РАН 05.02.2013, регистрационный номер РККК (П) 755Д.
Также целью настоящего изобретения является предоставление способа получения рекомбинантного фактора IX человека в клетках млекопитающих, включающего культивирование в питательной среде описанных выше клеток млекопитающих -продуцентов рекомбинантного фактора IX человека, и выделение полученного целевого рекомбинантного белка из культуральной жидкости.
Выращивание клеток, выделение и очистка целевого белка из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам культивирования, в которых рекомбинантный белок продуцируется с использованием клеток млекопитающих.
Питательная среда, используемая для культивирования, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста клеток. В качестве источника углерода могут использоваться различные углеводы, такие как глюкоза или сахароза и другие органические кислоты. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п.
Для получения фармацевтически значимого рекомбинантного фактора IX человека предпочтительно использование бессывороточной питательной среды для культивирования.
Выращивание может осуществляться в аэробных условиях, предпочтительно с повышенным содержанием СО2 (8%), таких как перемешивание культуральной жидкости в колбах, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. Обычно, выращивание в течение от 12 часов до 4 дней приводит к накоплению целевого рекомбинантного белка в культуральной среде или в цитоплазме клетки.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования, а затем целевой белок может быть выделен и очищен методами хроматографии и/или концентрирования.
Особенности созданной экспрессионной плазмиды, линии клеток и результаты практического применения изобретения приведены на фигурах 1-3.
Осуществление изобретения
Пример 1. Получение генетической конструкции p1.1-F9, кодирующей белок человеческого фактора свертываемости крови IX, для трансфекции линии клеток CHO-DG-44.
В качестве источника кДНК для клонирования гена fIX использовали коммерчески доступный клон pCMV6-XL4/NM_000133.2 (проприетарная коллекция компании Origene Inc, США, номер sc 126517, последовательность верифицирована к публичной коллекции IMAGE), содержащий полную последовательность полноразмерной кДНК фактора IX, совпадающую с теоретически определенной кДНК фактора IX по данным Human Genome Organization. При помощи праймеров AD-9-AbsF и AD-9-NheR (SEQ ID NO:3-4) и Origen sc 126517 в качестве матрицы получали ПЦР-продукт, содержащий открытую рамку считывания фактора IX свертываемости крови человека. Олигонуклеотиды были синтезированы ЗАО «Евроген», РФ. ПЦР проводили при помощи смеси Tersus polymerase mix (ЗАО «Евроген», РФ) по инструкции производителя на приборе РТС-100 Thermal Cycler (MJ Reseach, США).
ПЦР продукты очищали, используя набор реактивов "Wizard SV Gel and PCR Clean-Up System" («Promega», США) по инструкции производителя, и клонировали в вектор pAL-TA (Евроген) ДНК-лигазой фага Т4 (Fermentas, Литва) по методике производителя фермента. Полученной лигазной смесью трансформировали клетки Е. coli штамма ТОР10 (Invitrogen, США) с генотипом: F- mcrA Δ(mrr-hsdRMS-mcrBC)φ80lacZAΔM15 ΔlacX74 nupG recAl araD139 A(ara-leu)7697 galE15 galK16 rpsL(StrR) end A1. Для этого к 100 мкл замороженной суспензии клеток Е. coli добавляли 5 мкл лигазной смеси, инкубировали на льду 30 минут для сорбции плазмидной ДНК, нагревали до 42°С на 45 секунд и инкубировали на льду 2 минуты. После чего добавляли 800 мкл питательного бульона SOC (20 г/л триптона, 5 г/л дрожжевого экстракта, 0,5 г/л NaCl, 250 мМ KCl, 10 мМ MgC2) и инкубировали при 37°С 60 минут. После инкубации переносили суспензию на чашку Петри с твердой агаризованной средой 2xYT-arap (16 г/л триптона, 10 г/л дрожжевого экстракта, 10 г/л NaCl, 18 г/л агара), содержащей ампициллин в концентрации 100 мкг/мл и помещали в термостат на 18 часов при 37°С. Отдельные клоны трансформантов инокулировали в 5 мл питательного бульона LB с добавлением ампициллина в концентрации 50 мкг/мл, наращивали 18 часов при 37°С, и выделяли плазмидную ДНК набором реактивов "Wizard Plus SV Minipreps" («Promega», США) по протоколу производителя. Полностью секвенировали области вставки полученных плазмид, используя праймеры к последовательностям вектора T7prom и SP6 (SEQ ID NO:5-6), а также специфический праймер к последовательности гена фактора IX человека 9SQf (SEQ ID NO:7) с использованием набора BigDye Terminator v. 3.1 cycle sequencing kit (Applied Biosystems, США) и капиллярного секвенатора ABI PRISM 3730 genetic analyzer (Applied Biosystems, США), анализ данных вели при помощи программы Chromas 1.45 (Technelysium Pty Ltd, Australia).
После обнаружения клонов с корректной нуклеотидной последовательностью области вставки плазмиду PAL-F9 рестрицировали эндонуклеазами AbsI и NheI и переносили фрагмент, содержащий OPC F9 с участком консенсусной последовательности Козак и блоком стоп-кодонов в рестрицированный эндонуклеазами AbsI и NheI вектор p1.1 с образованием экспрессионной плазмиды p1.1-F9 (SEQ ID NO:1). Проводили лигирование, трансформацию и выделение плазмидной ДНК как описано выше.
Открытую рамку считывания FIX, а также области основных функциональных элементов экспрессионной конструкции секвенировали как описано выше. Для секвенирования области ОРС и функциональных элементов экспрессионной плазмиды использовали специфический прайме? к последовательности гена фактора IX человека 9SQf (SEQ ID NO:7), а также праймеры к последовательностям вектора SQ-5CH6-F, IRESArev (SEQ ID NO:8-9). Результаты сравнивали с теоретичсески предсказанными последовательностями гена фактора FIX свертываемости крови человека и соответствующих регуляторных элементов, нуклеотидных замен не было обнаружено.
Полученная экспрессионная конструкция фактора свертываемости крови IX человека в векторе p1.1-p1.1-F9 (Фиг.1) имеет размер 13299 п.о. и содержит уникальные сайты узнавания эндонуклеазами рестрикции AscI (16), PvuI (1409), FseI (5213), AbsI (6446), NheI (7852). Данная конструкция предназначена для трансфекции эукариотических клеток геном фактора свертываемости крови IX человека с последующим отбором и амплификацией по сцепленному признаку DHFR+ Сообщает клеткам-реципиентам следующие фенотипические признаки: при трансформации прокариот - устойчивость к ампицилину, карбенициллину; при трансфекции эукариот - ограниченная устойчивость к метотрексату, увеличивающаяся при селективном отборе, экспрессия рекомбинантного фактора FIX свертываемости крови человека. Созданную генетическую конструкцию использовали для получения линии-продуцента.
Пример 2. Получение экспрессионной генетической конструкции p1.2-Hygro-FurVQ, кодирующей протеазу PACE/furin человека для трансфекции линии клеток DG-1.1-F9.
При помощи праймеров AD-FUR-AbsF и AD-FUR-XbaR (SEQ ID NO:10-11) и Origene SC118550 в качестве матрицы получили ПЦР-продукт, содержащий открытую рамку считывания растворимого делеционного варианта протеазы PACE/furin человека с делецией двух аминокислот (VQ). Полимеразную цепную реакцию проводили как описано выше, продукт клонировали в вектор pAL-TA как описано выше, полученную в результате плазмиду pAL-Fur секвенировали с использованием праймеров T7prom и SP6 (SEQ ID NO:5-6), а также специфических праймеров SQ-FUR639-F, SQ-FUR1228-F, SQ-FUR1563-R (SEQ ID NO:12-14).
Для введения шести недостающих нуклеотидов в открытую рамку считывания PACE/furin в соответствие с NM_002569 был проведен сайт-направленный мутагенез плазмиды pAL-Fur методом инвертированной ПЦР с использованием праймеров IP-fVQ-F (SEQ ID NO:15) и IP-fVQ-R (SEQ ID NO:16). Сайт-направленный мутагенез методом инвертированной ПЦР проводили по [Michael P. Weiner, Tim Gackstetter, Gina L. Costa, John C. Bauer, and Keith A. Kretz. Site-directed Mutagenesis using PCR in Molecular Biology: Current Innovations and Future Trends. Eds. A.M. Griffin and H.G. Griffin. ISBN 1-898486-01-8 1995 Horizon Scientific Press, PO Box 1, Wymondham, Norfolk, U.K.] с модификациями. Каждый праймерный олигонуклеотид фосфорилировали отдельно. Реакцию проводили в буфере Трис-HCl, рН 7,5, содержащем 10 мМ MgCl2, 50 мМ дитиотреитола, 1 мМ АТФ и 100 пМ олигонуклеотида, 1 ед. полинуклеотидкиназы фага Т4 (Сибэнзим, Россия) в течение 30 минут при 37°С. После окончания реакции фермент инактивировали при 65°С 10 мин. Затем реакционную смесь использовали для проведения инвертированной ПЦР в количестве 20 пМ на реакцию. ПЦР проводили с использованием набора реактивов "Encyclo PCR kit" (ЗАО Евроген, Россия) по инструкции производителя. ПЦР проводили по следующей схеме: 1 цикл: 4 мин 94°С, 2 мин 50°С, 2 мин 72°С; затем 11 циклов 11 мин - 94°С, 1 мин - 55°С, 2 мин 72°С. После чего разводили вдвое однократным буфером эндонуклеазы DpnI, добавляли эндонуклеазу DpnI (10 U) и инкубировали при 37°С 30 минут, затем вносили полимеразу Pfu (2.5U) и переносили на 72°С и инкубировали еще 30 минут. Полученную смесь очищали, используя набор "Wizard SV Gel and PCR Clean-Up System" («Promega», США) по протоколу производителя. После чего проводили лигирование очищенного продукта инвертированной ПЦР с использованием ДНК-лигазы фага Т4 и стандартного буферного раствора (Fermentas, Литва) в течение 1 часа при комнатной температуре. Полученной лигазной смесью трансформировали клетки Е. coli штамма ТОРЮ (Invitrogen, США) как описано выше. Колонии Е. coli анализировали методом ПЦР с клонов, с использованием праймерных олигонуклеотидов T7prom и SP6 (SEQ ID NO:5-6) и специфического олигонуклеотида SQ-fVQ-R (SEQ ID NO:17) на мутант.
4 клона наращивали в 5 мл питательного бульона 2xYT-Amp и выделяли плазмидную ДНК при помощи набора GeneJET Plasmid Miniprep Kit (Fermentas, Литва) по протоколу производителя. Для полученных генетических конструкций определяли нуклеотидную последовательность методом ПЦР-секвенирования с использованием олигонуклеотидов T7prom и SP6 (SEQ ID NO:5-6), а также специфических праймеров SQ-FUR639-F, SQ-FUR1228-F, SQ-FUR1563-R (SEQ IDNO:12-14).
После обнаружения клонов с корректной нуклеотидной последовательностью области вставки плазмиду PAL-FurVQ рестрицировали эндонуклеазами AbsI и XbaI и переносили фрагмент, содержащий OPC PACE/furin с участком консенсусной последовательности Козак и блоком стоп-кодонов в рестрицированный эндонуклеазами AbsI и NheI вектор p1.2-Hygro с образованием экспрессионной плазмиды p1.2-Hygro-FurVQ (SEQ ID NO:18). Проводили лигирование, трансформацию и выделение плазмидной ДНК как описано выше. Для секвенирования использовали специфические праймеры SQ-FUR639-F, SQ-FUR1228-F, SQ-FUR1563-R (SEQ ID NO:12-14), а также праймеры к последовательностям вектора SQ-5CH6-F (SEQ ID NO:8), 3CH1-Rev (SEQ ID NO:19).
Пример 3. Препаративное выделение плазмидной ДНК для трансфекций и получение первичных поликлональных линий клеток CHO-DG44, стабильно трансфицированных плазмидой p1.1-F9.
Экспрессионная плазмида p1.1-F9, кодирующая фактор IX человека, была сконструирована по методике, приведенной в Примере 1, выращена в препаративных количествах в штамме Е. coli ТОРЮ (Invitrogen, Ltd., США), очищена при помощи набора EndoFree Plasmid MaxiKit, (Qiagen, США), линеаризована эндонуклеазой рестрикции Pvul (Fermentas, Литва) с разрушением гена бета-лактамазы и стерилизована фильтрованием.
Клетки линии CHO-DG-44 (Life Technologies, США) культивировали в безбелковой среде Lonza Pro-CHO 5 (Lonza AG, Швейцария) с 8 мМ L-глутамина. Для поддержания роста клеток, дефектных по гену dhfr в среду вносили нуклеотидные добавки -гипоксантин ЮмМ и тимидин 1,6 мМ. Клетки выращивали в стерильных одноразовых колбах Эрленмеера (30 мл суспензии в колбах вместимостью 125 мл) на орбитальной качалке при 130 об/мин в атмосфере, содержащей 5% углекислого газа при температуре 37°С. Подсчет плотности клеточной суспензии и доли живых клеток проводится в счетной камере Горяева, при окрашивании трипановым синим. Пассирование культуры проводили по достижении плотности 1,2 млн клеток/мл, посевная концентрация 0,3 млн клетка/мл. За 48 часов и 24 ч до трансфекций клетки дополнительно пассировали до посевной концентрации 0,5 млн клеток/мл. Трансфекцию линеаризованной плазмиды p1.1-F9 проводили при помощи липосомного реагента FuGENE HD (Promega, США) в бессывороточной среде CHO-S-SFM2 (Life Technologies, США), используя 1,5×107 клеток в 30 мл среды в колбе Эрленмеера, 60 мкг плазмидной ДНК и 80 мкл трансфекционного агента. Смешивание ДНК и трансфекционного реагента проводили по методике производителя агента. Эффективность трансфекций по регистрации флуоресценцентного продукта транзиентно котрансфецированной (5% от общей массы ДНК) плазмиды pEGFP-С2 (Clontech, США) через 48 часов составила 8,2%. По истечении 48 часов после трансфекций среду полностью заменяли центрифугированием на Lonza PRO-CHO 5 с 8 мМ глутамина, но не содержащую гипоксантин и тимидин. При этом клеточную массу разделили на три равные части и в дальнейшем культивировали раздельно в описанных выше суспензионных условиях в присутсвии специфического ингибитора дигидрофолатредуктазы (DHFR) метотрексата (МТХ) в концентрациях 50 нМ, ЮОнМ и 200 нМ. Культуры пересевали по прошествии 5 дней с полной заменой среды центрифугированием, либо по достижении плотности 1,2 млн клеток/мл разведением до посевной плотности 3×105 клеток/мл. Культуры считались стабильными при достижении доли живых клеток более 90% по окраске трипановым синим. Генерация стабильных поликлональных линий была проведена за 6 пассажей и заняла от 27 до 30 дней. Для полученных таким образом поликлональных культур уровень секреции FIX определяли методом твердофазного иммуноферментного анализа (ИФА, ELISA) по достижении плотности пересева 1,2 млн клетка/мл. Уровень секреции в трех последовательных пассажах составил 0,69±0.04 мкг/мл, 1,05±0.05 мкг/мл и 1,83±0.24 мкг/мл при действии 50 нМ, 100 нМ и 200 нМ МТХ соответственно, при этом время удвоения полученных культур было определено как 29,5 часов, 26,8 часов и 28,1 часов. Полученная при действии 200 нМ МТХ поликлональная линия была клонирована методом предельных разведении в бессывороточной среде ex-cell Cloning (Sigma-Aldrich, США) с 8 мМ L-глутамина, 20 мМ гипоксантина и 3,2 мМ тимидина без селекционного давления МТХ. Эффективность клонирования составила 41%. Наилучшие по уровню секреции FIX клональные культуры были возвращены к суспензионному культивированию без нуклеотидных добавок и селективного давления. Уровень секреции FIX для трех наилучших полученных моноклональных линий составил 11,9±0,4 мкг/мл, 12,3±0,4 мкг/мл, 9,9±0,3 мкг/мл после 3-х дней культивации. Выбранная для дальнейшей работы моноклональная линия p1.1-F9-T2/S показала в трех последовательных пассажах удельную продуктивность 2,99±0,06 пкг/клетка/день, что более чем в 6 раз превзошло показатели поликлонального клеточного пула при сократившемся времени удвоения клеточной культуры 22,5 ч. При этом копийность векторной вставки в геном, определенная по гену dhfr, как описано в Примере 8, составила 14±7 копий целевого гена на гаплоидный геном, что оказалось меньше, чем для родительской поликлональной популяции - 20±4 копии.
Пример 4. Амплификация целевого гена под действием метотрексата и получение клональных линий-продуцентов FIX.
Полученная, как описано в Примере №3 моноклональная клеточная линия p1.1-F9-T2/S была подвергнута амплификации векторной вставки в геноме. Для этого исходную моноклональную клеточную линию культивировали в суспензионных условиях как описано в Примере 3, используя питательную среду Lonza PRO-CHO 5 с 8 мМ глутамина и 20 мкг/мл водорастворимого витамина КЗ (менадионбисульфита), но не содержащей гипоксантин и тимидин. На каждом шаге амплификации в клеточную суспензию добавляли возрастающие концетрации МТХ 1 мкМ, 2 мкМ, 4 мкМ, 8 мкМ. Культуры пересевали по прошествии 5 дней с полной заменой среды центрифугированием, либо по достижении плотности 1,2×106 клеток/мл разведением до посевной плотности 3×105 клеток/мл. Культуры считали стабильными при достижении доли живых клеток более 90% по окраске трепановым синим. Стабильная культура замораживалась в среде Lonza PRO-CHO 5 с добавлением 10% диметилсульфоксида (DMSO) в виде образцов объемом 1 мл, в которых клетки были сконцентрированы цетрифугированием при 300 g до плотности 107 клеток/мл. Для стабильных культур, размороженных в обычных условиях супензионного культивирования при действии генерационной концентрации МТХ, определяли уровень секреции рекомбинантного FIX, время клеточного удвоения культуры (по методикам Примера 3) и копийность векторной вставки в геном (по методике Примера 8). Успешно размороженную культуру также переводили на следующий шаг амплификации со следующей концентрацией МТХ. При этом применение МТХ в концентрации 8 мкМ не позволило получить стабильной культуры, таким образом, максимальное селективное давление составило 4 мкМ МТХ.
Полученную поликлональную культуру p1.1-F9-T2/4k клонировали методом предельных разведении в бессывороточной среде ex-cell Cloning с 8 мМ L-глутамина, 20 мМ гипоксантина и 3,2 мМ тимидина без селекционного давления МТХ. Эффективность клонирования составила 34,6%. Всего было получено 432 моноклональных колонии, для которых на 21 день роста прикрепленных условиях методом ИФА определяли концентрацию накопленного в среде фактора IX. Наилучшие по уровню секреции фактора IX клональные культуры (24 клона) повторно адаптировались к суспензионному культивированию без нуклеотидных добавок и селективного давления, при этом у половины моноклональных культур была утеряна продуктивность и/или способность к росту в суспензии (менее 0,5 пкг/клетка/день или время удвоения более 48 часов).
Наилучшая из 12 успешно адаптированных к суспензионному культивированию моноклональных клеточных культур p1.1-F9-T2/4k-3B12 показала в трех последовательных пассажах удельную продуктивность 10,72±0,43 пкг фактора IX/клетка/день, что в 2 раза превзошло показатели поликлонального клеточного пула при времени удвоения клеточной культуры 20,2 ч (определено по методике Примера 3). При этом копийность векторной вставки в геном уменьшилась до 75±4 (определено по методике Примера 8).
Пример 5. Получение линии клеток, стабильно транфицированных плазмидами p1.1-F9 и p1.2-Zeo-CHO-VKORCL
Моноклональная клеточная линия p1.1-F9-T2/4k-3B12 при определении ее удельной продуктивности (как описано в Примере 4) на трехдневных культивационных циклах с плотностью в момент пересева 1,2×106 клеток/мл накапливала не более 0,22 МЕ/мл активного фактора IX при общей концентрации фактора IX, определенной по ИФА, 59 мкг/мл, что соответствовало удельной активности секретируемого фактора IX человека 1,83% (полная удельная активность - 200 МЕ/мг). Прокоагуянтная активность рекомбинантного FIX зависит от степени гамма-карбоксилирования его Gla-домена, и соответствует природной при карбоксилировании первых 10 из 12 остатков глутаминовой кислоты Gla-домена [McGraf D.M., Walsh G. Directory of therapeutic enzymes. NY 2005. 312 pp.]. Удельная активность рекомбинантного FIX может быть увеличена при коэкспресии в линиях-продуцентах фермента витамин-К-эпоксид-редуктазы (VKORC1), восстанавливающей витамин К (донор электронов для ферментативной гамма-карбоксилирования до его активной формы [Wajih N. Et al. Increased production of functional recombinant human clotting factor IX by baby hamster kidney cells engineered to overexpress VKORC1, the vitamin K 2,3-epoxide-reducing enzyme of the vitamin К cycle. Journal of Biological Chemistry 2005 280 (280), 31603-31607].
Для интеграции в геном моноклональной клеточной линии p1.1-F9-T2/4k-3В12 дополнительных копий гена vkorcl китайского хомячка, находящихся под контролем сильного конститутивного промотора, использовали экспрессионную плазмиду p1.2-Zeo-CHO-VKORC (SEQ ID NO:20, Фиг.3), полученную аналогично описанной в Примере 2. Плазмиду вводили в клетки методом электротрансфекции одинарным прямоугольным импульсом длительностью 20 мс при постоянном напряжении 200 В и зазоре кюветы 4 мм, использовали 30 мкг плазмидной ДНК p1.2-Zeo-CHO-VKORC, линеаризованной рестриктазой PvuI. Эффективность трансфекции составила 12,4%. Через 48 часов после трансфекции к культуре добавили селекционный антибиотик зеоцин (Life Technologies, США) в концентрации 1 мг/мл. Пассирования культуры проводили по достижении плотности 1,2 млн клеток/мл, но не позднее чем через 5 суток после предыдущего пассирования. Через 30 дней после трансфекции была получена стабильная культура с долей, живых клеток 87%. Уровень секреции фактора IX в полученной культуре составил 6,87±0,39 пкг/клетка/день при времени удвоения клеточнойкультуры 22,5 часа (определены по методикам примера №3), а копийность вставки гена vkorcl составила 3,24±0,53 копий на гаплоидный геном после отмены селекционного давления зеоцина (по методике примера №8).
Пример 6. Получение линии клеток, стабильно транфицированных плазмидами p1.1-F9, p1.2-Zeo-CHO-VKORCl и p1.2-Hygro-FurVQ.
При секреции зрелой формы фактора свертывания IX, способной проявлять прокоагуляционую активность, от него отделяется пропептид. Такая же пострансляционая модификация может производиться в культуральной среде при коэкспрессии рекомбинантного FIX и растворимого укороченного варианта протеазы РАСЕ/фурин [McGraf D.M., Walsh G. Directory of therapeutic enzymes. NY 2005. 312 pp.]. Полученная в Примере №4 моноклональная клеточная культура p1.1-F9-T2/4k-3B12 секретировала рекомбинантный фактор IX с низкой удельной активностью - 1,8% от стандарта, при этом более 97% молекул фактора IX содержали неотделенный пропептид по данным ИФА с использованием антител к пропептиду фактора IX.
Для повышения активности целевого белка поликлональную клеточную популяцию p1.1-F9-T2/4k-3B12-VKOR/Zeo, полученную в Примере 5, трансфицировали экспрессионной плазмидой pl.2-Hygro-FurVQ (SEQ ID NO:18, Фиг.2), полученной как описано в Примере 2. Трансфекцию проводили электропорацией по методике, описанной в Примере 5, но в качестве селекционно антибиотика применялся Гигромицин В (Sigma-Aldrich, США) в концентрации 750 мкг/мл. Эффективность трансфекции составила 20,2%. Генерация стабильно трансфицированной поликлональной культуры с долей живых клеток более 90% продолжалась 21 день. Полученная поликлональная популяция p1.1-F9-T2/4k-3B12-VKOR/Zeo-FurVQ/Hyg обладала уровнем секреции фактора IX 5,83±0,42 пкг/клетка/день, долей молекул фактора IX с неотделенным пропептидом 3,1%, удельная прокоагуляционная активность продукта в культуральной среде - 27% от стандарта, копийность вставки гена fix в геном 40,6±1,0 копий на гаплоидный геном (по методике из Примера 8).
Удельная продуктивность популяции p1.1-F9-T2/4k-3B12-FurVQ/Hyg по биологически активному фактору IX составила 1,6±0,03 МЕ/млн клеток/день при скорости удвоения клеток 23,25 часа.
Для получения моноклональных линий-продуцентов рекомбинантного фактора IX, пригодных для фармацевтического производства, поликлональная популяция p1.1-F9-T2/4k-3B12-VKOR/Zeo-FurVQ/Hyg была клонирована методом предельных разведении в бессывороточной среде ex-cell cloning с 8 мМ L-глутамина, 20 мМ гипоксантина и 3,2 мМ тимидина без селекционного давления МТХ или антибиотиков. Эффективность клонирования составила 25,9%. Всего было получено 199 моноклональных колоний, для которых на 21 день роста в прикрепленных условиях методом ИФА определяли общий уровень секреции фактора IX. По результатам первичного скрининга было отбрано 80 клонов, накопивших более 12,5 мкг/мл целевого белка. Отобранные клоны были переведены на полуадгезионное культивирование без перемешивания в среде Lonza PRO-СНО 5 с 8 мМ глутамина и 20 мкг/мл витамина КЗ, но не содержащей гипоксантина, тимидина и селекционных компонентов. После 5 дней культивирования в кондиционированной среде при помощи флуориметра Fusion-Alpha FP НТ 4 (PerkinElmer, Inc, США) с парой светофильтров 400 нм/460 нм была кинетическим методом измерена пептидазная активность по отношению к флуорогенному субстрату протеиназы PACE/furin. Всего было отобрано 24 моноклона, для которых относительная пептидазная активность в кондиционированной среде превысила более чем в 100 раз пептидазную активность в кондиционированной среде родительской линии 1.1-F9-T2/4k-3B12, не трансфицированной геном PACE/furin. Для всех отобранных клонов доля молекул фактора IX, содержащих неотделенный пропетид, составила менее 3,5% (то есть находилась ниже предела определения для использованного метода ИФА). Для дальнейшего суспензионного культивирования с перемешиванием было отобрано 12 моноклональных линий, секретировавших более 14,5 мкг/мл фактора IX за 3 дня культивации. Только 5 из 12 отобраных моноклональных линий сохранили способность делиться в в обычных условиях супензионного культивирования в среде Lonza PRO-CHO 5 с 8 мМ глутамина и 20 мкг/мл витамина K3. Удельная активность рекомбинантного фактора IX, секретирумого всеми пятью отобранными моноклональными линиями-продуцентами составила более 185 МЕ/мг. Другие характеристики полученных клеточных линий обобщены в Таблице 2.
Пример 7. Измерение числа копий экспресионных плазмид, введенных в геном клеток и уровней мРНК FIX человека в клетках.
Количественный анализ копийности экспрессионной кассеты в геноме и уровня мРНК проводили методом ПЦР в реальном времени (ПЦР-РВ) с использованием амплификатора iCycler iQ (Bio-Rad, США). Для ПЦР использовали готовую 5х реакционную смесь с горячим стартом, содержащую интеркалирующий краситель SYBR Green I, qPCRmix-HS SYBR («Евроген», Россия). Каждую реакцию повторяли 3 раза в объеме 25 мкл, в 3-5 повторах. Геномную ДНК выделяли из 0,5-5 млн. клеток набором «Wizard SV Genomic DNA Purification System» (Promega, США) по инструкции производителя. Суммарную РНК выделяли из 0,5-5 млн клеток набором «RNeasy Mini Kit» (Qiagen, США) по инструкции производителя. Для приготовления образцов кДНК использовали по 1 мкг суммарной РНК и набор реактивов «Mint» (Евроген, Россия). Для определения копийности экспрессионной кассеты в геноме в качестве матрицы использовали геномную ДНК и олигонуклеотидные праймеры, не гомологичные геномным последовательностям китайского хомячка - к гену FIX человека - RT-F9-f и RT-F9-r (SEQ ID NO:21-22) и к области IRES-DHFR RT-ID-F и RT-ID-R (SEQ ID NO:23-24). Для анализа копийности вспомогательных кассет в геномной ДНК клеток использовали пару праймеров к гену устойчивости к гигромицину - RT-Hyg-F и RT-Hyg-R (SEQ ID NO:25-26); пару праймеров к гену устойчивости к зеоцину - RT-Zeo-F и RT-Zeo-R (SEQ ID NO:27-28); пару праймеров к С-концевой области VKORC1 китайского хомячка и 3′ НТО плазмиды p1.2-Zeo-CHO-VKORC - RT-cVKOspC -F и RT-cVKOspC-R (SEQ ID NO:29-30), пару праймеров к С-концевой области фурина человека RT-FURC-F и RT-FURC-R (SEQ ID NO:31-32).
Для определения уровня экспрессии мРНК в качестве матрицы использовали кДНК и уникальные олигонуклеотидные праймеры, не гомологичные последовательностям китайского хомячка. Для определения уровня экспрессии VKORC1 использовали праймеры RT-cVKOspN-F и RT-cVKOspN-R (SEQ ID NO:33-34).
Для амплификации опорных генов, в случае ПЦР с геномной ДНК, использовали праймеры к области гена пептидил-пролил изомеразы В (циклофилина В), предположительно уникальной для генома СНО, RT-PPIB-F и RT-PPIB-R (SEQ ID NO:35-36), а в случае ПЦР с кДНК использовали прамеры к бета-актину СНО - RT-bACT-F и RT-bACT-R (SEQ ID NO:37-38).
Копийность экспрессионной кассеты определяли из калибровочной кривой, построенной для серийных разведении экспрессионных плазмид p1.1-F9, p1.2-Zeo-CHO-VKORC1, p1.2-Hygro-FurVQ. Результаты ПЦР сравнивали с результатами для контрольного ампликона, представленного в геноме клеток СНО только один раз по поисковой выдаче алгоритма BLAST из базы данных NCBI Nucleotide Collection. При анализе уровней экспрессии мРНК было установлено, что эффективность ПЦР составляет не менее 99% для всех использованных пар праймеров, вычисление относительных концентраций мРНК проводили по формуле C=2^(-CT), где СТ - пороговый цикл амплификации.
Хотя указанное изобретение описано в деталях со ссылкой на Примеры, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Список литературы
1. Патент США 4,770,999.
2. Wasley L.C., Rehemtulla A., Bristol J.A., Kaufman R.J. // J. Biol. Chem. 1993. V.268. №12. P.8458-8465.
3. Европейская патентная заявка ЕР 0705901 А2.
4. Европейский патент ЕР 0430930 B1.
5. Европейская патентная заявка ЕР 2164971 А2.
6. Патентная заявка РСТ WO 2011011841 A1.
7. Европейская патентная заявка ЕР 2496252 A1.
8. Патент США US 7375084 В2.
9. Европейская патентная заявка ЕР 1969127 А2.
10. Патентная заявка РСТ WO 2005071077.
11. Патентная заявка РФ 2011146243.
12. McGraf D.M., Walsh G. Directory of therapeutic enzymes. NY 2005. 312 pp.
13. Wajih N. et al. Journal of Biological Chemistry 2005 280 (280), 31603-31607.
14. Invitrogen, Inc. "Lipofectamine® 2000 Reagent" Pub. No.MAN0000995 Rev. Date 20 July 2012.
15. Kaufman RJ et al. Mol Cell Biol 5, 1750-1759 1985.
16. Michael P. Weiner, Tim Gackstetter, Gina L. Costa, John C. Bauer, and Keith A. Kretz. Site-directed Mutagenesis using PCR in Molecular Biology: Current Innovations and Future Trends. Eds. A.M. Griffin and H.G. Griffm. ISBN 1-898486-01-8 1995 Horizon Scientific Press, PO Box 1, Wymondham, Norfolk, U.K.
Краткое описание Фигур.
На Фигуре 1 показана карта экспрессионной плазмиды p1.1-F9. Используются следующие обозначения: pUC origin - область начала репликации плазмиды pUC; bla -открытая рамка считывания бета-лактамазы, обеспечивающей устойчивость к ампициллину; bla promoter - прокариотический промотер гена bla; EBV TR - участок терминального повтора вируса Эпштейна-Барр человека; СНО EEF1A UFR функциональный промотор гена фактора элонгации 1 альфа китайского хомячка, 5' нетранслируемая область этого гена и нетранскрибируемая область, фланкирующая этот ген; transcription start - точка начала транскрипции, ТАТА - ТАТА-бокс, СНО EEF1A intron I - первый интрон гена фактора элонгации 1 альфа китайского хомячка, EMCV IRES - внутренний сайт связывания рибосом вируса энцефаломиокардита (EMCV); DHFR - открытая рамка считывания дигидрофолатредуктазы мыши для селективного отбора и амплификации в эукариотических клетках; СНО EEF1A DFR функциональный I терминатор и сигнал полиаденилирования гена фактора элонгации 1 альфа китайского хомячка, 3′ нетранслируемая область этого гена и нетранскрибируемая область, фланкирующая этот ген; Kozak - область, кодирующая последовательность Козак для кэп-зависимой инициации трансляции, F9 ORF - ОРС фактора IX свертывания крови человека, stop - блок стоп-кодонов. Стрелками указаны направления транскрипции генов, в скобках указаны номера первого и последнего нуклеотидов фрагментов. Курсивом выделены сайты узнавания эндонуклеаз рестрикции, в скобках указаны номера нуклеотидов в точках разрезания.
На Фигуре 2 показана карта экспрессионной плазмиды p1.2-Hygro-FurVQ. Используются обозначения аналогично Фигуре 1, а также Fur ORF - ОРС протеаы PACE/furin человека, SV40 promoter - область промотора вируса SV40; SV40pA, terminator - терминатор и сигнал полиаденилирования вируса SV40; hygroB - ОРС гена устойчивости к гигромицину, VQ - точка инсерции пары кодонов, кодирующих аминокислоты V и.
На Фигуре 3 показана карта экспрессионной плазмиды p1.2-Zeo-CHO-VKORC1. Используются обозначения аналогично Фигуре 1, а также СНО VKORC1 ORF - ОРС VKORC1 китайского хомячка, SV40 promoter - область промотора вируса SV40; SV40pA, terminator - терминатор и сигнал полиаденилирования вируса SV40; ZeoR - ОРС гена устойчивости к зеоцину.
































Изобретение относится к области биотехнологии, в частности к рекомбинантной продукции факторов свертываемости крови, и может быть использовано для экспрессии фактора свертываемости крови IX человека (hFIX). Конструируют плазмиду для экспрессии hFIX в клетках СНО, состоящую из области начала репликации плазмиды pUC, открытой рамки считывания бета-лактамазы (bla) и прокариотического промотера гена bla; участка терминального повтора EBVTR, функционального промотора и первого интрона гена фактора элонгации 1 альфа китайского хомячка, фланкированного 5' нетранслируемой областью этого гена; открытой рамки считывания гена, кодирующего hFIX; внутреннего сайта IRES EMCV; открытой рамки считывания DHFR, экспрессирующейся в составе бицистронной мРНК вместе с геном, кодирующим hFIX; и функционального терминатора гена фактора элонгации 1 альфа китайского хомячка, фланкированного 3' нетранслируемой областью этого гена. Изобретение позволяет повысить эффективность продукции hFIX. 3 н. и 12 з.п. ф-лы, 3 ил., 3 табл., 7 пр.
1. Плазмида для экспрессии рекомбинантного фактора свертываемости крови IX человека в культивируемых клетках китайского хомячка линии СНО, в следующей последовательности по существу состоящая из области начала репликации плазмиды pUC, открытой рамки считывания бета-лактамазы (bla) и прокариотического промотера гена bla; участка терминального повтора вируса Эпштейн-Барр человека (EBVTR), функционального промотора и первого интрона гена фактора элонгации 1 альфа китайского хомячка, фланкированного 5′ нетранслируемой областью этого гена; открытой рамки считывания гена, кодирующего фактор свертываемости крови IX человека; внутреннего сайта связывания рибосом (IRES) вируса энцефаломиокардита (EMCV); открытой рамки считывания дигидрофолатредуктазы (DHFR), экспрессирующейся в составе бицистронной мРНК вместе с геном, кодирующим фактор свертываемости крови IX человека; и функционального терминатора гена фактора элонгации 1 альфа китайского хомячка, фланкированного 3′ нетранслируемой областью этого гена.
2. Плазмида по п. 1, отличающаяся тем, что ген фактор свертываемости крови IX человека кодирует полипептид фактора свертываемости крови IX человека, последовательность аминокислот которого приведена в SEQ ID NO: 2.
3. Плазмида по п. 1, отличающаяся тем, что участок терминального повтора вируса Эпштейн-Барр человека (EBVTR) представляет собой фрагмент конкатемера терминального повтора EBVTR.
4. Плазмида по п. 1, отличающаяся тем, что используют открытую рамку считывания дигидрофолатредуктазы (DHFR) мыши.
5. Плазмида по п. 1, отличающаяся тем, что указанная плазмида дополнительно содержит консенсусную последовательность Козак перед последовательностью, кодирующей открытую рамку считывания фактора свертываемости крови IX человека.
6. Плазмида по п. 1, отличающаяся тем, что указанной плазмидой является плазмида p1.1-F9, представленная в Перечне последовательностей под номером SEQ ID NO: 1.
7. Клетка яичника китайского хомячка (СНО) - продуцент рекомбинантного фактора свертываемости крови IX человека, трансформированная плазмидой по пп. 1-6.
8. Клетка по п. 7, дополнительно трансформированная плазмидой, экспрессирующей витамин-К-эпоксид-редуктазу (VKORC1).
9. Клетка по п. 8, отличающаяся тем, что указанной плазмидой является плазмида р1.2-Zeo-CHO-VKORC1, представленная в Перечне последовательностей под номером SEQ ID NO: 20.
10. Клетка по п. 8, дополнительно трансформированная плазмидой, экспрессирующей растворимый укороченный вариант протеазы РАСЕ/фурин.
11. Клетка по п. 10, отличающаяся тем, что указанной плазмидой является плазмида p1.2-Hygro-FurVQ, представленная в Перечне последовательностей под номером SEQ ID NO: 18.
12. Клетка по п. 11, отличающаяся тем, что указанной клеткой является клетка яичника китайского хомячка моноклональной линии P1.1-F9/3B12-86, депонированной в Российской Коллекции Культур Клеток позвоночных Института Цитологии РАН под регистрационным номером РККК (П) 755Д.
13. Способ получения рекомбинантного фактора свертываемости крови IX человека, включающий следующие стадии:
- культивирование в питательной среде клеток по пп. 7, 8 или 10; и
- выделение полученного рекомбинантного белка из культуральной жидкости.
14. Способ по п. 13, отличающийся тем, что культивируют клетки яичника китайского хомячка моноклональной линии P1.1-F9/3B12-86, депонированной в Российской Коллекции Культур Клеток позвоночных Института Цитологии РАН, регистрационный номер РККК (П) 755Д.
15. Способ по п. 13, отличающийся тем, что питательная среда для культивирования является бессывороточной.
| EP 1969127 A2, 17.09.2008 | |||
| ЭКСПРЕССИОННЫЙ ПЛАЗМИДНЫЙ ВЕКТОР ДЛЯ ГЕТЕРОЛОГИЧНОЙ ЭКСПРЕССИИ РЕКОМБИНАНТНЫХ БЕЛКОВ, ВЫСОКОЧАСТОТНОЙ ИНТЕГРАЦИИ И УСИЛЕННОЙ АМПЛИФИКАЦИИ ЭКСПРЕССИОННОЙ КАССЕТЫ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ, БИЦИСТРОННАЯ мРНК, СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНЫХ ЛИНИЙ ПРОДУЦЕНТОВ РЕКОМБИНАНТНЫХ БЕЛКОВ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО ВЕКТОРА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ | 2011 |
|
RU2488633C1 |
| Способ получения катализатора для гидрогенизации жиров | 1938 |
|
SU62863A1 |
| US 7220569 B2, 22.05.2007. | |||
Авторы
Даты
2016-05-27—Публикация
2014-01-31—Подача