Изобретение относится к оксадиазолонам и их физиологически приемлемым солям и физиологически функциональным производным, проявляющим агонистическую активность по отношению к PPAR-дельта.
Агонисты PPAR-дельта описаны в уровне техники (например, международные заявки WO 03/043997, WO 01/00603 и WO 02/092590). Соединения, включающие оксадиазолоновый структурный элемент, в качестве ингибиторов фактора Ха раскрываются в выложенной заявке на патент ФРГ 10112768-А1, в качестве пероральных гипогликемических агентов - в международной заявке WO 96/13264.
Целью изобретения является получение соединений, которые позволяют осуществлять терапевтически используемую модуляцию липидного и/или углеводного метаболизма и, таким образом, пригодны для профилактики и/или лечения заболеваний, таких как диабет типа 2 и атеросклероз и их различные осложнения. Другой целью изобретения является лечение нейродегенеративных заболеваний, и/или демиелинизирующих нарушений центральной и периферической нервных систем, и/или неврологических заболеваний, включающих нейровоспалительные процессы и/или другие периферические невропатии.
Обнаружен ряд соединений, модулирующих активность РРА-рецепторов. Соединения пригодны, в особенности, для активации PPAR-дельта и PPAR-альфа, однако, возможно в пределах относительной активации, изменяющейся в зависимости от соединений.
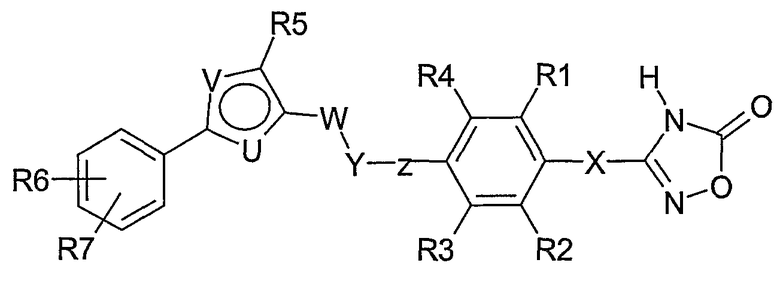
Соединения согласно настоящему изобретению отвечают формуле (I):
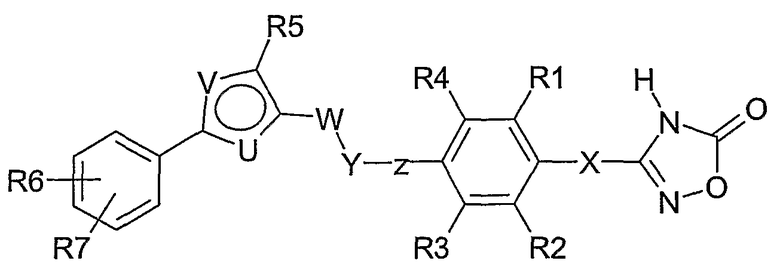
Формула I
где
Х означает СН2 или связь;
R1, R2, R3, R4 независимо означают Н, F, Cl, Br, CF3, (C1-C4)-алкил, (С0-С4)-алкилен-О-(С0-С4)-алкилен-Н, SCH3, S(O)CH3, S(O)2CH3, CN, OCF3, OCHF2,
OCH2F;
Z означает связь или СН2;
Y означает О, S, S(O) или S(O)2;
W означает СН2 или СН2СН2;
один из U и V означает N, а другой означает S или О;
R5 выбирают из группы, состоящей из (С1-С8)-алкила, (С1-С6)-алкилен-О-(С0-С4)-алкилен-Н, (С0-С6)-алкиленфенила,
(С1-С6)-алкилен-О-(С0-С4)-алкиленфенила, (С3-С6)-циклоалкила, (С2-С8)-алкенила, и где (С1-С8)-алкил или алкилен может быть однократно или двукратно замещен ОН или О-(С1-С4)-алкилом;
R6, R7 независимо означают H, F, Br, CF3, OCF3, (C1-C6)-алкил,
(С0-С4)-алкилен-О-(С0-С4)-алкилен-Н, SCF3, SF5, OCF2-CHF2, OCHF2, OCH2F, O-фенил, фенил, NO2; или
так же, как их физиологически приемлемые соли и таутомерные формы.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где Х означает связь.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где один или более заместителей имеют следующее значение:
U означает S и
V означает N, или
U означает N и
V означает S, или
U означает O и
V означает N, или
U означает N и
V означает O;
и/или
U означает S,
V означает N,
Z означает связь;
и/или
U означает N,
V означает O,
Z означает связь,
Х означает связь;
и/или
Х означает связь,
Z означает связь
и/или
R6 находится в пара-положении;
и/или
R7 означает Н или F, предпочтительно Н;
и/или
R2, R3, R4 означают Н;
R1 означает Н, F, Cl, Br, CF3, (C1-C4)-алкил, (С0-С4)-алкилен-О-(С0-С4)-алкилен-Н, SCH3, S(O)CH3, S(O)2CH3, CN;
и/или
Y означает О или S, предпочтительно О;
и/или
W означает СН2;
и/или
R5 означает (С1-С4)-алкил, (С1-С4)-алкилен-О-(С0-С4)-алкилен-Н или (С1-С4)-алкилен-О-(С0-С4)-алкиленфенил, где алкилен может быть замещен с помощью О-(С0-С4)-алкилен-Н.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
Х означает связь или СН2, предпочтительно связь;
R1 означает Н, F, Cl, Br, CF3, (C1-C4)-алкил, О-(С1-С4)-алкил, SCH3, S(O)CH3,
S(O)2CH3, CN;
R2 означает Н, F;
R3 означает Н, Br, О-(С1-С4)-алкил;
R4 означает Н;
Z означает связь или СН2, предпочтительно связь;
Y означает O, S, S(O) или S(O)2, предпочтительно О;
W означает СН2 или СН2СН2, предпочтительно СН2;
U означает S и
V означает N, или
U означает N и
V означает S, или
U означает N и
V означает O;
R5 означает (С1-С6)-алкил или (С2-С6)-алкенил, где (С1-С6)-алкил может быть однократно или двукратно замещен ОН;
R6 находится в пара-положении и означает СF3, SF5, OCH3, фенил;
R7 означает Н или F.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
Х означает связь;
R1 означает Cl или СН3;
R2, R3, R4 означают Н;
Z означает связь;
Y означает О;
W означает СН2;
U означает S и
V означает N, или
U означает N и
V означает О, или
U означает O и
V означает N;
R5 означает (С1-С4)-алкилен-О-(С1-С4)-алкилен-Н, предпочтительно СН2-О-(С1-С3)-алкилен-Н, или (С1-С4)-алкилен-О-(С1-С4)-алкиленфенил, где алкилен может быть замещен О-(С1-С4)-алкилом, предпочтительно, с помощью метокси- или этоксигруппы;
R6 находится в пара-положении и означает CF3 или ОCH3;
R7 означает Н.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
R1, R2 независимо означают H, F, Cl, Br, OCH3, SCH3, CF3, CH3, CN, S(O)CH3, S(O)2CH3;
Х означает связь и
Z означает связь; или
Х означает СН2,
Z означает связь и
W означает СН2; или
Х означает связь и
W означает СН2;
R3, R4 независимо означают Н, ОСН3;
R6 находится в пара-положении и означает H, F, CF3, CH3, SF5, OCH3, фенил;
R7 означает Н.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
Х означает связь;
R1 означает ОСН3 или F;
R2, R3, R4 означают Н;
Z означает связь;
Y означает О или S;
W означает СН2 или СН2СН2;
U означает S и
V означает N, или
U означает N и
V означает S, или
U означает O и
V означает N, или
U означает N и
V означает О;
R5 означает (С1-С4)-алкил, (С1-С4)-алкилен-О-(С1-С4)-алкилен-Н или (С1-С4)-алкилен-О-(С1-С4)-алкиленфенил, где алкилен может быть замещен О-(С1-С4)-алкилом;
R6 находится в пара-положении и означает CF3 или ОСН3;
R7 означает Н.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
Х означает связь или СН2;
R1 означает H, F, Cl, Br, OCH3, SCH3, CF3, CH3, CN, S(O)CH3, S(O)2CH3;
R2 означает H, F;
R3 означает H, OCH3, Br;
R4 означает H;
Z означает связь или СН2;
Y означает O, S, S(O) или S(O)2;
W означает СН2 или СН2СН2;
U означает S и
V означает N, или
U означает N и
V означает S;
R5 означает (С1-С4)-алкил или (С2-С4)-алкенил, где (С1-С4)-алкил может быть однократно или двукратно замещен ОН, как, например, СН2СН2СН(ОН)СН2ОН или СН2СН2СН2СН2ОН, или
R5 означает (С1-С4)-алкилен-О-(С1-С4)-алкилен-Н или (С1-С4)-алкилен-О-(С1-С4)-алкиленфенил, где алкилен может быть замещен О-(С1-С4)-алкилом, предпочтительно метокси- или этоксигруппой;
R6 означает п-CF3 или п-SF5; и
R7 означает Н.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
Х означает связь;
R1 означает Cl, CH3;
R2 означает H;
R3 означает H;
R4 означает H;
Z означает связь;
Y означает O;
W означает СН2;
U означает N и
V означает O, или
U означает O и
V означает N;
R5 означает (С1-С4)-алкил, (С1-С4)-алкилен-О-(С1-С4)-алкилен-Н или (С1-С4)-алкилен-О-(С1-С4)-алкиленфенил, где алкилен может быть замещен О-(С1-С4)-алкилом, предпочтительно метокси- или этоксигруппой;
R6 означает п-CН3 или п-фенил; и
R7 означает Н.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
R1 означает F, Cl, CH3, OCH3, предпочтительно F, Cl.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
R5 означает (С1-С4)-алкил.
Другим вариантом осуществления настоящего изобретения является соединение формулы (I), где
R6 означает CF3, SF5, фенил, OCH3, предпочтительно CF3.
Наиболее предпочтительными соединениями являются:
3-{2-фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-ил-метокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{3-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-пентафторсульфанилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-метил-2-(4-пентафторсульфанилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-(4-{2-[4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]этокси}-2-хлорфенил)-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорбензил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-фторфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2,6-дифторфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-бром-4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метоксифенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бут-3-енил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-(4-гидроксибутил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-(3,4-дигидроксибутил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
5-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-(5-оксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)бензонитрил;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфанилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфинилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метансульфонилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметметансульфинил]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфонил]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]-2-фторфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-[4-(2-бифенил-4-ил-5-метилоксазол-4-илметокси)-2-хлорфенил]-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[2-(4-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-(2-хлор-4-{2-[5-метил-2-(4-трифторметилфенил)тиазол-4-ил]этокси}фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-метоксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-(2-метоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-(2-этоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-(3-метоксипропоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[5-метоксиметил-2-(4-метоксифенил)оксазол-4-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[5-(2-метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-4-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-метоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-(2-метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-(2-этоксиэтоксиметил)-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[2-(4-метоксифенил)-4-(3-метоксипропоксиметил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-этоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-бензилоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[5-метоксиметил-2-(4-метоксифенил)оксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[5-(2-метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-метоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[2-(4-метоксифенил)-4-(3-метоксипропоксиметил)оксазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{5-бром-2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{4-[4-(3-бензилоксипропил)-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он;
3-{2-хлор-4-[4-(3-гидроксипропил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он.
Настоящее изобретение также включает все комбинации предпочтительных аспектов изобретения, описанных в настоящем контексте.
Алкильные и алкенильные радикалы в заместителях R1, R2, R3, R4, R5, R6 и R7 могут быть либо с линейной цепью, либо разветвленными.
Соединения формулы (I) могут находиться в форме их рацематов, рацемических смесей, чистых энантиомеров, диастереомеров и смесей диастереомеров, а также в их таутомерных формах. Настоящее изобретение включает все эти изомерные и таутомерные формы соединений формулы (I). Эти изомерные формы могут быть получены известными способами, даже если в некоторых случаях конкретно не описаны.
Фармацевтически приемлемые соли, так как их растворимость в воде больше, чем таковая первоначальных или основных соединений, являются особенно пригодными для применений в медицине. Эти соли должны содержать фармацевтически приемлемый анион или катион. Пригодными фармацевтически приемлемыми аддитивными солями кислот соединений согласно изобретению являются соли неорганических кислот, таких как соляная кислота, бромистоводородная кислота, фосфорная кислота, метафосфорная кислота, азотная кислота и серная кислота, и органических кислот, таких как, например, уксусная кислота, бензолсульфокислота, бензойная кислота, лимонная кислота, этансульфокислота, фумаровая кислота, глюконовая кислота, гликолевая кислота, изетионовая кислота, молочная кислота, лактобионовая кислота, малеиновая кислота, яблочная кислота, метансульфокислота, янтарная кислота, п-толуолсульфокислота и винная кислота. Пригодными фармацевтически приемлемыми основными солями являются аммониевые соли, соли щелочных металлов (такие, как соли натрия и калия), соли щелочноземельных металлов (такие, как соли магния и кальция) и соли трометамола (2-амино-2-гидроксиметил-1,3-пропандиол), соли диэтаноламина, лизина или этилендиамина.
Соли с фармацевтически неприемлемым анионом, таким как, например, трифторацетат, также входят в рамки изобретения в качестве пригодных промежуточных продуктов для получения или очистки фармацевтически приемлемых солей и/или для использования при нетерапевтических, например, in vitro, применениях.
Термин «физиологически функциональное производное», используемый в данном контексте, относится к любому физиологически переносимому производному соединения формулы (I) согласно изобретению, как, например, сложный эфир, которое при введении млекопитающему, такому как, например, человек, способно образовывать (прямо или опосредованно) соединение формулы (I) или его активный метаболит.
Физиологически функциональные производные также включают пролекарственные формы соединений согласно изобретению, как описывается, например, H. Okada и др., Chem. Pharm. Bull., 42, 57-61 (1994). Такие пролекарства могут быть метаболизированы in vivo до соединения согласно изобретению. Эти пролекарства сами могут быть активными или нет.
Соединения согласно изобретению также могут находиться в различных полиморфных формах, например в виде аморфной и кристаллической полиморфных форм. Все полиморфные формы соединений согласно изобретению входят в рамки изобретения и составляют дальнейший аспект изобретения.
Все ссылки на «соединение (соединения) формулы (I)» в дальнейшем относятся к соединению (соединениям) формулы (I), как указанная выше, и их солям, сольватам и физиологически приемлемым производным, как описываемые в данном контексте.
Применение
Изобретение относится, далее, к применению соединений формулы (I) и их фармацевтических композиций в качестве лигандов PPAR. Лиганды PPAR согласно изобретению пригодны в качестве модуляторов активности PPAR.
Рецепторы, активируемые стимулирующими рост пероксисом агентами, (PPAR), являются факторами транскрипции, которые могут быть активированы лигандами и относятся к классу рецепторов нуклеарных гормонов. Имеются три изоформы PPAR - PPAR-альфа, PPAR-гамма и PPAR-дельта (идентичная PPAR-бета)-, которые кодируются разными генами (Peroxisome proliferator-activated receptor (PPAR): structure, mechanisms of activation and diverse functions: Motojima K., Cell Struct. Funct., 18(5), 267-277 (1993)).
У людей PPAR-гамма находится в трех вариантах - PPAR-гамма1, -гамма2 и -гамма3, которые являются результатом альтернативного использования промоторов и дифференциального мРНК-сплайсинга. Различные изоформы PPAR имеют разное распределение в тканях и модулируют разные физиологические функции. Изоформы PPAR играют ключевую роль в различных аспектах регуляции большого числа генов, продукты которой гены прямо или непрямо решающим образом вовлекаются в липидный и углеводный метаболизм. Так, например, PPAR-альфа-рецептор играет важную роль в регуляции катаболизма жирных кислот или метаболизма липопротеинов в печени, тогда как PPAR-гамма решающим образом вовлекается, например, в регуляцию дифференцировки липоцитов. Кроме того, однако, изоформы PPAR также вовлекаются в регуляцию множества других физиологических процессов, включая такие, которые непрямо связаны с углеводным или липидным метаболизмом. Активность разных изоформ PPAR может быть модулирована в разной степени разными жирными кислотами, производными жирных кислот и синтетическими соединениями. В отношении соответствующих обзоров по поводу функций, физиологических эффектов и патофизиологии см. Berger J. и др., Annu. Rev. Med., 53, 409-435 (2002); Wilson T. и др., J. Med. Chem., 43(4), 527-550 (2000); Kliewer S. и др., Recent Prog. Horm. Res., 56, 239-263 (2001); Moller D.E. и Berger J.P., Int. J. Obes. Relat. Metab. Disord., 27 (дополнение 3), 17-21 (2003); Ram V.J., Drugs Today, 39(8), 609-632 (2003).
Из трех изоформ PPAR физиологические функции PPAR-дельта долгое время оставались неизвестными. Первой предполагаемой фармакологической ролью PPAR-дельта является регуляция гомеостаза холестерина. Показано, что до некоторой степени селективный PPAR-дельта-лиганд L-165041 повышает содержание холестерина в плазме в случае животной модели диабета (Berger J. и др., J. Biol. Chem., 274, 6718-6725 (1999); Leibowitz M.D. и др., FEBS Lett., 473(3), 333-336 (2000)). В случае страдающих ожирением, резистентных к инсулину макак резус сильнодействующий и селективный PPAR-дельта-лиганд GW501516 повышает уровень холестерина альфа-липопротеинов высокой плотности, снижает уровни в плазме холестерина липопротеинов низкой плотности, триглицеридов и инсулина (Oliver W. и др., Proc. Natl. Acad. Sci., 98, 5306-5311 (2001)). Двойной агонист PPAR-дельта/PPAR-альфа YM-16638 значительно снижает уровни липидов в плазме у макак резус и обезьян cynomolgus (Goto S. и др., Br. J. Pharm., 118, 174-178 (1996)) и действует подобным образом при проводимых в течение двух недель клинических исследованиях в случае здоровых добровольцев (Shimokawa T. и др., Drug Dev. Res., 38, 86-92 (1996)).
В более новых публикациях подчеркивается, что PPAR-дельта является важным объектом для лечения дислипидемии, резистентности к инсулину, диабета типа 2, атеросклероза и синдрома Х (Wang Y-X. и др., Cell, 113, 159-170 (2003); Luquet S. и др., FASEB J., 17, 209-226 (2003); Tanaka T. и др., PNAS, 100, 15924-15929 (2003); Holst D. и др., BioChem. Biophys. Acta, 1633, 43-50 (2003); Dressel U. и др., Mol. Endocrin., 17, 2477-2493 (2003); Lee C.H. и др., Science, 302, 453-457 (2003)).
Кроме его действий в качестве регулятора липидного метаболизма, метаболизма глюкозы и холестерина, известно, что PPAR-дельта играет роль в эмбриональном развитии, имплантации и остеогенезе (Lim H. и Dey S.K., Trends Endocrinol. Metab., 11(4), 137-142 (2000); Ding N.Z. и др., Mol. Reprod. Dev., 66(3), 218-224 (2003); Mano H. и др., J. Вiol. Chem., 275(11), 8126-8132 (2000)).
В многочисленных публикациях указывается, что PPAR-дельта стимулирует пролиферацию и дифференцировку кератиноцитов, что свидетельствует о его роли в кожных нарушениях и заживлении ран (Di-Poi N. и др., J. Steroid. Biochem. Mol. Biol., 85(2-5), 257-265 (2003); Tan N.S. и др., Am. J. Clin. Dermatol., 4(8),523-530 (2003); Wahli W., Swiss Med. Wkly, 132(7-8), 83-91 (2002)).
Показано, что PPAR-дельта в значительной степени экспрессируется в центральной нервной системе; однако многие из его функций до сих пор остаются нераскрытыми. Значительный интерес, однако, представляет раскрытие того, что PPAR-дельта экспрессируется в олигодендроцитах грызунов, продуцирующих большинство липидов в клетках центральной нервной системы (J. Granneman и др., J. Neurosci. Res., 51, 563-573 (1998)). Кроме того, также найдено, что селективный агонист PPAR-дельта в значительной степени повышает экспрессию олигодендриального миелинового гена и диаметр миелинового слоя в мышиных культурах (I. Saluja и др., Glia, 33, 194-204 (2001)). Таким образом, активаторы PPAR-дельта могут быть использованы для лечения демиелинизирующего и дисмиелинизирующего заболеваний.
Демиелинизирующие состояния проявляются в утрате миелина - многократных плотных слоев липидов и белка, которые покрывают множество нервных волокон. Эти слои обеспечиваются олигодендроглией в центральной нервной системе (CNS) и шванновскими клетками в периферической нервной системе (PNS). У пациентов с демиелинизирующими состояниями демиелинизация может быть необратимой; она обычно сопровождается, или за которой следует, аксональной дегенерацией и часто клеточной дегенерацией. Демиелинизация может происходить в результате нейронного повреждения или повреждения самого миелина, обусловленного или аберрантными иммунными ответами, локальным повреждением, ишемией, метаболическими нарушениями, токсическими агентами, или вирусными инфекциями (Prineas and McDonald, “Demyelinating Diseases”, Greenfield's Neuropathology, 6.sup.th.ed. (Edward Arnold: Нью-Йорк, 1997), 813-811; Beers и Berkow, ред., ”The Merck Manual of Diagnosis and Therapy”, 17.sup.th.ed. (Whitehouse Station, N.J.: Merck Research Laboratories, 1999), 1299, 1437, 1473-1476, 1483).
Центральная демиелинизация (демиелинизация центральной нервной системы) происходит при тяжелых состояниях, часто точно неизвестной этиологии, которые известны как первичные демиелинизирующие заболевания. Из них наиболее распространенным является рассеянный склероз (MS). Другие первичные демиелинизирующие заболевания включают адренолейкодистрофию (ALD), адреномиелоневропатию, относящуюся к вакуоли при СПИДе миелопатию, ассоциированную с вирусом человеческого Т-клеточного лейкоза миелопатию, наследственную зрительную атрофию Лебера, прогрессирующую многоочаговую лейкоэнцефалопатию (PLM), под-острый склеротический панэнцефалит, синдром Гийена-Барре и тропический спастический парапарез. Кроме того, имеются «острые» состояния, при которых демиелинизация может происходить в центральной нервной системе, например острый диссеминированный энцефаломиелит (ADEM) и острый вирусный энцефалит. Кроме того, результатом демиелинизации также может быть острый поперечный миелит, синдром, при котором трансфекция спинного мозга неизвестной причины поражает как серое, так и белое вещество в одном или более смежных торакальных сегментах. Также нарушения, при которых повреждаются миелинобразующие глиальные клетки, включают травмы спинного мозга, невпропатии и повреждение нерва.
Настоящее изобретение относится к соединениям формулы (I), пригодным для модуляции активности изоформ PPAR, особенно активности PPAR-дельта и PPAR-альфа. В зависимости от профиля модуляции соединения формулы (I) пригодны для лечения, контроля и профилактики описанных ниже симптомов и для некоторого числа других, связанных с этим, фармацевтических применений (см., например, Berger J. и др., Annu. Rev. Med., 53, 409-435 (2002); Wilson T. и др., J. Med. Chem., 43(4), 527-550 (2000); Kliewer S. и др., Recent Prog. Horm. Res., 56, 239-263 (2001); Fruchart J.C. и др., Pharmacological Research, 44(5), 345-352 (2001); Kersten S. и др., Nature, 405, 421-424 (2000); Torra I.P. и др., Curr. Opin. Lipidol., 12, 245-254 (2001)).
Соединения этого типа особенно пригодны для лечения и/или профилактики
1) нарушений метаболизма жирных кислот и нарушений использования глюкозы; нарушений, в которые вовлекается резистентность к инсулину;
2) сахарного диабета, особенно диабета типа 2, включая профилактику ассоциированных с ним осложнений. Особыми аспектами в этой связи являются гипергликемия, ослабление резистентности к инсулину, ослабление толерантности к глюкозе, защита панкреатических β-клеток, профилактика макро- и микроваскулярных нарушений;
3) дислипидемий и их осложнений, таких как, например, атеросклероз, коронарная болезнь сердца, цереброваскулярные нарушения и т.д., особенно такие (но без ограничения ими), которые характеризуются одним или более из следующих факторов: высокие концентрации триглицеридов в плазме; высокие, возникающие после приема пищи, концентрации триглицеридов в плазме; низкие концентрации холестерина липопротеинов высокой плотности; низкие концентрации АроА-липопротеина; высокие концентрации холестерина липопротеинов низкой плотности; небольшие плотные частицы холестерина липопротеинов низкой плотности; высокие концентрации АроА-липопротеина;
4) различных других состояний, которые могут быть ассоциированы с метаболическим синдромом, таких как ожирение (избыточная масса), включая центральное ожирение; тромбозы, состояния гиперкоагуляции и прототромботические состояния (артериальные и венозные); высокое кровяное давление; сердечная недостаточность, такая как, например, (но без ограничения этим), после инфаркта миокарда, гипертензивное заболевание сердца или кардиомиопатия;
5) нарушений или состояний, в которые вовлекаются воспалительные реакции, как: атеросклероз, такой как, например, (но без ограничения этим) коронарный склероз, включая стенокардию или инфаркт миокарда, инсульт; васкулярный рестеноз или реокклюзия; хронические воспалительные кишечные заболевания, такие как, например, болезнь Крона и язвенный колит; астма; красная волчанка (LE) или воспалительные ревматические нарушения, такие как, например, ревматоидный артрит; другие воспалительные состояния;
6) нарушений клеточного цикла или процессов дифференцировки клеток, как: липоцитные опухоли; липоматозные карциномы, такие как, например, липосаркомы; солидные опухоли и неоплазмы, такие как, например, (но без ограничения этим) карциномы желудочно-кишечного тракта, печени, желчных путей и поджелудочной железы, эндокринные опухоли, раковые заболевания легких, почек и мочевых путей, половых путей, карциномы простаты и т.д.; острые и хронические миелопролиферативные нарушения и лимфомы; ангиогенез;
7) нейродегенеративных заболеваний и/или демиелинизирующих нарушений центральной и периферической нервных систем и/или неврологических заболеваний, включающих нейровоспалительные процессы и/или другие периферические невропатии, как: болезнь Альцгеймера; рассеянный склероз; болезнь Паркинсона; адренолейкодистрофия (ALD); адреномиелоневропания; относящаяся к вакуоли при СПИДе миелопатия; ассоциированная с вирусом человеческого Т-клеточного лейкоза миелопатия; наследственная зрительная атрофия Лебера; прогрессирующая многоочаговая лейкоэнцефалопатия (PML); подострый склеротический панэнцефалит; синдром Гийена-Барре; тропический спастический парапарез; острый диссеминированный энцефаломиелит (ADEM); острый вирусный энцефалит; острый поперечный миелит; травма спинного мозга и головного мозга; болезнь Шарко-Мари-Тута;
8) кожных нарушений и/или нарушений процессов заживления ран, как: эритематозно-сквамозные дерматозы, такие как, например, псориаз; обыкновенные угри; другие кожные заболевания и дерматологические состояния, которые модулируются PPAR; экземы и нейродермиты; дерматиты, такие как, например, себорейный дерматит или фотодерматит; кератиты и кератозы, такие как, например, себорейные кератозы, сенильные кератозы, актинические кератозы, фотоиндуцированные кератозы или фолликулярные кератозы; келоиды и профилактика келоидов; бородавки, включая кондиломы или остроконечные кондиломы; вирусные инфекции папилломы человека (HPV), такие как, например, венерическая папиллома, вирусные бородавки, такие как, например, molluscum contagiosum; лейкоплакия; узелковые дерматозы, такие как, например, красный плоский лишай; рак кожи, такой как, например, базально-клеточные карциномы, меланомы или кожные Т-клеточные лимфомы; локализованные доброкачественные эпидермальные опухоли, такие как, например, кератодермия, эпидермальные родимые пятна; отморожения; заживление ран;
9) других нарушений, как: высокое кровяное давление, панкреатит, синдром Х, синдром поликистозного яичника (PCOS), астма, остеоартрит; красная волчанка (LE) или воспалительные ревматодные нарушения, такие как, например, ревматоидный артрит; васкулит; истощение (кахексия); подагра; синдром ишемия/реперфузия; острый респираторный дистресс-синдром (ARDS).
Готовые лекарственные формы
Количество соединения формулы (I), необходимое для достижения желательного биологического эффекта, зависит от ряда факторов, например выбора конкретного соединения, предназначаемого применения, способа введения и клинического состояния пациента. Суточная доза обычно находится в пределах от 0,001 мг до 100 мг (типично от 0,01 мг до 50 мг) в сутки и на килограмм массы тела, например 0,1-10 мг/кг/сутки. Внутривенная доза может быть, например, в пределах от 0,001 мг/кг до 1,0 мг/кг, которая пригодным образом может быть введена в виде инфузии от 10 нг до 100 нг на килограмм в минуту. Пригодные инфузионные растворы для этих целей могут содержать, например, от 0,1 нг до 10 мг, обычно от 1 нг до 10 мг, на миллилитр. Разовые дозы могут содержать, например, от 1 мг до 10 г активного ингредиента. Так, ампулы для инъекций могут содержать, например, от 1 мг до 100 мг и готовые лекарственные формы в виде разовой дозы, которые могут быть введены перорально, такие как, например, капсулы или таблетки, могут содержать, например, от 0,05 мг до 1000 мг, обычно от 0,5 мг до 600 мг активного ингредиента. Для терапии вышеуказанных состояний соединения формулы (I) можно использовать в виде самого соединения, однако они предпочтительно находятся в виде фармацевтической композиции с приемлемым носителем. Само собой разумеется, носитель должен быть приемлем в том смысле, что он совместим с другими ингредиентами композиции и не вреден для здоровья пациентов. Носитель может быть твердым веществом или жидкостью и предпочтительно использован согласно технологии приготовления лекарственного средства вместе с соединением в виде разовой дозы, например в виде таблетки, которая может содержать от 0,05 мас.% до 95 мас.% активного ингредиента. Также могут присутствовать другие фармацевтически активные вещества, включая другие соединения формулы (I). Фармацевтические композиции согласно изобретению могут быть получены любым из известных фармацевтических способов, которые по существу состоят в смешении ингредиентов с фармацевтически приемлемыми носителями и/или эксципиентами.
Фармацевтические композиции согласно изобретению представляют собой таковые, пригодные для орального, ректального, локального, перорального (например, подъязычного) и парентерального (например, подкожного, внутримышечного, интрадермального или внутривенного) введения, хотя наиболее пригодный способ введения зависит в каждом индивидуальном случае от природы и тяжести состояния, которое нужно лечить, и от природы соединения формулы (I), используемого в каждом случае. Готовые лекарственные формы с нанесенным покрытием и готовые лекарственные формы с нанесенным покрытием пролонгированного действия также входят в рамки изобретения. Предпочтительно получают готовые лекарственные формы, резистентные к кислоте и желудочному соку. Пригодные покрытия, резистентные к желудочному соку, включают ацетатфталат целлюлозы, поливинилацетатфталат, гидроксипропилметилцеллюлозофталат и анионные полимеры метакриловой кислоты и метилметакрилата.
Пригодные фармацевтические композиции для орального введения могут быть в виде отдельных единиц, таких как, например, капсулы, облатки, таблетки для сосания или таблетки, каждая из которых содержит определенное количество соединения формулы (I); в виде порошков или гранул, в виде раствора или суспензии в водной или неводной жидкости; или в виде эмульсии "масло-в-воде" или "вода-в-масле". Эти композиции, как уже указано, могут быть получены любым подходящим фармацевтическим способом, который включает стадию, на которой активный ингредиент и носитель (который может состоять из одного или более дополнительных ингредиентов) вводят в контакт. Композиции обычно получают путем постоянного и гомогенного перемешивания активного ингредиента с жидким и/или тонкоизмельченным твердым носителем, после чего продукт, если необходимо, формуют. Так, например, таблетка может быть получена путем прессования или формования порошка или гранул соединения, где предназначено, с одним или более дополнительными ингредиентами. Прессованные таблетки могут быть получены путем таблетирования в подходящей машине соединения в свободнотекучей форме, такой как, например, порошок или гранулы, где предназначено, в смеси со связующим, агентом, улучшающим скольжение, инертным разбавителем и/или одним (или более) поверхностно-активным веществом/диспергатором (поверхностно-активными веществами/диспергаторами). Формованные таблетки могут быть получены в подходящей машине путем формования соединения, которое находится в порошковой форме и смочено инертным жидким разбавителем.
Фармацевтические композиции, которые пригодны для перорального (подъязычного) введения, включают таблетки для сосания, которые содержат соединение формулы (I) с ароматизатором, обычно сахарозой и гуммиарабиком или трагакантом, и пастилки, которые включают соединение в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик.
Фармацевтические композиции, пригодные для парентерального введения, включают предпочтительно стерильные водные композиции соединения формулы (I), которые предпочтительно изотоничны с кровью реципиента, для которого они предназначены. Эти композиции предпочтительно вводят внутривенно, хотя введение также можно осуществлять путем подкожной, внутримышечной или интрадермальной инъекции. Эти композиции предпочтительно можно получать путем смешения соединения с водой и придания полученному раствору стерильности и изотоничности с кровью. Инъецируемые композиции согласно изобретению обычно содержат от 0,1 мас.% до 5 мас.% активного соединения.
Фармацевтические композиции, пригодные для ректального введения, предпочтительно находятся в форме суппозиториев в виде разовой дозы. Они могут быть получены путем смешения соединения формулы (I) с одним или более обычными твердыми носителями, как, например, масло какао, и формования полученной смеси.
Фармацевтические композиции, пригодные для местного применения на коже, предпочтительно находятся в виде мази, крема, лосьона, спрея, аэрозоля или масла. Носителями, которые могут быть использованы, являются вазелин, ланолин, полиэтиленгликоли, спирты и комбинации из двух или более этих веществ. Активный ингредиент обычно находится в концентрации от 0,1 мас.% до 15 мас.% в пересчете на массу композиции, например от 0,5 мас.% до 2 мас.%.
Также возможно трансдермальное введение. Фармацевтические композиции, пригодные для трансдермальных применений, могут быть в виде разовых пластырей, которые пригодны для долговременного тесного контакта с эпидермисом пациентов. Такие пластыри, соответственно, содержат активный ингредиент в водном растворе, который забуферен, где предназначено, растворенным и/или диспергированным в адгезиве или диспергированным в полимере. Пригодная концентрация активного ингредиента составляет от примерно 1% до 35%, предпочтительно от примерно 3% до 15%. Особой возможностью является высвобождение активного ингредиента путем электротранспорта или ионофореза, как описывается, например, в Pharmaceutical Research, 2(6), 318 (1986).
Соединения формулы (I) отличаются благоприятными воздействиями на метаболические нарушения. Они благотворно влияют на липидный и сахарный метаболизм, в особенности они снижают уровень триглицеридов и пригодны для профилактики и лечения диабета типа II и атеросклероза и их различных осложнений.
Комбинации с другими лекарственными средствами
Соединения согласно изобретению можно вводить индивидуально или в комбинации с одним или более другими фармакологически активными веществами, которые оказывают, например, благоприятные воздействия на метаболические нарушения или расстройства, часто ассоциирующиеся с ними. Примерами таких лекарственных средств являются
1) лекарственные средства, которые снижают уровень глюкозы в крови, антидиабетические средства;
2) активные ингредиенты для лечения дислипидемий;
3) антиатеросклеротические лекарственные средства;
4) средства против ожирения;
5) противовоспалительно активные ингредиенты;
6) активные ингредиенты для лечения злокачественных опухолей;
7) антитромботически активные ингредиенты;
8) активные ингредиенты для лечения высокого кровяного давления;
9) активные ингредиенты для лечения сердечной недостаточности и
10) активные ингредиенты для лечения и/или профилактики осложнений, вызываемых диабетом или ассоциированных с диабетом.
Они могут быть комбинированы с соединениями согласно изобретению формулы (I), в особенности, для синергического улучшения эффекта. Введение комбинации активных ингредиентов можно осуществлять либо путем раздельного введения активных ингредиентов пациенту, либо в форме комбинированных продуктов, в которых множество активных ингредиентов находится в одной фармацевтической композиции.
Примерами, которые могут быть указаны, являются:
Антидиабетические средства
Пригодные антидиабетические средства раскрываются, например, в «Rote Liste 2001», глава 12, или в «USP Dictionary of USAN and International Drug Names», Фармакопея США, Роквилл, 2001. Антидиабетические средства включают все инсулины и производные инсулина, такие как, например, Lantus® (см. www. lantus.com) или Apidra® и другие быстродействующие инсулины (см. патент США 6221633), модуляторы рецептора GLP-1, как описанные в международной заявке WO 01/04146, или еще, например, таковые, раскрытые в международной заявке WO 98/08871 фирмы Novo Nordisk A/S.
Орально эффективные гипогликемически активные ингредиенты включают предпочтительно сульфонилмочевины, бигуаниды, меглитиниды, оксадиазолидиндионы, тиазолидиндионы, ингибиторы глюкозидазы, антагонисты глюкагона, агонисты GLP-1, ингибиторы DPP-IV, открыватели калиевого канала, такие как, например, таковые, раскрытые в международных заявках WO 97/26265 и WO 99/03861, сенсибилизаторы инсулина, ингибиторы ферментов печени, вовлекаемые в стимуляцию глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, соединения, которые изменяют липидный метаболизм и приводят к изменению состава липидов крови, соединения, которые снижают потребление пищи, модуляторы PPAR и PXR и активные ингредиенты, которые воздействуют на АТФ-зависимый калиевый канал бета-клеток.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с инсулином.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с веществами, которые влияют на продуцирование глюкозы в печени, такие как, например, ингибиторы гликогенфосфорилазы (см. международные заявки WO 01/94300, WO 02/096864, WO 03/084923, WO 03/084922, WO 03/104188).
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с сульфонилмочевиной, такой как, например, толбутамид, глибенкламид, глипизид или глимепирид.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с активным ингредиентом, который воздействует на АТФ-зависимый калиевый канал бета-клеток, таким как, например, толбутамид, глибенкламид, глипизид, глимепирид или репаглинид.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с бигуанидом, таким как, например, метформин.
Согласно другому варианту осуществления изобретения соединения формулы (I) вводят в комбинации с меглитинидом, таким как, например, репаглинид.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с тиазолидиндионом, таким как, например, циглитазон, пиоглитазон, розиглитазон или соединения, раскрытые в международной заявке WO 97/41097 на имя Dr. Reddy's Research Foundation, в частности 5-[[4-[(3,4-дигидро-3-метил-4-оксо-2-хиназолинилметокси]фенил]метил]-2,4-тиазолидиндион.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором DPPIV, как описывается, например, в международных заявках WO 98/19998, WO 99/61431, WO 99/67278, WO 99/67279, WO 01/72290, WO 02/38541, WO 03/040174, как, в частности, Р-93/01 (1-циклопентил-3-метил-1-оксо-2-пентанаммонийхлорид), Р-31/98, LAF237 (1-[2-(3-гидроксиадамант-1-иламино)ацетил]пирролидин-2-(S)-карбонитрил), TS021 ((2S,4S)-4-фтор-1-[[(2-гидрокси-1,1-диметилэтил)амино]ацетил]пирролидин-2-карбонитрилмонобензол-
сульфонат).
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с агонистом PPAR-гамма, таким как, например, розиглитазон, пиоглитазон.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с соединениями с ингибирующим воздействием на SGLT-1 и/или -2, как раскрытые прямо или непрямо, например, в РСТ/ЕР03/06841, РСТ/ЕР03/13454 и РСТ/ЕР03/13455.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором α-глюкозидазы, таким как, например, миглитол или акарбоза.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с более чем одним из вышеуказанных соединений, например в комбинации с сульфонилмочевиной и метформином, сульфонилмочевиной и акарбозой, репаглинидом и метформином, инсулином и сульфонилмочевиной, инсулином и метформином, инсулином и троглитазоном, инсулином и ловастатином, и т.д.
Липидные модуляторы
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором HMGCoA-редуктазы, таким как ловастатин, флувастатин, правастатин, симвастатин, ивастатин, итавастатин, аторвастатин, розувастатин.
Согласно одному варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором реабсорбции желчной кислоты (см., например, патенты США 6245744, 6221897, 6277831; европейские патенты 0683773, 0683774).
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с полимерным адсорбентом желчной кислоты, таким как, например, холестирамин, колесевелам.
Согласно одному варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором абсорбции холестерина, как описывается, например, в международной заявке WO 02/50027, или как эзетимиб, тиквесид, памаквесид.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с индуктором рецептора LDL (см., например, патент США 6342512).
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с балластными веществами (см., например, сarob/Caromax® (Zunft H.J. и др. «Carob pulp preparation for treatement of hypercholesterolemia», ADVANCES IN THERAPY (2001, сентябрь-октябрь), 18(5), 230-236). Каромакс представляет собой содержащий кароб продукт, выпускаемый фирмой Nutrinova, Nutrition Specialties and Food Ingredients GmbH, Industriepark Höchst, 65926, Франкфурт-на-Майне. Комбинация с Caromax® возможна в виде одного препарата или возможно раздельное введение соединений формулы (I) и Caromax®. В этой связи Caromax® также может быть введен в форме пищевых продуктов, таких как, например, в хлебобулочных изделиях или батончиках мюсли.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с агонистом PPAR-альфа.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с агонистом смешанного PPAR-альфа/-гамма, таким как, например, AZ 242 (тесаглитазар, (S)-3-(4-[2-(4-метансульфонилоксифенил)этокси]фенил)-2-этоксипропионовая кислота), BMS 298585 (N-[(4-метоксифенокси)карбонил]-N-[[4-[2-(5-метил-2-фенил-4-оксазолил)этокси]фенил]метил]глицин) или как описанный в международных заявках WO 99/62872, WO 99/62871, WO 01/40171, WO 01/40169, WO 96/38428, WO 01/81327, WO 01/21602, WO 03/020269, WO 00/64888 или WO 00/64876.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с фибратом, таким как, например, фенофибрат, гемфиброзил, клофибрат, безафибрат.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с никотиновой кислотой или ниацином.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором СЕТР, например СР-529414 (торцетрапиб).
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором АСАТ.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором МТР, таким как, например, имплитапид.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с антиоксидантом.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором липопротеинлипазы.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором АТФ-цитратлиазы.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором скваленсинтетазы.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с антагонистом липопротеина(а).
Средства против ожирения
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с ингибитором липазы, таким как, например, орлистат.
Согласно одному варианту осуществления изобретения дальнейшим активным ингредиентом является фенфлурамин или дексфенфлурамин.
Согласно другому варианту осуществления изобретения дальнейшим активным ингредиентом является сибутрамин.
Согласно дальнейшему варианту осуществления изобретения соединения формулы (I) вводят в комбинации с модуляторами CART (см. «Cocaine-amphetamine-regulated transcript influences energy metabolism, anxiety and gastric emptying in mice» Asakawa A. и др., М.: Hormone and Metabolic Research, 33(9), 554-558 (2001); антагонистами NPY, как, например, гидрохлорид {4-[(4-аминохиназолин-2-иламино)метил]циклогексилметил}амида нафталин-1-сульфокислоты (CGP 71683А); агонистами МС4 (например, [2-(3а-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-c]пиридин-5-ил)-1-(4-хлорфенил)-2-оксоэтил]амид 1-амино-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (WO 01/91752)); антагонистами орексина (например, гидрохлорид 1-(2-метилбензоксазол-6-ил)-3-[1,5]нафтиридин-4-илмочевины (SB-334867-А)); агонистами Н3 (соль щавелевой кислоты 3-циклогексил-1-(4,4-диметил-1,4,6,7-тетрагидроимидазо[4,5-c]пиридин-5-ил)пропан-1-она (WO 00/63208)); агонистами TNF; антагонистами CRF (например, [2-метил-9-(2,4,6-триметилфенил)-9Н-1,3,9-триазафлуорен-4-ил]дипропиламин (WO 00/66585)); антагонистами CRF BP (например, урокортин); агонистами урокортина; агонистами β3 (например, 1-(4-хлор-3-метансульфонилметилфенил)-2-[2-(2,3-диметил-1Н-индол-6-илокси)этиламино]этанолгидрохлорид (WO 01/83451)); агонистами MSH (меланоцитстимулирующего гормона); агонистами ССК-А (например, соль трифторуксусной кислоты {2-[4-(4-хлор-2,5-диметоксифенил)-5-(2-циклогексилэтил)тиазол-2-илкарбамоил]-5,7-диметилиндол-1-ил}уксусной кислоты (WO 99/15525)); ингибиторами повторного поглощения серотонина (например, дексфенфлурамин); смешанными серотонинергическими и норадренергическими соединениями (например, WO 00/71549); агонистами 5НТ, как, например, соль щавелевой кислоты 1-(3-этилбензофуран-7-ил)пиперазина (WO 01/09111); агонистами бомбезина; антагонистами галанина; гормоном роста (например, человеческий гормон роста); высвобождающими гормон роста соединениями (трет-бутиловый эфир 6-бензилокси-1-(2-диизопропиламиноэтилкарбамоил)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты (WO 01/85695)); агонистами TRH (см., например, европейский патент 0462884); 2 или 3 модуляторами несвязывающего белка; агонистами лептина (см., например, Lee Daniel W.; Leinung Matthew C.; Rozhavskaya-Arena Marina; Grasso, Patricia. «Leptin agonists as a potential approach to the treatment of obesity», Drugs of the Future, 26(9), 873-881 (2001)); агонистами DA (бромкриптин, допрексин); ингибиторами липазы/амилазы (например, WO 00/40569); модуляторами PPAR (например, WO 00/78312); модуляторами RXR или агонистами TR-β.
Согласно одному варианту осуществления изобретения дальнейшим активным ингредиентом является лептин.
Согласно одному варианту осуществления изобретения дальнейшим активным ингредиентом является дексамфетамин, амфетамин, мазиндол или фентермин.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с лекарственными средствами, оказывающими воздействия на венечное кровообращение и сердечно-сосудистую систему, такими как, например, ингибиторы АСЕ (например, рамиприл), лекарственными средствами, которые воздействуют на систему ангиотензин-ренин, антагонистами кальция, бета-блокаторами и т.д.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с лекарственными средствами, оказывающими противовоспалительное действие.
Согласно одному варианту осуществления изобретения соединения формулы (I) вводят в комбинации с лекарственными средствами, используемыми для лечения рака и профилактики рака.
Следует заметить, что каждую пригодную комбинацию соединений согласно изобретению с одним или несколькими из вышеуказанных соединений и необязательно с одним или несколькими другими фармакологически активными веществами рассматривают как подпадающую под объем охраны настоящего изобретения.
Активность соединений тестировали следующим образом:
Определение значений ЕС50 агонистов PPAR путем анализа клеточного PPAR-альфа
Принцип
Активность веществ, которые связываются с человеческим PPAR-альфа и активируют его агонистическим образом, анализировали, используя стабильно трансфецированную клеточную линию НЕК (НЕК = человеческая эмбриональная почка), которую в данном случае применяли в качестве PPAR-альфа-репортерной клеточной линии. Она содержит два генетических элемента, люциферазный репортерный элемент (pdeltaM-GAL4-Luc-Zeo) и PPAR-альфа-гибридный белок (GR-GAL4-humanPPAR-альфа-LBD), который опосредует экспрессию люциферазного репортерного элемента в зависимости от PPAR-альфа-лиганда. Стабильно и конструктивно экспрессированный гибридный белок GR-GAL4-humanPPAR-альфа-LBD связывается в клеточном ядре PPAR-альфа-репортерной клеточной линии посредством части белка GAL4 с GAL4-ДНК-связывающими мотивами, расположенными со стороны 5'-конца против хода транскрипции, люциферазного репортерного элемента, который стабильно интегрирован в геном клеточной линии. Имеется только одна незначительная экспрессия люциферазного гена-репортера в отсутствие PPAR-альфа-лиганда, если в анализе используют фетальную телячью сыворотку со сниженным содержанием жирных кислот (cs-FCS). PPAR-альфа-лиганды связывают и активируют PPAR-альфа-гибридный белок и таким образом стимулируют экспрессию люциферазного гена-репортера. Образующаяся люцифераза может быть детектирована посредством хемилюминесценции при использовании соответствующего субстрата.
Конструкция PPAR-альфа-репортерной клеточной линии
PPAR-альфа-репортерную клеточную линию получали в две стадии. Во-первых, конструировали люциферазный репортерный элемент и стабильно трансфицировали в НЕК-клетки. Для этой цели пять сайтов связывания фактора транскрипции дрожжей GAL4 (регистрационный номер AF264724) клонировали в сайт, расположенный со стороны 5'-конца против хода транскрипции, минимального MMTV-промотора размером 68 пар оснований (регистрационный номер V01175). Часть минимального MMTV-промотора содержит блок ССААТ и элемент ТАТА для активизирования эффективной транскрипции РНК-полимеразой II. Клонирование и секвенирование конструкции GAL4-MMTV осуществляли по аналогии с описанием Sambrook J. и др. (Molecular cloning, Cold Spring Harbor Laboratory Press, 1989). Затем полный ген Photinus pyralis (регистрационный номер М15077) клонировали в сайт, расположенный со стороны 3'-конца по ходу транскрипции, GAL4-MMTV-элемента. После секвенирования люциферазный репортерный элемент, состоящий из пяти сайтов связывания GAL4, MMTV-промотора гена люциферазы, снова клонировали в плазмиду, которая придает резистентность к зеоцину, для получения плазмиды pdeltaM-CAL4-Luc-Zeo. Этот вектор трансфицировали в НЕК-клетки в соответствии с указаниями Ausubel F.M. и др. (Current protocols in molecular biology, том 1-3, John Wiley and Sons, Inc., 1995). Затем содержащую зеоцин (0,5 мг/мл) среду использовали для отбора подходящего стабильного клеточного клона, который проявляет очень низкую базальную экспрессию гена люциферазы.
На второй стадии PPAR-альфа-гибридный белок (GR-GAL4-humanPPAR-альфа-LBD) вводили в описанный стабильный клеточный клон. Для этой цели первоначально кДНК, кодирующую 76 N-терминальных аминокислот глюкокортикоидного рецептора (регистрационный номер Р04150), связывали с участком кДНК, кодирующим аминокислоты 1-147 фактора транскрипции дрожжей GAL4 (регистрационный номер Р04386). кДНК связывающего лиганд домена человеческого PPAR-альфа-рецептора (аминокислоты S167-Y468; регистрационный номер S74349) клонировали в сайт, расположенный со стороны 3'-конца, этой GR-GAL4-конструкции. Полученную таким путем гибридную конструкцию (GR-GAL4-humanPPAR-альфа-LBD) снова клонировали в плазмиду рсDNA3 (Invitrogen) для активизации конструктивной экспрессии в ней с помощью цитомегаловирусного промотора. Эту плазмиду линеаризировали с помощью рестрикционной эндонуклеазы и стабильно трансфицировали в вышеописанный клеточный клон, содержащий люциферазный репортерный элемент. Полученную в результате PPAR-альфа-репортерную клеточную линию, содержащую люциферазный репортерный элемент и конструктивно экспрессированный PPAR-альфа-гибридный белок (GR-GAL4-humanPPAR-альфа-LBD), выделяли путем отбора с помощью зеоцина (0,5 мг/мл) и G418 (0,5 мг/мл).
Методика проведения анализа
Активность PPAR-альфа-агонистов определяли при трехдневном анализе, который описывается ниже.
День 1
PPAR-альфа-репортерную клеточную линию культивировали до 80%-ной конфлюэнции в модифицированной по способу Дульбекко среде Игла (DMEM) (регистрационный номер 41965-039; Invitrogen), смешанной со следующими добавками: 10% cs-FCS (фетальная телячья сыворотка; регистрационный номер SH-30068.03; Hyclone), 0,5 мг/мл зеоцина (регистрационный номер R250-01; Invitrogen), 0,5 мг/мл G418 (регистрационный номер 10131-027; Invitrogen), 1% раствор пенициллина-стрептомицина (регистрационный номер 15140-122; Invitrogen) и 2 мМ L-глутамина (регистрационный номер 25030-024; Invitrogen). Культивирование осуществляли в стандартных сосудах для клеточных культур (регистрационный номер 353112; Becton Dickinson) в инкубаторе для клеточных культур при температуре 37°С в присутствии 5% СО2. Конфлюэнтные на 80% клетки промывали однократно 15 мл забуференного фосфатом физиологического раствора (регистрационный номер 14190-094; Invitrogen), обрабатывали 3 мл раствора трипсина (регистрационный номер 25300-054; Invitrogen) при температуре 37°С в течение 2 минут, вносили в 5 мл описанной DMEM и подсчитывали клетки в цитометре. После разведения до концентрации 500000 клеток/мл производили посев по 35000 клеток в каждую лунку 96-луночного титрационного микропланшета с прозрачным пластиковым основанием (регистрационный номер 3610; Corning Costar). Планшеты инкубировали в инкубаторе для клеточных культур при температуре 37°С и 5% СО2 в течение 24 часов.
День 2
Тестируемые PPAR-альфа-агонисты растворяли в диметилсульфоксиде при концентрации 10 мМ. Этот исходный раствор разводили в DMEM (регистрационный номер 41965-039; Invitrogen), смешанной с 5% cs-FCS (регистрационный номер SH-30068.03; Hyclone), 2 мМ L-глутамина (регистрационный номер 25030-024; Invitrogen) и вышеуказанными антибиотиками (зеоцин, G418, пенициллин и стрептомицин). Тестируемые вещества испытывали в 11 разных концентрациях в диапазоне от 10 мкМ до 100 пМ. Более эффективные соединения тестировали в концентрации в диапазоне от 1 мкМ до 10 пМ или от 100 нМ до 1 пМ.
Среду PPAR-альфа-репортерной клеточной линии, в которую произведен посев в день 1, полностью удаляли путем аспирации и тестируемые вещества, разведенные в среде, немедленно добавляли к клеткам. Разведение и добавление веществ осуществляли с помощью робототехнического устройства (Beckman FX). Конечный объем разведенных в среде тестируемых веществ составляет 100 мкл на лунку 96-луночного титрационного микропланшета. Концентрация диметилсульфоксида при анализе составляет меньше чем 0,1% об./об., во избежание цитотоксических эффектов растворителя.
В каждый планшет вводили стандартный PPAR-альфа-агонист, который также разводили в 11 разных концентрациях, для доказательства протекания анализа в каждом индивидуальном планшете. Аналитические планшеты инкубировали в инкубаторе при температуре 37°С и 5% СО2 в течение 24 часов.
День 3
PPAR-альфа-репортерные клетки, обработанные тестируемыми веществами, удаляли из инкубатора и среду удаляли путем аспирации. Клетки лизировали путем пипетирования 50 мкл реагента Bright Glo (выпускается фирмой Promega) в каждую лунку 96-луночного титрационного микропланшета. После инкубации при комнатной температуре в темноте в течение 10 минут титрационные микропланшеты измеряли в люминометре (Trilux; выпускается фирмой Wallac). Измеряемое время для каждой лунки титрационного микропланшета составляет 1 секунду.
Оценка
Необработанные данные, полученные при измерении в люминометре, переносили в файл Microsoft Excel. Кривые доза-эффект и значения ЕС50 PPAR-агонистов рассчитывали, используя программу XL.Fit, как указанная изготовителем (IDBS).
Значения ЕС50 в случае PPAR-альфа для соединений примеров 1-32 при этом анализе представляют собой таковые в диапазоне от 100 нМ до >10 мкМ. Соединения формулы (I) согласно изобретению активируют PPAR-альфа-рецептор.
Определение значений ЕС50 агонистов PPAR путем анализа клеточного PPAR-дельта
Принцип
Активность веществ, которые связываются с человеческим PPAR-дельта и активируют его агонистическим образом, анализировали, используя стабильно трансфицированную клеточную линию НЕК (НЕК = человеческая эмбриональная почка), которую в данном случае применяли в качестве PPAR-дельта-репортерной клеточной линии. Аналогично анализу, описанному для PPAR-альфа, PPAR-дельта-репортерная клеточная линия содержит два генетических элемента, люциферазный репортерный элемент (pdeltaM-GAL4-Luc-Zeo) и PPAR-дельта-гибридный белок (GR-GAL4-humanPPAR-дельта-LBD), который опосредует экспрессию люциферазного репортерного элемента в зависимости от PPAR-дельта-лиганда. Стабильно и конструктивно экспрессированный гибридный белок GR-GAL4-humanPPAR-дельта-LBD связывается в клеточном ядре PPAR-дельта-репортерной клеточной линии посредством части белка GAL4 с GAL4-ДНК-связывающими мотивами, расположенными со стороны 5'-конца против хода транскрипции, люциферазного репортерного элемента, который стабильно интегрирован в геном клеточной линии. Имеется только одна незначительная экспрессия люциферазного гена-репортера в отсутствие PPAR-дельта-лиганда, если в анализе используют фетальную телячью сыворотку со сниженным содержанием жирных кислот (cs-FCS). PPAR-дельта-лиганды связывают и активируют PPAR-дельта-гибридный белок и таким образом стимулируют экспрессию люциферазного гена-репортера. Образующаяся люцифераза может быть детектирована посредством хемилюминесценции при использовании соответствующего субстрата.
Конструкция PPAR-дельта-репортерной клеточной линии
Получение стабильной PPAR-дельта-репортерной клеточной линии основано на стабильном НЕК-клеточном клоне, который стабильно трансфицирован люциферазным репортерным элементом. Эта стадия уже описана выше в разделе «Конструкция PPAR-альфа-репортерной клеточной линии». На второй стадии PPAR-дельта-гибридный белок (GR-GAL4-humanPPAR-дельта-LBD) стабильно вводили в этот клеточный клон. Для этой цели кДНК, кодирующую 76 N-терминальных аминокислот глюкокортикоидного рецептора (регистрационный номер Р04150), связывали с участком кДНК, кодирующим аминокислоты 1-147 фактора транскрипции дрожжей GAL4 (регистрационный номер Р04386). кДНК связывающего лиганд домена человеческого PPAR-дельта-рецептора (аминокислоты S139-Y441; регистрационный номер L07592) клонировали в сайт, расположенный со стороны 3'-конца, этой GR-GAL4-конструкции. Полученную таким путем гибридную конструкцию (GR-GAL4-humanPPAR-дельта-LBD) снова клонировали в плазмиду рсDNA3 (Invitrogen) для активизации конструктивной экспрессии с помощью цитомегаловирусного промотора. Эту плазмиду линеаризировали с помощью рестрикционной эндонуклеазы и стабильно трансфицировали в вышеописанный клеточный клон, содержащий люциферазный репортерный элемент. Полученную в результате PPAR-дельта-репортерную клеточную линию, содержащую люциферазный репортерный элемент и конструктивно экспрессированный PPAR-дельта-гибридный белок (GR-GAL4-humanPPAR-дельта-LBD), выделяли путем отбора с помощью зеоцина (0,5 мг/мл) и G418 (0,5 мг/мл).
Методика проведения анализа и оценка
Активность PPAR-дельта-агонистов определяли при трехдневном анализе полностью аналогично методике, уже описанной для PPAR-альфа-репортерной клеточной линии, за исключением того, что в качестве стандарта для контролирования эффективности теста использовали PPAR-дельта-репортерную клеточную линию и специфический PPAR-дельта-агонист.
Для PPAR-агонистов примеров 1-51, описанных в настоящей заявке, определены значения ЕС50 в случае PPAR-дельта в диапазоне от 0,2 нМ до >10 мкМ. Соединения формулы (I) согласно изобретению активируют PPAR-дельта-рецептор.
Примеры, приведенные в таблице I, служат для пояснения изобретения, не ограничивая его объема охраны.
Эффективности некоторых из описанных соединений примеров представлены в нижеследующей таблице:
Способы
Соединения общей формулы (I) согласно изобретению могут быть получены, как представлено в общих чертах на нижеприводимых реакционных схемах.
Способ А
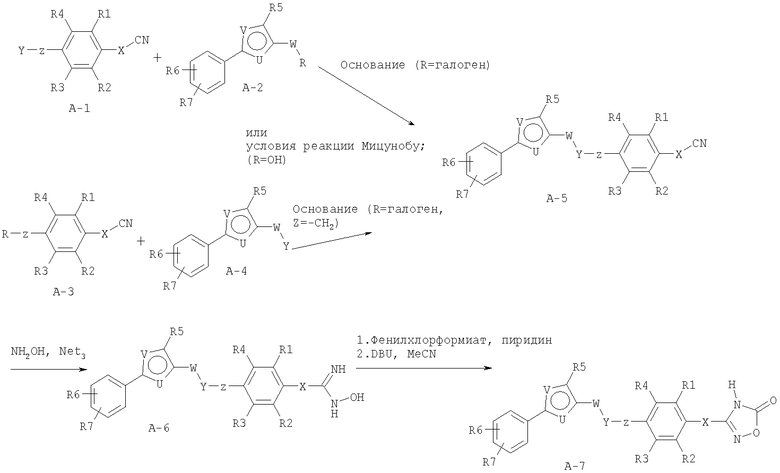 Соединение общей формулы А-1, где Y означает -ОН или -SH и X, Z, R1, R2, R3 и R4 имеют вышеуказанные значения, либо вводят во взаимодействие с галогенидом общей формулы А-1, где R означает галоген и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в присутствии основания, как карбонат цезия или гидрид натрия, в растворителе, как диметилформамид, либо вводят во взаимодействие со спиртом общей формулы А-2, где R = OH и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в условиях реакции Мицунобу (например, трифенилфосфин, диэтилазодикарбоксилат) в неполярном растворителе, как дихлорметан, получая соединение общей формулы А-5. Альтернативно, соединение общей формулы А-5 может быть получено путем взаимодействия соединения общей формулы А-3, где R = галоген, Z = -CН2 и X, R1, R2, R3 и R4 имеют вышеуказанные значения, с соединением общей формулы А-4, где Y означает -ОН и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в присутствии основания, как гидрид натрия, в растворителе, как диметилформамид. Если Y = S в соединении общей формулы А-5, то атом серы может быть окислен (Y = SO или Y = SO2) известными в уровне техники способами, например с помощью окислителя, как м-хлорпероксибензойная кислота, в неполярном растворителе, как дихлорметан. Соединение общей формулы А-5 вводят во взаимодействие с гидроксиламингидрохлоридом в присутствии основания, как триэтиламин, в растворителе, как тетрагидрофуран и метанол, получая соединение общей формулы А-6. Соединение общей формулы А-6 превращают в продукт общей формулы А-7 путем введения во взаимодействие с фенилхлорформиатом в присутствии основания, как пиридин, и обработки этого промежуточного соединения основанием, как 1,8-диазабицикло-[5,4,0]ундец-7-ен (DBU), в растворителе, как ацетонитрил.
Соединение общей формулы А-1, где Y означает -ОН или -SH и X, Z, R1, R2, R3 и R4 имеют вышеуказанные значения, либо вводят во взаимодействие с галогенидом общей формулы А-1, где R означает галоген и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в присутствии основания, как карбонат цезия или гидрид натрия, в растворителе, как диметилформамид, либо вводят во взаимодействие со спиртом общей формулы А-2, где R = OH и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в условиях реакции Мицунобу (например, трифенилфосфин, диэтилазодикарбоксилат) в неполярном растворителе, как дихлорметан, получая соединение общей формулы А-5. Альтернативно, соединение общей формулы А-5 может быть получено путем взаимодействия соединения общей формулы А-3, где R = галоген, Z = -CН2 и X, R1, R2, R3 и R4 имеют вышеуказанные значения, с соединением общей формулы А-4, где Y означает -ОН и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в присутствии основания, как гидрид натрия, в растворителе, как диметилформамид. Если Y = S в соединении общей формулы А-5, то атом серы может быть окислен (Y = SO или Y = SO2) известными в уровне техники способами, например с помощью окислителя, как м-хлорпероксибензойная кислота, в неполярном растворителе, как дихлорметан. Соединение общей формулы А-5 вводят во взаимодействие с гидроксиламингидрохлоридом в присутствии основания, как триэтиламин, в растворителе, как тетрагидрофуран и метанол, получая соединение общей формулы А-6. Соединение общей формулы А-6 превращают в продукт общей формулы А-7 путем введения во взаимодействие с фенилхлорформиатом в присутствии основания, как пиридин, и обработки этого промежуточного соединения основанием, как 1,8-диазабицикло-[5,4,0]ундец-7-ен (DBU), в растворителе, как ацетонитрил.
Соединения примеров 1-9, 12-14, 28-32 и 45-48 получают в соответствии со способом А.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ В
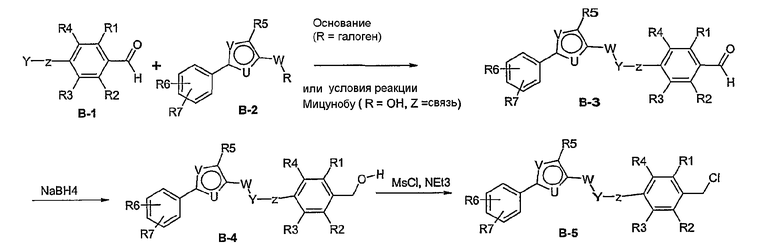
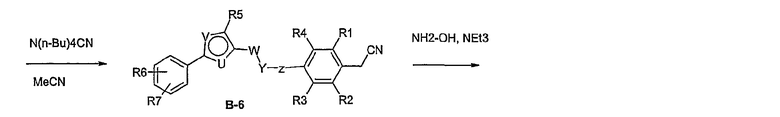

Соединение общей формулы В-1, где Y означает -ОН или -SH и Z, R1, R2, R3 и R4 имеют вышеуказанные значения, либо вводят во взаимодействие с галогенидом общей формулы В-2, где R означает галоген и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в присутствии основания, как карбонат цезия или гидрид натрия, в растворителе, как диметилформамид, либо вводят во взаимодействие со спиртом общей формулы В-2, где R = OH и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, в условиях реакции Мицунобу (трифенилфосфин, диэтилазодикарбоксилат), в неполярном растворителе, как дихлорметан, получая соединение общей формулы В-3. Соединение общей формулы В-3 превращают в спирт общей формулы В-4 путем обработки восстановителем, как боргидрид натрия, в растворителе, как тетрагидрофуран. Спирт общей формулы В-4 вводят во взаимодействие с метансульфонилхлоридом в присутствии основания, как триэтиламин, в растворителе, как дихлорметан, получая соединение общей формулы В-5. Соединение общей формулы В-5 вводят во взаимодействие с тетрабутиламмонийцианидом в растворителе, как ацетонитрил, получая соединение общей формулы В-6. Соединение общей формулы В-6 вводят во взаимодействие с гидроксиламингидрохлоридом в присутствии основания, как триэтиламин, в растворителе, как тетрагидрофуран и метанол, получая соединение общей формулы В-7. Соединение общей формулы В-7 превращают в продукт общей формулы В-8 путем введения во взаимодействие с фенилхлорформиатом в присутствии основания, как пиридин, и обработки этого промежуточного соединения основанием, как 1,8-диазабицикло[5,4,0]-ундец-7-ен (DBU), в растворителе, как ацетонитрил.
Соединение примера 10 получают в соответствии со способом В.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ С
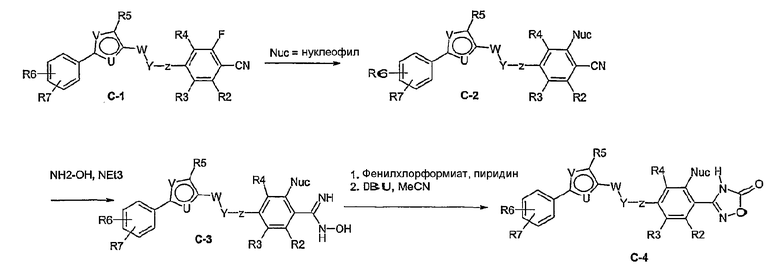
Соединение общей формулы С-1, где R1 = F и U, V, W, Y, Z, R2, R3, R4, R5, R6 и R7 имеют вышеуказанные значения, вводят во взаимодействие с нуклеофилом, например метилатом натрия, получая соединение общей формулы С-2. Соединение общей формулы С-2 вводят во взаимодействие с гидрохлоридом гидроксиламина в присутствии основания, как триэтиламин, в растворителе, как тетрагидрофуран и метанол, получая соединение общей формулы С-3. Соединение общей формулы С-3 превращают в продукт общей формулы С-4 путем введения во взаимодействие с фенилхлорформиатом в присутствии основания, как пиридин, и обработки этого промежуточного продукта основанием, как 1,8-диазабицикло[5,4,0]ундец-7-ен, в растворителе, как ацетонитрил.
Соединения примеров 11, 22 и 23 получают в соответствии со способом С.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ D
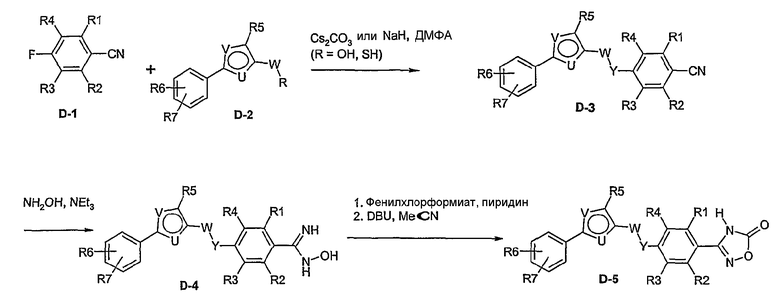
Соединение общей формулы D-2, где R означает -ОН или -SH и U, V, W, R5, R6 и R7 имеют вышеуказанные значения, вводят во взаимодействие с фторнитрилом общей формулы D-1, где R1, R2, R3 и R4 имеют вышеуказанные значения, в присутствии основания, такого как карбонат цезия или гидрид натрия, в растворителе, таком как диметилформамид, получая соединение общей формулы D-3, где U, V, W, R1, R2, R3, R4, R5, R6 и R7 имеют вышеуказанные значения. Если Y = S в соединение общей формулы D-3, то атом серы может быть окислен (Y = SO или Y = SO2) известными в уровне техники способами, например, с помощью окислителя, как м-хлорпероксибензойная кислота, в неполярном растворителе, как дихлорметан. Как описано в способе А, соединение D-3 обрабатывают гидрохлоридом гидроксиламина в присутствии основания, такого как триэтиламин, в растворителе, как тетрагидрофуран и метанол, получая соединение общей формулы D-4. Соединение D-4 превращают в продукт общей формулы D-5 путем введения во взаимодействие с фенилхлорформиатом в присутствии основания, такого как пиридин, и обработки этого промежуточного продукта основанием, таким как 1,8-диазабицикло[5,4,0]ундец-7-ен, в растворителе, как ацетонитрил.
Соединения примеров 15-19, 37-44 и 50 получают в соответствии со способом D.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ Е
Этот способ используют для синтеза элемента структуры Е-4, где U, V, R5, R6 и R7 имеют вышеуказанные значения.
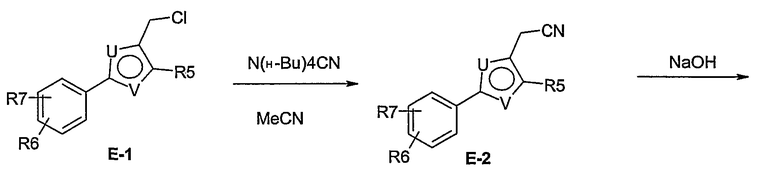
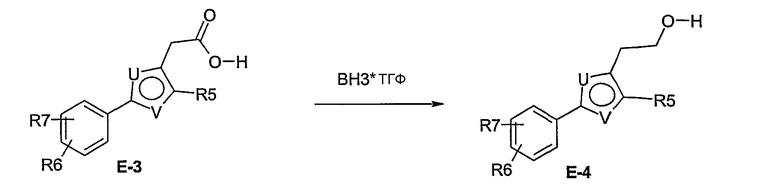
Галогенид общей формулы Е-1, где U, V, R5, R6 и R7 имеют вышеуказанные значения, вводят во взаимодействие с тетрабутил-аммонийцианидом в растворителе, как ацетонитрил, получая соединение общей формулы Е-2. Это соединение общей формулы Е-2 гидролизуют с помощью основания, как гидроксид натрия, получая карбоновую кислоту общей формулы Е-3. Карбоновую кислоту общей формулы Е-3 восстанавливают с помощью восстановителя, например борана, до спирта общей формулы Е-4.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ F
Этот способ используют для синтеза элементов структуры F-5 и F-6, где R5, R6 и R7 имеют вышеуказанные значения и U означает S или О.
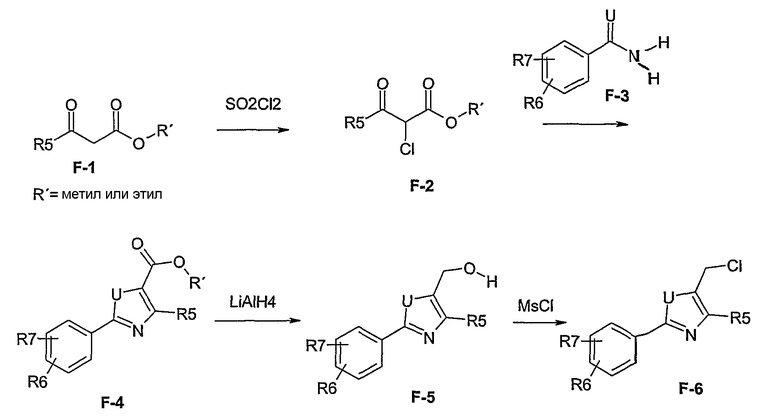
Метиловый или этиловый эфир 3-оксомасляной кислоты общей формулы F-1, где R5 имеет вышеуказанное значение, вводят во взаимодействие с сульфурилхлоридом, получая хлорзамещенное соединение общей формулы F-2. Это соединение общей формулы F-2 вводят во взаимодействие с бензамидом или тиобензамидом общей формулы F-3, где U означает S или O и R7 и R8 имеют вышеуказанные значения, получая сложный эфир фенилтиазола или фенилоксазола общей формулы F-4. Сложный эфир общей формулы F-4 восстанавливают с помощью восстановителя, например литийалюминийгидрида, до спирта общей формулы F-5. Спирт общей формулы F-5 вводят во взаимодействие с метансульфонилхлоридом в присутствии основания, как триэтиламин, в растворителе, как дихлорметан, получая элемент структуры общей формулы F-6, где R5, R6 и R7 имеют вышеуказанные значения.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ G
Этот способ используют для синтеза элемента структуры G-4, где V = S или O и R5, R6 и R7 имеют вышеуказанные значения.

Галогенид общей формулы G-1, где Hal = хлор или бром, R' = метил или этил и R5 имеет вышеуказанное значение, вводят во взаимодействие с бензамидом или тиобензамидом общей формулы G-2, где V = O или S и R6 и R7 имеют вышеуказанные значения, получая сложный эфир общей формулы G-3. Сложный эфир общей формулы G-3 восстанавливают с помощью восстановителя, например литийалюминийгидрида, до спирта общей формулы G-4.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ Н 1
Этот способ используют для синтеза элементов структуры Н-4 и Н-5, где R5, R6 и R7 имеют вышеуказанные значения.
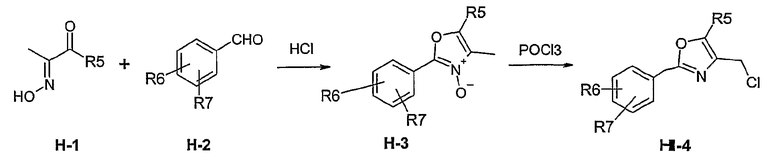

(1: патенты США 10/788997; 10/788996; 10/789017)
В этаноле и при использовании хлороводорода соединение Н-1, где R5 имеет вышеуказанное значение, вводят во взаимодействие с альдегидом Н-2, где R6 и R7 имеют вышеуказанные значения, получая соединение Н-3.
Соединение Н-3 нагревают до температуры кипения с обратным холодильником в фосфорилхлориде, получая соединение Н-4. Его нагревают до температуры кипения с обратным холодильником с иодидом натрия в ацетоне. Таким образом получают соединение Н-5.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ I
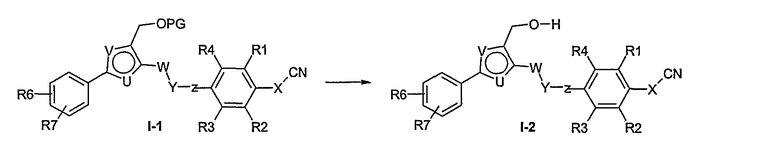
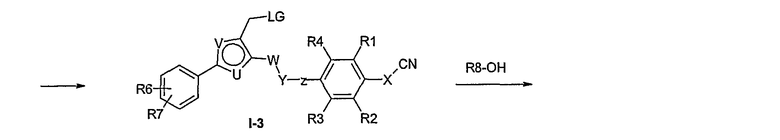
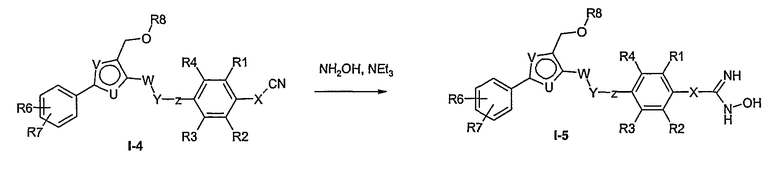
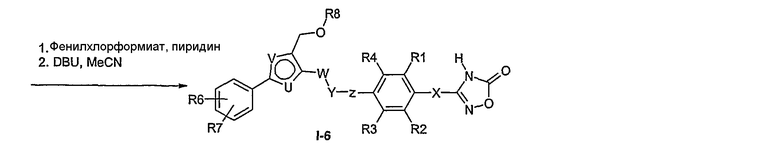
Соединение общей формулы I-1 (которое может быть синтезировано в соответствии со способами А, В и D, где заместитель R5 элементов структуры А-2, В-2 и D-2 означает -СН2-OPG; синтез этих элементов структуры описывается в способах J и К), где X, Y, Z, W, R1, R2, R3, R4, R6 и R7 имеют вышеуказанные значения и PG означает защитную группу, как, например, простой тетрагидропираниловый эфир. Защитную группу соединения общей формулы I-1 удаляют, в случае, когда PG означает простой тетрагидропираниловый эфир, например, путем обработки кислотой в полярном растворителе, как метанол, получая соединение общей формулы I-2. Гидроксильную группу соединения общей формулы I-2 превращают в удаляемую группу (LG), например мезилат, путем обработки метансульфонилхлоридом в присутствии основания, как триэтиламин, в растворителе, как дихлорметан, получая соединение общей формулы I-3. Соединение общей формулы I-3 вводят во взаимодействие со спиртом в присутствии основания, как гидрид натрия, получая соединение общей формулы I-4, где определение -СН2-О-R8 включено в определение R5, как описано выше. Соединение общей формулы I-4 вводят во взаимодействие с гидрохлоридом гидроксиламина в присутствии основания, как триэтиламин, в растворителе, как тетрагидрофуран и метанол, получая соединение общей формулы I-5. Соединение общей формулы I-5 превращают в продукт общей формулы I-6 путем введения во взаимодействие с фенилхлорформиатом в присутствии основания, как пиридин, и обработки этого промежуточного продукта основанием, как 1,8-диазабицикло[5,4,0]ундец-7-ен, в растворителе, как ацетонитрил.
Соединения примеров 33-36 получают в соответствии со способом I.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ J
Этот способ используют для синтеза элементов структуры А-2, В-2 и D-2, где R5 = -CH2-OPG (PG = защитная группа), U означает S или О, W = -СН2, R = -ОН или -Cl и R6 и R7 имеют вышеуказанные значения.
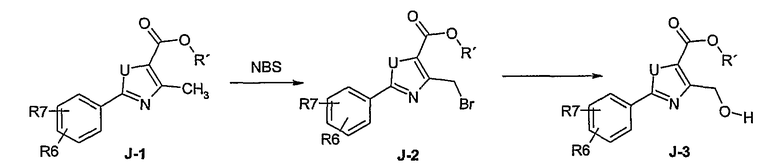
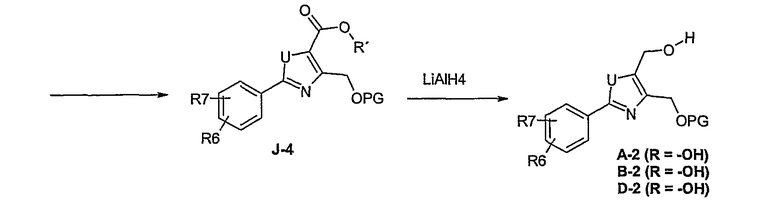
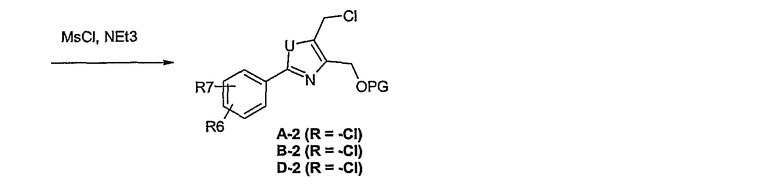
Соединение общей формулы J-1 (которое может быть синтезировано в соответствии со способом F (J-1 составляет часть F-4)), где U означает S или O, R' означает алкил, как метил или этил, и R6 и R7 имеют вышеуказанные значения, бромируют путем обработки N-бромсукцинимидом в неполярном растворителе, как тетрахлорметан, получая соединение общей формулы J-2. Бромид общей формулы J-2 превращают в спирт общей формулы J-3 путем обработки трифторацетатом серебра в растворителе, как диметилформамид, и последующего нагревания полученного трифторацетата в растворителе, как этанол. Гидроксильную группу соединения общей формулы J-2 защищают, например, в виде простого тетрагидропиранильного эфира, путем обработки 3,4-дигидро-2Н-пираном в растворителе, как дихлорметан, в присутствии кислоты, как пиридиний-п-толуолсульфонат, получая соединение общей формулы J-4. Сложный эфир соединения общей формулы J-4 восстанавливают с помощью восстановителя, как литийалюминийгидрид, в растворителе, как тетрагидрофуран, получая соединение общей формулы А-2, В-2 или D-2, где R означает ОН. Гидроксильная группа может быть превращена в хлор путем обработки метансульфонилхлоридом в присутствии основания, как триэтиламин, в растворителе, как дихлорметан, получая соединение общей формулы A-2, B-2 или D-2, где R означает Cl.
Другие соединения могут быть получены соответственным образом или известными способами.
Способ К
Этот способ используют для синтеза элементов структуры А-2, В-2 и D-2, где R5 = -CH2-OPG (PG = защитная группа), V означает N и U означает O, W = -CH2-, R = -OH или -Cl и R6 и R7 имеют вышеуказанные значения.
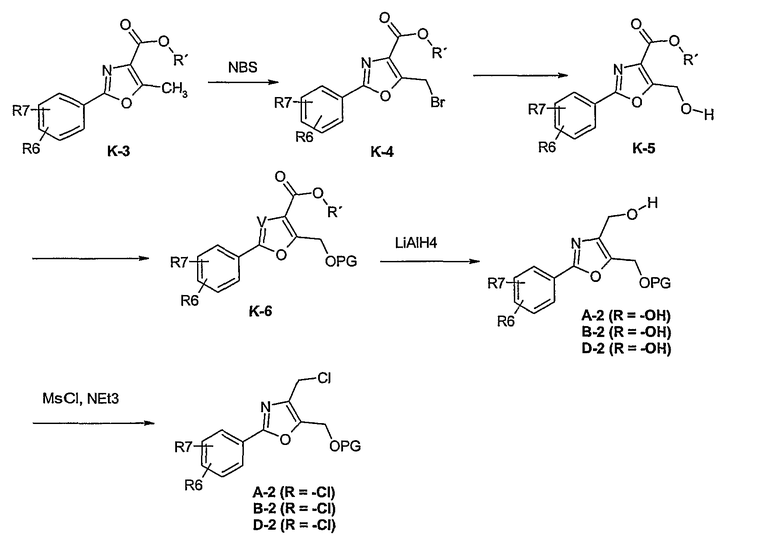
Метил-2-диазо-3-оксобутаноат (R' = метил) или этил-2-диазо-3-оксобутаноат (R' = этил) вводят во взаимодействие с бензамидом общей формулы К-1, где R6 и R7 имеют вышеуказанные значения, в присутствии диродийтетраацетата в неполярном растворителе, как 1,2-дихлорэтан, получая соединение общей формулы К-2. Соединение общей формулы К-2 циклизуют путем обработки трифенилфосфином и иодом в неполярном растворителе, как дихлорметан, получая соединение общей формулы К-3. Соединение общей формулы К-3 бромируют путем обработки N-бромсукцинимидом в неполярном растворителе, как тетрахлорметан, получая соединение общей формулы К-4. Бромид общей формулы К-4 превращают в спирт общей формулы К-5 путем обработки трифторацетатом серебра в растворителе, как диметилформамид, и последующего нагревания полученного трифторацетата в растворителе, как этанол. Гидроксильную группу соединения общей формулы К-5 защищают, например, в виде простого тетрагидропиранильного эфира, путем обработки 3,4-дигидро-2Н-пираном в растворителе, как дихлорметан, в присутствии кислоты, как пиридиний-п-толуолсульфонат, получая соединение общей формулы К-6. Сложный эфир соединения общей формулы К-6 восстанавливают восстановителем, как литийалюминийгидрид, в растворителе, как тетрагидрофуран, получая соединение общей формулы А-2, В-2 или D-2, где R означает ОН. Гидроксильная группа может быть превращена в хлор путем обработки метансульфонилхлоридом в присутствии основания, как триэтиламин, в растворителе, как дихлорметан, получая соединение общей формулы А-2, В-2 или D-2, где R означает Cl.
Список сокращений:
Дальнейшие соединения формулы (I) могут быть получены соответственным образом или известными способами.
Ниже описываются экспериментальные методики для получения соединений примеров, указанных выше.
Синтез элемента структуры в соответствии со способом F:
4-Бутил-5-хлорметил-2-(4-трифторметилфенил)тиазол
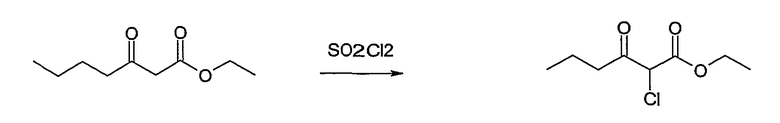
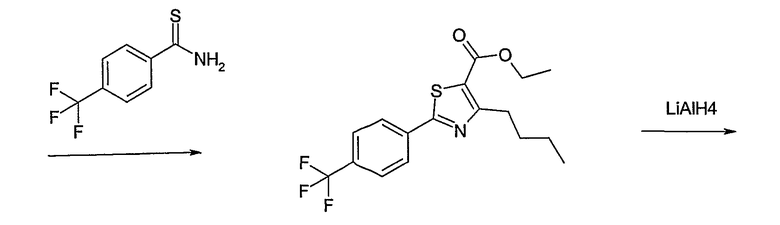
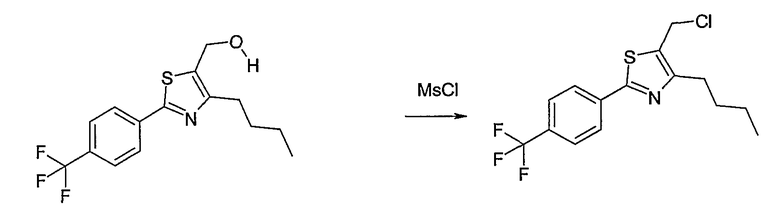
Метиловый эфир 4-бутил-2-(4-трифторметилфенил)тиазол-5-карбоновой кислоты
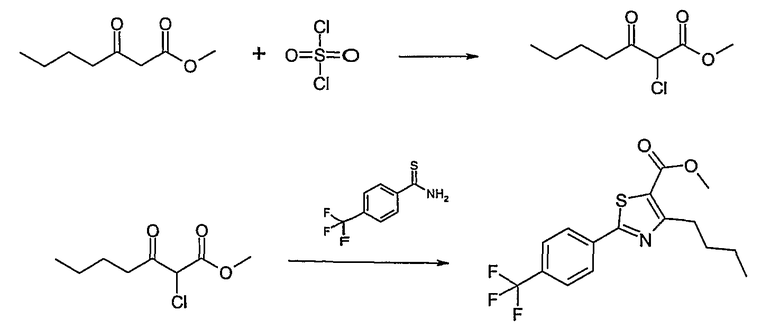
5,0 г Метилового эфира 3-оксогептановой кислоты растворяют в 80 мл безводного дихлорметана и добавляют 2,82 мл сульфурилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 30 минут. Добавляют 20 мл воды и реакционную смесь экстрагируют пять раз порциями по 30 мл дихлорметана. Объединенные органические экстракты промывают водой, насыщенным раствором NaHCO3 и рассолом и сушат над сульфатом магния. Растворитель удаляют при пониженном давлении, получая 6,0 г метилового эфира 2-хлор-3-оксогептановой кислоты в виде сырого вещества. Это вещество используют без дальнейшей очистки. 6,0 г Метилового эфира 2-хлор-3-оксогептановой кислоты растворяют в 50 мл этанола и добавляют 6,4 г 4-(трифторметил)тиобензамида. Реакционную смесь кипятят с обратным холодильником в течение ночи. Растворитель удаляют при пониженном давлении и остаток очищают хроматографией с помощью смеси н-гептан:этилацетат = 100:1 => 60:1 в качестве элюента. Таким образом получают 7,4 г метилового эфира 4-бутил-2-(4-трифторметилфенил)тиазол-5-карбоновой кислоты в виде масла желтого цвета.
С16Н16F3NO2S (343,37); MC(ESI): 344,1 (M+H+);
Rf (н-гептан:этилацетат = 4:1) = 0,62.
[4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанол
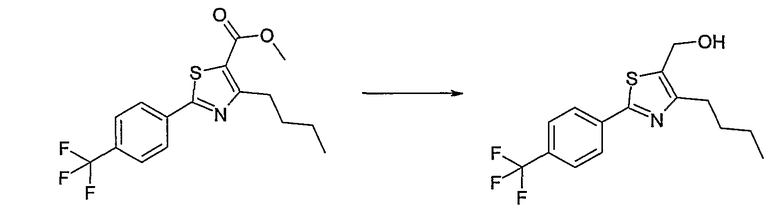
1,2 г Литийалюминийгидрида растворяют в 100 мл тетрагидрофурана. Добавляют 5,3 г метилового эфира 4-бутил-2-(4-трифторметилфенил)тиазол-5-карбоновой кислоты, растворенные в 100 мл тетрагидрофурана. Реакционную смесь перемешивают при комнатной температуре в течение одного часа, затем добавляют 50 мл насыщенного раствора хлорида аммония и 50 мл 1М раствора соляной кислоты. Реакционную смесь экстрагируют пять раз порциями по 60 мл этилацетата. Объединенные органические слои сушат над сульфатом магния и растворитель удаляют при пониженном давлении, получая 4,6 г [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола в виде масла желтого цвета, которое затвердевает при стоянии при комнатной температуре.
С15H16F3NOS (315,36); MC(ESI): 316,4 (M+H+).
4-Бутил-5-хлорметил-2-(4-трифторметилфенил)тиазол
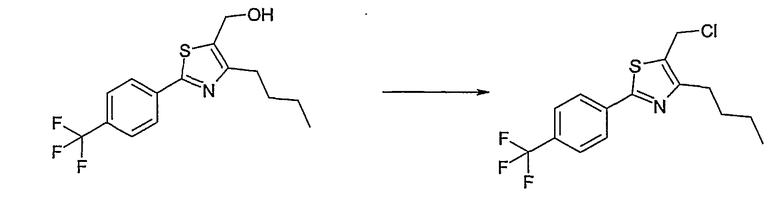
1,0 г [4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола растворяют в 50 мл дихлорметана, добавляют 0,88 мл триэтиламина и 0,39 мл метансульфонилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение трех часов, затем добавляют 100 мл дихлорметана и реакционную смесь промывают 50 мл насыщенного раствора NaHCO3, воды и рассола. Органический слой сушат над сульфатом магния и растворитель удаляют при пониженном давлении. Таким образом получают 1,0 г 4-бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола в виде масла желтого цвета.
С15Н15ClF3NS (333,81); MC(ESI): 334,3 (M+H+).
[4-Бут-3-енил-2-(4-трифторметилфенил)тиазол-5-ил]метанол
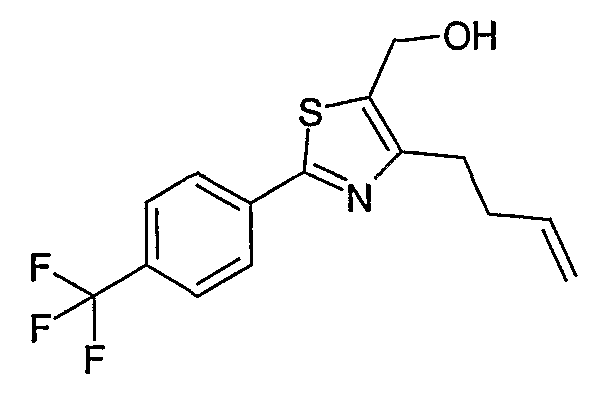
В соответствии со способом, описанным для получения [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола, [4-бут-3-енил-2-(4-трифторметилфенил)тиазол-5-ил]метанол получают из этилового эфира 3-оксогепт-6-еновой кислоты и 4-(трифтор)тиобензамида.
С15Н14F3NOS (313,34); MC(ESI): 312 (M-H+).
[4-(3-Бензилоксипропил)-2-(4-трифторметилфенил)тиазол-5-ил]метанол
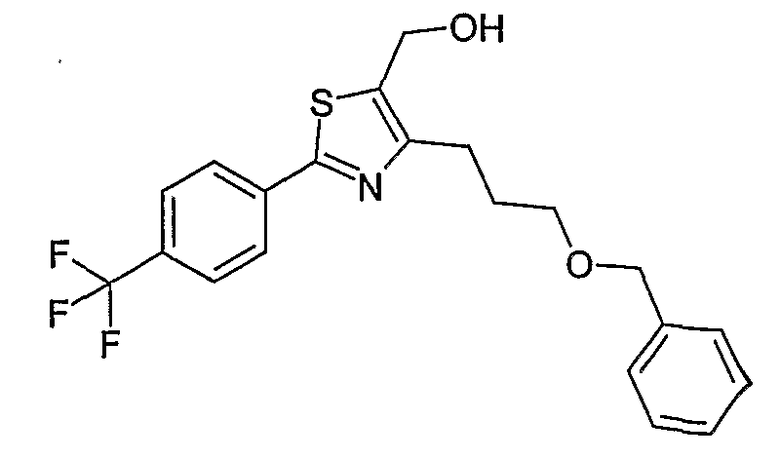
В соответствии со способом, описанным для получения [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола, [4-(3-бензилоксипропил)-2-(4-трифторметилфенил)тиазол-5-ил]метанол получают из известного метилового эфира 6-бензилокси-3-оксогексановой кислоты и 4-(трифтор)тиобензамида.
С21Н20F3NO2S (407,45); MC(ESI): 408 (M+H+).
4-Бутил-5-хлорметил-2-(4-пентафторсульфанилфенил)тиазол
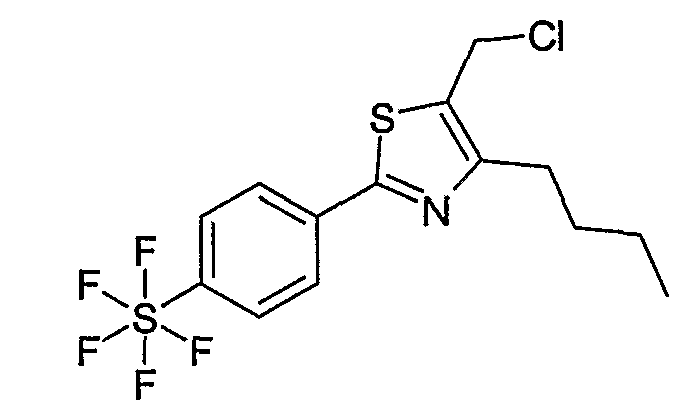
В соответствии со способом, описанным для получения 4-бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола, 4-бутил-5-хлорметил-2-(4-пентафторсульфанилфенил)тиазол получают из коммерчески доступного метилового эфира 3-оксогептановой кислоты и 4-(пентафторсульфанил)тиобензамида.
С14Н15ClF5NS2 (391,86); MC(ESI): 392,3 (M+H+).
5-Хлорметил-4-метил-2-(4-пентафторсульфанилфенил)тиазол
В соответствии со способом, описанным для получения 4-бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола, 5-хлорметил-4-метил-2-(4-пентафторсульфанилфенил)тиазол получают из коммерчески доступного этил-2-хлорацетоацетата и 4-(пентафторсульфанил)тиобензамида.
С11Н9ClF5NS2 (349,77); MC(ESI): 350,4 (M+H+).
Этиловый эфир 2-(4-метоксифенил)-4-метилоксазол-5-карбоновой кислоты
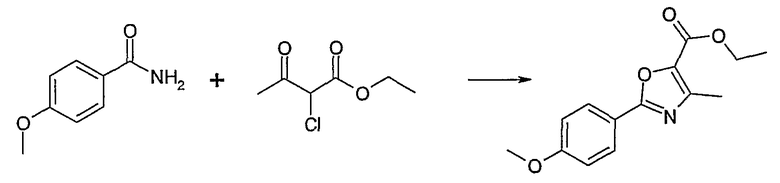
40,0 г 4-Метоксибензамида растворяют в 400 мл этанола. Смесь нагревают до температуры 50°С и в одну порцию добавляют 48,8 мл этил-2-хлорацетоацетата. Полученную смесь кипятят с обратным холодильником в течение четырех дней. Реакционную смесь охлаждают и растворитель удаляют при пониженном давлении. Полученный остаток очищают флэш-хроматографией на силикагеле, получая 23,5 г этилового эфира 2-(4-метоксифенил)-4-метилоксазол-5-карбоновой кислоты в виде твердого вещества.
С14Н15NO4 (261,28); MC(ESI): 262,1 (M+H+).
Синтез элемента структуры в соответствии со способом Е:
2-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]этанол
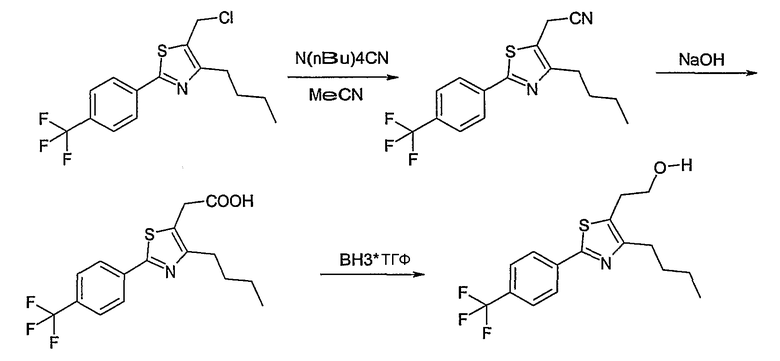
[4-Бутил-2-(4-(трифторметилфенил)тиазол-5-ил]ацетонитрил
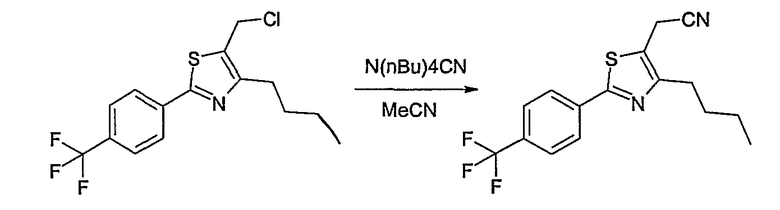
3,0 г 4-Бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола растворяют в 50 мл ацетонитрила. К этому раствору добавляют 2,89 г тетрабутиламмонийцианида. Реакционную смесь перемешивают при комнатной температуре в течение тридцати минут. Затем добавляют смесь из насыщенного раствора NaHCO3, льда и этилацетата. Водную фазу отделяют и экстрагируют три раза порциями по 30 мл этилацетата. Объединенные органические слои промывают ледяной водой и рассолом и сушат над сульфатом магния. Растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией при использовании смеси н-гептан:этилацетат = 5:1 в качестве элюента, получая 1,1 г [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]ацетонитрила в виде масла.
С16Н15F3N2S (324,37); МC(ESI): 325,3 (M+H+);
Rf (н-гептан:этилацетат = 4:1) = 0,32.
[4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]уксусная кислота
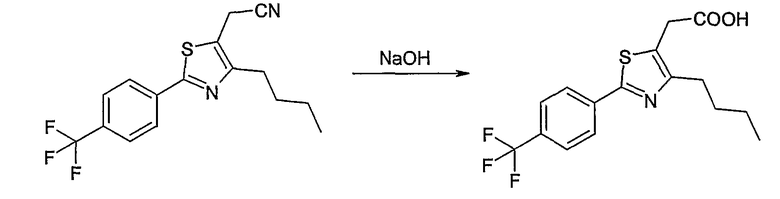
1,1 г [4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]ацетонитрила растворяют в смеси из 1 мл воды и 6 мл изопропанола. Добавляют 1,36 г гидроксида натрия и смесь нагревают до температуры 100°С. Спустя три часа охлажденную реакционную смесь нейтрализуют концентрированной соляной кислотой и экстрагируют три раза порциями по 50 мл этилацетата. Объединенные органические экстракты сушат над сульфатом магния и растворитель удаляют в вакууме, получая 1,15 г сырой [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]уксусной кислоты в виде масла коричневого цвета. Это вещество используют без дальнейшей очистки.
С16Н16F3NO2S (343,37); MC(ESI): 344,4 (M+H+).
2-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]этанол
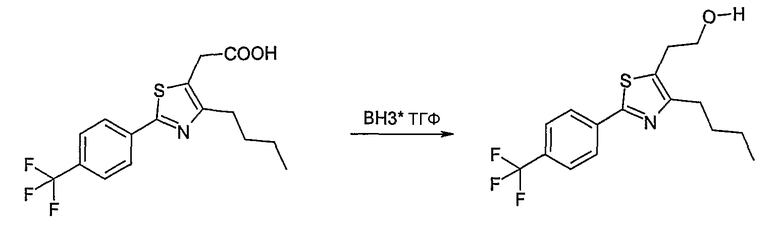
1,15 г Сырой [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]уксусной кислоты растворяют в 50 мл тетрагидрофурана и охлаждают на бане со льдом до температуры 0°С. При температуре 0°С добавляют 9,3 мл 1М раствора борантетрагидрофуранового комплекса. Реакционную смесь нагревают до температуры 55°С и перемешивают в течение одного часа при этой температуре. Реакционную смесь охлаждают на бане со льдом и добавляют 50 мл воды. Добавляют органический слой. Тетрагидрофуран удаляют в вакууме и остаток экстрагируют три раза порциями по 80 мл этилацетата. Объединенные органические слои промывают рассолом, сушат над сульфатом магния и растворитель удаляют в вакууме, получая 1,1 г сырого 2-[4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]этанола в виде масла коричневого цвета. Вещество используют без дальнейшей очистки.
C16H18F3NOS (329,39), MC(ESI): 330,4 (M+H+).
Синтез элемента структуры в соответствии со способом G:
2-[5-Метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]этанол
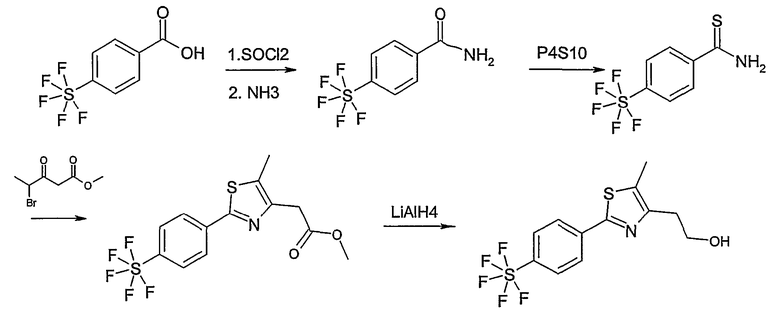
4-Пентафторсульфанилбензамид
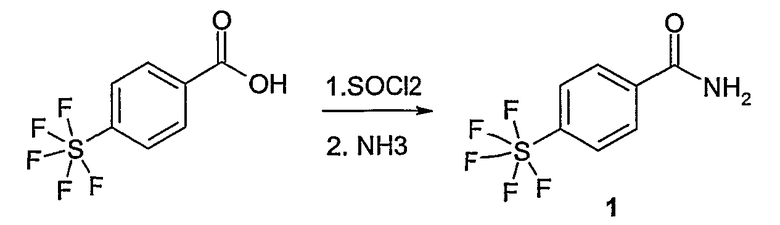
20 г 4-Пентафторсульфанилбензойной кислоты кипятят с обратным холодильником в 300 мл тионилхлорида в течение трех часов. Тионилхлорид удаляют при пониженном давлении, полученный остаток растворяют в 100 мл тетрагидрофурана. Этот раствор по каплям добавляют к 80 мл концентрированного раствора аммиака. Растворитель удаляют в вакууме и полученный остаток растворяют в 300 мл воды и экстрагируют три раза порциями по 250 мл этилацетата. Объединенные органические слои сушат над сульфатом магния и растворитель удаляют в вакууме, получая 24,5 г 4-пентафторсульфанилбензамида в виде твердого вещества желтого цвета. Это вещество используют без дальнейшей очистки.
С7Н6F5NOS (247,19); MC(ESI): 248 (M+H+).
4-Пентафторсульфанилтиобензамид
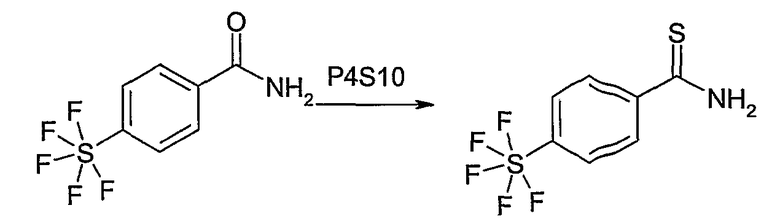
9 г Пентасульфида фосфора растворяют в 300 мл толуола. Добавляют 16,8 г NaHCO3 и смесь кипятят с обратным холодильником в течение тридцати минут. Затем добавляют 25,2 г 4-пентафторсульфанилбензамида, растворенные в 200 мл толуола, и реакционную смесь перемешивают при температуре 90°С в течение трех часов. Растворитель удаляют в вакууме и полученный остаток растворяют в 300 мл рассола и экстрагируют три раза порциями по 250 мл дихлорметана. Объединенные органические слои сушат над сульфатом магния и растворитель удаляют в вакууме, получая 17,4 г 4-пентафторсульфанилтиобензамида в виде твердого вещества желтого цвета.
С7Н6F5NS2 (263,25); MC(ESI): 264 (M+H+).
Этиловый эфир [5-метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]уксусной кислоты
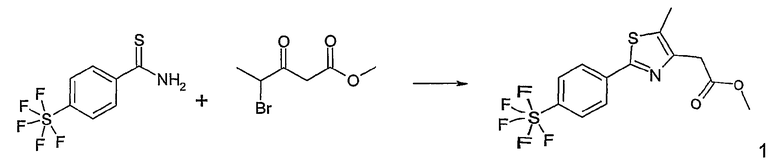
12,0 г 4-Пентафторсульфанилтиобензамида и 9,93 г метилового эфира 4-бром-3-оксопентановой кислоты растворяют в 30 мл ацетона и кипятят с обратным холодильником в течение одного часа. Охлажденную реакционную смесь разбавляют путем добавления 250 мл этилацетата и промывают три раза насыщенным раствором NaHCO3. Органический слой сушат над сульфатом магния и растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией при использовании смеси н-гептан:этилацетат = 5:1 в качестве элюента, получая 4,5 г этилового эфира [5-метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]уксусной кислоты в виде масла, которое затвердевает при стоянии.
С13Н12F5NO2S2 (373,37), MC(ESI): 374 (M+H+).
2-[5-Метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]этанол
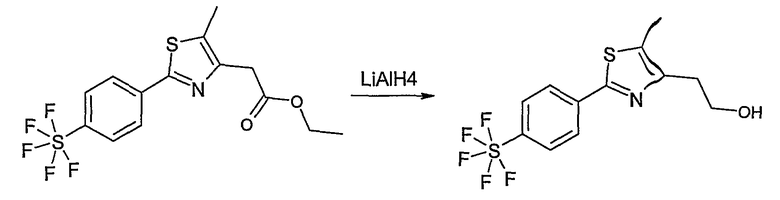
458 мг Литийалюминийгидрида суспендируют в 100 мл безводного тетрагидрофурана и охлаждают на бане со льдом. К этой охлажденной льдом суспензии добавляют 4,5 г этилового эфира [5-метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]уксусной кислоты, растворенные в 50 мл тетрагидрофурана. Реакционную смесь перемешивают в течение одного часа. Затем добавляют 300 мл этилацетата и 20 мл насыщенного раствора NH4Cl. Органический слой отделяют. Водную фазу экстрагируют три раза порциями по 50 мл этилацетата. Объединенные органические слои сушат над сульфатом магния и растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией при использовании смеси н-гептан:этилацетат = 2:1 в качестве элюента, получая 1,44 г 2-[5-метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]этанола в виде масла, которое затвердевает при стоянии.
С12Н12F5NOS2 (345,36); MC(ESI): 346 (M+H+).
Синтез элемента структуры в соответствии со способом Н:
4-Иодметил-2-(4-метоксифенил)-5-метилоксазол
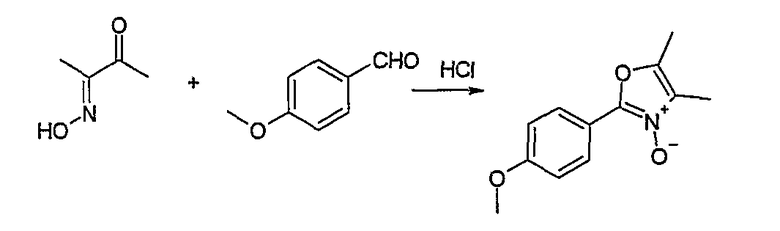
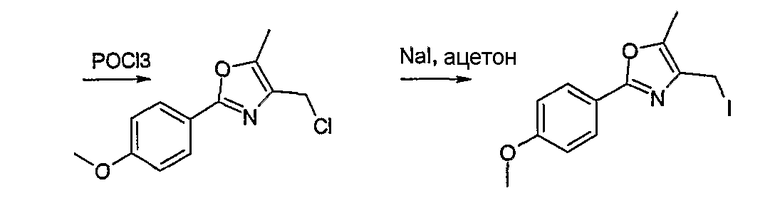
2-(4-Метоксифенил)-4,5-диметилоксазол-3-оксид
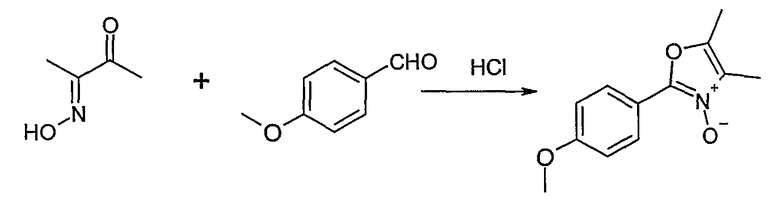
50,6 г Диацетилмоноксима и 66,7 мл 4-метоксибензальдегида добавляют к 100 мл ледяной уксусной кислоты и в течение 30 минут при охлаждении льдом вводят газообразный HCl. Продукт осаждают в виде гидрохлорида путем добавления метил-трет-бутилового эфира и отфильтровывают путем отсасывания и осадок промывают метил-трет-бутиловым эфиром. Осадок суспендируют в воде и значение рН доводят до щелочного, используя аммиак. Смесь экстрагируют три раза, используя в каждом случае 200 мл дихлорметана, объединенные органические фазы сушат над сульфатом магния и растворитель затем удаляют при пониженном давлении. Таким образом получают 82,1 г 2-(4-метоксифенил)-4,5-диметилоксазол-3-оксида в виде твердого вещества белого цвета.
С12Н13NO3 (219,24); MC(ESI) = 220 (M+H+).
4-Хлорметил-2-(4-метоксифенил)-5-метилоксазол
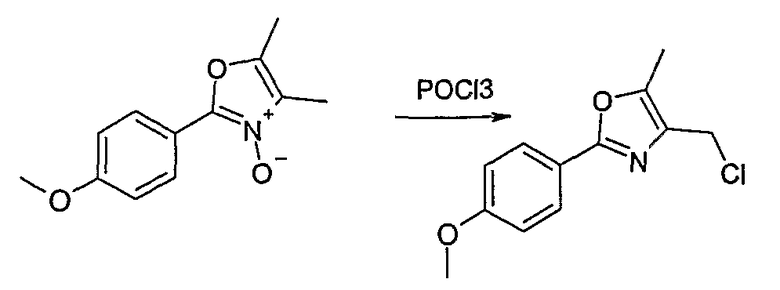
82 г 2-(4-метоксифенил)-4,5-диметилоксазол-3-оксида растворяют в 400 мл хлороформа, добавляют 37,4 мл оксихлорида фосфора и смесь кипятят с обратным холодильником в течение 30 минут. Реакционную смесь охлаждают до температуры 0°С, значение рН доводят до слегка щелочного, используя аммиак, и смесь экстрагируют три раза, используя в каждом случае 100 мл этилацетата. Объединенные органические фазы промывают водой и сушат над сульфатом магния и растворитель затем удаляют при пониженном давлении. Остаток очищают на силикагеле, используя подвижную фазу н-гептан:этилацетат = 80:1=>5:1. Таким образом получают 46,3 г 4-хлорметил-2-(4-метоксифенил)-5-метилоксазола в виде твердого вещества желтого цвета.
С12Н12ClNO2 (237,69); MC(ESI) = 238 (M+H+);
Rf (н-гептан:этилацетат = 7:3) = 0,45.
4-Иодметил-2-(4-метоксифенил)-5-метилоксазол
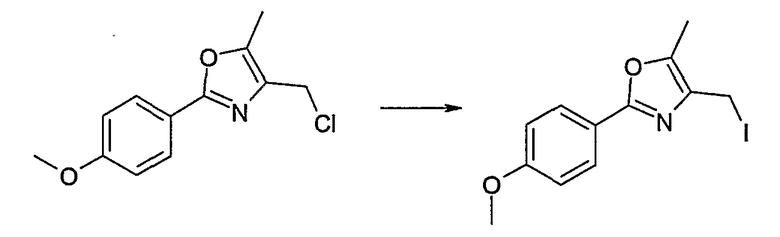
19,9 г 4-Хлорметил-2-(4-метоксифенил)-5-метилоксазола вместе с 37,7 г иодида натрия в 300 мл ацетона кипятят с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси растворитель удаляют при пониженном давлении и остаток растворяют в 300 мл метил-трет-бутилового эфира, смесь промывают три раза насыщенным раствором NaHCO3 и сушат над сульфатом магния и растворитель затем удаляют при пониженном давлении. Таким образом получают 49,8 г 4-иодметил-2-(4-метоксифенил)-5-метилоксазола в виде твердого вещества слегка коричневого цвета.
С12Н12INO2 (329,14); MC(ESI): 330 (M+H+).
4-Иодметил-5-метил-2-п-бифенилоксазол
Аналогично синтезу элемента структуры 4-иодметил-2-(4-метоксифенил)-5-метилоксазола, при использовании диацетилмоноксима и п-бифенилкарбальдегида получают 4-иодметил-5-метил-2-п-бифенилоксазол.
С12Н12INO (375,21); MC(ESI): 376 (M+H+).
Синтез элемента структуры в соответствии со способом J:
[2-(4-Метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанол и 5-хлорметил-2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол
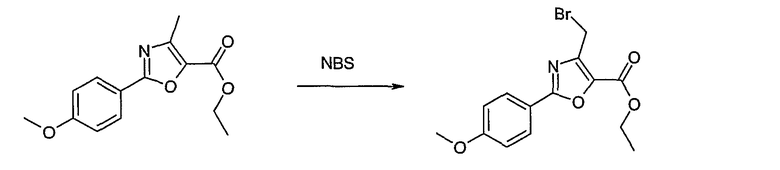

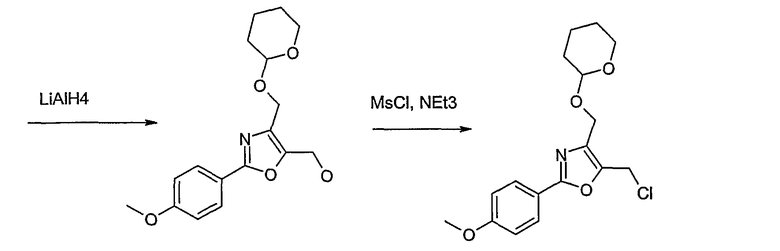
Этиловый эфир 4-бромметил-2-(4-метоксифенил)оксазол-5-карбоновой кислоты

К кипящему раствору 23,5 г этилового эфира 2-(4-метоксифенил)-4-метилоксазол-5-карбоновой кислоты в 250 мл тетрахлорметана порциями добавляют смесь 5,92 г 2,2'-азобис(2-метилпропионитрила) и 19,3 г N-бромсукцинимида. Реакционную смесь кипятят с обратным холодильником в течение семи часов. Охлажденную реакционную смесь фильтруют через слой целита и растворитель удаляют в вакууме, получая 30,7 г сырого этилового эфира 4-бромметил-2-(4-метоксифенил)оксазол-5-карбоновой кислоты. Вещество используют без дальнейшей очистки на ближайшей стадии.
С14Н14BrNO4 (340,18); MC(ESI): 340,0 и 342,0 (M+H+);
Rf (этилацетат:н-гептан = 7:3) = 0,43.
Этиловый эфир 4-гидроксиметил-2-(4-метоксифенил)оксазол-5-карбоновой кислоты
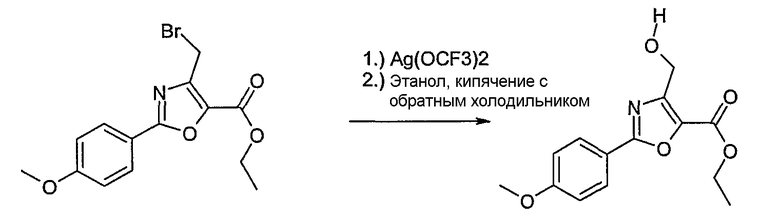
30,7 г Сырого этилового эфира 4-бромметил-2-(4-метоксифенил)оксазол-5-карбоновой кислоты растворяют в 170 мл безводного диметилформамида. Добавляют 29,95 г трифторацетата серебра и смесь перемешивают при комнатной температуре в течение ночи. Добавляют 100 мл рассола и смесь перемешивают в течение одного часа. Реакционную смесь фильтруют через слой целита, растворитель удаляют в вакууме и полученный остаток растворяют в 200 мл этанола. Смесь кипятят с обратным холодильником в течение трех часов. Затем растворитель удаляют в вакууме и остаток растворяют в воде и экстрагируют пять раз этилацетатом. Объединенные органические слои сушат над сульфатом магния, растворитель удаляют в вакууме и остаток очищают флэш-хроматографией на силикагеле (элюируя смесью н-гептан:этилацетат = 5:1 => этилацетат), получая 17,8 г этилового эфира 4-гидроксиметил-2-(4-метоксифенил)оксазол-5-карбоновой кислоты в виде твердого вещества.
С14Н15NO5 (277,28); MC(ESI): 278,1 (M+H+);
Rf (этилацетат:н-гептан = 1:2) = 0,11.
Этиловый эфир 2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-карбоновой кислоты

10,0 г Этилового эфира 4-гидроксиметил-2-(4-метоксифенил)оксазол-5-карбоновой кислоты растворяют в 85 мл дихлорметана. Добавляют 4,0 мл 3,4-дигидро-2Н-пирана и 1,85 мг пиридиний-п-толуолсульфоната и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют в вакууме и остаток очищают флэш-хроматографией на силикагеле (элюируя смесью н-гептан:этилацетат = 4:1 => 1:1), получая 12,3 г этилового эфира 2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-карбоновой кислоты в виде масла.
С19Н23NO6 (361,40); MC(ESI): 362,2 (M+H+), 278,2 (M-THP+H+);
Rf (этилацетат:н-гептан = 1:1) = 0,56.
[2-(4-Метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанол
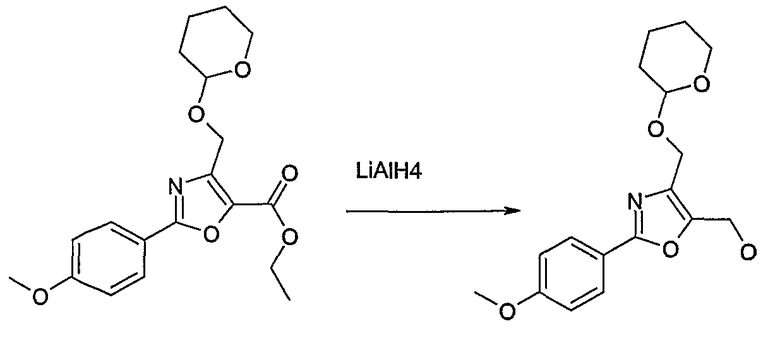
К охлажденной суспензии 2,73 г литийалюминийгидрида в 180 мл тетрагидрофурана при температуре 0°С добавляют раствор 12,3 г этилового эфира 2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-карбоновой кислоты в 120 мл тетрагидрофурана. Баню со льдом удаляют и реакционную смесь перемешивают при комнатной температуре в течение одного часа. Реакционную смесь снова охлаждают на бане со льдом и добавляют 100 мл этилацетата с последующим добавлением 300 мл метил-трет-бутилового эфира. Затем добавляют раствор 10,92 г гидроксида натрия в 12,3 мл воды. Твердый осадок отфильтровывают при использовании слоя целита. Фильтрат сушат над сульфатом магния и затем растворитель удаляют в вакууме, получая 11,8 г [2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола в виде твердого вещества.
С17Н21NO5 (319,36); MC(ESI): 320,2 (M+H+);
Rf (этилацетат:н-гептан = 1:1) = 0,18.
5-Хлорметил-2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол
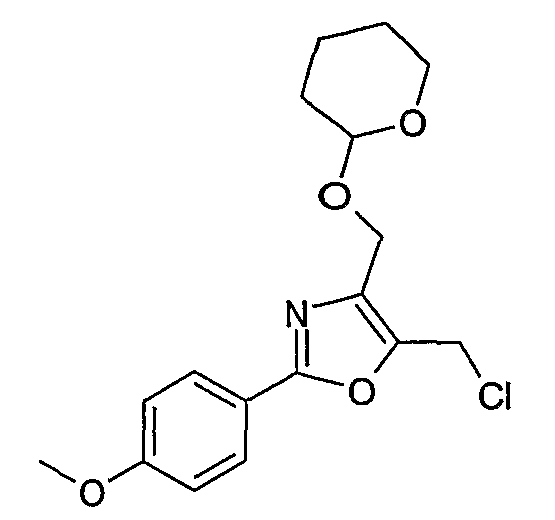
2,0 г [2-(4-Метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола растворяют в 30 мл дихлорметана и охлаждают на бане со льдом. Добавляют 0,88 мл триэтиламина с последующим добавлением 0,49 мл метансульфонилхлорида. Баню со льдом удаляют и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь затем промывают водой и рассолом, сушат над сульфатом магния и растворитель удаляют в вакууме, получая 2,5 г 5-хлорметил-2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазола в виде масла, которое используют без дальнейшей очистки.
С17Н20ClNO4 (337,81); MC(ESI): 338,2 (M+H+);
Rf (этилацетат:н-гептан = 1:1) = 0,42.
Синтез элемента структуры в соответствии со способом К:
[2-(4-Метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-ил]метанол и 2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-илметиловый эфир метансульфокислоты
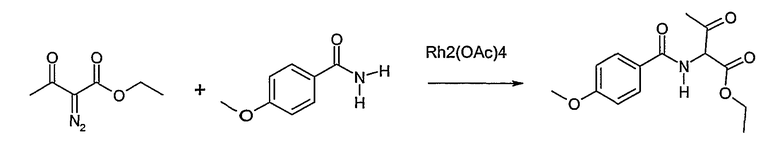

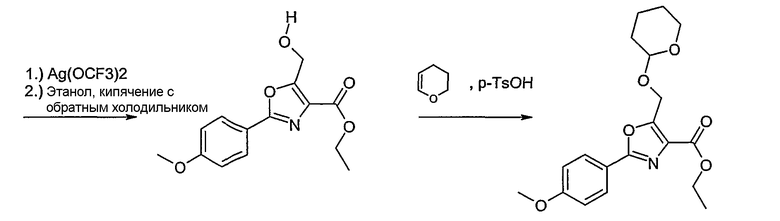
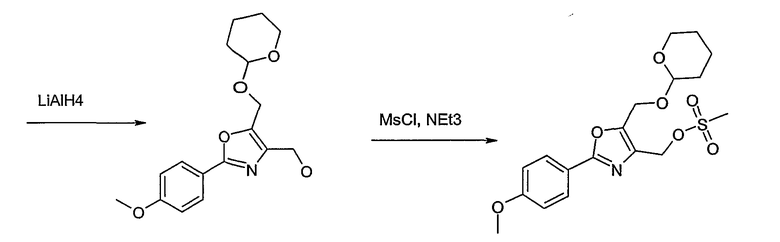
Этиловый эфир 2-(4-метоксибензоиламино)-3-оксомасляной кислоты
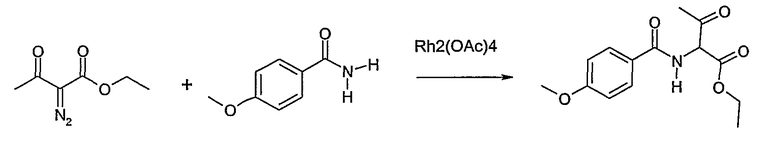
Раствор 12,1 г этил-2-диазо-3-оксобутаноата2 (2: J. Chem. Soc., Perkin Trans., 1, 591-600 (1998)) в 100 мл 1,2-дихлорметана в течение 5 часов по каплям добавляют к кипящему раствору 9,0 г 4-метоксибензамида и 1,05 г димера ацетата родия(II) в 200 мл безводного 1,2-дихлорэтана. Смесь кипятят с обратным холодильником в течение тридцати минут, затем охлаждают, выпаривают в вакууме и очищают флэш-хроматографией на силикагеле, получая 11,3 г этилового эфира 2-(4-метоксибензоиламино)-3-оксомасляной кислоты.
С14Н17NO5 (279,30); MC(ESI): 280,2 (M+H+);
Rf (этилацетат:н-гептан = 1:1) = 0,32.
Этиловый эфир 2-(4-метоксифенил)-5-метилоксазол-4-карбоновой кислоты
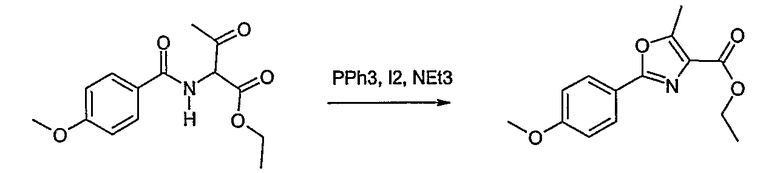
23,2 мл Триэтиламина и раствор 11,3 г этилового эфира 2-(4-метоксибензоиламино)-3-оксомасляной кислоты в 200 мл дихлорметана последовательно добавляют к перемешиваемому раствору 20,5 г иода и 21,2 г трифенилфосфина в 500 мл дихлорметана. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают в вакууме и полученный остаток очищают флэш-хроматографией на силикагеле, получая 6,0 г этилового эфира 2-(4-метоксифенил)-5-метилоксазол-4-карбоновой кислоты в виде твердого вещества бледно-желтого цвета.
С14Н15NO4 (261,28); MC(ESI): 262,2 (M+H+);
Rf (этилацетат:н-гептан = 2:1) = 0,31.
Этиловый эфир 5-бромметил-2-(4-метоксифенил)оксазол-4-карбоновой кислоты
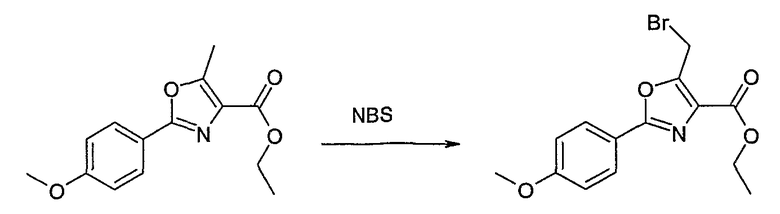
К кипящему раствору 6,0 г этилового эфира 2-(4-метоксифенил)-5-метилоксазол-4-карбоновой кислоты в 100 мл тетрахлорметана порциями добавляют смесь из 1,51 г 2,2'-азобис(2-метилпропионитрила) и 4,9 г N-бромсукцинимида. Реакционную смесь кипятят с обратным холодильником в течение трех часов. Охлажденную реакционную смесь фильтруют через слой целита и растворитель удаляют в вакууме, получая 10,6 г сырого этилового эфира 5-бромметил-2-(4-метоксифенил)оксазол-4-карбоновой кислоты, который содержит некоторое количество дибромированного побочного продукта. Вещество используют без дальнейшей очистки на ближайшей стадии.
С14Н14BrNO4 (340,18); MC(ESI): 340,0 и 342,0 (M+H+);
Rf (этилацетат:н-гептан = 2:1) = 0,27.
Этиловый эфир 5-гидроксиметил-2-(4-метоксифенил)оксазол-4-карбоновой кислоты
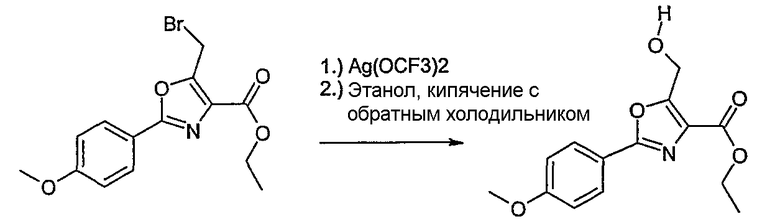
8,0 г Этилового эфира 5-бромметил-2-(4-метоксифенил)оксазол-4-карбоновой кислоты растворяют в 50 мл безводного диметилформамида. Добавляют 7,8 г трифторацетата серебра и смесь перемешивают при комнатной температуре в течение двух часов. Добавляют 30 мл рассола и смесь перемешивают в течение двух часов. Реакционную смесь фильтруют через слой целита, растворитель удаляют в вакууме и полученный остаток растворяют в 200 мл этанола. Смесь кипятят с обратным холодильником в течение трех часов. Затем растворитель удаляют в вакууме и остаток растворяют в воде и экстрагируют пять раз этилацетатом. Объединенные органические слои сушат над сульфатом магния, растворитель удаляют в вакууме и остаток очищают флэш-хроматографией на силикагеле (элюируя смесью н-гептан:этилацетат = 2:3 => этилацетат), получая 4,8 г этилового эфира 5-гидроксиметил-2-(4-метоксифенил)оксазол-4-карбоновой кислоты в виде твердого вещества.
С14Н15NO5 (277,28); MC(ESI): 278,1 (M+H+);
Rf (этилацетат:н-гептан = 1:2) = 0,09.
Этиловый эфир 2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-карбоновой кислоты
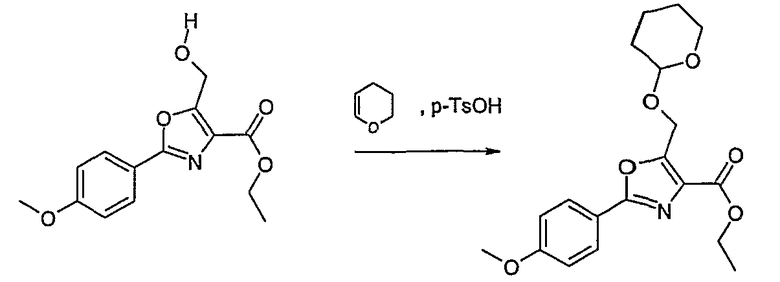
4,8 г Этилового эфира 5-гидроксиметил-2-(4-метоксифенил)оксазол-4-карбоновой кислоты растворяют в 75 мл дихлорметана. Добавляют 1,9 мл 3,4-дигидро-2Н-пирана и 870 мг пиридиний-п-толуолсульфоната и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют в вакууме и остаток очищают флэш-хроматографией на силикагеле (элюируя смесью н-гептан:этилацетат = 3:1 => 1:1), получая 5,3 г этилового эфира 2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-карбоновой кислоты.
С19Н23NO6 (361,40); MC(ESI): 362,2 (M+H+), 278,1 (M-THP+H+).
[2-(4-Метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-ил]метанол

5,3 г Этилового эфира 2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-карбоновой кислоты растворяют в 100 мл тетрагидрофурана и охлаждают на бане со льдом. Добавляют 21,8 мл 1М раствора литийалюминийгидрида в тетрагидрофуране. Баню со льдом удаляют и реакционную смесь перемешивают при комнатной температуре в течение тридцати минут. Реакционную смесь снова охлаждают на бане со льдом и последовательно добавляют 6 мл воды, 12 мл 15%-ного раствора NaOH и 18 мл воды. После перемешивания в течение одного часа при комнатной температуре реакционную смесь фильтруют через слой целита и промывают этилацетатом. Фильтрат сушат над сульфатом магния и растворитель удаляют в вакууме и остаток очищают флэш-хроматографией на силикагеле (элюируя смесью н-гептан:этилацетат = 6:4 => 9:1 => этилацетат), получая 3,0 г [2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-ил]метанола.
С17Н21NO5 (319,36); MC(ESI): 320,2 (M+H+).
2-(4-Метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-илметиловый эфир метансульфокислоты
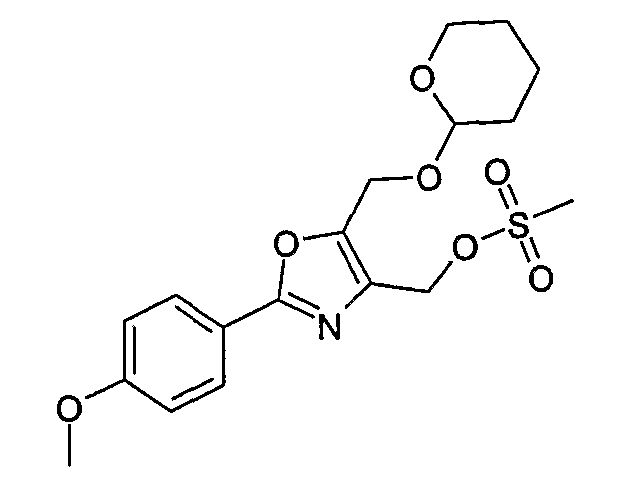
0,44 г [2-(4-Метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-ил]метанола растворяют в 30 мл дихлорметана и охлаждают на бане со льдом. Добавляют 0,29 мл триэтиламина с последующим добавлением 0,13 мл метансульфонилхлорида. Реакционную смесь перемешивают при температуре 0°С в течение одного часа, затем баню со льдом удаляют и полученную смесь перемешивают при комнатной температуре в течение дополнительного часа. Реакционную смесь затем промывают водой и рассолом, сушат над сульфатом магния и растворитель удаляют в вакууме, получая 0,55 мг 2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-илметилового эфира метансульфокислоты в виде масла, которое используют без дальнейшей очистки.
С18Н23NO7S (397,45); MC(ESI): 398,2 (M+H+).
Пример 1
3-{2-Фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
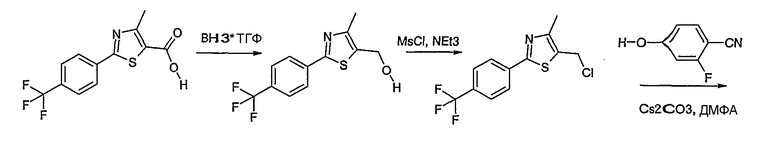
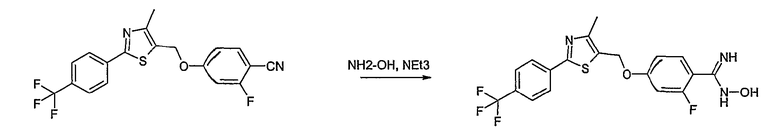
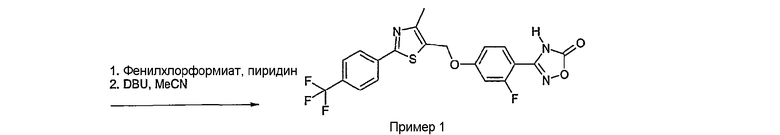
[4-Метил-2-(4-трифторметилфенил)тиазол-5-ил]метанол
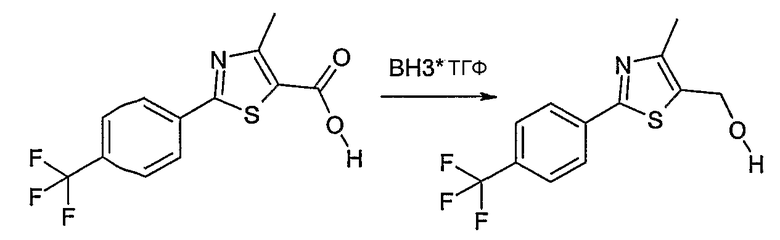
10,0 г 4-Метил-2-(4-трифторметилфенил)тиазол-5-карбоновой кислоты в атмосфере аргона растворяют в 50 мл тетрагидрофурана. Добавляют 69,7 мл боран-тетрагидрофуранового комплекса (1М раствор в тетрагидрофуране) и смесь кипятят с обратным холодильником в течение трех часов. К охлажденной реакционной смеси добавляют воду и растворитель удаляют в вакууме. Остаток экстрагируют пять раз порциями по 50 мл этилацетата. Объединенные экстракты сушат над сульфатом магния. Растворитель удаляют в вакууме, получая 9,3 г [4-метил-2-(4-трифторметилфенил)тиазол-5-ил]метанола в виде твердого вещества желтого цвета.
С12Н10F3NOS (273,28); MC(ESI): 274,2 (M+H+);
Rf = 0,21 (н-гептан:этилацетат = 2:1).
5-Хлорметил-4-метил-2-(4-трифторметилфенил)тиазол
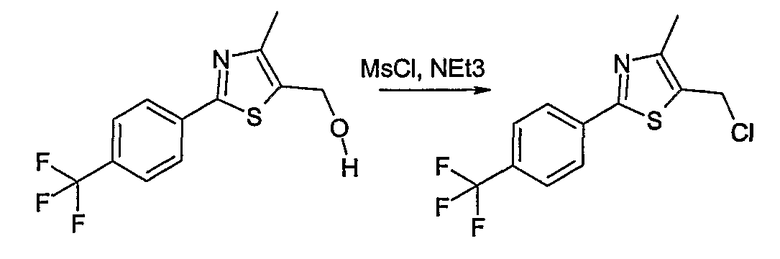
3,0 г [4-Метил-2-(4-трифторметилфенил)тиазол-5-ил]метанола растворяют в 50 мл дихлорметана, добавляют 3,0 мл триэтиламина, затем 1,36 мл метансульфонилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение двух часов. Добавляют 100 мл дихлорметана и смесь промывают насыщенным раствором гидрокарбоната натрия, водой и солевым раствором. Органический слой сушат над MgSO4. Растворитель удаляют в вакууме, получая 3,3 г сырого 5-хлорметил-4-метил-2-(4-трифторметилфенил)тиазола в виде масла коричневого цвета.
С12Н9ClF3NS (291,72); MС (ESI): 292,2 (М+Н+).
2-Фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрил
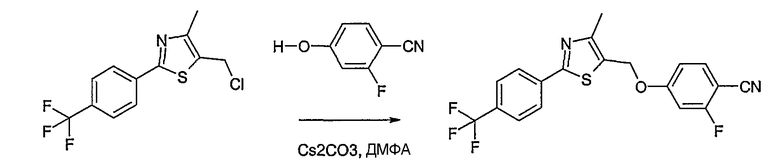
560 мг 5-Хлорметил-4-метил-2-(4-трифторметилфенил)тиазола растворяют в 10 мл диметилформамида. Добавляют 1,2 г карбоната цезия и 395 мг 2-фтор-4-гидроксибензонитрила и смесь перемешивают при комнатной температуре в течение трех часов. Затем добавляют 50 мл метил-трет-бутилового эфира, смесь промывают солевым раствором и сушат над MgSO4. Растворитель удаляют в вакууме. Полученный сырой продукт очищают с помощью ВЭЖХ с обращенной фазой, получая 153 мг 2-фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила в виде аморфного лиофилизата.
С19Н12F4N2ОS (392,38); MС (ESI): 393,1 (М+Н+).
2-Фтор-N-гидрокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензамидин
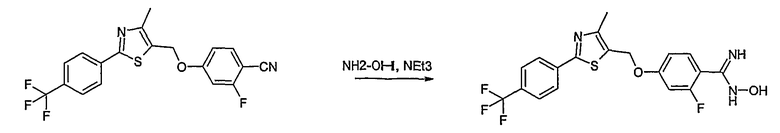
153 мг 2-Фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила растворяют в смеси 1 мл тетрагидрофурана и 2 мл метанола. Добавляют 265 мг гидрохлорида гидроксиламина и 0,5 мл триэтиламина. Реакционную смесь перемешивают при температуре 60°С в течение двадцати часов. Растворители удаляют в вакууме и полученный остаток выливают в воду и экстрагируют пять раз этилацетатом. Объединенные органические экстракты промывают солевым раствором, сушат над MgSO4 и растворитель выпаривают в вакууме, получая 138 мг 2-фтор-N-гидрокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензамидина в виде сырого вещества.
С19Н15F4N3О2S (425,41); MС (ESI): 426,1 (М+Н+).
3-{2-Фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он

138 мг 2-Фтор-N-гидрокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензамидина растворяют в 2 мл дихлорметана. Добавляют 35 мкл пиридина и 53 мкл фенилхлорформиата и смесь перемешивают при комнатной температуре в течение тридцати минут. Смесь разбавляют добавлением 20 мл этилацетата, промывают солевым раствором и сушат над MgSO4. Растворитель выпаривают в вакууме. Полученный остаток растворяют в 2 мл ацетонитрила и добавляют 105 мкл 1,8-диазабицикло[5,4,0]ундец-7-ена. Смесь перемешивают при комнатной температуре в течение 10 минут. Смесь выпаривают в вакууме и полученное сырое вещество очищают с помощью ВЭЖХ с обращенной фазой, получая 70 мг 3-{2-фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-она в виде аморфного лиофилизата.
С20Н13F4N3О3S (451,40); MС (ESI): 452,1 (М+Н+).
Пример 2
3-{4-[4-Метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
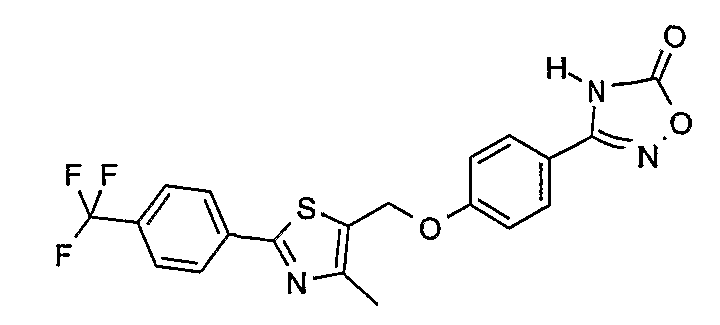
В соответствии со способом, описанным в примере 1, 3-{4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 5-хлорметил-4-метил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 4-гидроксибензонитрила.
С20Н14F3N3О3S (433,41); MС (ESI): 434,3 (М+Н+).
Пример 3
3-{3-Метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
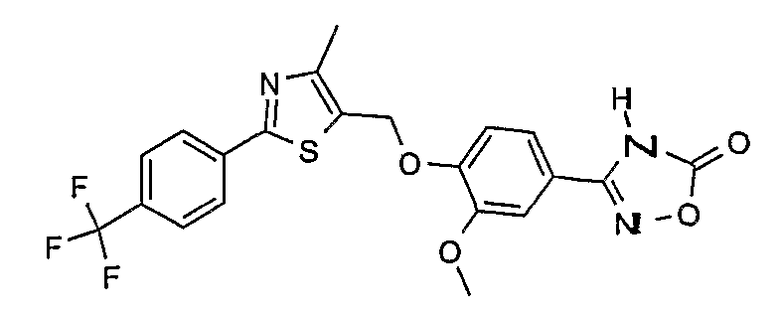
В соответствии со способом, описанным в примере 1, 3-{3-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 5-хлорметил-4-метил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 4-гидрокси-3-метоксибензонитрила.
С21Н16F3N3О4S (463,44); MС (ESI): 464,2 (М+Н+).
Пример 4
3-{2-Хлор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
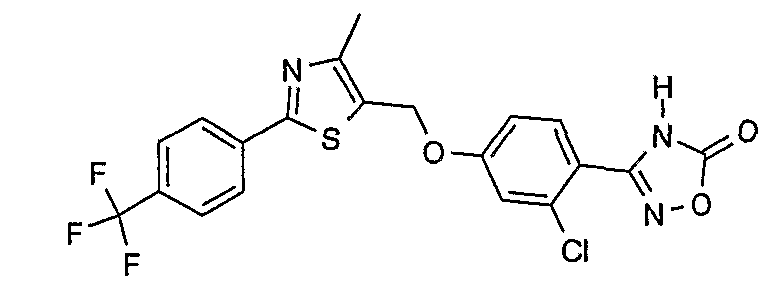
В соответствии со способом, описанным в примере 1, 3-{2-хлор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 5-хлорметил-4-метил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С20Н13ClF3N3О3S (467,86); MС (ESI): 468,2 (М+Н+).
Пример 5
3-{4-[4-Метил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]фенил}-4Н-[1,2,4]оксадиазол-5-он
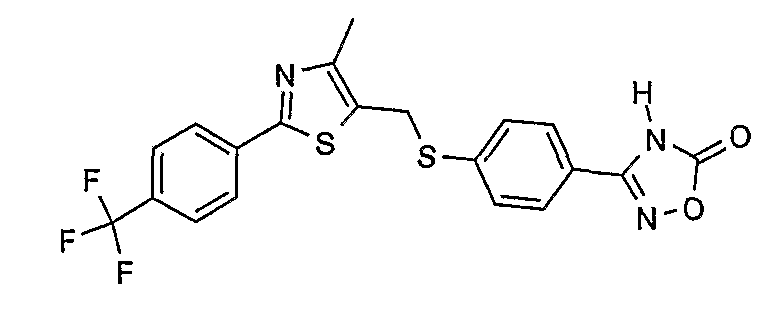
В соответствии со способом, описанным в примере 1, 3-{4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 5-хлорметил-4-метил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 4-меркаптобензонитрила.
С20Н14F3N3О2S2 (449,48); MС (ESI): 450,2 (М+Н+).
Пример 6
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он
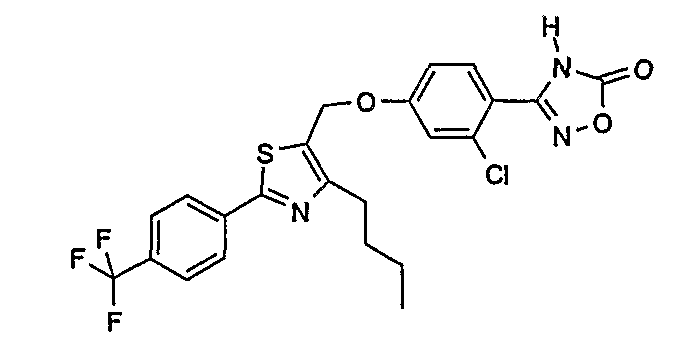
В соответствии со способом, описанным в примере 1, 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он получают из 4-бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С23Н19ClF3N3О3S (509,94); MС (ESI): 510,3 (М+Н+).
Пример 7
3-{4-[4-Бутил-2-(4-пентафторсульфанилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он
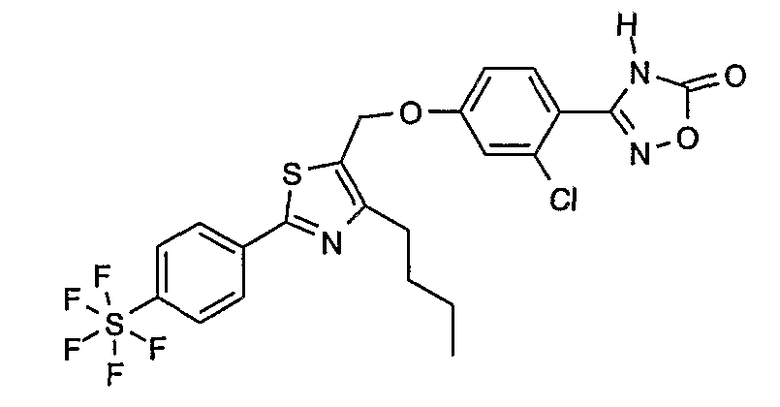
В соответствии со способом, описанным в примере 1, 3-{4-[4-бутил-2-(4-пентафторсульфанилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он получают из 4-бутил-5-хлорметил-2-(4-пентафторсульфанилфенил)тиазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С22Н19ClF5N3О3S2 (567,4); MС (ESI): 568,1 (М+Н+).
Пример 8
3-{2-Хлор-4-[4-метил-2-(4-пентафторсульфанилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
В соответствии со способом, описанным в примере 1, 3-{2-хлор-4-[4-метил-2-(4-пентафторсульфанилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 5-хлорметил-4-метил-2-(4-пентафторсульфанилфенил)тиазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С19Н13ClF5N3О3S2 (525,91); MС (ESI): 526,0 (М+Н+).
Пример 9
3-(4-{2-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]этокси}-2-хлорфенил)-4Н-[1,2,4]оксадиазол-5-он
4-{2-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]этокси}-2-хлорбензонитрил
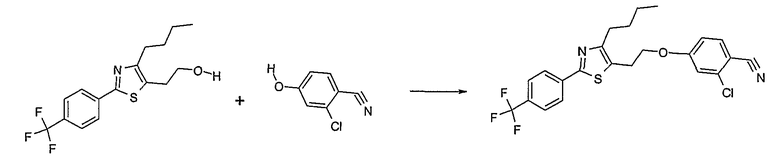
К охлажденному льдом раствору 1,1 г 2-[4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]этанола в 50 мл дихлорметана добавляют 0,56 г коммерчески доступного 2-хлор-4-гидроксибензонитрила и 0,95 г трифенилфосфина. К этому раствору по каплям добавляют 0,57 мл диэтилазодикарбоксилата. Баню со льдом убирают и реакционную смесь перемешивают при комнатной температуре в течение шести часов. Растворитель удаляют в вакууме и остаток очищают с помощью ВЭЖХ с обращенной фазой, получая 400 мг 4-{2-[4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]этокси}-2-хлорбензонитрила в виде лиофилизата.
С23Н20ClF3N2ОS (464,94); MС (ESI): 465,2 (М+Н+).
3-(4-{2-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-ил]этокси}-2-хлорфенил)-4Н-[1,2,4]оксадиазол-5-он
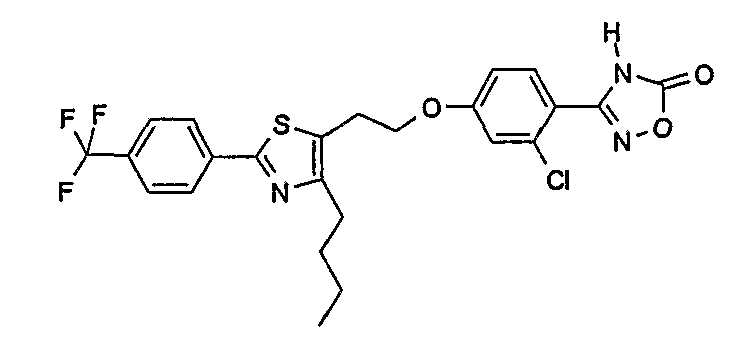
В соответствии со способом, описанным в примере 1, 3-(4-{2-[4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]этокси}-2-хлорфенил)-4Н-[1,2,4]оксадиазол-5-он получают из 4-{2-[4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]этокси}-2-хлорбензонитрила.
С24Н21ClF3N3О3S (523,97); MС (ESI): 524,3 (М+Н+).
Пример 10
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорбензил}-4Н-[1,2,4]оксадиазол-5-он
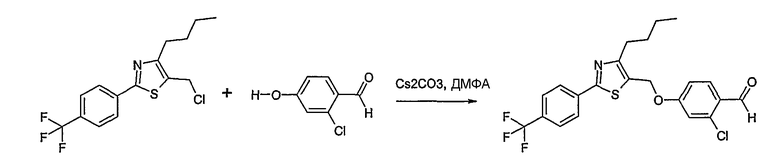
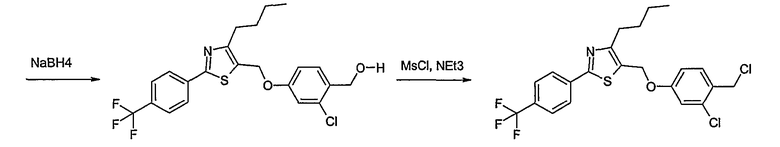
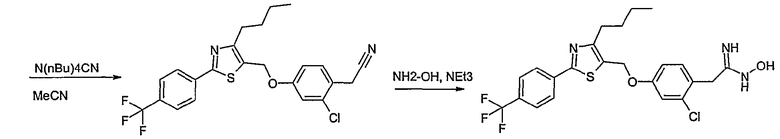
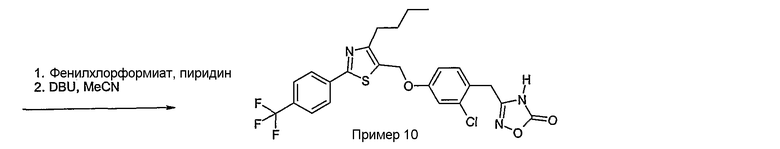
4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорбензальдегид
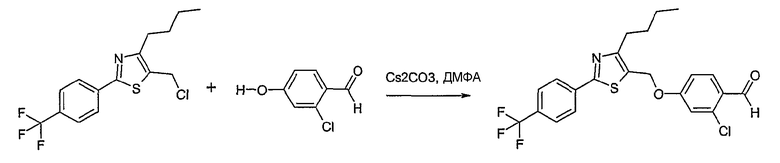
3,2 г 4-Бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола и 1,5 г 2-хлор-4-гидроксибензальдегида растворяют в 150 мл диметилформамида. Добавляют 4,7 г карбоната цезия и реакционную смесь перемешивают при комнатной температуре в течение четырех часов. Затем реакционную смесь разбавляют добавлением 300 мл этилацетата и промывают три раза по 50 мл воды, насыщенным раствором NaHCO3 и солевым раствором. Органический слой сушат над MgSO4 и растворитель удаляют в вакууме, получая 3,0 г 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорбензальдегида в виде масла.
С22Н19ClF3NО2S (453,91); MС (ESI): 454,4 (М+Н+).
Rf (н-гептан:этилацетат = 4:1) = 0,63.
{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}метанол
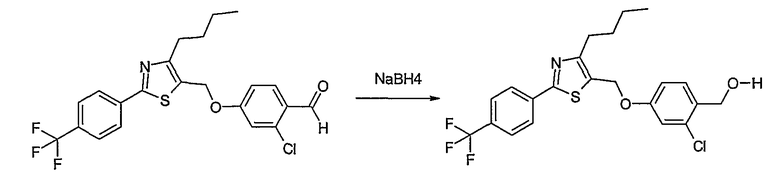
3,0 г 4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорбензальдегида растворяют в 100 мл метанола и добавляют 300 мг боргидрида натрия. Реакционную смесь перемешивают при комнатной температуре в течение двух часов, затем растворитель удаляют в вакууме и остаток растворяют в 100 мл этилацетата. Этот раствор промывают три раза по 30 мл солевого раствора, сушат над MgSO4 и растворитель удаляют в вакууме, получая 3,0 г {4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}метанола в виде твердого вещества бледно-желтого цвета.
С22Н21ClF3NО2S (455,93); MС (ESI): 456,4 (М+Н+).
Rf (н-гептан:этилацетат = 1:1) = 0,44.
4-Бутил-5-(3-хлор-4-хлорметилфеноксиметил)-2-(4-трифторметилфенил)тиазол

3,0 г {4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}метанола и 1,84 мл триэтиламина растворяют в 150 мл дихлорметана. К этому охлажденному льдом раствору добавляют 0,82 мл метансульфонилхлорида. Баню со льдом убирают и реакционную смесь перемешивают при комнатной температуре дополнительные три часа. Реакционную смесь промывают три раза по 50 мл насыщенного раствора
NaHCO3, сушат над MgSO4 и растворитель удаляют в вакууме, получая 3,1 г 4-бутил-5-(3-хлор-4-хлорметилфеноксиметил)-2-(4-трифторметилфенил)тиазола в виде сырого продукта. Этот продукт используют без дальнейшей очистки.
С22Н20Cl2F3NОS (474,38); MС (ESI): 476,4 (М+Н+).
{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}ацетонитрил
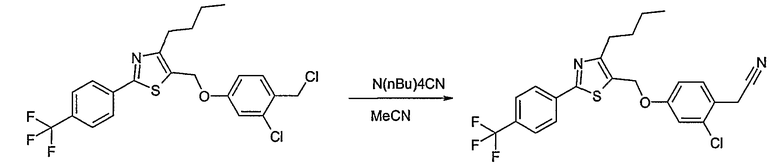
3,1 г Сырого 4-бутил-5-(3-хлор-4-хлорметилфеноксиметил)-2-(4-трифторметилфенил)тиазола растворяют в 50 мл ацетонитрила. Добавляют 2,0 г тетрабутиламмонийцианида и реакционную смесь перемешивают при комнатной температуре в течение одного часа. Затем добавляют смесь насыщенного раствора NaHCO3, льда и этилацетата. Водную фазу отделяют и экстрагируют три раза порциями по 30 мл этилацетата. Объединенные органические слои промывают ледяной водой и солевым раствором и сушат над MgSO4. Растворитель удаляют в вакууме. Остаток очищают с помощью флэш-хроматографии с помощью элюента н-гептан:этилацетат = 4:1, получая 2,2 г {4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}ацетонитрила в виде масла.
С23Н20ClF3N2ОS (464,94); MС (ESI): 465,5 (М+Н+).
Rf (н-гептан:этилацетат = 4:1) = 0,32.
2-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-N-гидроксиацетамидин
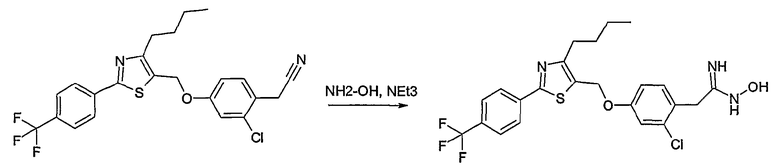
2,2 г {4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}ацетонитрила растворяют в смеси из 6 мл тетрагидрофурана и 12 мл метанола. Добавляют 3,3 г гидроксиламина и затем 6,6 мл триэтиламина. Реакционную смесь перемешивают при температуре 60°С в течение двух часов. Растворители удаляют в вакууме и полученный остаток выливают в воду и экстрагируют пять раз порциями по 30 мл этилацетата. Объединенные органические экстракты сушат над MgSO4 и растворитель выпаривают в вакууме, получая 2,3 г 2-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-N-гидроксиацетамидина в виде сырого вещества.
С23Н23ClF3N3О2S (497,97); MС (ESI): 498,5 (М+Н+).
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорбензил}-4Н-[1,2,4]оксадиазол-5-он

2,3 г Сырого 2-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-N-гидроксиацетамидина растворяют в 30 мл дихлорметана. Добавляют 0,46 мл пиридина и 0,71 мл фенилхлорформиата и смесь перемешивают при комнатной температуре в течение десяти минут. Смесь разбавляют добавлением 150 мл этилацетата, промывают солевым раствором и сушат над MgSO4. Растворитель выпаривают в вакууме. Полученный остаток растворяют в 20 мл ацетонитрила и добавляют 0,70 мл 1,8-диазабицикло[5,4,0]ундец-7-ена. Смесь перемешивают при комнатной температуре в течение 10 минут. Смесь выпаривают в вакууме и полученный сырой продукт очищают с помощью ВЭЖХ с обращенной фазой, получая 820 мг 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорбензил}-4Н-[1,2,4]оксадиазол-5-она в виде аморфного лиофилизата.
С24Н21ClF3N3О3S (523,97); MС (ESI): 524,3 (М+Н+).
Пример 11
3-{2-Метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
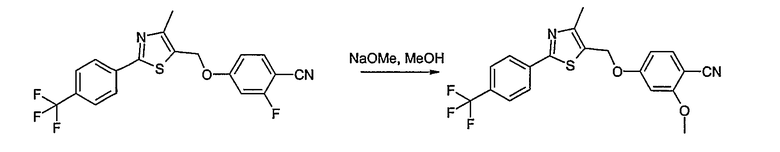
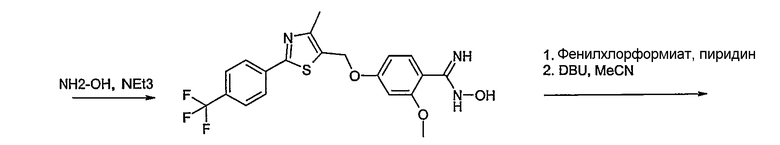
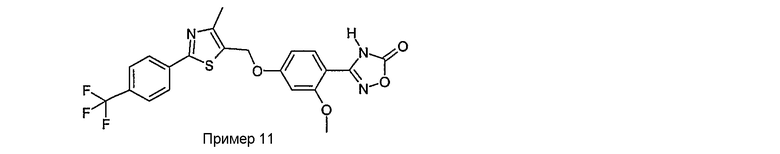
2-Метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрил
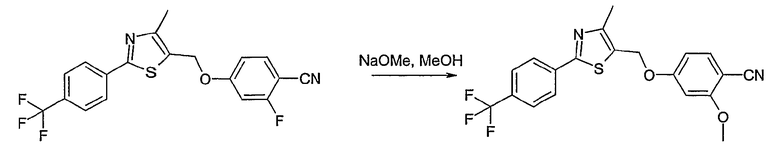
280 мг 2-Фтор-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила (промежуточный продукт примера 1) растворяют в 10 мл метанола. Добавляют 390 мг метилата натрия и реакционную смесь перемешивают при температуре 60°С в течение двух часов. Охлажденную реакционную смесь разбавляют добавлением 200 мл этилацетата и промывают три раза порциями по 50 мл воды. Органический слой сушат над MgSO4 и растворитель удаляют в вакууме, получая 140 мг 2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила в виде твердого вещества бледно-желтого цвета.
С20Н15F3N2О2S (404,41); MС (ESI): 405,4 (М+Н+);
Rf (н-гептан:этилацетат = 2:1) = 0,32.
3-{2-Метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
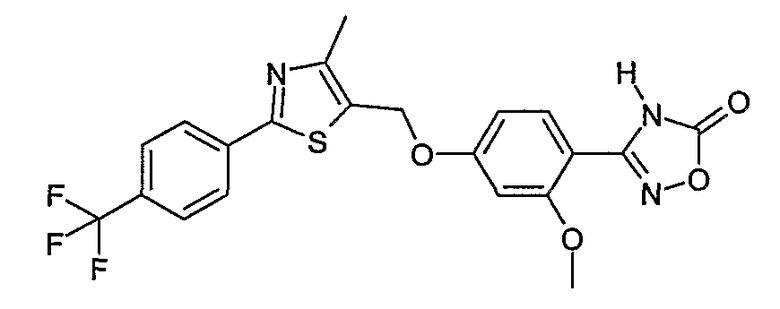
В соответствии со способом, описанным в примере 1, 3-{2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]-фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила.
С21Н16F3N3О4S (463,44); MС (ESI): 464,3 (М+Н+).
Пример 12
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-фторфенил}-4Н-[1,2,4]оксадиазол-5-он
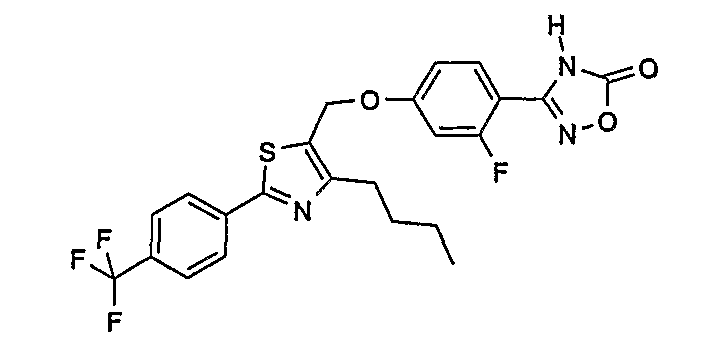
В соответствии со способом, описанным в примере 1, 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-фторфенил}-4Н-[1,2,4]оксадиазол-5-он получают из 4-бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 2-фтор-4-гидроксибензонитрила.
С23Н19F4N3О3S (493,11); MС (ESI): 494,3 (М+Н+).
Пример 13
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2,6-дифторфенил}-4Н-[1,2,4]оксадиазол-5-он
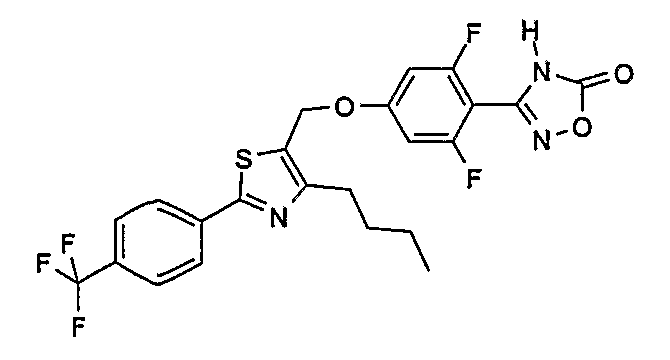
В соответствии со способом, описанным в примере 1, 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2,6-дифторфенил}-4Н-[1,2,4]оксадиазол-5-он получают из 4-бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 2,6-дифтор-4-гидроксибензонитрила.
С23Н18F5N3О3S (511,10); MС (ESI): 512,2 (М+Н+).
Пример 14
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]фенил}-4Н-[1,2,4]оксадиазол-5-он
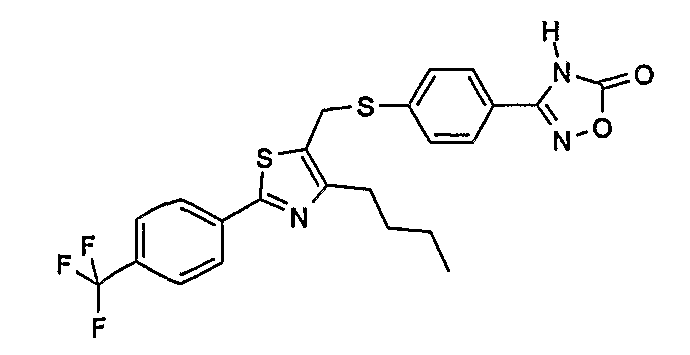
В соответствии со способом, описанным в примере 1, 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 4-бутил-5-хлорметил-2-(4-трифторметилфенил)тиазола и коммерчески доступного 4-меркаптобензонитрила.
С23Н20F3N3О2S2 (491,09); MС (ESI): 492,2 (М+Н+).
Пример 15
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилфенил}-4Н-[1,2,4]оксадиазол-5-он
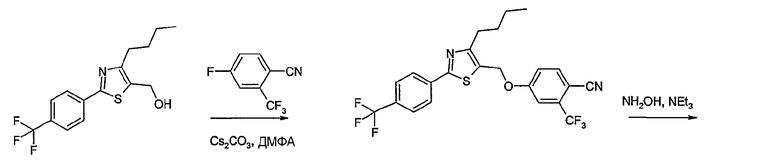
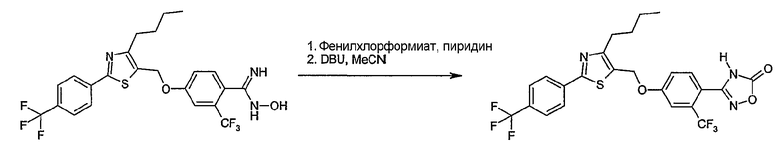
4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилбензонитрил
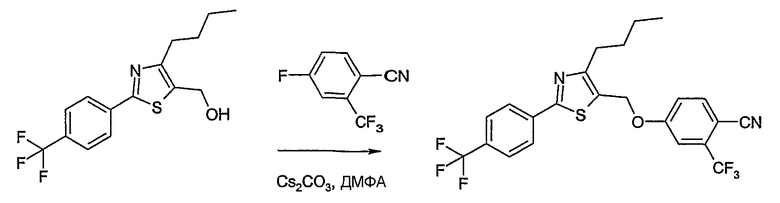
К раствору 100 мг 4-фтор-2-трифторметилбензонитрила в 5 мл безводного диметилформамида добавляют 200 мг [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола и 0,49 г карбоната цезия. Полученную смесь перемешивают при комнатной температуре в течение ночи, выливают в воду и экстрагируют смесью гептан/этилацетат = 1:3. Органические экстракты сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (гептан/этилацетат = 4:1), получая 180 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилбензонитрила.
С23Н18F6N2ОS (484,10); MС (ESI): 485 (М+Н+).
4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-N-гидрокси-2-трифторметилбензамидин
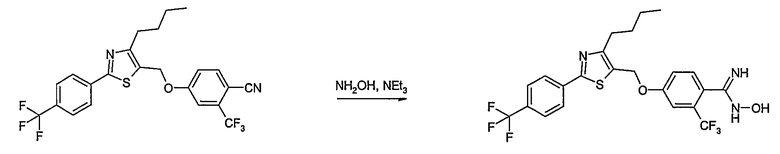
К раствору 180 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилбензонитрила в 5 мл тетрагидрофурана и 10 мл метанола добавляют 267 мг гидрохлорида гидроксиламина и 0,55 мл триэтиламина. Полученную смесь нагревают при температуре 60°С в течение ночи. Растворители удаляют в вакууме, полученный остаток выливают в воду и экстрагируют этилацетатом. Органические экстракты сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (гептан/этилацетат = 1:1), получая 90 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-N-гидрокси-2-трифторметилбензамидина и 50 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилбензамида.
С23Н21F6N3О2S (517,49); MС (ESI): 518 (М+Н+).
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилфенил}-4Н-[1,2,4]оксадиазол-5-он
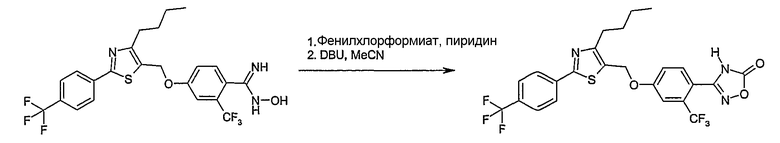
К раствору 89,3 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-N-гидрокси-2-трифторметилбензамидина в 2 мл безводного дихлорметана по каплям добавляют 92 мкл пиридина, затем 21,6 мкл фенилхлорформиата. Полученную смесь перемешивают при комнатной температуре в течение 1 часа. Растворитель удаляют в вакууме. К раствору полученного остатка в 2,5 мл ацетонитрила добавляют 88 мкл 1,8-диазабицикло[5,4,0]ундец-7-ена. Смесь перемешивают при микроволновом нагреве при температуре 180°С в течение 10 минут (или перемешивают при комнатной температуре в течение ночи). Растворитель удаляют в вакууме и сырой продукт очищают с помощью колоночной хроматографии на силикагеле (гептан/этилацетат = 1:1, затем дихлорметан/метанол = 95:5, после этого, на другой колонке, при использовании смеси дихлорметан/ацетон = 90:10), получая 65 мг 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-трифторметилфенил}-4Н-[1,2,4]оксадиазол-5-она.
С24Н19F6N3О3S (543,10); MС (ESI): 544,4 (М+Н+).
Пример 16
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он
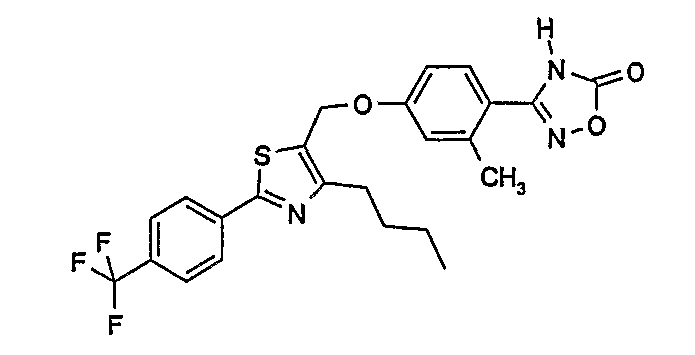
В соответствии со способом, описанным в примере 15, 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила.
С24Н22F3N3О3S (489,13); MС (ESI): 490,4 (М+Н+).
Пример 17
3-{2-Бром-4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
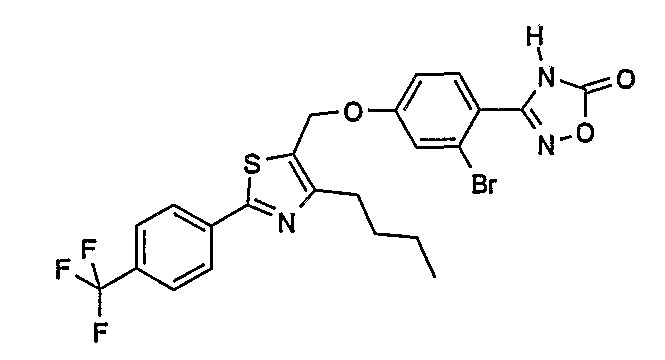
В соответствии со способом, описанным в примере 15, 3-{2-бром-4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-фенил}-4Н-[1,2,4]оксадиазол-5-он получают из [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола и коммерчески доступного 2-бром-4-фторбензонитрила.
С23Н19BrF3N3О3S (553,03); MС (ESI): 554,2 (М+Н+).
Пример 18
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метоксифенил}-4Н-[1,2,4]оксадиазол-5-он
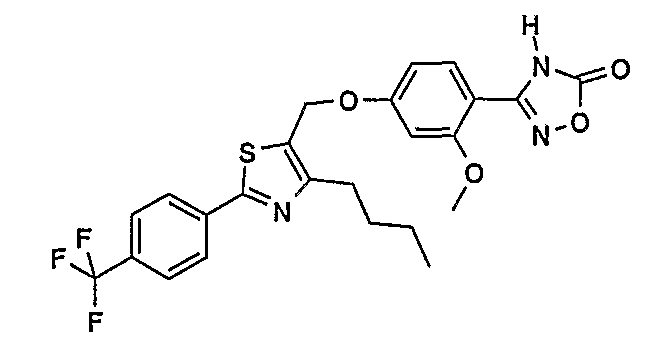
В соответствии со способом, описанным в примере 15, 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метоксифенил}-4Н-[1,2,4]оксадиазол-5-он получают из [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метоксибензонитрила.
С24Н22F3N3О4S (505,12); MС (ESI): 506,3 (М+Н+).
Пример 19
3-{4-[4-Бут-3-енил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он
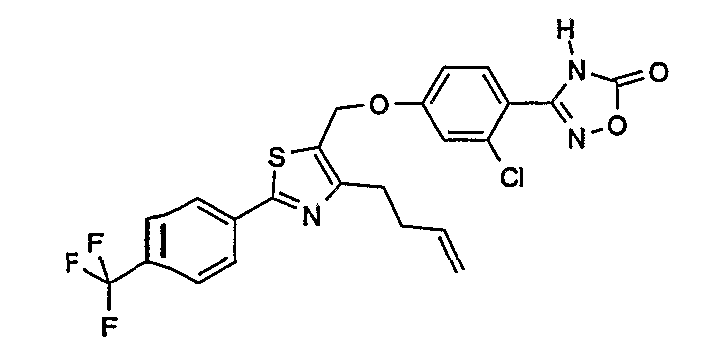
В соответствии со способом, описанным в примере 15, 3-{4-[4-бут-3-енил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [4-бут-3-енил-2-(4-трифторметилфенил)тиазол-5-ил]метанола и коммерчески доступного 4-фтор-2-хлорбензонитрила.
С23Н17ClF3N3О3S (507,06); MС (ESI): 508 (М+Н+).
Пример 20
3-{2-Хлор-4-[4-(4-гидроксибутил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
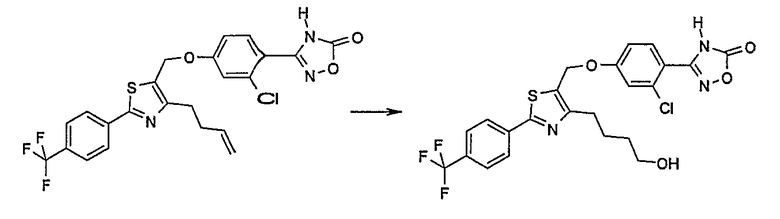
К раствору 50 мг 3-{4-[4-бут-3-енил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]-оксадиазол-5-она в 2 мл тетрагидрофурана при температуре 0°С добавляют 0,3 мл 2М раствора комплекса боранметилсульфид в тетрагидрофуране. Полученную смесь перемешивают при нагревании ее до комнатной температуры, затем перемешивают при комнатной температуре в течение 30 минут. После охлаждения до температуры 0°С добавляют 0,1 мл 5М водного раствора гидроксида натрия и 0,1 мл 30%-ного водного раствора пероксида водорода. Полученную смесь перемешивают при нагревании ее до комнатной температуры в течение 1 часа. Затем ее выливают в воду, экстрагируют этилацетатом, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (градиент дихлорметан/метанол = от 100/0 до 95/5) с последующей кристаллизацией из смеси дихлорметан/пентан, получая 28 мг 3-{2-хлор-4-[4-(4-гидроксибутил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-она.
С23Н19ClF3N3О4S (525,07); MС (ESI): 526,2 (М+Н+).
Пример 21
3-{2-Хлор-4-[4-(3,4-дигидроксибутил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
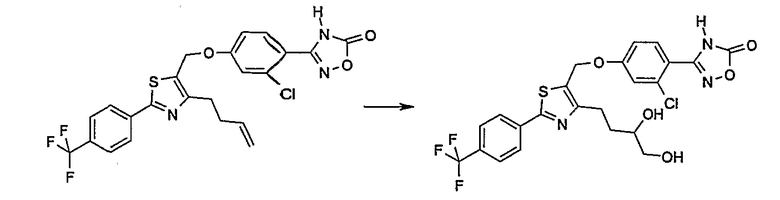
К смеси 189 мг 3-{4-[4-бут-3-енил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-она в 0,4 мл тетрагидрофурана, 0,2 мл воды и 0,4 мл трет-бутанола добавляют 0,05 мл 25%-ного раствора тетроксида осмия в трет-бутаноле и 76 мг N-метилморфолиноксида. Полученную смесь перемешивают при комнатной температуре в течение 24 часов. Затем ее выливают в насыщенный водный раствор гидрокарбоната натрия, экстрагируют дихлорметаном, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (градиент дихлорметан/метанол = от 100/0 до 95/5), получая 32 мг 3-{2-хлор-4-[4-(3,4-дигидроксибутил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]-оксадиазол-5-она.
С23Н19ClF3N3О5S (541,06); MС (ESI): 542,2 (М+Н+).
Пример 22
5-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-(5-оксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)бензонитрил
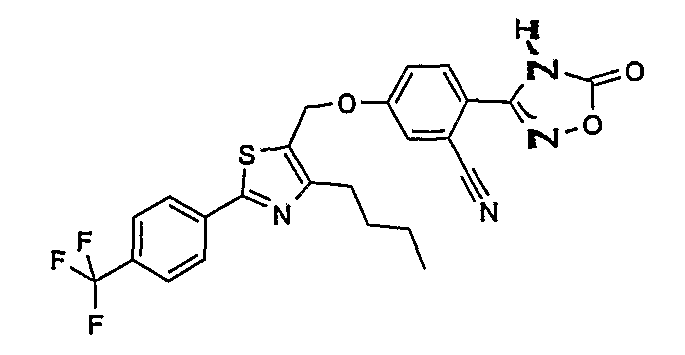
К раствору 100 мг 3-{2-бром-4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]-оксадиазол-5-она в 4 мл пиридина добавляют 29 мг цианида меди. Полученную смесь перемешивают при микроволновом нагреве при температуре 210°С в течение 10 минут, затем концентрируют при пониженном давлении. Остаток обрабатывают этилацетатом, промывают водным раствором аммиака с рН 9, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью препаративной тонкослойной хроматографии на силикагеле (дихлорметан/метанол = 95/5) и осаждают из смеси этилацетат/диизопропиловый эфир/пентан, получая 9,5 мг 5-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-(5-оксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)бензонитрила.
С24Н19F3N4О3S (500,11); MС (ESI): 501,3 (М+Н+).
Пример 23
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфанилфенил}-4Н-[1,2,4]оксадиазол-5-он
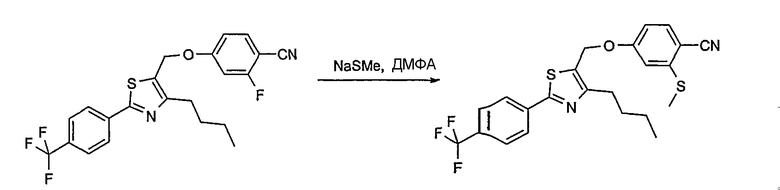
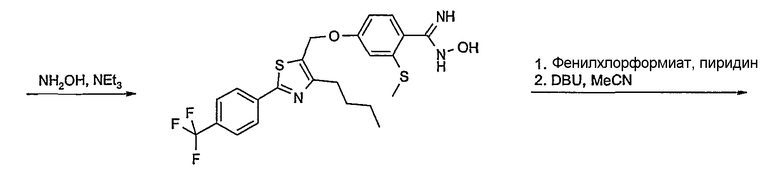

К раствору 50 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-фторбензонитрила (получают в соответствии со способом, описанным в примере 1) в 10 мл диметилформамида добавляют 121 мг тиометилата натрия. Полученную смесь перемешивают при комнатной температуре в течение ночи, затем выливают в воду, экстрагируют диизопропиловым эфиром. Объединенные органические экстракты промывают водой, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают путем кристаллизации из смеси диизопропиловый эфир/гептан, получая 350 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфанилбензонитрила, который превращают в 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфанилфенил}-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С24Н22F3N3О3S2 (521,10); MС (ESI): 522,3 (М+Н+).
Пример 24
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфинилфенил}-4Н-[1,2,4]оксадиазол-5-он
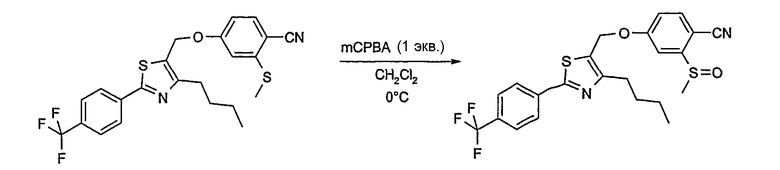
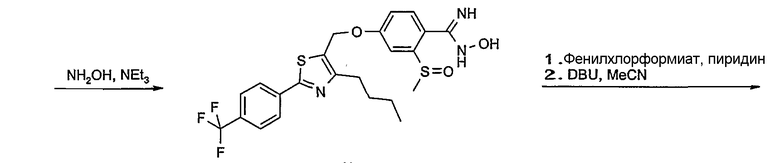
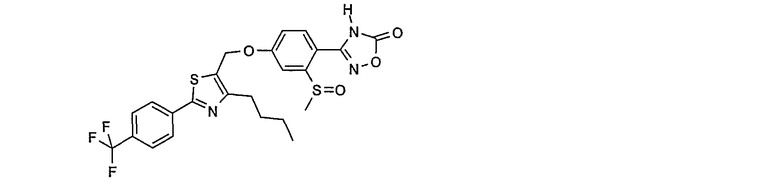
К раствору 200 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфанилбензонитрила (получают в соответствии со способом, описанным в примере 23) в 4 мл дихлорметана при температуре 0°С добавляют 74 мг мета-хлорпероксибензойной кислоты (mCPBA). Полученную смесь перемешивают при температуре 0°С в течение 2 часов, затем выдерживают в морозильной камере в течение ночи. Добавляют насыщенный водный раствор гидрокарбоната натрия и органический слой отделяют. Водный слой экстрагируют дихлорметаном. Объединенные экстракты сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении, получая 203 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфинилбензонитрила, который превращают в 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфинилфенил}-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С24Н22F3N3О4S2 (537,10); MС (ESI): 538,3 (М+Н+).
Пример 25
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метансульфонилфенил}-4Н-[1,2,4]оксадиазол-5-он
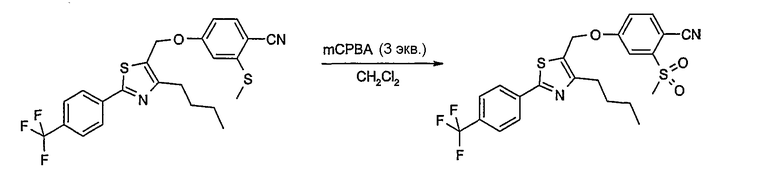
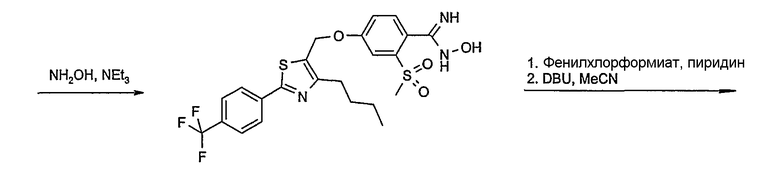
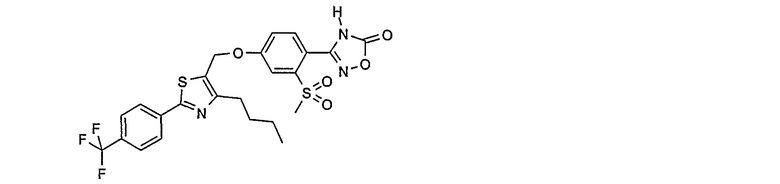
К раствору 200 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метилсульфанилбензонитрила (получают в соответствии со способом, описанным в примере 23) в 20 мл дихлорметана при температуре 0°С добавляют 149 мг мета-хлорпероксибензойной кислоты (mCPBA). Полученную смесь перемешивают при температуре 0°С в течение 2 часов, затем в течение 1 часа при комнатной температуре. После добавления еще 75 мг мета-хлорнадбензойной кислоты, реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Добавляют насыщенный водный раствор гидрокарбоната натрия и органический слой отделяют. Водный слой экстрагируют дихлорметаном. Объединенные экстракты сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении, получая 210 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метансульфонилбензонитрила, который превращают в 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-метансульфонилфенил}-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С24Н22F3N3О5S2 (553,09); MС (ESI): 554,1 (М+Н+).
Пример 26
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметансульфинил]фенил}-4Н-[1,2,4]оксадиазол-5-он
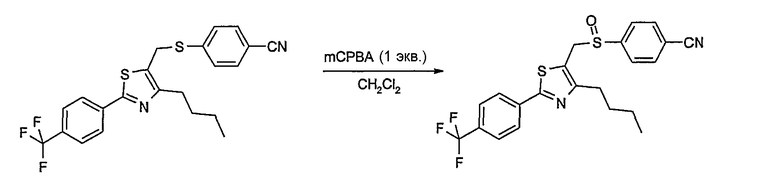
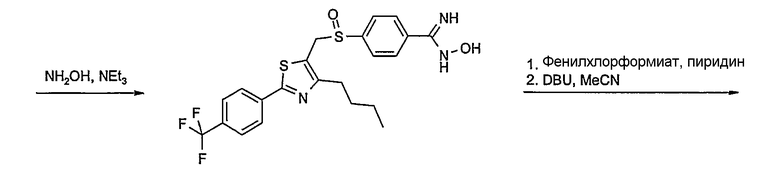
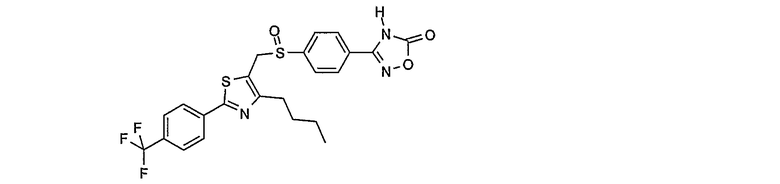
К раствору 200 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]бензонитрила (получают в соответствии со способом, описанным в примере 14) в 4 мл дихлорметана при температуре 0°С добавляют 80 мг мета-хлорпероксибензойной кислоты (mCPBA). Полученную смесь перемешивают при температуре 0°С в течение 5 часов, при комнатной температуре в течение 2 часов, затем выдерживают в холодильнике в течение ночи. Добавляют насыщенный водный раствор гидрокарбоната натрия и органический слой отделяют. Водный слой экстрагируют дихлорметаном. Объединенные экстракты сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (градиент: 1-4% ацетон/дихлорметан), получая 185 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфинил]бензонитрила, который превращают в 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметансульфинил]фенил}-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С23Н20F3N3О3S2 (507,09); MС (ESI): 508 (М+Н+).
Пример 27
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфонил]фенил}-4Н-[1,2,4]оксадиазол-5-он
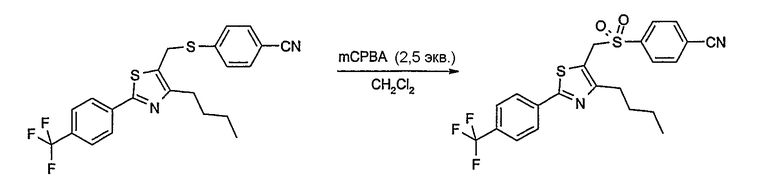
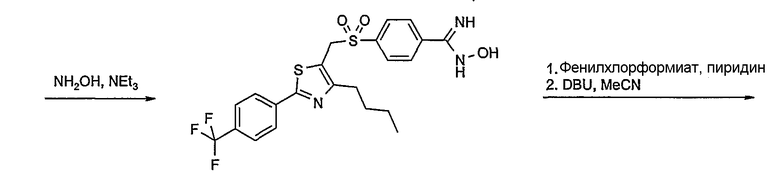
К раствору 200 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфанил]бензонитрила (получают в соответствии со способом, описанным в примере 14) в 4 мл дихлорметана при температуре 0°С добавляют 200 мг мета-хлорпероксибензойной кислоты (mCPBA). Полученную смесь перемешивают при температуре 0°С в течение 5 часов. Добавляют насыщенный водный раствор гидрокарбоната натрия и органический слой отделяют. Водный слой экстрагируют дихлорметаном. Объединенные экстракты сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении, получая 225 мг 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметилсульфонил]бензонитрила, который превращают в 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметансульфонил]фенил}-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С23Н20F3N3О4S2 (523,08); MС (ESI): 522 (М-Н+).
Пример 28
3-{4-[4-Бутил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]-2-фторфенил}-4Н-[1,2,4]оксадиазол-5-он
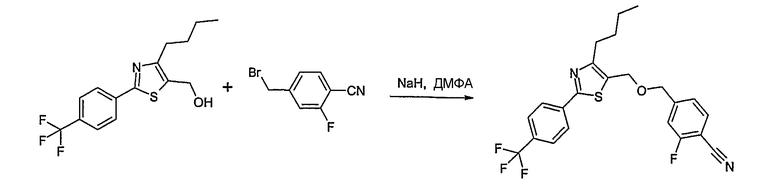
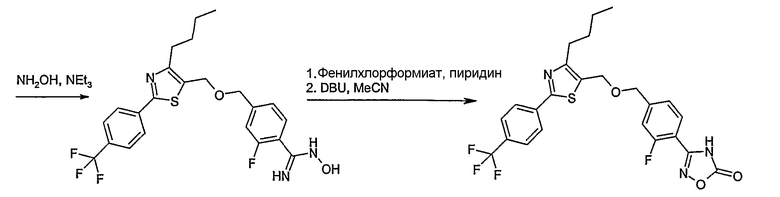
К раствору 2,255 г [4-бутил-2-(4-трифторметилфенил)тиазол-5-ил]метанола в 25 мл диметилформамида добавляют 0,286 г 60%-ной дисперсии гидрида натрия в минеральном масле. После перемешивания в течение 15 минут добавляют 3 г 4-бромметил-2-фторбензонитрила. Полученную смесь перемешивают при комнатной температуре в течение ночи, затем выливают в воду, экстрагируют диизопропиловым эфиром. Объединенные органические экстракты промывают водой, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (гептан/этилацетат = 95/5), получая 0,6 г 4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]-2-фторбензонитрила, который превращают в 3-{4-[4-бутил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]-2-фторфенил}-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С24Н21F4N3О3S (507,12); MС (ESI): 508,3 (М+Н+).
Пример 29
3-{4-[4-Метил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]фенил}-4Н-[1,2,4]оксадиазол-5-он
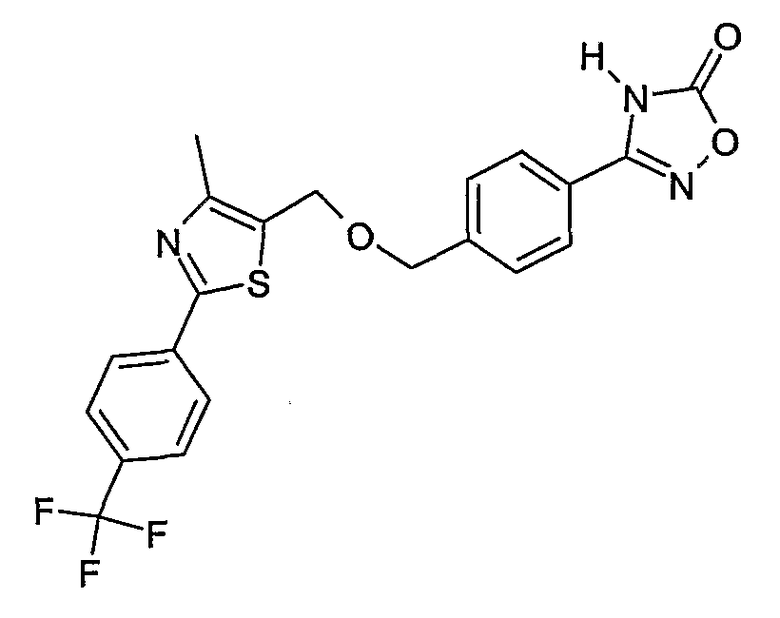
В соответствии со способом, описанным в примере 28, 4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]бензонитрил получают из [4-метил-2-(4-трифторметилфенил)тиазол-5-ил]метанола и коммерчески доступного 4-бромметилбензонитрила. 4-[4-Метил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]бензонитрил превращают в 3-{4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметоксиметил]фенил}-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С21Н16F3N3О3S (447,74); MС (ESI): 448 (М+Н+).
Пример 30
3-[4-(2-Бифенил-4-ил-5-метилоксазол-4-илметокси)-2-хлорфенил]-4Н-[1,2,4]оксадиазол-5-он
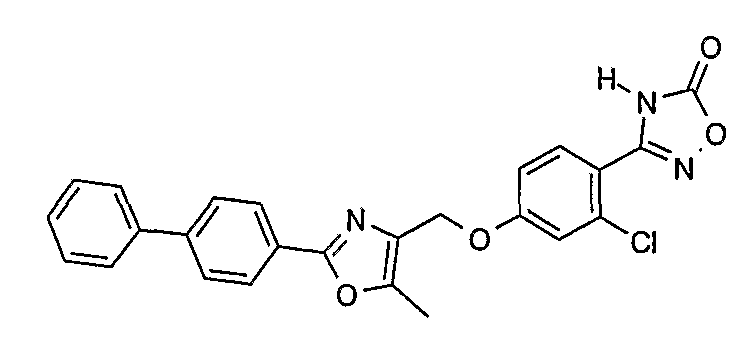
В соответствии со способом, описанным в примере 1, 3-[4-(2-бифенил-4-ил-5-метилоксазол-4-илметокси)-2-хлорфенил]-4Н-[1,2,4]оксадиазол-5-он получают из 4-иодметил-5-метил-2-п-бифенилоксазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С25Н18ClN3О4 (459,89); MС (ESI): 460 (М+Н+).
Пример 31
3-{2-Хлор-4-[2-(4-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он

В соответствии со способом, описанным в примере 1, 3-{2-хлор-4-[2-(4-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 4-иодметил-2-(4-метоксифенил)-5-метилоксазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С20Н16ClN3О5 (413,82); MС (ESI): 414 (М+Н+).
Пример 32
3-(2-Хлор-4-{2-[5-метил-2-(4-трифторметилфенил)тиазол-4-ил]этокси}фенил)-4Н-[1,2,4]оксадиазол-5-он

В соответствии со способом, описанным в примере 9, 2-хлор-4-{2-[5-метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]этокси}бензонитрил получают из 2-[5-метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]этанола и коммерчески доступного 2-хлор-4-гидроксибензонитрила. 2-Хлор-4-{2-[5-метил-2-(4-пентафторсульфанилфенил)тиазол-4-ил]этокси}бензонитрил превращают в 3-(2-хлор-4-{2-[5-метил-2-(4-трифторметилфенил)тиазол-4-ил]этокси}фенил)-4Н-[1,2,4]оксадиазол-5-он в соответствии со способом, описанным в примере 1.
С20Н15ClF5N3О3S2 (439,93), MС (ESI): 540 (М+Н+).
Пример 33
3-{2-Хлор-4-[4-метоксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
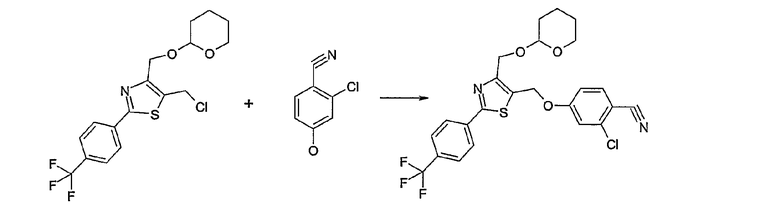
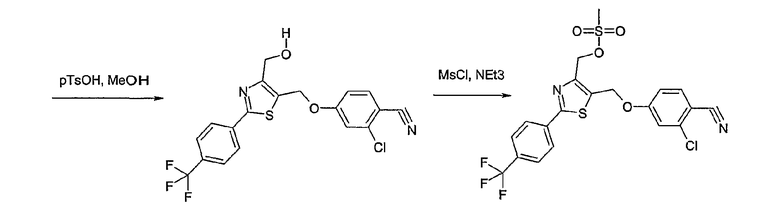
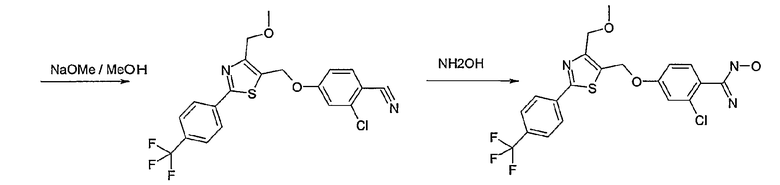
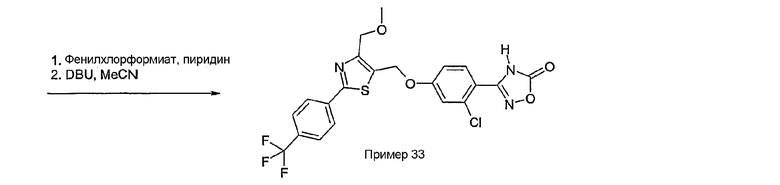
2-Хлор-4-[4-(тетрагидропиран-2-илоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрил
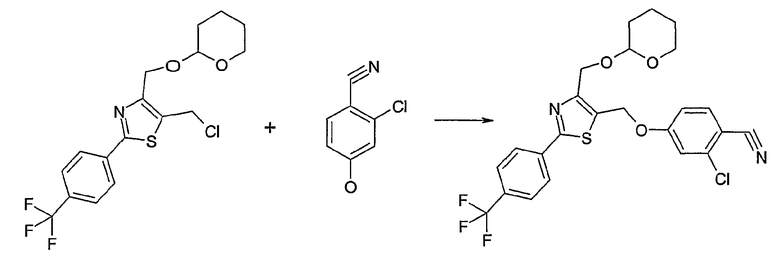
3,0 г 5-(Хлорметил)-4-[(тетрагидро-2Н-пиран-2-илокси)метил]-2-[4-(трифторметил)фенил]-1,3-тиазола (синтез описан в WO 2002/067912) растворяют в 100 мл диметилформамида, добавляют 5,0 г карбоната цезия и 1,53 г 2-хлор-4-гидроксибензонитрила и смесь перемешивают при комнатной температуре в течение ночи. Затем добавляют 300 мл этилацетата, смесь промывают три раза насыщенным раствором NaHCO3 и солевым раствором, затем сушат над MgSO4. Растворитель удаляют в вакууме, получая 4,1 г сырого 2-хлор-4-[4-(тетрагидропиран-2-илоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила в виде масла желтого цвета. Этот продукт используют без дальнейшей очистки.
С24Н20ClF3N2О3S (508,95); MС (ESI): 509,1 (М+Н+), 425,1 (М-ТНР+Н+).
2-Хлор-4-[4-гидроксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрил
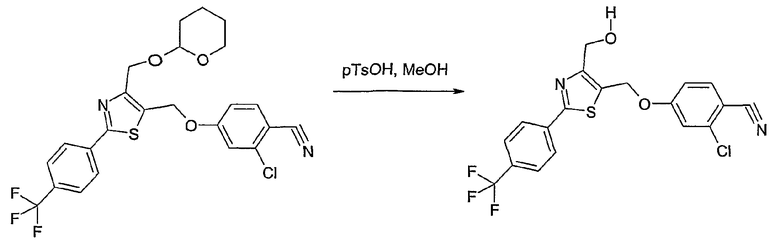
4,1 г 2-Хлор-4-[4-(тетрагидропиран-2-илоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила растворяют в 50 мл метанола. Добавляют 320 мг моногидрата п-толуолсульфокислоты и смесь перемешивают в течение одного часа при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в этилацетате и дважды промывают насыщенным раствором NaHCO3 и солевым раствором, затем сушат над MgSO4. Растворитель удаляют в вакууме, получая 3,4 г 2-хлор-4-[4-гидроксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила в виде твердого вещества бледно-желтого цвета.
С19Н12ClF3N2О2S (424,83); MС (ESI): 425,1 (М+Н+);
Rf (н-гептан:этилацетат = 1:1) = 0,27.
5-(3-Хлор-4-цианофеноксиметил)-2-(4-трифторметилфенил)тиазол-4-илметиловый эфир метансульфокислоты
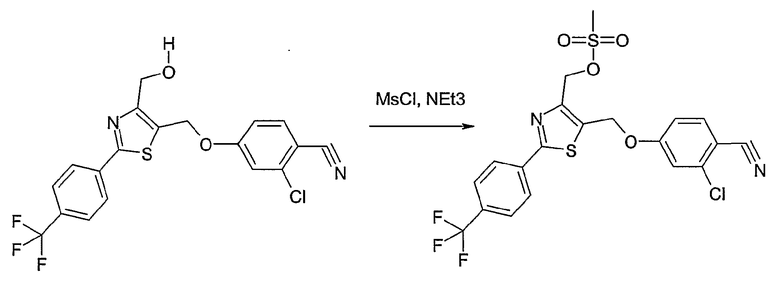
1,8 г 2-Хлор-4-[4-гидроксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила суспендируют в 50 мл дихлорметана и охлаждают на бане со льдом. Добавляют 0,39 мл метансульфонилхлорида и 0,89 мл триэтиламина. Полученную смесь перемешивают при температуре 0°С в течение одного часа, затем промывают водой и солевым раствором, сушат над MgSO4. Растворитель удаляют в вакууме, получая 1,0 г 5-(3-хлор-4-цианофеноксиметил)-2-(4-трифторметилфенил)тиазол-4-илметилового эфира метансульфокислоты в виде твердого вещества бледно-желтого цвета.
С20Н14ClF3N2О4S2 (502,92); MС (ESI): 503,1 (М+Н+).
2-Хлор-4-[4-метоксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрил
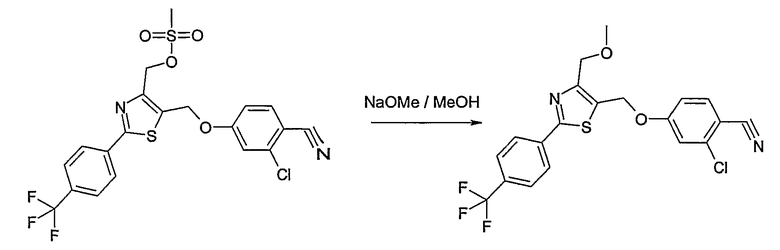
120 мг 5-(3-Хлор-4-цианофеноксиметил)-2-(4-трифторметилфенил)тиазол-4-илметилового эфира метансульфокислоты растворяют в 5 мл метанола. Добавляют 12,9 мг метилата натрия и смесь перемешивают при температуре 50°С в течение одного часа. Реакционную смесь разбавляют добавлением 50 мл этилацетата, промывают 1М соляной кислотой, затем сушат над MgSO4. Растворитель удаляют в вакууме и остаток очищают с помощью ВЭЖХ с обращенной фазой, получая 30 мг 2-хлор-4-[4-метоксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила в виде лиофилизата.
С20Н14ClF3N2О2S (438,86); MС (ESI): 439,1 (М+Н+).
3-{2-Хлор-4-[4-метоксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
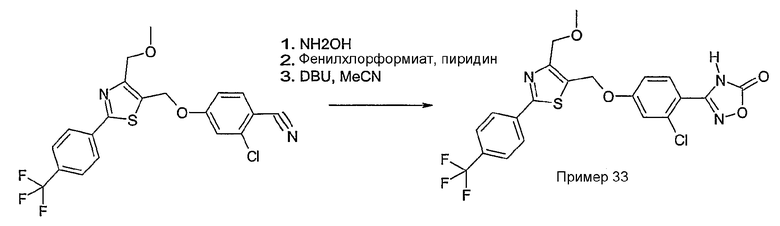
В соответствии со способом, описанным в примере 1, 3-{2-хлор-4-[4-метоксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 2-хлор-4-[4-метоксиметил-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила.
С21Н15ClF3N3О4S (497,88); MС (ESI): 498,3 (М+Н+).
Пример 34
3-{2-Хлор-4-[4-(2-метоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
2-Хлор-4-[4-(2-метоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрил
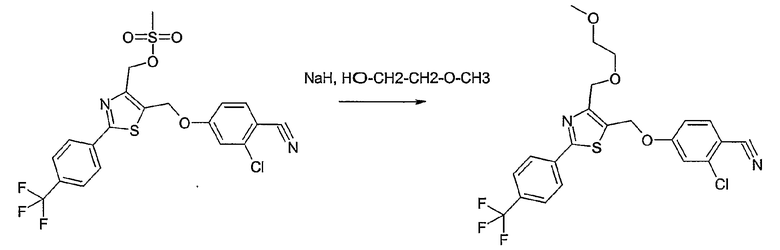
120 мг 5-(3-Хлор-4-цианофеноксиметил)-2-(4-трифторметилфенил)тиазол-4-илметилового эфира метансульфокислоты растворяют в 5 мл 2-метоксиэтанола. Добавляют 10,0 мг гидрида натрия и смесь перемешивают при температуре 50°С в течение одного часа. Реакционную смесь разбавляют добавлением 50 мл этилацетата, промывают солевым раствором, затем сушат над MgSO4. Растворитель удаляют в вакууме и остаток очищают с помощью ВЭЖХ с обращенной фазой, получая 30 мг 2-хлор-4-[4-(2-метоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила в виде лиофилизата.
С22Н18ClF3N2О3S (482,91); MС (ESI): 483,1 (М+Н+).
3-{2-Хлор-4-[4-(2-метоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
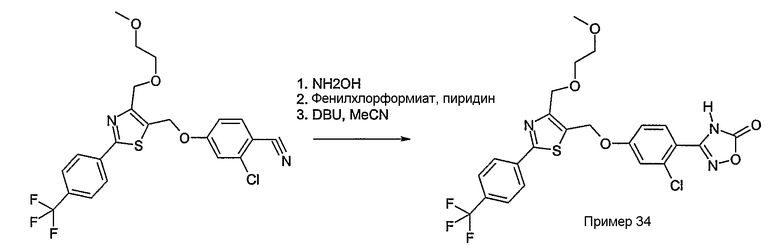
В соответствии со способом, описанным в примере 1, 3-{2-хлор-4-[4-(2-метоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 2-хлор-4-[4-(2-метоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]бензонитрила.
С23Н19ClF3N3О5S (541,94); MС (ESI): 542,2 (М+Н+).
Пример 35
3-{2-Хлор-4-[4-(2-этоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
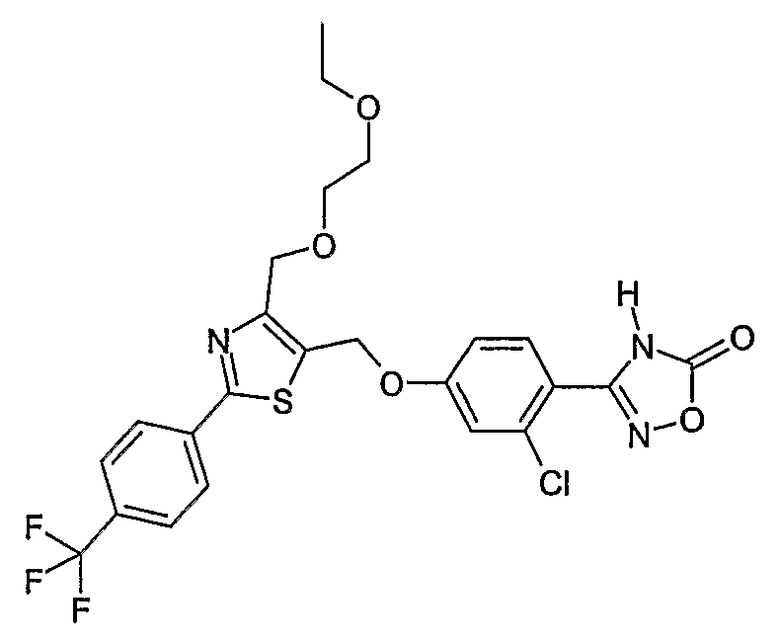
В соответствии со способом, описанным в примерах 1 и 34, 3-{2-хлор-4-[4-(2-этоксиэтоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 5-(3-хлор-4-цианофеноксиметил)-2-(4-трифторметилфенил)тиазол-4-илметилового эфира метансульфокислоты и 2-этоксиэтанола.
С24Н21ClF3N3О5S (555,96); MС (ESI): 556,3 (М+Н+).
Пример 36
3-{2-Хлор-4-[4-(3-метоксипропоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]-оксадиазол-5-он
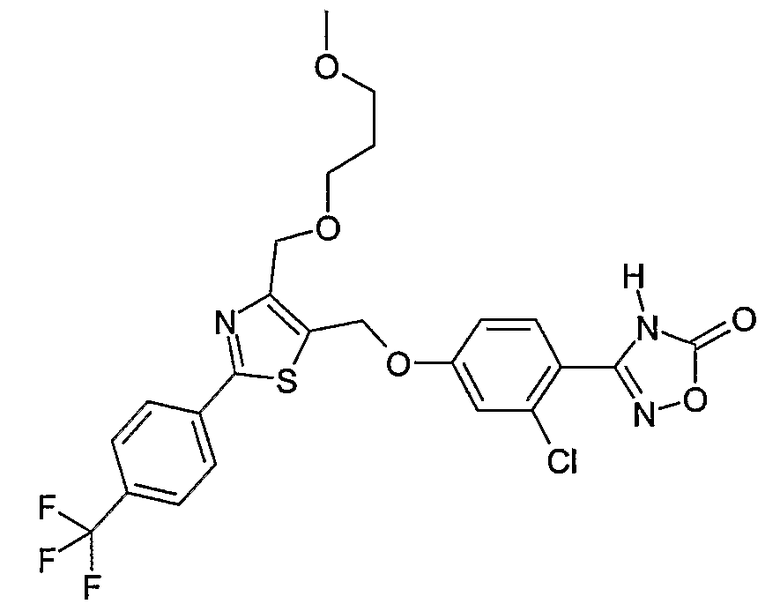
В соответствии со способом, описанным в примерах 1 и 34, 3-{2-хлор-4-[4-(3-метоксипропоксиметил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]-оксадиазол-5-он получают из 5-(3-хлор-4-цианофеноксиметил)-2-(4-трифторметилфенил)тиазол-4-илметилового эфира метансульфокислоты и 3-метокси-1-пропанола.
С24Н21ClF3N3О5S (555,96); MС (ESI): 556,3 (М+Н+).
Пример 37
3-{4-[5-Метоксиметил-2-(4-метоксифенил)оксазол-4-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он
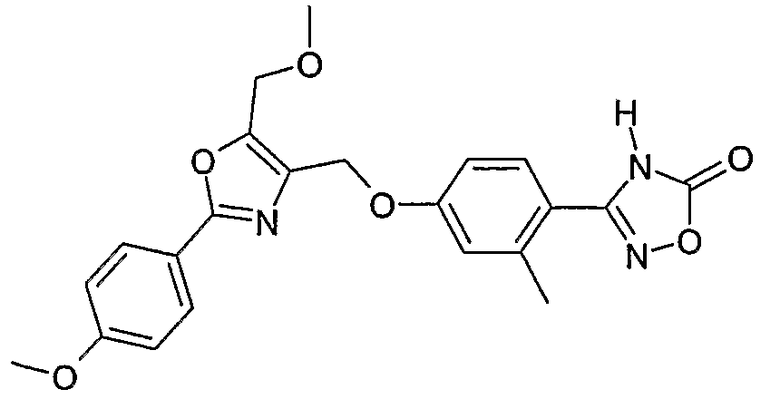
В соответствии со способом, описанным в примере 15 и примере 33, 3-{4-[5-метоксиметил-2-(4-метоксифенил)оксазол-4-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила.
С22Н21N3О6 (423,43); MС (ESI): 424,2 (М+Н+).
Пример 38
3-{4-[5-(2-Метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-4-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он
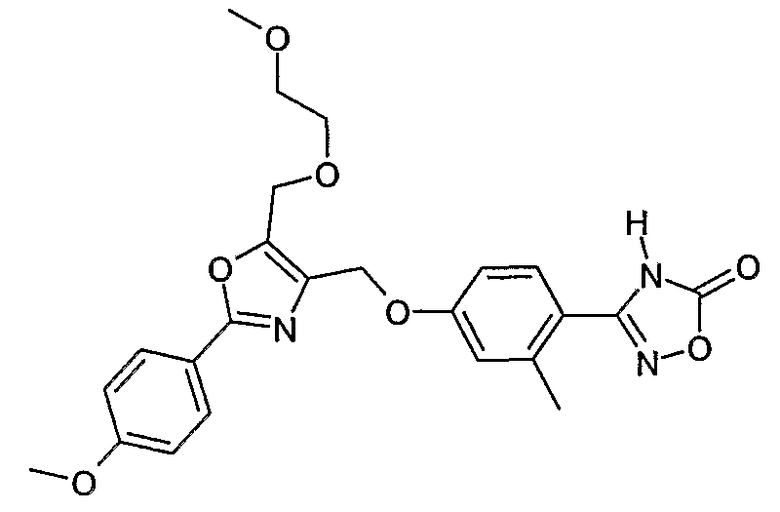
В соответствии со способом, описанным в примере 15 и примере 34, 3-{4-[5-(2-метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-4-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила и 2-метоксиэтанола.
С24Н25N3О7 (467,48); MС (ESI): 468,2 (М+Н+).
Пример 39
3-{4-[4-Метоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он

В соответствии со способом, описанным в примере 15 и примере 33, 3-{4-[4-метоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила.
С22Н21N3О6 (423,43); MС (ESI): 424,2 (М+Н+).
Пример 40
3-{4-[4-(2-Метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он
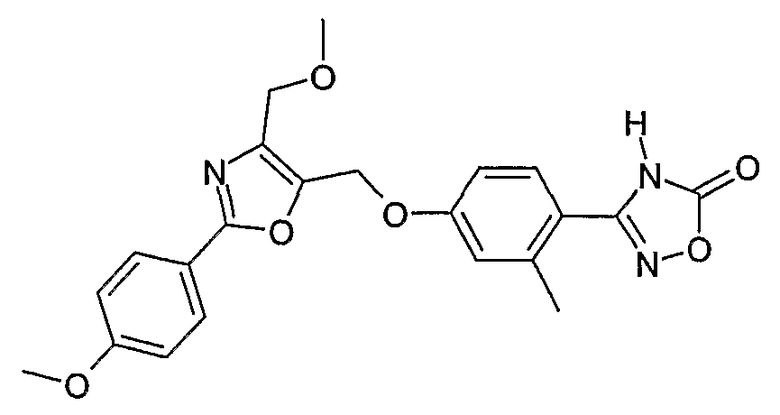
В соответствии со способом, описанным в примере 15 и примере 34, 3-{4-[4-(2-метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила и 2-метоксиэтанола.
С24Н25N3О7 (467,48); MС (ESI): 468,2 (М+Н+).
Пример 41
3-{4-[4-(2-Этоксиэтоксиметил)-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он

В соответствии со способом, описанным в примере 15 и примере 34, 3-{4-[4-(2-этоксиэтоксиметил)-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила и 2-этоксиэтанола.
С25Н27N3О7 (481,51); MС (ESI): 482,2 (М+Н+).
Пример 42
3-{4-[2-(4-Метоксифенил)-4-(3-метоксипропоксиметил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он
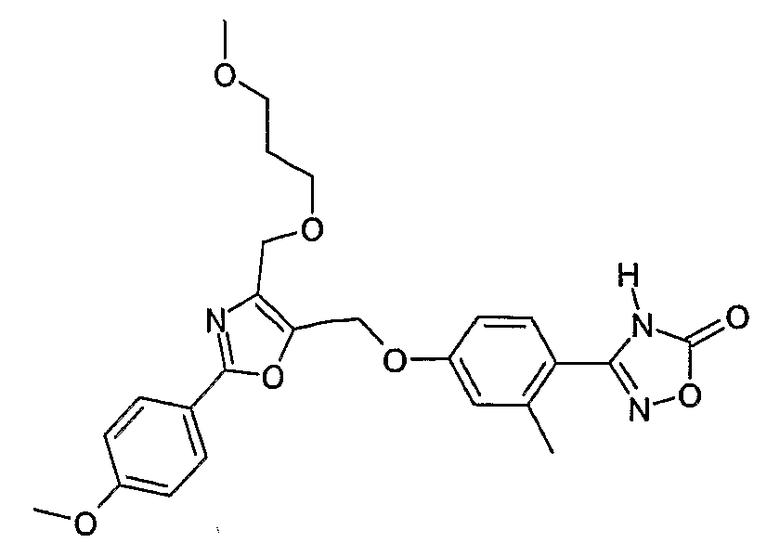
В соответствии со способом, описанным в примере 15 и примере 34, 3-{4-[2-(4-метоксифенил)-4-(3-метоксипропоксиметил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила и 3-метоксипропан-1-ола.
С25Н27N3О7 (481,51); MС (ESI): 482,2 (М+Н+).
Пример 43
3-{4-[4-Этоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он
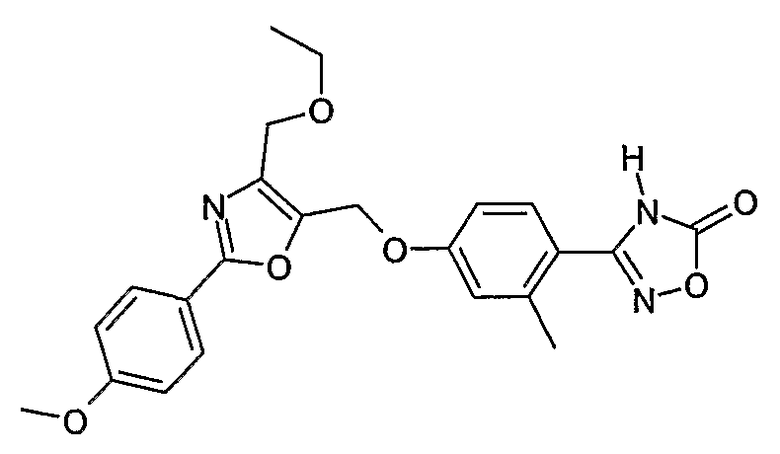
В соответствии со способом, описанным в примере 15 и примере 34, 3-{4-[4-этоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила и этанола.
С23Н23N3О6 (437,46); MС (ESI): 438,2 (М+Н+).
Пример 44
3-{4-[4-Бензилоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он
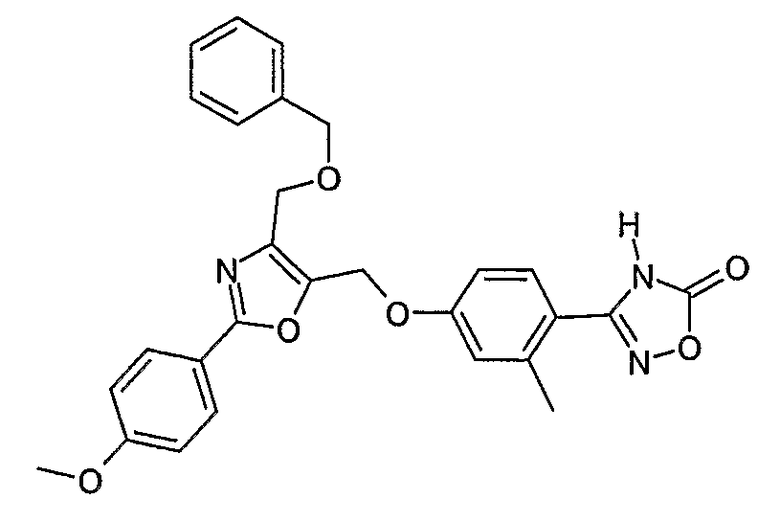
В соответствии со способом, описанным в примере 15 и примере 34, 3-{4-[4-бензилоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]-2-метилфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазол-5-ил]метанола и коммерчески доступного 4-фтор-2-метилбензонитрила и фенилметанола.
С28Н25N3О6 (499,53); MС (ESI): 500,2 (М+Н+).
Пример 45
3-{2-Хлор-4-[5-метоксиметил-2-(4-метоксифенил)оксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
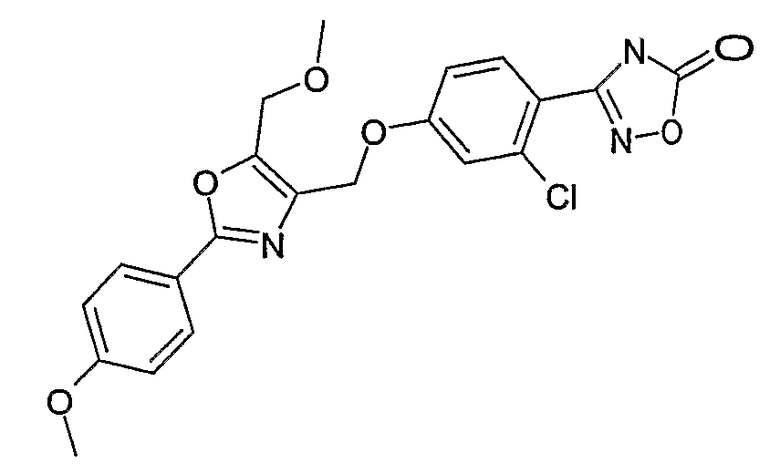
В соответствии со способом, описанным в примере 1 и примере 33, 3-{2-хлор-4-[5-метоксиметил-2-(4-метоксифенил)оксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-илметилового эфира метансульфокислоты и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С21Н18ClN3О6 (443,85); MС (ESI): 444,2 (М+Н+).
Пример 46
3-{2-Хлор-4-[5-(2-метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
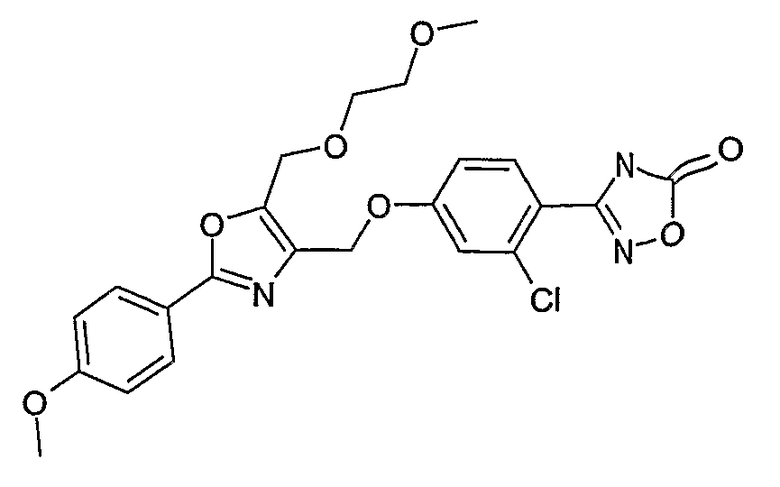
В соответствии со способом, описанным в примере 1 и примере 34, 3-{2-хлор-4-[5-(2-метоксиэтоксиметил)-2-(4-метоксифенил)оксазол-4-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 2-(4-метоксифенил)-5-(тетрагидропиран-2-илоксиметил)оксазол-4-илметилового эфира метансульфокислоты и коммерчески доступного 2-хлор-4-гидроксибензонитрила и 2-метоксиэтанола.
С23Н22ClN3О7 (487,90); MС (ESI): 488,2 (М+Н+).
Пример 47
3-{2-Хлор-4-[4-метоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
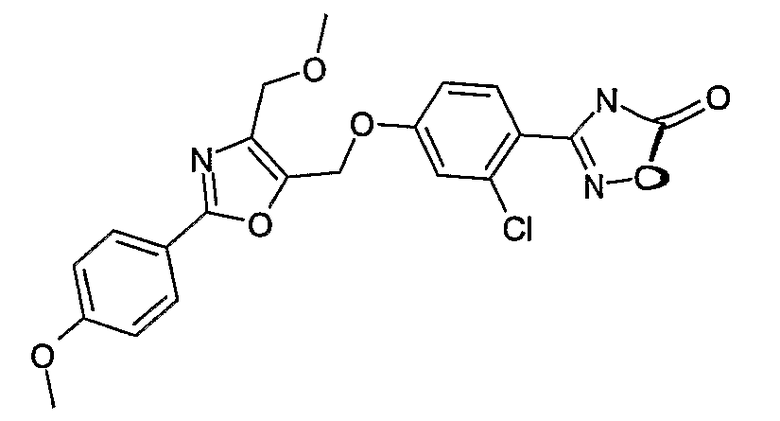
В соответствии со способом, описанным в примере 1 и примере 33, 3-{2-хлор-4-[4-метоксиметил-2-(4-метоксифенил)оксазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он получают из 5-хлорметил-2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила.
С21Н18ClN3О6 (443,85); MС (ESI): 444,2 (М+Н+).
Пример 48
3-{2-Хлор-4-[2-(4-метоксифенил)-4-(3-метоксипропоксиметил)оксазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
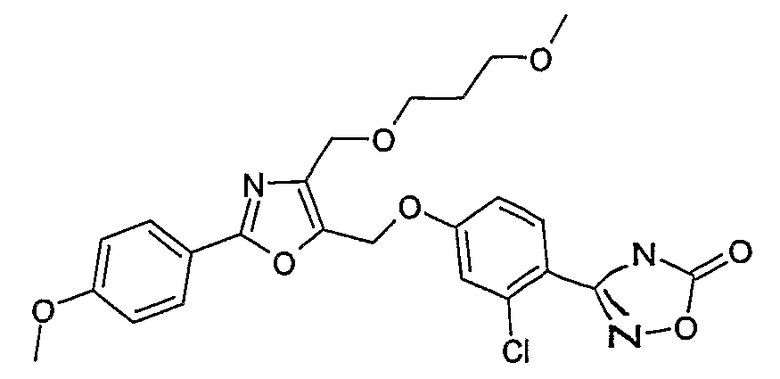
В соответствии со способом, описанным в примере 1 и примере 34, 3-{2-хлор-4-[2-(4-метоксифенил)-4-(3-метоксипропоксиметил)оксазол-5-илметокси]фенил}-4Н-[1,2,4]-оксадиазол-5-он получают из 5-хлорметил-2-(4-метоксифенил)-4-(тетрагидропиран-2-илоксиметил)оксазола и коммерчески доступного 2-хлор-4-гидроксибензонитрила и 3-метоксипропан-1-ола.
С24Н24ClN3О7 (501,93); MС (ESI): 502,2 (М+Н+).
Пример 49
3-{5-Бром-2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
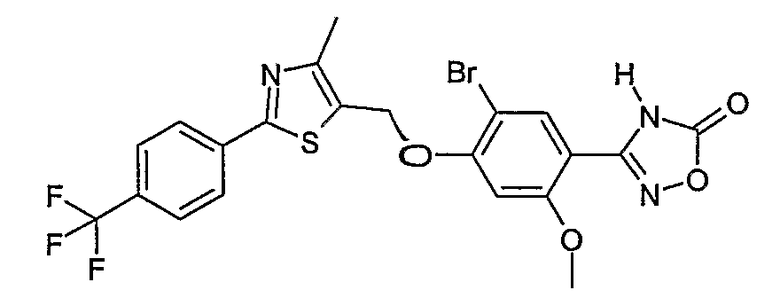
К раствору 100 мг 3-{2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]-оксадиазол-5-она в 1 мл ацетонитрила добавляют 0,08 г N-бромсукцинимида. Полученную смесь нагревают при температуре 70°С в течение ночи, концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (градиент: дихлорметан/метанол = от 100/0 до 94/6) и промывают смесью дихлорметан/метанол = 94/6, получая 35 мг 3-{5-бром-2-метокси-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-она.
С21Н15BrF3N3О4S (542,33); MС (ESI): 542,0 (М+Н+).
Пример 50
3-{4-[4-(3-Бензилоксипропил)-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он
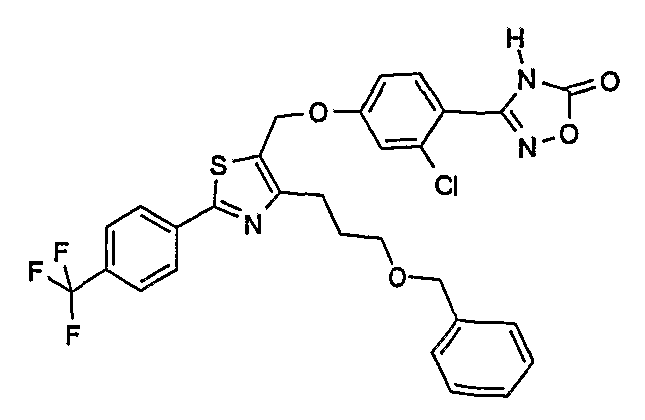
В соответствии со способом, описанным в примере 15, 3-{4-[4-(3-бензилоксипропил)-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]оксадиазол-5-он получают из [4-(3-бензилоксипропил)-2-(4-трифторметилфенил)тиазол-5-ил]метанола и коммерчески доступного 2-хлор-4-фторбензонитрила.
С29Н23ClF3N3О4S (602,03); MС (ESI): 602,2 (М+Н+).
Пример 51
3-{2-Хлор-4-[4-(3-гидроксипропил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-он
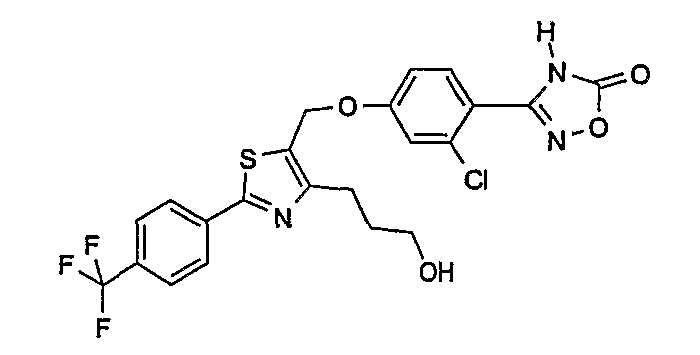
К раствору 200 мг 3-{4-[4-(3-бензилоксипропил)-2-(4-трифторметилфенил)тиазол-5-илметокси]-2-хлорфенил}-4Н-[1,2,4]-оксадиазол-5-она в 6 мл дихлорметана, охлажденному до температуры -70°С, добавляют 0,8 мл 1М раствора трибромида бора в дихлорметане. После перемешивания в течение 45 минут при температуре -60°С, раствор выливают в смесь метанола и насыщенного водного раствора гидрокарбоната натрия, отфильтровывают и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле (градиент: дихлорметан/метанол = от 100/0 до 90/10), затем кристаллизуют из смеси дихлорметан/диизопропиловый эфир, получая 18 мг 3-{2-хлор-4-[4-(3-гидроксипропил)-2-(4-трифторметилфенил)тиазол-5-илметокси]фенил}-4Н-[1,2,4]оксадиазол-5-она.
С22Н17ClF3N3О4S (511,91); MС (ESI): 512,1 (М+Н+).
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ТИРОЗИНФОСФАТАЗЫ БЕЛКА ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2435763C2 |
| 1,3,4-ОКСАДИАЗОЛ-2-ОНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ PPAR-ДЕЛЬТА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2375358C2 |
| АНТАГОНИСТЫ РЕЦЕПТОРА АДЕНОЗИНА A, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2318824C2 |
| ЗАМЕЩЕННЫЕ ПИПЕРАЗИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ | 2002 |
|
RU2300533C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ АРИЛСУЛЬФОНЫ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, КОТОРЫЕ ОТВЕЧАЮТ НА МОДУЛИРОВАНИЕ 5HT РЕЦЕПТОРОВ | 2007 |
|
RU2451012C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНЫХ МОДУЛЯТОРОВ МЕТАБОТРОПНОГО ГЛУТАМАТНОГО РЕЦЕПТОРА 2 (РЕЦЕПТОРА MGLU2) | 2008 |
|
RU2479577C2 |
| АГЕНТ, АКТИВИРУЮЩИЙ РЕЦЕПТОР, АКТИВИРУЕМЫЙ ПРОЛИФЕРАТОРАМИ ПЕРОКСИСОМ δ | 2007 |
|
RU2435764C2 |
| N-(1,2,5-ОКСАДИАЗОЛ-3-ИЛ)БЕНЗАМИДЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2010 |
|
RU2554349C9 |
| ПРОИЗВОДНЫЕ КСАНТИНА В КАЧЕСТВЕ АНТАГОНИСТОВ A АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2003 |
|
RU2318825C2 |
| АРИЛКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2340605C2 |
Описываются производные оксадиазолона формулы (I) где Х означает СН2 или связь; R1, R2, R3, R4 независимо означают H, F, Cl, Br, CF3, (С1-С4)-алкил, (С0)-алкилен-O-(С1-С4)-алкилен-Н, SCH3, S(O)СН3, S(O)2СН3, CN; Z означает связь или СН2; Y означает О, S, S(O) или S(O)2; W означает СН2 или СН2СН2; один из U и V означает N, а другой означает S или О; R5 выбирают из группы, состоящей из (С1-С8)-алкила, (С1-С6)-алкилен-O-(С0-С4)-алкилен-Н, (C1-С6)-алкилен-O-(С0-С4)-алкиленфенила,
(С2-С8)-алкенила, и где (C1-C8)-алкил или алкилен может быть однократно или двукратно замещен ОН или O-(C1-C4)-алкилом; R6, R7 независимо означают Н, CF3, (С0-С4)-алкилен-O-(С0-С4)-алкилен-Н, SF5, фенил; и их физиологически приемлемые соли. Соединения проявляют агонистическую активность по отношению к PPAR-дельта. 22 з.п. ф-лы, 2 табл.
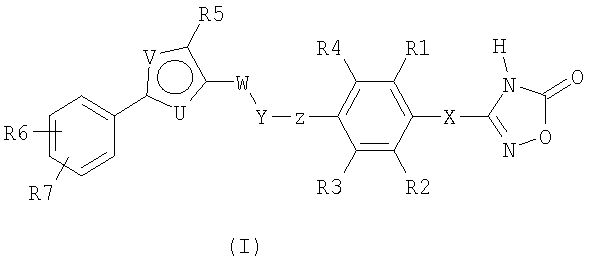
1. Производные оксадиазолона формулы (I)
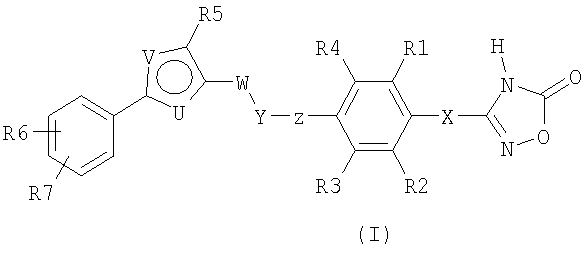
где X означает СН2 или связь;
R1, R2, R3, R4 независимо означают Н, F, Cl, Br, CF3, (С1-С4)-алкил, (С0)-алкилен-O-(С1-С4)-алкилен-Н, SCH3, S(O)СН3,
S(O)2СН3, CN;
Z означает связь или СН2;
Y означает О, S, S(O) или S(O)2;
W означает СН2 или СН2СН2;
один из U и V означает N, а другой означает S или О;
R5 выбирают из группы, состоящей из (C1-C8)-алкила, (С1-С6)-алкилен-O-(C0-С4)-алкилен-Н, (С1-С6)-алкилен-O-(C0-С4)-алкиленфенила,
(С2-С8)-алкенила, и где (С1-С8)-алкил или алкилен может быть однократно или двукратно замещен ОН или O-(С1-С4)-алкилом;
R6, R7 независимо означают Н, CF3, (C0-С4)-алкилен-O-(C0-С4)-алкилен-Н, SF3, фенил; или
так же как их физиологически приемлемые соли.
2. Соединение формулы (I) по п.1, где Х означает связь.
3. Соединения формулы (I) по п.1, где
Х означает связь или СН2;
R1 означает Н, F, Cl, Br, CF3, (С1-С4)-алкил, O-(С1-С4)-алкил, SCH3, S(O)СН3, S(O)2СН3, CN;
R2 означает Н, F;
R3 означает H, Br, O-(С1-С4)-алкил;
R4 означает H;
Z означает связь или СН3;
Y означает О, S, S(O) или S(O)2;
W означает CH2 или СН2СН3;
U означает S и
V означает N, или
U означает N и
V означает S, или
U означает N и
V означает О;
R5 означает (С1-С6)-алкил или (С2-С6)-алкенил, где (С1-С6)-алкил может быть однократно или двукратно замещен ОН;
R6 находится в пара-положении и означает CF3, SF5, ОСН3, фенил;
R7 означает Н.
4. Соединения формулы (I) по п.1, где Х означает связь;
R1 означает Н, F, Cl, Br, CF3, (С1-С4)-алкил, O-(С1-С4)-алкил, SCH3, S(O)СН3, S(O)2СН3, CN;
R2 означает Н, F;
R3 означает Н, Br, O-(С1-С4)-алкил;
R4 означает Н;
Z означает связь или СН2;
Y означает O, S, S(O) или S(O)2;
W означает CH2 или CH2CH2;
U означает S и V означает N, или U означает N и V означает S, или U означает N и V означает О;
R5 означает (С1-С6)-алкил или (С2-С6)-алкенил, где (С1-С6)-алкил может быть однократно или двукратно замещен ОН;
R6 находится в пара-положении и означает CF3, SF5, ОСН3, фенил;
R7 означает Н или F.
5. Соединения формулы (I) по п.1, где
Х означает связь;
R1 означает Cl или СН3;
R2, R3, R4 означают Н;
Z означает связь;
Y означает О;
W означает СН2;
U означает S и V означает N, или U означает N и
V означает О, или U означает О и V означает N;
R5 означает (С1-С4)-алкилен-O-(С1-С4)-алкилен-Н или (С1-С4)-алкилен-O-(С1-С4)-алкиленфенил, где алкилен может быть замещен O-(С1-С4)-алкилом;
R6 находится в пара-положении и означает CF3 или ОСН3;
R7 означает Н.
6. Соединения формулы (I) по п.1, где Х означает связь;
R1 означает ОСН3 или F;
R2, R3, R4 означают Н;
Z означает связь;
Y означает О или S;
W означает СН3 или СН2СН2;
U означает S и
V означает N, или
R5 означает (С1-С4)-алкил,
R6 находится в пара-положении и означает CF3;
R7 означает Н.
7. Соединения формулы (I) по п.1 или 2, где
Х означает связь или СН2;
R1 означает Н, F, Cl, Br, ОСН3, SCH3, CF3, СН3, CN, S(O)СН3, S(O)2СН3;
R2 означает Н, F;
R3 означает Н, ОСН3, Br;
R4 означает Н;
Z означает связь или CH2;
Y означает О, S, S(O) или S(O)2;
W означает СН2 или СН2СН2; U означает S и V означает N, или U означает N и V означает S;
R5 означает (С1-С4)-алкил или (С2-С4)-алкенил, где (С1-С4)-алкил может быть однократно или двукратно замещен ОН, или
R5 означает (С1-С4)-алкилен-O-(С1-С4)-алкилен-Н или (C1-C4)-алкилен-O-(С1-С4)-алкиленфенил, где алкилен может быть замещен O-(C1-С4)-алкилом;
R6 означает п-CF3 или п-SF5; и
R7 означает Н.
8. Соединения формулы (I) по п.1, где
Х означает связь;
R1 означает Cl, СН3;
R2 означает Н;
R3 означает Н;
R4 означает Н;
Z означает связь;
Y означает О;
W означает СН2;
U означает N и
V означает О, или
U означает О и
V означает N;
R5 означает (С1-С4)-алкил, (С1-С4)-алкилен -O-(С1-С4)-алкилен-Н или (С1-С4)-алкилен-O-(С1-С4)-алкиленфенил, где алкилен может быть замещен O-(С1-С4)-алкилом;
R6 означает п-ОСН3 или п-фенил; и R7 означает Н.
9. Соединения формулы (I) по п.1, где
R1, R2 независимо означают Н, F, Cl, Br, ОСН3, SCH3, CF3, СН3, CN, S(O)СН3, S(O)2СН3;
Х означает связь и Z означает связь;
R3, R4 независимо означают Н, ОСН3;
R6 находится в пара-положении и означает CF3, SF5, ОСН3, фенил;
R7 означает Н.
10. Соединения формулы (I) по п.1, где R1, R2 независимо означают Н, F, Cl, Br, ОСН3, SCH3, CF3, СН3, CN, S(O)СН3, S(O)2СН3;
Х означает связь и W означает СН3;
R3, R4 независимо означают Н, ОСН3;
R6 находится в пара-положении и означает CF3, SF5, ОСН3, фенил;
R7 означает Н.
11. Соединения формулы (I) по п.1, где
U означает S и
V означает N, или
U означает N и
V означает S, или
U означает О и
V означает N, или
U означает N и
V означает О.
12. Соединения формулы (I) по п.1, где
U означает S;
V означает N;
Z означает связь.
13. Соединения формулы (I) по п.1, где U означает N;
V означает О;
Z означает связь;
Х означает связь.
14. Соединения формулы (I) по п.1, где Х означает связь и Z означает связь.
15. Соединения формулы (I) по п.1, где R6 находится в пара-положении.
16. Соединения формулы (I) по п.1, где R7 означает Н.
17. Соединения формулы (I) по п.1, где R2, R3, R4 означают Н;
R1 означает Н, F, Cl, Br, CF3, (С1-С4)-алкил, C0-алкилен-O-(C1-C4)-алкилен-Н, SCH3, S(O)СН3, S(O)2CH3, CN.
18. Соединения формулы (I) по п.1, где Y означает О или S.
19. Соединения формулы (I) по п.1, где W означает СН3.
20. Соединения формулы (I) по п.1, где R5 означает (С1-С4)-алкил или (С1-С4)-алкилен-O-(С0-С4)-алкилен-Н, где алкилен может быть замещен O-(С0-С4)-алкилен-Н.
21. Соединения формулы (I) по п.1, где R1 означает F, Cl, СН3, ОСН3.
22. Соединения формулы (I) по п.1, где R5 означает (С1-С4)-алкил.
23. Соединение формулы (I) по п.1, где R6 означает CF3, SF5, фенил, ОСН3.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КАТИОННЫЕ СОЛИ ИЛИ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ | 1992 |
|
RU2079497C1 |
Авторы
Даты
2009-11-27—Публикация
2005-03-19—Подача