Область техники
Изобретение относится к активаторам рецепторов, активируемых пролифераторами пероксисом (PPAR).
Предпосылки изобретения
По виду активатора были идентифицированы три подтипа рецепторов, активируемых пролифераторами пероксисом (PPAR), а именно, PPARα, PPARγ и PPARδ (Proc. Natl. Acad. Sci. USA, 91, p7335-7359, 1994).
В литературе опубликованы различные соединения, функциями которых являются активация транскрипции подтипов PPAR, понижение уровня сахара в крови или улучшение метаболизма липидов. Например, было опубликовано, что соединения GW-590735 (GSK), KRP-101 (Kyorin) и NS-220 (Roche-Nippon Shinyaku) являются селективными α-агонистами, способными улучшать метаболизм липидов (J Pharmacol Exp Ther 309(3): 970, Jun 2001).
Другие агенты функционируют как двойные агонисты PPARγ и PPARα. Например, известны, как обладающие этим действием изображенные ниже производные TZD (тиазолидиндиона), такие как KRP-297 (Kyorin), и другие, такие как Мураглитазар (BMS) и Тезаглитазар (AstraZeneca). Эти соединения были разработаны как соединения-агонисты PPAR для лечения диабета в основном для воздействия на PPARα. Поэтому, сообщалось, что эти соединения не обладают сильным действием в отношении PPARγ .
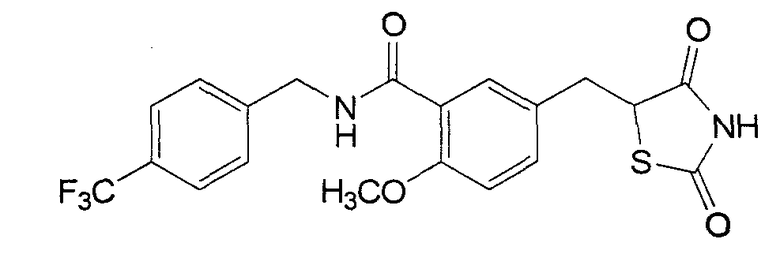
KRP-297 (Kyorin)
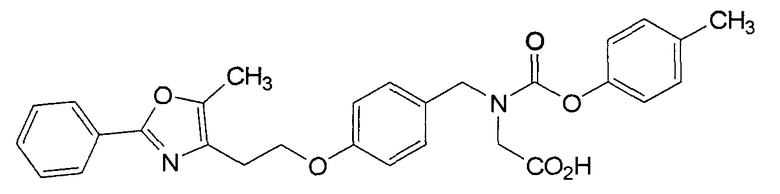
Мураглитазар (BMS)
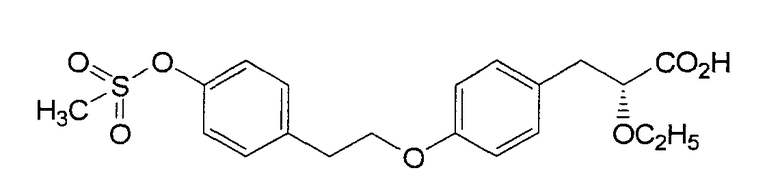
Тезаглитазар (AstraZeneca)
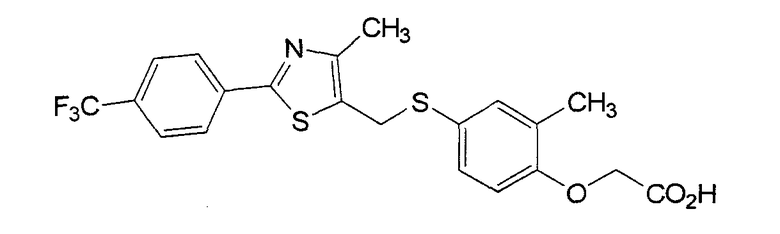
В качестве селективного агониста PPARδ известно соединение GW-501516 (GSK) с приведенной ниже формулой, которое относится к феноксиуксусным кислотам. В патенте WO 01/603 и статье в Bioorg Med Chem Lett 13 (2003) 1517-1521 было опубликовано, что соединение было разработано, как агент, улучшающий метаболизм липидов.
Патент WO 01/603 далее раскрывает следующие соединения, относящиеся к фенилглицинам и фенилпропионовым кислотам.
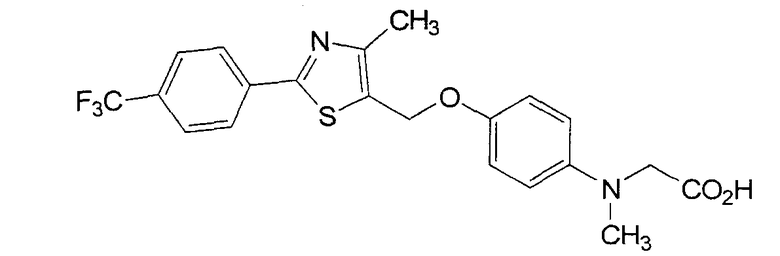
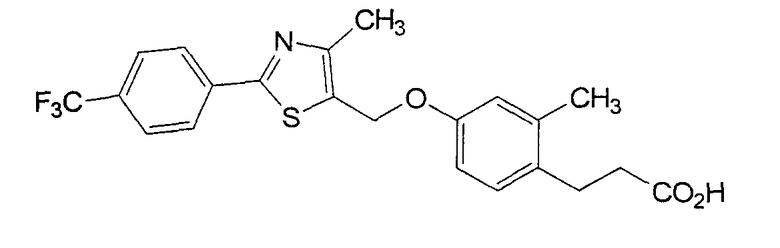
Авторы настоящего изобретения подали заявку WO 02/76957, которая раскрывает приведенное ниже соединение, относящееся к фенилуксусным кислотам, способное активировать транскрипцию PPARδ.
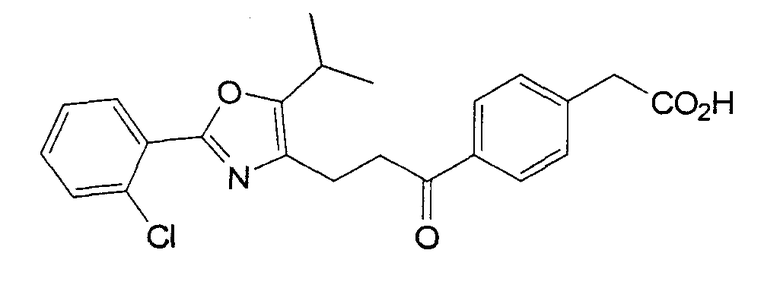
Авторы настоящего изобретения дополнительно подали заявку WO 03/16291, в которой описано соединение, относящееся к замещенным феноксиуксусным кислотам, которое также является превосходным активатором транскрипции PPARδ.
Недавно, в патенте WO 04/63184 в качестве модулятора PPAR было раскрыто соединение, относящееся к фенилпропионовым кислотам, в формуле которого присутствует тиофен.
В статье Bioorg Med Chem Lett 13 (2003) 1517-1521 описано, что активирующее действие соединений фенилпропионовой кислоты на PPARδ примерно в 30 раз слабее, чем действие соединений феноксиуксусной кислоты.
В патенте WO 01/603 и статье Bioorg Med Chem Lett 13 (2003) 1517-1521 не описан медицинский эффект фенилглицинов.
Соединения, представленные формулами (I), (II) и (III) по настоящему изобретению, отличаются от вышеприведенных соединений, таких как GW-501516. Вышеупомянутые документы не описывают эти соединения.
Описание изобретения
Предметом настоящего изобретения являются соединения, представленные формулами (I), (II) и (III), которые действуют как активаторы PPAR.
В ходе исследований, проведенных авторами настоящего изобретения, неожиданно было обнаружено, что соединения фенилпропионовой кислоты являются превосходными активаторами PPAR δ, что отличается от описания в статье Bioorg Med Chem Lett 13 (2003) 1517-1521. На основе этого открытия было выполнено настоящее изобретение.
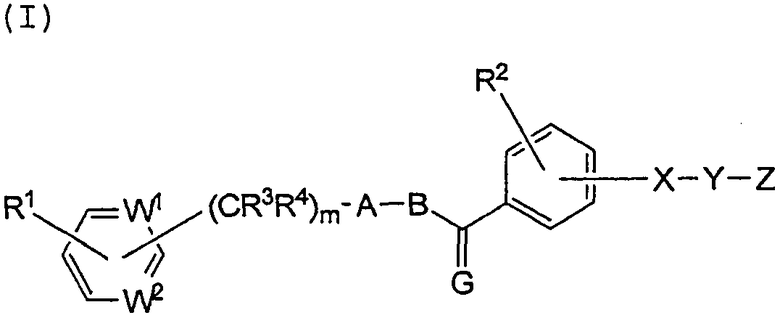
Настоящее изобретение относится к соединению, имеющему следующую формулу (I), или к его соли:
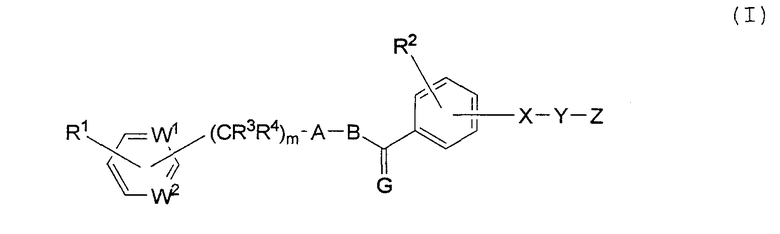
где каждый из W1 и W2, независимо, представляет собой СН или азот;
Х представляет собой NR5 или CR6R7, где R5 является водородом, С1-8 алкилом, С1-8-алкилом, замещенным галогеном, С1-8-алкилом, замещенным С1-8алкокси, циклоалкилом с числом звеньев в кольце от трех до семи, С1-8-алкилом, замещенным циклоалкилом из трехчленного или семичленного кольца, С1-8-алкилом, замещенным фенилом, С2-8 ацилом или С2-8 алкенилом, а каждый из R6 и R7, независимо, представляет собой водород или С1-8 алкил;
Y представляет собой -(СR8R9)n-, где каждый из R8 и R9, независимо, представляет собой водород или С1-8 алкил, а n является числом от 1 до 4; или
Х и Y вместе образуют -CR10=CR11- или этилен, где каждый из R10 и R11, независимо, представляет собой водород или С1-8 алкил;
Z является карбоксилом или тетразолилом;
G представляет собой О, S или CR12R13, где каждый из R12 и R13, независимо, представляет собой водород или С1-8 алкил;
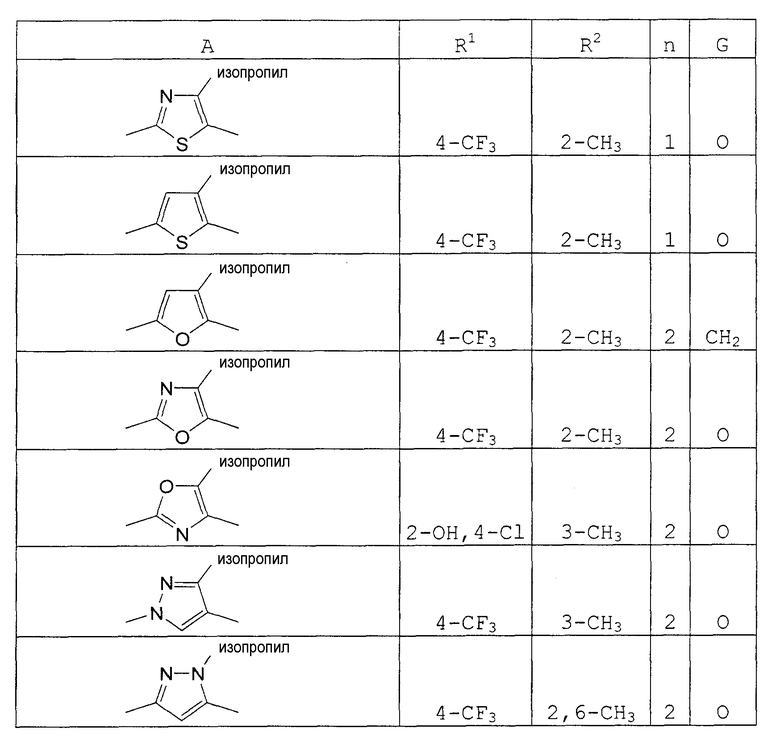
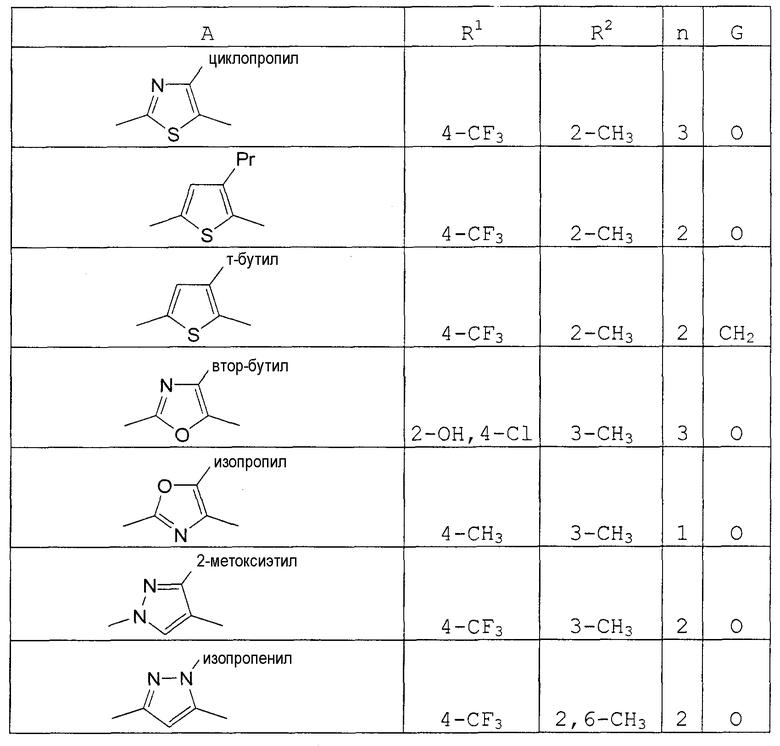
А представляет собой пятичленное гетероциклическое кольцо, выбранное из группы, состоящей из тиазола, оксазола, имидазола, пиразола, тиофена, фурана и пиррола, необязательно замещенного заместителем, выбранным из группы, состоящей из С1-8 алкила, С2-8 алкенила, С2-8 алкинила, С1-8 алкокси, галогена, С1-8 алкила, замещенного галогеном, С1-8 алкокси, замещенного галогеном, гидроксила, нитро-группы, С2-8 ацила, С6-10 арила и пятичленной или шестичленной гетероциклической группы;
В представляет собой С1-8 алкиленовую, С2-8 алкениленовую или С2-8 алкиниленовую цепь, где цепь может иметь заместитель, выбранный из группы, состоящей из С1-8 алкила, циклоалкила с числом звеньев в кольце от трех до семи, С1-8 алкокси и галогена;
каждый из R1 и R2, независимо, представляет собой водород, С1-8 алкил, С2-8 алкенил, С2-8 алкинил, С1-8 алкокси, галоген, С1-8 алкил, замещенный галогеном, С1-8 алкокси, замещенный галогеном, гидроксил, нитро-группу, С2-8 ацил, С6-10 арил или пятичленную или шестичленную гетероциклическую группу;
каждый из R3 и R4, независимо, представляет собой водород или С1-8 алкил; и
m является целым числом от 0 до 3.
Изобретение также относится к соединению, имеющему следующую формулу (II), или к его соли:
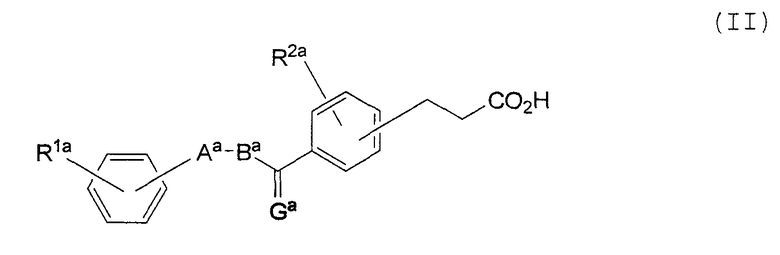
где Gа представляет собой О, S или CН2;
Аа представляет собой пятичленное гетероциклическое кольцо, выбранное из группы, состоящей из тиазола, оксазола и тиофена, в которых может находиться заместитель, выбранный из группы, состоящей из С1-8 алкила, С1-8 алкокси, галогена, С1-8 алкила, замещенного галогеном, С1-8 алкокси, замещенного галогеном, гидроксила, нитро-группы и С2-8 ацила;
Ва представляет собой С1-8 алкиленовую или С2-8 алкениленовую цепь; а
каждый из R1а и R2а, независимо, представляет собой водород, С1-8 алкил, С1-8 алкокси, галоген, С1-8 алкил, замещенный галогеном, С1-8 алкокси, замещенный галогеном, гидроксил, нитро-группу или С2-8 ацил.
Изобретение также относится к соединению, имеющему следующую формулу (III), или к его соли:
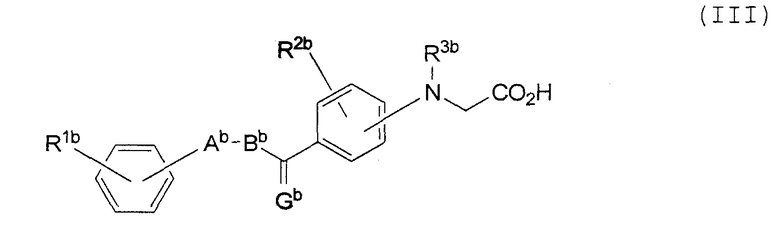
где Gb представляет собой О, S или CН2;
Аb представляет собой пятичленное гетероциклическое кольцо, выбранное из группы, состоящей из тиазола, оксазола и тиофена, в которых может находиться заместитель, выбранный из группы, состоящей из С1-8 алкила, С1-8 алкокси, галогена, С1-8 алкила, замещенного галогеном, С1-8 алкокси, замещенного галогеном, гидроксила, нитро-группы и С2-8 ацила;
Вb представляет собой С1-8 алкиленовую или С2-8 алкениленовую цепь;
каждый из R1b и R2b независимо представляет собой водород, С1-8 алкил, С1-8 алкокси, галоген, С1-8 алкил, замещенный галогеном, С1-8 алкокси, замещенный галогеном, гидроксил, нитро-группу или С2-8 ацил; а
R3b представляет собой водород или С1-8 алкил.
Настоящее изобретение относится к активатору PPAR δ, который содержит в качестве действующего компонента соединение, имеющее формулу (I), (II) или (III), или его соль.
Изобретение также относится к способу активации PPAR δ, который отличается тем, что эффективная доза соединения, имеющего формулу (I), (II) или (III), или его соли, вводится в качестве действующего компонента.
Изобретение далее относится к способу лечения и/или профилактики заболевания, опосредуемого PPAR δ, такого как дислипидемия, метаболический синдром, ожирение, включая ожирение внутренних органов, атеросклероз или болезни, которые ассоциированы с ним, или диабет, отличающемуся тем, что эффективная доза соединения, имеющего формулу (I), (II) или (III), или его соли, вводится в качестве действующего компонента.
Кроме того, изобретение относится к применению соединения, имеющего формулу (I), (II) или (III), или его соли для лечения и/или профилактики заболевания, опосредуемого PPAR δ, такого как дислипидемия, метаболический синдром, ожирение, включая ожирение внутренних органов, атеросклероз или болезни, которые ассоциированы с ним, или диабет.
Наилучшие варианты осуществления изобретения
Далее изобретение описано более подробно.
В формуле (I), R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, заместителем пятичленного гетероциклического кольца, представленного А, и заместителем С1-8 алкиленовой, С2-8 алкениленовой цепи, С2-8 алкиниленовой цепи, представленной В, может быть С1-8 алкил. Примеры С1-8 алкила включают метил, этил, пропил, изопропил, бутил, изобутил, т-бутил, пентил и гексил.
R1, R2, R5 и заместителем пятичленного гетероциклического кольца, представленного А, может быть С2-8 алкенил. Примеры С2-8 алкенила включают винил и аллил.
R1, R2 и заместителем пятичленного гетероциклического кольца, представленного А, может быть С2-8 алкинил. Примеры С2-8 алкинила включают пропаргил.
R1, R2, заместителем пятичленного гетероциклического кольца, представленного А, и заместителем С1-8 алкиленовой, С2-8 алкениленовой или С2-8 алкиниленовой цепи, представленной В, может быть С1-8 алкокси. Примеры С1-8 алкокси включают метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси-, т-бутокси-, пентилокси- и гексилокси-группу.
R1, R2, заместителем пятичленного гетероциклического кольца, представленного А, и заместителем С1-8 алкиленовой, С2-8 алкениленовой или С2-8 алкиниленовой цепи, представленной В, может быть галоген. Примеры галогена включают фтор, хлор и бром.
R1, R2, R5 и заместителем пятичленного гетероциклического кольца, представленного А, может быть С1-8 алкил, замещенный галогеном. Примеры замещенного галогеном С1-8 алкила включают метил, этил, пропил, изопропил, бутил и т-бутил, в которых от одного до трех атомов водорода замещены галогенами, такими как фтор, хлор и бром. Предпочтительными являются трифторметил, хлорметил, 2-хлорэтил, 2-бромэтил и 2-фторэтил.
R1, R2 и заместителем пятичленного гетероциклического кольца, представленного А, может быть С1-8 алкокси, замещенный галогеном. Примеры замещенного галогеном С1-8 алкокси включают метокси-, этокси-, пропокси-, изопропокси-, бутокси и т-бутокси-группу, в которой от одного до трех атомов водорода замещены атомами галогена, такими как атомы фтора, хлора или брома. Предпочтительными являются трифторметокси-, хлорметокси-, 2-хлорэтокси, 2-бромэтокси и 2-фторэтокси-группы.
R1, R2, R5 и заместителем пятичленного гетероциклического кольца, представленного А, может быть С2-8 ацил. Примеры С2-8 ацила включают ацетил и пропионил.
R1, R2 и заместителем пятичленного гетероциклического кольца, представленного А, может быть С6-10 арил. Примеры С6-10 арила включают фенил.
R1, R2 и заместителем пятичленного гетероциклического кольца, представленного А, может быть пятичленная или шестичленная гетероциклическая группа. Примеры пятичленной или шестичленной гетероциклической группы включают пиридил.
R5 может быть С1-8 алкилом, замещенным С1-8 алкокси. Примеры С1-8 алкила, замещенного С1-8 алкокси, включают метил, этил, пропил, изопропил, бутил, изобутил, т-бутил, пентил и гексил, замещенные метокси-, этокси-, пропокси-, изопропокси-, бутокси, изобутокси, т-бутокси-, пентилокси- или гексилокси-группой.
R5 может быть циклоалкилом с числом звеньев в кольце от 3 до 7. Примеры циклоалкила с числом звеньев в кольце от 3 до 7 включают циклопропил, циклобутил, циклопентил и циклогексил.
R5 может быть С1-8 алкилом, замещенным циклоалкилом с числом звеньев в кольце от 3 до 7. Примеры С1-8 алкила, замещенного циклоалкилом с числом звеньев в кольце от 3 до 7, включают метил, этил, пропил, изопропил, бутил, изобутил, т-бутил, пентил и гексил, которые замещены циклопропилом, циклобутилом, циклопентилом или циклогексилом.
R5 может быть С1-8 алкилом, замещенным фенилом. Примеры С1-8 алкила, замещенного фенилом, включают бензил и фенэтил.
Заместителем С1-8 алкиленовой, С2-8 алкениленовой или С2-8 алкиниленовой цепи, представленной В, может быть циклоалкил с числом звеньев в кольце от 3 до 7. Примеры циклоалкила с числом звеньев в кольце от 3 до 7 включают циклопропил, циклобутил, циклопентил или циклогексил.
В формуле (II), R1а, R2а и заместителем пятичленного гетероциклического кольца, представленного Аа, может быть С1-8 алкил, С1-8 алкокси, галоген, С1-8 алкил, замещенный галогеном, С1-8 алкокси, замещенный галогеном, и С2-8 ацил. Их примеры такие же, как примеры R1, R2 и заместителя пятичленного гетероциклического кольца, представленного А, в формуле (I).
В формуле (III), R1b, R2b и заместителем пятичленного гетероциклического кольца, представленного Аb, может быть С1-8 алкил, С1-8 алкокси, галоген, С1-8 алкил, замещенный галогеном, С1-8 алкокси, замещенный галогеном, и С2-8 ацил. Их примеры такие же, как примеры R1, R2 и заместителя пятичленного гетероциклического кольца, представленного А, в формуле (I).
В формуле (III), R3b может быть С1-8 алкил. Примеры его такие же, как примеры R5 в формуле (I).
Каждый из R1, R2 в формуле (I), R1а, R2а в формуле (II), R1b, R2b в формуле (III) может представлять собой от одной до трех групп, присоединенных к кольцам, таким как бензольное кольцо. Две или три группы могут различаться между собой.
Предпочтительные соединения по настоящему изобретению приведены ниже.
(1) Соединение, имеющее формулу (I), или его соль, где каждый из W1 и W2 является СН.
(2) Соединение, имеющее формулу (I), его соль, соединение по п. (1) или его соль, где Х является СR6R7.
(3) Соединение, имеющее формулу (I), его соль, соединение по п. (1) или его соль, где Х является СН2.
(4) Соединение, имеющее формулу (I), его соль, соединение по п. (1) или его соль, где Х является NR5.
(5) Соединение, имеющее формулу (I), его соль, соединение по п. (1) или его соль, где Х является NН.
(6) Соединение, имеющее формулу (I), его соль, соединение по п. (1) или его соль, где Х является NR5, а R5 является С1-8 алкилом.
(7) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(6) или его соль, где Y является СН2.
(8) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(7) или его соль, где Z является карбоксилом.
(9) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(8) или его соль, где G является О.
(10) Соединение, имеющее формулу (I), его соль, соединение, по одному из пп. (1)-(9) или его соль, где А является тиазолом, в котором может находиться заместитель, выбранный из группы, состоящей из С1-8 алкила, С2-8 алкенила, С2-8 алкинила, С1-8 алкокси, галогена, С1-8 алкила, замещенного галогеном, С1-8 алкокси, замещенного галогеном, гидроксила, нитро-группы, С2-8 ацила, С6-10 арила и пятичленной или шестичленной гетероциклической группы.
(11) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(10) или его соль, где В является цепью этилена.
(12) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(11) или его соль, где каждый из R1 и R2, независимо, является водородом, С1-8 алкилом, С2-8 алкенилом, С1-8 алкокси, галогеном, С1-8 алкилом, замещенным галогеном, или С1-8 алкокси, замещенным галогеном.
(13) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(11) или его соль, где каждый из R1 и R2, независимо, является водородом, С1-8 алкилом, галогеном или С1-8 алкилом, замещенным галогеном.
(14) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(13) или его соль, где каждый из R3 и R4 является водородом.
(15) Соединение, имеющее формулу (I), его соль, соединение по одному из пп. (1)-(14) или его соль, где m равно 0.
(16) Соединение, имеющее формулу (II) или его соль, где Gа является О.
(17) Соединение, имеющее формулу (II), его соль, соединение по п. (16) или его соль, где Аа является тиазолом, в котором может находиться заместитель, выбранный из группы, состоящей из С1-8 алкила, С1-8 алкокси, галогена, С1-8 алкила, замещенного галогеном, С1-8 алкокси, замещенного галогеном, гидроксила, нитро-группы и С2-8 ацила.
(18) Соединение, имеющее формулу (II), его соль, соединение по п. (16) или (17) или его соль, где Ва является цепью этилена.
(19) Соединение, имеющее формулу (II), его соль, соединение по одному из пп. (16)-(18) или его соль, где каждый из R1а и R2а, независимо, является водородом, С1-8 алкилом, С1-8 алкокси, галогеном, С1-8 алкилом, замещенным галогеном, или С1-8 алкокси, замещенным галогеном.
(20) Соединение, имеющее формулу (III), или его соль, где Gb является О.
(21) Соединение, имеющее формулу (III), его соль, соединение по п. (20) или его соль, где Аb является тиазолом, в котором может находиться заместитель, выбранный из группы, состоящей из С1-8 алкила, С1-8 алкокси, галогена, С1-8 алкила, замещенного галогеном, С1-8 алкокси, замещенного галогеном, гидроксила, нитро-группы и С2-8 ацила.
(22) Соединение, имеющее формулу (III), его соль, соединение, по п. (20) или (21) или его соль, где Вb является цепью этилена.
(23) Соединение, имеющее формулу (III), его соль, соединение по одному из пп. (20)-(22) или его соль, где каждый из R1b и R2b, независимо, является водородом, С1-8 алкилом, С1-8 алкокси, галогеном, С1-8 алкилом, замещенным галогеном, или С1-8 алкокси, замещенным галогеном.
Соединение, имеющее формулу (I), (II) или (III), может находиться в виде фармацевтически приемлемой соли. Примеры соли включают соль щелочного металла, такую как натриевая соль, калиевую соль и литиевую соль.
Соединение по настоящему изобретению также может находиться в виде оптического изомера, такого как энантиомер, или рацемического соединения, или в виде геометрического изомера, такого как цис- или транс-изомер. Эти изомеры включены в объем настоящего изобретения.
Процессы получения соединения формулы (I) по изобретению описаны ниже.
Схема синтеза 1 (где G является О, В является этиленом, а Z является карбоксилом)
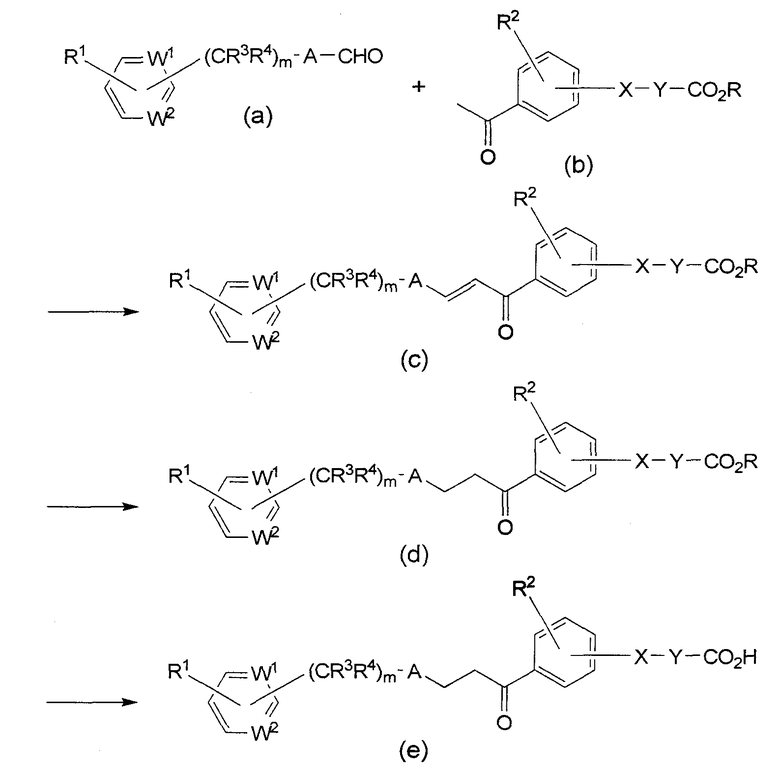
В формулах приведенной выше схемы синтеза, R является низшим алкилом, а каждый из W1, W2, X, Y, A, R1, R2, R3, R4 и m описаны выше.
Соединение формулы (с) можно получить в результате реакции альдегида формулы (а) с производным ацетофенона формулы (b) в присутствии основания, такого как метилат натрия или этилат натрия в инертном растворителе, таком как ТГФ (тетрагидрофуран), метанол или этанол.
Реакцию каталитического гидрирования полученного соединения формулы (с) проводят в присутствии палладиевого катализатора на активированном угле в инертном растворителе, таком как ТГФ или метанол, получая сложный эфир формулы (d). Гидролиз сложного эфира формулы (d) осуществляют в присутствии гидроксида лития или аналогичного соединения, получая соединение формулы (е) по настоящему изобретению.
Если Х-Y-СО2Н является пропионовой кислотой, то в качестве соединения формулы (b) можно использовать акриловый эфир. В этом случае, чтобы получить формулу (d), акриловый эфир восстанавливают до пропионового эфира на стадии восстановления формулы (с).
Схема синтеза 2 (где G является СН2, а Z является карбоксилом)
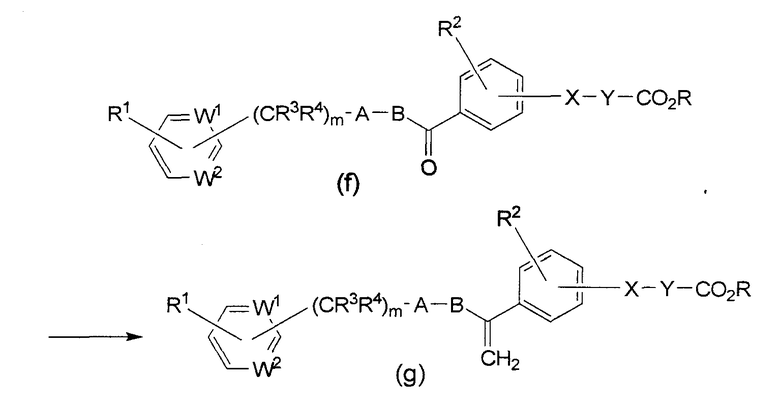
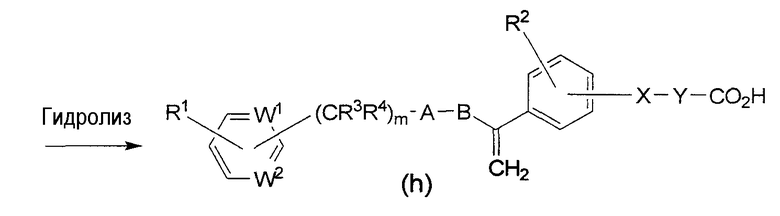
В формулах приведенной выше схемы синтеза, R является низшим алкилом, а каждый из W1, W2, X, Y, A, В, R1, R2, R3, R4 и m описаны выше.
Эфир формулы (g) можно получить в результате реакции кетона формулы (f) с метилтрифенилфосфинийбромидом, амидом натрия в инертном растворителе, таком как ТГФ. Гидролиз эфира формулы (g) проводят в присутствии гидроксида лития, получая соединение формулы (h) по настоящему изобретению.
Схема синтеза 3 (где Х является NR5, а Z является карбоксилом)
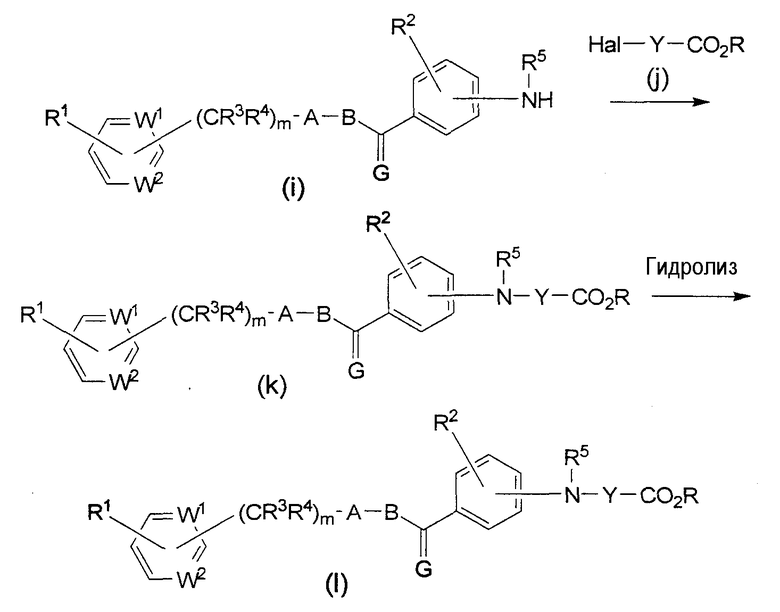
В формулах приведенной выше схемы синтеза, R является низшим алкилом, Hal = галоген, а каждый из W1, W2, Y, A, В, R1, R2, R3, R4, R5 и m описаны выше.
Сложный эфир формулы (k) можно получить реакцией амина формулы (i) с алифатическим сложным эфиром формулы (j). Гидролиз сложного эфира формулы (k) проводят, чтобы получить соединение формулы (l) по настоящему изобретению.
Исходный амин формулы (i), в котором R5 является алкилом, можно получить по следующей схеме.
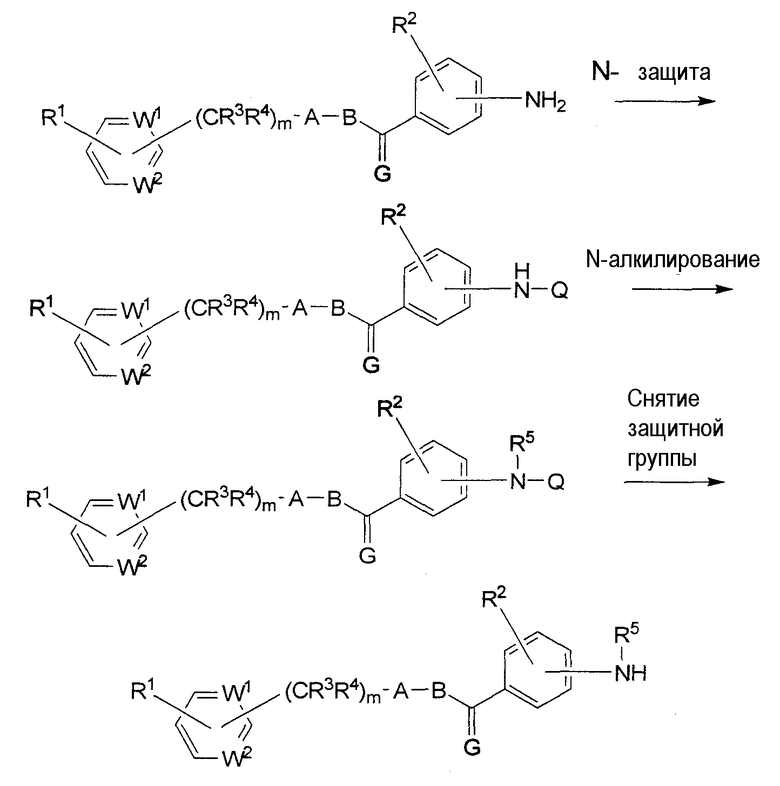
В этих формулах R5 является алкилом, Q является защитной группой, например, о-нитробензолсульфонилом и т.п., а каждый из W1, W2, A, В, R1, R2, R3, R4 и m описаны выше.
Исходный амин (i), в котором R5 является водородом, можно получить по следующей схеме.
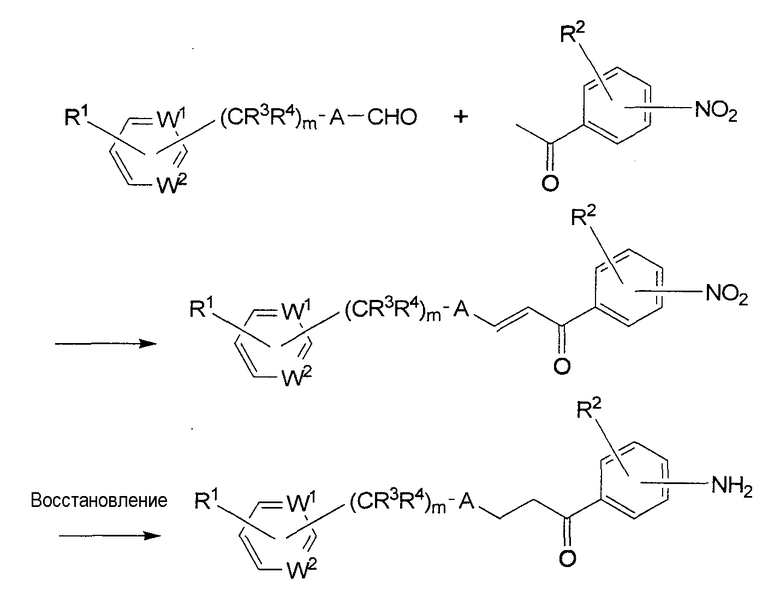
В формулах этой схемы реакции каждый из W1, W2, A, R1, R2, R3, R4 и m описаны выше.
Соединение по настоящему изобретению, имеющее формулу (I), (II) или (III), можно получить по приведенным выше схемам синтеза, по приведенным далее примерам и по приведенным выше патентам или опубликованным документам.
Примеры соединений по настоящему изобретению показаны в нижеследующих таблицах 1-37.
(1)
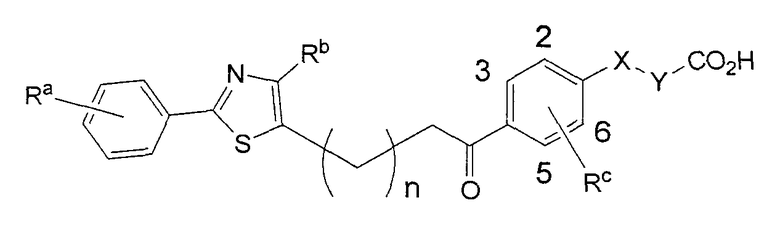
В этой формуле Х, Y, Ra, Rb, Rc и n указаны в таблицах 1-3.
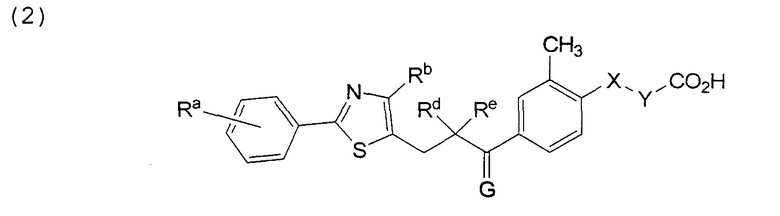
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 4.
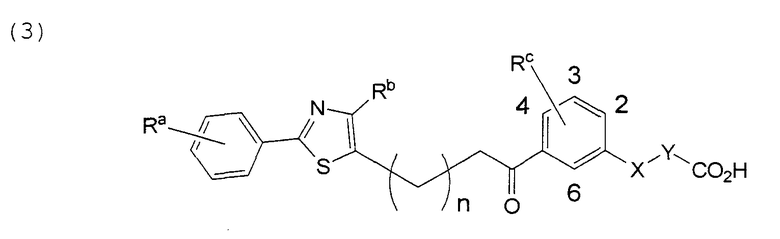
В этой формуле Х, Y, Ra, Rb, Rс и n указаны в таблицах 5 и 6.
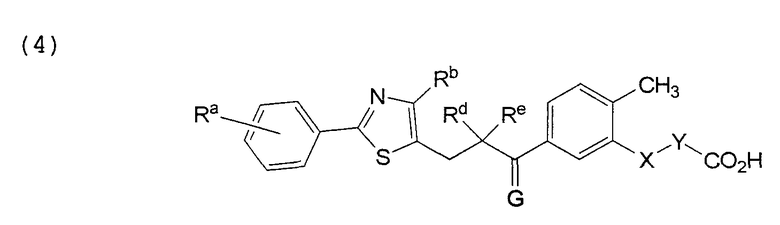
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 7.
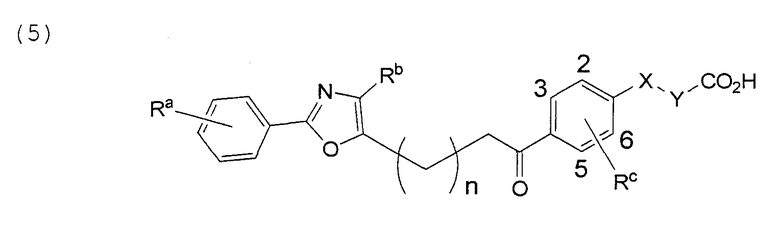
В этой формуле Х, Y, Ra, Rb, Rс и n указаны в таблицах 8 и 9.
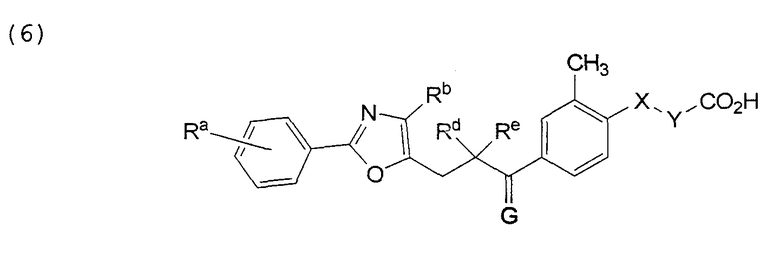
В этой формуле Х, Y, Ra, Rd, Re и G указаны в таблице 10.
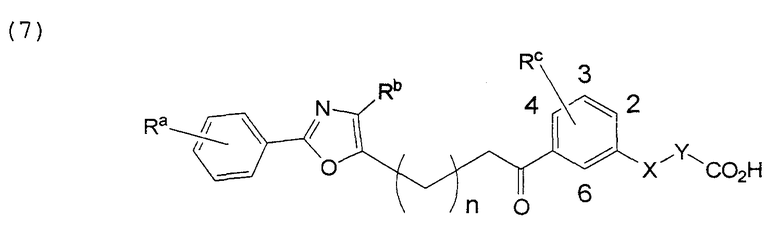
В этой формуле Х, Y, Ra, Rb, Rc и n указаны в таблицах 11-13.
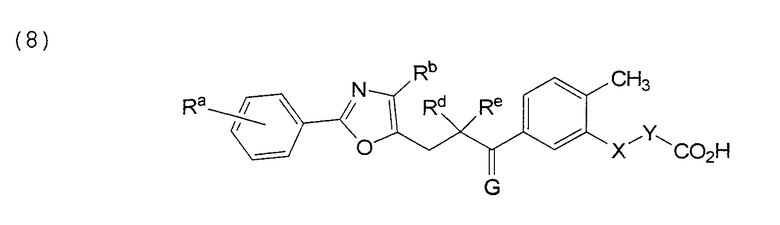
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 14.
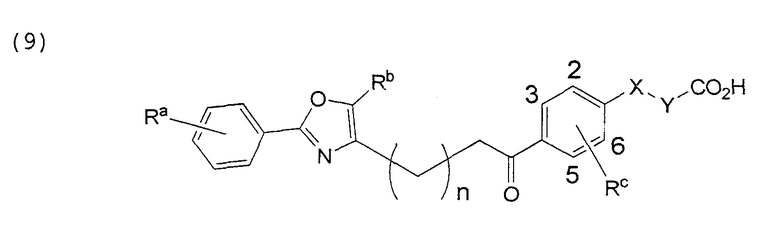
В этой формуле Х, Y, Ra, Rb, Rc и n указаны в таблицах 15-17.
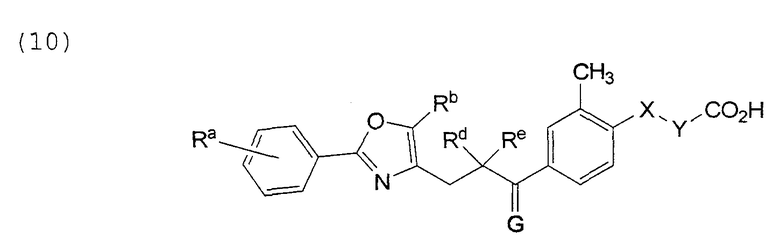
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 18.
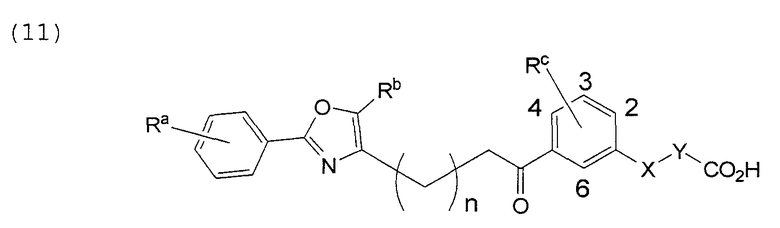
В этой формуле Х, Y, Ra, Rb, Rс и n указаны в таблицах 19 и 20.
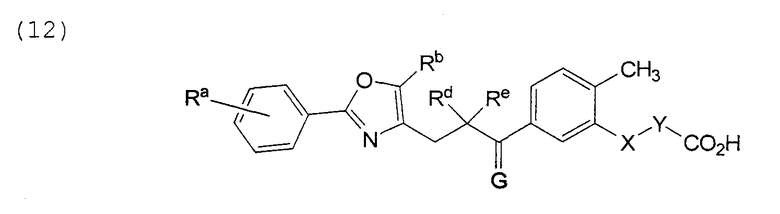
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 21.
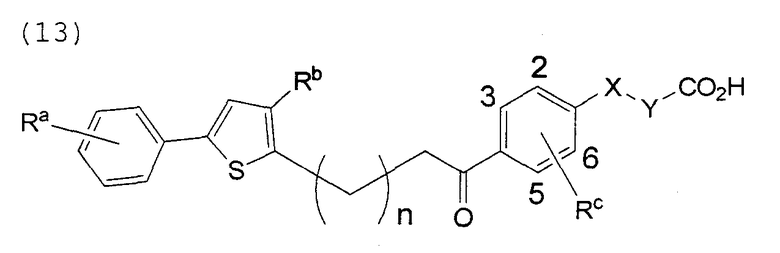
В этой формуле Х, Y, Ra, Rb, Rс и n указаны в таблицах 22 и 23.
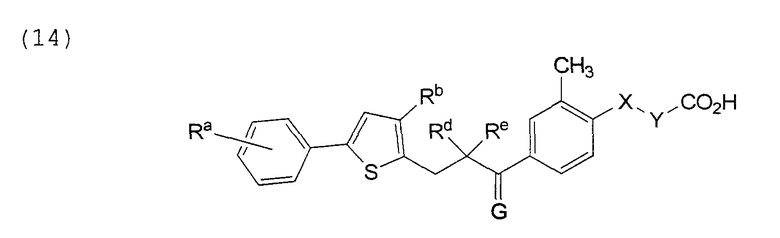
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 24.
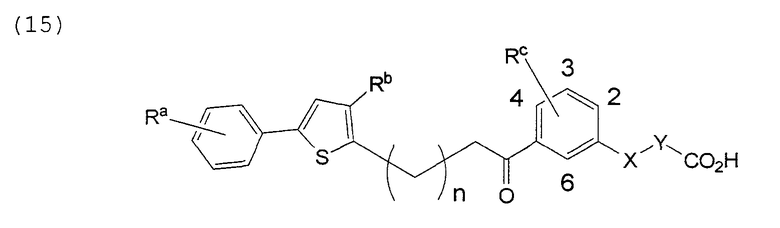
В этой формуле Х, Y, Ra, Rb, Rс и n указаны в таблицах 25 и 26.
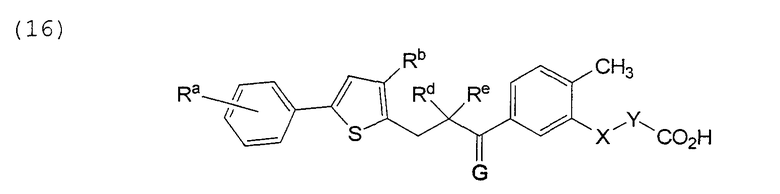
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 27.
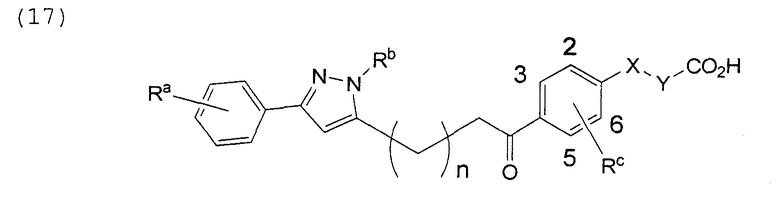
В этой формуле Х, Y, Ra, Rb, Rс и n указаны в таблицах 28 и 29.
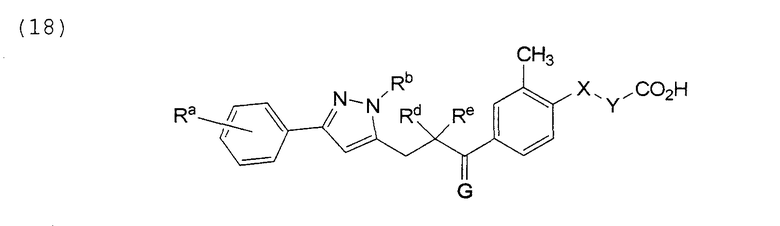
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 30.
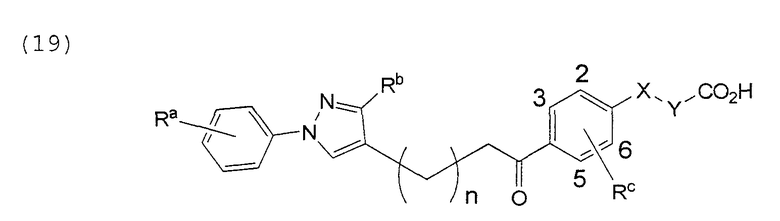
В этой формуле Х, Y, Ra, Rb, Rс и n указаны в таблицах 31 и 32.
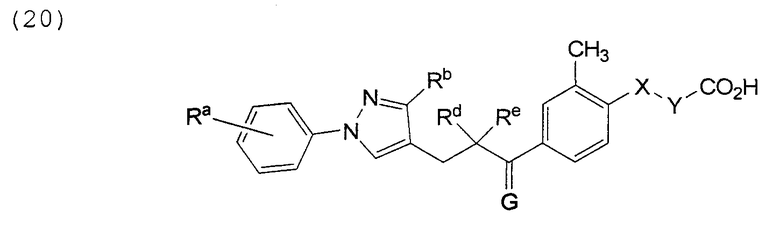
В этой формуле Х, Y, Ra, Rb, Rd, Re и G указаны в таблице 33.
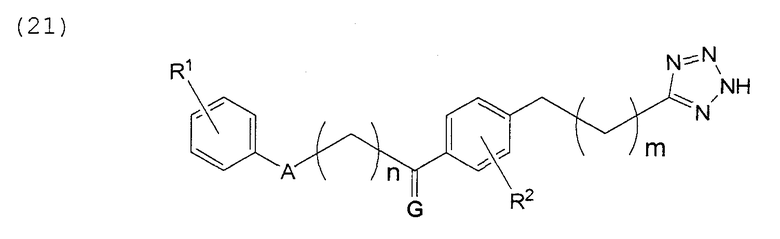
В этой формуле А, R1, R2, m, n и G указаны в таблицах 34 и 35.
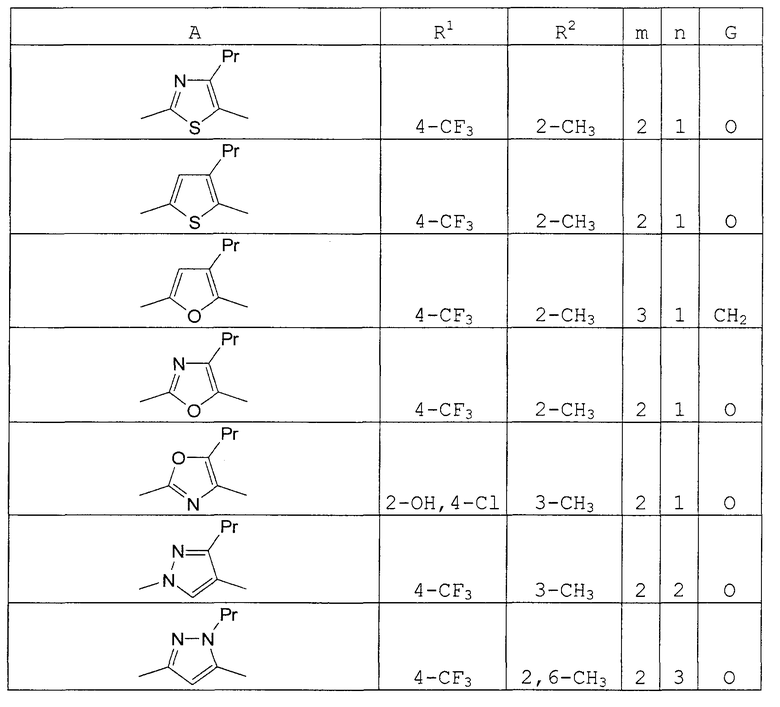
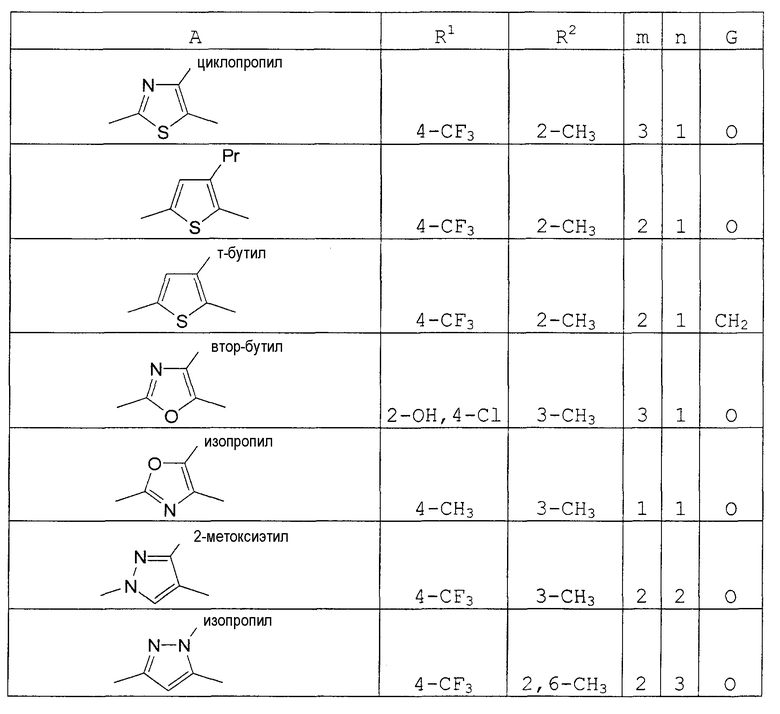
В этой формуле А, R1, R2, n и G указаны в таблицах 36 и 37.
Фармакологические эффекты изобретения описаны ниже.
Активирующее действие на PPAR соединения по изобретению определяли следующим способом:
Клетки CV-1 (АТСС) трансформировали плазмидой, экспрессирующей рецептор (pSG5-GAL4-hPPARα или γ или δ (LBD)), плазмидой, экспрессирующей люциферазу (МН100×4-ТК-Luc), и плазмидой, экспрессирующей β-галактозидазу (pCMX-β-GAL) (Kliewer, S.A. et al., (1992) Nature, 358: 771-774). После проведения переноса генов с помощью липофекционного реагента (Lipofectamine 2000, Invitrogen) клетки инкубировали примерно 40 часов в присутствии тестируемого соединения. Активность люциферазы и β-GAL измеряли в лизированных клетках.
Люциферазную активность калибровали по активности β-GAL. Относительную активность лиганда подсчитывали при условии, что люциферазную активность клеток, обработанных GW-590735 для PPARα, Розиглитазоном для PPARγ или GW-501516 для PPARδ, устанавливали как 100% для определения ЕС50 (см. приведенные ниже примеры 14 и 15).
В отличие от описанного в Bioorg Med Chem Lett 13 (2003) 1517-1521 слабого активирующего действия соединений фенилпропионовой кислоты на PPARδ, соединения по изобретению превосходно активируют транскрипцию PPARδ, как показано в таблицах 38 и 39. Описанные выше соединения, представленные формулами (I), (II) и (III), являются сильными агонистами PPARδ.
Лекарственное средство, состоящее из агониста PPARδ по настоящему изобретению, эффективно для лечения или профилактики заболеваний, опосредуемых PPARδ. Заболевания включают гиперлипидемию, дислипидемию, гиперхолестеринемию, гипертриглицеридемию, HDL-гипохолестеринемию, LDL-гиперхолестеринемию и/или пониженное содержание HLD-холестерина, VLDL-гиперпротеинемию (повышение количества VLDL), дислипопротеинемию, гипопротеинемию аполипопротеина A-I, атеросклероз, артериосклеротические заболевания, сердечно-сосудистые заболевания, цереброваскулярные заболевания, расстройства периферического кровообращения, метаболический синдром, синдром Х, ожирение, включая ожирение внутренних органов, диабет, гипергликемию, инсулинорезистентность, нарушенную глюкозотолерантность, гиперинсулинизм, диабетические осложнения, сердечную недостаточность, инфаркт миокарда, кардиомиопатию, гипертонию, ожирение печени, неалкогольный жировой гепатит, тромбоз, болезнь Альцгеймера, нейродегенеративные заболевания, демиелинизирующие заболевания, рассеянный склероз, лейкодистрофия надпочечников, дерматит, псориаз, угри, старение кожи, трихоз, воспаление, артрит, астму, синдром гиперчувствительного желудка, язвенный колит, болезнь Крона, панкреатит или рак, включая, рак ободочной кишки, рак толстой кишки, рак кожи, рак молочной железы, карциному простаты, рак яичников и рак легких.
Для введения людям соединения по изобретению можно использовать обычные способы введения, такие как пероральное введение или парентеральное введение.
Соединение можно гранулировать обычным способом для получения фармацевтических препаратов. Например, соединение можно переработать таким образом, чтобы получить таблетки, гранулы, порошок, капсулы, суспензию, препарат для инъекций, суппозитории и т.п.
Для получения этих фармацевтических препаратов можно применять обычные добавки, такие как носители, разрыхлители, связывающие вещества, смазки, красители и разбавители. В качестве носителей можно отметить лактозу, D-маннит, кристаллическую целлюлозу и глюкозу. Далее, в качестве разрыхлителей можно упомянуть крахмал и кальциевую карбоксиметилцеллюлозу (КМЦ-Са), в качестве смазок - стеарат магния и тальк, а в качестве связующих веществ - гидроксипропилцеллюлозу (ГПЦ), желатин и поливинилпирролидон (ПВП).
Соединение по изобретению может вводиться взрослому человеку обычно в количестве от 0,1 мг до 100 мг в день парентерально и от 1 мг до 2000 мг в день перорально. Дозировку можно изменять в зависимости от возраста и состояния пациента.
Далее изобретение описано в следующих неограничивающих примерах.
Примеры
Пример 1
3-[4-[3-[4-Гексил-2-(4-метилфенил)тиазол-5-ил]пропионил]-2-метилфенил]пропионовая кислота
(1) 4-Гексил-2-(4-метилфенил)тиазол-5-карбальдегид
[4-Гексил-2-(4-метилфенил)тиазол-5-ил]метанол (500 мг, 1,727 ммоль) растворяли в безводном метиленхлориде (6 мл). К раствору добавляли молекулярное сито (3А порошок, 890 мг) и хлорхромат пиридиния (745 мг, 3,455 ммоль). Смесь перемешивали 30 минут при комнатной температуре. К смеси добавляли диэтиловый эфир (20 мл) и силикагель (Wako-gel, C-300HG, 2 г). Полученную смесь далее перемешивали 10 минут при комнатной температуре. Реакционную смесь отфильтровывали через стеклянный фильтр. Осадок промывали диэтиловым эфиром. Из полученного фильтрата удаляли растворитель при пониженном давлении. Полученный остаток очищали с помощью хроматографии на силикагеле в системе гексан/этилацетат (8:1, об./об.), что давало целевое соединение (346 мг) в виде белых кристаллов (выход 70%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 0,89 (3H, т, J=7 Гц), 1,3-1,4 (6Н, м), 1,8-1,9 (2Н, м), 2,41 (3Н, с), 3,09 (2Н, т, J=7 Гц), 7,27 (2Н, д, J=8 Гц), 7,90 (2Н, д, J=8 Гц), 10,08 (1Н, с).
(2) Метил 3-(4-ацетил-2-метилфенил)-2-бромпропионат
1-(4-амино-3-метилфенил)этанон (1,70 г, 11,39 ммоль) растворили в смеси метанола (15 мл) и ацетона (38 мл). Раствор охладили до 0°С. К раствору по каплям добавили 48% бромистоводородную кислоту (5,15 мл, 45,56 ммоль) в течение одной минуты. К раствору затем добавили раствор нитрита натрия (943 мг, 13,67 ммоль) в воде (1,8 мл). Смесь 30 минут перемешивали при той же температуре. Смесь оставили при комнатной температуре. К смеси добавили метилакрилат (7,23 мл, 80,30 ммоль) и оксид меди(I) (117 мг). Полученную смесь перемешивали 30 минут при 40°С. Растворитель удаляли при пониженном давлении. К остатку добавляли ледяную воду (150 мл). Смесь нейтрализовали аммиачной водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, что давало целевое соединение (2,79 г) в виде коричневого масла (выход 82%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 2,41 (3Н, с), 2,58 (3Н, с), 3,33 (1Н, дд, J=7,15 Гц), 3,52 (1Н, дд, J=7,15 Гц), 3,74 (3Н, с), 4,43 (1Н, т, J=7 Гц), 7,2-7,9 (3Н, м).
(3) 3-(4-Ацетил-2-метилфенил)акриловая кислота
Полученный метиловый эфир 3-(4-ацетил-2-метилфенил)-2-бромпропионовой кислоты (2,79 г, 9,33 ммоль) растворили в метаноле (80 мл). Раствор охладили до 5°С. К раствору добавили метилат натрия (1,51 г, 27,98 ммоль). Смесь перемешивали 20 минут при комнатной температуре, кипятили с обратным холодильником 1 час, охлаждали до комнатной температуры и подкисляли 1N соляной кислотой. К смеси добавили 50 мл воды. Смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, что дало 657 мг целевого соединения в виде желтых кристаллов (выход 34%).
1Н-ЯМР (CD3OD, 400 МГц): δ= 2,49 (3Н, с), 2,59 (3Н, с), 6,49 (1Н, д, J=16 Гц), 7,73 (1Н, д, J=8 Гц), 7,8-7,9 (3Н, м), 7,97 (1Н, д, J=16 Гц).
(4) Метиловый эфир 3-(4-ацетил-2-метилфенил)акриловой кислоты
Полученную 3-(4-ацетил-2-метилфенил)акриловую кислоту (657 мг, 3,22 ммоль) растворили в метаноле (20 мл). К раствору добавили концентрированную серную кислоту (250 мкл). Смесь 2 часа кипятили с обратным холодильником и охлаждали до комнатной температуры. К раствору добавили воду (50 мл). Метанол удалили при пониженном давлении. Раствор экстрагировали этилацетатом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой высушивали над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле в системе гексан/этилацетат (9:1, об./об.), что давало целевое соединение (665 мг) в виде желтых кристаллов (выход 95%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 2,45 (3Н, с), 2,60 (3Н, с), 3,83 (3Н, с), 6,43 (1Н, д, J=16 Гц), 7,62 (1Н, д, J=9 Гц), 7,7-7,8 (2Н, м), 7,96 (1Н, д, J=16 Гц).
(5) Метиловый эфир 3-[4-[3-[4-гексил-2-(4-метилфенил)тиазол-5-ил]пропеноил]-2-метилфенил]акриловой кислоты
Полученный метиловый эфир 3-(4-ацетил-2-метилфенил)акриловой кислоты (200 мг, 0,916 ммоль) растворили в безводном тетрагидрофуране (1 мл) в атмосфере азота. К раствору добавили молекулярное сито (3А порошок, 200 мг). К раствору, охлажденному в ледяной бане при перемешивании, добавили 0,5 М раствор метилата натрия в метаноле (1,83 мл, 0,916 ммоль). Смесь перемешивали 10 минут при той же температуре. К смеси медленно добавили раствор в безводном тетрагидрофуране (1 мл) 4-гексил-2-(4-метилфенил)тиазол-5-карбальдегида (132 мг, 0,458 ммоль), полученного на стадии (1) примера 1. Полученную смесь перемешивали три часа в бане со льдом. Органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Проводили перекристаллизацию осадка из гексана и этилацетата, что давало целевое соединение (185 мг) в виде желтых кристаллов (выход 83%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 0,89 (3Н, т, J=7 Гц), 1,3-1,5 (6Н, м), 1,7-1,8 (2Н, м), 2,41 (3Н, с), 2,53 (3Н, с), 2,93 (2Н, т, J=7 Гц), 3,84 (3Н, с), 6,46 (1Н, д, J=16 Гц), 7,20 (1Н, д, J=16 Гц), 7,8-7,9 (2Н, м), 7,66 (1Н, д, J=8 Гц), 7,8-7,9 (4Н, м), 7,99 (1Н, д, J=16 Гц), 8,02 (1Н, д, J=16 Гц).
(6) Метиловый эфир 3-[4-[3-[4-гексил-2-(4-метилфенил)тиазол-5-ил]пропионил]-2-метилфенил]пропионовой кислоты
Полученный метиловый эфир 3-[4-[3-[4-гексил-2-(4-метилфенил)тиазол-5-ил]пропеноил]-2-метилфенил]акриловой кислоты (112 мг, 0,230 ммоль) растворили в метаноле (1 мл) и тетрагидрофуране (1 мл). Добавили 10% палладия на активированном угле (22 мг) для того, чтобы вызвать обмен водорода в системе. Смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали на целите. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле в системе гексан/этилацетат (5:1, об./об.), что давало целевое соединение (46 мг) в виде бесцветного масла (выход 41%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 0,88 (3Н, т, J=7 Гц), 1,2-1,4 (6Н, м), 1,6-1,8 (2Н, м), 2,37 (3Н, с), 2,38 (3Н, с), 2,61 (2Н, т, J=8 Гц), 2,72 (2Н, т, J=8 Гц), 2,99 (2Н, т, J=8 Гц), 3,2-3,3 (4Н, м), 3,68 (3Н, с), 7,19 (2Н, д, J=8 Гц), 7,23 (1Н, д, J=8 Гц), 7,7-7,8 (4Н, м).
(7) 3-[4-[3-[4-Гексил-2-(4-метилфенил)тиазол-5-ил]пропионил]-2-метилфенил]пропионовая кислота
Полученный метиловый эфир 3-[4-[3-[4-гексил-2-(4-метилфенил)тиазол-5-ил]пропионил]-2-метилфенил]пропионовой кислоты (45 мг, 0,0915 ммоль) ресуспендировали в этаноле (2 мл) и воде (1 мл). К суспензии добавили лития гидроксид моногидрат (12 мг, 0,275 ммоль). Смесь кипятили 1 час с обратным холодильником. К смеси добавили 1N соляную кислоту (5 мл) и ледяную воду (2 мл). Смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Полученный остаток перекристаллизовывали из гексана и этилацетата, что давало целевое соединение (38 мг) в виде белых кристаллов (выход 87%).
ББА-МС (m/e): 478 (M+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 0,88 (3Н, т, J=7 Гц), 1,3-1,4 (6Н, м), 1,6-1,8 (2Н, м), 2,37 (3Н, с), 2,38 (3Н, с), 2,6-2,8 (4Н, м), 3,00 (2Н, т, J=8 Гц), 3,1-3,3 (4Н, м), 7,19 (2Н, д, J=8 Гц), 7,24 (1Н, с), 7,7-7,8 (4Н, м).
Пример 2
3-[4-[3-[3-Изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропионил]-2-метилфенил]пропионовая кислота
(1) 3-Изопропил-5-[4-(трифторметил)фенил]тиофен-2-карбальдегид
Целевое соединение получали методом, аналогичным методу стадии (1) примера 1, из [3-изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]метанола.
Продукт - бледно-желтые кристаллы
Выход - 57%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,39 (6Н, д, J=7 Гц), 3,6-3,8 (1Н, м), 7,37 (1Н, с), 7,68 (2Н, д, J=8 Гц), 7,77 (2Н, д, J=8 Гц), 10,11 (1Н, с).
(2) Метиловый эфир 3-[4-[3-[3-изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропеноил]-2-метилфенил]акриловой кислоты
Целевое соединение было получено методом, аналогичным методу стадии (5) примера 1.
Продукт - желтые кристаллы
Выход - 67%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,32 (6Н, д, J=7Гц), 2,54 (3Н, с), 3,3-3,5 (1Н, м), 3,84 (3Н, с), 6,46 (1Н, д, J=16 Гц), 7,3-7,4 (1Н, м), 7,6-7,9 (8Н, м), 8,00 (1Н, д, J=15 Гц), 8,11 (1Н, д, J=15 Гц).
(3) Метиловый эфир 3-[4-[3-[3-изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропионил]-2-метилфенил]пропионовой кислоты
Целевое соединение было получено методом, аналогичным методу стадии (6) примера 1.
Продукт - бледно-желтые кристаллы
Выход - 58%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,26 (6Н, д, J=7 Гц), 2,38 (3Н, с), 2,61 (2Н, т, J=8 Гц), 2,99 (2Н, т, J=8 Гц), 3,0-3,1 (1Н, м), 3,2-3,4 (4Н, м), 3,68 (3Н, с), 7,20 (1Н, с), 7,23 (1Н, д, J=8 Гц), 7,58 (2Н, д, J=8 Гц), 7,64 (2Н, д, J=8 Гц), 7,7-7,8 (2Н, м).
(4) 3-[4-[3-[3-Изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропионил]-2-метилфенил]пропионовая кислота
Целевое соединение было получено методом, аналогичным методу стадии (7) примера 1.
Продукт - белые кристаллы
Выход - 79%
ББА-МС (m/e): 488 (М)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,25 (6Н, д, J=7 Гц), 2,38 (3Н, с), 2,67 (2Н, т, J=8 гц), 3,01 (2Н, т, J=8 Гц), 3,0-3,1 (1Н, м), 3,2-3,4 (4Н, м), 7,20 (1Н, с), 7,24 (1Н, с), 7,58 (2Н, д, J=8 Гц), 7,64 (2Н, д, J=8 Гц), 7,7-7,8 (1Н, м), 7,77 (1Н, с).
Пример 3
3-[4-[3-(5-Изопропил-2-фенил-4-оксазолил)пропионил]-2-метилфенил]пропионовая кислота
(1) 5-Изопропил-2-(2,4-дихлорфенил)оксазол-4-карбальдегид
Целевое соединение получали методом, аналогичным методу стадии (1) примера 1, из 5-изопропил-2-(2,4-дихлорфенил)оксазол-4-метанола.
Продукт - бледно-желтые кристаллы
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,39 (6Н, д, J=7 Гц), 3,72 (1Н, д.кв, J=7,7 Гц), 7,37 (1Н, дд, J=2,8 Гц), 7,55 (1Н, д, J=2 Гц), 7,99 (1Н, д, J=8 Гц), 10,06 (1Н, с).
(2) Метиловый эфир 3-[4-[3-[5-изопропил-2-(2,4-дихлорфенил)-4-оксазолил]пропеноил]-2-метилфенил]акриловой кислоты
Целевое соединение получали методом, аналогичным методу стадии (5) примера 1, из полученного 5-изопропил-2-(2,4-дихлорфенил)оксазол-4-карбальдегида и метилового эфира 3-(4-ацетил-2-метилфенил)акриловой кислоты.
Продукт - бледно-желтые кристаллы
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,39 (6Н, д, J=7 Гц), 2,52 (3Н, с), 3,39 (1Н, д кв, J=7,7 Гц), 3,83 (3Н, с), 6,46 (1Н, д, J=16 Гц), 7,38 (1Н, дд, J=2,8 Гц), 7,55 (1Н, д, J=2 Гц), 7,66 (1Н, д, J=8 Гц), 7,75 (1Н, д, J=15 Гц), 7,80 (1Н, д, J=15 Гц), 7,9-8,0 (2Н, м), 7,99 (1Н, д, J=16 Гц), 8,01 (1Н, д, J=8 Гц).
(3) Метиловый эфир 3-[4-[3-(5-изопропил-2-фенил-4-оксазолил]пропионил]-2-метилфенил]пропионовой кислоты
Целевое соединение получали методом, аналогичным методу стадии (6) примера 1, из метилового эфира 3-[4-[3-[5-изопропил-2-(2,4-дихлорфенил)-4-оксазолил]пропеноил]-2-метилфенил]акриловой кислоты.
Бесцветное масло
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,30 (6Н, д, J=7 Гц), 2,35 (3Н, с), 2,59 (2Н, т, J=7 Гц), 2,9-3,1 (4Н, м), 3,17 (1Н, дд, J=7,7 Гц), 3,36 (2Н, т, J=7 Гц), 3,67 (3Н, с), 7,20 (1Н, д, J=8 Гц), 7,3-7,5 (3Н, м), 7,7-7,9 (2Н, м), 7,9-8,1 (2Н, м).
(4) 3-[4-[3-(5-Изопропил-2-фенил-4-оксазолил)пропионил]-2-метилфенил]пропионовая кислота
Целевое соединение получали методом, аналогичным методу стадии (7) примера 1, из метилового эфира 3-[4-[3-(5-изопропил-2-фенил-4-оксазолил)пропионил]-2-метилфенил]пропионовой кислоты.
Бесцветное масло
ББА-МС (m/e): 406 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,30 (6Н, д, J=7 Гц), 2,35 (3Н, с), 2,63 (2Н, т, J=7 Гц), 2,9-3,1 (4Н, м), 3,17 (1Н, д кв, J=7,7 Гц), 3,34 (2Н, т, J=7 Гц), 7,21 (1Н, д, J=8 Гц), 7,3-7,5 (3Н, м), 7,7-7,9 (2Н, м), 7,9-8,1 (2Н, м).
Пример 4
3-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропеноил]-2-метилфенил]акриловая кислота
Целевое соединение получали методом, аналогичным методу стадии (5) примера 1, из метилового эфира 3-(4-ацетил-2-метилфенил)акриловой кислоты и [4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]карбальдегида.
Продукт - желтые кристаллы
ББА-МС (m/e): 486 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,40 (6Н, д, J=7 Гц), 2,56 (3Н, с), 3,4-3,5 (1Н, м), 6,49 (1Н, д, J=16 Гц), 7,28 (1Н, д, J=16 Гц), 7,7-7,8 (3Н, м), 7,8-7,9 (2Н, м), 8,0-8,2 (4Н, м).
Пример 5
3-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]-2-метилфенил]пропионовая кислота
Целевое соединение получали методом, аналогичным методу стадии (6) примера 1, с использованием 3-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропеноил]-2-метилфенил]акриловой кислоты, полученной в примере 4.
Продукт - белые кристаллы
ББА-МС (m/e): 490 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,33 (6Н, д, J=7 Гц), 2,38 (3Н, с), 2,66 (2Н, т, J=8 Гц), 3,00 (2Н, т, J=8 Гц), 3,1-3,2 (1Н, м), 3,2-3,3 (4Н, м), 7,25 (1Н, д, J=7 Гц), 7,64 (2Н, д, J=8 Гц), 7,7-7,8 (2Н, м), 8,00 (2Н, д, J=8 Гц).
Пример 6
3-[4-[1-[2-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]этил]винил]-2-метилфенил]пропионовая кислота
(1) Метиловый эфир 3-[4-[1-[2-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]этил]винил]-2-метилфенил]пропионовой кислоты
Метилтрифенилфосфонийбромид (89 мг, 0,250 ммоль) ресуспендировали в безводном тетрагидрофуране (3,5 мл) под азотом. Суспензию перемешивали 30 минут при комнатной температуре. К суспензии по каплям добавили раствор (1,5 мл) метилового эфира 3-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]-2-метилфенил]пропионовой кислоты (84 мг, 0,167 ммоль) в безводном тетрагидрофуране. Смесь перемешивали при той же температуре в течение 19 часов. К смеси по каплям добавили насыщенный раствор хлорида аммония. Смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (8:1, об./об.), что давало целевое соединение (70 мг) в виде бледно-желтого масла (выход 84%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,28 (6Н, д, J=7 Гц), 2,34 (3Н, с), 2,5-2,7 (2Н, м), 2,8-2,9 (2Н, м), 2,9-3,1 (5Н, м), 3,69 (3Н, с), 5,06 (1Н, с), 5,31 (1Н, с), 7,13 (1Н, д, J=9 Гц), 7,1-7,3 (2Н, м), 7,64 (2Н, д, J=8 Гц), 8,01 (2Н, д, J=8 Гц).
(2) 3-[4-[1-[2-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]этил]винил]-2-метилфенил]пропионовая кислота
Целевое соединение получали методом, аналогичным методу стадии (7) примера 1.
Продукт - белые кристаллы
ББА-МС (m/e) : 488 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,28 (6Н, д, J=7 Гц), 2,35 (3Н, с), 2,66 (2Н, дд, J=7,8 Гц), 2,82 (2Н, дд, J=7,8 Гц), 2,9-3,0 (5Н, м), 5,07 (1Н, с), 5,32 (1Н, с), 7,1-7,3 (3Н, м), 7,64 (2Н, д, J=8 Гц), 8,00 (2Н, д, J=8 Гц).
Пример 7
N-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-N-метилглицин
(1) 3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]-1-(4-нитрофенил)пропенон
4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-карбальдегид (4,53 г, 15,14 ммоль) и 4-нитроацетофенон (2,50 г, 15,14 ммоль) растворили в смеси безводного метанола (30 мл) и безводного тетрагидрофурана (30 мл). К раствору добавили метилат натрия (258 мг, 3,79 ммоль). Полученную смесь перемешивали при комнатной температуре в течение одного часа в атмосфере азота. Растворитель удаляли при пониженном давлении. Смесь ресуспендировали в хлороформе. Нерастворимые частицы отфильтровывали, промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Растворитель повторно удаляли при пониженном давлении. Остаток перекристаллизовывали из н-гексана и этилацетата (1:1), что давало целевое соединение (4,08 г) в виде желтых кристаллов (выход 60%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,40 (6Н, д, J=7 Гц), 3,4-3,5 (1Н, м), 7,24 (1Н, д, J=12 Гц), 7,73 (2Н, д, J=8 Гц), 8,14 (5Н, м), 8,37 (2Н, д, J=8 Гц).
(2) 1-(4-Аминофенил)-3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]-пропан-1-он
Полученный 3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]-1-(4-нитрофенил)пропенон (4,08 г, 9,14 ммоль) растворили в тетрагидрофуране (120 мл) и метаноле (100 мл). К раствору добавили 10% суспензии (20 мл) палладия на угле (400 мг). Смесь перемешивали при 60°С в течение 2 часов в атмосфере водорода. Смесь охлаждали до комнатной температуры. Нерастворимые частицы отфильтровывали. Растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (7:3, об./об.), что давало целевое соединение (2,31 г) в виде желтых кристаллов (выход 60%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,33 (6Н, д, J=7 Гц), 3,1-3,3 (5Н, м), 4,12 (2Н, уш. С), 6,65 (2Н, тд, J=2,8 Гц), 7,63 (2Н, д, J=8 Гц), 7,82 (2Н, тд, J=2,8 Гц), 8,00 (2Н, д, J=8 Гц).
(3) N-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-2-нитробензолсульфонамид
Полученный 1-(4-аминофенил)-3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]-пропан-1-он (250 мг, 0,597 ммоль) растворили в безводном пиридине (5 мл). К раствору добавили о-нитрофенилсульфонилхлорид (146 мг, 0,659 ммоль). Смесь перемешивали 1 час при комнатной температуре. Температуру бани довели до 80°С, и смесь далее перемешивали 16 часов. Смесь охладили до комнатной температуры. К смеси добавили воду. Смесь экстрагировали этилацетатом. Органический слой промыли насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, и сушили над безводным сульфатом натрия, чтобы удалить растворитель. Остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (8:2, об./об.), что давало целевое соединение (265 мг) в виде желтых кристаллов (выход 74%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,32 (6Н, д, J=7 Гц), 3,0-3,2 (1Н, м), 3,2-3,3 (4Н, м), 7,32 (2Н, д, J=8 Гц), 7,45 (1Н, с), 7,6-7,7 (4Н, м), 7,87 (1Н, д, J=8 Гц), 7,9 (2Н, д, J=8 Гц), 7,94 (1Н, дд, J=1,8 Гц), 7,99 (2Н, д, J=8 Гц).
(4) N-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-N-метил-2-нитробензолсульфонамид
Полученный N-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-2-нитробензолсульфонамид (265 мг, 0,439 ммоль) растворили в безводном диметилформамиде (10 мл). К раствору добавили иодметан (30 мкл, 0,483 ммоль) и карбонат калия (121 мг, 0,875 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. Смесь нейтрализовали 0,2N водным раствором соляной кислоты и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, и сушили над безводным сульфатом натрия, чтобы удалить растворитель. Остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (7:3, об./об.), что давало целевое соединение (230 мг) в виде желтого масла (выход 85%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,34 (6Н, д, J=7Гц), 3,1-3,2 (1Н, м), 3,2-3,4 (4Н, м), 3,41 (3Н, с), 7,38 (2Н, д, J=8 Гц), 7,5-7,8 (6Н, м), 7,94 (2Н, д, J=8 Гц), 8,00 (2Н, д, J=8 Гц).
(5) 3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]-1-(4-метиламинофенил)пропан-1-он
Полученный N-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-N-метил-2-нитробензолсульфонамид (230 мг, 0,372 ммоль) растворили в безводном диметилформамиде (5 мл). К раствору добавили карбонат калия (154 мг, 1,116 ммоль) и тиофенол (46 мкл, 0,446 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разводили водой и экстрагировали этилацетатом. Органический слой промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (8:2, об./об.), что давало целевое соединение (154 мг) в виде желтых кристаллов (выход 95%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,33 (6Н, д, J=7 Гц), 2,90 (3Н, д, J=5 Гц), 3,1-3,3 (5Н, м), 4,26 (1Н, уш.с), 6,56 (2Н, д, J=8 Гц), 7,63 (2Н, д, J=8 Гц), 7,85 (2Н, д, J=8 Гц), 8,00 (2Н, д, J=8 Гц).
(6) Этиловый эфир N-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-N-метилглицина
Полученный 3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]-1-(4-метиламинофенил)пропан-1-он (40 мг, 0,0931 ммоль) и диизопропилэтиламин (80 мкл, 0,462 ммоль) растворили в безводном диметилформамиде (2 мл). К раствору добавили этилбромацетат (66 мг, 0,393 ммоль). Смесь перемешивали 16 часов при 110°С. Смесь охлаждали до комнатной температуры, разводили водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия, чтобы удалить растворитель. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/хлороформ (7:3, об./об.), что давало целевое соединение (56 мг) в виде желтых кристаллов (выход 47%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,25 (3Н, т, J=7Гц), 1,33 (6Н, д, J=7 Гц), 3,14 (3Н, с), 3,1-3,2 (1Н, м), 3,2-3,3 (4Н, м), 4,12 (2Н, с), 4,19 (2Н, кв, J=7 Гц), 6,65 (2Н, д, J=8 Гц), 7,63 (2Н, д, J=8 Гц), 7,88 (2Н, д, J=8 Гц), 8,00 (2Н, д, J=8 Гц).
(7) N-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-N-метилглицин
Полученный этиловый эфир N-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]-N-метилглицина (54 мг, 0,104 ммоль) растворили в этаноле (1 мл) и ТГФ (1 мл). К раствору добавили 1N гидроксид натрия (208 мкл, 0,208 ммоль). Смесь перемешивали при комнатной температуре в течение 20 минут, разводили водой (2 мл), нейтрализовали 1N водным раствором соляной кислоты и перемешивали при 5°С в течение 30 минут. Выпавший осадок отфильтровывали, промывали водой и высушивали при 60°С в течение 2 часов при пониженном давлении, что давало желаемое соединение (40 мг) в виде желтых кристаллов (выход 78%).
ББА-МС (m/e): 491 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,32 (6Н, д, J=7 Гц), 3,1-3,2 (4Н, м), 3,2-3,3 (4Н, м), 4,17 (2Н, с), 6,66 (2Н, д, J=8 Гц), 7,63 (2Н, д, J=8 Гц), 7,89 (2Н, д, J=8 Гц), 7,99 (2Н, д, J=8 Гц).
Пример 8
N-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]глицин
(1) Этиловый эфир N-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]глицина
Целевое соединение получали методом, аналогичным методу стадии (6) примера 7, из 1-(4-аминофенил)-3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропан-1-она.
Аморфное вещество бледно-желтого цвета
Выход - 83%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,31 (3Н, т, J=7 Гц), 1,33 (6Н, д, J=7 Гц), 3,1-3,3 (5Н, м), 3,95 (2Н, д, J=5 Гц), 4,27 (2Н, кв, J=7 Гц), 4,82 (1Н, м), 6,58 (2Н, д, J=8 Гц), 7,63 (2Н, д, J=8 Гц), 7,86 (2Н, д, J=8 Гц), 8,00 (2Н, д, J=8 Гц).
(2) N-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]глицин
Целевое соединение получали методом, аналогичным методу стадии (7) примера 7, из этилового эфира N-[4-[3-[4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-ил]пропионил]фенил]глицина.
Продукт - желтые кристаллы
Выход - 75%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,33 (6Н, д, J=7 Гц), 2,17 (1Н, с), 3,1-3,3 (5Н, м), 4,06 (2Н, с), 6,60 (2Н, д, J=8 Гц), 7,63 (2Н, д, J=8 Гц), 7,87 (2Н, д, J=8 Гц), 7,99 (2Н, д, J=8 Гц).
Пример 9
N-[4-[3-[3-Изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропионил]фенил]-N-метилглицин
(1) Этиловый эфир N-(4-ацетофенил)-N-метилглицина
4-Метиламиноацетофенон (277 мг, 1,86 ммоль) и диизопропилэтиламин (485 мкл, 2,79 ммоль) растворили в безводном ДМФА (диметилформамиде) (10 мл). К раствору добавили этилбромацетат (372 мг, 2,23 ммоль). Смесь перемешивали в течение 16 часов при 110°С под азотом. Смесь охлаждали до комнатной температуры. К смеси добавляли диизопропилэтиламин (162 мкл, 0,93 ммоль) и этилбромацетат (155 мг, 0,93 ммоль). Полученную смесь перемешивали в течение 16 часов при 110°С. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водой, насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/хлороформ (1:1, об./об.), что давало целевое соединение (274 мг) в виде коричневого масла (выход 63%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,26 (3Н, т, J=7 гц), 2,51 (3Н, с), 3,14 (2Н, с), 4,12 (2Н, с), 4,20 (2Н, кв, J=7 Гц), 6,65 (2Н, д, J=8 Гц), 7,87 (2Н, д, J=8 Гц).
(2) Этиловый эфир N-[4-[3-[3-изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропеноил]фенил]-N-метилглицина
Полученный этиловый эфир N-(4-ацетофенил)-N-метилглицина (92 мг, 0,389 ммоль) растворили в безводном ТГФ (2 мл). К раствору добавили молекулярное сито (3А порошок, 200 мг). Смесь охлаждали до 5°С. К смеси прибавили по каплям раствор (21% (вес.)) этилата натрия в этаноле (145 мкл, 0,389 ммоль) в атмосфере азота. Полученную смесь перемешивали при той же температуре в течение 10 минут. К смеси добавили раствор (10 мл) 3-изопропил-5-(4-трифторметилфенил)тиофен-2-карбальдегида (116 мг, 0,389 ммоль) в безводном ТГФ. Полученную смесь перемешивали при той же температуре в течение 30 минут. Смесь нейтрализовали 1N водным раствором соляной кислоты и разводили хлороформом. Нерастворимые частицы отфильтровывали, промывали 0,2N водным раствором соляной кислоты и насыщенным солевым раствором, и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Очистка полученного остатка с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (9:1, об./об.) давала недостаточно чистое целевое соединение (100 мг).
(3) Этиловый эфир N-[4-[3-[3-изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропионил]фенил]-N-метилглицина
Полученный неочищенный этиловый эфир N-[4-[3-[3-изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропеноил]фенил]-N-метилглицина (100 мг) растворяли в безводном тетрагидрофуране (5 мл) и метаноле (4 мл). К раствору добавляли 10% палладия на угле (10 мг) в виде суспензии в метаноле (1 мл). Смесь перемешивали 2 часа при комнатной температуре в атмосфере азота. Нерастворимые частицы отфильтровывали. Растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (9:1, об./об.), что давало целевое соединение (37 мг) в виде бесцветного масла (выход после двух стадий - 18%).
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,2-1,3 (9Н, м), 3,0-3,1 (1Н, м), 3,14 (3Н, с), 3,2-3,3 (4Н, м), 4,12 (2Н, с), 4,19 (2Н, кв, J=7 Гц), 6,65 (2Н, д, J=9 Гц), 7,20 (1Н, с), 7,57 (2Н, д, J=8 Гц), 7,64 (2Н, д, J=8 Гц), 7,90 (2Н, д, J=9 Гц).
(4) N-[4-[3-[3-Изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропионил]фенил]-N-метилглицин
Полученный этиловый эфир N-[4-[3-[3-изопропил-5-[4-(трифторметил)фенил]тиофен-2-ил]пропионил]фенил]-N-метилглицина (37 мг, 0,071 ммоль) растворили в этаноле (0,5 мл) и ТГФ (0,5 мл). К раствору добавили 1N гидроксид натрия (143 мкл, 0,143 ммоль). Смесь 30 минут перемешивали при комнатной температуре, нейтрализовали 1N водным раствором соляной кислоты и перемешивали 20 минут при 5°С. Выпавшие кристаллы отфильтровывали, промывали водой и холодным этанолом, и сушили 1 час при 50°С при пониженном давлении, что давало целевое соединение (26 мг) в виде белых кристаллов (выход 75%).
ББА-МС (m/e): 490 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,25 (6Н, д, J=7 Гц), 3,0-3,1 (1Н, м), 3,14 (3Н, с), 3,1-3,3 (4Н, м), 4,18 (2Н, с), 6,67 (2Н, д, J=8 Гц), 7,19 (1Н, с), 7,57 (2Н, д, J=8 Гц), 7,63 (2Н, д, J=8 Гц), 7,91 (2Н, д, J=8 Гц).
Пример 10
N-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]фенил]-N-метилглицин
(1) Этиловый эфир N-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]фенил]-N-метилглицина
Целевое соединение получали методом, аналогичным методу стадии (2) примера 9, из 2-(4-хлор-2-гидроксифенил)-5-изопропилоксазол-4-карбальдегида и этилового эфира N-(4-ацетофенил)-N-метилглицина.
Продукт - желтовато-коричневые кристаллы
Выход -49%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,27 (3Н, т, J=7 Гц), 1,39 (6Н, д, J=7 Гц), 3,18 (3Н, с), 3,3-3,5 (1Н, м), 4,16 (2Н, с), 4,22 (2Н, кв, J=7 Гц), 6,71 (2Н, д, J=9 Гц), 6,97 (1Н, дд, J=2 Гц, 8 Гц), 7,13 (1Н, д, J=2 Гц), 7,66 (1Н, д, J=15 Гц), 7,71 (1Н, д, J=15 Гц), 7,76 (1Н, д, J=8 Гц), 8,03 (2Н, д, J=9 Гц), 11,38 (1Н, с).
(2) Этиловый эфир N-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]фенил]-N-метилглицина
Целевое соединение получали методом, аналогичным методу стадии (3) примера 9, из полученного этилового эфира N-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]фенил]-N-метилглицина.
Продукт - желтоватые кристаллы
Выход - 53%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,25 (3Н, т, J=7 Гц), 1,31 (6Н, д, J=7 Гц), 2,93 (2Н, т, J=7 Гц), 3,13 (3Н, с), 3,1-3,3 (1Н, м), 3,25 (2Н, т, J=7 Гц), 4,11 (2Н, с), 4,19 (2Н, кв, J=7 Гц), 6,64 (2Н, д, J=9 Гц), 6,90 (1Н, дд, J=1Гц, 8Гц), 7,05 (1Н, д, J=1 Гц), 7,68 (1Н, д, J=8 Гц), 7,88 (2Н, д, J=9 Гц), 11,53 (1Н, с).
(3) N-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]фенил]-N-метилглицин
Целевое соединение получали методом, аналогичным методу стадии (4) примера 9, из полученного этилового эфира N-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]фенил]-N-метилглицина.
Продукт - бледно-желтые кристаллы
Выход - 85%
Точка плавления 166-168°С
ББА-МС (m/e): 457 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,31 (6Н, д, J=7 Гц), 2,93 (2Н, т, J=7 Гц), 3,14 (3Н, с), 3,1-3,3 (1Н, м), 3,26 (2Н, т, J=7 Гц), 4,18 (2Н, с), 6,66 (2Н, д, J=9 Гц), 6,90 (1Н, дд, J=2 Гц, 9 Гц), 7,04 (1Н, д, J=2 Гц), 7,68 (1Н, д, J=9 Гц), 7,89 (2Н, д, J=9 Гц).
Пример 11
3-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]-5-тиазолил]пропионил]-2-этилфенил]пропионовая кислота
(1) Метиловый эфир 3-[2-этил-4-[3-[4-изопропил-2-[4-(трифторметил)фенил]-5-тиазолил]пропеноил]фенил]акриловой кислоты
Целевое соединение получали методом, аналогичным методу стадии (5) примера 1, из 4-изопропил-2-[4-(трифторметил)фенил]тиазол-5-карбальдегида и метилового эфира 3-(4-ацетил-2-этилфенил)акриловой кислоты.
Продукт - желтые кристаллы
Выход - 55% (2 стадии)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,29 (3Н, т, J=7 Гц), 1,39 (6Н, д, J=7 Гц), 2,88 (2Н, кв, J=8 Гц), 3,4-3,5 (1Н, м), 3,84 (3Н, с), 6,47 (1Н, д, J=15 Гц), 7,28 (1Н, д, J=15 Гц), 7,7-7,8 (3Н, м), 7,8-7,9 (2Н, м), 8,0-8,2 (4Н, м).
(2) Метиловый эфир 3-[2-этил-4-[3-[4-изопропил-2-[4-(трифторметил)фенил]-5-тиазолил]пропионил]фенил]пропионовой кислоты
Целевое соединение получали методом, аналогичным методу стадии (6) примера 1, из полученного метилового эфира 3-[2-этил-4-[3-[4-изопропил-2-[4-(трифторметил)фенил]-5-тиазолил]пропеноил]фенил]акриловой кислоты.
Желтое масло
Выход - 60%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,26 (3Н, т, J=8 Гц), 1,34 (6Н, д, J=7 Гц), 2,61 (2Н, т, J=8 Гц), 2,72 (2Н, кв, J=8 Гц), 3,02 (2Н, т, J=8 Гц), 3,1-3,2 (1Н, м), 3,2-3,4 (4Н, м), 3,68 (3Н, с), 7,24 (1Н, д, J=8 Гц), 7,64 (2Н, д, J=8 Гц), 7,73 (1Н, дд, J=2 Гц, 8 Гц), 7,80 (1Н, д, J=2 Гц), 8,00 (2Н, д, J=8 Гц).
(3) 3-[4-[3-[4-Изопропил-2-[4-(трифторметил)фенил]-5-тиазолил]пропионил]-2-этилфенил]пропионовая кислота
Целевое соединение получали методом, аналогичным методу стадии (7) примера 1, из полученного метилового эфира 3-[2-этил-4-[3-[4-изопропил-2-[4-(трифторметил)фенил]-5-тиазолил]пропионил]фенил]пропионовой кислоты.
Продукт - бледно-желтые кристаллы
Выход - 74%.
ББА-МС (m/e): 504 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,26 (3Н, т, J=7 Гц), 1,33 (6Н, д, J=7 Гц), 2,6-2,8 (4Н, м), 3,03(2Н, т, J=8 Гц), 3,1-3,2 (1Н, м), 3,2-3,4 (4Н, м), 7,26 (1Н, д, 8 Гц), 7,64 (2Н, д, J=8 Гц), 7,74 (1Н, дд, J=8 Гц, 2 Гц), 7,80 (1Н, д, J=2 Гц), 8,00 (2Н, д, J=8 Гц).
Пример 12
3-[4-[3-[2-(4-Хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]-2-метилфенил]пропионовая кислота
(1) Метиловый эфир 3-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропеноил]-2-метилфенил]акриловой кислоты
Целевое соединение получали методом, аналогичным методу стадии (5) примера 1, из 2-(4-хлор-2-гидроксифенил)-5-изопропилоксазол-4-карбальдегида и метилового эфира 3-(4-ацетил-2-этилфенил)акриловой кислоты.
Продукт - бледно-коричневые кристаллы
Выход - 61%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,41 (6Н, д, J=7 Гц), 2,54 (3Н, с), 3,3-3,5 (1Н, м), 3,84 (3Н, с), 6,47 (1Н, д, J=16 Гц), 6,98 (1Н, дд, J=2Гц, 9 Гц), 7,13 (1Н, д, J=2 Гц), 7,64 (1Н, д, J=15 Гц), 7,67 (1Н, д, J=9 Гц), 7,73 (1Н, д, J=15 Гц), 7,77 (1Н, д, J=8 Гц), 7,8-7,9 (2Н, м), 7,99 (1Н, д, J=16 Гц), 11,27 (1Н, с).
(2) Метиловый эфир 3-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]-2-метилфенил]пропионовой кислоты
Целевое соединение получали методом, аналогичным методу стадии (6) примера 1, из полученного метилового эфира 3-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропеноил]-2-метилфенил]акриловой кислоты.
Бесцветное масло
Выход - 47%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,32 (6Н, д, J=7 Гц), 2,36 (3Н, с), 2,59 (2Н, т, J=8 Гц), 2,94 (2Н, т, J=7 Гц), 2,98 (2Н, т, J=8 Гц), 3,1-3,3 (1Н, м), 3,33 (2Н, т, J=7 Гц), 3,68 (3Н, с), 6,90 (1Н, дд, J=2 Гц, 8 Гц), 7,04 (1Н, д, J=2 Гц), 7,21 (1Н, д, J=8 Гц), 7,68 (1Н, д, J=8 Гц), 7,7-7,8 (2Н, м), 11,47 (1Н, с).
(3) 3-[4-[3-[2-(4-Хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]-2-метилфенил]пропионовая кислота
Целевое соединение получали методом, аналогичным методу стадии (7) примера 1, из полученного метилового эфира 3-[4-[3-[2-(4-хлор-2-гидроксифенил)-5-изопропил-4-оксазолил]пропионил]-2-метилфенил]пропионовой кислоты.
Продукт - белые кристаллы
Выход - 93%
Точка плавления - 141-144°С
ББА-МС (m/e): 456 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,32 (6Н, д, J=7 Гц), 2,37 (3Н, с), 2,65 (2Н, т, J=8 Гц), 2,95 (2Н, т, J=7 Гц), 2,99 (2Н, т, J=8 Гц), 3,1-3,3 (1Н, м), 3,33 (2Н, т, J=7 Гц), 6,90 (1Н, дд, J=2 Гц, 8 Гц), 7,04 (1Н, д, J=2 Гц), 7,24 (1Н, д, J=8 Гц), 7,68 (1Н, д, J=8 Гц), 7,7-7,8 (2Н, м).
Пример 13
3-[4-[3-[5-Изопропил-2-(2-гидроксифенил)-4-оксазолил]пропионил]-2-метилфенил]пропионовая кислота
(1) Метиловый эфир 3-[4-[3-[5-изопропил-2-(2-гидроксифенил)-4-оксазолил]пропионил]-2-метилфенил]пропионовой кислоты
Метиловый эфир 3-[4-[3-[5-изопропил-2-(2-метоксифенил)-4-оксазолил]пропионил]-2-метилфенил]пропионовой кислоты (24 мг, 0,0534 ммоль) растворили в метиленхлориде (1,2 мл). К раствору добавили 1М раствор трихлорборана в дихлорметане (127 мкл, 0,127 ммоль) при 0°С. Смесь перемешивали 24 часа при комнатной температуре. К смеси добавили ледяную воду (5 мл). Полученную смесь экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором карбоната натрия и водой, и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем в системе гексан/этилацетат (3:1, об./об.), что давало целевое соединение (4 мг) в виде белых кристаллов (выход - 17%).
Продукт - белые кристаллы
Выход - 17%
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,32 (6Н, д, J=7 Гц), 2,36 (3Н, с), 2,59 (2Н, т, J=7 Гц), 2,9-3,0 (4Н, м), 3,1-3,3 (1Н, м), 3,34 (2Н, т, J=7 Гц), 3,68 (3Н, с), 6,92 (1Н, т, J=8 Гц), 7,03 (1Н, д, J=8 Гц), 7,21 (1Н, д, J=8 Гц), 7,2-7,3(1Н, м), 7,7-7,8 (3Н, м).
(2) 3-[4-[3-[5-Изопропил-2-(2-гидроксифенил)-4-оксазолил]пропионил]-2-метилфенил]пропионовая кислота
Целевое соединение получали методом, аналогичным методу стадии (7) примера 1, из полученного метилового эфира 3-[4-[3-[5-изопропил-2-(2-гидроксифенил)-4-оксазолил]пропионил]-2-метилфенил]пропионовой кислоты.
Белый порошок
Выход - 75%
ББА-МС (m/e): 422 (М+1)
1Н-ЯМР (CDCl3, 400 МГц): δ= 1,32 (6Н, т, J=7 Гц), 2,37 (3Н, с), 2,65 (2Н, т, J=7 Гц), 2,9-3,0 (4Н, м), 3,1-3,3 (1Н, м), 3,34 (2Н, т, J=7 Гц), 6,92 (1Н, т, J=8 Гц), 7,02 (1Н, д, J=8 Гц), 7,2-7,3 (2Н, м), 7,7-7,8 (3Н, м).
Пример 14 (Фармакологические испытания 1)
I. Способ измерения
PPAR-активирующее действие тестируемых соединений (соединений из примеров) измеряли описанным ниже методом.
Клетки CV-1 (АТСС) трансформировали плазмидой, экспрессирующей рецептор (pSG5-GAL4-hPPARα или γ или δ (LBD)), плазмидой, экспрессирующей люциферазу (pUC8-МН100×4-ТК-Luc), и плазмидой, экспрессирующей β-галактозидазу (pCMX-β-GAL) (Kliewer, S.A. Et al., (1992) Nature, 358: 771-774). После проведения переноса генов с помощью липофекционного реагента (Lipofectamine 2000, Invitrogen) клетки инкубировали примерно 40 часов в присутствии тестируемого соединения. Активность люциферазы и β-GAL измеряли в лизированных клетках.
Люциферазную активность калибровали по активности β-GAL. Относительную активность лиганда подсчитывали при условии, что люциферазную активность клеток, обработанных GW-590735 для PPARα, Розиглитазоном для PPARγ или GW-501516 для PPARδ, устанавливали как 100% для определения ЕС50.
II. Результаты
Результаты испытаний приведены в таблице 38.
Активность PPAR: относительная величина при использовании 10-7М тестируемого соединения (контроль - 100%)
α: GW-590735 10-6М
γ: Розиглитазон 10-5М
δ: GW-501516 10-7М
(За исключением соединений из примеров 3 и 8, действие которых измеряли при концентрации 10-6М).
Как видно из таблицы 38, тестируемые соединения являются прекрасными агонистами PPARδ. Соединение из примера 5 является наиболее сильным агонистом PPARδ.
Пример 15 (Фармакологические испытания 2)
Испытания проводились тем же методом, как и в примере 14(1).
Результаты испытаний приведены в таблице 39.
Активность PPAR: относительная величина при использовании 10-7М тестируемого соединения (контроль - 100%)
α: GW-590735 10-6М
γ: Розиглитазон 10-5М
δ: GW-501516 10-7М
(За исключением соединения из примера 13, действие которого измеряли при концентрации 10-6М).
Как видно из таблицы 39, тестируемые соединения являются прекрасными агонистами PPARδ.
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВИРУЮЩИЙ АГЕНТ ДЛЯ РЕЦЕПТОРА, АКТИВИРУЕМОГО СТИМУЛИРУЮЩИМИ РОСТ ПЕРОКСИСОМ АГЕНТАМИ | 2009 |
|
RU2501794C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСАЗОЛОВ КОНДЕНСАЦИЕЙ АРОМАТИЧЕСКИХ АЛЬДЕГИДОВ С АЛЬФА-КЕТОКСИМАМИ С ОБРАЗОВАНИЕМ N-ОКСИДОВ И ПОСЛЕДУЮЩИМ ВЗАИМОДЕЙСТВИЕМ С АКТИВИРОВАННЫМИ ПРОИЗВОДНЫМИ КИСЛОТ | 2005 |
|
RU2402537C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИН-2,4-ДИАМИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2672916C2 |
| ПРИМЕНЕНИЕ ХИРАЛЬНЫХ АРИЛКЕТОНОВ В ЛЕЧЕНИИ НЕЙТРОФИЛ-ЗАВИСИМЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2345759C2 |
| ИНГИБИТОРЫ ТИРОЗИНФОСФАТАЗЫ БЕЛКА ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2435763C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2697090C1 |
| СЕЛЕКТИВНЫЕ АНТАГОНИСТЫ АДЕНОЗИНОВЫХ A РЕЦЕПТОРОВ | 2007 |
|
RU2467009C2 |
| ИНГИБИТОРЫ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2011 |
|
RU2586974C2 |
| ТИЕНО[2,3-d]ПИРИМИДИНЫ В КАЧЕСТВЕ АНТИМИКРОБНЫХ АГЕНТОВ | 2018 |
|
RU2803136C2 |
| β-D-2'-ДЕЗОКСИ-2'-α-ФТОР-2'-β-С-ЗАМЕЩЕННЫЕ-2-МОДИФИЦИРОВАННЫЕ-N6-ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ НУКЛЕОТИДЫ ДЛЯ ЛЕЧЕНИЯ ВЫЗВАННЫХ HCV ЗАБОЛЕВАНИЙ | 2016 |
|
RU2764767C2 |
Изобретение относится к соединению, представленному общей формулой (I) или его фармацевтически приемлемой соли, где каждый из W1 и W2 независимо является СH; Х представляет собой NR5 или CR6R7, где R5 является водородом, С1-8алкилом, и каждый из R6 и R7 независимо является водородом; Y представляет собой -(CR8R9)n-, где каждый из R8 и R9 независимо представляет собой водород или С1-8алкил, а n является числом от 1 до 4; или Х и Y вместе образуют -CR10=CR11-, где каждый из R10 и R11 независимо представляет собой водород; Z является карбоксилом; G представляет собой О, S или CR12R13, где каждый из R12 и R13 независимо представляет собой водород; А представляет собой пятичленное гетероциклическое кольцо, выбранное из группы, состоящей из тиазола, оксазола и тиофена, в котором гетероциклическое кольцо необязательно замещено С1-8алкилом; В представляет собой С1-8алкиленовую или С2-8алкениленовую цепь; каждый из R1 и R2 независимо представляет собой водород, С1-8алкил, галоген, C1-8алкил, замещенный галогеном, или гидроксил; каждый из R3 и R4 независимо представляет собой водород или С1-8алкил; и m является целым числом, равным 0. Соединения формулы (I) действуют как активаторы рецептора, активируемого пролифератором пероксисом. 8 н. и 15 з.п. ф-лы, 39 табл.
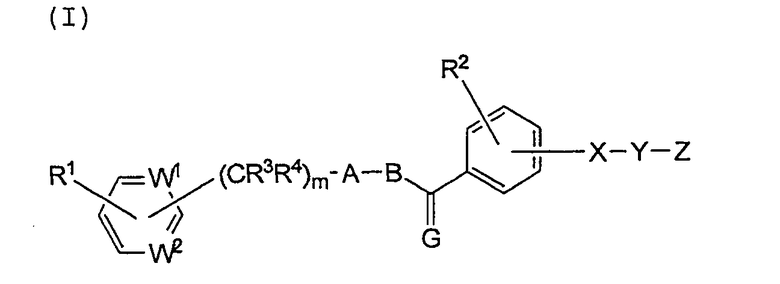
1. Соединение, имеющее следующую формулу (I), или его фармацевтически приемлемая соль:
где каждый из W1 и W2 независимо является СН;
Х представляет собой NR5 или CR6R7, где R5 является водородом, C1-8алкилом, и каждый из R6 и R7 независимо является водородом;
Y представляет собой -(CR8R9)n-, где каждый из R8 и R9 независимо представляет собой водород или С1-8алкил, а n является числом от 1 до 4; или
Х и Y вместе образуют -CR10=CR11-, где каждый из R10 и R11 независимо представляет собой водород;
Z является карбоксилом;
G представляет собой О, S или CR12R13, где каждый из R12 и R13 независимо представляет собой водород;
А представляет собой пятичленное гетероциклическое кольцо, выбранное из группы, состоящей из тиазола, оксазола и тиофена, в котором гетероциклическое кольцо необязательно замещено С1-8алкилом;
В представляет собой С1-8алкиленовую или С2-8алкениленовую цепь;
каждый из R1 и R2 независимо представляет собой водород, С1-8алкил, галоген, С1-8алкил, замещенный галогеном, или гидроксил;
каждый из R3 и R4 независимо представляет собой водород или С1-8алкил;
и m является целым числом, равным 0.
2. Соединение или его соль по п.1, где Х является CR6R7.
3. Соединение или его соль по п.1, где X является NR5.
4. Соединение или его соль по п.1, где Х является NH.
5. Соединение или его соль по п.1, где Х является NR5, a R5 является C1-8алкилом.
6. Соединение или его соль по п.1, где Y является СН2.
7. Соединение или его соль по п.1, где А является тиазолом, необязательно замещенным С1-8алкилом.
8. Соединение или его соль по п.1, где В является цепью этилена.
9. Соединение, имеющее следующую формулу (II), или его фармацевтически приемлемая соль:
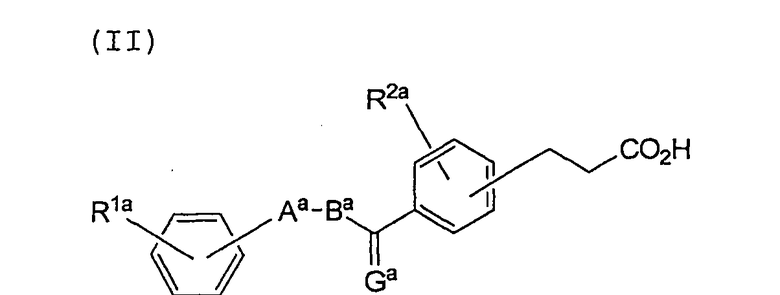
где Ga представляет собой О;
Аa представляет собой пятичленное гетероциклическое кольцо, выбранное из группы, состоящей из тиазола, оксазола и тиофена, где гетероциклическое кольцо необязательно замещено С1-8алкилом;
Вa представляет собой С1-8алкиленовую или С2-8алкениленовую цепь; и каждый из R1a и R2a независимо представляет собой водород, С1-8алкил, галоген, С1-8алкил, замещенный галогеном, или гидроксил.
10. Соединение или его соль по п.9, где Аa является тиазолом, необязательно замещенным С1-8алкилом.
11. Соединение или его соль по п.9, где Вa является цепью этилена.
12. Соединение, имеющее следующую формулу (III), или его фармацевтически приемлемая соль:
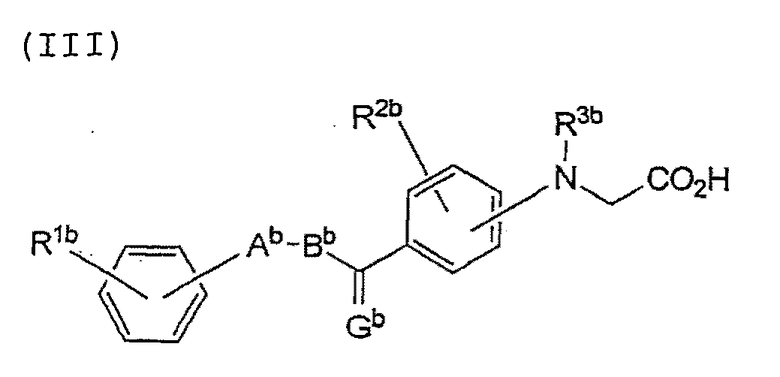
Gb представляет собой О;
Аb представляет собой пятичленное гетероциклическое кольцо, выбранное из группы, состоящей из тиазола, оксазола и тиофена, необязательно замещенного С1-8алкилом;
Вb представляет собой С1-8алкиленовую или С2-8алкениленовую цепь;
каждый из R1b и R2b независимо представляет собой водород, С1-8алкил, галоген, С1-8алкил, замещенный галогеном, или гидроксил; и
R3b представляет собой водород или С1-8алкил.
13. Соединение или его соль по п.12, где Аb является тиазолом, необязательно замещенным С1-8алкилом.
14. Соединение или его соль по п.12, где Вb является цепью этилена.
15. Активатор рецептора, активируемого пролифератором пероксисом δ, который содержит в качестве активного компонента соединение или его соль по любому из пп.1, 9 или 12.
16. Лекарственное средство, которое содержит соединение, представляющее собой агонист рецептора, активируемого пролифератором пероксисом δ, или его соль по любому из пп.1, 9 или 12, и фармацевтически приемлемый носитель.
17. Способ активации рецептора, активируемого пролифератором пероксисом δ, отличающийся тем, что эффективная доза соединения или его соли по любому из пп.1, 9 или 12 вводится пациенту, которому необходимо соединение или его соль.
18. Способ лечения и/или профилактики заболевания, опосредуемого рецептором, активируемым пролифератором пероксисом δ, отличающийся тем, что эффективная доза соединения или его соли по любому из пп.1, 9 или 12 вводится пациенту, которому необходимо соединение или его соль.
19. Способ лечения и/или профилактики по п.18, где заболевание, опосредуемое рецептором, активируемым пролифератором пероксисом δ, представляет собой гиперлипидемию, дислипидемию, гиперхолестеринемию, гипертриглицеридемию, HDL-гипохолестеринемию, LDL-гиперхолестеринемию и/или пониженное содержание HLD-холестерина, VLDL-гиперпротеинемию, дислипопротеинемию, гипопротеинемию аполипопротеина A-I, атеросклероз, артериосклеротические заболевания, сердечно-сосудистые заболевания, цереброваскулярные заболевания, расстройства периферического кровообращения, метаболический синдром, синдром X, ожирение, включая ожирение внутренних органов, диабет, гипергликемию, инсулинорезистентность, нарушенную глюкозотолерантность, гиперинсулинизм, диабетические осложнения, сердечную недостаточность, инфаркт миокарда, кардиомиопатию, гипертонию, ожирение печени, неалкогольный жировой гепатит, тромбоз, болезнь Альцгеймера, нейродегенеративные заболевания, демиелинизирующие заболевания, рассеянный склероз, лейкодистрофию надпочечников, дерматит, псориаз, угри, старение кожи, трихоз, воспаление, артрит, астму, синдром гиперчувствительного желудка, язвенный колит, болезнь Крона, панкреатит или рак, включая рак ободочной кишки, рак толстой кишки, рак кожи, рак молочной железы, карциному простаты, рак яичников и рак легких.
20. Способ лечения и/или профилактики по п.18, где заболевание, опосредуемое рецептором, активируемым пролифератором пероксисом δ, представляет собой дислипидемию, метаболический синдром, ожирение, включая ожирение внутренних органов, атеросклероз или болезни, которые ассоциированы с ним, или диабет.
21. Применение соединения или его соли по любому одному из пп.1, 9 или 12 для лечения и/или профилактики заболевания, опосредуемого рецептором, активируемым пролифератором пероксисом δ.
22. Применение соединения или его соли по п.21, где заболевание, опосредуемое рецептором, активируемым пролифератором пероксисом δ, представляет собой гиперлипидемию, дислипидемию, гиперхолестеринемию, гипертриглицеридемию, HDL-гипохолестеринемию, LDL-гиперхолестеринемию и/или пониженное содержание HLD-холестерина, VLDL-гиперпротеинемию, дислипопротеинемию, гипопротеинемию аполипопротеина A-I, атеросклероз, артериосклеротические заболевания, сердечно-сосудистые заболевания, цереброваскулярные заболевания, расстройства периферического кровообращения, метаболический синдром, синдром X, ожирение, включая ожирение внутренних органов, диабет, гипергликемию, инсулинорезистентность, нарушенную глюкозотолерантность, гиперинсулинизм, диабетические осложнения, сердечную недостаточность, инфаркт миокарда, кардиомиопатию, гипертонию, ожирение печени, неалкогольный жировой гепатит, тромбоз, болезнь Альцгеймера, нейродегенеративные заболевания, демиелинизирующие заболевания, рассеянный склероз, лейкодистрофию надпочечников, дерматит, псориаз, угри, старение кожи, трихоз, воспаление, артрит, астму, синдром гиперчувствительного желудка, язвенный колит, болезнь Крона, панкреатит или рак, включая рак ободочной кишки, рак толстой кишки, рак кожи, рак молочной железы, карциному простаты, рак яичников и рак легких.
23. Применение соединения или его соли по п.21, где заболевание, опосредуемое рецептором, активируемым пролифератором пероксисом δ, представляет собой дислипидемию, метаболический синдром, ожирение, включая ожирение внутренних органов, атеросклероз или болезни, которые ассоциированы с ним, или диабет.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Загрузчик сыпучих кормов | 1985 |
|
SU1371650A1 |
| Устройство для натяжения затяжки напрягаемой несущей конструкции | 1985 |
|
SU1310494A1 |
| СПОСОБ ДЛЯ ПОДДЕРЖКИ, ПО МЕНЬШЕЙ МЕРЕ, ЧАСТИЧНО РУЧНОГО УПРАВЛЕНИЯ ПРОКАТНЫМ СТАНОМ МЕТАЛЛООБРАБОТКИ | 2008 |
|
RU2457054C2 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| H.GULHAN PILLI et al | |||
| Kurzmitteiling: Syndnone Derivatives: Synthesis and Antimicrobal Activity, ARCHIV DER PHARMAZIE, 1993, vol.326, p.559-561 | |||
| RU 2005109163 A, 20.01.2006. | |||
Авторы
Даты
2011-12-10—Публикация
2007-04-18—Подача