Настоящее изобретение относится к соли тенатопразола, в частности к моногидрату соли (-)-энантиомера тенатопразола или S-тенатопразола, способу его получения, а также к его терапевтическому применению в медицине или ветеринарии, в частности, в качестве ингибитора протонного насоса при лечении гастроэзофагеального рефлюкса, желудочно-кишечных кровотечений и диспепсии.
Различные производные сульфоксидов, в частности пиридинилметилсульфинилбензимидазолов, описаны в литературе в связи с их терапевтическими свойствами, позволяющими предполагать их применение в качестве лекарственных средств, проявляющих свойства ингибиторов протонного насоса, то есть лекарственных средств, которые ингибируют желудочную кислотную секрецию и являются полезными при лечении язв желудка и двенадцатиперстной кишки.
Омепразол или 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1H-бензимидазол, описанный в патенте EP 005129, является одним из первых известных производных из серии ингибиторов протонного насоса, которое обладает свойствами ингибиторов желудочной кислотной секреции и широко применяется в качестве противоязвенного средства в медицине. Среди других известных производных пиридинилметилсульфинилбензимидазолов подобной структуры можно упомянуть рабепразол, пантопразол и лансопразол.
Тенатопразол или 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]сульфинил]имидазо[4,5-b]пиридин, описанный в патенте EP 254588, также входит в число лекарственных средств, считающихся ингибиторами протонного насоса, и может применяться для лечения гастроэзофагеального рефлюкса, желудочно-кишечных кровотечений и диспепсии.
Данные сульфоксиды обладают асимметрией относительно атома серы и, следовательно, могут существовать в виде рацемической смеси двух энантиомеров или в виде одного или другого из энантиомеров. Данные энантиомеры могут применяться традиционно в виде солей магния, калия или натрия, которые в общем случае легче применять, чем основания.
В патенте EP 652872 описывается соль эзомепразола магния, (-)-энантиомера омепразола, а также способ получения и разделения диастереоизомеров и сольволиза в щелочном растворе. Селективное получение (-)-энантиомера омепразола или его натриевых солей окислением соответствующего сульфида пероксидом водорода в присутствии комплекса титана и хирального лиганда описано в патенте США 5948789. Способ, описанный в данном патенте, позволяет получить смесь, обогащенную одним или другим из (-)- или (+)-энантиомеров в зависимости от применяемого лиганда.
С целью улучшения свойств или активности ингибиторов протонного насоса были предложены различные препараты. Например, в заявке WO 0128558 описывается жидкий стабильный препарат на основе омепразола, который получается действием гидроксида на омепразол, образуя на месте соли натрия или калия в растворе полиэтиленгликоля. Подготовленное таким образом лекарственное средство может быть применено при показаниях, обычных для ингибиторов протонного насоса.
В предшествующих работах было показано, что в отличие от всех других ингибиторов протонного насоса, таких как, например, омепразол или лансопразол, и неожиданным образом тенатопразол обладает отчетливо более длительным действием, показывая примерно в 7 раз больший период полураспада в плазме. Также собранные медицинские данные показывают, что тенатопразол дает более высокий уровень облегчения симптомов и заживления поражений желудка, чем другие лекарственные средства того же терапевтического класса ингибиторов протонного насоса, а это делает возможным его эффективное применение для лечения атипических и эзофагеальных симптомов гастроэзофагеального рефлюкса, желудочно-кишечных кровотечений и диспепсии, как было указано ранее. Более того, было показано, что каждый из двух (+)- и (-)-энантиомеров, или R и S соответственно, влияет различным образом на свойства тенатопразола и что S-тенатопразол имеет фармакокинетические свойства, существенно отличающиеся от свойств рацемической смеси и другого энантиомера. S-тенатопразол описан во французской заявке 2848555, опубликованной 18.06.2004.
Выполненные авторами изобретения работы позволили показать, что соль моногидрата S-тенатопразола натрия проявляет неожиданные свойства, которые отличают ее от собственно S-тенатопразола и от других ингибиторов протонного насоса и, в частности, превосходную растворимость, облегчающую возможность получения фармацевтической формы и значительно улучшающую поглощающую способность и терапевтическую эффективность лекарственных средств, содержащих ее.
Объектом настоящего изобретения является, таким образом, моногидратная соль S-тенатопразола натрия и ее терапевтическое применение в медицине или ветеринарии.
Другим объектом настоящего изобретения является концентрированный раствор соли тенатопразола, в частности водный раствор, в котором концентрация соли моногидрата S-тенатопразола натрия больше или равна 50 г/л и предпочтительно больше или равна 100 г/л.
Объектом изобретения в равной мере являются фармацевтические композиции, содержащие моногидрат натриевой соли S-тенатопразола, в существенной степени свободную от (+)-энантиомера или R-тенатопразола, ассоциированную с одним или несколькими фармацевтически приемлемыми наполнителями и основами.
Объектом изобретения является также применение моногидрата натриевой соли S-тенатопразола для производства лекарственных средств, применяемых для лечения желудочно-кишечных патологий, при которых требуется интенсивное и длительное ингибирование кислотной секреции при лечении симптомов и нарушений гастроэзофагеального рефлюкса, желудочно-кишечных кровотечений, устойчивых к другим ингибиторам протонного насоса, а также для лечения этих заболеваний у больных, которым назначают полимедикаментозную терапию.
Объектом изобретения является также применение моногидрата натриевой соли S-тенатопразола для производства лекарственных средств, обеспечивающих значительное улучшение заживления, а также увеличение скорости нормализации гистологических изменений при поражениях желудка и пищевода животных или человека и, следовательно, резкое уменьшение рецидивов.
Еще одним объектом изобретения является применение моногидрата натриевой соли S-тенатопразола для производства лекарственных средств, обладающих улучшенными фармакокинетическими свойствами, допускающими дозировку лекарственного средства для приема один раз в день при соответствующих признаках, как указано далее, в частности для эрадикационной терапии в отношении Helicobacter pylori при лечении язвы двенадцатиперстной кишки, при которой необходим двукратный прием, утром и вечером, других ингибиторов протонного насоса.
Объектом изобретения в равной мере является способ энантиоселективного получения S-тенатопразола, приводящего к получению соли (-)-энантиомера с хорошей чистотой и удовлетворительным выходом.
Моногидрат натриевой соли S-тенатопразола может быть получен энантиоселективным окислением сульфида общей формулы (I), приведенной далее:
A-CH2-S-B (I),
где A представляет собой ядро замещенного пиридила и B представляет собой цикл имидазопиридила,
окислительным агентом в присутствии катализатора на основе ванадия и хирального лиганда в специфическом по отношению к сульфиду растворителе и специфическом по отношению к лиганду растворителе в соответствии со способом получения, описанным в заявке FR 2863611, с последующим переводом в соль гидроксидом натрия.
В общей формуле (I), приведенной выше, группа пиридила A представляет собой группу 4-метокси-3,5-диметил-2-пиридил и B представляет собой группу 5-метоксиимидазо[4,5-b]пиридил.
Применяемым окислителем является предпочтительно пероксид, например пероксид водорода. По предпочтительному варианту осуществления применяют предпочтительно пероксид водорода с высокой концентрацией, например выше 30%.
Катализатор может быть выбран из таких катализаторов, как оксокомплекс ванадия V и более предпочтительно ацетилацетонат ванадия. Такие катализаторы имеются в продаже.
Лиганд, такой как производное основание Шиффа замещенного салицилового альдегида и хирального аминоспирта, применяют предпочтительно в комбинации с катализатором. Выбор лиганда позволяет селективно направить реакцию на получение требуемого энантиомера. Так, применение 2,4-ди-трет-бутил-6-[1-R-гидроксиметил-2-метилпропилимино)-метил]-фенола позволяет селективно направить реакцию окисления 5-метокси-2-[[4-метокси-3,5-диметил-2-пиридил)метил]тио]-имидазо[4,5-b]пиридина на селективное получение S-тенатопразола.
Реакцию проводят в растворителе, предпочтительно в смеси растворителей, в нейтральной или слабощелочной среде, выбирая специфический по отношению к сульфиду растворитель и специфический по отношению к лиганду растворитель, выбирая их из группы, в которую входят метанол, тетрагидрофуран, дихлорметан, ацетонитрил, ацетон и N-метилпирролидон или толуол, один из них или их смесь. Применяемым основанием при необходимости может быть третичный амин, такой как пиридин, диизопропилэтиламин или триэтиламин. Реакция окисления может быть легко проведена на холоду или при комнатной температуре.
Наиболее предпочтительным является применение катализатора на основе ванадия и лиганда в растворе ацетонитрила, в то время как сульфид растворен в хлорсодержащем растворителе, таком как дихлорметан, и объединение обоих растворов для того, чтобы окислитель стал действовать.
В частности, окисление сульфида формулы (I) позволяет получить (-)-энантиомер, то есть S-тенатопразол, с превосходными степенью чистоты и выходом, применяя катализатор на основе ванадия в сочетании с лигандом, представляющим собой 2,4-ди-трет-бутил-6-[1-R-гидроксиметил-2-метилпропилиминометил]-фенол в растворе ацетонитрила, и раствор сульфида в дихлорметане. В условиях реакции лиганд образует с металлическим катализатором асимметричный комплекс, в котором атом металла окисляется окислителем.
Реакция окисления легко проходит на холоду или при комнатной температуре, предпочтительно при температуре в интервале от 0 до 10°C для повышения энантиоселективности.
Сульфид формулы (I), примененный в качестве исходного продукта, является известным продуктом, который может быть получен различными способами, описанными в литературных источниках, например способами, описанными в патентах EP 254588 и EP 103553.
Таким образом получают S-тенатопразол, то есть левовращающий энантиомер тенатопразола, который может быть представлен следующей структурной формулой:

(-)-Энантиомер тенатопразола или S-тенатопразол представляет собой (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]сульфинил]имидазо[4,5-b]пиридин или (-)-тенатопразол. Данная форма может быть определена измерением оптического вращения по принятым методикам. Так, угол оптического вращения (-)-тенатопразола в диметилформамиде и ацетонитриле направлен в левую сторону, температура плавления составляет 130°C (с разложением).
По одному из вариантов осуществления S-тенатопразол может быть получен в чистой оптической форме, исходя из рацемической смеси, по широко известным методикам с применением соответствующего способа разделения, например колоночной препаративной хроматографии, такой как хиральная хроматография или ВЭЖХ. Принцип метода хиральной хроматографии основан на разнице в сродстве каждого из энантиомеров к хиральноселективному соединению неподвижной фазы.
Приемлемая для применения в качестве исходного вещества рацемическая смесь может быть получена известными способами, например способом, описанным в патенте EP 254588. Так, она может быть получена обработкой окислительным агентом, таким как пероксибензойная кислота, соответствующего сульфида, получаемого конденсацией тиола и пиридина. Реакция осуществляется предпочтительно при нагревании в присутствии основания, такого как гидроксид калия, в соответствующем растворителе, например в этаноле. Полученная таким образом рацемическая смесь может быть разделена хроматографически ВЭЖХ, как было указано ранее.
S-тенатопразол, полученный по одному или другому из упомянутых ранее способов, далее переводят в солевую форму для получения соли следующей формулы (II):
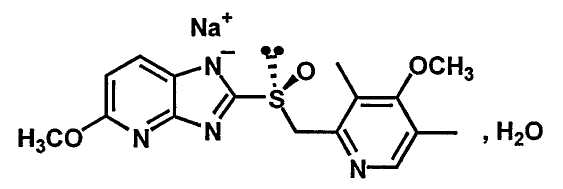
В приведенной формуле атом натрия может быть присоединен к второму атому азота имидазопиридильного ядра, расположенному рядом с сульфоксидной группой, с получением двух изомеров, находящихся в равновесии.
Перевод в солевую форму осуществляют действием гидроксида натрия на S-тенатопразол при температуре в интервале от 50 до 70°C, предпочтительно приблизительно 60°C, в растворителе, таком как вода, хлороформ, ДМСО, или в протонном растворителе, например в метаноле или этаноле, с последующим осаждением полученной соли после удаления растворителя. Реакцию осуществляют предпочтительно в инертной атмосфере (азот или аргон).
Соль осаждают традиционным способом, применяя смешивающийся с водой растворитель, в котором также может растворяться и соль, например кетон, такой как ацетон и метилэтилкетон. Полученная моногидратная соль может быть идентифицирована по физико-химическим свойствам, как указано далее.
Рацемическая соль тенатопразола может быть получена тем же самым способом для осуществления сравнительных испытаний, в частности по растворимости, с натриевой солью энантиомера.
Результаты термического анализа и рентгеновской дифрактометрии позволили установить структуру соли моногидрата S-тенатопразола натрия и показали существование соли моногидрата S-тенатопразола натрия, которая значительно отличается от других форм, таких как безводная форма, аморфная форма и сольваты.
Так, другие кристаллические формы натриевой соли могут быть получены изменением условий кристаллизации (температура, способ разделения) и сменой растворителей (изменение полярности). Например, применение диоксана приводит к образованию сольвата натриевой соли изомера, который отлично кристаллизуется и позволяет описать свойства. Присутствие диоксана в кристаллической решетке представляется все же неприемлемым для фармацевтического применения.
Аморфная форма, получение которой описано далее в примере 6, является некристаллической, нестабильной и мало приемлемой для применения в фармацевтических композициях.
Другая кристаллическая форма, которая может быть получена, представляет собой безводную натриевую соль, описанную далее в примере 4. Однако исследование методом DVS (динамическая сорбция паров) показало нестабильный характер данного полиморфного образования в обычных условиях относительной влажности, ведущий к ожижению продукта. По причине нестабильного характера данное полиморфное образование не может быть адаптировано к фармацевтическому применению, в частности, в традиционных препаратах.
Термогравиметрическая кривая натриевой соли показывает, что вода десорбируется в переменной доле (в интервале от 1 до 4%) при низкой температуре (от 30 до 50°C) и образует лабильную и обратимую фракцию воды. Отщепление молекулы воды наблюдается при 130°C (приблизительно 5% потери массы). Моногидратированная натриевая соль была равным образом исследована методом DVS (динамическая сорбция паров).
Как было указано ранее, моногидрат натриевой соли тенатопразола проявляет превосходную растворимость в воде и основных растворителях. Так, растворимость в воде составляет от 140 до 150 г/л при 25°C и от 240 до 290 г/л при 45°C, что значительно превышает растворимость рацемической соли тенатопразола натрия (приблизительно от 18 до 19 г/л), в то время как растворимость рацемического тенатопразола и S-тенатопразола составляет менее 1 г/л.
Данный результат является совершенно неожиданным по сравнению с растворимостью других хорошо известных ингибиторов протонного насоса.
Так, соль моногидрата S-тенатопразола натрия позволяет получить растворы с очень высокими концентрациями действующего лекарственного вещества, превышающими концентрации 50 г/л и предпочтительно превышающими 100 г/л. В качестве сравнительного примера рацемическая натриевая соль не позволяет получить концентрации более 19 г/л при комнатной температуре.
Соль моногидрата S-тенатопразола натрия показывает хорошие свойства стабильности в нормальных условиях температуры, давления и влажности. В зависимости от окружающих условий и условий хранения стехиометрическое соотношение между натриевой солью и водой может изменяться и составлять от 1 до 2. Так, может быть определено содержание воды, соответствующее формам сесквигидрата и дигидрата. К тому же, данный феномен является обратимым. Настоящая заявка относится совокупно к моногидрату соли натрия и солям сесквигидрата и дигидрата S-тенатопразола натрия.
Исследование на собаках показало, что применение соли моногидрата S-тенатопразола натрия позволяет получить более высокую биодоступность, чем биодоступность, получаемая с S-тенатопразолом, то есть более высокую концентрацию (Cmax), а также более высокую экспозицию, определенную по площади под кривой зависимости концентрации от времени (AUCt), при равной дозе. К тому же более быстрое высвобождение (Tmax равно 1,3 часа для моногидрата натриевой соли против 2,5 часов для S-тенатопразола) позволяет ожидать более быстрого достижения терапевтических концентраций и, следовательно, уменьшения времени начала действия лекарственного средства, благоприятствуя, таким образом, возможностям лечения по настоящему изобретению.
Результаты представлены в приведенной далее таблице для сравнения моногидрата натриевой соли (соль) и S-тенатопразола в виде основания (свободная кислота).
(соль)
(свободная кислота)
Улучшение позволяет уменьшить принимаемую дозу с коэффициентом в интервале от 1,5 до 2 при равной экспозиции. Из этого следует, что при равной дозе действующего вещества терапевтический эффект при применении моногидрата натриевой соли по настоящему изобретению в два раза выше.
Исследование фармакокинетики на собаках (n=6) в течение 4 недель по сравнению эффекта рацемического тенатопразола и соли моногидрата S-тенатопразола натрия выявило специфические свойства последнего.
Результаты представлены в приведенной далее таблице.
(соль)
В данной таблице сокращения имеют принятые значения, то есть Cmax означает максимальную концентрацию в плазме, Tmax означает время (продолжительность), за которое концентрация в плазме достигает максимума, AUCt означает площадь под кривой концентрации в плазме.
Данные результаты получены в 28-й день введения.
В данном исследовании моногидрат натриевой соли S-тенатопразола в дозах 5 мг/кг, 25 мг/кг и 50 мг/кг массы и рацемический тенатопразол в дозе 50 мг/кг вводили в виде порошка в желатиновых капсулах.
Данные результаты показывают, что моногидрат натриевой соли действует быстрее (меньшее Tmax), чем рацемат, при любой примененной дозе и обеспечивает значения AUC и Cmax в два раза большие при равной дозе.
Данные результаты были подтверждены клиническим исследованием на человеке (n=6), в ходе которого больным последовательно вводили следующие разовые дозы, представлявшие собой:
a) желатиновые капсулы соли моногидрата S-тенатопразола натрия в желудочно-резистентной форме по традиционной методике; b) такую же натриевую соль моногидрата в виде порошка (желудочно-нерезистентного) и c) рацемический тенатопразол, не переведенный в солевую форму, также в желатиновых капсулах, содержащих желудочно-нерезистентный порошок.
Полученные результаты представлены в приведенной далее таблице.
ч
AUCinf представляет собой площадь под кривой концентрации в плазме, рассчитанной до значения дозы в бесконечности с экстраполяцией на конечную стадию, и T1/2 означает период полураспада в плазме.
Можно констатировать, следовательно, что моногидрат натриевой соли S-тенатопразола, даже в желудочно-нерезистентной форме, дает значительное улучшение показателей.
Данные результаты подтверждают результаты исследований на животных и показывают, что моногидрат натриевой соли S-тенатопразола позволяет увеличить экспозицию (AUC) приблизительно на 50% по сравнению с рацемическим тенатопразолом. Это относится также к максимальной концентрации (Cmax).
Таким образом, моногидрат натриевой соли S-тенатопразола не только обладает отличающимися фармакокинетическими свойствами, но и позволяет уменьшить дозу приблизительно на треть при сравнимой эффективности.
Моногидрат натриевой соли S-тенатопразола при лечении упомянутых ранее патологий можно вводить в принятых формах, адаптированных к выбранному способу введения, например перорально или парэнтерально, предпочтительно перорально или внутривенно. В частности, превосходная растворимость моногидрата натриевой соли S-тенатопразола допускает внутривенное введение и обеспечивает таким образом максимальную биодоступность лекарственного средства.
Могут быть применены традиционные фармацевтические формы, например таблетки или желатиновые капсулы, содержащие моногидрат натриевой соли S-тенатопразола в качестве активного начала, или питьевые растворы, или эмульсии или растворы для парэнтерального введения, содержащие натриевую соль тенатопразола с традиционной фармацевтически приемлемой основой.
В качестве предпочтительной формы можно изготавливать желудочно-резистентные гранулы, которые могут быть помещены в желатиновые капсулы или введены в состав таблеток. Желудочно-резистентные гранулы могут быть получены, например, нанесением слоя соответствующего полимера, такого как полимер целлюлозы или метакрилата, например Eudragit®, на нейтральное ядро, несущее слой, содержащий действующее вещество.
В другой форме, в частности, приспособленной к свойствам растворимости моногидрата натриевой соли S-тенатопразола, ядро состоит из смеси разбавителя, например целлюлозного разбавителя, дезинтегрирующего агента и моногидрата натриевой соли S-тенатопразола, при этом данное ядро покрыто желудочно-резистентной пленкой, например ацетофталата или метакрилата.
Дезинтегрирующим агентом может быть полимер целлюлозы, такой как полимер карбоксиметилцеллюлозы, например кроскармеллоза натрия. Применяемым разбавителем является предпочтительно наполнитель прямого прессования, который позволяет избежать повторной стадии мокрого гранулирования. Желудочно-резистентное защитное покрытие может состоять из Eudragit®.
Такой препарат разработан для высвобождения активного начала по меньшей мере приблизительно за 25 минут при pH 6,8, то есть в двенадцатиперстной кишке после прохождения желудка с более кислым pH.
Вследствие другого свойства моногидратированная натриевая соль показывает относительную стабильность в кислой среде, что отличает ее от других ингибиторов протонного насоса. Данное свойство позволяет применять моногидрат натриевой соли S-тенатопразола в препаратах без желудочно-резистентной оболочки в зависимости от требуемого способа лечения. Такие препараты показывают оптимальную фармакокинетику, обеспечивающую идеальный компромисс между высвобождением активного начала, его немедленным действием и его относительно слабой деградацией в желудке. Они позволяют таким образом предоставить в распоряжение практикующим врачам альтернативу желудочно-резистентным препаратам, описанным ранее.
Моногидратная натриевая соль тенатопразола может быть применена для производства лекарственных средств, применяемых для лечения желудочно-кишечных патологий, в частности, таких, при которых требуется интенсивное и длительное ингибирование кислотной секреции, для лечения симптомов и нарушений гастроэзофагеального рефлюкса, желудочно-кишечных кровотечений, устойчивых к другим ингибиторам протонного насоса.
Дозировка определяется практикующими врачами в зависимости от состояния больного и тяжести заболевания. В общем случае она составляет от 10 до 120 мг, предпочтительно от 10 до 80 мг, более предпочтительно от 15 до 40 мг активного начала в день.
Превосходная растворимость моногидрата натриевой соли S-тенатопразола обеспечивает наилучшую поглощающую способность активного начала и, таким образом, наилучшую биодоступность.
В частности, биодоступность действующего вещества в форме для перорального приема, такой как таблетка или желатиновая капсула, близка к биодоступности, достигаемой при внутривенном введении, и это свидетельствует о большой эффективности продукта.
Далее описано получение моногидрата натриевой соли S-тенатопразола, а также его специфические свойства с целью проиллюстрировать настоящее изобретение, не ограничивая пределов его действия.
Пример 1
Получение (S)-(-)-тенатопразола
В колбу вместимостью 5 л вносят 3 л дихлорметана, затем 360 г 5-метокси-2-[[4-метокси-3,5-диметил]-2-пиридил)метил]тио]имидазо[4,5-b]пиридина. Перемешивают при комнатной температуре в течение 30 минут.
В колбу вместимостью 2 л вносят последовательно 700 мл ацетонитрила, 5,22 г 2,4-ди-трет-бутил-6-[1-R-гидроксиметил-2-метилпропилимино)-метил]-фенола, затем 2,90 г ванадилацетилацетоната. Смесь перемешивают воздухом при комнатной температуре. После 30 минут перемешивания данный раствор прибавляют к раствору, приготовленному ранее.
К этой смеси прибавляют при перемешивании 135 мл пероксида водорода с концентрацией 30% в течение 20 часов при комнатной температуре. После отделения водного слоя органический слой дважды промывают водой, затем сушат и концентрируют при пониженном давлении. Получают 283 г требуемого энантиомера с содержанием энантиомера более 80% (выход 75%). Последовательно дважды перекристаллизовывают из смеси метанол/вода или ДМФ/этилацетат и получают энантиомер с содержанием энантиомера более 99%.
tпл: 127,5°C
[α]D: -182 (c 0,1, ДМФ)
Спектр УФ (метанол-вода): λmax: 272 нм (ε=6180), 315 нм (ε=24877).
Инфракрасный спектр (KBr): 3006, 1581, 1436, 1364, 1262 см-1.
ЯМР 13C (KOH, стандарт: 3-(триметилсилил)-1-пропансульфонат натрия) δ (м.д.): 13,2; 15,0; 56,6; 60,8; 62,6; 107,2; 129,5; 130,4; 131,9; 135,1; 150,5; 151,4; 156,9; 160,7; 163,0; 166,6.
ЯМР 1H (ДМСО d6, стандарт: ТМС) δ (м.д.): 2,20 (с, 6H), 3,70 (с, 3H), 3,91 (с, 3H), 4,69-4,85 (м, 2H), 6,80 (д, J 8,5 Гц, 1H), 7,99 (д, J 8,5 Гц, 1 H), 8,16 (с, H), 13,92 (с, 1H).
Пример 2
Получение моногидрата натриевой соли S-(-)-тенатопразола
В колбу вместимостью 50 мл, снабженную перемешивающим устройством, термодатчиком и холодильником, вносят 1,0 г S-(-)-тенатопразола, полученного по примеру 1, прибавляют 1,0 мл воды, затем 0,6 мл водного раствора гидроксида натрия (5 M) при комнатной температуре и проводят реакцию при медленном перемешивании.
Реакционную смесь нагревают до 60°C и перемешивают в течение 2,5 часов. Получают маслянистую жидкость, которую охлаждают до комнатной температуры, затем растворитель удаляют при пониженном давлении при 40°C на роторном испарителе. После прибавления 6 мл ацетона и перемешивания выпадает продукт желтоватого цвета, который отделяют фильтрованием через пористый стеклянный фильтр, затем промывают 2,0 мл ацетона или диэтилового эфира.
После высушивания при 40°C при пониженном давлении в течение 20 ч получают 1,1 г соли моногидрата S-тенатопразола натрия с выходом более 90%.
Свойства моногидрата натриевой соли были определены термическим анализом и рентгеновской дифрактометрией. Температура плавления tпл: 235°C (метод капилляров; прибор Бюхи B545).
Содержание воды: 5,8% (по методу Фишера).
Содержание энантиомера: более 99% (хиральная хроматография).
ЯМР 1Н (ДМСО d6, стандарт: ДМС) δ (м.д.): 8,23 (1H, с); 7,70 (1H, д, J=8,4 Гц); 6,37 (1H, д, J=8,4 Гц); 4,73 (1H, д, J=12,9 Гц); 4,37 (1H, д, J=12,9 Гц); 3,82 (3H, с); 3,70 (3H, с); 2,22 (3H, с); 2,21 (3H, с).
Термогравиметрический анализ
Термогравиметрический анализ проводили с применением термовесов Netzsch SCA 409 PC/PG. Измерения проводили в алюминиевой кювете в интервале от 20 до 150°C со скоростью нагрева 2°С/мин в атмосфере азота.
Термогравиметрическая кривая характеризуется тремя последовательными участками:
- в интервале от 10 до 40°C: испарение, потеря воды 1,35%;
- в интервале от 90 до 130°C: дегидратация, потеря 4,65% (десорбция молекул воды);
- в интервале от 160 до 230°C: разложение, потеря 9,42%.
Рентгеновская дифрактометрия
Анализ проводили с применением дифрактометра Siemens D5005 (медный антикатод, напряжение 40 кВ, ток 30 мA, комнатная температура, интервал измерений от 3 до 30°C, инкремент между измерениями 0,04°, пошаговое время измерений 4 с).
Таблица с результатами измерений приведена далее:
2-тэта, °
Натриевая соль моногидрата была равным образом исследована методом DVS (динамическая сорбция паров).
Запись осуществляли с применением прибора компании SMS (Surface Measurement System) со следующими характеристиками:
максимальная проба: 1,5 г;
чувствительность: 0,1 мкг;
диапазон температур: 5-48°C;
диапазон относительной влажности: 0-98%;
точность: 1% относительной влажности.
Данная методика позволяет определить способность продукта гидратироваться, дегидратироваться, сольватироваться и десольватироваться измерением прибыли или потери массы в зависимости от атмосферы с изменяемым содержанием воды или растворителя при средней температуре.
Результаты представлены в приведенной далее таблице:
Полученные результаты показывают, что стехиометрическое соотношение для моногидратной формы сохраняется при относительной влажности от 20 до 80% без появления феномена ожижения в отличие от безводной формы (см. пример 3). Все это показывает превосходную стабильность моногидрата натриевой соли в условиях влажности.
В условиях высокой относительной влажности, более 80%, стехиометрическое соотношение для моногидрата натриевой соли S-тенатопразола может меняться, число молекул воды может составлять от 1 до 2. Результаты рентгеновской дифрактометрии для данной формы, которая в равной мере является объектом настоящего изобретения, представлены аналогично результатам, приведенным ранее:
Пример 3
Получение моногидрата натриевой соли S-(-)-тенатопразола
По варианту способа примера 2 получают моногидрат натриевой соли в соответствии с описанными далее процедурами.
В трехгорлую колбу вместимостью 250 мл, снабженную перемешивающим устройством, холодильником и термодатчиком, вносят 25 мл хлороформа. Прибавляют 10 г S-тенатопразола, полученного по примеру 1, и перемешивают до растворения в хлороформе. Охлаждают на бане со смесью вода/лед до 4-5°C, затем прибавляют 150 мл ацетона и выдерживают до 4-5°C.
Прибавляют при перемешивании 3,85 г раствора гидроксида натрия (30%), поддерживая температуру 4-5°C, затем реакционной массе дают нагреваться до комнатной температуры (20-25°C) при перемешивании в течение 16 часов. После часа взаимодействия наблюдается начало выпадения осадка.
Реакционную массу охлаждают до температуры 4-5°C на бане со льдом и выдерживают при перемешивании в течение 4 часов. После фильтрования реакционной массы через стеклянный пористый фильтр получают порошок, который промывают 15 мл предварительно охлажденного ацетона. После высушивания в сушильном шкафу в вакууме при 60°C в течение ночи получают приблизительно 1,1 г продукта в виде моногидрата натриевой соли S-тенатопразола с выходом более 90%.
Свойства соли идентичны свойствам, приведенным в примере 2.
Сравнительный пример 4
Получение безводной соли S-(-)-тенатопразола натрия
Исходя из S-(-)-тенатопразола примера 1 и действуя согласно примеру 2, дают взаимодействовать водному раствору гидроксида натрия с S-тенатопразолом при 60°C с получением маслянистой жидкости, которую после удаления воды при пониженном давлении обрабатывают ацетоном, затем промывают и сушат. Полученный продукт переводят в суспензию смесью метанол/ацетонитрил (25/75) при 50°C, затем охлаждают до 5°C с образованием белого осадка, который отделяют фильтрованием, предохраняя от увлажнения.
Выход после перекристаллизации: 85%.
Результаты рентгеновской дифрактометрии, полученные на оборудовании типа Brüker D5000 (медный антикатод, 40 В, 30 мА), приведены далее:
Результаты анализа DVS (запись осуществляли в таких же условиях, как и в примере 2):
Можно констатировать, что при относительной влажности (остаточная влажность) более 60% безводная форма становится необратимо ожиженной в отличие от моногидратной формы.
Сравнительный пример 5
Получение сольвата 1,4-диоксан/натриевая соль S-(-)-тенатопразола
Исходя из S-(-)-тенатопразола примера 1, осуществляют взаимодействие водного раствора гидроксида натрия с S-тенатопразолом при 60°C согласно способу, описанному в примере 2, с получением маслянистой жидкости, которую после удаления воды при пониженном давлении обрабатывают ацетоном, затем промывают и сушат.
Полученный таким образом продукт переводят в суспензию достаточным объемом 1,4-диоксана при 25 °C (приблизительно 100 мл на 1 г). Медленно концентрируют суспензию при комнатной температуре в течение 48 часов, затем фильтруют с получением сольвата 1,4-диоксан/натриевая соль (1/1) в виде белого порошка.
Термогравиметрический анализ:
Термогравиметрический анализ проводили в условиях, описанных в примере 2.
На первой стадии наблюдается испарение.
На второй стадии в интервале от 70 до 100°C происходит десольватация 1,4-диоксана. Вследствие потери массы на 3-й и 4-й стадиях устанавливается стехиометрическое соотношение сольвата 1/1.
Рентгеновская дифрактометрия:
Рентгеновскую дифрактометрию проводили на оборудовании типа Brüker D5000 (медный антикатод, 40 В, 30 мА). Результаты приведены далее.
Сравнительный пример 6
Получение аморфной натриевой соли S-(-)-тенатопразола
В колбу вместимостью 50 мл с 1,0 г S-(-)-тенатопразола, полученного по примеру 1, прибавляют 1,0 мл воды, затем 0,6 мл водного раствора гидроксида натрия (5 M) при комнатной температуре.
Реакционную смесь нагревают до 60°C и перемешивают в течение 2,5 часов. Получают маслянистую жидкость, которую охлаждают до комнатной температуры, затем растворитель удаляют при пониженном давлении при 40°C. После прибавления 5 мл воды и перемешивания выпадает аморфная соль, которую отделяют фильтрованием. В спектре дифракции рентгеновских лучей полоса дифракции отсутствует.
Изобретение относится к моногидрату натриевой соли S-тенатопразола, соответствующего формуле:
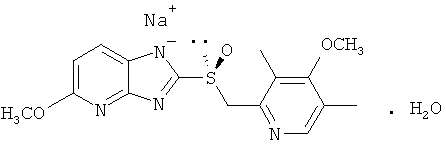
Изобретение также относится к способу получения моногидрата натриевой соли S-тенатопразола, к применению и фармацевтической композиции на его основе для лечения желудочно-кишечных патологий. Технический результат - получение нового соединения и фармацевтической композиции на его основе, которое может использоваться в медицине для производства лекарственных средств для лечения желудочно-кишечных патологий, гастроэзофагеального рефлюкса и желудочно-кишечных кровотечений у больных, которым назначают полимедикаментозную терапию. 10 н. и 9 з.п. ф-лы, 9 табл.
1. Моногидрат натриевой соли S-тенатопразола, соответствующий приведенной далее общей формуле (II):

2. Концентрированный водный раствор моногидрата натриевой соли S-тенатопразола, отличающийся тем, что концентрация соли моногидрата больше или равна 50 г/л.
3. Концентрированный раствор по п.2, отличающийся тем, что концентрация соли моногидрата больше или равна 100 г/л.
4. Фармацевтическая композиция для лечения желудочно-кишечных патологий, отличающаяся тем, что она содержит моногидрат натриевой соли S-тенатопразола по п.1, ассоциированный с одним или несколькими фармацевтически приемлемыми наполнителями и основами.
5. Композиция по п.4, отличающаяся тем, что она представляет собой форму стандартной дозы, содержащей от 10 до 80 мг активного начала.
6. Композиция по п.5, отличающаяся тем, что стандартная доза содержит от 15 до 40 мг активного начала.
7. Применение моногидрата натриевой соли S-тенатопразола, свободной от (+)-энантиомера или R-тенатопразола, для лечения желудочно-кишечных патологий.
8. Применение моногидрата натриевой соли S-тенатопразола для производства лекарственных средств для лечения желудочно-кишечных патологий, при которых требуется интенсивное и длительное ингибирование кислотной секреции.
9. Применение моногидрата натриевой соли S-тенатопразола для производства лекарственных средств для лечения желудочно-кишечных патологий, гастро-эзофагеального рефлюкса и желудочно-кишечных кровотечений у больных, которым назначают полимедикаментозную терапию.
10. Применение моногидрата натриевой соли S-тенатопразола для производства лекарственных средств, проявляющих улучшенные фармакокинетические свойства при эрадикационной терапии в отношении Helicobacter pylori при лечении язвы двенадцатиперстной кишки.
11. Способ получения моногидрата натриевой соли S-тенатопразола натрия, отличающийся тем, что действуют гидроксидом натрия на S-тенатопразол при температуре в интервале от 50 до 70°С с последующим осаждением полученной соли после удаления растворителя.
12. Способ по п.11, отличающийся тем, что температура, при которой осуществляют реакцию, составляет приблизительно 60°С.
13. Способ по любому из пп.11 и 12, отличающийся тем, что реакцию осуществляют в растворителе, таком, как вода, хлороформ, ДМСО, или в протонном растворителе, например в метаноле или этаноле.
14. Способ энантиоселективного получения моногидрата натриевой соли S-тенатопразола, отличающийся тем, что он состоит в энантиоселективном окислении сульфида общей формулы (I), приведенной далее:
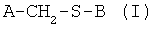
в которой А представляет собой группу 4-метокси-3,5-диметил-2-пиридил и В представляет собой группу 5-метоксиимидазо[4,5-b]пиридил, по меньшей мере, одним окислительным агентом в присутствии катализатора на основе ванадия и хирального лиганда в специфическом по отношению к сульфиду растворителе и специфическом по отношению к лиганду растворителе, где указанные растворители выбраны из группы, в которую входят метанол, тетрагидрофуран, дихлорметан, ацетонитрил, ацетон и N-метилпирролидон или толуол, один из них или их смесь, с последующим переводом в соль гидроксидом для получения моногидрата натриевой соли S-тенатопразола.
15. Композиция для перорального приема моногидрата натриевой соли S-тенатопразола для лечения желудочно-кишечных патологий, отличающаяся тем, что она состоит из смеси разбавителя, дезинтегрирующего агента и моногидрата натриевой соли S-тенатопразола, ядро которой покрыто желудочно-резистентной пленкой.
16. Композиция по п.15, отличающаяся тем, что разбавителем является целлюлозный разбавитель.
17. Композиция по п.16, отличающаяся тем, что разбавителем является наполнитель для прямого прессования.
18. Композиция по п.15, отличающаяся тем, что дезинтегрирующим агентом является полимер целлюлозы, такой, как полимер карбоксиметилцеллюлозы.
19. Композиция по п.18, отличающаяся тем, что дезинтегрирующим агентом является кроскармеллоза натрия.
| 0 |
|
SU254588A1 | |
| KAKINOKI В at al, METHODS AND FINDINGS IN EXPERIMENTAL AND CLINICAL PHARMACOLOGY, vol.21, no.3, p.p.179-187, 1999 | |||
| ИМИДАЗОПИРИМИДИНЫ И ИМИДАЗОПИРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 1998 |
|
RU2201929C2 |
Авторы
Даты
2009-12-20—Публикация
2005-06-17—Подача