Данное изобретение относится к бензилокси производным общей формулы
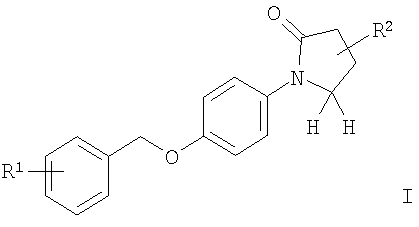
где R1 представляет собой галоген;
R2 представляет собой -C(O)NH2, -C(NH2)=N-OH, -C(O)CH2Br,
-С(O)N(СН3)ОСН3 или -С(O) - низший алкил, или представляет собой 5-членную гетероарильную группу, содержащую 2 или 3 гетероатома, выбранных из группы, состоящей из N, О или S, которая может быть замещена низшим алкилом, -NR'R'' или -C(O)R;
R представляет собой -NR'R'', низший алкил или низший алкокси;
R'/R'' независимо друг от друга представляют собой водород или низший алкил; а также к их фармацевтически приемлемым солям.
Данное изобретение включает как индивидуальные изомеры соединений формулы I, так и их рацемические и нерацемические смеси.
Соединения формулы I и их фармацевтически приемлемые соли, как индивидуальные изомеры соединений формулы I, так и их рацемические и нерацемические смеси (в дальнейшем: Фармацевтическое Соединение) обладают фармакологической активностью и пригодны для использования в качестве фармацевтических средств. В частности, Фармацевтические Соединения ингибируют активность моноаминоксидазы В.
Моноаминоксидаза (МАО) является флавинсодержащим ферментом, отвечающим за окислительное дезаминирование эндогенных моноаминных нейротрансмиттеров, таких как дофамин, серотонин, адреналин или норадреналин, и следовых аминов, например фенилэтиламина, а также ряда аминных ксенобиотиков. Данный фермент существует в двух формах, МАО-А и МОА-В, кодируемых разными генами (A.W.Bach et al., Proc. Natl. Acad. Sci. USA 1988, 85, 4934-4938) и отличающихся тканевым распределением, строением и субстратной специфичностью. МАО-А обладает более высоким сродством к серотонину, октопамину, адреналину и норадреналину; тогда как фенилэтиламин и тирамин являются природными субстратами для МАО-В. Считается, что дофамин окисляется обеими изоформами. МАО-В широко распределен в некоторых органах, включая мозг (A.M.Cesura and A.Pletscher, Prog. Drug Research 1992, 38, 171-297). Полагают, что с возрастом МАО-В активность мозга увеличивается. Это увеличение было объяснено глиозом, связанным со старением (C.J.Fowler et al., J.Neural. Transm. 1980, 49, 1-20). Кроме того, активность МАО-В значительно выше в мозге пациентов с болезнью Альцгеймера (P.Dostert et al., Biochem. Pharmacol. 1989, 38, 555-561) и, как было найдено, высоко выражена в астроцитах вокруг старческих бляшек (Saura et. al., Neoroscience 1994, 70, 755-774). В связи с этим, так как окислительное дезаминирование первичных моноаминов под действием МАО приводит к NH3, альдегидам и H2O2, веществам с установленной или потенциальной токсичностью, представляется целесообразным использование селективных МАО-В ингибиторов для лечения слабоумия и болезни Паркинсона. Ингибирование МАО-В вызывает снижение ферментативной инактивации дофамина и, таким образом, пролонгирование работоспособности нейротрансмиттера в дофаминергических нейронах. Также дегенеративные процессы, связанные с возрастом и болезнями Альцгеймера и Паркинсона, можно объяснить окислительным стрессом из-за увеличенной активности МАО и, как следствие, увеличенного образования H2O2 под действием МАО-В. Поэтому МАО-В ингибиторы могут влиять как на уменьшение образования радикалов кислорода, так и на повышение уровней моноаминов в мозге.
Учитывая вышеупомянутое влияние МАО-В на неврологические нарушения, существует значительный интерес получить эффективные и селективные ингибиторы, которые позволили бы контролировать эту ферментативную активность. Например, фармакология некоторых известных МАО-В ингибиторов обсуждается D.Bentue-Ferrer et. al. в CNS Drugs 1996, 6, 217-236. Главным ограничением активности необратимого и неселективного МАО ингибитора является необходимость соблюдения диетических ограничений из-за риска проявления гипертонического криза при употреблении тирамина с пищей, а также возможность взаимодействий с другими лекарственными препаратами (D.M.Gardner et al., J.Clin. Psychiatry 1996, 57, 99-104), а к обратимым и селективным МАО ингибиторам, в особенности к МАО-В, эти неблагоприятные факты относятся в меньшей степени. Таким образом, существует потребность в МАО-В ингибиторах с высокой селективностью и без неблагоприятных побочных эффектов, обычных для необратимых МАО ингибиторов с низкой селективностью к ферменту.
Фармацевтические Соединения соответственно полезны как селективные ингибиторы моноаминоксидазы В, например, при лечении или предотвращении болезней и состояний, при которых играет роль или включается активность моноаминоксидазы В. В особенности подобные состояния включают острые и/или хронические неврологические нарушения.
Острые и/или хронические неврологические нарушения включают психоз, шизофрению, болезнь Альцгеймера, когнитивные расстройства и нарушения памяти подобные умеренному когнитивному расстройству, возрастному когнитивному спаду, мультиинфарктной деменции, болезни Паркинсона, нарушению памяти, связанному с депрессией или тревогой, синдрому Дауна, инсульту, травматическому повреждению мозга и синдрому дефицита внимания. Другие состояния, которые можно лечить, представляют собой ограниченную функцию мозга, вызванную операциями шунтирования или трансплантациями, недостаточное мозговое кровоснабжение, травмы спинного мозга, травмы головы, гипоксию, вызванную беременностью, остановку сердца и гипогликемию. Также состояниями, которые можно лечить, являются острая и хроническая боль, хорея Хантингтона, боковой амиотрофический склероз (ALS), слабоумие, вызванное ВИЧ, травмы глаз, ретинопатия, идиопатический паркинсонизм или лекарственный паркинсонизм, а также состояния, которые ведут к глутамат-недостаточным функциям, таким, например, как спазмы мышц, конвульсии, мигрени, недержание мочи, никотиновая зависимость, психотические приступы, опиатная зависимость, тревога, рвота, дискенезия и депрессия.
В одном воплощении острым и/или хроническим неврологическим нарушением является болезнь Альцгеймера. В другом воплощении острое и/или хроническое неврологическое нарушение представляет собой умеренное когнитивное расстройство или старческое слабоумие.
Таким образом, задача настоящего изобретения заключается в создании соединений, которые должны обладать обозначенными выше полезными свойствами. Было найдено, что соединения формулы 1 настоящего изобретения и их фармацевтически приемлемые соли показывают потенциал, чтобы считаться высоко селективными МАО-В ингибиторами. Кроме того, предметами настоящего изобретения являются лекарства, основанные на соединении формулы 1 согласно данному изобретению, способ изготовления соединений формулы 1 и их фармацевтически приемлемых солей, а также применение соединений формулы 1 для лечения или предотвращения болезней, опосредованных ингибиторами моноаминоксидазы В, и, соответственно, применение для изготовления соответствующих лекарств.
Следующие определения общих терминов, используемых в настоящей заявке, применяются независимо от того, появляются ли эти термины отдельно или в комбинации. Следует отметить, что используемые в описании и приложенной формуле изобретения формы единственного числа включают и формы множественного числа, за исключением тех случаев, когда из контекста ясно не следует противоположное.
Термин «низший алкил», используемый в настоящей заявке, обозначает неразветвленные или разветвленные насыщенные углеводородные остатки с 1-6 атомами углерода, предпочтительно с 1-4 атомами углерода, такие как метил, этил, н-пропил, изо-пропил, н-бутил, втop-бутил, трет-бутил и т.п.
Термин «галоген» обозначает фтор, хлор, бром и иод.
«Низший алкокси» означает остаток -O-R, где R представляет собой остаток низшего алкила, как определено здесь. Примеры алкокси радикалов включают, но не ограничиваются ими, метокси, этокси, изопропокси и т.п.
Термин «5-членный гетероарил, содержащий 2 или 3 гетероатома, выбранных из группы, состоящей из N, О или S» означает систему гетероароматического кольца, выбранную из группы, состоящей из [1.2.4]оксадиазолила, 1,3-тиазолила, имидазолила, пиразолила или изоксазолила. Предпочтительными группами являются [1.2.4]оксадиазолил, 1,3-тиазолил или имидазолил.
«Фармацевтически приемлемые соли» соединения означает соли, которые являются фармацевтически приемлемыми: которые в целом являются безопасными, нетоксичными и не являются нежелательными биологически, или как-либо иначе неподходящими, и которые обладают требуемой фармакологической активностью исходного соединения. Данные соли получают из неорганической или органической кислоты или основания.
Такие соли включают:
(1) кислотно-аддитивные соли, образованные неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образованные органическими кислотами, такими как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептиловая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, 2-нафталенсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, дибензоил-L-винная кислота, винная кислота, п-толуолсульфоновая кислота, триметилуксусная кислота, 2,2,2-трифторуксусная кислота и т.п.; или
(2) соли, образованные либо при замещении кислотного протона в исходном соединении ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо при координации с органическим или неорганическим основанием. Приемлемые органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и т.п. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия.
Следует понимать, что все ссылки на фармацевтически приемлемые соли включают формы включения растворителя (сольваты) или кристаллические формы (полиморфы) той же кислотно-аддитивной соли.
«Фармацевтически приемлемый», например фармацевтически приемлемый носитель, эксципиент и т.д., означает фармакологически приемлемый и по существу нетоксичный для субъекта, которому вводится конкретное соединение.
«Терапевтически эффективное количество» означает количество, которое эффективно для того, чтобы предотвратить, облегчить или улучшить симптомы болезни или продлить жизнь объекта, проходящего курс лечения.
Кроме того, как используется здесь, термин «млекопитающее, которое нуждается в лечении острого и/или хронического неврологического нарушения» означает млекопитающее, например человека, которое страдает или подвергается риску страдать острым и/или хроническим неврологическим нарушением.
Как используется здесь, термины «лечить», «лечимый», «лечение» и т.п., применимые к острому и/или хроническому неврологическому нарушению, относятся как к способам, которые замедляют, улучшают, ослабляют или устраняют подобное нарушение или любые симптомы, связанные с данным нарушением, беспокоящим субъекта в настоящее время, так и к способам, которые предотвращают такое нарушение или любые симптомы его проявления.
Среди соединений настоящего изобретения предпочтительными являются некоторые соединения формулы 1 или их фармацевтически приемлемые соли.
Кроме того, предпочтительными являются соединения формулы I, в которых R2 представляет собой 5-членную гетероарильную группу, содержащую 2 или 3 гетероатома, выбранных из группы, состоящей из N, О или S, которая может быть замещена R3, представляющим собой низший алкил, -NR'R'' или -C(O)R. Следующая структура включает такие соединения.
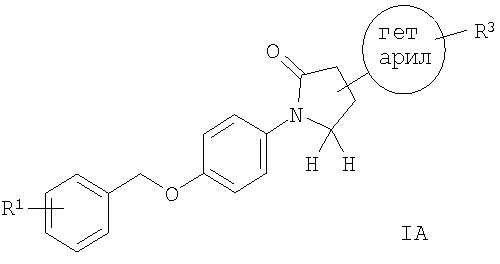
Соединениями формулы IA являются, например, следующие:
(R)-1-[4-(3-фтор-бензилокси)-фенил]-4-(5-метил-[1.2.4]оксадиазол-3-ил)-пирролидин-2-он,
этиловый эфир 3-{(R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-ил}-[1.2.4]оксадиазол-5-карбоновой кислоты,
амид 3-{(R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-ил}-[1.2.4]оксадиазол-5-карбоновой кислоты,
(R)-1-[4-(3-фтор-бензилокси)-фенил]-4-(2-метил-тиазол-4-ил)-пирролидин-2-он или
(R)-1-[4-(3-фтор-бензилокси)-фенил]-4-(1Н-имидазол-4-ил)-пирролидин-2-он.
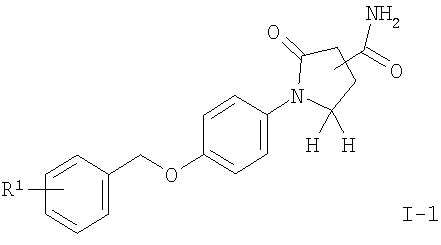
Кроме того, соединениями формулы I являются те, в которых R2 представляет собой -C(O)NH2, -C(NH2)=N-OH, -C(O)CH2Br, -С(O)N(СН3)ОСН3 или -С(O) - низший алкил, например
амид (R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновой кислоты,
(R)-1-[4-(3-фтор-бензилокси)-фенил]-N-гидрокси-5-оксо-пирролидин-3-карбоксамидин,
метокси-метил-амид (R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновой кислоты или
(R)-4-ацетил-1-[4-(3-фтор-бензилокси)-фенил]-пирролидин-2-он.
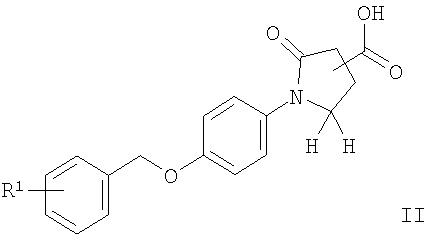
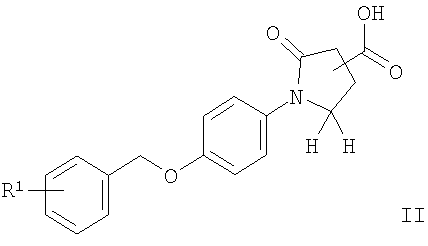
Данные соединения общей формулы I и их фармацевтически приемлемые соли можно получить известными из предшествующего уровня техники способами, например способами, описанными ниже, при которых
а) соединение формулы
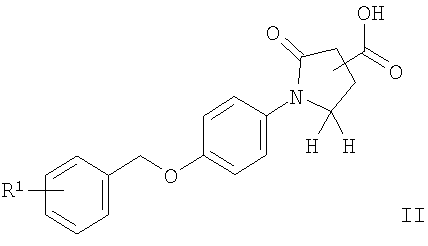
подвергают взаимодействию с ацетатом аммония в присутствии конденсирующего реагента подобного, например, CDI (1,1'-карбонилдиимидазолу), с получением соединения формулы
где R1 является таким, как описано выше, или
б) соединение формулы
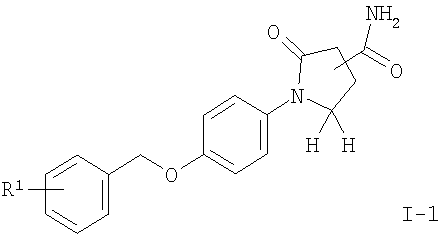
подвергают взаимодействию с тионилхлоридом с получением соединения формулы
где R1 является таким, как описано выше, или
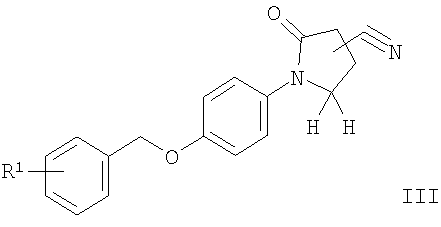
в) соединение формулы
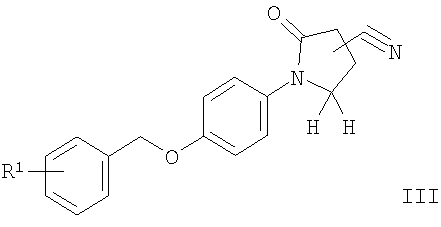
подвергают взаимодействию с гидроксиламином с получением соединения формулы
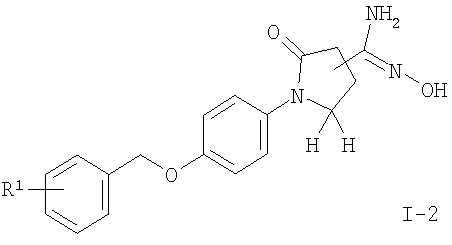
где R1 является таким, как описано выше, или
г)соединение формулы

подвергают взаимодействию с ацетилхлоридом в присутствии основания с получением соединения формулы
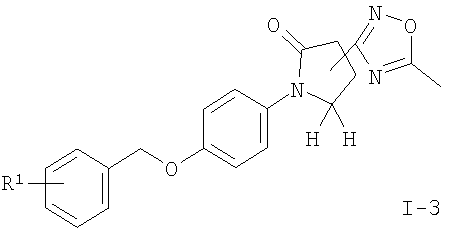
где R1 является таким, как описано выше, или
д)соединение формулы

подвергают взаимодействию с этилоксалилхлоридом с получением соединения формулы
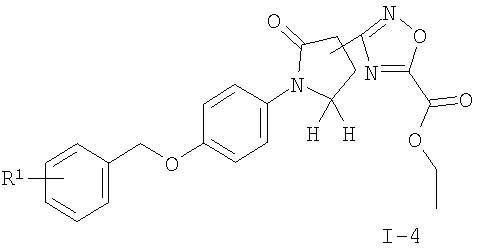
где R1 является таким, как описано выше, или
е) соединение формулы

подвергают взаимодействию с NH4OH с получением соединения формулы
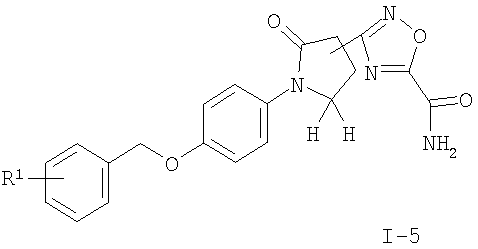
где R1 является таким, как описано выше, или
ж)соединение формулы
подвергают взаимодействию с тионилхлоридом в присутствии N,N'-диметилформамида, триметилсилилдиазометана и HBr с получением соединения формулы
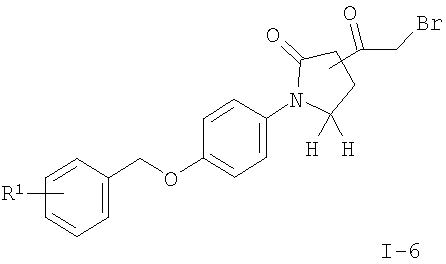
где R1 является таким, как описано выше, или
з) соединение формулы

подвергают взаимодействию с формамидом с получением соединения формулы
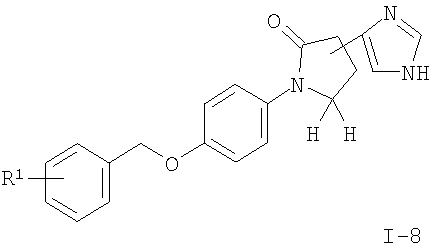
где R1 является таким, как описано выше, или
и) соединение формулы

подвергают взаимодействию с тиоацетамидом в ТГФ с получением соединения формулы
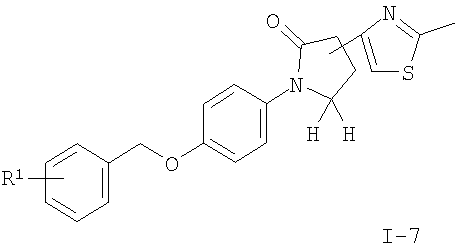
где R1 является таким, как описано выше, или
к) соединение формулы
подвергают взаимодействию с N,O-диметилгидроксиламина гидрохлоридом и CDI с получением соединения формулы
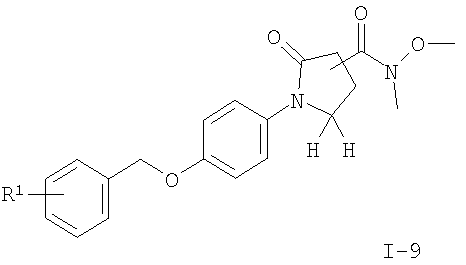
где R1 является таким, как описано выше, или
л) соединение формулы

подвергают взаимодействию с MeMgBr в ТГФ с получением соединения формулы
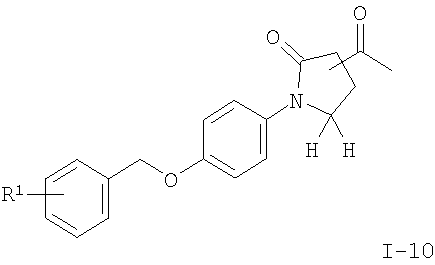
где R1 является таким, как описано выше, и
при желании переводят полученное соединение формулы I в фармацевтически активные кислотно-аддитивные соли.
Согласно настоящему изобретению на схемах 1 и 2 показана возможность получения соединений общей формулы I.
Соединения общей формулы I можно получить с помощью реакции соединения формулы II с 1,1'-карбонилдиимидазолом (CDI) в N,N'-диметилформамиде (ДМФ) и добавления ацетат аммония (схема 1), чтобы получить соответствующий амид формулы I-1. Нитрильное соединение можно получить из амида дегидратацией с реагентом, подобным тионилхлориду, предпочтительно при 90°С. Реакция соединения формулы III с гидроксиламина гидрохлоридом в присутствии основания подобного N,N-диизопропилэтиламину (DIPEA) приводит к необходимому N-гидрокси-карбоксамидину формулы I-2, который реагирует с ацетилхлоридом в присутствии основания, подобного пиридину, с получением соединений формулы I-4 или с этилоксалилхлоридом с получением соединений формулы I-3. Соответствующий амид формулы I-5 может быть получен из эфира нагреванием с аммиаком в растворителе, подобном метанолу.
Схема 1
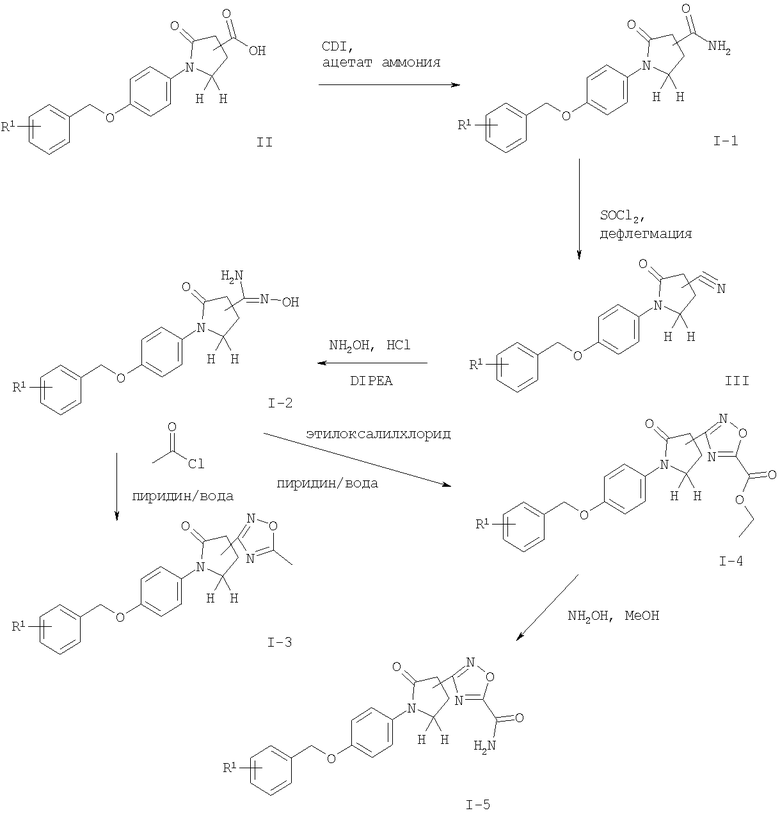
Определение R1 является таким, как описано выше.
Другие соединения общей формулы I можно получить по реакции соединения формулы II с тионилхлоридом в присутствии каталитического N,N'-диметилформамида с образованием промежуточного хлорангидрида, который реагирует с триметилсилилдиазометаном и 33% бромисто-водородной кислотой в уксусной кислоте с получением 2-бром-ацетильного соединения I-6. Соединения формулы I, где R2 означает имидазол (I-8), можно получить нагреванием с обратным холодильником соединений формулы I-6 с формамидом и водой. Соединения формулы I, где R2 означает тиазол (I-7), можно получить нагреванием с обратным холодильником соединений формулы I-6 с тиоацетамидом в растворителе, подобном тетрагидрофурану.
Другие соединения формулы I, где R2 означает амид, подобный метоксиметиламиду (I-9), можно получить из соответствующей кислоты формулы II и 1,1'-карбонилдиимидазола (CDI) в N,N'-диметилформамиде (ДМФ) с образованием активированного промежуточного соединения, которое реагирует с соответствующим амином, подобным метоксиметиламину. Метоксиметиламид I-9 реагирует с нуклеофилами, подобными алкилмагнийбромиду, например метилмагнийбромидом, с получением соответствующего кетона формулы 1-10.
Схема 2
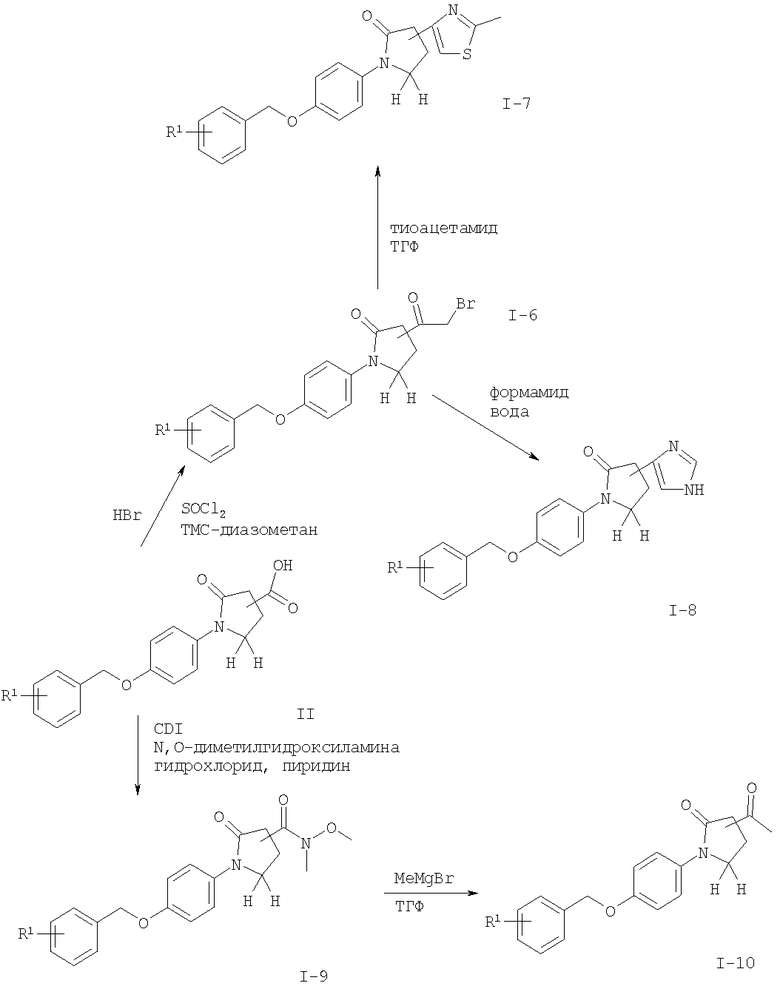
Заместитель R1 имеет значение, как описано выше.
Фармацевтически приемлемые соли соединений формулы 1 можно легко получить согласно известным методам, принимая во внимание природу превращаемого в соль соединения. Неорганические или органические кислоты, такие как, например соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п., подходят для образования фармацевтически приемлемых солей основных соединений формулы I. Соединения, содержащие щелочные или щелочноземельные металлы, например натрий, калий, кальций, магний и т.п., основные амины или основные аминокислоты подходят для образования фармацевтически приемлемых солей кислотных соединений.
Как уже было сказано, соединения формулы I и их фармацевтически приемлемые соли представляют собой ингибиторы моноаминоксидазы В и могут быть использованы для лечения или предотвращения заболеваний, при которых МАО-В ингибиторы могут быть полезны. Эти заболевания включают острые и хронические неврологические нарушения, когнитивные расстройства и нарушения памяти. Излечиваемыми неврологическими нарушениями являются, например, травматические или хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, другие виды слабоумия, минимальное когнитивное расстройство или болезнь Паркинсона. Другие показания включают психиатрические расстройства, такие как депрессия, тревога, приступ паники, социальная фобия, шизофрения, расстройства питания и метаболические расстройства, например ожирение, а также предотвращение и лечение абстинентных синдромов, вызванных употреблением алкоголя, никотина и других препаратов, вызывающих привыкание. Другими излечиваемыми показаниями могут быть синдром дефицита значимости (G.M.Sullivan, международная заявка № WO 01/34172 А2), периферическая невропатия, вызванная химиотерапией рака (G.Bobotas, международная заявка № WO 97/33572 А1) или лечение рассеянного склероза (R.Y.Harris, международная заявка № WO 96/40095 А1) и другие нейровоспалительные заболевания.
Используя следующий метод, проверяли фармакологическую активность соединений:
Фармакологическую активность Фармацевтических соединений можно показать, например, следующим образом:
кДНК, кодирующей МАО-А и МАО-В человека, временно трансфицировали в EBNA клетки, используя описанную Schlaeger и Christensen процедуру [Cytotechnology 15: 1-13 (1998)]. После трансфекции клетки гомогенизировали посредством гомогенизатора Polytron в 20 мМ Tris HCl буфере, рН 8,0, содержащем 0,5 мМ EGTA и 0,5 мМ фенилметансульфонилфторида. Клеточные мембраны получали центрифугированием при 45,000 × g, и после двукратного промывания с 20 мМ Tris HCl буфером, рН 8,0, содержащим 0,5 мМ EGTA, мембраны ресуспендировали в вышеописанном буфере и аликвоты хранили при -80°С до использования.
Ферментативную активность МАО-А и МАО-В проверяли на 96-луночном планшете, используя спектрофотометрический анализ согласно адаптированному методу, описанному Zhou и Panchuk-Voloshina [Analitical Biochemistry 253: 169-174
(1997)]. Кратко, аликвоты мембран инкубировали в 0,1 М калийфосфатном буфере, рН 7,4, в течение 30 минут при 37°С без или с различными концентрациями соединений. После этого начинали ферментативную реакцию, добавляя МАО субстрат тирамин вместе с 1 Ед/мл пероксидазы хрена (Roche Biochemical) и 80 мкМ N-ацетил-3,7-дигидроксифеноксазином (Amplex Red, Molecular Probes). Затем образцы инкубировали в течение 30 минут при 37°С в конечном объеме 200 мкл и определяли оптическую плотность на длине волны 570 нм, используя считывающее устройство для планшетов SpectraMax (Molecular Devices). Фоновую (неспецифическую) оптическую плотность определяли для МАО-А в присутствии 10 мкМ клоргилина, а для МАО-В - в присутствии 10 мкМ L-депренила.
Значения ИК50 определяли по кривым ингибирования, полученным при использовании девяти дублированных концентраций ингибитора, подбором данных к четырехпараметрическому логистическому уравнению, используя компьютерную программу.
Соединения настоящего изобретения представляют собой специфические МАО-В ингибиторы. Значения ИК50 соединений формулы I, измеренные в ходе ранее описанного анализа, находятся в пределах 1 мкМ или менее, и идеально 0,1 мкМ или менее. В таблице ниже показаны характерные значения ИК50 соединений формулы I в одной из их энатиомерных форм:
Фармацевтические соединения можно использовать в качестве лекарств, например в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако эффективным также может быть ректальное введение, например в форме суппозиториев, или парентеральное, например в форме растворов для инъекций.
Фармацевтические соединения можно переработать с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. можно использовать, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; однако в зависимости от природы активного вещества для мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п. Адъюванты, такие как спирты, полиолы, глицерин, растительные масла и т.п., могут быть использованы для водных инъекционных растворов водорастворимых солей соединений формулы I, но, как правило, они не являются необходимыми. Подходящими носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, ароматизаторы, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Также они могут содержать другие терапевтически ценные вещества.
Дозировка может варьировать в широких пределах и, конечно, должна быть подобрана по индивидуальным потребностям в каждом конкретном случае. В общем, эффективная дозировка для перорального или парентерального введения находится в интервале 0,01-20 мг/кг/день, для всех описанных показаний дозировка 0,1-10 мг/кг/день является предпочтительной. Суточная дозировка для взрослого человека весом 70 кг, соответственно, находится в интервале 0,7-1400 мг в день, предпочтительно в интервале 7-700 мг в день.
Следующие примеры поясняют изобретение. Они не ограничивают объем изобретения, а только представляют его.
Пример 1
Амид (R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновой кислоты
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновую кислоту (1,5 г, 0,005 моль) растворяли в безводном N,N'-диметилформамиде в атмосфере аргона и охлаждали до 0°С. 1,1'-Карбонилдиимидазол (1,4 г, 0,009 моль) добавляли к смеси и реакционную смесь перемешивали в течение одного часа, пока температура повышалась от 0°С до комнатной температуры. Добавляли ацетат аммония (5,6 г, 0,073 моль) и реакционную смесь перемешивали в течение одного часа при комнатной температуре. Воду к смеси добавляли по каплям, и выпадал осадок. Твердое вещество фильтровали, промывали водой и высушивали в вакууме, получая 1,36 г (0,0041 моль, 91% от теоретического) указанного в заголовке соединения в виде белого твердого вещества. MS (m/e)=329,3 (М+Н)+.
Пример 2
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбонитрил
Смесь амида (R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновой кислоты (0,400 г, 0,001 моль) и тионилхлорида (2,3 мл, 0,032 моль) нагревали с обратным холодильником в атмосфере аргона в течение 3 часов. Смесь охлаждали до комнатной температуры, разбавляли 5 мл тетрагидрофурана, концентрировали в вакууме и очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана в соотношении 2:3. Фракции продукта концентрировали досуха, получая (0,106 г, 28% от теоретического) светло-коричневое масло. MS (m/e)=311,1 (М+Н)+.
Пример 3
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-N-гидрокси-5-оксо-пирролидин-3-карбоксамидин
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбонитрил (0,211 г, 0,001 моль) и гидроксиламина гидрохлорид (0,047 г, 0,001 моль) растворяли в этаноле (4 мл) и добавляли N,N-диизопропилэтиламин (0,120 мл, 0,001 моль). Реакционную смесь перемешивали при нагревании с обратным холодильником в течение трех часов. Реакционную смесь охлаждали до комнатной температуры, растворитель выпаривали, остаток экстрагировали дихлорметаном и очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь дихлорметана и метанола в соотношении 19:1, и получали (0,220 г, 94% от теоретического) желтое масло. MS (m/e)=344,3 (М+Н)+.
Пример 4
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-4-(5-метил-[1.2.4]оксадиазол-3-ил)-пирролидин-2-он
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-N-гидрокси-5-оксо-пирролидин-3-карбоксамидин (0,020 г, 0,58 ммоль) растворяли в 0,4 мл пиридина и медленно добавляли ацетилхлорид (0,01 мл, 0,116 ммоль) при 0°С. Затем смесь перемешивали при 70°С всю ночь. Добавляли ледяную воду и перемешивали смесь в течение одного часа. Экстракция с насыщенным раствором хлорида аммония и дихлорметана давала неочищенный продукт, который очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь дихлорметана и метанола в соотношении 19:1, и получали указанное в заголовке соединение в виде светло-желтого твердого вещества (0,0197 г, 92% от теоретического). MS (m/e)=368,4 (М+Н)+.
Пример 5
Этиловый эфир 3-{(R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-ил}-[1.2.4]оксадиазол-5-карбоновой кислоты
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-N-гидрокси-5-оксо-пирролидин-3-карбоксамидин (0,020 г, 0,58 ммоль) растворяли в 0,4 мл пиридина и медленно добавляли этилоксалилхлорид (0,01 мл, 0,116 ммоль) при 0°С. Затем смесь перемешивали при 70°С полчаса. Добавляли ледяную воду и перемешивали смесь в течение одного часа. Экстракция с насыщенным раствором хлорида аммония и дихлорметана давала неочищенный продукт, который очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана в соотношении 2:1, и получали указанное в заголовке соединение в виде светло-желтого твердого вещества (0,019 г, 77% от теоретического). MS (m/e)=426,3 (М+Н)+.
Пример 6
Амид 3-{(R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-ил}-[1.2.4]оксадиазол-5-карбоновой кислоты
Этиловый эфир 3-{(R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-ил}-[1.2.4]оксадиазол-5-карбоновой кислоты (0,110 г, 0,25 ммоль) растворяли в 3,5 мл аммиака (2 М раствор в метаноле). Полученную в результате смесь перемешивали при 50°С полчаса. Смесь охлаждали до 0°С и осаждали твердое вещество. Реакционную смесь фильтровали, и твердое вещество промывали гексаном и высушивали в вакууме. Остаток суспендировали в этилацетате и нагревали с обратным холодильником. Добавляли диэтиловый эфир, суспензию охлаждали до 0°С и фильтровали, получая указанное в заголовке соединение в виде светло-коричневого твердого вещества (0,045 г, 44% от теоретического). MS (m/e)=397,4 (M+H)+.
Пример 7
(R)-4-(2-Бром-ацетил)-1-[4-(3-фтор-бензилокси)-фенил]-пирролидин-2-он
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновую кислоту (0,204 г, 0,62 ммоль) растворяли в смеси дихлорметана (4 мл), тионилхлорида (0,15 мл, 2,1 ммоль) и каталитического количества N,N'-диметилформамида. Реакционную смесь перемешивали полчаса при комнатной температуре до образования промежуточного ацилхлорида. Затем растворитель удаляли при пониженном давлении, и остаток суспендировали в толуоле, концентрировали в вакууме и высушивали. Полученное в результате масло растворяли в ацетонитриле (2 мл) и добавляли триметилсилилдиазометан (2 М в гексане) (1,55 мл, 3,1 ммоль) в атмосфере аргона. Полученный в результате желтый раствор перемешивали при комнатной температуре полчаса, пока наблюдался диазокетон. После охлаждения реакционной смеси до 0°С по каплям добавляли бромисто-водородную кислоту (33% в уксусной кислоте) (0,71 мл, 4 ммоль). Полученный в результате темный раствор перемешивали полчаса при комнатной температуре. Добавляли бикарбонат натрия (5 мл) и смесь экстрагировали дихлорметаном. Органические слои высушивали над сульфатом магния, фильтровали и выпаривали досуха, получая остаток, который очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана в соотношении 1:1, и получали указанное в заголовке соединение в виде светло-желтого масла (0,067 г, выход 67,5% от теоретического). MS (m/e)=407,3 (М+Н)+.
Пример 8
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-4-(2-метил-тиазол-4-ил)-пирролидин-2-он
(R)-4-(2-Бром-ацетил)-1-[4-(3-фтор-бензилокси)-фенил]-пирролидин-2-он (0,040 г, 0,098 ммоль) растворяли в тетрагидрофуране (1 мл), добавляли тиоацетамид (0,007 г, 0,098 ммоль) и смесь перемешивали при 40°С в течение 24 часов. Тетрагидрофуран выпаривали, и остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана сначала в соотношении 1:1, затем 4:1, и получали указанное в заголовке соединение в виде светло-желтого твердого вещества (0,030 г, 80% от теоретического). MS (m/e)=383,3 (М+Н)+.
Пример 9
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-4-(1H-имидазол-4-ил)-пирролидин-2-он
(R)-4-(2-Бром-ацетил)-1-[4-(3-фтор-бензилокси)-фенил]-пирролидин-2-он (0,050 г, 0,123 ммоль) растворяли в воде (0,1 мл), добавляли формамид (0,6 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 6 часов. Добавляли 2 М HCl и смесь экстрагировали этилацетатом. Водный слой нейтрализовали водным раствором (10%) гидроксида натрия (рН 7-8) и снова экстрагировали этилацетатом с получением неочищенного материала, который подвергали хроматографии на силикагеле, используя в качестве элюента смесь дихлорметана и метанола в соотношении 19:1. Получали 0,011 г (25% от теоретического) указанного в заголовке соединения в виде бесцветного твердого вещества. MS (m/e)=352,4 (М+Н)+.
Пример 10
Метокси-метил-амид (R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновой кислоты
(R)-1-[4-(3-Фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновую кислоту (0,200 г, 0,001 моль) растворяли в безводном N,N'-диметилформамиде (1 мл) в атмосфере аргона и охлаждали раствор до 0°С. 1,1'-Карбонилдиимидазол (0,108 г, 0,001 моль) добавляли к смеси и реакционную смесь перемешивали в течение одного часа, пока температура повышалась от 0°С до комнатной температуры. После добавления N,O-диметилгидроксиламина гидрохлорида (0,063 г, 0,001 моль) и пиридина (0,053 мл, 0,001 ммоль) реакционную смесь перемешивали в течение двух часов при комнатной температуре. Добавляли воду (10 мл) и соляную кислоту (0,1 н) и смесь экстрагировали этилацетатом. Органическую фазу промывали раствором карбоната натрия (1 М) и снова экстрагировали этилацетатом, получая 0,225 г (99% от теоретического). Неочищенный продукт, полученный данным образом, использовали на следующей стадии без дополнительной очистки. MS (m/e)=373,4 (М+Н)+.
Пример 11
(R)-4-Ацетил-1-[4-(3-фтор-бензилокси)-фенил]-пирролидин-2-он
Метокси-метил-амид (R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-карбоновой кислоты (0,050 г, 0,143 ммоль) растворяли в атмосфере аргона в тетрагидрофуране (1 мл) и добавляли метилмагнийбромид (0,188 ммоль, 0,063 мл) при 0°С. Полученный в результате раствор перемешивали при 0°С в течение двух часов. Добавляли воду при 0°С и смесь перемешивали в течение одного часа. Экстракция этилацетатом давала остаток, который подвергали хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и циклогексана в соотношении 9:1, и получали 0,040 г (91% от теоретического) указанного в заголовке соединения в виде белого твердого вещества. MS (m/e)=328,4 (М+Н)+.
Пример А
Таблетки следующего состава готовят традиционным способом:
Пример Б
Таблетки следующего состава готовят традиционным способом:
Пример В
Готовят капсулы следующего состава:
Активный ингредиент с подходящим размером частиц, кристаллическую лактозу и микрокристаллическую целлюлозу смешивают друг с другом до получения однородной смеси, просеивают и затем смешивают с тальком и стеаратом магния. Конечной смесью заполняют твердые желатиновые капсулы подходящего размера.
Пример Г
Раствор для инъекции может быть следующего состава и изготовлен традиционным способом:
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 4-ПИРРОЛИДИНОФЕНИЛБЕНЗИЛОВОГО ЭФИРА | 2003 |
|
RU2336268C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДОНА В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАМИНОКСИДАЗЫ В (МАО-В), СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2003 |
|
RU2323209C2 |
| ИНГИБИТОРЫ ДЕМЕТИЛАЗЫ LSD1 НА ОСНОВЕ АРИЛЦИКЛОПРОПИЛАМИНА И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2011 |
|
RU2611437C2 |
| ОКСАЗОЛИДИНОНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2006 |
|
RU2417223C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНАМИДОВ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2003 |
|
RU2309950C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛИДИН-3,4-ДИКАРБОКСАМИДА | 2005 |
|
RU2379288C2 |
| ПРОИЗВОДНЫЕ 3-ЗАМЕЩЕННОГО 1,5-ДИФЕНИЛПИРАЗОЛА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ СВ1 МОДУЛЯТОРОВ | 2005 |
|
RU2375349C2 |
| ДИФЕНИЛЬНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1997 |
|
RU2175319C2 |
| ПРИМЕНЕНИЕ ОКСАЗОЛИДИНОН-ХИНОЛИНОВЫХ ГИБРИДНЫХ АНТИБИОТИКОВ ДЛЯ ЛЕЧЕНИЯ СИБИРСКОЙ ЯЗВЫ И ДРУГИХ ИНФЕКЦИЙ | 2004 |
|
RU2351335C2 |
| (3-ЦИКЛОАЛКИЛ-2,3,4,5-ТЕТРАГИДРО-1Н-БЕНЗО[d]АЗЕПИН-7-ИЛОКСИ)ПРОИЗВОДНЫЕ, ИХ ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ Н3 РЕЦЕПТОРОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ | 2003 |
|
RU2388752C2 |
Изобретение относится к новым бензилокси-производным общей формулы (I)

где: R1 означает галоген; R2 означает 5-членную гетероарильную группу, содержащую 2 или 3 гетероатома, выбранных из группы, состоящей из N, О или S, которая может быть замещена R3, где R3 означает низший алкил или -C(O)R; R означает -NR'R'' или низший алкокси; R'/R'' независимо друг от друга означают Н; а также их фармацевтически приемлемые соли. Соединения I ингибируют моноаминоксидазу В, что позволяет использовать их для приготовления лекарственного средства. 3 н. и 2 з.п. ф-лы.
1. Соединения общей формулы

где R1 представляет собой галоген;
R2 представляет собой 5-членную гетероарильную группу, содержащую 2 или 3 гетероатома, выбранных из группы, состоящей из N, О или S, которая может быть замещена R3, где R3 представляет собой низший алкил или -C(O)R;
R представляет собой -NR'R'' или низший алкокси;
R'/R'' независимо друг от друга представляют собой водород;
а также их фармацевтически приемлемые соли.
2. Соединения формулы I по п.1, которые представляют собой
(R)-1-[4-(3-фтор-бензилокси)-фенил]-4-(5-метил-[1.2.4]оксадиазол-3-ил)-пирролидин-2-он,
этиловый эфир 3-{(R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-ил}-[1.2.4]оксадиазол-5-карбоновой кислоты,
амид 3-{(R)-1-[4-(3-фтор-бензилокси)-фенил]-5-оксо-пирролидин-3-ил}-[1.2.4]оксадиазол-5-карбоновой кислоты,
(R)-1-[4-(3-фтор-бензилокси)-фенил]-4-(2-метил-тиазол-4-ил)-пирролидин-2-он или
(R)-1-[4-(3-фтор-бензилокси)-фенил]-4-(1Н-имидазол-4-ил)-пирролидин-2-он.
3. Соединение формулы I по п.1 или 2, а также его фармацевтически приемлемые соли, ингибирующие моноаминоксидазу В.
4. Лекарство, ингибирующее моноаминоксидазу В, содержащее одно или более соединений по п.1 или 2 и фармацевтически приемлемые эксципиенты.
5. Применение соединения формулы I по п.1 или 2, а также его фармацевтически приемлемых солей для изготовления лекарства, ингибирующего моноаминоксидазу В.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ЗАМЕЩЕННЫЕ (ПИРИДИНИЛАМИНО)-БЕНЗИЗОКСАЗОЛЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ АДДИТИВНЫЕ СОЛИ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2083575C1 |
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА, ИХ ПРИМЕНЕНИЕ В ПРОИЗВОДСТВЕ ИНГИБИРУЮЩЕГО МОНОАМИНООКСИДАЗУ АГЕНТА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ МОНОАМИНООКСИДАЗЫ ТИПА В | 1995 |
|
RU2140414C1 |
Авторы
Даты
2010-01-10—Публикация
2005-07-27—Подача