Изобретение относится к биохимии, к биологически активным пептидам, обладающим антимикробной активностью, которые могут быть использованы в биотехнологии для создания устойчивых к патогенам форм сельскохозяйственных культур и в пищевой промышленности для консервации продуктов питания.
Потери урожая сельскохозяйственных культур, связанные с патогенами (грибами, бактериями, вирусами и вироидами), насекомыми-вредителями и нематодами достигают 45% [Oeke B.C., Dehne H.W., Schonbeck P., Weber A. Crop Production and Crop Protection: Estimated Losses in Major Food and Cash Crops. - 1994. - Elsevier, Amsterdam]. Помимо снижения производства сельскохозяйственной продукции, патогены ухудшают ее качество. Так микотоксины Fusarium sp., присутствующие в зараженном зерне, токсичны для человека и животных. Ежегодно ущерб, наносимый патогенами и вредителями, достигает 100 миллиардов долларов. На фоне стремительного роста населения Земли на 1,5% в год увеличивается и потребность в пищевом белке, которая в настоящее время составляет 230 млн. тонн в год, что делает проблему повышения урожайности сельскохозяйственных культур чрезвычайно актуальной. Традиционные методы селекции не всегда эффективны из-за отсутствия соответствующих генов устойчивости, кроме того, они трудоемки и длительны. Использование химических средств защиты растений представляет существенную угрозу экологической безопасности и позволяет снизить потери урожая лишь на 5-10%.
Альтернативной стратегией повышения устойчивости сельскохозяйственных культур к патогенам и насекомым-вредителям, а также к стрессовым факторам окружающей среды абиотической природы (засухе, засоленности почвы и др.) служит генетическая инженерия, которая позволяет встраивать чужеродные гены, обуславливающие устойчивость, в геномы культурных растений. Растет спектр трансгенов, используемых для трансформации растений. Путем генетической трансформации уже получены сельскохозяйственные культуры, устойчивые к гербицидам, насекомым-вредителям, а также абиотическому стрессу.
Известен генетически модифицированный сорт папайи, устойчивый к вирусу кольцевой пятнистости, за счет встраивания в геном гена белка оболочки вируса [Ferreira S.A., Pitz K.Y., Manshardt R., Zee F., Fitch M., Gonsalves D. Virus coat protein transgenic papaya provides practical control of papaya ringspot virus in Hawaii. // Plant Dis. - 2002. - Vol.86. - P.101-106]. Известен генетически модифицированный сорт картофеля, устойчивый к вирусу скручивания листа. В этом случае устойчивость к вирусу обеспечивается ингибированием активности гена репликазы [Delvas M., Ceriani M.F., Collavita M., Butzonich I., Hopp H.E. Analysis of transgenic potato plants expressing potato leaf-roll virus coat protein gene. // Plant Physiol. - 1993. - Vol.102 - P.174-180].
В настоящее время не известны генетически модифицированные сельскохозяйственные культуры, устойчивые к грибам и бактериям.
По современным представлениям в растениях содержится целый арсенал средств, который позволяет им бороться с патогенами и насекомыми-вредителями. Существенную роль среди них играют соединения, обладающие антимикробными свойствами, к которым относятся вторичные метаболиты растений - фитоалексины и фитоантисипины, а также ряд белков и пептидов. Повышение устойчивости растений может быть достигнуто как усилением экспрессии собственных генов, участвующих в защитных реакциях, так и встраиванием в геном генов, кодирующих белки и пептиды с антимикробными свойствами, из других видов растений. В этом смысле антимикробные пептиды, обладающие широким спектром антимикробного действия, представляют особый интерес, поскольку их гены могут быть непосредственно встроены в геном чувствительных к патогенам растений с использованием методов генетической трансформации [Carlini C.R., Grossi-de-Sa M.F. Plant toxic proteins with insecticidal properties. A review on their potentialities as bioinsecticides. // Toxicon. - 2002. - Vol.40. - P.1515-1539].
Известен наиболее близкий к заявляемому по структуре и антифунгальным свойствам пептид EAFP1, выделенный из коры Eucommia ulmoides [Two novel antifungal peptides distinct with a five-disulfide motif from the bark of Eucommia ulmoides Oliv. // FEBS Lett. - 2002. - Vol.521. - P.87-90]. Вещество относится к семейству цистеин-богатых хитин-связывающих пептидов, ингибирует рост некоторых патогенных грибов и бактерий в концентрациях 3,5-30 мкМ.
Изобретение решает задачу расширения ассортимента пептидов растительного происхождения, обладающих антимикробной активностью.
Поставленная задача решается за счет структуры нового пептида WAMP-1, имеющего следующую аминокислотную последовательность:
Ala1-Gln2-Arg3-Cys4-Gly5-Asp6-Gln7-Ala8-Arg9-Gly10-Alall-Lysl2-Cys13-Pro14-Asnl5-Cysl6-Leul7-Cysl8-Cysl9-Gly20-Lys21-Tyr22-Gly23-Phe24-Cys25-Gly26-Ser27-Gly28-Asp29-Ala30-Tyr31-Cys32-Gly33-Ala34-Gly35-Ser36-Cys37-Gln38-Ser39-Gln40-Cys41-Arg42-Gly43-X,
где Х - Cys44 (WAMP-1a) или Cys44-Arg45 (WAMP-1b).
Заявляемый пептид проявляет выраженную антифунгальную и антимикробную активность в отношении следующих грибов-патогенов растений, плесневых грибов и патогенных бактерий: Fusarium solani VKM F-142, Fusarium verticillioides VKM F-670, Fusarium oxysporum TCXA-4, Botrytis cinerea VKM F-85, Neurospora crassa VKM F-184, Pseudomonas syringae pv. tomato, Clavibacter michiganensis subsp. michiganensis и Erwinia carotovora. Для полного ингибирования роста перечисленных грибов и бактерий in vitro необходимы микромолярные концентрации пептида.
Техническим результатом предлагаемого изобретения является высокая антимикробная активность заявляемого пептида.
Пептид WAMP-1 состоит из 44 или 45 аминокислотных остатков и может быть получен химическим синтезом, биотехнологически или выделен из семян пшеницы Triticum kiharae, которая относится к семейству злаковые Роасеае, классу однодольные Monocotyledones, отделу покрытосеменные или цветковые растения Magnoliophyta (Angiospermae).
Изобретение иллюстрируют рисунки:
Фиг.1 - Разделение суммарного экстракта из 10 г семян пшеницы методом аффинной хроматографии на колонке HiTrap™ Heparin HP объемом 5 мл (Amersham Biosciences, США) ступенчатым градиентом NaCl, скорость элюции - 1 мл/мин. Детектирование белков и пептидов в элюате по оптической плотности при 280 нм. Серым прямоугольником отмечена фракция, содержащая пептид WAMP-1.
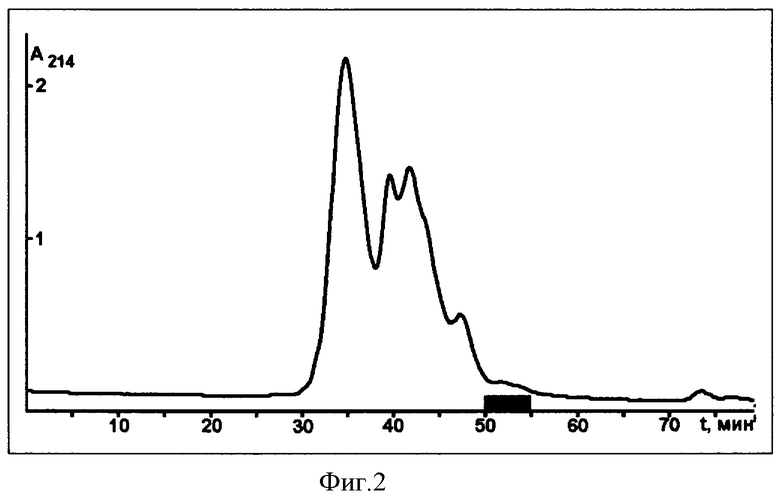
Фиг.2 - Разделение 100-мМ фракции, содержащей пептид WAMP-1 (см. фиг.1), с помощью гель-фильтрации на колонке Superdex Peptide HR 10/30 (GE Healthcare Bio-Sciences AB, Uppsala, Sweden) размером 1×30 см. Разделение в 5%-ном ацетонитриле в 0,05%-ной трифторуксусной кислоте, скорость элюции - 1 мл/мин. Детекция белков и пептидов по оптической плотности при 214 нм. Серым прямоугольником отмечена фракция, содержащая пептид WAMP-1.
Фиг.3 - Разделение фракции, содержащей пептид WAMP-1 (см. фиг.2) методом обращенно-фазовой высокоэффективной жидкостной хроматографии на колонке Vydac С18 размером 4,6×250 мм, размер пор 300 Å, диаметр частиц 5 мкм, (The Nest Group, Inc., США) в линейном градиенте ацетонитрила в присутствии 0,1%-ной трифторуксусной кислоты при скорости элюции 1 мл/мин и температуре 40°С. Регистрация оптической плотности элюата при 214 нм. Стрелкой отмечена фракция, содержащая пептид WAMP-1.
Изобретение иллюстрируют следующие примеры.
Пример 1
Выделение пептида WAMP-1
Семена пшеницы измельчают до состояния муки в кофемолке и экстрагируют 5-ю объемами смеси 1%-ной трифторуксусной кислоты, 1 М НСl, 5%-ной НСООН и 1%-ного NaCl при комнатной температуре и перемешивании в течение 1 ч. Суспензию центрифугируют при 22000 g в течение 15 мин при комнатной температуре, осадок отбрасывают, а надосадочную жидкость обессоливают с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии на колонке Aquapore RP-300 C8 (10×30 мм, размер пор 300 Å, диаметр частиц 7,5 мкм; Applied Biosystems, США). Используют следующие растворы: А - 0,1%-ная трифторуксусная кислота в воде, Б - 80%-ный ацетонитрил в 0,1%-ной трифторуксусной кислоте. Колонку промывают 6-ю объемами раствора Б и уравновешивают 6-ю объемами раствора А при скорости элюции 1,5 мл/мин. Детекцию проводят по оптическому поглощению элюата при 214 нм. После нанесения кислотного экстракта на колонку ее промывают раствором А до тех пор, пока величина поглощения элюата не станет равной исходному значению. Белки и пептиды десорбируют с колонки 70% раствора Б, упаривают на вакуумном концентраторе для удаления ацетонитрила и лиофильно высушивают.
Полученный сухой остаток из 10 г исходного сырья растворяют в 5 мл раствора В (10 мМ Трис-HCl, рН 7,2) и разделяют с помощью аффинной хроматографии на колонке HiTrap™ Heparin HP объемом 5 мл (Amersham Biosciences, США), предварительно уравновешенной 5-ю объемами буфера В. После нанесения образца сорбент сначала отмывают буфером В от несвязавшихся веществ, после чего белки и пептиды элюируют сначала 100 мМ NaCl в буфере В (фракция I), а затем 500 мМ NaCl в буфере В (фракция II) со скоростью 1 мл/мин. Детекцию белков и пептидов проводят по оптическому поглощению элюата при 280 нм (рис.1). Полученные фракции обессоливают и высушивают, как описано выше, и проводят тестирование их биологической активности.
Фракцию I растворяют в 1 мл раствора Г (5%-ный ацетонитрил в 0,05%-ной трифторуксусной кислоте) и разделяют с помощью гель-фильтрации на колонке Superdex Peptide HR 10/30 column (GE Healthcare Bio-Sciences AB, Uppsala, Sweden) размером 1×30 см, предварительно уравновешенной раствором Г. На колонку наносят 200 мкл раствора фракции I. Разделение ведут при скорости элюции 150 мкл/мин и комнатной температуре. Детекцию белков и пептидов осуществляют по оптическому поглощению при 214 нм (рис.2). Полученные фракции высушивают, проводят тестирование их биологической активности.
Фракции со временем элюции 50-55 мин (рис.2), обладающие антифунгальной активностью, объединяют и разделяют с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии на колонке Vydac C18 (4,6×250 мм, размер пор 300 Å, диаметр частиц 5 мкм; The Nest Group, Inc., США). Фракционирование проводят в линейном градиенте ацетонитрила: 10-50% раствора Б за 60 мин при скорости элюции 1 мл/мин и температуре 40°С. Детекцию проводят по оптическому поглощению при 214 нм (рис.3), проводят тестирование полученных фракций. Пептид WAMP-1 элюируется со временем удерживания 17,5 мин. В результате получают препарат искомого пептида с содержанием примесей менее 3%. Две молекулярные формы пептида WAMP-1 разделяются путем рехроматографии в тех же условиях.
Пример 2
Установление аминокислотной последовательности пептида WAMP-1
Для определения числа остатков цистеина в аминокислотной последовательности пептида проводят восстановление дисульфидных связей и алкилирование образовавшихся тиольных групп. Восстановление и алкилирование проводят по модифицированной методике [Thomsen J., Bayne S. Microscale alkylation with 4-vinylpyridine. // J. Protein Chem. - 1988. - Vol.7. - P.295-296]. Пептид (1 нмоль) растворяют в 35 мкл буфера, содержащего 6 М гуанидин-гидрохлорид и 2 мМ ЭДТА в 0,5 М Трис-НСl буфере, рН 8,5), добавляют 2 мкл водного раствора, содержащего 1 мкмоль 1,4-дитиотреитола, продувают азотом, перемешивают и инкубируют при 40°С в течение 4 час. Затем к смеси добавляют 2 мкл 50%-ного раствора 4-винилпиридина в 2-пропаноле, перемешивают и инкубируют в темноте 20 мин при комнатной температуре. К смеси добавляют 120 мкл 0,1%-ной трифторуксусной кислоты, и восстановленный и алкилированный пептид отделяют с помощью обращенно-фазовой высокоэффективной хроматографии на колонке Vydac C18 (4,6×250 мм, размер пор 300 Å, диаметр частиц 5 мкм; The Nest Group, Inc., США), предварительно уравновешенной 0,1%-ной трифторуксусной кислотой. Продукты реакции и реагенты отделяют промывкой колонки этим же растворителем до достижения исходного оптического поглощения элюата, пептид элюируют в тех же условиях, которые описаны в примере 1 для очистки пептида WAMP-1.
Определение аминокислотной последовательности очищенного восстановленного и алкилированного пептида WAMP-1 проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Precise 492 (Applied Biosystems, США). В результате устанавливают полную аминокислотную последовательность WAMP-1, состоящую из 44 или 45 аминокислотных остатков:
Alal-Gln2-Arg3-Cys4-Gly5-Asp6-Gln7-Ala8-Arg9-Glyl0-Alall-Lysl2-Cys13-Prol4-Asnl5-Cysl6-Leul7-Cysl8-Cysl9-Gly20-Lys21-Tyr22-Gly23-Phe24-Cys25-Gly26-Ser27-Gly28-Asp29-Ala30-Tyr31-Cys32-Gly33-Ala34-Gly35-Ser36-Cys37-Gln38-Ser39-Gln40-Cys41-Arg42-Gly43-X,
где X - Cys44 (WAMP-1a) или Cys44-Arg45 (WAMP-1b).
Пример 3
Определение относительной молекулярной массы и числа свободных и дисульфидсвязанных остатков цистеина в пептиде WAMP-1
Полученную аминокислотную последовательность, а также индивидуальность очищенного пептида подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре Ultraflex II TOF/TOF (Bruker Daltonik, Германия), с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют дигидробензойную кислоту (10 мг/мл в 50%-ном ацетонитриле, содержащем 0,1%-ную трифторуксусную кислоту). Для калибровки прибора используют стандартную смесь пептидов и белков с диапазоном молекулярных масс 700-66000 Да (Sigma, США).
Измеренная моноизотопная молекулярная масса природного пептида WAMP-1 составляет 4431,95 Да и в пределах точности MALDI-масс-спектрометра (0,01%) не отличается от расчетной (4431,66 Да). Молекулярная масса алкилированного невосстановленного пептида WAMP-1 составляет 4431,88 Да, т.е. также не отличается от измеренной молекулярной массы природного пептида. Таким образом, пептид WAMP-1 не содержит свободных сульфгидрильных групп, а все 10 остатков цистеина вовлечены в образование 5 дисульфидных связей, пептид не содержит каких-либо иных химических модификаций.
Пример 4
Биологические свойства пептида WAMP-1
Для определения антифунгальной активности фракций, полученных при разделении кислоторастворимых белков и пептидов пшеницы, а также очищенного пептида WAMP-1 используют следующие культуры грибов: Fusarium solani VKM F-142, Fusarium verticillioides VKM F-670, Fusarium oxysporum TCXA-4, Botrytis cinerea VKM F-85, Neurospora crassa VKM F-184. Для определения антибактериальной активности выделенного пептида WAMP-1 используют следующие культуры бактерий: Pseudomonas syringaepv. tomato, Clavibacter michiganensis subsp. michiganensis и Erwinia carotovora.
Для изучения активности выделенные фракции и очищенный пептид WAMP-1 замораживают в жидком азоте, лиофильно высушивают, перерастворяют в воде и вновь высушивают. Сухие вещества перерастворяют в 50 мкл воды. Концентрацию определяют по спектру поглощения в УФ области.
Антифунгальную активность определяют по ингибированию прорастания спор в жидкой питательной среде (картофельный декстрозный раствор) в 96-луночных планшетах. Определение концентраций пептида, необходимых для 50%-ного подавления прорастания спор грибов (IC50), проводят методом двойного разбавления. Готовят серию двукратных разведении тестируемых веществ в воде. В лунки помещают тестируемый образец и суспензию спор гриба. Общий объем пробы составляет 100 мкл. В качестве контроля служит лунка, в которую вместо раствора тестируемого образца добавлена стерильная дистиллированная вода. Планшеты инкубируют в течение 24 ч и проводят оценку ингибирования прорастания спор по оптической плотности суспензии при 620 нм. Результаты для пептида WAMP-1 приведены в табл.1.
Антибактериальную активность определяют методом радиальной диффузии. Для тестирования антибактериальной активности по 50 мкл растворов исследуемых пептидов разной концентрации наносят на ватные тампоны, которые затем помещают в лунки диаметром 0,5 см на чашках Петри с агаризованной средой LB. Чашки предварительно засевают бактериальными культурами, росшими в течение 16-18 ч в жидкой среде LB. Для тестирования используют штамм возбудителя бактериальной крапчатости томата Pseudomonas syringae pv. tomato, штамм возбудителя бактериального рака томата Clavibacter michiganensis subsp.michiganensis и штамм возбудителя мокрой гнили Erwinia carotovora. Чашки инкубируют при комнатной температуре. Результаты теста оценивают через 24-48 ч по размеру зоны подавления роста бактерий. В качестве контроля используют антибиотик клафоран. Результаты для пептида WAMP-1 приведены в табл.2.
В скобках приведен размер зон подавления роста бактерий, вызванного антибиотиком клафораном.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД, ОБЛАДАЮЩИЙ АНТИФУНГАЛЬНОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2352580C1 |
| ПЕПТИД ЗВЕЗДЧАТКИ STELLARIA MEDIA L., ОБЛАДАЮЩИЙ АНТИФУНГАЛЬНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2603058C1 |
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2005 |
|
RU2302467C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pЕ-Trx-Lc-def, ШТАММ Escherichia coli ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА ДЕФЕНСИНА ЧЕЧЕВИЦЫ Lens culinaris И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2010 |
|
RU2456345C1 |
| СРЕДСТВО ДЛЯ ПОЛУЧЕНИЯ ПРОТИВОГРИБКОВОГО ПЕПТИДНОГО АНТИБИОТИКА, АКТИВНОГО В ОТНОШЕНИИ ВОЗБУДИТЕЛЕЙ ИНВАЗИВНЫХ МИКОЗОВ | 2020 |
|
RU2764304C1 |
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2005 |
|
RU2302466C1 |
| КОМПОЗИЦИЯ НА ОСНОВЕ ГИБРИДНОГО РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ООМИЦЕТАМИ | 2021 |
|
RU2786706C2 |
| ПЕПТИДЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2005 |
|
RU2302425C2 |
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2006 |
|
RU2306148C1 |
| Штамм Emericellopsis alkalina Bilanenko & Georgieva - продуцент антибиотиков - пептаиболов с антигрибной и антибактериальной активностью | 2019 |
|
RU2704421C1 |


Биологически активный пептид WAMP-1, имеющий следующую аминокислотную последовательность: Ala1-Gln2-Arg3-Cys4-Gly5-Asp6-Gln7-Ala8-Arg9-Gly10-Ala11-Lysl2-Cys13-Prol4-Asn15-Cys16-Leul7-Cysl8-Cysl9-Gly20-Lys21-Tyr22-Gly23-Phe24-Cys25-Gly26-Ser27-Gly28-Asp29-Ala30-Tyr31-Cys32-Gly33-Ala34-Gly35-Ser36-Cys37-Gln38-Ser39-Gln40-Cys41-Arg42-Gly43-X, где Х - Cys44 или Cys44-Arg45, обладает антимикробным действием. Может быть использован для защиты растений и пищевых продуктов от поражения патогенными грибками и бактериями. 3 ил., 2 табл.
Пептид, обладающий антимикробной активностью, имеющий следующую аминокислотную последовательность:
Ala1-Gln2-Arg3-Cys4-Gly5-Asp6-Gln7-Ala8-Arg9-Gly10-Ala11-Lys12-Cys13-Pro14-Asn15-Cys16-Leu17-Cys18-Cys19-Gly20-Lys21-Tyr22-Gly23-Phe24-Cys25-Gly26-Ser27-Gly28-Asp29-Ala30-Tyr31-Cys32-Gly33-Ala34-Gly35-Ser36-Cys37-Gln38-Ser39-Gln40-Cys41-Arg42-Gly43-X,
где Х - Cys44 или Cys44-Arg45.
| АНТИМИКРОБНЫЕ БЕЛКИ | 1994 |
|
RU2158762C2 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| US 7214786 B2, 08.05.2007 | |||
| FEBS LETTERS, 307(3): 389-392 (1992). | |||
Авторы
Даты
2010-01-27—Публикация
2008-07-15—Подача