Изобретение относится к биохимии, к биологически активным пептидам, обладающим антифунгальной активностью, которые могут быть использованы в биотехнологии для создания устойчивых к патогенам форм сельскохозяйственных культур и в пищевой промышленности для консервации продуктов питания.
Патогены и вредители наносят огромный вред сельскохозяйственным культурам, снижая урожаи и ухудшая качество конечной продукции. Важнейшими мерами борьбы с патогенами являются селекция на устойчивость и использование химических средств защиты растений - фунгицидов и пестицидов. Первый подход является трудоемким и длительным, второй, хотя и эффективен, наносит ощутимый вред экологии. Новые перспективы для повышения устойчивости растений к патогенам открылись с развитием генетической инженерии, которая позволяет встраивать отдельные гены, обусловливающие устойчивость, из одних видов в другие. Наиболее ощутимые результаты были достигнуты при встраивании генов энтомотоксинов почвенной бактерии Bacillus thuringiensis, что позволило получить растения, устойчивые к ряду насекомых-вредителей [de Maagd R.A., Bosch D., Stiekma W. Bacillus thuringiensis toxin-mediated insect resistance in plants // Trends Plant Sci. - 1999. - Vol. 4. - P. 9-14].
Уже получены и представлены на рынке генетически модифицированные сорта растений, устойчивые к вирусам. Первым таким растением была папайя, устойчивая к вирусу кольцевой пятнистости, что было достигнуто за счет встраивания в геном гена белка оболочки вируса [Ferreira S.A., Pitz K.Y., Manshardt R., Zee F., Fitch M., Gonsalves D. Virus coat protein transgenic papaya provides practical control of papaya ringspot virus in Hawaii // Plant Dis. - 2002. - Vol. 86 - P. 101-112]. Коммерческий генетически модифицированный сорт картофеля, устойчивый к вирусу скручивания листьев, а также несущий Bt ген был коммерциализован в 1990-х годах. Устойчивость к вирусу обеспечивалась за счет ингибирования активности гена репликазы [Delvas М., Ceriani M.F., Collavita М., Butzonich I., Норр Н.Е. Analysis of transgenic potato plants expressing potatao leaf-roll virus coat protein gene // Plant Physiol. - 1993. - Vol. 102 - P. 174-182].
Однако до сих пор на рынке не представлены генетически модифицированные сельскохозяйственные культуры, устойчивые к фитопатогенным грибам.
Несмотря на огромные возможности, которые открывает генетическая инженерия для повышения устойчивости сельскохозяйственных растений к заболеваниям, вызванных патогенами, многие вопросы остаются неясными. В частности, непонятны экологические последствия встраивания генов прокариот в геном растений и безопасности таких трансгенных сортов для млекопитающих [Vazquez-Padron R.I., Moreno-Fierros L., Neri-Bazan L., de la Riva G.A., Lopez-Revilla R. Intragastric and intraperitoneal administration of Cry1Ac protoxin from Bacillus thuringiensis induces systemic and mucosal antibody responses in mice // Life Sci. - 1999. - Vol. 64. - P. 1897-1912]. Более перспективными и безопасными для использования в качестве трансгенов являются гены, определяющие устойчивость самих растений. Установлено, что в ходе эволюции растения выработали сложную многоуровневую систему защиты от патогенов, в которой участвуют соединения различной природы. Важнейшая роль среди них принадлежит антимикробным пептидам (АМП), обеспечивающим устойчивость к широкому кругу патогенов. Дикорастущие растения обладают повышенной устойчивостью к биотическому стрессу в значительной степени благодаря наличию высоко активных АМП. Перспективность использования генов АМП для повышения устойчивости растений определяется тем, что они могут быть непосредственно встроены в геном чувствительных к патогенам растений с использованием методов генетической трансформации [Carlini C.R., Grossi-de-Sa M.F. Plant toxic proteins with insecticidal properties. A review on their potentialities as bioinsecticides // Toxicon - 2002. - Vol. 40. - P. 1515-1539].
По структуре и антифунгальным свойствам к заявляемому пептиду наиболее близок пептид SmAMP1.1a, выделенный ранее из семян Stellaria media (PDB ID: 2KUS A). Вещество относится к семейству цистеин-богатых хитин-связывающих пептидов, ингибирует рост некоторых патогенных грибов в концентрациях 1.6-5.4 мкМ.
Изобретение решает задачу расширения ассортимента пептидов растительного происхождения, обладающих антифунгальной активностью.
Поставленная задача решается за счет структуры нового пептида Sm-AMP3, имеющего аминокислотную последовательность SEQ ID №1.
Заявляемый пептид проявляет выраженную антифунгальную активность в отношении следующих грибов-патогенов растений: Fusarium solani, Aspergillus niger, Bipolaris sorokiniana, Botrytis cinerea, Alternaria alternata. Для полного ингибирования роста перечисленных грибов in vitro необходимы микромолярные концентрации пептида. Техническим результатом предлагаемого изобретения является высокая антимикробная активность заявляемого пептида.
Пептид Sm-AMP3 состоит из 35 аминокислотных остатков. Заряд при pH 7.0 составляет 2,0, а изоэлектрическая точка - 10,43. Пептид может быть получен химическим синтезом или биотехнологически.
Пептид Sm-AMP3 получают из листьев мокрицы Stellaria media L., которая относится к семейству Гвоздичные Caryophyllaceae, классу двудольные Dicotyledones, отделу покрытосеменные или цветковые растения Magnoliophyta (Angiospermae).
Изобретение иллюстрируют следующие примеры.
Пример 1
Выделение пептида Sm-AMP3
Листья звездчатки измельчают в жидком азоте и экстрагируют 10 объемами 10%-ной уксусной кислоты (вес/объем) с добавлением смеси ингибиторов протеиназ (Sigma-Aldrich, США) (1 мл раствора на 30 г растительного материала в 100 мл буфера) при комнатной температуре в течение 1 ч при интенсивном перемешивании. После центрифугирования (10 мин, 22000 g, 4°C) осадок отбрасывают, а надосадочную жидкость концентрируют в 2 раза на роторном испарителе (Ika-Werke, Германия). Белки и пептиды осаждают охлажденным ацетоном в соотношении 1:7 (объем/объем) при температуре 4°C в течение ночи. После центрифугирования (15 мин, 22000 g, 4°C) осадок отбирают и высушивают на воздухе. Белково-пептидную фракцию обессоливают путем обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) на колонке NewGuard C18 (Applied Biosystems, США) при скорости элюции 1 мл/мин. Колонку предварительно уравновешивают раствором А (0,1%-ная водная трифторуксусная кислота). После нанесения кислотного экстракта на колонку ее промывают раствором А до тех пор, пока величина поглощения элюата не станет равной исходному значению. Белки и пептиды десорбируют с колонки 60% ацетонитрилом в 0,1% ТФУ, упаривают на вакуумном концентраторе для удаления ацетонитрила и лиофильно высушивают.
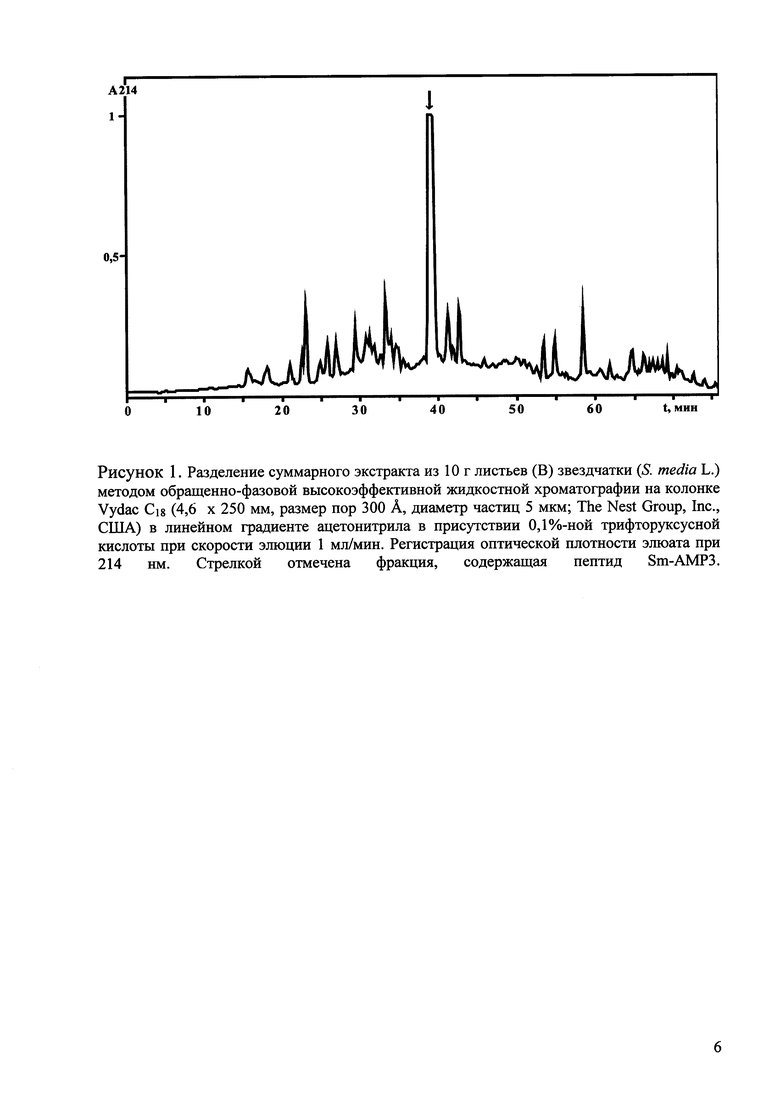
Полученный сухой остаток из 10 г исходного сырья растворяют в 2,5 мл раствора А и разделяют с помощью ОФ-ВЭЖХ на колонке Vydac C18 (4,6×250 мм, размер пор 300 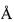 , диаметр частиц 5 мкм; The Nest Group, Inc., США). Фракционирование проводят в линейном градиенте концентрации ацетонитрила: 5-40% раствора Б (80% CH3CN в 0,1% ТФУ) за 60 мин при скорости элюции 1 мл/мин, а затем 40-60% Б за 15 мин. Детекцию проводят по оптическому поглощению при 214 нм (рис. 1). Пептид элюируется со временем удерживания 40 мин. В результате получают препарат искомого пептида с содержанием примесей менее 3%.
, диаметр частиц 5 мкм; The Nest Group, Inc., США). Фракционирование проводят в линейном градиенте концентрации ацетонитрила: 5-40% раствора Б (80% CH3CN в 0,1% ТФУ) за 60 мин при скорости элюции 1 мл/мин, а затем 40-60% Б за 15 мин. Детекцию проводят по оптическому поглощению при 214 нм (рис. 1). Пептид элюируется со временем удерживания 40 мин. В результате получают препарат искомого пептида с содержанием примесей менее 3%.
Пример 2
Установление аминокислотной последовательности пептида Sm-AMP3
Для определения числа остатков цистеина в аминокислотной последовательности пептида проводят восстановление дисульфидных связей и алкилирование образовавшихся тиольных групп. Восстановление и алкилирование проводят по модифицированной методике [Thomsen J., Bayne S. Microscale alkylation with 4-vinylpyridine // J. Protein Chem. - 1988. - Vol. 7. - P. 295-296]. Пептид (1 нмоль) растворяют в 35 мкл буфера, содержащего 6 М гуанидин-гидрохлорид и 2 мМ ЭДТА в 0,5 М Трис-HCl буфере, pH 8,5), добавляют 2 мкл водного раствора, содержащего 1 мкмоль 1,4-дитиотреитола, продувают азотом, перемешивают и инкубируют при 40°C в течение 4 часов. Затем к смеси добавляют 2 мкл 50%-ного раствора 4-винилпиридина в 2-пропаноле, перемешивают и инкубируют в темноте 20 мин при комнатной температуре. К смеси добавляют 120 мкл 0,1%-ной трифторуксусной кислоты, и восстановленный и алкилированный пептид отделяют от продуктов реакции путем обращенно-фазовой высокоэффективной хроматографии на колонке Vydac C18 (4,6×250 мм, размер пор 300 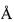 , диаметр частиц 5 мкм; The Nest Group, Inc., США), предварительно уравновешенной 0,1%-ной трифторуксусной кислотой. Продукты реакции и реагенты отделяют промывкой колонки этим же растворителем до достижения исходного оптического поглощения элюата, пептид элюируют в тех же условиях, которые описаны в примере 1 для очистки пептида Sm-AMP3.
, диаметр частиц 5 мкм; The Nest Group, Inc., США), предварительно уравновешенной 0,1%-ной трифторуксусной кислотой. Продукты реакции и реагенты отделяют промывкой колонки этим же растворителем до достижения исходного оптического поглощения элюата, пептид элюируют в тех же условиях, которые описаны в примере 1 для очистки пептида Sm-AMP3.
Определение аминокислотной последовательности очищенного восстановленного и алкилированного пептида Sm-AMP3 проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Procise 492 (Applied Biosystems, США). В результате устанавливают полную аминокислотную последовательность SEQ ID №1 пептида Sm-AMP3, состоящую из 35 аминокислотных остатков.
Пример 3
Определение относительной молекулярной массы и числа свободных и дисульфидсвязанных остатков цистеина в пептиде Sm-AMP3
Полученную аминокислотную последовательность SEQ ID №1, а также индивидуальность очищенного пептида подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре Ultraflex II TOF/TOF (Bruker Daltonik, Германия) с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют а-циано-4-гидроксикоричную кислоту (СНСА) (15 мг/мл в 80%-ном (v/v) ацетонитриле, содержащем 0,1%-ную (v/v) трифторуксусную кислоту). Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Sigma, США).
Измеренная моноизотопная молекулярная масса природного пептида Sm-AMP3 составляет 3362,9 Да и в пределах точности MALDI-масс-спектрометра (0,1%) не отличается от расчетной (4431,66 Да). Молекулярная масса алкилированного невосстановленного пептида Sm-AMP3 составляет 3363,0 Да, т.е. отличается от измеренной молекулярной массы природного пептида на 0,1 Да. Таким образом, пептид Sm-AMP3 не содержит свободных сульфгидрильных групп, а все 6 остатков цистеина вовлечены в образование 3 дисульфидных связей, пептид не содержит каких-либо иных химических модификаций.
Пример 4
Биологические свойства пептида Sm-AMP3
Для определения антигрибной активности фракций, полученных при разделении кислоторастворимых белков и пептидов мокрицы, а также очищенного пептида Sm-AMP3 используют следующие культуры грибов: Fusarium solani, Aspergillus niger, Bipolaris sorokiniana, Botrytis cinerea, Alternaria alternata.
Для изучения активности выделенные фракции и очищенный пептид Sm-AMP3 замораживают в жидком азоте, лиофильно высушивают, перерастворяют в воде и вновь высушивают. Сухие вещества перерастворяют в 50 мкл воды. Концентрацию определяют по спектру поглощения в УФ-области. Антифунгальную активность определяют по ингибированию прорастания спор в жидкой питательной среде (картофельный декстрозный раствор) в 96-луночных планшетах. Готовят серию двукратных разбавлений тестируемых веществ в воде. В лунки помещают тестируемый образец и суспензию спор гриба. Общий объем пробы составляет 100 мкл. В качестве контроля служит лунка, в которую вместо раствора тестируемого образца добавлена дистиллированная вода. Планшеты инкубируют в течение 48 ч и проводят оценку ингибирования прорастания спор по оптической плотности суспензии при 620 нм.
Определение концентраций пептида, необходимых для 50%-ного подавления прорастания спор грибов (IC50), проводят методом двойного разбавления. Результаты для пептида Sm-AMP3 приведены в табл. 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД, ОБЛАДАЮЩИЙ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2380374C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ АНТИФУНГАЛЬНОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2352580C1 |
| ГЕН ЗВЕЗДЧАТКИ Stellaria media, КОДИРУЮЩИЙ АНТИМИКРОБНЫЙ ПЕПТИД Sm-AMP-X | 2013 |
|
RU2531505C1 |
| ГЕНЫ ПШЕНИЦЫ Triticum kiharae, КОДИРУЮЩИЕ АНТИМИКРОБНЫЕ ПЕПТИДЫ | 2011 |
|
RU2483109C1 |
| ГЕНЫ ЗВЕЗДЧАТКИ STELLARIA MEDIA, КОДИРУЮЩИЕ ЗАЩИТНЫЕ ПЕПТИДЫ | 2011 |
|
RU2457251C1 |
| БЕЛКИ, ИНДУЦИРУЮЩИЕ МНОЖЕСТВЕННУЮ УСТОЙЧИВОСТЬ РАСТЕНИЙ К ФИТОПАТОГЕНАМ И ВРЕДИТЕЛЯМ | 2004 |
|
RU2333220C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pЕ-Trx-Lc-def, ШТАММ Escherichia coli ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА ДЕФЕНСИНА ЧЕЧЕВИЦЫ Lens culinaris И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2010 |
|
RU2456345C1 |
| НОВЫЕ ПЕСТИЦИДНЫЕ ПРОТЕИНЫ И ШТАММЫ | 1995 |
|
RU2196824C2 |
| НОВЫЙ ИММУНОГЕННЫЙ ЭКСТРАКТ ГРИБОВ И ПАТТЕРН-РАСПОЗНАЮЩИЙ РЕЦЕПТОР РАСТЕНИЙ | 2013 |
|
RU2700621C2 |
| СЛИТЫЕ БЕЛКИ, РЕКОМБИНАНТНЫЕ БАКТЕРИИ И СПОСОБЫ ПРИМЕНЕНИЯ РЕКОМБИНАНТНЫХ БАКТЕРИЙ | 2015 |
|
RU2771828C2 |
Изобретение относится к области биохимии, в частности к пептиду Sm-AMP3, обладающему антифунгальной активностью. Изобретение позволяет эффективно защищать растения от поражения патогенными грибами. 1 ил., 1 табл., 4 пр.
Пептид Sm-AMP3, обладающий антифунгальной активностью, имеющий аминокислотную последовательность SEQ ID №1.
| ГЕН ЗВЕЗДЧАТКИ Stellaria media, КОДИРУЮЩИЙ АНТИМИКРОБНЫЙ ПЕПТИД Sm-AMP-X | 2013 |
|
RU2531505C1 |
| SHUKUROV R.R | |||
| et al., Increase of resistance of Arabidopsis thaliana plants to phytopathogenic fungi expressing hevein-like peptides from weed plant Stellaria media, Russian Agricultural Sciences, 2010, Volume 36, Issue 4, pp 265-267 | |||
| ПЕПТИД, ОБЛАДАЮЩИЙ АНТИФУНГАЛЬНОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2352580C1 |
| SLAVOKHOTOVA A.A | |||
| ET AL., Novel antifungal a-hairpinin | |||
Авторы
Даты
2016-11-20—Публикация
2015-04-29—Подача