Изобретение относится к области биотехнологии и защиты растений и направлено на разработку средства биологической защиты растений против специфических болезней, вызываемых спектром грибоподобных микроорганизмов оомицетов. Предложены композиция и способ защиты культурных растений от поражения фитопатогенными оомицетами с применением рекомбинантного полипептида, основой функциональной активности которого является взаимодействие с оболочкой клеток-мишеней с последующей интеграцией в клеточную мембрану и ее разрушением (контактный тип действия).
Постоянно растущее население Земли и сокращающийся фонд сельскохозяйственных пахотных земель стимулируют исследования, направленные на повышение эффективности сельского хозяйства. Урожай и качество сельскохозяйственных культур зависят не только от погодных условий, места выращивания и качества семенного материала, но также от степени заражения различными патогенами, которые наносят значительный ущерб растениеводству, снижая урожайность, качество и срок хранения сельскохозяйственной продукции.
Наряду с подходами генетики и селекции, которые позволяют создавать культуры, характеризующиеся различными улучшенными агротехническими признаками, в том числе и устойчивостью к патогенам, актуальной остается разработка экологически чистых средств защиты растений, которые используют подходы, основанные на естественных механизмах иммунитета растений.
Задача настоящего изобретения состояла в разработке технически простого средства защиты культурных растений на основе антимикробного полипептида, обеспечивающего ингибирование развитие фитопатогенных оомицетов на поверхности растения. Действующее вещество по изобретению представляет из себя рекомбинантный гибридный белок, состоящий из двух компонентов - бактериального тиоредоксина и растительного антимикробного пептида из структурного семейства дефензинов. Препарат может применяться для обработки растений путем опрыскивания их наземной биомассы с целью защиты сельскохозяйственных культур от заражения болезнями, вызываемыми оомицетами.
Антимикробные пептиды (АМП) растительного происхождения представляют собой эффективные агенты, обладающие прямым ингибирующим действием по отношению к широкому спектру фитопатогенным микроорганизмов, преимущественно эукариотам (мицелиальным грибам) (Srivastava et al., 2020). Первые публикации по наличию антимикробных свойств у пептидов растений датируются началом 1990х гг. (Terras et al., 1992, 1995). Оомицеты как группа, включающая в себя целый ряд видов, вызывающих экономически значимые (в том числе носящие характер эпифитотий) болезни сельскохозяйственных культур, в плане восприимчивости/устойчивости к природным АМП растений исследованы достаточно фрагментарно. Так, было установлено подавляющее влияние на Phytophthora infestans дефензинов семян ряда дикорастущих и культурных злаковых и двудольных растений: ежовник обыкновенный (Echinochloa crusgalli), звездчатка средняя (Stellariamedia), картофель (Solanum tuberosum), колосняк песчаный {Leymus arenarius) (Odintsova et al., 2008; Slavokhotova et al., 2011; Bartova et al, 2019) в тестах in vitro; установлено фунгицидное и фунгистатическое действие на данный оомицет представителей некоторых других структурных групп (липид-переносящие белки, харпино-подобные пептиды, гевеино-подобные пептиды) (Odintsova et al., 2009; Уткина и др., 2010; Rogozhin et al., 2012, 2015; Ryazantsev et al., 2014, 2019). Кроме того, установлено защитное действие некоторых запасных белков семян одуванчика лекарственного (Taraxacum officinale), клубней картофеля (Solanum tuberosum) (Sharma et al., 2004; Odintsova et al., 2010), а также фрагментов ограниченного протеолиза некоторых хлоропластных белков (Rogozhin et al., 2020). Из уровня техники известны генетические конструкции для экспрессии в Escherichiacoli рекомбинантного дефензина чечевицы (Lens culinaris), обладающего ингибирующим действием на ряд фитопатогенных мицелиальных грибов (RU 2456345).
Также существуют сведения об активности тиоредоксинов растений против группы фитопатогенных грибов. Белок арабидопсиса AtTrx-h5 проявляет активность против Aspergillus flavus (КСТС 6905), Aspergillus fumigatus (KCTC 6145), Fusarium moniliforme (KCTC 6149), F. solani (KCTC 6326), Phytophthora nicotianae (KCTC 40164), Trichoderma harzianum (KCTC 6043), Trichoderma viride (KCTC 6047), Candida albicans (KCTC 7270), Candida catenulate (KCTC 7642), Candida tropicalis (KCTC 7221) (Pari et al., 2017). Белок риса OsTDX показал активность против грибов и дрожжей (Candida albicans, Candida krusei, или Colletotrichum gloeosporioides, Fusarium graminearum, F. oxysporum, F. solani) (Park et al., 2019). Предположительный механизм их действия основан на дестабилизации клеточной мембраны. Также есть данные о том, что тиоредоксин растений является ключевым элементом ответа на окислительный стресс (Vieira Dos Santos et al., 2006). Единственным примером антифунгальной активности по отношению к мицелиальным фитопатогенным грибам является упоминание о действии гибридного рекомбинантного белка, содержащего тиоредоксин и фунгистатическийгевеино-подобный пептид WAMP-3 с хитин-связывающим доменом по отношению к мицелиальным формам Fusarium oxysporum и Bipolar is sorokiniana (Истомина и др., 2017).
В соответствии с заявленным изобретением получена препаративная форма, включающая в себя основное действующее вещество - рекомбинантный гибридный белок, состоящий из двух компонентов - бактериального тиоредоксина, который обеспечивает корректное сворачивание молекулы в пространстве и замыкание дисульфидных связей, и растительного антимикробного пептида из структурного семейства дефензинов, определяющего непосредственно мембрано-активный эффект. Авторы изобретения обнаружили, что данное соединение обладает высокой эффективностью в отношении фитопатогенных оомицетов и может быть использовано для контактной обработки сельскохозяйственных растений с целью их защиты от фитофтороза, вызываемого Phytophthora infestans. В уровне техники отсутствуют публикации о применении рекомбинантных гибридных белков, содержащих тиоредоксин бактериального происхождения и растительный антимикробный пептид группы дефензинов как средства защиты растений от фитопатогенных микроорганизмов, таких как бактерии, грибы, оомицеты. Известные документы относятся к ингибирующему действию отдельно используемых природных и/или рекомбинантных растительных пептидов против фитопатогенных грибов и оомицетов. Ранее был раскрыт ингибирующий эффект одного из двух компонентов заявляемого действующего вещества - природного дефензина№02 семян нигеллы посевной (Nigella sativa L.) по отношению к оомицету Phythophthora infestans (Mont.) deBary в лабораторных условиях (Rogozhin Е.А., Oshchepkova Y.I., Odintsova Т. I., Khadeeva N.V., Veshkurova O.N., Egorov T.A., Grishin E.V., Salikhov S.I.Novel antifungal defensins from Nigella sativa L. seeds. // Plant Physiol Biochem., 2011, V. 49 (2), P. 131-137).
В качестве основного компонента для нового средства защиты растений авторы изобретения предлагают использовать антимикробный пептид дефензин, ассоциированый в составе химерной конструкции с оригинальным белком Е. coli - тиоредоксином, способствующим, в частности, правильному процессу фолдирования пептидной части. SEQ ID NO: 1 описывает аминокислотную последовательность химерного белка trx-NsD2:
MSDKIIHLTDDSFDTDVLKADGAILVDFWAEWCGPCKMIAPILDEIADEYQGKLTVAK LDIDQNPGTAPKYGIRGIPTLLLFKNGEVAATKVGALSKGQLKEFLDANLAGSGSGHMHHHH HHSSGLVPRGSGMKETAAAKFERQHMDSPDLGTMKFCEKPSGTWSGVCQNSGACKDQCIRLE GAKHGSCNYKLPAHRCICYYEC
Полипептид может быть получен с использованием биотехнологических подходов. В частности, возможного получения в прокариотической системе гетерологичной экспрессии в виде препарата гибридного белка, включающего тиоредоксин и растительный антимикробный пептид из семейства дефензинов NsD2. Эффективность синтезированного препарата была подтверждена в опытах in vitro и вегетационных экспериментах на растениях картофеля. Экспериментально продемонстрирован синергический эффект дефензина и бактериального тиредоксина: гибридный белок значительно превосходит по эффективности отдельно взятые препараты дефензина и тиоредоксина, что является новым техническим результатом. Данный препарат является биологическим средством защиты растений и, в отличие от химических средств не опасен для млекопитающих, насекомых и других групп организмов.
Описание чертежей
Фигура 1. Аминокислотная последовательность рекомбинантного гибридного белка trx-NsD2.
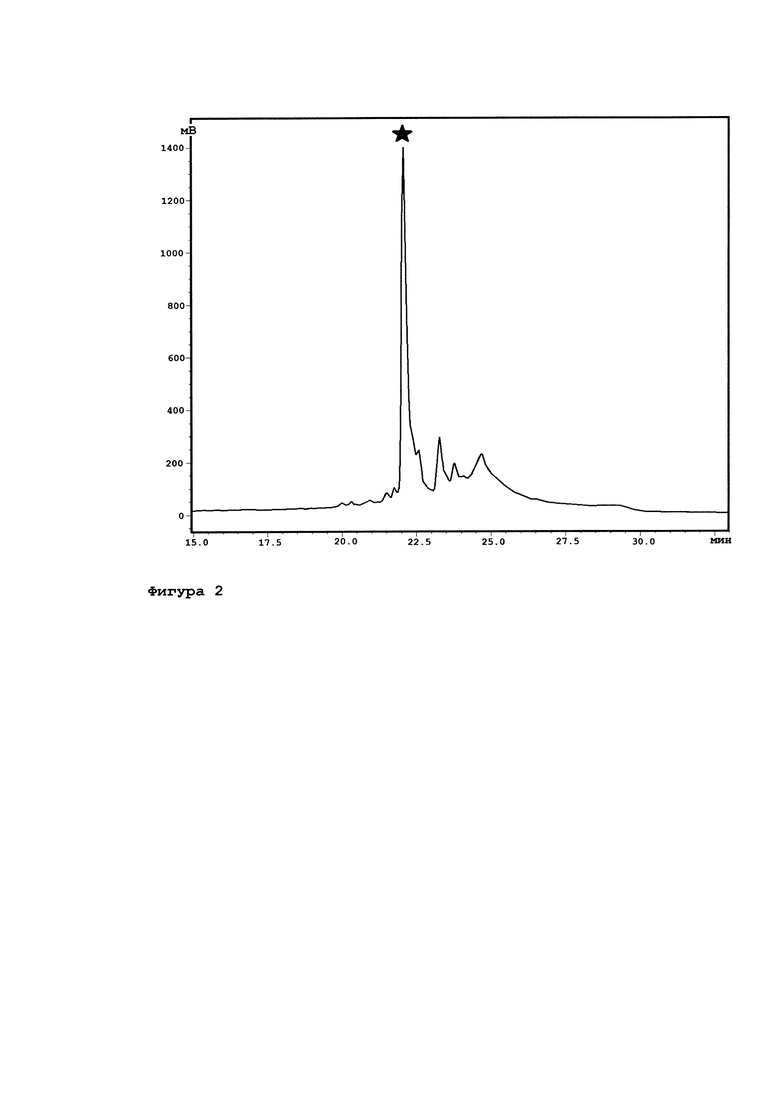
Фигура 2. Профиль очистки рекомбинантного гибридного белка trx-NsD2 из препаративной формы. Целевой пик отмечен черной звездочкой.
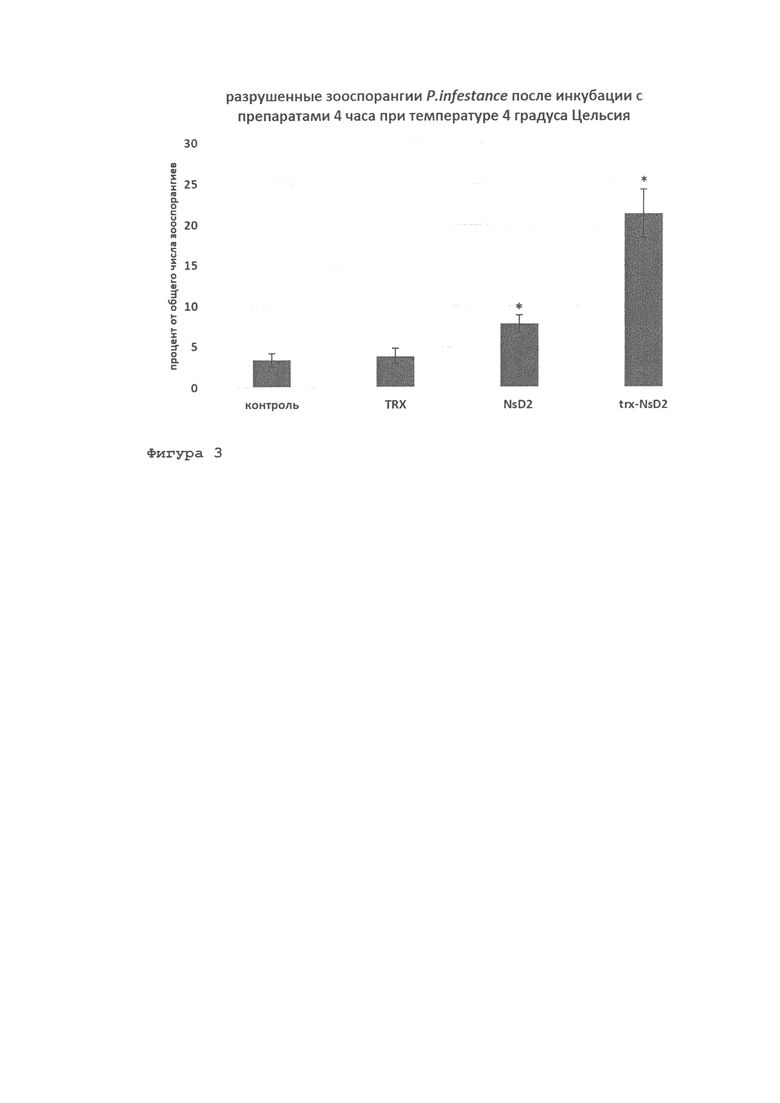
Фигура 3. Антимикробная активность рекомбинантного гибридного белка trx-NsD2 по отношению к оомицету Phytophthorainfestansnocne инкубации суспензии зооспорангиев с препаратами в течение 4 часов при температуре 4°С (влияние на клеточные структуры): TRX-тиоредоксин; NsD2 - рекомбинантный дефензин семян черного тмина (Nigella sativa); trx-NsD2 рекомбинантный гибридный белок. Концентрация по вариантам - 10 мкМ. Данные представлены в виде средних значений 2 биологических повторностей (±SE). Значимые отличия между контролем и вариантами обозначены * (р<0,05) (ANOVA withTukey's HSD post-hoctest).
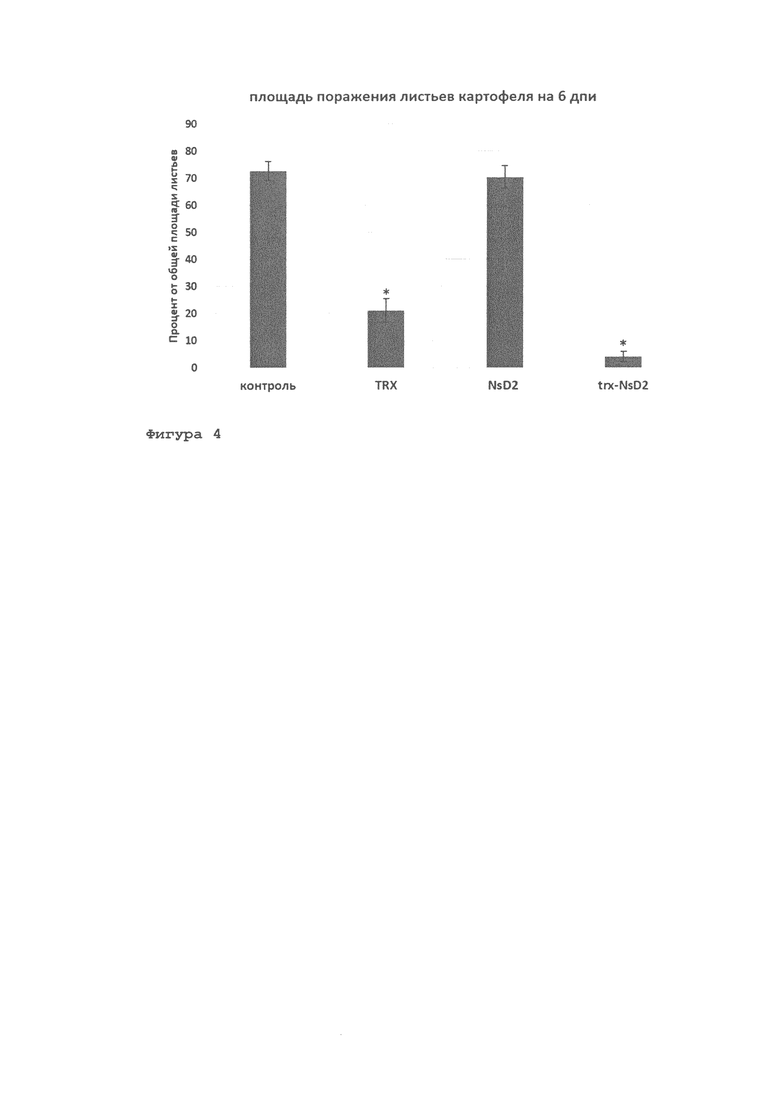
Фигура 4. Антимикробная активность рекомбинантного гибридного белка trx-NsD2 по отношению к оомицету Phytophthora infestans на 6 день после инфицирования (дпи) суспензией фитофторы, предварительно инкубированной 4 часа при 4°С совместно с препаратами (оценка площади поражения отделенных листьев картофеля): TRX-тиоредоксин; NsD2 - рекомбинантный дефензин семян черного тмина (N. sativa); trx-NsD2 рекомбинантный гибридный белок. Концентрация по вариантам - 10 мкМ. Данные представлены в виде средних значений 2 биологических повторностей (±SE). Значимые отличия между контролем и вариантами обозначены * (р<0,05) (ANOVA withTukey's HSD post-hoctest).
Осуществление изобретения
В заявленном изобретении предложен гибридный белок trx-NsD2 и содержащая его препаративная форма для поверхностной обработки сельскохозяйственных растений с целью защиты от болезней, вызываемых фитопатогенными оомицетами. Препаративная форма включает: рекомбинантный гибридный белок, в составе которого последовательно расположены аминокислотные последовательности, кодирующие бактериальный тиоредоксин и антимикробный пептид (дефензин); расчетная чистота действующего вещества должна составлять не менее 95% (по ВЭЖХ); расчетная чистота препаративной формы должна составлять не менее 75% (по ВЭЖХ). Опыты показали, что фунгицидной активностью обладает также неочищенный белок, содержащийся в бактериальном лизате (см. пример 3). Для эффективного действия предложенного препарата достаточно привести его в контакт с поверхностью листа растения посредством опрыскивания с помощью автоматического или ручного опрыскивания, что обеспечивает прямой контакт препарата с надземной поверхностью растений. Удерживание препарата на надземной поверхности растений обеспечивает ингибирование развития оомицетов на растении в течение не менее 10 дней после обработки препаратом. Приведенные примеры иллюстрируют возможные варианты получения препарата, а также демонстрируют сравнительную эффективность препаратов дефензина, тиоредоксина и гибридного белка по изобретению.
Пример 1. Получение штамма-продуцента рекомбинантного гибридного белка контактного действия trx-NsD2.
Нуклеотидная последовательность, кодирующая целевой белок, была получена из аминокислотной методом обратной трансляции с использованием таблицы частоты использования кодонов для Е. coli, на 5'-конец полученных последовательностей сайт узнавания эндонуклеазы рестрикции KpnI и кодон ATG, кодирующий метионин, на 3'-конце - стоп-кодон и сайт узнавания эндонуклеазы рестрикции Hindlll. Фрагмент, кодирующий целевой полипептид был собран из олигонуклеотидов (Евроген, Россия) с помощью высокоточной полимеразы PhusionHotStart II DNA Polymerase (ThermoFisher Scientific, США) и клонирован в вектор pJET12blunt (Invitrogen, США). После отбора клонов методом ПЦР и подтверждения идентичности последовательности нуклеотидов запланированной методом дидезоксисеквенирования (Евроген, Россия), фрагмент, кодирующий целевой АМП дефензинбыл переклонирован в вектор pET32b и в итоге была проведена трансформация клеток Е. coli штамма Origami. Дефензин был ассоциирован в составе химерной конструкции с оригинальным белком Е. coli - тиоредоксином, способствующим, в частности, правильному процессу фолдирования пептидной части.
Пример 2. Получение очищенного рекомбинантного гибридного белка контактного действия trx-NsD2.
Полученным штаммом Е. coli, несущим плазмиду, кодирующую гибридный белок trx-NsD2, была инокулирована среда LB. Полученной ночной культурой бактерий (50 мл) была инокулирована свежая среда LB (1 л), культура была подращена до OD600=0.6, после чего добавляли индуктор экспрессии (ИПТГ, до концентрации 1 мМ). После выращивания еще на протяжении 5 ч, клетки были собраны центрифугированием и лизированы буфером для лизиса в нативных условиях (50 mM дигидрофосфат натрия, 300 mM хлорид натрия, 10 m Мимдазол, рН 8.0). Для выделения гибридного белка осветленный лизат наносили на Ni-NTA агарозу, после промывки лизирующим и промывочным буферами (50 mM дигидрофосфат натрия, 300 mM хлорид натрия, 20 mM имидазол, рН 8.0), гибридный белок был элюирован элюирующим буфером (50 mМ дигидрофосфат натрия, 300 mM хлорид натрия, 250 mM имидазол, рН 8.0). В результате путем ферментации в колбах было наработано примерно по 7,5 г сырой массы бактериальных клеток и TRX-NS-D2. В дальнейшем все количество имеющихся клеток было лизировано посредством ультразвукового дезинтегратора, целевой белок очищен методом металл-аффинной хроматографии на Ni-NTA посредством взаимодействия поли-His-tag и обессолен путем обращенно-фазовой ВЭЖХ на полупрепаративной колонке Jupiter С5 10 × 250 мм 300 Анг (Phenomenex, США). Для структурного подтверждения данные фракции были визуализированы с помощью ДСН ПААГ ЭФ, а изначальные (до разделения) образцы проанализированы путем автоматической деградации по Эдману на приборе PPSQ-33A (Shimadzu Corp., Япония). В итоге было сделано заключение, что данные фракции представляют собой пространственные изомеры, что не повлияет на процесс дальнейшей работы с ними.
Пример 3. Получение препарата рекомбинантного гибридного белка контактного действия trx-NsD2.
Полученным штаммом Е. coli, несущим плазмиду, кодирующую гибридый белок (дефензин с тиоредоксином) была инокулирована среда LB. Полученной ночной культурой бактерий (50 мл) была инокулирована свежая среда LB (1 л), культура была подращена до OD600=0.6, после чего добавляли индуктор экспрессии (ИПТГ, до концентрации 1 мМ). Клетки выращивали на протяжении 5 ч. Клеточную массу дезентегрировали и ресуспендировали в буфере 200 мМ фосфат натрия рН 9 с добавлением 1 мМ ЭДТА (из расчета 25 мл буфера на 1 г биомассы). Затем суспензию инкубировали 1 ч при 60 градусов и отделяли клеточный дебрис от фильтрата. Фильтрат напрямую использовали для обработки растений.
Пример 4. Антимикробная активность рекомбинантного
гибридного белка trx-NsD2 по отношению к оомицету Pbytopbtborainfestans (влияние на клеточные структуры).
Тестирование антимикробной активности белка trx-NsD2 проводилось в условиях in vitro на высоко агрессивном штамме 161.1 из коллекции РГАУ-МСХА им. К.А. Тимирязева оомицета Phytophthora infestans, который обладает наиболее широким набором генов вирулентности среди изолятов, выделенных в Нечерноземной зоне РФ, и сохраняет свои свойства на протяжении ряда лет. Культуру фитофторы выращивали на агаризованной питательной среде (овсяный агар). Для подготовки инокулюма фитофторы использовали 2-недельную культуру фитофторы с хорошо развитым мицелием. Суспензию готовили путем смыва зооспорангиев с мицелия стерильной водой, с последующим пипетированием для отделения зооспорангиев от мицелия, подсчетом в микроскопе концентрации зрелых зооспорангиев и разведением суспензии до концентрации 2,5 - 5,0×104 зооспорангиев/мл. Тестирование проводили в 24-луночных культуральных стерильных плашках, где в каждую лунку вносили суспензию зооспорангиев фитофторы и растворы следующих препаратов: 1) TRX-тиоредоксин; 2) NsD2 -рекомбинантный дефензин семян черного тмина (Nigella sativa); 3) trx-NsD2 - рекомбинантный гибридный белок. Конечная концентрация вещества в растворе составляла не более 10 мкМ. На каждый вариант - по 6 лунок (6 повторностей). После тщательного перемешивания суспензии фитофторы с препаратами плашку помещали на инкубацию на 4 часа при температуре 4°С. После инкубации из каждой лунки отбирали аликвоту (по 30-4 0 мкл) для оптического микроскопирования в проходящем свете (увеличение 10х и 40х, ZEISS, Германия) и проводили оценку морфологических изменений развития зооспорангиев. В каждой повторности оценивали не менее 10-15 полей зрения микроскопа. Количество подсчитываемых зооспорангиев в каждом варианте - 500-600 шт. Эффект ингибирования культуры фитофторы препаратами контактного действия в условиях in vitro оценивали по количеству разрушенных зооспорангиев, в которых наблюдалось вытекание протопласта наружу из-за разрывов в оболочке клетки или сжатие протопласта внутри зооспорангия. Количество разрушенных зооспорангиев выражали в процентах от общего количества оцененных зооспорангиев. Эксперимент был проведен дважды. В результате было показано, что более 20% зооспорангиев фитофторы оказались разрушенными под действием рекомбинантного гибридного белка trx-NsD2, что в 6 раз больше, чем в контроле, а также в 5 раз и в 2 раза больше, чем в вариантах с TRX и NsD2 соответственно.
Пример 5. Антимикробная активность рекомбинантного гибридного белка trx-NsD2 по отношению к оомицету Phytophthora infestans (оценка площади поражения листьев картофеля).
Тестирование антимикробной активности белка trx-NsD2 проводилось в условиях in vivo на листьях восприимчивого к фитофторозу сортообразца картофеля 12-12-8 (селекция ООО «Дока-Генные Технологии»). Растения сортообразца 12-12-8, предварительно прошедшие процедуру оздоровления от вирусных, бактериальных, грибковых заболеваний, поддерживались в культуре in vitro. Для проведения опытов пробирочные растения сортообразца 12-12-8 высаживали в почву и выращивали в контролируемых условиях до стадии 6-7 настоящих листьев. Для проведения тестирования хорошо развитые листья среднего яруса срезали с растения, помещали во влажный бокс и охлаждали при +11°С в течение 1 часа перед заражением. Для заражения листьев готовили смесь суспензии фитофторы (концентрации 2,5-5,0×104 зооспорангиев/мл) и препаратов (конечная концентрация - 10 мкМ): 1) TRX-тиоредоксин; 2) NsD2 рекомбинантный дефензин семян черного тмина (Nigella sativa); 3) trx-NsD2 - рекомбинантный гибридный белок. Смесь суспензии зооспорангиев и препаратов инкубировали в течение 4 часов при температуре 4°С, после чего ею инокулировали отделенные, предварительно охлажденные листья картофеля. Для этого на обратную сторону каждого листа с помощью атомайзера (пульверизатор объемом 5 мл) наносили по 50 мкл смеси зооспорангиев и препаратов. После инокуляции листья помещалив термостат во влажном боксе на 1 сутки при температуре +11°С, после чего их переносили в условия комнатной температуры до появления симптомов заболевания. Эффект ингибирования культуры фитофторы препаратами контактного действия в условиях in vivo оценивали по площади некротических пятен, которую выражали в процентах от общей площади поверхности листа. Учет развития болезни проводили на 6 день после инокуляции (дпи). На каждый вариант - по 18-20 листьев. Эксперимент был проведен дважды. В результате было показано значительное ингибирование развития фитофтороза на отделенных листьях картофеля, которые были заражены суспензией зооспорангиев фитофторы, предварительно инкубированной с рекомбинантным гибридным белком с trx-NsD2 4 часа при 4°С.
Список литературы:
1. Srivastava S, Dashora K, Ameta KL, Singh NP, El-Enshasy HA, Pagano MC, Hesham AE, Sharma GD, Sharma M, Bhargava A. Cysteine-rich antimicrobial peptides from plants: The future of antimicrobial therapy. Phytother Res. 2020.
2. Terras FR, Goderis I J, Van Leuven F, Vanderleyden J, Cammue BP, Broekaert WF. In Vitro Antifungal Activity of a Radish (Raphanus sativus L.)Seed Protein Homologous to Nonspecific Lipid Transfer Proteins. Plant Physiol. 1992. 100(2): 1055-8.
3. Terras FR, Eggermont K, Kovaleva V, Raikhel NV, Osborn RW, Kester A, Rees SB, Torrekens S, Van Leuven F, Vanderleyden J, et al. Small cysteine-rich antifungal proteins from radish: their role in host defense. Plant Cell. 1995, 7(5):573-88.
4. Bartova V, Barta J, Jarosova M. Antifungal and antimicrobial proteins and peptides of potato (Solanum tuberosum L.) tubers and their applications. Appl Microbiol Biotechnol. 2019 Jul; 103(14): 5533-5547.
5. Sharma N, Gruszewski HA, Park SW, Holm DG, Vivanco JM. Purification of an isoform of patatin with antimicrobial activity against Phytophthora infestans. Plant Physiol Biochem. 2004 Jul-Aug; 42(7-8): 647-55.
6. Odintsova T.I., Rogozhin E.A., Baranov Yu.V., MusolyamovA.Kh., Yalpani N., Egorov Ts.A., Grishin E.V. Seed defensins of barnyard grass Echinochloa crusgalli (L.) Beauv. // Biochimie, 2008, V. 90, P. 1667-1673.
7. Odintsova T.I., Vassilevski A.A., Slavokhotova A. A., MusolyamovA.Kh., Finkina E.I., Khadeeva N.V., Rogozhin E.A., Korostyleva T.V., Pukhalsky V.A., EgorovTs.A., Grishin E.V. A novel antifungal hevein-type peptide from Triticum kiharae seeds with a unique 10-cysteine motif // FEBS J. 2009, V. 276 (15), P. 4266-4275.
8. Odintsova T.I., Rogozhin E.A., Sklyar I.V., Musolyamov A.K., Kudryavtsev A.M., Pukhalsky V.A., Smirnov A.N., Grishin E.V. and Egorov T.A. Antifungal activity of storage 2S albumins from seeds of the invasive weed dandelion Taraxacum officinale Wigg. Protein & Peptide Letters.2010, V. 17, P. 522-529.
9. Уткина Л.Л., Жабон Е.О., Славохотова А.А., Рогожин Е.А., ШиянА.А., Гришин Е.В., Егоров Ц.А., Одинцова Т.И., Пухальский В.А. Гетерологическая экспрессия синтетического гена нового гевеиноподобного пептида Leymus arenarius в клетках Escherichia coli. Генетика, 2010, Т. 46, №12, С. 1-7.
10. Slavokhotova А.А., Odintsova T.I., Rogozhin Е.А., Musolyamov А.К., Andreev Y.A., Grishin E.V., Egorov T.A. Isolation, molecular cloning and antimicrobial activity of novel defensins from common chickweed (Stellaria media L.) seeds. // Biochimie, 2011, V. 93 (3), P. 450-456.
11. Rogozhin E.A., Ryazantsev D.Y., Grishin E.V., Egorov T.A., Zavriev S.K. Defense peptides from barnyard grass (Echinochloa crusgalli L.) seeds // Peptides, 2012, V. 38 (1), P. 33-40.
12. D.Yu. Ryazantsev, E.A. Rogozhin, T.V. Dimitrieva, P.E. Drobyazina, N.V. Khadeeva, T.A. Egorov, E.V. Grishin, S.K. Zavriev. A novel hairpin-like antimicrobial peptide from barnyard grass (Echinochloa crusgalli L.) seeds: Structure-functional and molecular-genetics characterization // Biochimie, 2014, V. 99, P. 63-70.
13. Rogozhin E.A., Slezina M.P.,Slavokhotova A.A., Istomina E.A., Korostyleva T.V., Smirnov A.N., Grishin E.V., Egorov T.A., Odintsova T.I. A novel antifungal peptide from leaves of the weed Stellaria media L. // Biochimie, 2015, V. 116, P. 125-32.
14. Рязанцев Д.Ю., Рогожин E.A., Цветков В.О., Яруллина Л.Г., Смирнов А.Н., Завриев С.К. Разнообразие харпино-подобных защитных пептидов семян ежовника (Echinochloa crusgalliL.) // Доклады Академии Наук, 2019, Т. 484, №1, С. 104-106.
15. Rogozhin E.A., Vasilchenko A.S., Barashkova A.S., Smirnov A.N., Zavriev S.K. and Demushkin V.P. Peptide Extract from Seven Medicinal Plants Discovered to Inhibit Oomycete Phytophthora infestans, a Causative Agent of Potato Late Blight Disease // Plants (Basel), 2020, V. 9(10), E. 1294.
16. Истомина E.A., Славохотова A.A., Коросытлева Т.В., Семина Ю.В., Щербакова Л.А., Пухальский В.А., Одинцова Т.И. Гены гевеиноподобных антимикробных пептидов семейства WAMP видов рода Aegilops // Генетика, 2017, Т. 53, №12, С. 1402-1410.
17. Vieira Dos Santos С, Rey P. Plant thioredoxins are key actors in the oxidative stress response. Trends Plant Sci. 2006 Jul; 11(7): 329-34. doi: 10.1016/j.tplants.2006.05.005. Epub 2006 Jun 16. PMID: 16782394.
18. Park SC, Kim IR, Kim JY, et al. Functional Characterization of a Rice Thioredoxin Protein OsTrxm and Its Cysteine Mutant Variant with Antifungal Activity. Antioxidants (Basel). 2019;8(12):598. Published 2019 Nov 29. doi:10.3390/antiox8120598
19. Park, SC., Jung, Y.J., Kim, I.R. et al. Functional characterization of thioredoxin h type 5 with antimicrobial activity from Arabidopsis thaliana. Biotechnol Bioproc E 22, 129-135 (2017). https://doi.org/10.1007/sl2257-017-0074-7
SEQ ID NO: 1. Аминокислотная последовательность химерного белка trx-NsD2.
MSDKIIHLTDDSFDTDVLKADGAILVDFWAEWCGPCKMIAPILDEIADEYQGKLTVAKLDIDQN PGTAPKYGIRGIPTLLLFKNGEVAATKVGALSKGQLKEFLDANLAGSGSGHMHHHHHHSSGLVP RGSGMKETAAAKFERQHMDSPDLGTMKFCEKPSGTWSGVCQNSGACKDQCIRLEGAKHGSCNYK LPAHRCICYYEC
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pЕ-Trx-Lc-def, ШТАММ Escherichia coli ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА ДЕФЕНСИНА ЧЕЧЕВИЦЫ Lens culinaris И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2010 |
|
RU2456345C1 |
| Композиция на основе интерферирующей дцРНК для защиты растений от фитофтороза | 2020 |
|
RU2808216C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pE-Lc-LTP, ШТАММ БАКТЕРИИ Escherichia coli ДЛЯ ЭКСПРЕССИИ ЛИПИД-ТРАНСПОРТИРУЮЩИХ БЕЛКОВ ЧЕЧЕВИЦЫ Lens culinaris И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННЫХ БЕЛКОВ | 2009 |
|
RU2415940C1 |
| ПЛАЗМИДНЫЙ ВЕКТОР pE-Trx-Aur, ШТАММ ESCHERICHIA COLI ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АУРЕЛИНА И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2009 |
|
RU2412999C1 |
| ГЕН RS-AP ИЗ RAPHANUS SATIVUS, ВЕКТОР ДЛЯ ТРАНСФОРМАЦИИ РАСТЕНИЙ И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОГО РАСТЕНИЯ | 2000 |
|
RU2176669C1 |
| Способ получения антимикробного пептида цекропина Р1 из экстракта трансгенных растений каланхоэ перистого | 2016 |
|
RU2632116C1 |
| Средство защиты растений от инфекционных болезней сельскохозяйственных культур | 2021 |
|
RU2767330C1 |
| СЛИТЫЙ БЕЛОК ТИОРЕДОКСИНА И ДОМЕНА 4 ИНФЕСТИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ЭКСПРЕССИОННАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ СЛИТЫЙ БЕЛОК, И БАКТЕРИЯ РОДА Escherichia coli, ТРАНСФОРМИРОВАННАЯ ТАКОЙ ПЛАЗМИДНОЙ ДНК | 2012 |
|
RU2528251C2 |
| Способ получения пептида, модулирующего активность пуринергических рецепторов | 2019 |
|
RU2714114C1 |
| N-ТЕРПЕНИЛЗАМЕЩЁННЫЕ БЕНЗИМИДАЗОЛЫ В КАЧЕСТВЕ ФУНГИЦИДОВ | 2019 |
|
RU2731472C1 |

Изобретение относится к биотехнологии. Представлены рекомбинантный гибридный белок, обладающий фунгицидной активностью и его применение для защиты культурных растений от Phytophthora infestans, При этом белок состоит из двух компонентов - бактериального тиоредоксина и растительного дефензина и имеет определенную аминокислотную последовательность. Изобретение позволяет получить средство биологической защиты растений против специфических болезней, вызываемых оомицетами. 2 н.п. ф-лы, 4 ил., 5 пр.
1. Рекомбинантный гибридный белок, обладающий фунгицидной активностью для защиты культурных растений от Phytophthora infestans, состоящий из двух компонентов - бактериального тиоредоксина и растительного дефензина и имеющий аминокислотную последовательность SEQ ID: 1
2. Применение белка по п. 1 для защиты культурных растений от поражения Phytophthora infestans.
| ROGOZHIN Е.А., OSHCHEPKOVA Y.I., ODINTSOVA Т | |||
| I., et.al., Novel antifungal defensins from Nigella sativa L | |||
| seeds | |||
| // Plant Physiol Biochem., 2011, V | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Способ получения продукта конденсации бетанафтола с формальдегидом | 1923 |
|
SU131A1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pЕ-Trx-Lc-def, ШТАММ Escherichia coli ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА ДЕФЕНСИНА ЧЕЧЕВИЦЫ Lens culinaris И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2010 |
|
RU2456345C1 |
| HUANG L et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Protein Expression and | |||
Авторы
Даты
2022-12-23—Публикация
2021-06-11—Подача