Область техники, к которой относится изобретение
Настоящее изобретение относится к комбинированной лекарственной форме для перорального введения, включающей лекарственную форму с замедленным высвобождением ингибитора 3-гидрокси-3-метилглутарил-кофермента A (HMG-CoA) редуктазы и пленочный слой с быстрым высвобождением гипотензивного средства, и способу ее получения.
Уровень техники
Гиперхолестеринемия, типичный пример гиперлипидемии, вызывается повышенными уровнями в сыворотке крови LDL (липопротеин низкой плотности)-холестерина и общего холестерина, и лечение гиперхолестеринемии путем снижения уровня липида, в частности LDL-холестерина, в сыворотке делает возможным снижение риска сердечно-сосудистых заболеваний, что приводит к замедлению развития атеросклероза (American diabetes association, Diabetic care, 23 (suppl), S57-S65, 2000). Поэтому проведено много исследований по терапии снижения содержания липида для замедления развития атеросклероза или облегчения атеросклеротического состояния и снижения риска сердечно-сосудистых заболеваний, например ишемической болезни сердца, у пациентов с диагнозом гиперлипидемии или гиперхолестеринемии.
Известно, что ингибитор 3-гидрокси-3-метилглутарил кофермента A (HMG-CoA) редуктазы, применяемый при гиперлипидемии, такой как гиперхолестеринемия, для ингибирования превращения HMG-CoA в мевалонат на ранней стадии биосинтетического пути метаболизма холестерина приводит к понижению уровней общего холестерина и LDL-холестерина или повышению уровня показателя липопротеин высокой плотности (HDL)- холестерин (S. M. Grundy, N. Engl. J. Med., 319(1), 24-32, 1988). Однако такой ингибитор HMG-CoA редуктазы вызывает побочные эффекты, такие как печеночная токсичность, миопатия и острый некроз скелетных мышц (Garnett W. R., Am. J. Cardiol, 78, 20-25, 1996; Dujovne C. A. et. al., Am. J. Med, 91, 25S-30S, 1991; and Mantell G. et. al., Am. J. Cardiol, 66, 11B-15B, 1990).
Поэтому было сделано много попыток разработать лекарственную форму ингибитора HMG-CoA с замедленным высвобождением, для того чтобы предотвратить или ослабить побочные эффекты, вызываемые быстрым высвобождением ингибитора HMG-CoA редуктазы.
Во многих исследованиях приходили к выводу о том, что лекарственная форма ингибитора HMG-CoA редуктазы с замедленным высвобождением характеризуется более низкой биологической доступностью ингибитора HMG-CoA редуктазы для большого круга кровообращения по сравнению с лекарственной формой с быстрым высвобождением, так как большая часть ингибитора HMG-CoA редуктазы, абсорбируемого в теле, подвергается метаболизму в печени (85% и более), в то время как только 5% или менее переносится в систему большого круга кровообращения. Однако было показано, что эффективность доставки лекарственного средства в лекарственной форме с замедленным высвобождением в требуемое место превосходит эффективность лекарственной формы с быстрым высвобождением (John R, Amer. J. Cardio. 89: 15, 2002). Соответственно, было сообщено, что лекарственная форма ингибитора HMG-CoA редуктазы с замедленным высвобождением является более эффективной для снижения уровня LDL-холестерина в крови, чем лекарственная форма с быстрым высвобождением (Monique P, Am. J. Drug Deliv. 1(4): 287-290, 2003).
Во многих случаях гипертензия сопровождается гиперлипидемией, что может приводить к сердечным заболеваниям, таким как стенокардия, и поэтому, независимо от того страдает или не страдает пациент от коронарных болезней, вместе с введением ингибитора синтеза холестерина очень важно контролировать гипертензию, для того чтобы уменьшить риск или летальный исход, вызываемый сердечно-сосудистыми заболеваниями. Например, Kramsch et. al. раскрыли, что блокатор кальциевых каналов, такой как гипотензивное средство амлодипин, может быть введен вместе с понижающим уровень липида средством для усиления терапевтических эффектов при лечении атеросклероза (Kramsch et. al., Journal of Human Hypertension, Suppl. 1, 53-59, 1995), а Lichtlen P. R. et. al. сообщили, что атеросклеротическое заболевание у человека можно эффективно лечить введением средства, блокирующего кальциевые каналы (Lichtlen P. R. et. al., Lancet, 335, 1109- 1139, 1990; and Waters D. et. al., Circulation, 82, 1940-1953, 1990).
Кроме того, в Патенте США 4681893 раскрывается, что для лечения атеросклероза могут применяться некоторые статины, включая аторвастатин, и было сообщено, что при введении статина (правастатина или ловастатина) вместе с блокатором кальциевых каналов (амплодипином) терапия атеросклеротические заболевания может быть более эффективной за счет синергетического действия этих двух лекарств (Jukema et. al., Circulation, Suppl. 1, 1-197, 1995; and Orekhov et. al., Cardiovescular Drug and Theraphy, 11, 350, 1997). Однако выпускаемая в промышленном масштабе лекарственная форма комбинации атровастатин-амлодипин с фирменным наименованием Caduet® (фирмы Pfizer) имеет недостаток, заключающийся в том, что оба лекарственных средства быстро высвобождаются, вызывая печеночную токсичность, и их терапевтическое действие не может поддерживаться в течение продолжительного периода времени.
Поэтому авторы настоящего изобретения стремились разработать лекарственную форму для перорального введения комбинации ингибитора HMG-CoA редуктазы и гипотензивного средства, которая не имела бы вышеуказанных недостатков, и было найдено, что комбинированная лекарственная форма для перорального введения, включающая лекарственную форму ингибитора HMG-CoA редуктазы с замедленным высвобождением, покрытая пленочным слоем с быстрым высвобождением гипотензивного средства, проявляет неожиданное синергетическое действие двух лекарственных средств с минимальными побочными эффектами.
Раскрытие изобретения
Соответственно, задачей настоящего изобретения является разработка комбинированной лекарственной формы ингибитора HMG-CoA редуктазы и антигипертензивного средства, которая обладает синергическим действием двух лекарственных средств с минимальными побочными эффектами. Другой задачей настоящего изобретения является разработка способа получения указанной лекарственной формы.
В соответствии с одним аспектом настоящего изобретения предлагается комбинированная лекарственная форма, включающая лекарственную форму ингибитора HMG-CoA редуктазы с замедленным высвобождением и пленочный слой с быстрым высвобождением, содержащий гипотензивное средство, причем пленочный слой с быстрым высвобождением наносят на лекарственную форму с замедленным высвобождением.
В соответствии с другим аспектом настоящего изобретения предлагается способ получения комбинированной лекарственной формы, который включает стадии:
1) сушки смеси ингибитора HMG-CoA редуктазы, солюбилизирующего носителя и стабилизатора с получением твердой дисперсии;
2) сухого смешения твердой дисперсии, полученной на стадии 1, с носителем для замедленного высвобождения и ускорителем гидратации геля, и формования полученной сухим способом смеси с получением лекарственной формы с замедленным высвобождением; и
3) нанесения на лекарственную форму с замедленным высвобождением, полученную на стадии 2, пленочного слоя с быстрым высвобождением, включающего гипотензивное средство, с получением комбинированной лекарственной формы.
Краткое описание чертежей
Приведенные выше и другие задачи и признаки настоящего изобретения станут очевидными из следующего описания изобретения в сочетании с сопровождающими чертежами, которые соответственно показывают:
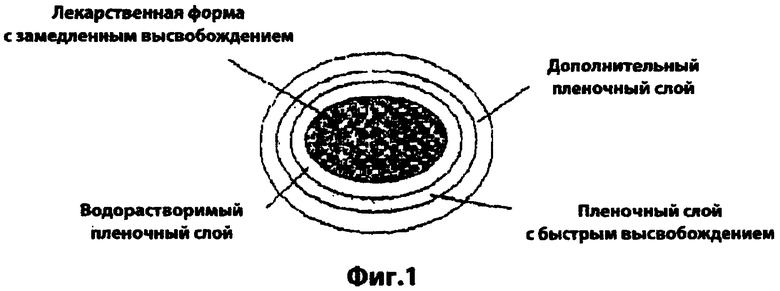
Фиг.1 - вид в разрезе характерного примера комбинированной лекарственной формы по изобретению;
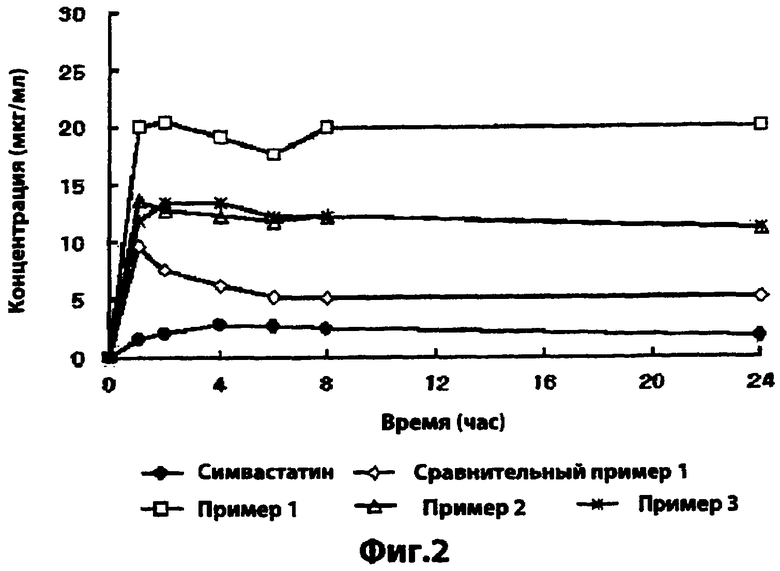
Фиг.2 - растворимости твердых дисперсий, полученных в примерах 1-3 и сравнительном примере 1;
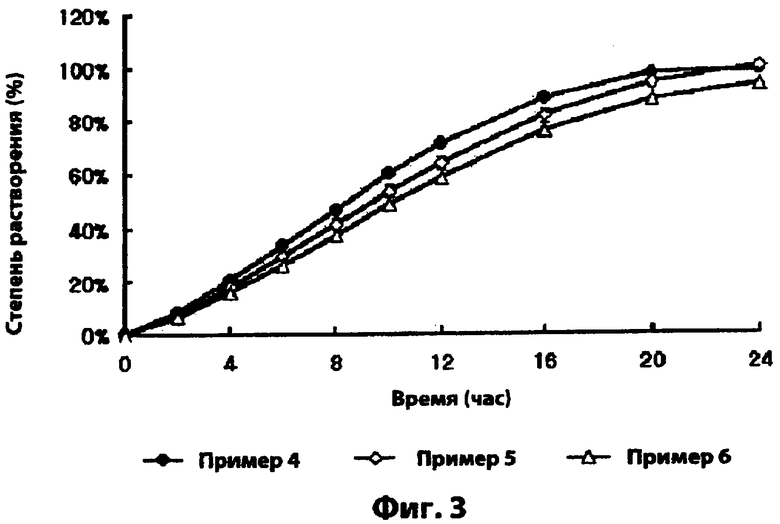
Фиг.3 - скорости растворения лекарственных средств лекарственных форм с замедленным высвобождением, полученных в примерах 4-6;
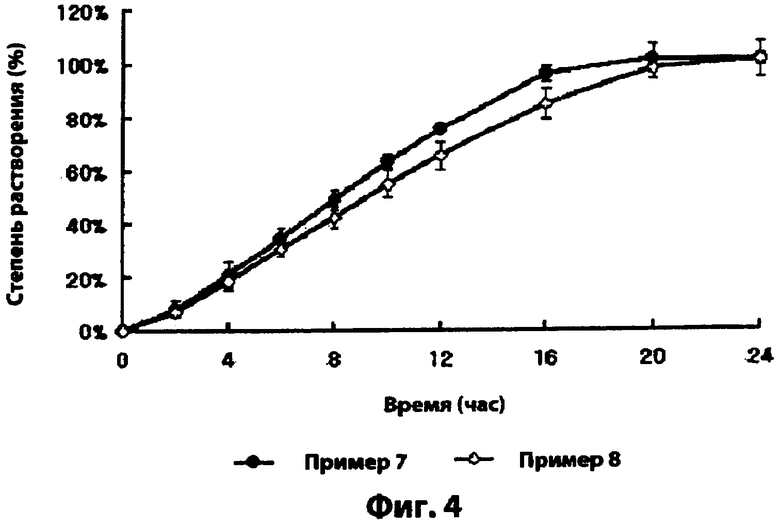
Фиг.4 - скорости растворения лекарственных средств лекарственных форм с замедленным высвобождением, полученных в примерах 7 и 8;
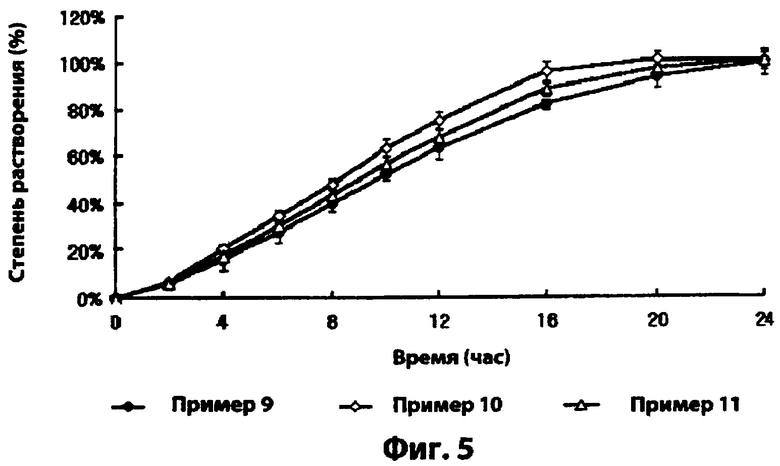
Фиг.5 - скорости растворения симвастатина комбинированных лекарственных форм, полученных в примерах 9-11;
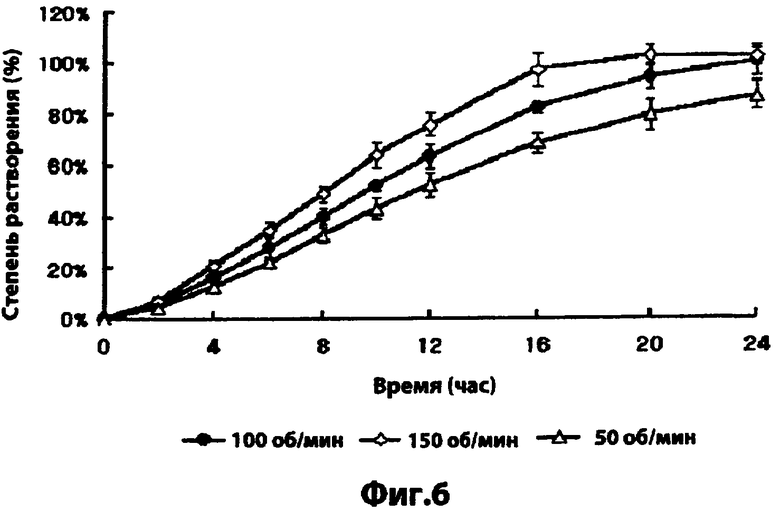
Фиг.6 - скорость растворения симвастатина комбинированной лекарственной формы, полученной в примере 9, при скорости вращения 50, 100 или 150 об/мин; и
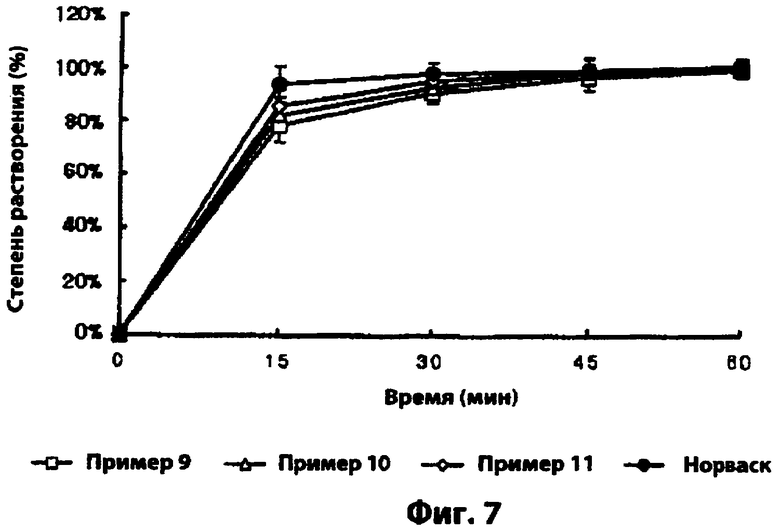
Фиг.7 - скорости растворения амлодипина комбинированных лекарственных форм, полученных в примерах 9-11, и Norvasc® (фирмы Pfizer).
Подробное описание изобретения
Далее подробно описываются следующие компоненты комбинированной лекарственной формы по настоящему изобретению.
1. Лекарственная форма с замедленным высвобождением
Лекарственная форма с замедленным высвобождением, которая является ядром комбинированной лекарственной формы по изобретению, включает твердую дисперсию, содержащую ингибитор HMG-CoA редуктазы в качестве активного ингредиента, солюбилизирующий носитель и стабилизатор; носитель для замедленного высвобождения и ускоритель гидратации геля.
1) Фармакологически активный ингредиент
Ингибитор HMG-CoA редуктазы может быть одним из известных ингибиторов HMG-CoA редуктазы, используемых для лечения гиперлипидемии и атеросклероза путем снижения уровня липопротеина или липида в крови. Его характерные примеры включают мевастатин (Патент США 3983140), ловастатин (Патент США 4231938), правастатин (Патенты США 4346227 и 4410629), лактон правастатина (Патент США 4448979), велостатин, симвастатин (Патенты США 4448784 и 4450171), ривастатин, флувастатин, аторвастатин, церивастатин и другие подобные статины. Ингибитор HMG-CoA редуктазы может быть использован в количестве от 1 до 50% по массе, предпочтительно - от 2 до 30% по массе от суммарной массы комбинированной лекарственной формы. Когда его количество составляет меньше, чем 1% по массе, будет отсутствовать его терапевтическое действие, а когда более чем 50% по массе, оно будет превышать допустимую суточную дозу.
2) Солюбилизирующий носитель
Так как большинство ингибиторов HMG-CoA редуктазы являются плохо растворимыми в воде соединениями, в настоящем изобретении используют солюбилизирующий носитель для повышения растворимости лекарственного средства. Характерные примеры солюбилизирующего носителя включают витамин E TPGS (d-α-токоферил полиэтиленгликоль 1000 сукцинат фирмы Eastman), эфир полиоксиэтиленстеариновой кислоты (например, Myrj фирмы ICI), полиэтиленгликоль, гидроксипропилметилцеллюлозу (HPMC, вязкость от 3 до 15 сп), блок-сополимер полиоксипропилен-полиоксипропилен и другие солюбилизирующие носители. Солюбилизирующий носитель может быть использован в количестве от 0,05 до 20 частей по массе, предпочтительно - от 0,1 до 10 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы. Когда его количество составляет меньше, чем 0,05 частей по массе, трудно достигнуть солюбилизации лекарственного средства, а когда больше, чем 10 частей по массе, не будет достигаться эффект замедленного высвобождения лекарственного средства.
3) Стабилизатор
Стабилизатор, используемый в настоящем изобретении, может быть любым одним из известных стабилизаторов, который предотвращает окисление лекарственного средства в процессе получения твердой дисперсии, включающей солюбилизирующий носитель, или образования пленочного слоя, включающего гипотензивное средство. Примеры стабилизаторов включают бутилированный гидрокситолуол (BHT), бутилированный гидроксианизол (BHA), изоаскорбиновую кислоту, аскорбиновую кислоту, токоферол и другие подобные стабилизаторы. Лекарственная форма с замедленным высвобождением настоящего изобретения может включать стабилизатор в количестве от 0,001 до 3 частей по массе, предпочтительно - от 0,002 до 2 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы. Когда его количество составляет меньше, чем 0,002 части по массе, не будет достигаться ожидаемая стабильность лекарственного средства, а когда более чем 3 части по массе, становится низкой стабильность самого стабилизатора. Кроме того, пленочный слой, включающий гипотензивное средство, может включать стабилизатор в количестве от 0,004 до 6 частей по массе, предпочтительно - от 0,008 до 4 частей по массе на 1 часть по массе гипотензивного средства. Когда его количество составляет меньше, чем 0,004 части по массе, не будет достигаться требуемая стабильность лекарственного средства, а когда больше, чем 6 частей по массе, трудно формировать пленочный слой.
4) Носитель для замедленного высвобождения
В настоящем изобретении носитель для замедленного высвобождения используют для формирования гидрогеля, и предпочтительно, чтобы он являлся смесью ксантановой смолы и смолы плодоворожкового дерева. Обычно ксантановая смола способствует поддержанию структурной целостности лекарственной формы, тем самым сводя к минимуму изменение скорости растворения за счет физических сил, таких как желудочно-кишечная подвижность, а смола плодоворожкового дерева повышает структурную целостность в комбинации с ксантановой смолой. Если носитель является смесью компонентов при их соответствующем соотношении, может быть уменьшено исходное мощное высвобождение и изменение скорости растворения, вызываемое физическими силами.
Носитель для замедленного высвобождения может быть использован в количестве от 0,5 до 20 частей по массе, предпочтительно - от 1 до 10 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы. Когда его количество составляет меньше, чем 0,5 частей по массе, становится неудовлетворительным замедленное высвобождение лекарственного средства, а когда больше, чем 20 частей по массе, лекарственное средство будет высвобождаться слишком медленно. Кроме того, в случае использования смеси ксантановой смолы и смолы плодоворожкового дерева в качестве носителя для замедленного высвобождения, смола плодоворожкового дерева может быть использована в количестве от 0,01 до 5 частей по массе, предпочтительно - от 0,05 до 2 частей по массе на 1 часть по массе ксантановой смолы.
5) Ускоритель гидратации геля
Когда лекарственную форму с замедленным высвобождением настоящего изобретения приводят в контакт in vivo с водной средой, ускоритель гидратации геля позволяет воде быстро просачиваться во внутреннее ядро лекарственной формы в результате быстрой гидратации, что позволяет получать лекарственную форму с единственным гомогенным желатинизированным ядром. В настоящем изобретении может быть предпочтительно, чтобы ускорителем гидратации геля была смесь пропиленгликольальгината и гидроксипропилметилцеллюлозы (HPMC). Предпочтительно, чтобы используемая HPMC имела вязкость от 4000 до 100000 сп.
Ускоритель гидратации геля может быть использован в количестве от 0,1 до 20 частей по массе, предпочтительно - от 0,5 до 10 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы. Когда его количество составляет меньше, чем 0,1 части по массе, не будет происходить гидратация геля, а когда более чем 20 частей по массе, трудно регулировать скорость высвобождения лекарственного средства. Кроме того, может быть использован пропиленгликольальгинат в количестве от 0,05 до 20 частей по массе, предпочтительно - от 0,1 до 10 частей по массе на 1 часть по массе HPMC.
6) Фармацевтически приемлемая добавка
Лекарственная форма с замедленным высвобождением по настоящему изобретению может дополнительно включать, по меньшей мере, одну из известных фармацевтически приемлемых добавок, такую как диспергирующее вещество, связующее, скользящее вещество, подсластитель, наполнитель и другие подобные добавки, для того чтобы получить твердую лекарственную форму, удобную для перорального введения. Характерные примеры фармацевтически приемлемой добавки могут включать поливинилпирролидон (PVP), желатин, гидроксипропилцеллюлозу, эфир сахарозы и жирной кислоты, тальк, мелкодисперсную безводную кремниевую кислоту, цинковые и магниевые соли стеариновой кислоты и другие подобные добавки.
2. Пленочный слой с быстрым высвобождением
Пленочный слой с быстрым высвобождением по настоящему изобретению включает гипотензивное средство в качестве активного ингредиента, которое может быть выбрано из группы, состоящей из блокаторов кальциевых каналов, таких как амлодипин, исрадипин, лацидипин, никардипин, нифедипин, фелодипин, нисолдипин, верапамил, дилтиазем и мибефрадил; бета блокаторы, такие как атенолол, метопролол, буцидолол и карведилол; ингибиторы ангиотензин-конвертирующего фермента (ACE), такие как эналаприл, фозиноприл, лизиноприл, периндоприл, беназеприл, каптоприл, трандолаприл, лозартан, ирбезартан, кандезартан, валзартан, телмизартан и эпрозартан; и калийсберегающее мочегонное средство, такое как амилорид и бендрофлуметиазид. Гипотензивное средство может быть использовано в количестве от 0,5 до 30% по массе, предпочтительно - от 1 до 20% по массе от массы комбинированной лекарственной формы по изобретению. Когда его количество составляет меньше, чем 0,5% по массе, будет отсутствовать его терапевтический эффект, а когда более чем 30% по массе, трудно формировать пленочный слой. Пленочный слой с быстрым высвобождением по настоящему изобретению может включать стабилизатор, который используют для получения лекарственной формы с замедленным высвобождением, для того чтобы предотвратить окисление гипотензивного средства. В пленочном слое с быстрым высвобождением стабилизатор может быть использован в количестве от 0,04 до 6 частей по массе от массы гипотензивного средства.
Кроме того, пленочный слой с быстрым высвобождением может включать, по меньшей мере, один из известных пленкообразующих материалов, таких как гидроксипропилметилцеллюлозу (HPMC), гидроксипропилцеллюлозу (HPC), гидроксиэтилцеллюлозу (HEC), ацетатфталат целлюлозы (CAP), этилцеллюлозу (EC), метилцеллюлозу (MC), полиметакрилат, Kollicoat® (фирмы Basf) и Opadry® (фирмы Colorcon). Он может дополнительно включать пластификаторы, такие как полиэтиленгликоль (PEG), триацетат глицерина (триацетин) и ацетилированный моноглицерид (Myvacet), и могут быть использованы для образования пленочного слоя традиционные растворители, способные растворять пленкообразующие материалы, такие как очищенная вода или этанол.
3. Водорастворимый пленочный слой
Комбинированная лекарственная форма по изобретению может дополнительно включать водорастворимый пленочный слой, расположенный между лекарственной формой с замедленным высвобождением и пленочным слоем с быстрым высвобождением, который блокирует взаимный контакт ингибитора HMG-CoA редуктазы в ядре с замедленным высвобождением с гипотензивным средством в пленочном слое с быстрым высвобождением. Водорастворимый пленочный слой может быть использован в количестве от 0,5 до 20% по массе, предпочтительно - от 1 до 10% по массе от массы комбинированной лекарственной формы по изобретению. Когда его количество составляет меньше чем 0,5% по массе, становится неудовлетворительным блокирующий эффект, а когда оно составляет более чем 20% по массе, он отрицательно влияет на высвобождение лекарственного средства.
Кроме того, водорастворимый пленочный слой может включать, по меньшей мере, один из известных водорастворимых пленкообразующих материалов, такой как гидроксипропилметилцеллюлозу (HPMC), гидроксипропилцеллюлозу (HPC), гидроксиэтилцеллюлозу (HEC), ацетатфталат целлюлозы (CAP), этилцеллюлозу (EC), метилцеллюлозу (MC), полиметакрилат, Kollicoat® (фирмы Basf) и Opadry® (фирмы Colorcon). Он может дополнительно включать пластификаторы, такие как полиэтиленгликоль (PEG), триацетат глицерина (триацетин) и ацетилированный моноглицерид (Myvacet), и могут быть использованы для образования пленочного слоя традиционные растворители, способные растворять пленкообразующие материалы, такие как очищенная вода или этанол.
4. Дополнительный пленочный слой
Комбинированная лекарственная форма по изобретению может дополнительно включать дополнительный пленочный слой на внешней стороне поверхности слоя с быстрым высвобождением для защиты лекарственных средств от неблагоприятных факторов, таких как свет и влага, а также для удобства введения (например, маскирования горького вкуса). Дополнительный пленочный слой может быть светозащитным пленочным слоем, защищающим от влаги пленочным слоем или сахарным пленочным слоем, и может быть использован в количестве от 0,5 до 20% по массе, предпочтительно - от 1 до 10% по массе от массы комбинированной лекарственной формы изобретения. Когда его количество составляет меньше, чем 0,5% по массе, не будет достигаться его защитный эффект, а когда больше, чем 20% по массе, он отрицательно действует на высвобождение лекарственного средства.
Кроме того, дополнительный пленочный слой может включать, по меньшей мере, один из известных пленкообразующих материалов, таких как гидроксипропилметилцеллюлозу (HPMC), гидроксипропилцеллюлозу (HPC), гидроксиэтилцеллюлозу (HEC), ацетатфталат целлюлозы (CAP), этилцеллюлозу (EC), метилцеллюлозу (MC), полиметакрилат, Kollicoat® (фирмы Basf) и Opadry® (фирмы Colorcon). Он может дополнительно включать пластификаторы, такие как полиэтиленгликоль (PEG), триацетат глицерина (триацетин) и ацетилированный моноглицерид (Myvacet), и могут быть использованы для образования пленочного слоя традиционные растворители, способные растворять пленкообразующие материалы, такие как очищенная вода или этанол.
Комбинированная лекарственная форма по изобретению для перорального введения ингибитора HMG-CoA редуктазы и гипотензивного средства может быть получена с помощью следующих стадий:
1) сушка смеси ингибитора HMG-CoA редуктазы, солюбилизирующего носителя и стабилизатора с получением твердой дисперсии;
2) сухое смешение твердой дисперсии, полученной на стадии 1, с носителем для замедленного высвобождения и ускорителем гидратации геля, и формирование смеси сухим смешением с получением лекарственной формы с замедленным высвобождением; и
3) нанесение на лекарственную форму с замедленным высвобождением, полученную на стадии 2, пленочного слоя с быстрым высвобождением, включающего гипотензивное средство, с получением комбинированной лекарственной формы.
На стадии 1 твердая дисперсия может быть получена традиционным способом, таким как сушка распылением, испарение растворителя, микрораспыление-увлажнение, расплавление и лиофилизация, и может предпочтительно иметь размер частицы от 5 до 200 мкм в диаметре. Кроме того, для облегчения формирования твердой дисперсии к раствору может быть добавлена описанная выше фармацевтически приемлемая добавка.
На стадии 2 лекарственная форма с замедленным высвобождением может быть сформована в таблетку путем прессования смеси, полученной сухим смешением, непосредственно прессованием, или прессованием, размолом и таблетированием смеси, полученной сухим смешением. Кроме того, перемешанная смесь может дополнительно включать фармацевтически приемлемую добавку для облегчения приготовления лекарственной формы.
Вышеприведенный способ может дополнительно включать стадию нанесения на лекарственную форму с замедленным высвобождением, полученную на стадии 2, водорастворимого пленочного слоя перед нанесением на нее пленочного слоя с быстрым высвобождением на стадии 3.
Кроме того, вышеприведенный способ может дополнительно включать стадию нанесения на окончательно полученную комбинированную лекарственную форму дополнительного пленочного слоя для защиты лекарственной формы от отрицательных факторов, таких как свет и влага, а также для улучшения восприятия ее пациентом (например, путем маскирования горького вкуса). Пероральная комбинированная лекарственная форма по настоящему изобретению, включающая ингибитор HMG-CoA редуктазы и гипотензивное средство, имеет преимущества в том, что оно максимизирует терапевтические эффекты лекарственных средств за счет синергизма, возникающего в результате объединения лекарственных средств с различными профилями высвобождения или дозами: гипотензивное средство быстро высвобождается для усиления его терапевтического эффекта, а ингибитор HMG-CoA редуктазы медленно высвобождается при постоянной скорости для поддержания его концентрации в крови. Кроме того, комбинированная лекарственная форма по изобретению может дополнительно включать разделяющий слой, с тем чтобы свести к минимуму контакт между двумя нестабильными составляющими лекарственными средствами. Соответственно, лекарственная форма по изобретению может быть эффективно использована для предотвращения и лечения гиперлипидемии, атеросклероза, гипертензии, сердечно-сосудистого заболевания или при их совместном наличии путем перорального введения разовой дозы один раз в день.
Следующие примеры предназначены для дополнительной иллюстрации настоящего изобретения без ограничения его объема.
Примеры 1-3 и сравнительный пример 1
Получение твердой дисперсии
Симвастатин (фирмы Hanmi Fine Chemical Co., Ltd., Korea), MYRJ (фирмы ICI, USA), HPMC 2910 (вязкость от 3 до 15 спз, фирмы Shin-Etsu, Japan), BHT (фирмы UENO Fine Chemical, USA) и мелкодисперсную безводную кремневую кислоту (в качестве диспергирующего средства) растворяли в смеси этанола и дихлорметана согласно количествам, приведенным в таблице 1, соответственно, и каждую из полученных смесей подвергали сушке распылением для получения твердой дисперсии со средним размером частицы 100 мкм или ниже. Полученные таким образом твердые дисперсии примеров 1-3 и сравнительного примера 1 приведены в таблице 1.
(мг/таблетка)
2910
Примеры 4-8
Получение лекарственной формы с замедленным высвобождением для перорального введения
Методику примера 1 повторяли с использованием симвастатина, ловастатина или флувастатина в качестве активного ингредиента вместе с MYRJ, HPMC 2910, BHT и мелкодисперсной безводной кремневой кислотой согласно количествам, приведенным в таблицах 2-4, соответственно, для получения твердых дисперсий. Затем, каждую из твердых дисперсий смешивали с ксантановой смолой (фирмы Kelco, USA), смолой плодоворожкового дерева (фирмы Cesalpinia, Italy), пропиленгликольальгинатом (фирмы ISP, USA), HPMC 2208 (вязкость от 4,000 до 100,000 сп, фирмы Shin-Etsu, Japan) и изоаскорбиновой кислотой в течение около 30 мин и добавляли к ней порошки эфира сахарозы и жирной кислоты и мелкодисперсной безводной кремневой кислоты (менее чем 40 меш), и смешивали в течение 5 мин. Каждую из полученных смесей расплавляли в массу с использованием формующей установки, и массу дробили на частицы с размером от 20 до 80 меш. Частицы затем формовали в таблетку прессованием в формователе с получением лекарственной формы с замедленным высвобождением. Полученные таким образом лекарственные формы с замедленным высвобождением примеров 4-8 приведены в таблицах 2-4.
2910
2208
(мг/таблетка)
Примеры 9-11
Получение комбинированной лекарственной формы для перорального введения
На каждую из лекарственных форм с замедленным высвобождением, полученных в примерах 5, 7 и 8, наносили пленку из Opadry® AMB (фирмы Colorcon). Амлодипина камсилат (фирмы Hanmi Fine Chemical Co., Ltd., Korea), HPMC 2910 (вязкость от 3 до 15 спз) и ацетилированный моноглицерид (Myvacet) растворяли в смеси этанола и дихлорметана согласно количествам, приведенным в таблице 5, соответственно, на которые уже было ранее нанесено пленочное покрытие.
На полученную таким образом каждую из лекарственных форм дополнительно наносили смесь, полученную согласно композиции, приведенной в таблице 6, для того чтобы защитить амплодипин от света, с получением комбинированной лекарственной формы. Комбинированные лекарственные формы примеров 9-11 приведены в таблице 5. Диоксид титана и HPMC 2910 применяли для защиты от света, а полиэтиленгликоль 6000 (PEG 6000) и тальк в качестве пластификатора.
2910
6000
лированная
вода
Тестовый пример 1
Тест на растворимость твердой дисперсии
Каждую из твердых дисперсий сравнительного примера 1 и примеров 1-3, и порошок симвастатина в качестве контроля подвергали тесту на растворимость в дистиллированной воде с использованием системы для исследования растворимости при следующих условиях согласно 1-му корзиночному способу, описанному в Корейской Фармакопее.
- Система для исследования растворимости: Erweka DT 80 (фирмы Erweka, Германия)
- Выходящий растворитель: 900 мл дистиллированной воды
- Температура растворителя: 37 ± 0,5°C
- Скорость вращения: 50, 100 и 150 об/мин
- Метод анализа: жидкостная хроматография
- Колонка: Cosmosil C18 (Nacalai tesque)
- Подвижная фаза: ацетонитрил/ буферный раствор pH 4,0
- Скорость потока: 1,5 мл/мин
- Детектор: УФ-спектрофотометр (238 нм)
- Вводимый объем: 20 мкл
Буферный раствор с pH 4,0 получали смешением 3 мл ледяной уксусной кислоты с 1 л дистиллированной воды и доводили pH смеси до 4,0 с помощью NaOH.
Как показано на фиг.2, твердые дисперсии примеров 1-3 продемонстрировали более высокую растворимость по сравнению с твердой дисперсией сравнительного примера 1 или порошком симвастатина, и, по видимому, рост растворимости зависит от количества MYRJ, а не количества HPMC.
Тестовый пример 2: Тест на растворимость лекарственной формы с замедленным высвобождением для количества активного ингредиента
Каждую из лекарственных форм с замедленным высвобождением, полученных в примерах 4-6, подвергали тесту на растворение лекарственного средства при следующих условиях согласно 2-му лопастному способу, описанному в Корейской Фармакопее. Количество симвастатина, вымываемого из лекарственной формы в процессе теста, измеряли жидкостной хроматографией на 1, 2, 4, 6, 8, 10, 12, 16, 20 и 24 час после начала теста.
- Система для исследования растворимости: Erweka DT 80
- Выходящий растворитель: буферный раствор 0,01 M фосфата натрия (pH 7,0), содержащий 0,5% натрийлаурилсульфата (SLS)
- Температура растворителя: 37 ± 0,5°C
- Скорость вращения: 100 об/мин
- Метод анализа: УФ-спектрофотометр (247 нм и 257 нм)
- Вычисление вымываемого количества: Суммарное высвобождающееся количество.
Образец, отобранный в каждое заданное время, подвергали взаимодействию с 40 мг предварительно промытого водой MnO2 (для USP таблетки симвастатина 1) в течение 30 мин и центрифугировали при 3000 об/мин в течение 5 мин. Затем измеряли поглощения при 247 и 257 нм каждого образца с использованием УФ-спектрофотометра и вычисляли истинное поглощение путем вычитания поглощения при 257 нм из поглощения при 247 нм.
Как видно из фиг.3, лекарственный формы, полученные в примерах 4-6, проявляют аналогичные скорости растворения вне зависимости от разницы в содержании активного ингредиента.
Тестовый пример 3
Тест на растворимость лекарственной формы с замедленным высвобождением для другого активного ингредиента
Лекарственные формы, полученные в примерах 7 и 8, подвергали тесту на растворимость согласно аналогичному методу, описанному в тестовом примере 2, за исключением того, что измеряли количество ловастатина или флувастатина вместо количества симвастатина. В результате, на фиг.4 видно, что лекарственные формы с замедленным высвобождением примера 7 и 8 проявляют аналогичные замедленные скорости растворения, вне зависимости от того, какой в них использовался ингибитор HMG-CoA редуктазы.
Тестовый пример 4
Тест на растворимость комбинированной лекарственной формы
Лекарственные формы, полученные в примерах 9-11, подвергали тесту на растворимость, согласно аналогичному методу, описанному в тестовом примере 2, за исключением того, что использовали высокоэффективную жидкостную хроматографию (HPLC) вместо УФ-спектрофотометра (UV) при следующих условиях.
- Система для исследования растворимости: Erweka DT 80
- Выходящий растворитель: буферный раствор 0,01 M фосфата натрия (pH 7,0), содержащий 0,5% натрийлаурилсульфата (SLS)
- Температура растворителя: 37 ± 0,5°C
- Скорость вращения: 100 об/мин
- Метод анализа: жидкостная хроматография
- Колонка: Cosmosil Ci8 (Nacalai tesque)
- Подвижная фаза: ацетонитрил/ буферный раствор pH 4,0
- Скорость потока: 1,5 мл/мин
- Детектор: УФ-спектрофотометр (238 нм)
- Вводимый объем: 20 мкл
Буферный раствор с pH 4,0 получали смешением 3 мл ледяной уксусной кислоты с 1 л дистиллированной воды и доводили pH смеси до 4,0 с помощью NaOH.
Как показано на фиг.5, комбинированные лекарственные формы примеров 9-11 проявляют скорости растворения, аналогичные скоростям растворения лекарственных форм с замедленным высвобождением примеров 4-8. Это предполагает, что на скорость растворения ингибитора HMG-CoA редуктазы не сильно влияют слои покрытий.
Тестовый пример 5
Скорость растворения комбинированной лекарственной формы для различных скоростей вращения
Лекарственную форму, полученную в примере 9, подвергали тесту на растворимость согласно методу, описанному в тестовом примере 4, за исключением того, что устанавливались скорости вращения 50, 100 или 150 об/мин.
В результате, на фиг.6 видно, что комбинированная лекарственная форма по настоящему изобретению не показывает какого-либо значительного различия в скоростях растворения ингибитора HMG-CoA редуктазы, даже когда изменяли скорость вращения. Это предполагает, что побочные эффекты из-за эффекта исходного мощного выброса ингибитора HMG-CoA редуктазы были бы значительно уменьшены при введении пациенту комбинированной лекарственной формы по изобретению.
Тестовый пример 6
Тест на растворимость комбинированной лекарственной формы
Каждую из комбинированных лекарственных форм, полученных в примерах 9-11, и доступный в продаже Norvasc® (фирмы Pfizer) в качестве лекарственной формы для сравнения подвергали тесту на растворимость лекарственного вещества при следующих условиях согласно со 2-м лопастным методом, описанным в Корейской Фармакопее. Количество амлодипина, вымываемого из тестируемой лекарственной формы во время теста, измеряли жидкостной хроматографией через 15, 30, 45 и 60 мин после начала теста.
- Система для исследования растворимости: Erweka DT 80
- Выходящий растворитель: 500 мл 0,01 N водной HCl
- Температура растворителя: 37 ± 0,5°C
- Скорость вращения: 75 об/мин
- Метод анализа: УФ-спектрофотометр (237 nm)
- Вычисление вымываемого количества: Суммарное высвобождающееся количество
Как показано на фиг.7, комбинированные лекарственные формы примеров 9-11 проявляют высокие скорости растворения амлодипина (90% за 30 мин), так же как и лекарственная форма сравнения.
Несмотря на то, что изобретение было описано с ссылкой на вышеприведенные конкретные варианты осуществления, следует осознавать, что различные модификации и изменения могут быть сделаны в этом изобретении специалистами в этой области, которые также подпадают под объем изобретения, определяемый прилагаемой формулой изобретения.
Настоящее изобретение относится к области лекарственных средств, в частности к комбинированной лекарственной форме для предотвращения и лечения гиперлипидемии, атеросклероза, гипертензии или сердечно-сосудистого заболевания, включающей лекарственную форму с замедленным высвобождением ингибитора HMG-CoA редуктазы и пленочный слой с быстрым высвобождением, содержащий гипотензивное средство, причем пленочный слой с быстрым высвобождением нанесен на лекарственную форму с замедленным высвобождением, где лекарственная форма с замедленным высвобождением включает твердую дисперсию, содержащую ингибитор HMG-CoA редуктазы, солюбилизирующий носитель и стабилизатор; носитель для замедленного высвобождения; и ускоритель гидратации геля. Изобретение также относится к способу получения указанной лекарственной формы. Пленочный слой с быстрым высвобождением обеспечивает улучшенные терапевтические эффекты гипотензивного средства путем его быстрого высвобождения при поддерживании постоянного уровня ингибитора HMG-CoA редуктазы в крови за счет медленного высвобождения. 2 н. и 29 з.п. ф-лы, 7 ил., 6 табл.
1. Комбинированная лекарственная форма для предотвращения и лечения гиперлипидемии, атеросклероза, гипертензии или сердечно-сосудистого заболевания, включающая лекарственную форму с замедленным высвобождением ингибитора HMG-CoA редуктазы и пленочный слой с быстрым высвобождением, содержащий гипотензивное средство, причем пленочный слой с быстрым высвобождением нанесен на лекарственную форму с замедленным высвобождением, где лекарственная форма с замедленным высвобождением включает твердую дисперсию, содержащую ингибитор HMG-CoA редуктазы, солюбилизирующий носитель и стабилизатор; носитель для замедленного высвобождения; и ускоритель гидратации геля.
2. Комбинированная лекарственная форма по п.1, в которой ингибитор HMG-CoA редуктазы выбран из группы, состоящей из мевастатина, ловастатина, правастатина, лактона правастатина, велостатина, симвастатина, ривастатина, флувастатина, аторвастатина и церивастатина.
3. Комбинированная лекарственная форма по п.1, в которой количество ингибитора HMG-CoA редуктазы составляет от 1 до 50% по массе от массы комбинированной лекарственной формы.
4. Комбинированная лекарственная форма по п.1, в которой солюбилизирующий носитель выбран из группы, состоящей из витамина Е TPGS (d-α-токоферил полиэтиленгликоль 1000 сукцината), полиоксиэтиленстеарата, гидроксипропилметилцеллюлозы, полиэтиленгликоля и блоксополимера полиоксипропилен-полиоксипропилен.
5. Комбинированная лекарственная форма по п.1, в которой количество солюбилизирующего носителя составляет от 0,05 до 20 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы.
6. Комбинированная лекарственная форма по п.1, в которой стабилизатор выбран из группы, состоящей из бутилированного гидрокситолуола (ВНТ), бутилированного гидроксианизола (ВНА), изоаскорбиновой кислоты, аскорбиновой кислоты и токоферола.
7. Комбинированная лекарственная форма по п.1, в которой количество стабилизатора составляет от 0,001 до 3 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы.
8. Комбинированная лекарственная форма по п.1, в которой носитель для замедленного высвобождения является смесью ксантановой смолы и смолы плодоворожкового дерева.
9. Комбинированная лекарственная форма по п.8, в которой количество смолы плодоворожкового дерева в смеси составляет от 0,01 до 5 частей по массе на 1 часть по массе ксантановой смолы.
10. Комбинированная лекарственная форма по п.1, в которой количество носителя для замедленного высвобождения составляет от 0,5 до 20 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы.
11. Комбинированная лекарственная форма по п.1, в которой ускоритель гидратации геля является смесью пропиленгликольальгината и гидроксипропилметилцеллюлозы (НРМС).
12. Комбинированная лекарственная форма по п.11, в которой НРМС имеет вязкость от 4000 до 100000 сПз.
13. Комбинированная лекарственная форма по п.11, в которой количество пропиленгликольальгината составляет от 0,05 до 20 частей по массе на 1 часть по массе НРМС.
14. Комбинированная лекарственная форма по п.1, в которой количество ускорителя гидратации геля составляет от 0,1 до 20 частей по массе на 1 часть по массе ингибитора HMG-CoA редуктазы.
15. Комбинированная лекарственная форма по п.1, в которой лекарственная форма с замедленным высвобождением дополнительно включает фармацевтически приемлемую добавку.
16. Комбинированная лекарственная форма по п.15, в которой фармацевтически приемлемая добавка выбрана из группы, состоящей из мелкодисперсной безводной кремневой кислоты, эфира сахарозы и жирной кислоты, талька, цинковых и магниевых солей стеариновой кислоты, и их смесей.
17. Комбинированная лекарственная форма по п.1, в которой гипотензивное средство выбрано из группы, состоящей из амлодипина, исрадипина, лацидипина, никардипина, нифедипина, фелодипина, нисолдипина, верапамила, дилтиазема, мибефрадила, атенолола, метопролола, буцидолола, карведилола, эналаприла, фозиноприла, лизиноприла, периндоприла, беназеприла, каптоприла, трандолаприла, лозартана, ирбезартана, кандезартана, валзартана, телмизартана, эпрозартана, амилорида и бендрофлуметиазида.
18. Комбинированная лекарственная форма по п.1, в которой количество гипотензивного средства составляет от 0,5 до 30% по массе от массы комбинированной лекарственной формы.
19. Комбинированная лекарственная форма по п.1, в которой пленочный слой с быстрым высвобождением дополнительно включает стабилизатор.
20. Комбинированная лекарственная форма по п.19, в которой стабилизатор выбран из группы, состоящей из бутилированного гидрокситолуола (ВНТ), бутилированного гидроксианизола (ВНА), изоаскорбиновой кислоты, аскорбиновой кислоты и токоферола.
21. Комбинированная лекарственная форма по п.19, в которой количество стабилизатора составляет от 0,004 до 6 частей по массе на 1 часть по массе гипотензивного средства.
22. Комбинированная лекарственная форма по п.1, которая дополнительно включает водорастворимый пленочный слой, расположенный между лекарственной формой с замедленным высвобождением и пленочным слоем с быстрым высвобождением.
23. Комбинированная лекарственная форма по п.22, в которой водорастворимый пленочный слой включает, по меньшей мере, один материал, выбранный из группы, состоящей из гидроксипропилметилцеллюлозы (НРМС), гидроксипропилцеллюлозы (НРС), гидроксиэтилцеллюлозы (НЕС), ацетатфталата целлюлозы (CAP), этилцеллюлозы (ЕС), метилцеллюлозы (МС), полиметакрилата, Kollicoat® (фирмы Basf) и Opadry® (фирмы Colorcon).
24. Способ получения комбинированной лекарственной формы по п.1, который включает следующие стадии:
1) сушка смеси ингибитора HMG-CoA редуктазы, солюбилизирующего носителя и стабилизатора с получением твердой дисперсии;
2) сухое смешение твердой дисперсии, полученной на стадии 1, с носителем для замедленного высвобождения и ускорителем гидратации геля, и формирование смеси сухим смешением с получением лекарственной формы с замедленным высвобождением; и
3) нанесение на лекарственную форму с замедленным высвобождением, полученную на стадии 2, пленочного слоя с быстрым высвобождением, включающего гипотензивное средство, с получением комбинированной лекарственной формы.
25. Способ по п.24, в котором процесс сушки на стадии 1 проводят с использованием метода сушки распылением, методом испарения растворителя, методом микрораспыления-увлажнения, методом расплавления или методом лиофилизации.
26. Способ по п.24, в котором твердая дисперсия, полученная на стадии 1, имеет размер частицы от 5 до 200 мкм в диаметре.
27. Способ по п.24, в котором процесс формования на стадии 2 осуществляют непосредственным прессованием смеси, полученной сухим смешением, с получением таблетки, или прессованием, размолом и таблетированием смеси, полученной сухим смешением, с получением таблетки.
28. Способ по п.24, в котором стадия 1 дополнительно включает стадию добавления фармацевтически приемлемой добавки к смеси, полученной сухим смешением.
29. Способ по п.24, который дополнительно включает стадию нанесения на лекарственную форму с замедленным высвобождением, полученную на стадии 2, водорастворимого пленочного слоя перед нанесением пленочного слоя с быстрым высвобождением на стадии 3.
30. Способ по п.24, который дополнительно включает стадию нанесения на комбинированную лекарственную форму, полученную на стадии 3, дополнительного пленочного слоя.
31. Способ по п.30, в котором дополнительный пленочный слой является светозащитным пленочным слоем, влагонепроницаемым пленочным слоем или сахарным пленочным слоем.
| ПРИСПОСОБЛЕНИЕ ДЛЯ ОПРЕДЕЛЕНИЯ ДЕФОРМАЦИЙ ВНУТРИ БЕТОННОЙ КЛАДКИ | 1930 |
|
SU21525A1 |
| WO 2004035090 A1, 29.04.2004 | |||
| WO 9911263 A1, 11.03.1999 | |||
| EP 0465096 A1, 08.01.1992 | |||
| US 2004132814 A1, 08.07.2004. | |||
Авторы
Даты
2010-02-20—Публикация
2005-12-28—Подача