Техническая область
Настоящее изобретение относится к капсуле, которая содержит соединение, вызывающее раздражение в полости рта, где ее содержимое не легко вытекает при разжевывании.
Предшествующая область техники
За исключением отдельных препаратов, таких как жевательные таблетки и сублингвальные таблетки, фармацевтические препараты, которые вводятся перорально, такие как таблетки и капсулы, обычно принимают с использованием воды и т.п. без разжевывания. Однако в случае пожилых людей и т.п. сообщалось о множестве случаев, когда при приеме этих фармацевтических препаратов, их разжевывали и дробили зубами намеренно или не намеренно. Поскольку способ приема фармацевтических препаратов внутрь является индивидуальным для соответствующих препаратов, которые были созданы с учетом области всасывания активного ингредиента, его длительности нахождения в кровотоке и т.п., то при ошибке в способе применения желаем эффект не может быть получен, и в некоторых случаях это приводит к тяжелым побочным эффектам. Таким образом, несмотря на то, что надлежащие рекомендации по способу применения даются всем пациентам в медицинских учреждениях, таких как больницы и аптеки, нельзя утверждать, что это приведет к благоприятным результатам, так что все еще остается множество пациентов, которые ошибаются в способе применения.
Мягкие капсулы, главным образом, получают инкапсулированием жидкости для наполнения капсулы в форме жидкости или суспензии в оболочку капсулы на основе желатина. Мягкую капсулу рассматривают как дозированную форму, откуда, как можно ожидать, происходит должное всасывание находящегося в ней лекарственного средства вследствие того, что после приема оболочка капсулы быстро распадается в пищеварительном тракте, так что распространение и растворение находящейся внутри капсулы жидкости происходит быстрее, чем в случае таблетки. Однако, поскольку главной целью фармацевтических препаратов, изготавливаемых для использования этого свойства мягкой капсулы, является способность легко распадаться в пищеварительном тракте, толщина оболочки капсулы, как правило, является небольшой, так что существует проблема, что находящаяся внутри жидкость легко проникает в полость рта при разжевывании по ошибке во время приема, как описано выше. В частности, если жидкость для наполнения капсулы представляет собой вещество, вызывающее раздражение в полости рта, то нельзя утверждать, что такая мягкая капсула, из которой находящаяся в ней жидкость легко вытекает при разжевывании, является желательной вследствие того, что она вызывает неприятные ощущения, такие как ощущение остроты, боль, ощущение жжения и т.п.
С другой стороны, например, существуют следующие сообщения в отношении капсулы, содержащей производное пентановой кислоты, включая сюда (2R)-2-пропилоктановую кислоту, которая эффективна в качестве средства, улучшающего церебральную функцию при различных заболеваниях вследствие действия с улучшением функции астроцитов.
Например, в ЕР 0632008 описано, что такое производное пентановой кислоты вводили в качестве твердой композиции для перорального введения в виде таблеток, пилюль, капсул, порошков, гранул и т.п., и что твердые капсулы и мягкие капсулы включены в указанные капсулы.
Кроме того, например, в ЕР 1174131 описан пример препарата, показывающий, что инкапсулированием (2R)-2-пропилоктановой кислоты (1 г) в желатиновую капсулу было получено 10 капсул, каждая из которых содержала 100 мг активного ингредиента.
Однако к настоящему времени не существует конкретного описания мягкой капсулы, в частности, устойчивой при разжевывании мягкой капсулы, которая содержит (2R)-2-пропилоктановую кислоту или ее соль.
Описание изобретения
С целью получить мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту или ее соль, авторы настоящего изобретения провели исследования с использованием (2R)-2-пропилоктановой кислоты, которая представляет собой жидкость, и получили результат, что, являясь высоко раздражающим веществом, (2R)-2-пропилоктановая кислота при инкапсулировании в мягкую капсулу обычного состава и разжевывании легко проникает в полость рта и вызывает достаточно сильное ощущение остроты, жжения и т.п. Несмотря на то, что (2R)-2-пропилоктановая кислота представляет собой вещество, которое предполагают вводить пожилым пациентам по показаниям, такие препараты, из которых содержимое легко вытекает при разжевывании, не являются желательными для их использования пожилыми пациентами, которые часто ошибаются в способе применения фармацевтических препаратов.
Таким образом, целью настоящего изобретения является следующее - разработать мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту или ее соль, где ее содержимое не легко вытекает при разжевывании.
Авторы изобретения провели тщательные исследования с целью решения описанных выше проблем и добились успеха в обеспечении в качестве результата свойства легко распадаться в желудке и свойства, что содержимое при разжевывании вытекает с трудом, получив мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту или ее соль, с использованием оболочки капсулы, содержащей желатин и глицерин, и получив такую капсулу с одним или несколькими свойствами, выбранными из свойств от (А) до (F), которые описаны ниже, предпочтительно со всеми из этих свойств. Кроме того, авторы изобретения провели исследования, основываясь на этих знаниях, и обнаружили, что такие способы могут применяться не только в отношении (2R)-2-пропилоктановой кислоты или ее соли, но также для всех соединений со свойством вызывать раздражение в полости рта, осуществив, таким образом, настоящее изобретение.
Таким образом, настоящее изобретение относится к следующему.
[1] Устойчивая при разжевывании капсула, содержащая (2R)-2-пропилоктановую кислоту или ее соль и обладающая свойством из следующих ниже (1) и/или (2):
(1) имеет оболочку капсулы, содержащую (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира и (b) смягчитель, и обладающую содержанием воды от 4,0 до 10,0%;
(2) легко распадается в желудке.
[2] Устойчивая при разжевывании капсула по п. [1], которая представляет собой мягкую капсулу.
[3] Устойчивая при разжевывании мягкая капсула по п. [2] с по меньшей мере одним свойством, выбранным из свойств от (А) до (F):
(A) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где она обладает временем распада от 3 до 10 минут при испытании на распадаемость, предусмотренном в Japanese Pharmacopoeia;
(C) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(D) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(Е) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(F) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
[4] Устойчивая при разжевывании мягкая капсула по п. [3], где свойство, по меньшей мере одно, выбрано из следующих ниже свойств от (А) до (F):
(А) где она обладает прочностью от 180 до 350 Н при испытании на растрескивание;
(B) где она обладает временем распада от 5 до 8 минут при испытании на распадаемость, предусмотренном в Japanese Pharmacopoeia;
(C) где оболочка капсулы обладает толщиной оболочки от 0,10 до 0,45 мм;
(D) где толщина первого шва оболочки капсулы составляет от 0,15 до 0,50 мм;
(Е) где толщина второго шва оболочки капсулы составляет от 0,10 до 0,40 мм;
(F) где содержание воды в оболочке капсулы составляет от 5,0 до 8,0%.
[5] Устойчивая при разжевывании мягкая капсула по п. [2], где основой капсулы является желатин.
[6] Устойчивая при разжевывании мягкая капсула по п. [2], где смягчитель представляет собой глицерин, который по существу не содержит сорбита или содержит сорбит в количестве 20 массовых частей или менее относительно 100 массовых частей основы капсулы.
[7] Устойчивая при разжевывании мягкая капсула по п. [6], где смягчитель представляет собой глицерин, который по существу не содержит сорбита.
[8] Устойчивая при разжевывании мягкая капсула по п. [2], где оболочка капсулы содержит желатин в качестве основы капсулы и глицерин в качестве смягчителя, который содержится в количестве от 25 до 40 массовых частей относительно 100 массовых частей желатина, и содержание воды в ней составляет от 5,0 до 9,0%.
[9] Устойчивая при разжевывании мягкая капсула по п. [8], где оболочка капсулы содержит желатин и глицерин, который содержится в количестве 30 массовых частей относительно 100 массовых частей желатина, и содержание воды в ней составляет от 5,0 до 8,0%.
[10] Устойчивая при разжевывании мягкая капсула, которая легко распадается в желудке, содержит (2R)-2-пропилоктановую кислоту и характеризуется следующим:
имеет оболочку капсулы, содержащую желатин и глицерин, который содержится в количестве 30 массовых частей относительно 100 массовых частей желатина, и имеющую содержание воды от 5,0 до 8,0%, толщину оболочки от 0,10 до 0,45 мм, толщину первого шва от 0,15 до 0,50 мм и толщину второго шва от 0,10 до 0,40 мм/обладает прочностью от 180 до 350 Н при испытании на растрескивание; и
обладает временем распада от 5 до 8 минут при испытании на распадаемость, предусмотренном в Japanese Pharmacopoeia.
[11] Устойчивая при разжевывании мягкая капсула по п.п. [2] или [10], которая содержит от 50 до 400 мг (2R)-2-пропилоктановой кислоты.
[12] Устойчивая при разжевывании мягкая капсула по п. [11], которая содержит 100 мг или 300 мг (2R)-2-пропилоктановой кислоты.
[13] Устойчивая при разжевывании мягкая капсула по п.п. [2] или [10], где замедление растворения, связанное с хранением, уменьшено.
[14] Устойчивая при разжевывании мягкая капсула по п. [13], которая обладает скоростью растворения через 30 минут после начала испытания на растворимость 90% или более в соответствии со вторым испытанием на растворимость, предусмотренным в Japanese Pharmacopoeia, после хранения при комнатной температуре в течение приблизительно полутора лет.
[15] устойчивая при разжевывании мягкая капсула по п.п. [2] или [10], которую подвергают герметичному упаковыванию.
[16] Устойчивая при разжевывании мягкая капсула по п. [15], где способ герметичной упаковки представляет собой упаковку РТР.
[17] Устойчивая при разжевывании мягкая капсула по п.п. [2] или [10], которая представляет собой средство для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов.
[18] Способ профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов, который включает в себя введение млекопитающему эффективного количества устойчивых при разжевывании мягких капсул по пп. [2] или [10].
[19] Применение устойчивых при разжевывании мягких капсул по п.п. [2] или [10] для изготовления средства для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов.
[20] Средство для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов, которое включает в себя устойчивую при разжевывании мягкую капсулу по п.п. [2] или [10].
[21] Способ придания мягкой капсуле устойчивости к разжевыванию, который включает в себя получение мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту или ее соль и имеющей оболочку капсулы, содержащую (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира и (b) смягчитель, с по меньшей мере одним свойством, выбранным из следующих ниже от (А) до (Е):
(A) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(C) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(D) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(Е) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
[22] Способ по п. [21], где свойство представляет собой по меньшей мере одно свойство, выбранное из следующих ниже от (А) до (Е):
(А) где прочность составляет от 180 до 350 Н при испытании на растрескивание;
(B) где оболочка капсулы обладает толщиной оболочки от 0,10 до 0,45 мм;
(C) где толщина первого шва оболочки капсулы составляет от 0,15 до 0,50 мм;
(D) где толщина второго шва оболочки капсулы составляет от 0,10 до 0,40 мм;
(Е) где содержание воды в оболочке капсулы составляет от 5,0 до 8,0%.
[23] Капсула, устойчивая при разжевывании, которая легко распадается в желудке, содержит соединение, вызывающее раздражение в полости рта, обладающая оболочкой капсулы, содержащей (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира и (b) смягчитель, и имеющая по меньшей мере одно свойство, выбранное из следующих ниже от (А) до (F):
(A) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где она обладает временем распада от 3 до 10 минут при испытании на распадаемость, предусмотренном в Japanese Pharmacopoeia;
(C) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(D) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(Е) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(F) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
[24] Способ придания мягкой капсуле устойчивости к разжевыванию, который включает в себя получение мягкой капсулы, содержащей соединение, вызывающее раздражение в полости рта, и имеющей оболочку капсулы, содержащую (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира и (b) смягчителя, с по меньшей мере одним свойством, выбранным из следующих ниже от (А) до (Е):
(A) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(C) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(D) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(Е) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
[25] Быстрорастворимая мягкая капсула, содержащая (2R)-2-пропилоктановую кислоту или ее соль.
[26] Капсула по п. [25], скорость растворения которой через 30 минут после начала испытания на растворимость составляет 90% или более в соответствии со вторым испытанием на растворимость, предусмотренным в Japanese Pharmacopoeia.
[27] Капсула по п. [25], где замедление растворения, связанное с хранением, уменьшено.
[28] Капсула по п. [27], скорость растворения которой через 30 минут после начала испытания на растворимость составляет 90% или более в соответствии со вторым испытанием на растворимость, предусмотренным в Japanese Pharmacopoeia, после хранения при комнатной температуре в течение приблизительно полутора лет.
[29] Быстрорастворимая мягкая капсула, содержащая (2R)-2-пропилоктановую кислоту, которая имеет оболочку капсулы, содержащую (а) желатин и (b) глицерин, который содержится в количестве 30 массовых частей относительно 100 массовых частей желатина, и обладает скоростью растворения через 30 минут после начала испытания на растворимость 90% или более в соответствии со вторым испытанием на растворимость, предусмотренным в Japanese Pharmacopoeia, после хранения при комнатной температуре в течение приблизительно полутора лет.
[30] Капсула по п. [29], которая содержит от 50 до 400 мг (2R)-2-пропилоктановой кислоты.
[31] Способ уменьшения замедления растворимости, связанного с хранением мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту и имеющей оболочку капсулы, содержащей желатин, глицерин и сорбит, который включает в себя доведение содержания сорбита в оболочке капсулы указанной мягкой капсулы до 20 массовых частей относительно 100 массовых частей желатина.
(2R)-2-пропилоктановая кислота по настоящему изобретению представляет собой соединение, представленное формулой (I):
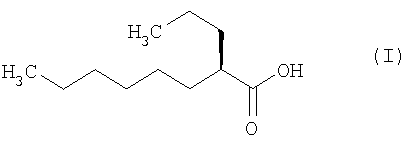
где  обозначает β-конфигурацию.
обозначает β-конфигурацию.
В соответствии с настоящим изобретением желательно, чтобы соль (2R)-2-пропилоктановой кислоты представляла собой фармакологически приемлемую соль. Желательно, чтобы фармакологически приемлемая соль не обладала токсичностью и была растворима в воде. Приемлемая соль (2R)-2-пропилоктановой кислоты включает в себя, например, соль с неорганическим основанием, соль с органическим основанием, соль с основной природной аминокислотой и т.п. В случае соли с неорганическим основанием предпочтительной является, например, соль щелочного металла (например, соль натрия, соль калия, соль лития и т.д.), соль аммония (например, соль тетраметиламмония, соль тетрабутиламмония и т.д.) и т.п. В случае соли с органическим основанием предпочтительными являются, например, соли с алкиламином (например, с метиламином, диметиламином, триметиламином, триэтиламином и т.д.), гетероциклическим амином (например, с пиридином, пиколином, пиперидином и т.д.), алканоламином (например, с этаноламином, диэтаноламином, триэтаноламином и т.д.), дициклогексиламином, N,N'-дибензилэтилендиамином, циклопентиламином, бензиламином, фенэтиламином, трис(гидроксиметил)метиламином, N-метил-D-глюкамином и т.п. Соли с основными природными аминокислотами практически не ограничиваются, поскольку они представляют собой соли с основными аминокислотами, которые представлены в природе и могут быть очищены, но предпочтительной является, например, соль с аргинином, лизином, орнитином, гистидином или сходные с ними. Среди этих солей предпочтительной является, например, соль щелочного металла, соль основной природной аминокислоты и т.п., и соль натрия является особенно предпочтительной.
(2R)-2-пропилоктановая кислота или ее соли могут быть получены в соответствии с традиционно известным способом, таким как способ, описанный в ЕР 0632008, WO 99/58513, WO 00/48982, в патенте Японии №3032447, в патенте Японии №3084354, WO 03/051852, WO 04/110972 или сходных с ними, или способом, описанным, например, в Comprehensive Organic Transformants: А Guide to Functional Group Preparations, 2 Edition (Richard C. Larock, John Wiley & Sons Inc. 1999) или сходных с ним, или произвольным сочетанием этих способов. Продукт реакции может быть очищен основными способами очистки, такими как дистилляция при нормальном давлении или при сниженном давлении, высокоэффективная жидкостная хроматография, тонкослойная хроматография или колоночная хроматография с использованием силикагеля или силиката магния, промывание, перекристаллизация и т.п. Кроме того, при необходимости он может подвергаться обработке, такой как лиофилизация.
(2R)-2-пропилоктановая кислота или ее соль практически не ограничены, поскольку они представляют собой по существу чистые и отдельные вещества, так что они могут содержать примеси (например, побочные продукты, растворители, исходные вещества и т.п., которые образуются в процессе получения или деградации их продуктов, и т.д.) в таком количестве, которое является приемлемым в качестве лекарственных примесей. Содержание примесей, приемлемых в качестве лекарственных примесей, варьирует в зависимости от того, используется ли (2R)-2-пропилоктановая кислота, или используется ее соль, а также варьирует в зависимости от содержания примесей, но в случае (2R)-2-пропилоктановой кислоты, например, желательно, чтобы содержание тяжелых металлов составляло приблизительно 20 ppm или менее, содержание S-форм в качестве их оптических изомеров составляло приблизительно 1,49% по массе или менее, содержание 2-пропанола и гептана в качестве остаточных растворителей в совокупности составляло приблизительно 5000 ppm или менее, и количество жидкости составляло приблизительно 0,2% по массе или менее. В частности, является пригодной (2R)-2-пропилоктановая кислота с оптической чистотой приблизительно 99% е.е. или более, более конкретно, (2R)-2-пропилоктановая кислота с оптической чистотой приблизительно 99,3% е.е. или более.
В соответствии с настоящим изобретением (2R)-2-пропилоктановая кислота или ее соль могут быть представлены в любой форме. Например, они могут быть жидкими или твердыми или могут быть полутвердыми с соответствующей текучестью (например, твердые, такие как гелеподобные или воскоподобные и т.д.). Такое твердое вещество может использоваться практически без ограничений, даже если оно кристаллическое или некристаллическое (аморфное) или их смесь в произвольном соотношении. Конкретно, оно может быть жидким, таким как (2R)-2-пропилоктановая кислота или воскоподобным твердым веществом, таким как натриевая соль (2R)-2-пропилоктановой кислоты.
В соответствии с настоящим изобретением в качестве (2R)-2-пропилоктановой кислоты или ее соли предпочтительными являются (2R)-2-пропилоктановая кислота и натриевая соль (2R)-2-пропилоктановой кислоты. В частности, желательной является (2R)-2-пропилоктановая кислота.
В соответствии с настоящим изобретением устойчивая при разжевывании капсула означает капсулу, из которой содержимое не легко вытекает при жевании. Несмотря на то, что в разжевывание входит намеренное разжевывание и ненамеренное разжевывание, устойчивая при разжевывании капсула по настоящему изобретению может более эффективно демонстрировать эффект в отношении того, что содержимое не легко вытекает, если разжевывание представляет собой ненамеренное разжевывание.
В соответствии с настоящим изобретением капсула может представлять собой предмет, который, как правило, специалистами в данной области называется капсулой. Например, как подробно описано ниже, она может представлять собой мягкую капсулу или твердую капсулу. В соответствии с настоящим изобретением предпочтительной является мягкая капсула. Ниже в качестве примера следует описание настоящего изобретения с использованием мягкой капсулы.
Устойчивая при разжевывании мягкая капсула, содержащая (2R)-2-пропилоктановую кислоту или ее соль, описанная в соответствии с настоящим изобретением (в дальнейшем иногда называемая капсулой по настоящему изобретению), обладает свойством: (1) имеет оболочку капсулы, содержащую (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира и (b) смягчитель, и имеющую содержание воды от 4,0 до 10,0%; и/или (2) легко распадается в желудке, предпочтительно обладает обоими из этих свойств.
В этом случае свойство (1) по настоящему изобретению относится к композиции оболочки капсулы. Аналогично случаю мягкой капсулы в целом, капсула по настоящему изобретению состоит из жидкости для наполнения капсулы и оболочки капсулы. Оболочка капсулы содержит (а) основу капсулы в виде вещества, которое становится основным каркасом оболочки капсулы и (b) смягчитель, и, если желательно, в нее может быть добавлено, например, ароматизирующее вещество (например, мятное масло, коричное масло, фруктовая эссенция, такая как земляничное ароматизирующее вещество и т.д.), антисептик (например, этилпарагидроксибензоат, пропилпарагидроксибензоат и т.д.), краситель (например, Желтый №4, Желтый №5, Красный №3, Синий №1, хлорофиллин меди и т.д.), замутнитель (например, диоксид титана, красный железооксидный пигмент, оксид железа и т.д.), вещество, изменяющее растворимость (например, ацетат фталат целлюлозы, соль щелочного металла гидроксипропилметилцеллюлозы, соль щелочного металла ацетата сукцината гидроксиметилцеллюлозы, соль щелочного металла альгиновой кислоты, метилцеллюлозу, карбоксиметилцеллюлозу, казеин, коллаген, порошкообразный агар, поливиниловый спирт, пектин и т.д.) и т.п. В этом описании такая оболочка капсулы в качестве составного компонента также содержит воду, аналогично случаю оболочки капсулы, обычно используемой в мягкой капсуле. Содержание воды в оболочке капсулы выражают с использованием индекса содержания воды, как описано ниже.
Основа капсулы для использования в оболочке капсулы по настоящему изобретению может представлять собой любое вещество, которое может использоваться в качестве основы оболочки мягкой капсулы. Например, пригодны для использования белки (например, желатин, гидролизованный желатин, коллаген, гидролизованный коллаген, казеин и т.д.), сахариды (например, крахмал, амилоза, полигалактуроновая кислота, агар, каррагенан, гуммиарабик, геллановая камедь, ксантановая смола, пектин, альгиновая кислота и т.д.), биологически деградируемые пластмассы (например, полимолочная кислота, полигидроксимасляная кислота, полиглутаминовая кислота и т.д.), гидрогенизированные жиры (например, триглицериды и диглицериды жирных кислот со средней длиной цепи (например, масло, маргарин, жир, добавляемый в тесто для рассыпчатости, масло какао и т.д.), и т.д.) и т.п. Эти основы капсул также могут использоваться в комбинации. В соответствии с настоящим изобретением белок, в частности желатин, является предпочтительным среди этих основ капсулы. Этот желатин может представлять собой любой желатин, который может использоваться в качестве основы оболочки мягкой капсулы. Например, в дополнение к тому, что обычно называют желатином, он может представлять собой обработанный щелочью желатин, обработанный кислотой желатин, желатин на основе пептидов, низкомолекулярный желатин, производное желатина, химически модифицированный желатин, сукцинированный желатин или сходные с ними. Кроме того, с точки зрения происхождения, может использоваться желатин, полученный из различных животных, таких как млекопитающие (например, крупный рогатый скот, свиньи и т.д.), рыбы (например, тиляпия, морской лещ, тунец, сом и т.д.), птицы (например, домашняя птица, страус и т.д.) и т.п. практически без ограничений.
Смягчитель для использования в оболочке капсулы по настоящему изобретению может представлять собой любое вещество, которое может использоваться в качестве смягчителя в оболочке мягкой капсулы. Например, пригодны для использования сахар (например, сахароза, белый сахар, крахмальная патока и т.д.), спирт на основе сахара (например, сорбит, ксилит, маннит и т.д.) многоатомный спирт (например, глицерин, этиленгликоль, полиэтиленгликоль, пропиленгликоль и т.д.) и сходные с ними. Более предпочтительными являются, например, глицерин, сорбит, полиэтиленгликоль и т.п., и предпочтительными являются глицерин или сорбит, особенно глицерин. Этот глицерин может представлять собой любое вещество, которое обычно называют глицерином, но, например, принятый в медицине глицерин и концентрированный глицерин являются предпочтительными, и, например, особенно предпочтительным является концентрированный глицерин.
Как описано выше, оболочка капсулы, в которой в качестве основы капсулы используется желатин, является желательной в качестве оболочки в капсуле по настоящему изобретению. Особенно желательной является оболочка капсулы, в которой используется желатин в качестве основы капсулы, и которая содержит глицерин в качестве смягчителя. Кроме того, если необходимо, такая оболочка капсулы может содержать сорбит в качестве смягчителя, и желательно, чтобы содержание сорбита составляло приблизительно 20 массовых частей или менее относительно 100 массовых частей желатина в качестве основы капсулы. Кроме того, если в состав входит сорбит, желательно, чтобы содержание глицерина также составляло приблизительно 20 массовых частей или менее относительно 100 массовых частей желатина в качестве основы капсулы. С другой стороны, если сорбит по существу не содержится, соотношение в смеси основы капсулы (в частности, желатина) и глицерина предпочтительно составляет от приблизительно 25 до приблизительно 40 массовых частей глицерина относительно 100 массовых частей основы капсулы, в частности, соотношение приблизительно 30 массовых частей глицерина относительно 100 массовых частей основы капсулы является предпочтительным.
Свойство (2) по настоящему изобретению относится к свойству капсулы распадаться. Для придания такого свойства капсуле по настоящему изобретению, композиция оболочки капсулы может быть подобрана, как описано выше, с использованием времени распада или сходных с ним такой капсулы в качестве показателя, или может быть подобрана толщина оболочки капсулы, содержание воды в оболочке капсулы или сходные с ними, как описано ниже. Время распада капсулы, необходимое для обеспечения капсулы по настоящему изобретению с описанным выше свойством способности "быстро распадаться в желудке" при испытании на распадаемость, составляет от приблизительно 3 до приблизительно 10 минут, более предпочтительно от приблизительно 5 до приблизительно 8 минут, особенно предпочтительно от приблизительно 5,7 до приблизительно 6,3 минут. Испытание на распадаемость можно проводить традиционно известным способом. Например, желательно проводить его способом, широко известным как испытание на распадаемость капсулы, в частности, испытание на распадаемость, описанное в фармакопее всех стран, более конкретно, испытание на распадаемость, описанное в Japanese Pharmacopoeia, наиболее конкретно, испытание на распадаемость, описанное в 14-ом издании Japanese Pharmacopoeia. Все мягкие капсулы, которые содержат (2R)-2-пропилоктановую кислоту или ее соль и демонстрируют описанное выше время распада при испытании на распадаемость, описанном в Japanese Pharmacopoeia, относятся к настоящему изобретению, несмотря на значения, показанные при любом другом испытании на распадаемость.
Кроме того, желательно, чтобы свойство (2) по настоящему изобретению, а именно, свойство способности "легко распадаться в желудке", не приводило к изменению со временем, связанному с хранением капсулы. Широко известно, что в зависимости от компонента жидкости для наполнения капсулы и компонента оболочки капсулы происходит замедление растворения мягкой капсулы, связанное с ее хранением. Замедление растворения означает, что при хранении мягкой капсулы со временем в оболочке капсулы происходят определенные изменения, и свойство указанной капсулы распадаться и свойство растворяться, таким образом, ухудшаются. Значит, поскольку быстрый распад и растворение во время приема внутрь не происходят в случае мягкой капсулы, в которой произошло замедление растворения, желаемый эффект лекарственного средства в некоторых случаях не может быть достигнут. Таким образом, желательно, чтобы свойство (2) по настоящему изобретению, а именно, свойство способности "легко распадаться в желудке", не приводило к изменениям со временем или почти его не приводило к ним, не приводило к так называемому замедлению растворимости или почти не приводило к нему.
Степень "замедления растворимости" можно определять, подвергая капсулу по настоящему изобретению испытанию на растворимость после произвольного периода ее хранения и сравнивая результат с исходным значением. Испытание на растворимость можно проводить традиционно известными способами. Например, желательно проводить его способом, широко известным как испытание на растворимость твердых фармацевтических препаратов для применения внутрь, таких как таблетки и капсулы, в частности, испытание на растворимость, описанное в фармакопее всех стран, более конкретно, испытание на растворимость, описанное в Japanese Pharmacopoeia, наиболее конкретно, испытание на растворимость, описанное в 14-ом издании Japanese Pharmacopoeia. Конкретно, желательно проводить его способом с лопастной мешалкой в соответствии со вторым тестом на растворимость в Japanese Pharmacopoeia, как описано ниже в примерах. В этом описании исходное значение означает значение, полученное при проведении для указанной капсулы описанного выше испытания на растворимость по существу сразу после ее получения (например, от времени сразу после получения до 10 суток или менее после получения или сходных с ними, предпочтительно от времени сразу после получения до 5 суток или менее после получения или сходных с ними, более предпочтительно от времени сразу после получения до 3 суток или менее после получения, или сходные с ними, особенно предпочтительно от времени сразу после получения до 24 часов или менее после получения и т.д.). Условия хранения для проверки степени "замедления растворимости" практически не ограничены, но, например, они могут представлять собой комнатную температуру, как в основном проводят специалисты в данной области, или могут представлять собой условия высокой температуры и/или высокой влажности, которые, как правило, называются испытанием в строгих условиях. При выборе условий с высокой температурой и/или высокой влажностью результат длительного хранения при комнатной температуре можно получать в течение более короткого периода времени.
В соответствии с настоящим изобретением "уменьшение замедления растворимости" означает, что скорость растворения после произвольного периода хранения по существу не меняется по сравнению с исходным значением (скорости растворения), или степень изменения растворимости находится в пределах 20%, предпочтительно в пределах 15%, более предпочтительно в пределах 10%. В этом случае скорость растворения может быть вычислена с помощью описанного выше испытания на растворимость. Конкретно, если количество лекарственного средства в одной капсуле, используемой для испытания на растворимость, определить как 100, то количество лекарственного средства, элюированное в исследуемой жидкости после истечения произвольного периода времени от начала испытания на растворимость, можно рассматривать как соотношение растворимостей. Например, "скорость растворения через 30 минут после начала испытания" означает скорость растворения, когда испытание на растворимость проводится в течение 30 минут. Что касается измерения количества элюированного лекарственного средства, то его можно проводить измерением поглощения в ультрафиолетовой области и можно проводить, например, с помощью высокоэффективной жидкостной хроматографии или сходных с ней. Кроме того, скорость изменения (%) можно вычислять по следующей формуле:
Скорость изменения (%) = ((А-В)/А)×100
(А: исходное значение (скорость растворения); В: скорость растворения после произвольного периода хранения).
В этом описании, хотя это очевидно специалистам в данной области, необходимо, чтобы условия испытания на растворимость для получения скорости изменения (%) были одинаковыми для образца до произвольного периода хранения и для образца после хранения. Например, если скорость изменения получена с использованием скорости растворения через 30 минут после начала испытания, то при испытании на растворимость после хранения в течение произвольного периода времени необходимо использовать значение скорости растворения через 30 минут после начала испытания на растворимость, проводимого в тех же условиях, что и для исходного значения (скорости растворения).
Несмотря на то, что условия хранения и продолжительность периода времени для проверки наличия или отсутствия замедления растворимости практически не ограничены, желательными являются условия, которые отражают его хранение в качестве лекарственного средства в больнице, аптеке, дома у пациентов и т.п. Конкретно, в качестве примера можно привести хранение при комнатной температуре, и хранение при приблизительно от 25 до приблизительно 30°С в течение 1,5 лет (например, от приблизительно 16 до приблизительно 20 месяцев или сходных с ними, предпочтительно от приблизительно 17 до приблизительно 19 месяцев и т.д.) можно привести в качестве примера, как описано ниже в "примерах" в качестве показателя в них.
В соответствии с настоящим изобретением быстрорастворимая мягкая капсула означает мягкую капсулу, из которой может высвобождаться жидкость для наполнения указанной капсулы вследствие быстрого растворения оболочки после приема капсулы внутрь. Степень "быстрого растворения" быстрорастворимой мягкой капсулы может быть выявлена различными способами испытания на растворимость, такими как способы, описанные в фармакопеях, как описано выше (например, способ с лопастной мешалкой второго испытания на растворимость в Japanese Pharmacopoeia, как описано ниже в примерах) и т.п.
В соответствии с настоящим изобретением быстрорастворимая мягкая капсула, которая содержит (2R)-2-пропилоктановую кислоту или ее соль, может представлять собой любую мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту или ее соль и демонстрирует описанные выше свойства способности к быстрому растворению. Конкретно, может быть получена мягкая капсула со скоростью растворения через 30 минут после начала испытания с помощью описанного выше испытания на растворимость приблизительно 60% или более (от приблизительно 60 до приблизительно 100%), предпочтительно приблизительно 80% или более (от приблизительно 80 до приблизительно 100%), более предпочтительно приблизительно 90% или более (от приблизительно 90 до приблизительно 100%) и т.п. Все мягкие капсулы, которые содержат (2R)-2-пропилоктановую кислоту или ее соли и удовлетворяет этому параметру, относятся к быстрорастворимой мягкой капсуле по настоящему изобретению. Испытание на растворимость можно проводить через любой промежуток времени после изготовления мягкой капсулы, но желательно, например, проводить измерения по существу сразу после получения, как описано выше. Проводя испытания на растворимость по существу сразу после получения, можно точно определить, являются ли указанные мягкие капсулы полученными в качестве быстрорастворимых мягких капсулы или нет.
В соответствии с мягкой капсулой, устойчивой при разжевывании, описанной в соответствии с настоящим изобретением, свойство устойчивости при разжевывании относится к прочности, а именно твердости, капсулы. В целях получить капсулу по настоящему изобретению с таким свойством могут быть подобраны толщина оболочки капсулы, содержание воды в оболочке капсулы и т.п. Прочность капсулы, пригодной для обеспечения капсулы по настоящему изобретению, устойчивой при разжевывании, а именно, описанное выше свойство, что "содержимое не легко вытекает при разжевывании", составляет предпочтительно приблизительно 150 ньютон (в дальнейшем, обозначается как "Н") или более, более предпочтительно от приблизительно 150 до приблизительно 400 Н, особенно предпочтительно от приблизительно 180 до приблизительно 350 Н, в частности, наиболее предпочтительно от приблизительно 193 до приблизительно 310 Н при испытании на растрескивание. Испытание на растрескивание можно проводить традиционно известным способом. Конкретно, как представлено далее в примерах, например, его можно проводить с использованием устройства для воздействия повышенным давлением, в котором образец может быть сдавлен сверху и снизу с помощью двух параллельных пластин, таком как компактный настольный универсальный прибор для испытаний, производимый Shimadzu Corp. (EZ Test-500H).
Как описано выше, оболочка капсулы по настоящему изобретению в дополнение к основе капсулы и смягчителю содержит воду, и прочность капсулы по настоящему изобретению можно подбирать регулированием количества воды, содержащейся в оболочке капсулы, а именно, содержания воды. Содержание воды в оболочке капсулы, пригодной для получения капсулы по настоящему изобретению с описанной выше прочностью, составляет от приблизительно 5,0 до приблизительно 9,0%, более предпочтительно от приблизительно 5,0 до приблизительно 8,0%, особенно предпочтительно от приблизительно 5,6 до приблизительно 7,3%. Содержание воды в оболочке капсулы можно измерять традиционно известным способом. Конкретно, как показано далее в примерах, например, оно может быть вычислено на основании следующей ниже формулы,
Содержание воды (%)
= ((масса до высушивания - масса после высушивания)/масса до высушивания)×100
с использованием оболочки капсулы в качестве образца, и измеряя ее массу (масса до высушивания) и ее массу (масса после высушивания) после высушивания образца при высокой температуре (например, 105°С и т.д.).
Толщина оболочки капсулы, пригодной для получения капсулы по настоящему изобретению с описанной выше прочностью, варьирует в зависимости от того, какую толщину из толщины оболочки, толщины первого шва и толщины второго шва измеряют. В этом случае, "толщина оболочки", "толщина первого шва" и "толщина второго шва" представляют собой термины, как правило, используемые специалистами в данной области, и "толщина оболочки" означает толщину той части, где оболочка увеличивается более всего при наполнении жидкостью для наполнения капсулы при формировании капсулы, "толщина первого шва" представляет собой толщину той части, где слой оболочки капсулы прежде всего прикрепляется при формировании капсулы, и "толщина второго шва" представляет собой толщину той части, где слой оболочки капсулы впоследствии прикрепляется при формировании капсулы. В этом описании слой оболочки капсулы означает слой, который содержит компоненты оболочки капсулы и используется в способе получения мягкой капсулы, обычно называемом способом штампования, таком как способ ротационного штампа. Способом ротационного штампа можно получать мягкую капсулу произвольной формы, такой как овального типа, круглого типа, в виде суппозиториев, продолговатого типа, в виде трубки или сходных с ними, посредством наполнения жидкостью для наполнения капсулы, в то время, как формируется два слоя оболочки капсулы с использованием цилиндра для штампования, который придает любую форму мягкой капсуле.
Толщину каждого элемента оболочки капсулы можно измерить традиционно известным способом. Например, это можно осуществить, разрезая центральную часть мягкой капсулы на круглые срезы с использованием инструмента с острыми краями, такого как ножницы или нож, вымывая находящуюся внутри жидкость с использованием органического растворителя (например, н-гексана, простого эфира, ацетона, гидрохлорфторуглерода и т.д.), и затем измеряя поверхность среза с использованием шкалы или сходных с ней при наблюдении его под оптическим микроскопом. Толщина оболочки капсулы, пригодной для получения капсулы по настоящему изобретению с описанной выше прочностью, составляет предпочтительно от приблизительно 0,05 до приблизительно 0,50 мм, более предпочтительно от приблизительно 0,10 до приблизительно 0,45 мм, особенно предпочтительно от приблизительно 0,14 до приблизительно 0,37 мм для толщины оболочки, предпочтительно от приблизительно 0,10 до приблизительно 0,55 мм, более предпочтительно от приблизительно 0,15 до приблизительно 0,50 мм, особенно предпочтительно от приблизительно 0,18 до приблизительно 0,42 мм для толщины первого шва и предпочтительно от приблизительно 0,05 до приблизительно 0,50 мм, более предпочтительно от приблизительно 0,10 до приблизительно 0,40 мм, особенно предпочтительно от приблизительно 0,14 до приблизительно 0,36 мм для толщины второго шва. Прочность капсулы по настоящему изобретению можно дополнительно повышать, изменяя любую из: толщины оболочки, толщины первого шва или толщины второго шва оболочки капсулы, предпочтительно толщину всех из них, в пределах описанных выше значений.
Таким образом, если капсула сформирована таким способом, чтобы толщина оболочки капсулы и содержание воды в оболочке капсулы соответственно находились в пределах описанных выше значений, предпочтительно, чтобы оба находились в пределах описанных выше значений, то может быть получена капсула по настоящему изобретению с описанной выше прочностью, и может быть получена капсула по настоящему изобретению с описанным выше свойством, что "содержимое не легко вытекает при разжевывании", так что она может быть получена в качестве капсулы, устойчивой при разжевывании.
В соответствии с настоящим изобретением мягкая капсула или сходные с ними, например, мягкая капсула, которая содержит (2R)-2-пропилоктановую кислоту и содержит (а) желатин и (b) приблизительно 30 массовых частей глицерина относительно 100 массовых частей желатина, где она обладает оболочкой капсулы с содержанием воды от приблизительно 5,0 до приблизительно 8,0%, толщиной оболочки от приблизительно 0,10 до приблизительно 0,45 мм, толщиной первого шва от приблизительно 0,15 до приблизительно 0,50 мм и толщиной второго шва от приблизительно 0,10 до приблизительно 0,40 мм, и показывает прочность от приблизительно 180 до приблизительно 350 Н при испытании на растрескивание, может быть приведена в пример в качестве одного из приемлемых вариантов осуществления капсулы по настоящему изобретению, имеющей обе из описанных выше характеристик (1) и (2). Поскольку для мягкой капсулы показано время распада от приблизительно 5 до приблизительно 8 минут при испытании на распадаемость, предусмотренном в Japanese Pharmacopoeia, то она представляет собой мягкую капсулу, которая имеет свойства, что содержимое не легко втекает при разжевывании, и что она легко распадается в желудке, и отвечает всем задачам в соответствии с настоящим изобретением.
Капсула по настоящему изобретению может быть получена в соответствии с традиционно известным способом получения мягкой капсулы. В частности, ее можно изготавливать получением: (1) жидкости для наполнения капсулы, содержащей (2R)-2-пропилоктановую кислоту или ее соль, и (2) раствора для оболочки капсулы, подвергая их, например, традиционно известному способу инкапсулирования, такому как способ штампования (например, способ ротационного штампа и т.д.) таким образом, чтобы толщина оболочки капсулы находилась в пределах описанного выше диапазона, содержание воды в оболочке капсулы также находилось в пределах описанного выше диапазона, и время распада, прочность и т.п. также находились в пределах описанных выше диапазонов, и затем высушивая полученную таким образом капсулу.
Раствор для оболочки капсулы может использоваться практически без ограничений, при условии, что он содержит компоненты, которые являются композицией оболочки капсулы, может образовывать тонкую оболочку (соответствует описанному выше слою для оболочки капсулы) в расплавленном состоянии или в растворенном состоянии и затвердевает при охлаждении и/или высушивании после формирования оболочки. Предпочтительно, такой раствор для оболочки капсулы может быть получен смешиванием описанной выше основы капсулы и смягчителя с соответствующим количеством воды (например, очищенной воды и т.д.). Если необходимо, в процессе получения оболочки капсулы можно проводить нагревание.
В соответствии с настоящим изобретением жидкость для наполнения капсулы, содержащая (2R)-2-пропилоктановую кислоту или ее соль, может быть получена с использованием (2R)-2-пропилоктановой кислоты или ее соли. Жидкость для наполнения капсулы может обладать соответствующей текучестью (например, текучестью, при которой жидкость можно инъецировать с использованием устройства для инкапсулирования в мягкую капсулу (например, текучестью с вязкостью от приблизительно 50000 миллипаскалей в секунду (мПа·с) или менее и т.д.), или сходных с ним), и она очевидно может представлять собой жидкость, но также может представлять собой полутвердое вещество или сходные с ним, которые представляют собой гелеподобную форму. Способ получения жидкости для наполнения капсулы можно произвольно изменять в зависимости от того, являются ли такие (2R)-2-пропилоктановая кислота или ее соль твердым веществом, жидкостью или полутвердым веществом.
Если (2R)-2-пропилоктановая кислота или ее соль представляют собой жидкость, их можно использовать непосредственно в качестве жидкости для наполнения капсулы или, если необходимо, можно использовать с добавлением пригодных дополнительных веществ. Также, их можно использовать, смешивая с жирами или сходными с ними. Жиры включают в себя, например, жирные кислоты со средней длиной цепи [например, растительное масло (например, соевое масло, хлопковое масло, сафлоровое масло, кукурузное масло, оливковое масло, кокосовое масло, масло Perilla, масло Perilla frutescens var. frutescens и т.д.), рыбий жир (например, жир печени трески и т.д.) и т.п.], триглицериды жирных кислот со средней длиной цепи (триглицериды средней цепи: МСТ) [например, Panacet (торговое название, производится Hippon Oil & Fats), ODO (торговое название, производится Hisshin Oil Mils) и т.п.] и химически синтезированные триглицериды [например, триглицериды известных композиций, липиды с известными структурами и сходные с ними, такие как 2-линолеоил-1,3-диоктаноилглицерин (8L8), 2-линолеоил-1,3-дидидеканоилглицерин (10L10)] и т.п. Эти жиры могут использоваться отдельно или в сочетании двух или более.
В отношении дополнительного вещества дополнительные вещества в препаратах для перорального введения, как правило, могут использоваться практически без ограничений. В частности, являются пригодными для использования дополнительные вещества, которые используются в препаратах мягких капсул и пероральных растворах (например, антисептическое средство, консервант, поверхностно-активное вещество, солюбилизатор, эмульгатор, растворитель, регулирующее рН средство, буферное средство, суспендирующее средство, загуститель, стабилизатор, средство, повышающее растворимость и т.д.). Если необходимо, может использоваться сочетание двух или более из этих дополнительных средств. Антисептическое средство и консервант включают в себя, например, бензойную кислоту, бензоат натрия, сорбат натрия, соединения парабензойной кислоты (например, этилпарагидроксибензоат, бутилпарагидроксибензоат, пропилпарагидроксибензоат и т.д.) и т.п. Поверхностно-активное вещество, солюбилизатор, эмульгатор и растворитель включают в себя, например, гидроксипропилметилцеллюлозу, поливинилпирролидон, сложный эфир сахарозы и жирной кислоты, полиоксиэтилен-гидрогенизированные касторовые масла, полисорбат 80, полиэтиленгликоль, глицерин, этанол, пропиленгликоль, воду (например, очищенную воду, дистиллированную воду для инъекций и т.д.) и т.п. Регулирующее рН средство и буферное средство включают в себя, например, неорганическую кислоту или основание, такое как щелочь или сходные с ней, например, хлористоводородную кислоту, гидроксид натрия, гидроксид калия или бикарбонат натрия, и также органическую кислоту, такую как лимонная кислота, яблочная кислота, виннокаменная кислота, или янтарная кислота или их соли, и т.п. рН можно регулировать способом регуляции рН, как правило, используемым в технической области пероральных растворов или в соответствии с этим способом. Суспендирующее средство и загуститель включают в себя, например, гуммиарабик, кристаллическую целлюлозу, пчелиную смолу, ксантановую смолу, желатин, метолозу и ее пищевую соль, кармеллозу и ее пищевую соль и т.п. Стабилизатор включает в себя, например, пищевую соль эдетовой кислоты, хлорид натрия, пищевую соль пиросерной кислоты и т.п. Средства, повышающие растворимость, включают в себя, например, циклодекстрин, аргинин и т.п. Эти дополнительные вещества смешиваются в соотношении, как правило, используемом в препаратах для перорального введения. Также, в дополнение к описанным выше веществам, могут использоваться дополнительные вещества, описанные, например, в традиционно известных справочных материалах, таких как "lyakuhin Tenkabuthu Jiten (Dictionary of Pharmaceutical Additives)" (под редакцией Japan Society of Pharmaceutical Additives), опубликованный Yakuji Hippo в 2000 году.
С другой стороны, если (2R)-2-пропилоктановая кислота или ее соль представляют собой твердые вещества, они могут использоваться в качестве жидкости для наполнения капсулы при их растворении, суспендировании или эмульгировании в соответствующем растворителе (например, вода (например, дистиллированная вода для инъекций, очищенная вода и т.д.), описанная выше жирная кислота со средней длиной цепи, описанный выше триглицерид жирной кислоты со средней длиной цепи или сходные с ними) в присутствии или с отсутствием соответствующего дополнительного средства. Дополнительное средство включает в себя описанные выше дополнительные средства, как правило, используемые в препаратах для перорального введения и т.п. Кроме того, если необходимо, эти дополнительные средства могут быть добавлены в виде сочетания двух или более компонентов.
Кроме того, если (2R)-2-пропилоктановая кислота или ее соль представляют собой полутвердые вещества, они могут использоваться непосредственно в качестве жидкости для наполнения капсулы аналогично случаю с жидкостью или, если необходимо, могут использоваться с добавлением соответствующего дополнительного средства. Также, аналогично случаю с твердым веществом, они могут использоваться в качестве жидкости для наполнения капсулы при их растворении, суспендировании или эмульгировании в соответствующем растворителе в присутствии или с отсутствием соответствующего дополнительного средства. При использовании дополнительного средства и растворителя при превращении полутвердого вещества в жидкость для наполнения капсулы могут использоваться указанные выше вещества.
Жидкость для наполнения капсулы, которая содержит (2R)-2-пропилоктановую кислоту, можно привести в пример в качестве предпочтительной жидкости для наполнения капсулы по настоящему изобретению. Как описано выше, (2R)-2-пропилоктановая кислота представляет собой жидкость, так что особенно желательно использовать ее непосредственно в качестве жидкости для наполнения капсулы. Кроме того, например, также желательно использовать ее, смешивая с описанными выше жирными кислотами.
Также, поскольку(2R)-2-пропилоктановая кислота представляет собой жидкость (масло), она может использоваться в качестве водной жидкости для наполнения капсулы при добавлении соответствующего средства. Дополнительное средство, пригодное для использования его в качестве водной жидкости для наполнения капсулы, включает в себя, например, соединение металла, которое демонстрирует основные свойства в водном растворе и т.п. Соединения металла, которые демонстрируют основные свойства в водном растворе, практически не ограничены, однако их примеры включают в себя соли металлов (например, одновалентные соли щелочных металлов (например, соль натрия, соль калия, соль лития, соль рубидия, соль цезия, соль франция и т.д.) или сходные с ними), слабые кислоты (например, фосфорная кислота, угольная кислота, борная кислота, сернистая кислота, органическая сульфоновая кислота, органическая карбоновая кислота с количеством атомов углерода от 2 до 6 (например, от одно- до трехвалентные органические карбоновые кислоты с количеством атомов углерода от 2 до 6, а именно, алифатическая монокарбоновая кислота, дикарбоновая кислота или трикарбоновая кислота с количеством атомов углерода от 2 до 6 и т.д.), другие органические кислоты или сходные с ними) и гидроксиды металлов (например, одновалентные гидроксиды щелочных металлов (например, гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид рубидия, гидроксид цезия, гидроксид франция и т.д.) или сходные с ними). Если необходимо, эти соединения металлов могут использоваться в виде сочетания двух или более компонентов. Если необходимо, (2R)-2-пропилоктановая кислота может использоваться в качестве водной жидкости для наполнения в капсуле по настоящему изобретению при смешивании с этими соединениями металлов, и при дополнительном смешивании с водой.
В отношении способа высушивания капсулы он может представлять собой любой способ, с помощью которого можно высушить такую капсулу при сохранении ее формы, но предпочтительно используется способ, при котором используются в сочетании два этапа высушивания, с сушильным барабаном и сушильным лотком. При проведении этих двух этапов высушивания может быть получена стандартная мягкая капсула по настоящему изобретению правильной формы. В этом описании капсула перед тем, как ее подвергают такому процессу высушивания, иногда здесь называется "капсулой до высушивания", в целях отличить ее от капсулы после высушивания.
Высушивание в сушильном барабане проводится при температуре от приблизительно 15 до приблизительно 40°С, предпочтительно от приблизительно 20 до приблизительно 35°С, особенно предпочтительно от приблизительно 23 до приблизительно 30°С в течение периода времени от нескольких часов до нескольких суток, предпочтительно от приблизительно 0,5 часа до приблизительно 1 суток, более предпочтительно от приблизительно 1 до приблизительно 12 часов, особенно предпочтительно от приблизительно 1,5 до приблизительно 6 часов.
Высушивание на сушильном лотке проводится при температуре от приблизительно 10 до приблизительно 40°С, предпочтительно от приблизительно 15 до приблизительно 35°С, особенно предпочтительно от приблизительно 20 до приблизительно 30°С, в течение периода времени от нескольких часов до нескольких суток, предпочтительно от приблизительно 6 часов до приблизительно 4 суток, более предпочтительно от приблизительно 12 часов до приблизительно 3 суток, особенно предпочтительно от приблизительно 1 до приблизительно 2 суток.
В соответствии с настоящим изобретением количество (2R)-2-пропилоктановой кислоты или ее соли, предназначенное для содержания в одной капсуле, практически не ограничено. Предпочтительной является мягкая капсула, в которой содержится (2R)-2-пропилоктановая кислота или ее соль в количестве от приблизительно 30 до приблизительно 600 мг, более предпочтительно от приблизительно 50 до приблизительно 400 мг, особенно предпочтительно от приблизительно 100 до приблизительно 300 мг в 1 капсуле. Особенно пригодной является мягкая капсула, которая содержит приблизительно 100 мг или приблизительно 300 мг (2R)-2-пропилоктановой кислоты или ее соли на капсулу.
Если необходимо, при получении описанным выше способом, для капсулы по настоящему изобретению применим произвольный способ упаковывания. Такая упаковка может, например, представлять собой не единичную упаковку без индивидуальной упаковки (например, упаковка россыпью) или сходные с ними, однако, желательной является, например, герметичная упаковка, такая как термическая упаковка, в которой лекарственное средство герметично упаковано в термоклейкую пленку. В этом описании, например, упаковка с использованием "герметичного контейнера" или "герметично закрытого контейнера", как представлено в Pharmacopoeia, также включена в своем значении в герметичную упаковку по настоящему изобретению. РТР упаковка (упаковка спрессовыванием), SP упаковка (контурная упаковка) и т.п. включены в термическую упаковку, и особенно желательной является упаковка РТР. Материал для упаковки РТР включает в себя PVC (поливинилхлорид), PVDC (поливинилиденхлорид), покрытый PVC (поливинилхлоридом), РР (полипропилен), многослойную систему полипропилена и т.п. Желательно, чтобы упаковка РТР использовалась совместно с алюминиевой упаковкой. Кроме того, после осуществления упаковывания РТР или упаковывания SP, определенное количество капсул по настоящему изобретению может подвергаться вторичному упаковыванию с использованием полиэтилена или алюминиевой фольги (так называемая подушечная упаковка).
Свойство "легко распадаться в желудке" и свойство, что "содержимое не легко вытекает при разжевывании", которыми обладает капсула по настоящему изобретению, также применимы, если вместо (2R)-2-пропилоктановой кислоты или ее соли в качестве жидкости для наполнения капсулы используется соединение, вызывающее раздражение в полости рта.
В этом описании соединения, вызывающие раздражение в полости рта, практически не ограничены, поскольку они представляют собой соединения, которые вызывают неприятный вкус (например, остроту, боль, горечь, ощущение жжения и т.д.), если такое соединение попадает в полость рта. Вызывает или не вызывает оно неприятный вкус в полости рта, можно легко определить, проведя традиционно известное испытание, которое, как правило, называют сенсорной пробой. Соединения, вызывающие раздражение в полости рта, включают в себя, например, L-триптофан, L-метионин, L-лизин, L-лейцин, азитромицин, аминопирин, аминофиллин, эритромицин, казеин, кофеин, кларитромицин, хлорамфеникол, горечавку, сапонин, дигитоксин, цикланделат, сульпирин, цефалексин, Swertia japonica, танин, тетрациклин, пантотенат кальция, фенобарбитал, оксапиума иодид, лимонен, ресцинамин, хлорид калия, хлорид берберина, гидрохлорид азеластина, гидрохлорид аминогуанидина, гидрохлорид этилэфрина, гидрохлорид хинина, дилтиазема гидрохлорид, цефотиам гексетила гидрохлорид, цефканел далоксата гидрохлорид, талампициллина гидрохлорид, тиклопидина гидрохлорид, донепезила гидрохлорид, бакампициллина гидрохлорид, папаверина гидрохлорид, гидрохлорид гидралазина, пропранолола гидрохлорид, прометазина гидрохлорид, меклофеноксата гидрохлорид, ленампициллина гидрохлорид, декстрометорфана гидробромид, сульфат хинина, сульфат магния, класс витаминов В (например, тиамин, рибофлавин, пиридоксин, цианкобаламин или их производные и т.д.) и т.п.
Инкапсулирование соединения, вызывающего раздражение в полости рта, в капсулу может быть осуществлено в соответствии со случаем, описанным выше для (2R)-2-пропилоктановой кислоты или ее соли. Аналогично случаю описанной выше мягкой капсулы, которая содержит (2R)-2-пропилоктановую кислоту или ее соль, мягкая капсула, которая в качестве ингредиента содержит соединение, вызывающее раздражение в полости рта, полученная тем же способом, что описано выше, представляет собой мягкую капсулу, которая легко распадается в желудке и устойчива при разжевывании, а именно, ее содержимое не легко вытекает при разжевывании.
С другой стороны, как описано выше, свойства капсулы по настоящему изобретению быть полученной в форме мягкой капсулы, а именно, свойство "легко распадаться в желудке" и свойство, что "содержимое не легко вытекает при разжевывании", также применимы к случаю, когда (2R)-2-пропилоктановая кислота или ее соль инкапсулированы в твердую капсулу.
Твердая капсула, как правило, состоит из двух частей крышечки и корпуса, и ее получают в такой форме, чтобы лекарственный компонент был инкапсулирован в ней. В целях получить такую твердую капсулу со свойством "легко распадаться в желудке" и свойством, что "содержимое не легко вытекает при разжевывании", такая капсула может быть получена таким образом, чтобы она показывала прочность предпочтительно приблизительно 150 ньютон (в дальнейшем обозначается Н) или более, более предпочтительно от приблизительно 150 до приблизительно 400 Н, особенно предпочтительно от приблизительно 180 до приблизительно 350 Н, в частности, наиболее предпочтительно от приблизительно 193 до приблизительно 310 Н при испытании на растрескивание, и также демонстрирует время распада от приблизительно 3 до приблизительно 10 минут, более предпочтительно от приблизительно 5 до приблизительно 8 минут, особенно предпочтительно от приблизительно 5,7 до приблизительно 6,3 минут при испытании на распадаемость, аналогично случаю описанной выше мягкой капсулы.
Получение такой твердой капсулы может быть осуществлено в соответствии с традиционно известным способом (например, шнековым способом, способом компрессии, способом прессования, дисковым способом и т.д.). Кроме того, если в качестве вещества для наполнения капсулы используется жидкое вещество, желательно запаивать область соединения отдельно, или выбирать такой размер, чтобы во время их соединения происходило закрывание, в целях предотвращения вытекания жидкости из соединения крышечки и корпуса.
Применение в фармации
Капсула по настоящему изобретению, содержащая (2R)-2-пропилоктановую кислоту или ее соли в качестве активного ингредиента, является пригодной для профилактики, лечения и/или ослабления, например, нейродегенеративного заболевания, невропатии или заболевания, при котором требуется регенерация нервов или замедления их прогрессирования у млекопитающих (например, человека, животных, не относящихся к человеку, например, обезьян, овец, крупного рогатого скота, лошадей, животных из семейства псовых, животных из семейства кошачьих, кроликов, крыс, мышей и т.д.).
Нейродегенеративное заболевание включает в себя все заболевания, сопровождающиеся дегенерацией нервных клеток, и не ограничивается с точки зрения его причины. Нейродегенеративное заболевание в соответствии с настоящим изобретением также включает в себя невропатию или заболевание, при котором требуется регенерация нервов. Нервная клетка может представлять собой клетку любого типа нервных клеток в живом организме, включая сюда, например, нервы центральной нервной системы (например, черепно-мозговые нервы, спинномозговые нервы и т.д.), периферические нервы (например, автономную нервную систему (например, симпатический нерв, парасимпатический нерв и т.д.) и т.д.) и т.д. Нейродегенеративное заболевание представляет собой, например, заболевание нервов центральной нервной системы, включая сюда болезнь Паркинсона, синдром Паркинсона, болезнь Альцгеймера, болезнь Дауна, боковой амиотрофический склероз, семейный боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Гентингтона, спинально-церебеллярную атаксию, дентато-рубро-паллидо-льюисову атрофию, оливопонтоцеребеллярную атрофию, кортикобазальную дегенерацию, семейную деменцию, лобно-височную деменцию, сенильную деменцию, диффузное заболевание с тельцами Леви, стриатонигральную дегенерацию, хореоатетоз, дистонию, синдром Мейгса, позднюю кортикальную мозжечковую атрофию, семейную спастическую параплегию, болезнь двигательного нейрона, болезнь Мачадо-Джозефа, болезнь Пика, дисфункцию нервов после церебральной апоплексии (например, после кровоизлияния в мозг (например, гипертензивного внутримозгового кровоизлияния и т.д.), церебрального инфаркта (например, церебрального тромбоза, церебрального эмбола и т.д.), транзиторной ишемической атаки, субарахноидального кровоизлияния и т.д.), дисфункцию нервов после цереброспинального повреждения, демиелинизирующее заболевание (например, рассеянный склероз, синдром Гийена-Барре, острый диссеминированный энцефаломиелит, острый церебеллит, поперечный миелит и т.д.), опухоль мозга (например, астроцитому и т.д.), цереброспинальное заболевание вследствие инфекции (например, менингит, церебральный абсцесс, болезнь Крейтцфельда-Якоба, деменцию при СПИДе и т.д.), психическое заболевание (шизофрению, маниакально-депрессивный психоз, невроз, психосоматическое заболевание, эпилепсию и т.д.) и т.п. Более предпочтительно нейродегенеративное заболевание представляет собой болезнь Паркинсона, синдром Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз, семейный боковой амиотрофический склероз или сходные с ними.
Невропатия включает в себя все виды дисфункции нервов. То есть невропатия, главным образом, включает в себя нарушения, распознаваемые как симптом при заболевании. Например, болезнь Паркинсона или синдром Паркинсона сопровождаются, например, тремором, ригидностью мышц (ригидность), брадикинезией, постуральными нарушениями, вегетативной дистонией, толчковыми движениями, нарушениями походки, ментальными симптомами и т.д. Например, болезнь Альцгеймера сопровождается симптомами деменции; боковой амиотрофический склероз или семейный боковой амиотрофический склероз сопровождается атрофией мышц, слабостью мышц, дисфункцией верхней конечности, нарушением походки, дизартрией, дисфагией, респираторными нарушениями и т.д.
Заболевание, при котором требуется регенерация нервов, означает такие заболевания, при которых абсолютное количество нервных клеток снижается вследствие недостатка количества нервных клеток с повреждением нормальной невральной функции, включая сюда, например, приведенное выше нейродегенеративное заболевание в таком состоянии. При таком заболевании, для его лечения клетки, способные образовывать нормальные нервы (например, стволовые нервные клетки, клетки-предшественники нервных клеток, нервные клетки, другие стволовые клетки, клетки глии и т.д.), трансплантируют хирургически или активируют собственные такие клетки для регенерации нерва. Капсулы по настоящему изобретению можно вводить временно или постоянно во время трансплантации указанных выше клеток или активации собственных клеток для ускорения регенерации нервов.
Кроме того, капсула по настоящему изобретению также пригодна для ускорения регенерации нервов или в качестве ингибитора повышения S100β. Капсула по настоящему изобретению может быть введена перорально в живой организм с целью профилактики, лечения и/или замедления прогрессирования упомянутых выше заболеваний. В соответствии с настоящим изобретением термин "профилактика" означает предотвращение начала самого заболевания; "лечение" означает доведение состояния заболевания до выздоровления; и "замедление прогрессирования" означает замедление ухудшения или остановку прогрессирования состояния.
Суточная доза капсул по настоящему изобретению практически не ограничена, вследствие того, что она варьирует в зависимости от степени выраженности симптомов; возраста, пола и массы тела объекта, которому их намереваются вводить; периода и интервала введения; вида активного ингредиента и т.п., однако, например, если их вводят перорально в качестве терапевтического средства при нейродегенеративном заболевании, таком как болезнь Паркинсона, синдром Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз или семейный боковой амиотрофический склероз, и если они содержат (2R)-2-пропилоктановую кислоту в качестве активного ингредиента, то капсулы, содержащие от приблизительно 50 до приблизительно 5000 мг, более предпочтительно от приблизительно 100 до приблизительно 1200 мг (2R)-2-пропилоктановой кислоты, вводят в качестве суточной дозы.
При использовании капсулы по настоящему изобретению, в сочетании с ней могут использоваться другие лекарственные средства. Другое лекарственное средство, которое может использоваться в сочетании с капсулой по настоящему изобретению, включает в себя, например, противосудорожный препарат (например, фенобарбитал, мефобарбитал, метарбитал, примидон, фенитоин, этотоин, триметадион, этосуксимид, ацетилфенитрид, карбамазепин, ацетазоламид, диазепам, вальпроат натрия и т.д.), ингибитор ацетилхолинэстеразы (например, донепезила гидрохлорид, ТАК-147, ривастигмин, галантамин и т.д.), нейротрофический фактор (например, ABS-205 и т.д.), ингибитор альдозоредуктазы, антитромботическое средство (например, t-PA, гепарин), пероральный антикоагулянт (например, варфарин и т.д.), лекарственное средство с синтетическим антитромбином (например, габексат мезилат, нафамостат мезилат, аргатробан и т.д.), антитромбоцитарное лекарственное средство (например, аспирин, дипиридамол, тиклопидина гидрохлорид, берапрост натрий, цилостазол, натрий озагрел и т.д.), тромболитическое средство (например, урокиназу, тизокиназу, альтеплазу и т.д.), ингибитор фактора Ха, ингибитор фактора VIIa, средство, улучшающее церебральный кровоток и метаболизм (например, идебенон, кальций гопантенат, амантадина гидрохлорид, меклофеноксата гидрохлорид, дигидроэрготоксина мезилат, пиритиоксина гидрохлорид, γ-аминомасляную кислоту, бифемелана гидрохлорид, лизурида малеат, инделоксазина гидрохлорид, ницерголин, пропентофиллин и т.д.), антиоксидант (например, эдаравон и т.д.), препарат глицерина (например, глицерин и т.д.), ингибитор β-секретазы (например, 6-(4-бифенилил)метокси-2-[2-(N,N-диметиламино)этил]тетралин, 6-(4-бифенилил)метокси-2-(N,N-диметиламино)метилтетралин, 6-(4-бифенилил)метокси-2-(N,N-дипропиламино)метилтетралин, 2-(N,N-диметиламино)метил-6-(4'-метоксибифенил-4-ил)метокситетралин, 6-(4-бифенилил)метокси-2-[2-(N,N-диэтиламино)этил]тетралин, 2-[2-(N,N-диметиламино)этил]-6-(4'-метилбифенил-4-ил)метокситетралин, 2-[2-(N,N-диметиламино)этил]-6-(4'-метоксибифенил-4-ил)метокситетралин, 6-(2',4'-диметоксибифенил-4-ил)метокси-2-[2-(N,N-диметиламино)этил]тетралин, 6-[4-(1,3-бензодиокол-5-ил)фенил]метокси-2-[2-(N,N-диметиламино)этил]тетралин, 6-(3',4'-диметоксибифенил-4-ил)метокси-2-[2-(N,N-диметиламино)этил]тетралин и их оптические изомеры, соли и гидраты, ОМ99-2 (WO 01/00663) и т.д.), ингибитор агрегации β-амилоидного белка (например, PTI-00703, ALZHEMED (НС-531), PPI-368 (JP-T-11-514333), PPI-558 (JP-T-2001-500852), SKF-74652 (Biochem. J., 340(1), 283-289 (1999)) и т.д.), активатор церебральной функции (например, анирацетам, ницерголин и т.д.), агонист рецепторов дофамина (например, L-дофа, бромкриптин, перголид, талипексол, прамипексол, каберголин, амантадин и т.д.), ингибитор моноаминооксидазы (МАО) (например, сафразин, депренил, селегилин, рамацемид, рилузол и т.д.), антихолинергическое лекарственное средство (например, тригексилфенидил, бипериден и т.д.), ингибитор КОМТ (например, энтакапон и т.д.), терапевтическое средство от бокового амиотрофического склероза (например, рилузол, нейротрофический фактор и т.д.), терапевтическое средство на основе статинов от гиперлипидемии (например, правастатин натрия, аторвастатин, симвастатин, розувастатин и т.д.), терапевтическое средство на основе фибратов от гиперлипидемии (например, клофибрат и т.д.), ингибитор апоптоза (например, CPI-1189, IDH-6556, СЕР-1347 и т.д.), активатор дифференцировки и регенерации нервов (например, летеприним, ксалипроден (SR-57746-A), SB-216763 и т.д.), нестероидное противовоспалительное средство (например, мелоксикам, теноксикам, индометацин, ибупрофен, целекоксиб, рофекоксиб, аспирин, индометацин и т.д.), стероидное лекарственное средство (например, дексаметазон, гексестрол, ацетат кортизона и т.д.), половой гормон или его производные (например, прогестерон, эстрадиол, бензоат эстрадиола и т.д.) или сходные с ними. Более того, его также можно комбинировать с регулятором никотиновых рецепторов, ингибитором γ-секретазы, β-амилоидной вакциной, ферментом, участвующим в деградации β-амилоида, ингибитором синтетазы сквалена, терапевтическим средством от аномального поведения, аномалии движений или сходных с ними, ассоциированных с прогрессированием деменции, гипотензивными средствами, терапевтическими средствами от сахарного диабета, антидепрессантом, анксиолитиком, смягчающим течение заболевания противоревмотоидным средством, антицитокиновым средством (например, ингибитором THF, ингибитором МАР-киназы и т.д.), паратиреоидным гормоном (РТН), антагонистом кальциевых рецепторов или сходными с ними.
Эти сочетания лекарственных средств являются только иллюстрациями и не ограничиваются ими. Способы введения этих сочетаний лекарственных средств практически не ограничены, они могут представлять собой пероральное введение или парентеральное введение. Также эти лекарственные средства могут быть введены в любом сочетании двух или более средств. Более того, лекарственные средства для комбинированного использования включают в себя лекарственные средства, которые были разработаны, а также лекарственные средства, которые будут разработаны в будущем, на основании механизма, описанного выше.
Токсичность
Токсичность капсулы, содержащей (2R)-2-пропилоктановую кислоту или ее соль в соответствии с настоящим изобретением, очень низкая, и она рассматривается как достаточно безопасная для использования в качестве фармацевтического лекарственного средства.
Эффект изобретения
В соответствии с настоящим изобретением может быть получена мягкая капсула, содержащая соединение, вызывающее раздражение в полости рта, в частности, (2R)-2-пропилоктановую кислоту или ее соли, которые являются пригодными в качестве средства для профилактики, лечения и/или замедления прогрессирования симптомов различных нейродегенеративных заболеваний и т.п. Поскольку такая мягкая капсула обладает свойством легко распадаться в желудке и свойством, что содержимое не легко вытекает при разжевывании, она представляет собой превосходный фармацевтический препарат, который можно безопасно принимать внутрь без ощущения остроты, боли, ощущения жжения и т.п. в полости рта и который может демонстрировать свои фармакологические эффекты вследствие его быстрого всасывания, например, даже если пожилые люди или сходные с ними разжевывают ее по ошибке во время приема.
Кроме того, поскольку мягкая капсула, которую получают в соответствии с настоящим изобретением, может выдерживать длительное хранение без замедления растворимости, то она может быть предложена для клинической области в качестве мягкой капсулы, которая сохраняет превосходное качество.
Лучший вариант осуществления изобретения
Настоящее изобретение подробно описано ниже на основании примеров, однако настоящее изобретение не ограничивается ими. Кроме того, оно может быть изменено в пределах объема настоящего изобретения, не отклоняясь от него.
В этом описании, в дополнение к мягкой капсуле, которая содержит (2R)-2-пропилоктановую кислоту, также описаны результаты исследований с использованием мягкой капсулы, содержащей триглицериды жирных кислот со средней длиной цепи (триглицериды средней цепи: МСТ). Хотя МСТ не является соединением, вызывающим раздражение в полости рта, то, что мягкая капсула, содержащая МСТ, и мягкая капсула, содержащая (2R)-2-пропилоктановую кислоту, обладают одинаковым свойством легко распадаться в желудке и свойством, что содержимое не легко вытекает при разжевывании, подтверждает эффект настоящего изобретения, что содержимое мягкой капсулы может представлять собой любое соединение.
Пример 1
Получение мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг)
Пример 1-1
Композиция оболочки капсулы. Бычий желатин:глицерин = 100:30
Бычий желатин (20 кг) и концентрированный глицерин (6 кг) смешивали при 70°С в присутствии очищенной воды (20 кг) с получением однородного раствора. Этот раствор и (2R)-2-пропилоктановую кислоту (0,9 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производится Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая полученные таким образом "капсулы до высушивания" высушиванию в сушильном барабане (24°С, 3 часа) и высушиванию на лотке (29°С, от 15 до 45 часов) в указанном порядке, получали мягкие капсулы (2100 капсул), содержащие 300 мг (2R)-2-пропилоктановой кислоты в одной капсуле. Проводя указанную процедуру 6 раз, в целом получали 7 партий мягких капсул. Время высушивания на лотке соответствующих партий составляло 27 часов в случае партий с #1 по #5, 15 часов в случае партии #6 и 45 часов в случае партии #7.
Пример 1-2
Композиция оболочки капсулы. Свиной желатин:глицерин = 100:30
Свиной желатин (20 кг) и концентрированный глицерин (6 кг) смешивали при 75°С в присутствии очищенной воды (16 кг) с получением однородного раствора. Этот раствор и (2R)-2-пропилоктановую кислоту (1,8 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производится Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая таким образом "капсулы до высушивания" высушиванию в сушильном барабане (23,5°С, 3 часа) и высушиванию на лотке (29°С, 27 часов) в указанном порядке, получали мягкие капсулы (5700 капсул), содержащие 300 мг (2R)-2-пропилоктановой кислоты в одной капсуле.
Пример 2
Получение мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг)
Пример 2-1
Композиция оболочки капсулы. Бычий желатин:глицерин = 100:30
Бычий желатин (15 кг) и концентрированный глицерин (4,5 кг) смешивали при 70°С в присутствии очищенной воды (15 кг) с получением однородного раствора. Этот раствор и (2R)-2-пропилоктановую кислоту (1,0 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производиться Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая полученные таким образом "капсулы до высушивания" высушиванию в сушильном барабане (22°С, 4 часа) и высушиванию на лотке (28,5°С, 26 часов) в указанном порядке, получали мягкие капсулы (3000 капсул), содержащие 100 мг (2R)-2-пропилоктановой кислоты в одной капсуле. Проводя указанную процедуру еще один раз, получали всего 2 партии мягких капсул.
Пример 2-2
Композиция оболочки капсулы. Свиной желатин:глицерин = 100:30
Свиной желатин (20 кг) и концентрированный глицерин (6 кг) смешивали при 75°С в присутствии очищенной воды (16 кг) с получением однородного раствора. Этот раствор и (2R)-2-пропилоктановую кислоту (1,2 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производиться Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая полученные таким образом "капсулы до высушивания" высушиванию в сушильном барабане (23,5°С, 3 часа) и высушиванию на лотке (29°С, 27 часов) в указанном порядке, получали мягкие капсулы (5300 капсул), содержащие 100 мг (2R)-2-пропилоктановой кислоты в одной капсуле.
Пример 3
Измерение толщины оболочки мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту
Толщину оболочки капсулы (толщина оболочки, толщина первого шва, толщина второго шва) в мягких капсулах, содержащих (2R)-2-пропилоктановую кислоту, полученных в соответствии с примером 1 и примером 2, и в содержащих МСТ мягких капсулах, полученных указанным способом с использованием триглицеридов жирных кислот со средней длиной цепи (триглицериды средней цепи: МСТ) вместо (2R)-2-пропилоктановой кислоты, измеряли следующим ниже способом.
<Способ>
(1) Центральную часть капсулы разрезали на круглые срезы с использованием ножа.
(2) Жидкость для наполнения капсулы вымывали с использованием н-гексана и быстро вытирали с использованием куска ткани.
(3) Толщину оболочки капсулы измеряли, наблюдая плоскость среза под оптическим микроскопом с использованием шкалы в качестве стандарта.
(4) Измеряя толщину каждой части (толщина оболочки, толщина первого шва, толщина второго шва) от 5 до 10 образцов из каждой партии, вычисляли максимальное значение (Мах), минимальное значение (Min) и среднее значение (Mean).
<Результаты>
Результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, представлены в таблице 1, а результаты для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 2, результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, и для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 3, и результаты для мягкой капсулы, полученной с использованием свиного желатина, представлены в таблице 4. В этом описании выражение "Активное вещество" в приведенных ниже таблицах означает мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту в качестве жидкости для наполнения капсулы, а выражение "МСТ" означает мягкую капсулу, которая содержит МСТ в качестве жидкости для наполнения капсулы.
Для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, толщина оболочки составляла от 0,145 до 0,320 мм, толщина первого шва составляла от 0,183 до 0,411 мм, и толщина второго шва составляла от 0,140 до 0,300 мм. Также, для мягкой капсулы, содержащей МСТ, полученной таким же способом, толщина оболочки составляла от 0,160 до 0,333 мм, толщина первого шва составляла от 0,224 до 0,452 мм, и толщина второго шва составляла от 0,156 до 0,303 мм.
Для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, толщина оболочки составляла от 0,230 до 0,365 мм, толщина первого шва составляла от 0,201 до 0,362 мм, и толщина второго шва составляла от 0,210 до 0,353 мм. Также, для мягкой капсулы, содержащей МСТ, полученной таким же способом, толщина оболочки составляла от 0,248 до 0,388 мм, толщина первого шва составляла от 0,204 до 0,400 мм, и толщина второго шва составляла от 0,230 до 0,306 мм.
Для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием свиного желатина, толщина оболочки составляла от 0,157 до 0,205 мм, толщина первого шва составляла от 0,222 до 0,294 мм, и толщина второго шва составляла от 0,154 до 0,179 мм. Также, для мягкой капсулы, содержащей МСТ, полученной таким же способом, толщина оболочки составляла от 0,193 до 0,212 мм, толщина первого шва составляла от 0,268 до 0,329 мм, и толщина второго шва составляла от 0,173 до 0,198 мм.
Для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием свиного желатина, толщина оболочки составляла от 0,212 до 0,243 мм, толщина первого шва составляла от 0,208 до 0,235 мм, и толщина второго шва составляла от 0,237 до 0,257 мм. Также, для мягкой капсулы, содержащей МСТ, полученной таким же способом, толщина оболочки составляла от 0,213 до 0,275 мм, толщина первого шва составляла от 0,187 до 0,243 мм, и толщина второго шва составляла от 0,241 до 0,298 мм.
Пример 4
Определение содержания воды в оболочке мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту
Содержание воды в оболочке капсулы в мягких капсулах, содержащих (2R)-2-пропилоктановую кислоту, полученных в соответствии с примером 1 и с примером 2, и в мягких капсулах, содержащих МСТ, полученных таким же способом с использованием МСТ вместо (2R)-2-пропилоктановой кислоты, определяли следующим ниже способом.
<Способ>
(1) Сосуд для взвешивания объемом 10 мл заранее подготавливали и нагревали до 105°С.
(2) Капсулу рассекали с использованием ножниц в растворителе (н-гексане) для вымывания жидкости для наполнения капсулы.
(3) Растворитель вытирали с помощью куска ткани, и оболочку капсулы нарезали на куски размером приблизительно от 2 до 4 мм с использованием ножниц.
(4) Указанную процедуру проводили для от 10 до 20 образцов из каждой партии.
(5) Приблизительно 1 г тонко нарезанной оболочки капсулы помещали в сосуд для взвешивания для измерения массы образца перед высушиванием, а затем сушили при 105°С в течение 2 часов.
(6) Определяли массу образца после высушивания, и содержание воды вычисляли с использованием следующей формулы.
Содержание воды (%)
= ((масса до высушивания - масса после высушивания)/масса до высушивания)×100
<Результаты>
Результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, представлены в таблице 5, а результаты для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 6, результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, и для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 7, и результаты для мягкой капсулы, полученной с использованием свиного желатина, представлены в таблице 8. В этом описании, аналогично описанному выше случаю, выражение "Активное вещество" означает мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту в качестве жидкости для наполнения капсулы, а выражение "МСТ" означает мягкую капсулу, которая содержит МСТ в качестве жидкости для наполнения капсулы.
Содержание воды в мягкой капсуле, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, составляло от 5,6 до 7,3% (среднее значение среди партий 6,6%). Также, содержание воды в мягкой капсуле, полученной таким же способом, составляло от 5,8 до 6,5% (среднее значение среди партий 6,3%).
Содержание воды в мягкой капсуле, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, составляло от 5,6 до 6,9% (среднее значение среди партий 6,3%). Также, содержание воды в мягкой капсуле, полученной таким же способом, составляло от 5,9 до 7,0% (среднее значение среди партий 6,5%).
Содержание воды в мягкой капсуле, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием свиного желатина, составляло 6,9%. Также, содержание воды в мягкой капсуле, полученной таким же способом, составляло 7,1%.
Содержание воды в мягкой капсуле, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием свиного желатина, составляло 6,7%. Также, содержание воды в мягкой капсуле, полученной таким же способом, составляло 6,8%.
Пример 5
Определение прочности мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту
Прочность капсулы (нагрузку, вызывающую образование трещин) для мягких капсул, содержащих (2R)-2-пропилоктановую кислоту, полученных в соответствии с примером 1 и с примером 2, и для мягких капсул, содержащих МСТ, полученных таким же способом с использованием МСТ вместо (2R)-2-пропилоктановой кислоты, определяли следующим способом.
<Способ>
(1) Каждой капсуле позволяли стоять на измерительной части небольшого настольного устройства для испытания, которое производится Shimadzu Corp. (EZ Test-500H), таким образом, чтобы нижняя плоскость и присоединяемая плоскость были параллельными.
(2) Повышение давления осуществлялось со скоростью 20 мм/мин с использованием компрессионного устройства диаметром 20 мм.
(3) Нагрузку в момент времени, когда капсула раскалывается (максимальную нагрузку), определяли для 5 образцов из каждой партии, и вычисляли среднее значение (Mean).
<Результаты>
Результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, представлены в таблице 9, а результаты для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 10, результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, и для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 11, и результаты для мягкой капсулы, полученной с использованием свиного желатина, представлены в таблице 12. В этом описании, аналогично описанному выше случаю, выражение "Активное вещество" означает мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту в качестве жидкости для наполнения капсулы, а выражение "МСТ" означает мягкую капсулу, которая содержит МСТ в качестве жидкости для наполнения капсулы.
Прочность мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, составляла от 280,6 до 306,2 Н (среднее значение среди партий 294,2 Н). Также, прочность мягкой капсулы, содержащей МСТ, полученной таким же способом, составляла от 268,5 до 331,3 Н (среднее значение среди партий 290,2 Н).
Прочность мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, составляла от 193,5 до 255,8 Н (среднее значение среди партий 224,7 Н). Также, прочность мягкой капсулы, содержащей МСТ, полученной таким же способом, составляла от 196,7 до 209,5 Н (среднее значение среди партий 203,1 Н).
Прочность мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием свиного желатина, составляла 273,1 Н. Также, прочность мягкой капсулы, полученной таким же способом, составляла 289,2 Н.
Прочность мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием свиного желатина, составляла 235,1 Н. Также, прочность мягкой капсулы, полученной таким же способом, составляла 274,7 Н.
Пример 6
Определение времени распада мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту
Время распада капсулы 6 образцов из каждой партии измеряли в соответствии с испытанием на распадаемость (капсул), описанном в 14-м издании Japanese Pharmacopoeia, для мягких капсул, содержащих (2R)-2-пропилоктановую кислоту, полученных в соответствии с примером 1 и с примером 2, и для мягких капсул, содержащих МСТ, полученных таким же способом с использованием МСТ вместо (2R)-2-пропилоктановой кислоты, и вычисляли среднее значение (Mean).
<Результаты>
Результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, представлены в таблице 13, а результаты для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 14, результаты для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, и для мягкой капсулы, содержащей МСТ, полученной таким же способом, представлены в таблице 15, и результаты для мягкой капсулы, полученной с использованием свиного желатина, представлены в таблице 16. В этом описании, аналогично описанному выше случаю, выражение "Активное вещество" означает мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту в качестве жидкости для наполнения капсулы, а выражение "МСТ" означает мягкую капсулу, которая содержит МСТ в качестве жидкости для наполнения капсулы.
Время распада мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием бычьего желатина, составляло от 5,7 до 6,3 минуты (среднее значение среди партий 6,0 минут). Также, время распада мягкой капсулы, содержащей МСТ, полученной таким же способом, составляло от 6,2 до 7,5 минуты (среднее значение среди партий 6,9 минуты).
Время распада мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием бычьего желатина, составляло от 5,8 до 6,0 минут (среднее значение среди партий 5,9 минут). Также, время распада мягкой капсулы, содержащей МСТ, полученной таким же способом, составляло от 6,0 до 7,0 минут (среднее значение среди партий 6,5 минут).
Время распада мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (300 мг), полученной с использованием свиного желатина, составляло 5,5 минуты. Также, время распада мягкой капсулы, содержащей МСТ, полученной таким же способом, составляло 6,8 минуты.
Время распада мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту (100 мг), полученной с использованием свиного желатина, составляло 6,2 минуты. Также, время распада мягкой капсулы, содержащей МСТ, полученной таким же способом, составляло 7,2 минуты.
Пример 7
Испытание на разжевывание мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту
Затрудненность дробления капсулы зубами для мягких капсул, содержащих (2R)-2-пропилоктановую кислоту, полученных в соответствии с примером 1 и примером 2, и для мягких капсул, содержащих МСТ, полученных таким же способом с использованием МСТ вместо (2R)-2-пропилоктановой кислоты, оценивали следующим способом.
<Способ>
(1) Мягкие капсулы дробили зубами без проглатывания 10 участников испытаний.
(2) Затрудненность дробления их зубами оценивали с помощью трех степеней (могут быть легко раздроблены зубами или очень легко; могут быть с трудом раздроблены зубами; не могут быть раздроблены зубами).
<Результаты>
Результаты для мягких капсул, полученных с использованием бычьего желатина, представлены в таблице 17, а результаты для мягких капсул, полученных с использованием свиного желатина, представлены в таблице 18. В этом описании, аналогично описанному выше случаю, выражение "Активное вещество" означает мягкую капсулу, которая содержит (2R)-2-пропилоктановую кислоту в качестве жидкости для наполнения капсулы, и выражение "МСТ" означает мягкую капсулу, которая содержит МСТ в качестве жидкости для наполнения капсулы.
Оба вида мягких капсул, содержащих (2R)-2-пропилоктановую кислоту, полученных в соответствии с примером 1 и с примером 2, и мягких капсул, содержащих МСТ, полученных таким же способом с использованием МСТ вместо (2R)-2-пропилоктановой кислоты, могут быть с трудом раздроблены зубами или не могут быть раздроблены зубами. Таким образом, считается, что такие мягкие капсулы являются устойчивыми при разжевывании.
Пример 8
Оценочные испытания замедления растворимости для мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту
Мягкие капсулы, содержащие (2R)-2-пропилоктановую кислоту, получали с составами с 1А по 5А (препараты с 300 мг) и с составами с 1В по 4В (препараты с 100 мг), и наличие или отсутствие замедления растворимости подтверждали проведением испытаний на растворимость (1) сразу после получения, (2) после испытания в строгих условиях и (3) после испытания на длительную стабильность.
(Состав 1А) Бычий желатин:глицерин:сорбит = 100:10:30
Бычий желатин (25 кг), концентрированный глицерин (2,5 кг) и 70% раствор D-сорбита (7,5 кг) смешивали при 70°С в присутствии очищенной воды (25 кг), получая таким образом однородный раствор. Этот раствор и (2R)-2-пропилоктановую кислоту (0,7 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производится Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая полученные таким образом "капсулы до высушивания" высушиванию в сушильном барабане (23°С, 3 часа) и высушиванию на лотке (30°С, 27 часов) в указанном порядке, получали указанные в заголовке мягкие капсулы (2800 капсул), содержащие 300 мг (2R)-2-пропилоктановой кислоты в одной капсуле.
(Состав 2А) Бычий желатин:глицерин = 100:20
Бычий желатин (25 кг) и концентрированный глицерин (5 кг) смешивали при 70°С в присутствии очищенной воды (25 кг), получая таким образом однородный раствор. Этот раствор и (2R)-2-пропилоктановую кислоту (0,9 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производится Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая полученные таким образом "капсулы до высушивания" высушиванию в сушильном барабане (22,5°С, 3 часа) и высушиванию на лотке (31°С, 27 часов) в указанном порядке, получали указанные в заголовке мягкие капсулы (2200 капсул), содержащие 300 мг (2R)-2-пропилоктановой кислоты в одной капсуле.
(Состав 3А) Бычий желатин:глицерин = 100:25
Используя бычий желатин (20 кг), концентрированный глицерин (5 кг), очищенную воду (20 кг) и (2R)-2-пропилоктановую кислоту (1,2 кг) и подвергая их такой же процедуре, что и для состава 2А, получали указанные в заголовке мягкие капсулы (2200 капсул).
(Состав 4А: указанная в примере 1-1 композиция оболочки) Бычий желатин:глицерин = 100:30
Используя бычий желатин (20 кг), концентрированный глицерин (6 кг), очищенную воду (20 кг) и (2R)-2-пропилоктановую кислоту (0,9 кг) и подвергая их такой же процедуре, что и для состава 2А, получали указанные в заголовке мягкие капсулы (2200 капсул).
(Состав 5А) Бычий желатин:глицерин = 100:40
Используя бычий желатин (20 кг), концентрированный глицерин (8 кг), очищенную воду (20 кг) и (2R)-2-пропилоктановую кислоту (0,9 кг) и подвергая из такой же процедуре, что и для состава 2А, получали указанные в заголовке мягкие капсулы (2100 капсул).
(Состав 1В) Бычий желатин:глицерин:сорбит = 100:20:20
Бычий желатин (25 кг), концентрированный глицерин (5 кг) и 70% раствор D-сорбита (5 кг) смешивали при 70°С в присутствии очищенной воды (25 кг), получая таким образом однородный раствор. Этот раствор и (2R)-2-пропилоктановую кислоту (6,4 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производится Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая полученные таким образом "капсулы до высушивания" высушиванию в сушильном барабане (24,5°С, 6 часов) и высушиванию на лотке (30°С, 18 часов) в указанном порядке, получали указанные в заголовке мягкие капсулы (58800 капсул), содержащие 100 мг (2R)-2-пропилоктановой кислоты в одной капсуле.
(Состав 2В) Бычий желатин:глицерин = 100:25
Бычий желатин (20 кг) и концентрированный глицерин (5 кг) смешивали при 70°С в присутствии очищенной воды (20 кг), получая таким образом однородный раствор. Этот раствор и (2R)-2-пропилоктановую кислоту (1,2 кг) помещали в инкапсулятор для мягких капсул (устройство для изготовления мягких капсул роликового типа, модель Н-1; производится Kamata) с получением мягких капсул с инкапсулированной (2R)-2-пропилоктановой кислотой в виде "капсул до высушивания". Подвергая полученные таким образом "капсулы до высушивания" высушиванию в сушильном барабане (23,5°С, 4 часа) и высушиванию на лотке (28,5°С, 26 часов) в указанном порядке, получали указанные в заголовке мягкие капсулы (3000 капсул), содержащие 100 мг (2R)-2-пропилоктановой кислоты в одной капсуле.
(Состав 3В: указанная в примере 2-1 композиция оболочки) Бычий желатин:глицерин = 100:30
Используя бычий желатин (15 кг), концентрированный глицерин (4,5 кг), очищенную воду (15 кг) и (2R)-2-пропилоктановую кислоту (0,6 кг) и подвергая их такой же процедуре, что и для состава 2В, получали указанные в заголовке мягкие капсулы (3000 капсул).
(Состав 4В) Бычий желатин:глицерин = 100:40
Используя бычий желатин (15 кг), концентрированный глицерин (6 кг), очищенную воду (15 кг) и (2R)-2-пропилоктановую кислоту (0,6 кг) и подвергая их такой же процедуре, что и для состава 2В, получали указанные в заголовке мягкие капсулы (4500 капсул).
(1) Испытание на растворимость сразу после получения
Испытание на растворимость проводили сразу после получения мягких капсул, полученных на основе составов с 1А по 5А (препараты с 300 мг) и составов с 1В по 4В (препараты с 100 мг) при следующих условиях испытания.
<Испытание на растворимость>
(Способ испытания)
Испытание на растворимость, второй способ (способ с лопастной мешалкой), 14-ое издание Japanese Pharmacopoeia
(Условия испытания)
Число оборотов: 50 об/мин (препараты с 100 мг), 75 об/мин (препараты с 300 мг);
Жидкость для испытания: 0,05 моль/л динатрийфосфат/0,025 моль/л буферная жидкость с лимонной кислотой (рН 8,0);
Объем жидкости; 900 мл; и
Температура: 37°С.
<Результаты>
Результаты теста на растворимость (соотношение растворимостей (%)), проведенного сразу после получения мягких капсул, полученных на основе составов с 1А по 5А (препараты с 300 мг) и составов с 1В по 4В (препараты с 100 мг), представлены в следующих ниже таблице 19 и таблице 20.
Составы 1А, 2А, 3А, 4А и 5А показывали соотношения растворимостей 100,0%, 99,6%, 99,6%, 99,5% и 99,4% соответственно через 30 минут после начала испытания на растворимость. Также, составы 1В, 2В, 3В и 4В показывали соотношения растворимостей 95,9%, 99,4%, 98,1% и 98,7% соответственно через 30 минут после начала испытания.
Все из мягких капсул, полученных на основе составов с 1А по 5А (препараты 300 мг) и составов с 1В по 4В (препараты 100 мг), представляли собой быстро растворяющиеся мягкие капсулы.
(2) Испытание на растворимость после испытания в строгих условиях (50°С, 2 недели или 1 месяц)
Все из мягких капсул, полученных на основе составов с 2А по 5А (препараты 300 мг) и составов с 2В по 4В (препараты 100 мг), подвергали испытанию в строгих условиях (50°С, 1 месяц для препаратов с 300 мг; 50°С, 2 недели для препаратов с 100 мг), и затем проводили испытание на растворимость, описанное в (1).
<Результаты>
Результаты испытания на растворимость (соотношение растворимостей (%)), проведенного после испытания в строгих условиях для мягких капсул, полученных на основе составов с 2А по 5А (препараты с 300 мг) и составов с 2В по 4В (препараты с 100 мг), представлены в таблице 21 и таблице 22. В этом случае, в качестве показателя исходных значений, исходное значение для состава 3А представлено в таблице для препаратов с 300 мг, а исходное значение для состава 3В представлено для препаратов с 100 мг. В этом описании, числовое значение, показанное снизу в круглых скобках для соотношения растворимостей через 30 минут, демонстрирует степень изменения (%) по отношению к исходному значению каждого состава.
В отношении состава 2А испытание на растворимость не проводили вследствие образования трещин в процессе испытания в строгих условиях. Составы 3А, 4А и 5А демонстрировали соотношения растворимостей 92,8%, 88,0% и 34,4% соответственно через 30 минут после начала испытания на растворимость. Также, составы 2В, 3В и 4В демонстрировали соотношения растворимостей 98,2%, 90,7% и 91,4% соответственно через 30 минут после начала испытания.
Состав 2А не выдержал испытания в строгих условиях, и в случае состава 5А было обнаружено замедление растворимости.
(3) Испытание на растворимость после испытания на долговременную устойчивость (25°С или 30°С, приблизительно 1,5 года)
Все из мягких капсул, полученных на основе составов 1А и 4А (препараты с 300 мг) и составов 1В и 3В (препараты с 100 мг), подвергали испытанию на долговременную устойчивость (состав 1А: 30°С, 18 месяцев; состав 4А: 30°С, 17 месяцев; состав 1В: 25°С, 18 месяцев; состав 3В: 25°С, 17 месяцев), а затем проводили испытание на растворимость, описанное в (1).
<Результаты>
Результаты теста на растворимость (соотношение растворимостей (%)), проведенного после испытания на долговременную устойчивость мягких капсул, полученных на основе составов 1А и 4А (препараты с 300 мг) и составов 1В и 3В (препараты с 100 мг), представлены в следующих ниже таблице 23 и таблице 24. В этом описании, числовое значение, описанное снизу в скобках для соотношения растворимостей через 30 минут, показывает степень изменения (%) по отношению к исходному значению для каждого состава.
Составы 1А и 4А демонстрировали соотношения растворимостей 71,5% и 95,3% соответственно через 30 минут после начала испытания на растворимость. Также, составы 1В и 3В демонстрировали соотношения растворимостей 93,3% и 95,4% соответственно через 30 минут после начала испытания.
Замедление растворимости было обнаружено в случае состава 1А.
Исходя из результатов приведенных выше испытаний на растворимость, было обнаружено, что испытание на долговременную устойчивость вызывает замедление растворимости состава 1А (бычий желатин:глицерин:сорбит = 100:10:30), что испытание в строгих условиях приводит к растрескиванию состава 2А (бычий желатин:глицерин = 100:20), и что испытание в строгих условиях приводит к замедлению растворимости состава 5А (бычий желатин:глицерин = 100:40).
Также, в каждом случае препаратов с 300 мг и препаратов с 100 мг, состав оболочки с соотношением желатин:глицерин = 100:30 представлял собой состав, для которого испытание на растворимость (1) сразу после получения, (2) после испытания в строгих условиях и (3) после испытания на долговременную устойчивость приводило к наиболее слабо выраженному замедлению растворимости.
Таким образом, было обнаружено, что, если замедление растворимости используется в качестве показателя в случае состава из бычьего желатина и глицерина в качестве состава, который не содержит сорбит, их предпочтительными соотношениями являются 25 массовых частей или более и 40 массовых частей или менее (предпочтительно менее 40 массовых частей) глицерина относительно 100 массовых частей желатина, особенно предпочтительно 30 массовых частей глицерина относительно 100 массовых частей желатина.
Кроме того, поскольку замедление растворимости, происходившее после испытания на долговременную устойчивость при использовании 30 массовых частей сорбита относительно 100 массовых частей желатина в составе из бычьего желатина, глицерина и сорбита в качестве состава, который содержит сорбит, было обнаружено, что может быть получен фармацевтический препарат, который является лучше всех с точки зрения устойчивости при хранении и почти не вызывает замедления растворимости, если выбрано соотношение сорбита менее, чем 30 массовых частей, предпочтительно 20 массовых частей или менее, относительно 100 массовых частей желатина.
Промышленная применимость
Как показано далее, является возможным применение настоящего изобретения для лекарственных средств.
Поскольку капсула по настоящему изобретению содержит (2R)-2-пропилоктановую кислоту или ее соль, она может использоваться в качестве средства для профилактики, лечения и/или замедления прогрессирования симптомов различных заболеваний млекопитающих, таких как нейродегенеративные заболевания (например, у человека, не относящихся к человеку животных, таких как обезьяны, овцы, крупный рогатый скот, лошади, животные из семейства псовых, животные из семейства кошачьих, кроликов, крыс, мышей и т.д.).
Также, поскольку капсула по настоящему изобретению обладает свойством легко распадаться в желудке и свойством, что содержимое не легко вытекает при разжевывании, ее можно безопасно принимать внутрь без ощущения остроты, боли, ощущения жжения и т.п. в полости рта, и она может демонстрировать свои фармакологические эффекты вследствие быстрого всасывания, например, даже если пожилые люди или сходные с ними разжевывают ее по ошибке во время приема.
Кроме того, поскольку капсула по настоящему изобретению представляет собой быстро растворяющуюся мягкую капсулу с такой высокой устойчивостью при хранении, что ее можно долго хранить в течение длительного периода хранения без замедления растворимости, то она может показывать свойства стабильного всасывания и приводить к стабильным фармакологическим эффектам даже после длительного хранения.
Изобретение относится к мягкой капсуле, содержащей соединение, вызывающее раздражение в полости рта, в частности, (2R)-2-пропилоктановую кислоту или ее соль. Указанные соединения являются пригодными в качестве средства для профилактики, лечения и/или замедления прогрессирования симптомов различных нейродегенеративных заболеваний. Капсула обладает прочностью от 150 до 400 Н при испытании на растрескивание, временем распада от 3 до 10 минут при испытании на распадаемость. Мягкая капсула по изобретению является устойчивой при разжевывании, ее можно безопасно принимать внутрь без ощущения жжения, остроты, боли в полости рта; капсула выдерживает длительное хранение без замедления растворимости. 11 н. и 23 з.п. ф-лы, 24 табл.
1. Устойчивая при разжевывании капсула, содержащая (2R)-2-пропилоктановую кислоту или ее соль и обладающая свойством из следующих ниже (1) и/или (2):
(1) имеет оболочку капсулы, содержащую (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира, и (b) смягчитель и обладающую содержанием воды от 4,0 до 10,0%;
(2) легко распадается в желудке.
2. Устойчивая при разжевывании капсула по п.1, которая представляет собой мягкую капсулу.
3. Устойчивая при разжевывании мягкая капсула по п.2, которая обладает по меньшей мере одним свойством, выбранным из следующих ниже от (А) по (F):
(A) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где она обладает временем распада от 3 до 10 мин при испытании на распадаемость, предусмотренном в 14-м издании Japanese Pharmacopoeia;
(C) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(D) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(Е) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(F) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
4. Устойчивая при разжевывании мягкая капсула по п.3, где указанное свойство представляет собой по меньшей мере одно свойство, выбранное из следующих ниже от (А) до (F):
(A) где она обладает прочностью от 180 до 350 Н при испытании на растрескивание;
(B) где она обладает временем распада от 5 до 8 мин при испытании на распадаемость, предусмотренном в 14-м издании Japanese Pharmacopoeia;
(C) где оболочка капсулы обладает толщиной оболочки от 0,10 до 0,45 мм;
(D) где толщина первого шва оболочки капсулы составляет от 0,15 до 0,50 мм;
(Е) где толщина второго шва оболочки капсулы составляет от 0,10 до 0,40 мм;
(F) где содержание воды в оболочке капсулы составляет от 5,0 до 8,0%.
5. Устойчивая при разжевывании мягкая капсула по п.2, где основа капсулы представляет собой желатин.
6. Устойчивая при разжевывании мягкая капсула по п.2, где смягчитель представляет собой глицерин, который, по существу, не содержит сорбит или содержит сорбит в количестве 20 мас.ч. или менее на 100 мас.ч. основы капсулы.
7. Устойчивая при разжевывании мягкая капсула по п.6, где смягчитель представляет собой глицерин, который, по существу, не содержит сорбит.
8. Устойчивая при разжевывании мягкая капсула по п.2, где оболочка капсулы содержит желатин в качестве основы капсулы и глицерин в качестве смягчителя, который содержится в количестве от 25 до 40 мас.ч. на 100 мас.ч. желатина, и обладает содержанием воды от 5,0 до 9,0%.
9. Устойчивая при разжевывании мягкая капсула по п.8, где оболочка капсулы содержит желатин и глицерин, который содержится в количестве 30 мас.ч. на 100 мас.ч. желатина, и обладает содержанием воды от 5,0 до 8,0%.
10. Устойчивая при разжевывании мягкая капсула по п.2, которая содержит от 50 до 400 мг (2R)-2-пропилоктановой кислоты.
11. Устойчивая при разжевывании мягкая капсула по п.10, которая содержит 100 мг или 300 мг (2R)-2-пропилоктановой кислоты.
12. Устойчивая при разжевывании мягкая капсула по п.2, где замедление растворимости, связанное с хранением, уменьшено.
13. Устойчивая при разжевывании мягкая капсула по п.12 со скоростью растворения через 30 мин после начала испытания на растворимость 90% или более в соответствии со вторым испытанием на растворимость, предусмотренным в 14-м издании Japanese Pharmacopoeia, после хранения при комнатной температуре в течение полутора лет.
14. Устойчивая при разжевывании мягкая капсула по п.2, которую подвергают герметичному упаковыванию.
15. Устойчивая при разжевывании мягкая капсула по п.14, где герметичная упаковка представляет собой упаковку спрессовыванием.
16. Устойчивая при разжевывании мягкая капсула по п.2, которая представляет собой средство для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов.
17. Способ профилактики, лечения и/или подавления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов, который включает в себя введение млекопитающему эффективного количества устойчивых при разжевывании мягких капсул по п.2.
18. Применение устойчивой при разжевывании мягкой капсулы по п.2 для получения средства для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов.
19. Средство для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов, которое включает в себя устойчивую при разжевывании мягкую капсулу по п.2.
20. Устойчивая при разжевывании мягкая капсула, которая легко распадается в желудке, содержит (2R)-2-пропилоктановую кислоту и характеризуется:
наличием оболочки капсулы, содержащей желатин и глицерин, который содержится в количестве 30 мас.ч. на 100 мас.ч. желатина, и обладающей содержанием воды от 5,0 до 8,0%, толщиной оболочки от 0,10 до 0,45 мм, толщиной первого шва от 0,15 до 0,50 мм и толщиной второго шва от 0,10 до 0,40 мм;
наличием прочности от 180 до 350 Н при испытании на растрескивание; и
наличием времени распада от 5 до 8 мин при испытании на распадаемость, предусмотренном в 14-м издании Japanese Pharmacopoeia.
21. Устойчивая при разжевывании мягкая капсула по п.20, которая содержит от 50 до 400 мг (2R)-2-пропилоктановой кислоты.
22. Устойчивая при разжевывании мягкая капсула по п.21, которая содержит 100 мг или 300 мг (2R)-2-пропилоктановой кислоты.
23. Устойчивая при разжевывании мягкая капсула по п.20, где замедление растворимости, связанное с хранением, уменьшено.
24. Устойчивая при разжевывании мягкая капсула по п.23 со скоростью растворения через 30 мин после начала испытания на растворимость 90% или более в соответствии со вторым испытанием на растворимость, предусмотренным в 14-м издании Japanese Pharmacopoeia, после хранения при комнатной температуре в течение полутора лет.
25. Устойчивая при разжевывании мягкая капсула по п.20, которую подвергают герметичному упаковыванию.
26. Устойчивая при разжевывании мягкая капсула по п.25, где герметичная упаковка представляет собой упаковку спрессовыванием.
27. Устойчивая при разжевывании мягкая капсула по п.20, которая представляет собой средство для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов.
28. Способ профилактики, лечения и/или подавления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов, который включает в себя введение млекопитающему эффективного количества устойчивых при разжевывании мягких капсул по п.20.
29. Применение устойчивой при разжевывании мягкой капсулы по п.20 для получения средства для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов.
30. Средство для профилактики, лечения и/или замедления прогрессирования симптомов нейродегенеративных заболеваний, невропатий или заболеваний, при которых требуется регенерация нервов, которое включает в себя устойчивую при разжевывании мягкую капсулу по п.20.
31. Способ придания мягкой капсуле устойчивости к разжевыванию, который включает в себя получение мягкой капсулы, содержащей (2R)-2-пропилоктановую кислоту или ее соль и обладающей оболочкой капсулы, содержащей (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира, и (b) смягчитель, с по меньшей мере одним свойством, выбранным из следующих ниже от (А) до (Е):
(A) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(C) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(D) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(Е) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
32. Способ по п.31, где указанное свойство представляет собой по меньшей мере одно свойство, выбранное из следующих ниже от (А) до (Е):
(A) где прочность составляет от 180 до 350 Н при испытании на растрескивание;
(B) где оболочка капсулы обладает толщиной оболочки от 0,10 до 0,45 мм;
(C) где толщина первого шва оболочки капсулы составляет от 0,15 до 0,50 мм;
(D) где толщина второго шва оболочки капсулы составляет от 0,10 до 0,40 мм;
(Е) где содержание воды в оболочке капсулы составляет от 5,0 до 8,0%.
33. Капсула, устойчивая при разжевывании, которая легко распадается в желудке, содержит соединение, вызывающее раздражение в полости рта, обладает оболочкой капсулы, содержащей (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира, и (b) смягчитель, и обладает по меньшей мере одним свойством, выбранным из следующих ниже от (А) до (F):
(А) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где она обладает временем распада от 3 до 10 мин при испытании на распадаемость, предусмотренном в 14-м издании Japanese Pharmacopoeia;
(C) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(D) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(Е) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(F) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
34. Способ придания мягкой капсуле устойчивости к разжевыванию, который включает в себя получение мягкой капсулы, содержащей соединение, вызывающее раздражение в полости рта, и обладающей оболочкой капсулы, содержащей (а) по меньшей мере одну основу капсулы, выбранную из белка, сахарида, биологически деградируемой пластмассы и гидрогенизированного жира, и (b) смягчитель, с по меньшей мере одним свойством, выбранным из следующих ниже от (А) до (Е):
(A) где она обладает прочностью от 150 до 400 Н при испытании на растрескивание;
(B) где оболочка капсулы обладает толщиной оболочки от 0,05 до 0,50 мм;
(C) где толщина первого шва оболочки капсулы составляет от 0,10 до 0,55 мм;
(D) где толщина второго шва оболочки капсулы составляет от 0,05 до 0,50 мм;
(Е) где содержание воды в оболочке капсулы составляет от 5,0 до 9,0%.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2010-03-20—Публикация
2005-06-10—Подача