Изобретение относится к области перорально вводимых фармацевтических композиций для лечения рака. Конкретно, изобретение относится к пероральным дозированным формам, содержащим алкалоид винка винорелбин в качестве фармацевтически активного ингредиента.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Винорелбин или 3',4'-дидегидро-4''-деокси-С'-норвинкалейкобластин представляет собой производное соединение алкалоида винка, которое проявляет цитостатические эффекты, ингибируя полимеризацию тубулина. Винорелбин ингибирует митоз в G2 + М фазе. Винорелбин и его фармацевтические солевые формы, иключая тартратную солевую форму, известны как в качестве антинеопластических средств, так и антимитотических средств и используются при лечении крупноклеточного рака легких и метастазирующего рака молочной железы.
Винорелбин широко используется для введения пациентам, больным раком, в качестве части химиотерапии парентеральным путем, посредством внутривенной инфузии или инъекции. Хотя лекарство может вводиться разнообразными путями, внутривенный путь является одной из наиболее общеприменяемых форм введения винорелбина вследствие того, что он связан с повышенной биодоступностью. Тартрат винорелбина в настоящее время производит Plantes et Industrie, Gaillac, France.
Для перорального пути введения лекарства исследовали пероральные дозированные формы, включая дозированные формы в виде мягких капсул, содержащие винорелбин. Возможное применение дозированных форм в виде мягких капсул для доставки жидких форм винорелбина для лечения раковых заболеваний исследованы в публикациях Rowinsky et al., "Pharmacokinetic, Bioavailability, and Feasibility Study of Oral Vinorelbine in Patients with Solid Tumors", J. Clin. Oncol., Vol.12 (9) (сентябрь, 1994), с.1754-63; Zhou et al., "Relative Bioavailability of Two Oral Formulations of Navelbine in Cancer Patients," Biopharmaceutics & Drug Disposition, Vol.15 (1994), с.577-86; и Jassem et al., "A Multicenter Randomized Phase II Study of Oral vs. Intravenous Vinorelbine in Advanced Non-small-cell Lung Cancer Patients", Annals of Oncology, Vol.12 (2001), с.1375-81.
Тем не менее, разработка композиций жидкого наполнителя, пригодных в качестве содержимого мягкой капсулы оказалось трудной. В композициях наполнителя для капсул, которые могут быть использованы в сочетании с мягкими капсулами, необходимо, чтобы активный ингредиент находился в растворенном состоянии в смеси с растворителем. Кроме того, композиция наполнителя, в целом, должна быть химически совместимой с материалом капсулы и не допускать деградации материала после инкапсуляции, а также быть инертной или снижать неблагоприятное химическое взаимодействие с активным ингредиентом. В конечном счете, для обеспечения применимости, биологическая активность активного ингредиента не должна подвергаться существенному риску. Соответственно, могут возникнуть сложности при разработке в обеспечении баланса между всеми данными характеристиками, с учетом, в то же время, химической природы активного ингредиента.
В фармацевтической области существует потребность в перорально вводимых дозированных формах, содержащих винорелбин в качестве активного ингредиента. Кроме того, существует потребность в готовых формах наполнителя капсул, содержащих винорелбин, которые обладают улучшенными характеристиками растворимости и стабильности и которые имеют эффективную биодоступность после проглатывания.
КРАТКОЕ СОДЕРЖАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное изобретение направлено на фармацевтическую композицию, содержащую винорелбин в качестве активного ингредиента, которая является пригодной для инкапсуляции в мягкие капсулы, и способ лечения раковых заболеваний посредством ее перорального введения. Соответственно, изобретение обеспечивает композицию жидкого наполнителя для дозированной формы в виде мягкой капсулы, указанная композиция включает:
a) винорелбин или его фармацевтически приемлемую соль;
b) этанол;
c) воду;
d) глицерин; и
е) полиэтиленгликоль.
В предпочтительном варианте воплощения в композиции применяют тартратную солевую форму винорелбина. В еще более предпочтительном варианте воплощения, композиция мягкой капсулы для инкапсуляции наполнителя включает смесь свиного и бычьего желатина.
Изобретение также обеспечивает способ лечения рака, включающий пероральное введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции, включающей:
a) фармацевтически эффективное количество винорелбина или его фармацевтически приемлемой соли;
b) этанол;
c) воду;
d) глицерин; и
e) полиэтиленгликоль;
где указанную композицию инкапсулируют в мягкую капсулу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин "фармацевтически приемлемая соль" в контексте винорелбина означает указание, что активный ингредиент винорелбин присутствует в фармацевтической композиции в его солевой форме, пригодной для перорального введения. Может применяться разнообразие солевых форм, известных в данной области техники, применимых для таких соединений как винорелбин и другие производные алкалоидов винка.
Термин "фармацевтически эффективное количество" в контексте винорелбина означает указание, что дозировка винорелбина как активного ингредиента, находится в диапазоне между минимальным количеством, которое обеспечивает требуемый фармацевтический эффект, но ниже количества, определенного как токсичное для пациента в целом, превышающее уровни переносимости пациента для предназначенного лечения, при аккомодации разнообразия ответов пациента. Таким образом, фармацевтическая эффективность для винорелбина может быть определена на основании проявляемых антинеопластической и антимитотической активностей in vivo.
Данное изобретение включает улучшенную перорально вводимую фармацевтическую композицию, включающую винорелбин, пригодный для инкапсуляции в дозированную форму в виде мягкой капсулы. Было обнаружено, что жидкая наполняющая композиция, содержащая винорелбин в качестве активного ингредиента, может быть формулирована для обеспечения улучшенных растворимости и биодоступности для перорального введения, в то же время, с обеспечением баланса химических свойств различных ингредиентов методом, пригодным для инкапсуляции в материал мягкой капсулы.
Винорелбин и его солевые формы для получения композиции наполнителя данного изобретения могут быть получены органическим синтезом из природных исходных веществ или приобретены непосредственно от производителя.
Количество винорелбина, именно, фармацевтически эффективное количество винорелбина или его фармацевтически приемлемой соли, которое может быть использовано в фармацевтической композиции данного изобретения, может изменяться при условии, что данные количество и концентрация активного ингредиента могут быть растворены в композиции наполнителя, обеспечивая общий объем дозированной формы, пригодный для перорального приема внутрь. Фармацевтическая композиция данного изобретения может включать базовые количества винорелбина, присутствующего в количествах, находящихся в диапазоне от приблизительно 5 мг до приблизительно 100 мг, предпочтительно, в диапазоне между приблизительно 20 мг и приблизительно 80 мг на мягкую капсулу. В отношении процентного содержания композиция данного изобретения может предпочтительно включать тартрат винорелбина в фармацевтически эффективном количестве, находящемся в диапазоне от приблизительно 14 мас.% до приблизительно 18 мас.% от общей массы композиции наполнителя.
Этанол присутствует в качестве сорастворителя с полиэтиленгликолем в композиции наполнителя данного изобретения и является важным для обеспечения стабильности и растворимости винорелбина и стабильности оболочки капсулы. Количество и соотношение этанола и полиэтиленгликоля в композиции наполнителя изобретения могут быть критическими для получения приемлемой мягкой капсулы. В процессе хранения капсул, содержащих композиции с этанолом, этанол обычно имеет тенденцию к испарению жидкой композиции наполнителя, вызывая эффект "появления вмятин" на капсуле. Предпочтительно, количество этанола для применения в композиции наполнителя данного изобретения является относительно низким. Таким образом, этанол присутствует в величестве, находящемся в диапазоне от приблизительно 0,3 мас.% до приблизительно 7,5 мас.% от общей массы композиции наполнителя. Предпочтительно, этанол присутствует в количестве от приблизительно 1,6 мас.% до приблизительно 5 мас.% от общей массы композиции.
Массовое отношение воды к этанолу в композиции данного изобретения может составлять от приблизительно 2:1 до приблизительно 3:1. Предпочтительно, массовое отношение воды к этанолу составляет от приблизительно 2,3:1 до приблизительно 2,7:1, более предпочтительно, 2,5:1. Водное содержимое композиции, предпочтительно, в виде очищенной воды, включает количество от приблизительно 1 мас.% до приблизительно 15 мас.% от общей массы композиции наполнителя.
Композиция в соответствии с данным изобретением может, кроме того, включать глицерин, сорбит и пропиленгликоль и их смеси. Общее количество глицерина, сорбита и/или пропиленгликоля, применяемое в композиции может находиться в диапазоне от приблизительно 0,1 мас.% до приблизительно 20 мас.% от общей массы композиции, предпочтительно, от приблизительно 0,2 мас.% до приблизительно 12 мас.%. В даже более предпочтительном варианте воплощения суммарный глицерин, сорбит и/или пропиленгликоль присутствует в количестве, находящемся в диапазоне между приблизительно 0,8 мас.% и 1,4 мас.% от общей массы наполнителя.
Форма полиэтиленгликоля, которая может быть использована в изобретении, представляет собой жидкую форму полиэтиленгликоля, имеющего среднюю молекулярную массу, находящуюся в интервале от приблизительно 200 до приблизительно 600 дальтон. В предпочтительном варианте воплощения, применяют полиэтиленгликоль, имеющий среднюю молекулярную массу от приблизительно 300 до приблизительно 400, наиболее предпочтительно 400. Полиэтиленгликоль может присутствовать в композиции данного изобретения в количестве, находящемся в интервале от приблизительно 66 мас.% до приблизительно 78 мас.% от общей массы композиции.
В еще более предпочтительном варианте воплощения материал мягкой капсулы включает смесь свиного и бычьего желатина при массовых отношениях от приблизительно 2:1 до 1:2. В следующих примерах все значения процентного содержания представляют собой значения массового процентного содержания, если не определено иначе.
ПРИМЕРЫ
Готовая форма винорелбина в виде мягкой капсулы
Пример 1. Готовая форма винорелбина для мягких капсул
Тартрат винорелбина растворяют в смеси эксципиентов: очищенной воды, этанола, глицерина и полиэтиленгликоля 400, применяя смеситель Becomix или эквивалентный ему смеситель. Альтернативный способ состоит, во-первых, в растворении тартрата винорелбина в очищенной воде и этаноле и, во-вторых, в медленном добавлении глицерина и полиэтиленгликоля 400.
Следующую готовую форму наполнителя мягкой капсулы получают в соответствии с изобретением. Она также представляет собой наилучший метод осуществления данного изобретения.
Формула 1
Оболочка мягкой капсулы может быть изготовлена из любого полимера или полимерной смеси, которые являются пригодными для применения в фармацевтических дозированных формах в виде мягких капсул. Может применяться разнообразие таких материалов для мягкой капсулы, которые хорошо известны специалистам в данной области. См., например, патент США № 6340473. Материалы оболочки мягкой капсулы, которые могут использоваться, включают, но не ограничиваются только ими, материалы, представленные в патенте США № 6340473. Материалы оболочки капсулы могут, кроме того, включать пластификаторы, такие как глицерин, сорбит и пропиленгликоль. В еще одном варианте воплощения, материал оболочки капсулы может, кроме того, включать ингибитор хрупкости. Одна такая композиция ингибитора описана в Европейском патенте № 121321, полный текст которого включен в данное описание в качестве ссылки. Когда в материале оболочки применяется ингибитор хрупкости, другие полиспирты могут сочетаться также с сорбитом и со смесями сорбитана. Один пример полиспирта, который может таким образом сочетаться, включает гидрированные полисахариды. В одном варианте воплощения материал капсулы включает от приблизительно 4 мас.% до приблизительно 25 мас.% смеси сорбит/сорбитан, предпочтительно, от приблизительно 9 мас.% до приблизительно 15 мас.% относительно общей массы оболочки капсулы.
Когда в качестве материала капсулы применяют желатин, предпочтительной является смесь свиного и бычьего желатинов. В еще более предпочтительном варианте воплощения оболочка капсулы включает 2 части свиного желатина на каждую часть бычьего желатина. Другие добавки, такие как красители и смазывающие средства, могут также использоваться в материале капсулы.
Фармацевтическая композиция данного изобретения может быть получена с использованием общепринятых методов и оборудования для производства фармацевтических композиций. Мягкие капсулы, которые содержат фармацевтическую композицию изобретения, могут быть также получены с использованием общепринятых методов производства и оборудования для инкапсуляции в мягкие капсулы. Методы инкапсуляции являются хорошо известными специалистам в данной области.
Пример 2. Сравнительные данные по содержанию этанола и отношению между содержанием воды и содержанием этанола
Две композиции наполнителя получают, используя различные количества этанола в композиции наполнителя. Формулу 1 и Формулу 2 получают одним и тем же способом. Во-первых, тартрат винорелбина растворяют в смеси очищенной воды и этанола, во-вторых, медленно добавляют глицерин и полиэтиленгликоль 400 и смешивают до получения гомогенной смеси.
Оцениваемые композиции наполнителя являются следующими:
Готовые формы винорелбина (для теоретического отношения тартрат винорелбина/основание винорелбина, равного 1,385)
Готовые формы получают таким образом, чтобы для сравнения было представлено 7% различие по массе в концентрациях этанола в готовых формах. Формула 1 имеет отношение содержания воды к этанолу, равное приблизительно 2,5:1, в то время как отношение воды к этанолу в Формуле 2 составляет приблизительно 0,6:1. Готовые формы наполнителя далее инкапсулируют в материал капсулы, изготовленный из смеси, включающей 2 части свиного и 1 часть бычьего желатинов.
Появление вмятин на 100 процентах из 20 капсул, содержащих Формулу 2, упакованных в емкость из янтарного стекла объемом 50 см3, наблюдают после 18 месяцев хранения. Данное явление "появления вмятин" происходит вследствие испарения этанола из композиции наполнителя. Результаты демонстрируют, что как содержание этанола, так и отношение воды к этанолу, представленные в композиции наполнителя изобретения, являются важными для сохранения требуемых свойств, как фармацевтической композиции, так и материала капсулы.
Пример 3. Сравнительные данные готовых форм винорелбина в виде мягких капсул
Получают пять различных жидких композиций наполнителя, содержащих винорелбин, и оценивают их характеристики растворимости. Каждую из сравниваемых готовых форм получают с содержанием одного и того же количества активного тартрата винорелбина, изменяя в то же время наличие и количества других ингредиентов. Для каждой готовой формы получают от 50 г до 100 г наполнителя, применяя лабораторный дисковый смеситель и вводя лекарственное вещество в различные ингредиенты. Растворимость оценивают визуальной проверкой прозрачности каждого препарата наполнителя. Ингредиенты композиции и относительные количества обобщены в следующей таблице 2:
Готовые формы винорелбина (для теоретического отношения тартрат винорелбина/основание винорелбина, равного 1,385)
Результаты данного эксперимента обобщены в таблице 3 следующим образом:
Данные по растворимости
Поскольку винорелбин не полностью растворяется в Формулах 3 и 4, их не сохраняют для дальнейшей оценки. Формулу 5 исключают вследствие ее высокой вязкости и невозможности подачи насосом в машину для инкапсуляции. Формула 2 является предпочтительней Формулы 6, поскольку жидкая композиция наполнителя должна включать полиэтиленгликоль 400 для сохранения хорошей совместимости с материалом капсулы. Кроме того, высокое процентное содержание этанола в Формуле 6 может приводить к неприемлемому явлению появления вмятин. Результаты демонстрируют необходимость присутствия воды и этанола вместе с полиэтиленгликолем, а также присутствия определенных количеств/соотношений для обеспечения требуемой растворимости винорелбина в готовой форме.
Готовая форма данного изобретения увеличивает концентрацию растворенного винорелбина, минимизируя в то же время присутствие как воды, так и этанола. Как можно видеть из данных, 20 мг винорелбина не полностью растворяются в 10 мг воды и попытка растворить количество винорелбина, равное 20 мг, в 10 мг этанола приводит к получению вязкого продукта. Неожиданно, было обнаружено, что 20 мг винорелбина могут растворяться в смеси, составленной только из 6,20 мг воды и 10,30 мг этанола, перед добавлением полиэтиленгликоля, без наблюдаемого осаждения винорелбина. Таким образом, готовая форма изобретения является особенно пригодной для дозированных форм в виде мягких капсул.
Пример 4. Данные по стабильности винорелбина
Стабильность винорелбина: 1) в форме порошка (активный фармацевтический ингредиент) в контейнере, состоящем из алюминиевой бутыли, покрытой изнутри эпоксидным лаком, и 2) растворенного в композиции наполнителя для мягкой капсулы, которую упаковывают в блистерную упаковку, оценивают измерением содержания примеси и окраски после хранения.
Содержание примеси измеряют в соответствии с методом ВЭЖХ для количественной оценки наличия активного винорелбина, причем измерения осуществляют с интервалами в 3, 6, 9, 12, 18 и 24 месяцев. Применяемый хроматографический метод ВЭЖХ включает сборку, снабженную автоматическим инжектором и УФ детектором с переменной длиной волны, настроенным на 267 нм. Колонка из нержавеющей стали длиной 150 мм и с диаметром 3,9 мм заполнена октадецилсиликагелем - 300 Å - сферическим, 5 мкм. Подвижная фаза представляет декансульфонат натрия (1,2217 г), фосфатный буфер 0,05 М (рН=4,2) 380 мл и метанол (620 мл) с термостатически-контролируемой температурой колонки, равной +40°С, и скоростью потока подвижной фазы 1 мл/мин.
Каждую загрузку хранят в течение времени анализа при 5±3°С.
Среднее отклонение рассчитывают как разницу между средним значением результатов на данное время анализа и средним значением результатов при начальном значении времени (t0) для нескольких загрузок (3 загрузки для порошка винорелбина, 3 загрузки для 20 мг мягких капсул, 4 загрузки для 30 мг мягких капсул, 3 загрузки для 40 мг мягких капсул, 3 загрузки для 80 мг мягких капсул).
Результаты обобщены в таблице 4.
Относительное пространственное процентное содержание примеси
Как видно из результатов, жидкая композиция наполнителя, содержащая растворенный винорелбин в мягкой капсуле, имеет значительно более низкое процентное содержание примесей для периодов времени, равных 12, 18 и 24 месяцев. Результаты демонстрируют, что жидкая готовая формула винорелбина изобретения обладает большей продолжительностью хранения по сравнению с порошковой формой лекарства.
Пример 5. Сравнительная эволюция цвета
Сравнительную эволюцию цвета также оценивают для каждого образца и соответствующего временного интервала, как представлено в примере 4. В данном эксперименте, чистую порошковую форму винорелбина сравнивают с жидкой композицией наполнителя инкапсулированного винорелбина изобретения для мягкой капсулы (Формула 1). Окраску измеряют при 5±3°С по поглощению в ультрафиолетовом диапазоне при 420 нм водного раствора винорелбина при 10 мг/мл в виде основания винорелбина. Данные по окраске являются показателем деградации винорелбина по нехроматографируемым окисленным примесям. Среднее отклонение рассчитывают как разницу между средним значением результатов на заданное время анализа и средним значением результатов при начальном значении времени (t0) для нескольких загрузок (3 загрузки для порошка винорелбина, 3 загрузки для 20 мг мягких капсул, 4 загрузки для 30 мг мягких капсул, 3 загрузки для 40 мг мягких капсул, 3 загрузки для 80 мг мягких капсул).
Результаты обобщены в таблице 5
Данные по эволюции цвета
Как видно из приведенных данных, жидкая композиция винорелбина проявляет более высокую чистоту при времени анализа через 6, 12, 18 и 24 месяцев по сравнению с порошковой формой лекарства при использовании окраски как индикатора стабильности при хранении.
Пример 6. Сравнительные данные для материала капсулы
Получают множество образцов для двух типов капсул, содержащих идентичные композиции наполнителя, и тестируют хрупкость капсул.
Композиции двух различных капсул приведены в таблице
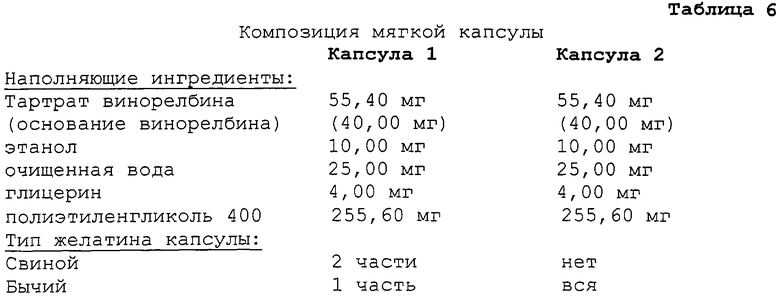
Мягкие капсулы хранят в течение периода двух (2) лет при температуре, равной 5±3°С. 10 капсул из каждой группы подвергают тестам на разрушение, осуществляемых с применением динамометрических щипцов, и средние значения рассчитывают в каждом тесте. Среднее усилие для капсулы 1 составляет 160 Н, в то время как среднее усилие для капсулы 2 составляет 98 Н. Капсула 2, следовательно, проявляет большую хрупкость по сравнению с капсулой 1.
Как видно из вышеприведенных данных, сам по себе материал капсулы может влиять на структурную целостность дозированной формы даже в случае идентичных композиций наполнителя, инкапсулированных внутрь. Капсула 1, содержащая смесь свиного и бычьего желатинов в качестве источника желатина, проявляет увеличенное сопротивление усилиям разрушения по сравнению с капсулой 2, содержащей только бычий желатин в качестве источника желатина.
Способ лечения с использованием мягких капсул, содержащих винорелбин.
Пероральное введение мягких капсул, включающих винорелбин, полученных в соответствии с данным изобретением можно использовать для лечения раковых заболеваний, отвечающих на винорелбин ингибированием роста раковых клеток. Антинеопластические и антимитотические эффекты винорелбина посредством ингибирования полимеризации тубулина реализуют в связи с системной биодоступностью лекарственного вещества путем перорального введения, предоставленного изобретением.
Промышленная применимость
Данное изобретение может применяться в химиотерапии для пациентов, больных раком, для которых введение винорелбина и связанные с ним антинеопластические и антимитотические эффекты могут быть благоприятными. Изобретение особенно применимо в ситуациях, где пероральное введение является желательным или предпочтительным внутривенному пути введения.
Каждый патент и публикация, цитируемые в данной заявке, включены в данное описание в качестве ссылки, как если бы полный текст каждого документа был индивидуально включен в качестве ссылки. Изобретение описано выше в данном документе со ссылкой на различные конкретные и предпочтительные варианты воплощения и методы. Следует понимать, однако, что могут быть осуществлены разумные модификации и вариации таких вариантов воплощения и методов без существенного отхода, как от сущности, так и от объема изобретения, определенных ниже формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ВОДОРАСТВОРИМОЙ СОЛИ ВИНОРЕЛБИНА | 2008 |
|
RU2476208C2 |
| Пероральные противоопухолевые средства и способ лечения онкологических заболеваний | 2016 |
|
RU2639479C1 |
| СТАБИЛЬНАЯ ТВЕРДАЯ ДИСПЕРСИЯ ПРОИЗВОДНОГО ВИНКА-АЛКАЛОИДА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2005 |
|
RU2412687C2 |
| САМОЭМУЛЬГИРУЮЩИЕСЯ КОМПОЗИЦИИ ДЛЯ ПЛОХОРАСТВОРИМЫХ В ВОДЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 1999 |
|
RU2257917C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНОЕ ЦИКЛОСПОРИНА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2126263C1 |
| ПЕРОРАЛЬНЫЕ ЖИДКИЕ КОМПОЗИЦИИ | 2000 |
|
RU2252019C2 |
| КАПСУЛА АВТ-263 | 2010 |
|
RU2550956C2 |
| АНТИОПЛАСТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ НКI-272 И ВИНОРЕЛБИН | 2009 |
|
RU2492860C2 |
| КОМБИНАЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ (НАПРИМЕР, ХЛОРПРОМАЗИНА И ПЕНТАМИДИНА) ДЛЯ ЛЕЧЕНИЯ НЕОПЛАСТИЧЕСКИХ НАРУШЕНИЙ | 2001 |
|
RU2286769C2 |
| АНТИНЕОПЛАСТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ HKI-272 И ВИНОРЕЛБИН | 2013 |
|
RU2670974C2 |
Изобретение относится к медицине. Описана жидкая фармацевтическая композиция для лечения рака, содержащая винорелбин в качестве активного ингредиента, которая является пригодной для инкапсуляции в мягкие капсулы. Жидкая пероральная фармацевтическая композиция, пригодная в качестве жидкой композиции наполнителя для дозированной формы в виде мягкой капсулы, включает винорелбин или его фармацевтически приемлемую соль, в частности тартрат винорелбина, этанол, воду, глицерин и полиэтиленгликоль. Изобретение также относится к способу лечения рака, включающему пероральное введение пациенту мягкой капсулы, включающей фармацевтическую композицию. Жидкая композиция, содержащая винорелбин, обеспечивает улучшенную растворимость и биодоступность для перорального введения. 2 н. и 11 з.п. ф-лы, 6 табл.
a) фармацевтически эффективное количество винорелбина или его фармацевтически приемлемой соли;
b) этанол, присутствующий в количестве от приблизительно 0,3 мас.% до приблизительно 7,5 мас.% от общей массы композиции наполнителя;
c) воду;
d) глицерин и
e) полиэтиленгликоль, присутствующий в количестве от приблизительно 66 мас.% до приблизительно 78 мас.% от общей массы композиции наполнителя.
a) тартрат винорелбина, присутствующий в количестве от приблизительно 5 мг до приблизительно 100 мг на капсулу;
b) этанол, присутствующий в количестве от приблизительно 0,3 мас.% до приблизительно 7,5 мас.% от общей массы композиции наполнителя;
c) воду, присутствующую в количестве от приблизительно 1 мас.% до приблизительно 15 мас.% от общей массы композиции наполнителя;
d) глицерин, присутствующий в количестве от приблизительно 0,1 мас.% до приблизительно 20 мас.% от общей массы композиции наполнителя;
e) полиэтиленгликоль 400, присутствующий в количестве от приблизительно 66 мас.% до приблизительно 78 мас.% от общей массы композиции наполнителя.
a) тартрат винорелбина, присутствующий в количестве от приблизительно 5 мг до приблизительно 100 мг на капсулу;
b) этанол, присутствующий в количестве от приблизительно 1,6 мас.% до приблизительно 5 мас.% от общей массы композиции наполнителя;
c) воду, присутствующую в количестве от приблизительно 1 мас.% до приблизительно 15 мас.% от общей массы композиции наполнителя;
d) глицерин, присутствующий в количестве от приблизительно 0,2 мас.% до приблизительно 12 мас.% от общей массы композиции наполнителя;
e) полиэтиленгликоль 400, присутствующий в количестве от приблизительно 66 мас.% до приблизительно 78 мас.% от общей массы композиции наполнителя.
a) фармацевтически эффективное количество винорелбина или его фармацевтически приемлемой соли;
b) этанол, присутствующий в количестве от приблизительно 0,3 мас.% до приблизительно 7,5 мас.% от общей массы композиции наполнителя;
c)воду;
d) глицерин и
e) полиэтиленгликоль, присутствующий в количестве от приблизительно 66 мас.% до приблизительно 78 мас.% от общей массы композиции наполнителя;
где указанную композицию инкапсулируют в мягкую капсулу и где
массовое отношение воды к этанолу в композиции составляет от приблизительно 2:1 до приблизительно 3:1.
a) приблизительно 15,8 мас.% тартрата винорелбина;
b) приблизительно 2,9 мас.% этанола;
c) приблизительно 7,1 мас.% воды;
d) приблизительно 1,1 мас.% глицерина и
e) приблизительно 73,1 мас.% полиэтиленгликоля 400.
| US 6197760 А, 06.03.2001 | |||
| Rowinsky EK, et al, Pharmacokinetic, bioavailability, and feasibility study of oral vinorelbine in patients with solid tumors, J Clin Oncol | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| ПРОИЗВОДНЫЕ АКРИДИНА, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 1992 |
|
RU2119482C1 |
Авторы
Даты
2006-07-20—Публикация
2003-05-28—Подача