Область техники изобретения
Настоящее изобретение относится к способам и композициям для обнаружения и лечения дегенеративных заболеваний сетчатки. В частности, изобретение относится к протеину, обладающему защитной функцией в отношении дегенерации колбочек, молекулам нуклеиновой кислоты, кодирующим такой протеин, антителам, распознающим протеин, и способам диагностики дегенеративных заболеваний сетчатки.
Предпосылки создания изобретения
Фоторецепторы представляют собой специализированную подгруппу нейронов сетчатки, ответственных за зрение. Фоторецепторы состоят из палочек и колбочек, которые представляют собой фоточувствительные клетки сетчатки. Каждая палочка и колбочка продуцируют специализированные реснички, обозначаемые как внешний сегмент, который обладает способностью к фототрансдукции. Палочки содержат специфический светопоглощающий зрительный пигмент родопсин. У человека существуют три класса колбочек, характеризующихся способностью экспрессировать различные зрительные пигменты: пигменты колбочек, специфических в отношении синего цвета, специфических в отношении зеленого цвета и специфических в отношении красного цвета. Каждый тип протеина зрительного пигмента характеризуется способностью максимально поглощать свет в определенном диапазоне длин волн, отличном от диапазона длин волн других типов протеина. Родопсин палочек опосредует скотопическое зрение (в тусклом свете), в то время как пигменты колбочек являются ответственными за фототопическое зрение (в ярком свете). Красный, синий и зеленый пигменты являются также основой цветного зрения у человека. Зрительные пигменты в палочках и колбочках реагируют на свет и создают биоэлектрический потенциал в клетках, генерирующих выходной сигнал, т.е. в биполярных нейронах палочек, который затем транслируется ганглиозными нейронами сетчатки, вызывая зрительный стимул в зрительной области коры головного мозга.
У человека многие заболевания сетчатки сопровождаются прогрессирующей дегенерацией и в конце концов гибелью фоторецепторов, что неизбежно приводит к слепоте. Все заболевания, связанные с дегенерацией фоторецепторов, такие как наследственные дистрофии сетчатки (например, пигментный ретинит), связанная с возрастом дегенерация желтого пятна и другие макулопатии, или отслоение сетчатки, характеризуются прогрессирующей атрофией и потерей функции фоторецепторов внешних сегментов. Кроме того, гибель фоторецепторов или утрата фоторецепторной функции у пациентов, страдающих дистрофией сетчатки, приводит к частичной дифференцировке вторичных нейронов сетчатки (биполярных клеток и горизонтальных клеток палочек), что вызывает снижение общей эффективности распространения электрического сигнала, генерируемого фоторецепторами. Вторичные изменения в глие и пигментном эпителии, обусловленные дегенерацией фоторецепторов, вызывают изменения в сосудах, приводящие к ишемии и глиозу. Для лечения таких состояний можно применять методы, основанные на использовании трофических факторов, которые обладают способностью защищать фоторецепторы от гибели клеток и/или восстанавливать функцию нефункционирующих (атрофических или дистрофических) фоторецепторов.
Прогрессирующее развитие этих состояний свидетельствует о последовательной гибели двух классов фоторецепторов: сначала погибают палочки вследствие непосредственного генетического повреждения или нарушения, вызванного окружающей средой, или имеющее неизвестное происхождение, что приводит к ночной слепоте и снижению поля зрения, после чего неизбежно происходит гибель колбочек, приводящая к полной слепоте. Таким образом, гибель колбочек происходит в результате косвенного действия, поскольку они не подвергаются первичному повреждению.
В настоящее время идентифицированы не все гены, связанные с дистрофией сетчатки. Идентификация таких генов может позволить как осуществлять диагностику, так и разрабатывать эффективные методы терапевтического лечения.
Краткое изложение сущности изобретения
Изобретение в целом относится к новому семейству генов, выведенному из палочек фактору жизнеспособности колбочек (Rod-derived Cone Viability Factor) (Rdcvf). Первым объектом изобретения является выделенный полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 2 или SEQ ID NO: 4. Установлено, что такой полипептид или его фрагменты присутствуют в глазу человека, страдающего дистрофиями сетчатки, в существенно меньших количествах, чем в глазу человека, который не страдает дистрофией сетчатки. Фрагменты выделенного полипептида, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 2 или SEQ ID NO: 4, включают полипептиды, содержащие от приблизительно 5 до 10 аминокислот, предпочтительно от приблизительно 10 до приблизительно 20 аминокислот, более предпочтительно от приблизительно 20 до приблизительно 100 аминокислот и наиболее предпочтительно от приблизительно 20 до приблизительно 50 аминокислот. Данный объект изобретения относится к новому полипептиду, происходящему из организма млекопитающего, в частности из организма мыши или человека, а также к его фрагментам, вариантам и производным, вариантам и производным фрагментов и их аналогам, которые можно применять в биологических, диагностических или терапевтических целях. Под объем изобретения подпадают также полипептиды, практически аналогичные полипептиду, имеющему аминокислотную последовательность, представленную в SEQ ID NO: 2 или SEQ ID NO: 4, например, аминокислотную последовательность, представленную в SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 и SEQ ID NO: 14.
Вторым объектом изобретения является выделенная молекула нуклеиновой кислоты, имеющая нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 3. Под объем изобретения подпадают также нуклеиновые кислоты, практически аналогичные нуклеиновой кислоте, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 3, например, нуклеотидные последовательности, представленные в SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11 или SEQ ID NO: 13. Предпочтительным вариантом осуществления изобретения является выделенная молекула нуклеиновой кислоты, которая кодирует полипептид, выбранный из группы, включающей полипептиды, представленные в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 и SEQ ID NO: 14, например, нуклеотиды 45-374 SEQ ID NO: 1, нуклеотиды 26-676 SEQ ID NO: 3, нуклеотиды 24-353 SEQ ID NO: 5, нуклеотиды 48-686 SEQ ID NO: 7, нуклеотиды 265-570 SEQ ID NO: 9, нуклеотиды 300-770 SEQ ID NO: 11 или нуклеотиды 331-738 SEQ ID NO: 13. В предпочтительном варианте осуществления изобретения выделенная ДНК находится в форме векторной молекулы, содержащей ДНК, представленную в SEQ ID NO: 1 или SEQ ID NO: 3.
Третьим объектом настоящего изобретения является способ диагностики дистрофии сетчатки у человека, предусматривающий выявление снижения транскрипции матричной РНК, транскрибируемой на основе Rdcvf-1- или Rdcvf'2-кодирующей ДНК, в глазу млекопитающего, предпочтительно человека, где такое снижение транскрипции является диагностическим признаком того, что пациент страдает от дистрофии сетчатки или патологического старения (ARMD). Другой вариант осуществления изобретения относится к способу диагностики дистрофии сетчатки в организме млекопитающего, предпочтительно человека, предусматривающему измерение количества полипептида Rdcvf1 или Rdcvf2 или его фрагментов в глазу человека, в отношении которого имеется предположение о том, что он страдает от дистрофии сетчатки, оценку снижения количества полипептида или его фрагментов по сравнению с количеством полипептида или его фрагментов в глазу человека, не страдающего от дистрофии сетчатки, что служит является диагностическим признаком наличия у пациента дистрофии сетчатки.
Следующим объектом настоящего изобретения являются антисмысловые полинуклеотиды, которые регулируют транскрипцию гена Rdcvf1 или Rdcvf2; другим вариантом осуществления изобретения является двухцепочечная РНК, которая обладает способностью регулировать транскрипцию гена Rdcvf1 или Rdcvf2.
Еще одним объектом изобретения является способ получения указанных выше полипептидов, фрагментов полипептидов, вариантов и производных, фрагментов вариантов и производных и их аналогов. Предпочтительным вариантом осуществления этого объекта изобретения являются способы получения указанных выше полипептидов Rdcvf1, предусматривающие культивирование клеток-хозяев, которые несут встроенный экспрессионный вектор, содержащий полученный экзогенным путем полипептид, кодирующий Rdcvf1 или Rdcvf2, в условиях, пригодных для экспрессии полипептидов Rdcvf1 или Rdcvf2 в хозяине, и последующее выделение экспрессированного полипептида.
Еще одним объектом изобретения являются продукты, композиции, процессы и способы, в которых применяют указанные выше полипептиды и полинуклеотиды в том числе для научных, биологических, клинических и терапевтических целей.
Другими конкретными предпочтительными объектами изобретения являются антитело или его фрагмент, обладающие способностью специфически связываться с полипептидом, имеющим аминокислотную последовательность, представленную в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 8, т.е. Rdcvf1, или SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14, т.е. Rdcvf2. В этой связи наиболее предпочтительными объектами являются антитела, обладающие высокой избирательной способностью в отношении полипептидов Rdcvf1 или Rdcvf2 млекопитающего, предпочтительно мыши и наиболее предпочтительно человека, или фрагментами таких полипептидов Rdcvf1 или Rdcvf2. Родственным с этим объектом изобретения является антитело или его фрагмент, которое(й) связывается с фрагментом или частью аминокислотной последовательности, представленной в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14.
Следующим объектом изобретения являются способы лечения заболевания у пациента, где заболевание опосредуется или связано с изменением экспрессии гена Rdcvf1 или Rdcvf2, например, снижением уровня полипептида RDCVF1 или RDCVF2 в глазу, предусматривающие введение пациенту, нуждающемуся в этом, терапевтически эффективного количества протеина RDCVF1 или RDCVF2, представленного в SEQ ID NO: 2 SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14, или родственного протеина или его фрагмента или части. В изобретении предложены также способы диагностики с помощью иммуноанализа заболевания или состояния, связанного со снижением экспрессии гена Rdcvf1 или Rdcvf2 или со снижением количества полипептида RDCVF1 или RDCVF2, у пациента, предусматривающие применение антитела, которое связывается с полипептидом, имеющим аминокислотную последовательность, представленную в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14, или ее фрагмент или часть.
Еще одним объектом изобретения являются клетки, которые могут размножаться in vitro, предпочтительно клетки позвоночных, которые способны при их выращивании в виде культуры продуцировать полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14 или ее фрагменты, где клетки содержат контролирующие транскрипцию последовательности ДНК, отличные от мышиных или человеческих контролирующих транскрипцию последовательностей Rdcvf1 или Rdcvf2, причем контролирующие транскрипцию последовательности контролируют транскрипцию ДНК, которая кодирует полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14 или ее фрагменты.
Родственным объектом настоящего изобретения является способ получения полипептидов Rdcvf1 или Rdcvf2, предусматривающий культивирование клетки-хозяина, содержащей встроенный в нее экспрессионный вектор, который содержит полученный экзогенным путем полинуклеотид, кодирующий Rdcvf1 или Rdcvf2, в условиях, пригодных для экспрессии полипептидов Rdcvf1 или Rdcvf2 в клетке-хозяине, с получением экспрессированного полипептида, и выделение экспрессированного полипептида.
Еще одним объектом настоящего изобретения являются способы анализа и наборы, включающие компоненты, необходимые для обнаружения аномальной экспрессии, например, пониженного по сравнению с нормальным уровня экспрессии полинуклеотидов Rdcvf1 или Rdcvf2 или полипептидов или их фрагментов в образцах ткани, полученных из организма пациента, где такие наборы содержат, например, антитела, которые обладают способностью к связыванию с Rdcvf1 или Rdcvf2, или олигонуклеотидные зонды, которые гибридизуются с полинуклеотидами по изобретению. В предпочтительном варианте осуществления изобретения такие наборы содержат также инструкции, подробно описывающие процессы применения компонентов набора.
Следующим объектом изобретения является полипептид Rdcvf1 или Rdcvf2, предназначенный для лечения человека или животного. Родственным объектом изобретения является применение полипептида Rdcvf1 или Rdcvf2 или его фрагмента, нуклеотида, кодирующего Rdcvf1 или Rdcvf2, или его фрагмента, или антитела, которое связывается с Rdcvf1 или Rdcvf2 или его фрагментом, для изготовления лекарственного средства, предназначенного для лечения дистрофии сетчатки.
Еще одним объектом изобретения является обладающий защитным действием в отношении сетчатки агент, содержащий полипептид, выбранный из группы, включающей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14, и необязательно фармацевтически приемлемый носитель. Родственный объект изобретения относится к фармацевтическим композициям, содержащим полипептид Rdcvf1 или Rdcvf2 или его фрагмент, нукдеотид, кодирующий Rdcvf1 или Rdcvf2 или его фрагмент, предназначенным для лечения дистрофии сетчатки. Еще одним родственным объектом изобретения является фармацевтическая композиция, содержащая терапевтически эффективное количество полипептида, выбранного из группы, включающей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14, и фармацевтически приемлемый носитель.
Еще одним родственным объектом изобретения является способ лечения дистрофии сетчатки, заключающийся во введении пациенту, нуждающемуся в этом, терапевтически эффективного количества полипептида, выбранного из группы, включающей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14, в сочетании с фармацевтически приемлемым носителем.
Еще одним объектом изобретения являются способы идентификации молекул, которые обладают способностью связываться с Rdcvf1 или Rdcvf2 и/или модулировать активность Rdcvf1 или Rdcvf2, или молекул, которые обладают способностью связываться с нуклеотидными последовательностями, которые модулируют транскрипцию или трансляцию Rdcvf1 или Rdcvf2. Такие методы описаны, например, в патентах US 5541070, 5567317, 5593853, 5670326, 5679582, 5856083, 5858657, 5866341, 5876946, 5989814, 6010861, 6020141, 6030779 и 6043024, содержание всех перечисленных патентов включено в полном объеме в настоящее описание в качестве ссылки. Молекулы, выявленные такими методами, также подпадают под объем настоящего изобретения.
Следующий объект изобретения относится к способам введения нуклеиновых кислот по изобретению в один или несколько типов ткани пациента, нуждающегося в таком лечении, для того, чтобы внутри ткани происходила экспрессия и/или секреция клетками одного или нескольких протеинов, кодируемых нуклеиновыми кислотами.
Еще одним объектом изобретения является способ получения предназначенных для имплантации фоторецепторных клеток, предусматривающий культивирование фоторецепторных клеток совместно с RdCVF1 или RdCVF2.
Другие цели, особенности, преимущества и объекты настоящего изобретения будут очевидны специалистам на основе приведенного ниже описания. При этом следует понимать, что приведенное ниже описание и конкретные примеры, касающиеся предпочтительных вариантов осуществления изобретения, представлены только с целью иллюстрации. Для специалистов в данной области после изучения приведенного ниже описания и изучения других разделов настоящего изобретения будет очевидно, что можно сделать различные изменения и модификации в рамках объема и сущности изобретения.
Краткое описание чертежей
На чертежах представлены:
на фиг.1 - нуклеотидная последовательность мышиного Rdcvf1, полученная путем экспрессионного клонирования, и аминокислотная последовательность мышиного RdCVF1;
на фиг.2 - аминокислотная последовательность мышиного Rdcvf1L;
на фиг.3 - нуклеотидная последовательность человеческого Rdcvf1 и аминокислотная последовательность человеческого Rdcvf1;
на фиг.4 - нуклеотидная последовательность человеческого Rdcvf1L и аминокислотная последовательность человеческого Rdcvf1L;
на фиг.5 - нуклеотидная последовательность мышиного Rdcvf2 и аминокислотная последовательность мышиного Rdcvf2;
на фиг.6 - нуклеотидная последовательность мышиного Rdcvf2L и аминокислотная последовательность мышиного Rdcvf2L;
на фиг.7 - нуклеотидная последовательность человеческого Rdcvf2 и аминокислотная последовательность человеческого Rdcvf2;
на фиг.8 - сравнение аминокислотных последовательностей коротких форм Rdcvf: (SEQ ID NO 2, 6, 10 и 14) и длинных форм Rdcvf: (SEQ ID NO 4, 8, 12 и 14);
на фиг.9 - праймеры для GST-Rdcvf1;
на фиг.10 - множественные сравнения последовательностей RDCVF1/RDCVF2;
на фиг.11 - результаты сравнительного анализа последовательностей мышиного и человеческого RDCVF2;
на фиг.12 - результаты множественного сравнительного анализа последовательности мышиного Rdcvf2 и последовательностей EST-клонов be552141, bi517442, bg707818 и bi603812;
на фиг.13 - результаты множественного сравнительного анализа последовательности Rdcvf1 и последовательностей клонов EST bg299078, ai716631, bg294111, be108041 и bg395178;
на фиг.14 - EST-последовательность bg299078, скорректированная для того, чтобы она совпадала с последовательностью Rdcvf1;
на фиг.15 - EST-последовательность bg294111, скорректированная для того, чтобы она совпадала с последовательностью Rdcvf1L;
на фиг.16 - результаты проведенного в режиме реального времени ОТ-ПЦР-анализа экспрессии аррестина палочками (А) и RdCSF1 (Б) в 5-недельной сетчатке C57BL/6 и 5-недельной N (обозначено серым цветом) и С3Н/НЕ и N (обозначено красным цветом);
на фиг.17 - результаты ОТ-ПЦР-анализа, свидетельствующие о том, что экспрессия Rdcvf2 зависит от присутствия палочек и его экспрессия происходит в других частях ЦНС;
на фиг.18 - результаты ПЦР-анализа, свидетельствующие о том, что экспрессия RdCVF1 зависит от присутствия палочек.
Подробное описание изобретения
Все процитированные заявки на патент, патенты и литературные публикации включены в настоящее описание в полном объеме в качестве ссылки.
При осуществлении настоящего изобретения применяют многочисленные пригодные для данной цели методы молекулярной биологии, микробиологии и рекомбинантной ДНК. Эти методы хорошо известны и описаны, например, в Current Protocols in Molecular Biology, тома I, II и III (под ред. F.M.Ausubel), 1997; Sambrook и др., 1989, Molecular Cloning: A Laboratory Manual, изд-во Cold Spring Harbor Laboratory Press, 2-е изд., Cold Spring Harbor, N.Y.; ДНК Cloning: A Practical Approach, тома I и II (под ред. D.N.Glover.), 1985; Oligonucleotide Synthesis (под ред. M.L.Gait.), 1984; Nucleic Acid Hybridization (под ред. Hames и Higgins), 1985; Transcription and Translation (под ред. Hames и Higgins), 1984; Animal Cell Culture (под ред. R.I.Freshney), 1986; Immobilized Cells and Enzymes, изд-во IRL Press, 1986; Perbal, A Practical Guide to Molecular Cloning; the series, Methods in Enzymology, изд-во Academic Press, Inc., 1984; Gene Transfer Vectors for Mammalian Cells (под ред. J.H.Miller и M.P.Calos, изд-во Cold Spring Harbor Laboratory, 1987; и Methods in Enzymology, том 154 и том 155 (под ред. Wu и Grossman и Wu соответственно).
В контексте настоящего описания понятие «дифференциально экспрессируемый ген» относится к (а) гену, содержащему по меньшей мере одну из указанных в настоящем описании последовательностей ДНК (например, представленную на фиг.1 и SEQ ID NO: 1, или представленную на фиг.2 и SEQ ID NO: 3); (б) любой последовательности ДНК, кодирующей аминокислотную последовательность, которая кодируется последовательностями ДНК, представленными в настоящем описании (например, представленными на фиг.1 и SEQ ID NO: 2 или представленными на фиг.2 и SEQ ID NO: 4); или (в) любой последовательности ДНК, практически аналогичной приведенным в настоящем описании кодирующим последовательностям.
В контексте настоящего описания понятие "практически аналогичный" применительно к нуклеотидной последовательности в наиболее широком смысле относится к нуклеотидной последовательности, соответствующей нуклеотидной последовательности, с которой производится сравнение, где соответствующая последовательность кодирует полипептид, имеющий практически такую же структуру и функцию, что и полипептид, кодируемый нуклеотидной последовательностью, с которой производится сравнение, например, в том случае, если замены аминокислот не оказывают влияния на функцию полипептида. Предпочтительно, чтобы практически аналогичная нуклеотидная последовательность кодировала полипептид, кодируемый нуклеотидной последовательностью, с которой производится сравнение. Предпочтительно процент идентичности между практически аналогичной нуклеотидной последовательностью и нуклеотидной последовательностью, с которой производится сравнение, составляет по меньшей мере 90, более предпочтительно по меньшей мере 95, еще более предпочтительно по меньшей мере 99%. Сравнение последовательностей осуществляют с использованием алгоритма сравнения последовательностей Смита-Уотермана (см., например, Waterman M.S. Introduction to Computational Biology: Maps, sequences and genomes, изд-во Chapman & Hall., London: 1995, ISBN 0-412-99391-0, или на сайте http://www-hto.usc.edu/software/seqaln/index.html). В программе localS, версия 1.16, используют следующие параметры: совпадение: 1, штраф за несовпадение: 0,33, штраф за открытие бреши: 2, штраф за расширение бреши: 2. Нуклеотидную последовательность, которая является «практически аналогичной» нуклеотидной последовательности, с которой производится сравнение, гибридизуют с нуклеотидной последовательностью, с которой производится сравнение, в 7% додецилсульфате натрия (ДСН), 0,5М NaPO4, 1 мМ ЭДТК при 50°С при отмывке 2Х SSC, 0,1% ДСН при 50°С, более предпочтительно в 7% додецилсульфате натрия (ДСН), 0,5М NaPO4, 1 мМ ЭДТК при 50°С при отмывке 1X SSC, 0,1% ДСН при 50°С, еще более предпочтительно в 7% додецилсульфате натрия (ДСН), 0,5М NaPO4, 1 мМ ЭДТК при 50°С при отмывке 0,5Х SSC, 0,1% ДСН при 50°С, предпочтительно в 7% додецилсульфате натрия (ДСН), 0,5М NaPO4, 1 мМ ЭДТК при 50°С при отмывке 0,1X SSC, 0,1% ДСН при 50°С, более предпочтительно в 7% додецилсульфате натрия (ДСН), 0,5М NaPO4, 1 мМ ЭДТК, 0,5 М NaPO4, 1 мМ ЭДТК при 50°С при отмывке 0,1X SSC, 0,1% ДСН при 65°С, при этом она все еще сохраняет способность кодировать функционально эквивалентный генный продукт.
Представленные в настоящем описании дифференциально экспрессируемые гены экспрессируются в ткани глаза и, в частности, они продуцируются в клетках палочек, однако в тканях человека, страдающего дистрофией сетчатки, такой как пигментный ретинит, связанная с возрастом дегенерация желтого пятна, синдром Барде, синдром Бессена-Корнцвейга, болезнь Беста, хороидема, атрофия мозговых извилин, врожденный амоуроз, синдром Рефсана, синдром Старгардта и синдром Ашера, они продуцируются в уменьшенных количествах, т.е. уровень их экспрессии меньше, чем в соответствующих тканях людей, не страдающих дистрофией сетчатки. Уровни матричной РНК, транскрибированной на основе дифференциально экспрессируемых генов, и протеина, транслированного из такой мРНК, которые присутствуют в тканях палочек и/или связаны с такими тканями, по меньшей мере в два раза, предпочтительно по меньшей мере в пять раз, более предпочтительно по меньшей мере в десять раз, наиболее предпочтительно по меньшей мере приблизительно в сто раз ниже уровней мРНК и протеина, выявленных в соответствующих тканях людей, которые не страдают дистрофией сетчатки. В настоящем описании такое снижение транскрипции мРНК Rdcvf1 или Rdcvf2 обозначено как «пониженная транскрипция».
В контексте настоящего описания понятие «клетка-хозяин» относится к прокариотической или эукариотической клетке, несущей гетерологичную ДНК, которая была встроена в клетку путем, например, электропорации, осаждения с помощью фосфата кальция, микроинъекции, трансформации, вирусной инфекции и т.п.
В контексте настоящего описания понятие «гетерологичный» означает «происходящий из различных естественных источников» или относится к состоянию, не встречающемуся в естественных условиях. Например, если клетку-хозяина трансформируют ДНК или геном, полученными из другого организма, в частности, из организма другого вида, то ген является гетерологичным по отношению к клетке-хозяину, а также по отношению к потомству клеток-хозяев, несущих этот ген. Аналогично этому понятие «гетерологичный» относится к нуклеотидной последовательности, полученной и встроенной в клетку того же исходного типа, встречающегося в естественных условиях, но которая находится в состоянии, не встречающемся в естественных условиях, например, присутствует в другом количестве копий или находится под контролем других регуляторных элементов.
Векторная молекула представляет собой молекулу нуклеиновой кислоты, в которую можно встраивать гетерологичную нуклеиновую кислоту и которую затем можно вводить в соответствующую клетку-хозяина. Предпочтительно векторы имеют один или несколько сайтов инициации репликации и один или несколько сайтов, в которые можно встраивать рекомбинантную ДНК. Как правило, векторы обладают определенными характеристиками, по которым клетки, несущие векторы, можно отличать от клеток, не имеющих векторов, например, они кодируют гены, обусловливающие устойчивость к лекарственным средствам. Обычно применяют такие векторы, как плазмиды, вирусные геномы и (прежде всего, в случае дрожжей и бактерий) «искусственные хромосомы».
В настоящем описании «плазмиды», как правило, обозначаются прописной буквой «р», перед которой или после которой следуют заглавные буквы и/или номера в соответствии со стандартными правилами обозначений, известными специалистам в данной области. Указанные в настоящем описании плазмиды, либо поступают в продажу, либо являются общедоступными без ограничений, либо их можно сконструировать на основе доступных плазмид, применяя стандартным образом хорошо известные опубликованные методы. Многие плазмиды и другие клонирующие и экспрессионные векторы, которые можно применять согласно настоящему изобретению, являются хорошо известными и специалисты в данной области могут легко их использовать. Кроме того, специалисты в данной области легко могут сконструировать любое количество других плазмид, пригодных для применения согласно изобретению. Специалист в данной области на основе настоящего описания легко может понять свойства, конструкцию и применение таких плазмид, а также других векторов по настоящему изобретению.
Понятие «выделенный» означает, что продукт выделен из своего исходного окружения (например, из естественного окружения, если он имеет естественное происхождение). Например, встречающийся в естественных условиях полинуклеотид или полипептид, присутствующий в организме живого животного, не является выделенным, однако этот же полинуклеотид или полипептид, отделенный от некоторых или всех сопутствующих материалов, присутствующих в естественных условиях (в природной системе), является выделенным, даже если его затем повторно интродуцируют в природную систему. Такие полинуклеотиды могут представлять собой часть вектора и/или такие полинуклеотиды или полипептиды могут представлять собой часть композиции и они все еще подпадают под это понятие, если такой вектор или композиция не находятся в их естественном окружении.
В контексте настоящего описания понятие «контролирующая транскрипцию последовательность» относится к последовательностям ДНК, таким как инициирующие последовательности, энхансерные последовательности и промоторные последовательности, которые индуцируют, подавляют или иным образом контролируют транскрипцию кодирующих протеин нуклеотидных последовательностей, с которыми они функционально связаны.
В контексте настоящего описания понятие «последовательности, контролирующие транскрипцию Rdcvf1» или «последовательности, контролирующие транскрипцию Rdcvf2» обозначают любые из таких контролирующих транскрипцию последовательностей, которые, как правило, связаны с геном Rdcvf1 или Rdcvf2 млекопитающих, предпочтительно с геном Rdcvf2, присутствующим в геноме мыши или человека.
В контексте настоящего описания понятие «полученная из организма кроме человека последовательность, контролирующая транскрипцию» обозначает любую последовательность, контролирующую транскрипцию, которая не присутствует в геноме человека.
В контексте настоящего описания понятие «полипептид» используется взаимозаменяемо с понятиями «полипептиды» и «протеин(ы)».
В контексте настоящего описания «химическое производное» полипептида по изобретению означает полипептид по изобретению, который содержит дополнительные химические фрагменты, которые обычно не содержатся в молекуле. Такие фрагменты могут улучшать растворимость, абсорбцию, биологическое время полужизни молекулы и т.д. В альтернативном варианте фрагменты могут снижать токсичность молекулы, устранять или уменьшать какие-либо нежелательные побочные действия молекулы и т.д. Фрагменты, обладающие способностью оказывать такие действия, описаны, например, в Remington's Pharmaceutical Sciences, 16-е изд., изд-во Mack Publishing Co., Easton, Pa. (1980).
В контексте настоящего описания «нейрозащитный агент» обозначает соединение, которое предупреждает дегенерацию нервных клеток или защищает их от нее. «Агент, защищающий сетчатку» обозначает соединение, которое предупреждает дегенерацию клеток сетчатки или защищает их от нее.
Под объем изобретения подпадают молекулы нуклеиновой кислоты, предпочтительно молекулы ДНК, такие как (1) выделенные молекулы, имеющие нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 3, (2) выделенные молекулы нуклеиновой кислоты, имеющие нуклеотидные последовательности, которые гибридизуются в строгих условиях с выделенной ДНК, представленной в SEQ ID NO: 1 или SEQ ID NO: 3, и (3) нуклеотидные последовательности, которые гибридизуются с последовательностями, указанными выше в (1) или (2). Как указано выше, такие условия гибридизации могут быть строгими или не строгими (расслабленными). В тех случаях, когда молекулы нуклеиновой кислоты представляют собой дезоксиолигонуклеотиды ("олигонуклеотиды"), строгие условия могут обозначать, например, отмывку в 6Х SSC/0,05% пирофосфате натрия при 37°С (для олигонуклеотидов, состоящих из 14 оснований), при 48°С (для олигонуклеотидов, состоящих из 17 оснований), при 55°С (для олигонуклеотидов, состоящих из 20 оснований) и при 60°С (для олигонуклеотидов, состоящих из 23 оснований). Пригодные диапазоны таких строгих условий для нуклеиновых кислот различного состава описаны у Krause и Aaronson, Methods in Enzymology, 200, 1991, cc.546-556, а также в процитированном выше справочнике Maniatis и др.
Такие молекулы нуклеиновой кислоты могут действовать в качестве антисмысловых молекул гена-мишени, которые можно применять, например, для регуляции гена-мишени и/или в качестве антисмысловых праймеров в реакциях амплификации нуклеотидных последовательностей гена-мишени. Кроме того, такие последовательности можно использовать в качестве части рибозима и/или последовательностей тройных спиралевидных структур, которые также можно применять для регуляции гена-мишени. Кроме того, такие молекулы можно применять в качестве компонентов в диагностических методах, благодаря чему можно выявлять присутствие аллеля, вызывающего заболевание, связанное с RdCVF1 или RdCVF2.
Под объем изобретения подпадают также (а) векторы, содержащие любую из указанных выше кодирующих последовательностей (т.е. смысловые последовательности) и/или ее комплементы (т.е. антисмысловые последовательности); (б) экспрессионные векторы, которые содержат любую из указанных выше кодирующих последовательностей, функционально связанную с регуляторным элементом, который контролирует экспрессию кодирующих последовательностей, и (в) сконструированные методами генной инженерии клетки-хозяева, которые содержат любую из указанных выше кодирующих последовательностей, функционально связанную с регуляторным элементом, контролирующим экспрессию кодирующих последовательностей в клетке-хозяине. В контексте настоящего описания регуляторные элементы включают (но не ограничиваясь ими) индуцибельные и неиндуцибельные промоторы, энхансеры, операторы и другие известные специалистам в данной области элементы, которые контролируют и регулируют экспрессию.
Под объем изобретения подпадают фрагменты любой из указанных в настоящем описании нуклеотидных последовательностей. Фрагменты полноразмерного гена Rdcvf1 или Rdcvf2 можно использовать в качестве зонда гибридизации для библиотеки кДНК с целью выделения полноразмерного гена и выделения других генов, обладающих высоким уровнем сходства с геном Rdcvf1 или Rdcvf2 и аналогичной биологической активностью. Зонды такого типа предпочтительно содержат по меньшей мере приблизительно 30 оснований и могут содержать, например, от приблизительно 30 до приблизительно 50 оснований, от приблизительно 50 до приблизительно 100 оснований, от приблизительно 100 до приблизительно 200 оснований или более 200 оснований (например, 300). Зонд можно применять также для выявления клона кДНК, соответствующего первичному транскрипту, и геномного клона или клонов, которые содержат полный ген Rdcvf1 или Rdcvf2, включая регуляторную и промоторную области, экзоны и интроны. Примером скрининга является выделение кодирующей области гена Rdcvf1 или Rdcvf2 с использованием известной последовательности ДНК для синтеза олигонуклеотидного зонда или случайного примирования выделенной последовательности, представленной на фиг.1-8. Меченые олигонуклеотиды, имеющие последовательность, комплементарную последовательности гена по настоящему изобретению, используют для скрининга библиотеки человеческой кДНК, геномной ДНК для определения индивидуальных клонов из библиотеки, которые гибридизуются с зондом.
Помимо описанных выше последовательностей генов можно без многочисленных экспериментов идентифицировать и легко выделять с помощью методов молекулярной биологии ортологи таких последовательностей, которые могут присутствовать, например, в других видах. Кроме того, в других генетических локусах генома могут присутствовать гены, которые кодируют протеины, обладающие большой степенью гомологии (гомологи) с одним или несколькими доменами таких генных продуктов. Такие гены можно идентифицировать также с помощью аналогичных методов. Примеры ортологов или гомологов представлены на фиг.8, 10, 11, 12 или 13.
Например, в выделенную экспрессированную последовательность гена можно ввести метку и использовать ее для скрининга библиотеки кДНК, полученной из мРНК представляющего интерес организма. Можно использовать расслабленные условия гибридизации, если библиотека кДНК получена из организма, отличного от типа организма, из которого выведена несущая метку последовательность. В альтернативном варианте для скрининга геномной библиотеки, полученной из представляющего интерес организма, можно применять меченый фрагмент, используя и в этом случае соответствующие расслабленные условия. Такие расслабленные условия хорошо известны специалистам в данной области и их можно целенаправленно варьировать в зависимости от филогении конкретных организмов, из которых получают библиотеку и меченые последовательности. Инструкции, касающиеся выбора таких условий, можно найти, например, в процитированном выше руководстве Sambrook и др.
Кроме того, можно выделять ранее неизвестную экспрессируемую последовательность генного типа, осуществляя ПЦР с использованием двух пулов вырожденных олигонуклеотидных праймеров, сконструированных на основе аминокислотных последовательностей, кодируемых представляющим интерес геном. В качестве матрицы для реакции может служить кДНК, полученная путем обратной транскрипции мРНК, выделенной из линий клеток или ткани человека или организма, отличного от человека, в отношении которых известно или имеется предположение, что они экспрессируют гомологи или полученные в результате сплайсинга варианты.
ПЦР-продукт можно субклонировать и секвенировать для подтверждения того, что амплифицированные последовательности представляют собой последовательности, аналогичные нуклеотидным последовательностям экспрессированного гена. Затем ПЦР-фрагмент можно применять для выделения полноразмерного клона кДНК с помощью различных методов. Например, в амплифицированный фрагмент можно вводить метку и использовать для скрининга библиотеки кДНК бактериофага. В альтернативном варианте меченый фрагмент можно использовать для скрининга геномной библиотеки.
Метод ПЦР можно применять также для выделения полноразмерных последовательностей кДНК. Например, с помощью стандартных методов можно выделять РНК из соответствующих источников, представляющих собой клетки или ткани. При синтезе первой цепи реакцию обратной транскрипции можно осуществлять на основе РНК с использованием олигонуклеотидного праймера, специфического в отношении большей части 5'-конца амплифицированного фрагмента. Затем образовавшийся гибрид РНК/ДНК можно «наращивать» остатками гуанина с помощью стандартной обработки концевых участков трансферазой, гибрид можно расщеплять РНКазой Н, и затем можно осуществлять синтез второй цепи путем примирования с использованием поли-С праймера. Таким образом, можно легко выделять последовательности кДНК, расположенные против хода транскрипции относительно амплифицированного фрагмента. Обзор стратегий клонирования, которые можно применять для этой цели, приведен, например, у Sambrook и др., 1989, выше.
В тех случаях, когда идентифицированный дифференциально экспрессируемый ген представляет собой нормальный ген или ген дикого типа, этот ген можно использовать для выделения мутантных аллелей гена. Такое выделение предпочтительно осуществляют в случае процессов и нарушений, в отношении которых известно или предполагается, что они имеют генетическую основу. Мутантные аллели можно выделять из организма пациентов, в отношении которых известно или предполагается, что они имеют генотип, обусловливающий симптомы заболевания. Мутантные аллели и продукты мутантных аллелей можно затем применять в описанных ниже диагностических системах анализа.
кДНК мутантного гена можно выделять, например, с помощью хорошо известного специалистам в данной области метода ОТ-ПЦР. В этом случае первую цепь кДНК можно синтезировать путем гибридизации олиго-дТ олигонуклеотида (или случайных гексамеров) с мРНК, выделенной из ткани пациента, который предположительно несет мутантный аллель, в отношении которой известно или предполагается, что в ней происходит экспрессия мутантного аллеля, и путем удлинения новой цепи с использованием обратной транскриптазы. Затем синтезируют вторую цепь кДНК с использованием олигонуклеотида, который специфически гибридизуется с 5'-концом нормального гена (или с помощью любых других средств). После этого продукт амплифицируют с помощью ПЦР с использованием указанных двух праймеров, клонируют в пригодном векторе и осуществляют секвенирование ДНК с помощью методов, хорошо известных специалистам в данной области. Путем сравнения последовательности ДНК мутантного гена с последовательностью ДНК нормального гена можно выявлять мутацию(и), обусловливающую(ие) потерю или изменение функции продукта мутантного гена.
В альтернативном варианте можно создавать библиотеку геномной или кДНК и осуществлять скрининг с использованием ДНК или РНК, выделенной из ткани пациента, который предположительно несет мутантный аллель, в отношении которой известно или предполагается, что в ней происходит экспрессия представляющего интерес гена. Затем в нормальный ген или любой пригодный его фрагмент можно вводить метку и использовать в качестве зонда для идентификации соответствующего мутантного аллеля в библиотеке. После этого клон, содержащий такой ген, можно очищать стандартными методами, применяемыми в данной области, и подвергать указанному выше секвенированию.
Кроме того, можно создавать библиотеку экспрессируемых последовательностей с использованием ДНК, выделенной из ткани пациента, который предположительно несет мутантный аллель, в отношении которой известно или предполагается, что в ней происходит экспрессия представляющего интерес гена, или кДНК, синтезированной из такой ткани. Таким образом, генные продукты, продуцируемые тканью, предположительно несущей мутацию, можно экспрессировать и подвергать скринингу с помощью стандартных методов скрининга с использованием антител, применяя, как описано ниже, антитела к нормальному генному продукту (см. описание методов скрининга, например, "Antibodies: A Laboratory Manual". /Под ред. Harlow Е. и Lane, изд-во Cold Spring Harbor Press, Cold Spring Harbor, 1988). В тех случаях, когда мутация приводит к тому, что экспрессированный генный продукт имеет измененную функцию (например, в результате миссенс-мутации), по-видимому, следует подвергать перекрестной реакции с продуктом мутантного гена набор поликлональных антител. Входящие в библиотеку клоны, выявленные на основе их реакции с такими мечеными антителами, можно очищать и подвергать секвенированию согласно описанному выше методу.
Дифференциально экспрессируемые генные продукты включают протеины, кодируемые нуклеотидной последовательностью, представленной в SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11 или SEQ ID NO: 13, в частности, полипептид, представляющий собой или включающий аминокислотную последовательность, представленную в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14, или ее фрагменты.
Кроме того, экспрессированные генные продукты могут включать протеины, представляющие собой функционально эквивалентные генные продукты. Такой эквивалентный генный продукт может иметь делеции, добавления или замены аминокислотных остатков в аминокислотной последовательности, кодируемой описанными выше последовательностями дифференциально экспрессируемого гена, но такие, которые приводят к «молчащему» изменению, в результате чего получается функционально эквивалентный продукт дифференциально экспрессируемого гена (полиморфизмы). Замены аминокислот можно производить на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или с учетом амфипатической природы рассматриваемых остатков и на основе сравнения с аминокислотными последовательностями других видов.
Например, к неполярным (гидрофобным) аминокислотам относятся аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; к полярным нейтральным аминокислотам относятся глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; к положительно заряженным (основным) аминокислотам относятся аргинин, лизин и гистидин; а к отрицательно заряженным (кислотным) аминокислотам относятся аспартамовая кислота и глутаминовая кислота. В контексте настоящего описания понятие "функциональный эквивалент" может относиться к протеину или полипептиду, которые обладают практически такой же активностью in vivo или in vitro, что и эндогенные продукты дифференциально экспрессируемого гена, кодируемые указанными выше последовательностями дифференциально экспрессируемых генов. Понятие "функциональный эквивалент" может относиться также к протеинам или полипептидам, обладающим способностью взаимодействовать с другими находящимися внутри клетки или внеклеточными молекулами таким же путем, как и соответствующая часть продукта эндогенного дифференциально экспрессируемого гена. Например, понятие «функционально эквивалентный» относится к пептиду, который согласно данным иммуноанализа обладает способностью уменьшать связывание антитела с соответствующим пептидом (т.е. аминокислотной последовательностью пептида, которая была модифицирована для получения «функционально эквивалентного» пептида) эндогенного протеина, или к самому эндогенному протеину, где антитело представляет собой антитело к соответствующему пептиду эндогенного протеина. Эквимолярная концентрация функционально эквивалентного пептида может уменьшать указанное выше связывание соответствующего пептида по меньшей мере приблизительно на 5%, предпочтительно приблизительно на 5-10%, более предпочтительно приблизительно на 10-25%, еще более предпочтительно приблизительно на 25-50%, и наиболее предпочтительно приблизительно на 40-50%.
Продукты дифференциально экспрессируемого гена можно получать с помощью методов рекомбинантной ДНК, известных в данной области. Так, в настоящем описании приведены методы получения полипептидов и пептидов, кодируемых дифференциально экспрессируемыми генами по изобретению, основанные на экспрессии нуклеиновой кислоты, кодирующей последовательности дифференциально экспрессируемых генов. Для создания экспрессионных векторов, содержащих кодирующие последовательности продуктов экспрессируемого гена и соответствующие сигналы контроля транскрипции/трансляции. Можно применять хорошо известные методы, включающие, например, методы рекомбинантной ДНК in vitro, методы синтеза и метод рекомбинации/генетической рекомбинации in vivo (см., например, методы, описанные у Sambrook и др., 1989, выше, и у Ausubel и др., 1989, выше). В альтернативном варианте РНК или кДНК, обладающую способностью кодировать последовательности протеина экспрессируемого гена, можно синтезировать химическим путем, например, с использованием синтезаторов (см., например, методы, описанные в "Oligonucleotide Synthesis". /Под ред. Gait, М. J., изд-во IRL Press, Oxford, 1984, указанная публикация полностью включена в настоящее описание в качестве ссылки).
Для экспрессии кодирующих последовательностей дифференциально экспрессируемого гена по изобретению можно использовать различные векторные системы, экспрессируемые в хозяине. Такие экспрессируемые в хозяине системы представляют собой носители, с помощью которых можно получать и затем очищать представляющие интерес последовательности, они включают также клетки, которые после их трансформации или трансфекции соответствующими кодирующими нуклеотидными последовательностями экспрессируют протеин дифференциально экспрессируемого гена по изобретению in situ. Они включают (но не ограничиваясь ими) микроорганизмы, такие как бактерии (например, Е.coli, В.subtilis), которые трансформированы с помощью рекомбинантной ДНК бактериофага, экспрессионные векторы на основе плазмидной ДНК или космидной ДНК, содержащие кодирующие протеин последовательности дифференциально экспрессируемого гена; дрожжи (например, Saccharomyces, Pichia), которые трансформированы рекомбинантными экспрессионными векторами дрожжей, содержащими кодирующие протеин последовательности дифференциально экспрессируемого гена; системы на основе клеток насекомых, инфицированных рекомбинантными экспрессионными вирусными векторами (например, бакуловирусом), содержащими кодирующие протеин последовательности дифференциально экспрессируемого гена; системы на основе клеток растений, инфицированных рекомбинантными экспрессионными вирусными векторами (например, на основе вируса мозаики цветной капусты, CaMV; вируса мозаики табака, TMV), или трансформированных рекомбинантными плазмидными трансформирующими векторами (например, Ti-плазмидой), содержащими кодирующие протеин последовательности дифференциально экспрессируемого гена; или системы на основе клеток млекопитающих (например, COS, СНО, ВНК, 293, 3Т3), несущие рекомбинантные системы экспрессии, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, поздний промотор аденовируса; промотор вируса коровьей оспы 7.5К; ранний промотор гена цитомегаловируса).
Можно осуществлять также экспрессию RDCVF1 или RDCVF2 в клетке, используя ген Rdcvf1 или Rdcvf2, которые являются нативными по отношению к клетке. Методы осуществления такой экспрессии подробно описаны, например, в US 5641670; 5733761; 5968502; и 5994127, содержание всех патентов полностью включено в настоящее описание в качестве ссылки. Клетки, подвергнутые индукции для экспрессии RDCVF1 или RDCVF2, с помощью любого из методов, описанных в патентах US 5641670, 5733761, 5968502 и 5994127, можно имплантировать в соответствующую ткань живого животного для того, чтобы увеличить местную концентрацию RDCVF1 или RDCVF2 в ткани.
Для бактериальных систем в зависимости от желаемого применения можно выбрать многочисленные экспрессионные векторы, предназначенные для экспрессии протеина, кодируемого дифференциально экспрессируемым геном. Например, когда требуется продуцировать большое количество такого протеина, может оказаться целесообразным применять для получения антител или для скрининга пептидных библиотек, например, векторы, обеспечивающие экспрессию высоких уровней продуктов в виде слитого протеина, которые легко поддаются очистке. Такие векторы включают (но не ограничиваясь ими) экспрессируемый в Е.coli экспрессионный вектор pUR278 (Ruther и др., ЕМВО J. 2, 1983, с.1791), в котором кодирующую протеин последовательность дифференциально экспрессируемого гена можно встраивать путем лигирования в вектор в рамке считывания, содержащей кодирующую область lac Z, в результате чего образуется слитый протеин; векторы pIN (Inouye и Inouye, Nucleic Acids Res. 13, 1985, cc.3101-3109; Van Heeke и Schuster, J. Biol. Chem. 264, 1989, cc.5503-5509); и т.п. Можно применять также векторы PGEX для экспрессии чужеродных полипептидов в виде слитых протеинов с глутатион S-трансферазой (GST). Как правило, такие слитые протеины являются растворимыми и их можно легко выделять из лизированных клеток с помощью абсорбции на глутатион-сефарозные гранулы и последующего элюирования в присутствии свободного глутатиона. Векторы PGEX создают таким образом, чтобы они содержали сайты расщепления протеазами тромбином или фактором Ха, благодаря чему протеин клонированного гена-мишени можно выделять из GST-фрагмента с помощью указанных эндопептидаз.
Промоторные области можно выделять из любого требуемого гена с использованием векторов, которые содержат единицу транскрипции репортера, в которой отсутствует промоторная область, такую, например, как единица транскрипции хлорамфениколацетилтрансферазы ("cat") или люциферазы, в направлении по ходу транскрипции от сайта рестрикции или сайтов, предназначенных для встраивания возможного промоторного фрагмента; т.е. фрагмента, который может содержать промотор. Хорошо известно, что встраивание содержащего промотор фрагмента в вектор в сайт рестрикции, расположенный против хода транскрипции относительно гена cat или люциферазы, вызывает проявление CAT- или люциферазной активности, которые можно выявлять стандартными методами САТ-анализа или с помощью люминометрии. Пригодные для этой цели векторы являются хорошо известными и легко доступными. Примерами таких векторов являются три вектора рКК232-8, -рСМ7 и pGL3 (фирма Promega, E1751, регистрационный номер в Genebank u47295). Промоторы для экспрессии полинуклеотидов по настоящему изобретению включают не только хорошо известные и легко доступные промоторы, но также и промоторы, которые можно легко получать описанным выше методом с использованием анализа репортерного гена.
Среди известных бактериальных промоторов, пригодных для экспрессии полинуклеотидов и полипептидов по настоящему изобретению, следует отметить промоторы Е.coli lacI and lacZ, промоторы Т3 и Т7, промотор Т5 tac, промоторы лямбда PR, PL и промотор trp.Среди известных эукариотических промоторов, пригодных для рассматриваемой цели, следует отметить очень ранний промотор ЦМВ (цитомегаловирус), тимидинкиназный промотор вируса герпеса простого (ВПГ), ранний и поздний промоторы обезьяньего вируса ОВ-40, промоторы ретровирусных LTR (длинные концевые повторы), такие как промоторы вируса саркомы Рауса ("RSV"), и промоторы металотионеина, такие как мышиный промотор металлотионеина-I.
Среди систем, основанных на использовании клеток насекомых, вирус ядерного полиэдроза Autographa californica (AcNPV) представляет собой одну из нескольких систем, основанных на использовании клеток насекомых, которую можно применять в качестве вектора для экспрессии чужеродных генов. Вирусы выращивают в клетках Spodoptera frugiperda. Кодирующую последовательность дифференциально экспрессируемого гена можно клонировать индивидуально в неэссенциальных областях (например, ген полиэдрина) вируса и помещать под контроль промотора AcNPV (например, промотора полиэдрина). Успешное встраивание кодирующей последовательности дифференциально экспрессируемого гена может приводить к инактивации гена полиэдрина и продуцированию «невкрапленного» рекомбинантного вируса (т.е. вируса, у которого отсутствует белковая оболочка, кодируемого геном полиэдрина). Затем такие рекомбинантные вирусы используют для инфицирования клеток Spodoptera frugiperda, в которых происходит экспрессия встроенного гена (см., например. Smith и др., J. Virol. 46, 1983, 584; Smith, патент США №4215051).
В случае использования в качестве клеток-хозяев клеток млекопитающих можно применять многочисленные экспрессионные системы на основе вирусов. В тех случаях, когда в качестве экспрессионного вектора используют аденовирус, представляющую интерес кодирующую последовательность дифференциально экспрессируемого гена можно лигировать с комплексом, контролирующим транскрипцию/трансляцию аденовируса, например, поздним промотором и трехраздельной лидерной последовательностью. Затем такой химерный ген можно встраивать в геном аденовируса с помощью методов рекомбинации in vitro или in vivo. Встраивание в неэссенциальную область вирусного генома (например, в область Е1 или Е3) приводит к получению рекомбинантного вируса, который является жизнеспособным и обладает способностью экспрессировать протеин дифференциально экспрессируемого гена в инфицированных хозяевах (см., например, Logan и Shenk, Proc. Natl. Acad. Sci. USA 81, 1984, cc.3655-3659). Для эффективной трансляции встроенных кодирующих последовательностей дифференциально экспрессируемого гена могут требоваться также специфические сигналы инициации. Такие сигналы включают инициирующий кодон ATG и смежные последовательности. В тех случаях, когда в соответствующий экспрессионный вектор встраивают полный дифференциально экспрессируемый ген, включая его собственный инициирующий кодон и смежные последовательности, могут не требоваться включения дополнительных регулирующих трансляцию сигналов. Однако в тех случаях, когда встраивают только часть кодирующей последовательности дифференциально экспрессируемого гена, следует вводить экзогенные регулирующие трансляцию сигналы, которые могут включать инициирующий кодон ATG. Кроме того, для того чтобы гарантировать трансляцию полной вставки, инициирующий кодон должен соответствовать рамке считывания требуемой кодирующей последовательности. Такие экзогенные регулирующие трансляцию сигналы (последовательность Козака) и инициирующие кодоны могут иметь различное происхождение, их можно получать как из природных источников, так и путем синтеза. Эффективность экспрессии можно повышать путем включения соответствующих энхансеров транскрипции, терминаторов транскрипции и т.д. (см. Bittner и др., Methods in Enzymol, 153, 1987, cc.516-544).
Процедура выбора соответствующих векторов и промоторов для экспрессии в клетке-хозяине является хорошо известной и методы, используемые для экспрессии векторных конструкций, встраивания вектора в хозяина и экспрессии в хозяине являются стандартными для специалистов в данной области.
Как правило, рекомбинантные экспрессионные векторы должны включать сайт инициации репликации, промотор, полученный из обладающего высоким уровнем экспрессии гена, который используют для контроля транскрипции структурной последовательности, расположенной по ходу транскрипции, и селектируемый маркер, позволяющий выделять клетки, содержащие вектор, после их обработки вектором.
Кроме того, можно выбирать штамм клеток-хозяев, который позволяет модулировать экспрессию встроенных последовательностей или модифицировать и процессировать генные продукты требуемым специфическим образом. Такие модификации (например, гликозилирование) и процессирование (например, расщепление) протеинов могут иметь важное значение для функции протеина. Различные клетки-хозяева обладают характерными для них и специфическими механизмами посттрансляционного процессинга и модификации протеинов. Для обеспечения правильной модификации и процессинга экспрессируемого чужеродного протеина можно выбирать соответствующие системы клеточных линий или хозяев. Для этой цели можно использовать эукариотические клетки-хозяева, которые обладают клеточным механизмом, позволяющим соответствующим образом осуществлять процессирование первичного транскрипта, гликозилирование и фосфорилирование генного продукта. Такие клетки-хозяева, выделенные из организма млекопитающих, включают (но не ограничиваясь ими) СНО, VERO, ВНК, HeLa, COS, MDCK, 293, 3Т3, WI38 и т.д.
Для продолжительного производства рекомбинантных протеинов с высоким выходом предпочтительно, чтобы экспрессия была стабильной. Например, можно конструировать линии клеток, которые стабильно экспрессируют дифференциально экспрессируемый протеин. Вместо того чтобы использовать экспрессионные векторы, содержащие вирусные сайты инициации репликации, клетки-хозяева можно трансформировать с помощью ДНК, находящейся под контролем соответствующих контролирующих экспрессию элементов (например, промоторных, энхансерных последовательностей, терминаторов транскрипции, сайтов полиаденилирования и т.д.), и с использованием селектируемого маркера. После встраивания чужеродной ДНК сконструированные клетки выращивают в обогащенных средах в течение 1-2 дней и затем переносят в избирательные среды. Селектируемый маркер придает устойчивость рекомбинантной плазмиды к селекции и позволяет осуществлять стабильную интеграцию плазмид в хромосомы клеток и выращивать их, получая небольшие группы клеток, которые в свою очередь можно клонировать и размножать с получением линий клеток. Этот метод предпочтительно можно использовать для конструирования линий клеток, которые экспрессируют дифференциально экспрессируемый протеин. Такие сконструированные линии клеток можно применять, в частности, для скрининга и выявления соединений, обладающих способностью воздействовать на эндогенную активность дифференциально экспрессируемого протеина. Такие стабильные линии клеток можно применять непосредственно или после инкапсулирования для клеточной терапии.
Можно применять многочисленные системы селекции, включая (но не ограничиваясь ими) гены тимидинкиназы вируса герпеса простого (Wigler и др., Cell 11, 1977, с.23), гипоксантингуанинфосфорибозилтрансферазы (Szybalska и Szybalski, Proc. Natl. Acad. Sci. USA 48, 1962, с.2026) и аденинфосфорибозилтрансферазы (Lowy и др., Cell 22, 1980, с.817) в клетках tk-, hgprt- или aprt- соответственно. Можно использовать также системы селекции, основанные на отборе по принципу устойчивости к антиметаболитам, для селекции гена dhfr, обусловливающего устойчивость к метотрексату (Wigler и др., Natl. Acad. Sci. USA 77, 1980, с.3567; O'Hare и др., Proc. Natl. Acad. Sci. USA 78, 1981, с.1527); gpt, обусловливающего устойчивость к микофеноловой кислоте (Mulligan и Berg, Proc. Natl. Acad. Sci. USA 78, 1981, с.2072); neo, обусловливающего устойчивость к аминогликозиду G-418 (Colberre-Garapin и др., J. Mol. Biol. 150, 1981, c.1); и hygro, 1981, обусловливающего устойчивость к гигромицину (Santerre и др., Gene 30, 1984, с.147).
Применение альтернативной системы на основе слитого протеина позволяет легко осуществлять очистку неденатурированных слитых протеинов, экспрессированных в линиях клеток человека (Janknecht и др., Proc. Natl. Acad. Sci. USA 88, 1991, cc.8972-8976). В такой системе представляющий интерес ген субклонируют в рекомбинантной плазмиде на основе вируса коровьей оспы таким образом, что открытую рамку считывания гена путем трансляции сливают с N-концевой меткой, состоящей из шести остатков гистидина. Экстракты клеток, инфицированных рекомбинантным вирусом коровьей оспы, вносят в колонки, заполненные Ni2+-нитрилацетатом-агарозой и меченные с помощью гистидина протеины селективно элюируют, используя содержащие имидазол буферы.
Дифференциально экспрессируемый протеин при его использовании в качестве компонента в системах анализа, таких как описанные ниже системы, можно метить либо непосредственно, либо косвенным образом для того, чтобы облегчать обнаружение комплекса, образованного дифференциально экспрессируемым протеином и тестируемой субстанцией. Можно применять любую из многочисленных систем мечения, включая (но не ограничиваясь ими) радиоизотопы, такие как 125I; системы мечения с использованием фермента, который генерирует обнаруживаемый калориметрический сигнал или испускание свет при обработке субстрата, и флуоресцентные метки.
Если для получения дифференциально экспрессируемого протеина, предназначенного для применения в таких системах анализа, используют метод рекомбинантной ДНК, может оказаться целесообразным сконструировать слитые протеины, которые позволяют упростить мечение, иммобилизацию и/или обнаружение.
Косвенное мечение заключается в использовании протеина, такого как меченое антитело, которое специфически связывается с любым продуктом дифференциально экспрессируемого гена. Такие антитела включают (но не ограничиваясь ими) поликлональные, моноклональные, химерные, одноцепочечные антитела, Fab-фрагменты и фрагменты, полученные с использованием экспрессионной библиотеки Fab.
В другом варианте осуществления изобретения в рамках генной терапии для стимулирования функции колбочек вводят нуклеиновые кислоты, содержащие последовательность, кодирующую протеин RDCVF1 или RDCVF2 или его функциональное производное. Генная терапия обозначает терапию, осуществляемую путем введения пациенту нуклеиновой кислоты. В этом варианте осуществления изобретения нуклеиновая кислота приводит к образованию кодируемого ею протеина, который вызывает терапевтическое действие, стимулируя функцию колбочек.
Согласно настоящему изобретению можно использовать любой из методов генной терапии, который применяют в данной области техники. Примеры методов описаны ниже.
В предпочтительном варианте осуществления изобретения терапевтическое лекарственное средство содержит нуклеиновую кислоту Rdcvf1 или Rdcvf2, которая является частью экспрессионного вектора, экспрессирующего протеин RDCVF1 или RDCVF2 или его фрагмент или содержащий его химерный протеин в пригодном хозяине. В частности, такая нуклеиновая кислота имеет промотор, функционально связанный с кодирующей областью Rdcvf1 или Rdcvf2, при этом промотор является индуцибельным или конститутивным и необязательно тканеспецифическим. В другом конкретном варианте осуществления изобретения используют молекулу нуклеиновой кислоты, в которой кодирующие последовательности Rdcvf1 или Rdcvf2 и любые другие необходимые последовательности фланкированы областями, которые усиливают гомологичную рекомбинацию в требуемом сайте в геноме, обеспечивая тем самым внутрихромосомную экспрессию нуклеиновой кислоты Rdcvf1 или Rdcvf2 (Koller и Smithies, Proc. Natl. Acad. Sci. USA 86, 1989, cc.8932-8935; Zijlstra и др., Nature 342, 1989, cc.435-438).
Введение нуклеиновой кислоты в организм пациента можно осуществлять либо непосредственно, в этом случае пациента обрабатывают непосредственно нуклеиновой кислотой или несущим нуклеиновую кислоту вектором, или косвенным образом, в этом случае клетки сначала трансформируют нуклеиновой кислотой in vitro и затем трансплантируют их в организм пациента. Эти два подхода называют соответственно генной терапией in vivo или ex vivo.
Согласно конкретному варианту осуществления изобретения нуклеиновую кислоту вводят непосредственно in vivo, где происходит ее экспрессия с получением кодируемого продукта. Это можно осуществлять любым из многочисленных известных в данной области методом, например, путем конструирования ее в виде части соответствующего несущего нуклеиновую кислоту экспрессионного вектора, и введения его таким образом, чтобы он попадал внутрь клетки, например, путем инфицирования с использованием дефектного или ослабленного ретровируса или других вирусных векторов (аденовируса, аденоассоциированного вируса и лентивируса) (см., например, патент США №4980286 и другие упомянутые в нем патенты), или путем непосредственной инъекции оголенной ДНК, или путем бомбардировки микрочастицами (например, с использованием генной пушки; фирмы Biolistic, Dupont), или нанесения покрытия с использованием липидов или расположенных на поверхности клетки рецепторов или трансфектирующих агентов, инкапсуляции в липосомы, микрочастицы или микрокапсулы, или путем введения с помощью связывания с пептидом, в отношении которого известно, что он обладает способностью проникать в ядро путем введения после связывания с лигандом, чувствительным к опосредуемому рецептором эндоцитозу (см., например, US 5166320; 5728399; 5874297; и 6030954, которые все включены в настоящее описание в качестве ссылки во всей их полноте) (что можно использовать для направленного переноса в те типы клеток, которые специфически экспрессируют рецепторы) и т.д. В другом варианте осуществления изобретения можно формировать комплекс нуклеиновой кислоты и лиганда, в котором лиганд содержит фузогенный (способный к слиянию) вирусный пептид, обладающий способностью разрушать эндосомы, что позволяет избежать деградации нуклеиновой кислоты в лизосоме. Согласно еще одному варианту осуществления изобретения можно осуществлять введение нуклеиновой кислоты in vivo для специфического для клетки поглощения и экспрессии путем направленного переноса к специфическому рецептору (см., например, публикации РСТ WO 92/06180; WO 92/22635; WO 92/20316; WO 93/14188; и WO 93/20221). В альтернативном варианте для осуществления экспрессии нуклеиновую кислоту можно вводить внутрь клетки и встраивать в ДНК клетки-хозяина путем гомологичной рекомбинации (см., например, US 5413923; 5416260; и 5574205; и Zijlstra и др., Nature 342, 1989, cc.435-438).
В конкретном варианте осуществления изобретения используют вирусный вектор, который содержит нуклеиновую кислоту Rdcvf1 или Rdcvf2. Например, можно применять ретровирусный вектор (см., например, US 5219740; 5604090; и 5834182). Такие ретровирусные векторы модифицируют с целью исключения ретровирусных последовательностей, которые не требуются для упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Нуклеиновую кислоту Rdcvf1 или Rdcvf2, предназначенную для применения в генной терапии, клонируют в векторе, который обеспечивает введение гена в организм пациента.
В генной терапии в качестве других вирусных векторов можно использовать также аденовирусы. Аденовирусы являются особенно предпочтительными носителями для введения генов в респираторный эпителий. Аденовирусы, как правило, поражают респираторный эпителий, вызывая слабую форму заболевания. Другими мишенями систем доставки, основанных на применении аденовирусов, являются печень, центральная нервная система, эндотелиальные клетки и мышечная ткань. Преимуществом аденовирусов является то, что они способны инфицировать неделящиеся клетки. Методы осуществления генной терапии, основанной на применении аденовирусов, описаны, например, в US 5824544; 5868040; 5871722; 5880102; 5882877; 5885808; 5932210; 5981225; 5994106; 5994132; 5994134; 6001557; и 60338843, которые все полностью включены в настоящее описание в качестве ссылки.
Для генной терапии было также предложено применять аденоассоциированный вирус (ААВ). Аденоассоциированные вирусы являются особенно предпочтительными носителями для введения генов в сетчатку. Методы получения и применения ААВ описаны, например, в US 5173414; 5252479; 5552311; 5658785; 5763416; 5773289; 5843742; 5869040; 5942496; и 5948675, которые все полностью включены в настоящее описание в качестве ссылки.
Другой подход для осуществления генной терапии включает перенос гена в клетки в культуре ткани с помощью таких методов, как электропорация, липофекция, опосредуемая фосфатом кальция трансфекция или инфицирование с помощью вируса. Как правило, метод переноса предусматривает перенос селектируемого маркера в клетки. Затем клетки подвергают селекции для выделения тех клеток, которые содержат и экспрессируют перенесенный ген. После этого такие клетки вводят в организм пациента непосредственно или после инкапсуляции.
Согласно этому варианту осуществления изобретения нуклеиновую кислоту интродуцируют в клетку до введения in vivo полученной рекомбинантной клетки. Такую интродукцию можно осуществлять любым методом, известным в данной области, включая (но не ограничиваясь ими) трансфекцию, электропорацию, микроинъекцию, инфицирование с помощью вектора на основе вируса или бактериофага, несущего нуклеотидные последовательности, слияние клеток, опосредуемый хромосомой перенос гена, опосредуемый микроклеткой перенос гена, слияние сферопластов и т.д. Согласно настоящему изобретению для интродукции чужеродных генов в клетки можно применять многочисленные методы, известные в данной области, при условии того, что не будут нарушены необходимые функции развития и физиологические функции клеток реципиента. Метод должен обеспечивать стабильный перенос нуклеиновой кислоты в клетку, так чтобы нуклеиновая кислота могла экспрессироваться клеткой и предпочтительно наследоваться и экспрессироваться ее клеткой-потомком.
Полученные рекомбинантные клетки можно вводить в организм пациента различными методами, известными в данной области. В предпочтительном варианте осуществления изобретения эпителиальные клетки вводят путем инъекции, например, подкожно. В другом варианте осуществления изобретения в качестве трансплантата кожи для пациента можно применять рекомбинантные клетки кожи. Рекомбинантные клетки крови (например, гематопоэтические стволовые клетки или клетки-предшественники) предпочтительно вводят внутривенным путем. Количество клеток, предназначенных для введения, зависит от желаемого действия, состояния пациента и т.д., и его может определить специалист в данной области.
В качестве клеток, в которые можно вводить нуклеиновую кислоту для целей генной терапии, можно использовать любой требуемый и доступный тип клеток, включая (но не ограничиваясь ими) эпителиальные клетки, эндотелиальные клетки, кератиноциты, фибробласты, мышечные клетки, гепатоциты; клетки крови, такие как Т-лимфоциты, В-лимфоциты, моноциты, макрофаги, нейтрофилы, эозинофилы, мегакариоциты, гранулоциты; различные стволовые клетки или клетки-предшественники, в частности, гематопоэтические стволовые клетки или клетки-предшественники, например, полученные из костного мозга, крови из пупочного канатика, периферической крови, печени эмбриона и т.д.
В предпочтительном варианте осуществления изобретения клетка, используемая для генной терапии, является аутологичной для пациента.
В варианте осуществления изобретения, предусматривающем использование рекомбинантных клеток в генной терапии, нуклеиновую кислоту Rdcvf1 или Rdcvf2 интродуцируют в клетки таким образом, чтобы она могла экспрессироваться клетками или их потомством, и затем рекомбинантные клетки вводят в организм для достижения терапевтического действия in vivo. В конкретном варианте осуществления изобретения применяют стволовые клетки или клетки-предшественники. В принципе согласно настоящему изобретению можно использовать любые стволовые и/или клетки предшественники, которые можно выделять и поддерживать in vitro. Такие стволовые клетки включают (но не ограничиваясь ими) гематопоэтические стволовые клетки (HSC), стволовые клетки эпителиальных тканей, таких как кожа и выстилка кишки, клетки сердечной мышцы эмбриона, стволовые клетки печени (см., например WO 94/08598), и нейронные стволовые клетки (Stemple и Anderson, Cell 71, 1992, cc.973-985).
Эпителиальные стволовые клетки (ESC) или кератиноциты можно получать из таких тканей, как кожа и выстилка кишки, с помощью хорошо известных методов (Rheinwald, Meth. Cell Bio. 21A, 1980, с.229). В стратифицированной эпителиальной ткани, такой как кожа, восстановление происходит в результате митоза стволовых клеток в зародышевом пласте, т.е. слое, наиболее близком к базальному слою. Стволовые клетки, находящиеся внутри выстилки кишки обеспечивают высокую скорость восстановления этой ткани. ESC или кератиноциты, полученные из кожи или выстилки кишки пациента или донора, можно выращивать в культуре ткани (Pittelkow и Scott, Mayo Clinic Proc. 61, 1986, с.771). Если ESC получают от донора, то можно применять также метод подавления реакции «трансплантат против хозяина» (например, облучение, введение лекарства или антитела для стимулирования умеренной иммуносупрессии) (Tropepe и др., Retinal stem cells. Science, 287, 2000, с.2032).
Согласно данному варианту осуществления изобретения для гематопоэтических стволовых клеток (HSC) можно применять любой метод, позволяющий осуществлять выделение, размножение и поддержание HSC in vitro. Методы, с помощью которых это можно осуществлять, включают (а) выделение и создание культур HSC из клеток костного мозга, выделенных из организма будущего хозяина или донора, или (б) применение ранее созданных долгоживущих культур HSC, которые могут быть аллогенными или ксеногенными. Неаутологичные HSC применяют предпочтительно в сочетании с методом подавления иммунных реакций на трансплантацию у будущего хозяина/пациента. В конкретном варианте осуществления настоящего изобретения клетки костного мозга человека можно получать из задней части подвзошного гребня путем пункционной биопсии (см., например, Kodo и др, J. Clin. Invest. 73, 1984, cc.1377-1384). В предпочтительном варианте осуществления изобретения HSC можно получать в существенно обогащенной или практически чистой форме. Такое обогащение можно производить до, в течение или после продолжительного культивирования и его можно осуществлять с помощью любого метода, известного в данной области. Долгоживущие культуры клеток костного мозга можно создавать и поддерживать, например, с помощью модифицированного метода получения культуры клеток декстеровского типа (Dexter и др., J. Cell Physiol. 91, 1977, с.335) или метода получения культуры Витлокка-Уайта (Witlock и Witte, Proc. Natl. Acad. Sci. USA 79, 1982, cc.3608-3612).
В конкретном варианте осуществления изобретения нуклеиновая кислота, предназначенная для интродукции для целей генной терапии, содержит индуцибельный промотор, функционально связанный с кодирующей областью, благодаря чему экспрессию нуклеиновой кислоты можно контролировать путем регулировки присутствия или отсутствия соответствующего индуктора транскрипции.
В настоящем описании представлены способы получения антител, способных специфически распознавать один из нескольких эпитопов дифференциально экспрессируемого гена. Такие антитела могут включать (но не ограничиваясь ими) поликлональные антитела, моноклональные антитела (МАт), гуманизированные или химерные антитела, одноцепочечные антитела, Fab-фрагменты, F(ab')2-фрагменты, фрагменты, полученные с помощью библиотеки экспрессируемых Fab-фрагментов, антиидиотипических (anti-Id) антител и эпитопсвязывающих фрагментов любого из перечисленных выше антител. Такие антитела можно применять, например, для обнаружения фингерпринта, мишени, гена в биологическом образце или в альтернативном варианте в способе ингибирования аномальной активности гена-мишени. Так, эти антитела можно применять в качестве составной части методов лечения заболевания и/или можно применять в качестве составной части методов диагностики, согласно которым пациентов можно тестировать в отношении аномальных уровней Rdcvf1 или Rdcvf2, или в отношении присутствия аномальных форм Rdcvf1 или Rdcvf2, отбирая образцы тканевой жидкости и/или стекловидного тела методами, известными специалистам в данной области (см. Forster RK, Abbott RL, Gelender H., Management of infectious endophthalmitis Ophthalmology 87, 1980, cc.313-319).
Для производства антител к дифференциально экспрессируемому гену можно иммунизировать различных хозяев-животных путем инъекции дифференциально экспрессируемого протеина или его части или путем иммунизации с помощью ДНК. Такие животные-хозяева включают (но не ограничиваясь ими) кроликов, мышей и крыс и т.д. В зависимости от вида хозяев для усиления иммунологического ответа можно применять различные адъюванты, включая (но не ограничиваясь ими) адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, полиолы плуроника, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки, динитрофенол и потенциально пригодные человеческие адъюванты, такие как BCG (палочка Кальметта-Герена) и Corynebacterium parvum.
Поликлональные антитела представляют собой гетерогенные популяции молекул антител, выведенных из сыворотки животных, иммунизированных антигеном, таким как продукт гена-мишени или его антигенное функциональное производное. Для получения поликлональных антител животных-хозяев, таких как перечисленные выше, можно иммунизировать путем инъекции с использованием продукта дифференциально экспрессируемого гена, дополненного также описанными выше адъювантами.
Моноклональные антитела, которые представляют собой гомогенную популяцию антител к конкретному антигену, можно получать любым методом, который обеспечивает производство молекул антител в непрерывной культуре клеток. Такие методы включают (но не ограничиваясь ими) метод на основе гибридомы Kohler и Milstein (см., Nature 256, 1975, cc.495-497; и US 4376110), метод на основе гибридомы человеческих В-клеток (Kosbor и др. Immunology Today 4, 1983, с.72; Cole и др., Proc. Natl. Acad. Sci. USA 80, 1983, 1983, cc.2026-2030) и метод на основе гибридомы ЭБВ (вирус Эпштейна-Барра) (Cole и др., Monoclonal Antibodies And Cancer Therapy, изд-во Alan R. Liss, Inc., 1985, cc.77-96). Такие антитела могут относиться к любому классу иммуноглобулинов, включая IgG, IgM, IgE, IgA, IgD и любые их подклассы. Гибридому, продуцирующую МАт по изобретению, можно культивировать in vitro или in vivo. Возможность получения высоких титров МАт in vivo делает этот метод получения наиболее предпочтительным в настоящее время.
Кроме того, можно применять методы, разработанные для получения «химерных антител» (Morrison и др. Proc. Natl. Acad. Sci., 81, 1984, cc.6851-6855; Neuberger и др., Nature, 312, 1984, cc.604-608; Takeda и др., Nature, 314, 1985, cc.452-454) путем сплайсинга генов из молекулы мышиного антитела, обладающей специфичностью в отношении соответствующего антигена, в сочетании с генами из молекулы человеческого антитела, обладающего соответствующей биологической активностью. Химерное антитело представляет собой молекулу, в которой различные фрагменты получены из различных видов животных, например, такие, которые имеют вариабельную или гипервариабельную область, полученную из мышиного МАт и константной области человеческого иммуноглобулина.
В альтернативном варианте для получения одноцепочечных антител к дифференциально экспрессируемым генам можно адаптировать метод, описанный для получения одноцепочечных антител (US 4946778; Bird, Science 242, 1988, cc.423-426; Huston и др., Proc. Natl. Acad. Sci. USA 85, 1988, cc.5879-5883; и Ward и др., Nature 334, 1989, cc.544-546). Одноцепочечные антитела можно получать путем связывания фрагментов тяжелой и легкой цепи Fv-области с помощью аминокислотного мостика, в результате чего образуется одноцепочечный полипептид.
Наиболее предпочтительно для получения антител к полипептидам, фрагментов, производных и функциональных эквивалентов, указанным в настоящем описании, можно применять методы, пригодные для получения «гуманизированных антител». Такие методы описаны в US 5932448; 5693762; 5693761; 5585089; 5530101; 5910771; 5569825; 5625126; 5633425; 5789650; 5545580; 5661016 и 5770429, которые все полностью включены в настоящее описание в качестве ссылки.
Фрагменты антитела, которые распознают специфические эпитопы, можно получать известными методами. Такие фрагменты включают (но не ограничиваясь ими), например, F(ab')2-фрагменты, которые можно получать путем расщепления молекулы антитела пепсином, и Fab-фрагменты, которые можно получать путем восстановления дисульфидных мостиков F(ab')2-фрагментов. В альтернативном варианте можно создавать библиотеку экспрессируемых Fab-фрагментов (Huse и др., Science, 246, 1989, cc.1275-1281) для осуществления быстрой и легкой идентификации Fab-фрагментов моноклонального антитела, обладающих требуемой специфичностью.
С точки зрения простоты обнаружения особенно предпочтительным является сэндвич-анализ, для которого существуют многочисленные варианты, причем следует иметь ввиду, что все они подпадают под объем настоящего изобретения.
Например, в типичном форвард-анализе немеченое антитело иммобилизуют на твердом субстрате и образец, подлежащий тестированию, приводят в контакт со связанной молекулой. После этого осуществляют инкубацию в течение периода времени, достаточного для образования бинарного комплекса антитело-антиген. Затем после образования комплекса добавляют второе антитело, меченное репортерной молекулой, которая способна индуцировать обнаруживаемый сигнал, и инкубируют в течение периода времени, достаточного для образования тройного комплекса антитело-антиген-меченое антитело. Весь непрореагировавший материал удаляют путем отмывки и присутствие антигена определяют путем обнаружения сигнала, или можно производить количественную оценку антигена путем сравнения с контрольным образцом, содержащим известные количества антигена. Варианты форвард-анализа включают одновременный анализ, в котором и образец, и антитело добавляют одновременно к связанному антителу, или обратный анализ, в котором сначала объединяют меченое антитело и образец, инкубируют и добавляют к немеченому связанному антителу. Такие методы хорошо известны специалистам в данной области и возможность внесения в них небольших вариаций является очевидной. Следует иметь ввиду, что в контексте настоящего описания понятие «сэндвич-анализ» включает все варианты, основанные на методе с использованием двух сайтов. Единственным лимитирующим фактором для иммуноанализа согласно настоящему изобретению является то, что немеченые и меченые антитела представляют собой специфические в отношении RdCVF1 или RdCVF2 антитела.
Наиболее часто применяемыми репортерными молекулами в этом типе анализа являются либо ферменты, либо содержащие флуорофор или радионуклид молекулы. В случае ферментного иммуноанализа фермент конъюгируют со вторым антителом, как правило, с помощью глутаральдегида или перйодата. Легко можно понять, однако, что существует широкое разнообразие различных методов лигирования, которые хорошо известны специалисту в данной области. Обычно применяемые ферменты включают среди прочего пероксидазу из хрена, глюкозооксидазу, бета-галактозидазу и щелочную фосфатазу. Предназначенные для применения с конкретными ферментами, субстраты, как правило, выбирают таким образом, чтобы после гидролиза соответствующим ферментом у них происходило обнаруживаемое изменение цвета. Например, для применения с конъюгатами, включающими щелочную фосфатазу можно применять пара-нитрофенил; для конъюгатов, включающих пероксидазы, как правило, применяют 1,2-фенилендиамин или толуидин. Можно применять также не хромогенные субстраты, а флуорогенные субстраты, которые дают флуоресцентный продукт. Затем раствор, содержащий соответствующий субстрат, добавляют к тройному комплексу антитело-RdCVF1-или RdCVF2-меченое антитело. Субстрат вступает в реакцию с ферментом, связанным со вторым антителом, в результате чего возникает качественный видимый сигнал, который можно затем оценивать количественно, как правило, спектрофотометрическим путем, получая оценку количества Rdcvf1 или Rdcvf2, присутствующего в образце сыворотки.
В альтернативном варианте флуоресцентные соединения, такие как, флуоресцеин и родамин, можно химически связывать с антителами, не изменяя их связывающую способность. При активации путем освещения светом определенной длины волны меченное флуорохромом антитело абсорбирует световую энергию, индуцируя состояние возбуждения в молекуле с последующей эмиссией света с большей длиной волны. Эмиссия проявляется в виде характерного цвета, который можно визуально обнаруживать с помощью светового микроскопа. Оба метода, т.е. метод иммунофлуоресценции и ИФА (иммуноферментный анализ) хорошо известны в данной области и являются особенно предпочтительными для рассматриваемого способа. Однако можно применять также и другие репортерные молекулы, такие как радиоизотопы, хемилюминисцентные или биолюминисцентные молекулы. Специалисту в данной области очевидно, каким образом варьировать процедуру для того, чтобы она соответствовала требуемой цели.
Изобретение относится также к применению полинуклеотидов по настоящему изобретению в качестве диагностических реагентов. Обнаружение мутантной формы гена, кодирующего полипептид, выбранный из группы, которая включает полипептиды, представленные в последовательностях SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 и SEQ ID NO: 14, которые связаны с дисфункцией, представляет собой диагностический инструмент, который можно использовать дополнительно или с его помощью непосредственно ставить диагноз заболевания или чувствительности к заболеванию, возникающего вследствие недостаточной экспрессии, сверхэкспрессии или измененной пространственной или временной экспрессии гена. Индивидуумов, несущих мутации в гене, можно выявлять на уровне ДНК с применением различных методов.
Нуклеиновые кислоты для диагностики можно получать из клеток пациента, таких как, кровь, моча, слюна, биопсия ткани или материала, полученного при аутопсии. Геномную ДНК можно применять для обнаружения непосредственно или можно подвергать ферментативной амплификации с помощью ПЦР или других методов амплификации, известных в данной области. Аналогичным образом можно использовать также РНК или кДНК. Делеции и инсерции можно обнаруживать по изменению размера амплифицированного продукта по сравнению с нормальным генотипом. Точковые мутации можно идентифицировать путем гибридизации амплифицированной ДНК с мечеными нуклеотидными последовательностями. Идеально совпадающие последовательности можно отличать от ошибочно спаренных дуплексов с помощью расщепления РНКазой или по различиям в температурах плавления. Различия последовательностей ДНК можно обнаруживать также по изменению элктрофоретической подвижности фрагментов ДНК в гелях в присутствии денатурирующих агентов (SSCP) или без них, или путем непосредственного секвенирования ДНК (см., например, Myers и др., Science, 230, 1985, cc.230-1242). Изменения последовательности в конкретных положениях можно оценивать также с помощью анализов защиты от нуклеазы, например, защиты от РНКазы и S1, или методом химического расщепления (см. у Cotton и др., Proc Nati Acad Sci USA, 85, 1985, cc.4397-4401). В другом варианте осуществления изобретения для осуществления эффективного скрининга, например, генетических мутаций, можно конструировать набор олигонуклеотидных зондов, содержащих нуклеотидную последовательность Rdcvf1 или Rdcvf2, или ее фрагменты. Методы, основанные на технологии с использованием набора, хорошо известны и являются общеприменимыми и их можно использовать для решения многих вопросов в молекулярной генетике, включая экспрессию гена, генетическое связывание и генетическую вариабельность (см., например, М. Chee и др., Science, том 274, cc.610-613, 1996).
Диагностический анализ представляет собой способ диагностики или определения чувствительности к заболеванию путем обнаружения мутаций в гене Rdcvf1 или Rdcvf2 с использованных описанных выше методов. Кроме того, такие заболевания можно диагностировать методами, включающими определение аномальной экспрессии Rdcvf1 или Rdcvf2 в образце, взятом из организма пациента: экспрессию можно измерять на уровне РНК с помощью любого из хорошо известных в данной области методов количественной оценки полинуклеотидов, таких, например, как амплификация нуклеиновых кислот, например, ПЦР, ОТ-ПЦР, защита от РНКазы, нозерн-блоттинг и другие методы гибридизации. Методы анализа, которые можно применять для определения уровней протеина, такого как полипептид по настоящему изобретению, в образце, полученном из хозяина, хорошо известны специалистам в данной области. Такие методы анализа включают радиоиммунные анализы, анализы конкурентного связывания, анализы методом вестерн-блоттинга и ELISA (твердофазный иммуноферментный анализ).
Таким образом, еще одним объектом настоящего изобретения является диагностический набор, который включает:
(а) полинуклеотид по настоящему изобретению, где предпочтительно нуклеотидную последовательность, кодирующую полипептид, выбирают из группы, включающей полипептиды, представленные в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 и SEQ ID NO: 14, или его фрагмент;
(б) нуклеотидную последовательность, комплементарную последовательности, указанной в (а);
(в) полипептид по настоящему изобретению, предпочтительно полипептид или его фрагмент; или
(г) антитело к полипептиду по настоящему изобретению, предпочтительно к полипептиду, выбранному из группы, включающей полипептиды, имеющие последовательности, представленные в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 и SEQ ID NO: 14.
Следует иметь ввиду, что в любом из таких наборов перечисленные в (а), (б), (в) или (г) элементы могут содержать имеющий решающее значение компонент. Такой набор можно применять для диагностики заболевания или чувствительности к заболеванию, в частности, такого как пигментный ретинит, связанная с возрастом дегенерация желтого пятна, синдром Барде, синдром Бессена-Корнцвейга, болезнь Беста, хороидема, атрофия мозговых извилин, врожденный амоуроз, синдром Рефсана, синдром Старгардта и синдром Ашера. Нуклеотидные последовательности по настоящему изобретению можно применять также для определения локализации в хромосоме. Локализацию в хромосоме можно определять с помощью ПЦР с использованием в качестве матрицы ДНК, полученной из панели гибридных линий клеток (мыши-хомячка). Положение человеческого гена в хромосоме можно предсказывать по положению мышиного гена на основе синтении (McCarthy и др., Genome research, 7, 1997, с.1153). Осуществляют специфический перенос последовательности в конкретный локус на отдельной хромосоме, включая мышиную или человеческую хромосому, и подвергают гибридизации.
Картирование пригодных последовательностей на хромосомах по настоящему изобретению является важным первым шагом в корреляции этих последовательностей с геном, связанным с заболеванием. После того, как последовательность картируют в точном положении на хромосоме, то физическое положение последовательности на хромосоме можно скоррелировать с данными генетической карты. Такие данные можно найти, например, у V.McKusick, Mendelian Inheritance in Man (их можно получить в режиме on-line из медицинской библиотеки университета Джона Гопкинса, Велх (Johns Hopkins University Welch Medical Library, RetNet). Затем с помощью анализа взаимосвязи (ко-наследственность физически смежных генов) выявляют связь между генами, картированными в той же самой области хромосомы, и заболеваниями.
Можно определять также различия кДНК или геномных последовательностей пораженных заболеванием и здоровых индивидуумов. Если мутацию обнаруживают у нескольких или у всех пораженных заболеванием индивидуумов, но ее не имеется ни у одного здорового индивидуума, мутация, вероятно, может являться причинным агентом заболевания.
Другой вариант осуществления изобретения относится к введению фармацевтической композиции в сочетании с фармацевтически приемлемым носителем для оказания любого из описанных выше терапевтических действий. Такие фармацевтические композиции могут содержать Rdcvf1 или Rdcvf2, миметики или агонисты. Композиции можно вводить индивидуально или в сочетании по меньшей мере с одним дополнительным агентом, таким как стабилизатор, который можно вводить в любом стерильном биологически совместимом фармацевтическом носителе, включая (но не ограничиваясь ими) физиологический раствор, забуференный физиологический раствор, декстрозу и воду. Композиции можно вводить пациенту индивидуально или в сочетании с другими агентами, лекарствами или гормонами.
Фармацевтические композиции, подпадающие под объем изобретения, можно вводить любым из многочисленных путей: например, путем трансклерального введения обладающего биологической реактивностью протеина в хороид и сетчатку согласно методу, описанному у Ambati и др., Investigative Ophthalmology and Visual Science, 41, 2000, с.1186. Композиции офтальмических препаратов, предназначенных для местного применения, включая офтальмические растворы, суспензии и мази, хорошо известны специалистам в данной области (см. Remington's Pharmaceutical Sciences, 18-изд., глава 6, cc.1581-1592, изд-во Mack Publishing Company, 1990). Можно применять другие пути введения, включая внутрикамерные инъекции (которые можно делать непосредственно в переднюю камеру или непосредственно в камеру стекловидного тела), субконъюнктивальные инъекции и ретробульбарные (в заднюю часть луковицы глазного яблока) инъекции, при этом методы и средства получения офтальмических препаратов, пригодных для таких путей введения, также являются хорошо известными.
В контексте настоящего описания понятие «экстраокулярный» относится к поверхности глаза и (внешнему) пространству между глазным яблоком и веком.
Примеры экстраокулярных областей включают свод века или слепой мешок, поверхность конъюнктивы и поверхность роговицы. Эта область является внешней по отношению ко всем другим тканям глаза и для доступа в эту область не требуется применять инвазивные процедуры. Примеры таких экстраокулярных систем включают вставки и вводимые «местно» капли, гели или мази, которые можно применять для введения терапевтического материала в указанные области. Экстраокулярные устройства, как правило, можно легко удалять, это может делать даже сам пациент.
В приведенных ниже патентах описаны экстраокулярные системы, которые применяют для введения лекарственных средств в экстраокулярные области. Higuchi и др. описали в US 3981303, 3986510 и 3995635 биоразложимую глазную вставку, содержащую лекарственное средство. Можно изготавливать вставки, имеющие различные формы для их удержания в слепом мешке глазного яблока, экстраокулярном пространстве между глазным яблоком и веком. Описан ряд обычных биосовместимых полимеров, которые можно применять для изготовления такого устройства. Такие полимеры включают альгинат цинка, поли(молочную кислоту), поли(виниловый спирт), поли(ангидриды) и поли(гликолевую кислоту). В патентах описаны также устройства, покрытые мембраной с уменьшенной проницаемостью для лекарственного средства и имеющие полые камеры, содержащие лекарственную композицию.
Theeuwes в патенте US 4217898 описал микропористые резервуары, применяемые для контролируемого введения лекарственного средства. Такие устройства помещают экстраокулярно в слепой мешок глаза. Представляющие интерес полимерные системы включают сополимеры поли(винилхлорида) и поли(винилацетата). Kaufman в патентах US 4865846 и 4882150 описал офтальмическую систему введения лекарственного средства, содержащую по меньшей мере один биоразложимый материал или масляный носитель, для введения в конъюнктивальный мешок. В качестве пригодных систем введения в патенте описаны полимерные системы, такие как полилактид, полигликолид, поливиниловый спирт и сшитый коллаген.
Преимущество представленного в настоящем описании применения протеина RDCVF1 или RDCVF2 для лечения заболевания или повреждения сетчатки заключается также в том, что офтальмическая композиция для местного применения включает агент, способствующий проникновению или транспорту терапевтического агента в глаз. Такие агенты известны в данной области. Например, Ке и др. в патенте US 5221696 описали применение материалов, усиливающих проникновение офтальмических препаратов через роговицу.
Интраокулярные системы представляют собой такие системы, которые можно применять в любом компартменте ткани внутри, между или снаружи слоев ткани самого глаза. Такие области включают субконъюнктивальную (под слизистой мембраной глаза, примыкающей к глазному яблоку), орбитальную (позади глазного яблока) и внутрикамерную (внутри камер самого глазного яблока). В отличие от экстраокулярных систем для доступа в эти области требуется инвазивная процедура, представляющая собой инъекцию или имплантацию.
Интраокулярные устройства описаны в приведенных ниже патентах. Wong в патенте US 4853224 описал микроинкапсулированные лекарственные средства для интродукции в камеру глаза. Полимеры, которые применяют в такой системе, включают сложные полиэфиры и простые полиэфиры. Lee в патенте US 4863457 описал биоразложимое устройство, которое хирургическим путем имплантируют интраокулярно для непрерывного высвобождения терапевтических агентов. Устройство предназначено для имплантации хирургическим путем под конъюнктиву (слизистую мембрану глазного яблока). Krezancaki в патенте US 4188373 описал фармацевтический носитель, который превращается в гель при температуре человеческого тела. Это устройство представляет собой водную суспензию лекарственного средства и смолы или синтетических производных целлюлозы. Haslam и др. описали в патентах US 4474751 и 4474752 систему полимер-лекарственное средство, которая находится в жидком состоянии при комнатной температуре и превращается в гель при температуре тела. Пригодные полимеры, которые можно применять в этой системе, включают полиоксиэтилен и полиоксипропилен. Davis и др. описали в патенте US 5384333 полимер для введения биоразложимого инъецируемого лекарственного средства, который обеспечивает продолжительное высвобождение лекарственного средства. Композиция лекарственного средства представляет собой обладающий фармацевтической активностью агент в биоразложимой полимерной матрице, где полимерная матрица находится в твердом состоянии при температурах от 20 до 37°С и находится в текучем состоянии при температурах от 38 до 52°С. Применение полимера для введения лекарственного средства не ограничено введением растворимых или жидких композиций лекарственного средства. Например, полимер можно применять в качестве матрицы для стабилизации и удержания в месте инъекции содержащих лекарственное средство микросфер, липосом или других связанных с частицами лекарственных средств.
Особенно предпочтительным носителем для внутриглазной инъекции является стерильная дистиллированная вода, с использованием которой на основе протеина RDCVF1 или RDCVF2 приготавливают стерильный изотонический раствор, предпочтительно консервированный. Еще один офтальмический препарат может содержать композицию протеина RDCVF1 или RDCVF2 с агентом, таким как инъецируемые микросферы или липосомы, который обеспечивает замедленное или непрерывное высвобождение протеина и который затем вводят путем инъекции в виде депо. Другие средства, пригодные для внутриглазного введения протеина RDCVF1 или RDCVF2, включают имплантируемые устройства для введения лекарственного средства или которые содержат протеин RDCVF1 или RDCVF2.
Офтальмические препараты по настоящему изобретению, в частности, препараты для местного применения, могут содержать другие компоненты, например, офтальмически приемлемые консерванты, агенты для регулировки тоничности, сорастворители, смачивающие агенты, комплексообразующие агенты, забуферивающие агенты, противомикробные средства, антиоксиданты и поверхностно-активные вещества, хорошо известные в данной области. Например, способствующие повышению тоничности агенты включают галогениды щелочных металлов (предпочтительно хлорид натрия или калия), маннит, сорбит и т.п. Предпочтительно добавляют повышающий тоничность агент в таком количестве, чтобы композиция, предназначенная для введения в глаз, была гипотоничной или практически изотоничной. Пригодные консерванты включают (но не ограничиваясь ими) бензалконийхлорид, тимеросал, фенэтиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновую кислоту и т.п. В качестве консерванта можно применять также перекись водорода. Пригодные сорастворители включают (но не ограничиваясь ими) глицерин, пропиленгликоль и политиэленгликоль. Пригодные комплексообразующие агенты включают кофеин, поливинилпирролидон, бета-циклодекстрин или гидроксипропил-бета-циклодекстрин. Пригодные поверхностно-активные вещества или смачивающие агенты включают (но не ограничиваясь ими) сложные эфиры сорбитана, полисорбаты, такие как полисорбат 80, трометамин, лецитин, холестерин, тилоксапол и т.п. В качестве буферов можно применять обычные буферы, такие как боратный, нитратный, фосфатный, бикарбонатный или Трис-HCl.
Компоненты композиции присутствуют в концентрациях, приемлемых для введения в экстраокулярную или интраокулярную области. Например, буферы применяют для поддержания физиологического значения рН или значения рН композиции, несколько меньшего чем физиологическое значение, как правило, значения рН от приблизительно 5 до приблизительно 8. Дополнительные компоненты композиции могут включать материалы, которые обеспечивают пролонгированное присутствие в глазу экстраокулярно вводимого терапевтического агента таким образом, чтобы максимизировать местный контакт с глазом и способствовать абсорбции. Пригодные материалы включают полимеры или желирующие материалы, обеспечивающие повышение вязкости офтальмического препарата. Особенно предпочтительным материалом в качестве агента, контролирующего скорость высвобождения в глазу, который применяют в жидких офтальмических композициях лекарственного средства, является хитозан (см. патент US 5422116 на имя Yen и др.). Пригодность композиций по настоящему изобретению для контролируемого высвобождения (например, непрерывного и пролонгированного введения) офтальмического лекарственного агента в глазу можно определять с помощью различных методов, известных в данной области, например, как описано в Journal of Controlled Release, 6, 1987, cc.367-373, 1987, а также их вариантов.
В дополнение к действующим веществам такие фармацевтические композиции могут содержать пригодные фармацевтически приемлемые носители, представляющие собой эксципиенты и вспомогательные вещества, облегчающие обработку действующих веществ с получением препаратов, которые можно применять в фармацевтических целях. Дополнительные подробности, касающиеся методов приготовления композиций и их введения, можно найти в последнем издании Remington's Pharmaceutical Sciences (изд-во Mack Publishing Co., Истон, Пенсильвания).
Фармацевтические композиции для перорального введения можно приготавливать с использованием фармацевтически приемлемых носителей, хорошо известных в данной области техники, применяя их в дозах, пригодных для перорального введения. Такие носители позволяют приготавливать фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, эмульсий, суспензий и т.п., предназначенных для поглощения через рот пациентом.
Фармацевтические препараты для перорального применения можно получать путем объединения действующих веществ с твердым эксципиентом, при необходимости путем необязательного размалывания образовавшейся смеси и обработки смеси гранул после добавления при необходимости пригодных вспомогательных веществ с получением таблеток или ядер драже. Пригодными эксципиентами являются углеводы или протеиновые наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал или крахмал из других видов растений; целлюлоза, такая как метилцеллюлоза, гидроксипропилметицеллюлоза или карбоксиметилцеллюлоза натрия; камеди, включая гуммиарабик и трагакантовую камедь; и протеины, такие как желатин и коллаген. При необходимости можно добавлять разрыхлители или солюбилизирующие агенты, такие как сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Можно применять ядра драже в сочетании с пригодными покрытиями, например, полученными с помощью концентрированных сахарных растворов, которые могут содержать также гуммиарабик, тальк, поливинилпирролидон, карбополовый гелеобразователь, полиэтиленгликоль и/или диоксид титана, лаковые растворы и пригодные органические растворители или смеси растворителей. В покрытие таблеток или драже можно добавлять красители или пигменты для идентификации продукта или для указания количества действующего вещества, т.е. дозы.
Фармацевтические препараты, которые можно применять перорально, включают легко проглатываемые желатиновые капсулы (типа push-fit), мягкие запечатанные желатиновые капсулы, имеющие покрытие из глицерина или сорбита. Капсулы типа push-fit могут содержать действующие вещества в смеси с наполнителем или связующими веществами, такими как лактоза или крахмалы, замасливателями, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах действующие вещества могут быть растворены или суспендированы в пригодных жидкостях, таких как жирные масла, жидкость или жидкий полиэтиленгликоль, содержащий стабилизаторы, или без них.
Фармацевтические композиции, пригодные для парентерального введения, можно приготавливать в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера или забуференный физиологический раствор. Водные инъецируемые композиции могут содержать субстанции, которые повышают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Кроме того, суспензии действующих веществ можно приготавливать в виде соответствующих масляных суспензий для инъекции. Пригодные липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеат, или триглицериды или липосомы. Для введения можно использовать также нежировые поликатионные аминополимеры. Суспензии необязательно могут содержать также пригодные стабилизаторы или агенты, повышающие растворимость соединений, что позволяет получать препараты в виде высококонцентрированных растворов.
В композиции для местного или назального применения можно использовать пенетранты (вещества, способствующие проникновению), пригодные для проникновения через конкретный барьер. Такие пенетранты широко известны в данной области.
Фармацевтические композиции по настоящему изобретению можно приготавливать способом, известным в данной области, например, с помощью общепринятых процессов смешения, растворения, грануляции, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, улавливания или лиофилизации.
Фармацевтическую композицию можно приготавливать в виде соли, которую можно образовывать с многочисленными кислотами, включая (но не ограничиваясь ими) соляную, серную, уксусную, молочную, винную, яблочную, янтарную и т.д. Соли, как правило, обладают большей растворимостью в водных или других протонных растворителях, чем соответствующие формы в виде свободного основания. В других случаях предпочтительный препарат может представлять собой лиофилизированный порошок, содержащий любой или все из перечисленных компонентов: 1-50 мМ гистидин, 0,1-2% сахарозы и 2-7% маннита при значении рН от 4,5 до 5,5, который перед применением объединяют с буфером.
После приготовления фармацевтических композиций их помещают в соответствующий контейнер и снабжают этикеткой с указанием условий лечения состояния, для которого показано применение композиции. Для введения Rdcvf1 или Rdcvf2 такая этикетка должна включать количество, частоту и способ введения.
Фармацевтические композиции, пригодные для применения согласно изобретению, включают композиции, в которых действующие вещества содержатся в количестве, эффективном для достижения необходимой цели. Определение эффективной дозы находится в компетентности специалиста в данной области.
Для любого соединения терапевтически эффективную дозу можно оценивать сначала либо путем анализа с использованием культур клеток, например, неопластических клеток, либо на моделях с использованием животных, как правило, мышей, кроликов, собак или свиней. Модели с использованием животных можно применять также для определения соответствующего диапазона концентраций и пути введения. Затем такую информацию можно использовать для определения пригодных доз и путей введения для человека.
Терапевтически эффективная доза представляет собой такое количество действующего вещества, например Rdcvf1 или Rdcvf2 или его фрагмента, антител к Rdcvf1, агонистов, которая приводит к ослаблению симптомов заболевания или улучшению состояния. Терапевтическую эффективность и токсичность можно определять стандартными фармацевтическими методами с использованием культур клеток или экспериментальных животных, например, определяя ED50 (доза, обладающая терапевтической эффективностью для 50% популяции) и LD50 (доза, летальная для 50% популяции). Отношение доз, характеризующих токсичное и терапевтическое действия, представляет собой терапевтический индекс, и его можно выразить в виде отношения LD50/ED50. Предпочтительными являются фармацевтические композиции, обладающие высокими терапевтическими индексами. Данные, полученные из анализов культуры клеток и исследований на животных, используют для обоснования диапазона доз, предназначенных для человека. Доза, содержащаяся в таких композициях, предпочтительно находится в диапазоне концентраций в кровотоке, которые включают ED50 и сопровождаются малой токсичностью или вообще не оказывают токсичного действия. Дозу варьируют в этом диапазоне в зависимости от применяемой дозируемой формы, чувствительности пациента и пути введения.
Точную дозу должен определять лечащий врач с учетом факторов, относящихся к пациенту, нуждающемуся в лечении. Дозу и путь введения регулируют для обеспечения достаточных уровней действующего фрагмента или для поддержания требуемого действия. Факторы, которые можно принимать во внимание, включают серьезность болезненного состояния, общее состояние здоровья пациента, возраст, вес и пол пациента, диету, время и частоту введения, комбинацию(и) лекарственных средств, реакционную чувствительность и толерантность/реакцию на лечение. Фармацевтические композиции с продолжительным действием можно вводить каждые 3-4 дня, каждую неделю или один раз каждые две недели в зависимости от времени полужизни и скорости клиренса конкретной композиции.
Обычные величины доз в зависимости от пути введения могут варьироваться от 0,1-100,000 мкг вплоть до суммарной дозы, составляющей приблизительно 1 г. Указания, касающиеся как конкретных доз, так методов введения, приведения в литературе и в целом доступны для лечащих врачей. Специалисты в данной области могут применять композиции содержащие нуклеотиды, отличные от композиций, содержащих протеины и их ингибиторы. Аналогично этому пути введения полинуклеотидов или полипептидов должны быть специфическими для конкретных клеток, условий, областей локализации и т.д. Фармацевтические композиции, пригодные для перорального введения протеинов, описаны, например, в US 5008114; 5505962; 5641515; 5681811; 5700486; 5766633; 5792451; 5853748; 5972387; 5976569 и 6051561.
Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем.
Пример
Очистка общего ARN из здоровой сетчатки мышей 5-недельного возраста
Библиотеку кДНК из сетчаток мышей 5-недельного возраста линии C57BL/6@N конструировали, следуя в целом методу, описанному Glissin и др., Biochemistry, 13, 1974, cc.2633-2637. В целом метод заключался в следующем: после умерщвления животных подвергали энуклеации и глаза сначала помещали в забуференный фосфатом физиологический раствор (ЗФР), дополненный 0,1% диэтилпирокарбонатом (ДЭПК). Невральную сетчатку сразу отсекали (из этого тканевого препарата удаляли пигментированный эпителий сетчатки). Сразу после каждого отсечения ткани гомогенизировали в свежеприготовленном 6М гуанидийхлориде (ГХ). Объединяли 10 сетчаток в 2,4 мл ГХ в стерильных пробирках объемом 4 мл и ткань полностью разрушали путем интенсивной гомогенизации в течение 1 мин при комнатной температуре.
Очистка матричной РНК (мРНК) из здоровой сетчатки мышей 5-недельного возраста
мРНК выделяли с помощью покрытых олиго-дТ пористых гранул (типа Oligotex, фирма Qiagen) в строгих условиях согласно методу Kuribayashi и др, Nucleic Acids Res. Symposium series, 19, 1988, cc.61-64. В целом метод заключался в следующем: 100-150 мкг общей РНК сетчатки мыши смешивали с 15 мкл покрытых олиго-дТ гранул в буфере для связывания [10 мМ Трис рН 7,5; 0,3М NaCl; 0,1M ЭДТК; 0,5 мас./об.% ДСН (додецилсульфат натрия)] и инкубировали в течение 6 мин при 65°С в химическом стакане в 0,5 л воды, затем постепенно охлаждали до комнатной температуры в течение приблизительно 3-4 ч, после чего центрифугировали при комнатной температуре, выделяя агарозные гранулы. Затем их дважды промывали путем инкубации в течение 10 мин в 0,4 мл раствора (0,1М Трис рН 7,5; 0,1М NaCl; 1 мМ ЭДТК; 0,5 мас./об.% ДСН). Связанную РНК (мРНК) элюировали в два этапа с помощью 50 мкл нагретой до 70°С воды, не содержащей РНКазы, осаждали с помощью 10 мкл ацетата натрия, рН 5,2 и 0,25 мл этанола и инкубировали в течение 12 ч при -70°С. мРНК собирали путем центрифугирования (1 ч при 15000 об/мин, после чего дважды промывали 70%-ным этанолом) и ресуспендировали в 20 мкл воды, не содержащей РНКазы. Концентрацию мРНК измеряли при 260 нм и отсутствие примесей в виде рРНК проверяли с помощью гель-электрофореза в описанных выше денатурирующих условиях.
Синтез кДНК
Синтез кДНК осуществляли согласно методу Okayama и Berg, Mol Cell Biol., 2, 1982, cc.161-170. Для синтеза первой цепи осуществляли примирование с использованием 2,5 мкг адапторного нуклеотида для NotI (5'-TGTTACCAATCTGAAGTGGGAGCGGCCGACAA(T)18-3') и инкубировали в течение 2 ч с 50 единицами обратной транскриптазы модифицированного вируса мышиного лейкоза (M-MLV) (Superscript II, фирма Life Technology) в условиях, рекомендованных поставщиком. Для синтеза второй цепи реакционную смесь инкубировали в течение 4 ч при 14°C с 4 единицами РНКазы Н и 100 единицами ДНК-полимеразы I в SS-буфере [40 мМ Трис рН 7,2; 85 мМ хлорид калия; 4,4 мМ хлорид магния; 3 мМ ДТТ (дитиотреитол); 5 мкг/мл бычьего сывороточного альбумина (БСА)] в конечном объеме 0,25 мл. EcoRI-адапторы (5'-ОН AATTCGGCACGAGG 3'-OH/3'-OH GCCGTGCTCC5'-PO4) лигировали с обоими концами двухцепочечной кДНК в течение 14 ч при 16°С с использованием 40 единиц ДНК лигазы фага Т4 (фирма Promega, Мэдисон, США) в общем объеме 20 мкл в условиях, рекомендованных поставщиком. Продукты этой реакции представляли собой двухцепочечную кДНК (дцДНК), которая имела полусайт EcoRI на 5'-конце и полусайт NotI на 3'-конце, что позволяло ориентировать ее в клонирующем векторе.
Встраивание дцкДНК путем лигирования в pcDNA3
Встраивание дцкДНК путем лигирования в pcDNA3 осуществляли согласно Maniatis Т., Molecular cloning: a laboratory manual, 2e изд., 1992, используя 10 мкг плазмиды pcDNA3 (фирма Invitrogen), полученной путем расщепления с помощью EcoRI и NotI (фирма Promega, Мэдисон, США) в условиях, рекомендованных поставщиком.
Размножение рекомбинантных клонов
Размножение рекомбинантных клонов осуществляли в целом согласно методу Birnboim и др., Nucleic Acids Res., 7, 1979, cc.1513-1523. В целом метод заключался в следующем: для получения пулов из 100 первичных клонов применяли протокол трансформации XL1 Gold (фирма Strategene), в который были внесены следующие небольшие изменения. После инкубации в среде для выращивания реакционную смесь для трансформации вносили в среду, содержащую 20 об.% глицерина и 8 об.% лошадиного сывороточного альбумина (ЛСА, фирма Life Technologies). ЛСА и глицерин препятствуют гибели в результате оттаивания после замораживания. Титрование осуществляли путем высевания на агаровые пластины (100 мкг/мл ампициллина) возрастающих объемов каждой реакционной смеси для трансформации для того, чтобы рассчитать объем, позволяющий получать 100 колоний, при этом маточный реакционный раствор для трансформации хранили при -80°С. Рекомбинантные плазмиды из библиотеки очищали, используя за один раз по 96 пулов. Для получения 96 пулов, состоящих из 100 клонов, рассчитанный объем, соответствующий 100 клонам, высевали на агар и выращивали в течение 20 ч при 37°С. ДНК очищали непосредственно из колоний, снятых с агаровых пластин. Маточный раствор каждой культуры в 23%-ном глицерине хранили при -80°С. ДНК очищали с помощью устройства Qiawell ultra (фирма Qiagen), используя протокол, рекомендованный поставщиком. Как правило, получали 10 мкг очищенной плазмиды, концентрацию каждого препарата оценивали, измеряя оптическую плотность при длине волны 260 нм. Для разделения отобранных пулов, содержащих 100 клонов, на пулы, содержащие по 10 клонов, 50 мкл разведения (1/250000) глицеринового маточного раствора исходного пула высевали на агаровую пластину, дополненную 100 мкг/мл ампициллина. После выращивания в течение 16 ч при 37°С 160 индивидуальных колоний реплицировали на 16 агаровых пластинах (по 10 колоний на пластину) и выращивали в течение 16 ч при 37°С. С каждой пластины собирали по 10 колоний и выращивали в жидкой среде [бульон Луриа (LB), 100 мкг/мл ампициллина] в течение 3 ч при 37°С.Маточный раствор этих культур в 30%-ном глицерине хранили при -80°С. Плазмидную ДНК получали согласно описанному выше методу. Для разделения субпулов, состоящих из 10 клонов, на индивидуальные клоны 50 мкл разведения (1/250000) глицеринового маточного раствора высевали на агаровую пластину, дополненную 100 мкг/мл ампициллина. После выращивания в течение 16 ч при 37°С, собирали 16 отдельных колоний и выращивали в течение 16 ч в 2 мл LB, дополненного 100 мг/мл ампициллина. Маточный раствор этих культур в 30%-ном глицерине хранили при -80°С. Плазмидную ДНК получали согласно описанному выше методу.
Кратковременная трансфекция клеток линии Cos-1
Кратковременную трансфекцию клеток линии Cos-1 осуществляли, используя метод Chen и Okayama, High-efficiency transformation of mammalian cells by plasmid ДНК, Mol Cell Biol., 7, 1987, cc.2745-2752).
Культуры клеток сетчатки куриного эмбриона
Для этой цели был адаптирован протокол, описанный у Adler и Hatlee, Science, 243, 1989, с.391. Сетчатку куриного эмбриона (6-дневные эмбрионы в яйце) подвергали диссоциации и культивировали в виде монослойной культуры. При таких условиях культивирования в отсутствие сигналов дифференцировки 60-80% клеток представляют собой колбочки. При создании изобретения получали в кроликах поликлональные антитела к визинину (маркер колбочек сетчатки кур, регистрационный номер М84729 в Genbank) и проверяли, что пропорция колбочек в описанной выше культуре составляла 60-80%. Простая окружающая среда, используемая в такой модели (определенный химический состав среды, отсутствие контактов клетка-клетка), в дополнение к простоте и скорости осуществления метода делают эту систему очень предпочтительной для изучения трофических факторов, участвующих в выживании колбочек. В целом, метод состоял в следующем: сетчатки эмбрионов, полученных от контрольного изолята прародителей, вырезали после 6 дней развития в яйце, клетки подвергали диссоциации и высевали с низкой плотностью (105 клеток/см2). В течение 10 дней оценивали жизнеспособность клеток (60-80% колбочек) с помощью метода анализа LIVE/DEAD (фирма Molecular probes, Эуген, США), т.е. анализа, который позволяет оценить количество живых и мертвых клеток. Количество живых клеток снижается до 8% от исходного количества клеток после культивирования в течение 7 дней в имеющей определенный химический состав среде. При осуществлении анализа в присутствии кондиционированных сред из COS1 количество живых клеток, трансфектированных клонами из библиотеки, подсчитывали после культивирования in vitro в течение 7 дней.
Куриц-прародителей (линия 657, красная метка) для цели данного эксперимента содержали в отдельном помещении на птицефабрике, расположенной в 25 км от лаборатории. Полученные в результате естественного оплодотворения яйца собирали еженедельно и после высиживания выдерживали в лаборатории при 17°С (что соответствует их биологическому нулю). Ежедневно по 5 яиц инкубировали в течение 24 ч при 20°С, а затем в течение 136 ч при 37°С при периодической смене угла наклона яиц в увлажняющей камере. В день начала культивирования поверхность яиц промывали Mucocit-A, затем скорлупу разбивали, куриные эмбрионы переносили в ЗФР. Проверку того, что стадия развития каждого эмбриона соответствовала 29-й стадии, осуществляли путем визуального сравнения в соответствии с методом Hamburger и Hamilton, Essential Development Biology, под ред. Stern и Holland, 1951. Отбирали два эмбриона и энуклеировали, глаза переносили в среду с произвольным содержанием СО2 (фирма Life Technologies). Сетчатки вырезали и переносили в буферный раствор Рингера и дважды промывали. Сетчатки разрезали на маленькие кусочки и обрабатывали в течение 20 мин при 37°С раствором трипсина (0,25% мас./об.). Реакцию прекращали путем добавления культуральной среды (M199, фирма Life Technologies), дополненной 10% инактивированной ФТС. Суспензию клеток обрабатывали в течение нескольких минут в 25 мкл ДНКазы I (1 мг/мл, фирма Sigma). Затем для того, чтобы удалить ФТС, суспензию клеток дважды промывали культуральной средой, имеющей определенный химический состав (Chemical Defined Culture Media) [CDCM, равными объемами сред DMEM и M199 (фирма Life Technologies) и средой АВ с добавками (5 мкг/мл инсулина; 5 мкг/мл трансферрина; 64 нМ прогестерона; 0,1 мМ путресцина; 5 нг/мл селена; 3 мМ таурина; 2,7 мкМ цитидин-5'-дифосфоэтаноламина; 5,2 мкМ цитидин-5'-дифосфохолина, 0,2 мкг/мл гидрокортизона; 30 нМ 3,3'-5-трийод-L-тиронина; 1 мМ пируват натрия), 0,3 мкМ простагландина D2; 0,1 мг/мл линолевой кислоты]. Концентрацию клеток, окрашенных трипановым синим, измеряли с помощью ячейки Маллассеза и доводили до двух концентраций (5,6 и 1,12×105 клеток/мл), соответствующих двум плотностям посева (2 и 4×105 клеток/см2).
Кондиционированные среды, содержащие трансфектированные клетки Cos-1, подвергали оттаиванию на льду и 50 мкл переносили в два 96-луночных черных планшета для культур ткани (фирма Corning Costar), которые сенсибилизировали раствором, содержащим 100 мкг/мл поли-L-лизина (фирма Sigma) согласно следующему плану.
Первый цикл скрининга:
В этой таблице числа обозначают номера пулов, состоящих из 100 клонов, С обозначает кондиционированные среды, полученные из клеток Cos-1, трансфектированные пустым вектором (pcDNA3), Р обозначает положительный контроль (кондиционированные среды, трансфектированные pcDNA-мышиный GDNF).
Второй и третий цикл скрининга:
В этой таблице х (второй цикл) и у (третий цикл) обозначают количество пулов, отобранных в первом и втором циклах соответственно. Числа от 01 до 16 обозначают использованные субпулы. х(у) обозначает родительский пул, из которого вывели 16 пулов. С имеет такое же значение, что и для первого цикла. Р модифицировали, используя pCMVScript-CNTF во втором цикле и затем pcDNA-939.09.08 в третьем цикле. 0 обозначает клетки колбочек сетчатки кур в средах, содержащих только CDCM. C57 и С3Н обозначают кондиционированные среды, полученные с использованием эксплантатов сетчаток, которые выделяли, как описано выше (получение кондиционированных сред из эксплантатов сетчатки мышей), из сетчаток 5-недельных мышей линий C57BL/6@N и C3H/He@N соответственно.
50 мкл суспензий клеток, соответствующих двум плотностям (2 и 4×105 клеток/см2), добавляли в каждую лунку двух 96-луночных планшетов, заполненных кондиционированными средами, с помощью 8-канальной автоматизированной пипетки (фирма Biohit) для того, чтобы минимизировать экспериментальные ошибки. Клетки инкубировали в течение 7 дней при 37°С в атмосфере, содержащей 5% CO2.
Получение кондиционированных сред из эксплантатов мышиных сетчаток
Во втором и третьем цикле скрининга использовали положительные контроли, которые получали согласно адаптированному методу Mohand-Saïd и др. (1998). Мышей линии 5C57BL/6@N (дикий тип) и C3H/He@N (rdl) 5-недельного возраста умерщвляли и энуклизировали. Вырезали две сетчатки и инкубировали в течение 24 ч при 37°С в атмосфере, содержащей 5% СО2 в 1,5 мл CDCM в 12-луночных планшетах. Выделяли кондиционированные среды и концентрировали в 40 раз путем ультрафильтрации с помощью устройства типа (фирма Sartorius, уровень среза 10 кДа). Кондиционированные среды замораживали в жидком азоте и хранили в аликвотных количествах при -20°С до использования. В день применения кондиционированные среды подвергали оттаиванию на льду, разбавляли в 10 раз в CDCM и стерилизовали фильтрацией через фильтр с размером ячеек 0,22 мкм (типа Acrodisk 13, фирма Gelman Sciences).
Функциональный анализ, Live/Dead-анализ
Функциональный анализ основан на определении количества куриных клеток ретины, выживших после инкубации in vitro в течение 7 дней. Для этого использовали набор для Live/Dead-анализа (фирма Molecular probes, Еуген, США), который основан на применении двух флуорогенных красителей (калцеина AM и димера этидия), окрашивающих живые и мертвые клетки соответственно. Живая клетка обладает метаболической активностью (в данном случае эстеразной активностью), в результате чего субстрат (калцеин AM) превращается в его флуоресцентный продукт, испускающий флуоресценцию при длине волны 520 нм. Проницаемость мембраны мертвой клетки изменяется, что позволяет осуществлять окрашивание ДНК ядра с помощью димера этидия, испускающего флуоресценцию при длине волны 635 нм. Если клетка жива, то испускание происходит при длине волны 520 нм после возбуждения при длине волны 485 нм, если мертва, то испускание происходит при длине волны 635 нм после возбуждения при длине волны 520 нм. С помощью эпифлуоресцентной микроскопии можно по отдельности визуализировать два типа флуоресцентных клеток. После культивирования в течение 7 дней in vitro клетки инкубировали в течение 30 мин при комнатной температуре в темноте в присутствии 2,7 мкМ калцеина-АМ и 0,3 мМ димера этидия.
Получение изображений
В целом получение изображения заключается в автофокусировании каждой лунки, автоматизированном подсчете клеток при двух длинах волн флуоресценции и последующей обработки первичных данных с использованием специализированного математического обеспечения, например, Metamorph (фирма Universal Imaging Corporation, Западный Честер, США), для получения преобразованных в цифровую форму изображений каждой лунки планшета. При этом использовали инвертированный микроскоп (Nikon ТЕ 200), снабженный ртутной эпифлуоресцентной лампой с двумя фильтрами для длин волн возбуждения 485 и 520 нм, двумя фильтрами для длин волн испускания 520 и 635 нм, объективом (×10), управляемой компьютером механизированной пластиной (Multicontrol 2000, фирма Martzauzer) и CCD-фотокамерой (фотокамера с зарядовой связью) (фирма Cohu).
Для получения изображения планшета его помещали на механизированную пластину и вручную фокусировали на первой лунке и получали изображение в этой плоскости (начало координаты z). На основе данных, полученных для первой лунки, устанавливали порог визуализации мертвых и живых клеток. Положение центра первой лунки регулировали в белом свете путем совмещения вручную дна первой лунки с дном изображения на мониторе компьютера, а затем совмещали самый правый край первой лунки с правой стороной изображения на компьютере и регистрировали два положения. Вычисляли положение центра первой лунки и определяли положение центра каждой лунки планшета. В процессе разработки метода было установлено, что в углу лунки имеется несколько более повышенная плотность клеток и поэтому угловую область исключали из обработок. Важно, чтобы изображение каждой лунки было строго центрировано для того, чтобы избежать любых результатов, вводящих в заблуждение. При настройке осуществляли первое сканирование для получения изображения мертвых клеток. В этих условиях плотность мертвых клеток является менее вариабельной. Программа выполняла автофокусирование путем получения изображений в различных фокальных плоскостях и выбирала наиболее яркий правильный фокус. Это z-положение запоминалось и пластина осуществляла запрограммированные перемещения относительно осей х и у, при этом получали в общей сложности 4 изображения, которые после преобразования в единое изображение охватывали 2/3 поверхности лунки. Весь объем изображений, полученных вне фокусных плоскостей, сохраняли для контроля. С помощью пластины осуществляли автофокусирование и 4-кратный сбор данных для каждой лунки планшета, начиная с лунок А1-А12, затем В12-B1, C1-С12 и т.д. В завершение пластина перемещалась за пределы планшета для того, чтобы переэкспонировать последнюю лунку (H1). Сканирование мертвых клеток занимало 30 мин. Второе сканирование (живых клеток) осуществляли после смены фильтра. При этом втором сканировании использовали z-положения каждой лунки, записанные при сканировании мертвых клеток. Также как и для мертвых клеток, для каждой лунки получали 4 изображения. После завершения второго сканирования (22 мин) преобразованные изображения живых и мертвых клеток запасали в файле, которому автоматически присваивался номер с указанием даты. Количества клеток (мертвых и живых) подсчитывались автоматически в соответствии с предварительно заданными морфометрическими параметрами (средние значения) и отображались на мониторе компьютера для того, чтобы можно было проверять правильность проведения эксперимента. Важно ежедневно проверять, что количество живых клеток не является слишком большим. Было установлено, что при высевании со слишком высокой плотностью клетки куриной сетчатки живут дольше по всей видимости благодаря тому, что они вырабатывают собственный фактор выживания. Клетки подвергали скринингу в отсутствие такого действия. Перед сканированием второго планшета (такой же эксперимент проводили при удвоенной плотности культивируемых клеток) в конце имени файла регистрации для первого планшета добавляли букву а. Изображения, полученные в каждом эксперименте, запасали на CD-ROM. Была создана библиотека, содержащая более 250 CD-ROMов.
Подсчет клеток и отбор пулов
Количества клеток (живых и мертвых) подсчитывали с использованием изображений, полученных в каждом эксперименте и запасенных на CD-ROMe. Скачали файл регистрации для конкретного эксперимента, загружали в компьютер (подсчет осуществляли в режиме off-line) и открывали его с использованием программного обеспечения Metamorph. На первой стадии открывали файлы с изображениями, соответствующие 14 лункам С (кондиционированная среда из клеток Cos-1, трансфектированных пустым вектором). После регулирования порога изображения использовали команду (программу) Интегрированного Морфометрического Анализа (Integrated Morphometry Analysis) для измерения для этих контрольных лунок распределения площадей объекта (количество живых клеток для каждой полной площади) в диапазоне от 10 до 250. Распределение описывалось кривой Гаусса, при этом максимальное количество объектов соответствовало изолированной клетке. Затем это стандартное значение (SV) использовали для расчета величины площади, выше которой объект следует рассматривать как две клетки (стандартное пороговое значение объекта, SOC), с помощью выведенной авторами изобретения эмпирической функции: SOC=29/20,74 SV. Величину SOC для каждого отдельного планшета использовали для подсчета количества живых клеток на планшете. Полученные данные затем переводили в Excel-таблицу.
Для первого цикла скрининга на основе данных для каждого пула строили график зависимости кратной разницы (увеличение или уменьшение количеств живых клеток по отношению к среднему значению для 14 контрольных лунок) ± стандартное отклонение. Для того чтобы устранить вариации, обусловленные разницей положений на планшете, рассчитывали среднюю кратную разницу индивидуально между 80 лунками, соответствующими положениям, в которых тестировали пулы и 14 контрольными лунками для 200 независимых планшетов. В среднем наблюдавшиеся различия были обусловлены только различием в положении, и количества клеток корректировали с учетом этого коэффициента. Для того чтобы более строго определять предназначенные для селекции пулы, строили график зависимости количеств живых клеток в виде кратной разницы по отношению к контролю, в качестве которого использовали все пулы, для которых значения кратной разницы не превышали 1,3, но превышали 0,4. Таким образом, считалось, что все пулы, для которых кратная разница по сравнению с 14 лунками, содержащими пустой вектор, находилась в интервале от 0,4 до 1,3, не оказывали действия и их рассматривали в качестве контроля. После коррекции кратную разницу по отношению к контролю для двух планшетов перемножали и результаты располагали в порядке уменьшения кратной разницы. Пулы, находившиеся во главе этого списка, подвергали дальнейшей проверке путем визуального исследования графика, соответствующего 20 пулам, на которых проводили эксперимент (оба планшета), и изображений живых и мертвых клеток для того, чтобы избежать скрининга сомнительных пулов.
Для второго и третьего цикла при скрининге планшетов для субпулов использовали дополнительный контроль. Приготавливали кондиционированные среды из эксплантатов сетчатки мышей 5-недельного возраста. Отбирали опыты, в которых были обнаружены положительные действия для эксплантатов сетчатки, полученных от C57BL/6@N и исключали другие. Результаты представляли в виде графика кратной разницы по отношению к 14 контрольным лункам, для контролей пересчета не производили. Перемножали кратную разницу по отношению к контролю для двух планшетов и результаты для 16 субпулов располагали в порядке уменьшения кратной разницы.
Выделенные кДНК секвенировали с использованием праймера Т7 (5'-GTAATACGACTCACTATAGGGC-3') на капиллярном секвенаторе (типа CEQ2000, фирма Beckman Coulter). Последовательность ДНК сравнивали с базой данных с использованием программы Basic Local Alignment Search Tool (BLAST).
Идентификация Rdcvf2 и человеческих гомологов
С использованием последовательности Rdcvf1 (нуклеотидная последовательность, кодирующая полипептиды, представленные в SEQ ID NO: 2 или SEQ ID NO: 4) и программы BLAST идентифицировали гомологичные мышиные и человеческие полипептиды (фиг.8). Были идентифицированы следующие EST-клоны, гомологичные мышиному RdCVF2 (регистрационный номер в GenBank: bc016199): регистрационные номера в GenBank: be552141, bi517442, bg707818, bi603812, ai433287, be088414, bg297383, bg297304 (см. также фиг.12). Были идентифицированы следующие EST-клоны, гомологичные мышиному Rdcvf1 (SEQ ID NO: 1): регистрационные номера в GenBank: bg299078, ai716631, bg294111, be108041, bg395178 (см. также фиг.13).
Анализ в реальном времени экспрессии Rdcvf1 с помощью ОТ-ПЦР
Экспрессию Rdcvf1 в клетках сетчатки мышей линий C57BL/6@N и C3H/He@N 5-недельного возраста, а также конгенных мышей С3Н (+/+ и rd/rd) такого же возраста изучали с помощью ОТ-ПЦР в реальном времени в прозрачной ячейке (фирма Roche) с использованием sybergreen-набора для ПЦР (фирма Roche). кДНКs получали путем случайного примирования с использованием гексамерного олигонуклеотида (pdN6, фирма Amersham), обратной транскриптазы M-MLV (superscript II, фирма Life Technologies) и общей РНК из сетчатки мыши, полученной, как описано в 1). кДНК стандартизовали с использованием «вездесущего» переносчика глюкозо-6-фосфатдегидрогеназы (G6PDH). 0,2 мкл синтезированной первой цепи кДНК (эквивалентное 10 нг общей РНК) амплифицировали с использованием 2 мкМ олигонуклеотидов, последовательности которых представлены в SEQ ID NO: 24 и SEQ ID NO: 25, в трех повторностях в общем объеме 25 мкл согласно следующей программе: 30 с при 95°С и 35 циклов, проводимых в следующей последовательности: (1 с при 95°С, 18 с при 55°С, 10 с при 72°С). Результаты анализа (фиг.16) свидетельствуют о том, что экспрессия Rdcvf1 уменьшается после дегенерации палочек у мышей линии rd1 (C3H/He@N). С помощью ОТ-ПЦР в реальном времени с использованием РНК, полученной из внешнего слоя сетчатки с применением вибратома для изготовления срезов, было установлено также, что Rdcvf1 экспрессируется непосредственно фоторецепторами. Продукты проверяли с помощью электрофореза в агарозном геле. Аналогичные результаты получали с использованием другой пары специфических в отношении Rdcvf1 праймеров. В качестве положительного контроля оценивали экспрессию аррестина палочек (регистрационный номер М24086) в тех же условиях с использованием праймеров (5'-CTATTACGTCAAGCCTGTAGCC-3' и 5'-САТССТСАТСТТТСТТСССТТС-3'). Подтверждение того, что Rdcvf1 представляет собой защитный фактор колбочек, можно получить, добавляя соответствующее количество Rdcvf1 к эксплантату сетчатки мыши линии rd1 (C3H/He@N) 5-недельного возраста. Необходимое количество можно оценивать путем нескольких предварительных экспериментов по титрованию исходного количества. По сравнению с соответствующими контролями через 7 дней выживаемость колбочек должна повышаться.
ОТ-ПЦР-анализ Rdcvf2
ОТ-ПЦР для экспрессии Rdcvf2 осуществляли с использованием праймеров 5'-GCCAGCGTTTTCTGCCTTTTAC-3' и 5'-AAGCCCTGCCTGCTCTAACATC-3'. Результаты анализа свидетельствуют о том, что экспрессия RdCVF2 зависит от палочек и что экспрессия Rdcvf2 происходит не только в сетчатке, другие нервные клетки также экспрессируют Rdcvf2 (фиг.17), в то время как экспрессия Rdcvf1, по-видимому, происходит только в клетках сетчатки.
Live-Dead-анализ Rdcvf1 или Rdcvf2
Клетки COS-1 трансфектировали пригодным экспрессионным вектором, несущим Rdcvf1 или Rdcvf2 под контролем индуцибельного промотора. Контрольные клетки трансфектировали пустым вектором. Клетки инкубировали в течение определенного периода времени после индукции экспрессии Rdcvf1 или Rdcvf2. Затем количество выживших клеток колбочек, которые инкубировали в кондиционированных средах из клеток COS-1, трансфектированных Rdcvf1 или Rdcvf2, и количество выживших контрольных клеток подсчитывали согласно описанному выше методу. Установлено, что клетки, экспрессирующие Rdcvf1 или Rdcvf2, характеризуются существенно более высокой выживаемостью, чем контрольные клетки.
Специфический в отношении палочек фактор
Результаты проведенного в стандартных условиях ОТ-ПЦР-анализа в реальном времени экспрессии аррестина палочек (контроль) и Rdcvf1 в эксплантатах сетчатки 5-недельных мышей C57BL/6@N и C3H/HE@N с использованием праймеров
SEQ ID NO: 24: 5'-TCTATGTGTCCCAGGACCCTACAG-3'
SEQ ID NO: 25: 5-TTTATGCACAAGTAGTACCAGGACAG-3'
свидетельствуют о том, что RdCVF1 экспрессируется только в присутствии палочек (выведенный из палочек CVF1).
Получение поликлональных антител
Поликлональные антитела получали в организме кроликов в результате инъекции кролику очищенного слитого протеина, несущего глутатион-S-трансферазу (GST) (GST-Rdcvf1), а также фрагмент пептидной последовательности мышиного RdCVF1, простирающийся от аминокислоты в положении 11 до аминокислоты в положении 32 SEQ ID N02 (Ат №2), и фрагмент пептидной последовательности, простирающийся от аминокислоты в положении 79 до аминокислоты в положении 96 SEQ ID N02 (Ат №3). Слитую конструкцию pGST-Rdcvf1 получали путем амплификации с помощью олигонуклеотидов, представленных в SEQ ID NO: 26 и SEQ ID NO: 27, с использованием pcDNA-Rdcvf1 в качестве матрицы в стандартных условиях. Открытую рамку считывания (OPC) Rdcvf1 клонировали в рамке считывания в pGex2TK (фирма Pharmacia) между сайтами рестрикции BamHI и EcoRI и трансформировали Е.coli [BL21 (DE3) pLysS, фирма Promega] с помощью стандартного метода. Индивидуальную колонию выращивали в 3 л жидкой среды LB, дополненной 100 мкг/мл ампициллина, при 30°С, производство протеина индуцировали путем добавления 1 мкг/мл изопропилтио-b-D-галактозида (ИПТГ) и продолжали в течение 5 ч при 30°С. Клетки собирали, лизировали путем облучения ультразвуком и очищали на глутатионсефарозе согласно стандартному протоколу. Слитый протеин элюировали с помощью 10 мМ восстановленного глутатиона при комнатной температуре. Элюированный протеин подвергали диализу в ЗФР перед инъекцией кроликам. Чистоту протеина оценивали с помощью электрофореза в полиакриламидном геле. Двух кроликов иммунизировали путем интрадермальной инъекции в 80 местах 100 мкг очищенного GST-Rdcvf1. Сыворотку отбирали через 8 недель.





























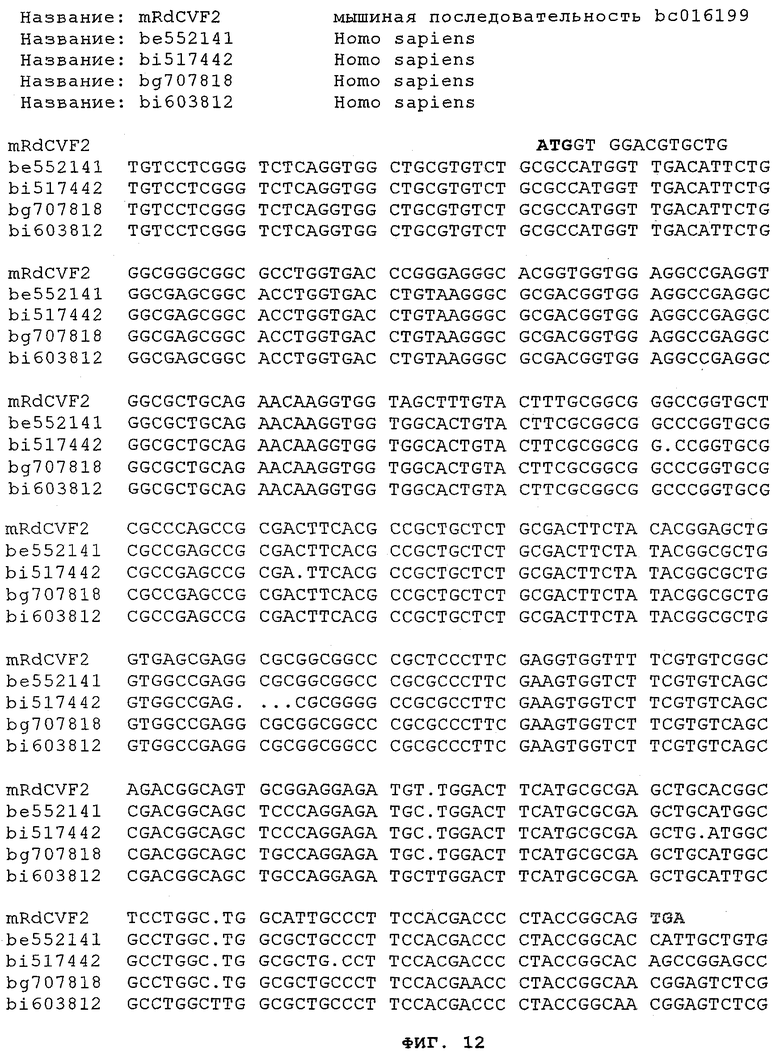
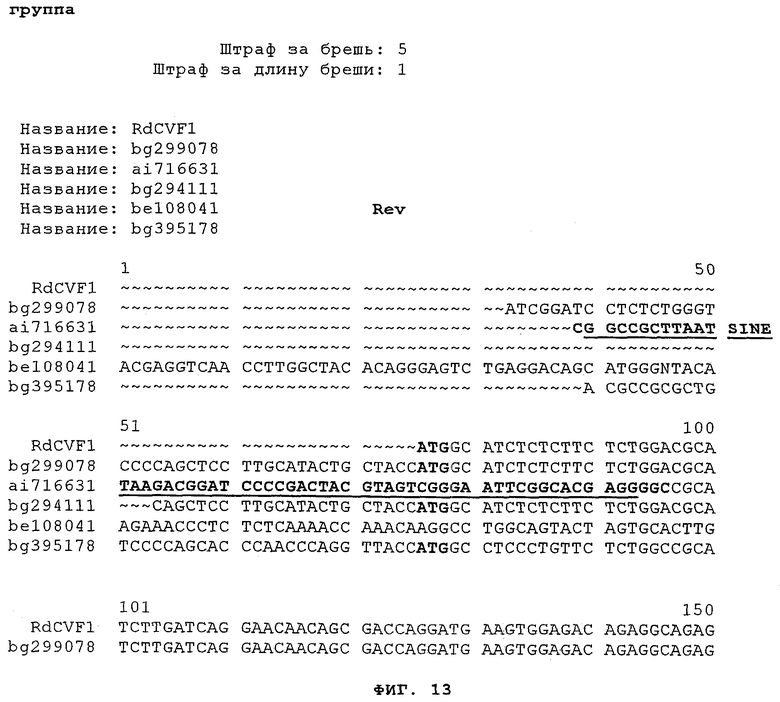
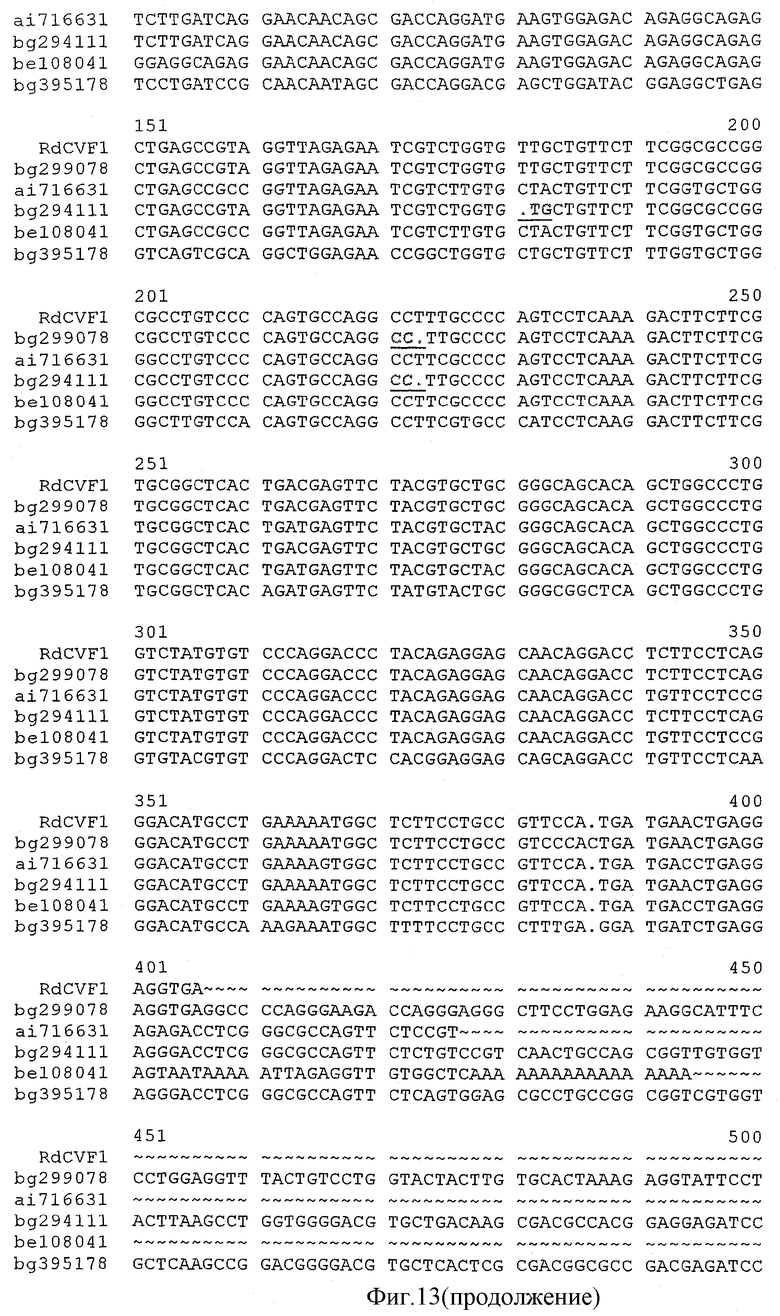
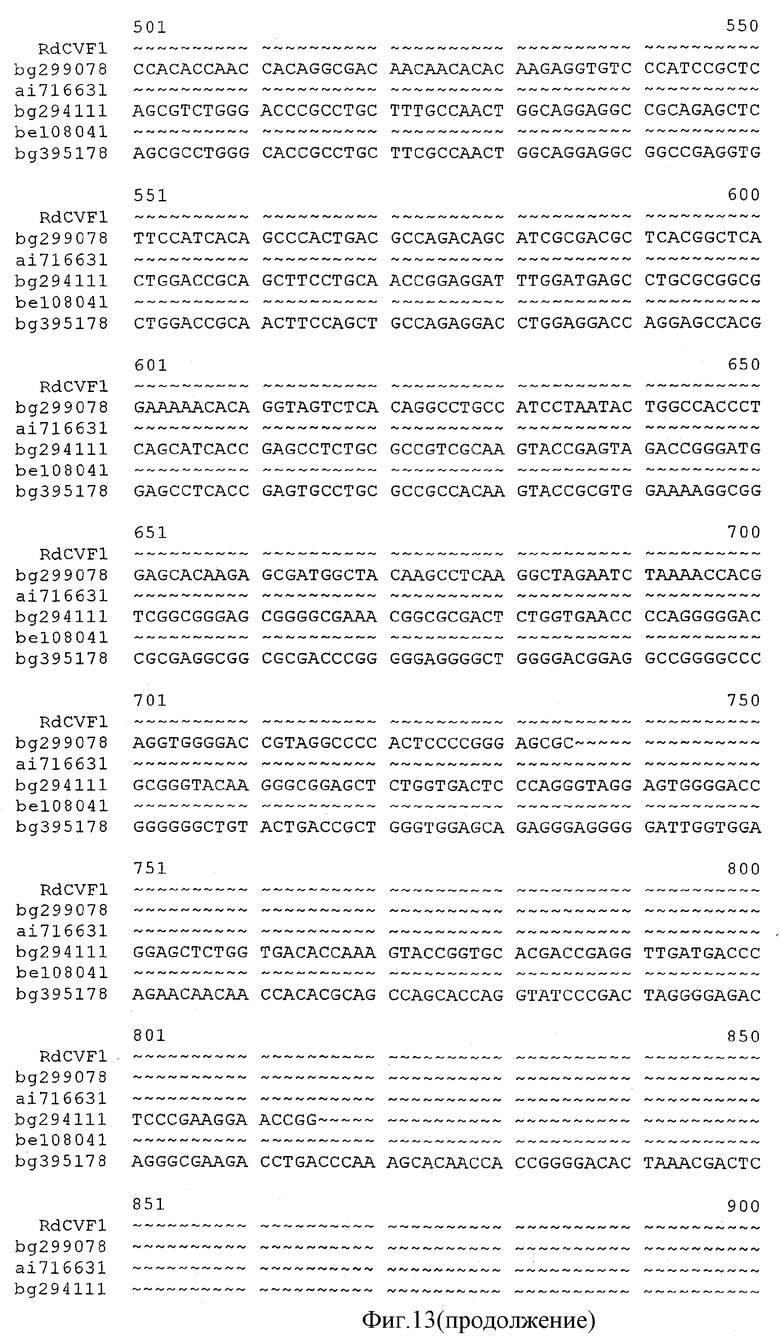


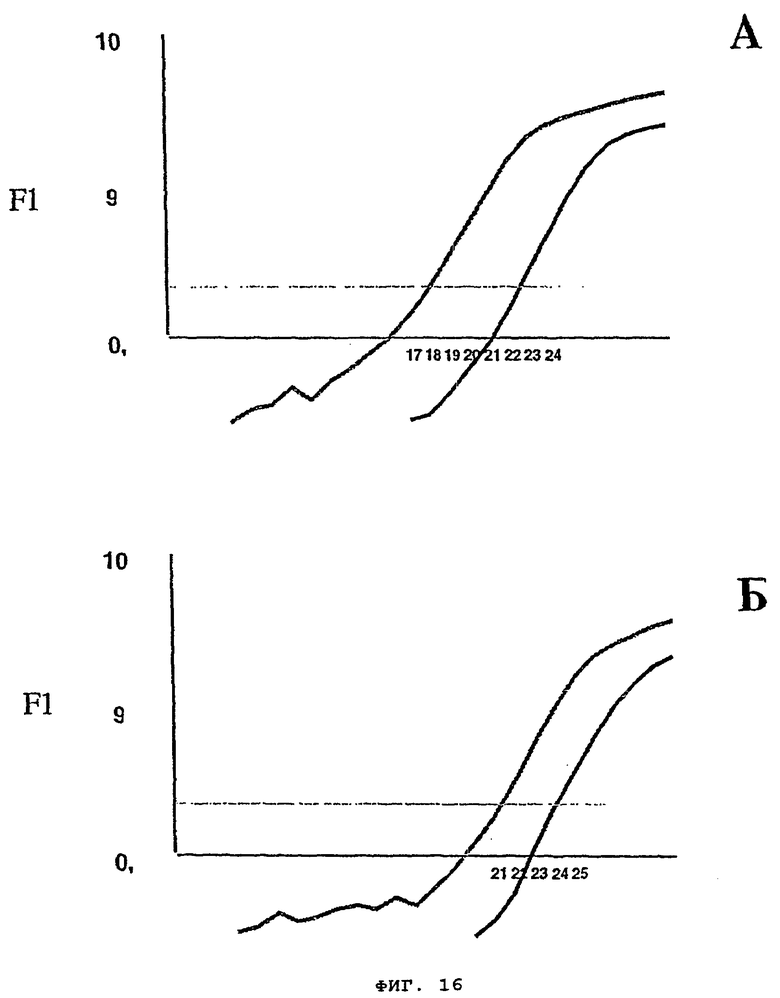
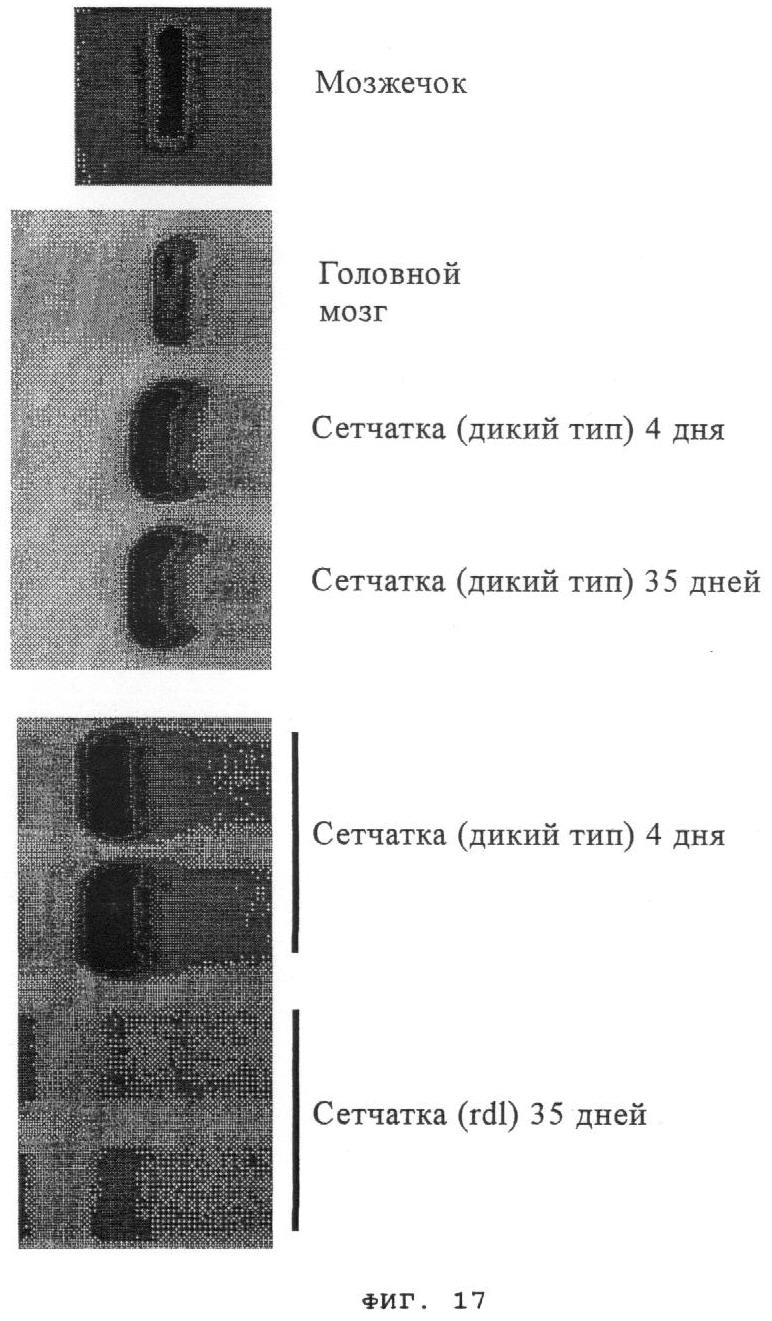
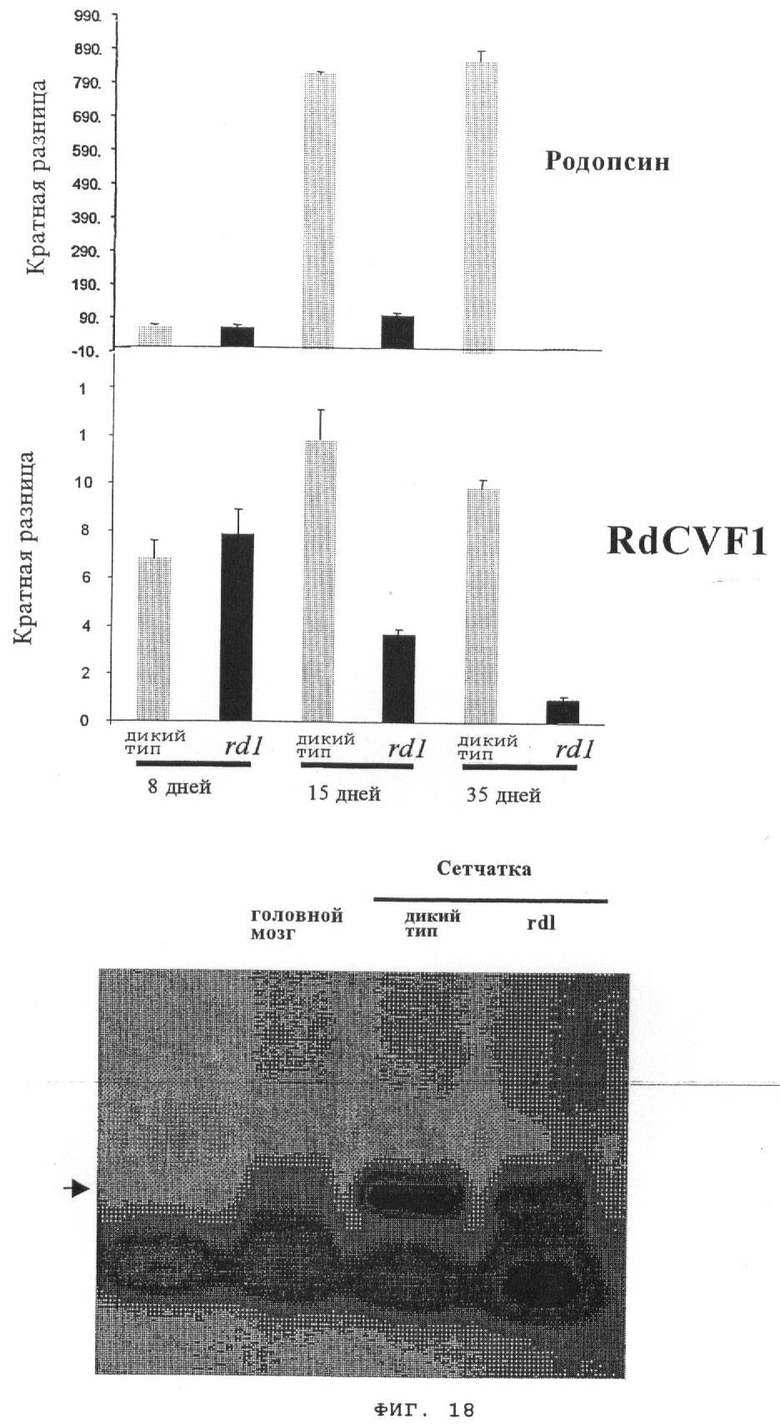
Изобретение относится к области биохимии и генетической инженерии и может быть использовано в медицине. Предлагается применение группы повышающих выживаемость колбочек сетчатки полипептидов, происходящих из палочек сетчатки и обозначенных как RDCF, а также кодирующих их молекул нуклеиновой кислоты для приготовления лекарственных средств, в частности фармацевтических композиций, предназначенных для лечения дистрофии сетчатки. Описаны способы получения RDCF с помощью технологий рекомбинантных ДНК и необходимые для их осуществления средства, а также получение антител, распознающих указанные полипептиды. 8 н. и 4 з.п. ф-лы, 18 ил.
1. Применение полипептида с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 10 и SEQ ID NO: 14, для приготовления лекарственного средства для лечения дистрофии сетчатки.
2. Фармацевтическая композиция, предназначенная для лечения дистрофии сетчатки и включающая терапевтически эффективное количество полипептида, выбранного из группы, включающей SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 10 и SEQ ID NO: 14, и фармацевтически приемлемый носитель.
3. Применение нуклеиновой кислоты, кодирующей полипептид с аминокислотной последовательностью, выбранной из SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 10 и SEQ ID NO: 14, для приготовления лекарственного средства для лечения дистрофии сетчатки.
4. Фармацевтическая композиция, предназначенная для лечения дистрофии сетчатки и включающая терапевтически эффективное количество нуклеиновой кислоты, выбранной из группы, включающей SEQ ID NO: 1, SEQ ID NO: 5, SEQ ID NO: 9 и SEQ ID NO: 13, и фармацевтически приемлемый носитель.
5. Очищенный полипептид, обладающий способностью повышать выживаемость колбочек сетчатки и включающий аминокислотную последовательность, представленную в SEQ ID NO: 2.
6. Нуклеиновая кислота с нуклеотидной последовательностью SEQ ID NO: 1, причем эта нуклеиновая кислота кодирует полипептид, который увеличивает выживаемость колбочек сетчатки.
7. Вектор экспрессии, включающий нуклеиновую кислоту с последовательностью, кодирующей полипептид с аминокислотной последовательностью SEQ ID NO: 2, которая функционально связана с последовательностью, контролирующей транскрипцию, для применения при приготовлении лекарственного препарата для лечения дистрофии сетчатки.
8. Вектор экспрессии по п.7, происходящий из аденовируса или вируса, ассоциированного с аденовирусом.
9. Очищенное антитело, полученное в результате иммунизации животного полипептидом с аминокислотной последовательностью, представленной в SEQ ID NO: 2, которое специфически связывается с указанным полипептидом, или его функционально активный фрагмент.
10. Фрагмент антитела по п.9, представляющий собой Fab- или F(ab')2-фрагмент.
11. Антитело по п.9, представляющее собой поликлональное антитело.
12. Антитело по п.9, представляющее собой моноклональное антитело.
| OHIRA A | |||
| ET AL., Lab | |||
| Invest., 70(2), 279-285, 1994 | |||
| SHIBUKI H | |||
| ET AL | |||
| Invest | |||
| Ophtalmol | |||
| Vis | |||
| Sci., 39(8), 1470-1477, 1998. |
Авторы
Даты
2010-03-20—Публикация
2002-04-05—Подача