Область техники, к которой относится изобретение
Настоящее изобретение относится к области адаптивной клеточной иммунотерапии. Его целью является повышение функциональности первичных иммунных клеток в отношении патологий, таких как опухоли, что приводит к развитию (устойчивость иммунной системы) иммунитета, повышая тем самым терапевтический потенциал указанных иммунных клеток. Способ, предлагаемый в изобретении, основан на генетической инсерции экзогенной(ых) кодирующей(их) последовательности(ей), которая(ые) помогает(ют) иммунным клеткам направлять их иммунный ответ против инфицированных или злокачественных клеток. Указанные экзогенные кодирующие последовательности более предпочтительно встраивают под транскрипционным контролем промоторов эндогенных генов, которые подвергаются повышающей или понижающей регуляции после активации иммунных клеток, под воздействием микроокружения опухоли или при опасных для жизни воспалительных состояниях, или промоторов, нечувствительных к активации иммунных клеток. Изобретение относится также к реагентам, представляющим собой специфические для последовательности эндонуклеазы, и векторам донорской ДНК, таким как AAV-векторы, для осуществления указанных таргетных инсерций в указанные конкретные локусы. Способ, предлагаемый в изобретении, способствует повышению терапевтического потенциала и безопасности сконструированных первичных иммунных клеток для их эффективного применения в клеточной терапии.
Предпосылки создания изобретения
Эффективное клиническое применение популяций первичных иммунных клеток, включая линии дифференцировки гематопоэтических клеток, было подтверждено в многочисленных клинических испытаниях в последнее десятилетие в отношении широкого разнообразия патологий, в частности ВИЧ инфекции и лейкозов (Tristen S.J. и др., Treating cancer with genetically engineered T cells. Trends in Biotechnology. 29(11), 2011, cc. 550-557).
Однако в большинстве указанных клинических испытаний применяли иммунные клетки, в основном NK- и Т-клетки, полученные из организма самих пациентов или совместимых доноров, что вносило некоторые ограничения касательно количества доступных иммунных клеток, их пригодности и их эффективности в отношении преодоления заболеваний, при которых уже развились стратегии ускользать от иммунной системы пациента или снижать ее воздействие.
В качестве основного достижения при создании аллогенных иммунных клеток были получены универсальные иммунные клетки, доступные в качестве «не требующих доработок» терапевтических продуктов, с помощью генного редактирования (Poirot и др., Multiplex Genome-Edited T-cell Manufacturing Platform for "Off-fhe-Shelf'' Adoptive T-cell Immunotherapies Cancer Res. 75, 2015, cc. 3853-3864). Указанные универсальные иммунные клетки можно получать путем экспрессии специфической редко расщепляющей эндонуклеазы в полученных из организма доноров иммунных клетках с эффектом дезинтеграции путем двухцепочечного разрыва их распознаваемых в качестве когнатных антигенных детерминант.
С момента появления на рубеже веков первых программируемых специфических для последовательности реагентов, сначала обозначенных как мегануклеазы (Smith и др., A combinatorial approach to create artificial homing endonucleases cleaving chosen sequences. Nucl. Acids Res. 34 (22), 2006, e149.), были разработаны различные типы реагентов, представляющих собой специфические для последовательности эндонуклеазы, которые обладали улучшенной специфичностью, безопасностью и надежностью.
TALE-нуклеазы (WO 2011/072246), которые представляют собой слияния TALE-связывающего домена с доменом каталитического расщепления, успешно применялись для первичных иммунных клеток, в частности, Т-клеток из мононуклеарных клеток периферической крови (РВМС). Указанные TALE-нуклеазы, поступающие в продажу под товарным знаком TALEN®, представляют собой нуклеазы, которые в настоящее время применяют для одновременной инактивации генных последовательностей в Т-клетках, полученных из доноров, в частности, для получения аллогенных терапевтических Т-клеток, в которых разрушены гены, кодирующие TCR (Т-клеточный рецептор) и CD52. Эти клетки могут быть наделены химерными антигенными рецепторами (CAR) для лечения раковых пациентов (US 2013/0315884). TALE-нуклеазы представляют собой высокоспецифичные реагенты, поскольку они должны связывать ДНК парами в облигатно гетеродимерной форме для димеризации домена расщепления Fok-1. Левый и правый элементы гетеродимера каждый может распознавать различные нуклеотидные последовательности, состоящие примерно из 14-20 пар оснований (bp), что определяет их специфичность в отношении последовательностей-мишеней, состоящих в целом из 30-50 пар оснований.
Другие реагенты, представляющие собой эндонуклеазы, созданы на основе компонентов CRISPR (кластеризованные, регулярно перемежающиеся короткие полиндромные повторы (Clustered Regularly Interspaced Short palindromic Repeats)) типа II прокариот из адаптивной иммунной системы бактерий S. pyogenes. Указанная многокомпонентная система, которую обозначают как система нуклеаз, работающих «по наводке» РНК (РНК-направляемые нуклеазы) (Gasiunas, Barrangou и др., 2012; Jinek, Chylinski и др., 2012), включает членов семейств эндонуклеаз Cas9 или Cpf1, сшитых с молекулами гидовой РНК, которые обладают способностью транспортировать указанную нуклеазу к некоторым конкретным геномным последовательностям (Zetsche и др., Cpf1 is а single RNA-guided endonuclease that provides immunity in bacteria and can be adapted for genome editing in mammalian cells. Cell 163, 2015, cc. 759-771). Указанные программируемые РНК-гидом (направляемые РНК) эндонуклеазы легко получать, поскольку специфичность их расщепления определяется последовательностью гидовой РНК, которую легко создавать и получать с небольшими материальными затратами. При этом, CRISPR/Cas9 обладают специфичностью в отношении более коротких последовательностей, чем TAL-нуклеазы, состоящих примерно из 10 bp, которые должны быть локализованы вблизи конкретного мотива РАМ, в генетической последовательности-мишени. Описаны аналогичные системы, в которых используется одноцепочечный олигонуклеотид ДНК (ДНК-гид) в комбинации с белками-аргонавтами (Argonaute) (Gao F. и др., DNA-guided genome editing using the Natronobacterium gregoryi Argonaut, 2016, doi: 10.1038/nbt.3547).
Другие эндонуклеазные системы, полученные из хоминг-эндонуклеаз (например, I-OnuI или I-CreI), объединенные или не объединенные с TAL-нуклеазой (например, MegaTAL) или нуклеазами с цинковыми пальцами, также обладают специфичностью, но пока в меньшей степени.
Наряду с этим новые специфичности можно придавать иммунным клеткам путем генетического переноса трансгенных Т-клеточных рецепторов или так называемых химерных антигенных рецепторов (CAR) (Jena и др., Redirecting Т-cell specificity by introducing a tumor-specific chimeric antigen receptor. Blood. 116, 2010, cc. 1035-1044). CAR представляют собой рекомбинантные рецепторы, состоящие из таргетирующего фрагмента, ассоциированного с одним или несколькими сигнальными доменами в одной слитой молекуле. В целом, связывающий фрагмент CAR состоит из антигенсвязывающего домена одноцепочечного антитела (scFv), который содержит фрагменты моноклонального антитела, содержащие вариабельные домены легкой и тяжелой цепи, соединенные гибким линкером. Успешно применяли также связывающие фрагменты на основе доменов рецептора или лиганда. Сигнальные домены для первого поколения CAR получали из цитоплазматической области дзета-цепей CD3 или гамма-цепей Fc-рецептора. Было продемонстрировано, что первое поколение CAR позволяло успешно перенаправлять Т-клеточную цитотоксичность, однако для них не удалось обеспечить пролонгированное размножение и противоопухолевую активность in vivo. Для повышения выживаемости и усиления пролиферации модифицированных с помощью CAR Т-клеток осуществляли добавление сигнальных доменов из костимуляторных молекул, включая CD28, ОХ-40 (CD134), ICOS и 4-1ВВ (CD137), по отдельности (второе поколение) или в комбинации (третье поколение). CAR позволяли успешно перенаправлять Т-клетки на антигены, экспрессируемые на поверхности опухолевых клеток при различных злокачественных заболеваниях, включая лимфомы и солидные опухоли.
Описано, что созданные в настоящее время Т-клетки с разрушенным их Т-клеточным рецептором (TCR) с помощью TALE-нуклеаз, наделенные химерным антигенным рецептором (CAR), мишенью которого является злокачественный антиген CD19, которые обозначены как продукт «UCART19», обладали терапевтическим потенциалом при исследовании по меньшей мере на двух детях с рефрактерным лейкозом (Leukaemia success heralds wave of gene-editing therapies. Nature 527, 2015, cc. 146-147). Для получения указанных UCART19-клеток TALE-нуклеазу кратковременно экспрессировали в клетках путем электропорации кэпированной мРНК для обеспечения разрушения гена TCR, в то время как кассету, кодирующую химерный антигенный рецептор (CAR CD19) интродуцировали случайным образом в геном с помощью ретровирусного вектора.
При использовании указанного последнего подхода стадии инактивации гена и экспрессии химерного антигенного рецептора осуществляют независимо после индукции активации Т-клеток ex vivo.
Однако конструирование первичных иммунных клеток происходит не без последствий в отношении роста/физиологии указанных клеток. В частности, одной из основных проблем является предотвращение истощения/анергии, что существенно снижает их иммунную реакцию и продолжительность жизни. Это с наибольшей вероятностью происходит, когда клетки искусственно активируют перед их инфузией пациенту. Это также относится к случаю, когда клетка наделена CAR, который обладает слишком большой реактивностью.
Для избегания указанных «подводных камней» при создании изобретения использовали преимущество регуляции транскрипции некоторых ключевых генов в процессе Т-клеточной активации для экспрессии экзогенных генетических последовательностей, которые повышают терапевтический потенциал иммунных клеток. Экзогенные генетические последовательности, подлежащие экспрессии или коэкспрессии после активации иммунных клеток, интродуцируют путем таргетной инсерции гена с использованием реагентов, представляющих собой специфические для последовательности эндонуклеазы, так, что их кодирующие последовательности транскрибируются под контролем эндогенных промоторов, которые присутствуют в указанных локусах. Альтернативно этому, локусы, которые не экспрессируются в процессе активации иммунных клеток, можно применять в качестве «локусов-безопасных гаваней» для интеграции кассет экспрессии без каких-либо вредных последствий для генома.
Указанные стратегии конструирования клеток, которые предложены в настоящем изобретении, имеют тенденцию к обеспечению повышения терапевтического потенциала первичных иммунных клеток в целом, в частности, путем увеличения продолжительности их жизни, персистенции и иммунной активности, а также путем ограничения клеточного истощения. Для осуществления изобретения можно использовать первичные клетки, полученные из организма пациентов, в качестве компонента стратегий аутологичного лечения, а также первичные клетки, полученные из организма доноров, в качестве компонента стратегий аллогенного лечения.
Краткое изложение сущности изобретения
Негомологичное соединение концов (NHEJ) и репарация, направляемая гомологией (HDR), представляют собой два основных пути, которые используются для репарации in vivo разрывов ДНК. Последний путь обеспечивает репарацию разрыва зависимым от матрицы образом (в естественных условиях в HDR используется сестринская хроматида в качестве матрицы для репарации ДНК). Гомологичную рекомбинацию применяли в течение нескольких десятилетий для точного редактирования геномов с помощью таргетных модификаций ДНК с использованием экзогенной донорской матрицы. Искусственное создание двухцепочечных разрывов (DSB) в области-мишени с использованием редко расщепляющих эндонуклеаз существенно повышает эффективность гомологичной рекомбинации (см., например, US 8921332). Кроме того, совместная доставка редко расщепляющей эндонуклеазы вместе с донорской матрицей, которая содержит последовательности ДНК, гомологичные сайту разрыва, позволяет осуществлять на основе HDR редактирование гена, такое как коррекция гена или инсерция гена. Однако указанные технологии не нашли широкого применения для первичных иммунных клеток, прежде всего CAR Т-клеток, из-за нескольких технических ограничений, таких как: трудность в осуществлении трансфекции ДНК в такие типы клеток, которая приводит к апоптозу, ограниченная продолжительность жизни иммунных клеток и ограниченное количество генераций, в результате чего гомологичная рекомбинация в целом происходит с низкой частотой.
До сих пор реагенты, представляющие собой специфические для последовательности эндонуклеазы, применяют главным образом для инактивации генов в первичных иммунных клетках (например, WO 2013/176915) с использованием NHEJ-пути.
Основным объектом настоящего изобретения является осуществление сайтнаправленного редактирования генов, в частности, для инсерции гена (или инсерций нескольких генов) в клетку-мишень таким образом, чтобы транскрипция интегрированного гена находилась под контролем эндогенного промотора.
Основным объектом настоящего изобретения является осуществление редактирования генов в первичных иммунных клетках таким образом, чтобы транскрипция интегрированного гена находилась под контролем эндогенного промотора, с сохранением экспрессии нативного гена посредством применения цис-регуляторных элементов (например, цис-действующие элементы гидролазы 2А) или участок внутренней посадки рибосомы (IRES) в донорской матрице.
Основным объектом настоящего изобретения является в качестве примеров (но, не ограничиваясь только ими) контроль экспрессии в первичных Т-клетках химерных антигенных рецепторов (CAR), цитокинов, имеющих решающее значение для запуска противоопухолевого ответа, стимулирующих цитокинов для повышения пролиферативного потенциала, хемокиновых рецепторов для стимуляции направленной миграции к опухоли или различных защитных или ингибирующих генов для блокады ингибирования иммунитета, осуществляемого опухолью. Фактически, одним из основных преимуществ настоящего изобретения является помещение указанных экзогенных последовательностей под контроль эндогенных промоторов, транскрипционная активность которых не снижается под воздействием активации иммунных клеток.
В отличие от применявшегося ранее метода конструирования терапевтических иммунных клеток, в котором, например, экзогенную кодирующую последовательность интегрировали и экспрессировали в TCR-локусе для конститутивной экспрессии гена, при создании изобретения кодирующую последовательность интегрировали в локусы, которые специфически транскрибируются в процессе Т-клеточной активации, предпочтительно CAR-зависимым образом.
Одним из объектов изобретения является экспрессия химерного антигенного рецептора (CAR) в выбранных генных локусах, которые подвергаются повышающей регуляции после активации иммунных клеток. Экзогенную(ые) последовательность(и), кодирующую(ие) CAR, и последовательность(и), кодирующую(ие) эндогенные гены, можно совместно транскрибировать, например, если они разделены, с помощью цис-регуляторных элементов (например, цис-действующих элементов гидролазы 2А) или с помощью участка внутренней посадки рибосомы (IRES), которые также интродуцируют. Например, экзогенные последовательности, кодирующие CAR, можно помещать под транскрипционный контроль промотора эндогенных генов, которые активируются микроокружением опухолей, таких как HIF1a, т.е. транскрипционный фактор, индуцируемый гипоксией, или арилуглеводородный рецептор (AhR), которые представляют собой сенсорные гены, индуцируемые соответственно гипоксией и ксенобиотиками в близком окружении опухолей.
Таким образом, настоящее изобретение можно применять для улучшения терапевтического результата терапий на основе CAR Т-клеток путем интеграции экзогенных генетических признаков/схем под контролем эндогенных Т-клеточных промоторов, на которые влияет микроокружение опухоли (ТМЕ). Известно, что отличительные признаки ТМЕ, включая (но, не ограничиваясь только ими), например, такие факторы как депривация аргинина, цистеина, триптофана и кислорода, а также внеклеточный ацидоз (накопление лактата), приводят к повышающей регуляции специфических эндогенных генов. Согласно изобретению повышающую регуляцию эндогенных генов можно «заимствовать» для повторной экспрессии релевантных экзогенных кодирующих последовательностей с целью повышения противоопухолевой активности CAR Т-клеток в микроокружении определенных опухолей.
В предпочтительных вариантах осуществления изобретения способ, предлагаемый в изобретении, содержит стадию создания двухцепочечного разрыва в локусе, для которого характерна высокая транскрипция в микроокружении опухоли, путем экспрессии реагентов, представляющих собой специфические для последовательности нуклеазы, такие, например, как (но, не ограничиваясь только ими) TALEN, ZFN или РНК-направляемые эндонуклеазы, в присутствии матрикса для репарации ДНК, предпочтительно помещенного в вектор на основе AAV6. Указанная содержащая ДНК донорская матрица, как правило, включает два гомологичных плеча, с встроенными уникальной или несколькими открытыми рамками считывания и регуляторными генетическими элементами (стоп-кодон и полиА-последовательности), обозначенные в контексте настоящего описания как экзогенные кодирующие последовательности.
Согласно другому объекту изобретения указанную экзогенную последовательность интродуцируют в геном путем делеции или модификации эндогенной(ых) кодирующей(их) последовательности(ей), присутствующей(их) в данном локусе (выключение путем добавления) («knock-out by knock-in», нокаут посредством нокина)), так, чтобы объединять инактивацию гена с трансгенезом.
В зависимости от локуса-мишени и его участия в активности иммунных клеток у таргетного эндогенного гена может инактивироваться или поддерживаться его исходная функция. Если таргетный ген является важным для активности иммунных клеток, то указанная процедура инсерции может приводить к единичному нокину (KI) без инактивации гена. В противоположность этому, если предполагается, что таргетный ген участвует в ингибировании/истощении иммунных клеток, то процедуру инсерции создают так, чтобы препятствовать экспрессии эндогенного гена, предпочтительно путем нокаута эндогенной последовательности, обеспечивая при этом экспрессию интродуцированной(ых) экзогенной(ых) кодирующей(их) последовательности(ей).
Более конкретные объекты изобретения относятся к повышающей регуляции с различной кинетикой экспрессии гена-мишени после активации путей передачи сигнала CAR с помощью таргетной интеграции (с разрушением нативного гена или без разрушения) в специфические локусы, такие, например, как (но, не ограничиваясь только ими) PD1, PDL1, CTLA-4, TIM3, LAG3, TNFa или IFNg.
Еще более конкретный объект изобретения относится к представленным в настоящем описании сконструированным иммунным клеткам и предпочтительно к первичным иммунным клеткам, предназначенным для инфузии пациентам, которые содержат экзогенные последовательности, кодирующие полипептид(ы) IL-15 или IL-12, интегрированный(ые) в эндогенный локус PD1, CD25 или CD69, для их экспрессии под контролем эндогенных промоторов, которые присутствуют в указанных локусах.
Иммунные клетки, предлагаемые в настоящем изобретении, могут представлять собой [CAR]позитивные, [CAR]негативные, [TCR]позитивные или [TCR]негативные клетки в зависимости от терапевтических показании и пациентов-реципиентов. Согласно одному из предпочтительных объектов изобретения иммунные клетки дополнительно создают в виде [TCR]негативных для аллогенной трансплантации. Для достижения этого прежде всего используют генетическое разрушение по меньшей мере одной эндогенной последовательности, кодирующей по меньшей мере один компонент TCR, такой как TRAC (локус, кодирующий TCRaльфa), предпочтительно путем интеграции экзогенной последовательности, которая кодирует химерный антигенный рецептор (CAR) или рекомбинантный TCR, или его компонент(ы).
Согласно следующему объекту изобретения иммунные клетки трансфектируют экзогенной последовательностью, кодирующей полипептид, который может вступать в ассоциацию (связываться) и предпочтительно взаимодействовать с цитокиновым рецептором семейства рецепторов IL-6, таким как мутантный GP130 (гликопротеин 130). В частности, в изобретении предложены иммунные клетки, предпочтительно Т-клетки, которые секретируют растворимый мутантный GP130, с целью снижения синдрома выброса цитокинов (цитокиновый шторм) (CRS) путем воздействия и в идеальном варианте блокады трансдукции сигналов интерлейкина-6 (IL-6). CRS представляет собой хорошо известное осложнение клеточной иммунотерапии, приводящее к аутоиммунитету, который проявляется, когда трансдуцированные иммунные клетки начинают активироваться in vivo. После связывания IL-6 с его рецептором IL-6R комплекс вступает в ассоциацию с субъединицей GP130, инициируя трансдукцию сигнала и каскад воспалительный ответов. Согласно конкретному объекту изобретения димерный белок, содержащий внеклеточный домен GP130, слитый с Fc-областью антитела в виде IgG1 (sgp130Fc), экспрессируют в сконструированных иммунных клетках для специфического связывания с комплексом растворимый IL-R/IL-6 для достижения частичной или полной блокады передачи сигналов IL-6 в транс-направлении. Таким образом, в настоящем изобретении предложен способ ограничения CRS при иммунотерапии, при котором иммунные клетки генетически модифицируют для экспрессии растворимого полипептида, который может связываться и предпочтительно взаимодействовать с цитокиновым рецептором из семейства рецепторов IL-6, таким как sgp130Fc. Согласно предпочтительному объекту изобретения указанную последовательность, кодирующую указанный растворимый полипептид, который может связываться и предпочтительно взаимодействовать с цитокиновым рецептором из семейства рецепторов IL-6A, интегрируют под контролем эндогенного промотора, предпочтительно в один локус, ответственный за Т-клеточную активацию, например, в один из выбранных из перечисленных в таблицах 6, 8 или 9, более конкретно в PD1, CD25 или CD69. Полинуклеотидные последовательности векторов, донорских матриц, которые содержат экзогенные кодирующие последовательности и/или последовательности, гомологичные эндогенным локусам, последовательности, относящиеся к полученным сконструированным клеткам, а также последовательности, позволяющие осуществлять обнаружение указанных сконструированных клеток, все являются частью настоящей заявки.
Основным объектом настоящего изобретения является, например (но, не ограничиваясь только этим) контроль экспрессии компонентов биологических «логических элементов» («И» или «ИЛИ», или «НЕ», или любой их комбинации) путем таргетной интеграции генов. Аналогично логическим элементам в электронике, клеточные компоненты, экспрессируемые в различных локусах, могут менять негативные и позитивные сигналы, которые управляют, например, состояниями активации иммунной клетки. Указанный компонент включает, например (но, не ограничиваясь только ими) позитивные и негативные химерные антигенные рецепторы, которые можно применять для контроля Т-клеточной активации и являющейся ее результатом цитотоксичности сконструированных Т-клеток, в которых они экспрессируются.
Предпочтительным вариантом осуществления изобретения является интродукция реагента, представляющего собой специфическую для последовательности эндонуклеазу, и/или донорской матрицы, содержащей представляющий интерес ген, и последовательности, гомологичной гену-мишени, путем трансфекции ssДНК (например, олигонуклеотидами (но, не ограничиваясь только ими)), dсДНК (например, плазмидной ДНК (но, не ограничиваясь только ею)), и наиболее предпочтительно, например, аденоассоциированным вирусом (AAV) (но, не ограничиваясь только им).
Изобретение относится также к векторам, донорским матрицам, реагентам и полученным с помощью описанных выше способов сконструированным клеткам, а также к их применению в терапии.
Краткое описание чертежей и таблиц:
На чертежах показано:
на фиг. 1 - стратегии конструирования гематопоэтических стволовых клеток (HSC) путем интродукции экзогенных последовательностей в специфические локусы под транскрипционным контролем эндогенных промоторов, которые специфически активируются в конкретных типах иммунных клеток. На чертеже представлены примеры специфических эндогенных генов, в локусы которых можно встраивать экзогенную(ые) кодирующую(ие) последовательность(и) для экспрессии в требуемых гематопоэтических линиях дифференцировки согласно настоящему изобретению. Задача состояла в получении ex vivo сконструированных HSC, которые можно трансплантировать пациентам для того, чтобы у них могли продуцироваться иммунные клетки in vivo, которые должны экспрессировать выбранные трансгены при их дифференцировке в требуемую линию;
на фиг. 2 - схематическое изображение донорских последовательностей, применение которых описано в экспериментальном разделе, для встраивания экзогенной кодирующей последовательности IL-15 в локусы CD25 и PD1, а также экзогенной кодирующей последовательности анти-CD22 CAR в локус TRAC. А: донорская матрица (обозначенная как IL-15m-CD25), созданная для сайтнаправленной инсерции IL-15 в локус CD25 для обеспечения совместной транскрипции полипептидов CD25 и IL-15 в иммунной клетке. Подробные сведения о последовательностях представлены в примерах. Б: донорская матрица (обозначенная как IL-15m-PD1), созданная для сайтнаправленной инсерции IL-15 в локус PD1 для обеспечения транскрипции IL-15 под контролем транскрипционной активности промотора эндогенного гена PD1. Правую и левую пограничные последовательности PD1 можно выбирать так, чтобы сохранять в интактном или поврежденном виде эндогенную кодирующую последовательность PD1. В последнем случае имеет место нокдаун PD1, когда происходит добавление (нокин) и транскрипция IL-15. В: донорская матрица, созданная для сайтнаправленной инсерции химерного антигенного рецептора (например, анти-CD22 CAR) в локус TCR (например, TRAC). В целом, левую и правую пограничные последовательности выбирают так, чтобы разрушать TCR для получения [TCR]neg[CAR]pos сконструированных иммунных клеток, пригодных для аллогенной трансплантации пациентам;
на фиг. 3 - полученные с помощью проточенной цитометрии данные о частоте таргетной интеграции IL-15m либо в локус PD1, либо в локус CD25 с помощью соответственно PD1- или CD25-TALEN®, в случае, когда анти-CD22 CAR также интегрировали в локус TRAC с использованием TRAC-TALEN®. Эти результаты демонстрируют эффективную таргетную интеграцию в обоих случаях, когда CAR анти-CD22 интегрируют в локус TRAC в сочетании с интеграцией кодирующей последовательности IL-15 в локусы PD1 или CD25. А: трансфектированные имитатором первичные Т-клетки. Б: первичные Т-клетки, трансфектированные донорскими последовательностями, описанными на фиг. 1 (Б и В) и специфической TALEN® для двойной интеграции в локусы TCR и PDI. В: первичные Т-клетки, трансфектированные донорскими последовательностями, описанными на фиг.1 (А и В) и специфической TALEN® для двойной интеграции в локусы TCR и CD25;
на фиг. 4 - схематическое изображение экзогенных последовательностей, применяемых в экспериментальном разделе, для трансфекции первичных иммунных клеток для получения результатов, которые представлены на фиг. 5 и 6;
на фиг. 5 и 6 - полученные с помощью проточной цитометрии данные об экспрессии LNGFR в жизнеспособных Т-клетках, трансфектированных донорскими матрицами, представленными на фиг. 4, и специфическими TALEN® (TCR и CD25) после неспецифической активации с помощью анти-CD3/CD28 (Dynabeads®) и после зависящей от CAR активации опухолевыми клетками (опухолевые клетки Raji (Раджи)). Как продемонстрировано на фиг. , экспрессия LNGFR специфически индуцировалась в [CAR анти-CD22]позитивных клетках после контакта CAR/опухоль;
на фиг. 7 и 8 - полученные с помощью проточной цитометрии данные об экспрессии CD25 в жизнеспособных Т-клетках, трансфектированных донорскими матрицами, представленными на фиг. 4, и специфическими TALEN® (TCR и CD25), после неспецифической активации с помощью анти-CD3/CD28 (Dynabeads®) и активации опухолевыми клетками (опухолевые клетки Raji). Как продемонстрировано на фиг. 8, экспрессия CD25 специфически индуцировалась в [CAR анти-CD22] позитивных клетках после контакта CAR/опухоль;
на фиг. 9 - схематическое изображение экзогенных последовательностей, применяемых в экспериментальном разделе, для трансфекции первичных иммунных клеток для получения результатов, которые представлены на фиг. 11 и 12;
на фиг. 10 и 11 - полученные с помощью проточной цитометрии данные об экспрессии LNGFR в жизнеспособных Т-клетках, трансфектированных донорскими матрицами, представленными на фиг. 9, и специфическими TALEN® (TCR и PD1) после неспецифической активации с помощью анти-CD3/CD28 (Dynabeads®) и после активации опухолевыми клетками (опухолевые клетки Raji). Как продемонстрировано на фиг.11, экспрессия LNGFR специфически индуцировалась в [CAR анти-CD22]позитивных [клетках после контакта CAR/опухоль;
на фиг. 12 - полученные с помощью проточной цитометрии данные об экспрессии эндогенного PD1 в жизнеспособных Т-клетках, трансфектированных донорскими матрицами, представленными на фиг. 9, и специфическими TALEN® (TCR и PD1) после неспецифической активации с помощью анти-CD3/CD28 (Dynabeads®) и активации опухолевыми клетками (опухолевые клетки Raji) с использованием TALEN® (TCR и PD1) или без них. PD1 эффективно «выключался» обработкой TALEN (остаточный уровень экспрессии PD1 составлял 8% по сравнению с 54%);
на фиг. 13 - диаграмма, на которой представлены данные о производстве IL-15 в [CAR]позитивных (CARm) и [CAR]негативных сконструированных иммунных клетках, предлагаемых в изобретении, которые трансфектировали донорской матрицей, представленной на фиг. 2(Б), и TALEN® для инсерции экзогенных кодирующих последовательностей IL-15 в локус PD1. IL-15, транскрипция которого находилась под контролем эндогенного промотора PD1, эффективно индуцировался после неспецифической активации с помощью анти-CD3/CD28 (Dynabeads®) и активации опухолевыми клетками (опухолевые клетки Raji) и секретировался в культуральные среды;
на фиг. 14 - график, на котором продемонстрировано количество секретируемого IL-15 в течение времени (в днях) после активации сконструированными иммунными клетками, предлагаемыми в изобретении. А: Клетки, сконструированные путем интеграции кодирующей последовательности IL-15 в локус CD25 с использованием донорских ДНК-матриц, представленных на фиг. 2А (IL-15m_CD25) и/или 2 В (CARm). Б: Клетки конструировали путем интеграции кодирующей последовательности IL-15 в локус PD1 с использованием донорских ДНК-матриц, представленных на фиг. 2Б (IL-15m_PD1) и/или 2В (CARm). Продемонстрировано, что интеграция в оба локуса приводила к получению сходных профилей секреции IL-15. Секреция IL-15 существенно увеличивалась при опухольспецифической активации CAR;
на фиг. 15 - график, на котором представлено количество опухолевых клеток Raji-Luc, экспрессирующих антиген CD22 (сигнал люциферазы), в течение времени при анализе выживаемости (серийный киллинг-анализ), который описан в примере 2. Конструировали иммунные клетки (РВМС) для интеграции кодирующих IL-15 последовательностей в локус PD1 (А) или локус CD25 (Б) и для экспрессии анти-CD22-CAR в локусе TCR (нарушая тем самым экспрессию TCR). При осуществлении указанного анализа опухолевые клетки регулярно добавляли в культуральную среду, поскольку они частично или полностью элиминировались CAR-позитивными клетками. Повторная экспрессия IL-15 либо на PD1-, либо на CD25-клетках в большой степени способствовала элиминации опухолевых клеток CAR-позитивными клетками;
на фиг. 16 - схематическое изображение донорских последовательностей, применяемых в экспериментальном разделе, для встраивания в локус PD1 эндогенных последовательностей, кодирующих IL-12 и gp130Fc. А: донорская матрица (обозначенная как IL-12m-PD1), созданная для сайтнаправленной инсерции кодирующих последовательностей IL-12a и IL-12b (SEQ ID NO: 47 и 48) в локус PD1 для достижения совместной транскрипции IL-12a и IL-12b с разрушением при этом эндогенной кодирующей последовательности PD1. Правая и левая пограничные последовательности, гомологичные последовательностям локуса PD1 имеют длину по меньшей мере 100 bp, предпочтительно длину по меньшей мере 200 bp и более предпочтительно длину по меньшей мере 300 bp и содержат SEQ ID NO: 45 и 46. Подробное описание последовательностей представлено в таблице 5. Б: донорская матрица (обозначенная как gp130Fcm-PD1), созданная для сайтнапрвленной инсерции кодирующих последовательностей gp130Fc (SEQ ID NO: 51) для достижения транскрипции в локусе PD1 под контролем промотора PD1 с разрушением при этом эндогенной кодирующей последовательности PD1. Правая и левая пограничные последовательности, гомологичные последовательностям локуса PD1 имеют длину по меньшей мере 100 bp, предпочтительно длину по меньшей мере 200 bp и более предпочтительно длину по меньшей мере 300 bp и содержат SEQ ID NO: 45 и 46. Подробное описание последовательностей представлено в таблице 5.
Таблица 1: Варианты ISU-домена из различных вирусов.
Таблица 2: Аминокислотные последовательности FP-полипептида из естественных и искусственных источников.
Таблица 3: Перечень генов, участвующих в путях ингибирования в иммунных клетках, которые можно успешно модифицировать или инактивировать путем встраивания экзогенной кодирующей последовательности, предлагаемой в изобретении.
Таблица 4: Последовательности, упомянутые в примере 1.
Таблица 5: Последовательности, упомянутые в примере 2.
Таблица 6: Перечень человеческих генов, для которых характерна повышающая регуляция при Т-клеточной активации (чувствительные к активации CAR промоторы), таргетная инсерция гена в которых согласно настоящему изобретению может повышать терапевтический потенциал иммунных клеток.
Таблица 7: Отобранные гены, которые устойчиво транскрибируются в процессе активации иммунных клеток (в зависимости или вне зависимости от Т-клеточной активации).
Таблица 8: Отобранные гены, для которых характерна кратковременная повышающая регуляция при Т-клеточной активации.
Таблица 9: Отобранные гены, для которых характерна повышающая регуляция при Т-клеточной активации в течение более 24 ч.
Таблица 10: Отобранные гены, для которых характерна понижающая регуляции при активации иммунных клеток.
Таблица 11: Отобранные гены, которые являются молчащими при Т-клеточной активации (локусы-«безопасные гавани» при таргетной интеграции генов).
Таблица 12: Перечень генных локусов, характеризующихся повышающей регуляцией в извлеченных из опухолей инфильтрующих лимфоцитах (полученные из множества опухолей), которые можно применять для генной интеграции экзогенных кодирующих последовательностей, предлагаемых в настоящих изобретении.
Таблица 13: Перечень генных локусов, характеризующихся повышающей регуляцией в условиях гипоксии в опухолях, которые можно применять для генной интеграции экзогенных кодирующих последовательностей, предлагаемых в настоящих изобретении.
Подробное описание изобретения
Если специально не указано иное, то все технические и научные понятия, использованные в настоящем описании, имеют значение, которое является общепринятым для специалистов в области генной терапии, биохимии, генетики и молекулярной биологии.
Для осуществления на практике или тестирования настоящего изобретения можно применять все методы и материалы, сходные или эквивалентные тем, которые указаны в настоящем описании, при этом в настоящей заявке описаны приемлемые методы и материалы. Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в настоящем описании, полностью включены в настоящее описание в качестве ссылки. В случае разночтения следует руководствоваться настоящим описанием, включая определения. Кроме того, материалы, методы и примеры представлены только для иллюстрации и не направлены на ограничение объема изобретения, если не указано иное.
При осуществлении на практике настоящего изобретения следует применять, если не указано иное, общепринятые методы клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, известные специалисту в данной области. Такие методы подробно описаны в литературе, см., например, Frederick M. Ausubel, Current Protocols in Molecular Biology, изд-во Wiley and son Inc, Library of Congress, USA, 2000; Sambrook и др., Molecular Cloning: A Laboratory Manual, 3-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 2001; Oligonucleotide Synthesis, под ред. M.J. Gait, 1984; Mullis и др., US №4683195; Nucleic Acid Hybridization, под ред. В.D. Harries и S.J. Higgins, 1984; Transcription And Translation, под ред. В.D. Hames и S.J. Higgins, 1984; R.I. Freshney, Culture Of Animal Cells, изд-во Alan R. Liss, Inc., 1987; Immobilized Cells And Enzymes, изд-во IRL Press, 198; B. Perbal, A Practical Guide To Molecular Cloning, 1984; серия: Methods In ENZYMOLOGY, под. ред. J. Abelson и M. Simon, изд-во Academic Press, Inc., New York, прежде всего т. 154 и т. 155, под ред. Wu и др., и т. 185, «Gene Expression Technology», под ред. D. Goeddel; Gene Transfer Vectors For Mammalian Cells, под ред. J.H. Miller и M.P. Calos, 1987, изд-во Cold Spring Harbor Laboratory; Immunochemical Methods In Cell And Molecular Biology, под ред. Mayer и Walker, изд-во Academic Press, London, 1987; Handbook Of Experimental Immunology, тома I-IV, под ред. D.M. Weir и С.С. Blackwell, 1986; и Manipulating the Mouse Embryo, изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986.
Настоящее изобретение относится к общему способу получения первичных иммунных клеток для клеточной иммунотерапии, включающему таргетную генную интеграцию экзогенной кодирующей последовательности в хромосомную ДНК указанных иммунных клеток. Согласно некоторым объектам изобретения указанную интеграцию осуществляют таким образом, чтобы помещать указанную кодирующую последовательность под транскрипционный контроль по меньшей мере одного промотора, эндогенного для указанных клеток, при этом указанный эндогенный промотор предпочтительно не является конститутивным промотором, таким как промотор, обеспечивающий транскрипцию константного домена альфа-цепи Т-клеточного рецептора (TRAC-NCBI Gene ID №28755). Конститутивным промотором согласно настоящему изобретению является, например, промотор, который является активным вне зависимости от активации CAR, например, когда Т-клетки еще не активированы.
Повышение терапевтического потенциала иммунных клеток путем таргетной интеграции гена
Методы редактирования гена с использованием специфических для полинуклеотидной последовательности реагентов, таких как редко расщепляющие эндонуклеазы, стали принятыми в данной области для интродукции генетических модификаций в первичные клетки. Однако до настоящего времени их не использовали в иммунных клетках для интродукции экзогенных кодирующих последовательностей под транскрипционным контролем эндогенных промоторов.
Задачей, положенной в основе настоящего изобретения, было повышение терапевтического потенциала иммунных клеток с помощью методов редактирования гена, прежде всего с помощью таргетной интеграции гена.
Под «таргетной интеграцией гена» подразумевают любые известные сайтспецифические методы, позволяющие встраивать, заменять или корректировать геномную последовательность в живой клетке. Согласно одному из предпочтительных объектов настоящего изобретения указанная таргетная интеграция гена включает гомологичную рекомбинацию гена в локусе таргетируемого гена, для достижения инсерции по меньшей мере одного экзогенного нуклеотида, предпочтительно последовательности, состоящей из нескольких нуклеотидов (т.е. полинуклеотида), и более предпочтительно кодирующей последовательности, или замены на указанный нуклеотид.
Под «специфическим для последовательности реагентом» подразумевают любую активную молекулу, которая обладает способностью специфически распознавать выбранную полинуклеотидную последовательность в геномном локусе, предпочтительно длиной по меньшей мере 9 bp, более предпочтительно по меньшей мере 10 bp и еще более предпочтительно по меньшей мере 12 bp, в контексте модификации указанного геномного локуса. Согласно предпочтительному объекту изобретения указанный специфический для последовательности реагент представляет собой реагент в виде специфической для последовательности нуклеазы.
Под «иммунной клеткой» подразумевают клетку гематопоэтического происхождения, функционально участвующую в инициации и/или реализации врожденного и/или адаптивного иммунного ответа, как правило, такие как CD3- или CD4-позитивные клетки. Согласно настоящему изобретению иммунная клетка может представлять собой дендритную клетку, дендритную клетку-киллера, тучную клетку, NK-клетку, В-клетку или Т-клетку, выбранную из группы, которая состоит из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хелперных Т-лимфоцитов. Клетки можно получать из целого ряда источников (но не ограничиваясь только ими), включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из области заражения, асциты, плевральный выпот, ткань селезенки и из опухолей, такие как инфильтрующие опухоль лимфоциты. В некоторых вариантах осуществления изобретения указанную иммунную клетку можно получать из здорового донора, из пациента, у которого диагностирован рак, или из пациента, у которого диагностирована инфекция. В другом варианте осуществления изобретения указанная клетка представляет собой часть смешенной популяции иммунных клеток, в которой присутствуют клетки с различными фенотипическими характеристиками, например, такие как CD4-, CD8- и CD56-позитивные клетки.
Под «первичной клеткой» или «первичными клетками» подразумевают клетки, полученные непосредственно из живой ткани (например, материал биопсии) и созданные для роста in vitro в течение ограниченного периода времени, что означает, что они могут подвергаться ограниченному по времени удвоению популяции. Первичные клетки являются противоположностью непрерывно размножающимся онкогенным или искусственно иммортализованным клеточным линиями. Примерами таких клеточных линий являются (но не ограничиваясь только ими) СНО-K1-клетки; HEK293-клетки; Сасо2-клетки; U2-OS-клетки; NIH 3Т3-клетки; NSO-клетки; SP2-клетки; CHO-S-клетки; DG44-клетки; K-562-клетки, U-937-клетки; MRC5-клетки; IMR90-клетки; Jurkat-клетки; HepG2-клетки; HeLa-клетки; НТ-1080-клетки; НСТ-116-клетки; Hu-h7-клетки; Huvec-клетки; Molt 4-клетки. Первичные клетки, как правило, применяют в клеточной терапии, поскольку, они, как предполагается, являются более функциональными и менее онкогенными.
В целом, первичные иммунные клетки получают из доноров или пациентов с помощью различных методов, известных в данной области, таких, например, как методы лейкафереза, которые обобщены у Schwartz J. и др. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing Committee of the American Society for Apheresis: 6-ой специальный выпуск J Clin Apher. 28(3), 2013, cc. 145-284).
Первичные иммунные клетки согласно настоящему изобретению могут представлять собой также дифференцированные стволовые клетки, такие как стволовые клетки пуповинной крови, клетки-предшественники, стволовые клетки костного мозга, гематопоэтические стволовые клетки (HSC) и индуцированные плюрипотентные стволовые клетки (iPS).
Под «реагентом, представляющим собой нуклеазу» подразумевают молекулу нуклеиновой кислоты, которая участвует в катализируемой нуклеазой реакции в клетке-мишени, предпочтительно в эндонуклеазной реакции, индивидуально или в качестве субъединицы комплекса, такого как гидовая РНК/Cas9, предпочтительно приводя к расщеплению нуклеотидной последовательности-мишени.
Реагенты, представляющие собой нуклеазы, предлагаемые в изобретении, как правило, являются «специфическими для последовательности реагентами», это означает, что они могут индуцировать расщепление ДНК в клетках в предварительно определенных локусах, в широком смысле рассматриваемых в качестве «таргетного гена». Нуклеотидную последовательность, которая распознается специфическими для последовательности реагентами, обозначают как «последовательность-мишень». Указанную последовательность-мишень, как правило, выбирают из редкой или уникальной для клеточного генома, и в более широко смысле для генома человека, что можно определять с использованием программного обеспечения и данных, доступных в базах данных генома человека, таких как http://www.ensembl.org/index.html.
«Редко расщепляющие эндонуклеазы»» представляют собой реагенты, такие как специфические для последовательности эндонуклеазы, при этом распознаваемые ими последовательности, как правило, состоят из 10-50 последовательных пар нуклеотидов, предпочтительно от 12 до 30 bp и более предпочтительно от 14 до 20 bp.
Согласно предпочтительному объекту изобретения указанный представляющий собой эндонуклеазу реагент представляет собой нуклеиновую кислоту, которая кодирует «сконструированную» или «программируемую» редко расщепляющую эндонуклеазу, такую как хоминг-нуклеаза, описанная, например, у Arnould S. и др. (WO 2004/067736), нуклеазу с цинковыми пальцами (ZFN), описанную, например, у Urnov F. и др. (Highly efficient endogenous human gene correction using designed zinc-finger nucleases Nature 435, 2005, cc. 646-651), TALE-нуклеазу, описанную, например, у Mussolino и др. (A novel TALE nuclease scaffold enables high genome editing activity in combination with low toxicity Nucl. Acids Res. 39(21), 2011, cc. 9283-9293), или Мега-TAL-нуклеазу, описанную, например, у Boissel и др. (MegaTALs: a rare-cleaving nuclease architecture for therapeutic genome engineering Nucleic Acids Research 42 (4), 2013, cc. 2591-2601).
Согласно другому варианту осуществления изобретения представляющий собой эндонуклеазу реагент представляет собой гидовую РНК, предназначенную для применения в сочетании с направляемой РНК эндонуклеазой, такой как Cas9 или Cpf1, что среди прочего описано у Doudna J. и Chapentier Е. (The new frontier of genome engineering with CRISPR-Cas9 Science 346 (6213), 2014, с. 1077) (публикация включена в настоящее описание в качестве ссылки).
Согласно предпочтительному объекту изобретения представляющий собой эндонуклеазу реагент кратковременно экспрессируется в клетках, это означает, что указанный реагент не предназначен для интеграции в геном или к сохранению в течение длительного периода времени, что имеет место в случае РНК, более конкретно мРНК, белков или комплексов в виде смеси белков и нуклеиновых кислот (например, рибонуклеопротеины).
Как правило, 80% представляющего собой эндонуклеазу реагента расщепляется в течение 30 ч, предпочтительно 24, более предпочтительно 20 ч после трансфекции.
Эндонуклеазу в форме мРНК предпочтительно синтезируют с кэпом для повышения ее стабильности с помощью хорошо известных в данной области методов, которые описаны, например, у Kore A.L. и др. (Locked nucleic acid (LNA)-modified dinucleotide mRNA cap analogue: synthesis, enzymatic incorporation, and utilization J Am Chem Soc. 131(18), 2009, cc. 6364-6365).
Как правило, стадию электропорации, которую применяют для трансфекции иммунных клеток, обычно осуществляют в закрытых камерах, содержащих параллельные пластинчатые электроды, создающие пульсирующее электрическое поле между указанными параллельными пластинчатыми электродами, напряженность которого выше чем 100 В/см и ниже чем 5000 В/см, практически однородное во всем обрабатываемом объеме, что описано в WO/2004/083379, которая включена в настоящее описание в качестве ссылки, прежде всего на с. 23, строка 25 до с. 29, строка 11. Одна из указанных камер для электропорации предпочтительно имеет геометрический фактор (см-1), определяемый как частное, полученное делением квадрата межэлектродного зазора (см2), на объем камеры (см3), где геометрический фактор меньше или равен 0,1 см-1 где суспензия клеток и специфический для последовательности реагент находятся в среде, которую регулируют таким образом, чтобы проводимость среды находилась в диапазоне от 0,01 до 1,0 мСм. Как правило, суспензию клеток подвергают воздействию одного или нескольких импульсов электрического поля. Согласно способу обрабатываемый объем суспензии можно масштабировать, а время обработки клеток в камере поддерживать практически постоянным.
Установлено, что благодаря их более высокой специфичности, TALE-нуклеазы являются наиболее приемлемыми специфическими для последовательности представляющим собой нуклеазы реагентами для терапевтического применения, особенно в гетеродимерных формах - т.е., когда они «работают» парами, включающими «правый» мономер (который обозначают также как «5'» или «прямой») и «левый» мономер (который обозначают также как «3'» или «обратный»), как это описано, например, у Mussolino и др. (TALEN® facilitate targeted genome editing in human cells with high specificity and low cytotoxicity Nucl. Acids Res. 42(10), 2014, cc. 6762-6773).
Как указано ранее, специфический для последовательности реагент предпочтительно находится в форме нуклеиновых кислот, например, в форме ДНК или РНК, кодирующих его субъединицу, представляющую собой редко расщепляющую эндонуклеазу, но они могут также представлять собой компонент конъюгата, включающего полинуклеотид(ы) и полипептид(ы), такого как так называемые «рибонуклеопротеины». Указанные конъюгаты могут быть образованы в сочетании с такими реагентами как Cas9 или Cpf1 (РНК-направляемые эндонуклеазы) или Аргонавт (Argonaute) (ДНК-направляемые эндонуклеазы), которые в настоящее время описаны соответственно у Zetsche В. и др. (Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System Cell 163(3), 2015, cc. 759-771) и у Gao F. и др. (DNA-guided genome editing using the Natronobacterium gregoryi Argonaute Nature Biotech, 2016), включающими гидовые РНК или ДНК, которые могут образовывать комплексы с соответствующими им нуклеазами.
Понятие «экзогенная последовательность» относится к любому нуклеотиду или нуклеотидной последовательности, который/которая в исходном состоянии отсутствует в выбранном локусе. Эта последовательность может быть гомологична или являться копией геномной последовательности или может представлять собой чужеродную последовательность, интродуцированную в клетку. В противоположность этому, «эндогенная последовательность» означает геномную последовательность, которая в исходном состоянии присутствует в локусе в клетке. Экзогенная последовательность предпочтительно кодирует полипептид, экспрессия которого обеспечивает терапевтическое преимущество по сравнению с сестринскими клетками, у которых в этот локус не интегрирована указанная экзогенная последовательность. Эндогенную последовательность, в которой происходит редактирование генома в результате инсерции нуклеотида или полинуклеотида способом, предлагаемым в настоящем изобретении, в результате чего экспрессируется другой полипептид, в широком смысле обозначают как экзогенная кодирующая последовательность.
Способ, предлагаемый в настоящем изобретении, можно объединять с другими методами, включая физические методы генетических трансформаций, такие как вирусная трансдукция или трансфекция с использованием наночастиц, а также их можно объединять с другими методами инактивации генов и/или инсерций трансгенов.
Согласно одному из объектов изобретения способ, предлагаемый в изобретении, включает стадии, на которых:
- получают популяцию первичных иммунных клеток;
- интродуцируют в часть указанных первичных иммунных клеток:
I) по меньшей мере одну нуклеиновую кислоту, содержащую экзогенную нуклеотидную или полинуклеотидную последовательность, подлежащую интеграции в выбранный эндогенный локус для того, чтобы кодировать по меньшей мере одну молекулу, повышающую терапевтический потенциал указанной популяции иммунных клеток;
II) по меньшей мере один специфический для последовательности реагент, который специфически таргетирует указанный выбранный эндогенный локус, при этом указанную нуклеотидную или полинуклеотидную последовательность встраивают посредством интеграции таргетного гена в указанный эндогенный локус так, чтобы указанная экзогенная нуклеотидная или полинуклеотидная последовательность находилась под транскрипционным контролем эндогенного промотора, присутствующего в указанном локусе.
Согласно одному из вариантов способа специфический для последовательности реагент представляет собой нуклеазу и интеграцию таргетного гена осуществляют посредством гомологичной рекомбинации или NHEJ в указанных иммунных клетках.
Согласно другому объекту изобретении указанный эндогенный промотор выбирают из промоторов, которые являются активными в процессе активации иммунных клеток и предпочтительно подвергаются повышающей регуляции.
Более конкретно, в изобретении предложен способ получения сконструированных первичных иммунных клеток для иммунотерапии, где указанный способ включает:
- получение популяции первичных иммунных клеток;
- интродукцию в часть указанных первичных иммунных клеток:
I) по меньшей мере одной экзогенной нуклеиновой кислоты, содержащей экзогенную кодирующую последовательность, которая кодирует по меньшей мере одну молекулу, повышающую терапевтический потенциал указанной популяции иммунных клеток;
II) по меньшей мере одного специфического для последовательности реагента, представляющего собой нуклеазу, который специфически таргетирует ген, находящийся под контролем эндогенного промотора, активного в процессе активации иммунных клеток;
в котором указанную кодирующую последовательность интродуцируют в геном первичной иммунной клетки посредством таргетной гомологичной интеграции, так, чтобы помещать указанную кодирующую последовательность под транскрипционный контроль по меньшей мере одного эндогенного промотора указанного гена.
Под «повышенным терапевтическим потенциалом» подразумевают, что сконструированные иммунные клетки приобретают по меньшей мере одно обеспечивающее преимущество свойство при их применении в клеточной терапии по сравнению с сестринскими не подвергнутыми инженерии иммунными клетками. Под терапевтическими свойствами в настоящем изобретении подразумевается любое из поддающихся оценке свойств, упомянутых в релевантной научной литературе.
Повышенный терапевтический потенциал более конкретно может отражаться в устойчивости иммунных клеток к лекарственному средству, повышению их персистенции in vitro или in vivo, или безопасности/большем удобстве обработки в процессе производства терапевтических композиций и при осуществлении обработок.
В целом, указанная молекула, повышающая терапевтический потенциал, представляет собой полипептид, но также может представлять собой нуклеиновую кислоту, обладающую способностью направлять или подавлять экспрессию других генов, например, интерферирующие РНК или гидовые РНК. Полипептиды могут действовать непосредственно или опосредованно в качестве трансдукторов сигналов или регуляторов транскрипции.
Согласно одному из вариантов осуществления настоящего способа экзогенную последовательность интродуцируют в эндогенную хромосомную ДНК путем таргетной гомологичной рекомбинации. Таким образом, экзогенная нуклеиновая кислота, интродуцированная в иммунную клетку, содержит по меньшей одну кодирующую(ие) последовательность(и) наряду с последовательностями, которые могут гибридизоваться с эндогенными хромосомными последовательностями в физиологических условиях. Как правило, указанные гомологичные последовательности обладают по меньшей мере 70%-ной, предпочтительно 80%-ной и более предпочтительно 90%-ной идентичностью последовательности с эндогенными генными последовательностями, локализованными в локусе, в который осуществляют инсерцию. Эти гомологичные последовательности могут фланкировать кодирующую последовательность для повышения точности рекомбинации, что уже описано, например, в US 6528313. С использованием доступного программного обеспечения и доступных в режиме онлайн баз данных геномов можно создавать векторы, которые включают указанную(ые) кодирующую(ие) последовательность(и), таким образом, чтобы указанную(ые) последовательности(и) интродуцировать в точный локус под транскрипционным контролем по меньшей мере одного эндогенного промотора, который является промотором эндогенного гена. Затем экзогенную(ые) кодирующую(ие) последовательность(и) предпочтительно встраивают в «рамке считывания» с указанным эндогенным геном. Последовательности, образовавшиеся в результате интеграции экзогенной(ых) полинуклеотидной(ых) последовательности(ей), могут кодировать много различных типов белков, включая слитые белки, меченый белок или мутантные белки. Слитые белки позволяют добавлять новые функциональные домены к белкам, экспрессируемым в клетке, такие как домен димеризации, который можно применять для «включения» или «выключения» активности указанного белка, например, переключение каспазы-9. Меченые белки могут обеспечивать преимущество в отношении детекции сконструированных иммунных клеток и их отслеживания в организме пациентов, обработанных указанными клетками. Интродукция мутации в белки может придавать устойчивость к лекарственным средствам или истощающим иммунную систему агентам, что дополнительно будет описано ниже.
Придание устойчивости к лекарственным средствам или истощающим иммунную систему агентам
Согласно одному из вариантов способа, предлагаемого в настоящем изобретении, экзогенная последовательность, которую интегрируют в геномный локус иммунных клеток, кодирует молекулу, которая придает устойчивость указанным иммунным клеткам к лекарственному средству.
Примерами предпочтительных экзогенных последовательностей являются варианты дигидрофолатредуктазы (DHFR), придающие устойчивость к фолатным аналогам, таким как метотрексат, варианты инозинмонофосфатдегидрогеназы 2 (IMPDH2), придающие устойчивость к ингибиторам IMPDH, таким как микофеноловая кислота (МРА) или ее пролекарство микофенолата мофетил (MMF), варианты кальцинеурина или метилгуанинтрансферазы (MGMT), придающие устойчивость к ингибитору кальцинеурина, такому как FK506 и/или CsA, варианты mTOR, такие как mTORmut, придающие устойчивость к рапамицину) и варианты Lck, такие как Lckmut, придающие устойчивость к иматинибу и гливеку.
Понятие «лекарственное средство» в контексте настоящего описания относится к соединению или его производному, предпочтительно к стандартному химиотерапевтическому агенту, который обычно применяют для взаимодействия с раковой клеткой, снижая тем самым пролиферативный или жизненный статус клетки. Примеры химиотерапевтических средств включают (но не ограничиваясь только ими) алкилирующие агенты (например, циклофосфамид, ифосфамид), антагонисты метаболизма (например, антиметаболит пуриновых нуклеозидов, такой как клофарабин, флударабин или 2'-дезоксиаденозин, метотрексат (МТХ), 5-фторурацил или его производные), противоопухолевые антибиотики (например, митомицин, адриамицин), противоопухолевые агенты растительного происхождения (например, винкристин, виндезин, таксол), цисплатин, карбоплатин, этопозид и т.п. Указанные агенты могут включать также (но не ограничиваясь только указанным) противораковые агенты TRIMETHOTRIXATE™ (ТМТХ), TEMOZOLOMIDE™, RALTRITREXED™, S-(4-нитробензил)-6-тиоинозин (NBMPR), 6-бензигуанидин (6-BG), бис-хлорнитрозомочевину (BCNU) и CAMPTOTHECIN™, или терапевтическое производное любого из них.
В контексте настоящего описания иммунной клетке придают «устойчивость или толерантность» к лекарственному средству, когда указанную клетку или популяцию клеток модифицируют так, чтобы она могла пролиферировать, по меньшей мере in vitro, в культуральной среде, содержащей половину от максимальной ингибирующей концентрации (IC50) указанного лекарственного средства (указанную IC50 определяют относительно немодифицированной(ых) клетки(ок) или популяции клеток).
В конкретном варианте осуществления изобретения устойчивость к указанному лекарственному средству можно придавать иммунным клеткам путем экспрессии по меньшей мере одной «обусловливающей устойчивость к лекарственному средству кодирующей последовательности». Указанное понятие «обусловливающая устойчивость к лекарственному средству кодирующая последовательность» относится к нуклеотидной последовательности, которая придает «устойчивость» к агенту, такому как один из химиотерапевтических агентов, указанных выше. Обусловливающая устойчивость к лекарственному средству кодирующая последовательность, предлагаемая в изобретении, может кодировать устойчивость к антиметаболиту, метотрексату, винбластину, цисплатину, алкилирующим агентам, антрациклинам, цитотоксическим антибиотикам, анти-иммунофилинам, их аналогам или производным и т.п.(Takebe N., S.С. Zhao и др. "Generation of dual resistance to 4-hydroperoxycyclophosphamide and methotrexate by retroviral transfer of the human aldehyde dehydrogenase class 1 gene and a mutated dihydrofolate reductase gene". Mol. Ther. 3(1), 2001, cc. 88-96, Zielske S.P., J.S. Reese и др. "In vivo selection of MGMT(P140K) lentivirus-transduced human NOD/SCID repopulating cells without pretransplant irradiation conditioning." J. Clin. Invest. 112(10), 2003, cc. 1561-1570, Nivens M.С., T. Felder и др. "Engineered resistance to camptothecin and antifolates by retroviral coexpression of tyrosyl DNA phosphodiesterase-I and thymidylate synthase" Cancer Chemother Pharmacol 53(2), 2004, cc. 107-115, Bardenheuer W., K. Lehmberg и др. "Resistance to cytarabine and gemcitabine and in vitro selection of transduced cells after retroviral expression of cytidine deaminase in human hematopoietic progenitor cells". Leukemia 19(12), 2005, cc. 2281-2288, Kushman M.E., S.L. Kabler и др. "Expression of human glutathione S-transferase P1 confers resistance to benzo[a]pyrene or benzo[a]pyrene-7,8-dihydrodiol mutagenesis, macromolecular alkylation and formation of stable N2-Gua-BPDE adducts in stably transfected V79MZ cells co-expressing hCYP1A1" Carcinogenesis 28(1), 2007, cc. 207-214).
Экспрессия указанных обусловливающих устойчивость к лекарственному средству экзогенных последовательностей в иммунных клетках, предлагаемых в настоящем изобретении, более конкретно обеспечивает применение указанных иммунных клеток в схемах лечения на основе клеточной терапии, в которых клеточную терапию объединяют с химиотерапией, или применение для пациентов, которых ранее лечили с помощью указанных лекарственных средств.
Идентифицировано несколько обусловливающих устойчивость к лекарственным средствам кодирующих последовательностей, которые потенциально пригодны для придания устойчивости к лекарственному средству согласно изобретению. Одним из примеров кодирующей последовательности, обусловливающей устойчивость к лекарственному средству, может являться, в частности, мутантная или модифицированная форма дигидрофолатредуктазы (DHFR). DHFR представляет собой фермент, участвующий в регулировании количества тетрагидрофолата в клетке, и является важным для синтеза ДНК. Аналоги фолата, такие как метотрексат (МТХ), ингибируют DHFR и поэтому применяются в качестве антинеопластических агентов в клинических условиях. Описаны различные мутантные формы DHFR, которые обладают повышенной устойчивостью к ингибированию антифолатными агентами, которые применяют в терапии. В конкретном варианте осуществления изобретения кодирующая последовательность, обусловливающая устойчивость к лекарственному средству, предлагаемая в настоящем изобретении, может представлять собой нуклеотидную последовательность, кодирующую мутантную форму человеческой DHFR дикого типа (GenBank: ААН71996.1), которая содержит по меньшей мере одну мутацию, обусловливающую устойчивость к лечению антифолатным средством, таким как метотрексат. В конкретном варианте осуществления изобретения мутантная форма DHFR содержит по меньшей мере одну измененную в результате мутации аминокислоту в положении G15, L22, F31 или F34, предпочтительно в положениях L22 или F31 (Schweitzer и др. "Dihydrofolate reductase as a therapeutic target" Faseb J 4(8), 1990, cc. 2441-2452; международная заявка на патент WO 94/24277; патент US 6642043). В конкретном варианте осуществления изобретения указанная мутантная форма DHFR содержит две измененные в результате мутации аминокислоты в положении L22 и F31. Соответствие аминокислотным положениям, указанным в настоящем описании, часто выражают в виде положений аминокислот в полипептиде DHFR дикого типа. В конкретном варианте осуществления изобретения остаток серина в положении 15 предпочтительно заменяют на остаток триптофана. В другом конкретном варианте осуществления изобретения остаток лейцина в положении 22 предпочтительно заменяют на аминокислоту, которая может нарушать связывание мутантной DHFR с антифолатными агентами, предпочтительно на незаряженные аминокислотные остатки, такие как фенилаланин или тирозин. В другом конкретном варианте осуществления изобретения остаток фенилаланина в положениях 31 или 34 предпочтительно заменяют на остаток низкомолекулярной гидрофильной аминокислоты, такой как аланин, серии или глицин.
Другим примером кодирующей последовательности, обусловливающей устойчивость к лекарственному средству, может являться также мутантная или модифицированная форма инозин-5'-монофосфатдегидрогеназы II (IMPDH2), фермента, ограничивающего скорость синтеза de novo гуанозиновых нуклеотидов. Мутантная или модифицированная форма IMPDH2 представляет собой ген, обусловливающий устойчивость к ингибитору IMPDH. Ингибиторы IMPDH могут представлять собой микофеноловую кислоту (МРА) или ее пролекарство микофенолата мофетил (MMF). Мутант IMPDH2 может содержать по меньшей мере одну, предпочтительно две мутации в сайте связывания MAP человеческой IMPDH2 дикого типа (Genebank: NP_000875.2), которые приводят к значительному повышению устойчивости к ингибитору IMPDH. В этом варианте мутации предпочтительно затрагивают положения Т333 и/или S351 (Yam P., М. Jensen и др. "Ex vivo selection and expansion of cells based on expression of a mutated inosine monophosphate dehydrogenase 2 after HIV vector transduction: effects on lymphocytes, monocytes, and CD34+ stem cells", Mol. Ther. 14(2), 2006, cc. 236-244), (Jonnalagadda M. и др. "Engineering human T cells for resistance to метотрексат and mycophenolate mofetil as an in vivo cell selection strategy", PLoS One 8(6), 2013, e65519).
Другой кодирующей последовательностью, обусловливающей устойчивость к лекарственному средству, является мутантная форма кальцинеурина. Кальцинеурин (РР2В - NCBI: АСХ34092.1) представляет собой повсеместно экспрессируемую серин/треониновую протеинфосфатазу, которая участвует во многих биологических процессах и которая играет центральную роль в активации Т-клеток. Кальцинеурин представляет собой гетеродимер, состоящий из каталитической субъединицы (CnA; три изоформы) и регуляторной субъединицы (CnB; две изоформы). После контакта с Т-клеточным рецептором кальцинеурин дефосфоририлирует фактор транскрипции NFAT, что приводит к его транслокации в ядро, где он активирует имеющий решающее значение ген, такой как IL2. FK506 в комплексе с FKBP12 или циклоспорин A (CsA) в комплексе с СуРА блокируют доступ NFAT к активному сайту кальцинеурина, препятствуя его дефосфорилированию и ингибируя тем самым активацию Т-клеток (Brewin и др., "Generation of EBV-specific cytotoxic T cells that are resistant to calcineurin inhibitors for the treatment of posttransplantation lymphoproliferative disease" Blood 114(23), 2009, cc. 4792-4803). В конкретном варианте осуществления изобретения указанная мутантная форма может содержать по меньшей мере одну мутантную аминокислоту в гетеродимере кальцинеурина дикого типа в положениях: V314, Y341, М347, Т351, W352, L354, K360, предпочтительно двойные мутации в положениях Т351 и L354 или V314 и Y341. В конкретном варианте осуществления изобретения остаток валина в положении 341 можно заменять на остаток лизина или аргинина, остаток тирозина в положении 341 можно заменять на остаток фенилаланина; метионин в положении 347 можно заменять на остаток глутаминовой кислоты, аргинина или триптофана; треонин в положении 351 можно заменять на остаток глутаминовой кислоты; остаток триптофана в положении 352 можно заменять на остаток цистеина, глутаминовой кислоты или аланина, серии в положении 353 можно заменять на остаток гистидина или аспарагина, лейцин в положении 354 можно заменять на остаток аланина; лизин в положении 360 можно заменять на остаток аланина или фенилаланина. В другом конкретном варианте осуществления изобретения указанная мутантная форма может содержать по меньшей мере одну мутантную аминокислоту в гетеродимере кальцинеурина дикого типа в положениях: V120, N123, L124 или K125, предпочтительно двойные мутации в положениях L124 и K125. В конкретном варианте осуществления изобретения валин в положении 120 можно заменять на остаток серина, аспарагиновой кислоты, фенилаланина или лейцина; аспарагин в положении 123 можно заменять на триптофан, лизин, фенилаланин, аргинин, гистидин или серии; лейцин в положении 124 можно заменять на остаток треонина; лизин в положении 125 можно заменять на аланин, глутаминовую кислоту, триптофан, или два остатка, такие как лейцин-аргинин или изолейцин-глутаминовая кислота, можно добавлять в аминокислотную последовательность после лизина в положении 125. Соответствие аминокислотным положениям, указанным в настоящем описании, часто выражают в виде положений аминокислот в человеческом полипептиде гетеродимера b кальцинеурина дикого типа ((NCBI: АСХ34095.1).
Другой кодирующей последовательностью, обусловливающей устойчивость к лекарственному средству, является последовательность О(6)-метилгуанинметилтрансферазы (MGMT - UniProtKB: Р16455), кодирующая человеческую алкилгуанинтрансферазу (hAGT). AGT представляет собой репарирующий ДНК белок, который придает устойчивость к цитотоксическим действиям алкилирующих агентов, таких как нитрозомочевины и темозоломид (TMZ). 6-бензилгуанин (6-BG) является ингибитором AGT, который усиливает токсичность нитрозомочевины и его вводят совместно с TMZ для усиления цитотоксических действий этого агента. Несколько мутантных форм MGMT, которые кодируют варианты AGT, обладают высокой устойчивостью к инактивации с помощью 6-BG, но сохраняют их способность к репарации повреждения ДНК (Maze R. и др., "Retroviral-mediated expression of the P140A, but not P140A/G156A, mutant form of О6-methylguanine DNA methyltransferase protects hematopoietic cells against О6-benzylguanine sensitization to chloroethylnitrosourea treatment" J. Pharmacol. Exp. Ther. 290(3), 1999, cc. 1467-1474). В конкретном варианте осуществления изобретения мутантная форма AGT может содержать мутантную аминокислоту в положении Р140 AGT дикого типа. В предпочтительном варианте осуществления изобретения указанный пролин в положении 140 заменяют на остаток лизина.
Другой кодирующей последовательностью, обусловливающей устойчивость к лекарственному средству, может являться ген обусловливающего устойчивость ко многим лекарственным средствам белка (MDR1). Этот ген кодирует мембранный гликопротеин, известный как P-гликопротеин (P-GP), который участвует в транспорте побочных продуктов метаболизма через клеточную мембрану. Белок P-GP обладает широким спектром специфичности в отношении нескольких структурно неродственных химиотерапевтических агентов. Таким образом, устойчивость к лекарственному средству можно придавать клеткам в результате экспрессии нуклеотидной последовательности, которая кодирует MDR-1 (Genebank NP_000918).
Другая кодирующая последовательностью, обусловливающая устойчивость к лекарственному средству, может принимать участие в производстве цитотоксических антибиотиков, таких как синтезируемые генами ble или mcrA. Эктопическая экспрессия гена ble или гена mcrA в иммунной клетке обеспечивает избирательное преимущество при воздействии соответствующих химиотерапевтических средств блеомицина и митомицина С (Belcourt M.F., "Mitomycin resistance in mammalian cells expressing the bacterial mitomycin С resistance protein MCRA", PNAS. 96(18), 1999, cc. 10489-10494).
Другая кодирующая последовательностью, обусловливающая устойчивость к лекарственному средству, может иметь происхождение из генов, кодирующих мутантную версию мишеней лекарственного средства, таких как мутантные варианты mTOR (mTOR mut), придающие устойчивость к рапамицину, которые описаны у Lorenz М.С. и др., "TOR Mutations Confer Rapamycin Resistance by Preventing Interaction with FKBP12-Rapamycin", The Journal of Biological Chemistry 270, 1995, cc. 27531-27537, или некоторые мутантные варианты Lck (Lckmut), придающие устойчивость к гливеку, которые описаны у Lee K.С. и др., "Lck is a key target of imatinib and dasatinib in T-cell activation", Leukemia, 24, 2010, cc. 896-900.
Как описано выше, стадия способа, включающая генетическую модификацию, может представлять собой стадию интродукции в клетки экзогенной нуклеиновой кислоты, содержащей по меньшей мере одну последовательность, которая кодирует кодирующую последовательность, обусловливающую устойчивость к лекарственному средству, и часть эндогенного гена, в результате чего имеет место гомологичная рекомбинация между эндогенным геном и экзогенной нуклеиновой кислотой. В конкретном варианте осуществления изобретения указанный эндогенный ген может представлять собой ген дикого типа, «обусловливающий устойчивость к лекарственному средству», в результате после гомологичной рекомбинации ген дикого типа заменяется на мутантную форму гена, которая придает устойчивость к лекарственному средству.
Повышенная персистенция иммунных клеток in vivo
Согласно одному из вариантов способа экзогенная последовательность, которую интегрируют в геномный локус иммунных клеток, кодирует молекулу, которая повышает персистенцию иммунных клеток, прежде всего персистенцию in vivo в окружении опухоли.
Под «повышенной персистенцией» подразумевают удлиненную выживаемость иммунных клеток в понятиях продолжительности жизни, прежде всего, когда сконструированные иммунные клетки инъецируют пациенту. Например, персистенция является повышенной, если средняя выживаемость модифицированных клеток является существенно удлиненной по сравнению с немодифицированными клетками, по меньшей мере на 10%, предпочтительно на 20%, более предпочтительно на 30%, еще более предпочтительно на 50%.
Особенно важно, когда иммунные клетки являются аллогенными. Их можно получать путем создания локальной иммунной защиты путем интродукции кодирующих последовательностей, которые эктопически экспрессируют и/или секретируют иммуносупресорные полипептиды на клеточной мембране или через клеточную мембрану. Различные панели указанных полипептидов, в частности, являются антагонистами иммунных контрольных точек, иммуносупрессорные пептиды из вирусной оболочки или лиганд NKG2D могут повышать персистенцию и/или приживление аллогенных иммунных клеток в организме пациентов.
Согласно одному из вариантов осуществления изобретения иммуносупрессорный полипептид, кодируемый указанной экзогенной кодирующей последовательностью, представляет собой лиганд антигена цитотоксических Т-лимфоцитов 4 (CTLA-4, известный также как CD152, GenBank, код доступа AF414120.1). Указанный полипептидный лиганд предпочтительно представляет собой анти-CTLA-4 иммуноглобулин, такой как CTLA-4a Ig и CTLA-4b Ig или их функциональный вариант.
Согласно одному из вариантов осуществления изобретения иммуносупрессорный полипептид, кодируемый указанной экзогенной кодирующей последовательностью, представляет собой антагонист PD1, такой как PD-L1 (другие названия: CD274, лиганд (запуска) запрограммированной гибели клеток 1; см. в UniProt человеческую полипептидную последовательность Q9NZQ7), который кодирует трансмембранный белок типа I из 290 аминокислот, состоящий из Ig V-подобного домена, Ig С-подобного домена, гидрофобного трансмембранного домена и цитоплазматического хвоста из 30 аминокислот. Согласно настоящему изобретению указанная связанная с мембраной форма PD-L1-лиганда может представлять собой нативную форму (дикого типа) или укороченную форму, такую, например, как полученная путем удаления внутриклеточного домена, или форму с одной или несколькими мутацией(ями) (Wang S. и др., J Exp Med. 197(9), 2003, cc. 1083-1091). Следует отметить, что PD1 не рассматривается в настоящем изобретении в качестве связанной с мембраной формы PD-L1-лиганда. Согласно другому варианту осуществления изобретения указанный иммуносупрессорный полипептид находится в секретируемой форме. Указанный рекомбинантный секретируемый PD-L1 (или растворимый PD-L1) можно получать путем слияния внеклеточного домена PD-L1 с Fc-областью иммуноглобулина (Haile S.T. и др., Cancer Immunol. Res. 2(7), 2014, cc. 610-615; Song M.Y. и др., Gut. 64(2), 2015, cc. 260-271). Указанный рекомбинантный PD-L1 может нейтрализовать PD-1 и аннулировать опосредуемое PD-1 ингибирование Т-клеток. PD-L1-лиганд можно экспрессировать совместно с CTLA4 Ig для еще большего повышения персистенции их обоих.
Согласно другому варианту осуществления изобретения экзогенная последовательность кодирует полипептид, который содержит вирусный иммуносупрессонный домен env (ISU), который получают, например, из HIV-1, HIV-2, SIV, MoMuLV, HTLV-I, -II, MPMV, SRV-1, синцитина 1 или 2, HERV-K или FELV.
Ниже в таблице 1 представлены варианты ISU-домена из различных вирусов, которые можно экспрессировать согласно настоящему изобретению.

Согласно другому варианту осуществления изобретения экзогенная последовательность кодирует FP-полипептид, такой как gp41. Ниже в таблице 2 представлено несколько FP-полипептидов из встречающихся в естественных условиях и искусственных источников.

Согласно другому варианту осуществления изобретения экзогенная последовательность кодирует нечеловеческий гомолог ГКГС, прежде всего вирусный гомолог ГКГС или химерный полипептид β2m, например, описанный у Margalit А. и др., "Chimeric β2 microglobulin/CD3ζ polypeptides expressed in T cells convert MHC class I peptide ligands into T cell activation receptors: a potential tool for specific targeting of pathogenic CD8+ T cells", Int. Immunol. 15 (11), 2008, cc. 1379-1387.
Согласно одному из вариантов осуществления изобретения экзогенная последовательность кодирует лиганд NKG2D. Некоторые вирусы, такие как цитомегаловирусы, имеют приобретенные механизмы ускользания от опосредованного NK-клетками иммунологического надзора и взаимодействуют с путем NKG2D путем секреции белка, который может связываться с лигандами NKG2D и препятствовать их экспрессии на поверхности (Welte S.А и др., "Selective intracellular retention of virally induced NKG2D ligands by the human cytomegalovirus UL16 glycoprotein", Eur. J. Immunol., 33, 2003, cc. 194-203). В опухолевых клетках несколько механизмов включены в ускользание от NKG2D-ответа в результате секреции лигандов NKG2D, таких как ULBP2, MICB или MICA (Salih H.R., Antropius Н., Gieseke F., Lutz S.Z., Kanz L. и др., Functional expression and release of ligands for the activating immunoreceptor NKG2D in leukemia, Blood 102, 2003, cc. 1389 1396).
Согласно одному из вариантов осуществления изобретения экзогенная последовательность кодирует цитокиновый рецептор, такой как рецептор IL-12. IL-12 является хорошо известным активатором активации иммунных клеток (Curtis J.H., "IL-12 Produced by Dendritic Cells Augments CD8+ T Cell Activation through the Production of the Chemokines CCL1 and CCL171", The Journal of Immunology. 181 (12), 2008, cc. 8576-8584.
Согласно одному из вариантов осуществления изобретения экзогенная последовательность кодирует антитело, направленное против ингибирующих пептидов или белков. Указанное антитело предпочтительно должно секретироваться иммунными клетками в растворимой форме. Нанотела из акул и верблюдов являются предпочтительными в этом плане, поскольку имеют структуру в виде одноцепочечных антител (Muyldermans S., "Nanobodies: Natural Single-Domain Antibodies", Annual Review of Biochemistry 82, 2013, cc. 775-797). Считается также, что их проще сливать с полипептидами секреторных сигналов и с растворимыми гидрофильными доменами.
Различные описанные выше аспекты повышения персистенции клеток являются особенно предпочтительными, если экзогенную кодирующую последовательность интродуцируют путем разрушения эндогенного гена, кодирующего β2m или другой компонент ГКГС, что будет подробно описано ниже.
Повышение терапевтической активности иммунных клеток
Согласно одному из вариантов способа, предлагаемого в настоящем изобретении, экзогенная последовательность, которую интегрируют в геномный локус иммунных клеток, кодирует молекулу, которая повышает терапевтическую активность иммунных клеток.
Под «повышением терапевтической активности» подразумевают, что иммунные клетки или популяция клеток, сконструированные согласно настоящему изобретению, становятся более агрессивными по сравнению с несконструированными клетками или популяцией клеток в отношении выбранного типа клеток-мишеней. Указанные клетки-мишени, как правило, принадлежат к определенному типу клеток или популяции клеток, которые предпочтительно отличаются общим(и) поверхностным(и) маркером(ами). В настоящем описании «терапевтический потенциал» отражает терапевтическую активность, измеренную в экспериментах in vitro. Как правило, чувствительные линии раковых клеток, такие как клетки Дауди, применяют для решения вопроса о том, являются ли иммунные клетки более или менее активными в отношении указанных клеток, путем оценки их способности осуществлять клеточный лизис или уменьшать рост. Это можно определять путем измерения уровней дегрануляции иммунных клеток или производства хемокинов и цитокинов. Эксперименты можно проводить также на мышах с инъецированными опухолевыми клетками и путем мониторинга распространения образовавшейся опухоли. Повышенную активность рассматривают как значимую, когда количество развывшихся клеток в этих экспериментах снижается иммунными клетками более чем на 10%, предпочтительно более чем на 20%, более предпочтительно более чем на 30%, еще более предпочтительно более чем на 50%.
Согласно одному из объектов изобретения указанная экзогенная последовательность кодирует хемокин или цитокин, такой как IL-12. Наиболее целесообразно экспрессировать IL-12, поскольку этот цитокин хорошо известен из литературы в качестве усилителя активации иммунных клеток (Colombo М.Р. и др., "Interleukin-12 in anti-tumor immunity and immunotherapy", Cytokine Growth Factor Rev. 13(2), 2002, cc. 155-168).
Согласно одному из объектов изобретения указанная экзогенная последовательность кодирует или активизирует секретируемые факторы, которые действуют на другие популяции иммунных клеток, такие как регуляторные Т-клетки, ослабляя их ингибирующее действие на указанные иммунные клетки.
Согласно одному из объектов изобретения указанная экзогенная последовательность кодирует ингибитор активности регуляторных Т-клеток, который представляет собой полипептидный ингибитор фактора транскрипции белков семейства forkhead/winged helix (раздвоенная/крылатая спираль) 3 (FoxP3), и более предпочтительно представляет собой проникающий в клетку пептидный ингибитор FoxP3, например, обозначенный как Р60 (Casares N. и др. "A peptide inhibitor of FoxP3 impairs regulatory T cell activity and improves vaccine efficacy in mice." J Immunol 185(9), 2010, cc. 5150-5159).
Под «ингибитором активности регуляторных Т-клеток» подразумевается молекула или предшественник указанной молекулы, секретируемая/секретируемый Т-клетками, и позволяющая/позволяющий Т-клеткам избегать понижающей регуляции активности, осуществляемой в отношении них регуляторными Т-клетками. В целом, указанный ингибитор активности регуляторных Т-клеток оказывает воздействие, снижая транскрипционную активность FoxP3 в указанных клетках.
Согласно одному из объектов изобретения указанная экзогенная последовательность кодирует секретируемый ингибитор ассоциированных с опухолью макрофагов (ТАМ), такой как нейтрализующий агент CCR2/CCL2. Ассоциированные с опухолью макрофаги (ТАМ) представляют собой имеющие решающее значение модуляторы микроокружения опухоли.
Клиникопатологические исследования позволили предположить, что накопление ТАМ в опухолях коррелирует с плохим клиническим исходом. В соответствии с указанными данными в экспериментальных исследованиях и в опытах на животных подтверждена указная точка зрения о том, что ТАМ могут обеспечивать предпочтительное микроокружение, усиливающие развитие и прогрессирование опухоли (Theerawut С. и др., "Tumor-Associated Macrophages as Major Players in the Tumor Microenvironment", Cancers (Basel) 6(3), 2014, cc. 1670-1690). Хемокин (мотив C-C) лиганд 2 (CCL2), который обозначают также как моноцитарный хемоаттрактантный белок 1 (МСР1 - NCBI NP_002973.1), представляет собой небольшой цитокин, принадлежащий к семейству СС-хемокинов, секретируемых макрофагами, который является фактором хемоаттрактивности (хемотаксиса) моноцитов, лимфоцитов и базофилов. CCR2 (рецептор хемокина (мотив С-С) типа 2 - NCBI NP_001116513.2) является рецептором CCL2.
Повышение специфичности и безопасности иммунных клеток
Экспрессия химерных антигенных рецепторов (CAR) стала общепринятой в данной области для контроля или повышения специфичности первичных иммунных клеток, таких как Т-клетки и NK-клетки, для лечения опухолей или инфицированных клеток. CAR, экспрессируемые указанными иммунными клетками, специфически таргетируют антигенные маркеры на поверхности патологических клеток, что дополнительно помогает иммунным клеткам разрушать указанные клетки in vivo (Sadelain М. и др., "The basic principles of chimeric antigen receptor design" Cancer Discov. 3(4), 2013, cc. 388-398). CAR, как правило, создают так, чтобы они содержали активирующие домены, которые стимулируют иммунные клетки в ответ на связывание со специфическим антигеном (так называемые позитивные CAR), но они могут содержать также ингибирующий домен с противоположным действие (так называемые негативные CAR) (Fedorov V. D., "Novel Approaches to Enhance the Specificity and Safety of Engineered T Cells", Cancer Journal 20 (2), 2014, cc. 160-165. Позитивные и негативные CAR можно объединять и совместно экспрессировать для точной настройки иммуноспецифичности клеток в зависимости от различных антигенов, которые присутствуют на поверхности клеток-мишеней.
Генетические последовательности, кодирующие CAR, как правило, интродуцируют в геном клеток с помощью ретровирусных векторов, которые обладают повышенной эффективностью трансдукции, но интегрируются в произвольные положения. Согласно настоящему изобретению компоненты химерного антигенного рецептора (CAR) можно интродуцировать в выбранные локусы, более предпочтительно под контролем эндогенных промоторов, с использованием рекомбинации таргетных генов.
Согласно одному из объектов изобретения в то время как позитивный CAR интродуцируют в иммунную клетку с помощью вирусного вектора, негативный CAR можно интродуцировать с помощью инсерции таргентного гена и наоборот, и предпочтительно он должен обладать активностью только в процессе активации иммунных клеток. Таким образом, ингибирующий (т.е. негативный) CAR принимает участие в повышении специфичности, препятствуя атаке иммунных клеток на конкретный тип клеток, которые требуется сохранять. Кроме того, согласно указанному объекту изобретения указанный негативный CAR может представлять собой стимулирующий апоптоз CAR, т.е. указанный CAR содержит домен апоптоза, такой как FasL (CD95 - NCBI: NP_000034.1) или его функциональный вариант, который трансдуцирует сигнал, индуцирующий клеточную гибель (Eberstadt М. и др., "NMR structure and mutagenesis of the FADD (Mort1) death-effector domain", Nature, 392 (6679), 1998, cc. 941-945).
Таким образом, экзогенная кодирующая последовательность, которую встраивают согласно изобретению, может кодировать фактор, обладающий способностью индуцировать клеточную гибель непосредственно, в сочетании с другим(ими) компонентом(ами)или путем активации другого(их) компонента(ов).
В качестве другого пути повышения безопасности применения первичных иммунных клеток экзогенная кодирующая последовательность может кодировать молекулы, которые придают чувствительность иммунным клеткам к лекарственным средствам или другим экзогенным субстратам. Указанные молекулы могут представлять собой цитохром(ы), например, семейства Р450 (Preissner S. и др., "SuperCYP: a comprehensive database on Cytochrome P450 enzymes including a tool for analysis of CYP-drug interactions". Nucleic Acids Res 38, 2010 (выпуск базы данных): D237-43), такие как CYP2D6-1 (NCBI - NP_000097.3), CYP2D6-2 (NCBI - NP_001020332.2), CYP2C9 (), CYP3A4 (NCBI - NP_000762.2), CYP2C19 (NCBI - NP_000760.1) или CYP1A2 (NCBI - NP_000752.2.), которые придают иммунных клеткам гиперчувствительность к лекарственному средству, такому как циклофосфамид и/или изофосфамид.
Согласно другому объекту изобретения экзогенную последовательность интродуцируют в иммунные клетки для ее экспрессии, прежде всего in vivo, для снижения передачи сигналов IL-6 или IL-8 в транс-направлении с целью контроля потенциального синдрома выброса цитокинов (CRS).
Указанная экзогенная последовательность может кодировать, например, антитела, направленные против IL-6 или IL-8 или против их рецепторов IL-6R или IL-8R.
Согласно предпочтительному объекту изобретения указанная экзогенная последовательность может кодировать растворимый внеклеточный домен GP130, например, характеризующийся по меньшей мере 80%-ной идентичностью с SEQ ID NO: 61.
Указанный растворимый внеклеточный домен GP130, описанный, например, у Rose-John S. ("The Soluble Interleukine Receptor: Advanced Therapeutic Options in Inflammation" Clinical Pharmacology & Therapeutics, 102(4), 2017, cc. 591-598), может представлять собой слияние с фрагментами иммуноглобулинов, такое как sgp130Fc (SEQ ID NO: 62). Как описано выше, указанную экзогенную последовательность можно стабильно интегрировать в геном с помощью сайтнаправленного мутагенеза (т.е. с использованием специфических для последовательности реагентов, представляющих собой нуклеазы) и помещать под транскрипционную активность эндогенного промотора в локус, являющийся активным в процессе активации иммунных клеток, такой как один из перечисленных в таблицах 6, 8 или 9, и предпочтительно для которого характерная повышающая регуляция при активации CAR или который является зависимым от CAR.
Согласно более предпочтительному варианту осуществления изобретения экзогенную последовательность интродуцируют в CAR-позитивную иммунную клетку, например, Т-клетку, экспрессирующую полинуклеотидную последовательность анти-CD22 CAR, такую как SEQ ID NO: 31. Согласно некоторым более конкретным вариантам осуществления изобретения указанную экзогенную последовательность, кодирующую полипептид, который может связываться и предпочтительно взаимодействовать, с цитокиновым рецептором семейства рецепторов IL-6, таким как указанный растворимый внеклеточный домен GP130, интегрируют в локус PD1, CD25 или CD69. Согласно настоящему изобретению эндогенную последовательность, кодирующую локус PD1, предпочтительно разрушают с помощью указанной экзогенной последовательности.
Таким образом, в изобретении предложен способ лечения или снижения CRS при клеточной иммунотерапии, в котором пациентам вводят клетки или их терапевтическую композицию, где указанные клетки являются генетически модифицированными, в результате чего они секретируют полипептид(ы), содержащий(ие) растворимый внеклеточный домен GP130, sGP130Fc, антитело к IL-6 или антитело к IL6R, антитело к IL-8 или антитело к IL8R или любое их слияние.
Примерами предпочтительных генотипов сконструированных иммунных клеток являются:
[CAR]позитивные[GP130]позитивные
[CAR]позитивные[GP130]позитивные
[CAR]позитивные[TCR]негативные[GP130]позитивные[PD1]негативные
[CAR]позитивные[TCR]негативные[GP130]позитивные[PD1]негативные
[CAR]позитивные[GP130]позитивные[CD25]негативные
[CAR]позитивные[TCR]негативные[GP130]позитивные[CD25]негативные
Повышение эффективности таргетной инсерции гена в первичные иммунные клетки с использованием AAV-векторов
В настоящем описании представлены донорские матрицы и специфические для последовательности реагенты, проиллюстрированные на чертежах, которые можно применять для осуществления эффективной инсерции кодирующей последовательности в рамке считывания с эндогенными промоторами, в частности PD1 и CD25, а также средства и последовательности для детекции правильной инсерции указанных экзогенных последовательностей в указанные локусы.
Донорские матрицы, предлагаемые в настоящем изобретении, как правило, представляют собой полинуклеотидные последовательности, которые можно включать в различные векторы, известные в данной области, которые способствуют доставке донорских матриц в ядро в момент времени, когда реагенты, представляющие собой эндонуклеазы, приобретают активность, для достижения сайтнаправленной инсерции в геном, как правило с помощью NHEJ или гомологичной рекомбинации.
В частности, в настоящем изобретении предложены специфические донорские полинуклеотиды для экспрессии IL-15 (SEQ ID NO: 59) в локусе PD1, которые содержат одну или несколько следующих последовательностей:
- последовательность, которая кодирует IL-15, например, одна из обладающих идентичностью с SEQ ID NO: 50;
- расположенные в обратном и прямом направлении (что обозначают также как левая и правая) последовательности, гомологичные локусу PD1, которые содержат предпочтительно полинуклеотидные последовательности SEQ ID NO: 45 и SEQ ID NO: 46;
- необязательно последовательность, которая кодирует растворимую форму рецептора IL-15 (sIL-15R), например, одна из обладающих идентичностью с SEQ ID NO: 50;
- необязательно по меньшей мере один сайт расщепления пептида 2А (сайт, распознаваемый пептидом 2А), такой как одна из SEQ ID NO: 53 (F2A), SEQ ID NO: 54 (P2A) и/или SEQ ID NO: 55 (T2A).
В частности, в настоящем изобретении предложены специфические донорские полинуклеотиды для экспрессии IL-12 (SEQ ID NO: 58) в локусе PD1, которые содержат одну или несколько следующих последовательностей:
- последовательность, которая кодирует IL-12a, например, одна из обладающих идентичностью с SEQ ID NO: 47;
- расположенные в обратном и прямом направлении (что обозначают также как левая и правая) последовательности, гомологичные локусу PD1, которые содержат предпочтительно полинуклеотидные последовательности SEQ ID NO: 45 и SEQ ID NO: 46;
- необязательно последовательность, которая кодирует IL-12b, например, одна из обладающих идентичностью с SEQ ID NO: 48;
- необязательно по меньшей мере один сайт расщепления пептида 2А такой как одна из SEQ ID NO: 53 (F2A), SEQ ID NO: 54 (P2A) и/или SEQ ID NO: 55 (T2A).
В частности, в настоящем изобретении предложены специфические донорские полинуклеотиды для экспрессии растворимого GP130 (содержащий SEQ ID NO: 61) в локусе PD1, которые содержат одну или несколько следующих последовательностей:
- последовательность, которая кодирует растворимый GP130, предпочтительно растворимый gp130, слитый с Fc, например, одна из обладающих идентичностью с SEQ ID NO: 62;
- расположенные в обратном и прямом направлении (что обозначают также как левая и правая) последовательности, гомологичные локусу PD1, которые содержат предпочтительно полинуклеотидные последовательности SEQ ID NO: 45 и SEQ ID NO: 46;
- необязательно по меньшей мере один сайт расщепления пептида 2А такой как одна из SEQ ID NO: 53 (F2A), SEQ ID NO: 54 (P2A) и/или SEQ ID NO: 55 (T2A).
В частности, в настоящем изобретении предложены специфические донорские полинуклеотиды для экспрессии IL-15 (SEQ ID NO: 59) в локусе CD25, которые содержат одну или несколько следующих последовательностей:
- последовательность, которая кодирует IL-15, например, одна из обладающих идентичностью с SEQ ID NO: 50;
- расположенные в обратном и прямом направлении (что обозначают также как левая и правая) последовательности, гомологичные локусу CD25, которые содержат предпочтительно полинуклеотидные последовательности SEQ ID NO: 43 и SEQ ID NO: 44;
- необязательно последовательность, которая кодирует растворимую форму рецептора IL-15 (sIL-15R), например, одна из обладающих идентичностью с SEQ ID NO: 50;
- необязательно по меньшей мере один сайт расщепления пептида 2А, такой как одна из SEQ ID NO: 53 (F2A), SEQ ID NO: 54 (P2A) и/или SEQ ID NO: 55 (T2A).
В частности, в настоящем изобретении предложены специфические донорские полинуклеотиды для экспрессии IL-12 (SEQ ID NO: 58) в локусе CD25, которые содержат одну или несколько следующих последовательностей:
- последовательность, которая кодирует IL-12a, например, одна из обладающих идентичностью с SEQ ID NO: 47;
- расположенные в обратном и прямом направлении (что обозначают также как левая и правая) последовательности, гомологичные локусу CD25, которые содержат предпочтительно полинуклеотидные последовательности SEQ ID NO: 43 и SEQ ID NO: 44;
- необязательно последовательность, которая кодирует IL-12b, например, одна из обладающих идентичностью с SEQ ID NO: 48;
- необязательно по меньшей мере один сайт расщепления пептида 2А такой как одна из SEQ ID NO: 53 (F2A), SEQ ID NO: 54 (P2A) и/или SEQ ID NO: 55 (T2A).
В частности, в настоящем изобретении предложены специфические донорские полинуклеотиды для экспрессии растворимого GP130 (содержащий SEQ ID NO: 61) в локусе CD25, которые содержат одну или несколько следующих последовательностей:
- последовательность, которая кодирует растворимый GP130, предпочтительно растворимый gp130, слитый с Fc, например, одна из обладающих идентичностью с SEQ ID NO: 62;
- расположенные в обратном и прямом направлении (что обозначают также как левая и правая) последовательности, гомологичные локусу CD25, которые содержат предпочтительно полинуклеотидные последовательности SEQ ID NO: 43 и SEQ ID NO: 44;
- необязательно по меньшей мере один сайт расщепления пептида 2А такой как одна из SEQ ID NO: 53 (F2A), SEQ ID NO: 54 (P2A) и/или SEQ ID NO: 55 (T2A).
Как проиллюстрировано в примерах, представленных в настоящем описании, при создании изобретения была существенно повышен уровень таргетной инсерции гена в человеческие клетки с использованием AAV-векторов, прежде всего векторов из семейства AAV6.
Таким образом, в широком смысле объектом настоящего изобретения является трансдукция AAV-векторов в человеческие первичные иммунные клетки в сочетании с экспрессией специфических для последовательностей реагентов, представляющих собой эндонуклеазы, такие как TALE-эндонуклеазы, которые более предпочтительно интродуцируют в форме мРНК, для повышения случаев гомологичной рекомбинации в указанных клетках.
Согласно одному из объектов настоящего изобретения специфические для последовательностей реагенты, представляющие собой эндонуклеазы, можно интродуцировать в клетки путем трансфекции, более предпочтительно путем электропорации мРНК, которая кодирует указанные специфические для последовательностей реагенты, представляющие собой эндонуклеазы, такие как TALE-нуклеазы.
Таким образом, в широком смысле в качестве более конкретного объекта изобретения предложен способ инсерции экзогенной нуклеотидной последовательности в эндогенную полинуклеотидную последовательность в клетке, который включает по меньшей мере стадии, на которых:
- осуществляют трансдукцию в указанную клетку AAV-вектора, содержащего указанную экзогенную последовательность и последовательности, гомологичные таргетируемой эндогенной ДНК-последовательности, и
- индуцируют экспрессию специфического для последовательности реагента, представляющего собой эндонуклеазу, для расщепления эндогенной последовательности в локусе инсерции.
Результатом осуществления инсерции экзогенной нуклеотидной последовательности может быть интродукция генетического материала, коррекция или замена эндогенной последовательности, более предпочтительно «в рамке считывания» с соответствующими эндогенными генными последовательностями в данном локусе.
Согласно другому объекту изобретения клетку трансдуцируют с использованием от 105 до 107, предпочтительно от 106 до 107, более предпочтительно примерно 5×106 вирусных геномов на клетку.
Согласно другому объекту изобретения клетки можно обрабатывать ингибиторами протеасом, такими как бортезомиб, для дополнительного облегчения гомологичной рекомбинации.
Согласно одному из объектов настоящего изобретения AAV-вектор, применяемый в способе, может содержать экзогенную кодирующую последовательность без промотора, соответствующую любой из указанных в настоящем описании, для того, чтобы ее можно было помещать под контроль эндогенного промотора в одном из локусов, выбранном из числа перечисленных в настоящем описании.
Согласно одному из объектов настоящего изобретения AAV-вектор, применяемый в способе, может содержать сайт расщепления пептида 2А, за которым расположена кДНК (минус стартовый кодон), что приводит к образованию экзогенной кодирующей последовательности.
Согласно одному из объектов изобретения указанный AAV-вектор содержит экзогенную последовательность, которая кодирует химерный антигенный рецептор, прежде всего анти-CD19 CAR, анти-CD22 CAR, анти-CD123 CAR, анти-CS1 CAR, анти-CCL1 CAR, анти-HSP70 CAR, анти-GD3 CAR или анти-ROR1 CAR.
Таким образом, изобретение относится к любым AAV-векторам, созданным для осуществления способа, указанного в настоящем описании, прежде всего векторам, которые содержат последовательность, гомологичную локусу, в который осуществляют инсерцию, локализованному в любом из эндогенных генов, ответственных за Т-клеточную активацию, которые указаны в таблице 4.
В соответствии с доктриной настоящего изобретения можно применять также многие другие векторы, известные в данной области, такие как плазмиды, эписомальный векторы, линейные ДНК-матрицы и т.д.
Как указано выше, ДНК-вектор, применяемый согласно изобретению, предпочтительно содержит: (1) указанную экзогенную нуклеиновую кислоту, которая содержит экзогенную кодирующую последовательность, подлежащую инсерции путем гомологичной рекомбинации, и (2) последовательность, которая кодирует специфический для последовательности реагент, представляющий собой эндонуклеазу, который способствует указанной инсерции. Согласно более предпочтительному объекту изобретения указанная в подпункте (1) экзогенная нуклеиновая кислота не содержит никакой промоторной последовательности, в то время как последовательность, указанная в подпункте (2), имеет собственный промотор. Согласно еще более предпочтительному объекту изобретения указанная в подпункте (1) нуклеиновая кислота содержит участок внутренней посадки рибосомы (IRES) или «саморасщепляющиеся» 2А-пептиды, такие как Т2А, Р2А, Е2А или F2A, в результате чего эндогенный ген, в которой встраивают экзогенную кодирующую последовательность, становится полицистронным. IRES 2А-пептида может располагаться до или после указанной экзогенной кодирующей последовательности.
Согласно настоящему изобретению предпочтительными векторами являются векторы, полученные из AAV6, которые содержат донорские полинуклеотиды, указанные выше в настоящем описании или проиллюстрированные в экспериментальном разделе и на чертежах. Примеры векторов, предлагаемых в изобретении, содержат или состоят из полинуклеотидов, обладающих идентичностью с последовательностями SEQ ID NO: 37 (матрица для интеграции последовательности, кодирующей IL-15, в локус CD25), SEQ ID NO: 38 (матрица для интеграции последовательности, кодирующей IL-15, в локус PD1), SEQ ID NO: 39 (матрица для интеграции последовательности, кодирующей IL-12, в локус CD25) и SEQ ID NO: 40 (матрица для интеграции последовательности, кодирующей IL-12, в локус PD1).
Таргетная интеграция гена в иммунные клетки под транскрипционным контролем эндогенных промоторов
Согласно одному из основных объектов настоящее изобретение основано на преимуществе эндогенной транскрипционной активности иммунных клеток для экспрессии экзогенных последовательностей, которые повышают их терапевтический потенциал.
В изобретении предложено несколько вариантов, основанных на профиле транскрипционной активности эндогенных промоторов и на выборе промоторных локусов, которые можно применять для осуществления изобретения. Предпочтительными являются локусы, транскрипционная активность которых, как правило, является высокой при активации иммунных клеток, прежде всего в ответ на активацию CAR (чувствительные к CAR промоторы), когда клетки наделены CAR.
Таким образом, в изобретении предложен способ получения аллогенных терапевтических иммунных клеток путем экспрессии первой экзогенной последовательности, кодирующей CAR в TCR-локусе, что нарушает экспрессию TCR, и экспрессии второй экзогенной кодирующей последовательности под транскрипционной активностью эндогенного локуса, предпочтительно зависящей от любой из таких причин как:
- CD3/CD28-активация, например, с использованием Dynabeads, что можно применять, например, для стимуляции клеточной экспансии;
- CAR-активация, например, через путь CD3дзета, что можно использовать, например, для активации функций иммунных клеток на мишени;
- транскрипционная активность, связанная с проявлением симптома болезни или молекулярного маркера, что можно использовать, например, для активации клеток in-situ в больных органах;
- дифференцировка клеток, которую можно использовать для придания терапевтической активности клеткам на данном уровне дифференцировки или для экспрессии белка в конкретной линии дифференцировки (см. фиг. 1), например, в момент времени, когда гематопоэтические клетки приобретают их иммунные функции; и/или
- ТМЕ (микроокружение опухоли), которое можно использовать для перенаправления активности клеток и их амплификации в специфических для опухоли условиях (гипоксия, низкий уровень глюкозы и т.д.) или для предотвращения истощения, и/или для поддержания активации;
- CRS (синдром выброса цитокинов), который можно использовать для уменьшения нежелательных явлений связанной с активностью CAR Т-клеток.
При создании изобретения впервые был создан перечень эндогенных генов (таблица 6), для которых установлена возможность их применения для рекомбинации таргентного гена в соответствии с настоящим изобретении. Для создания этого перечня было изучено несколько баз данных транскриптомов мышей, в частности, полученных в рамках международного проекта по расшифровке генома иммунных клеток мышей (Immunological Genome Project Consortium), которые описаны у Best J.А. и др., "Transcriptional insights into the CD8(+) T cell response to infection and memory T cell formation", Nat. Immunol. 14(4), 2013, cc. 404-142, что позволило сравнивать уровни транскрипции различных генов при Т-клеточной активации в ответ на обработку антигенами овальбумина. Кроме того, поскольку доступно очень мало данных касательно активации человеческих Т-клеток, при создании изобретения были сделаны некоторые экстраполяции и проведен анализ этих данных и сравнение с ситуацией у человека путем изучения доступной литературы, касающейся генов человека. Отобранные локусы являются особенно релевантными для инсерции последовательностей, кодирующих CAR. Основываясь на первом этапе отбора, результаты которого представлены в таблице 6, при создании изобретения были проведены последующие отборы генов на основе их предполагаемых профилей экспрессии (таблицы 7-10).
С другой стороны, при создании изобретения в результате отбора идентифицированы транскрипционные локусы, которые являются наиболее неактивными, которые могут быть наиболее приемлемыми для инсерции кассет(ы) инсерции для экспрессии экзогенной кодирующей последовательности под транскрипционным контролем экзогенных промоторов. Эти локусы обозначают как «локусы-безопасные гавани», поскольку они являются наиболее неактивными в отношении транскрипции, прежде всего в процессе Т-клеточной активации. Их можно применять для интеграции кодирующей последовательности путем снижения до максимума риска вмешательства в экспрессию генома иммунных клеток.
Таргетная инсерция гена под контролем эндогенных промоторов, которые являются стабильно активными в процессе активации иммунных клеток
Отобранные локусы эндогенных генов, связанных с указанным вариантом осуществления изобретения, перечислены в таблице 7.
Таким образом, в настоящем изобретении предложен способ, включающий стадию, на которой осуществляют таргетную инсерцию гена под контролем эндогенного промотора, который является постоянно активным в процессе активации иммунных клеток, предпочтительно из эндогенного гена, выбранного из CD3G, Rn28s1, Rn18s, Rn7sk, Actg1, β2m, Rpl18a, Pabpc1, Gapdh, Rpl17, Rpl19, Rplp0, Cfl1 и Pfn1.
Под «стабильной активностью» подразумевается, что на транскрипционную активность, обнаруженную у этих промоторов в первичной иммунной клетке, не влияет отрицательная (понижающая) регуляция при активации иммунной клетки.
Как уже известно (Acuto, О. "Tailoring T-cell receptor signals by proximal negative feedback mechanisms". Nature Reviews Immunology 8, 2008, cc. 699-712), промоторы, присутствующие в локусе TCR, подвергаются различным механизмам отрицательной обратной связи при контакте с TCR и поэтому могут не быть стабильно активными или подвергаться повышающей регуляции при осуществлении способа, предлагаемого в настоящем изобретении. Одной из задач, положенных в основу настоящего изобретения, является избегание применения локуса TCR в качестве возможного сайта инсерции для экзогенных кодирующих последовательностей, которые должны экспрессироваться в процессе Т-клеточной активации. Таким образом, согласно одному из объектов изобретения таргентную инсерцию экзогенной кодирующей последовательности не осуществляют в локус гена TCRaльфa или TCRбета.
Примеры экзогенной кодирующей последовательности, которую целесообразно интродуцировать в указанные локусы под контролем стабильно активных эндогенных промоторов, являются последовательности, кодирующие или позитивно регулирующие производство цитокина, хемокинового рецептора, молекулы, придающей устойчивость к лекарственному средству, костимуляторного лиганда, такого как 4-1BRL и OX40L, или секретируемого антитела.
Интеграция гена под контролем эндогенных промоторов, которые зависят от активации иммунных клеток или зависят от активации CAR
Как указано выше, способ, предлагаемый в настоящем изобретении, включает стадию, на которой осуществляют таргетную инсерцию гена под контролем эндогенного промотора, транскрипционная активность которого предпочтительно подвергается повышающей регуляции при активации иммунных клеток, либо кратковременно, либо в течение более 10 дней.
Под «активацией иммунной клетки» подразумевают иммунный ответ согласно механизмам, которые описаны в целом и являются общепринятыми согласно литературным сведениям для данного типа иммунных клеток. Касательно, например, Т-клетки, Т-клеточная активация, как правило, характеризуется одним из изменений, включающих экспрессию на клеточной поверхности в результате производства ими различных белков, включая CD69, CD71 и CD25 (который является также маркером Treg-клеток) и HLA-DR (маркер активации человеческих Т-клеток), высвобождение перфорина, гранзимов и гранулизина (дегрануляция), или производство цитокиновых эффекторов IFN-γ, TNF и LT-альфа.
Согласно предпочтительному варианту осуществления изобретения транскрипционная активность эндогенного гена подвергается повышающей регуляции в иммунной клетке, прежде всего в ответ на активацию с помощью CAR. CAR может независимо экспрессироваться в иммунной клетке. Под понятием «независимо экспрессируется» подразумевают, что CAR может транскрибироваться в иммунной клетке из экзогенной кассеты экспрессии, интродуцированной, например, с использованием ретровирусного вектора, такого как лентивирусный вектор, или с помощью трансфекции путем электропорации кэпированными РНК, кодирующими указанный CAR. В данной области известно много методов экспрессии CAR в иммунной клетке, которые описаны, например, в приведенных в качестве ссылок источников (REF).
Указанный эндогенный ген, транскрипционная активность которого подвергается повышающей регуляции, является наиболее пригодным для интеграции экзогенных последовательностей для кодирования цитокина(ов), таких как IL-12 и IL-15, иммуногенного(ых) пептида(ов) или секретируемого антитела, такого как антитело к IDO1, к IL10, к PD1, к PDL1, к IL6 или к PGE2.
Согласно предпочтительному варианту осуществления изобретения эндогенный промотор выбирают на основе того, что его транскрипционная активность является чувствительной и более предпочтительной зависимой от активации CAR.
Как продемонстрировано в настоящем описании, CD69, CD25 и PD1 представляют собой локусы, наиболее пригодные для инсерции экспрессии экзогенных кодирующих последовательностей, которые должны экспрессироваться, когда иммунные клетки становятся активированными, прежде всего в CAR-позитивные иммунные клетки.
Таким образом, в настоящем изобретении объединены любые способы экспрессии CAR в иммунной клетке со стадией осуществления сайтнаправленной инсерции экзогенной кодирующей последовательности в локус, транскрипционная активность которого является чувствительной или зависит от контакта указанного CAR с опухолевым антигеном. Прежде всего, способ включает стадию интродукции в CAR-позитивную или рекомбинантную TCR-позитивную иммунную клетку экзогенной последовательности, кодирующей IL-12 или IL-15 под транскрипционным контролем одного промотора, выбранного из промоторов PD1, CD25 и CD69.
В частности, CAR-позитивные клетки можно получать, осуществляя стадии совместной экспрессии в иммунной клетке, предпочтительно первичной клетке и более предпочтительно в первичной Т-клетке, по меньшей мере одной экзогенной последовательности, кодирующей CAR, и другой экзогенной последовательности, помещенной по контроль эндогенного промотора, транскрипционная активность которого зависит от указанного CAR, такого как промотор PD1, CD25 или CD71.
Выражение «зависит от указанного CAR» означает, что транскрипционная активность указанного эндогенного промотора обязательно повышается более чем на 10%, предпочтительно более чем на 20%, более предпочтительно более чем на 50% и еще более предпочтительно более чем на 80% в результате контакта CAR с его когнатным антигеном в ситуации, когда, как правило, количество антигенов превышает количество CAR, которые присутствуют на клеточной поверхности, и количество CAR, которые экспрессируются на клеточной поверхности, составляет более чем 10 молекул на клетку, предпочтительно более чем 100 и более предпочтительно более чем 1000 молекул на клетку.
Таким образом, согласно настоящему изобретению экспрессия последовательности CAR, предпочтительно встроенной в локус TCR, представляет собой конститутивную экспрессию, в то время как другая экзогенная последовательность, интегрированная в другой локус, совместно экспрессируется в ответ или в зависимости от контакта указанного CAR с его когнатным антигеном. Указанный другой локус представляет собой, например, локус CD25, PD1 или CD71 или любые локусы, специфически транскрибируемые при активации CAR.
Другим словами, в изобретении предложено осуществление совместной экспрессии CAR и по меньшей мере одной экзогенной кодирующей последовательности, при этом экспрессия указанной экзогенной последовательности находится под контролем эндогенного промотора, на транскрипционную активность которого влияет активность CAR, для получения сконструированных иммунных клеток, характеризующихся улучшенным иммунным ответом.
Как описано ранее, это можно осуществлять путем трансфекции клеток специфическими для последовательности реагентами, представляющими собой нуклеазы, мишенями которых являются кодирующие области указанных локусов, специфически зависящие от CAR, наряду с донорскими матрицами, содержащими последовательности, гомологичные указанным геномным областям. Специфические для последовательности реагенты, представляющие собой нуклеазы, помогают донорским матрицам интегрироваться путем гомологичной рекомбинации или NHEJ.
Согласно предпочтительному варианту осуществления изобретения экзогенную кодирующую последовательность интегрируют в рамке считывания с эндогенным геном, так, чтобы сохранять экспрессию указанного эндогенного гена. Это имеет место в случае, например, CD25 и CD69, что продемонстрировано в одном из примеров в экспериментальном разделе настоящего описания.
Согласно предпочтительному варианту осуществления изобретения экзогенная последовательность разрушает эндогенную кодирующую последовательность гена, предотвращая экспрессию одной эндогенной кодирующей последовательности, прежде всего, когда указанная экспрессия оказывает негативное воздействие на функции иммунных клеток, что имеет место в случае, например, PD1, что продемонстрировано в экспериментальном разделе в настоящем описании.
Согласно еще более предпочтительным вариантам осуществления экзогенную кодирующую последовательность, которая разрушает эндогенную генную последовательность, помещают в рамку считывания с эндогенным промотором, так, чтобы сделать ее экспрессию зависящей от эндогенного промотора, что также продемонстрировано в экспериментальном разделе.
Настоящее изобретение относится также к полинуклеотидным и полипептидным последовательностям, которые кодируют различные TAL-нуклеазы, примеры которых представлены в настоящем описании, прежде всего те, которые обеспечивают сайтнаправленную инсерцию в локус CD25 (SEQ ID NO: 18 и 19), а также к последовательностям соответствующей им мишени и к RVD-последовательностям.
В настоящем изобретении предложены также наборы для трансфекции иммунных клеток, которые содержат полинуклеотиды, кодирующие специфические для последовательности реагенты, представляющие собой эндонуклеазы, донорские последовательности, созданные для интеграции экзогенной последовательности в локус, являющийся мишенью указанных реагентов. Примерами указанных наборов являются набор, содержащий мРНК, которая кодирует редко расщепляющую эндонуклеазу, таргетирующую локус PD1 (например, PD1 TALEN®), и AAV-вектор, содержащий экзогенную последовательность, кодирующую IL-12, набор, содержащий мРНК, которая кодирует редко расщепляющую эндонуклеазу, таргетирующую локус PD1 (например, PD1 TALEN®), и AAV-вектор, содержащий экзогенную последовательность, кодирующую IL-15, набор, содержащий мРНК, которая кодирует редко расщепляющую эндонуклеазу, таргетирующую локус CD25 (например, CD25 TALEN®), и AAV-вектор, содержащий экзогенную последовательность, кодирующую IL-12, набор, содержащий мРНК, которая кодирует редко расщепляющую эндонуклеазу, таргетирующую локус CD25 (например, CD25 TALEN®), и AAV-вектор, содержащий экзогенную последовательность, кодирующую IL-15, набор, содержащий мРНК, которая кодирует редко расщепляющую эндонуклеазу, таргетирующую локус PD1 (например, PD1 TALEN®), и AAV-вектор, содержащий экзогенную последовательность, кодирующую растворимый gp130, набор, содержащий мРНК, которая кодирует редко расщепляющую эндонуклеазу, таргетирующую локус CD25 (например, CD25 TALEN®), и AAV-вектор, содержащий экзогенную последовательность, кодирующую растворимый gp130, и любые наборы, включающие реагенты, представляющие собой эндонуклеазы, таргетирующие гены, перечисленные в таблице 6, и донорскую матрицу для интродукции кодирующей последовательности, указанной в настоящем описании.
Согласно одному из объектов изобретения эндогенные ген выбирают по признаку слабой повышающей регуляции. Экзогенная кодирующая последовательность, интродуцированная в указанный эндогенный ген, для транскрипционной активности которого характерна слабая повышающая регуляция, может предпочтительно состоять из ингибирующего CAR или индуцирующего апоптоз CAR, уровень экспрессии которого, как правило, остается более низким по сравнению с позитивным CAR. Указанная комбинация экспрессии CAR, например, одна из которых трансдуцируется вирусным вектором, а другая интродуцируется согласно изобретению, может значительно повышать специфичность или безопасность несущих CAR иммунных клеток.
Для некоторых эндогенных промоторов характерна кратковременная повышающая регуляция, иногда в течение менее 12 ч при активации иммунных клеток, таких как выбранные их локусов эндогенных генов Spata6, Itga6, Rcbtb2, Cd1d1, St8sia4, Itgae и Fam214a (таблица 8). Для других эндогенных промоторов характерна повышающая регуляция, иногда в течение менее 24 ч при активации иммунных клеток, таких как выбранные их локусов эндогенных генов IL3, IL2, Ccl4, IL21, Gp49a, Nr4a3, Lilrb4, Cd200, Cdkn1a, Gzmc, Nr4a2, Cish, Ccr8, Lad1 и Crabp2 (таблица 9), а для других более 24 ч, в целом, более 10 дней при активации иммунных клеток. Указанные промоторы представляют собой выбранные из Gzmb, Tbx21, Plek, Chek1, Slamf7, Zbtb32, Tigit, Lag3, Gzma, Wee1, IL12rb2, Eea1 и Dtl (таблица 9).
Альтернативно этому, при создании изобретения было обнаружено, что эндогенный ген под транскрипционным контролем промоторов, для которых характерна понижающая регуляция при активации иммунных клеток, может также представлять собой интерес для применения в способе, предлагаемом в настоящем изобретении. Так, при создании изобретения установлено, что экзогенные кодирующие последовательности, которые кодируют антиапоптозные факторы, такие как относящиеся к семейству Вс12, а также Bc1XL, NF-kB, сурвивин, а также анти-FAP (фибробласт-активирующий белок), такой как компонент CAR анти-FAP, можно интродуцировать в указанные локусы. Указанный эндогенный ген под транскрипционным контролем промоторов, для которых характерна понижающая регуляция при активации иммунных клеток, более конкретно можно выбирать из Slc6a19, Cd55, Xkrx, Mturn, H2-Ob, Cnr2, Itgae, Raver2, Zbtb20, Arrb1, Abca1, Tet1, Slc16a5 и Ampd3 (таблица 10).
Интеграция гена под контролем эндогенных промоторов, активируемых в условиях микроокружения опухолей (ТМЕ)
Одним и объектов настоящего изобретения более конкретно являются способы предотвращения истощения иммунных клеток в условиях микроокружения опухолей (ТМЕ). Часто истощение иммунных клеток происходит в ответ на истощение питательных веществ или молекулярных сигналов, присутствующих в микроокружении опухолей, что способствует устойчивости опухолей. Способ включает стадии конструирования иммунных клеток путем интеграции экзогенных кодирующих последовательностей под контролем эндогенных промоторов, для которых характерна повышающая регуляция при депривации аргинина, цистеина, триптофана и кислорода, а также внеклеточного ацидоза (накопление лактата).
Указанные экзогенные последовательности могут кодировать химерные антигенные рецепторы, интерлейкины или любой полипептид, указанный в любом месте в настоящем описании для усиления функции или активации иммунных клеток и/или для придания им терапевтического преимущества.
В изобретении перечислен ряд локусов, для которых обнаружена повышающая регуляция в большом количестве истощающих инфильтрующих опухоль лимфоцитах (TIL), и они перечислены в таблицах 12 и 13. В изобретении предложена стадия интеграции экзогенных кодирующих последовательностей в указанные предпочтительные локусы для предотвращения истощения иммунных клеток, в частности, Т-клеток, в микроокружении опухолей.
Например, экзогенные последовательности, кодирующие CAR, можно помещать под транскрипционный контроль промотора эндогенных генов, которые активируются микроокружением опухолей, таких как HIF1a, т.е. транскрипционный фактор, индуцируемый гипоксией, или арилуглеводородный рецептор (AhR). Эти гены представляют собой сенсорные гены, индуцируемые соответственно гипоксией и ксенобиотиками в близком окружении опухолей.
Таким образом, настоящее изобретение можно применять для улучшения терапевтического результата терапий на основе CAR Т-клеток путем интеграции экзогенных кодирующих последовательностей и более конкретно генетических атрибутов (признаков)/цепей (схем) под контролем эндогенных Т-клеточных промоторов, на которые влияет микроокружение опухолей (ТМЕ).
Согласно изобретению повышающую регуляцию эндогенных генов можно «заимствовать» для повторной экспрессии релевантных экзогенных кодирующих последовательностей с целью повышения противоопухолевой активности CAR Т-клеток в микроокружении определенных опухолей.
Инсерция и экспрессия таргетного гена в гематопоэтических стволовых клетках (HSC)
Более конкретно, одним из объектов настоящего изобретения является инсерция трансгенов в гематопоэтические стволовые клетки (HSC).
Гематопоэтические стволовые клетки (HSC) представляют собой мультипотентные, самообновляющиеся клетки-предшественники, из которых образуются все типы дифференцированных клеток крови в процессе гематопоэза. Указанные клетки включают лимфоциты, гранулоциты и макрофаги иммунной системы, а также циркулирующие эритроциты и тромбоциты. В классическом варианте считается, что HSC дифференцируются в две ограниченные линии дифференцировки лимфоидные и миелоэритроидные олигопотентные клетки-предшественники. Считается, что на механизмы, контролирующие самообновление и дифференцировку HSC, влияет различный набор цитокинов, хемокинов, рецепторов и молекул внутриклеточной передачи сигналов. Дифференцировка HSC частично регулируется факторами роста и цитокинами, включая колониесимулирующие факторы (CSF) и интерлейкины (IL), которые активируют пути внутриклеточной передачи сигналов. Известно, что указанные ниже факторы влияют на мультипотентность, пролиферацию и специфичность линии дифференцировки HSC. HSC и их дифференцированное потомство можно идентифицировать по экспрессии специфических для линии дифференцировки маркеров клеточной поверхности, таких как белки кластера дифференцировки (CD) и цитокиновые рецепторы в гематопоэтических стволовых клетках.
Генная терапия с использованием HSC имеет огромный потенциал для лечения болезней гематопоэтической системы, включая иммунные заболевания. При осуществлении указанного подхода HSC получают из пациента, подвергают генной модификации ex vivo с использованием интеграции ретровирусных векторов и затем инфузируют пациенту. К настоящему времени ретровирусные векторы представляли собой единственную эффективную систему доставки генов при осуществлении генной терапии с использованием HSC. При этом доставка генов в HSC с использованием интегрирующих векторов обеспечивает эффективное введение в полученные из HSC зрелые гематопоэтические клетки. Однако генномодифицированные клетки, которые инфузируют пациенту, представляют собой поликлональную популяцию, при применении которой в различные клетки интегрированы провирусные векторы в различные хромосомные положения, что может приводить ко многим нежелательным мутациям, которые могут амплифицироваться в результате некоторых связанных с пролиферацией/выживаемостью преимуществ указанных мутаций (Powers и Trobridge, "Identification of Hematopoietic Stem Cell Engraftment Genes in Gene Therapy Studies", J Stem Cell Res Ther S3:004. doi:10.4172/2157-7633.S3-00, 2013).
HSC, как правило, собирают из периферической крови после мобилизации (пациенты получают рекомбинантный человеческий гранулоцитарный колониесимулирующий фактор (G-CSF)). Периферическую кровь пациента собирают и обогащают HSC с использованием CD34+-маркера. Затем HSC культивируют ex vivo и обрабатывают вирусными векторами. Период культивирования ex vivo варьируется от 1 до 4 дней. Перед инфузией генномодифицированных HSC пациентов можно обрабатывать химиотерапевтическими агентами или облучением для повышения эффективности приживления. Генномодифицированные HSC повторно инфузируют пациенту внутривенно. Клетки мигрируют в костный мозг перед их окончательным внедрением в синусоиды и периваскулярную ткань. Хоминг и гематопоэз оба являются составными частями приживления. Клетки, достигшие ниши стволовых клеток посредством хоминга, должны начинать продуцировать зрелые миелоидные и лимфоидные клетки из каждой линии дифференцировки крови. Гематопоэз продолжается в результате действия долгоживущих HSC, которые обладают способностью к самообновлению в течение долгоживущего поколения зрелых кровяных клеток пациента, в частности, производства общих лимфоидных клеток-предшественников, таких как Т-клетки и NK-клетки, которые являются иммунными клетками, имеющими решающее значение для элиминации зараженных и злокачественных клеток.
В настоящем изобретении предложено осуществление таргетной инсерции гена в HSC для интродукции экзогенных кодирующих последовательностей под контролем эндогенных промоторов, прежде всего эндогенных промоторов генов, которые специфически активируются в клетках конкретной гематопоэтической линии дифференцировки или на конкретной стадии дифференцировки, предпочтительно на поздней стадии дифференцировки. HSC можно трансдуцировать полинуклеотидным вектором (донорская матрица), таким как AAV-вектор, в процессе обработки ex vivo, что описано в предыдущем параграфе, при этом экспрессируют специфический для последовательности реагент, представляющий собой нуклеазу, для облегчения инсерции кодирующих последовательностей в выбранный локус. Полученные в результате сконструированные HSC затем можно трансплантировать пациенту, нуждающемуся в этом, для долговременного производства in vivo сконструированных иммунных клеток, которые должны содержать указанные экзогенные кодирующие последовательности. В зависимости от активности выбранного эндогенного промотора кодирующие последовательности могут избирательно экспрессироваться в определенных линиях дифференцировки или в ответ на местное окружение иммунных клеток in vivo, осуществляя тем самым адаптивную иммунотерапию.
Согласно одному из предпочтительных объектов изобретения экзогенные кодирующие последовательности помещают под контроль промоторов генов, транскрипционная активность которых специфически индуцируется в общих лимфоидных клетках-предшественниках, таких как CD34, CD43, Flt-3/Flk-2, IL-7R альфа/CD127 и неприлизин /CD10.
Более предпочтительно экзогенные кодирующие последовательности помещают под контроль промоторов генов, транскрипционная активность которых специфически индуцируется в NK-клетках, таких как CD161, CD229/SLAMF3, CD96, DNAM-1/CD226, Fc гаммаRII/CD32, Fc гамма RII/RIII (CD32/CD16), Fc гамма RIII (CD16), IL-2 R бета, интегрин альфа 2/CD49b, KIR/CD158, NCAM-1/CD56, NKG2A/CD159a, NKG2C/CD159c, NKG2D/CD314, NKp30/NCR3, NKp44/NCR2, NKp46/NCR1, NKp80/KLRF1, сиглек-7/CD328 и TIGIT, или индуцируется в Т-клетках, таких как CCR7, CD2, CD3, CD4, CD8, CD28, CD45, CD96, CD229/SLAMF3, DNAM-1/CD226, CD25/IL-2 R альфа, L-селектин/CD62b и TIGIT.
В изобретении предложена в качестве предпочтительного объекта интродукция экзогенной последовательности, кодирующей CAR или его компонент, в HSC, предпочтительно под транскрипционным контролем промотора гена, который не экспрессируется в HSC, более предпочтительно гена, который экспрессируется только в гематопоэтических клетках, продуцируемых указанной HSC, и еще более предпочтительно гена, который экспрпессируется только в Т-клетках или NK-клетках.
Кондиционная экспрессия CAR в HSC для преодоления (гемато)-тимусного барьера
Конкретным объектом настоящего изобретения является получение in vivo с применением описанных выше сконструированных HSC гематопоэтических иммунных клеток, таких как Т-клетки или NK-клетки, которые экспрессируют экзогенные кодирующие последовательности, в частности, CAR или его компонент.
Одним из основных препятствий для получения гематопоэтических CAR-позитивных клеток с помощью сконструированных HSC является, например, отторжение CAR-позитивных клеток самой иммунной системой, прежде всего тимусом.
Гемато-тимусный барьер регулирует обмен субстанций между кровеносной системой и тимусом, что обеспечивает изолированное (секвестрированное) окружение для развития незрелых Т-клеток. Барьер также препятствует контакту незрелых Т-клеток с чужеродными антигенами (поскольку контакт с антигенами на этой стадии может приводить к гибели Т-клеток в результате апоптоза).
Одним из решений, предложенных в настоящем изобретении, является помещение последовательностей, которые кодируют компоненты CAR в HSC, под транскрипционный контроль промоторов, которые не транскрибируются в значительной степени в гематопоэтических клетках, когда они проходят через тимусный барьер. Одним из примеров гена, который обеспечивает кондиционную экспрессию CAR в гематопоэтических клетках с пониженной или с незначимой транскрипционной активностью в тимусе, является LCK (Uniprot: Р06239).
Согласно предпочтительному объекту изобретения экзогенную последовательность, кодирующую CAR или его компонент, интродуцируют в HSC под транскрипционным контролем гена, для которого известно, что он специфически экспрессируется в Т-клетках или NK-клетках, предпочтительно только в указанных типах клеток.
Таким образом, в изобретении предложен способ получения HSC, которые содержат экзогенные кодирующие последовательности, которые должны экспрессироваться исключительно в выбранной(ых) гематопоэтической(их) линии(ях) дифференцировки, указанные кодирующие последовательности кодируют по меньшей мере один компонент CAR или антиген для стимуляции иммунной системы.
В более широком смысле в изобретении предложен способ конструирования HSC путем таргетной инсерции в геном экзогенных кодирующих последовательностей, которые должны селективно экспрессироваться в гематопоэтических клетках, продуцируемых указанными HSC. В качестве предпочтительного варианта осуществления изобретения указанные гематопоэтические клетки, продуцируемые указанными сконструированными HSC, экспрессируют указанные экзогенные кодирующие последовательности в ответ на определенные факторы окружающей среды или стимулы in vivo для повышения их терапевтического потенциала.
Объединение таргетной(ых) инсерции(ий) последовательности в иммунные клетки с инактивацией эндогенных геномных последовательностей
Одной из конкретных целей настоящего изобретения является осуществление инактивации гена в первичных иммунных клетках в локусе путем интеграции экзогенной кодирующей последовательности в указанный локус, экспрессия которой повышает терапевтический потенциал указанных сконструированных клеток. Примеры релевантных экзогенных кодирующих последовательностей, которые можно встраивать согласно изобретению, представлены выше в сочетании с их положительными воздействиями на терапевтический потенциал клеток. Ниже в настоящем описании представлены эндогенные гены, которые предпочтительно таргетируются путем таргетной инсерции гена, и преимущества, ассоциированные с их инактивацией.
Согласно предпочтительному объекту изобретения действие инсерции кодирующей последовательности состоит в снижении или предотвращении экспрессии генов, участвующих в распознавании «своего» и «чужого», для уменьшения реакции трансплантат-против-хозяина (GVHD) или иммунного отторжения аллогенных клеток у пациента-реципиента. Например, один или специфических для последовательности реагентов, применяемых в способе, может уменьшать или предотвращать экспрессию TCR в первичных Т-клетках, например, генов, кодирующих TCR-альфа или TCR-бета.
В качестве другого предпочтительно объекта изобретения одной стадией редактирования гена является снижение или предотвращение экспрессии белка β2m и/или другого белка, участвующего в его регуляции, такого как С2ТА (Uniprot Р33076), или в распознавании ГКГС, такого как белки HLA. Это обеспечивает меньшую аллореактивность сконструированных иммунных клеток при их инфузии пациентам.
Под «аллогенным терапевтическим применением» подразумевают, что клетки, полученные из донора, подлежат инфузии пациентам с другим гаплотипом. Фактически в настоящем изобретении предложен эффективный способ получения первичных клеток, у которых может быть отредактирован геном в различных генных локусах, участвующих во взаимодействии и в распознавании трансплантат-хозяин.
Другие локусы могут также быть отредактированы для повышения активности, персистенции терапевтической активности сконструированных первичных клеток, что более подробно описано ниже:
Инактивация рецепторов контрольных точек и ингибирующих путей иммунных клеток:
Согласно предпочтительному объекту изобретения встроенная экзогенная кодирующая последовательность обладает способностью снижать или предотвращать экспрессию белка, который участвует в ингибирующих путях иммунных клеток, которые, в частности, обозначены в литературе как «иммунная контрольная точка» (Pardoll D.M. The blockade of immune checkpoints in cancer immunotherapy, Nature Reviews Cancer, 12, 2012, cc. 252-264). В контексте настоящего изобретения выражение «ингибирующие пути иммунных клеток» относится к любой экспрессии генов в иммунных клетках, которая приводит к снижению цитотоксической активности лимфоцитов в отношении злокачественных или инфицированных клеток. Это может, например, относиться к гену, участвующему в экспрессии FOXP3, который, как известно, увеличивает активность Treg в отношении Т-клеток (уменьшение Т-клеточной активности).
«Иммунные контрольные точки» представляют собой молекулы в иммунной системе, которые либо повышают сигнал (костимуляторные молекулы), либо понижают сигнал активации иммунной клетки. Согласно настоящему изобретению иммунные контрольные точки более предпочтительно означают поверхностные белки, участвующие во взаимодействиях лиганд-рецептор между Т-клетками и антигенпрезентирующими клетками (АРС), которые регулируют Т-клеточный ответ на антиген (обусловленный комплексами пептид- молекула главного комплекса гистосовместимости (ГКГС), которые распознаются Т-клеточным рецептором (TCR)). Указанные взаимодействия могут происходить при инициации Т-клеточных ответов в лимфатических узлах (в которые основными АРС являются дендритные клетки) или в периферических тканях или опухолях (в которых регулируют эффекторные ответы). Одним из важных семейств связанных с мембраной лигандов, которые связаны как с костимуляторными, так и с ингибирующими рецепторами, является семейство В7. Все члены семейства В7 и их известные лиганды принадлежат к суперсемейству иммуноглобулинов. Многие рецепторы в последние время идентифицированные как члены семейства В7, еще не полностью изучены. Члены семейства фактора некроза опухоли (TNF), которые связываются с когнатными молекулами семейства TNF-рецептора, представляют собой второе семейство регуляторных пар лиганд-рецептор. Указанные рецепторы главным образом испускают костимуляторные сигналы при контакте с их когнатными лигандами. Другая основная категория сигналов, которые регулируют активацию Т-клеток, исходит от растворимого цитокина в микроокружении. В других случаях активированные Т-клетки осуществляют повышающую регуляцию лигандов, таких как CD40L, которые задействуют когнатные рецепторы на АРС, например, A2aR, аденозиновый А2а-рецептор; B7RP1, В7-связанный белок 1; BTLA, аттенюатор В- и Т-лимфоцитов; GAL9, галектин 9; HVEM, медиатор проникновения вируса герпеса; ICOS, индуцибельный Т-клеточный костимулятор; IL, интерлейкин; KIR, иммуноглобулинподобный рецептор клеток-киллеров; LAG3, ген активации лимфоцитов 3; PD1, лиганд (белок) запрограммированной гибели клеток 1; PDL, PD1-лиганд; TGFβ, трансформирующий рост фактор-β; TIM3, Т-клеточный мембранный белок 3.
Примеры дополнительных эндогенных генов, экспрессию которых можно понижать или подавлять для повышения активации в сконструированных иммунных клетках, предлагаемых в настоящем изобретении, перечислены в таблице 3.
Например, встроенная(ые) экзогенная(ые) кодирующая(ие) последовательность(и) может(гут) обладать способностью снижать или предотвращать экспрессию в сконструированной иммунной клетке по меньшей мере одного белка, выбранного из PD1 (Uniprot Q15116), CTLA4 (Uniprot Р16410), РРР2СА (Uniprot Р67775), РРР2СВ (Uniprot Р62714), PTPN6 (Uniprot P29350), PTPN22 (Uniprot Q9Y2R2), LAG3 (Uniprot PI8627), HAVCR2 (Uniprot Q8TDQ0), BTLA (Uniprot Q7Z6A9), CD160 (Uniprot O95971), TIGIT (Uniprot Q495A1), CD96 (Uniprot P40200), CRTAM (Uniprot 095727), LAIR1 (Uniprot Q6GTX8), SIGLEC7 (Uniprot Q9Y286), SIGLEC9 (Uniprot Q9Y336), CD244 (Uniprot Q9BZW8), TNFRSF10B (Uniprot O14763), TNFRSF10A (Uniprot O00220), CASP8 (Uniprot Q14790), CASP10 (Uniprot Q92851), CASP3 (Uniprot P42574), CASP6 (Uniprot P55212), CASP7 (Uniprot P55210), FADD (Uniprot Q13158), FAS (Uniprot P25445), TGFBRII (Uniprot P37173), TGFRBRI (Uniprot Q15582), SMAD2 (Uniprot Q15796), SMAD3 (Uniprot P84022), SMAD4 (Uniprot Q13485), SMAD10 (Uniprot B7ZSB5), SKI (Uniprot P12755), SKIL (Uniprot P12757), TGIF1 (Uniprot Q15583), IL10RA (Uniprot Q13651), IL10RB (Uniprot Q08334), HMOX2 (Uniprot P30519), IL6R (Uniprot P08887), IL6ST (Uniprot P40189), EIF2AK4 (Uniprot Q9P2K8), CSK (Uniprot P41240), PAG1 (Uniprot Q9NWQ8), SIT1 (Uniprot Q9Y3P8), FOXP3 (Uniprot Q9BZS1), PRDM1 (Uniprot Q60636), BATF (Uniprot Q16520), GUCY1A2 (Uniprot P33402), GUCY1A3 (Uniprot Q02108), GUCY1B2 (Uniprot Q8BXH3) и GUCY1B3 (Uniprot Q02153). Редактирование гена, интродуцированного в гены, которые кодируют указанные выше белки, предпочтительно объединяют с инактивацией TCR в CAR Т-клетках.
Предпочтительной является инактивация PD1 и/или CTLA4 в сочетании с экспрессией неэндогеного иммуносупрессорного полипептида, такого как лиганд PD-L1 и/или CTLA-4 Ig (см. также пептиды, указанные в таблице 1 и 2).

Ингибирование супрессорных цитокинов/метаболитов
Согласно другому объекту изобретения встроенная экзогенная кодирующая последовательность обладает способностью снижать или предотвращать экспрессию генов, кодирующих или позитивно регулирующих супрессорные цитокины или метаболиты или их рецепторы, в частности TGFбета (Uniprot:P01137), TGFbR (Uniprot:P37173), IL10 (Uniprot:P22301), IL10R (Uniprot: Q13651 and/or Q08334), A2aR (Uniprot: P29274), GCN2 (Uniprot: P15442) и PRDM1 (Uniprot: O75626).
Предпочтительными являются сконструированные иммунные клетки в которых последовательностью, кодирующей IL-2, IL-12 или IL-15, заменяют последовательность по меньшей мере одного из вышеуказанных эндогенных генов.
Индукция устойчивости к химиотерапевтическим лекарственным средствам
Согласно другому варианту способа, предлагаемого в настоящем изобретении, встроенная экзогенная кодирующая последовательность обладает способностью снижать или предотвращать экспрессию гена, ответственного за чувствительность иммунных клеток к соединениям, которые применяют для стандартных вариантов лечения рака или инфекции, таким как лекарственные средства, представляющие собой пуриновые нуклеотидные аналоги (PNA) или 6-меркаптопурин (6МР) и 6-тиогуанин (6TG), которые обычно применяют в химиотерапии. Снижение или инактивация генов, участвующих в механизме действия указанных соединений (которые обозначают как «гены, повышающие чувствительность к лекарственным средствам»), повышают устойчивость к ним иммунных клеток.
Примерами генов, повышающих чувствительность к лекарственным средствам, представляют собой гены, кодирующие DCK (Uniprot Р27707), влияющие на активность PNA, такие как клофарабин и флударабин, HPRT (Uniprot Р00492), влияющие на активность пуриновых антиметаболитов, таких как 6МР и 6TG, и GGH (Uniprot Q92820), влияющие на активность антифолатных лекарственных средств, в частности метотрексата.
Это позволяет применять клетки после или в сочетании с общепринятыми противораковыми химиотерапиями.
Устойчивость к подавляющим иммунитет обработкам
Согласно другому объекту настоящего изобретения встроенная экзогенная кодирующая последовательность обладает способностью снижать или предотвращать экспрессию рецепторов или белков, представляющих собой мишени для лекарственных средств, придавая указанным клеткам устойчивость к истощающим иммунитет обработкам лекарственными средствами. Указанная мишень может представлять собой рецепторы или антигены глюкокортикоидов, при конструировании иммунных клеток, устойчивых к глюкокортикоидам или истощающим иммунитет обработкам с использованием антител, таких как алемтузумаб, который применяют для истощения CD52-позитивных иммунных клеток при многих вариантах лечения рака.
Кроме того, способ, предлагаемый в изобретении, может включать таргетную инсерцию гена в эндогенный(ые) ген(ы), кодирующий(ие) или регулирующий(ие) экспрессию CD52 (Uniprot Р31358) и/или GR (рецептор глюкокортикоидов, который обозначают также как NR3C1 - Uniprot Р04150).
Повышение активности и выживаемости CAR-позитивных иммунных клеток
Согласно другому объекту настоящего изобретения встроенная экзогенная кодирующая последовательность может обладать способностью снижать или предотвращать экспрессию поверхностного антигена, такого как BCMA, CS1 и CD38, где указанный антиген представляет собой антиген, являющийся мишенью CAR, который экспрессируется в указанных иммунных клетках.
Указанный вариант осуществления изобретения позволяет решать проблему антигенов, являющихся мишенями для CAR, которые присутствуют на поверхности инфицированных или злокачественных клеток, но также в некоторой степени экспрессируются самой иммунной клеткой.
Согласно предпочтительному варианту осуществления изобретения экзогенную последовательность, кодирующую CAR или один из его компонентов, интегрируют в ген, который кодирует антиген, являющийся мишенью указанного CAR, во избежание саморазрушения иммунных клеток.
Сконструированные иммунные клетки и популяции иммунных клеток
Настоящее изобретение относится также к разнообразным сконструированным иммунным клеткам, которые можно получать с помощью одного из описанных выше методов в выделенной форме или в качестве части популяций клеток.
Согласно предпочтительному объекту изобретения сконструированные клетки представляют собой первичные иммунные клетки, такие как NK-клетки или Т-клетки, которые, как правило, являются частью популяций клеток, которые могут включать различные типы клеток. Как правило, популяцию из пациентов или доноров выделяют путем лейкафереза из РВМС (мононуклеарные клетки периферической крови).
Согласно предпочтительному объекту изобретения более 50% иммунных клеток, входящих в указанную популяцию, представляют собой TCR-негативные Т-клетки. Согласно более предпочтительному объекту изобретения более 50% иммунных клеток, входящих в указанную популяцию, представляют собой CAR-позитивные Т-клетки.
Настоящее изобретение относится к иммунным клеткам, содержащим любые комбинации различных экзогенных кодирующих последовательностей и инактивированных генов, которые соответствующим образом и независимо описаны выше. Из этих комбинаций наиболее предпочтительными являются те, в которых объединена экспрессия CAR под транскрипционным контролем эндогенного промотора, который является стабильно активным в процессе активации иммунных клеток и предпочтительно не зависит от указанной активации, и экспрессия экзогенной последовательности, кодирующей цитокин, такой как IL-2, IL-12 или IL-15, под транскрипционным контролем промотора, для которого характерна повышающая регуляция в процессе активации иммунных клеток.
Другой предпочтительной комбинаций является инсерция экзогенной последовательности, кодирующей CAR или один из его компонентов под транскрипционным контролем индуцируемого гипоксией промотора гена фактора 1 (Uniprot: Q16665).
Изобретение относится также к фармацевтической композиции, содержащей описанную выше сконструированную первичную иммунную клетку или популяцию иммунных клеток, для лечения инфекции или рака и к способу лечения пациента, нуждающегося в этом, где указанный способ включает:
- получение популяции сконструированных первичных иммунных клеток согласно описанному выше способу изобретения;
- необязательно очистку или сортировку указанных сконструированных первичных иммунных клеток;
- активацию указанной популяции сконструированных первичных иммунных клеток при или после инфузии указанных клеток указанному пациенту.
Активация и размножение Т-клеток
Как до, так и после осуществления генетической модификации, иммунные клетки, предлагаемые в настоящем изобретении, можно активировать или размножать даже в том случае, если их активация или пролиферация не зависит от механизмов связывания с антигеном. В частности, Т-клетки можно активировать и размножать с помощью методов, описанных, например, в US 6352694; 6534055; 6905680; 6692964;5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и публикации заявки на патент США №2006/0121005. Т-клетки можно размножать in vitro или in vivo. Как правило, Т-клетки размножают путем приведения в контакт с агентом, который стимулирует комплекс CD3 TCR, и костимуляторной молекулой на поверхности Т-клеток с целью создания сигнала активации для Т-клетки. Например, для создания сигнала активации для Т-клетки можно применять химические соединения, такие как ионофор кальция А23187, форбол-12-миристат-13-ацетат (ФМА), или митогенные лектины, такие как фитогемагглютинин (ФГА).
Например (но не ограничиваясь только этим), популяции Т-клеток можно стимулировать in vitro путем приведения в контакт с антителом к CD3 или его антигенсвязывающим фрагментом, или антителом к CD2, иммобилизованным на поверхности, или путем приведения в контакт с активатором протеинкиназы С (например, бриостатином) в сочетании с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности Т-клеток используют лиганд, который связывается со вспомогательной молекулой. Например, популяцию Т-клеток можно приводить в контакт с антителом к CD3 и антителом к CD28 в условиях, обеспечивающих стимуляцию пролиферации Т-клеток. Условия, пригодные для культивирования Т-клеток, включают соответствующие среды (например, минимальную поддерживающую среду или среду RPMI 1640, или X-vivo 5, (фирма Lonza)), которые могут содержать факторы, необходимые для обеспечения пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью сыворотку или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-g, 1L-4, 1L-7, GM-CSF, -10, -2, 1L-15, TGFp и TNF, или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают (но не ограничиваясь только ими) сурфактант, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут представлять собой RPMI 1640, A1M-V, DMEM, MEM, а-МЕМ, F-12, X-Vivo 1 и X-Vivo 20, Optimizer, содержащие в качестве добавок аминокислоты, пируват натрия и витамины, они могут быть бессывороточными или могут содержать в качестве добавок в определенном количестве сыворотку (или плазму) или определенный набор гормонов, и/или цитокин(ы) в количестве, достаточном для роста и размножения Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые предназначены для введения путем инфузии индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, при 37°C) и атмосфере (например, в воздухе плюс 5% СО2). Т-клетки, которые подвергали стимуляции в течение различных промежутков времени, могут обладать различными характеристиками.
В другом конкретном варианте осуществления изобретения указанные клетки можно размножать путем совместного культивирования с тканью или клетками. Указанные клетки можно размножать также in vivo, например, в крови индивидуума после введения указанной клетки индивидууму.
Терапевтические композиции и применения
Описанный выше способ, предлагаемый в настоящем изобретении, позволяет получать сконструированные первичные иммунные клетки в ограниченной временной рамке, составляющей примерно 15-30 дней, предпочтительно от 15 до 20 дней и наиболее предпочтительно от 18 до 20 дней, что позволяет сохранять их полный иммунный терапевтический потенциал, прежде всего касательно их цитотоксической активности.
Указанные клетки образуют популяцию клеток, которые предпочтительно имеют происхождение из одного донора или пациента. Указанные популяции клеток можно размножать в закрытых емкостях, специально предназначенных для культуры, для того, чтобы удовлетворять самым высоким требованиям практики производства, и можно замораживать перед инфузией пациенту, получая тем самым «не требующие доработок» или «готовые к применению» терапевтические композиции.
Согласно настоящему изобретению с помощью одного лейкафереза можно получать значительное количество клеток, что имеет решающее значение для получения достаточного количества доз для лечения пациента. Хотя могут наблюдаться вариации между популяциями клеток, полученных из различных доноров, количество иммунных клеток, полученных при лейкаферезе, как правило, составляет примерно от 108 до 1010 клеток РВМС. РВМС содержат несколько типов клеток: гранулоциты, моноциты и лимфоциты, из которых на долю Т-клеток приходится от 30 до 60%, что, как правило, соответствует от 108 до 109 первичных Т-клеток из одного донора. Способ, предлагаемый в настоящем изобретении, как правило, завершается получением популяции сконструированных клеток, обычно достигающей более чем примерно 108 Т-клеток, более конкретно более чем примерно 109 Т-клеток, еще более конкретно более чем примерно 1010 Т-клеток и, как правило, более чем 1011 Т-клеток.
Таким образом, более конкретно изобретение относится к терапевтически эффективной популяции первичных иммунных клеток, при этом по меньшей 30%, предпочтительно 50%, более предпочтительно 80% клеток в указанной популяции модифицированы с помощью любого метода, указанного в настоящем описании. Указанная терапевтически эффективная популяция первичных иммунных клеток, предлагаемая в настоящем изобретении, содержит иммунные клетки, в которые интегрирована по меньшей мере одна экзогенная генетическая последовательность под транскрипционным контролем эндогенного промотора по меньшей мере одного из генов, перечисленных в таблице 6.
Таким образом, указанные композиции или популяции клеток можно применять в качестве лекарственных средств; прежде всего для лечения рака, в частности, для лечения лимфомы, но также и солидных опухолей, таких как меланомы, нейробластомы, глиомы или карциномы, например, опухолей легкого, молочной железы, ободочной кишки, предстательной железы или яичника, у пациента, который нуждается в этом.
Более конкретно изобретение относится к популяциям первичных TCR-негативных Т-клеток из одного донора, при этом по меньшей мере 20%, предпочтительно 30%, более предпочтительно 50% клеток в указанной популяции модифицированы с использованием специфических для последовательности реагентов по меньшей мере в двух, предпочтительно в трех различных локус ах.
Другим объектом настоящего изобретения являются способы лечения пациентов, которые нуждаются в этом, где указанный способ включает по меньшей мере одну из следующих стадий:
(а) выявление специфических антигенных маркеров, присутствующих на поверхности опухолей пациентов по данным биопсий;
(б) получение популяции сконструированных первичных иммунных клеток, созданной с помощью одного из описанных выше способов, предлагаемых в настоящем изобретении, так, что она экспрессирует CAR, направленный против указанных специфических антигенных маркеров;
(в) введение указанной сконструированной популяции созданных первичных иммунных клеток указанному пациенту.
Как правило, указанные популяции клеток главным образом содержат CD4- и CD8-позитивные иммунные клетки, такие как Т-клетки, которые можно подвергать интенсивному Т-клеточному размножению in vivo и их можно сохранять в течение продолжительного периода времени в условиях in vitro и in vivo.
Обработки с использованием сконструированных первичных иммунных клеток, предлагаемых в настоящем изобретении, могут быть облегчающими, лечебными или профилактическими. Они могут представлять собой либо составную часть аутологичного иммунотерапевтического лечения, либо составную часть аллогенного иммунотерапевтического лечения. Понятие «аутологичный» означает, что клетки, клеточная линия или популяция клеток, применяемые для лечения пациентов, получают из организма указанного пациента или из организма совместимого по человеческому лейкоцитарному антигену (HLA) донора. Понятие «аллогенный» означает, что клетки или популяция клеток, применяемые для лечения пациентов, получают не из организма указанного пациента, а получают из организма донора.
В другом варианте осуществления изобретения указанную выделенную клетку, предлагаемую в изобретении, или клеточную линию, полученную из указанной выделенной клетки, можно применять для лечения жидких опухолей, предпочтительно Т-клеточного острого лимфобластного лейкоза.
Под объем изобретения подпадают также опухоли/раки взрослых и педиатрические опухоли/раки.
Лечение с использованием сконструированных иммунных клеток, предлагаемых в изобретении, можно объединять с одной или несколькими противораковыми терапиями, выбранными из группы, включающей терапию с использованием антител, химиотерапию, цитокиновую терапию, терапию с использованием дендритных клеток, генную терапию, гормональную терапию, лазерную терапию и лучевую терапию.
Согласно предпочтительному варианту осуществления изобретения указанное лечение можно применять для пациентов, подвергающихся иммуносупрессорной терапии. Так, настоящее изобретение предпочтительно относится к клеткам или популяции клеток, которым придана устойчивость по меньшей мере к одному иммуносупрессорному агенту благодаря инактивации гена, кодирующего рецептор для указанного иммуносупрессорного агента. В этом контексте иммуносупрессорная терапия может способствовать селекции и размножению Т-клеток, предлагаемых в изобретении, в организме пациента.
Введение клеток или популяции клеток, предлагаемых в настоящем изобретении, можно осуществлять любым общепринятым методом, включая аэрозольную ингаляцию, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию. Композиции, представленные в настоящем описании, можно вводить пациенту подкожно, внутрикожно, внутрь опухоли, интранодально, интрамедуллярно, внутримышечно, путем внутривенной или внутрилимфатической инъекции или внутрибрюшинно. В одном из вариантов осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, предпочтительно вводят путем внутривенной инъекции.
Введение клеток или популяции клеток может заключаться во введении 104-109 клеток/кг веса тела, предпочтительно от 105 до 106 клеток/кг веса тела, включая все целочисленные количества клеток в указанных диапазонах. Таким образом, в настоящем изобретении предложено применение более 10, как правило, более 50, более конкретно более 100 и обычно более 1000 доз, содержащих от 106 до 108 клеток с отредактированным геном, полученных при отборе образца из одного донора или пациента.
Клетки или популяцию клеток можно вводить в виде одной или нескольких доз. В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде однократной дозы. В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде более чем одной дозы в течение некоторого периода времени. График введения находится в компетенции лечащего врача и зависит от клинического состояния пациента. Клетки или популяцию клеток можно получать из любого источника, такого как банк крови или донор. Поскольку индивидуальные потребности варьируются, определение оптимальных диапазонов эффективных количеств рассматриваемого типа клеток для конкретного заболевания или состояний, находится в компетенции специалиста в данной области. Эффективное количество представляет собой количество, которое обеспечивает терапевтическое или профилактическое полезное действие. Вводимая доза должна зависеть от возраста, состояния здоровья и веса реципиента, вида одновременно применяемого лечения, если это имеет место, частоты обработки и природы требуемого действия.
В другом варианте осуществления изобретения клетки или композицию, содержащую эти клетки, вводят в указанном эффективном количестве парентерально. Указанное введение может представлять собой внутривенное введение. Указанное введение можно осуществлять непосредственно путем инъекции в опухоль.
В некоторых вариантах осуществления настоящего изобретения клетки вводят пациенту в сочетании с осуществлением (например, до, одновременно или после) любого количества соответствующих форм лечения, включая (но не ограничиваясь только ими) лечение с помощью средств противовирусной терапии, таких как цидофовир и интерлейкин-2, цитарабин (известный также под названием ARA-C), или лечение натализумабом пациентов с MS (рассеянный склероз), или лечение эфализумабом пациентов с псориазом, или другие виды лечения пациентов с PML (прогрессирующая многоочаговая лейкоэнцефалопатия). В других вариантах осуществления изобретения Т-клетки, предлагаемые в изобретении, можно применять в сочетании с химиотерапией, лучевой терапией, иммуносупрессорными агентами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммунодеструктивными агентами, такими как САМРАТН, антитела к CD3, или с другими видами терапии на основе антител, цитоксином, флударибином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и облучением. Эти лекарственные средства или ингибируют кальций-зависимую фосфатазу кальцинеурин (циклоспорин и FK506), или ингибируют киназу p70S6, которая важна для индуцируемой фактором роста передачи сигнала (рапамицин) (Henderson, Naya и др., 1991; Liu, Albers и др., 1992; Bierer, Hollander и др., 1993). В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят пациенту в сочетании с (например, до, одновременно или после) трансплантацией костного мозга, Т-клеточной абляционной терапией с использованием либо химиотерапевтических средств, таких как флударабин, либо внешней лучевой терапии (XRT), циклофосфамида, либо антител, таких как OKT3 или САМРАТН. В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят после осуществления В-клеточной абляционной терапии с использованием агентов, которые взаимодействуют с CD20, таких, например, как ритуксан. Например, в одном из вариантов осуществления изобретения индивидуумов можно подвергать стандартной обработке химиотерапевтическими средствами в высокой дозе с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления изобретения после трансплантации индивидуумам вводят путем инфузии размноженные иммунные клетки, предлагаемые в настоящем изобретении. В еще одном варианте осуществления изобретения размноженные клетки вводят до или после хирургического вмешательства.
Когда CAR экспрессируются в иммунных клетках или популяциях иммунных клеток, предлагаемых в настоящем изобретении, то предпочтительными являются CAR, таргетирующие по меньшей мере один антиген, выбранный из CD22, CD38, CD123, CS1, HSP70, ROR1, GD3 и CLL1.
Сконструированные иммунные клетки, предлагаемые в настоящем изобретении, которые наделены CAR или модифицированным TCR, таргетирующим CD22, предпочтительно применяют для лечения лейкоза, такого как острый лимфобластный лейкоз (ALL), клетки с CAR или модифицированным TCR, таргетирующим CD38, предпочтительно применяют для лечения лейкоза, такого как Т-клеточный острый лимфобластный лейкоз (T-ALL) или множественная миелома (ММ), клетки с CAR или модифицированным TCR, таргетирующим CD123, предпочтительно применяют для лечения лейкоза, такого как острый миелоидный лейкоз (AML) и неоплазмы из бластных плазмацитоидных дендритных клеток (BPDCN), клетки с CAR или модифицированным TCR, таргетирующим CS1, предпочтительно применяют для лечения множественной миеломы (ММ).
Настоящее изобретение относится также к средствам обнаружения сконструированных клеток, предлагаемых в настоящем изобретении, включающих требуемые генетические инсерции, прежде всего путем осуществления стадий, на которых используют ПЦР-методы для выявления инсерции экзогенных кодирующих последовательностей в эндогенные локусы, указанные в настоящем описании, прежде всего в локусы PD1, CD25, CD69 и TCR, с использованием зондов или праймеров, гибридизующихся с любой из последовательностей, которые представлены в SEQ ID NO: 36-40.
Иммунологические анализы можно осуществлять также для выявления экспрессии в сконструированных клетках CAR, GP130 и обнаружения отсутствия или снижения экспрессии TCR, PD1, IL-6 или IL-8 в клетках, в которых гены были «выключены» (в результате нокаута) или их экспрессия снижена.
Другие определения
- Аминокислотные остатки в полипептидной последовательности обозначают в настоящем описании с помощью однобуквенного кода, согласно которому, например, Q обозначает Gln или остаток глутамина, R обозначает Arg или остаток аргинина и D обозначает Asp или остаток аспарагиновой кислоты.
- Аминокислотная замена обозначает замену одного аминокислотного остатка на другой, например, замена остатка аргинина на остаток глутамина в пептидной последовательности представляет собой аминокислотную замену.
- Нуклеотиды обозначают следующим образом: однобуквенный код используют для обозначения основания нуклеозида: а обозначает аденин, t обозначает тимин, с обозначает цитозин и g обозначает гуанин. Для вырожденных нуклеотидов r обозначает g или а (пуриновые нуклеотиды), k обозначает g или t, s обозначает g или с, w обозначает а или t, m обозначает а или с, у обозначает t или с (пиримидиновые нуклеотиды), d обозначает g, а или t, v обозначает g, а или с, b обозначает g, t или с, h обозначает a, t или с и n обозначает g, a, t или с.
- В контексте настоящего описания понятия «нуклеиновая кислота» или «полинуклеотиды» относятся к нуклеотидам и/или полинуклеотидам, таким как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК), олигонуклеотидам, фрагментам, созданным с помощью полимеразной цепной реакции (ПЦР), и фрагментам, созданным путем лигирования, расщепления, обработки эндонуклеазами и обработки экзонуклеазами. Молекулы нуклеиновой кислоты могут состоять из мономеров, которые являются встречающимися в естественных условиях нуклеотидами (такими как ДНК или РНК) или аналогами встречающихся в естественных условиях нуклеотидов (например, энантиомерными формами встречающихся в естественных условиях нуклеотидов), или представляют собой их комбинацию. Модифицированные нуклеотиды могут иметь изменения в сахарных фрагментах и/или в фрагментах, содержащих пиримидиновые или пуриновые основания. Модификации сахаров включают, например, замену одной или нескольких гидроксильных групп на галогены, алкильные группы, амины и азидогруппы, или сахара могут быть функционализированы до простых или сложных эфиров. Кроме того, весь сахарный фрагмент может быть заменен стерически и электронно сходными структурами, такими как аза-сахара и карбоциклические аналоги сахаров. Примерами модификаций во фрагменте, представляющем собой основание, могут служить алкилированные пурины и пиримидины, ацилированные пурины или пиримидины или другие хорошо известные гетероциклические заместители. Мономеры нуклеиновой кислоты могут быть сшиты фосфодиэфирными связями или аналогами таких связей. Нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными.
- Понятие «эндонуклеаза» относится к любому ферменту дикого типа или его варианту, обладающему способностью катализировать гидролиз (расщепление) связей между нуклеиновыми кислотами в молекуле ДНК или РНК, предпочтительно в молекуле ДНК. Эндонуклеазы не расщепляют молекулу ДНК или РНК независимо от ее последовательности, но они распознают и расщепляют молекулу ДНК или РНК в специфических полинуклеотидных последовательностях, в дальнейшем обозначенных как «последовательности-мишени» или «сайты-мишени». Эндонуклеазы можно классифицировать как редко расщепляющие эндонуклеазы, для которых, как правило, полинуклеотидный сайт распознавания имеет длину более 10 пар оснований (bp), более предпочтительно 14-55 пар оснований. Редко расщепляющие эндонуклеазы существенно повышают гомологичную рекомбинацию путем индукции двухцепочечных разрывов ДНК (DSB) в определенном локусе, обеспечивая тем самым осуществление терапий на основе генной репарации или инсерции генов (Pingoud А. и G.Н. Silva Precision genome surgery. Nat. Biotechnol. 25(7), 2007, cc. 743-744.).
- Под «ДНК-мишенью», «последовательностью-мишенью ДНК», «ДНК-последовательностью-мишенью», «нуклеотидной последовательность-мишенью», «последовательностью-мишенью» или «сайтом процессирования» подразумевают полинуклеотидную последовательность, которая может таргетироваться и процессироваться редко расщепляющей эндонуклеазой, предлагаемой в настоящем изобретении. Указанные понятия относятся к специфической области ДНК, предпочтительно геномной области в клетке, но также к участку генетического материала, который может существовать независимо от основного генетического материла организма, такому как плазмиды, эписомы, вирус, транспозоны, или в органеллах, таких как митохондрии (но не ограничиваясь только ими). Например (но не ограничиваясь только ими) направляемые РНК последовательности-мишени представляют собой такие геномные последовательности, которые могут гибридизоваться с гидовой РНК, которая направляет РНК-направляемую эндонуклеазу к требуемому локусу.
- Под «мутацией» подразумевают замену, делецию, инсерцию вплоть до одного/одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, двадцати, двадцати пяти, тридцати, сорока, пятидесяти или большего количества нуклеотидов/аминокислот в полинуклеотидной (кДНК, ген) или полипептидной последовательности. Мутация может влиять на кодирующую последовательность гена или его регуляторную последовательность. Она может влиять также на структуру геномной последовательности или структуру/стабильность кодируемой мРНК.
- Под «вектором» подразумевают молекулу нуклеиновой кислоты, обладающую способностью транспортировать другую нуклеиновую кислоту, с которой она сцеплена. К «векторам» согласно настоящему изобретению, относятся (но не ограничиваясь только ими) вирусный вектор, плазмида, РНКовый вектор или молекула линейной или кольцевой ДНК или РНК, которые могут состоять из хромосомальных, нехромосомальных, полусинтетических или синтетических нуклеиновых кислот. Предпочтительными векторами являются векторы, которые способны автономно реплицировать (эписомальный вектор) и/или экспрессировать нуклеиновые кислоты, с которыми они сцеплены (экспрессионные векторы). Специалистам в данной области известно большое количество пригодных векторов, которые поступают в продажу. К вирусным векторам относятся ретровирус, аденовирус, парвовирус (например, аденоассоциированные вирусы, AAV)), коронавирус, РНК-вирусы с негативной цепью, такие как ортомиксовирус (например, вирус гриппа), рабдовирус (например, вирус бешенства и вирус везикулярного стоматита), парамиксовирус (например, вирус кори и вирус Сендай), РНК-вирусы с позитивной цепью, такие как пикорнавирус и альфавирус, и вирусы с двухцепочечной ДНК, включая аденовирус, вирус герпеса (например, вирус герпеса простого типов 1 и 2, вирус Эпштейна-Барра, цитомегаловирус) и вирус оспы (например, вирус коровьей оспы, вирус оспы птиц и вирус оспы канарейки). Другие вирусы включают, например, вирус Норвалк, тогавирус, флавивирус, реовирусы, паповирус, гепаднавирус и вирус гепатита. Примерами ретровирусов являются: вирус птичьего лейкоза-саркомы, вирусы млекопитающих С-типа, В-типа, вирусы D-типа, группа HTLV-BLV, лентивирус, спумавирус (Coffin J.М., Retroviridae: The viruses and their replication, в: Fundamental Virology, 3-е изд., под ред. В.N. Fields и др., изд-во Lippincott-Raven Publishers, Philadelphia, 1996).
- В контексте настоящего описания понятие «локус» относится к специфической физической области (месту) ДНК-последовательности (например, гена) в геноме. Понятие «локус» может относиться к специфической физической области последовательности-мишени редко расщепляющей эндонуклеазы на хромосоме или геномной последовательности инфекционного агента. Такой локус может содержать последовательность-мишень, которая распознается и/или расщепляется специфической для последовательности эндонуклеазой, предлагаемой в изобретении. Следует понимать, что представляющий интерес согласно настоящему изобретению локус может не только представлять собой локус на нуклеотидной последовательности, которая существует в основном генетическом материале организма (т.е. в хромосоме) клетки, но также и часть генетического материал, которая может существовать независимо от основного генетического материла организма, такая как плазмиды, эписомы, вирус, транспозоны, или в органеллах, таких как митохондрии (но не ограничиваясь указанными примерами).
- Понятие «расщепление» относится к разрушению ковалентно связанного каркаса полинуклеотида. Расщепление можно инициировать с помощью различных методов, включая (но не ограничиваясь только ими) ферментативный или химический гидролиз фосфодиэфирной связи. Возможно как одноцепочечное, так и двухцепочечное расщепление, и двухцепочечное расщепление может происходить в результате двух различных случаев одноцепочечного расщепления. Расщепление двухцепочечных ДНК, РНК или гибрида ДНК/РНК может приводить в образованию либо тупых концов, либо ступенчатых концов.
- Понятие «идентичность» относится к идентичности последовательностей двух молекул нуклеиновых кислот или полипептидов. Идентичность можно оценивать путем сравнения положений в каждой из последовательностей, которые можно выравнивать для целей сравнения. Если положение в сравниваемой последовательности занято тем же самым основанием, то молекулы являются идентичными в этом положении. Степень сходства или идентичности между двумя нуклеотидными или аминокислотными последовательностями является функцией количества идентичных или совпадающих нуклеотидов в положениях нуклеотидных последовательностей. Для расчета идентичности двух последовательностей можно использовать различные алгоритмы и/или программы сравнительного анализа первичной структуры последовательностей, включая FASTA или BLAST, которые доступны в виде компонента пакета программ анализа последовательностей GCG (Университет Висконсина, Мэдисон, шт. Висконсин), и их можно применять, например, с использованием задаваемых по умолчанию параметров. Например, можно рассматривать полипептиды, обладающие идентичностью, составляющей по меньшей мере 70%, 85%, 90%, 95%, 98% или 99%, с конкретными полипептидами, представленными в настоящем описании, и предпочтительно обладающие практически такими же функциями, а также полинуклеотиды, кодирующие такие полипептиды.
В контексте настоящего описания понятие «индивидуум» или «пациент» включает всех представителей царства животных, в том числе приматов кроме человека и человека.
В представленном выше описании изобретения изложены подход и способ его осуществления и применения, так что любой специалист в данной области способен осуществлять и применять его, эта возможность относится, прежде всего, к сущности изобретения, изложенной в прилагаемой формуле изобретения, которая представляет собой составную часть исходного описания.
Если в настоящем описании указаны численные пределы или численный диапазон, то они включают их границы. Кроме того, считается, что включены все значения и поддиапазоны, находящиеся в указанных пределах или указанном численном диапазоне, как если бы они были специально указаны.
Имея общее описание настоящего изобретения, можно достичь более полного понимания после ознакомления с некоторыми конкретными примерами, которые представлены в настоящем описании только для целей иллюстрации и не направлены на ограничение объема.
Примеры
Пример 1: Управляемая AAV гомологичная рекомбинация в человеческих первичных Т-клетках в различных локусах под контролем эндогенных промоторов с нокдауном эндогенного гена
Введение
Специфические для последовательности реагенты, представляющие собой эндонуклеазы, такие как TALEN® (фирма Cellectis, 8 rue de la Croix Jarry, 75013, Париж, Франция), обеспечивают сайтспецифическую индукцию двухцепочечных разрывов (DSB) в геноме в требуемых локусах. Репарация DSB с помощью клеточных ферментов происходит главным образом посредством двух путей: посредством негомологичного соединения концов (NHEJ) и репарации, направляемой гомологией (HDR). Для HDR используется гомологичный участок ДНК (ДНК-матрица) для репарации DSB путем рекомбинации и ее можно применять для интродукции любой генетической последовательности, содержащей в ДНК-матрице. Как продемонстрировано в настоящем изобретении указанную ДНК-матрицу можно доставлять с помощью рекомбинантного аденоассоциированного вируса (rAAV) наряду со сконструированной нуклеазой, такой как TALEN®, для интродукции сайтспецифического DSB.
Создание матриц для интеграции
1.1. Инсерция индуцирующего апоптоз CAR в локус с повышающей регуляцией с помощью нокдауна эндогенной кодирующей ген PD1 последовательности
Создавали область, представляющую собой сайт-мишень для TALEN, которая должна быть локализована в таргетируемом эндогенном гене PDCD1 (белок запрограммированной гибели клеток 1, обозначенный как PD1 - Uniprot № Q15116). Последовательности, содержащие 1000 bp, расположенные в обратном и прямом направлении от мишеней TALEN, представлены в SEQ ID NO: 1 и SEQ ID NO: 2. Последовательности-мишени TALEN (SEQ ID NO: 3 и NO: 4) представлены в SEQ ID NO: 5. Создавали предназначенную для интеграции матрицу, которая должна состоять из последовательности (300 bp), гомологичной эндогенному гену, расположенной в обратном направлении относительно сайта TALEN (SEQ ID NO: 1), за которой следует регуляторный элемент 2А (SEQ ID NO: 6), а далее последовательность, кодирующая индуцирующий апоптоз CAR без стартового кодона (SEQ ID NO: 7), далее стоп-кодон (TAG), за ним следует последовательность полиаденилирования (SEQ ID NO: 8), а затем последовательность (1000 bp), гомологичная эндогенному гену, расположенная в прямом направлении относительно сайта TALEN (SEQ ID NO: 2). Затем предназначенную для инсерции матрицу клонировали в несодержащем промотор векторе rAAV и применяли для получения AAV6.
1.2 Инсерция интерлейкина в локус с повышающей регуляцией с помощью нокдауна эндогенного гена
Создавали область, представляющую собой сайт-мишень для TALEN, которая должна быть локализована в таргетируемом эндогенном гене PDCD1 (белок запрограммированной гибели клеток 1, PD1). Последовательности, содержащие 1000 bp, расположенные в обратном и прямом направлении от мишеней TALEN, представлены в SEQ ID NO: 1 и SEQ ID NO: 2. Последовательности-мишени TALEN (SEQ ID NO: 3 и NO: 4) представлены в SEQ ID NO: 5. Создавали предназначенную для интеграции матрицу, которая должна состоять из последовательности (300 bp), гомологичной эндогенному гену, расположенной в обратном направлении относительно сайта TALEN (SEQ ID NO: 1), за которой следует регуляторный элемент 2A (SEQ ID NO: 6), а далее последовательность, кодирующая сконструированный одноцепочечный слитый белок, содержащий субъединицу р35 человеческого IL-12 (SEQ ID NO: 9) и субъединицу р40 (SEQ ID NO: 10), далее стоп-кодон (TAG), за ним следует последовательность полиаденилирования (SEQ ID NO: 8), а затем последовательность (1000 bp), гомологичная эндогенному гену, расположенная в прямом направлении относительно сайта TALEN (SEQ ID NO: 2). Затем предназначенную для инсерции матрицу клонировали в несодержащем промотор векторе rAAV и применяли для получения AAV6.
1.3 Инсерция индуцирующего апоптоз CAR в локус со слабой экспрессией без нокдауна эндогенного гена - N-концевая инсерция
Создавали область, представляющую собой сайт-мишень для TALEN, которая должна быть локализована в максимальной близости от стартового кодона таргетируемого эндогенного гена LCK (LCK, LCK представляет собой протоонкоген из семейства тирозинкиназ Src [Homo sapiens (человеческий)]). Последовательности, содержащие 1000 bp, расположенные в обратном и прямом направлении от стартового кодона, представлены в SEQ ID NO: 11 и SEQ ID NO: 12. Создавали предназначенную для интеграции матрицу, которая должна состоять из последовательности (1000 bp), гомологичной эндогенному гену, расположенному в обратном направлении относительно стартового кодона, за которой следует последовательность, кодирующая индуцирующий апоптоз CAR (SEQ ID NO: 13), содержащая стартовый кодон, за которой следует регуляторный элемент 2А (SEQ ID NO: 8), далее последовательность (1000 bp), гомологичная эндогенному гену, расположенная в прямом направлении относительно стартового кодона (SEQ ID NO: 12). Затем предназначенную для инсерции матрицу клонировали в несодержащем промотор векторе rAAV и применяли для получения AAV6.
1.4 Инсерция индуцирующего апоптоз CAR в локус со слабой экспрессией без нокдауна эндогенного гена- С-концевая инсерция
Создавали область, представляющую собой сайт-мишень для TALEN, которая должна быть локализована в максимальной близости от стоп-кодона таргетируемого эндогенного гена LCK (LCK, LCK представляет собой протоонкоген из семейства тирозинкиназ Src [Homo sapiens (человеческий)]). Последовательности, содержащие 1000 bp, расположенные в обратном и прямом направлении от стартового кодона, представлены в SEQ ID NO: 14 и SEQ ID NO: 15. Создавали предназначенную для интеграции матрицу, которая должна состоять из последовательности (1000 bp), гомологичной эндогенному гену, расположенному в обратном направлении относительно стоп-кодона, за которой следует регуляторный элемент 2A (SEQ ID NO: 8), далее последовательность, кодирующая индуцирующий апоптоз CAR без стартового кодона (SEQ ID NO: 7), далее стоп-кодон (TAG), за которым последовательность (1000 bp), гомологичная эндогенному гену, расположенная в прямом направлении относительно стоп-кодона (SEQ ID NO: 15). Затем предназначенную для инсерции матрицу клонировали в несодержащем промотор векторе rAAV и применяли для получения AAV6.
Экспрессия специфических для последовательности реагентов, представляющих собой нуклеазы, в трансдуцированных клетках
мРНК TALEN® синтезировали с использованием набора mMessage mMachine Т7 Ultra (фирма Thermo Fisher Scientific, Гранд-Айленд, шт. Нью-Йорк), каждую TALEN клонировали в прямом направлении относительно промотора Т7, очищали с помощью колонок RNeasy (фирма Qiagen, Валенсия, шт. Калифорния) и элюировали в «среде Т для цитопорации» (фирма Harvard Apparatus, Холлистон, шт. Массачусетс). Человеческие Т-клетки собирали и активировали из цельной периферической крови (фирма ALLCELLS, Аламеда, шт. Калифорния) в среде Х-Vivo-15 (фирма Lonza, Базель, Швейцария), дополненной 20 нг/мл человеческого IL-2 (фирма Miltenyi Biotech, Сан-Диаего, шт. Калифорния), 5% человеческой АВ-сыворотки (фирма Gemini Bio-Products, Западный Сан-Франциско, шт. Калифорния) и гранулами Dynabeads® с активатором человеческих Т-клеток CD3/CD28 при соотношении гранулы: клетки 1:1 (фирма Thermo Fisher, Гранд-Айленд, шт. Нью-Йорк). Гранулы удаляли через 3 дня и 5×106 клеток трансформировали путем электропорации 10 мкг мРНК каждой из двух соответствующих TALEN® с использованием устройства (фирма ВТХ Harvard Apparatus, Холлистон, шт. Массачусетс), путем обработки с использованием двух импульсов по 0,1 мс при 3000 В/см с последующими 4 импульсами по 0,2 мс при 325 В/см в кюветах с расстоянием между электродами 0,4 см в конечном объеме 200 мкл среды Т для цитопорации (фирма ВТХ Harvard Apparatus, Холлистон, шт. Массачусетс). Клетки немедленно разводили в среде X-Vivo-15, дополненной 20 нг/мл IL-2, и инкубировали при 37°С с 5% СО2. Через 2 ч клетки инкубировали с частицами AAV6, используя 3×105 вирусных геномов (vg) на клетку (37°С, 16 ч). Клетки пересевали и поддерживали в среде X-Vivo-15, дополненной 5% человеческой АВ-сыворотки и 20 нг/мл IL-2, до оценки с помощью проточной цитометрии экспрессии соответствующих встроенных генных последовательностей.







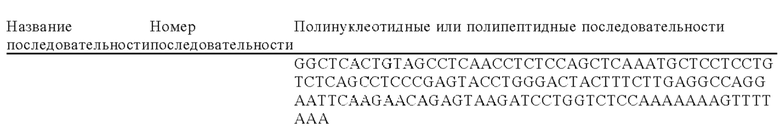
Пример 2: Опосредуемая TALEN двойная таргетная интеграция кодирующих IL-15 и CAR матриц в Т-клетки
Материалы
Среду X-vivo-15 получали от фирмы Lonza (каталожный №BE04-418Q), IL-2 от фирмы Miltenyi Biotech (каталожный №130-097-748), человеческую АВ-сыворотку от фирмы Seralab (каталожный № GEM-100-318), активатор человеческих Т-клеток CD3/CD28 от фирмы Life Technology (каталожный №11132D), QBEND10-APC от фирмы R&D Systems (каталожный № FAB7227A), меченное Vioblue® антитело к CD3, меченное РЕ антитело к LNGFR, меченное АРС антитело к CD25 и меченное РЕ антитело к PD1 от фирмы Miltenyi (каталожные №№130-094-363, 130-112-790, 130-109-021 и 130-104-892 соответственно), которыми обрабатывали 48-луночные планшеты (фирма CytoOne, каталожный №СС7682-7548), набор для определения человеческого IL-15 Quantikine ELISA фирмы R&D systems (каталожный № S1500), ONE-Glo фирмы Promega (каталожный № Е6110). Партии AAV6, содержащие различные матрицы, получали от фирмы Virovek, РВМС-клетки получали от фирмы Allcells (каталожный № PB004F) и клетки Raji, экспрессирующие люциферазу, получали путем трансдукции клеток Raji из АТСС (каталожный № CCL-86), кодирующими люциферазу светлячка лентивирусными частицами.
Методы
2.1 Трансфекция-трансдукция
Двойную таргетную интеграцию в локусы TRAC и PD1 или CD25 осуществляли следующим образом. РВМС-клетки сначала подвергали оттаиванию, затем промывали, ресуспендировали и культивировали в полной среде X-vivo-15 (X-vivo-15, 5% АВ-сыворотка, 20 нг/мл IL-2). Через 1 день клетки актировали с помощью Dynabeads® с активатором человеческих Т-клеток CD3/CD28 (25 мкл гранул /1Е6 CD3-позитивных клеток) и культивировали с плотностью 1Е6 клеток/мл в течение 3 дней в полной среде X-vivo при 37°С в присутствии 5% СО2. Затем клетки расщепляли, используя свежую полную среду и на следующий день трансдуцировали/трансфектировали согласно следующей процедуре. В день трансдукции-трансфекции из клеток сначала удаляли гранулы с помощью магнитной сепарации (набор EasySep), промывали дважды в буфере Т для цитопорации (фирма ВТХ Harvard Apparatus, Холлистон, шт. Массачусетс) и ресуспендировали в конечной концентрации 28×106 клеток/мл в этом же растворе. Клеточную суспензию смешивали с 5 мкг мРНК, кодирующих плечи TRAC TALEN® (SEQ ID NO: 16 и 17) в отсутствии или в присутствии 15 мкг мРНК, кодирующих плечи либо CD25-, либо PD1-TALEN® (SEQ ID NO: 18 и 19 и SEQ ID NO: 20 и 21 соответственно) в конечном объеме 200 мкл. TALEN представляет собой стандартный формат TALE-нуклеаз, полученных в результате слияния TALE с Fok-1. Трансфекцию осуществляли, используя технологию Pulse Agile, применяя два импульса по 0,1 мс при 3000 В/см с последующими 4 импульсами по 0,2 мс при 325 В/см в кюветах с расстоянием между электродами 0,4 см в конечном объеме 200 мкл среды Т для цитопорации (фирма ВТХ Harvard Apparatus, Холлистон, шт. Массачусетс). Клетки после электропорации немедленно переносили в 12-луночный планшет, содержащий 1 мл предварительно нагретой бессывороточной среды X-vivo-15, и инкубировали при 37°С в течение 15 мин. Затем клетки концентрировали до получения 8×106 клеток/мл в 250 мкл этой же среды в присутствии AAV6-частиц (MOI=3×105 vg/клетку), содержащих донорские матрицы, в 48-луночных регулярно обрабатываемых планшетах. После культивирования в течение 2 ч при 30°С добавляли к клеточной суспензии 250 мкл среды Xvivo-15, дополненной 10% АВ-сыворотки и 40 нг/мл IL-2, и смесь инкубировали в течение 24 ч в таких же условиях культивирования. Через 1 день клетки высевали из расчета 1×106 клеток/мл в полную среду X-vivo-15 и культивировали при 37°С в присутствии 5% СО2.
2.2 Зависящая от активации экспрессия ΔLNGFR и секреция IL-15
Сконструированные Т-клетки выделяли после процесса трансфекции-трансдукции, описанного выше, и высевали из расчета 1×106 клеток/мл индивидуально или в присутствии клеток Raji (Е:Т=1:1) или Dynabeads (12,5 мкл/1×106 клеток) в конечном объеме 100 мкл полной среды X-vivo-15. Клетки культивировали в течение 48 ч, после чего выделяли, метили и анализировали с помощью проточной цитометрии. Клетки метили с использованием двух независимых наборов антител. Первый набор антител, предназначенных для выявления присутствия ΔLNGFR-, CAR- и CD3-клеток, состоял из QBEND10-АРС (разведенного в соотношении 1/10), меченного Vioblue® антитела к CD3 (разведенного в соотношении 1/25) и меченного РЕ антитела к ΔLNGFR (разведенного в соотношении 1/25). Второй набор антител, предназначенных для выявления экспрессии эндогенных CD25 и PD1, состоял из меченного АРС антитела к CD25 (разведенного в соотношении 1/25) и меченного Vioblue® антитела к PD1 (разведенного в соотношении 1/25).
Такую же экспериментальную процедуру применяли для изучения секреции IL-15 в среду. Смесь клеток выдерживали в совместной культуре в течение 2, 4, 7 и 10 дней, после чего собирали и супернатант анализировали с помощью специфического для IL-15 набора ELISA.
2.3 Серийный киллинг-анализ
Для оценки противоопухолевой активности сконструированных CAR Т-клеток осуществляли серийный киллинг-анализ. Принцип этого анализа заключается в том, что ежедневно индуцируют противоопухолевую активность CAR Т-клеток путем добавления каждый день постоянного количества опухолевых клеток. Мониторинг пролиферации, контроля и рецидива опухолевых клеток можно осуществлять на основе определения люминесценции люциферазы в качестве маркера, стабильно интегрированного в опухолевые линии клеток.
Как правило, CAR Т-клетки смешивали с суспензией 2,5×105 опухолевых клеток Raji-luc, используя различные соотношения Е:Т (Е:Т=5:1 или 1:1), в общем объеме 1 мл среды Xvivo 5% АВ, дополненной 20 нг/мкл IL-2. Смесь инкубировали в течение 24 ч, после чего определяли люминесценцию в 25 мкл клеточной суспензии, используя реагент ONE-Glot. Смесь клеток затем центрифугировали, старую среду отбрасывали и заменяли 1 мл свежей полной среды X-vivo-15, содержащей 2,5×105 клеток Raji-Luc, и полученную смесь клеток инкубировали в течение 24 ч. Указанный протокол повторяли в течение 4 дней.
Эксперименты и результаты
В данном примере описаны способы повышения терапевтического результата терапий на основе CAR Т-клеток путем интеграция кассеты экспрессии, содержащей гетеродимер IL-15/растворимый IL-15-рецептор альфа (IL15/sIL15rα), под контролем эндогенных Т-клеточных промоторов, регулирующих гены PD1 и CD25. Поскольку известно, что имеет место повышающая регуляция обоих генов при контакте опухоли с CAR Т-клетками, их можно перенаправлять на экспрессию IL- IL15/sIL15rα только вблизи опухоли. Указанный способ способствует уменьшению потенциальных побочных действий, обусловленных системной секрецией IL15/sIL15rα, поддерживая при этом способность к пониженной индуцированной активацией смерти Т-клеток (AICD), улучшает выживаемость Т-клеток, повышает противоопухолевую активность Т-клеток и реверсирует Т-клеточную анергию.
Способ, разработанный для интеграции IL15/sIL15rα в локусы PD1 и CD25, состоит в создании двухцепочечного разрыва в обоих локусах с использованием TALEN в присутствии ДНК-матрицы для репарации, для внесения которой применяют векторизацию с использованием AAV6. Указанная матрица состоит из двух гомологичных плечей, окружающих кодирующие области IL15/sIL15rα, разделенные цис-действующими 2А-элементами и регуляторными элементами (стоп-кодон и полиА-последовательности). В зависимости от являющегося мишенью локуса и его участия в Т-клеточной активности, таргетируемый эндогенный ген может быть инактивирован или не инактивирован с использованием специфической конструкции матрицы. Когда ген CD25 рассматривается в качестве таргетируемого локуса, то встраиваемую матрицу создавали для нокина (KI) IL15/sIL15rα без инактивации CD25, поскольку белковый продукт этого гена считается важным для Т-клеточной функции. В противоположность этому, поскольку PD1 участвует в Т-клеточном ингибировании/истощении Т-клеток, то встраиваемую матрицу создавали для предупреждения его экспрессии с сохранением способности к экспрессии и секреции IL15/sIL15rα.
Для иллюстрации указанного подхода и демонстрации целесообразности двойной таргетной инсерции в первичные Т-клетки создавали три различные матрицы (фиг. 2А, 2Б и 2В). Первую, обозначенную как CARm, которая представлена в SEQ ID NO: 36, создавали для инсерции кДНК анти-CD22 CAR в локус TRAC в присутствии TRAC TALEN® (SEQ ID NO: 16 и 17). Вторую, обозначенную как IL-15_CD25m (SEQ ID NO: 37), создавали для интеграции кДНК IL15, sIL15rα и поверхностного маркера, обозначенного как ΔLNGFR, разделенных цис-действующими 2А-элементами, непосредственно перед стоп-кодоном эндогенной кодирующей последовательности CD25, с использованием CD25 TALEN® (SEQ ID NO: 18 и 19). Третью, IL-15_PD1m (SEQ ID NO: 38), содержащую такую же кассету экспрессии, создавали для интеграции в середину открытой рамки считывания PD1, используя PD1 TALEN® (SEQ ID NO: 20 и 21). Три матрицы, содержащие дополнительный цис-действующий 2А-элемент, локализованный в обратном направлении относительно кассет экспрессии, обеспечивали совместную экспрессию IL15/sIL15rα и CAR с эндогенным таргетируемым геном.
При создании изобретении впервые оценена эффективность двойной таргетной инсерции в Т-клетки путем их трансдукции одной из конструкций AAV6, кодирующей матрицы IL15/sIL15rα (SEQ ID NO: 41; pCLS30519), наряду с одной конструкцией, кодирующей CAR, и последующей трансфекции соответствующей TALEN®. Применение векторизации на основе AAV6 матриц в присутствии мРНК, кодирующей TRAC TALEN® (SEQ ID NO: 22 и 23) и PD1 TALEN® (SEQ ID NO: 24 и 25) или CD25 TALEN® (SEQ ID NO: 26 и 27), обеспечивает экспрессию анти-CD22 CAR в вплоть до 46% сконструированных Т-клеток (фиг. 3).
Для определения уровня интеграции IL15m в локусы CD25 и PD1 сконструированные Т-клетки активировали либо с помощью покрытых анти-CD3/CD28 гранул, либо с помощью экспрессирующих CD22 опухолевых клеток Raji. Через 2 дня после активации клетки выделяли и анализировали с помощью FACS, применяя экспрессию LNGFR в качестве имитатора секреции IL15/sIL15rα (фиг. 4 и 5). Полученные при создании изобретения результаты продемонстрировали, что покрытые анти-CD3/CD28 гранулы индуцировали экспрессию ΔLNGFR Т-клетками, содержащими IL-15m_CD25 или IL-15m_PD1, вне зависимости от присутствия анти-CD22 CAR (фиг. 4А-Б). Однако опухолевые клетки индуцировали экспрессию ΔLNGFR только Т-клетками, обработанными и CARm, и IL-15m. Это свидетельствует о том, что экспрессию ΔLNGFR можно специфически индуцировать посредством контакта опухолевой клетки с CAR (фиг. 5 и 6).
Как и ожидалось, эндогенный ген CD25 все еще экспрессировался в активированных обработанных Т-клетках (фиг. 7 и 8), в то время как экспрессия PD1 сильно нарушалась (фиг. 12).
Для подтверждения того, что экспрессия ΔLNGFR коррелировала с секрецией IL-15 в среду, Т-клетки, экспрессирующие анти-CD22 CAR и ΔLNGFR, инкубировали в присутствии экспрессирующих CD22 опухолевых клеток Raji (соотношение Е:Т=1:1) в течение в целом 10 дней. Супертанат собирали в дни 2, 4, 7 и 10 и присутствие IL15 оценивали количественно с помощью анализа ELISA. Полученные результаты продемонстрировали, что IL-15 секретировался в среду только Т-клетками, которые совместно обрабатывали матрицами и CARm, и IL15m вместе с соответствующими им TALEN® (фиг. 13). Т-клетки, обработанные любой одной из указанных матриц не обладали способностью секретировать какой-либо существенный уровень IL-15 относительно покоящихся Т-клеток. Важно отметить, что установлено, что уровень секреции IL-15 был кратковременным с максимальным пиком в день 4 (фиг. 14).
Для решения вопроса о том, может ли уровень секретированного IL-15 (SEQ ID NO: 59) влиять на активность CAR Т-клеток, CAR Т-клетки совместно культивировали в присутствии опухолевых клеток при соотношении Е:Т 5:1 в течение 4 дней. Их противоопухолевую активность вызывали ежедневно путем их пеллетирования и ресуспедирования в культуральной среде, лишенной IL-2 и содержащей свежие опухолевые клетки. Мониторинг противоопухолевой активности CAR Т-клеток осуществляли ежедневно путем измерения люминесценции оставшихся опухолевых клеток Raji, экспрессирующих люциферазу. Полученные результаты продемонстрировали, что CAR Т-клетки, коэкспрессирующие IL-15, обладали более высокой противоопухолевой активностью, чем клетки, лишенные IL-15, во все изученные моменты времени (фиг. 15).
Таким образом, в совокупности полученные результаты продемонстрировали, что при создании изобретения разработан способ, обеспечивающий осуществление одновременных таргетных инсерции кДНК CAR и IL-15 в локусы TRAC и CD25 или PD1. Указанная двойная таргетная инсерция приводила к сильной экспрессии анти-СD22 CAR и к секреции IL-15 в средах. Уровни секретируемого IL-15 оказались достаточными для повышения активности CAR Т-клеток.



































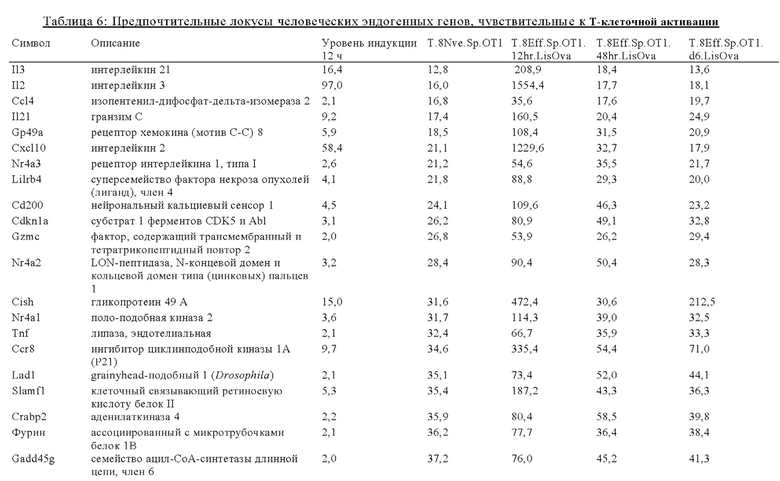
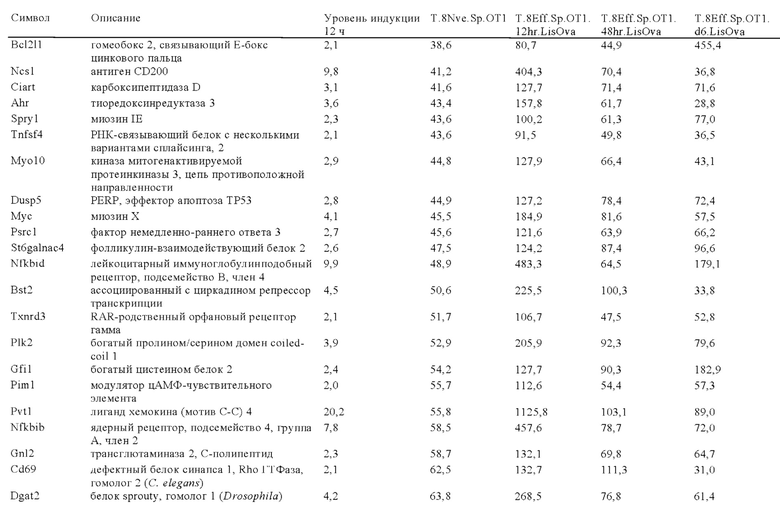
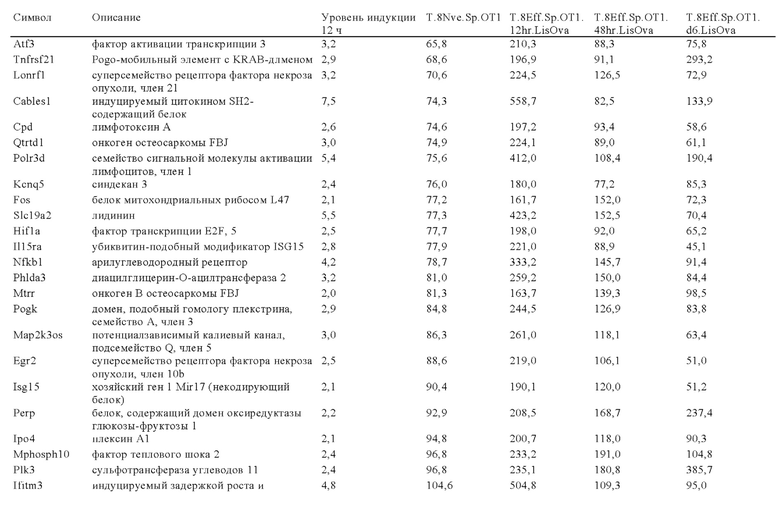
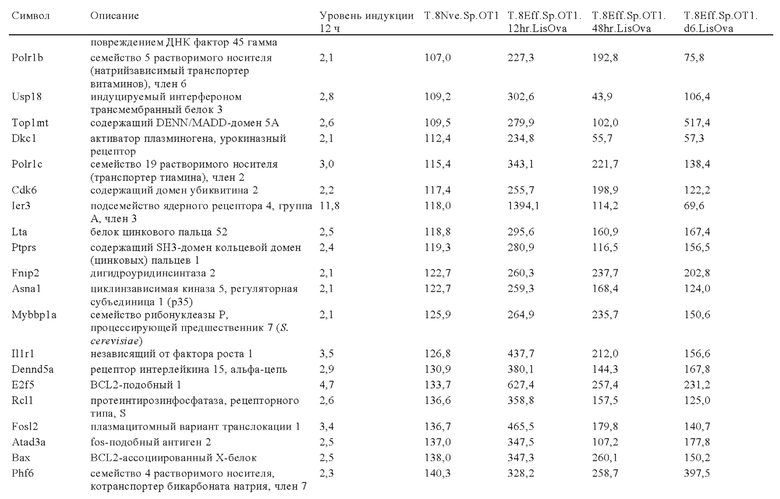
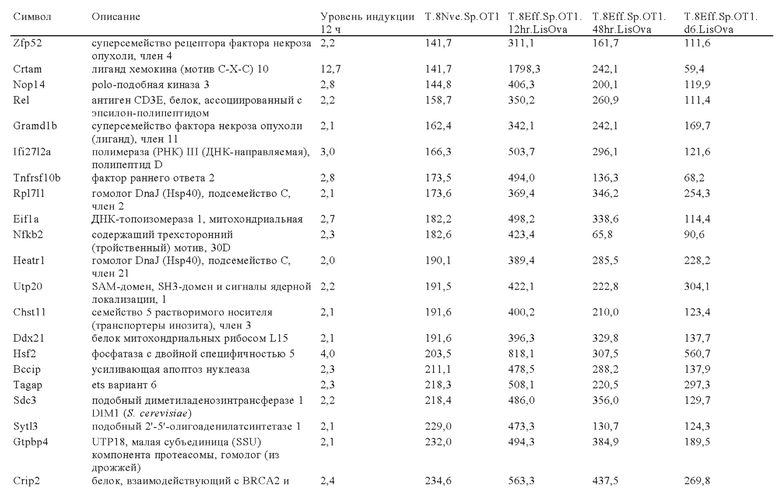
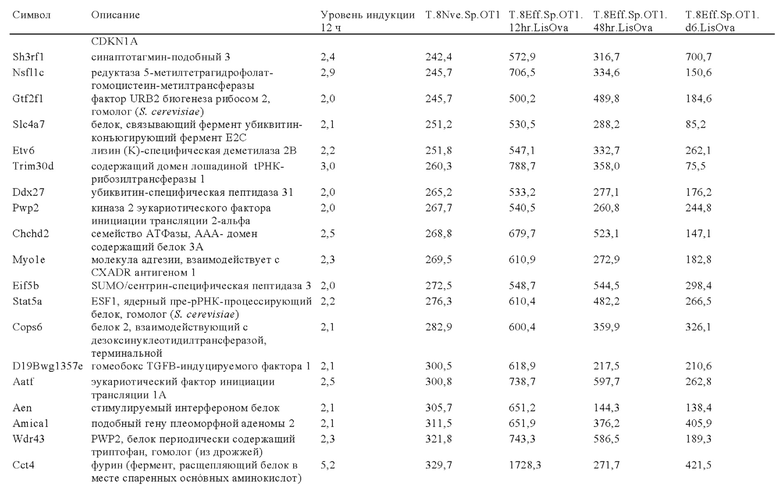
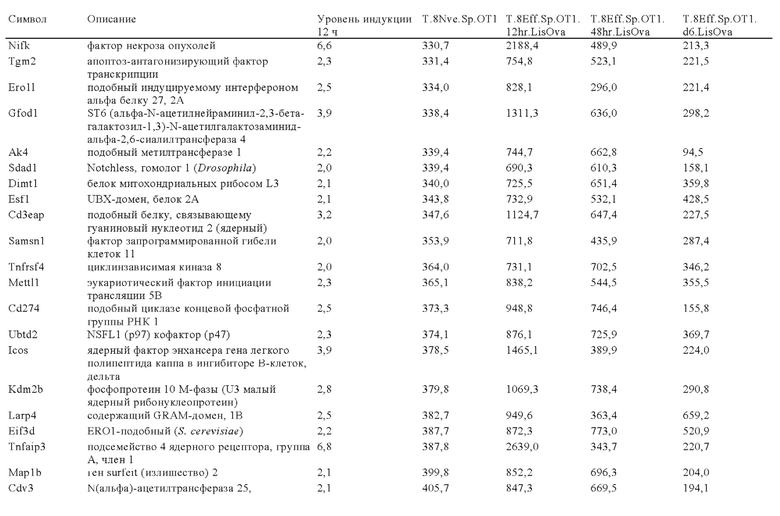
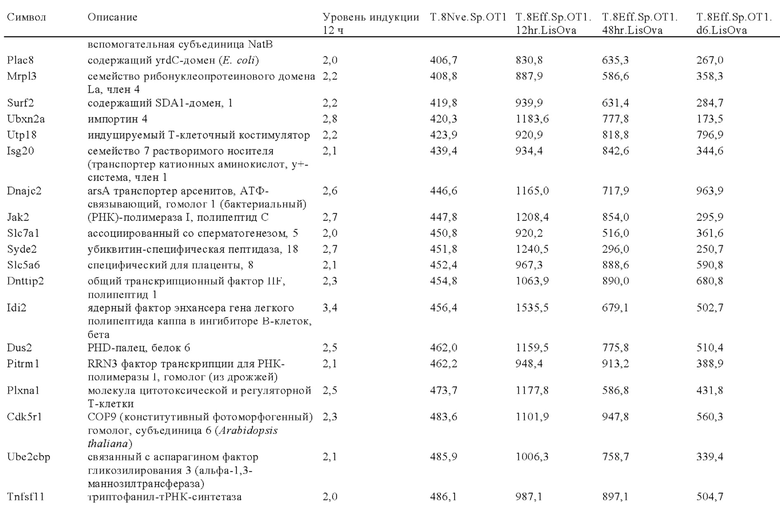
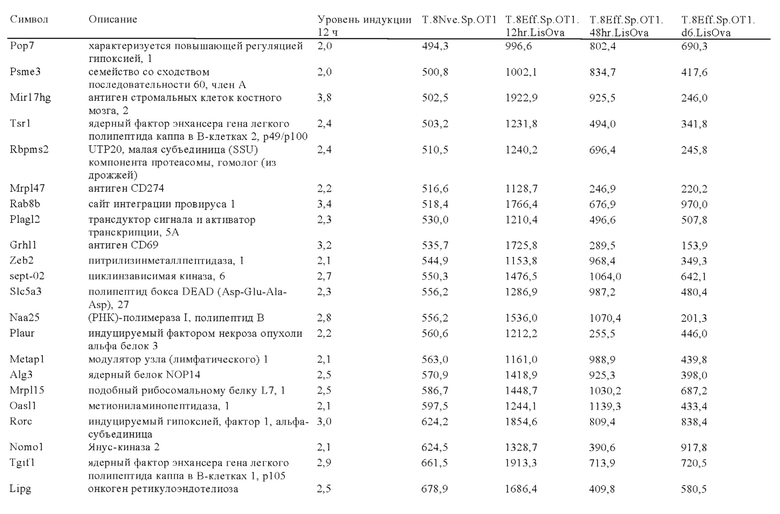
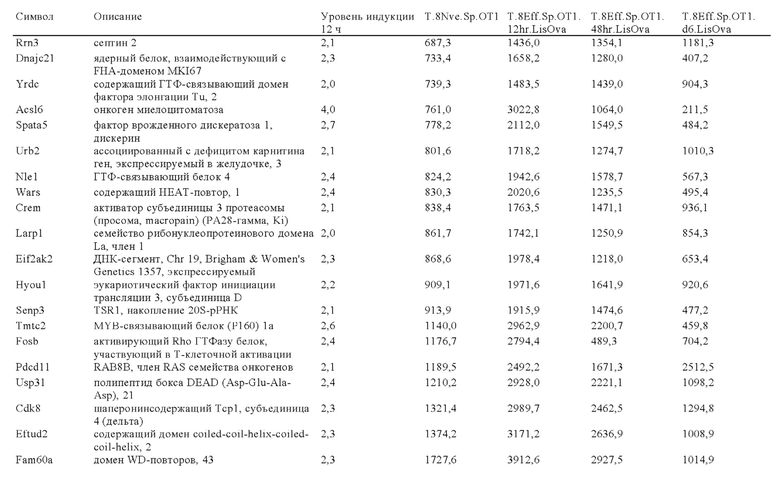










| название | год | авторы | номер документа |
|---|---|---|---|
| ЦЕЛЕВАЯ ГЕННАЯ ИНТЕГРАЦИЯ ГЕНОВ-ИНГИБИТОРОВ NK ДЛЯ УЛУЧШЕННОЙ ИММУННОЙ КЛЕТОЧНОЙ ТЕРАПИИ | 2018 |
|
RU2797304C2 |
| СПОСОБ СОЗДАНИЯ Т-КЛЕТОК, ПРИГОДНЫХ ДЛЯ АЛЛОГЕННОЙ ТРАНСПЛАНТАЦИИ | 2015 |
|
RU2752933C2 |
| НАЦЕЛИВАНИЕ НА КЛЕТКИ, ОПОСРЕДУЕМОЕ ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ | 2018 |
|
RU2783316C2 |
| МНОГОЦЕПОЧЕЧНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2663725C2 |
| СПОСОБЫ КОНСТРУИРОВАНИЯ АЛЛОГЕННЫХ И ВЫСОКОАКТИВНЫХ Т-КЛЕТОК ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2736616C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЙ РЕЦЕПТОР, И РОДСТВЕННЫЕ КОМПОЗИЦИИ | 2019 |
|
RU2835579C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19 | 2015 |
|
RU2718542C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |
| СПОСОБЫ КОНСТРУИРОВАНИЯ ВЫСОКОАКТИВНЫХ Т-КЛЕТОК ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2725542C2 |
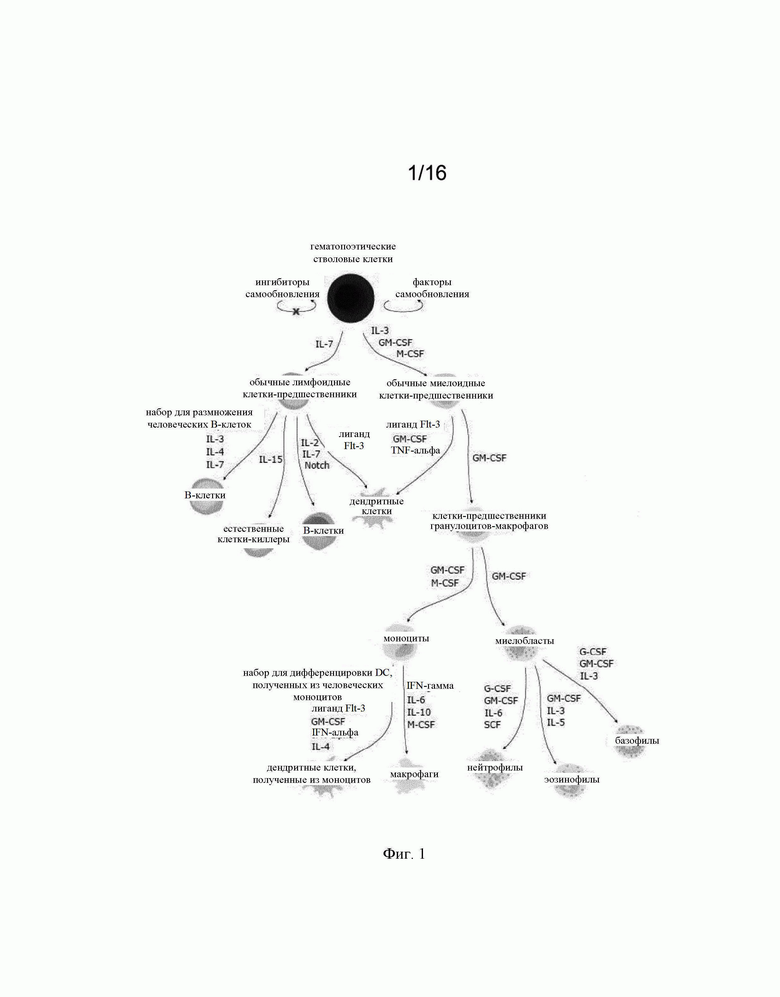
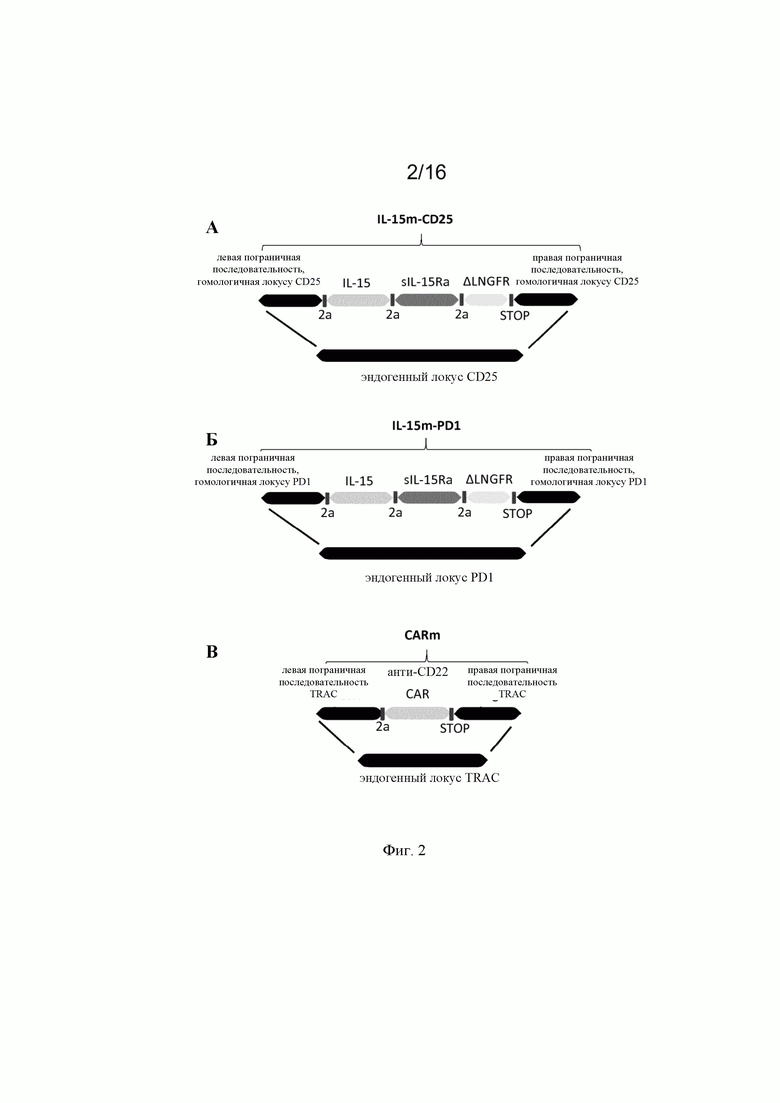
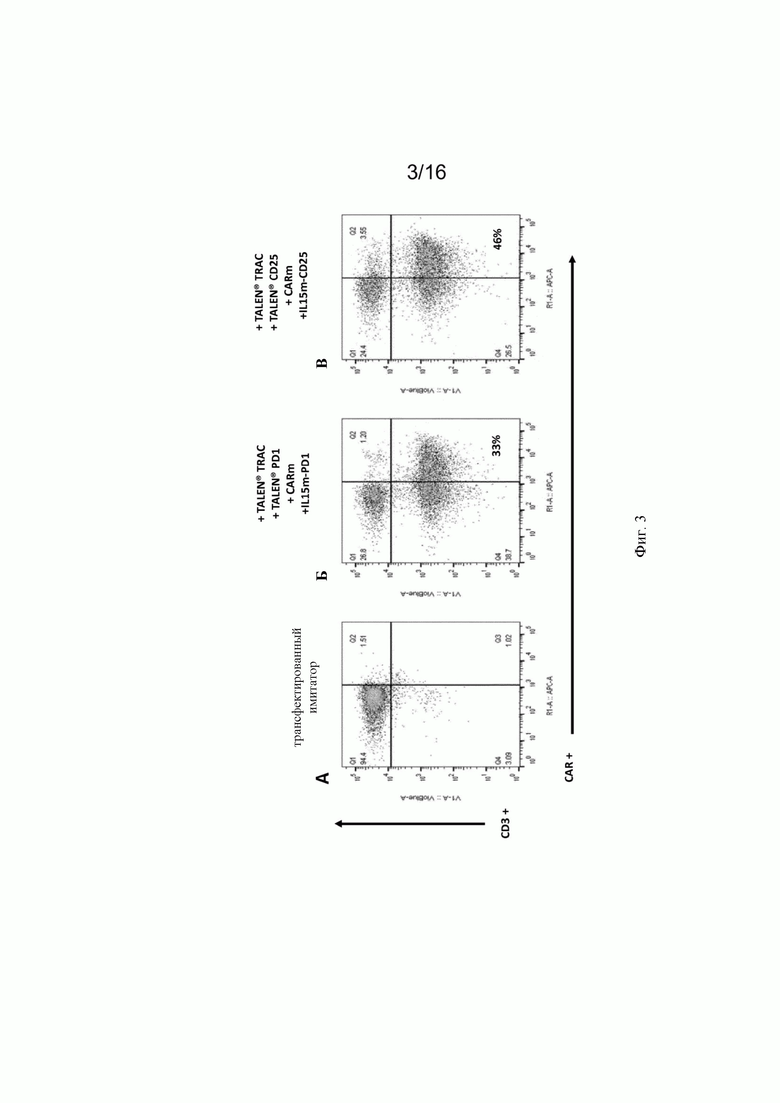
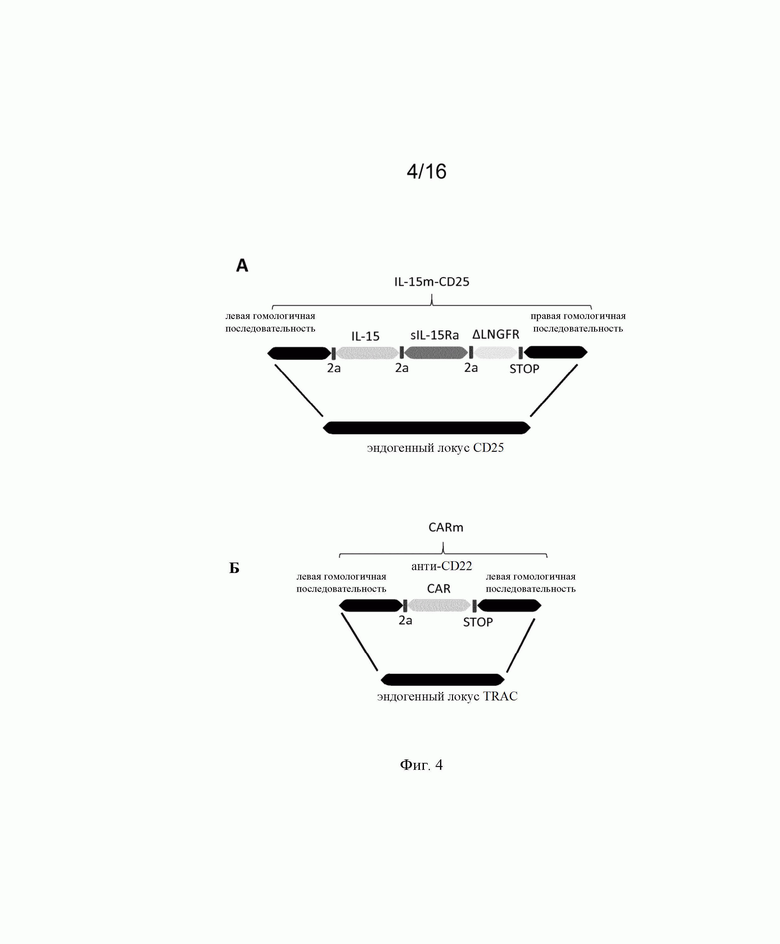
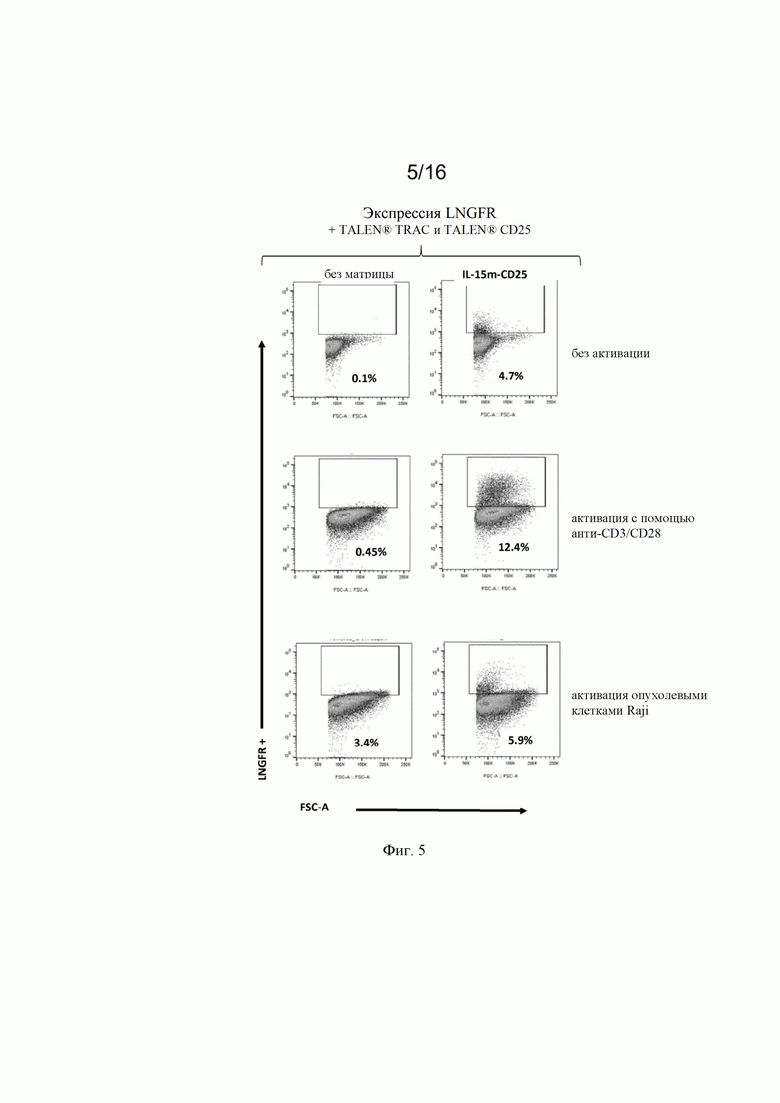
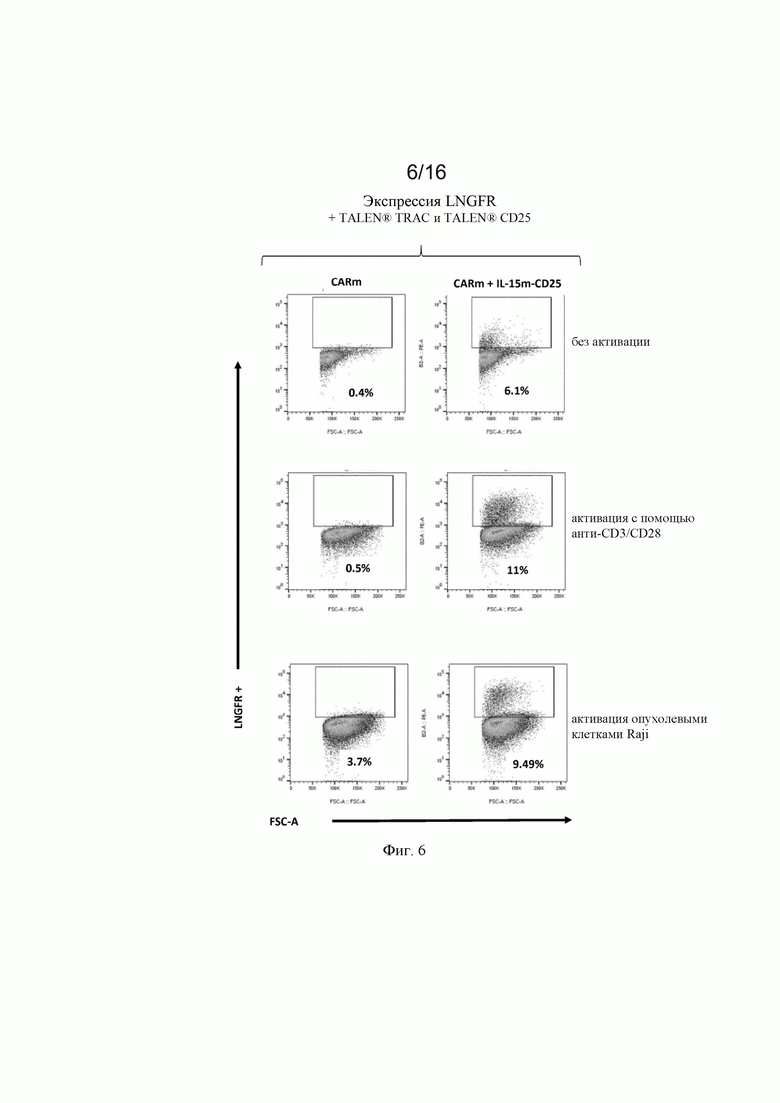
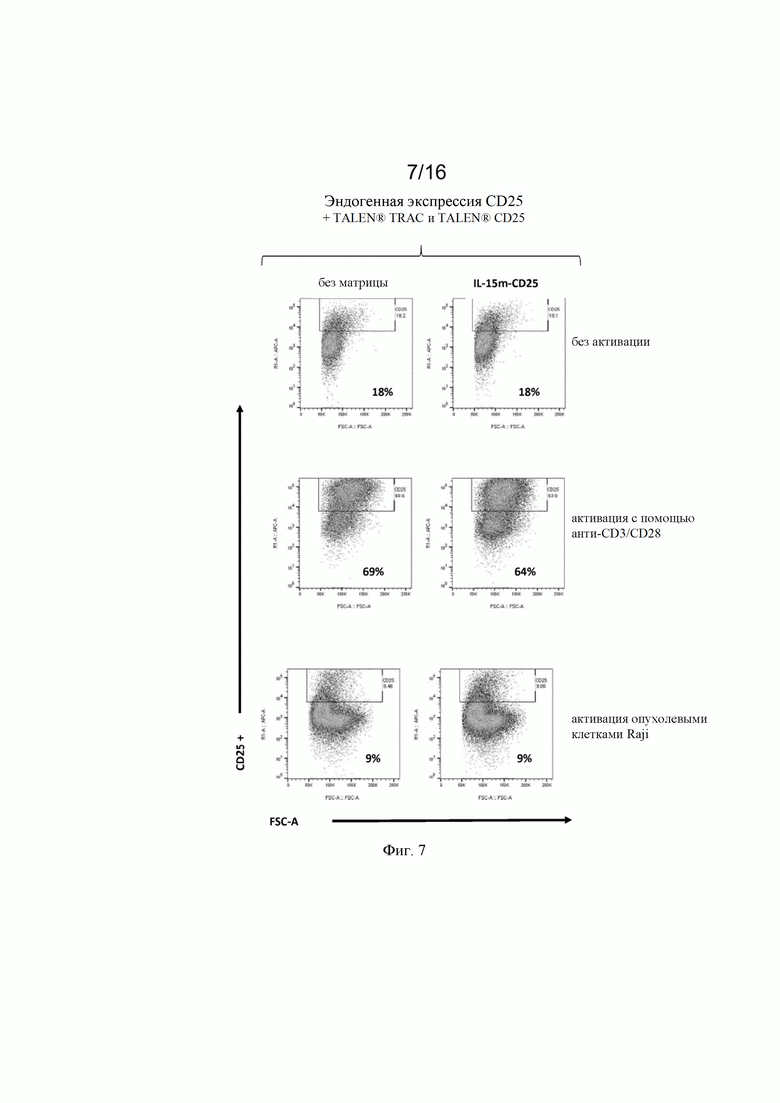
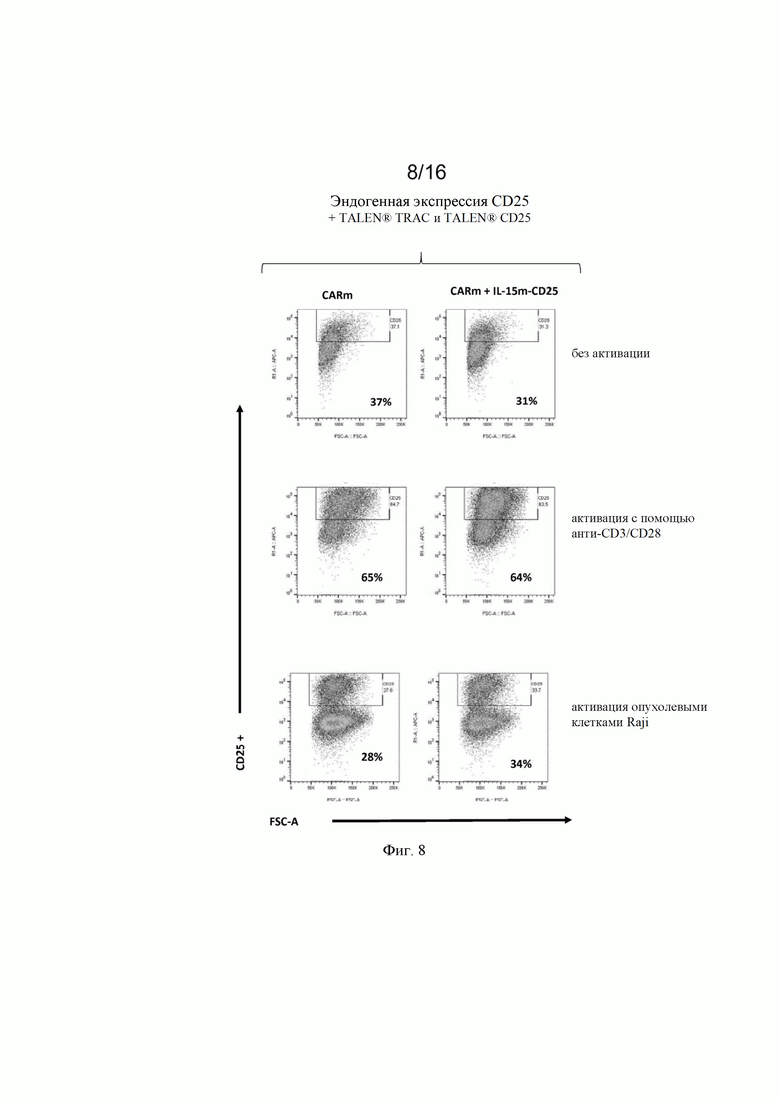
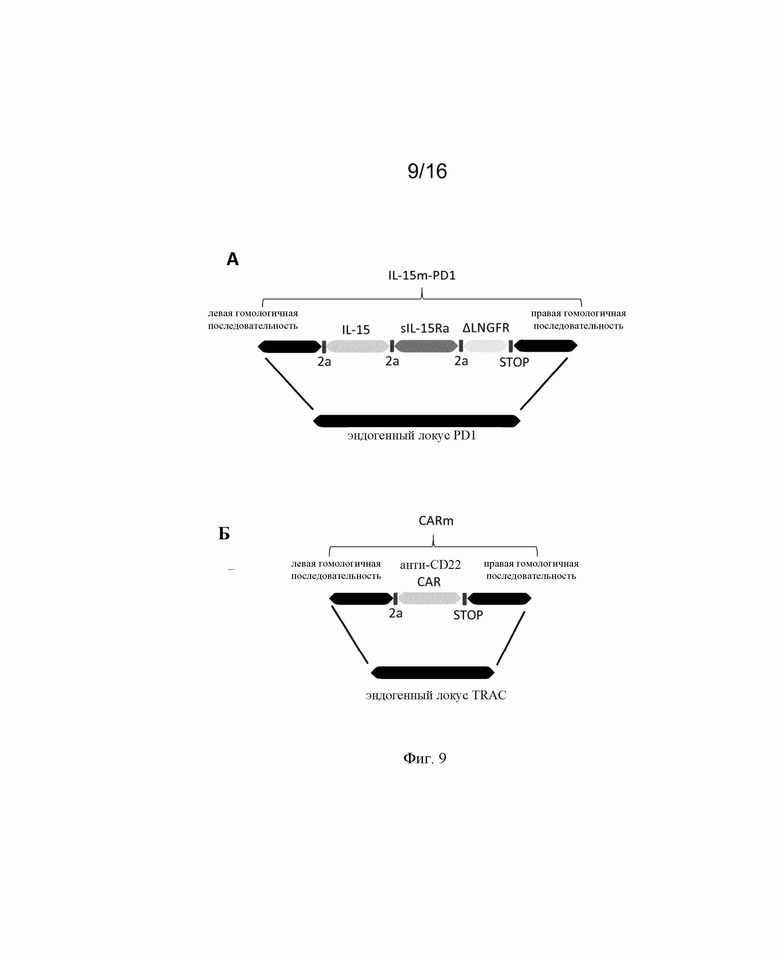
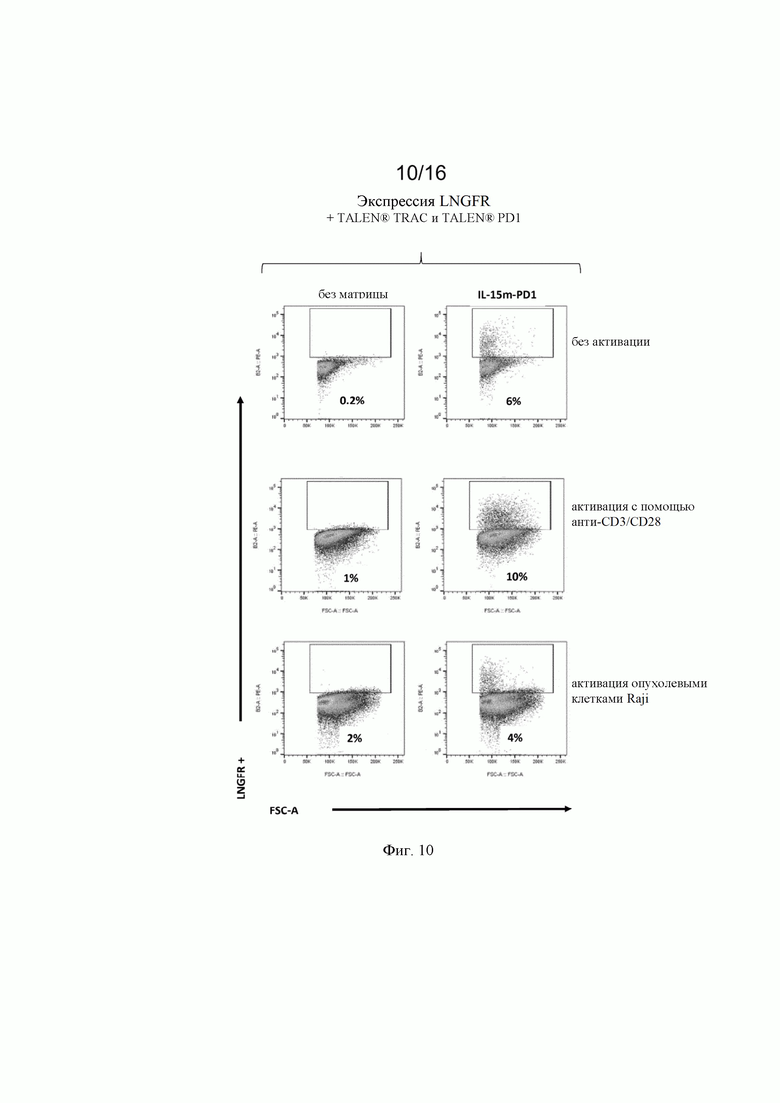
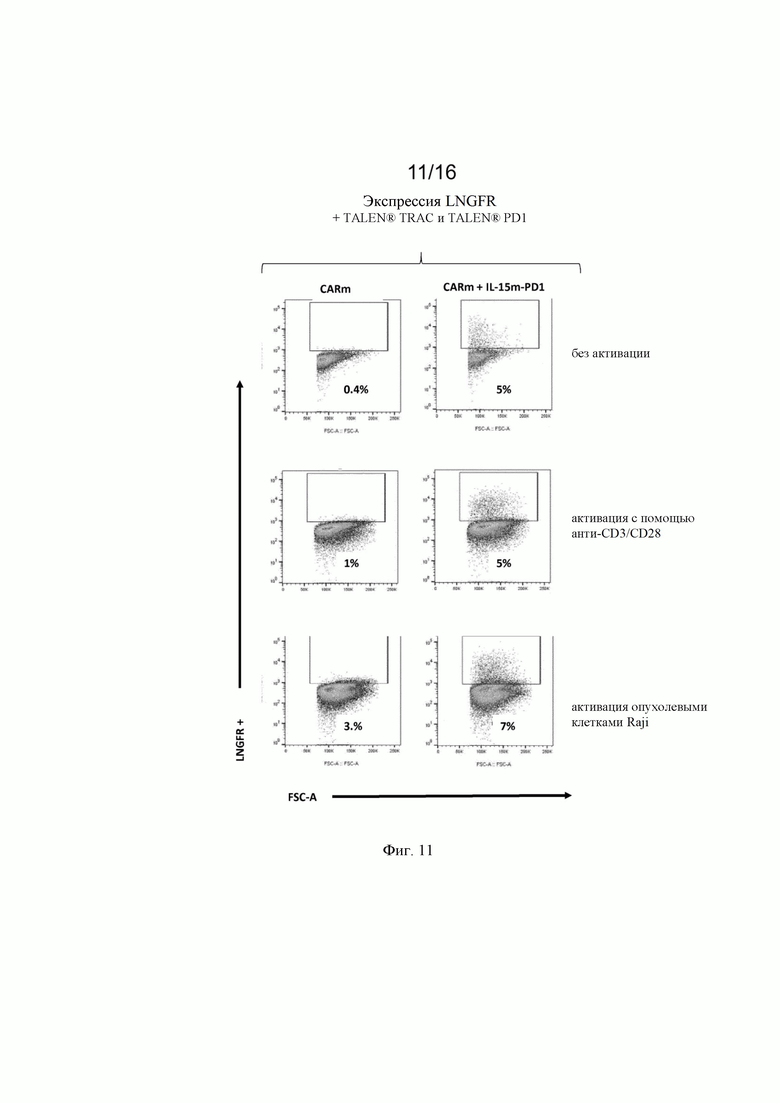
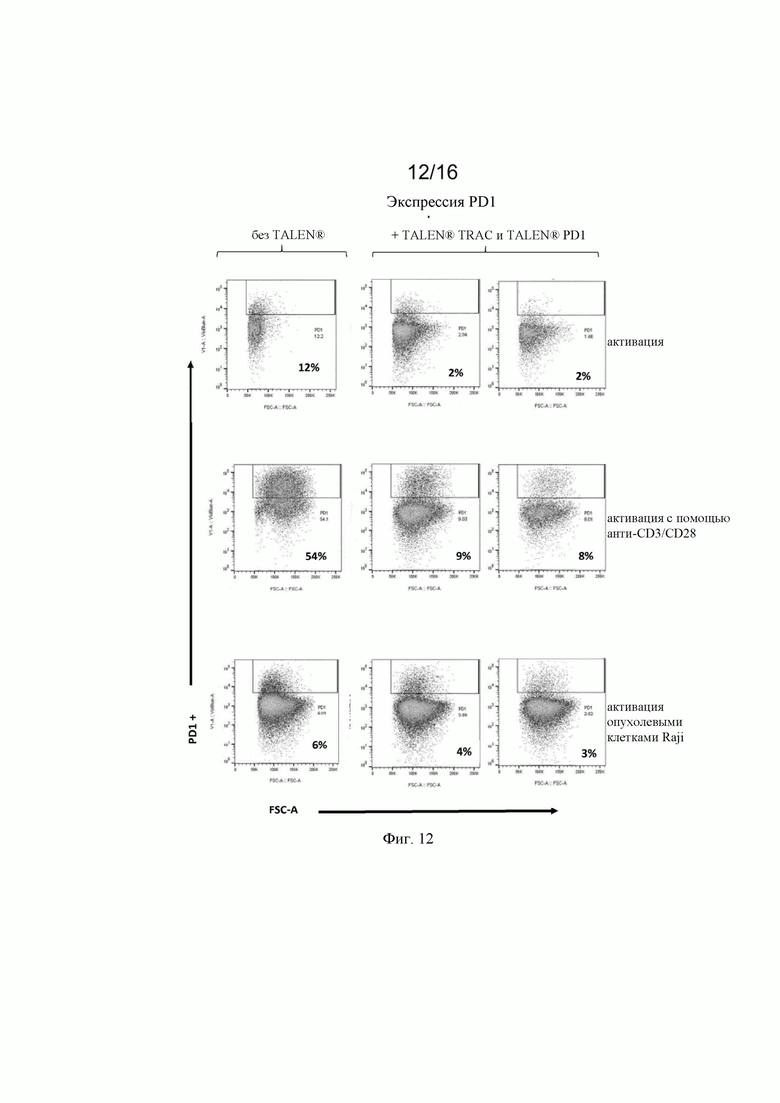
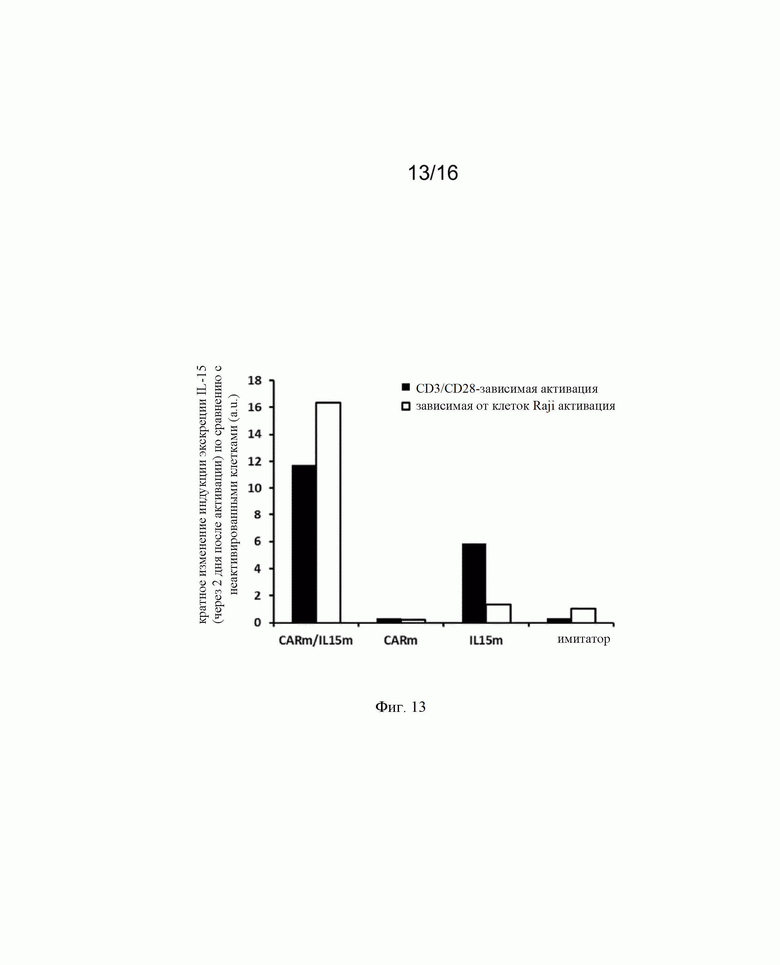
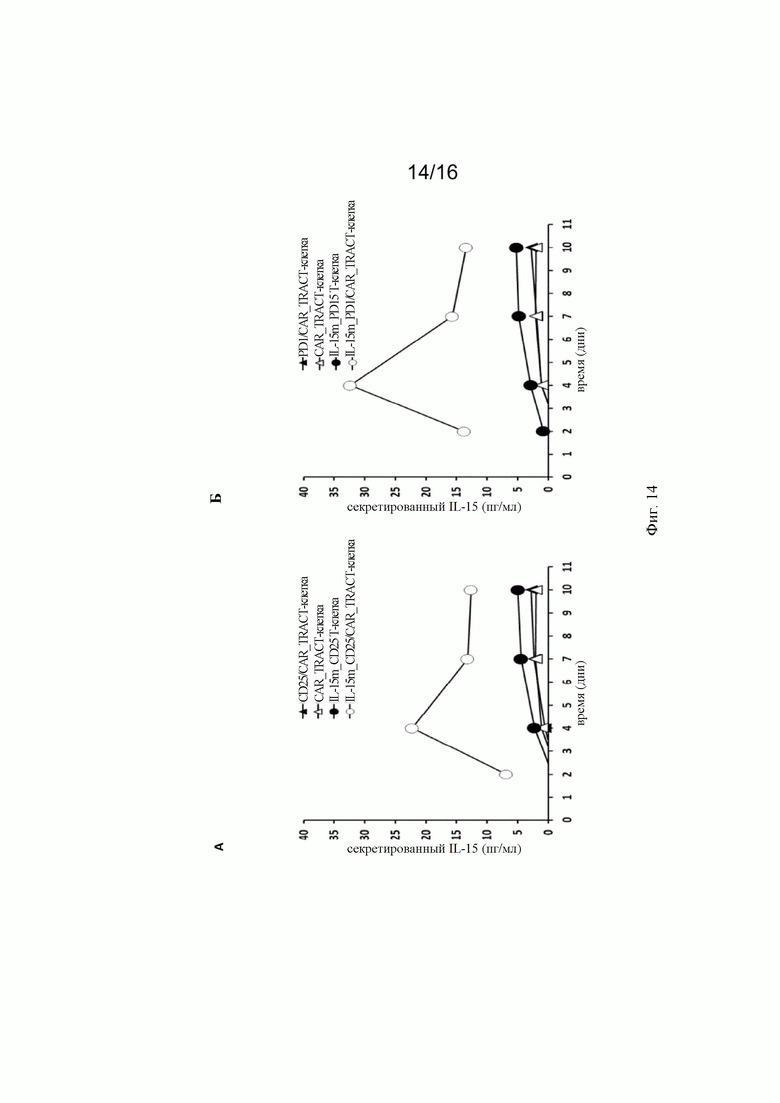
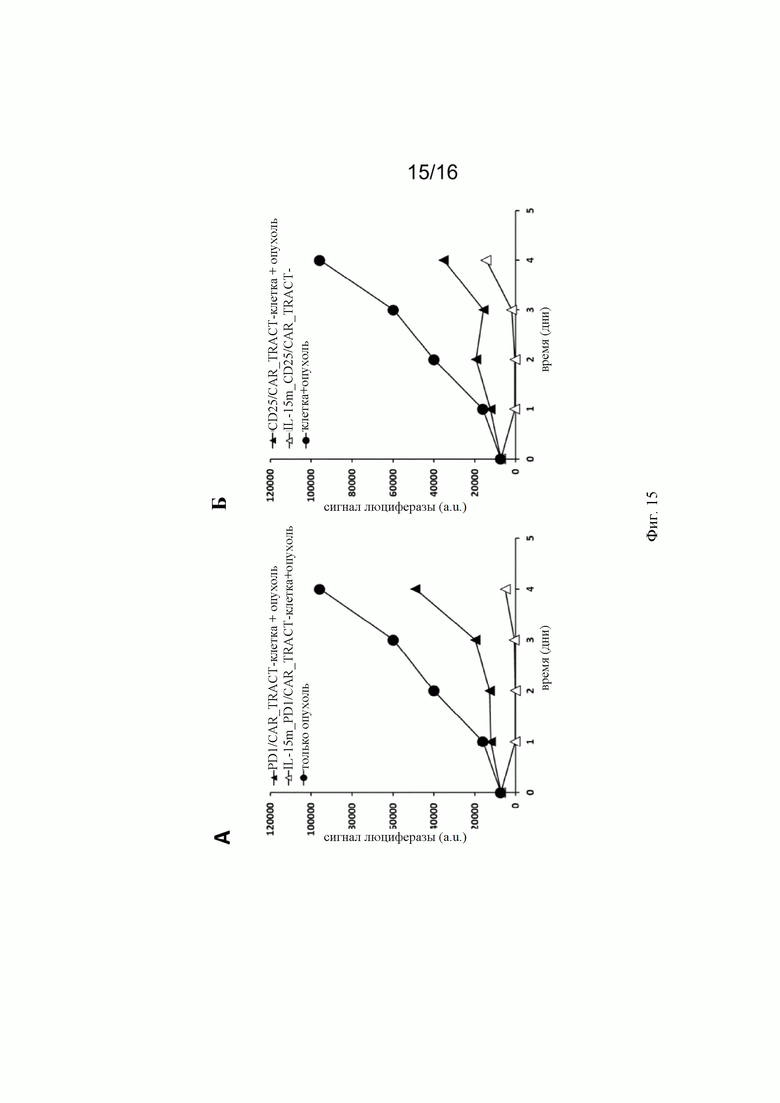
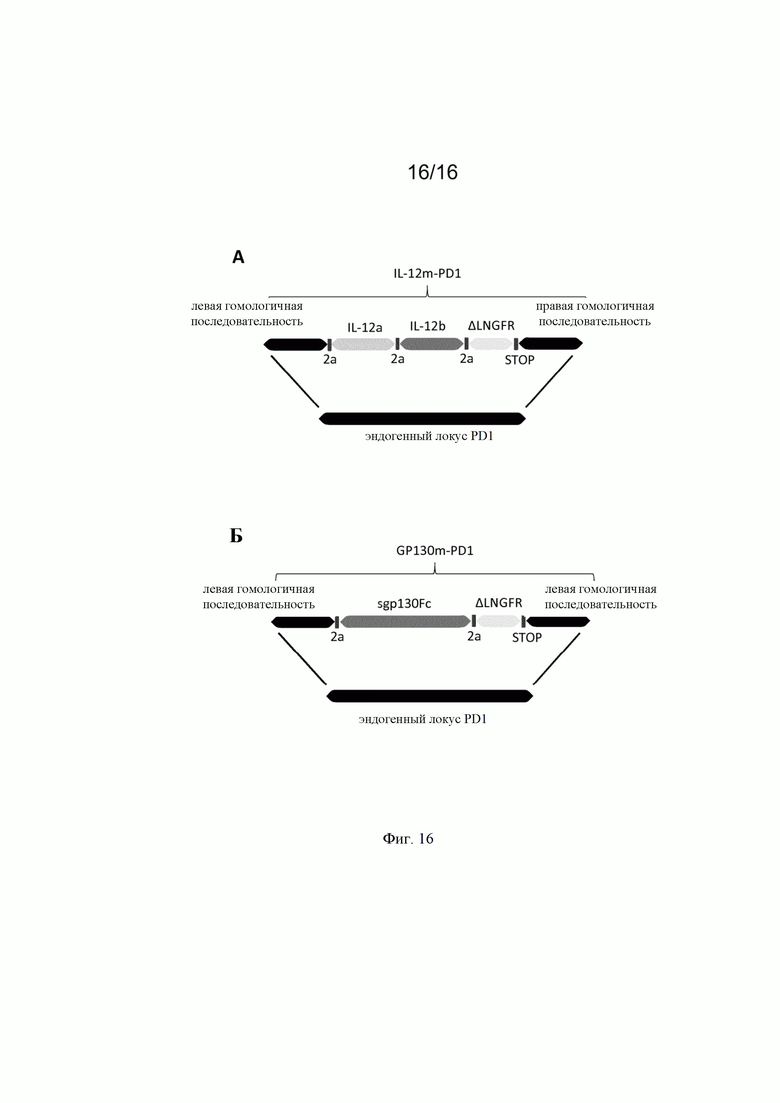
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ получения сконструированных Т-клеток или природных киллеров (NK) клеток для клеточной иммунотерапии, сконструированную Т-клетку или NK-клетку для применения в клеточной иммунотерапии, популяцию клеток для применения в иммунотерапии и фармацевтическую композицию для применения в лечении рака, где фармацевтическая композиция содержит сконструированную Т-клетку или NK-клетку или популяцию иммунных клеток. В одном из вариантов реализации способ включает стадии получения популяции первичных Т-клеток или NK-клеток и интродукции в указанные клетки нуклеиновой кислоты, содержащей экзогенную полинуклеотидную последовательность, кодирующую хемокин или цитокин, которые требуется интегрировать в эндогенный ген, и одного специфического для последовательности эндонуклеазного реагента. Изобретение расширяет арсенал средств для клеточной иммунотерапии. 4 н. и 16 з.п. ф-лы, 16 ил., 13 табл., 2 пр.
1. Способ получения сконструированных T-клеток или природных киллеров (NK) клеток для клеточной иммунотерапии, где способ включает:
- получение популяции первичных Т-клеток или NK-клеток;
- интродукцию в указанные Т-клетки или NK-клетки:
I) нуклеиновой кислоты, содержащей экзогенную полинуклеотидную последовательность, кодирующую хемокин или цитокин, которую требуется интегрировать в эндогенный ген, выбранный из гена, кодирующего PD1, CTLA4, PPP2CA, PPP2CB, PTPN6, PTPN22, LAG3, HAVCR2, BTLA, CD160, TIGIT, CD96, CRTAM, LAIR1, SIGLEC7, SIGLEC9, CD244, TNFRSF10B, TNFRSF10A, CASP8, CASP10, CASP3, CASP6, CASP7, FADD, FAS, TGFBRII, TGFRBRI, SMAD2, SMAD3, SMAD4, SMAD10, SKI, SKIL, TGIF1, IL10RA, IL10RB, HMOX2, IL6R, IL6ST, EIF2AK4, CSK, PAG1, SIT1, FOXP3, PRDM1, BATF, GUCY1A2, GUCY1A3, GUCY1B2, GUCY1B3, CD25, CD69, TGFb, IL-10, IL-10R, GCN2, PRDM1, DCK, HPRT, GGH или CD52, или эндогенный ген, выбранный из Spata6, Itga6, Rcbtb2, Cd1d1, St8sia4, Itgae, Fam214a, IL3, IL2, Ccl4, IL21, Gp49a, Nr4a3, Lilrb4, Cd200, Cdkn1a, Gzmc, Nr4a2, Cish, Ccr8, Lad1, Crabp2; Gzmb, Tbx21, Plek, Chek1, Slamf7, Zbtb32, Tigit, Lag3, Gzma, Wee1, IL12rb2, Eea1 и Dtl;
II) одного специфического для последовательности эндонуклеазного реагента, выбранного из направляемых РНК или ДНК эндонуклеаз, таких как Cas9 или Cpf1, TAL-эндонуклеазы, нуклеазы цинковых пальцев, самонаводящаяся эндонуклеаза или любая их комбинация, и который специфично нацелен на указанный выбранный эндогенный ген,
в котором указанную экзогенную полинуклеотидную последовательность встраивают путем интеграции таргетного гена в указанный эндогенный ген так, что указанная экзогенная полинуклеотидная последовательность формирует экзогенную кодирующую последовательность под транскрипционным контролем эндогенного промотора, присутствующего в указанном гене, и где химерный антигенный рецептор (CAR) или модифицированный TCR независимо экспрессируется в трансфицированных Т-клетках или NK-клетках.
2. Способ по п. 1, в котором указанный специфический для последовательности реагент является реагентом, представляющим собой эндонуклеазу.
3. Способ по п. 1 или 2, в котором указанную интеграцию таргетного гена осуществляют путем гомологичной рекомбинации или негомологичным соединением концов (NHEJ) в указанных Т-клетках или NK-клетках.
4. Способ по одному из пп. 1-3, в котором указанная молекула, кодируемая указанной экзогенной кодирующей последовательностью, представляет собой РНК-транскрипт, такой как РНКi, или полипептид, такой как функциональный белок.
5. Способ по одному из пп. 1-4, в котором указанная экзогенная последовательность кодирует интерлейкин-2 (IL-2), интерлейкин 12 (IL-12) или интерлейкин (IL-15).
6. Способ по одному из пп. 1-5, в котором указанный специфический представляющий собой эндонуклеазу реагент интродуцируют с помощью электропорации в виде полипептида или мРНК, которая транслируется в клетке.
7. Способ по одному из пп. 1-6, в котором указанную экзогенную нуклеиновую кислоту, содержащую указанную кодирующую последовательность, включают в ДНК-вектор, предпочтительно вирусный вектор, такой как AAV-вектор.
8. Способ по п. 7, в котором нуклеиновую кислоту, кодирующую указанный специфический для последовательности реагент, представляющий собой эндонуклеазу, и указанную экзогенную нуклеиновую кислоту - обе включают в указанный ДНК-вектор.
9. Способ по одному из пп. 1-8, в котором перед или после экзогенной последовательности, которую интродуцируют в Т-клетки или NK-клетки, помещают последовательность, кодирующую 2A-пептид, для обеспечения транскрипции указанной экзогенной кодирующей последовательности вместе по меньшей мере с одной частью эндогенного гена.
10. Способ по одному из пп. 1-9, в котором интродуцируют экзогенную последовательность, обладающую способностью инактивировать экспрессию по меньшей мере одной эндогенной геномной последовательности, исходно присутствующей в указанном эндогенном гене.
11. Способ по п. 10, в котором указанная эндогенная геномная последовательность, подлежащая инактивации, кодирует TGFb, TGFbR, IL-10, IL-10R, GCN2 или PRDM1.
12. Способ по п. 10, в котором указанная эндогенная геномная последовательность, подлежащая инактивации, кодирует PD1, PDL1, CTLA4, TIM3 или LAG3.
13. Способ по п. 10, в котором указанная эндогенная геномная последовательность, подлежащая инактивации, экспрессирует DCK, HPRT или GGH.
14. Способ по одному из пп. 1-13, в котором указанные Т-клетки или NK-клетки представляют собой первичные T-клетки или NK-клетки соответственно.
15. Сконструированная Т-клетка или NK-клетка для применения в клеточной иммунотерапии, где Т-клетка или NK-клетка оснащена химерным антигенным рецептором и содержит экзогенную полинуклеотидную последовательность, кодирующую хемокин или цитокин под транскрипционным контролем промотора эндогенного гена, презентируемого на эндогенном гене, выбранном из гена, кодирующего PD1, CTLA4, PPP2CA, PPP2CB, PTPN6, PTPN22, LAG3, HAVCR2, BTLA, CD160, TIGIT, CD96, CRTAM, LAIR1, SIGLEC7, SIGLEC9, CD244, TNFRSF10B, TNFRSF10A, CASP8, CASP10, CASP3, CASP6, CASP7, FADD, FAS, TGFBRII, TGFRBRI, SMAD2, SMAD3, SMAD4, SMAD10, SKI, SKIL, TGIF1, IL10RA, IL10RB, HMOX2, IL6R, IL6ST, EIF2AK4, CSK, PAG1, SIT1, FOXP3, PRDM1, BATF, GUCY1A2, GUCY1A3, GUCY1B2, GUCY1B3, CD25, CD69, TGFb, IL-10, IL-10R, GCN2, PRDM1, DCK, HPRT, GGH или CD52, или эндогенный ген, выбранный из Spata6, Itga6, Rcbtb2, Cd1d1, St8sia4, Itgae, Fam214a, IL3, IL2, Ccl4, IL21, Gp49a, Nr4a3, Lilrb4, Cd200, Cdkn1a, Gzmc, Nr4a2, Cish, Ccr8, Lad1, Crabp2, Gzmb, Tbx21, Plek, Chek1, Slamf7, Zbtb32, Tigit, Lag3, Gzma, Wee1, IL12rb2, Eea1 и Dtl.
16. Сконструированная иммунная Т-клетка или NK-клетка по п. 15, где указанная Т-клетка или NK-клетка представляет собой первичную T-клетку или NK-клетку соответственно.
17. Сконструированная иммунная клетка по п. 15 или 16, где указанная клетка экспрессирует первую экзогенную последовательность, кодирующую CAR в локусе TCR, нарушая тем самым экспрессию TCR, и экспрессирует вторую экзогенную последовательность, кодирующую хемокин или цитокин, под транскрипционной активностью промотора эндогенного гена, выбранном из гена, кодирующего PD1, CD25, CD71 или CD69.
18. Сконструированная иммунная клетка по одному из пп. 15-17, в которой указанный транскрипционный контроль указанного промотора эндогенного гена является чувствительным к сигналу активации указанного химерного антигенного рецептора (CAR).
19. Популяция клеток по одному из пп. 15-18 для применения в иммунотерапии.
20. Фармацевтическая композиция для применения в лечении рака, где указанная композиция содержит сконструированную Т-клетку или NK-клетку по одному из пп. 15-18 или популяцию иммуногенных клеток по п. 19, содержащая от 104 до 109 клеток для введения на кг массы тела пациентам, нуждающимся в этом.
| WO 2014191128 A1, 04.12.2014 | |||
| WO 2014184744 A1, 20.11.2014 | |||
| WO 2015155341 A1, 15.10.2015 | |||
| WO 2015075195 A1, 28.05.2015 | |||
| СКОНСТРУИРОВАННЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ МНОЖЕСТВЕННЫЕ ИММУНОМОДУЛЯТОРЫ, И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2573912C2 |
Авторы
Даты
2024-08-06—Публикация
2017-10-19—Подача