Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биологии, медицины, биотехнологии и касается способа проведения полимеразной цепной реакции (ПЦР) и устройства для его осуществления с регистрацией накопления продуктов реакции в режиме реального времени (ПЦР в реальном времени, ПЦР РВ). Предложенный способ и устройство могут быть использованы в медицине, ветеринарии, пищевой промышленности, при исследовании окружающей среды и в других областях, связанных с выявлением, идентификацией и количественной оценкой нуклеиновых кислот в исследуемых образцах.
ПЦР представляет собой многократно повторяющиеся циклы синтеза определенной области ДНК (амплификацию), вызванные циклической сменой температуры реакционной смеси и приводящие к экспоненциальному увеличению количества фрагмента ДНК, ограниченного двумя олигонуклеотидными праймерами. При циклическом изменении температуры реакционной смеси, известном специалистам в данной области как термоциклирование, последовательно происходят следующие стадии: денатурация двухцепочечной молекулы ДНК мишени (плавление), присоединение олигонуклеотидных праймеров к комплементарным участкам образовавшихся одноцепочечных молекул ДНК мишени (отжиг) и достройка праймеров с помощью термостабильной полимеразы до образования протяженных фрагментов комплементарных ДНК молекул (элонгация). Условия, при которых выполняются указанные стадии, хорошо известны специалистам в данной области.
ПЦР применяется для амплификации нуклеиновых кислот и позволяет выявить и идентифицировать присутствие, а также определить количество нуклеиновой кислоты с искомой последовательностью нуклеотидов в ДНК- или РНК-образце.
Для проведения ПЦР готовят реакционную смесь в буферном растворе, содержащую, как правило, термостабильную полимеразу, дезоксинуклеозид-трифосфаты (дНТФ), прямой и обратный олигонуклеотидные праймеры, ионы магния, в которую добавляют анализируемую нуклеиновую кислоту для ее амплификации, с последующей регистрацией амплифицированных нуклеотидных последовательностей.
Для регистрации результатов реакции в режиме реального времени реакцию проводят в термоциклере, снабженном флуоресцентным детектором, в присутствии либо флуоресцентных интеркалирующих красителей, либо флуоресцентно-меченых олигонуклеотидных праймеров или зондов.
Термины и определения
Термическая масса объекта (Дж/К), равная теплоемкости материала, из которого он изготовлен, умноженной на его массу, характеризует способность рассматриваемого объекта изменять свою температуру при подведении или отведении тепловой энергии. Полная термическая масса составного объекта, содержащего несколько частей из различных материалов, равна сумме термических масс всех его частей.
Коэффициент теплопроводности материала (Вт/м·К) характеризует способность материала проводить тепловую энергию.
Тепловая проводимость объекта (Вт/К), равная произведению коэффициента теплопроводности материала, из которого он сделан, на площадь поверхности теплообмена, деленному на толщину материала, характеризует способность объекта проводить тепловую энергию через поверхность теплообмена.
Коэффициент тепловой диффузии (м2/с), равный отношению теплопроводности материала к произведению его теплоемкости на его плотность, характеризует способность материала к тепловому обмену с окружающей средой по отношению к процессу накопления тепла в самом материале.
Для системы, содержащей два объекта: первый, нагреваемый или охлаждаемый, и второй, через который происходит теплообмен, справедлива следующая характеристика. Отношение термической массы первого объекта к тепловой проводимости второго объекта, выражаемое в секундах, характеризует способность системы быстро подводить к и отводить тепло от первого объекта через второй.
Уровень техники
Существующие методы проведения ПЦР с использованием коммерчески доступного оборудования, как правило, основаны на применении полимерных пробирок, которые устанавливаются в металлические нагревательные блоки. Высокая термическая масса стандартных нагревательных блоков с установленными в них пробирками и образцами, невысокая теплопроводность материала стенок пробирок ограничивают скорость нагрева и охлаждения образца, а также могут приводить к высокой неоднородности температурного поля в образце, находящемся в пробирке.
При использовании обычных лабораторных приборов, предназначенных для выполнения ПЦР в полимерных пробирках или планшетах, рекомендуемое время поддержания температуры в термоцикле составляет 2 или более минут. Например, Ausubel et al., eds. (1996) Current Protocols in Molecular Biology, Current Protocols, Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., рекомендуют использовать 5 минут на цикл, без учета времени, которое тратится на переходы между температурными уровнями. В результате, ПЦР процесс из 40 циклов с использованием обычного оборудования при объеме пробы 20-50 мкл может занять 3 или более часов.
В последние годы для сокращения времени, затрачиваемого на один цикл, было предложено много методов проведения ПЦР в миниатюрных реакционных контейнерах. Для ускорения времени, требуемого на переход между температурными уровнями, в подобных устройствах существенно уменьшена масса нагревательного элемента, масса контейнеров и объем образцов, что позволило сократить термическую массу, применяются материалы с высокими коэффициентами теплопроводности и повышается соотношение площади поверхности образца к его объему, а также для нагревания используются способы бесконтактного подвода тепла к образцам. Например, прибор RapidCycler (Idaho Technologies, Inc., США) позволяет относительно быстро изменять температуру ПЦР смеси при переходе между температурными уровнями и обеспечивает относительно эффективный перенос тепла от нагревателя к образцам. В этом устройстве 30 циклов ПЦР РВ могут быть завершены за 10 минут.
Известны также методы, реализованные в микрофлюидных устройствах, позволяющие сократить время, требуемое на один цикл. Например, Kорр et al. (1998) Science, 280:1046, описывает устройство, в котором ПЦР смесь последовательно протекает по микроканалу в виде меандра, выполненному в микрофлюидном чипе, через три температурные зоны, что приводит к циклической смене температуры ПЦР смеси в течение 20 термоциклов. Так как поперечное сечение микроканала относительно мало, то температура раствора внутри микроканала устанавливается достаточно быстро. Время, в течение которого смесь находится при определенной температуре, в этом случае регулируется при помощи скорости потока. Авторами показана возможность выполнения ПЦР в описанном устройстве при времени цикла, равном 6,6 секунд.
Таким образом, применение микрочиповых технологий позволяет существенно сократить время цикла ПЦР и соответственно сократить время ПЦР анализа и увеличить производительность.
Однако реализация ПЦР РВ в подобных микрофлюидных устройствах сталкивается с определенными трудностями.
Увеличение соотношения площади поверхности между микрореактором и образцом к объему вызывает снижение активности и даже необратимую деактивацию фермента полимеразы. На поверхностях таких материалов, как кремний, металлы, кварц, стекло, наблюдается необратимая сорбция ДНК и фермента, других компонентов реакции. Для устранения указанных ограничений требуется добавление в реакционную смесь дополнительных веществ, предотвращающих сорбцию и деактивацию компонентов ПЦР, например введение аминокислот, белков и поверхностно-активных веществ [патент США 6,660,517 "Mesoscale polynucleotide amplification devices"]. В этом же патенте раскрываются также способы, позволяющие создавать защитное покрытие поверхностей микрореакторов, в которых проводится ПЦР. Подобные покрытия предотвращают адсорбцию и ингибирование компонентов ПЦР, что позволяет достичь высокой чувствительности ПЦР анализа.
Одной из известных для специалистов проблем при проведении ПЦР является испарение образцов при термоциклировании. Так как температура денатурации ДНК близка к температуре кипения водных растворов, интенсивное испарение ПЦР смеси во время реакции может препятствовать протеканию ПЦР, что в стандартных устройствах, как правило, устраняется либо путем изолирования водной поверхности смеси от атмосферы при помощи жидкости, несмешивающейся с водой, например минерального масла, либо путем герметизации реакционных сосудов при помощи нагреваемой крышки.
В закрытых каналах микрофлюидных чипов возможно герметизировать микрореакторы при помощи клапанов в микроканале [патент США 7,118,910 «Microfluidic device and methods of using same»]. Реализация подобного способа герметизации технически сложна и увеличивает стоимость анализа с использованием такого микрочипа.
Для микрочипов, содержащих открытые реакционные ячейки, известны способы изоляции реакционной смеси от атмосферы, заключающиеся в нанесении на поверхность водного раствора реакционной смеси несмешивающейся с водой жидкости, например минерального или силиконового масла [патент США 6,664,044 «Method for conducting PCR protected from evaporation»], для предотвращения испарения образцов при термоциклировании. Однако в описанном устройстве для ввода рабочей ПЦР смеси и образцов многократно задействована система струйной печати, что может привести к неконтролируемой деградации ПЦР реактивов и взаимному загрязнению образцов в процессе нанесения. Известен способ и устройство [патентная заявка США 20070196237 «Apparatus for regulating the temperature of a biological and/or chemical sample and method of using the same»], в котором используется микрочип с нанесенными на поверхность подложки реакционными объемами, представляющими собой каплю несмешивающейся с водой жидкости, в которую помещена ПЦР смесь. Однако в этом способе реакционная смесь отделена от нагреваемой поверхности подложки слоем несмешивающейся с водой жидкости, как правило, обладающей невысокой теплопроводностью, что замедляет процесс нагрева и охлаждения. Кроме того, в этом способе реакционные объемы могут неконтролируемо перемещаться, т.к. вся поверхность теплопроводящей подложки изотропна, что потенциально может приводить к пространственному несовпадению нагреваемой зоны и нагреваемого образца в процессе ввода пробы и термоциклирования, что приведет к недостоверным результатам ПЦР анализа.
Еще одним недостатком, общим для известных микрофлюидных устройств, является повышенная трудоемкость смешивания образцов с компонентами ПЦР смеси до ввода в микрочип. Кроме того, эта процедура требует затрат на дополнительные расходные материалы (пластиковые наконечники, пробирки) и практически нереализуема в обычных пробирках при объеме манипулируемых жидкостей меньше одного мкл из-за повышенной вероятности испарения реактивов и образцов во время смешивания. Известны способы, позволяющие иммобилизовать в микрореакторе один или несколько компонентов реакционной смеси, необходимые для проведения ПЦР, для того, чтобы затем заполнить микрореактор водным раствором, содержащим нуклеиновые кислоты и недостающие компоненты ПЦР смеси [патент США 7,118,910 «Microfluidic device and methods of using same»]. Однако указанный способ трудоемок и нелегко поддается контролю при производстве, так как требует нанесения биологических реагентов непосредственно в процессе изготовления микрочипа, что повышает опасность негативного воздействия последующих технологических процессов на нанесенные реактивы (воздействие повышенной температуры, химических соединений, излучения).
Известны способы лиофильного высушивания подготовленной ПЦР смеси, содержащей все или почти все компоненты реакции, а также дополнительные стабилизаторы, в пробирках [патент РФ 2259401 «Сухая смесь реагентов для полимеразной цепной реакции и способ проведения ПЦР анализа», патент США 6,153,412 «Lyophilized reagent for polymerase chain reaction»]. Этот метод может быть реализован практически в любой микрореакторной системе с открытыми реакторами.
Несмотря на наличие большого числа способов и устройств реализации ПЦР РВ в микрофлюидном и микрочиповом форматах, потребность в разработке новых, более совершенных способов и устройств сохраняется. В данной области техники существует потребность в экономически эффективном способе экспрессного количественного определения нуклеиновых кислот множества образцов, обладающем высокой чувствительностью и не требующем больших трудозатрат при подготовке к анализу, а также потребность в устройстве для его осуществления.
Наиболее близким аналогом настоящего изобретения может служить способ и устройство, описанные в заявке на изобретение США 20070196237 «Apparatus for regulating the temperature of a biological and/or chemical sample and method of using the same». В заявке раскрыт способ осуществления биохимических реакций, в том числе ПЦР РВ, содержащий стадии термоциклирования и детектирования флуоресцентного сигнала, с использованием модуля терморегулирования, состоящего из нагревателя и датчика температуры, на указанный модуль помещается подложка из теплопроводящего материала, а на указанную подложку наносится биологический образец, например смесь, содержащая все компоненты для проведения ПЦР РВ, которая изолируется от атмосферы путем внесения в виртуальную реакционную ячейку, образованную несмешивающейся с водой жидкостью, например минеральным маслом.
Основными недостатками протопипа являются: невысокие реальные скорости нагрева и охлаждения образца, техническая сложность модуля терморегулирования с интегрированными микронагревателем и термодатчиком, что приводит к удорожанию и снижает коммерческую привлекательность устройства. Еще одним недостатком аналога является неконтролируемое снижение чувствительности при возможном контакте образца с поверхностью теплопроводящего материала. Кроме того, раскрытые в описании аналога способ и устройство требуют предварительного приготовления растворов ПЦР компонентов, смешивания ПЦР компонентов с пробой и введения получившейся смеси в реакционные зоны, что приводит к дополнительным трудозатратам, повышает риск ошибки оператора и приводит к удорожанию анализа из-за возрастающего количества расходных материалов (пробирки, наконечники для дозатора, реактивы). Еще одним недостатком аналога является возможность пространственного несовпадения нагреваемой зоны и нагреваемого образца в процессе ввода пробы и термоциклирования, что приведет к недостоверным результатам ПЦР анализа.
Сущность изобретения
Задачей настоящего изобретения является разработка способа и устройства для его осуществления, которые бы позволили:
1) сократить время анализа и повысить производительность анализа;
2) увеличить чувствительность, достоверность и надежность анализа;
3) сократить трудозатраты на проведение определения нуклеиновых кислот методом ПЦР РВ;
4) снизить стоимость проведения ПЦР анализа.
Поставленная задача решается использованием описанного в настоящем изобретении способа определения нуклеиновых кислот при помощи полимеразно-цепной реакции в режиме реального времени и устройства для выполнения ПЦР РВ анализа, содержащего микрочип.
Предлагается способ определения нуклеиновых кислот при помощи полимеразно-цепной реакции в режиме реального времени, включающий в себя следующие стадии:
введение жидких проб, содержащих нуклеиновую кислоту, в реакционные зоны на верхней поверхности теплопроводящей подложки микрочипа и изолирование вводимых проб от атмосферы;
взаимодействие нуклеиновой кислоты пробы с компонентами полимеразно-цепной реакции при термоциклировании проб с отводом тепла через внешнюю поверхность микрочипа;
флуоресцентное определение изменения количества продуктов полимеразно-цепной реакции в процессе термоциклирования;
определение количества исходной нуклеиновой кислоты в пробах по динамике роста флуоресцентного сигнала.
При этом микрочип выполняют с теплопроводящей подложкой из теплопроводящего материала с коэффициентом теплопроводности больше 1 Вт/см·К и с коэффициентом тепловой диффузии больше 0.6 см2/с; реакционные зоны на поверхности микрочипа отделяют от теплопроводящей подложки слоем пассивирующего материала, который ковалентно связан с поверхностью теплопроводящего материала, а изолирование вводимых проб выполняют путем отделения их от атмосферы слоем жидкости, несмешивающейся с водой, которую удерживают на верхней поверхности теплопроводящей подложки с помощью периферийного барьера, причем отношение суммарной термической массы микрочипа с введенными пробами и слоем несмешивающейся с водой жидкости к тепловой проводимости подложки микрочипа не превышает 0.04 секунды.
Устройство для осуществления указанного способа содержит микрочип по меньшей мере с одной реакционной зоной на его поверхности, который механически связан с держателем микрочипа, термически связан с блоком термоциклирования и оптически связан с детектором флуоресцентного излучения; устройство также содержит по меньшей мере один источник излучения, оптически связанный с блоком фильтрации излучения канала освещения и микрочипом, указанный детектор флуоресцентного излучения оптически связан с микрочипом через блок фильтрации излучения канала регистрации, а указанный блок термоциклирования выполнен с возможностью нагревания, охлаждения и поддержания температуры микрочипа, кроме того, устройство содержит систему управления, электрически связанную с указанным детектором, источником излучения и блоком термоциклирования.
При этом указанный микрочип содержит теплопроводящую подложку, выполненную из материала с коэффициентом теплопроводности больше 1 Вт/см·К и с коэффициентом тепловой диффузии больше 0.6 см2/с, каждая из реакционных зон на поверхности указанного микрочипа отделена от теплопроводящей подложки слоем пассивирующего материала, ковалентно связанного с поверхностью теплопроводящей подложки; на верхней поверхности указанного микрочипа выполнен периферический барьер с возможностью удержания заданного количества несмешивающейся с водой жидкости на верхней поверхности микрочипа, при этом отношение суммарной термической массы микрочипа с введенными пробами и слоем несмешивающейся с водой жидкости к тепловой проводимости подложки микрочипа не превышает 0.04 секунды.
Приведенная совокупность признаков предлагаемого изобретения за счет:
1) увеличения скорости термоциклирования;
2) устранения ингибирования реакции при помощи защитного покрытия поверхности реакционных зон;
3) устранения неконтролируемого перемещения пробы относительно реакционной зоны;
4) создания микрочипа, содержащего высушенные ПЦР реагенты, необходимые для определения заданных нуклеиновых кислот;
5) сокращения расхода реагентов и расходных материалов и сокращения трудоемкости анализа
позволяет решить поставленную задачу. В предлагаемом изобретении используется микрочип, подложка которого выполнена из материалов с высокой теплопроводностью и тепловой диффузией, при этом поверхность реакционных зон на верхней поверхности микрочипа покрыта пассивирующим слоем, причем испарение ПЦР смеси предотвращается при помощи слоя изолирующей жидкости, а микрочип также может содержать в реакционных зонах один или несколько компонентов ПЦР смеси.
Возможны различные схемы выполнения способа, описанного в настоящем изобретении.
Способы осуществления взаимодействия нуклеиновой кислоты пробы с компонентами ПЦР могут выполняться в различных вариантах. Например, проба, содержащая нуклеиновую кислоту, перед проведением анализа предварительно смешивается с одним или несколькими компонентами ПЦР смеси. Возможно смешивание пробы с раствором, содержащим все компоненты, необходимые для проведения ПЦР. Также возможно смешивание пробы с буферным раствором, содержащим один компонент, например ионы магния Мg2+, или несколько компонентов, например ионы магния Мg2+ и полимеразу, или, например, ионы магния Мg2+, олигонуклеотидные праймеры и флуоресцентно-меченые зонды. В подобных случаях добавление недостающих компонентов ПЦР может быть осуществлено путем введения в реакционные зоны жидких растворов, содержащих эти компоненты, до или после ввода проб любым из известных способов. Предпочтительно, чтобы недостающие компоненты ПЦР были внесены в реакционные зоны до ввода проб.
Еще более предпочтительно, чтобы до ввода проб компоненты ПЦР были внесены в реакционные зоны в высушенном виде. Для этого в реакционные зоны на поверхности микрочипа на слой пассивирующего материала предпочтительно нанести один или несколько компонентов ПЦР в виде водного раствора и высушить указанный раствор. Способ предполагает, что в реакционные зоны могут быть внесены и высушены ПЦР компоненты, такие как дезоксинуклеозидтрифосфаты (дНТФ), прямой и обратный олигонуклеотидные праймеры, флуоресцентно-меченые зонды. Еще более предпочтительно нанести в реакционные зоны и высушить дезоксинуклеозидтрифосфаты (дНТФ), прямой и обратный олигонуклеотидные праймеры, флуоресцентно-меченые зонды, термостабильную полимеразу и стабилизаторы. Стабилизаторы могут быть выбраны из ряда веществ, таких как полисахара (маннитол, глюкоза, сахароза).
Способ предполагает, что флуоресцентное определение изменения количества продуктов полимеразно-цепной реакции в пробах в процессе термоциклирования может быть выполнено путем облучения проб выбранным диапазоном длин волн и регистрации сигнала флуоресценции в выбранном диапазоне длин волн. Преимущественно облучение проб должно проводиться в интервале 350-700 нм, а флуоресценция должна регистрироваться в интервале 450-1000 нм.
Далее, способ предполагает, что микрочип может быть выполнен из различных материалов, предпочтительно обладающих высокими коэффициентами теплопроводности (больше 1 Вт/см·К) и тепловой диффузии (больше 0.6 см2/с). Таким материалом могут служить металлы, например алюминий, медь, или диэлектрики, такие как кремний или керамика. Наиболее предпочтительными материалами являются кремний и алюминий. Геометрические размеры микрочипа и его масса должны быть невелики, чтобы его термическая масса была малой. Предпочтительно, чтобы толщина подложки была менее 1 мм, чтобы обеспечить ее высокую тепловую проводимость.
Способ предполагает, что слой пассивирующего материала выполнен из веществ, предотвращающих необратимую сорбцию компонентов ПЦР и ингибирование реакции. Преимущественно слой должен быть нанесен путем ковалентного связывания пассивирующего вещества с материалом теплопроводящей подложки микрочипа, чтобы повысить стойкость пассивирующего слоя к длительному хранению и к термоциклированию во время проведения реакции. Такие вещества могут быть выбраны из ряда: оксид алюминия, оксид кремния, органические молекулы, образующие монослои или полимерные покрытия. Органические молекулы могут быть выбраны из ряда: полидиметилсилоксан, полиметилметоксисилоксан, 3-глицидоксипропилтриметоксисилан, этиленгликольдиглициловый эфир.
Еще более предпочтительно, чтобы слой пассивирующего материала в реакционных зонах обладал гидрофильными свойствами, чтобы обеспечить хорошую растекаемость раствора при вводе ПЦР смеси в реакционную зону. При этом предпочтительно, чтобы слой пассивирующего материала вне области реакционных зон обладал гидрофобными свойствами для предотвращения растекания водного раствора за границы реакционной зоны.
Наиболее предпочтительно, чтобы пассивирующий материал в реакционных зонах был образован в результате реакции слоя 3-глицидоксипропилтриметоксисилана с этиленгликольдиглициловым эфиром.
Также предпочтительно, чтобы пассивирующий материал вне области реакционных зон был образован из полимерного слоя полиметилметоксисилоксана.
Изолирование от атмосферы проб, введенных в реакционные зоны, может осуществляться путем нанесения слоя изолирующей жидкости на реакционные зоны. В качестве изолирующей жидкости предпочтительно использовать несмешивающиеся с водой жидкости, обладающие меньшей плотностью, чем вода, и предпочтительно имеющие температуру кипения выше 100°С при атмосферном давлении. Изолирующие жидкости могут быть выбраны из ряда: минеральное масло, силиконовые жидкости различной вязкости и их смеси. Способ предполагает, что изолирующая жидкость оптически прозрачна в диапазоне длин волн, в котором ведется возбуждение и регистрация люминесценции флуоресцентных красителей, использующихся для детектирования продуктов ПЦР РВ. Предпочтительно оптическое пропускание слоя изолирующей жидкости в указанном диапазоне длин волн должно быть не меньше 10%. Еще более предпочтительно, чтобы в диапазоне регистрации люминесценции красителей слой изолирующей жидкости создавал сигнал флуоресценции не выше 10% от сигнала, создаваемого пробами, помещенными в реакционные зоны.
Способ предполагает, что возможно наносить слой изолирующей жидкости как однократно (до или после ввода проб), так и в два этапа: сначала слой изолирующей жидкости наносить на незаполненные реакционные зоны, затем производить ввод жидких проб сквозь указанный слой изолирующей жидкости, а затем дополнительно добавлять изолирующую жидкость.
Возможны различные конструктивные и компоновочные решения устройства настоящего изобретения.
Микрочип из кремния по меньшей мере одной реакционной зоной на его поверхности может быть изготовлен методом фотолитографии с последующим жидкостным анизотропным или изотропным травлением, хорошо известным специалистам в области микроэлектромеханических систем. Микрочип из металла, керамики или пластика может быть изготовлен путем точной штамповки, горячего литья, лазерной абляции, жидкостного изотропного травления, плазменного травления, хорошо известным специалистам в данной области. Линейные размеры реакционной зоны выбираются из диапазона 101-104 мкм в длину и ширину и 101-103 мкм в глубину. Предпочтительно линейные размеры реакционной зоны выбираются из диапазона 5×102-5×103 мкм в длину и ширину и 2×102-5×102 мкм в глубину.
Габаритные размеры микрочипа должны быть выбраны такими, чтобы термическая масса микрочипа была мала, а толщина теплопроводящей подложки должна быть минимальной при сохранении достаточной прочности конструкции.
Предпочтительно, чтобы отношение термической массы микрочипа с введенными пробами и слоем несмешивающейся с водой жидкости к тепловой проводимости подложки микрочипа не превышало 0.04 секунды. Например, этим условиям удовлетворяет микрочип с подложкой, выполненной из кремния с размерами (Д×Ш×В) 28×25×0.6 мм, с 16 реакционными зонами размером (Д×Ш×Г) 2×2×0.4 мм каждая, с периферическим барьером, выполненным из полиакриламида в виде прямоугольной рамки с габаритными размерами (Д×Ш×В) 28×25×3 мм и шириной бортов 4 мм.
Периферический барьер может быть выполнен с помощью конструктивного элемента, возвышающегося над верхней поверхностью микрочипа и образующего замкнутый контур так, чтобы изолирующая жидкость заключалась в этом контуре в процессе проведения ПЦР. Возможно, чтобы периферический барьер был изготовлен из материала теплопроводящей подложки микрочипа. Предпочтительно материал для изготовления периферического барьера должен быть с невысоким коэффициентом теплопроводности и малой теплоемкостью. Периферическим барьером может служить слой материала с олеофобными свойствами, нанесенный на поверхность микрочипа вокруг реакционных зон. Преимущественно материалом с олеофобными свойствами являются алкилсиланы с насыщенными фторуглеводородными цепями. Возможно, что периферический барьер выполняется в виде комбинации конструктивного элемента и слоя олеофобного материала. Предпочтительно, чтобы периферический барьер был изготовлен с возможностью изолирования реакционных зон от атмосферы путем нанесения на него клейкой пленки.
Слой пассивирующего материала, ковалентно связанный с поверхностью микрочипа, может быть выполнен путем проведения химических реакций на поверхности микрочипа. Возможно проводить указанные реакции путем взаимодействия компонентов из газовой фазы с поверхностью микрочипа, например термохимическое окисление кремния с образованием слоя оксида кремния. Предпочтительно, чтобы указанные реакции выполнялись при взаимодействии компонентов из жидкой фазы с поверхностью микрочипа. Предпочтительно раздельно нанести слой пассивирующего материала на поверхность микрочипа в областях вне реакционных зон и слой пассивирующего материала в области реакционных зон. Еще более предпочтительно нанести на поверхность микрочипа в областях вне реакционных зон слой полиметилметоксисилана, обладающего гидрофобными свойствами, путем контактного смачивания указанных областей раствором неполимеризованного полиметилметоксисилана и последующей термической полимеризацией. При этом слой пассивирующего материала в области реакционных зон нанести путем проведения последовательных химических реакций в реакционных зонах, например путем последовательной инкубации в реакционных зонах жидкого 3-глицидоксипропилтриметоксисилана, а затем жидкого этиленгликольдиглицилового эфира.
Нанесение одного или нескольких компонентов полимеразно-цепной реакции в реакционные зоны на поверхности микрочипа предпочтительно выполнять путем высушивания водного раствора указанных компонентов ПЦР смеси. При этом растворы, содержащие необходимые компоненты, должны быть внесены в реакционные зоны и высушены в ламинарном шкафу при комнатной температуре. Еще более предпочтительно, чтобы высушивание указанных растворов производилось в режиме лиофилизации, при пониженных температурах и давлениях, например при температуре в диапазоне от минус 20°С до минус 50°С и давлении в диапазоне от 0.01 до 10 мм рт.ст.
Детектор флуоресцентного излучения может включать в себя блок фильтрации излучения, выполненный с использованием абсорбционных и интерференционных светофильтров, а также дихроичных зеркал. Источником излучения может служить светодиод, оптически связанный с блоком фильтрации излучения и микрочипом посредством оптических элементов, например линз и зеркал. В устройстве согласно изобретению для детектирования нескольких продуктов ПЦР в одном микрореакторе возможно выполнить детектор, содержащий несколько источников излучения и несколько блоков фильтрации излучения, выполненных с возможностью переключения между одним и другим источником и блоком фильтрации излучения. Такой многоканальный детектор может быть построен с использованием нескольких светодиодов, светофильтров и дихроичных зеркал, отличающихся по своим спектральным характеристикам. Предпочтительно, чтобы источники излучения и блоки фильтрации излучения создавали световой поток в выбранном диапазоне длин волн возбуждения флуоресценции из интервала 350-700 нм и позволяли регистрировать сигнал флуоресценции в выбранном диапазоне длин волн из интервала 450-1000 нм. Диапазоны длин волн возбуждения и регистрации флуоресценции выбираются так, чтобы детектировать флуоресцентные красители, использующиеся в практике ПЦР РВ, которые хорошо знакомы специалистам в данной области. Примерами красителей являются карбоксифлуоресцеин (FAM), 6-карбокси-2',4,4',5',7,7'-гексахлорфлуоресцеин (HEX), 6-карбоксиродамин (R6G), карбокси-Х-родамин (ROX), тетраметилкарбоксиродамин (TAMRA), 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин (6-JOE), карбоксиродамин (R110).
Детектором флуоресцентного излучения может служить матричный детектор, фотоэлектронный умножитель или фотодиод. В устройстве согласно изобретению предпочтительно, чтобы в качестве детектора излучения использовался матричный детектор, например ПЗС-матрица (ПЗС - прибор с зарядовой связью) или КМОП-матрица (КМОП - комплементарный металл-оксид-полупроводник). В этом случае предпочтительно, чтобы на матричном детекторе формировалось изображение микрочипа при помощи оптических элементов, например при помощи линзового, зеркально-линзового или зеркального объектива. Предпочтительно, чтобы матричный детектор позволял регистрировать сигнал флуоресценции во всем диапазоне длин волн из интервала 450-1000 нм.
Блок термоциклирования, который термически связан с микрочипом, может быть выполнен с возможностью нагревания, охлаждения и поддержания температуры микрочипа с использованием резистивных нагревателей, полупроводниковых термоэлектрических модулей (элементов Пельтье), индукционных нагревателей, нагревателей, использующих перенос энергии в виде излучения, нагревателей, использующих перенос тепловой энергии с помощью потока жидкости или газа, в том числе с использованием конденсации и испарения. В устройстве согласно изобретению предпочтительно, чтобы блок термоциклирования был выполнен с использованием элемента Пельтье, т.к. в этом случае осуществляется и активный нагрев, и активное охлаждение микрочипа.
Перечень чертежей
Настоящее изобретение поясняется следующими чертежами, на которых представлены:
на фиг.1 - схема микрочипа для осуществления способа анализа нуклеиновых кислот методом ПЦР РВ;
на фиг.2 - вариант схемы микрочипа для осуществления способа анализа нуклеиновых кислот методом ПЦР РВ с компонентами полимеразно-цепной реакции в высушенном виде;
на фиг.3 - пример схемы конструкции устройства микрочипового ПЦР анализатора;
на фиг.4 - результат определения ДНК методом ПЦР РВ с использованием устройства согласно изобретению при использовании температурного режима, рекомендованного производителем реактивов;
на фиг.5 - результат определения ДНК методом ПЦР РВ с использованием устройства согласно изобретению при использовании температурного режима с сокращенными длительностями стадий ПЦР.
Подробное раскрытие изобретения
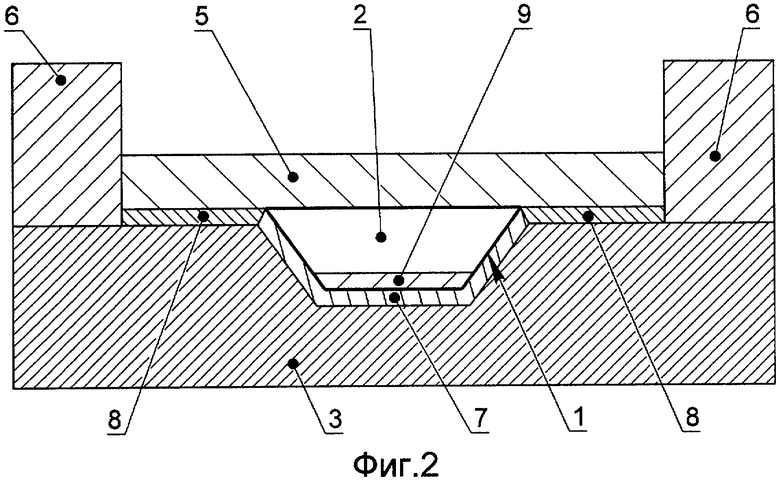
Пример выполнения микрочипа для осуществления способа анализа нуклеиновых кислот методом ПЦР РВ в соответствии с настоящим изобретением изображен на фиг.1 и фиг.2. В реакционной зоне 1, расположенной на верхней поверхности микрочипа, находится проба 2. Микрочип содержит теплопроводящую подложку 3, выполненную из теплопроводящего материала, коэффициент теплопроводности которого больше 1 Вт/см·К, а коэффициент тепловой диффузии больше 0.6 см2/с.
Согласно варианту исполнения, изображенному на фиг.1, реакционная зона 1 отделена от теплопроводящей подложки 3 слоем пассивирующего материала 4, который ковалентно связан с поверхностью теплопроводящего материала.
В другом исполнении, изображенном на фиг.2, реакционная зона 1 на поверхности микрочипа отделена от теплопроводящей подложки 3 слоем пассивирующего материала 7, который обладает гидрофильными свойствами и ковалентно связан с поверхностью теплопроводящего материала. В области вне реакционной зоны 1 поверхность теплопроводящей подложки 3 покрыта слоем пассивирующего материала 8, который обладает гидрофобными свойствами и ковалентно связан с поверхностью теплопроводящего материала. В реакционной зоне 1 на слое пассивирующего материала 8 расположен слой 9, содержащий один или несколько компонентов полимеразно-цепной реакции в высушенном виде.
Согласно вариантам исполнения, изображенным на фиг.1 и фиг.2, слой изолирующей жидкости 5 отделяет вводимую пробу 2 от атмосферы. Периферический барьер 6 удерживает слой изолирующей жидкости 5 на верхней поверхности теплопроводящей подложки 3. Для осуществления способа согласно изобретению ввод пробы 2, содержащей нуклеиновую кислоту, в реакционную зону 1 осуществляют сквозь слой изолирующей жидкости 5. Нагрев и охлаждение пробы 2, помещенной в реакционную зону 1, осуществляют со стороны нижней поверхности теплопроводящей подложки 3. Флуоресцентное определение количества продуктов полимеразно-цепной реакции в пробе 2, помещенной в реакционную зону 1, в процессе термоциклирования выполняют со стороны верхней поверхности теплопроводящей подложки 3, сквозь слой изолирующей жидкости 5.
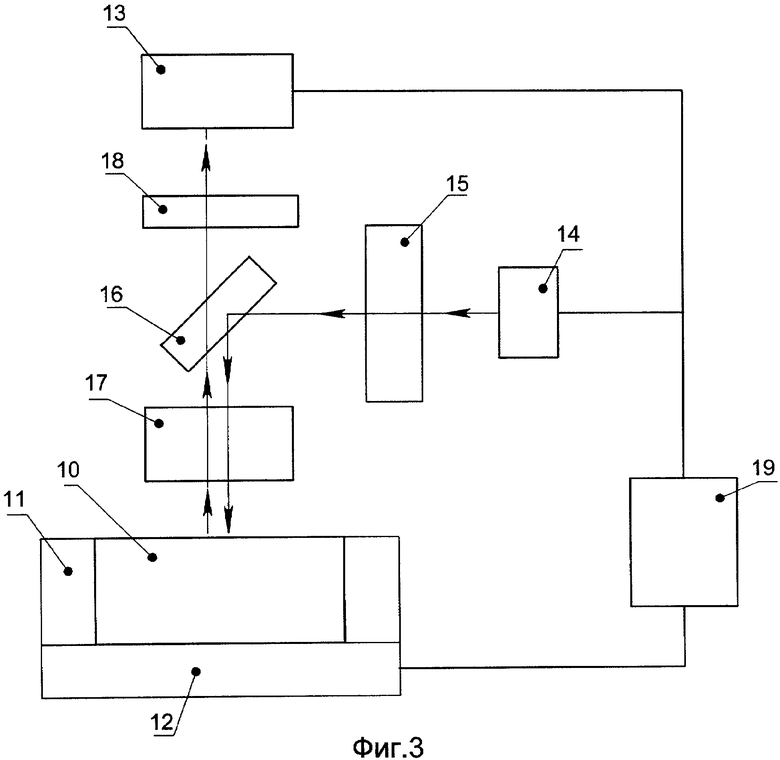
Пример конструкции устройства в соответствии с настоящим изобретением изображен на фиг.3. Устройство содержит по меньшей мере одну реакционную зону на его поверхности микрочипа 10, который механически связан с держателем микрочипа 11, термически связан с блоком термоциклирования 12 и оптически связан с детектором флуоресцентного излучения 13. Устройство содержит по меньшей мере один источник излучения 14, оптически связанный с блоком фильтрации излучения канала освещения 15, дихроичным зеркалом 16, объективом 17 и микрочипом 10. Детектор флуоресцентного излучения 13 оптически связан с микрочипом 10 через объектив 17, дихроичное зеркало 16 и блок фильтрации излучения канала регистрации 18. Блок термоциклирования 12 выполнен с возможностью нагревания, охлаждения и поддержания температуры микрочипа 10.
Устройство содержит также систему управления 19, электрически связанную с детектором излучения 13, по крайней мере с одним источником излучения 14 и блоком термоциклирования 12. Система управления 19 выполнена с возможностью переключения источников излучения 14 между одним источником излучения и другим источником излучения (если источников больше одного), а также с возможностью изменения спектрального диапазона блока (или блоков) фильтрации излучения.
Устройство работает следующим образом. Микрочип 10 вставляется в держатель микрочипа 11. На верхнюю поверхность микрочипа 10 наносится слой изолирующей жидкости 5 и сквозь него осуществляется ввод пробы 2 в реакционную зону 1. Держатель микрочипа 11 со снаряженным микрочипом 10 затем устанавливается в блок термоциклирования 12. Излучение от источника излучения 14 направляется в блок фильтрации излучения канала освещения 15, затем отражается от дихроичного зеркала 16, попадает в объектив 17 и попадает на пробу 2, расположенную в реакционной зоне микрочипа 1 сквозь слой изолирующей жидкости 5. Флуоресцентное излучение от пробы сквозь слой изолирующей жидкости 5 собирается объективом 17 и направляется через дихроичное зеркало 16 и блок фильтрации излучения канала регистрации 18 на детектор флуоресцентного излучения 13. Блок термоциклирования 12, который термически связан с микрочипом 10, осуществляет подвод и отвод тепла для осуществления нагревания, охлаждения и поддержания температуры микрочипа 10. Высокие скорости нагрева и охлаждения достигаются благодаря малой суммарной термической массе микрочипа с введенными пробами и слоем несмешивающейся с водой жидкости (в диапазоне от 0,5 до 4 Дж/К), выполненного с использованием теплопроводящей подложки с высокой тепловой проводимостью (в диапазоне от 100 до 500 Вт/К), что приводит в результате к малому отношению суммарной термической массы микрочипа к тепловой проводимости подложки микрочипа (в диапазоне от 0.001 до 0.04 с). Управление температурным режимом блока термоциклирования 12, выбор и включение источника излучения 14, а также сбор и обработку сигналов флуоресцентного детектора 13 во время термоциклирования пробы осуществляет система управления 19, электрически связанная с блоками 12, 13 и 14.
Сведения, подтверждающие возможность осуществления изобретения
Изобретение иллюстрируют следующие примеры.
Описание данных примеров не должно быть использовано для ограничения притязаний данного патента, оно лишь иллюстрирует возможность для специалистов в данной области осуществить изобретение.
Пример 1
Микрочип, содержащий 16 реакционных зон на его поверхности, был изготовлен из полированных кристаллических кремниевых пластин толщиной 0,6 мм методом фотолитографии с последующим анизотропным жидкостным химическим травлением. Размер теплопроводящей подложки составлял 25×28×0,6 мм. Реакционные зоны были расположены на поверхности микрочипа в виде матрицы 4×4, каждая реакционная зона представляла собой усеченную пирамиду с размерами верхнего основания 2×2 мм, нижнего основания 1,7×1,7 мм и глубиной 0,4 мм. На кремниевую подложку по всей поверхности был нанесен слой оксида кремния SiO2 методом термохимического окисления. Кремниевая подложка с нанесенным слоем SiO2 была очищена в смеси концентрированной серной кислоты и пероксида водорода (3:1) в течение 20 минут. После тщательной промывки дистиллированной и деионизованной водой и высушивания поверхность кремниевой подложки в области вне реакционных зон была обработана полиметилметоксисилоксаном «Пента-111» (Пента-Север, Россия). После полимеризации при термической обработке поверхность реакционных зон была обработана сначала 3-глицидоксипропилтриметоксисиланом (Sigma, США) в течение 60 мин, а затем этиленгликольдиглициловым эфиром (Sigma, США) в течение 60 мин. Затем подготовленная таким образом подложка присоединялась при помощи клея к периферическому барьеру, выполненному из полиакриламида толщиной 3 мм.
Согласно проведенным расчетам полная термическая масса микрочипа с введенными в реакционные зоны пробами и изолирующей жидкостью составила 3.35 Дж/К. Тепловая проводимость кремниевой подложки составила 175 Вт/К. При этом отношение полной термической массы микрочипа к тепловой проводимости подложки микрочипа не превышает 0.02 секунды.
Изготовленный микрочип проходил обработку УФ-излучением в течение 5 мин, а затем на верхнюю поверхность периферического барьера наносилась защитная полимерная пленка для предотвращения загрязнения поверхности реакционных зон при хранении и при обращении с микрочипом. В таком виде микрочип мог храниться при комнатной температуре в течение нескольких месяцев.
В устройстве согласно настоящему изобретению в качестве источников излучения были использованы светодиоды XL9030 (Сгее, США), в качестве детектора - ПЗС камера MultiBlue (Perkin-Elmer Optoelectronics, США), а в блоке фильтрации излучения использовался набор интерференционных светофильтров XF-52 (Omega Optical, США). В блоке термоциклирования был использован элемент Пельтье (40 Вт, Криотерм, Россия), а в качестве системы управления использовался персональный компьютер с установленным программным обеспечением.
Для проведения ПЦР РВ были приготовлены следующие растворы:
1) амплификационная смесь, содержащая:
80 мМ Tris-HCl (рН 8,0), 0,1% Triton Х-100, 5% глицерин (Sigma, США), 5 мМ МgCl2, 24 мМ (NH4)2SO4, 0,5 мМ EDTA, дезоксинуклеозидтрифосфаты dATP, dTTP, dGTP, dCTP по 500 мкМ каждого, OligoTaq ДНК-полимераза 0,1 U/µI (Promega, США); прямой и обратный олигонуклеотидные праймеры в концентрации 0,5 мкМ, флуоресцентно-меченый олигонуклеотидный зонд в концентрации 0,2 мкМ для определения Escherichia coli, штамм С600, фрагмент гена 16S рРНК, стерильная деионизованная вода;
2) раствор образца, содержащий 104 ДНК копий Escherichia coli в 1 мкл, штамм С600, в стерильной деионизованной воде (образец К+). В качестве образца, не содержащего специфичную ДНК, использовалась стерильная деионизованная вода (образец К-).
Растворы готовились непосредственно перед проведением анализа, смешивались между собой в соотношении 1:1, перемешивались путем вортексирования и пипетирования, а затем центрифугировались. Полученную рабочую ПЦР смесь использовали для ввода в реакционные зоны микрочипа.
На верхнюю поверхность микрочипа, ограниченную периферическим барьером, при помощи микродозатора вносилось 100 мкл силиконовой жидкости ПМС-200 (Пента-Север, Россия), которая служила изолирующей жидкостью. Введение рабочей ПЦР смеси объемом 2 мкл осуществлялось при помощи микродозатора сквозь слой изолирующей жидкости. Благодаря тому, что поверхность реакционных зон обладала гидрофильными свойствами, а поверхность вне области реакционных зон обладала гидрофобными свойствами, раствор легко растекался по реакционным зонам и при этом удерживался в них, не растекаясь по поверхности подложки и предотвращая таким образом взаимную контаминацию.
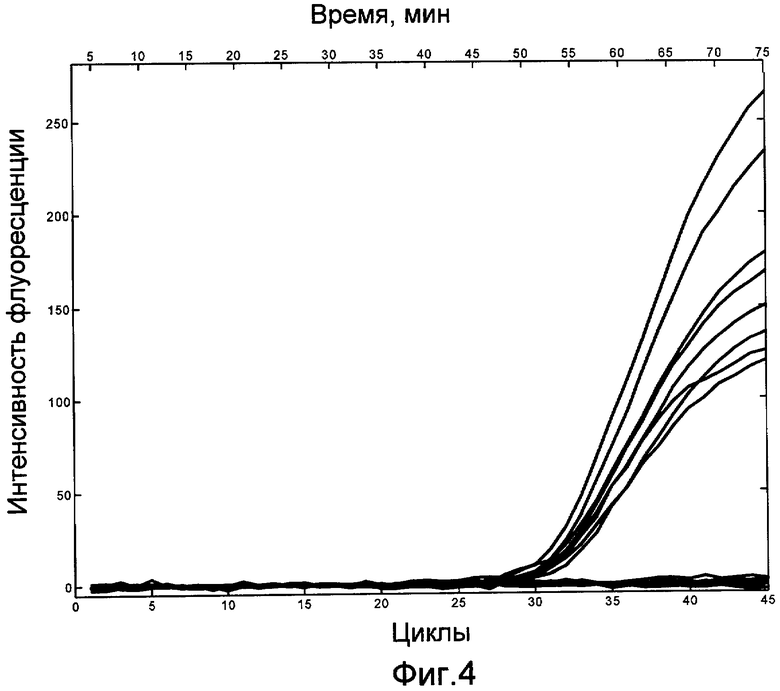
Термоциклирование осуществлялось по температурному режиму, рекомендованному производителем реактивов, а именно: активация полимеразы 94°С в течение 180 с (1 цикл), денатурация ДНК 94°С в течение 20 с, отжиг праймеров 58°С в течение 40 с, элонгация ампликонов и считывание сигнала флуоресценции 72°С в течение 20 с (45 циклов).
Результат ПЦР РВ приведен на фиг.4. Для ПЦР РВ кривых характерно то, что на начальных циклах интенсивность флюоресценции мала и практически не изменяется. Этот уровень флюоресценции называется базовым. Показателем накопления продукта реакции является так называемый "пороговый цикл" (Ct, threshold cycle), т.е. цикл, на котором интенсивность флюоресценции начинает превышать базовый порог. Из фиг.4 видно, что в пробах, содержащих искомую ДНК, наблюдается увеличение сигнала флуоресценции, а в пробах, не содержащих ДНК, сигнал флуоресценции остается на базовом уровне.
Сравнение средней величины пороговых циклов (Ct), полученных для описанных в настоящем примере растворов с использованием устройства согласно изобретению (Ct=31.3), и пороговых циклов, полученных на коммерчески доступном оборудовании SmartCycler II (Cepheid, США) с использованием полностью аналогичного режима термоциклирования (Ct=31.0), показывает, что аналитические характеристики устройства согласно изобретению и коммерческого оборудования сравнимы.
При этом максимальные скорости нагрева и охлаждения для устройства согласно изобретению составили 16,5 и 14,3°С/с, соответственно, что в 4 и 8 раз выше, чем аналогичные параметры у обычного лабораторного оборудования, а также в 2 и 5 раз выше, чем у наиболее быстрых образцов коммерчески доступного оборудования.
Время, затрачиваемое в настоящем примере на достижение порогового цикла при использовании устройства согласно изобретению, составило 53.1 мин.
Пример 2
Использовались микрочип и устройство согласно настоящему изобретению, аналогичные описанным в примере 1.
Для проведения ПЦР РВ были приготовлены растворы, аналогичные примеру 1. Приготовление рабочей ПЦР смеси и ее ввод в реакционные зоны микрочипа осуществлялся аналогично примеру 1.
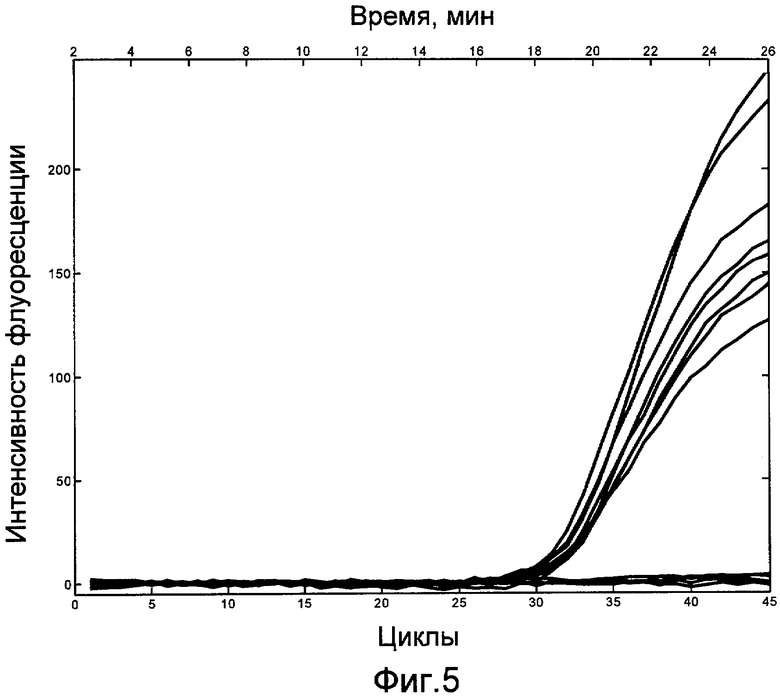
Термоциклирование осуществлялось по температурному режиму, в котором были сокращены длительности стадий денатурации, отжига праймеров и элонгации, а именно: активация полимеразы 94°С в течение 120 с (1 цикл), денатурация ДНК 94°С в течение 3 с, отжиг праймеров 58°С в течение 3 с, элонгация ампликонов и считывание сигнала флуоресценции 72°С в течение 8 с (45 циклов).
Результат ПЦР РВ приведен на фиг.5. Из чертежа видно, что в пробах, содержащих искомую ДНК, наблюдается увеличение сигнала флуоресценции, а в пробах, не содержащих ДНК, увеличения сигнала флуоресценции не происходит. Сравнение пороговых циклов (Ct), полученных с использованием устройства согласно изобретению при температурном режиме, рекомендованном производителем тест-систем Ct=31.3, и при температурном режиме, в котором были сокращены длительности стадий ПЦР Ct=31.9, показывает, что эффективность ПЦР реакции при использовании сокращенного температурного режима изменилась незначительно.
При этом время, затрачиваемое в настоящем примере на достижение порогового цикла, при использовании устройства согласно изобретению составило 18.0 мин, что более чем в 3 раза быстрее, чем при использовании одного из самых быстрых коммерчески доступных ПЦР анализаторов Smart Cycler II (54.7 мин).
Пример 3
Использовались микрочип и устройство согласно настоящему изобретению, аналогичные описанным в примере 1.
Для проведения ПЦР РВ были приготовлены следующие растворы:
1) амплификационная смесь, содержащая: 80 мМ Tris-HCl (рН 8,0), 0,1% Triton Х-100, 24 мМ (NH4)2SO4, 0,5 мМ EDTA, дезоксинуклеозидтрифосфаты dATP, dTTP, dGTP, dCTP по 500 мкМ каждого, 0,16% D-глюкоза, 1,6% инулин, 8% D-маннитол (Sigma, США), OligoTaq ДНК-полимераза 0,1 U/µI (Promega, США); прямой и обратный праймеры в концентрации 0,5 мкМ, флуоресцентно-меченый олигонуклеотидный зонд в концентрации 0,2 мкМ для определения ДНК Escherichia coli, штамм С600, фрагмент гена 16S рРНК, стерильная деионизованная вода;
2) раствор образца, содержащий: 104 ДНК копий в 1 мкл Escherichia coli, штамм С600, в стерильной деионизованной воде (образец К+) или стерильная деионизованная вода (образец К-), растворенные в растворе, содержащем 5 мМ MgCl2, 10 мМ Tris-HCl (рН 8,0), 0,1% Triton Х-100, 5% глицерин (Sigma, США) и стерильную деионизованную воду.
В каждую из 16 реакционных зон микрочипа вносилось по 1 мкл амплификационной смеси, приготовленной согласно п.1 настоящего примера. Смесь высушивалась в ламинарном шкафу при комнатной температуре в течение 2-3 часов до образования плотного слоя, прочно удерживаемого в реакционных зонах. На верхнюю поверхность периферического барьера наносилась защитная пленка с клеевым слоем, изолирующая реакционные зоны от атмосферы, для предотвращения загрязнения поверхности реакционных зон при хранении и при обращении с микрочипом. В таком виде микрочип мог храниться при комнатной температуре в течение нескольких недель.
Для проведения ПЦР анализа ввод раствора образца согласно п.2 настоящего примера осуществлялся в реакционные зоны микрочипа аналогично примеру 1.
Термоциклирование осуществлялось по температурному режиму, рекомендованному производителем реактивов, а именно: активация полимеразы 94°С в течение 180 с (1 цикл), денатурация ДНК 94°С в течение 20 с, отжиг праймеров 58°С в течение 40 с, элонгация ампликонов и считывание сигнала флуоресценции 72°С в течение 20 с (45 циклов).
В результате были получены ПЦР РВ кривые (данные не приведены), из которых было видно, что в пробах, содержащих искомую ДНК, наблюдается увеличение сигнала флуоресценции, а в пробах, не содержащих ДНК, увеличения сигнала флуоресценции не происходит. В эксперименте было установлено, что количество расходных материалов, трудозатрат и времени, затрачиваемых на выполнение подготовительных операций по приготовлению образцов и введению полученных смесей в реакционные зоны, значительно сокращается при использовании способа и устройства согласно настоящему изобретению, по сравнению с обычным оборудованием. Например, количество ПЦР реагентов сократилось в 12 раз, количество наконечников для дозатора сократилось в 6 раз, количество стадий пипетирования сократилось в 2 раза, время, требуемое на проведение подготовительных операций, сократилось в 4 раза.
К важным достоинствам настоящего изобретения, приводящим к достижению поставленной задачи, можно отнести:
1) увеличение скорости термоциклирования образца за счет использования материалов с высокой теплопроводностью, а также за счет обеспечения контакта образца с поверхностью реакционной зоны;
2) устранение ингибирования ПЦР при помощи пассивирующего покрытия поверхности реакционных зон, что увеличивает чувствительность, достоверность и надежность анализа;
3) сокращение трудозатрат и стоимости проведения ПЦР анализа за счет использования микрочипа, содержащего высушенные ПЦР реагенты.
Выше приведены предпочтительные примеры осуществления изобретения, не ограничивающие существо и объем изобретения, а лишь иллюстрирующие его. Специалисты в данной области без затруднений смогут найти различные изменения и усовершенствования предложенного изобретения, которые тоже подпадают под его объем, отраженный в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АВТОМАТИЗИРОВАННЫЙ ПРИБОР ДЛЯ ВЫДЕЛЕНИЯ, ОЧИСТКИ И АНАЛИЗА НУКЛЕИНОВЫХ КИСЛОТ МЕТОДОМ ПЦР-РВ | 2020 |
|
RU2784821C2 |
| ПРИБОР ДЛЯ ПРОВЕДЕНИЯ АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ | 2020 |
|
RU2757987C1 |
| Способ количественного определения ДНК бактерии Propionibacterium acnes в крови пациента путем амплификации фрагментов ДНК Propionibacterium acnes со специфическими праймерами | 2024 |
|
RU2840020C1 |
| УСТРОЙСТВО ДЛЯ ОДНОВРЕМЕННОГО КОНТРОЛЯ В РЕАЛЬНОМ МАСШТАБЕ ВРЕМЕНИ МНОЖЕСТВА АМПЛИФИКАЦИЙ НУКЛЕИНОВОЙ КИСЛОТЫ | 2005 |
|
RU2304277C2 |
| УСТРОЙСТВО ДЛЯ ОДНОВРЕМЕННОГО КОНТРОЛЯ В РЕАЛЬНОМ МАСШТАБЕ ВРЕМЕНИ МНОЖЕСТВА АМПЛИФИКАЦИЙ НУКЛЕИНОВОЙ КИСЛОТЫ | 2016 |
|
RU2691763C2 |
| УСТРОЙСТВО ДЛЯ АНАЛИЗА НУКЛЕИНОВЫХ КИСЛОТ ИЗ ОБРАЗЦОВ БИОЛОГИЧЕСКОГО МАТЕРИАЛА | 2021 |
|
RU2757986C1 |
| УСТРОЙСТВО ДЛЯ ОДНОВРЕМЕННОГО КОНТРОЛЯ В РЕАЛЬНОМ МАСШТАБЕ ВРЕМЕНИ МНОЖЕСТВА АМПЛИФИКАЦИЙ НУКЛЕИНОВОЙ КИСЛОТЫ | 2009 |
|
RU2418289C1 |
| УНИВЕРСАЛЬНАЯ СИСТЕМА ПОДГОТОВКИ ОБРАЗЦОВ И ПРИМЕНЕНИЕ В ИНТЕГРИРОВАННОЙ СИСТЕМЕ АНАЛИЗА | 2010 |
|
RU2559541C2 |
| ОДНОРАЗОВЫЙ ЧИП-КАРТРИДЖ ДЛЯ ПРОВЕДЕНИЯ АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ | 2020 |
|
RU2758719C1 |
| МИКРОФЛЮИДНЫЕ КАРТРИДЖИ ДЛЯ ПОВЫШЕННОЙ АМПЛИФИКАЦИИ ПОЛИНУКЛЕОТИДСОДЕРЖАЩИХ ПРОБ | 2020 |
|
RU2839388C1 |
Изобретение относится к области молекулярной биологии, медицины, биотехнологии и касается устройства для проведения полимеразной цепной реакции в режиме реального времени. Создают микрочип с теплопроводящей подложкой с коэффициентом теплопроводности больше 1 Вт/см·К и с коэффициентом тепловой диффузии больше 0.6 см2/с. Реакционные зоны на поверхности микрочипа отделяют от теплопроводящей подложки слоем пассивирующего материала. Пробы изолируют от атмосферы слоем жидкости, несмешивающейся с водой. Жидкость удерживают с помощью периферийного барьера. Отношение суммарной термической массы микрочипа с введенными пробами и изолирующим слоем жидкости к тепловой проводимости подложки микрочипа не превышает 0.04 секунды. Изобретение позволяет увеличить скорость термоциклирования, устранить неконтролируемое перемещение пробы относительно реакционной зоны и устранить ингибирование реакции. 2 н. и 25 з.п. ф-лы, 5 ил.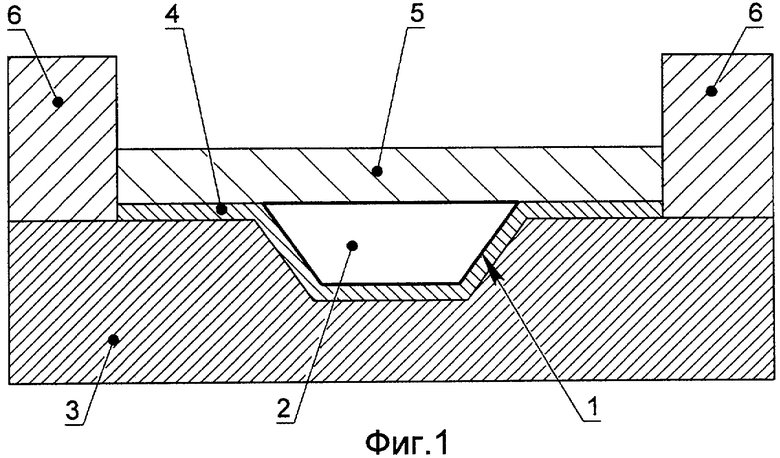
1. Способ определения нуклеиновых кислот методом полимеразно-цепной реакции в режиме реального времени, включающий введение жидких проб, содержащих нуклеиновую кислоту, в реакционные зоны на верхней поверхности теплопроводящей подложки микрочипа; изолирование вводимых проб от атмосферы; взаимодействие нуклеиновой кислоты пробы с компонентами полимеразно-цепной реакции при термоциклировании проб с отводом тепла через внешнюю поверхность микрочипа; флуоресцентное определение изменения количества продуктов полимеразно-цепной реакции в процессе термоциклирования; определение количества исходной нуклеиновой кислоты в пробах по динамике роста флуоресцентного сигнала, отличающийся тем, что используют микрочип с теплопроводящей подложкой из теплопроводящего материала с коэффициентом теплопроводности больше 1 Вт/(см·К) и с коэффициентом тепловой диффузии больше 0,6 см2/с, при этом реакционные зоны на поверхности микрочипа отделяют от теплопроводящей подложки слоем пассивирующего материала, который ковалентно связан с поверхностью теплопроводящего материала, а изолирование вводимых проб выполняют путем отделения их от атмосферы слоем жидкости, несмешивающейся с водой, которую удерживают на верхней поверхности теплопроводящей подложки с помощью периферийного барьера, причем отношение суммарной термической массы микрочипа с введенными пробами и слоем несмешивающейся с водой жидкости к тепловой проводимости подложки микрочипа не превышает 0,04 с.
2. Способ по п.1, отличающийся тем, что флуоресцентное определение изменения количества продуктов полимеразно-цепной реакции в пробах в процессе термоциклирования выполняют путем облучения проб выбранным диапазоном длин волн из интервала 350-700 нм и регистрации сигнала флуоресценции в выбранном диапазоне длин волн из интервала 450-1000 нм.
3. Способ по п.1, отличающийся тем, что в качестве теплопроводящего материала используют кремний.
4. Способ по п.1, отличающийся тем, что в качестве теплопроводящего материала используют металл.
5. Способ по п.4, отличающийся тем, что в качестве металла используют алюминий или медь.
6. Способ по п.1, отличающийся тем, что в качестве пассивирующего материала используют оксид кремния, или оксид металла, или полиметилметоксисилоксан, или 3-глицидоксипропил-триметоксисилан с этиленгликольдиглициловым эфиром.
7. Способ по п.1, отличающийся тем, что введение жидких проб в реакционные зоны осуществляют сквозь слой несмешивающейся с водой жидкости.
8. Способ по п.1, отличающийся тем, что в качестве пассивирующего материала на поверхности микрочипа в реакционных зонах используют гидрофильный материал, а в качестве пассивирующего материала на поверхности микрочипа между реакционными зонами используют гидрофобный материал.
9. Способ по п.8, отличающийся тем, что в качестве пассивирующего материала на поверхности микрочипа в реакционных зонах используют 3-глицидоксипропилтриметоксисилан с этиленгликоль-диглициловым эфиром, а в качестве пассивирующего материала на поверхности микрочипа между реакционными зонами используют полиметилметоксисилоксан.
10. Способ по п.1, отличающийся тем, что используют слой несмешивающейся с водой жидкости, пропускание которого в выбранном спектральном диапазоне облучения и в выбранном спектральном диапазоне флуоресценции не менее 10%.
11. Способ по п.1, отличающийся тем, что используют слой несмешивающейся с водой жидкости, сигнал флуоресценции от которой не превышает 10% от сигнала, создаваемого пробами, помещенными в реакционные зоны.
12. Способ по п.1, отличающийся тем, что в качестве несмешивающейся с водой жидкости используют полиметилсилоксановую жидкость, плотность которой меньше, чем плотность воды.
13. Способ по п.1, отличающийся тем, что в реакционные зоны на поверхности микрочипа на слой пассивирующего материала наносят один или несколько компонентов полимеразно-цепной реакции в виде водного раствора и высушивают указанный раствор.
14. Способ по п.13, отличающийся тем, что водный раствор, содержащий один или несколько компонентов полимеразно-цепной реакции, высушивают путем лиофильного высушивания.
15. Устройство для определения нуклеиновых кислот методом полимеразно-цепной реакции в режиме реального времени, содержащее микрочип по меньшей мере с одной реакционной зоной на его поверхности, который механически связан с держателем микрочипа и оптически связан с детектором флуоресцентного излучения через блок фильтрации излучения канала регистрации, включающее по меньшей мере один источник излучения, оптически связанный с блоком фильтрации излучения канала освещения и микрочипом, а также систему управления, электрически связанную с блоком термоциклирования, который термически связан с микрочипом и выполнен с возможностью нагревания, охлаждения и поддержания температуры микрочипа, отличающееся тем, что микрочип содержит термически связанную с блоком термоциклирования теплопроводящую подложку, выполненную из материала с коэффициентом теплопроводности больше 1 Вт/(см·К) и с коэффициентом тепловой диффузии больше 0,6 cм2/c, а каждая из реакционных зон отделена от теплопроводящей подложки слоем пассивирующего материала, ковалентно связанного с поверхностью теплопроводящей подложки, причем на верхней поверхности микрочипа выполнен периферический барьер с возможностью удержания заданного количества несмешивающейся с водой жидкости на верхней поверхности микрочипа, причем отношение суммарной термической массы микрочипа с введенными пробами и слоем несмешивающейся с водой жидкости к тепловой проводимости подложки микрочипа не превышает 0,04 с.
16. Устройство по п.15, отличающееся тем, что в качестве источника излучения используется по крайней мере один светодиод.
17. Устройство по п.15, отличающееся тем, что в качестве источника излучения используется матрица светодиодов.
18. Устройство по п.15, отличающееся тем, что система управления выполнена с возможностью переключения источников излучения между одним источником излучения и другим источником излучения.
19. Устройство по п.15, отличающееся тем, что система управления выполнена с возможностью изменения спектрального диапазона блока (или блоков) фильтрации излучения.
20. Устройство по п.15, отличающееся тем, что детектором флуоресцентного излучения служит матричный детектор.
21. Устройство по п.17, отличающееся тем, что в качестве детектора флуоресцентного излучения используется фотоэлектронный умножитель.
22. Устройство по п.17, отличающееся тем, что в качестве детектора флуоресцентного излучения используется фотодиод.
23. Устройство по п.15, отличающееся тем, что блок термоциклирования включает в себя Пельтье элемент.
24. Устройство по п.15, отличающееся тем, что микрочип выполняют таким образом, что поверхность микрочипа в реакционных зонах покрыта слоем гидрофильного пассивирующего материала, а поверхность микрочипа между реакционными зонами покрыта гидрофобным пассивирующим материалом.
25. Устройство по п.15, отличающееся тем, что микрочип выполняют таким образом, что реакционные зоны на поверхности микрочипа сверху слоя пассивирующего материала содержат один или несколько компонентов полимеразно-цепной реакции в высушенном виде.
26. Устройство по п.15, отличающееся тем, что периферический барьер выполняют с возможностью изоляции реакционных зон от атмосферы при помощи клеевой пленки.
27. Устройство по п.15, отличающееся тем, что система управления выполнена с возможностью автоматического переключения источников излучения и блоков фильтрации светового излучения и синхронизованного с этими переключениями сбора сигналов от детектора излучения.
| US 20070196237, 23.08.2007 | |||
| MATSUBARA Y | |||
| et al.: "Application of a microchamber array for DNA amplification using a novel dispensing method", Arch | |||
| Histol | |||
| Cytol., 2002, v.65, n.5, p.481-488 | |||
| ZHANG C | |||
| et al.: "Miniaturized PCR chips for nucleic acid amplification and analysis: latest advances and future trends", NAR, 2007, v.35, n.13, 4223-4237. |
Авторы
Даты
2010-04-10—Публикация
2008-10-23—Подача