Настоящее изобретение относится к таблетке, в состав которой входит ядро, содержащее лекарственное вещество, и оболочка, которую наносят на указанное ядро методом напрессования. Таблетка может содержать любые виды лекарственных веществ, но особенно подходит для введения таких веществ, высвобождение которых желательно только через некоторое время (период задержки) после введения. Данные таблетки особенно подходят для введения глюкокортикостероидов, например, таких как преднизон, преднизолона и метилпреднизолона.
Исследования в области хронофармакологии продемонстрировали важность биологических ритмов в лекарственной терапии. Очень часто оптимальные клинические результаты не могут быть достигнуты, если высвобождение лекарства после приема внутрь происходит непрерывно. Это особенно относится к случаям, когда симптомы болезни проявляют циркадианные изменения. В таких случаях высвобождение лекарственного средства должно изменяться в соответствии с этими изменениями, чтобы концентрации лекарственного средства в плазме были на оптимальном уровне только когда это необходимо для лечения симптомов болезненного состояния.
В частности, если симптомы проявляются ночью или в первые часы после пробуждения, время, когда пациенту следует принимать его лекарство для достижения наилучшего клинического результата, требует тщательного рассмотрения. Например, большинство приступов астмы случается в ранние утренние часы, например с 4 до 6 часов утра. Это является результатом сложных циркадианных ритмов, таких как секреция гидрокортизона и адреналина. Приступы ишемической болезни сердца наиболее часто случаются в течение ночи или в первые часы после пробуждения, приблизительно во время завтрака. Скованность и боль, связанные с ревматоидным артритом и остеоартритом наблюдаются в первые часы бодрствования, что считают результатом секреции интерлейкина IL-6 в ранние утренние часы, например около 4-6 часов утра.
Для синхронизации введения лекарственных средств в составе обычных лекарственных форм немедленного высвобождения с ночными циркадианными ритмами, которые отвечают за испытываемые пациентом симптомы, необходимо тревожить пациента, чтобы разбудить его для приема лекарства в ранние утренние часы с целью достижения наиболее эффективного клинического результата. Безусловно, это весьма неудобно для пациента.
Соответственно, сохраняется необходимость создания лекарственной формы, которую можно принимать в удобное время перед сном и которая высвободит эффективную дозу лекарственного вещества только через некоторое заранее заданное время (период задержки), что позволит синхронизовать его пиковую концентрацию в плазме с конкретным циркадианным ритмом.
Кроме того, особенно в отношении лекарственных веществ с узкой областью всасывания, или в случае, когда лекарство адаптируют для лечения местных состояний в ободочной кишке, таких как болезнь Крона, язвенный колит, синдром раздраженного кишечника, воспалительные заболевания кишечника, существует необходимость создания лекарственной формы, которая к тому же быстро высвобождает лекарственное вещество по достижении конца периода задержки.
Далее, принимая во внимания различия в образе жизни пациентов, для того, чтобы снизить индивидуальную и междуиндивидуальную вариабельность биодоступности, необходимо создать лекарственную форму, которая высвобождает лекарственное средство с надежным периодом задержки, и обеспечить его пиковую концентрации в плазме в заранее заданное время, независимо от того, находится пациент в голодном или сытом состоянии (т.е. получает ли пациент пищу).
В данной области известны рецептуры с времяконтролируемым высвобождением, которые способны доставлять лекарственные вещества с заданной скоростью высвобождения после периода задержки, в течение которого высвобождение лекарственного вещества не происходит. Такая лекарственная форма раскрыта в WO 02/072033. Характерной чертой этой лекарственной формы является оболочка, содержащая натуральную или синтетическую камедь, которая в присутствии водной среды превращается в гель. Оболочка действует как барьер, препятствующий поступлению водной среды внутрь содержащего активный компонент ядра, и таким образом создает период задержки, в течение которого высвобождение лекарственного вещества не происходит. Желирующееся покрытие действует как среда, сквозь которую высвобождение лекарственного средства происходит замедленным или измененным образом. Установлено, что период задержки можно регулировать, изменяя массу оболочки.
С таким подходом связано несколько сложностей: во-первых, высвобождение лекарственного средства происходит путем диффузии через желированное покрытие. В случае лекарственных средств, которые имеют узкую область всасывания, или в случае лекарства, адаптируемого для лечения сравнительно небольшой пораженной области желудочно-кишечного тракта или ободочной кишки, желательно, чтобы по истечении периода задержки высвобождение лекарственного средства происходило как можно быстрее, чтобы обеспечить полное или почти полное высвобождение лекарственного средства в желаемом участке. В таких случаях медленная диффузия лекарственного средства не подходит. Кроме того, попытка контролировать период задержки путем контроля массы оболочки ограничивает в этом смысле свободу изготовителя, поскольку увеличение массы оболочки увеличивает стоимость лекарственной формы, а также приводит к увеличению ее размера, что может сделать ее глотание затруднительным для некоторых групп пациентов, таких как пациенты младшего возраста, а также старые и немощные пациенты. Кроме того, простой подбор массы оболочки не гарантирует ее желаемой толщины в конкретном участке. Остается вероятность того, что если ядро находится в неправильном положении в пресс-форме таблетировочной машины для нанесения оболочки путем напрессовывания (таблет-пресса), часть покрытия может случайно оказаться тоньше, чем желательно, несмотря на заданную массу оболочки, что в результате приведет к непредвиденному преждевременному высвобождению лекарственного средства.
Заявитель неожиданно обнаружил, что путем тщательного подбора геометрии ядра внутри покрытия можно управлять толщиной оболочки в отдельных точках таблетки, чтобы гарантировать подходящую толщину оболочки для получения таблеток с более точно подобранным периодом задержки. Более того, возможность увеличения толщины покрытия там, где это необходимо, позволяет уменьшить количество используемого материала оболочки до минимума, необходимого для достижения желаемых характеристик высвобождения, таким образом, что при этом сокращаются затраты на материалы, а также уменьшается общий размер таблетки.
Кроме того, заявитель обнаружил, что путем подбора подходящих материалов ядра и оболочки можно не только точно контролировать период задержки, но также гарантировать, что по истечении периода задержки лекарственное вещество будет быстро полностью или практически полностью высвобождено в участке всасывания, либо в участке, на который оно должно воздействовать местно.
Соответственно, в первом аспекте настоящего изобретения предусмотрена таблетка, в состав которой входят ядро, содержащее лекарственное вещество, и окружающая указанное ядро оболочка, причем ядро расположено внутри указанной оболочки таким образом, что толщина оболочки по оси (X-Y) (см. фиг.1) больше, чем толщина оболочки по оси (А-В)) (см. фиг.1), ортогональной оси (X-Y), и где толщина оболочки по оси (X-Y) выбрана таким образом, чтобы оболочка разрушалась через 2-4 ч после погружения в водную среду.
Согласно настоящему изобретению толщина оболочки по оси (X-Y) больше, чем толщина оболочки по оси (А-В). Отношение толщины оболочки по оси (X-Y) к толщине оболочки по оси (А-В) может составлять 2.2-2.6:1.0-1.6.
В другом аспекте изобретения предусмотрена таблетка, в состав которой входят ядро, содержащее лекарственное вещество, и окружающая указанное ядро оболочка, причем ядро расположено внутри указанной оболочки таким образом, что толщина оболочки по оси (X-Y) (см. фиг.1) больше, чем толщина оболочки по оси (А-В), ортогональной оси (X-Y), и толщина оболочки по оси (X-Y) составляет по меньшей мере 2.2 мм, точнее 2.2-2.6 мм, более точно - 2.35-2.45 мм.
Толщина оболочки по оси А-В не является критической для регулирования периода задержки. Соответственно, изготовитель обладает некоторой свободой в выборе ее толщины. Она не должна быть настолько толстой, чтобы в итоге таблетка становилась слишком большой, но, с другой стороны, оболочка не должна быть настолько тонкой, чтобы оболочка становилась хрупкой и подверженной растрескиванию под действием малейшего механического напряжения. Толщина оболочки по оси (А-В) составляет предпочтительно от приблизительно 1.0 мм до приблизительно 1.6 мм. Толщина оболочки по оси (А-В) по разные стороны от ядра может быть неодинаковой. Например, с одной стороны ядра (А-ядро) оболочка может иметь толщину приблизительно от 1.2 до 1.6 мм, более предпочтительно - 1.35-1.45 мм, в то время как с другой стороны ядра (В-ядро), толщина может составлять приблизительно - от 1.0 до 1.4 мм, более предпочтительно 1.15-1.25 мм.
Соответственно, в конкретном способе реализации настоящего изобретения таблетка имеет ядро, содержащее лекарственное вещество, и оболочку, причем ядро расположено внутри оболочки таким образом, что оболочка обладает по оси (X-Y) толщиной по меньшей мере 2.2 мм, точнее - от приблизительно 2.2 до приблизительно 2.6 мм, еще точнее от 2.35 до 2.45 мм, а толщина оболочки по оси (А-В), ортогональной оси (X-Y), составляет 1.0-1.6 мм. Более точно, вдоль оси (А-В) с одной стороны ядра (А-ядро) толщина может составлять приблизительно от 1.2 до 1.6 мм, более предпочтительно от 1.35 до 1.45 мм, а со второй стороны ядра (В-ядро) толщина может составлять приблизительно от 1.0 до 1.4 мм, более предпочтительно от 1.15 до 1.25 мм.
Таблетки согласно настоящему изобретению формуют по способу нанесения покрытия (оболочки) путем прессования (т.е. напрессовывания оболочки), как будет описано ниже более подробно. Таблетки с напрессованной оболочкой обычно формуют, путем размещения порции порошкообразного материала оболочки в пресс-форме (матрице), и прессования порошка до компактной формы при помощи пуансона. Затем ядро помещают на спрессованный таким образом материал оболочки, после чего в матрицу добавляют оставшийся материал оболочки и прикладывают усилие сжатия для формования таблетки, покрытой оболочкой. Для размещения ядра на уплотненном материале оболочки таким образом, чтобы обеспечить правильную геометрию ядра по отношению к оболочке в окончательной форме таблетки, предпочтительно использовать средства позиционирования ядра относительно материала оболочки в матрице. Обычно для этого можно использовать пробивной пуансон (в форме стержня, pin punch). Пробивной пуансон представляет собой пуансон с выпуклой поверхностью, которая контактирует с материалом оболочки и оставляет небольшое углубление или выемку в уплотненном материале оболочки. Таким образом, когда ядро помещают в матрицу на уплотненный материал, оно попадает в углубление или выемку и его правильная геометрия в конечной форме таблетки гарантирована.
Толщина оболочки вдоль оси направления движения пуансона и по оси (ось «(А-В)», упоминавшаяся выше) определяется количеством материала оболочки, добавленного в матрицу и силы сжатия, приложенной для формования таблетки. С другой стороны, толщина оболочки вдоль оси «(X-Y)» и по ней определяется размером ядра, его положением в матрице и диаметром матрицы. Для специалиста очевидно, что существует множество осей X-Y, ортогональных оси направления движения пуансона (ось «(А-В)»), которые расходятся радиально от центра таблетки к ее периметру, и когда говорят о толщине оболочки по оси X-Y, имеют в виду толщину по любой из этих осей или их всех. В ходе прессования оболочки вокруг ядра, материал оболочки под и над ядром (материал вдоль оси «(А-В)) сравнительно более сильно спрессован и имеет большую плотность. С другой стороны, материал, расположенный вдоль оси (X-Y), подвергается действию более слабых прессующих сил и имеет сравнительно более низкую плотность. Соответственно, материал вдоль оси (X-Y) относительно порист и проницаем для поступающей внутрь водной среды. Скорость проникновения внутрь водной среды сквозь покрытие вдоль направления оси X-Y частично является ответственной за высвобождение лекарственного вещества из ядра. Как только водная среда достигает ядра, оно реагирует разбуханием или газообразованием, что приводит к разрушению оболочки в основном в направлении поступления водной среды (т.е. оси X-Y), обычно - с образованием двух полусфер из материала оболочки, которые могут остаться соединенными (в виде раскрытой раковины моллюска). Реакция материала ядра на присутствие водной среды также частично отвечает за контроль высвобождения лекарственного вещества из ядра.
Прочность таблетки предпочтительно составляет по меньшей мере 60 ньютонов например, от 60 до 80 ньютонов, а более точно - от 60 до 75 ньютонов. Прочность можно измерить в соответствии с процессом, описанным в The European Pharmacopoeia 4, 2.9.8, стр.201. В тесте используют аппарат, состоящий из располагающихся друг напротив друга губок (тисков), одна из которых перемещается навстречу другой. Плоские поверхности губок перпендикулярны направлению движения. Дробящие поверхности губок являются плоскими, а их размер превосходит размер зоны контакта с таблеткой. Аппарат калибруют, используя систему с точностью в один ньютон. Таблетку помещают между губками. Для каждого измерения таблетку ориентируют одинаковым образом относительно направления прикладываемой силы. Измерения проводят на 10 таблетках. Результаты представляют в виде среднего, минимального и максимального значений (в ньютонах) силы, необходимой для того, чтобы раздробить таблетки.
Таблетки, обладающие прочностью в этих интервалах, механически устойчивы к силам, возникающим в желудке, особенно в присутствии пищи. Кроме того, таблетки являются достаточно пористыми в плоскости (X-Y) таблетки, чтобы физиологическая среда могла поступать к ядру со скоростью, подходящей для того, чтобы обеспечить, что лекарственное вещество будет высвобождено после соответствующего периода задержки, например, от 2 до 6 часов.
Как уже было выше упомянуто, предпочтительным аспектом настоящего изобретения является то, что таблетки выполнены таким образом, что высвобождение лекарственного вещества из ядра происходит после заранее заданного периода задержки, а кроме того, таблетки приспособлены для полного или практически полного высвобождения лекарственного вещества в течение очень короткого периода времени по истечении периода задержки. Это обеспечивает полное или практически полное высвобождение лекарственного вещества в заданном участке всасывания желудочно-кишечного тракта, или в пораженном участке желудочно-кишечного тракта (если состояние, подлежащее лечению, представляет собой местное топическое состояние). В предпочтительном выполнении таблетки согласно данному изобретению высвобождают лекарственное вещество полностью или практически полностью за время от 1/2 часа до 1 часа после выбранного периода задержки.
Этот аспект настоящего изобретения важен для доставки лекарств, для которых характерна узкая область всасывания в верхних отделах желудочно-кишечного тракта, таких как упомянутые выше глюкокортикостероиды. В таких случаях лекарство должно быть высвобождено до того, как таблетка попадет в кишечник, где подобные вещества всасываются плохо. Это становится особенно важным, если таблетка должна действовать одинаковым образом вне зависимости от воздействия пищи. Хорошо известно, что скорость, с которой таблетка пройдет желудочно-кишечный тракт, будет варьировать в зависимости от того, получает ли пациент пищу или голодает (т.е. находится ли он в сытом или голодном состоянии). Если пациент находится в голодном состоянии, таблетка обычно покидает желудок за время приблизительно от 1/2 часа до 1 часа после проглатывания, после чего еще 4-5 часов уходит на то, чтобы покинуть верхние отделы желудочно-кишечного тракта через илиоцекальное соединение. В состоянии, когда пациент принимает пищу, на то, чтобы таблетка покинула желудок, может уйти до 4 часов и еще 4-5 часов - на то, чтобы таблетка покинула верхние отделы желудочно-кишечного тракта. Соответственно, если таблетка должна полностью или практически полностью высвободить лекарственное вещество в верхних отделах желудочно-кишечного тракта вне зависимости от приема пищи пациентом, предпочтительно, чтобы высвобождение лекарственного средства после периода задержки происходило в течение упомянутого выше отрезка времени.
Следует понимать, что несмотря на то, что желательно, чтобы высвобождение лекарства в течение периода задержки не происходило, оно все-таки может в некоторой степени иметь место. Однако любое высвобождение лекарственного вещества в течение периода задержки не должно превосходить 10% общего количества лекарственного вещества в ядре.
Оболочка, применяемая в таблетке согласно настоящему изобретению, предпочтительно состоит из нерастворимых или плохо растворимых в воде гидрофобных материалов. На практике оболочка в идеальном случае действует просто как преграда для поступления внутрь водной физиологической среды, что обеспечивает таким образом период задержки высвобождения лекарственного средства. По изложенным выше причинам в идеале таблетка должна обладать минимальной толщиной, согласующейся с желаемым периодом задержки. Соответственно, применение нерастворимых или плохо растворимых в воде гидрофобных материалов оболочки дает возможность получить оболочку, сравнительно устойчивую к проникновению внутрь жидкости, что позволяет добиться длительных периодов задержки при сравнительно тонких оболочках.
Далее, для того, чтобы достичь быстрого высвобождения лекарственного вещества по истечении периода задержки, желательно, чтобы оболочка не содержала, или практически не содержала, ингредиентов, которые вызывают разбухание или желирование веществ до такой степени, при которой оболочка действует как диффузионный барьер для высвобождения лекарственного вещества. В этом отношении предпочтительно, оболочка не содержит, или практически не содержит, таких материалов, как природные или синтетические камеди, которые модулируют высвобождение лекарственного вещества через интактную набухшую оболочку. Лекарственное вещество высвобождается из ядра в результате физического разрушения оболочки, а не в результате диффузии через набухший материал оболочки. То, что механизм высвобождения лекарственного средства существенно зависит от физического разрушения оболочки, а не от процесса диффузии через подверженную разбуханию и желированию оболочку, означает, что можно осуществлять доставку разнообразных лекарственных веществ из таблеток согласно настоящему изобретению надежным воспроизводимым образом.
Оболочка таблетки может содержать один или более нерастворимых или плохо растворимых в воде гидрофобных наполнителей. Такие наполнители могут быть выбраны среди любых известных гидрофобных производных целлюлозы и полимеров, включая алкилцеллюлозу, например, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу и их производные, полимерные производные полиметакрила, поливинилацетата и ацетата целлюлозы, жирные кислоты, либо их эфиры или соли, длинноцепочечные жирные спирты, полиоксиэтилен алкил эфиры, стеараты полиэтилена, эфиры сахаров, лауроил макрогол-32 глицерил, стеароил макрогол-32 глицерил и т.п. Из гидроксипропилметил-целлюлозных материалов предпочтительно выбирают те, которые обладают низкой молекулярной массой и низкой плотностью, такие как метоцел Е-типа и типов 29-10 согласно фармакопее США.
Другие вещества и наполнители, которые придают оболочке свойство гидрофобности, могут быть выбраны из воскоподобных веществ, известных как наполнители для таблеток. Предпочтительно, они имеют показатель HLB (гидрофильно-липофильного баланса), меньший 5, более предпочтительно, около 2. Подходящие гидрофобные вещества включают воскоподобные вещества, такие как воск карнаубы, парафин, микрокристаллический воск, пчелиный воск, воск из цетилового эфира и тому подобные, либо нежирные гидрофобные вещества, такие как соли фосфата кальция, например двухосновный фосфат кальция.
Оболочка предпочтительно содержит соли фосфата кальция, глицерил бегенат и поливинил пирролидон либо их смеси, а также один или больше адъювантов, дилюэнтов, любрикантов или наполнителей (собственно инертных наполнителей).
Предпочтительными компонентами оболочки являются следующие, с подходящими в большинстве случаев процентными долями, выраженными в процентных долях массы оболочки:
Поливинилпирролидон (Povidone) предпочтительно присутствует в количестве приблизительно от 1 до 25% от массы оболочки, точнее от 4 до 12%, например от 6 до 8%.
Глицерил бегенат представляет собой эфир глицерола и бегеновой кислоты (С22 -жирная кислота). Глицерил бегенат может присутствовать в форме своего моно-, ди- или триэфира или в виде смеси этих форм. Предпочтительно он обладает показателем HLB, меньшим чем 5, более предпочтительно приблизительно 2. Он может присутствовать в количествах приблизительно от 5 до 85% массы оболочки, точнее от 10 до 70% от массы оболочки, а в некоторых предпочтительных способах реализации - от 30 до 50%.
Соли фосфата кальция могут представлять собой двухосновный дигидрат фосфата кальция и могут присутствовать в количестве приблизительно от 10 до 90% от массы оболочки, предпочтительно от 20 до 80%, например от 40 до 75%.
Оболочка может содержать другие обычные наполнители для таблеток, такие как смазывающие вещества, красители, связывающие вещества, скользящие вещества, такие как диоксид кремния, например кололлоидный диоксид кремния. Желтый оксид железа может быть применен в количествах приблизительно от 0.01 до 0.5% по массе относительно оболочки; стеарат магния может присутствовать в количествах от 1 до 10% от массы оболочки, более предпочтительно от 2 до 10%, например от 5 до 10%; коллоидный кварц может быть использован в количестве от 0.1 до 20% от массы оболочки, более предпочтительно от 0.25 до 1.0%.
В дополнение к лекарственному веществу ядро содержит дезинтегрирующее вещество или смеси дезинтегрирующих веществ, применяющихся в составах с немедленным высвобождением и хорошо известных специалистам в данной области. Дезинтегрирующие вещества, полезные в осуществлении настоящего изобретения, могут представлять собой материалы, которые пузырятся или разбухают в присутствии водной среды, создавая тем самым силу, необходимую для механического разрушения материала оболочки.
В дополнение к лекарственному веществу ядро предпочтительно содержит поперечно сшитый поливинилпирролидон и кроскармеллозу натрия (натриевую соль кроскарбоксиметилцеллюлозы).
Далее представлен список предпочтительных материалов ядра. Количество материалов выражено в виде процентной доли массы материала относительно массы оболочки.
Поперечно сшитый поливинилпирролидон описан выше. ПВП полезен в качестве дезинтегрирующего вещества и может быть применен в ядре в количествах, раскрытых в описании ядра.
Кроскармеллоза натрия представляет собой натриевую карбоксиметилцеллюлозу с внутренними поперечными сшивками (также известную как Ac-Di-Sol), полезную в качестве дезинтегрирующего вещества.
Дезинтегрирующие вещества можно применять в количестве от 5 до 30% от массы ядра. Однако большие количества определенных дезинтегрирующих веществ могут разбухать, что создает матрицу, способную модулировать высвобождение лекарственного вещества. Соответственно, особенно в тех случаях, когда требуется быстрое высвобождение после периода задержки, предпочтительно применять дезинтегрирующие вещества в количестве до 10% по массе, например примерно от 5 до 10% по массе.
Ядро может дополнительно содержать обычные наполнители для таблеток, такие как уже были описаны выше для материалов оболочки. Подходящие наполнители включают смазывающие вещества, разбавители (дилюенты) и собственно наполнители, включая, без ограничения, лактозу (например, ее моногидрат), оксид железа, стеараты магния и коллоидный кварц.
Моногидрат лактозы представляет собой дисахарид, состоящий из одной молекулы глюкозы и одной молекулы галактозы. В таблетках согласно настоящему изобретению он может действовать как наполнитель или разбавитель (дилюент). Он может присутствовать в диапазоне примерно от 10 до 90%, предпочтительно от 20 до 80%, а в некоторых предпочтительных способах реализации от 65 до 70%.
Как утверждалось выше, важным аспектом настоящего изобретения является то, что ядро правильно расположено внутри оболочки, что позволяет получить таблетку с подходящей толщиной оболочки. При этом полученные таблетки будут иметь надежный и воспроизводимый период задержки при отсутствии «разброса» показателей биодоступности как для отдельного пациента так и для разных пациентов. Для того чтобы обеспечить стабильность и гарантировать, что таблетки в партии содержат ядра, обладающие подходящей геометрией относительно оболочки, необходимо проводить надежный контроль в процессе производства. Контроль может быть трудоемким, поскольку для него необходим оператор, который будет случайным образом изымать образцы из партии и разрезать их, чтобы физически обследовать качество ядра (например, является ли оно неповрежденным, правильно ли оно расположено). Более того, если значительное количество таблеток из выборки не прошло проверку, вся партия таблеток может быть забракована. Заявитель обнаружил, что при добавлении в ядро сильного красителя, такого как оксид железа, так чтобы при интенсивном освещении таблетки ядро заметно контрастировало с оболочкой, становится возможным автоматически определять любые дефекты положения или цельности ядра при помощи камеры, расположенной соответствующим образом вблизи таблетирующей машины, чтобы можно было осуществлять осмотр выталкиваемых из нее таблеток. Таким образом, если обнаружена дефективная таблетка, можно остановить производство и быстро исправить любые неполадки в процессе изготовления, что потенциально позволит избежать брака в масштабах партий таблеток.
Несмотря на то, что для этой цели пригоден краситель, также возможны эквивалентные решения. Например, вместо красителя в ядро можно ввести материал, непроницаемый для рентгеновских лучей, такой как сульфат бария. Если затем к таблетирующей машине присоединить рентгенограф, ядро будет контрастировать с материалом оболочки и рентгенограф аналогичным образом зафиксирует любые дефекты положения или целостности ядра.
Количество лекарственного вещества, применяемое в таблетках согласно настоящему изобретению, будет зависеть от конкретного применяемого лекарственного вещества, состояния пациента, а также природы и тяжести состояния, подлежащего лечению. Типичное содержание лекарственного вещества может составлять от 1 до 50% веса ядра.
Как утверждалось выше, в настоящем изобретении могут быть применены разнообразные лекарственные вещества. Настоящее изобретение в особенности подходит для лекарственных средств для лечения состояний, причиной симптомов которых являются ночные циркадианные ритмы. В частности, особенно подходят для применения в таблетках согласно настоящему изобретению лекарственные средства для лечения недержания, расстройств сна, апноэ, астмы, эпилепсии, бронхита, паркинсонизма, ревматоидного артрита, аллергического ринита, а также ишимической болезни сердца, гистаминовой головной боли и мигрени, застойной сердечной недостаточности и депрессии. Далее, лекарственные вещества, которые метаболизируются цитохромом Р450 также являются особенно подходящими. Они включают Amitriptyline, кофеин, кломипрамин, клозапин, флювоксамин, галоперидол, имипрамин, мексилитин, эстрадиол, оланзепин, парацетамол, пропранолол, такрин, теофиллин, варфарин, Bupropion, Cyclophosphamide, Celecoxib, Diclofenac, Flubiprofen, Ibuprofen, глимепирид, индом, тацин, напроксен, фенитоин, пироксикам, теноксикам, циталопрам, диазепам, лансопразол, омепразол, пантопрозол, пропанолол, топирамат, Alpranolol, хлорпромазин, кломипрамин, кодеин, Desipramine, декстрометорфан, дифенилгидрамин, донепезил, флекаинид, флюоксетин, лабеталол, Methadone, метопролол, миансерин, нортрипилин, ондансетрон, окспренолол, оксикодон, пароксетин, пергексилен, петидин, прометазин, риспердон, тиоридазин, тиклопидин, тимолол, тримипрамин, венлафаксин, парацетамол, алпразолам, амиодарон, будезонид, бупренорфин, буспирон, блокаторы кальциевых каналов (Calcium Channel Blockers), карбамазепин, цисаприд, кларитромицин, клоназепам, кокаин, кортизол, циклоспорин, дексаметазон, эритромицин, фентанил, кетоконазол, лозартан, миконазол, мидазолам, квинидин, сертралин, статины, такролим, тамоксифен, трициклические антидепрессанты, тиамзолам, золпидем или их смеси.
Дополнительные примеры классов лекарственных средств и лекарственных средств, которые можно применять в таблетках согласно настоящему изобретению, включают: антигистаминовые препараты (например, азатадина малеат, бромфенирамина малеат, хлорфенирамина малеат, дексхлорфенирамина малеат, дифенилгидрамина гидрохлорид, диоксиламина сукцинат, метдизалина гидрохлорид, прометазин, тримепразина тартрат, трипеленнамин цитрат, трипеленнамина гидрохлорид и триполидина гидрохлорид),
антибиотики (например, пенициллин Фау калиевая соль, клоксациллин натрия, диклоксациллин натрия, нафциллин натрия, карбенциллин инданил натрия, окситетракцилина гидрохлорид, тетрациклина гидрохлорид, клиндамицина фосфат, клиндамицина гидрохлорид, клиндамицин (в форме пальмитат хлорида), линкомицина хлорид, новобиоцин натрия, нитрофурантоин натрия, нитрофурантоин натрия, метронизадола гидрохлорид), противотуберкулезные вещества (например, изониазид),
холинергические вещества (например, амбенония хлорид, бетанекола хлорид, неостигмина бромид, пиридостигмина бромид),
антимускариновые препараты (например, анизотропина метилбромид, клидиния бромид, дицикломина гидрохлорид, гликопирролат, гексоциклий метилсульфат, гоматропина метилбромид, гиосциамина сульфат, метантелина бромид, гиосцина гидробромид, оксифенония бромид, пропантелина бромид, тридигексетила хлорид),
симпатомиметики (например, битолтирола мезилат, эфедрин, эфедрина гидрохлорид, эфедрина сульфат, орципреналина сульфат, фенилпропаноламина гидрохлорид, псевдоэфедрина гидрохлорид, ритодрина гидрохлорид, салбутамола сульфат, тербуталина сульфат),
симпатолитики (например, феноксибензамина гидрохлорид), разнообразные самостоятельные лекарственные средства (например, никотин),
препараты железа (например, глюконат железа, сульфат железа), гемостатики (например, аминокапроновая кислота),
сердечные лекарственные средства (например, ацетобутолола гидрохлорид, дизопирамида фосфат, флециенида ацетат, прокаинамида гидрохлорид, пропанолола гидрохлорид, квинидина глюконат, тимолола малеат, токаинида гидрохлорид, верапамила гидрохлорид),
антигипертензивные вещества (например, каптоприл, клонидина гидрохлорид, гидралазина гидрохлорид, мекамиламина гидрохлорид, метапролола тартрат), сосудорасширяющие средства (например, папаверина гидрохлорид),
нестероидные противовоспалительные вещества (например, холина салицилат, ибупрофен, кетопрофен, салицилат магния, меклофенамат натрия, напроксен натрия, толметин натрия),
опиатные агонисты (например, кодеина гидрохлорид, кодеина фосфат, кодеина сульфат, декстроморамида тартрат, гидрокодона битартрат, гидроморфона гидрохлорид, петидина гидрохлорид, метадона гидрохлорид, морфина сульфат, морфина ацетат, морфина лактат, морфина меконат, морфина нитрат, одноосновный фосфат морфина, морфина тартрат, морфина валерат, морфина гидробромид, морфина гидрохлорид, пропоксифена гидрохлорид),
противосудорожные (например, фенобарбитал натрия, фентоин натрия, троксидон, это сукцимид, валпроат натрия),
транквилизаторы (например, ацетофеназина малеат, хлоропромазина гидрохлорид, флюфеназина гидрохлорид, прохлорперазина эдизилат, прометазина гидрохлорид, тиоридазина гидрохлорид, трифлюороперазина гидрохлорид, цитрат лития, молиндона гидрохлорид, тиотиксина гидрохлорид),
хемотерапевтические вещества (например, доксорубицин, цисплатин, флоксуридин, метотрексат, их комбинации),
вещества, снижающие уровень жиров (например, гемофиброзил, клофибрат, ингибиторы редуктазы HMG-CoA (3-гидрокси-3-метилглутарил коэнзим А), такие как, например, аторвастатин, церивастатин, флувастатин, ловастатин, правастатин, симвастатин),
антагонисты Н2-рецепторов (например, циметидин, фамотидин, низатидин, ранитидина гидрохлорид),
бронхорасширяющие (например, альбутерол, изопротеренол, метапротеренол, тербуталин),
стимулирующие (например, бензамфетамина агидрохлорид, декстроамфетамина сульфат, декстроамфетамина фосфат, диэтипропиона гидрохлорид, фенфлюрамина гидрохлорид, метамфетамина гидрохлорид, метилфенидата гидрохлорид, фендиметразина тартрат, фенметазина гидрохлорид, кофеина цитрат),
барбитураты (например, амилобрабитал натрия, бутабарбитал натрия, секобрабитал натрия),
седативные (например, гидроксизина гидрохлорид, метприлон), отхаркивающие (например, йодид калия) метоклопропамид гидрохлорид, триметобензамид гидрохлорид),
противорвотные (например, гидроксизина гидрохлорид, метоклопропамида гидрохлорид, триметобензамида гидрохлорид),
лекарственные средства для желудочно-кишечного тракта (например, ранитидина гидрохлорид), антагонисты тяжелых металлов (например, пеницилламин, пеницилламина гидрохлорид),
антитироидные вещества (например, метимазол),
вещества, расслабляющие гладкую мускулатуру мочеполовой системы (например, флавоксата гидрохлорид, оксибутинина гидрохлорид),
витамины (например, тиамина гидрохлорид, аскорбиновая кислота),
неклассифицированные вещества (например, амантадина гидрохлорид, колхицин, двунатриевый этидронат, лейковарин кальция, метиленовый голубой, хлорид калия, пралидоксима хлорид),
стероиды, в частности глюкокортикоиды (например, преднизолон, метилпреднизолон, преднизон, кортизон, гидрокортизон, метилпреднизолон, бетаметазон, дексаметазон, триамцинолон).
Несмотря на широкую применимость данных таблеток для широкого диапазона лекарственных веществ, настоящее изобретение особенно подходит для доставки упомянутых выше глюкокортикостероидов, в особенности преднизона, преднизолона и метилпреднизолона. Эти стероиды полезны для лечения, в числе прочего, ревматоидного артрита и суставных болей. Как уже утверждалось, симптомы этих состояний возникают в соответствии с циркадианными ритмами, и с высокой степенью вероятности можно предсказывать их возникновение в ранние утренние часы. Соответственно, глюкокортикостероиды, в особенности преднизон, в наибольшей степени подходят для доставки при помощи таблеток согласно данному изобретению не только из-за узкой области всасывания, но также потому, что таблетку можно вводить вечером пред сном в любое время от приблизительно 8 часов вечера до полуночи, например приблизительно в 10-12 часов вечера. Такое введение даст максимум концентрации лекарственного вещества в плазме до наступления максимума секреции IL-6 (которая наблюдается приблизительно в 2-4 часа утра), и будет, таким образом, эффективно направлено на причины утренних симптомов. Лечение этих симптомов таким образом является более эффективным.
Название «преднизон», употребленное выше, относится к самому соединению, его солям и их производным, включая преднизона 21-ацетат.
Название «преднизолон», употребленное выше, относится к самому соединению, его солям или производным, включая 21-ацетат, его 21-тер-бутилацетат, 21-сукцинатнатриевую соль, 21-стеароилгликолат, 21-мета-сульфобензоат натрия и его триметилацетат.
Название «метилпреднизолон», употребленное выше, относится к самому соединению, его солям и их производным, включая его 21-ацетат, 21-фосфатдинатриевую соль, 21-сукцинатнатриевую соль и ее ацетонат.
Обычно ядро может содержать около 0.1-50 мас.%, точнее 1-20%, еще более точно 1-10 мас.% стероида (проценты даны по отношению к общей массе ядра). В случае преднизона, его можно применять в количествах, которые дают общую массу на единичную дозированную лекарственную форму, равную 1 или 5 мг, что предполагает удобство и гибкость дозирования; хотя, если это желательно, можно применять лекарственные формы, содержащие большие или меньшие количества лекарственного вещества.
Особенно предпочтительны таблетки согласно данному изобретению, содержащие в ядре глюкокортикостероид, выбранный из группы, состоящей из преднизона, преднизолона, а также поперечно сшитый поливинилпирролидон, поперечно сшитую карбоксиметилцеллюлозу натрия и один или больше адъювантов, дилюентов, смазывающих веществ или материалов - наполнителей, как описано выше. Оболочка предпочтительно содержит соль фосфат кальция, глицерил бегенат, поперечно сшитый поливинилпирролидон и один или больше адъювантов, дилюентов, смазывающих веществ или материалов - наполнителей, как описано выше.
Состав согласно одному особенно предпочтительному способу реализации данного изобретения включает следующие вещества:
Ядро таблетки, содержащей 5 мг преднизона:
Преднизон 8.33%
Моногидрат лактозы 64.47%
Повидон (Povidone) 6.67%
Кроскармеллоза натрия 18.33%
Красный оксид железа 0.5%
Стеарат магния растительного происхождения 1.0%
Коллоидный диоксид кремния 0.5%
Оболочка
Дигидрат двухосновного фосфата кальция 50%
Глицерил бегенат 40%
Повидон 8.40%
Желтый оксид железа 0.1%
Стеарат магния растительного происхождения 1.0%
Коллоидный диоксид кремния 0.5%
Другой предпочтительный способ реализации:
Ядро таблетки, содержащей 1 мг преднизона:
Преднизон 1.67%
Моногидрат лактозы 71.13%
Повидон 6.67%
Кроскармелоза натрия 18.33%
Красный оксид железа 0.5%
Стеарат магния растительного происхождения 1.0%
Коллоидный диоксид кремния 0.5%
Оболочка
Дигидрат двухосновного фосфата кальция 50%
Глицерил бегенат 40%
Повидон 8.40%
Желтый оксид железа 0.1%
Стеарат магния растительного происхождения 1.0%
Коллоидный диоксид кремния 0.5%
Удивительно, что таблетки, содержащие глюкокортикостероиды, демонстрируют такое быстрое высвобождение, принимая во внимание, что скорость высвобождения в некоторой степени зависит от увлажнения ядра, а эти стероиды по своей природе весьма гидрофобны.
Описанные выше таблетки представляют собой таблетки с напрессованной оболочкой, в состав которых входят ядро и оболочка, покрывающая это ядро. Однако в рамках объема настоящего изобретения возможны различные варианты этой базовой конструкции. Так, напрессованная оболочка может быть далее покрыта внешней оболочкой функционального или эстетического назначения. Например, функциональные оболочки могут дополнительно включать оболочку для немедленного высвобождения, содержащую лекарственные вещества, которые могут быть теми же, что и лекарственные вещества в ядре, или другими.
Таким образом, таблетка может обеспечивать пульсирующее высвобождение, которое полезно при лечении симптомов, основанных на циркадианных ритмах, таких как расстройства сна. В этом отношении в такой лекарственной форме можно применять седативные снотворные, например лекарственные вещества, упомянутые в патенте США US 6485746. Лекарственные формы для пульсирующего высвобождения могут также найти широкое применение для разнообразных активных веществ для лечения разнообразных проявлений с целью обеспечить более удобные режимы приема препаратов пациентами. Например, пульсирующее высвобождение может явиться хорошей альтернативой множественному введению форм с немедленным высвобождением.
Функциональные оболочки также включают растворяющиеся в кишечнике оболочки, покрывающие напрессованную оболочку. Формы с растворяющимися в кишечнике оболочками могут применяться в лечении местных состояний в кишечнике, таких как болезнь Крона, язвенный колит, синдром раздраженного кишечника и воспалительные заболевания кишечника. В таком способе реализации растворяющаяся в кишечнике оболочка может предотвращать высвобождение лекарственного средства до того, как таблетка поступит в кишечник.
Эстетические оболочки включают оболочки, маскирующие вкус, а также окрашенные оболочки, общеизвестные в данной области.
В данной области хорошо известно, что пища может изменять биодоступность лекарственного средства. Прием пищи может привести к изменению биодоступности лекарственных средств вследствие различных факторов, таких как задержка опорожнения желудка, изменения рН в ЖКТ, изменения метаболизма в просвете, а также физических и химических взаимодействий пищевых объектов с лекарственной формой или лекарственным веществом. Это изменение биодоступности вследствие принятия пищи часто называют «эффектом приема пищи». Эффекты приема пищи вполне обычны для лекарственных форм с измененным высвобождением, а также для лекарственных средств, которые обладают либо плохой растворимостью, либо плохой проницаемостью, либо и тем и другим (классы II III и IV согласно Биофармацевтической классификации лекарственных средств).
Неожиданный эффект, обнаруженный Заявителем, заключается в том, что полученная таблетка способна к полному или почти полному высвобождению содержащегося в ней лекарственного вещества в течение периода от 2 до 6 часов (Tlag, периода задержки).
Также заявителем было неожиданно обнаружено, что полученная таблетка способна к тому, чтобы высвобождать лекарственное вещество после периода задержки, а также способна доставлять лекарственное средство в организм пациента, таким образом, что после всасывания пиковая (максимальная) концентрация лекарственного средства Сmax достигается через время Тmax, которое не зависит от потребления пищи пациентом.
Tmax - это термин, хорошо известный в данной области, который обозначает время, проходящее между введением лекарственного вещества и достижением максимума концентрации в плазме Сmax. Сmax также представляет собой признанный в данной области термин, который обозначает пиковую концентрации лекарственного вещества в плазме.
Tmax представляет собой важный параметр, особенно в отношении лекарств, которые предназначены для приема в удобное для пациента время, но которые высвобождают лекарственные вещества после периода задержки, что позволяет синхронизировать высвобождение лекарственного средства с циркадианным ритмом, в частности с ночным циркадианным ритмом. Например, упомянутые выше глюкокортикостероиды, такие как преднизон, полезны в лечении, между прочим, артритических состояний, таких как ревматоидный артрит и остеоартрит.
При пробуждении пациенты часто испытывают симптомы слабости. Современная терапия требует, чтобы по пробуждении пациент принимал DecortinR. Однако это не самый эффективный способ лечения данных симптомов, поскольку считают, что они связаны с секрецией IL-6, которая имеет место в ранние утренние часы, например, примерно от 2 до 4 часов утра. Лекарство, которое позволило бы достичь Сmax, совпадающей по времени с выделением IL-6, или предшествующей ему, потенциально могло бы принести пациенту большую пользу. Кроме того, с учетом того, что различия в образе жизни разных лиц, степень сытости пациентов, принимающих лекарство между 8 часами вечера и сном, например от 10 часов вечера до полуночи, может быть различной, даже более предпочтительно, чтобы Тmax не зависело от потребления пищи.
Лекарства, которые могут обладать заранее заданным периодом задержки и которые высвобождают лекарственное вещество после этого периода задержки таким образом, который обеспечивает Тmax, независимое от того, принимал ли пациент пищу, приносят потенциально большую пользу, не только в отношении глюкокортикостероидов и лечения артрита, но также для других активных веществ, доставка которых предпочтительнее, если она синхронизирована с циркадианными ритмами, или даже в отношении лекарственных веществ, эффективность которых зависит от точной доставки в некоторый участок всасывания, или в сайт местного поражения в желудочно-кишечном тракте и внутренних органах. Такие лекарства предусмотрены настоящим изобретением.
В настоящее время не существует доступных указаний по регулированию биодоступности или биоэквивалентности для Тmax. Однако, руководство для промышленности «Food Effect Bioavailability and Fed Bioequivalence Studies» (Департамент здоровья США, CDER, Декабрь 2002) предполагает, что различия в Тmax не должны быть клинически значимыми. Будут ли такие различия клинически значимыми, зависит от доставляемого лекарства и конкретного проявления заболевания. Заявитель обнаружил, что в отношении рецептур согласно настоящему изобретению, эффект пищи на среднее значение Тmax составляет разницу только около +/-20%, более точно +/-10%.
Далее, заявителем получены лекарства, содержащие лекарственные вещества, на биоактивность которых в терминах Сmax и AUC (площадь под кривой «концентрация-время») прием пищи не оказывает значительного влияния, иными словами, для которых отсутствует эффект приема пищи.
«Эффект приема пищи» в отношении биодоступности лекарственных веществ представляет собой хорошо задокументированный феномен, относящийся к доставке лекарственного вещества, который характеризуется различиями в усвоении лекарственного вещества пациентами в зависимости от того, принимают они лекарственный препарат натощак или после еды (т.е. на голодный или сытый желудок). Наличие или отсутствие эффекта приема пищи может быть оценено количественно путем измерения площади под кривой «время-концентрация»(АUС) и/или Сmax в соответствии с хорошо известными в данной области методиками. Обычно измерения AUC и измерения Сmax проводят путем отбора в заданные моменты времени пробы биологической жидкости и построения зависимости концентрации лекарственного вещества в сыворотке от времени. Полученные значения представляют собой набор значений для разных пациентов из группы и, поэтому их выражают в виде средних значений для всей группы пациентов. Сравнивания средние значения (AUC) и/или Сmax, можно определить, оказывает ли пища какое либо влияние на данное лекарственное вещество.
Изучение эффекта приема пищи на биодоступность может быть проведено на достаточном количестве здоровых добровольцев, причем количество должно быть достаточным для получения достаточного количества данных для соответствующей статистической обработки. Число пациентов предпочтительно должно быть не меньше 12.
Для изучения эффекта приема пищи на биодоступность лекарственного вещества можно применять любую обычную схему исследования, известную в данной области, например схему с рандомизированным, сбалансированным, основанным на однократном приме дозы, с двумя циклами лечения двумя препаратами, с двумя периодами, перекрестным исследованием. Анализ результатов может быть проведен при помощи любой известной в данной области программы, такой как SAS PROC GLM, SAS Institute, Саrу, Северная Каролина.
В количественном выражении, можно сказать, что пища не оказывает влияния на действие лекарственного вещества, если с 90% доверительным интервалом отношения средних значений (соотвествующих пациентам, получающим и не получающим пищу) попадают в интервал от 0.8 до 1.25 для AUC и/или от 0.7 до 1.43 для Сmax.
Соответственно, настоящее изобретение предусматривает в одном из других своих аспектов такую таблетку, как описана выше, для которой отношение в AUC при приеме на сытый/голодный желудок после введения однократной дозы составляет от 0.8 до 1.25, а отношение Сmax в на сытый/голодный желудок составляет от 0.7 до 1.43.
Обычно принято считать, что лекарственный препарат принимают «на сытый желудок» в том случае, если субъект (пациент), после периода отсутствия пищи в течение по меньшей мере 10 часов принимает пищу, которая Управлением по контролю за продуктами и лекарствами США (FDA) официально признана как пища с высоким содержанием жира. Через короткое время после завершения приема пищи, например в пределах 5 мин, пациент принимает лекарство, возможно с водой. Предпочтительно исключить прием любой пищи в течение, например, 4 ч после приема лекарства, хотя допустимо пить воду в небольших количествах после, например, 2 ч после приема лекарства.
Прием пациентом лекарства «на голодный желудок» (натощак) обычно считается в том случае, когда лекарство принимают с водой по меньшей мере через 10 часов после последнего приема пищи. После этого исключают прием пищи в течение, например, 4 часов, хотя допустимо пить воду в небольших количествах, например, спустя 2 часа после приема лекарства.
Упомянутая выше пища с высоким содержанием жиров по стандарту FDA может включать любую пищу, которая, как ожидается, вызовет в ЖКТ максимальные изменения (возмущения), связанные с приемом пищи. Обычно 50% калорийности указанной пищи с высоким содержанием жира содержится в жирах. Представительным примером могут быть яичница из двух яиц, поджаренных на масле, 2 полоски бекона, 2 тоста с маслом, 4 унции жареного картофеля и 8 унций молока.
Таким образом, согласно настоящему изобретению предложены таблетки, которые демонстрируют пониженную индивидуальную и междуиндивидуальную вариабельность уровней восстановления/биодоступности.
Таблетки согласно настоящему изобретению могут быть упакованы разнообразными способами. Обычно распространяемый продукт включает контейнер для таблеток. Подходящие контейнеры хорошо известны специалистам в данной области, они включают такие материалы, как бутылки, упаковки из фольги и т.п. Дополнительно контейнер может быть снабжен ярлыком и вкладышем, содержащими описание его содержимого и соответствующие предупреждения или инструкции (указания) по применению. Преимуществом настоящего изобретения является то, что вкладыш и/или ярлык могут содержать указания на то, что таблетку можно принимать с пищей или без нее, при этом могут отсутствовать указания о том, что таблетку следует принимать только с пищей или только без пищи.
В другом аспекте изобретение предусматривает способ формования таблеток, описанных выше. Такие таблетки можно формовать на любом оборудовании для напрессовывания оболочки.
Обычно такое оборудование состоит из множества матриц, расположенных на вращающейся платформе. Матрицы установлены на платформе с возможностью их замены, что позволяет применять матрицы разных размеров, если необходимо. Матрицы являются полыми, так чтобы в них мог входить нижний пуансон. Пуансон располагается внутри матрицы таким образом, что между верхней поверхностью пуансона и внутренней поверхностью матрицы образуется пространство, которое определяет объем для получения точного количества материала оболочки. После загрузки платформа поворачивается и матрица оказывается под верхним пуансоном. Верхний пуансон опускается на материал оболочки, оказывая некоторое сжимающее давление, при этом материал покрытия подпрессовывается или уплотняется между верхним и нижним пуансонами. Затем предварительно сформованное ядро подают в матрицу, где оно занимает некоторое положение на уплотненном материале оболочки. Обычный таблет-пресс может быть оснащен центрирующими устройствами, которые позволяют задавать как вертикальное, так и радиальное положение ядра. Это может быть достигнуто в процессе уплотнения, когда исходное количество материала оболочки помещают в матрицу и затем уплотняют при помощи пуансона заданной формы, такого как пробивной пуансон, который оставляет в материале оболочки углубление, которое принимает ядро. Затем, на стадии второго заполнения, в матрицу подают точное количество материала оболочки, чтобы покрыть ядро, и верхний пуансон сжимает материал оболочки с заданной прессующей силой, в результате чего происходит формирование таблетки согласно настоящему изобретению.
В ходе процесса уплотнения прикладывают сравнительно небольшую сжимающую силу, едва достаточную для образования углубления в материале покрытия, которое примет ядро, и предотвращения движения материала оболочки под действием центробежной силы. Последующая сила сжатия, в результате которого образуется (формуется) таблетка может быть подобрана таким образом, чтобы придать таблеткам требуемую прочность. Предпочтительно сила сжатия составляет 400 кг, хотя для придания таблетке требуемой прочности ее можно произвольно изменять в пределах +/-30%.
Количество материала оболочки, подаваемого в матрицу, можно точно определить, исходя из плотности материала оболочки с тем, чтобы гарантировать, что образованная после прессования таблетка имеет требуемую толщину оболочки по оси (А-В), и что размеры матрицы выбраны, чтобы обеспечить толщину по оси X-Y. Если необходимо изменить толщину оболочки, на вращающуюся платформу помещают матрицу с соответствующими внутренними размерами и соответственно подбирают количество материала оболочки, подаваемого в матрицу.
Подходящие таблетирующие машины роторного типа с высокой рабочей скоростью известны в данной области и обсуждать их здесь далее нет необходимости. Ядра предпочтительно формуют под действием сжимающих сил, достаточных для того, чтобы получить ядра с прочностью по меньшей мере 60 ньютонов, например от 50 до 70 ньютонов. Ядра, обладающие прочностью в этом диапазоне, обеспечивают желаемые параметры высвобождения. По желанию, ядра можно формовать одновременно с производством таблеток с напрессованной оболочкой. Для этого можно применять пресс Manesty Dry Cota. Такой пресс состоит из двух соседних сцепленных прессов, один из которых производит ядро, которое после этого механически передается в другой пресс для напрессовки оболочки. Такое оборудование и методики производства таблеток известны в данной области, и нужды говорить здесь об этом больше нет.
Ядра предпочтительно производят по методике мокрой грануляции, широко известной в данной области. В ходе обычной типичной процедуры материалы ядра просеивают и перемешивают. Затем к смеси добавляют гранулирующую жидкость, обычно воду, гомогенизируют полученную смесь, в результате чего получают гранулят, который затем сушат распылительным высушиванием или сушкой в псевдоожиженном слое, для получения гранулята с требуемой остаточной влажностью. Остаточная влажность предпочтительно составляет приблизительно от 0.4 до 2.0% по массе. Затем гранулят просеивают, пропуская его через сито с желаемым размером ячеи. На этой стадии адъюванты просеивают и добавляют к грануляту, чтобы получить подходящий для прессования состав ядра. Специалисты в данной области также оценят, что состав оболочки может быть получен аналогичным образом. Специалисты в данной области также поймут, что можно получать грануляты с различными размерами гранул.
Предпочтительно, чтобы тонкая фракция гранулированного материала оболочки составляла менее 30%. Под «тонкой фракцией» понимают гранулят с размером гранул до, приблизительно, 63 микронов.
Предпочтительные особенности второго и последующих аспектов данного изобретения могут быть такими же, как и для первого с внесением необходимых изменений.
На Фиг.1 представлен поперечный разрез таблетки, на котором показана оболочка, ядро и оси (А-В) и (X-Y).
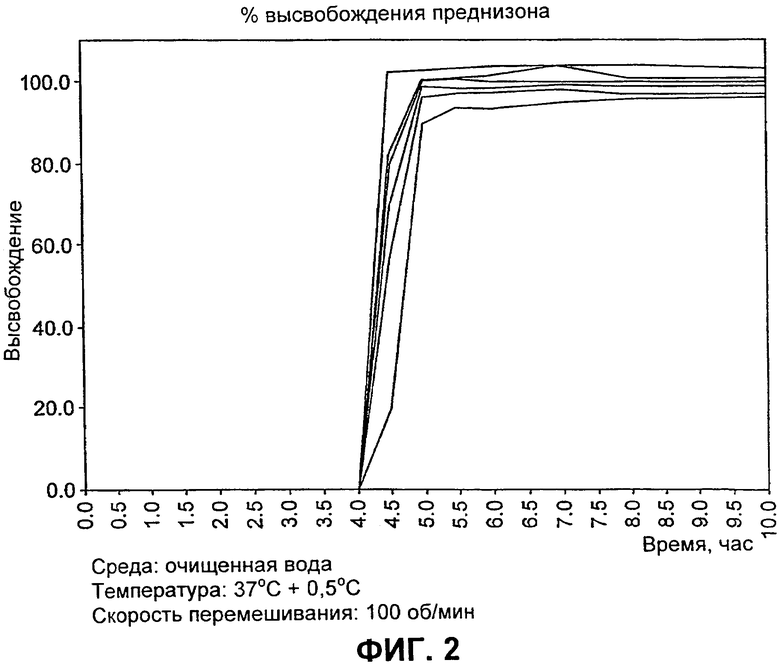
На Фиг.2 представлен профиль растворения it vitro лекарственной формы из примера 2.
Далее следует ряд примеров, иллюстрирующих изобретение.
Пример 1
(Приготовление таблетки, содержащей преднизон)
Активное ядро для системы с напрессованной оболочкой готовили следующим образом. Моногидрат лактозы(Lactose Pulvis H2O®NF 313/ Danone, Франция, и Lactose Fast Flo® NF 316, Foremost Ing. Group, США) представляет собой вещество - наполнитель с интересными техническими и функциональными свойствами. Lactose Pulvis Н2О® применяют в смеси, приготовленной путем мокрой грануляции, a Lactose Fast Flo® - в смеси, приготовленной для прямого прессования. Микрокристаллическую целлюлозу (Avicel® pH 101, FMC, Ирландия) применяют в качестве нерастворимого дилюента для прямого прессования. Поливинилпирролидон (Plasdone® K29032, ISP Technology, США) представляет собой гранулирующее вещество, растворимое в воде, которое обладает способностью связывать частицы порошка. Натриевую соль кроскармеллозы (кроскармеллоза натрия, Ac-Di-Sol®, FMC Corporation, США) применяют в качестве превосходного дезинтегрирующего вещества. В качестве внешней фазы добавляют стеарат магния (Merck, Швейцария), как смазывающее вещество, и диоксид кремния (Aerosil® 200, Degussa AG, Германия) для улучшения сыпучести гранулированного порошка.
Таблетка преднизона имеет напрессованную оболочку, которая по своей природе гидрофобна и нерастворима в воде. Этот защитный слой в основном образован из двухосновного фосфата кальция (Emcompress® 200, Mendell, США) и глицерил бегената (Compritol® 888ATO, gattefossé, Франция). Поливинилпирролидон (Plasdone® K29032, ISP Technology, США) представляет собой гранулирующее вещество, растворимое в воде, которое обладает способностью связывать частицы порошка. Желтый оксид железа (Sicovit® Yellow 10, BASF, Германия) добавляли в качестве красителя. Подробный состав этой защитной смеси дан в таблице 2.
Требуемые количества преднизона, Ac-Di-Sol®, Lactose Pulvis H2O® NF 313, Plasdone® K29032 взвешивали и просеивали вручную через сито с размером ячеи 0.710 мм. Компоненты смешивали с образованием однородной смеси в 25-литровом миксере-грануляторе Niro-Fielder PMA в течение 6 минут при скорости вращения импеллера, равной 250 об/мин, без измельчителя. Этот премикс анализировали на преднизон. Затем добавляли гранулирующий раствор (очищенная вода, 25.47% массы сухой смеси) в течение 4 мин при скорости вращения импеллера, равной 250 об/мин, и скорости измельчителя, равной 1500 об/мин, используя насадку H1/4VV-95-15 (скорость распыления 250 г/мин). Для гомогенизации и уплотнения мокрой массы смешивание продолжали в течение 3 минут при скорости импеллера 500 об/мин и скорости измельчителя 3000 об/мин.
Затем перемешанный мокрый гранулят высушивали в сушилке в псевдоожиженном слое Glatt WSG5. Входную температуру в ходе сушки поддерживали на уровне 45°С. Сушка продолжалась 20 минут, в результате получали гранулят с остаточной влажностью менее 2.5%. Полученный сухой гранулят калибровали в грануляторе Frewitt MGI 205, используя сито с размером ячеи 0.8 мм, в течение 3 минут на скорости 244 осц/мин (деление 7). Соответствующие количества Aerosil® 200 и стеарата магния просеивали вручную через сито с размером ячеи 1.0 мм. В 25-литровый миксер-гранулятор Niro-Fielder PMA закладывали сначала половину сухого гранулята, затем Aerosil® 200, и после него - оставшуюся половину сухого гранулята. Ингредиенты перемешивали в течение 2 минут при скорости импеллера, равной 250 об/мин. Наконец, добавляли стеарат магния и продолжали перемешивание в течение 2 минут при скорости импеллера, равной 250 об/мин.
Смесь для оболочки готовили в соответствии с описанным ниже процессом. Размер партии защитной смеси составлял 13кг. Взвешенные количества Emcompress®, Compritol® 8888ATO, Lactose Pulvis H2O®, Plasdone® K29-32 и Sicovit® Yellow 10 E 172 просеивали вручную через сито с размером ячеи 0.710 мм. Их помещали в 65-литровый миксер-гранулятор Niro-Fielder PMA. Затем компоненты перемешивали до гомогенного состояния в течение 6 мин при скорости импеллера, равной 200 об/мин, без измельчителя. Затем добавляли гранулирующий раствор (очищенная вода, 8.12% массы сухой смеси) в течение 2 мин при скорости вращения импеллера, равной 200 об/мин, и скорости измельчителя, равной 1500 об/мин, используя насадку 4,5 (скорость распыления 520 г/мин). Для гомогенизации и уплотнения мокрой массы перемешивание продолжали в течение 1 мин при скорости импеллера 400 об/мин и скорости измельчителя 3000 об/мин.
Затем перемешанный мокрый гранулят высушивали в сушилке в псевдоожиженном слое Glatt WSG5. Входную температуру в ходе сушки поддерживали на уровне 45°С. Сушка продолжалась 33 минут, в результате получали гранулят с остаточным содержанием влаги менее 2.5%. Полученный сухой гранулят калибровали в грануляторе Frewitt MGI 205, используя сито с размером ячеи 0.8 мм, в течение 3 мин на скорости 244 об/мин (деление 7). Соответствующие количества Aerosil® 200 и стеарата магния просеивали вручную через сито с размером ячеи 1.0 мм. В 25-литровый миксер-гранулятор Niro-FielderPMA закладывали сначала половину сухого гранулята, затем Aerosil® 200, и после него - оставшуюся половину сухого гранулята. Ингредиенты перемешивали в течение 2 мин при скорости импеллера, равной 200 об/мин. Наконец, добавляли стеарат магния и продолжали перемешивание в течение еще 2 мин при скорости импеллера, равной 200 об/мин, без измельчителя.
На ядро наносили 440 мг массы для оболочки и получали таблетки с напрессованной оболочкой диаметром 9 мм. При нанесении на ядро 305 мг массы для оболочки, получали таблетки с напрессованной оболочкой диаметром 8 мм. Эти разные варианты напрессовывания оболочки осуществляли при помощи таблетирующей машины Kilian RUD. Первый и второй загрузочные бункеры заполняли гранулятом для получения оболочки. У машины между двумя загрузочными бункерами имеется система транспортировки, приспособленная для подачи ядер. Для каждой таблетки первый загрузочный бункер подает приблизительно половину количества материала оболочки, которое должно быть нанесено на ядро. Затем, система подачи доставляет ядро и помещает его в центре матрицы. После этого второй загрузочный бункер подает оставшуюся половину количества материала оболочки, которое должно быть нанесено на ядро. Затем идет стадия прессования.
Пример 2
(профиль растворения in vitro)
Профиль растворения in vitro таблетки, содержащей нагрузку 5мг преднизона и приготовленной согласно способу, описанному в примере 1, определяли при помощи аппарата растворения №2 USP (лопасти) со стационарными корзинами, при скорости перемешивания, равной 100 об/мин. Растворяющая среда представляла собой очищенную воду (объем 500 мл).
После 4 часов не наблюдали высвобождения лекарственного вещества. Однако в течение 4.5 часов произошло высвобождение приблизительно 80% лекарственного вещества, а в течение 5 часов - приблизительно 100% лекарственного вещества (см. фиг.2).
Пример 3
Было проведено исследование' по определению эффекта приема пищи на биодоступность описанной выше таблетки, содержащей 5 мг преднизона.
В исследование не входило сравнение таблетки при приеме на сытый и голодный желудок. Вместо этого исследование было организовано таким образом, чтобы привести в соответствие хронофармакокинетику преднизона с его вечерним приемом, например около 8 вечера, что необходимо для того, чтобы пик концентрации в плазме был достигнут до секреции IL-6, чтобы повысить эффективность лечения. Исследование было спланировано таким образом, чтобы сравнить воздействие от таблетки в реальное время при различных вероятных сценариях приема пищи в это время. Было признано маловероятным, чтобы к 8 часам вечера с момента последнего приема пищи пациентом могло пройти приблизительно 8 часов. Соответственно, исследовали следующие сценарии приема пищи.
a) Для того, чтобы смоделировать состояние «на голодный желудок» в 8 часов вечера, за 21/2 часа до введения пациенту давали легкую пищу, содержащую ограниченное количество калорий (т.е. 22% общего дневного потребления калорий и с содержанием жиров, ограниченным 15.5 граммами) и не содержащую медленно перевариваемых питательных веществ. Это называют «полуголодным» состоянием. Эта трапеза состояла из черного хлеба, маргарина, сырного спреда, яблока (без кожуры) и фруктового коктейля в сиропе.
b) Состояние «на сытый желудок» моделируют, давая пациенту за 1/2 часа до приема дозы лекарства пищу с более высоким содержанием жиров, содержащую 35% дневного потребления калорий и 26 г жира.
Было сделано предположение, что в случае «полуголодного» состояния, после 21/2 часов желудок уже опустошен или практически опустошен от пищи.
В состав трапезы с высоким содержанием жиров вошли макароны с соусом спагетти, суп и овощи, яблочный сок, мороженое и взбитые сливки.
Методика состояла в проведении открытого рандомизированного трехпериодического перекрестного исследования, основанного на однократном приеме дозы перорально, с периодами вымывания длительностью 7 дней. Группа пациентов состояла из 27 добровольцев мужского пола.
Фармакокинетику лекарственной формы в состоянии на «полуголодный» и на «сытый» желудок сравнивали со стандартной формой с немедленным высвобождением (Decortin®) вводимой в 2 ч утра.
При приеме таблетки в состоянии на «полуголодный» желудок, лекарственная форма продемонстрировала средний период задержки, равный 3.5 часам. Данная лекарственная форма и принимаемый в 2 ч утра Decortin® были полностью биоэквивалентны, с отношением Сmax 97% и относительной биодоступностью 101% (AUC0-бесконечность).
При приеме таблетки «на сытый желудок», средняя длительность периода задержки составила 4 ч. Отношение Сmax составило 105% по сравнению с Decortin®, a относительная биодоступность (AUC0-∞) составила 113%.
Отношения Сmax и AUC0-∞ лекарственной формы при приеме «на сытый желудок» и на «полуголодный желудок» составили 108% и 113% соответственно.
Эти результаты демонстрируют тот факт, что лекарственные формы согласно настоящему изобретению демонстрируют прекрасную биодоступность при отсутствии значительного влияния приема пищи.
Настоящее изобретение относится к области лекарственных средств, в частности к таблетке, изготовленной методом напрессовывания оболочки, в состав которой входят ядро, содержащее лекарственное средство, и окружающая ядро оболочка из нерастворимого или плохо растворимого в воде материала, причем ядро расположено внутри указанной оболочки таким образом, что оболочка по оси (X-Y) имеет большую толщину и меньшую плотность, чем по оси (А-В), ортогональной оси (X-Y), при этом пористость оболочки по оси (X-Y) достаточна для того, чтобы обеспечить проникание водной среды, так чтобы при погружении в водную среду после периода от 2 ч до 6 ч происходило разрушение оболочки и высвобождение лекарственного средства. Также изобретение относится к способу получения указанной таблетки, фармацевтической упаковке ее содержащей и способу лечения. Указанная форма таблетки обеспечивает быстрое высвобождение и доставку активного компонента после периода задержки, который может быть задан с большой точностью. Такая система обеспечит направленную доставку активного компонента в место всасывания или действия.
4 н. и 15 з.п. ф-лы, 2 ил., 3 табл.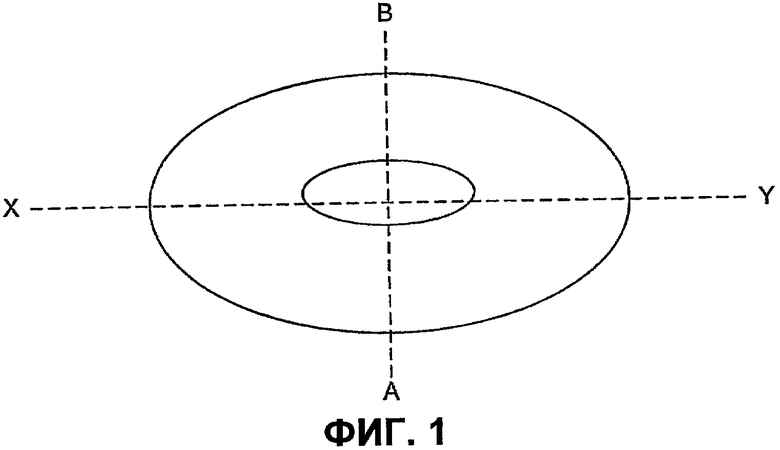
1. Таблетка, изготовленная методом напрессовывания оболочки, в состав которой входят ядро, содержащее лекарственное средство, и окружающая ядро оболочка из нерастворимого или плохо растворимого в воде материала, причем ядро расположено внутри указанной оболочки таким образом, что оболочка по оси (X-Y) имеет большую толщину и меньшую плотность, чем по оси (А-В), ортогональной оси (X-Y), при этом пористость оболочки по оси (X-Y) достаточна для того, чтобы обеспечить проникание водной среды, так чтобы при погружении в водную среду после периода от 2 до 6 ч происходило разрушение оболочки и высвобождение лекарственного средства.
2. Таблетка по п.1, отличающаяся тем, что толщина покрытия по оси (X-Y) составляет по меньшей мере 2,2 мм.
3. Таблетка по п.1, отличающаяся тем, что толщина покрытия по оси (X-Y) составляет приблизительно от 2,2 мм до 2,6 мм.
4. Таблетка по п.1, отличающаяся тем, что оболочка содержит гидрофобные производные целлюлозы и полимеры, включая алкилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу и их производные, полимерные производные полиметакрила, поливинилацетат и полимерные производные ацетата целлюлозы, жирные кислоты, либо их эфиры или соли, длинноцепочечные жирные спирты, полиоксиэтиленалкил эфиры, стеараты полиэтилена, эфиры сахаров, лауроил макрогол-32 глицерил, стеароил макрогол-32 глицерил и т.п.
5. Таблетка по п.1, отличающаяся тем, что оболочка содержит соль фосфат кальция, глицерил бегенат и поливинилпирролидон, либо их смеси.
6. Таблетка по п.1, отличающаяся тем, что ядро содержит лекарственное вещество и дезинтегрирующее вещество.
7. Таблетка по п.1, отличающаяся тем, что она содержит поперечно сшитые поливинилпирролидон и кроскармеллозу натрия.
8. Таблетка по п.1, отличающаяся тем, что активное вещество представляет собой глюкокортикостероид, выбранный из преднизона, преднизолона или метилпреднизолона.
9. Таблетка по п.8, отличающаяся тем, что она содержит 1 или 5 мг преднизона.
10. Таблетка по п.9, отличающаяся тем, что она содержит следующие ингредиенты:
Ядро таблетки, содержащей 5 мг преднизона:
Преднизон 8,33%
Моногидрат лактозы 64,47%
Повидон (Povidone) 6,67%
Кроскармеллоза натрия 18,33%
Красный оксид железа 0,5%
Стеарат магния растительного происхождения 1,0%
Коллоидный диоксид кремния 0,5%
Оболочка
Дигидрат двухосновного фосфата кальция 50%
Глицерил бегенат 40%
Повидон 8,40%
Желтый оксид железа 0,1%
Стеарат магния растительного происхождения 1,0%
Коллоидный диоксид кремния 0,5%
11. Таблетка по любому из пп.1-10, отличающаяся тем, что после введения пациенту период задержки перед высвобождением лекарственного средства составляет от 2 до 6 ч.
12. Таблетка по любому из пп.1-10, отличающаяся тем, что она обладает профилем растворения in vitro при скорости перемешивания, равной 100 об/мин, и в растворяющей среде, состоящей из очищенной воды (500 мл), в котором наблюдается период задержки средней длительностью 4 ч, при этом по меньшей мере приблизительно 80% лекарственного средства высвобождается после 4,5 ч, а 100% высвобождение происходит после 5 ч.
13. Таблетка по п.12, отличающаяся тем, что лекарственное вещество выбрано из преднизона, преднизолона или метилпреднизолона.
14. Таблетка по любому из пп.1-10, 13, отличающаяся тем, что индивидуальная и межиндивидуальная вариабельность Тмах составляет менее ±20%, независимо от того, находится пациент в сытом или голодном состоянии.
15. Таблетка по любому из пп.1-10, 13, отличающаяся тем, что после введения однократной дозы отношение Смах сытое/голодное составляет от 0,7 до 1,43.
16. Таблетка по любому из пп.1-10, 13, отличающаяся тем, что после введения однократной дозы отношение AUC сытое/голодное составляет от 0,8 до 1,25.
17. Фармацевтическая упаковка, содержащая таблетки по любому из пп.1-16, вместе с ярлыком или инструкцией о том, что таблетки можно принимать с пищей или без нее (независимо от приема пищи).
18. Способ лечения артритных болей, аллергий, астмы, болезни Крона, язвенного колита, синдрома раздраженного кишечника и воспалительных заболеваний кишечника путем предоставления нуждающемуся в лечении пациенту таблетки, описанной в любом из пп.1-16, содержащей преднизон, преднизолон или метилпреднизолон.
19. Способ приготовления таблетки по любому из пп.1-16, включающий стадию формования первого гранулята, содержащего материал оболочки, получение второго гранулята, содержащего материал ядра, формование второго гранулята в виде ядра и напрессовывание первого гранулята вокруг ядра.
| US 5279832 A, 18.01.1994 | |||
| US 6365185 В1, 02.04.2002 | |||
| СПОСОБ ДОРАЗРАБОТКИ НЕФТЯНОГО МЕСТОРОЖДЕНИЯ | 1994 |
|
RU2072033C1 |
| WO 9832425 A1, 30.07.1998 | |||
| ТВЕРДЫЕ СТАБИЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ ПРЕДНИЗОЛОНА | 2001 |
|
RU2187307C1 |
| WO 9319741 A, 14.10.1993 | |||
| US 6183780 A, 06.02.2001. | |||
Авторы
Даты
2010-06-10—Публикация
2004-04-23—Подача