Данная заявка испрашивает приоритет Предварительной заявки США №60/762750, зарегистрированной 27 января 2006 г., содержание которой включено сюда в виде ссылки.
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Данное изобретение относится к дозированным лекарственным формам с модифицированным высвобождением, включающих одну или более из совокупностей гранул со спланированным по времени пульсирующим высвобождением, содержащих слабощелочной содержащий азот (N) селективный 5-HT3 серотониновый блокатор, имеющий рКа в интервале от приблизительно 5 до 14 и растворимость не более чем 200 мкг/мл при pH 6,8, и одну или более из фармацевтически приемлемых органических кислот. Данная дозированная форма проявляет сравнимые характеристики высвобождения как активного вещества, так и органической кислоты после заранее определенной задержки (время задержки) при испытании на распад по методу определения распадаемости United States Pharmacopeia (USP/ Фармакопеи Соединенных Штатов) с применением среды для двухэтапного распада (в первые 2 часа в 0,1 N HCl с последующим испытанием в буфере при pH 6,8). В соответствии с другим аспектом данного изобретения описаны системы доставки лекарственного средства при пероральном приеме для получения целевых ФК (фармакокинетических, т.е. концентрации в плазме в зависимости от времени) характеристик, подходящих для режима дозирования один раз в сутки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Многие терапевтические средства являются наиболее эффективными, когда они изготовлены так, что поступают с постоянной скоростью в место всасывания или в области вблизи него. Всасывание терапевтических средств, которые изготовлены с поступлением таким способом, обычно дает в результате желаемые концентрации в плазме, приводя к максимальной эффективности и минимальным побочным токсическим эффектам. Предпринято много усилий по разработке сложных систем доставки лекарственного средства, таких как осмотические устройства для перорального применения. Однако существуют примеры, когда поддержание постоянного уровня лекарственного средства в крови нежелательно. Например, главной целью хронотерапии при сердечно-сосудистых заболеваниях является доставка лекарственного средства в более высоких концентрациях в течение срока наибольшей потребности в нем, например в ранние утренние часы, и в меньших концентрациях, когда потребность меньше, например поздно вечером и в первые часы сна. В дополнение к правильно созданной системе доставки лекарственного средства одинаково важно время введения. Необходимые специфические фармакокинетические характеристики можно рассчитать, используя компьютерные методы имитации и моделирования на основе знания фармакокинетических параметров, растворимости, всасывания по всему желудочно-кишечному тракту и полупериода выведения.
В то время когда перорально вводимая лекарственная дозированная форма проходит по пищеварительному тракту человека, лекарственное средство должно быть высвобождено из дозированной формы и быть доступно в форме раствора в месте, где происходит всасывание из желудочно-кишечного (ЖК) тракта или вблизи него. Скорость, с которой лекарственное средство переходит в раствор и высвобождается из дозированной формы, важна для кинетики всасывания лекарственного средства. Дозированная форма и, следовательно, активный ингредиент подвергается действию среды с разными pH во время этого прохождения, т.е. pH меняющейся от приблизительно 1,2 (pH в желудке натощак, но может меняться между 1,2 и 4,0 при приеме пищи) до приблизительно 7,4 (pH желчи: 7/0-7,4 и pH в кишечнике: 5-7). Кроме того, время прохождения дозированной формы в отдельных частях пищеварительного тракта может значительно меняться в зависимости от их размера и превалирующих местных условий. Другие факторы, которые влияют на всасывание лекарственного средства, включают физико-химические свойства самого лекарственного вещества, такие как рКа, растворимость, энергия кристалла и удельная площадь поверхности. Преобладающие местные условия, которые играют важную роль, включают свойства содержимого в просвете отдела (pH, поверхностное натяжение, объем, перемешивание и буферная способность) и изменения после переваривания пищи. Поэтому часто трудно достичь высвобождения лекарственного вещества с постоянной скоростью,
Щелочные и кислые лекарственные вещества проявляют зависимые от pH характеристики растворимости, меняющиеся в амплитуде значений более чем 2 порядка в интервале физиологических pH. Наиболее трудными кандидатами для работы с ними являются слабо щелочные фармакологически активные вещества, которые практически нерастворимы при pH>6, и требуются высокие дозы, чтобы они были терапевтически эффективны. При поступлении в область кишечника часть лекарственного вещества, высвобожденного из дозированной формы, может выпадать в осадок в среде с неблагоприятным pH, если только скорость всасывания не является более быстрой, чем скорость высвобождения лекарственного вещества. Альтернативно, лекарственное вещество может оставаться в состоянии перенасыщенного раствора, которому способствует присутствие в кишечнике желчных солей и лецитина. Перенасыщение значительно выше порядка амплитуды, выше, чем растворимость в воде, которую наблюдали в предшествующих работах. При явлении выпадения в осадок, существуют данные о повторном растворении для всасывания при более медленной фазе.
Функциональные полимерные мембраны, содержащие комбинации синтетических полимеров, таких как водорастворимые (например, повидон), нерастворимые в воде (например, этилцеллюлоза, нерастворимая при физиологических pH), растворимые в желудке (например, Eudragit EPO) или кишечнорастворимые (например, устойчивый в желудке фталат гипромеллозы) полимеры, наносили на таблеточные и пилюльные ядра, содержащие активное вещество и один или более из солюбилизаторов для достижения высвобождения лекарственного вещества с постоянной скоростью с ограниченным успехом. Описана разработка фармацевтических композиций активных веществ с высокой растворимостью в воде при кислых и щелочных pH с использованием фармацевтически приемлемых буферных кислот, буферных солей кислот и их смесей для получения высвобождения лекарственных веществ с по существу постоянной скоростью. Органические кислоты использовали для улучшения биодоступности, для снижения вариабельности у разных пациентов и у одного и для сведения к минимуму воздействия пищи на слабо щелочные фармакологически активные вещества. Состоящие из множества частиц дозированные формы слабо щелочных лекарственных веществ для получения характеристик с расширенным высвобождением также описаны в литературе. Эти дозированные формы обычно получают путем гранулирования или наслаивания лекарственного вещества с одной или более из органических кислот и покрытия комбинацией нерастворимых в воде и водорастворимых или кишечнорастворимых полимеров.
Хотя высвобождение лекарственного вещества в этих описаниях умерено увеличено, они страдают двумя недостатками, а именно, невозможностью поддержания адекватного профиля концентраций в плазме для достижения режима дозирования один раз в сутки, и частичное осуществление получения in situ формы соли с образованием таким образом нового химического соединения. Даже когда содержащие органическую кислоту ядра покрывали полимерной мембраной с замедленным высвобождением, с данной системой доставки нельзя было продлить высвобождение кислоты в процессе длительного распада и происходящего в результате всасывания активного вещества с получением адекватных уровней в плазме через 24 часа после перорального приема. Кроме того, многие слабо щелочные лекарственные вещества, как известно, образуют соли в присутствии органических кислот, особенно при растворении в обычных растворителях в отношении наслаивания лекарственного средства или во время гранулирования. Даже в дозированных формах, когда органическая кислота и слои лекарственного вещества разделены мембраной для замедленного высвобождения (ЗВ; SR), препарат со слоем лекарственного вещества содержит органическую кислоту. Поэтому активное вещество в конечной дозировке существует в частично или полностью нейтрализованной форме соли. Это является неприемлемой ситуацией со стороны регуляции. Регулирующие органы могут рассматривать эти активные вещества как новые лекарственные соединения. Таким образом, существует неудовлетворенная потребность в разработке систем доставки лекарственного вещества, содержащих слабо щелочные лекарственные вещества с рКа в интервале от 5 до 14 и требующие высоких доз и содержания органических кислот в неизмененной форме для высвобождения активных веществ таким образом, что поддерживаются намечаемые концентрации в плазме от Cmax до Cmin с тем, чтобы они подходили для режимов дозирования с введением один раз в сутки. После интенсивных исследований неожиданно открыто, что эту неудовлетворенную потребность можно удовлетворить путем предотвращения контакта друг с другом органической кислоты и слабо щелочного активного вещества с образованием соли во время переработки и/или в дозированной форме во время хранения, перед попаданием в среду для растворения (распада) in vitro или до перорального приема. Это может быть достигнуто путем применения регулирующей скорость распадаемости (растворения) ЗВ (SR) мембраны между слоем кислоты на инертных ядрах и слоем лекарственного вещества, нанесенного на содержащие кислоту ядра для отделения этих двух компонентов, а также за счет мембраны (ЗВ) и/или оболочки с покрытием с задержкой времени высвобождения (TPR) на гранулах с быстрым высвобождением для того, чтобы синхронизировать высвобождение кислоты с высвобождением лекарственного вещества.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение представляет фармацевтические композиции и способы создания систем с пульсирующей доставкой, которые включают предотвращение контакта слабощелочного содержащего азот (N) селективного блокирующего серотониновые 5HT3 средства, имеющего рКа в интервале от приблизительно 5 до 14 и растворимость не более 200 мкг/мл при pH 6,8, и фармацевтически приемлемой органической кислоты с образованием вещества с присоединением кислоты. Кроме того, дозированные формы, описанные здесь, обеспечивают намечаемые графики высвобождения лекарственного вещества посредством солюбилизации лекарственного вещества перед его высвобождением во враждебную среду кишечника, в которой лекарственное вещество практически нерастворимо, повышая тем самым возможность достижения приемлемой концентрации в плазме через 24 часа после приема дозы, для того, чтобы они стали пригодными для режима дозирования с приемом один раз в сутки. Данное изобретение особенно применимо, как описано в предварительной патентной заявке сер. №60/762766, для получения дозированных форм для режима дозирования два раза или один раз в сутки слабо щелочных содержащих (N) терапевтических средств, имеющих рКа в интервале от приблизительно 5 до 14 (обычно растворимых при кислых pH, но плохо растворимых или практически нерастворимых при нейтральных и щелочных pH) и с полупериодом выведения приблизительно 2 часа или более, путем доставки активного вещества в форме раствора через желудочно-кишечный тракт.
Другое воплощение данного изобретения относится к фармацевтической композиции, состоящей из множества частиц, включающей одно или более множеств покрытых гранул, содержащих слабо щелочное содержащее азот (N) селективное блокирующее серотониновые 5HT3 средство с растворимостью не более приблизительно 200 мкг/мл, более конкретно не более приблизительно 100 мкг/мл при pH 6,8 и отношение оптимальной наивысшей дозы к растворимости при pH 6,8, равное по меньшей мере приблизительно 100. Например, режим дозирования для ондансетрона, активного вещества в зофране (Zofran®; БВ таблетка) с растворимостью приблизительно 0,05 мг/мл при pH 6,8 обычно составляет 8 мг два или три раза в сутки, и оптимальная наивысшая доза составляет 16 или 24 мг, отношение оптимальной наивысшей дозы (мг) к растворимости (мг/мл) при pH 6,8 должно быть 320. Композиция, состоящая из множества частиц, получаемая в соответствии с одним из аспектов данного изобретения будет содержать включающие органическую кислоту ядра, покрытые ЗВ (дающей замедленное высвобождение или изолирующей) мембраной, на которую наслаивают слабо щелочное терапевтическое средство с рКа в интервале от приблизительно 5 до 14 и далее покрывают ЗВ мембраной и/или мембраной для задержки времени высвобождения, так что как органическая кислота, так и слабо щелочное терапевтическое средство проявляют сравнимые графики высвобождения лекарственного вещества.
Композиции, состоящие из множества частиц, полученные в соответствии с одним из аспектов данного изобретения, содержат одну или более из совокупностей гранул, проявляющих сходные графики высвобождения композита как органической кислоты, так и слабо щелочного включающего азот (N) селективного блокирующего серотониновые 5HT3 средства при испытании на распадаемость с использованием аппарата 1 по Фармакопее Соединенных Штатов (барабаны @ 100 об/мин) или аппарата 2 (лопасти @ 50 об/мин) и двухэтапной методики определения распадаемости (испытание в 700 мл 0,1 N HCl (соляной кислоты) в течение первых 2 часов, а затем в 900 мл при pH 6,8, получаемом путем добавления 200 мл модификатора pH). Другое воплощение данного изобретения относится к фармацевтической композиции из множества частиц, содержащей одну совокупность или более, покрытых гранул, проявляющих характер высвобождения кислоты, который, в частности, является более медленным по сравнению с характером высвобождения слабо щелочного активного вещества, чтобы избежать образования нерастворимого активного вещества, которое может оставаться за внутренней стороной покрытых гранул.
Фармацевтическая композиция из множества частиц по одному из аспектов данного изобретения содержит совокупности покрытых гранул из слабо щелочного содержащего азот (N) селективного 5-HT3 серотонинового блокатора с рКа в интервале от приблизительно 5 до 14, содержащая
a) включающие ядра из органической кислоты частицы (кристалл органической кислоты, лепешка, шарик и тому подобное);
b) изолирующую или дающую замедленное высвобождение мембрану на содержащих ядро из кислоты частицах, состоящую из нерастворимого в воде полимера в сочетании с водорастворимым или кишечнорастворимым полимером;
c) слабо щелочное лекарственное вещество, наслоенное на покрытую изолирующим слоем частицу с ядром из кислоты и, необязательно, снабженную герметичным покрытием с образованием гранулы с быстрым высвобождением (БВ; IR),
d) если представлены ЗВ гранулы, покрывающую ЗВ мембрану на БВ гранулах, содержащую нерастворимый в воде полимер или нерастворимый в воде полимер в сочетании с водорастворимым полимером, образующие 3 В гранулу; и/или
e) если представлены СПВ (TPR) гранулы, мембрану с задержкой времени высвобождения на покрытой 3 В грануле, содержащую комбинацию нерастворимого в воде и кишечнорастворимого полимеров с образованием синхронизированных с пульсирующим высвобождением (СПВ; TPR) гранул.
Композиции в соответствии с конкретными аспектами данного изобретения обычно проявляют желаемые или намеченные характеристики высвобождения как активного соединения, так и органической кислоты после заранее установленной задержки времени высвобождения, равной по меньшей мере 2 часам при испытании лекарственного средства и/или высвобождения органической кислоты с использованием 2-этапной методики определения распадаемости, описанной выше.
Фармацевтическая композиция слабо щелочного содержащего азот (N) селективного 5-HT3 серотонинового блокатора с растворимостью, составляющей не более приблизительно 200 мкг/мл при pH 6,8 и отношении оптимальной наивысшей дозы к растворимости при pH 6,8 не менее чем приблизительно 100, такими как у дигидрата гидрохлорида ондансетрона, может быть получена путем заполнения соответствующими совокупностями гранул твердой желатиновой капсулы или прессования их в обычную таблетку или в форму РРТ (ODT; распадающуюся во рту таблетку) в соответствии с некоторыми воплощениями данного изобретения. Фармацевтическая композиция слабо щелочного содержащего азот (N) селективного 5-НТ3 серотонинового блокатора в форме PPT, получаемую в соответствии с другим воплощением данного изобретения распадается при контакте со слюной в защечной полости в пределах приблизительно 60 секунд, образуя однородную легко проглатываемую суспензию (не зернистую или без послевкусия мела). Фармацевтическая композиция слабо щелочного фармакологически активного соединения в форме PPT, которая может содержать одну или более из совокупностей покрытых гранул со средним размером частиц не более приблизительно 400 мкм, таких как микрокапсулы с маскировкой вкуса, содержащие включающие лекарственное вещество ядра (кристаллы, гранулы, пилюли, шарики и тому подобное), совокупности ЗВ гранул и синхронизированных с пульсирующим высвобождением (СПВ) гранул, содержащие включающие кислоту ядра с ЗВ покрытием. Маскировка вкуса может быть достигнута в соответствии с любым из хорошо известных специалистам описаний. PPT могут также включать быстро диспергирующиеся микрогранулы со средним размером частиц не более приблизительно 400 мкм или, в некоторых воплощениях не более приблизительно 300 мкм, содержащие улучшающее распадаемость вещество (например, кросповидон, структурированный поливинилпирролидон) и сахаро-спирт (например, маннит), сахарид (например, лактоза) или их сочетание, причем каждый имеет средний размер частиц не более приблизительно 30 мкм и, необязательно, фармацевтически приемлемые вспомогательные вещества, обычно используемые в составе РРТ, а именно, улучшающие вкус и запах вещества, подсластитель, красители и дополнительное улучшающее распадаемость вещество.
PPT в соответствии с одним из воплощений проявляет следующие свойства:
1) распадается при контакте со слюной в полости рта через приблизительно 60 секунд, образуя однородную легко проглатываемую суспензию, содержащую частицы с замаскированным вкусом и/или покрытые частицы (ЗВ и/или СПВ гранулы).;
2) частицы с замаскированным вкусом, если они присутствуют, обеспечивают быстрое, по существу полное высвобождение дозы при поступлении в желудок (например, обычно более приблизительно 50% через приблизительно 60 минут);
3) покрытые частицы (ЗВ и/или СПВ гранулы) обеспечивают продолжительное высвобождение активного вещества для продолжительного всасывания по ЖК тракту.
PPT в соответствии с одним из воплощений, содержащие микрокапсулы с замаскированным вкусом, проявляют эффективное маскирующее вкус действие путем высвобождения не более чем 10% через приблизительно 3 минуты (наиболее длительное обычное время присутствия, предполагаемое для PPT в полости рта), когда распадаемость испытывали в имитирующей слюну жидкости (pH~6,8), тогда как высвобождается не менее приблизительно 50% дозы через приблизительно 60 минут, когда распадаемость испытывали в 0,1N HCl.
В соответствии с некоторыми воплощениями быстро диспергируемые микрогранулы и покрытые гранулы (БВ с замаскированным вкусом, ЗВ и СПВ гранулы) одного или более слабо щелочных активных веществ могут присутствовать в весовом отношении от приблизительно 6:1 до 1:1, более конкретно, от приблизительно 4:1 до 2:1 для достижения ощущения гладкости (не крупинок) во рту. В соответствии с некоторыми другими воплощениями покрытые гранулы (IR с замаскированным вкусом, ЗВ и/или СПВ гранулы) одного или более из слабо щелочных активных веществ могут быть покрыты прессуемым покрытием (например, покрытием в псевдоожиженном слое пластифицированной водной дисперсией ацетилцеллюлозы), чтобы минимизировать разрывы мембраны во время прессования с быстро диспергируемыми микрогранулами.
Фармацевтическая композиция со слабо щелочным фармакологически активным веществом в форме обычной таблетки в соответствии с другим воплощением данного изобретения может включать одну или более из совокупностей гранул, таких как БВ гранулы (кристаллы, гранулы, лепешки, шарики и тому подобное) и ЗВ гранулы и/или СПВ гранулы, содержащие, покрытые ЗВ содержащие кислоту ядра. Фармацевтическая композиция слабо щелочного фармакологически активного вещества в форме обычной таблетки распадается на образующие ее гранулы (частицы с замаскированным вкусом, покрытые ЗВ гранулы и/или СПВ гранулы) при пероральном приеме через приблизительно 10 минут. Обычная таблетка может также включать фармацевтически приемлемые вспомогательные вещества, обычно используемые в распадающихся таблетированных препаратах, такие как прессуемые разбавители, наполнители, красители и, необязательно, улучшающие скольжение вещества.
Обычная таблетка, изготовленная в соответствии с одним из воплощений, проявляет следующие свойства:
1) распадается при пероральном приеме через приблизительно 10 минут на БВ частицы и/или покрытые частицы (ЗВ и/или СПВ гранулы);
2) БВ частицы, если они присутствуют, обеспечивают быстрое, по существу полное высвобождение (например, более приблизительно 95%) дозы через приблизительно 60 минут, более конкретно, в пределах приблизительно 30 минут после поступления в желудок;
3) ЗВ и/или СПВ гранулы обеспечивают длительное высвобождение активного вещества для непрерывного всасывания по кишечному тракту (КТ).
Другое воплощение данного изобретения относится к фармацевтической композиции из множества частиц, содержащей одну или более из совокупностей гранул в оболочке, содержащих одно или более слабо щелочных терапевтических средств, имеющих полупериод выведения, равный приблизительно 2 часам или более, причем активное вещество наслоено на покрытые ЗВ содержащие органическую кислоту ядра. Система с пульсирующей доставкой, разработанная в соответствии с этим аспектом данного изобретения может содержать совокупности БВ гранул, ЗВ гранул и синхронизированных с пульсирующим высвобождением (СПВ) гранул. Покрытые ЗВ содержащие органическую кислоту ядра обычно изготавливают путем нанесения слоя органической кислоты (например, фумаровой кислоты) на инертные частицы (например, сахарные сферы) из полимерного связывающего раствора и покрывают нерастворимым в воде полимером (например, этилцеллюлозой с вязкостью приблизительно 10 сПз) одним или в сочетании с водорастворимым полимером (например, поливинилпирролидоном, повидоном K-25 или полиэтиленгликолем, ПЭГ 400) или кишечнорастворимым полимером (например, фталатгипромеллоза, НРМСР или HP-55). Совокупность БВ гранул, ЗВ покрытые содержащие кислоту ядра получают путем наслоения лекарственного вещества на 3 В покрытые содержащие кислоту ядра из связывающего раствора полимера и создания защитного герметичного покрытия Opadry Clear. Совокупности гранул ЗВ и СПВ получают путем покрытия гранул БВ нерастворимым в воде полимером (например, этилцеллюлозой), одним или в комбинации с водорастворимым полимером (например, ПВП K-25 или ПЭГ 400). В соответствии с одним из аспектов данного изобретения совокупность гранул ЗВ и СПВ высвобождает как лекарственное вещество, так и кислоту со сравнимыми скоростями, по графикам быстрого высвобождения или замедленного высвобождения после заранее установленного времени задержки (например, времени задержки до 10 часов) при пероральном приеме. БВ гранулы, если они включены в дозированную форму (капсулы или обычные таблетки или распадающиеся во рту таблетки), могут содержать лекарственное вещество, наслоенное непосредственно на инертные ядра и покрытое защитным герметичным покрытием или маскирующей вкус мембраной, которые являются частью общей дозы, обеспечивают быстрое всасывание (нагрузочная доза) при пероральном введении.
Представлен также способ производства фармацевтической композиции из множества частиц, в которой система доставки разработанная в соответствии с некоторыми воплощениями данного изобретения, содержит один или более из слабо щелочных активных фармацевтических ингредиентов в количествах, достаточных для возможности перорального приема пациентом при назначенном режиме дозирования с приемом один раз в сутки, с получением терапевтической эффективности.
Способ производства фармацевтической композиции из множества частиц в соответствии с конкретными воплощениями включает наслоение фармацевтически приемлемой органической кислоты, такой как фумаровая кислота, из связывающего раствора полимера на инертные частицы, выбранные из группы, состоящей из сферических сахарных частиц и сферических целлюлозных частиц. Можно применять нанесение покрытия в псевдоожиженном слое или чане, чтобы нанести органическую кислоту и связывающий раствор полимера. В соответствии с другими воплощениями ядра частиц могут быть кристаллами с желаемым распределением частиц по размеру, микрогранулами, лепешками или шариками, содержащими одну или более из органических кислот. В соответствии с некоторыми воплощениями микрогранулы, экструдированные сферонизированные гранулы или прессованные микротаблетки, содержащие одну или более из органических кислот, полимерное связывающее вещество, которое придает свойства эластичности сухим микрогранулам, гидрофильные наполнители/разбавители и, необязательно, вкусовую добавку, подсластитель и/или дезинтегрирующее вещество. Эти содержащие кислоту частицы покрыты с помощью изолирующей ЗВ (замедленное высвобождение) полимерной мембраны, содержащей нерастворимый в воде полимер (например, этилцеллюлозу с обычной вязкостью в 10 сПз) один или в сочетании с водорастворимым полимером (например, поливинилпирролидоном или полиэтиленгликолем) или кишечнорастворимым полимером (например, фталатгипромеллозой (НРМСР или HP-55)). Нерастворимый в воде и водорастворимый или кишечнорастворимый полимеры могут присутствовать в весовом отношении от приблизительно 95:5 до приблизительно 50:50, более конкретно, от приблизительно 90:10 до 60:40, и толщина мембрана может варьировать от приблизительно 3% до 50%, более конкретно от приблизительно 5% до 30% по весу в соответствии с конкретными воплощениями.
В соответствии с конкретными воплощениями одно или более из слабо щелочных лекарственных веществ наносят на покрытые ЗВ содержащие кислоту частицы из связывающего раствора полимера, а также защитное герметичное покрытие гидрофильным полимером (например, Pharmacoat™ 603 или Opadry® Clear) наносят на гранулы со слоем лекарственного вещества с получением БВ гранул. Содержание органической кислоты или лекарственного вещества зависит от физико-химических, а также фармакологических свойств слабо щелочных активных веществ, выбранных для разработки, и лекарственное вещество и органическая кислота могут присутствовать в весовом отношении от приблизительно 5:1 до 1:10 или более, в частности, от приблизительно 3:1 до 1:3, в зависимости от того, используют ли кристаллы органической кислоты или содержащие органическую кислоту ядра в соответствии с определенными воплощениями.
В соответствии с некоторыми воплощениями данного изобретения БВ гранулы, содержащие покрытые ЗВ содержащие кислоту ядра имеют изолирующее покрытие из ЗВ полимерной мембраны, содержащей нерастворимый в воде полимер (например, этилцеллюлозу с обычной вязкостью 10 спз), один или в сочетании с водорастворимым полимером (например, поливинилпирролидоном или полиэтиленгликолем). Нерастворимый в воде и водорастворимый полимеры могут присутствовать в весовом отношении от приблизительно 95:5 до приблизительно 50:50, более конкретно, от приблизительно 90:10 до 60:40, и толщина мембраны может меняться от приблизительно 3% до 50%, более конкретно, от приблизительно 5% до 30% по весу в соответствии с конкретными воплощениями.
В соответствии с другими воплощениями данного изобретения 3 В гранулы, содержащие гранулы с наслоенным лекарственным веществом, покрыты мембраной, дающей задержку времени высвобождения, содержащей комбинацию нерастворимого в воде полимера (например, этилцеллюлозу с обычной вязкостью в 10 сПз) и кишечнорастворимого полимера (например, фталатгипромеллозу (НРМСР или HP-55)) с получением СПВ гранул. В соответствии с некоторыми другими воплощениями нерастворимые в воде и кишечнорастворимые полимеры могут присутствовать в весовом отношении от приблизительно 9:1 до приблизительно 1:4, более конкретно, от приблизительно 3:1 до 1:1, и толщина мембраны может меняться от приблизительно 5% до 60%, более конкретно, от приблизительно 15% до 50% по весу в соответствии с конкретными воплощениями.
Функциональные полимерные системы, наносимые из водных композиций или композиций на основе растворителя, обычно содержат пластификаторы в соответствующих концентрациях. Законченная дозированная форма может быть капсулой с модифицированным высвобождением (МВ; MR), стандартной (общепринятой) таблеткой или распадающейся во рту таблеткой (PPT), содержащей совокупность покрытых сферических гранул, содержащих активное вещество, одну или комбинацию из двух или более совокупностей покрытых гранул для получения целевых концентраций в плазме, пригодных для режима дозирования с одним приемом в сутки. Например, форма дозирования с введением один раз в сутки активного вещества с полупериодом выведения, равным приблизительно 7 часам, может содержать смесь совокупности гранул БВ, которые дают возможность быстрого высвобождения, второй совокупности гранул СПВ с более коротким временем задержки (приблизительно 3-4 часа), которые дают возможность отсроченного быстрого высвобождения, и третьей совокупности гранул СПВ с более длинным временем задержки (приблизительно 7-8 часов), которая дает возможность графика отсроченного, замедленного высвобождения в течение приблизительно 8-12 часов с сохранением приемлемых концентраций в плазме через 24 часа с повышением, таким образом, безопасности, терапевтической эффективности и согласия пациента, со снижением в то же время стоимости лечения. Альтернативно, конечная дозированная форма может содержать совокупность гранул БВ и вторую совокупность гранул СПВ с временем задержки, равным приблизительно 7-8 часам с последующим графиком замедленного высвобождения в течение 10-12 часов. Достигаемое время задержки зависит от композиции и толщины изолирующего покрытия, а также композиции и толщины покрытия, обеспечивающего время задержки. Специфические факторы, которые могут влиять на получение оптимальных дозированных форм для однократного приема в сутки включают, но не ограничиваются этим, рКа терапевтических средств (и их растворимость при pH выше 6,0), полупериод выведения и повышение растворимости в водном растворе органической кислоты, выбранной из группы, состоящей из аспарагиновой кислоты, лимонной кислоты, фумаровой кислоты, яблочной кислоты, щавелевой кислоты, янтарной кислоты, виннокаменной кислоты и тому подобного.
В соответствии с некоторыми воплощениями данного изобретения представлен также способ производства композиции из множества частиц, включающий слабо щелочной содержащий азот (N) селективный 5-HT3 серотониновый блокатор/ имеющее рКа в интервале от приблизительно 5 до 14, и растворимость не более 200 мкг/мл при pH 6,8. Данный способ может включать стадии:
a) получения частиц ядер (кристаллы с распределением частиц по размеру 20-500 мкм, более конкретно, 100-300 мкм, гранулы и лепешки) из одной или более из фармацевтически приемлемых органических кислот;
b) нанесения на эти содержащие кислоту ядра покрытия из нерастворимого в воде полимера или нерастворимого в воде полимера в комбинации с водорастворимым или кишечнорастворимым полимером с привесом от приблизительно 3% до 50%, чтобы запрограммировать высвобождение кислоты;
с) наслаивание слабощелочного содержащего азот (N) селективного 5-HT3 серотонинового блокатора из связывающего раствора полимера и нанесения защитного герметичного покрытия на гранулы со слоем лекарственного вещества с получением гранул БВ;
а) нанесения изолирующего (с замедленным высвобождением) покрытия из нерастворимого в воде полимера или нерастворимого в воде полимера в сочетании с водорастворимым полимером с привесом от приблизительно 3% до 30% с получением ЗВ гранул;
e) нанесения покрытия, обеспечивающего задержку времени высвобождения (запаздывания) из комбинации нерастворимого в воде и кишечнорастворимого полимеров при весовом отношении от приблизительно 10:1 до 1:4 с привесом от приблизительно 10% до 60% от веса покрытой гранулы с получением гранул СПВ; и
f) заполнения твердых желатиновых капсул после перемешивания с фармацевтически приемлемыми вспомогательными веществами одной или более из совокупностями гранул (например, в комбинации БВ гранул, 3 В гранул и/или СПВ гранул в желаемом соотношении) или прессования их в обычные таблетки/распадающиеся во рту таблетки (PPT).
Композиция, содержащая одну или более из совокупностей гранул (например, в комбинации из совокупностей ЗВ и СПВ гранул), может проявлять следующие свойства:
а) композиция распадается при контакте со слюной в полости рта, образуя однородную легко проглатываемую суспензию (если она имеет форму PPT), или распадается через 10 минут при пероральном приеме (если она имеет форму таблетки или капсулы);
b) гранулы БВ, если их вкус замаскирован, быстро высвобождают дозу при поступлении в желудок (например, обычно более приблизительно 50%, более конкретно, более приблизительно 75%, через приблизительно 60 минут);
c) гранулы ЗВ и СПВ, высвобождающие лекарственное вещество в течение периода, составляющего от приблизительно 4 до 20 часов при синхронизации с высвобождением органической кислоты после заранее установленной (например, до 10 часов) задержки времени высвобождения после перорального введения;
а) сложный график высвобождения лекарственного вещества из композиции сходен с целевым высвобождением лекарственного вещества in vitro/графиком изменения концентрации в плазме in vivo, который приемлем для режима дозирования с приемом 1 раз в сутки.
Эти и другие воплощения, преимущества и характерные признаки данного изобретения станут ясными по представлении подробных описаний и примеров в последующих разделах.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1 иллюстрирует графики зависимости растворимости от pH (а) гидрохлорида ондансетрона, (b) карведилола, (с) дипиридамола и (d) клоназепама.
Фиг.2 представляет поперечное сечение ЗВ покрытого, содержащего кислоту ядра в соответствии с одним из аспектов данного изобретения.
Фиг.3 представляет поперечное сечение СПВ гранулы, содержащей ЗВ покрытое, содержащее кислоту ядро в соответствии с одним из конкретных аспектов данного изобретения.
Фиг.4 иллюстрирует высвобождение фумаровой кислоты из ЗВ-покрытых кристаллов кислоты из примера 1А.
Фиг.5 иллюстрирует высвобождение кислоты и гидрохлорида ондансетрона из СПВ гранул из примера 1C.
Фиг.6 представляет графики зависимости имитации концентрации в плазме от времени MR препарата гидрохлорида ондансетрона для приема один раз в сутки (1 р. в. с.) по сравнению с реально существующей 8 мг БВ таблеткой гидрохлорида ондансетрона для приема 3 раза в день (твд).
Фиг.7 представляет графики высвобождения гидрохлорида ондансетрона из гранул СПВ из примера 3.
Фиг.8 представляет графики высвобождения фумаровой кислоты и гидрохлорида ондансетрона из БВ гранул (серия # 1084-060), покрытых 60/40 ЕС-10/ПЭГ 400 при 5 и 10% из примера 3.
Фиг.9 представляет графики высвобождения гидрохлорида ондансетрона из СПВ гранул из примера 4.
Фиг.10 иллюстрирует графики высвобождения гидрохлорида ондансетрона из MR капсул, содержащих БВ и СПВ гранулы в соотношении 35/65 по весу из примера 5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все документы, процитированные здесь, в значимой части, включены сюда в виде ссылки; цитирование любого документа не должно рассматриваться как признание того, что он является прототипом в отношении данного изобретения.
В соответствии с описанием, а также в конкретных его примерах термин «слабо щелочное фармакологически активное соединение» включает основание, фармацевтически приемлемые соли, полиморфы, стереоизомеры и их смеси. Этот термин, которому дано более полное определение в следующем разделе, относится к содержащему азот (N) селективному 5-НТ3 серотониновому блокатору, имеющему рКа в интервале от приблизительно 5 до 14 и растворимость не более 200 мкг/мл при pH 6,8 и отношение оптимальной наивысшей дозы к растворимости при pH 6,8, равное не менее приблизительно 100.
В соответствии с описанием термин «быстрое высвобождение» относится к высвобождению более чем или равному приблизительно 50% (особенно, если она с замаскированным вкусом для включения в дозированную форму распадающихся во рту таблеток), предпочтительно, более приблизительно 75%, более предпочтительно, более приблизительно 90%, и в соответствии с некоторыми воплощениями более приблизительно 95% активного вещества через приблизительно 2 часа, более конкретно, через приблизительно один час после введения дозированной формы. Данный термин может также относится к высвобождению активного вещества из синхронизированной дозированной формы с дозированным высвобождением, отличающейся пульсирующим быстрым высвобождением после запланированного времени задержки. Термин «время задержки» относится к периоду времени, в который менее приблизительно 10%, более конкретно, по существу ничего из дозы (лекарственного средства) не высвобождается, и время задержки составляет от, по меньшей мере, приблизительно 2 до 10 часов, достигается путем покрытия обычно комбинацией нерастворимого в воде и кишечнорастворимого полимеров (например, этилцеллюлозой и фталатгиптомеллозой).
Если не указано иначе, все проценты и отношения рассчитаны по весу от композиции в целом.
Для получения частиц с ядрами, содержащими органическую кислоту, для нанесения слоя лекарственного вещества можно использовать водную среду или среду из фармацевтически приемлемого растворителя, а именно, содержащие кислоту гранулы путем наслаивания кислоты на инертные ядра (например, сферические гранулы из сахара) или БВ гранулы путем нанесения слоя лекарственного вещества на содержащие кислоту ядра или непосредственно на сферические частицы из сахара из соответствующего связывающего раствора полимера в аппарате с псевдоожиженным слоем. А также при нанесении покрытия на содержащие кислоту гранулы, БВ и ЗВ гранулы можно использовать водную дисперсию функциональных полимеров, которые доступны для приобретения в виде систем из дисперсий или растворителей, для растворения функциональных полимеров.
Многие активные фармацевтические ингредиенты (АФИ) являются слабо щелочными в том смысле, что эти активные вещества являются, от свободно до умеренно, растворимыми при кислых pH, но плохо растворимыми до практически нерастворимыми при нейтральных и щелочных pH. Значения их рКа находятся в интервале от приблизительно 5 до 14. Данные по зависимой от pH растворимости для типичных слабо щелочных активных веществ представлены на фиг.1. Например, растворимость дипиридамола в 0,1 N HCl (соляной кислоте) составляет приблизительно 1 мг/мл, тогда как при pH 6,8 его растворимость составляет только 30 мкг/мл. Хотя растворимость карведилола подобным же образом является зависимой от pH и изменяющейся, из фиг.1 не видно, как быстро он подвергается образованию in situ соли с буферным веществом, таким как лимонная, уксусная и соляная кислоты и, следовательно, наблюдаемая растворимость является растворимостью соли, образованной in situ.
В таблице 1 представлены данные повышения растворимости слабо щелочных активных веществ в буферах с органическими кислотами. Можно определить три отдельных группы. Активные вещества группы A, которая представлена гидрохлоридом ондансетрона, проявляет заметное повышение растворимости слабо щелочного активного вещества в буфере со следами фумаровой кислоты. Например, растворимость ондансетрона составляет приблизительно 26 мг/мл в буфере, содержащем только 0,05 мг/мл фумаровой кислоты, остается неизменной при повышении концентрации фумаровой кислоты в буфере до 5 мг/мл. В группе B, представляемой дипиридамолом, карведилолом и ламотриджином, растворимость слабо щелочных лекарств повышается с повышением концентрации кислоты. В группе C, представляемой клоназепамом, органическая кислота оказывает очень ограниченное воздействие, т.е. размер повышения растворимости обычно менее 3-кратного. Например, растворимость клоназепама находится приблизительно между 11,6 и 6,9 мкг/мл в буферах при pH 2,3 и 6,8, содержащих более высокую и более низкую концентрацию фумаровой кислоты, соответственно.
Конкретные воплощения данного изобретения будут описаны более детально со ссылкой на сопровождающие фигуры 2 и 3. На фиг.2 покрытое 3 В ядро 10, содержащее 3 В покрытие 12, нанесенное на включающее органическую кислоту ядро, содержащее слой фармацевтически приемлемой органической кислоты в связывающем веществе 14, покрывающем инертное ядро частицы 16. Инертное ядро частицы 16, слой покрытия с органической кислотой 14 и регулирующий скорость распада слой ЗВ 12 составляют в итоге ЗВ-покрытое содержащее органическую кислоту ядро 10. На фиг.3 представлен пример типичной СПВ гранулы 20. Гранула СПВ 20 содержит покрытие, обеспечивающее задержку времени высвобождения 22, нанесенное на первичный слой ЗВ 24, защитное герметичное покрытие 26 и слой слабо щелочного лекарственного вещества 28, нанесенный на ЗВ покрытое содержащее кислоту ядро 10. Слабо щелочное лекарственное вещество обычно наносят со связывающим раствором полимера. ЗВ покрытие поддерживает высвобождение лекарственного вещества, тогда как покрытие, обеспечивающее время задержки, дает задержку времени высвобождения (период времени, в который происходит менее 10%, более конкретно, по существу не происходит, высвобождения дозы). Таким образом, покрытие, обеспечивающее время задержки 22, наружное покрытие ЗВ на гранулах БВ 24 и внутреннее ЗВ покрытие 1 на содержащем кислоту ядре вместе регулируют свойства высвобождения как лекарственного вещества, так и кислот из СПВ гранул.
Новизна/практическая применимость препаратов, разработанных в соответствии с некоторыми воплощениями данного изобретения показаны с использованием гидрохлорида ондансетрона в качестве примера содержащего азот (N) селективного 5-HT3 серотонинового блокатора, имеющего рКа в интервале от приблизительно 5 до 14. Дигидрат гидрохлорида ондансетрона химически представляет собой дигидрат моногидрохлорида (±)1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1H-имидазол-1-ил)метил]-4H-карбазол-4-она. Ондансетрон показан для профилактики тошноты и рвоты, связанных с лучевой терапией и/или химиотерапией, и профилактики послеоперационной тошноты и/или рвоты. В продаже имеются таблетки зофрана® (дигидрата ондансетрона·HCl, эквивалент 4, 8 и 24 мг основания).
Данное лекарственное средство принимают по 8 мг 2 р. в д. при химиотерапии и 8 мг 3 р. в д. при лучевой терапии. Для промышленного производства желательна дозировка гидрохлорида ондансетрона для приема один раз в сутки, и она должна упростить режим дозирования и повысить согласие пациента и соблюдение им режима приема. Ондансетрон существует в виде рацемата, и он содержит α-гидроксил-вторичный амин с рКа 7,4. Ондансетрон·HCl, как известно, проявляет зависимые от pH характеристики растворимости (снижение растворимости на 2-3 порядка по амплитуде). Ондансетрон хорошо всасывается из желудочно-кишечного тракта и подвергается некоторому метаболизму при пресистемном метаболизме. Полупериод выведения составляет в среднем приблизительно 3,8±1 часа. Так как распадаемость лекарственного средства является ограничивающим скорость фактором всасывания в дистальной части ЖК тракта потенциально из-за снижения растворимости, дозированная форма для однократного приема в сутки в соответствии с одним из воплощений должна содержать, по меньшей мере, две совокупности гранул -одну совокупность гранул БВ и другую совокупность гранул СПВ, содержащие 3 В покрытые ядра с органической кислотой.
В соответствии с некоторыми воплощениями данного изобретения в его интересах используется свойство буферов с органическими кислотами повышать растворимость и в то же время предотвращается образование in situ соединений с присоединением кислоты путем наличия покрытия ЗВ мембраной между внутренним слоем органической кислоты и слоем слабо щелочного лекарственного средства. Покрытие 3 В мембраной, нанесенное таким образом точно регулирует высвобождение органической кислоты так, чтобы гарантировать то, что после в дозированной форме не остается лекарственного средства для отсутствия солюбилизации кислотой в СПВ грануле. В одном из воплощений активное ядро дозированной формы данного изобретения может содержать инертную частицу, покрытую органической кислотой, с ЗВ покрытием, слоем лекарственного вещества (БВ гранулы), с дополнительным изолирующим покрытием или ЗВ покрытием и/или обеспечивающим время задержки покрытием. Количество органической кислоты и содержание лекарственного вещества в ядре будет зависеть от лекарственного вещества, дозы, его зависимой от pH растворимости, повышения растворимости и полупериода выведения. Специалисты в данной области будут способны выбрать соответствующее количество лекарственного средства/кислоты для нанесения покрытия на ядро для достижения желаемого режима дозирования с введением OPC (OD) один раз в сутки. В одном из воплощений инертная частица может быть сферической частицей из сахара, сферической частицей из целлюлозы, сферической частицей из двуокиси кремния и тому подобным. Альтернативно, в качестве ядер могут функционировать кристаллы органической кислоты с желаемым распределением частиц по размеру, особенно для лекарственных средств группы C, и в этом случае эти кристаллы являются покрытыми мембраной для программирования высвобождения кислоты, которое, в соответствии с некоторыми воплощениями, синхронизируется с высвобождением лекарственного вещества, чтобы гарантировать полное высвобождение лекарственного вещества до исчерпания кислоты.
В соответствии с одним из аспектов данного изобретения ядро дозированной формы может содержать кристалл органической кислоты (например, фумаровой кислоты) с желаемым средним размером частицы или инертную частицу, такую как сферическая частица из сахара со слоем органической кислоты, нанесенным с помощью раствора в связывающем полимере. Кристаллы органической кислоты или содержащие кислоту ядра покрывают нерастворимым в воде полимером, одним или в сочетании с водорастворимым или кишечнорастворимым полимером, и композицию и толщину ЗВ мембраны оптимизируют так, что высвобождение кислоты происходит медленнее растворения/высвобождения лекарственного вещества из гранулы или синхронизируется с ними, гарантируя то, что высвобождение кислоты не завершается до окончания высвобождения лекарственного вещества. В некоторых аспектах данного изобретения содержащие кислоту ядра могут находиться в форме микрогранул или лепешек, которые можно получить с помощью роторной грануляции, грануляции с высоким усилием сдвига и экструзии-сферонизации или прессования (в виде микротаблеток диаметром приблизительно 1-1,5 мм) из органической кислоты, полимерного связывающего вещества и, необязательно, наполнителей/разбавителей.
Слабощелочное активное вещество, такое как дигидрат гидрохлорида ондансетрона, наслаивают на покрытые ЗВ содержащие фумаровую кислоту гранулы из раствора полимерного связывающего вещества (например, повидона) и наносят защитное герметичное покрытие, содержащее гидрофильный полимер, такой как Pharmacoat 603 (гипромеллоза 2910, 3 спз) или Opadry® Clear с образованием БВ гранул. В одном из воплощений содержащие лекарственное вещество гранулы БВ могут быть покрыты дважды - мембраной внутреннего изолирующего покрытия нерастворимым в воде полимером (например, этилцеллюлозой), одним или в сочетании с водорастворимым полимером и мембраной обеспечивающей задержку времени высвобождения или водонерастворимый полимер в сочетании с кишечнорастворимым полимером с получением СПВ гранул с временем задержки высвобождения (высвобождение с запаздывающим началом), равной приблизительно от 1 часа до 10 часов после перорального приема. Нерастворимый в воде полимер и кишечнорастворимый полимер могут присутствовать в весовом отношении от приблизительно 9:1 до приблизительно 1:4, предпочтительно, в весовом отношении от приблизительно 3:1 до приблизительно 1:1. Покрывающая мембрана обычно составляет от приблизительно 5% до приблизительно 60%, предпочтительно, от приблизительно 10% до приблизительно 50% по весу от покрытых гранул. В соответствии с еще одним воплощением гранулы БВ могут быть просто покрыты комбинацией нерастворимого в воде полимера и кишечнорастворимого полимера в приведенных выше количествах.
Дозированная форма в виде капсулы или обычной таблетки на один прием в соответствии с данным изобретением может содержать только СПВ гранулы или их сочетание с БВ гранулами, тогда как элемент PPT может содержать только СПВ гранулы или в сочетании с гранулами для быстрого высвобождения (БВ). БВ гранулы, не имеющие маскирующей вкус мембраны, будут давать быстрое высвобождение слабо щелочного лекарственного вещества в желудочно-кишечном тракте в пределах приблизительно 60 минут, предпочтительно, в пределах 30 минут после перорального введения. Если их вкус замаскирован, эти гранулы проявляют маскирующее вкус свойство в защечной полости и по существу полное высвобождение слабо щелочного лекарственного вещества в желудочно-кишечном тракте в пределах 2 часов, предпочтительно в пределах одного часа после перорального приема. СПВ гранулы будут высвобождать слабо щелочное лекарственное вещество в желудочно-кишечном тракте в течение периода до приблизительно 4-20 после задержки времени, равной приблизительно 1-10 часам после перорального приема.
В соответствии с конкретными аспектами данного изобретения дозированная форма, состоящая из множества частиц, может содержать, по меньшей мере, совокупность гранул БВ, первой совокупности гранул СПВ и совокупности гранул ЗВ или второй совокупности гранул СПВ. В некоторых воплощениях отношение совокупности гранул БВ к первой совокупности гранул СПВ, к гранулам ЗВ или второй совокупности гранул СПВ могут варьировать от приблизительно 10:90:0 до приблизительно 40:10:50.
Данное изобретение представляет также способ производства фармацевтически превосходной дозированной формы, состоящей из множества частиц, имеющей одну или более из совокупностей синхронизированных, с пульсирующим высвобождением гранул одного или более из слабо щелочных активных веществ, содержащих покрытые ЗВ включающие органическую кислоту ядра, т.е. с хорошо отрегулированными по времени сериями импульсов высвобождения, так что активные вещества и кислота, которые расположены в хорошо разделенных/изолированных слоях для того, чтобы они не вступали в контакт друг с другом с образованием соединений с присоединением кислоты до тех пор, пока дозированная форма не придет в контакт со средой для распада или жидкостями тела после перорального приема. Дозированная форма, получаемая таким образом, проявляет сложные графики высвобождения активного вещества и кислоты, которые сравнимы, более конкретно, график высвобождения кислоты, чем высвобождение лекарственного вещества, так что нерастворенного лекарственного вещества не остается после в дозированной форме из-за отсутствия солюбилизирующей органической кислоты.
В соответствии с одним из воплощений данного изобретения данный способ может включать стадии:
a) получения содержащих органическую кислоту частиц (например, кристаллов органической кислоты с желаемым распределением частиц по размеру или частиц, содержащих инертную частицу (например, шарик из сахара, целлюлозный шарик, шарик из двуокиси кремния), покрытую слоем органической кислоты из полимерного связывающего раствора);
b) нанесения покрытия на содержащее органическую кислоту ядро частицы в виде покрывающей ЗВ мембраны, состоящей из нерастворимого в воде полимера, такого как ЕС-10 (этилцеллюлоза со средней вязкостью 10 спз), одного или в комбинации с водорастворимым полимером (например, повидоном или ПЭГ 400) или кишечнорастворимым полимером, таким как фталатгидроксипропилцеллюлоза (например, HP-55);
c) нанесения слоя слабо щелочного лекарственного вещества, такого как дигидрат гидрохлорида ондансетрона на покрытые 3 В частицы с содержащим органическую кислоту ядром и, кроме того, нанесение защитного герметичного покрытия из Pharmacoat 603 или Opadry® Clear с образованием БВ гранул;
d) нанесение мембраны изолирующего покрытия на БВ гранулы из раствора нерастворимого в воде полимера (например, этилцеллюлозы), одного или в комбинации с водорастворимым полимером (например, полиэтиленгликолем, ПЭГ 400) с получением ЗВ гранул;
e) нанесения мембраны покрытия, обеспечивающего время задержки, на ЗВ гранулы с помощью раствора нерастворимого в воде полимера в комбинации с кишечнорастворимым полимером (например, этилцеллюлозой и фталатгипромеллозой) в соотношении приблизительно от 10:1 до 1:4 с образованием синхронизированных гранул с пульсирующим высвобождением лекарственного средства (СПВ).
В соответствии с некоторыми воплощениями данного изобретения данный способ включает стадии:
i) маскировки вкуса ЗВ гранул путем коацервации в растворителе с помощью нерастворимого в воде полимера (например, этилцеллюлозы со средней вязкостью 100 спз), одного или в комбинации с растворимым в желудке образующем поры веществом (например, карбонатом кальция) в соответствии с описанием в находящейся на одновременном рассмотрении патентной заявке США сер. №11/213266, зарегистрированной 26 августа 2005 г. (публикация №U.S. 2006/0105038, опубликованная 18 мая 2006) или путем нанесения покрытия из нерастворимого в воде полимера (например, этилцеллюлозы со средней вязкостью 10 спз), одного или в комбинации с растворимым в желудке полимером (например, Eudragit E100 или ЕРО) в псевдоожиженном слое в соответствии с описанием в находящейся на одновременном рассмотрении патентной заявке США сер. №11/248596, зарегистрированной 12 октября 2005 г. (публикация №U.S. 2006/0078614, опубликованная 13 апреля 2006) или растворимым в желудке образующим поры веществом (например, карбонатом кальция) в соответствии с описанием в находящейся на одновременном рассмотрении патентной заявке США сер. №11/256653, зарегистрированной 21 октября 2005 г. (публикация № U.S. 2006/0105039, опубликованная 18 мая 2006), содержание данных заявок, представленных в этом абзаце, включено сюда в виде ссылки;
ii) гранулирования порошковой смеси спирта-сахара, такого как маннит, или сахарида, такого как лактоза и кросповидон, например, с использованием описания в находящейся на одновременном рассмотрении патентной заявке США сер. №10/827106, зарегистрированной 19 апреля 2004 г (публикация № U.S. 2005/0232988, опубликованная 20 октября 2005 г.), содержание которой тем самым включено сюда в виде ссылки, для получения быстро диспергируемых микрогранул;
iii) смешивания одной или более из совокупностей СПВ гранул со стадии (е) одних или в комбинации с БВ гранулами с замаскированным вкусом со стадии (i) и/или ЗВ гранул со стадии (а) в желаемом соотношении с получением желаемого графика концентраций в плазме при однократном приеме в сутки, быстро диспергируемых микрогранул со стадии (ii) и других фармацевтически приемлемых вспомогательных веществ; и
iv) прессования смеси со стадии (iii) в распадающиеся во рту таблетки, содержащие необходимую дозу одного или более из слабощелочных лекарственных веществ, которые должны быстро распадаться при контакте со слюной в защечной полости, образующие однородную легко проглатываемую суспензию и дающие график концентраций в плазме, подходящий для режима дозирования один раз в сутки со сниженным числом случаев побочных явлений, включая несоблюдение режима.
Для получения частиц ядер на основе покрытых инертных частиц можно использовать водную среду и среду из фармацевтически приемлемого растворителя. Тип инертного связывающего вещества, который используют для связывания водорастворимой органической кислоты или слабо щелочного лекарственного вещества с инертной частицей или с покрытым ЗВ содержащим кислоту ядром не является важным, но обычно представляет водорастворимые или растворимые в спирте связывающие вещества, такие как поливинилпирролидон (ПВП или повидон), или гидроксипропилцеллюлозу. Связывающее вещество можно использовать в любой концентрации, которую можно нанести на инертную частицу. Обычно связывающее вещество используют в концентрации от приблизительно 0,5 до 10% по весу. Органическая кислота или слабо щелочное лекарственное вещество предпочтительно может присутствовать в этой композиции для покрытия в форме раствора. Концентрация лекарственного вещества может меняться в зависимости от применения, но обычно будет использоваться в концентрациях от приблизительно 5 до 30% по весу в зависимости от вязкости композиции для покрытия.
В соответствии с другими воплощениями содержащие органическую кислоту ядра могут быть получены путем центробежной грануляции или путем грануляции с последующей экструзией-сферонизацией или таблетирования в микротаблетки. Органическая кислота, связывающее вещество и, необязательно, другие фармацевтически приемлемые вспомогательные вещества (например, разбавители/наполнители) могут быть смешаны друг с другом в грануляторе с высоким усилием сдвига или в грануляторе с псевдоожиженным слоем, таком как гранулятор Glatt GPCG и гранулированы с образованием агломератов. Влажную массу можно экструдировать и сферонизировать с получением сферических частиц (лепешек). Смесь, содержащую частицы кислоты, связывающее вещество и, необязательно, наполнитель/разбавитель или содержащие лекарственное вещество гранулы, можно также прессовать в микротаблетки (диаметром 1-1,5 мм) с получением лепешечек, содержащих органическую кислоту. При этих воплощениях содержание кислоты могло быть таким высоким, как 95% по весу от веса гранулированных, экструдированных и прессованных ядер в целом. Эти содержащие кислоту ядра покрывают ЗВ мембрану перед нанесением слоя лекарственного вещества и последующим нанесением покрытия с функциональными полимерами.
Отдельные полимерные покрытия на содержащих кислоту ядрах и БВ гранулы будут варьировать приблизительно от 5 до 50% по весу в зависимости от относительной растворимости органической кислоты к активному веществу, природы активного вещества, композиции изолирующего покрытия и необходимого времени задержки. В одном из воплощений ядра из кислоты могут быть снабжены изолирующим покрытием из пластифицированного нерастворимого в воде полимера, такого как этилцеллюлоза (ЕС-10) с приблизительно 5-50% по весу с поддержанием высвобождения кислоты в течение приблизительно 5-20 часов. В некоторых других воплощениях ядра из кислоты могут быть снабжены изолирующим покрытием из пластифицированной этилцеллюлозы и фталатгидроксипропилметилцеллюлозы (HP-55) (гипромеллозы) с приблизительно 10-50% по весу, тогда как БВ гранулы покрывают этилцеллюлозой (EC-10) с 5-20% по весу для достижения высвобождения лекарственного вещества, синхронизированного с высвобождением кислоты. В еще одном воплощении данного изобретения БВ гранулы не могут быть снабжены изолирующим покрытием, и наружное покрытие обеспечивающее время задержки из EC-10/НР-55/пластификатора при соотношении приблизительно 45,5/40/14,5 с привесом приблизительно 30-50% по весу регулирует высвобождение лекарственного средства после времени задержки. Композиция слоя мембраны и индивидуальный вес полимеров являются важными факторами, которые нужно учитывать для достижения желаемого графика высвобождения лекарственного средства/кислоты и времени задержки до заметного высвобождения лекарственного вещества.
Графики высвобождения лекарственного средства/кислоты из БВ гранул, покрытых изолирующей оболочкой/ЗВ гранул и СПВ гранул могут быть определены следующим методом:
Определение растворимости БВ гранул, с замаскированным вкусом или нет, проводят с помощью аппарата 1 (барабаны при 100 об/мин) или аппарата 2 (лопасти при 50 об/мин) в 900 мл 0,1N HCl при 37°C, тогда как испытание распадаемости ЗВ гранул и СПВ гранул проводят в аппарате по USP с использованием двухэтапной среды для распада (первая 2 часа в 700 мл 0,1N HCl при 37°C с последующим испытанием распадаемости при pH 6,8, получаемым путем добавления 200 мл модификатора pH). Высвобождение лекарственного средства/кислоты со временем определяют с помощью ВЭЖХ по образцам, взятым через выбранные интервалы.
Существуют примеры, когда начало высвобождения лекарственного вещества должно начинаться через несколько часов после перорального приема для получения адекватной концентрации в плазме, которая подходит для режима дозирования один раз в сутки, зависящего от полупериода выведения активного вещества. В соответствии с конкретными аспектами данного изобретения высвобождение лекарственного вещества может быть задержано на приблизительно 8-10 часов после перорального введения.
В соответствии с некоторыми воплощениями данного изобретения представлен одноцелевой график поддерживаемого высвобождения в течение нескольких часов после перорального введения с импульсом быстрого высвобождения или без него.
Водную или из фармацевтически приемлемого растворителя среду можно использовать для получения содержащих ядро из органической кислоты частиц или содержащих лекарственное вещество БВ гранул путем нанесения слоя лекарственного вещества на инертные ядра, такие как сферические частицы из сахара, или на покрытые ЗВ содержащие кислоту ядра. Тип инертного связывающего вещества, которое используют для связывания водорастворимой органической кислоты с инертной частицей или слабо щелочным лекарственным средством на покрытых ЗВ ядрах из кислоты не является определяющим моментом, но обычно используют водорастворимые или растворимые в спирте и/или ацетоне связывающие вещества. Типичные примеры связывающих веществ включают, но не ограничиваются этим, поливинилпирролидон (ПВП), гидроксипропилметилцеллюлозу (ГПМЦ), гидроксипропилцеллюлозу, карбоксиалкилцеллюлозы, полиэтиленоксид, полисахариды, такие как декстран, картофельный крахмал, который может Сыть растворен или диспергирован в воде, спирте, ацетоне или их смесях. Связывающие вещества обычно используют в концентрации от приблизительно 0,5 до 10% по весу.
Типичные инертные частицы, используемые для наслаивания кислоты или фармакологически активного вещества включают сферические частицы из сахара, целлюлозы и двуокиси кремния с подходящим распределением частиц по размеру (например, сферические частицы из сахара 20-25 меш для изготовления покрытых гранул для включения в препарат в капсулах и сферические частицы из сахара 60-80 меш для изготовления покрытых гранул для включения в препарат PPT).
Типичные фармацевтически приемлемые органические кислоты, которые повышают растворимость фармакологически активного вещества, включают лимонную кислоту, фумаровую кислоту, яблочную кислоту, малеиновую кислоту, виннокаменную кислоту, янтарную кислоту, щавелевую кислоту, аспарагиновую кислоту, глюгаминовую кислоту и тому подобное. Отношение органической кислоты к фармакологически активному веществу варьирует от 5:1 до 1:10 по весу.
Типичные примеры водонерастворимых полимеров, пригодных при данном изобретении, включают этилцеллюлозу, поливинилацетат (например, Kollicoat SR#30D от BASF), ацетилцеллюлозу, ацетобутиратцеллюлозу, нейтральные сополимеры на основе этилакрилата и метилметакрилата, сополимеров сложных эфиров акриловой и метакриловой кислоты с четвертичными аммониевыми группами, такие как Eudragit NE, RS и RS30D, RL или RL30D и тому подобное. Типичные примеры водорастворимых полимеров, применимых в данном изобретении, включают поливинилпирролидон (ПВП), гидроксипропилметилцеллюлозу (ГПМЦ), гидроксипропилцеллюлозу (ГПЦ), полиэтиленгликоль и тому подобное.
Типичные примеры кишечнорастворимых полимеров, применимых в данном изобретении включают сложные эфиры целлюлозы и их производные (фталатацетилцеллюлозу, фталат гидроксипропилметилцеллюлозы, ацетосукцинат гидроксипропилметилцеллюлозы), поливинилацетофталат, чувствительные к pH сополимеры метакриловой кислоты-метаметакрилата и шеллак. Эти полимеры можно использовать в виде сухого порошка или водной дисперсии. Некоторые доступные для приобретения материалы, которые можно использовать, представлены сополимерами метакриловой кислоты, продаваемыми под торговым названием Eudragit (L100, S100, L30D), производимыми Rohm Pharma, целлацефат (Cellacefate; ацетофталатцеллюлоза) от Eastman Chemical Co., акватерик (Aquateric; водная дисперсия ацетофталатцеллюлоза) от FMC Corp. и акоат (Aqoat; водная дисперсия ацетосукцината гидроксипропилметилцеллюлозы) от Shin Etsu K.K.
Кишечнорастворимые, нерастворимые в воде и водорастворимые полимеры, используемые при формировании мембран обычно пластифицированы. Типичные примеры пластификаторов, которые можно использовать для пластификации мембран, включают триацетин, трибутилцитрат, триэтилцитрат, ацетил-три-н-бутилцитрат, диэтилфталат, касторовое масло, дибутилсебакат, ацетилированные моноглицериды и тому подобное или их смеси. Пластификатор, при использовании, может содержать приблизительно от 3 до 30 масс%, и более типично, приблизительно 10-25 масс% от веса полимера. Тип пластификатора и его содержание зависит от полимера или полимеров и природы системы покрытия (например, на водной основе или на основе растворителя, на основе раствора или дисперсии и твердые вещества в целом).
В основном желательно подготавливать поверхность частиц для нанесения слоя лекарственного вещества перед нанесением покрытий изолирующих мембран или для разделения разных слоев мембран путем нанесения тонкой пленки гидроксипропилметилцеллюлозы (ГПМЦ) (например, Pharmacoat 603 или Opadry® Clear). Тогда как обычно используют ГПМЦ, можно также применять другие примеры, такие как гидроксипропилцеллюлоза (ГПЦ) или этилцеллюлоза с низкой вязкостью.
Активные фармацевтические ингредиенты, пригодные для включения в эти системы с пульсирующим высвобождением, регулируемым по времени, включают слабо щелочные активные фармацевтические ингредиенты, их производные или соли, проявляющие рКа в интервале от приблизительно 5 до 14, растворимость не более приблизительно 200 мкг/мл при pH 6,8 и отношение оптимальной высшей дозы к растворимости при pH 6,8, равное, по меньшей мере, приблизительно 100. Данное лекарственное вещество может быть выбрано из группы 5-HT3 селективных блокаторов, имеющих рКа в интервале от 5 до 14.
Типичным примером является ондансетрон или его гидрохлоридная соль с доказанной фармакологической активностью у людей.
Мембранные покрытия могут быть нанесены на ядро с использованием любой из методик нанесения покрытия, используемых в фармацевтической промышленности, но особенно применимо нанесение покрытия в псевдоожиженном слое. Данное изобретение относится к многодозовым формам, т.е. лекарственным продуктам в форме дозированных форм, состоящих из множества частиц (твердых желатиновых капсул, обычных таблеток или PPT (распадающихся в ротовой полости таблеток)), включающих использование роторного таблеточного прессование одной или более из совокупностей гранул для перорального приема с получением целевых ФК графиков у пациентов, нуждающихся в лечении. Обычные таблетки быстро диспергируются при поступлении в желудок, тогда как PPT быстро распадаются при контакте со слюной в полости рта с образованием однородной суспензии покрытых гранул для легкого проглатывания. Одну или более из совокупностей покрытых гранул можно прессовать вместе с соответствующими вспомогательными веществами в таблетки (например, связывающим веществом, разбавителем/наполнителем и дезинтегрантом для обычных таблеток, тогда как в PPT быстро диспергируемый гранулят может заменять комбинацию связывающего вещества-разбавителя/наполнителя). Кроме того, прессование в PPT может быть выполнено с использованием таблеточного пресса, оборудованного наружной смазочной системой для смазывания пуансонов и матриц перед прессованием.
Следующие неограничивающие примеры иллюстрируют дозированные формы для доставки лекарственных веществ в виде капсул, обычных таблеток или распадающихся в ротовой полости таблеток, дающих один или более импульсов высвобождения/ каждый с предназначенной задержкой начала, и характеристики полного высвобождения лекарственного вещества in vitro или получением в результате графика концентраций в плазме in vivo после перорального введения дозированной формы должны имитировать желаемый график для достижения максимальной терапевтической эффективности, для повышения согласия пациента и соблюдения им режима, и качества жизни. Такие дозированные формы, при введении в «правильное время» или как рекомендовано врачом, должны сделать возможным поддержание концентраций лекарственного вещества в плазме на уровне потенциально благоприятных для минимизации появления побочных эффектов, связанных с Cmax или Cmin.
Пример 1:
A. Покрытые ЗВ кристаллы фумаровой кислоты
Кристаллы фумаровой кислоты 40-80 меш (3750 г) загружали в аппарат для нанесения покрытия в псевдоожиженном слое, Glatt GPCG 5, оборудованном донной вставкой для распыления 9" Wurster, колонкой длиной 10" и 16 мм трубопроводом. Эти кристаллы кислоты покрывали раствором (с 6% твердых веществ) 250 г этилцеллюлозы (Ethocel Premium 10 спз) и 166,7 полиэтиленгликоля (ПЭГ 400) при соотношении 60/40, растворенных в ацетоне/воде 98/2 (6528,3 г) с привесом до 10% по весу. Условия процесса были следующими: давление воздуха для распыления: 2,0 бар; диаметр сопла: 1,00 мм; донная плита распределителя: В с решеткой 15 калибра 100 меш; интервалы распыления/встряхивания: 30 сек/3 сек; поддерживаемая температура продукта 35±1°С; объем воздуха на входе: 155-175 кубических футов в минуту (фт3/мин) и скорость распыления повышали от приблизительно 8 до 30 г/мин.
Кристаллы фумаровой кислоты покрывали так же, как описано выше, с использованием этилцеллюлозы и ПЭГ в разном соотношении. Более конкретно, кристаллы кислоты покрывали раствором EC-10 (Ethocel Premium 10 спз)/ПЭГ 400 в соотношении или 75/25 или 67,5/32,5 с привесом до 10% по весу в каждом случае. На фиг.4 показаны графики высвобождения фумаровой кислоты из покрытых 3 В кристаллов фумаровой кислоты, покрытых EC-10/ПЭГ в разных соотношениях.
B. БВ гранулы гидрохлорида ондансетрона, содержащие 3 В покрытые кристаллы фумаровой кислоты
Повидон (PVP K-29/32; 23 г) медленно добавляли к смеси воды/денатурированного спирта 3С 50/50, крепостью 190 (3699,4 г) при перемешивании для растворения. К связывающему раствору медленно добавляли дигидрат гидрохлорида ондансетрона (197,2 г), чтобы лекарственное вещество растворилось. Покрытые ЗВ кристаллы фумаровой кислоты (3000 г), полученные, как указано выше, покрывали в Glatt GPCG 5 раствором лекарственного вещества (5% твердых веществ) при сохранении температуры продукта на уровне 40±1°С; и объемом подаваемого воздуха 180-195 кфм и скоростью распыления, которую повышали от приблизительно 8 до 15 г/мин. Гранулы с наслоенным лекарственным веществом обеспечивали защитным герметичным покрытием из Opadry Clear (гипромеллоза 2910; 3 спз) (2% привеса) с образованием гранул с БВ.
C. СПВ гранулы гидрохлорида ондансетрона, содержащие покрытые 3 В кристаллы фумаровой кислоты НМ гранулы гидрохлорида ондансетрона (2800 г) из представленного выше, покрывали распылением раствора EC-10/ГПМЦП (HP-55)/ТЭЦ (триэтилцитрата) в ацетоне/воде 98/2 (6% твердых веществ) при соотношении 45,5/40/14,5 с привесом до 50% и сушили в Glatt в течение приблизительно 10 минут при 60°C для удаления избытка остаточного растворителя. Высушенные гранулы просеивали для отбрасывания любых сдвоенных форм.
Фиг.5 представляет графики высвобождения как фумаровой кислоты, так и ондансетрона из СПВ гранул, содержащих покрытые ЗВ кристаллы кислоты. Более конкретно, гранулы СПВ представленные на фиг.5, включают БВ гранулы (6% наслоенного лекарственного вещества из ондансетрона/ПВП 90/10), содержащих кристаллы фумаровой кислоты, покрытые EC-10/ПЭГ 400 при соотношении 67,5/32,5 при 10%, покрытые EC-10/ГПМЦП (HP-55)/ТЭЦ при соотношении 45,5/40/14,5 с привесом до 50% по массе. Хотя высвобождение лекарственного вещества происходит значительно быстрее, чем высвобождение кислоты, для специалиста в данной области очевидно, что путем снижения толщины изолирующего покрытия (ЗВ покрытия) на кристаллах фумаровой кислоты и дополнительного нанесения изолирующего покрытия (ЗВ покрытия) под СПВ покрытием для поддержания высвобождения лекарственного средства графики высвобождения как для ондансетрона, так и для фумаровой кислоты могут быть синхронизированы.
Пример 2:
Чтобы оценить тип графика высвобождения, необходимый для достижения графика концентрации в плазме для однократного введения в сутки, in vitro, выполняли моделирующее осуществление с использованием фармакокинетических параметров для гидрохлорида ондансетрона, представленных в «Ondansetron Absorption in Adults: Effect of Dosage Form, Food and Antacids» в Journal of Pharmaceutical Sciences Vol.(1994) by Bozigian et al. Использовали средние концентрации в плазме, достигнутые у 24 здоровых взрослых мужчин-добровольцев, которые получали одну 8 мг БВ таблетку гидрохлорида ондансетрона натощак, применяя программное обеспечение WinNonlin™, стандартная версия 2.1, чтобы привести в соответствие этому 1-компонентную первого порядка модель с задержкой времени высвобождения, принимая кинетику выведения первого порядка. Были получены следующие параметры:
Первичный параметр; F=1,0 (принято); Vd=238,26; Ka=1,49 в час (ч); Ke=0,19 в час (отсюда t1/2=3,65 час); Тзад=0,41 час. Вторичные параметры: ППК=0,17 мг·час/л; Cl=46,06 л/час; Тмах=1,98 час; Cm=0,0248 мг/л. Эти показатели близко соответствовали значениям, представленным в приведенном выше источнике, а также в PDR (справочник для врачей).
Первичные параметры были затем введены в другое программное обеспечение, Stella Version 6/01, используя ранее принятую модель с небольшими модификациями. Были получены разные графики высвобождения in vitro, и по целевым графикам высвобождения для одного приема в сутки, желаемые графики высвобождения in vitro (средний, целевой и быстрый) были получены путем деконволюции. Эти имитированные графики концентраций в плазме представлены на фиг.6.
Пример 3:
A. Ядра, содержащие фумаровую кислоту
Гидроксипропилцеллюлозу (Klucel LF, 23,9 г) медленно добавляли к денатурированному SD 3С 190 крепости спирту при 4% твердых веществ при энергичном перемешивании для растворения, а затем медленно добавляли фумаровую кислоту (215,4 г) до растворения. В Glatt GPCG 5 оборудованный донной вставкой для распыления 9" Wurster, разделительной колонкой 10" и 16 мм трубопроводом, загружали 3750 г сферических сахарных частиц 25-30 меш. На сахарные сферические частицы наносили слой с помощью раствора фумаровой кислоты, поддерживая в то же время температуру продукта на уровне приблизительно 33-34°C и скорость воздуха на входе при открытии клапана на 38%. Ядра из кислоты сушили в установке в течение 10 минут для удаления остаточного растворителя/влаги и просеивали через сито 20-30 меш.
B. ЗВ-покрытые ядра из фумаровой кислоты
Ядра из фумаровой кислоты (3750 г) из представленного выше, покрывали раствором EC-10 и ПЭГ-400, растворенных в ацетоне/воде 98/2 (6% твердых веществ) с привесом 10% по массе в двух соотношениях (B.1) 60/40 и (В.2) 75/25, чтобы оценить их действие на высвобождение лекарственного вещества из гранул ЗВ и СПВ.
C. БВ гранулы гидрохлорида ондансетрона, содержащие покрытые ЗВ ядра из кислоты.
Повидон (PVP K-29/32, 19,5 г) медленно добавляли к воде/денатурированному спирту 3С 50/50, 190 крепости (3699,4 г) при перемешивании для растворения. Дигидрат гидрохлорида ондансетрона (175,2 г) медленно добавляли к связывающему раствору до растворения лекарственного вещества. Покрытые ЗВ ядра из кислоты (3700 г), полученные из B.1 и В.2, выше, покрывали в Glatt GPCG 5 раствором лекарственного вещества (5% твердых веществ).
D. ЗВ гранулы гидрохлорида ондансетрона
БВ гранулы гидрохлорида ондансетрона (3700 г) из представленного выше, покрывали изолирующим покрытием (ЗВ покрытие) путем распыления раствора (7,5% твердых веществ) ЕС/-10/ТЭЦ (триэтилцитрата) 90/10 при 5 и 10% по весу и сушили в Glatt в течение 10 минут для удаления избытка остаточного растворителя. Высушенные гранулы просеивали для отбрасывания любых сдвоенных частиц, если они образовались.
E. СПВ гранулы гидрохлорида ондансетрона
ЗВ гранулы гидрохлорида ондансетрона (3500 г) из примера 3D дополнительно покрывали мембраной для задержки времени высвобождения из ЕС-10/НР-55/ТЭЦ (триэтилцитрата) в соотношении 45,5/40,0/14,5 с привесом приблизительно 30%, 40% и 50%. СПВ гранулы сушили в Glatt при той же температуре для удаления остаточного растворителя и просеивали.
На фиг.7 показаны графики высвобождения лекарственного вещества гидрохлорида ондансетрона из СПВ гранул (партия # 1084-066), содержащих ядра, включающие фумаровую кислоту, покрытые ЕС-10/ПЭГ 400 60/40 и СПВ гранул (партия # 1084-082), содержащих ядра, включающие фумаровую кислоту, покрытые ЕС-10/ПЭГ 400 75/25.
На фиг.8 представлены графики синхронизированного высвобождения, получаемые для фумаровой кислоты и ондансетрона, из ЗВ гранул (серия # 1084-060 - БВ гранулы, покрытые ЕС-10/ПЭГ 400 60/40 при 5 и 10% по весу по включающим фумаровую кислоту ядрам, покрытым ЕС-10/ПЭГ 400 75/25 при 10%).
Пример 4:
A. Ядра, содержащие фумаровую кислоту
Ядра, содержащие фумаровую кислоту, получали по методике, описанной в примере 3А, за исключением того, что использовали денатурированный спирт (SD 3С, 190 крепости)/воду 90/10 вместо только спирта.
B. Покрытые ЗВ ядра, содержащие фумаровую кислоту
Ядра из фумаровой кислоты (3750 г) из представленного выше покрывали раствором ЕС-10 и или ПЭГ 400 (B.1) в соотношении 60/40 или ТЭЦ (B.2) в соотношении 90/10 в качестве пластификатора, растворенных в ацетоне/воде 98/2 (6% твердых веществ) с привесом 10%.
C. БВ гранулы гидрохлорида ондансетрона
БВ гранулы гидрохлорида ондансетрона из B.1 и B.2, выше, были получены, как описано в примере 3 С. Гранулы с наслоенным лекарственным веществом получали с защитным герметичным покрытием Pharmacoat 603 (гипромеллоза 2910; 3 спз) с привесом 2%.
D. ЗВ гранулы гидрохлорида ондансетрона
БВ гранулы гидрохлорида ондансетрона (1080 г) покрывали изолирующим слоем (3 В покрытые) путем распыления раствора EC-10 и или ПЭГ 400 (D.1) при соотношении 60/40 или ТЭЦ (D.2) при соотношении 90/10 в качестве пластификатора, растворенного в ацетоне/воде 98/2 (7,5% твердых веществ) с привесом 10% и сушили в Glatt при той же температуре в течение 10 минут для удаления избытка оставшегося растворителя. Высушенные гранулы просеивали, чтобы отбросить любые сдвоенные гранулы, если они образовались.
Е. СПВ гранулы гидрохлорида ондансетрона
ЗВ гранулы гидрохлорида ондансетрона из D.1 и D.2, выше, дополнительно покрывали мембраной для задержки времени высвобождения из ЕС-10/НР-55/ТЭЦ в трех соотношениях 45,5/40/14,5 (E.1 - серия # 1084-066), 50,5/35/14,5 (Е.2 - серия # 1117-025) и 60,5/25/14,5 (Е.3 - серия # 1117-044), растворенных в ацетоне/воде 90/10 (7,5% твердых веществ), с привесом до 50% по массе. Гранулы СПВ сушили в Glatt для удаления остаточного растворителя и просеивали через сито 18 меш. На фиг.9 показаны графики высвобождения гидрохлорида ондансетрона из гранул СПВ, покрытых EC-10/НР-55/ТЭЦ при трех разных соотношениях (E.1, E.2 и E.3). Более конкретно, на фиг.9 представлены графики высвобождения для следующих препаратов:
(1) СПВ гранулы серия # 1084-066 - Покрытие EC-10/HP-55/ТЭЦ в соотношении 45,5/40/14,5 при 50% привесе, нанесенное на БВ гранулы, покрытые EC-10/ПЭГ 400 60/40 при 10% привесе, тогда как БВ гранулы (с 5% наслоенного лекарственного вещества из ондансетрона/ПВП 90/10) содержат ядра из фумаровой кислоты (4% наслоенной на сахарные сферические частицы из раствора кислоты/Klucel), покрытые EC-10/ПЭГ 400 60/40 при 10% привесе.
(2) СПВ гранулы серия # 1117-025 - Покрытие ЕС-10/НР-55/ТЭЦ в соотношении 50,5/35/14,5 при 50% привесе, нанесенное на БВ гранулы, покрытые EC-10/ТЭЦ 90/10 при 10% привесе, тогда как БВ гранулы (с 6% наслоенного лекарственного вещества из ондансетрона/Klucel LF 90/10) содержат ядра из фумаровой кислоты (наслоенной на сахарные сферические частицы из раствора кислоты/ПВП), покрытые EC-10/ТЭЦ 90/10 при 10% привесе.
(3) СПВ гранулы серия # 1117-044 - покрытие EC-10/НР-55/ТЭЦ в соотношении 60,5/25/14,5 при 50% привесе, нанесенное на БВ гранулы, покрытые 90/10 EC-10/ТЕС при 10% привесе, тогда как БВ гранулы (6% наслоенного лекарственного вещества из ондансетрон/Rlugel 90/10) содержат ядра из фумаровой кислоты (наслоенной на сахарные сферические частицы из раствора кислоты/ПВП), покрытые ЕС-10/ТЭЦ 90/10 при 10% привесе.
Пример 5:
A. Ядра, содержащие фумаровую кислоту
Содержащие фумаровую кислоту ядра получали по методике, описанной в примере 3A, за исключением того, что содержание фумаровой кислоты во включающих кислоту ядрах составляло 11,25% вместо 6% в примере 3A.
B. Покрытые БВ включающие фумаровую кислоту ядра
Включающие фумаровую кислоту ядра (3750 г) из представленного выше покрывали раствором EC-10/ТЭЦ в соотношении 90/10, растворенных в ацетоне/воде 95/5 (7,5% твердых веществ) с привесом 5%.
C. БВ гранулы гидрохлорида ондансетрона
БВ гранулы гидрохлорида ондансетрона, из представленного выше, получали, как описано в примере 3С.
D. ЗC гранулы гидрохлорида ондансетрона
БВ гранулы гидрохлорида ондансетрона (3500 г) покрывали распылением раствора EC -10/ТЭЦ 90/10 (7,5% твердых веществ) растворенного в ацетоне/воде 95/5 при привесе 10% и сушили в Glatt в течение 10 минут для удаления избытка остаточного растворителя. Высушенные гранулы просеивали через сито 18 меш, чтобы отбросить сдвоенные гранулы, если они образовались.
E. СПВ гранулы ондансетрона гидрохлорида
ЗВ гранулы гидрохлорида ондансетрона (2600 г) из представленного выше дополнительно покрывали мембраной для задержки времени высвобождения, из ЕС-10/НР-55/ТЭЦ 60,5/25/14,5, растворенных в ацетоне/воде 90/10 (7,5% твердых веществ), с привесом 30%, 45% и 50%. Покрытые гранулы отверждали при 60°C в течение 30 минут в той же установке и просеивали через сито 18 меш после охлаждения при комнатной температуре.
F. ЗВ капсулы гидрохлорида ондансетрона
БВ гранулы гидрохлорида ондансетрона (PE364EA0001) и СПВ гранулы (серия # РЕ366ЕА0001 с покрытием для задержки времени высвобождения с 30% привесом, серия # PE367EA0001 с покрытием для задержки времени высвобождения с 45% привесом и серия# PE368EA0001 с покрытием для задержки времени высвобождения с 50% привесом) инкапсулировали при отношении 35%/65% в твердые желатиновые капсулы, с получением MB (с модифицированным высвобождением) капсул, с 16 мг (серия # PE380EA0001, серия # PE381EA0001 и серия # PE382EA0001) 1 р. в д. (OD; введение один раз в сутки) для предварительного изучения биодоступности у людей при сравнении с продаваемым зофраном® 8 мг (в виде ондансетрона) для приема 2 р. в д. (два раза в день). На фиг.10 показаны графики высвобождения лекарственного средства из трех MB капсул, содержащих БВ и СПВ гранулы.
Пример 6:
A. Ядра, содержащие фумаровую кислоту
На сферические частицы из сахара 60-80 меш (933,3 г) наслаивали фумаровую кислоту (240 г) из раствора (4% твердых веществ) Klucel LF (26,7 г), как описано в примере 3 с получением содержания кислоты 20% по весу. Ядра с кислотой сушили в установке в течение 10 мин для удаления остаточного растворителя/влаги и просеивали через сита 40-80 меш.
B. Покрытые ЗВ ядра фумаровой кислоты
Ядра с кислотой (910 г) из представленного выше покрывали раствором 441,5 г этилцеллюлозы (ЕС-10) и 49 г триэтилцитрата (ТЭЦ) в соотношении 90/10, растворенных в ацетоне/воде 95/5 (7,5% твердых веществ) с привесом 35%.
C. БВ гранулы гидрохлорида ондансетрона
БВ гранулы дигидрата гидрохлорида ондансетрона с содержанием лекарственного вещества 11,13% по весу получали, следуя методике, описанной в примере 5С.Наносили слой раствора дигидрата гидрохлорида ондансетрона (140,4 г) и Klucel LF (15,6 г) на покрытые ЗВ содержащие кислоту ядра (1080 г) и наносили герметичное покрытие Pharmacoat 603 с привесом 2%.
D. ЗВ гранулы гидрохлорида ондансетрона
БВ гранулы гидрохлорида ондансетрона, 1080 г, покрывали изолирующей оболочкой (ЗВ покрытие) путем распыления раствора (7,5% твердых веществ) EC-10/ТЭЦ 90/10 с привесом 5 и 10% и сушили в Glatt при той же температуре в течение 10 минут для удаления избытка остаточного растворителя. Высушенные гранулы просеивают, чтобы отбросить любые сдвоенные, если они образовались.
E. СПВ гранулы гидрохлорида ондансетрона
ЗВ гранулы гидрохлорида ондансетрона дополнительно покрывали мембраной для задержки времени высвобождения, из EC-10/HP-55/ТЕЦ при соотношении 60,5/25/14,5 с привесом 30%, 35% и 40%. Гранулы СПВ отверждали при 60°C в течение 30 минут в Glatt для удаления остаточного растворителя и просеивали через сито 30 меш.
F. Быстро диспергируемые микрогранулы
Быстро диспергируемые микрогранулы, содержащие сахаро-спирт, такой как маннит, и дезинтегрирующее средство, такое как кроссповидон, получали по методике, описанной в публикации одновременно находящейся на рассмотрении патентной заявки США № U.S. 2005/0232988, опубликованной 20 октября 2005 г, содержание которой включено сюда в виде ссылки. D-маннит (152 кг) со средним размером частиц приблизительно 20 мкм или менее (Pearlitol 25 от Roquett, Франция) перемешивали с 8 кг структурированного повидона (кросповидон XL-10 от ISP) в грануляторе с высоким усилием сдвига (GMX 600 от Vector) и гранулировали с очищенной водой (приблизительно 32 кг) и размалывали во влажном состоянии с использованием Comil от Quadro и сушили в Glatt GPCG 200. Быстро диспергируемые микрогранулы, полученные таким образом, имели средний размер частиц в интервале приблизительно 125-200 мкм.
G. РРТ MB гидрохлорида ондансетрона, 12 мг
Быстро диспергируемые микрогранулы (2541,2 г) смешивали с СПВ гранулами (460,8 г), ЗВ гранулами (479,0 г), БВ гранулами (377,4 г) и другими фармацевтически приемлемыми ингредиентами (142,0 г), такими как вкусовые добавки, подсластитель и дополнительное дезинтегрирующее вещество в двухстенном V-образном смесителе в течение достаточного времени для получения смешивания с гомогенным распределением для прессования. Таблетки, весящие приблизительно 400 мг, прессовали, используя таблеточный пресс производственного масштаба, оборудованный внешней системой смазки для получения средней твердости приблизительно 4-5 кП. РРТ MB дигидрата гидрохлорида ондансетрона, 12 мг, полученные таким образом, быстро распадаются, в ротовой полости, давая однородную легко проглатываемую суспензию, содержащую покрытые гранулы гидрохлорида ондансетрона, которые обеспечивали намеченный график высвобождения, подходящий для режима приема один раз в сутки.
Пример 7:
Проводили 4-стороннее предварительное решающее (proof of concept) исследование, в котором участвовало 12 мужчин-добровольцев кавказского типа в возрасте 18-55 лет с периодом вымывания 7 дней. Каждый доброволец получал дозу 16 мг испытуемого препарата с 250 мл минеральной воды (или A (PF380EA0001), В (PF381EA0001) или С (PF382EA0001) из примера 4) в 8 часов утра или 8 мг зофрана® два раза (т.е. одну в 8 часов утра, а другую в 16:30, натощак, при отсутствии приема пищи в течение ночи (по меньшей мере в течение 12 часов), и второй завтрак давали в 11 часов утра. Образцы крови брали в сроки 0 (перед приемом препарата), через 20 мин, 40 мин, 1 час, 1,5 часа, 2 часа, 3 часа, 4 часа, 6 часов, 8,5 часов (перед получением второй дозы), 9 часов 10 мин., 9,5 часов, 10 часов, 10,5 часов, 11,5 часов, 12,5 часов, 14,5 часов, 17 часов, 20 часов, 24 часа и 36 часов. ФК (фармакокинетические) параметры представлены в таблице 2. В таблице показано, что графики концентраций испытуемых препаратов (PE280EA0001), В (PE281EA0001) или С (PE282EA0001) в плазме характерны для препаратов с замедленным высвобождением, т.е. наблюдаемый полупериод выведения значительно длиннее, чем у зофрана. ППК или Смах испытуемых препаратов по существу не отклоняются от этих показателей у зофрана (т.е. ППК находится в пределах ±25% и Смах приблизительно 70% от показателей зофрана). Фактическая Смах для зофрана, 8 мг, составила 30 нг/мл по сравнению с предсказанными 24 нг/мл, тогда как фактическая Смах для БВ компонента составила приблизительно 24 нг/мл после нормализации. Приблизительно 70% зофрана, 8 мг × 2 р.в.д. (дважды в день) всасывалось через 24 часа. Испытуемые препараты с A по C проявляли ожидаемую тенденцию после приема дозы до критической точки через приблизительно 15-16 часов; затем для препарата C продолжал проявляться график более низкой концентрации в плазме в зависимости от времени по сравнению с предсказываемым поведением.
По этим показателям ясно, что включение органической кислоты в качестве солюбилизатора для слабо щелочных лекарственных средств, проявляющих зависимый от pH график растворения (т.е. у которых проявляется снижение растворимости при pH в кишечнике 6,8 на 2 порядка по амплитуде по сравнению с их максимальной растворимостью в ЖК жидкости), и функциональное покрытие кислоты перед нанесением активного фармацевтического ингредиента обладает значительным влиянием на время задержки, график желаемого, но полного высвобождения лекарственного вещества перед исчерпанием буфера. Кроме того, активный фармацевтический ингредиент остается в неизменной форме в твердой дозированной форме до тех пор, когда он высвобождается для всасывания в ЖК тракте.
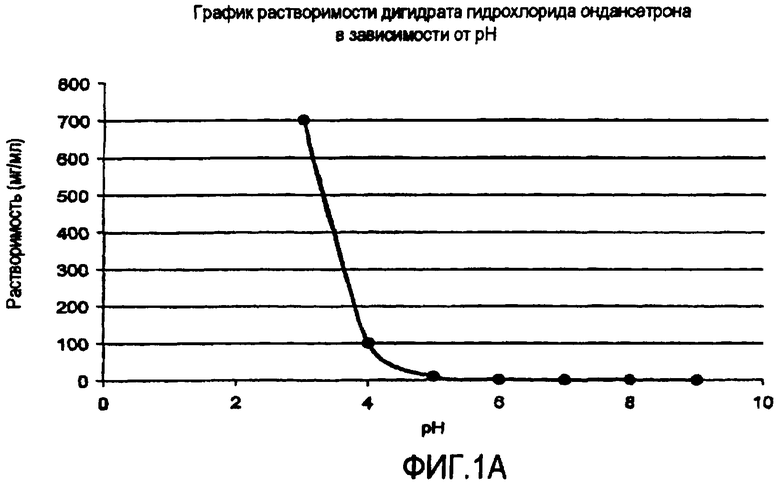
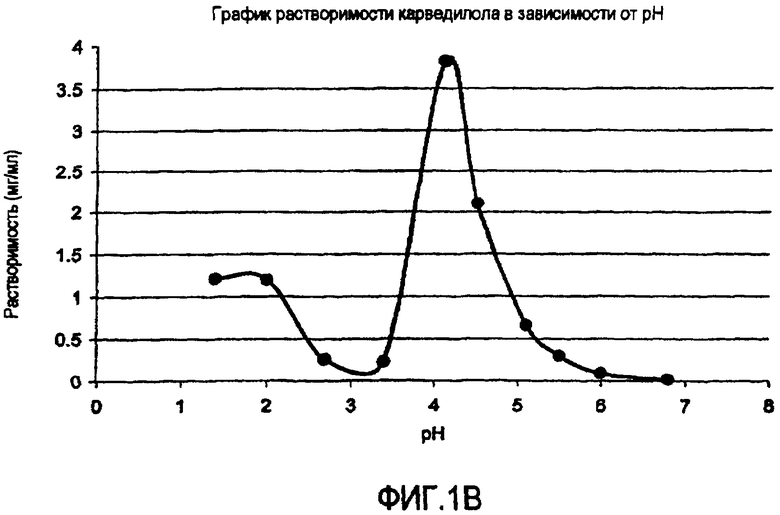
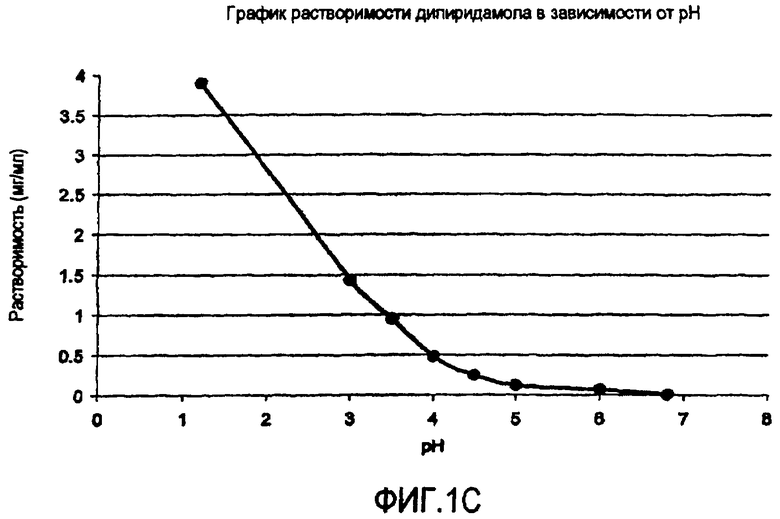
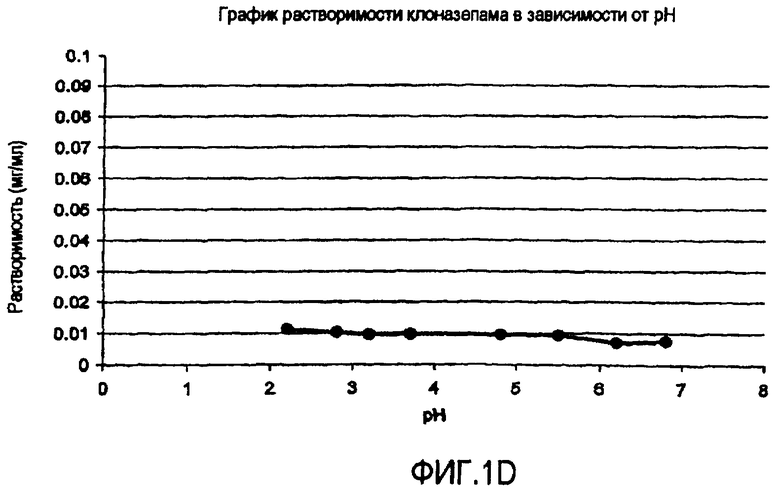
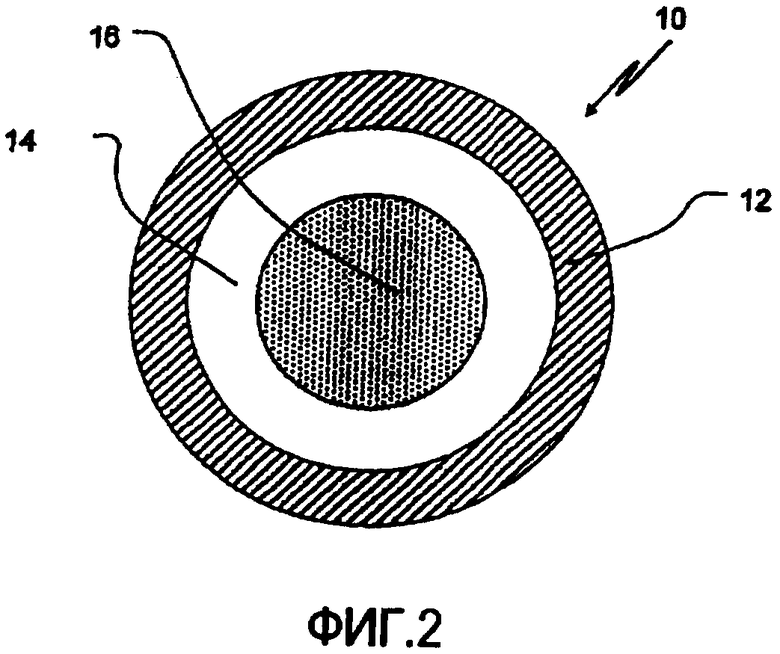
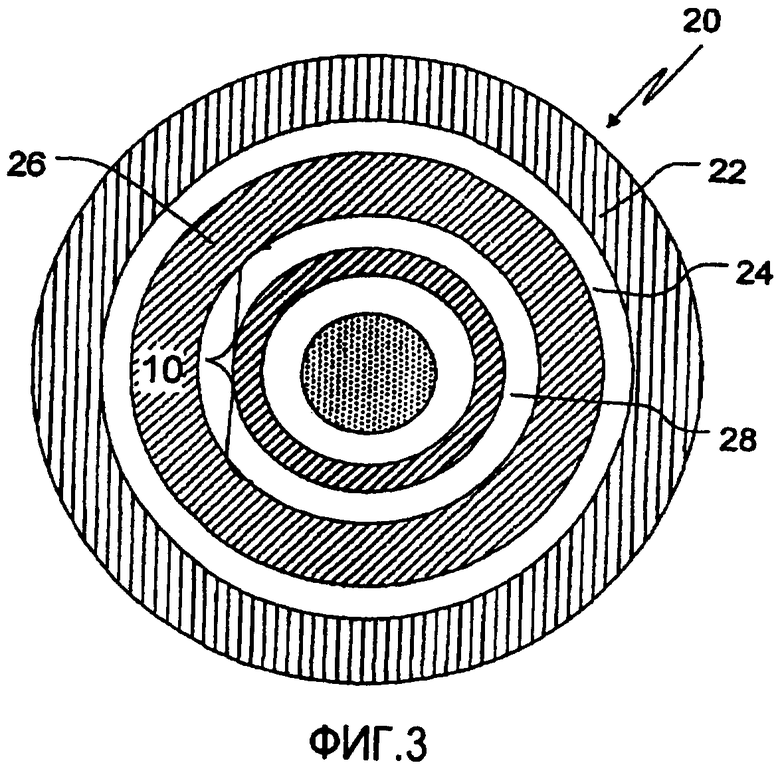
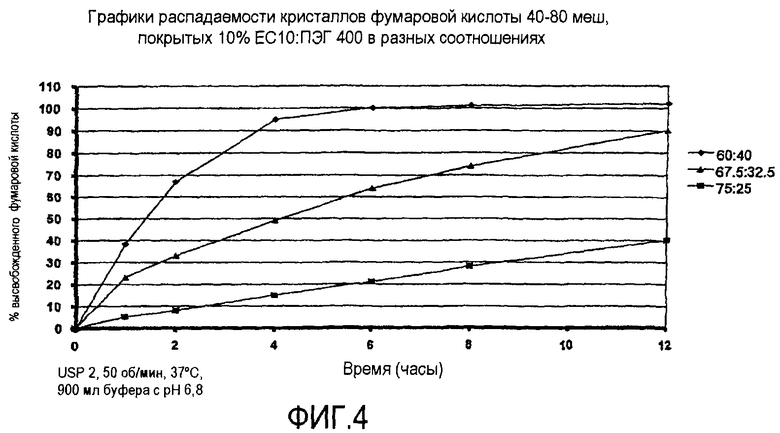
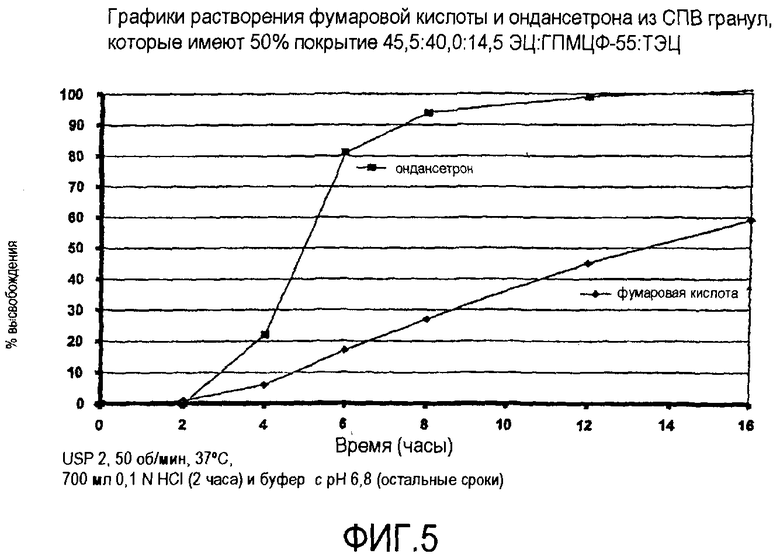
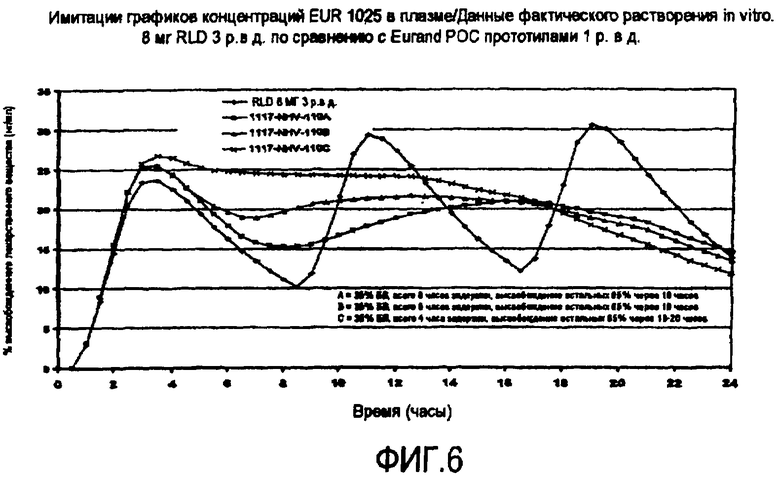
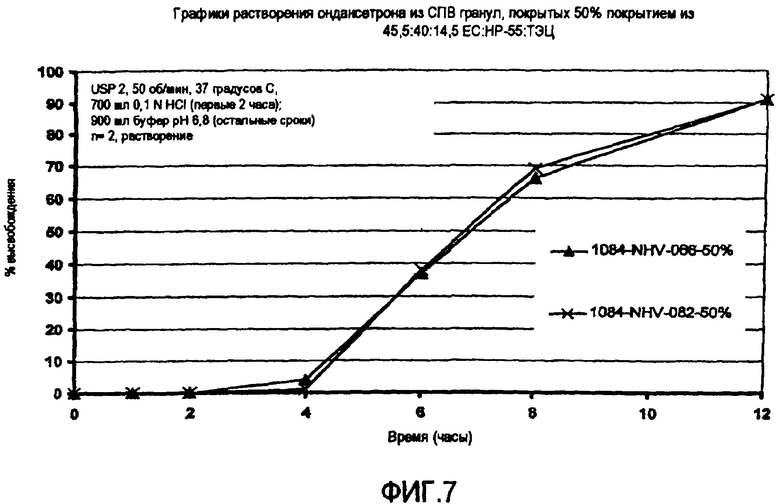
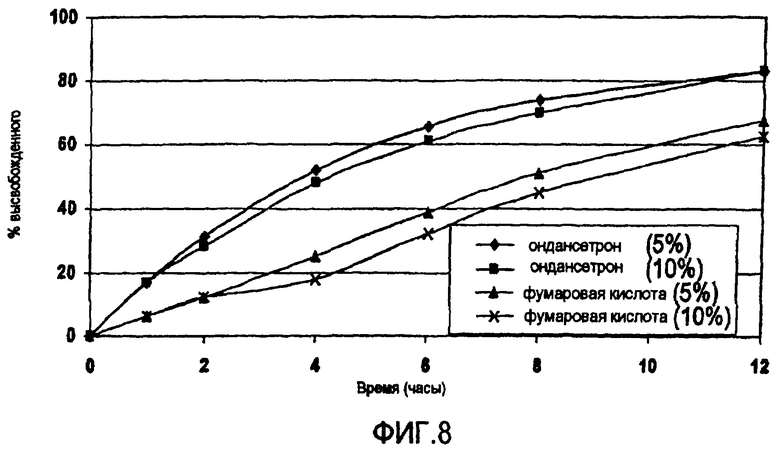
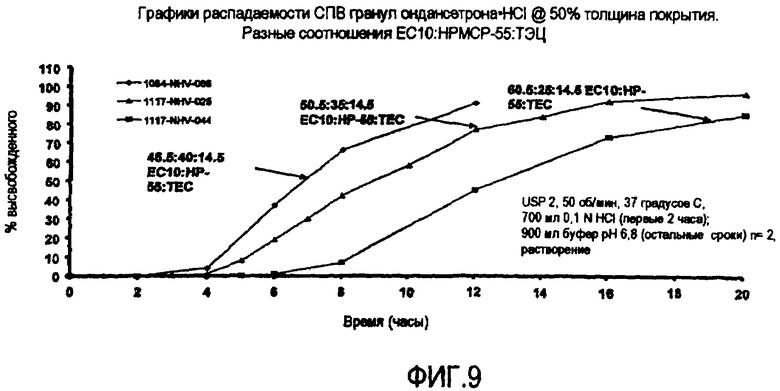
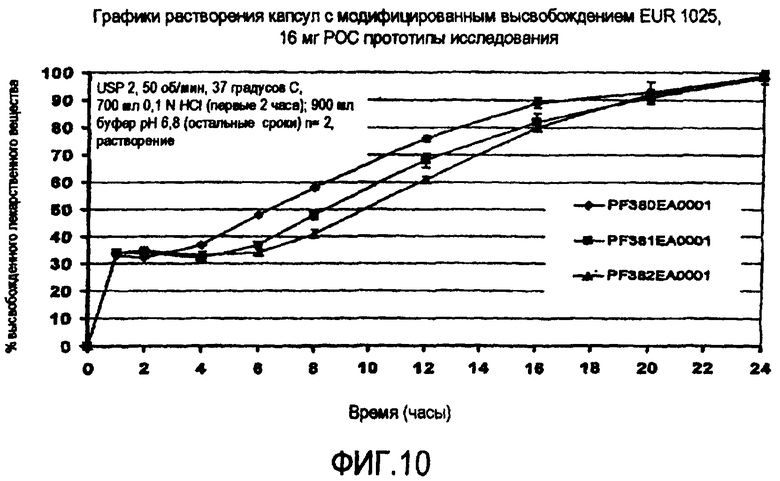
Изобретение относится к фармацевтически дозированной лекарственной форме из множества частиц. Заявленная лекарственная форма включает одну или более из совокупностей синхронизированных с пульсирующим высвобождением (СПВ) гранул слабощелочного лекарственного вещества, где слабощелочное лекарственное вещество состоит из включающего азот (N) селективного серотонинового 5-НТ3 блокатора или его фармацевтически приемлемой соли, имеющих рКа в интервале от приблизительно 5 до 14 и растворимость не более приблизительно 200 мкг/мл при pH 6,8. Указанные СПВ гранулы включают частицы с ядром из органической кислоты, покрытые оболочкой, обеспечивающей задержку времени высвобождения. Также изобретение относится к способу получения фармацевтически дозированной лекарственной формы. Заявленное изобретение обеспечивает возможность достижения приемлемой концентрации лекарственного вещества в плазме через 24 часа после приема дозы, что делает его пригодным для режима дозирования с приемом один раз в сутки. 2 н. и 37 з.п. ф-лы, 10 ил., 2 табл., 7 пр.
1. Фармацевтическая дозированная лекарственная форма из множества частиц, содержащая одну или более из совокупностей синхронизированных с пульсирующим высвобождением (СПВ) гранул слабощелочного лекарственного вещества: причем слабощелочное лекарственное вещество состоит из включающего азот (N) селективного серотонинового 5-НТ3 блокатора или его фармацевтически приемлемой соли, имеющих рКа от приблизительно 5 до 14 и растворимость не более приблизительно 200 мкг/мл при pH 6,8, причем СПВ-гранулы включают частицы с ядром из органической кислоты, покрытые оболочкой, обеспечивающей задержку времени высвобождения,
причем частицы с ядром из органической кислоты включают, по меньшей мере, одну фармацевтически приемлемую органическую кислоту и слабощелочное лекарственное вещество,
где слабощелочное лекарственное вещество распределено по поверхности органической кислоты,
где мембрана с замедленным высвобождением, содержащая не растворимый в воде полимер, необязательно, в сочетании с водорастворимым полимером или кишечно-растворимым полимером находится между слабощелочным лекарственным веществом и органической кислотой и
мембрана с замедленным высвобождением контролирует высвобождение органической кислоты.
2. Фармацевтическая дозированная лекарственная форма из множества частиц по п.1, причем отношение оптимальной высшей дозы для слабощелочного лекарственного вещества к растворимости слабощелочного лекарственного средства при pH 6,8 составляет не менее чем приблизительно 100 и слабощелочное лекарственное средство практически нерастворимо.
3. Фармацевтическая дозированная лекарственная форма из множества частиц по п.1, причем
указанные СПВ-гранулы содержат наружное покрытие, обеспечивающее задержку времени высвобождения, включающее не растворимый в воде полимер в сочетании с кишечно-растворимым полимером; причем
а) указанное наружное покрытие, обеспечивающее задержку времени высвобождения, обеспечивает время задержки от приблизительно 2 до приблизительно 7 ч до начала высвобождения слабощелочного лекарственного вещества;
b) указанные СПВ-гранулы содержат дополнительное изолирующее 3В покрытие под СПВ-покрытием; причем указанное 3В покрытие включает не растворимый в воде полимер, необязательно в комбинации с водорастворимым образующим поры полимером, и
с) указанные частицы с ядром из органической кислоты содержат по меньшей мере одну фармацевтически приемлемую органическую кислоту.
4. Фармацевтическая дозированная форма из множества частиц по п.1 в форме распадающейся во рту таблетки (РРТ).
5. Фармацевтическая дозированная форма из множества частиц по п.1, причем:
а) указанные СПВ-гранулы включают наружное обеспечивающее задержку высвобождения покрытие, включающее не растворимый в воде полимер в сочетании с кишечно-растворимым полимером, распределенное по поверхности указанных частиц с ядром из органической кислоты; причем указанное наружное обеспечивающее задержку покрытие обеспечивает время задержки от приблизительно 2 до приблизительно 7 ч до начала высвобождения слабощелочного лекарственного вещества, указанные частицы с ядром из органической кислоты содержат по меньшей мере одну фармацевтически приемлемую органическую кислоту.
6. Фармацевтическая дозированная форма из множества частиц по п.1, дополнительно содержащая совокупность гранул быстрого высвобождения (БВ), первую совокупность гранул СПВ; или совокупность гранул БВ, первую совокупность гранул СПВ и вторую совокупность гранул СПВ, причем соотношение совокупности БВ-гранул к первой совокупности СПВ-гранул, необязательно, ко второй совокупности гранул СПВ колеблется от приблизительно 10:90:0 до приблизительно 40:10:50, где совокупность БВ-гранул включает ядра из органической кислоты, покрытые мембраной с замедленным высвобождением, содержащие по меньшей мере одну фармацевтически приемлемую органическую кислоту и слабощелочное лекарственное вещество.
7. Фармацевтическая дозированная форма из множества частиц по п.1, причем указанным слабощелочным лекарственным веществом является ондансетрон или его фармацевтически приемлемая соль.
8. Фармацевтическая дозированная форма из множества частиц по п.1, причем органическая кислота выбрана из группы, состоящей из лимонной кислоты, фумаровой кислоты, яблочной кислоты, виннокаменной кислоты, янтарной кислоты, щавелевой кислоты, оксалиновой кислоты, аспарагиновой кислоты, глютаминовой кислоты и их смесей.
9. Фармацевтическая дозированная форма из множества частиц по п.1, причем отношение слабощелочного лекарственного вещества к органической кислоте варьируется от приблизительно 5:1 до 1:10 по весу.
10. Фармацевтическая дозированная форма из множества частиц по п.3, причем указанная органическая кислота представлена в форме:
i) кристалла органической кислоты;
ii) инертной частицы, покрытой органической кислотой и полимерным связывающим веществом; или
iii) гранулы или микротаблетки, включающей органическую кислоту, полимерное связывающее вещество и разбавитель/наполнитель.
11. Фармацевтическая дозированная форма из множества частиц по п.3, где мембрана с замедленным высвобождением, включает не растворимый в воде полимер один или не растворимый в воде полимер в комбинации с водорастворимым полимером в соотношении от приблизительно 9:1 до 5:5.
12. Фармацевтическая дозированная форма из множества частиц по п.11, причем не растворимый в воде полимер выбран из группы, состоящей из этилцеллюлозы, ацетилцеллюлозы, ацетобутиратцеллюлозы, поливинилацетата, нейтральных сополимеров метакриловой кислоты - метилметакрилата и их смесей.
13. Фармацевтическая дозированная форма из множества частиц по п.11, причем водорастворимый полимер выбран из группы, состоящей из метилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, поливинилпирролидона и полиэтиленгликоля и их смесей.
14. Фармацевтическая дозированная форма из множества частиц по п.3, причем указанное обеспечивающее задержку времени высвобождения покрытие включает не растворимый в воде полимер в комбинации с кишечно-растворимым полимером в соотношении от приблизительно 9:1 до 1:3 соответственно, с привесом от приблизительно 10 до 60% по весу от сухого веса гранул СПВ.
15. Фармацевтическая дозированная форма из множества частиц по п.14, причем кишечно-растворимый полимер выбран из группы, состоящей из ацетофталатцеллюлозы, фталат гидроксипропилметилцеллюлозы, сукцинат гидроксипропилметилцеллюлозы, поливинилацетофталат, чувствительные к pH сополимеры метакриловой кислоты и метилметакрилата, шеллака, их производных и их смесей.
16. Фармацевтическая дозированная форма из множества частиц по п.3, причем, по меньшей мере, один из внутреннего изолирующего покрытия и наружного обеспечивающего задержку времени высвобождения покрытия дополнительно содержит пластификатор, выбранный из группы, состоящей из триацетина, трибутилцитрата, триэтилцитрата, ацетилтри-н-бутилцитрата, диэтилфталата, дибутилсебаката, полиэтиленгликоля, полипропиленгликоля, касторового масла, ацетилированных моно- и диглицеридов и их смесей.
17. Фармацевтическая дозированная форма из множества частиц по п.3, дополнительно включающая БВ-гранулы, которые высвобождают не менее приблизительно 50% слабощелочного лекарственного вещества, заключенного в указанных БВ-гранулах в пределах первого часа после перорального приема дозированной лекарственной формы, где БВ-гранулы включают ядра из органической кислоты, покрытые мембраной с замедленным высвобождением, содержащие по меньшей мере одну фармацевтически приемлемую органическую кислоту и слабощелочное лекарственное вещество.
18. Фармацевтическая дозированная форма из множества частиц по п.3, дополнительно включающая БВ-гранулы, которые включают указанное слабощелочное лекарственное вещество и полимерное связующее вещество, нанесенные в виде слоя на инертное ядро.
19. Фармацевтическая дозированная форма из множества частиц по п.3, включающая одну или более из совокупностей СПВ-гранул, причем указанное слабощелочное лекарственное вещество включает ондансетрон или его фармацевтически приемлемую соль и органическая кислота представляет собой фумаровую кислоту, где каждая совокупность гранул СПВ включает покрытие, обеспечивающее задержку времени высвобождения;
причем покрытие, обеспечивающее задержку времени высвобождения, включает этилцеллюлозу и фталат гидроксипропилметилцеллюлозы в соотношении от приблизительно 9:1 до приблизительно 1:3 с привесом от 5 до 60% и
причем каждая совокупность СПВ-гранул обеспечивает при пероральном введении дозированной формы предварительно заданное время задержки и различные характеристики высвобождения.
20. Фармацевтическая дозированная форма из множества частиц по п.1 в форме распадающейся во рту таблетки, включающей одну совокупность СПВ-гранул.
причем каждая совокупность СПВ-гранул содержит наружное СПВ покрытие, распределенное по поверхности частиц с ядром из органической кислоты, включающих ядра из фумаровой кислоты, дополнительно покрытые дигидратом гидрохлорида ондансетрона.
21. Фармацевтическая дозированная форма из множества частиц по п.1, причем фармацевтически приемлемая органическая кислота не исчерпывается в указанной дозированной форме до полного завершения высвобождения слабощелочного лекарственного вещества при испытании на распадаемость по методу из Фармакопеи Соединенных Штатов (USР) с использованием сред для двухэтапной распадаемости (первые 2 ч в 0,1 N НСl с последующим испытанием в буфере с pH 6,8).
22. Фармацевтическая дозированная форма из множества частиц по п.1, дополнительно включающая гранулы с быстрым высвобождением (БВ), где
БВ-гранулы включают ядра из органической кислоты, покрытые мембраной с замедленным высвобождением, содержащие по меньшей мере одну фармацевтически приемлемую органическую кислоту и слабощелочное лекарственное вещество.
23. Фармацевтическая дозированная форма из множества частиц по п.2, причем указанная дозированная форма проявляет фармакокинетические характеристики через 24 ч после приема дозы, подходящие для режима дозирования с одним приемом в сутки у пациентов, нуждающихся в таком лечении.
24. Фармацевтическая дозированная форма по п.4, причем указанная РРТ распадается при контакте со слюной в полости рта через приблизительно 60 с или менее.
25. Фармацевтическая дозированная форма из множества частиц по п.20, причем указанная дозированная форма дополнительно содержит совокупность БВ-гранул с замаскированным вкусом, где БВ-гранулы включают ядра из органической кислоты, покрытые мембраной с замедленным высвобождением, содержащие по меньшей мере одну фармацевтически приемлемую органическую кислоту и слабощелочное лекарственное вещество.
26. Фармацевтическая дозированная форма из множества частиц по п.3, содержащая СПВ-гранулы, причем покрытие, обеспечивающее задержку времени высвобождения, содержит этилцеллюлозу и гидроксипропилцеллюлозу.
27. Фармацевтическая дозированная форма из множества частиц по п.26, причем покрытие, обеспечивающее задержку времени высвобождения, дополнительно содержит пластификатор.
28. Фармацевтическая дозированная форма из множества частиц по п.26, причем слабощелочное лекарственное вещество является ондансетроном или его фармацевтически приемлемой солью.
29. Фармацевтическая дозированная форма из множества частиц по п.4, причем указанные PPT дополнительно содержат быстро распадающиеся микрогранулы, причем указанные быстро распадающиеся микрогранулы содержат дезинтегрирующее вещество и сахар-спирт, или сахарид, или их сочетание, и каждый из дезинтегрирующего вещества, сахара-спирта и сахарида имеет размер частиц не более приблизительно 30 мкм.
30. Фармацевтическая дозированная форма из множества частиц по п.29, причем быстро распадающиеся микрогранулы имеют средний размер частиц не более приблизительно 400 мкм.
31. Способ получения фармацевтической дозированной формы из множества частиц по п.1, включающий:
а) получение частиц, содержащих органическую кислоту, включающих, по меньшей мере, одну фармацевтически приемлемую органическую кислоту;
b) получение покрытых мембраной с замедленным высвобождением частиц, содержащих органическую кислоту, путем нанесения на частицы с ядром, содержащим органическую кислоту, мембраны с замедленным высвобождением, включающей только не растворимый в воде полимер один или не растворимый в воде полимер в комбинации с водорастворимым полимером или кишечно-растворимым полимером в соотношении от приблизительно 95:5 до приблизительно 50:50, с привесом до 20%;
с) получение частиц с ядром из органической кислоты путем нанесения покрытия из раствора слабощелочного лекарственного вещества или его фармацевтически приемлемой соли и связующего полимера;
е) получение СПВ-гранул путем нанесения наружного обеспечивающего задержку времени высвобождения покрытия, содержащего не растворимый в воде полимер в комбинации с кишечно-растворимым полимером на частицы с ядром из органической кислоты в соотношении от приблизительно 9:1 до 1:3 с привесом от приблизительно 10 до 60% от сухого веса СПВ-гранул в целом.
32. Способ по п.31, причем каждое из указанных стадий покрытия или нанесения покрытия включает покрытие или нанесение покрытия из раствора в фармацевтически приемлемой системе растворителей или из водной дисперсии.
33. Способ по п.31, причем дозированная форма из множества частиц содержит терапевтически эффективное количество совокупности одной или более из совокупностей СПВ-гранул, причем каждая из совокупностей СПВ-гранул проявляет разные характеристики высвобождения и заданное время задержки высвобождения.
34. Способ по п.31, дополнительно включающий:
i) грануляцию сахара-спирта, или сахарида, или их комбинаций и дезинтегрирующее вещество, причем каждый имеет средний размер частиц не более приблизительно 30 мкм с получением быстро распадающихся микрогранул;
j) смешивание одной или более из совокупностей СПВ-гранул с быстро
распадающимися микрогранулами и
k) прессование смеси со стадии (j) в распадающиеся во рту таблетки.
35. Способ по п.34, причем отношение одной или более из совокупностей СПВ-гранул к быстро распадающимся микрогранулам находится от приблизительно 1:6 до приблизительно 1:2.
36. Способ по п.31, дополнительно включающий
f) заполнение капсул, или прессование таблеток или распадающихся в ротовой полости таблеток с использованием одной или более из совокупностей СПВ-гранул в количествах, достаточных для получения фармакокинетических характеристик, подходящих для режима дозирования с одним приемом в сутки у пациентов, нуждающихся в таком медикаментозном лечении.
37. Способ по п.36, причем указанная стадия прессования в распадающиеся в ротовой полости таблетки включает прессование на роторном таблеточном прессе, оборудованном внешней системой для смазки матриц и пуансонов перед прессованием.
38. Способ по п.31, где на стадии с) происходит нанесение защитного герметичного покрытия, включающего водорастворимый полимер, на покрытые мембраной с замедленным высвобождением частицы с ядром из органической кислоты.
39. Способ по п.31, далее включающий нанесение дополнительного изолирующего 3В покрытия на частицы с ядром из органической кислоты.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| RU 97120754 A, 10.11.1999 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2013-08-20—Публикация
2007-01-29—Подача