Область техники, к которой относится изобретение
Настоящее изобретение относится к способу приготовления заменителя костного трансплантата с использованием бычьей кости и, в частности, к способу приготовления безопасного заменителя костного трансплантата, который исключает риск заражения губчатой энцефалопатией крупного рогатого скота, включающему обработку бычьей кости гипохлоритом натрия при высокой температуре более 600°C.
Предшествующий уровень техники
Заменитель костного трансплантата (BGS) относится к материалу для трансплантации, который используется для замены дефектов костной ткани, происходящих вследствие различных болезней зубов или травм, связанной с заболеванием дегенерации или другими потерями ткани, который заполняет поровое пространство в костной ткани и способствует образованию новой кости. Известно, что лучшим трансплантатом является аутогенный костный трансплантат, однако аутогенный костный трансплантат имеет проблемы, связанные с тем, что требуется повторная хирургическая операция, существует сложность получения необходимого количества, существует сложность в проведении операции в условиях небольших госпиталей и имеется вероятность, которая способствует болезненности для пациента и тяжести заболеваемости.
По этой причине для трансплантации используются различные заменители, включая донорские кости человека, искусственные кости и искусственно синтезированные материалы, сделанные из костного гидроксиапатита. Коммерчески доступные костные заменители имеют преимущества в том, что они доступны в различных формах, включая порошок, гель, суспензию/замазку, таблетки, чипы, кусочки, пеллеты, планки, пластины и блоки, являются гомогенными, имеют низкий риск относительно инфекции и болезни, снижают риск болей, связанных с взятием собственных костей пациента для трансплантации, и имеют сниженные ограничения по размеру. Однако эти коммерческие костные заменители имеют различные проблемы. Например, поскольку их структура значительно отличается от физической структуры кости человека, они имеют низкую скорость регенерации ткани.
При попытке решить эти проблемы костные минералы, полученные путем физико-химической обработки костей животных, имеющих сходную структуру со структурой костей человека, с удалением органических субстанций, обрабатывали таким образом, что они могли применяться в стоматологических и ортопедических хирургических операциях. Типичный пример может включать Bio-Oss®, коммерчески доступный от Geistlich Biomaterials.
Способ приготовления указанного заменителя костного трансплантата с использованием костей животного включает следующие стадии: обработку бедренной кости жвачного животного растворителем, имеющим температуру кипения 80-120°C, для удаления липидов; добавление аммиака или первичного амина к обработанной кости для удаления протеинов и органических субстанций с получением костного минерала; нагревание бычьего минерала при температуре 250-600°C в течение нескольких часов с последующим высушиванием (патенты США №5167961 и №5417975).
Хотя существовал пример, где хрящ был обработан гипохлоритом натрия для селективного устранения коллагеновой фазы с целью изучения оставшейся структуры хряща (Broz, JJ. et al, J. Mater. Sci. Mater. Med., 8:395, 1997), еще не было отмечено, что гипохлорит натрия используется для удаления всех протеинов в приготовлении костных минералов.
Среди таких костей животных наиболее часто использующейся костью является бычья кость, и указанный продукт Bio-Oss® также получается с использованием бычьей кости в качестве сырьевого материала. Однако, поскольку до недавнего времени часто отмечалось проявление губчатой энцефалопатии крупного рогатого скота, безопасность бычьей кости в качестве сырьевого материала относительно губчатой энцефалопатии крупного рогатого скота не обеспечивалась. По этой причине, в стадии преобразования бычьей кости в материал костного трансплантата, прион, который вызывает губчатую энцефалопатию крупного рогатого скота, должен быть удален. Поскольку прион полностью не исчезает даже при высокой температуре в 600°C, то он не может быть удален известными из уровня техники способами, вследствие чего требуется разработка нового способа.
В этой связи настоящие изобретатели получали заменитель костного трансплантата, который не исключал риск наличия губчатой энцефалопатии крупного рогатого скота, с использованием способа, содержащего стадии инактивации прионового протеина гипохлоритом натрия в процессе приготовления заменителя костного трансплантата, используя бычью кость, и нагревания результирующей кости при высокой температуре 600°C, таким образом завершая настоящее изобретение.
Сущность изобретения
В одном аспекте настоящее изобретение относится к способу приготовления заменителя костного трансплантата, который полностью освобожден от прионового протеина, который вызывает губчатую энцефалопатию крупного рогатого скота, способу, включающему обработку бычьей кости гипохлоритом натрия и нагревание обработанной кости при высокой температуре.
В другом аспекте настоящее изобретение относится к композиции заменителя костного трансплантата, содержащей заменитель костного трансплантата, приготовленный в соответствии с указанным способом.
Другие признаки и воплощения настоящего изобретения проявятся из следующих подробного описания и формулы изобретения.
Краткое описание чертежей
Фиг.1 представляет фотографию, сделанную с помощью сканирующей электронной микроскопии, костного порошка, термически обработанного при 600°С;
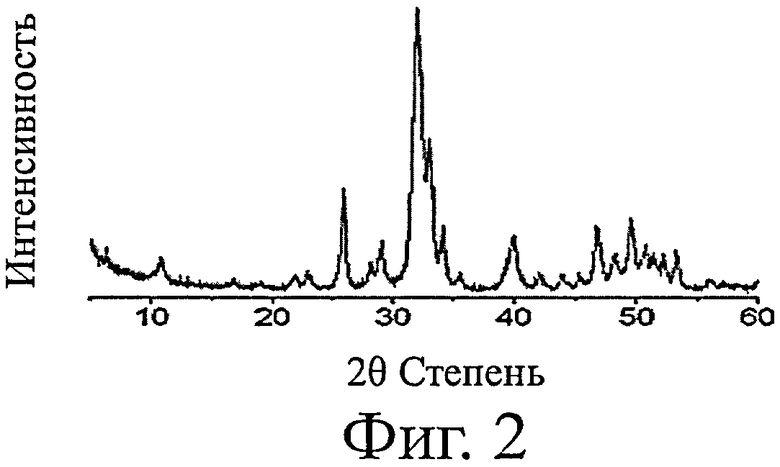
фиг.2 показывает результаты измерения XRD (дифракционный рентгеновский анализ) для костного порошка, термически обработанного при 600°С;
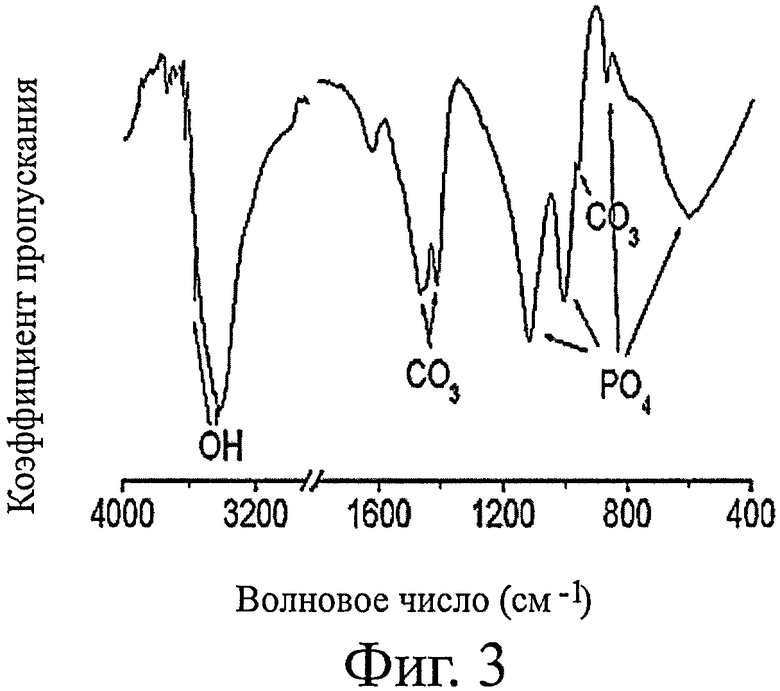
фиг.3 демонстрирует результаты измерения FT-IR (Фурье-ИК-спектральный анализ) для костного порошка, термически обработанного при 600°С;
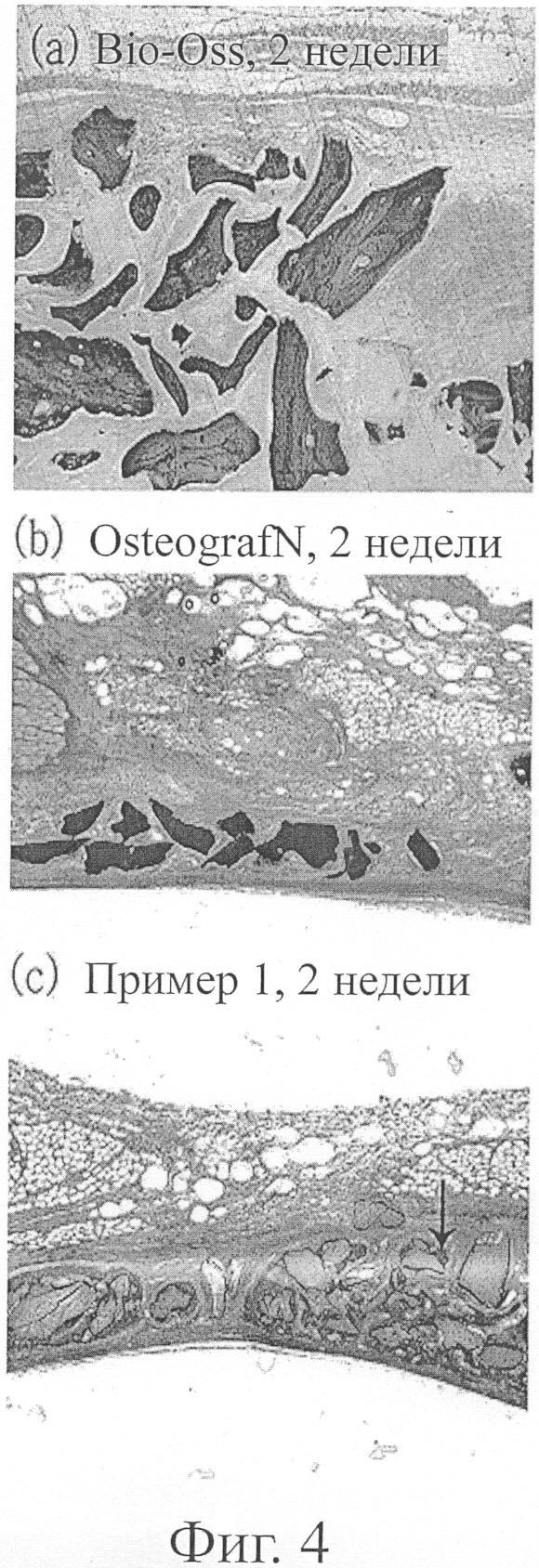
фиг.4 показывает фотографии образцов ткани, взятых через 2 недели после имплантации каждого костного порошка, приготовленного в примере 1, Bio-Oss® и OsteoGrar®/N, в циркулярные дефекты новозеландских белых кроликов;
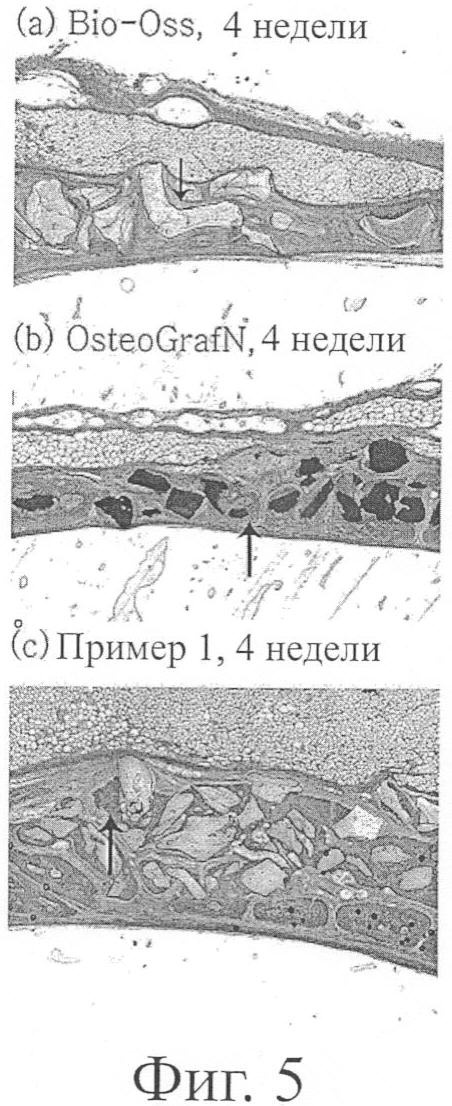
фиг.5 демонстрирует фотографии образцов ткани, взятых через 4 недели после имплантации каждого костного порошка, приготовленного в примере 1, в циркулярные дефекты новозеландских белых кроликов.
Подробное описание изобретения
Настоящее изобретение обеспечивает способ приготовления заменителя костного трансплантата из бычьей кости, включающий следующие стадии: (а) кипячение бычьей кости, из которой удалены компоненты крови, в деионизированной воде для удаления липидов и протеинов и высушивание сваренной кости; (b) измельчение высушенной кости, погружение и перемешивание перемолотого костного порошка в органическом растворителе; (с) удаление органического растворителя и высушивание костного порошка; (d) обработка высушенного костного порошка, из которого удален растворитель, раствором 2-20% гипохлорита натрия; (е) удаление раствора гипохлорита натрия из костного порошка и высушивание результирующего костного порошка; (f) термическая обработка высушенного костного порошка при 600-1000°С в течение 1-6 часов для полного удаления липидов и протеинов.
В способе по изобретению стадия погружения костного порошка в органический растворитель представляет стадию удаления липидов, оставшихся в порошке бычьей кости, в которой органический растворитель может предпочтительно быть смешанным растворителем, состоящим из хлороформа и метанола. Соотношение хлороформ:метанол в смешанном растворителе может быть 2-8:8-2 и предпочтительно 1:1.
В способе по изобретению стадия обработки костного порошка раствором гипохлорита натрия представляет стадию удаления протеинов, оставшихся в порошке бычьей кости, и инактивации приона, который вызывает губчатую энцефалопатию крупного рогатого скота.
Используемый в этой стадии раствор гипохлорита натрия может быть раствором, содержащим гипохлорит натрия в концентрации 2-20% (масса/объем) и наиболее предпочтительно около 4% (масса/объем). Стадия обработки костного порошка гипохлоритом натрия должна проводиться в течение, по меньшей мере, 20 минут для инактивации приона и предпочтительно проводится в течение, по меньшей мере, 72 часов для удаления оставшихся протеинов.
В способе по изобретению стадия (d) может дополнительно содержать добавление 1-10N гидроксида натрия к раствору гипохлорита натрия для повышения эффективности инактивации приона. Концентрация гидроксида натрия предпочтительно составляет около 2N.
Способ по изобретению может дополнительно включать вслед за стадией (f) следующие стадии: фильтрацию термически обработанного костного порошка через фильтр, имеющий размер пор 212-425 мкм; и промывание фильтрованного костного порошка.
В другом аспекте настоящее изобретение обеспечивает композицию для замещения костного трансплантата, содержащую заменитель костного трансплантата, приготовленный в соответствии с указанным способом.
Композиция по изобретению для замещения костного трансплантата может дополнительно содержать, по меньшей мере, одно биологически активное вещество, выбранное из группы, состоящей из фактора, стимулирующего рост кости, фибрина, костного морфогенетического фактора, агента роста кости, хемотерапевтического агента, антибиотика, анальгетика, дифосфоната, соли стронция, соли фтора, соли магния и соли натрия. Также она может дополнительно содержать, по меньшей мере, одно химическое соединение, выбранное из группы, состоящей из гиалуроновой кислоты, хондроитин сульфата, альгиновой кислоты, хитозана, коллагена, гидроксиапатита, карбоната кальция, фосфата кальция, сульфата кальция и керамик.
В еще другом аспекте настоящее изобретение обеспечивает композицию гелевого типа для замещения костного трансплантата, в которой указанное химическое соединение представляет собой гиалуроновую кислоту.
В используемом здесь значении термин "заменитель костного трансплантата" относится к материалу для заполнения пространства в костной ткани. Заменитель костного трансплантата может использоваться в форме замазки, пасты, формуемых пластинок, блоков, чипов и др., которые образуются путем прессования, уплотнения, прессового уплотнения, сжатия, сдавливания или набивания костного порошка в желаемой форме. Также он может использоваться в форме геля, гранул, пасты, таблеток, пеллет и др., которые формируются с использованием химических добавок, и он может использоваться в порошковой форме, как он есть.
Если заменитель костного трансплантата используется в вышеуказанных формах, то предпочтительным является добавление к нему биологически активных веществ. Примеры биологически активных веществ, которые могут быть использованы в настоящем изобретении, включают фактор, стимулирующий рост кости, фибрин, костный морфогенетический фактор, агент роста кости, хемотерапевтический агент, антибиотик, анальгетик, дифосфонат, соль стронция, соль фтора, соль магния и соль натрия.
Примеры фактора роста, который может использоваться в настоящем изобретении, включают BMP (костный морфогенетический протеин), PDGF (тромбоцитарный фактор роста), TGF-бета (трансгенный фактор роста), IGF-I (инсулиноподобный фактор роста), IGF-II, FGF (фактор роста фибробластов) и BGDF-II (бета-2-микроглобулин). Примеры костного морфогенетического фактора, который может использоваться в настоящем изобретении, включают остеокальцин, белок bonesialo, остеогенин, BMP и подобные. Агент костного роста может использоваться без каких-либо определенных ограничений до тех пор, пока он безвреден для организма человека и стимулирует рост кости. Примеры агента костного роста, который может использоваться в настоящем изобретении, включают пептиды или нуклеиновые кислоты, которые обеспечивают образование кости, и антагонисты веществ, которые ингибируют образование кости.
Примеры химических добавок, которые используются для формирования заменителя костного трансплантата в настоящем изобретении, включают гиалуроновую кислоту, хондроитин сульфат, альгиновую кислоту, хитозан, коллаген, гидроксиапатит, карбонат кальция, фосфат кальция, сульфат кальция и керамики. В зависимости от вида добавок заменитель костного трансплантата может образовываться в форме геля, стрипс, гранул, пеллет, таблеток, пасты и др.
Сведения, подтверждающие возможность осуществления изобретения
В дальнейшем настоящее изобретение будет описано в дополнительных подробностях со ссылкой на примеры. Однако необходимо понимать, что эти примеры служат только для иллюстративных целей и не интерпретируются для ограничения объема притязаний настоящего изобретения.
Пример 1: Приготовление заменителя костного трансплантата
Стадия предварительной обработки и измельчения
Бычью бедренную кость обрезали до размера 5 см3 с использованием костной пилы. Нарезанные костные куски погружали в деионизированую воду на 24 часа для удаления компонентов крови, присутствующих в кости. Куски кости, промытые деионизированой водой, варили в течение 72 часов при смене деионизированой воды с 12-часовыми интервалами, таким образом, первично удаляя липиды и протеины, присутствующие в костях. Куски кости, из которых липиды и протеины были первично удалены, полностью высушивали в термостате при 60°С в течение 24 часов и затем измельчали до размера менее 0,7 мм с использованием мельницы.
Стадия обезжиривания
К 1 г измельченного костного порошка добавляли 20 мл смешанного растворителя, содержащего хлороформ и метанол (1:1 объем/объем), и раствор встряхивали при скорости вращения 120 rpm в течение 24 часов, так что костный порошок обезжиривался. Для удаления растворителя, оставшегося в обезжиренном костном порошке, добавляли деионизированую воду к костному порошку в массовом соотношении 50:1 и затем раствор встряхивали при 120 rpm в течение 12 часов, таким образом удаляя растворитель, оставшийся в порошке. В это время деионизированую воду заменяли свежей деионизированой водой с 2-часовыми интервалами для повышения эффективности промывания. Промытый костный порошок полностью высушивали в термостате при 60°С.
Стадия депротеинизации
К 1 г измельченного костного порошка добавляли 25 мл раствора 4% (масса/объем) гипохлорита натрия и порошковый раствор встряхивали при скорости вращения 120 rpm в течение 24 часов для удаления протеинов, присутствующих в кости, и для инактивации приона, который вызывает губчатую энцефалопатию крупного рогатого скота. Для удаления растворителя, присутствующего в депротеинизированном костном порошке, добавляли 50 г деионизированой воды к 1 г костного порошка и раствор встряхивали при 120 rpm в течение 72 часов, таким образом, освобождая от гипохлорита натрия, оставшегося в порошке. В это время деионизированую воду заменяли свежей деионизированой водой каждые два часа в первые 12 часов и заменяли свежей деионизированой водой каждые последующие 12 часов. Промытый водой костный порошок полностью высушивали в термостате при 60°C.
Стадия термической обработки
Обезжиренный, депротеинизированный и высушенный костный порошок термически обрабатывали при высокой температуре для удаления липидов и протеинов, оставшихся там. Температура электрической печи, используемой для термической обработки, повышалась при скорости 2°С/мин, и костный порошок термически обрабатывали при 600°C в течение 3 часов с последующим охлаждением в печи.
Стадия фильтрации
Термически обработанный костный порошок фильтровали через фильтр, имеющий размер пор 215-425 мкм, и отфильтрованный костный порошок промывали несколько раз деионизированой водой для удаления мелких частиц, оставшихся на его поверхности, и затем высушивали в термостате при 60°C в течение 24 часов. Высушенный костный порошок собирали и использовали в качестве заменителя костного трансплантата.
Костный порошок, полученный в вышеуказанных стадиях, анализировали с использованием сканирующего электронного микроскопа и, как результат, наблюдали гидроксиапатитные частицы, имеющие размер 50-80 нм, в костном порошке (фиг.1). Также, костный порошок анализировали с помощью XRD и, как результат, могли наблюдать, что в костном порошке образовалась чистая, низкокристаллическая апатитная фаза (фиг.2). Также из результатов анализа FT-IR было подтверждено, что костный порошок являлся низкокристаллическим карбонатапатитом, содержащим карбонатную группу, аналогичным кости человека (фиг.3).
Пример 2: Приготовление композиции для замещения костного трансплантата
К 100 г обессоленной воды добавляли 20 г гиалуроновой кислоты для образования вязкого раствора гиалуроновой кислоты, к которому затем добавляли 10 г костного порошка, приготовленного в примере 1, для получения инъецируемой пасты.
Пример 3: Определение костной проводимости заменителя костного трансплантата
Для оценки костной проводимости заменителя по изобретению костного трансплантата осуществляли определение костной проводимости для заменителя костного трансплантата, приготовленного в соответствии со способом примера 1, и коммерчески доступных костных заменителей Bio-Oss® и OsteoGraf® в качестве контрольных групп. В этом примере использовали новозеландских белых кроликов и формировали циркулярные дефекты, имеющие диаметр 8 мм, в костях черепа животных и затем имплантировали каждым из заменителя костного трансплантата, Bio-Oss® и OsteoGraf®/N гранулами. На 2 неделе и 4 неделе после имплантации приготавливали образцы ткани и проводили сравнительный анализ на костную проводимость на основании объема кости, образованного вокруг каждого заменителя костного трансплантата, и образования или отсутствия соединительных тканей.
В результате, в тестируемых образцах, приготовленных на 2 неделе после имплантации трех заменителей кости, только соединительная ткань образовалась вокруг участков, имплантированных Bio-Oss® и OsteoGraf®/N, и образование новых костей с трудом наблюдалось вокруг имплантированных участков (фиг.4). С другой стороны, как показано на фиг.4(c), можно видеть, что образец, имплантированный заменителем костного трансплантата, приготовленного в примере 1, имел большее количество новых костей, образованных в нем (см. стрелку на фиг.4(c)).
Фиг.5 показывает фотографии образцов ткани, образованных на 4 неделе после имплантации тремя заменителями кости. Как показано на фиг.5, в образцах ткани, имплантированных Bio-Oss® и OsteoGraf®/N, образовалось очень небольшое количество новых костей и преимущественно окруженных соединительными тканями, и, с другой стороны, в образцах ткани, имплантированных заменителем костного трансплантата, приготовленного в примере 1, большое количество новых костей было образовано и наращено вокруг заменителя костного трансплантата. Это предполагает, что заменитель костного трансплантата, приготовленный в соответствии с настоящим изобретением, имеет прекрасную костную проводимость по сравнению с таковой предшествующих заменителей костного трансплантата.
Промышленная применимость
Как описано выше, настоящее изобретение обеспечивает способ приготовления свободного от приона заменителя костного трансплантата, содержащий обработку бычьей кости раствором гипохлорита натрия и представление обработанной кости высокотемпературной обработке, а также композицию, содержащую указанный заменитель костного трансплантата. Заменитель по изобретению костного трансплантата не вызывает иммунного ответа, поскольку он приготовлен путем эффективного удаления липидов и органических растворителей из бычьей кости, имеющей структуру, схожую со структурой кости человека. Также он имеет отличную костную проводимость, свободен от прионов и, следовательно, не имеет риска заражения губчатой энцефалопатией крупного рогатого скота. Согласно настоящему изобретению заменитель костного трансплантата, имеющий такие преимущества, может быть приготовлен аналогичным образом.
Хотя настоящее изобретение описано подробно со ссылками на специфические признаки, для специалиста в данной области очевидно, что данное описание представляется только для предпочтительного воплощения и не ограничивает объем настоящего изобретения. Таким образом, действительный объем настоящего изобретения будет определяться приведенной формулой изобретения и ее эквивалентами.

Изобретение относится к области медицины, более конкретно к способу приготовления свободного от прионов заменителя костного трансплантата из бычьей кости, включающему обработку костного порошка, полученного из бычьей кости, раствором гипохлорита натрия и последующую термическую обработку костного порошка при 600-1000°С. Изобретение обеспечивает заменитель костного трансплантата, не вызывающий иммунного ответа, имеющий высокую костную проводимость, а также исключающий риск заражения губчатой энцефалопатией крупного рогатого скота. 2 н. и 8 з.п. ф-лы, 5 ил.
1. Способ приготовления свободного от прионов заменителя костного трансплантата из бычьей кости, включающий следующие стадии:
(a) кипячение бычьей кости, из которой удалены компоненты крови, в деионизированой воде для удаления липидов и протеинов, и высушивание сваренной кости;
(b) измельчение высушенной кости, погружение и перемешивание перемолотого костного порошка в органическом растворителе;
(c) удаление органического растворителя и высушивание костного порошка;
(d) обработка высушенного костного порошка, из которого удален растворитель, раствором 2-20% гипохлорита натрия;
(e) удаление раствора гипохлорита натрия из костного порошка и высушивание результирующего костного порошка; и
(f) термическая обработка высушенного костного порошка при 600-1000°С в течение 1-6 ч для полного удаления липидов и протеинов.
2. Способ по п.1, в котором органический растворитель представляет смешанный растворитель из хлороформа и метанола.
3. Способ по п.1, в котором концентрация гипохлорита натрия составляет около 4% (масса/объем).
4. Способ по п.1, в котором стадия (d) дополнительно включает добавление 1-10 N гидроксида натрия к раствору гипохлорита натрия.
5. Способ по п.4, в котором концентрация гидроксида натрия составляет около 2N.
6. Способ по п.1, который за стадией (f) дополнительно включает стадию просеивания термически обработанного костного порошка через фильтр, имеющий размер пор 212-425 мкм; и промывание отфильтрованного костного порошка.
7. Композиция для замещения костного трансплантата, содержащая заменитель костного трансплантата, приготовленный способом по любому из пп.1-6.
8. Композиция по п.7, которая дополнительно содержит, по меньшей мере, одно биологически активное вещество, выбранное из группы, состоящей из фактора, стимулирующего рост кости, фибрина, костного морфогенетического фактора, агента роста кости, хемотерапевтического агента, антибиотика, анальгетика, дифосфоната, соли стронция, соли фтора, соли магния и соли натрия.
9. Композиция по п.7 или 8, которая дополнительно содержит, по меньшей мере, одно химическое соединение, выбранное из группы, состоящей из гиалуроновой кислоты, хондроитин сульфата, альгиновой кислоты, хитозана, коллагена, гидроксиапатита, карбоната кальция, фосфата кальция, сульфата кальция и керамик.
10. Композиция по п.9, в которой химическое соединение представляет гиалуроновую кислоту, изготовленную в виде пасты.
| US 2006014283 A1, 19.01.2006 | |||
| US 5167961 A, 01.12.1992 | |||
| US 5417975 A, 23.05.1995 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ АКТИВИЗАЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 1993 |
|
RU2088240C1 |
Авторы
Даты
2010-07-10—Публикация
2006-05-12—Подача