Представленное изобретение предусматривает ингаляционное применение производных метилксантина, в частности теофиллина, и стероидных лекарственных средств в синергической комбинации для производства лекарственного средства, используемого при лечении хронических респираторных заболеваний, в частности хронической обструктивной болезни легких (ХОБЛ). Использование метилксантина и стероида в комбинации, вводимой ингаляционным путем в легкие, приводит к лечебной синергической противовоспалительной реакции.
Введение
Теофиллин - это недорогой белый кристаллический порошок, используемый как оральное средство при хронических респираторных заболеваниях, в частности бронхиальной астме и ХОБЛ. Аминофиллин или теофиллин-этилендиамин представляет собой комбинацию теофиллина и этилендиамина, обладая сходными с обоими препаратами свойствами. Известно, что теофиллин обладает бронхорасширяющим эффектом и умеренным противовоспалительным эффектом, что отчасти связано с его активностью в качестве слабого неизбирательного ингибитора фосфодиэстеразы (ФДЭ). До настоящего времени это лекарственное средство, которое характеризовалось узким спектром терапевтического применения и токсичностью, проявлявшейся желудочно-кишечным расстройством, тремором, сердечными аритмиями и другими осложнениями, довольно широко используется в клинической практике. Для исключения этих неблагоприятных побочных эффектов при хронических респираторных заболеваниях вместо орального теофиллина часто назначают другие лекарственные средства, в частности ингаляционные бета-агонисты, ингаляционные антихолинергические средства и ингаляционные стероиды. Однако до сих пор было проведено очень мало исследований, посвященных изучению терапевтического потенциала ингаляционного теофиллина при лечении хронических респираторных заболеваний, в частности ХОБЛ и бронхиальной астмы.
Хотя теофиллин используется в клинической практике уже много лет, молекулярный механизм и место его действия в организме остаются неизвестными. Было предложено несколько молекулярных механизмов действия теофиллина, включая следующий.
Теофиллин - это слабый и неизбирательный ингибитор фосфодиэстераз, разрушающих циклические нуклеотиды в клетках, что приводит к увеличению концентраций внутриклеточного циклического АМФ и ГМФ. Теофиллин расслабляет гладкую мускулатуру дыхательных путей за счет угнетения активности ФДЭ (ФДЭ3, ФДЭ4 и ФДЭ5), но для максимального расслабления нужны относительно высокие концентрации (Rabe, et al., Eur Respir J 1999, 8:637-42). В терапевтически приемлемых концентрациях теофиллин ингибирует ФДЭ очень незначительно. Нет никаких данных о том, что теофиллин обладает избирательностью в отношении какого-либо изофермента, в частности ФДЭ4В, преобладающе изофермента ФДЭ в воспалительных клетках, опосредующего противовоспалительные эффекты в дыхательных путях.
Теофиллин способствует увеличению выброса интерлейкина-10, обладающего широким спектром противовоспалительных эффектов. Эти эффекты могут быть опосредованы ингибированием ФДЭ, хотя оно и не наблюдается при использовании тех доз, которые дают лечебный эффект при астме (Oliver, et al. Allergy 2001, 56: 1087-90).
Теофиллин препятствует перемещению провоспалительного фактора транскрипции, ядерного фактора κB (NF-κB) в ядро, что потенциально снижает экспрессию воспалительных генов при астме и ХОБЛ (Tomita, et al. Strategies 1999(359): 249-55). Эти эффекты наблюдаются при высоких концентрациях и также могут быть опосредованы ингибированием ФДЭ. Таким образом, вполне вероятно, что ингибирование ФДЭ не является механизмом действия теофиллина при его использовании в низких оральных дозах (<10 мг/л).
Теофиллин также является мощным ингибитором рецепторов аденозина в терапевтической концентрации с антагонизмом к рецепторам A1 и A2, хотя он менее эффективен против рецепторов типа A3 (Pauwels & Joos, Arch Int Pharmacodyn Ther 1995, 329: 151-60). Имеется сообщение о том, что ингаляционная монотерапия теофиллином может вступать в антагонизм с бронхосуживающим эффектом ингаляций аденозина у астматиков (Cushley et al., Am Rev Resp Disease 1984,129, 380-4). В дополнение к этому было установлено, что ингалируемый теофиллин (в виде аминофиллина) действует на больных с астмой как бронходилататор (Kokubu H. Arerugi. 1995, 44(12): 1379-86).
Кроме того, относительно недавно было установлено, что теофиллин активирует гистоновую диацетилазу (HDAC). Ацетилирование гистоновых протеинов связано с активацией функции гена, и принято считать, что факторы провоспалительной транскрипции, активирующие воспалительные гены, также вызывают увеличение активности гистоновой ацетилтрансферазы. Увеличивая активность HDAC, способствующую дезацетилированию гистоновых протеинов, теофиллин, по мнению исследователей, подавляет экспрессию воспалительных генов (см. Barnes PJ, Am J Respir Crit Care Med, 2003, 167:813-818). Считается, что теофиллин на молекулярном пути метаболизма взаимодействует с ключевой регуляторной киназой или ферментом фосфатазой, что приводит к повышению активности HDAC, хотя этот вопрос еще предстоит выяснить.
Минимальная, но достаточно значимая противовоспалительная активность теофиллина была продемонстрирована при оральной монотерапии у больных с ХОБЛ при использовании таких доз теофиллина, которые обусловливают его уровень в плазме ≤10 мг/л, но ≥5 мг/л (Culpitt et al., Am. J. Respir. Crit Care Med, 2002, 165(10): 1371-1376, Kobayashi et al., Respirology 2004, 9: 249-254).
Глюкокортикоидные лекарственные средства (стероиды) стали терапией выбора при астме и широко используются при лечении ХОБЛ, обычно в форме ингаляций. Ингаляционные стероиды обычно применяют один или два раза в день в фиксированной дозе, зависящей от свойств стероидного препарата. Например, для будесонида типичные дозы составляют 200 мкг, 400 мкг или 800 мкг один или два раза в день. Для флутиказона типичные дозы составляют 50 мкг, 100 мкг, 250 мкг или 500 мкг один или два раза в день. Для циклесонида типичные дозы составляют 80 мкг, 160 мкг или 320 мкг один или два раза в день. Абсолютная доза, попадающая в легкие, зависит от многих факторов, включая свойства используемого стероида, характеристики устройства для ингаляций, рецептуру ингаляционного лекарственного средства, особенности конкретного больного и методику ингаляции, но в норме эти факторы оказывают значительно меньшее влияние по сравнению с общей введенной дозой препарата.
Однако, хотя ингаляционные стероиды эффективны для большинства больных с астмой, их использование при ХОБЛ спорно из-за отсутствия противовоспалительного эффекта в образцах мокроты (Keatings et al., Am. J. Respir. Crit Care Med, 1997, 155(2): 542-8, Culpitt et al., Am. J. Respir. Crit Care Med-1999, 160, 5(1): 1635-1639, Loppow et at., Respir. Med. 2001, 95(2): 115-121) и их кажущейся неспособности влиять на развитие заболевания (Burge, et al (2000). BMJ 320: 1297-1303). Другие исследования, в которых изучалась мокрота, привели к предположению о том, что более длительные периоды лечения, особенно с использованием высоких доз ингаляционных стероидов, действительно производят у части больных поддающиеся измерению, но минимальные противовоспалительные эффекты (Confalonieri et al., Thorax, 1998, 53(7): 583-585, Mirici et al., Clinical Drug Investigation. 2001, 21:835-842, Yildiz et al., Respiration. 2000, 67:71-76).
Однако оценка противовоспалительной активности при исследовании материалов, полученных при бронхиальной биопсии, а не мокроты, также дала неутешительные результаты. В отличие от того, что было продемонстрировано на больных с астмой, Hattatowa et al. (Am J Respir Crit Care Med. 2002, 165:1592-1596) не выявили значительного снижения численности ключевых воспалительных клеток у больных ХОБЛ после трех месяцев лечения ингаляционными стероидами (500 мкг флутиказона два раза в день). Несмотря на минимальную общую противовоспалительную активность в легких ингаляционные кортикостероиды действительно снижают частоту обострений у больных ХОБЛ на 20-30%.
Вполне вероятно, что улучшение этой минимальной легочной противовоспалительной активности ингаляционных стероидов принесет больным с ХОБЛ большую пользу, заключающуюся в улучшении состояния здоровья, улучшении легочной функции, улучшении показателей диспноэ и дополнительном снижении частоты обострений.
Больным с астмой, не реагирующим на низкие дозы стероидов, назначают более высокие дозы, например для будесонида доза может быть повышена до 1600 мкг в день. В работе Evans et al., (2004) NEJM 337:1412, высказано предположение о том, что высокие дозы ингаляционных стероидов для больных с астмой можно заменить нормальными дозами глюкокортикоидов в сочетании с низкой дозой орального теофиллина. Больным назначали 400 мкг будесонида (стандартная доза) вместе с 250 или 375 мг теофиллина или 800 мкг будесонида в комбинации с плацебо два раза в день. Концентрации теофиллина в плазме, достигнутые в этом исследовании, составляли от 2,5 до 17,1 мг/л при среднем значении 8,7 мг/л. Эффекты обоих вариантов лечения оказались сходными, а это наводило на мысль о том, что теофиллин при совместном применении со стероидом дает эффект экономии дозы. Однако при тех дозах лекарственных средств, которые были использованы в этом исследовании, у больных отмечались побочные эффекты, включая желудочно-кишечные расстройства, усиленное сердцебиение, фарингит, а также другие побочные эффекты, связанные с лечением стероидами и/или теофиллином. Авторы не обнаружили никаких эффектов комбинации лекарственных средств в отношении воспаления. Аналогичных исследований по изучению возможного эффекта экономии дозы ингаляционных стероидов при назначении орального теофиллина на больных с ХОБЛ пока не проводилось.
В работе Cazzola et al, (2004) Pulm Pharm Ther 17:141-145, проводилось сравнение комбинации бронходилататора сальметерола и стероида флутиказона с комбинацией орального теофиллина и ингаляционного флутиказона (500 мкг два раза в день) при лечении больных с ХОБЛ в течение 4 месяцев. Дозу орального теофиллина титровали до достижения концентрации в плазме 10-20 мг/л, который необходим для клинически эффективной бронходилатации. Воспалительный статус у этих больных не изучали ни при одном из вариантов терапии.
Патент US20030134865 раскрывает метод скрининга для идентификации лекарственно-подобных соединений, которые можно использовать при лечении астмы или других воспалительных заболеваний. Он включает ксантин или родственное соединение, используемое для модуляции активности или экспрессии HDAC. Это изобретение описывает роль стероидов в репрессии воспалительных генов. Оно предсказывает, что теофиллин должен усиливать действие глюкокортикоидов, придавая им способность задействовать HDAC с повышенной активностью. Теофиллин используют in vitro для синергического эффекта со стероидами дексаметазоном и будесонидом в целях усиления клеточной активности HDAC и репрессии воспалительных генов.
Патент US6025360 раскрывает использование теофиллина в качестве дополнительной терапии или для полной либо частичной замены кортикостероидов при хроническом, профилактическом, противовоспалительном лечении астмы с обеспечением уровня в плазме в стабильной фазе от 1 до менее 5 мг/л. Указанный уровень в плазме достигается при использовании теофиллина в оральных формах в дозе от 50 до 600 мг в день.
В публикации Barnes (Am J Respir Crit Care Med, 2003, 167:813-818) обсуждается использование теофиллина и стероидов в комбинации при лечении ХОБЛ и высказывается предположение о том, что эта комбинация обладает синергическим эффектом в снижении воспаления. Однако в этой работе не предлагается ни схема дозирования препаратов, ни использование теофиллина посредством ингаляций.
Для ясности в таблице 1 представлена сводка известных данных в отношении назначаемых оральных доз метилксантинов и соответствующего уровня теофиллина в плазме, определяемого у больных.
Для ясности в таблице 2 представлена сводка ограниченных данных в отношении назначаемых ингаляционных доз метилксантинов и соответствующего уровня теофиллина в плазме, определяемого у больных с астмой.
Bull. Eur. Physiopathol. Respir., 16(1): 13-24.
Таким образом, существует медицинская потребность в схеме медикаментозной терапии при ХОБЛ, которая обеспечит достаточную противовоспалительную активность и позволит избежать побочных эффектов, присущих современным методам лечения. Комбинация ингаляционного теофиллина с ингаляционным стероидом в производстве лекарственного средства раскрыта в находящейся на одновременном рассмотрении международной патентной заявке PCT/GB05/003039 авторов настоящего изобретения, но пока не описана в доступных литературных публикациях. Такое лекарственное средство обеспечивает комбинированную терапию при ХОБЛ и других хронических респираторных заболеваниях, которая способна повысить легочную противовоспалительную активность ингаляционного стероида. Такая ингаляционная комбинация дает минимальный системный контакт с метилксантином (уровень в плазме менее 1 мг/л), что придает ей намного более привлекательный профиль побочных эффектов по сравнению с хроническим оральным введением этих лекарственных средств.
Краткое описание изобретения
Авторы представленного изобретения определили, что стероиды, введенные в организм вместе с соединениями метилксантина ингаляционным способом в таких дозах, которые по отдельности неэффективны при лечении воспаления, индуцированного табачным дымом (ТД) на животной модели ХОБЛ, проявляют синергический эффект и способны значительно ослабить воспаление на упомянутых моделях, в частности, на 44% и более в тестах, описанных ниже. Воздействие ТД широко признано как главная причина ХОБЛ у человека.
Поэтому в первом аспекте данное изобретение предлагает использование метилксантинового соединения и стероида в производстве лекарственного состава для лечения хронического респираторного заболевания, выбранного из группы, в состав которой входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма человека, причем упомянутый лекарственный состав вводят в организм ингаляционным способом для его доставки в легкие, а метилксантиновое соединение вводят в суточной дозе от 0,1 до 25 мг.
Преимущественным образом ингаляционный стероид вводят в такой дозе, которая, взятая в отдельности, неэффективна для снижения воспаления, связанного с упомянутым респираторным заболеванием. Ингаляционный стероид можно также вводить в такой дозе, которая, взятая в отдельности, проявляет минимальную эффективность в отношении улучшения функции легких и уменьшения воспаления при лечении упомянутого респираторного заболевания.
Данное изобретение также предлагает использование ингаляционной комбинации, в которой ингаляционный стероид вводят в более низкой дозе по сравнению с изолированным применением стероида, причем такая комбинация проявляет значительную эффективность в отношении улучшения легочной функции и снижения воспаления при лечении упомянутого респираторного заболевания (экономия стероида).
Улучшение этой минимальной легочной противовоспалительной активности ингаляционных стероидов (таких как будесонид, флутиказон или циклесонид) при их использовании в комбинации с ингаляционным метилксантином (в частности, теофиллином) приносит значительную пользу больным, страдающим хроническими респираторными заболеваниями, например ХОБЛ, приводя к улучшению их общего состояния здоровья, улучшению функции легких, уменьшению одышки и снижению частоты обострений.
В данном изобретении открывается и используется синергическая активность при взаимодействии между метилксантиновым соединением и стероидными лекарственными средствами, приводящая к исключительно высокой легочной противовоспалительной активности. Эта синергия может быть достигнута при использовании лекарственных средств в таких дозах, которые неэффективны, если те же лекарственные средства используются поодиночке. Эффект комбинации не аддитивен, а синергичен в том отношении, что два лекарственных средства, которые поодиночке вообще не проявляют эффекта или проявляют слабый эффект, могут применяться одновременно и давать высокозначимое подавление воспалительной реакции в организме.
Под метилксантиновым соединением, используемым в данном изобретении, подразумевается теофиллин и фармакологически эквивалентные соединения и соли, включая аминофиллин и окстрифиллин. Такими соединениями являются метилксантины, включая кофеин, ацепифиллин, бамифиллин, буфиллин, кафаминол, кафедрин, дипрофиллин, дигидроксипропилтеофиллин, доксофиллин, энпрофиллин, этамифиллин, этофиллин, проксифиллин, суксамидофиллин, теобромин, фурафиллин, 7-пропил-теофиллин-допамин, пентоксифиллин, репротерол, денбуфиллин, IBMX, арофиллин, ципамфиллин, HWA 448, SDZ MKS 492, BB-1502 и т.п.
Стероидные лекарственные средства включают глюкокортикоиды, кортикостероиды и минералокортикоиды, в частности дексаметазон и будесонид, беклометазон, беклометазон дипропионат, флунизолид, флутиказон, циклесонид, мометазон, гидрокортизон, преднизон, преднизолон, метил преднизолон, нафлокорт, дефлазакорт, галопредон ацетат, флуоцинолон ацетонид, флуоцинонид, клокортолон, типредан, предникарбат, алклометазон дипропионат, галометазон, римексолон, депродон пропионат, триамсинолон, бетаметазон, флудрокоритизон, дезоксикортикостерон, рофлепонид, этипренднол диклоацетат и т.п. Стероидные лекарственные средства дополнительно могут включать стероиды для лечения респираторных заболеваний, находящиеся на клинической или доклинической стадии разработки, в частности, GW-685698, GW-799943, NCX-1010, NCX-1020, NO-дексаметазон, PL-2146, NS-126 (ранее ST-126), также соединения, упоминаемые в международных патентных заявках WO0212265, WO0212266, WO02100879, WO03062259, WO03048181 и WO03042229. Стероидные лекарственные средства также дополнительно могут включать молекулы следующего поколения на стадии разработки с улучшенным профилем побочных эффектов, в частности селективные агонисты глюкокортикоидных рецепторов (САГР), включая ZK-216348 и соединения, упоминаемые в международных патентных заявках WO-00032585, WO-000210143, WO-2005034939, WO-2005003098, WO-2005035518 и WO-2005035502.
Предпочтительный метилксантин представляет собой теофиллин.
Предпочтительный стероид представляет собой будесонид, флутиказон или циклесонид.
В соответствии с изобретением стероид может вводиться в стандартной дозе или в такой дозе, которая давала бы минимальный эффект при введении больному без метилксантинового соединения.
Преимущественно, стероид неэффективен в снижении воспаления при упомянутом респираторном заболевании, если используется в упомянутой дозе один. Некоторые респираторные заболевания, включая ХОБЛ, не поддаются лечению стероидами, а стероидные лекарственные средства минимально эффективны в снижении воспаления в легких. Однако при совместном применении с метилксантиновым соединением, в частности теофиллином, наблюдается противовоспалительный эффект в легких.
Введение лекарственных средств осуществляется посредством ингаляции, что дает больному дополнительное удобство, заключающееся в возможности получать целевые дозы ингаляционных лекарственных средств (метилксантинового соединения и стероида) без бронходилататора длительного действия из одного и того же устройства. В типичном варианте бронходилататор длительного действия - это либо бета-агонист с длительным эффектом, например сальметерол или формотерол, или противомускариновый агент, например тиотропиум. Стероид также можно вводить в организм оральным путем, тогда как метилксантиновое соединение всегда вводят посредством ингаляции.
Комбинации изобретения могут по выбору включать одно или более дополнительных активных веществ, заведомо полезных при лечении респираторных заболеваний, в частности ингибиторы ФДЭ4, ингибиторы ФДЭ5, ингибиторы ФДЭ7, ингибиторы лейкотриена D4, ингибиторы лейкотриена B4, ингибиторы egfr-киназы, ингибиторы p38 MAP киназы, ингибиторы пути NF-κB, в частности, ингибиторы IκK, агонисты рецепторов аденозина A2A, сигнальные ингибиторы TNFα (в частности, агенты связывания лиганда, антагонисты рецепторов), сигнальные ингибиторы интерлейкина-1, антагонисты рецепторов CRTH2, ингибиторы протеаз (в частности, ингибиторы нейтрофилэластазы, ингибиторы MMP, ингибиторы катепсина), сигнальные молекулы IL-8, ингибиторы CXCR1, ингибиторы CXCR2, модуляторы iNOS, агонисты PPAR, антиоксиданты (включая N-ацетилцистеин и миметики супероксиддисмутазы) и/или антагонисты рецепторов NK-1.
В другом аспекте данное изобретение предлагает фармацевтический состав, включающий метилксантиновое соединение и стероид для использования при лечении хронического респираторного заболевания, выбранного из группы, в состав которой входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма; причем упомянутый лекарственный состав адаптирован для введения в организм ингаляционным способом с целью его доставки в легкие, а метилксантиновое соединение вводится в суточной дозе от 0,1 до 25 мг.
Кроме того, данное изобретение предлагает метилксантиновое соединение и стероид для совместного, одновременного (по отдельности) или последовательного введения в организм с целью лечения хронического респираторного заболевания, выбранного из группы, в состав которой входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма, причем упомянутый лекарственный состав адаптирован для введения в организм ингаляционным способом с целью его доставки в легкие, а метилксантиновое соединение вводится в суточной дозе от 0,1 до 25 мг.
В предпочтительном варианте метилксантиновое соединение вводится в лекарственный состав в количестве от 0,1 до 25 мг или от 0,05 до 13 мг, или от 0,033 до 9 мг на разовую дозу состава, причем упомянутые разовые дозы используются для лечения один раз в день, два раза в день или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 1 до 24 мг, 23 мг, 22 мг, 21 мг или 20 мг. Например, суточная доза может составлять 5, 10, 15, 16, 17, 18 или 19 мг. Разовые дозы могут быть рассчитаны с учетом приема лекарственных средств один, два или три раза в день.
В предпочтительном варианте метилксантиновое соединение представляет собой теофиллин. Теофиллин преимущественно назначают в таких дозах, которые указаны выше.
Другие метилксантины, кроме теофиллина, можно назначать в указанных выше дозах или в таких дозах, которые могут быть адаптированы исходя из упомянутых доз специалистом, компетентным в данной области.
Стероид можно назначать, в целом, в дозах приблизительно от 40 мкг до 1600 мкг, применяя его или в разовой суточной дозе или в нескольких дробных дозах, которые суммарно соответствуют упомянутой дозе. Например, стероид можно назначать в суточной дозе 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 750, 800, 900 или 1000 мкг.
В предпочтительном варианте стероид - это будесонид, который назначают в дозе от 200 до 1600 мкг или от 100 до 800 мкг, или от 65 до 525 мкг на разовую дозу лекарственного состава, причем упомянутые разовые дозы используются для лечения один раз в день, два раза в день или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 200 мкг до 1600, 1500, 1400, 1300, 1200, 1100 или 1000 мкг. Например, суточная доза составляет 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850 или 900 мкг. Разовые дозы можно рассчитать с учетом приема лекарственных средств один, два или три раза в день.
В другом варианте стероид это флутиказон, который вводят в лекарственный состав в количестве от 44 до 1000 мкг или от 22 до 500 мкг, или от 15 до 335 мкг в расчете на разовую дозу, которая используется в схеме лечения с приемом лекарственного средства один, два или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 44 мкг до 900, 880, 800, 700, 660, 600 или 500 мкг, например, доза может составлять 50, 60, 88, 100, 110, 125, 150, 200, 220, 250, 300, 350, 375, 400, 440 или 450 мкг. Разовые дозы можно рассчитать с учетом приема лекарственного средства один, два или три раза в день.
Кроме того, в качестве стероида может использоваться циклесонид, который вводят в лекарственный состав в количестве от 40 до 500 мкг или от 20 до 250 мкг, или от 17 до 170 мкг в расчете на разовую дозу, которая используется в схеме лечения с приемом лекарственного средства один, два или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 40 мкг до 480, 450, 400, 350, 320 или 300 мкг, например, доза может составлять 80, 100, 120, 150, 160, 200 или 250 мкг. Разовые дозы можно рассчитать из расчета приема лекарственного средства один, два или три раза в день.
Такие разовые дозы можно упаковать, составляя набор для лечения упомянутого респираторного заболевания, включающий метилксантиновое соединение и стероид в виде разовых доз, причем лекарственный состав вводят в организм посредством ингаляции для его доставки в легкие. Например, набор в соответствии с данным изобретением может представлять собой смесь метилксантинового соединения и стероида в правильном соотношении для одновременного введения. В альтернативных вариантах отдельные компоненты лекарственного состава могут использоваться самостоятельно для раздельного (одновременного или последовательного) введения.
В наиболее предпочтительном варианте метилксантиновое соединение и стероид используются в виде ингалятора для их введения в организм ингаляционным способом. Ингалятор может представлять собой объединенный баллон, в котором компоненты находятся в виде смеси, или спаренный баллон с раздельными компонентами, ингаляция которых происходит одновременно.
Такой набор может сопровождаться, например, инструкциями по применению, которые наставляют пользователя вдыхать оба компонента практически одновременно, чтобы они попадали в организм больного, особенно в его/ее легкие в одно и то же время.
В соответствии с изобретением в упомянутых наборах или разовых дозах стероид преимущественно представлен в такой дозе, которая недостаточна для лечебного эффекта при лечении только этим препаратом.
Важно отметить, что уровень активного вещества в плазме, достигаемый при использовании упомянутых доз метилксантинового соединения, в частности теофиллина (общая суточная доза 0,1-25 мг), бывает ниже того уровня, который в настоящее время считается необходимым для нужного клинического эффекта (10-20 мг/л) (Cazzola et al, Pulmonary Pharmacology & Therapeutics, 2004, 17, 141-145), и ниже того уровня, при котором удается продемонстрировать противовоспалительную активность (5 мг/л) (Culpitt et al., Am. J. Respir. Crit Care Med, 2002, 165(10): 1371-1376, Kobayasbi et al., Respirology, 2004, 9:249-254). Номинальная доза, которая попадает в легкие, может превышать эту цифру в зависимости от характеристик устройства и конкретного используемого лекарственного состава, однако изобретение предусматривает, что эффективная доза, приводящая к уровню метилксантина в плазме от 1 пг/л до 1 мг/л через 1 час после введения лекарственного средства, достаточна для лечения упомянутых респираторных заболеваний, если метилксантиновое соединение вводится в организм посредством ингаляции для доставки в легкие в комбинации со стероидным лекарственном средством.
Предпочтительный уровень метилксантинового соединения в плазме, который достигается так, как это описано выше, находится в диапазоне от 1 мкг/л до 1 мг/л, преимущественно 100 мкг/л - 1 мг/л, 250 мкг/л - 1 мг/л, 500 мкг/л - 1 мг/л или 750 мкг/л - 1 мг/л. В преимущественном варианте он составляет 950 мкг/л или менее, 900 мкг/л или менее, 850 мкг/л или менее либо 800 мкг/л или менее.
В вышеупомянутых аспектах изобретения дозировка стероида, которая не вызывает какого-либо заметного фармакологического эффекта на животной модели ХОБЛ, преимущественно составляла менее 0,5 мг/кг, предпочтительно - от 0,1 до 0,4 мг/кг, наиболее предпочтительно - от 0,1 до 0,3 мг/кг. В преимущественном варианте доза стероида составляет 0,1 мг/кг или менее.
Кроме того, изобретение обеспечивает способ лечения хронического респираторного заболевания, выбираемого из группы болезней, в которую входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма, а суть этого способа заключается во введении больному человеку лекарственного состава, соответствующего вышеупомянутым аспектам изобретения.
В соответствии с изобретением эффективность лечения может быть проанализирована с использованием любой методики, способной оценивать воспаление. В предпочтительном варианте лечение респираторного заболевания оценивают путем подсчета клеток, восстановленных в бронхоальвеолярном смыве (БАС). Воспаление также можно оценивать в мокроте или в материале, полученном при биопсии бронхиального эпителия (Rutgers et al., Eur. Respir. J., 2000, 15(1):109-15). Возможна также и неинвазивная оценка легочного воспаления, которую осуществляют по методике позитронной эмиссионной томографии и поглощения
18F-фтордезоксиглюкозы (Jones et al., Eur. Respir. J., 2003, 21: 567-573).
Предпочтительно, легочные клетки выбираются из группы, в которую входят макрофаги, нейтрофилы и лимфоциты.
Данное изобретение способно значительно снижать воспаление при респираторных заболеваниях. Количество клеток при ингаляционном лечении метилксантиновым соединением и стероидом преимущественно снижается на 40% или более, предпочтительно на 44%, 50%, 60% или более.
В то же время индивидуальные дозы метилксантинового соединения и стероида, если оценивать их эффекты аддитивно, преимущественно могут снизить количество клеток в целом на 31% или менее, предпочтительно на 30% или менее, а в идеальном варианте на 20% или менее. С другой стороны, синергическое уменьшение количества клеток при совместном введении метилксантинового соединения и стероида составляет 40% или более, предпочтительно 44% и в идеальном варианте 50% или более, тогда как аддитивный эффект индивидуальных агентов предпочтительно составляет 31% или менее, а в преимущественном варианте 20% и менее.
Краткое описание чертежей
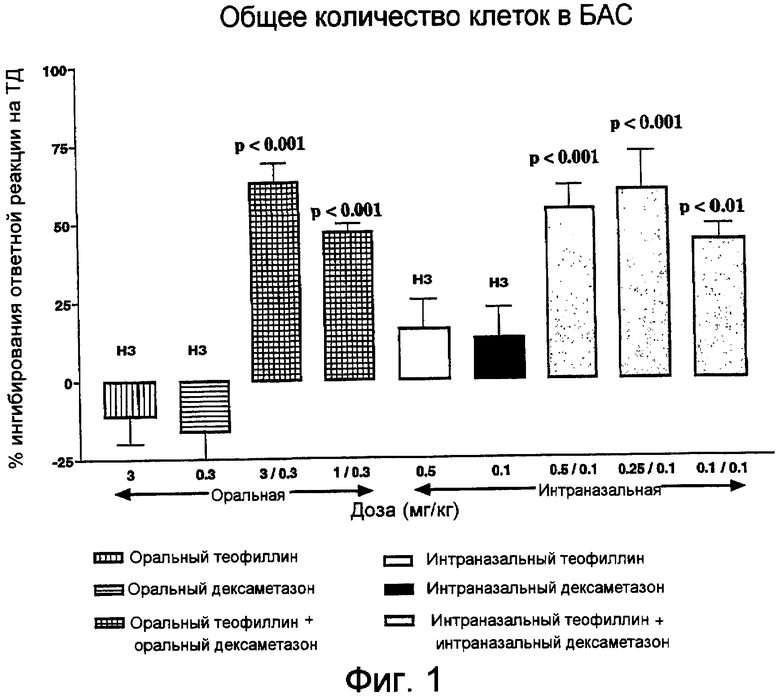
Фиг.1. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на общее количество клеток, восстанавливаемых в БАС через 24 часа после последнего контакта.
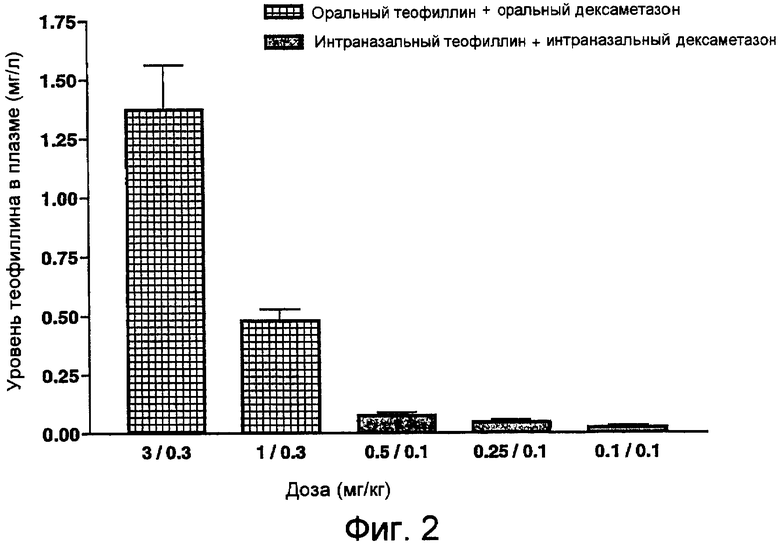
Фиг.2. Уровень теофиллина в плазме через 1 час после орального или интраназального введения в комбинации с дексаметазоном мышам, контактировавшим с ТД.
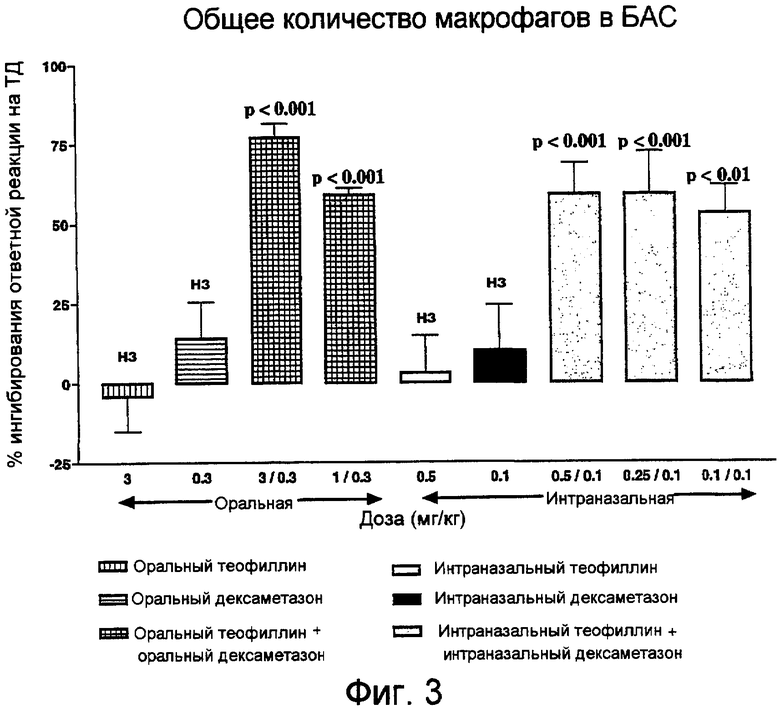
Фиг.3. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на количество макрофагов, восстанавливаемых в БАС через 24 часа после последнего контакта.
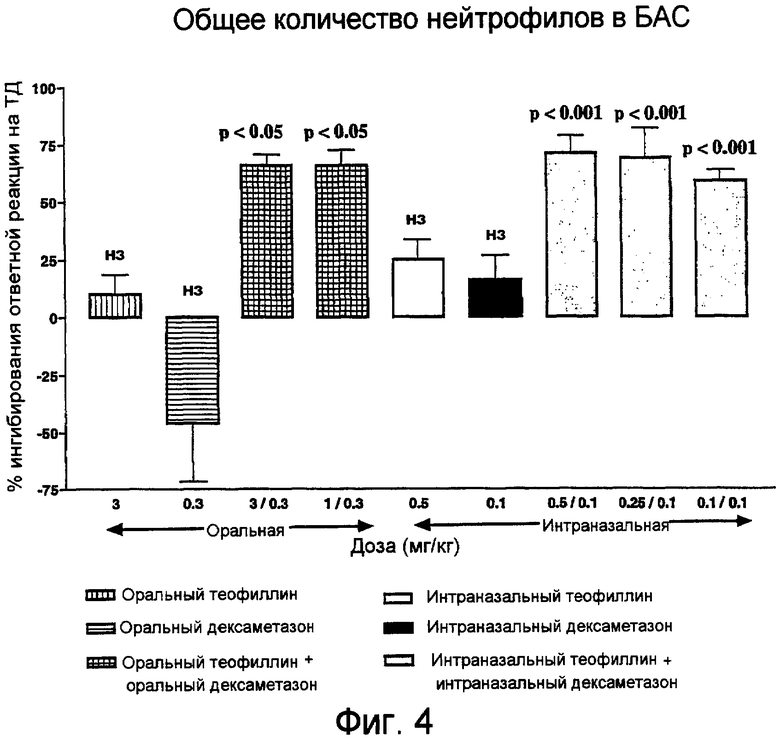
Фиг.4. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на количество нейтрофилов, восстанавливаемых в БАС через 24 часа после последнего контакта.
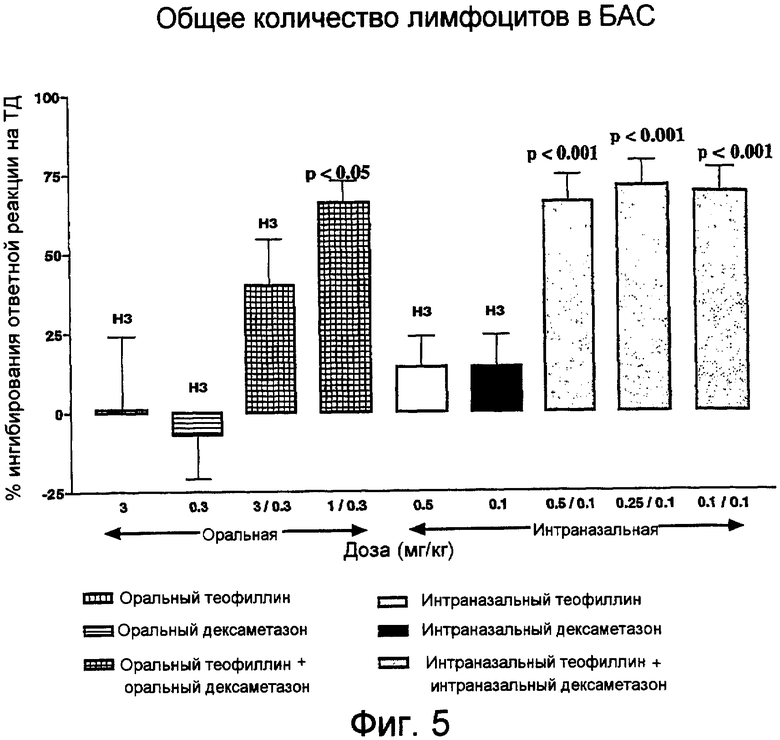
Фиг.5. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на количество лимфоцитов, восстанавливаемых в БАС через 24 часа после последнего контакта.
Подробное описание изобретения
Данное изобретение использует стандартные методики фармакологии и биохимии, как это описано ниже с большими подробностями. В контексте изобретения некоторые термины имеют следующее специальное значение.
Изобретение описывает введение теофиллина и стероидных лекарственных средств в комбинации и противопоставляет комбинированное введение индивидуальному введению упомянутых лекарственных средств по отдельности. Таким образом, словосочетание "по отдельности" означает введение теофиллина без стероида (или наоборот) независимо от того, вводится ли стероид до теофиллина, параллельно с ним или после него. Изобретение проводит грань между применением теофиллина и стероида таким образом, что они проявляют свою фармакологическую активность в целевом организме одновременно или порознь.
"Комбинированное применение" или "комбинацию" в контексте данного изобретения необходимо понимать в том смысле, что индивидуальные компоненты могут вводиться в организм совместно (в виде комбинированного лекарственного средства), по отдельности, но почти одновременно (например, отдельными дозами) или вслед друг за другом (подряд или с подходящим интервалом по времени, при том условии, что оба средства будут активны в организме субъекта в одно и то же время).
Термин "эффективность" применительно к лечению воспалительных состояний и/или респираторного заболевания означает получение позитивного результата в анализе, при помощи которого измеряется воспаление при респираторном заболевании. Предпочтительным анализом считается подсчет клеток в бронхоальвеолярном смыве (БАС), причем наличие клеток свидетельствует о воспалительном процессе в легких. У больных людей предпочтительными методиками/материалами для оценки воспаления считаются БАС, индуцированная мокрота и бронхиальная биопсия. Воспаление можно индуцировать любыми уместными средствами, например вдыханием табачного дыма, введением раздражителей, в частности ЛПС и т.п. Предпочтительным вариантом является вдыхание табачного дыма, поскольку, как было ранее продемонстрировано в британской патентной заявке 0417481.9, использование ЛПС неточно воспроизводит резистентную к стероидам воспалительную реакцию, которая наблюдается при ХОБЛ. В контексте БАС/анализа с подсчетом клеток термин "эффективность" предпочтительно означает снижение количества клеток на 30%, 35%, 40%, 45%, 50%, 60%, 65%, 70% или более по сравнению с контролем, в котором не было использовано лекарственное средство.
Термин "неэффективность" в том же анализе означает намного более слабую ответную реакцию. В контексте БАС/анализа с подсчетом клеток термин "неэффективность" предпочтительно означает снижение количества клеток на 30% или менее, предпочтительно 28%, 27%, 26%, 25%, 24%, 23%, 22% или 21% или менее, еще предпочтительнее 20% или менее. В некоторых случаях понятие "неэффективность" охватывает ситуации, связанные с увеличением воспаления, о чем может свидетельствовать, например, увеличение количества клеток в анализируемом материале.
Термин "синергизм" означает, что эффективность двух средств больше ожидаемой при простом суммировании их индивидуального эффекта в рамках данного анализа. Например, если теофиллин и стероид снижают количество клеток в анализе БАС на 10% и 20% соответственно, в том случае, когда они используются по отдельности, то синергический эффект будет наблюдаться, если при комбинированном применении тех же средств в тех же дозах снижение клеток превысит 30%, предпочтительно превысит 35%, 40%, 50% или более.
Термин "введенный" означает введение всей дозы средства, например, в виде болюсной дозы, определенному субъекту. В контексте данного изобретения дозировка предпочтительно выражается в смысле достигаемого уровня активного вещества в плазме (<5 мг/л, 6-9 мг/л, 10-20 мг/л), причем уровень в плазме предпочтительно составляет менее 5 мг/л или еще более предпочтительно менее 1 мг/л.
"Доза" означает количество средства, введенного так, как это описано выше.
Форма "разовой дозы" означает подготовку фармацевтического состава в одной или более упакованных расфасовок, каждая из которых содержит единичную дозу активного вещества в соответствии с изобретением.
Матилксантины и стероиды
Теофиллин и аминофиллин
Теофиллин имеет приведенную ниже структуру:
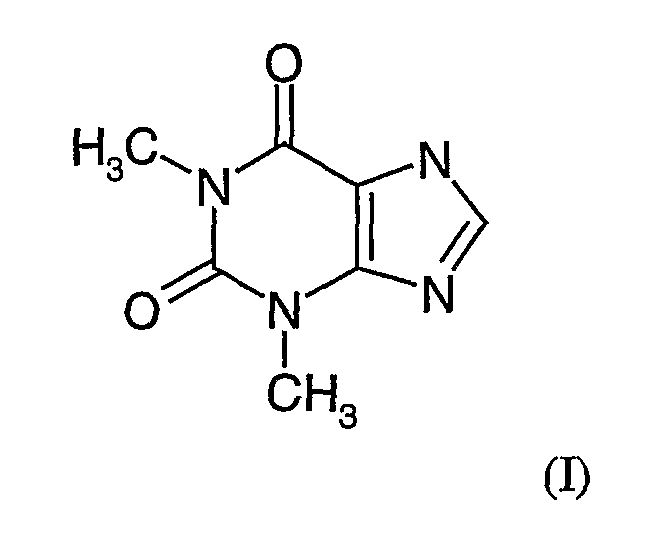
и поступает в продажу под разными торговыми названиями, включая Аккурбон, Аэробин, Аэролат, Афолинум, Аквафиллин, Армофиллин, Асмаликс, Аустин, Билордил, Бронхоретард, Бронкодил, Цетрафиллин, Констант T, Дурафиллин, Диффумал, Эликсомин, Эликсофиллин, Этеофил, Эуфиллин, Эуфилонг, ЛаБИД, Ланофиллин, Ласма, Нуэлин, Фиспан, Про-вент, Пульмидур, Пульмо-таймлетс, Квиброн, Респид, Сло-бид, Сло-филлин, Солосин, Сустейр, Талотрен, Теосона, Теобид, Теоклир, Теохрон, Тео-дур, Теолейр, Теон, Теофил, Теоград, Тео-сав, Теоспан, Теостат, Теовент, T-фил, Унифил, Uniphyl, Унифиллин и Ксантиум. Химическое название теофиллина 3,7-дигидро-1,3-диметил-1H-пурин-2,6-дион или 1,3-диметилксантин, а его общая химическая формула C7H8N4O2.
Аминофиллин
Производное теофиллина, имеющее синонимическое название теофиллин этилендиамин. Аминофиллин представляет собой производное теофиллина: оба относятся к метилксантинам и происходят из ксантинов. Лекарственный препарат аминофиллин несколько отличается по структуре от теофиллина в том отношении, что он содержит этилендиамин, а также больше молекул воды. Аминофиллин проявляет тенденцию к менее мощному и укороченному действию по сравнению с теофиллином. Его структура показана ниже:
Поскольку значительная часть ингалированной дозы может быть проглочена, важно отметить, что теофиллин хорошо всасывается в желудочно-кишечном тракте с биологической доступностью до 90-100 процентов. Пиковый уровень достигается в течение 1-2 часов после проглатывания, но в случае присутствия пищи это время может растягиваться. Теофиллин связывается белками плазмы примерно на 60 процентов, а средний объем его распределения составляет 0,5 л/кг. Связывание с белками плазмы ограничено у детей и у больных с циррозом печени. Средний период полувыведения теофиллина из плазмы у взрослых составляет около 8 часов, хотя по этому признаку наблюдается большая внутри- и межиндивидуальная вариабельность, а также большая возрастная изменчивость: приблизительно 30 часов у недоношенных новорожденных, 12 часов в первые 6 месяцев жизни, 5 часов к концу первого года жизни и 3,5 часа до 20-летнего возраста с постепенным увеличением на протяжении последующей жизни.
Теофиллин метаболизируется, главным образом, в печени посредством деметилирования и окисления с использованием системы цитохрома P450. Почками выводится лишь небольшое количество неизмененного вещества, поэтому специальный подбор дозы при почечной недостаточности не нужен. Однако необходимо проявлять осторожность при использовании других лекарственных средств, которые также метаболизируются системой цитохрома - в этом случае необходимо подбирать дозу в зависимости от результатов измерения уровня лекарственного средства в плазме. В метаболизм теофиллина могут вмешиваться многие лекарственные средства. Особое внимание в этом плане надо уделять некоторым антибиотикам, поскольку они могут неосторожно назначаться больным при остром инфекционном ухудшении обструкции дыхательных путей без учета последствий для метаболизма теофиллина. К таковым относятся макролиды (например, эритромицин) и хинолоны (например, ципрофлоксацин): антибиотики, принадлежащие к обоим семействам, в различной степени снижают клиренс теофиллина. К числу других лекарственных средств, снижающих клиренс теофиллина, относятся циметидин, аллопуринол и пропанолол (хотя их использование в терапевтической комбинации с теофиллином довольно необычно). К числу лекарственных средств, усиливающих метаболизм теофиллина, относятся рифампицин, фенобарбитон, а также частично фенитоин и карбамазепин, но не оральные контрацептивные пилюли. Скорость метаболизма теофиллина существенно возрастает у курильщиков (период полувыведения может сократиться вдвое), хотя бывает незначительным у тех, кто выкуривает менее 10 сигарет в день. Курение марихуаны производит аналогичный эффект так же, как и диета с высоким содержанием белков. Дисфункция печени, сердечная недостаточность и легочное сердце (cor pulmonale) снижают элиминацию теофиллина, а состояния с низким содержанием альбуминов уменьшают количество лекарственного средства, связанного с белками, в крови, в результате чего показатели уровня лекарственного средства в плазме приходится интерпретировать с осторожностью. Следовательно, при улучшении клинического статуса больного с сердечной или дыхательной недостаточностью, а также с легочным сердцем клиренс теофиллина изменяется, что может потребовать корректировки дозы.
Введение метилксантина ингаляционным способом для его доставки в легкие не только желательно для максимизации локально опосредованной легочной противовоспалительной синергии с ингаляционным стероидом, но и позволяет использовать меньшие дозы метилксантина (<25 мг), что приводит к уменьшению системной экспозиции (<1 мг/л). При очень низком уровне метилксантина в плазме возможно значительное снижение частоты системных побочных эффектов, которые наблюдаются при описанной выше стандартной оральной терапии метилксантинами.
Метилксантины
Метилксантиновые соединения, к которым относятся теофиллин и аминофиллин, имеют общую формулу
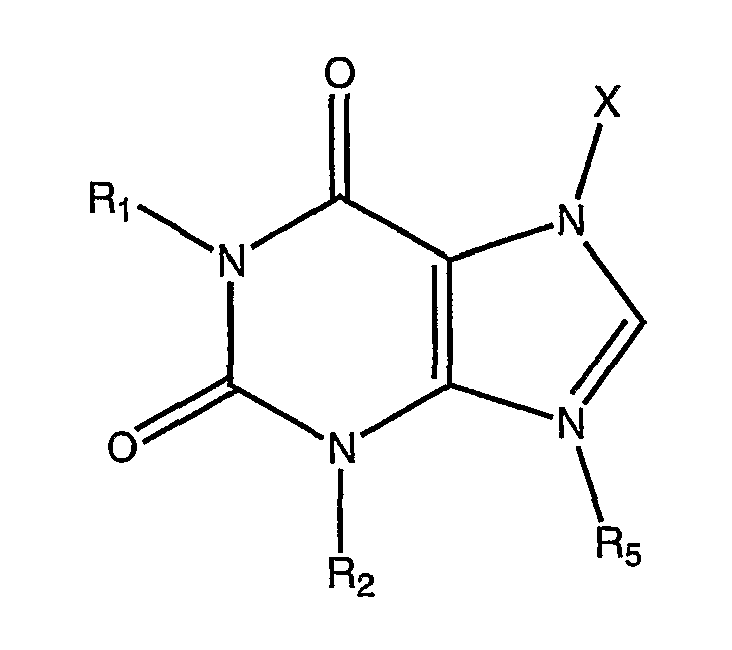
где
X представляет водород, алифатический углеводородный радикал или -CO-NR3R4;
R1, R2 и R3 представляют алифатические углеводородные радикалы;
R4 представляет водород или алифатический углеводородный радикал, а R3 и R4 вместе с атомом азота могут также представлять алкиленовый иминорадикал с 5-6 членами кольца или морфолиновый радикал; и
R5 представляет водород или алифатический углеводородный радикал.
Все соединения такого рода входят в сферу данного изобретения, однако наиболее предпочтительным из них является именно теофиллин.
Стероиды
Для применения в данном изобретении подходят стероидные лекарственные средства в целом. Конкретные стероиды приведены ниже.
Обычно употребляемые ингаляционные стероиды включают:
- Пульмикорт® (будесонид)
- Фловент® (флутиказон)
- Асманекс® (мометазон)
- Альвеско® (циклесонид)
- Аэробид® (флунизолид)
- Азмакорт® (триамсинолон)
- Qvar® (беклометазон HFA)
- Стероиды также могут использоваться в сочетании с бронходилататорами длительного действия в широком спектре механизмов действия, включая активность бета 2 адренергических агонистов (таких, как формотерол или сальметерол) и/или мускариновых антагонистов (таких, как ипратропиум и тиотропиум). Бронходилататор, включенный в комбинацию со стероидом, может обладать активностью бета 2 адренергического агониста и мускаринового антагониста в одной и той же молекуле.
- Адваир® (Фловент® и Серевент®). Внимание: Серевент® - это бета-агонист длительного действия сальметерол.
- Симбикорт® (Пульмикорт® и Оксис®). Внимание: Оксис® - это бета-агонист длительного действия формотерол.
- Другие комбинации стероидов/B2 агонистов, находящиеся на стадии клинической разработки, - это циклесонид и формотерол, а также флутиказон и формотерол (Флутиформ). Указанные продукты также могут быть полезны при ингаляционной терапии в сочетании с ингаляционным теофиллином.
Обычно применяемые стероидные пилюли и сиропы включают:
- Дельтазон® (преднизон)
- Медрол® (метилпреднизолон)
- Орапред®, Прелон®, Педиапред® (преднизолон)
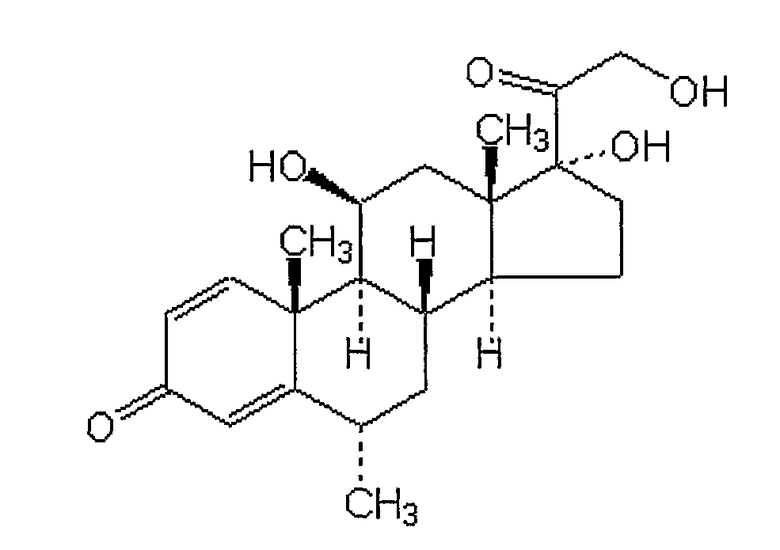
Будесонид
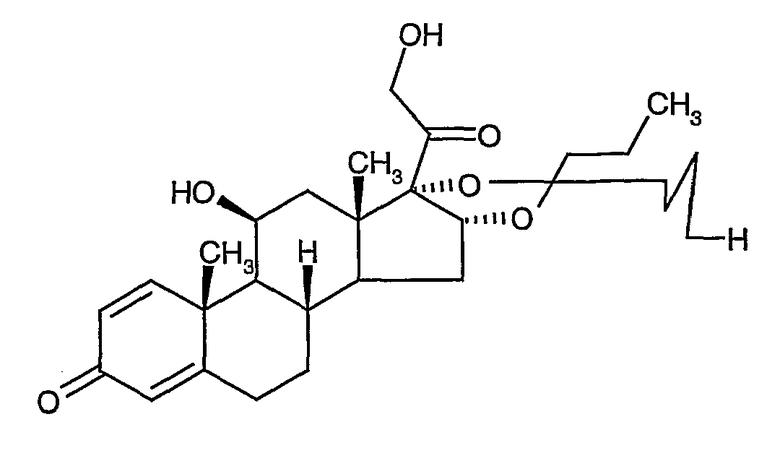
Химическое название: C25H34O6: 430,54 (+)-[(RS)-16a,17a-бутилидендиокси-11b,21-дигидрокси-1,4-прегнадиен-3,20-дион].
Номер в регистре CAS: 51333-22-3.
Будесонид был впервые синтезирован из 16a-гидроксипреднизолона. Уникальная структура молекулы - это ключевой момент для его использования в лекарственных комбинациях с высокой местной противовоспалительной активностью и относительно низким потенциалом системных побочных эффектов. В дополнение к этому будесонид хорошо растворим в воде, что позволяет ему легко разводиться в слизистых жидкостях, а также в липидах, что придает ему свойство быстро всасываться через слизистые оболочки. Поскольку ацетальная группа асимметрична, будесонид существует в виде смеси (1:1) двух эпимеров, известных как 22R и 22S.
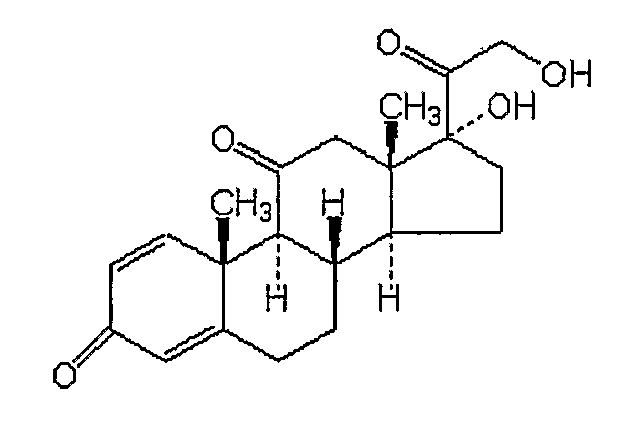
Флутиказон
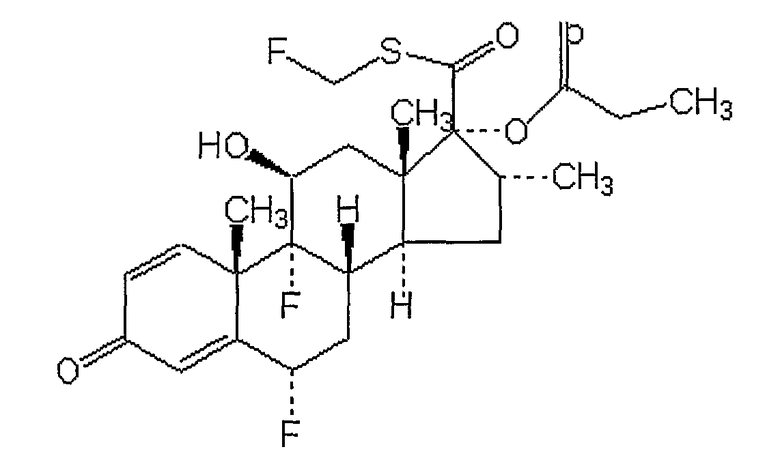
ТОРГОВЫЕ НАЗВАНИЯ: Кутиват, Фликсоназа, Фликсотид, Флоназа, Фловент, Флуназа
ХИМИЧЕСКОЕ НАЗВАНИЕ: S-(фторметиловый) эфир (6(,11(,16(,17()-6,9-дифтор-11-гидрокси-16-метил-3-оксо-17-(1-оксопропокси)андроста-1,4-диен-17-карботионовой кислоты.
ХИМИЧЕСКАЯ ФОРМУЛА: C25H31F3O5S.
НОМЕР CAS: 80474-14-2.
Циклесонид
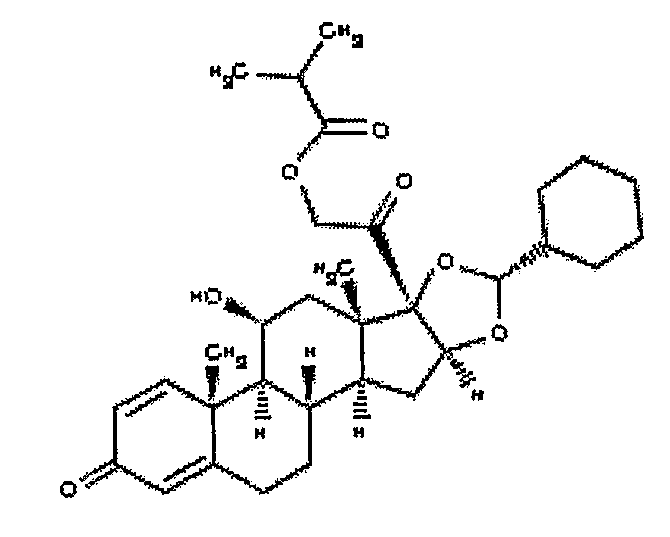
ТОРГОВЫЕ НАЗВАНИЯ: Альвеско.
ХИМИЧЕСКОЕ НАЗВАНИЕ: (R)-11бета,16альфа,17,21-тетрагидроксипрегна-1,4-диен-3,20-дион, циклический 16,17-ацеталь с циклогексанкарбоксальдегидом, 21-изобутират.
ХИМИЧЕСКАЯ ФОРМУЛА: C32-H44-О7.
НОМЕР CAS: 141845-82-1.
Беклометазон
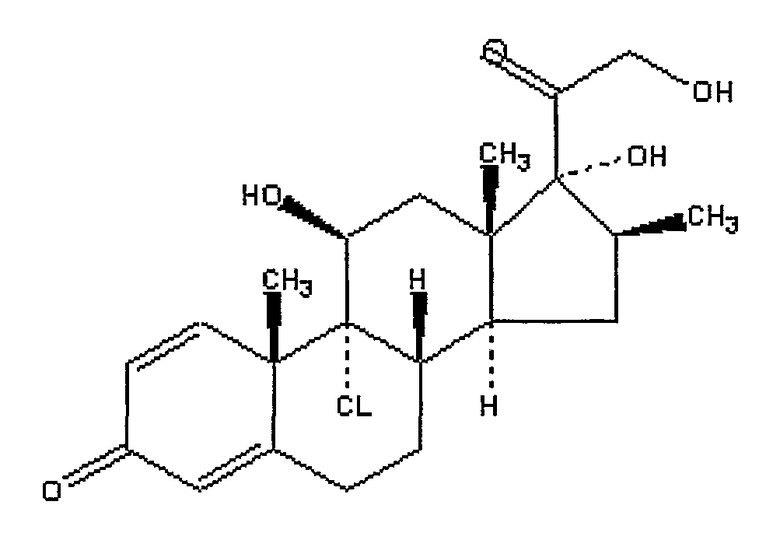
ХИМИЧЕСКОЕ НАЗВАНИЕ: (11(,16()-9-хлор-11,17,21-тригидрокси-16-метилпрегна-1,4-диен-3,20-дион.
ХИМИЧЕСКАЯ ФОРМУЛА: C22H29ClO5.
НОМЕР CAS: 4419-39-0.
ТОРГОВЫЕ НАЗВАНИЯ (ВАРИАНТЫ): Аэробек (беклометазон дипропионат), Альдецин (беклометазон дипропионат), Анцерон (беклометазон дипропионат), Андион (беклометазон дипропионат), Беклацин (беклометазон дипропионат), Беклофорте (беклометазон дипропионат), Бекломет (беклометазон дипропионат), Беклоринол (беклометазон дипропионат), Бекловал (беклометазон дипропионат), Бекловент (беклометазон дипропионат), Беклодиски (беклометазон дипропионат), Беконаза (беклометазон дипропионат), Беконасол (беклометазон дипропионат), Бекотид (беклометазон дипропионат), Кленил-A (беклометазон дипропионат), Энтидерма (беклометазон дипропионат), Иналон (беклометазон дипропионат), Корбутон (беклометазон дипропионат), Propaderm (беклометазон дипропионат), Qvar (беклометазон дипропионат), Рино-Кленил (беклометазон дипропионат), Санастмакс (беклометазон дипропионат), Санастмил (беклометазон дипропионат), Ванценаза (беклометазон дипропионат), Ванцерил (беклометазон дипропионат), Виарекс (беклометазон дипропионат) и Виарокс (беклометазон дипропионат).
Триамсинолон
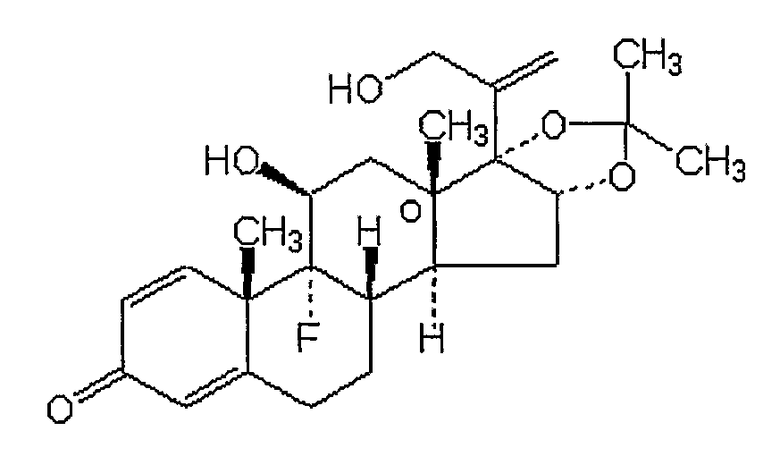
ТОРГОВЫЕ НАЗВАНИЯ: Аристокорт, Аристоспан, Азмакорт, Кеналог Насакорт.
ХИМИЧЕСКОЕ НАЗВАНИЕ: (11(,16()-9-фторо-11,21-дигидрокси-16,17-[1-метилэтилиденбис(окси)]прегна-1,4-диен-3,20-дион.
ХИМИЧЕСКАЯ ФОРМУЛА: C24H31FO6.
НОМЕР CAS: 76-25-5.
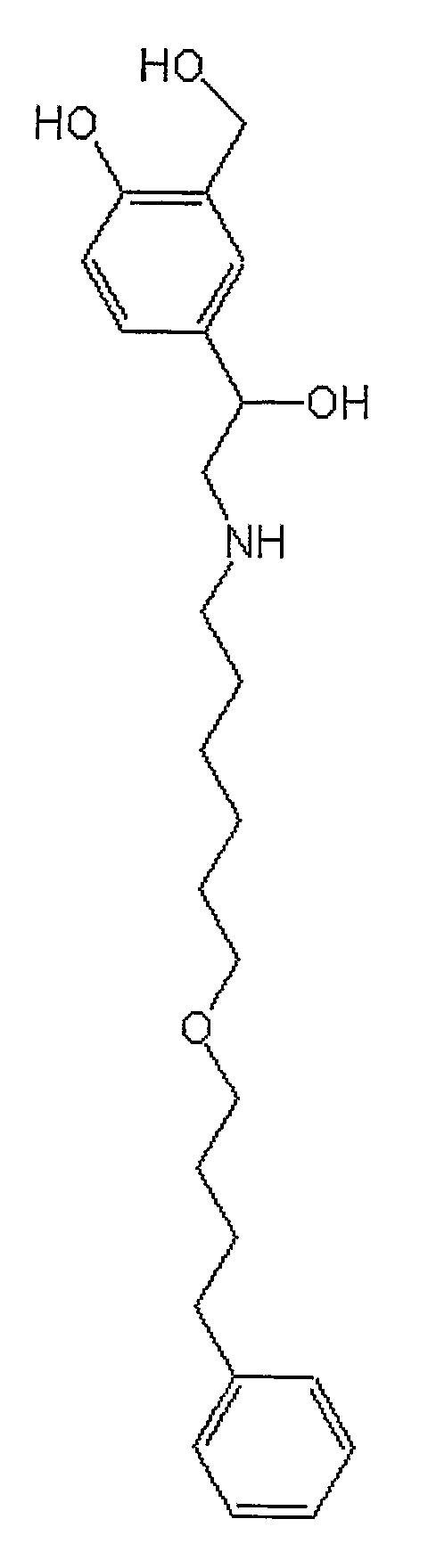
Сальметерол/Адваир
ТОРГОВЫЕ НАЗВАНИЯ: *1-гидрокси-2-нафтоат *1-гидрокси-2-нафтоат: Ариал, Сальметедур, Серевент.
ХИМИЧЕСКОЕ НАЗВАНИЕ: (()-4-гидрокси-('-[[[6-(4-фенилбутокси) гексил]амино]метил]-1,3-бензолдиметанол.
ХИМИЧЕСКАЯ ФОРМУЛА: C25H37NO4.
НОМЕР CAS: 89365-50-4.
Метилпреднизолон
ХИМИЧЕСКОЕ НАЗВАНИЕ: (6(,11()-11,17,21-тригидрокси-6-метилпрегна-1,4-диен-3,20-дион.
ХИМИЧЕСКАЯ ФОРМУЛА: C22H30O5.
НОМЕР CAS: 83-43-2.
ТОРГОВЫЕ НАЗВАНИЯ: Медрат, Медрол, Медрон, Метастаб, Метризон, Промакортин, Супраметил, Урбазон.
Преднизон
ТОРГОВЫЕ НАЗВАНИЯ: Анкортон, Колизон, Кортанцил, Дакортин, Декортанцил, Декортин, Делькортин, Дельтакортон, Дельтазон, Дельтизон, Ди-Адрезон, Энкортон, Метикортен, Нуризон, Оразон, Паракорт, Преднилонга, Пронизон, Ректодельт, Sone, Ультракортен.
ХИМИЧЕСКОЕ НАЗВАНИЕ: 17,21-дигидроксипрегна-1,4-диен-3,11,20,трион.
ХИМИЧЕСКАЯ ФОРМУЛА: C21H26O5.
НОМЕР CAS: 53-03-2.
Технология приготовления лекарственного средства
Производные ксантина, в частности теофиллин и аминофиллин, входят в состав разных фармацевтических препаратов. Точно так же стероидные лекарственные средства широко используются во многих лекарственных составах. Лекарственные составы, использованные в приведенных здесь примерах, подробно описаны ниже, однако в данном изобретении может быть использован любой состав, который позволяет доставлять лекарственные средства в организм больного посредством ингаляции (оральной или назальной) в необходимой дозе.
Согласно изобретению предпочтительные композиции для лечебного применения могут соответствующим образом иметь форму таблеток, блистеров, капсул, гранул, сфероидов, порошков или жидкостей.
В этом изобретении теофиллин вводится в организм посредством ингаляции. Образование аэрозоля может осуществляться, например, реактивным распылителем под механическим давлением или ультразвуковым распылителем, но, преимущественно, пропеллентыми мерными аэрозольными ингаляторами или беспропеллентным введением тонкоизмельченных активных составов, например, при помощи ингаляционных капсул или других "сухопорошковых" систем доставки. Стероидные лекарственные средства могут вводиться в организм оральным или ингаляционным способом. Преимущественно, стероидные лекарственные средства вводятся посредством ингаляции.
Активные соединения дозируются, как это описано, в зависимости от используемой ингаляционной системы, причем в дополнение к активным соединениям вводимые в организм составы могут содержать необходимые наполнители, например пропелленты (в частности, Frigen в случае мерных аэрозолей), поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, ароматизаторы, заполнители (например, лактозу в порошковых ингаляторах) или, если это уместно, дополнительные активные вещества.
В целях ингаляции можно использовать множество разных аппаратов, способных генерировать и вводить в организм аэрозоли с частицами оптимального размера, используя такую методику ингаляций, которая в наибольшей степени приемлема для больного. В дополнение к использованию адаптеров (спейсеров, экспандеров), грушевидных контейнеров (например, Nebulator®, Volumatic®) и автоматических устройств, испускающих пневматический спрей (Autohaler®), для мерных аэрозолей, особенно в случае порошковых ингаляторов, существует множество технических решений (например, Diskhaler®, Rotadisk®, Accuhaler®, Turbohaler®, Clickhaler®, Duohaler®, Evohaler®, Twisthaler®, Aerobec, Airmax, SkyeHaler, HandiHaler®, Respimat® Soft Mist™ Inhaler) или другие ингаляторы, в частности, описанные в Европейских патентных заявках EP 0505321, EP 407028, EP 650410, EP 691865 или EP 725725.
Респираторные заболевания, на лечение которых направлено данное изобретение, в частности, включают ХОБЛ (бронхит, обструктивный бронхит, спастический бронхит, эмфизему), муковисцидоз, астму, не поддающуюся лечению стероидами (включая курящих астматиков) и педиатрическую астму - упомянутые заболевания можно лечить лекарственными комбинациями, предложенными в данном изобретении. Синергическая комбинация лекарственных средств, предложенная изобретением, особенно показана при длительной терапии, поскольку требует меньшего количества лекарственных средств, чем традиционная монотерапия.
1. МАТЕРИАЛЫ
Соединения были закуплены у внешних поставщиков. Карбоксиметилцеллюлоза (СМС) (натриевая соль) (код продукта C-4888) была приобретена в компании Sigma. Фосфатный забуференный солевой раствор (PBS) был приобретен в компании Gibco. Стерильный солевой раствор (0,95 вес/объем NaCl) и Euthatal (фенобарбитон натрия) были закуплены у фирм Fresenius Ltd. и Veterinary Drug Company, соответственно.
Табачный дым был получен с использованием сигарет 1R1, приобретенных в Институте научных исследований табака (университет штата Кентукки, США).
Мыши
Самки мышей инбредной линии A/J (масса тела в первый день использования: приблизительно 20 г) были получены от компании Harlan (при получении животных гарантировались полный барьер размножения и достоверное отсутствие специфических микроорганизмов). Мыши были помещены в клетки (до 5 особей в каждой) с индивидуальной вентиляцией, твердым поликарбонатным полом (системы IVC) и настилом из осиновых планок 8 стандарта качества. Окружающая среда в клетках (приток воздуха, температура и влажность) контролировались системой IVC (Techniplast). Пища (рацион RM 1, специальная служба питания) и вода предоставлялись животным без ограничений. Отдельных животных идентифицировали по уникальной цветовой маркировке "pentel" на хвосте, взвешивали и случайным образом (через процедуру рандомизации) распределяли по группам альтернативного воздействия.
2. ПРИГОТОВЛЕНИЕ ЛЕКАРСТВЕННОГО СОСТАВА
Частота приготовления: свежие смеси готовили каждый день непосредственно перед интраназальной (и/н) или оральной ингаляцией.
3.0 МЕТОДЫ
Предыдущие исследования показали, что общее количество клеток, восстанавливаемых в БАС, значительно возрастает через 24 часа после последнего контакта с табачным дымом при ежедневном воздействии этого фактора на протяжении 11 дней подряд. Поэтому в данном исследовании была использована именно эта точка времени.
Протоколы контакта мышей с ТД, получения бронхоальвеолярных смывов (БАС), приготовления цитоспиновых слайдов для дифференциального подсчета клеток соответствовали приведенным ниже описаниям.
Ежедневный контакт животных с ТД на протяжении 11 дней подряд.
Согласно протоколу экспозиции мышей подвергали воздействию ТД группами по 5 особей в отдельных чистых камерах из поликарбоната размером 27 см × 16 см × 12 см. Из сигарет получали ТД, который вводили в камеры со скоростью потока 100 мл/мин. Для сведения к минимуму любых возможных проблем, обусловленных повторным контактом с высоким уровнем ТД (6 сигарет), контакт мышей с ТД увеличивали постепенно на протяжении всего периода экспозиции, доводя его до максимума 6 сигарет. В этом исследовании был использован следующий график экспозиции:
Альтернативную группу мышей ежедневно обрабатывали потоком чистого воздуха (без ТД) в течение таких же промежутков времен и использовали в качестве контроля.
Бронхоальвеолярный смыв и цитоспиновый анализ
Бронхоальвеолярный смыв проводили следующим образом:
Трахею канюлировали при помощи внутривенной канюли из нейлона Portex (розовый люэровский фитинг) с укорочением примерно на 8 мм. В качестве промывной жидкости использовали фосфатный забуференный солевой раствор (PBS) с гепарином (10 единиц/мл). Эту жидкость в объеме 0,4 мл осторожно вливали и откачивали 3 раза при помощи шприца объемом 1 мл, после чего помещали ее в пробирку Эппендорфа и держали на льду вплоть до последующего анализа.
Подсчет клеток:
Промывную жидкость сепарировали от клеток центрифугированием, а надосадочную жидкость сливали и замораживали для последующего анализа. Клеточный осадок ресуспендировали в известном объеме PBS, а общее количество клеток определяли подсчетом в окрашенной аликвотной пробе (краситель Turks) под микроскопом при помощи гемоцитометра.
Дифференциальный подсчет клеток проводили следующим образом:
Резидуальный клеточный осадок разбавляли, доводя содержание клеток примерно до 105 на мл. Объем жидкости 500 мкл помещали в воронку цитоспинового слайда и центрифугировали в течение 8 минут на скорости 800 оборотов в минуту. Слайд (предметное стекло) высушивали воздухом и окрашивали раствором "Kwik-Diff" (Shandon) по патентованной инструкции. После высушивания и снятия покрышки проводили дифференциальный подсчет клеток под световым микроскопом. Беспристрастный оператор подсчитывал под световым микроскопом до 400 клеток. Дифференциацию клеток проводили по стандартным морфометрическим методикам.
Фармакокинетическая оценка уровня теофиллина в плазме после его оральной или и/н ингаляции у мышей линии A/J, контактировавших с ТД
В конце эксперимента мыши были анестезированы для сбора крови через пункцию сердца шприцем, содержащим 20 единиц гепарина лития на 5 мкл. Собранную кровь перемешивали и сливали в пробирки Эппендорфа с последующим центрифугированием в микроцентрифуге. Плазму собирали и хранили при температуре -80°C вплоть до анализа по методу ЖХВР/МС/МС. Для измерения уровня лекарственного средства в плазме было использовано следующее оборудование: масс-спектрометр Miromann Quatro (производства фирмы Micromass UK Limited) и жидкостный хроматограф Waters 2795 Alliance HT (производства фирмы Waters, США).
Шесть эталонных стандартных концентраций были приготовлены путем фиксации мышиной плазмы с исходными концентрациями теофиллина, растворенного в метаноле. Образцы были приготовлены для анализа добавлением 200 мкл ацетонитрила, содержащего 0,25 мг/л декстрорфана в качестве внутреннего стандарта, к 50 мкл каждого размороженного образца и стандарта с энергичным перемешиванием. Затем каждый образец и стандарт были центрифугированы с ускорением 10000g в течение двух минут, а надосадочная жидкость извлекалась для последующего ЖХ-МС/МС анализа.
Анализ на теофиллин и декстрорфан проводили по методу ЖХВР обратной фазы с тандемным масс-спектрометрическим определением. Положительные ионы родоначального соединения и специфический фрагментарный продукт отслеживались в режиме мониторинга множественных реакций при помощи масс-спектрометра Micromass Quatro с программным обеспечением Micromass MassLynx версии 4.0. Затем 25 мкл аликвотной пробы каждого образца и стандарта впрыскивали в систему жидкостной хроматографии. Наименьший порядок количественного определения был установлен на уровне 0,016 мг/л с предельным значением 0,003 мг/л.
3.1 Режимы эксперимента
Для изучения оральной дозы мыши получали носитель (1% карбоксиметилцеллюлозу), теофиллин (3 мг/кг), дексаметазон (0,3 мг/кг), комбинацию теофиллин/дексаметазон (3 и 0,3 мг/кг соответственно) или комбинацию теофиллин/дексаметазон (1 и 0,3 мг/кг соответственно) за одни час до и через шесть часов после контакта с табачным дымом (-1 час и +6 часов) в каждый из 11 дней эксперимента. Кроме того, животные, которым вводили стероид или комбинированный состав со стероидом, получали дозу стероида за 20 часов до первого контакта с табачным дымом. Мыши также получали дополнительную дозу лекарственных средств за 1 час до умерщвления в 12-й и последний день (через 23 часа после последнего контакта с табачным дымом). Контрольная группа мышей получала носитель с 1-го по 12-й день эксперимента и ежедневное обдувание чистым воздухом (не более 50 минут в день). Сбор материалов для анализа (БАС и образцов плазмы) проводили в 12-й день - через 24 часа после одиннадцатого и последнего контакта с ТД.
Для изучения интраназальной дозы мыши получали носитель (PBS), теофиллин (0,5 мг/кг), дексаметазон (0,1 мг/кг) комбинацию теофиллин/дексаметазон (0,5 и 0,1 мг/кг соответственно), комбинацию теофиллин/дексаметазон (0,25 и 0,1 мг/кг соответственно) или комбинацию теофиллин/дексаметазон (0,1 и 0,1 мг/кг соответственно) за одни час до контакта с табачным дымом в каждый из 11 дней эксперимента. Кроме того, животные, которым вводили стероид или комбинированный состав со стероидом, получали дозу стероида за 20 часов до первого контакта с табачным дымом. Мыши также получали дополнительную дозу лекарственных средств за 1 час до умерщвления в 12-й и последний день (через 23 часа после последнего контакта с табачным дымом). Контрольная группа мышей получала носитель с 1-го по 12-й день эксперимента и ежедневное обдувание чистым воздухом (не более 50 минут в день). Сбор материалов для анализа (БАС и образцов плазмы) проводили в 12-й день эксперимента - через 24 часа после одиннадцатого и последнего контакта с ТД.
3.2 Измерение показателей и статистический анализ
Все результаты представлены в виде индивидуальных точек данных для каждого животного с расчетом средней величины в каждой группе.
Поскольку тесты на нормальность оказались позитивными, данные были подвергнуты однофакторному дисперсионному анализу (ANOVA) с последующей поправкой Бонферрони на множественные сравнения для тестирования значимости различий между альтернативными группами. Для установления статистической значимости различий было принято значение p<0,05. Процентный показатель ингибирования вычислялся автоматически в ячейках данных электронной таблицы Excel по следующей формуле:
 Результаты ингибирования по другим параметрам были вычислены вручную по той же формуле.
Результаты ингибирования по другим параметрам были вычислены вручную по той же формуле.
4.0 РЕЗУЛЬТАТЫ
4.1 Воспалительная реакция в бронхоальвеолярном смыве, индуцированная одиннадцатью подряд ежедневными контактами с ТД (через 24 часа после последнего контакта)
В этом исследовании контакт с ТД в течение 11 дней подряд индуцировал воспалительную реакцию через 24 часа после последнего контакта. Эта реакция заключалась в значительном увеличении содержания нейтрофилов, макрофагов и лимфоцитов в БАС по сравнению с контрольными мышами, получавшими обдувание чистым воздухом.
4.2 Влияние теофиллина, дексаметазона и комбинации теофиллин/дексаметазон на воспалительную реакцию в бронхоальвеолярном смыве, индуцированную одиннадцатью подряд ежедневными контактами с ТД (через 24 часа после последнего контакта)
Ни монотерапия теофиллином, ни монотерапия дексаметазоном при оральном или интраназальном введении лекарственного средства не приводили к значимому снижению общего количества клеток, восстанавливаемых в БАС, при контакте с ТД (фиг.1). В отношении любого специфического типа клеток также не наблюдалось статистически значимого ингибиторного эффекта (фиг.3-5).
В отличие от этого, комбинация теофиллин/дексаметазон во всех дозах при оральном или интраназальном введении лекарственного средства значительно (на 44-63%) снижала общее количество клеток, восстанавливаемых в БАС (p<0,001) (фиг.1). Этот эффект в отношении общего количества клеток заключался в ингибировании макрофагов, нейтрофилов и лимфоцитов (фиг.3-5).
Полное разрушение или ингибирование воспалительного клеточного инфильтрата, индуцированного ТД, в результате комбинированной терапии представлено в таблице 3.
4.3 Фармакокинетический анализ
Мыши получали последнюю дозу лекарственных средств при соответствующей комбинированной терапии теофиллином/дексаметазоном за 1 час до умерщвления, а плазму, полученную от этих животных, исследовали на содержание теофиллина. У мышей, получавших оральную комбинированную терапию, наблюдалось более высокое среднее содержание теофиллина в плазме по сравнению с мышами, получавшими интраназальную комбинированную терапию (фиг.2).
Оральная комбинированная терапия с использованием теофиллина (3 мг/кг или 1 мг/кг) в комбинации с дексаметазоном (0,3 мг/кг) приводила к среднему уровню этих лекарственных средств в плазме порядка 1,37±0,192 мг/л и 0,479±0,047 мг/л соответственно. Интраназальная комбинированная терапия с использованием теофиллина (0,5 мг/кг, 0,25 мг/кг или 0,1 мг/кг) в комбинации с дексаметазоном (0,1 мг/кг) приводила к среднему уровню этих лекарственных средств в плазме 0,074±0,013 мг/л, 0,045±0,010 мг/л и 0,022±0,009 мг/л соответственно. При интраназальном введении теофиллина наблюдалось его очень низкое системное воздействие (<0,1 мг/л) через 1 час после введения дозы лекарственного средства.
5.0 ОБСУЖДЕНИЕ
В этом исследовании ежедневное лечение теофиллином или стероидами в виде монотерапии не проявляло никакой ингибиторной активности в отношении модели легочного воспаления при ХОБЛ. Такое отсутствие противовоспалительной активности в легких наблюдалось независимо от того, проводилось ли медикаментозное лечение оральным способом или суррогатным вариантом ингаляции (интраназальное введение лекарственного средства). Однако когда эти соединения использовались совместно (оральным или интраназальным способом), причем в тех же дозах, что и при монотерапии, была продемонстрирована значительная противовоспалительная активность. Кроме того, при комбинировании с дексаметазоном лечебный эффект проявляли пониженные дозы теофиллина.
Кроме того, эффективность, наблюдавшаяся при интраназальной комбинированной терапии, была эквивалентна эффективности оральной комбинированной терапии, несмотря на то, что использовались низкие дозы и теофиллина, и дексаметазона. Это наводит на мысль о том, что в данном случае эффективность определяется местной (специфичной для легких) противовоспалительной активностью. Это предположение [гипотетическое] дополнительно поддерживается результатами изучения содержания теофиллина в плазме, поскольку при интраназальном введении наблюдался очень низкий системный уровень лекарственных средств (<0,1 мг/л). В качестве иллюстрации можно привести данные о том, что лечебный эффект при оральной комбинированной терапии (1 мг/кг теофиллина и 0,3 мг/кг дексаметазона) в отношении общего количества клеток в БАС (ингибирование на 47%) был сходен с таковым при интраназальной комбинированной терапии (0,1 мг/кг теофиллина и 0,1 мг/кг дексаметазона) (ингибирование на 44%), когда доза стероида была в три раза ниже, а доза теофиллина в десять раз ниже. В дополнение к этому следует отметить, что системный уровень теофиллина в данном примере был ниже приблизительно в 17 раз. Взятые вместе эти данные позволяют думать о том, что комбинированная терапия теофиллином и стероидом дает синергическую противовоспалительную реакцию, которая in vivo специфично опосредована в легких.
Эти данные демонстрируют нечувствительность к стероидам в мышиной модели субхронического раздражения легких ТД и дополнительно подкрепляют синергический эффект комбинирования терапевтической дозы стероида с индивидуально неактивной дозой теофиллина в парадигме лечения ХОБЛ. Критично, что этот эффект достигается в том случае, когда комбинированная терапия проводится по методу суррогатной ингаляции (интраназальное введение лекарственных средств), что позволяет использовать теофиллин в очень низких дозах, ограничивая его уровень в плазме намного более низкими величинами по сравнению с теми, которые в норме ассоциированы с противовоспалительной активностью (5 мг/л).
Сводные данные по эффектам теофиллина, дексаметазона
или их комбинации в отношении воспалительной реакции в БАС, индуцированной ТД и наблюдаемой через 24 часа
после 11-дневного контакта с агрессивным фактором
В исследованиях in vivo, подробно описанных выше, где была продемонстрирована синергическая противовоспалительная активность доставляемой в легкие комбинации теофиллина и стероида дексаметазона, при их повторном проведении были использованы другие стероиды, включая флутиказон, будесонид или циклесонид. Дозы стероидов находились в диапазоне от 1 мкг/кг в день до 1 мг/кг в день.
Среди специалистов, компетентных в данной области знаний, широко признано, что эффективные дозы ингаляционных лекарственных средств для экспериментальных животных могут значительно отличаться от доз, необходимых для достижения лечебного эффекта у человека. Это в особой степени относится к ингаляционным стероидам. Эффективные дозы ингаляционных стероидов для больных с респираторными заболеваниями в типичных случаях находятся в диапазоне от 40 до 1600 мкг (общая доза независимо от массы тела субъекта) и зависят как от конкретного используемого стероида, так и от многих других факторов. Дозы ингаляционных стероидов, используемые в экспериментах на животных, обычно бывают выражены как относительные величины на единицу массы тела (например, мг/кг), а не как абсолютные величины. Конвертирование доз, используемых в клинической практике, в мкг/кг позволяет провести сравнение между дозами для человека и дозами для животных и демонстрирует значительные различия между ними. Например, типичные дозы будесонида для больных людей находятся в диапазоне от 200 до 1600 мкг в день, что для взрослого человека среднего веса (70 кг) соответствует 2,9 - 22,9 мкг/кг. На мышиной модели астмы будесонид в дозе 350 мкг/кг был эффективен, в отличие от доз 35 мкг/кг или 3,5 мкг/кг при интраназальном введении (Shen et al., Am. J. Respix. Crit. Care Med. 2002, 166(2): 146-153).
Все публикации, цитированные в настоящем описании, приведены здесь только для ссылки. Разные модификации и вариации описанных способов, а также общая система представленного изобретения будут очевидны для специалистов, компетентных в данной области знаний, без какого-либо отступления от его сущности. Хотя данное изобретение было описано здесь в связи со специфическими предпочтительными вариантами его осуществления, необходимо понимать, что изобретение в том виде, в котором оно заявлено, нельзя ограничивать только этими специфическими вариантами осуществления. Действительно, разные модификации описанных способов реализации этого изобретения, очевидные для специалистов, компетентных в биохимии, молекулярной биологии и биотехнологии или смежных областях знаний, предназначены для воплощения в пределах следующих пунктов формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО РЕСПИРАТОРНОГО ЗАБОЛЕВАНИЯ | 2005 |
|
RU2395284C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ БРОНХИАЛЬНОЙ АСТМОЙ | 2008 |
|
RU2356544C1 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ АНТИМУСКАРИНОВЫЕ АГЕНТЫ И КОРТИКОСТЕРОИДЫ | 2005 |
|
RU2385721C2 |
| КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2300379C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2011 |
|
RU2568882C2 |
| АЭРОЗОЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ | 1992 |
|
RU2129424C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ДЛИТЕЛЬНОСТИ ИШЕМИИ МИОКАРДА У ПАЦИЕНТОВ С ХОБЛ И СОПУТСТВУЮЩЕЙ ИБС | 2016 |
|
RU2625028C1 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА Н, К-АТФАЗЫ ДЛЯ ЛЕЧЕНИЯ НОСОВЫХ ПОЛИПОВ | 1997 |
|
RU2197966C2 |
| ПРИМЕНЕНИЕ ГЛЮКОКОРТИКОИДНОЙ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ТЯЖЕЛОЙ И НЕКОНТРОЛИРУЕМОЙ АСТМЫ | 2010 |
|
RU2519344C2 |
| КРИСТАЛЛИЧЕСКИЙ СУЛЬФАТ ЛЕВОСАЛЬБУТАМОЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕГО | 2005 |
|
RU2440972C2 |
Изобретение относится к применению метилксантинового соединения, в частности теофиллина в суточной дозе от 0,1 до 25 мг, и глюкокортикоида в композиции для лечения хронического респираторного заболевания, как хроническая обструктивная болезнь легких, астма, причем композицию вводят в организм ингаляционным способом для ее доставки в легкие. Комбинация метилксантинового соединения в низкой дозе и глюкокортикоида обеспечивает синергетический эффект в отношении улучшения легочной функции и снижения воспаления. 6 н. и 13 з.п. ф-лы, 3 табл., 5 ил.
1. Применение метилксантинового соединения и глюкокортикоида для изготовления композиции для лечения хронического респираторного заболевания, выбранного из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), муковисцидоза, астмы, не поддающейся лечению стероидами, тяжелой астмы и педиатрической астмы человека, согласно которому указанную композицию вводят ингаляционным способом для легочной доставки, а метилксантиновое соединение вводят в суточной дозе от 0,1 до 25 мг.
2. Применение по п.1, где композиция содержит одну или более фармацевтически приемлемых добавок, разбавителей и/или носителей.
3. Применение по пп.1 и 2, согласно которому метилксантиновое соединение вводят в дозе, обеспечивающей его уровень в плазме от 1 пг/л до 1 мг/л.
4. Применение по п.1, согласно которому метилксантиновое соединение, используемое в композиции, выбрано из группы, состоящей из теофиллина, аминофиллина и окстрифиллина.
5. Применение по п.1, где ингаляционный глюкокортикоид выбран из группы, состоящей из будесонида, флутиказона и циклесонида.
6. Применение по п.5, где ингаляционный глюкокортикоид является будесонидом, причем указанный стероид вводят в организм в дозах от 200 до 1600 мкг в день.
7. Применение по п.5, где ингаляционный глюкокортикоид является флутиказоном, причем указанный стероид вводят в организм в дозах от 44 до 1000 мкг в день.
8. Применение по п.5, в котором ингаляционный глюкокортикоид представляет собой циклесонид, причем указанный стероид вводят в организм в дозах от 40 до 500 мкг в день.
9. Комбинация метилксантинового соединения и глюкокортикоида для совместного, одновременного (по отдельности) или последовательного применения для лечения хронического респираторного заболевания, выбранного из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), муковисцидоза, астмы, не поддающейся лечению стероидами, тяжелой астмы и педиатрической астмы, причем указанная комбинация адаптирована для введения ингаляционным способом для легочной доставки, а метилксантиновое соединение вводят в суточной дозе от 0,1 до 25 мг.
10. Фармацевтическая композиция, содержащая метилксантиновое соединение и глюкокортикоид для применения при лечении хронического респираторного заболевания, выбранного из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), муковисцидоза, астмы, не поддающейся лечению стероидами, тяжелой астмы и педиатрической астмы, причем указанная композиция адаптирована для введения ингаляционным способом с целью ее доставки в легкие, а метилксантиновое соединение вводят в суточной дозе от 0,1 до 25 мг.
11. Композиция по п.10, где метилксантиновым соединением является теофиллин, причем оно представлено в количестве от 0,1 до 25 мг, или от 0,05 до 13 мг, или от 0,033 до 9 мг на лекарственную дозу композиции, а указанные лекарственные дозы используют соответственно для введения один, два или три раза в сутки.
12. Композиция по п.10, где глюкокортикоидом является будесонид, причем он представлен в количестве от 200 до 1600 мкг, или от 100 до 800 мкг, или от 65 до 525 мкг на лекарственную дозу композиции, а указанные лекарственные дозы используют соответственно для введения один, два или три раза в сутки.
13. Композиция по п.10, где глюкокортикоидом является флутиказон, причем он представлен в количестве от 44 до 1000 мкг, или от 22 до 500 мкг, или от 11 до 335 мкг на лекарственную дозу композиции, а указанные лекарственные дозы используют соответственно для введения один, два или три раза в сутки.
14. Композиция по п.10, где глюкокортикоидом является циклесонид, причем он представлен в количестве от 40 до 500 мкг, или от 20 до 250 мкг, или от 14 до 170 мкг на лекарственную дозу композиции, а указанные лекарственные дозы используют соответственно для введения один, два или три раза в сутки.
15. Способ лечения хронического респираторного заболевания, выбранного из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), муковисцидоза, астмы, не поддающейся лечению стероидами, тяжелой астмы и педиатрической астмы человека, предусматривающий введение человеку, нуждающемуся в этом, композиции по любому из пп.10-14.
16. Набор для лечения хронического респираторного заболевания, выбранного из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), муковисцидоза, астмы, не поддающейся лечению стероидами, тяжелой астмы и педиатрической астмы, причем указанный набор содержит метилксантиновое соединение и глюкокортикоид в дозированной лекарственной форме, адаптированной для введения путем ингаляции с целью его доставки в легкие, при этом метилксантиновое соединение вводят в суточной дозе от 0,1 до 25 мг.
17. Набор по п.16, в котором метилксантиновое соединение и глюкокортикоид представлены в лекарственных дозах по любому из пп.11-14.
18. Набор по п.16 или 17, причем указанный набор изготовлен в виде ингалятора.
19. Способ лечения хронического респираторного заболевания, выбранного из группы, состоящей из хронической обструктивной болезни легких (ХОБЛ), муковисцидоза, астмы, не поддающейся лечению стероидами, тяжелой астмы и педиатрической астмы, предусматривающий введение субъекту, нуждающемуся в этом, путем ингаляции для легочной доставки количества глюкокортикоида, эффективного для лечения указанного легочного заболевания у субъекта, где улучшение, связанное с указанным способом, включает в себя повышение эффективности глюкокортикоида путем введения субъекту указанным путем ингаляции также и теофиллина, причем теофиллин вводят в дозе от 0,1 до 25 мг в сутки.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| 1971 |
|
SU421587A1 | |
| DAVID J | |||
| EVANS «A comparison of low-dose inhaled budesonide plus theophyllineand high-dose inhaled budesonide for moderate asthma» | |||
| The New England Journal of Medicine, том 337, №20, 1997, стр.1412-1418. | |||
Авторы
Даты
2010-07-27—Публикация
2006-02-13—Подача