Данное изобретение относится к кристаллическому сульфату левосальбутамола, его полиморфным формам, способам получения кристаллического продукта и к композициям на его основе.
Оно относится также к фармацевтической композиции, содержащей терапевтически эффективный изомер сальбутамола в комбинации с глюкокортикоидом, при этом композиция пригодна для лечения респираторных расстройств, включая бронхостеноз, астму, COPD и связанные с ними нарушения.
Известно, что астма представляет собой хроническое заболевание, которое включает воспаление легочных путей и бронхиальную гиперчувствительность, что приводит к клиническому проявлению обструкции нижних дыхательных путей, которая обычно является обратимой. Патофизиология астмы и связанных с ней нарушений включает бронхостеноз в результате бронхиального спазма гладких мышц и воспаление дыхательных путей с отеком слизистой оболочки. Известно, что при лечении астмы и родственных болезней применяют β-2-агонисты, известные также как агонисты β-2-адренорецепторов. Известно, что такие агонисты β-2-адренорецепторов приводят к расширению бронхов у пациентов, облегчая симптомы одышки. Более конкретно, было показано, что агонисты β-2-адренорецепторов увеличивают проводимость калиевых каналов в клетках мышц дыхательных путей, что приводит к гиперполяризации и релаксации мембран. Такие быстродействующие β-2-адренорецепторы, как сальбутамол и тербуталин, были рекомендованы для ослабления острых симптомов, в то время как агенты длительного действия, такие как сальметерол, формотерол и бамбутерол, предпочтительно применяются с другими лекарствами для длительного контроля за астмой.
Хроническая обструктивная легочная болезнь (COPD) является заболеванием, поддающимся профилактике и лечению, характеризующимся ограничением воздушного потока, которое не является полностью обратимым. COPD является зонтичным термином, используемым для описания заболевания легких, связанного с обструкцией (нарушением) дыхания. Ограничение дыхания обычно прогрессирует и связано с аномальным воспалительным ответом легких на вредные частицы или газы, в основном связанным с курением.
Бронходилататоры (бронхорасширители) являются основным средством лечения пациентов с устойчивым хроническим обструктивным легочным заболеванием (COPD), но в настоящее время большинство пациентов применяет β-агонисты.
Ингаляция сальбутамола признана в Британской фармакопее и применяется для лечения астмы.
Патент США №6702997, Dey, относится к ингаляционному раствору альбутерола, к системе, набору и способу облегчения бронхоспазма у детей, страдающих от астмы, он включает примерно от 0,63 мг до примерно 1,25 мг альбутерола.
Патент США №6251368 относится к составу аэрозоля, который содержит порошкообразное лекарство, выбранное из группы, состоящей из сальметерола, сальбутамола, флутиказона пропионата, беклометазона дипропионата и их физиологически приемлемых солей и сольватов, и фторированный углеводород или водородсодержащий хлорфторуглеводородный пропеллент, при этом состав практически не содержит поверхностно-активного вещества.
Патент США №5547884, Sepracor, описывает способ лечения астмы, использующий оптически чистый R-(-)-изомер альбутерола, который практически не содержит S(+)-изомера и является активным бронходилататором для облегчения симптомов, связанных с астмой, у индивидуумов.
Патент CN №1413976, Suzhou Junning New Drug Dev CT (CN), относится к синтезу левосальбутамола.
Заявка США на патент №2004054215, CIPLA Limited, относится к способу получения оптически чистого изомера альбутерола.
Несколько способов получения левальбутерола описаны в уровне техники, например в заявке США на патент №20040115136, King Code, которая относится к способу получения тартрата левальбутерола. Она также описывает свойства L-тартрата левальбутерола, желательные для его применения в дозирующем ингаляторе.
Сальбутамол (альбутерол) является антигистаминным соединением и агонистом β-2-адренорецептора, применяемым в качестве бронходилататора при лечении астмы и в качестве релаксанта матки для отсрочки преждевременных родов. Сальбутамол продается как рацемическая смесь, хотя активность β-2-агониста характерна почти исключительно для (R)-энантиомера. Энантиоселективное строение сальбутамола и возможность того, что (S)-сальбутамол имеет вредное действие, привели к получению энантиомерно чистого (R)-сальбутамола, известного как левосальбутамол (левальбутерол) (Формула I):
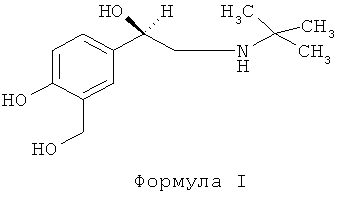
Способ получения оптически чистого сальбутамола из монозащищенного предшественника сальбутамола описан в патенте США №5545745.
В заявке США №2004114136 и заявке WO 2004/052835 описаны способ получения L-тартрата левальбутерола в кристаллической форме; фармацевтическая композиция, содержащая тартрат левальбутерола в кристаллической форме; дозирующий ингалятор, включающий приемник, содержащий аэрозоль L-тартрата левальбутерола в кристаллической форме и способ воздействия на расширение бронхов у пациента с применением L-тартрата левальбутерола в кристаллической форме.
Левосальбутамол получают гидрированием R-бензилсальбутамола в присутствии палладия на угле.
R-бензилсальбутамол может быть получен способом, описанным в патенте США №5545745.
Исследования доказали, что рацемат альбутерола, обычно применяемый бронходилататор, представляет собой точно 50:50 смесь двух энантиомеров, R- и S-изомеров сальбутамола. Только R-энтантиомер (левосальбутамол) является активным стимулятором β2-адренорецептора, в то время как S-энантиомер (декстросальбутамол) обнаруживает небольшую активность адренорецептора или совсем ее не имеет.
Среди различных классов лекарств, которые обычно применяются для ингаляции при лечении респираторных заболеваний, большое значение имеют глюкокортикостероиды, такие как беклометазона дипропионат (BDP), дексаметазон, флунизолид, будесонид, флутиказона пропионат. Они могут быть введены в виде мелкоизмельченного, а именно микронизированного, порошка, в виде суспензии в водной фазе, содержащей любой необходимый сурфактант и/или сорастворители; при введении в виде отмеренных доз аэрозоля, они должны также содержать низкокипящий пропеллент.
Эффективность вводимой формы зависит от осаждения адекватного количества частиц в месте действия. Один из наиболее критических параметров, определяющих количество вдыхаемого лекарства, которое должно достичь нижних дыхательных путей пациента, представляет собой размер частиц, выходящих из прибора. Для обеспечения эффективного проникновения в бронхиолы и альвеолы и, следовательно, получения вдыхаемой фракции средний аэродинамический диаметр (MMAD) частиц должен быть менее 5-6 мк. Для введения через нос требуются частицы с большим MMAD.
Флутиказона пропионат сам по себе известен из GB 2088877, он имеет противовоспалительную активность и пригоден для лечения аллергических и воспалительных состояний носа, горла или легких, таких как астма или ринит, включая сенную лихорадку. Флутиказона пропионат в виде аэрозоля одобрен для лечения астмы и продается под марками Flovent I и "Flonase". Флутиказона пропионат можно также применять в виде физиологически приемлемого сольвата.
НК №1009406 относится к дозирующему ингалятору для доставки путем ингаляции лекарственного состава, содержащего флутиказона пропионат, или его физиологически приемлемый сольват, фторуглеводородный пропеллент, возможно в комбинации с одним или более физиологически активными агентами или одним или более наполнителями.
Авторы настоящего изобретения полагают, что применение комбинации сальбутамола или его физиологически приемлемой соли и вдыхаемого кортикостероида имеет клинические преимущества при лечении COPD по сравнению с применением сальбутамола или кортикостероида в отдельности.
Патент США №6013245 относится к фармацевтическому составу аэрозоля, который содержит частицы безводного беклометазона дипропионата вместе с 1,1,1,2,3,3,3-гептафтор-н-пропаном в качестве пропеллента, при этом состав не содержит поверхностно-активного вещества. Состав может также содержать сальбутамол, и прибор включает баллон, пригодный для доставки; описан также способ лечения респираторных нарушений путем введения состава при помощи ингаляции.
Заявка США №2004136920 относится к составу аэрозоля, вводимого путем ингаляции, который содержит частицы сальбутамола и его физиологически приемлемые соли, и сольваты, и фторуглеводород или водородсодержащий хлорфторуглеводород в качестве пропеллента, и практически не содержит поверхностно-активных веществ. В заявке описан также способ лечения респираторных заболеваний путем введения путем ингаляции эффективного количества аэрозольного состава, указанного выше.
Данное изобретение направлено на создание активной фармацевтической композиции, содержащей терапевтически эффективный изомер сальбутамола или его соли, сольвата, эфира, производного или его полиморфа в комбинации с кортикостероидом.
Цель данного изобретения состоит в создании фармацевтической композиции, содержащей по меньшей мере два лекарства, одно из которых является терапевтически эффективным изомером сальбутамола или его солью, сольватом, эфиром, производным или полиморфной формой в сочетании со вдыхаемым кортикостероидом и фармацевтически приемлемый носитель или эксципиент и, возможно, один или несколько других терапевтических агентов.
Другой целью данного изобретения является создание фармацевтической композиции, содержащей терапевтически эффективный изомер сальбутамола или его соль, сольват, эфир, производное или полиморфную форму, которая не имеет побочного действия, связанного с высокими дозами рацемата.
Еще одной целью данного изобретения является создание способа получения фармацевтической композиции, содержащей терапевтически эффективный изомер сальбутамола в комбинации со вдыхаемым кортикостероидом.
Еще одной целью данного изобретения является создание способа лечения млекопитающего, такого как человек, от респираторных расстройств, таких как астма, нарушения, приводящие к бронхостенозу, этот способ включает введение терапевтически эффективного количества фармацевтической композиции по данному изобретению.
Цель данного изобретения состоит также в создании способа уменьшения побочных эффектов комбинации лекарств, содержащей по меньшей мере два лекарства, у пациента, включающего стадии введения путем ингаляции пациентом, нуждающимся в этом, эффективного количества фармацевтической композиции, содержащей по меньшей мере два лекарства и пропеллент.
Согласно данному изобретению предусмотрена фармацевтическая композиция, содержащая терапевтически эффективный изомер сальбутамола, или его соль, сольват, эфир, производное или полиморфную форму, глюкокортикоид и фармацевтически приемлемые носитель или эксципиент и, необязательно, один или несколько других терапевтических агентов.
Предусмотрен также способ получения фармацевтической композиции, содержащей терапевтически эффективный изомер сальбутамола, или его соль, сольват, эфир, производное или полиморфную форму, глюкокортикоид и фармацевтически приемлемые носитель, при этом способ включает смешение ингредиентов с получением указанной композиции.
Изобретение предусматривает также применение композиции по изобретению в качестве лекарственного вещества для лечения респираторных расстройств и связанных с ними состояний, включая бронхостеноз, астму и COPD.
Данное изобретение предусматривает также способ лечения млекопитающего, такого как человек, от респираторных расстройств, таких как астма, нарушения, приводящие к бронхостенозу, этот способ включает введение терапевтически эффективного количества фармацевтической композиции по данному изобретению.
Известно, что β-2-адренорецепторы обеспечивают бронхорасширяющее действие на пациентов за счет воздействия на β-2-адренергические рецепторы в гладких мышцах дыхательных путей и гладких бронхиальных мышцах, приводя к облегчению симптомов одышки. Более конкретно, они увеличивают проводимость калиевых каналов в клетках мышц дыхательных путей, что приводит к гиперполяризации и релаксации мембран. Поэтому они предпочтительны при лечении астмы, которое требует расширения бронхиальных гладких мышц и облегчения одышки, связанной с астмой. Более конкретно, β-2-адренорецепторы быстрого действия очень полезны, так как они обеспечивают более быстрое начало действия и скорое облегчение.
Данное изобретение относится к одному такому быстро действующему β-2-адренорецептору, сальбутамолу. Сальбутамол доступен в виде рацемической смеси, содержащей R- и S-формы. Но только R-энантиомер (левосальбутамол) является активным стимулянтом β-2-адренорецептора, в то время как S-энантиомер (декстросальбутамол) не проявляет активности как адренорецептор или проявляет небольшую активность. Бронхорасширяющее действие рацемата сальбутамола обусловлено только (R)-сальбутамолом, который обладает сродством к связыванию β-2-адренорецепторов, примерно в 100 раз превышающим этот показатель для (S)-сальбумамола. Сообщалось, что сальбутамол in vitro ускоряет поступление внутриклеточного Са2+ в клетки гладких мышц дыхательных путей и увеличивает холинергическую активацию гладких мышц дыхательных тулей. Таким образом, в отсутствие (R) -сальбутамола (S)-сальбутамол обладает способностью вызывать бронхостеноз у больных астмой. Это повышает предпочтительность левосальбутамола по сравнению с рацематом сальбутамола при лечении астмы и других заболеваний дыхательных путей.
Левосальбутамол является также более активным бронходилататором при введении как единственный энантиомер по сравнению с тем же количеством рацемической смеси.
Левосальбутамол обеспечивает сравнимую эффективность при дозе, равной почти 1/4 дозы рацемического сальбутамола, одновременно снижая бета-опосредованное побочное действие.
Согласно данному изобретению предусмотрены также составы аэрозолей, которые содержат два или более лекарственных вещества в виде частиц. Лекарства могут быть выбраны из подходящих комбинаций лекарств, упомянутых выше, или из любых других подходящих для ингаляции лекарств. Предпочтительно, чтобы лекарственное вещество было в форме, которая практически полностью не растворима в выбранном пропелленте.
Подходящие лекарства могут, таким образом, быть выбраны из, например, анальгетиков, в том числе кодеина, дигидроморфина, эрготамина, фентанила или морфина; лекарств для лечения ангин, например дилтиазема; противоаллергических веществ, например кромогликата, кетотифена или недокромила; противоинфекционных средств, например цефалоспоринов, пенициллинов, стрептомицина, сульфонамидов, тетрациклинов и пентамидина; антигистаминных веществ, например метапирилена; противовоспалительных средств, например флунисолида, будесонида, типредана или триамцинолона ацетонида; противокашлевых средств, например носкапина; бронходилататоров, например эфедрина, адреналина, фенотерола, формотерола, изопреналина, метапротенерола, фенилэфрина, фенилпропаноламина, пирбутерола, репротерола, римитерола, тербуталина, изоэтарина, тулобутерола, орципреналина или (-) -амино-3,5-дихлор-[альфа]-[[[6-[2-(2-пиридинил)этокси[гексил]амино]метил]-бензолметанола; диуретиков, например амилорида; антихолинергиков, например ипатропия, атропина или окситропия; гормонов, например кортизона, гидрокортизона или преднизолона; ксантинов, например аминофиллина, холина теофиллината, лизина теофиллината или теофиллина; терапевтических белков или пептидов, например инсулина или глюкагона. Специалисту ясно, что, где это можно, лекарства можно применять в виде солей (например, щелочных металлов или солей с аминами или солей присоединения к кислотам) или в виде эфиров (например, низших алкиловых эфиров), или в виде сольватов (например, гидратов) для оптимизации активности и/или стабильности лекарства и/или для снижения растворимости лекарства в пропелленте.
Коммерчески доступная композиция сальбутамола, содержащая рацемическую форму, содержит 100-200 мкг сальбутамола, а композиция по изобретению содержит почти половину этой дозы или даже меньше и является терапевтически более эффективной за счет использования R-формы сальбутамола, левосальбутамола. Благодаря сниженной дозе наблюдаются менее выраженные сердечно-сосудистые осложнения, которые связаны с более высокими дозами бронходилататоров. Следовательно, применение такого терапевтически эффективного изомера приводит к лучшему самочувствию пациентов.
Таким образом, данное изобретение предусматривает фармацевтическую композицию, содержащую терапевтически эффективный изомер сальбутамола или его соль, сольват, эфир производное или полиморф, которая не обладает побочным действием, связанным с более высокими дозами рацемата.
По всему описанию и в формуле используется термин "левосальбутамол" в широком его смысле, он включает не только левосальбутамол сам по себе, но также его фармацевтически приемлемые соли, производные или полиморфные формы. Фармацевтически приемлемые соли левосальбутамола включают сульфат левосальбутамола, тартрат левосальбутамола, гидрохлорид левосальбутамола. Предпочтительно применять сульфат левосальбутамола.
Активные соединения и различные их производные могут быть получены в соответствии с известными методами, очевидными для специалистов.
Данное изобретение предусматривает применение самого активного в терапевтическом смысле изомера сальбутамола. Композиции практически не содержат менее терапевтически эффективного изомера, что означает, что этот изомер не содержится в сколько-нибудь значительном количестве.
Такие изомеры содержатся в количестве не более 10% вес./вес. активного вещества, более предпочтительно в количестве 1% вес./вес. или менее.
Так, например, композиции, содержащие левосальбутамол, практически не содержат S-изомер этого соединения.
Хотя можно применять любую форму композиции, особенно предпочтительными являются аэрозоль, DPI или растворы/суспензии для ингаляции, содержащие левосальбутамол (например, в виде свободного основания или сульфата) в сочетании с противовоспалительным стероидом, таким как эфир беклометазона (например, дипропионат) или эфир флутиказона (например, пропионат) или антиаллергеном (например, его натриевой солью).
Композиции сальбутамола и флутиказона пропионата или беклометазона дипропионата или будесонида предпочтительны. Очевидно, что для композиций для ингаляции, таких как аэрозоли, активные вещества должны быть в виде, пригодном для ингаляции.
В композициях по изобретению мы предпочитаем применять полиморфные формы сульфата левосальбутамола, обозначаемые как Форма I, Форма II и Форма III. Эти соединения являются новыми и образуют дальнейший аспект данного изобретения.
Соответственно, согласно одному аспекту изобретение предусматривает кристаллический сульфат левосальбутамола (Форма I), характеризующийся параметрами дифракционной решетки порошка: 10,8, 11,9, 13,0, 18,3, 28,5±0,2 градуса 2-тета.
Согласно другому аспекту предусмотрена кристаллическая форма сульфата левосальбутамола (Форма II), характеризующаяся рентгеновской порошковой рентгенограммой с пиками при 8,7, 9,6, 15,2, 15,7, 19,1, 27,2, 30,7±0,2 градуса (2 θ).
Согласно еще одному аспекту предусмотрена кристаллическая форма сульфата левосальбутамола (Форма III), характеризующаяся порошковой рентгенограммой с пиками при 5,5, 6,9, 7,3, 18,7±0,2 градуса (2 θ).
Данное изобретение предусматривает также различные способы получения Форм I, II и III.
Способ получения кристаллической Формы I сульфата левосальбутамола включает (а) добавление левосальбутамола к органическому растворителю, (б) регулирование рН путем добавления серной кислоты при температуре от 1 до 10°С и (в) выделение продукта (Формы I) при температуре от 0 до 10°С.
Способ получения кристаллической Формы I сульфата левосальбутамола включает (а) растворение любой формы сульфата левосальбутамола в воде, (б) соединение раствора со стадии (а) со смешивающимся с водой органическим растворителем для осаждения продукта и (в) выделение Формы I.
Способ получения кристаллической Формы II сульфата левосальбутамола включает (а) растворение любой формы сульфата левосальбутамола в воде, (б) отгонку с получением остатка, (в) обработку остатка органическим растворителем и (г) суспендирование твердого продукта в органическом растворителе и (д) выделение кристаллической Формы II.
Еще один способ получения Формы II включает струйное измельчение любой другой формы сульфата левосальбутамола, например струйное измельчение кристаллической Формы I.
Способ получения кристаллической Формы III сульфата левосальбутамола включает (а) добавление левосальбутамола к органическому растворителю, (б) регулирование рН путем добавления серной кислоты при температуре от 25 до 30°С и (в) выделение продукта (Формы III) при температуре от 25 до 30°С.
Другой способ получения кристаллической формы III сульфата левосальбутамола включает (а) растворение любой формы сульфата левосальбутамола в воде, (б) соединение раствора со стадии (а) со смешивающимся с водой органическим растворителем для осаждения продукта и (в) выделение Формы III при температуре от 25 до 30°С.
Данное изобретение относится также к фармацевтической композиции, содержащей соединение по изобретению и фармацевтически приемлемый носитель.
Новые соединения и композиции на их основе предназначены для применения в качестве лекарственных веществ, особенно при лечении респираторных расстройств и родственных состояний.
На Фиг.1 представлена рентгеновская порошковая диффрактограмма Формы I сульфата левосальбутамола.
На Фиг.2 показаны ИК-спектры Формы I сульфата левосальбутамола.
На Фиг.3 представлена рентгеновская порошковая диффрактограмма Формы II сульфата левосальбутамола.
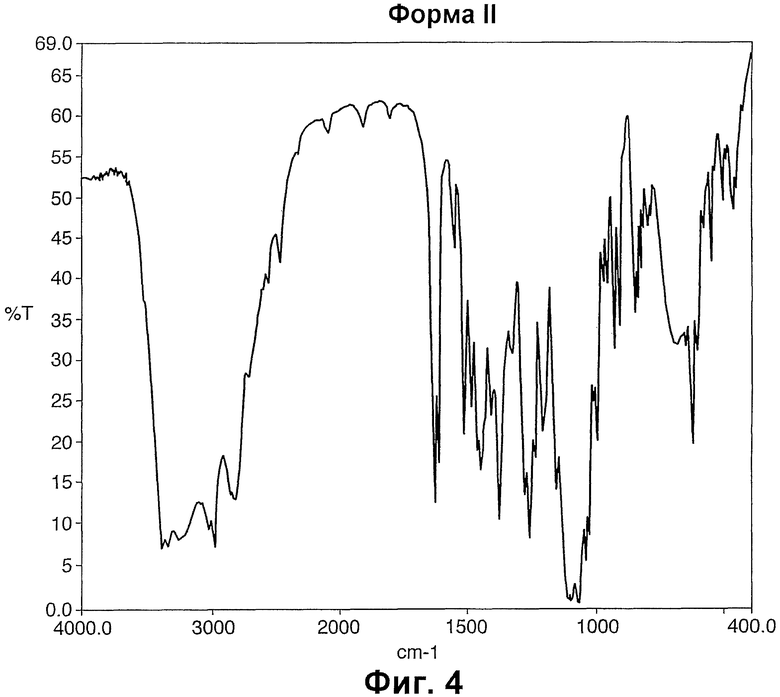
Фиг.4 отражает ИК-спектры Формы II сульфата левосальбутамола.
На Фиг.5 показана рентгеновская порошковая диффрактограмма Формы III сульфата левосальбутамола.
На Фиг.6 представлены ИК-спектры Формы III сульфата левосальбутамола.
В Таблице 1 приведены числовые данные для рентгеновской диффрактограммы на Фиг.1 (Форма I).
В Таблице 2 приведены числовые данные для рентгеновской диффрактограммы на Фиг.3 (Форма II).
В Таблице 3 приведены числовые данные для ренгеновской диффрактограммы на Фиг.5 (Форма III).
Кристаллическая Форма I сульфата левосальбутамола характеризуется параметрами дифракционной решетки, имеющими значительные отражения, выраженные как величины 2θ при 10.781, 11.941, 13.002, 18.341, 28.541±0.2 градуса, что видно из Таблицы 1.
Порошковая диффрактограмма кристаллической Формы I сульфата левосальбутамола показана на Фиг.1. Основные пики и их интенсивности порошковой диффрактограммы показаны в Таблице 1. Интенсивности отражений также выражены в процентах от величины наиболее интенсивного отражения.
Другие предпочтительные значительные отражения для Формы I, выраженные как значения 2θ, включают 12.66, 15.819, 17.4, 20.939, 21.72, 22.5, 23.14, 24.341, 26.12, 31.28, 31.93±0.2 градуса. Порошковые диффрактограммы для всех полиморфных форм, описанных в данной заявке, были получены на диффрактометре Rigaku d-max 2200 с применением Cu K α-излучения (λ=1,5405 Å).
Кристаллическая Форма I сульфата левосальбутамола также охарактеризована ИК-спектрами с пиками при 3568, 3307, 2980, 2799, 2561, 2458, 1615, 1508, 1440, 1380, 1342, 1258, 1200, 1112, 1082, 1029, 976, 915, 836, 793, 775, 752, 648, 617, 535, 497, 453 см-1.
На Фиг.2 приведены ИК-спектры Формы I. ИК-спектры для всех полиморфных Форм, описанных в данной заявке, записывали, используя Spectrum - 1 Perkin Elmer Sample, и анализировали гранулы KBr в области 4000-400 см-1.
При получении кристаллической Формы I сульфата левосальбутамола предпочтительно гидрируют R-бензилсальбутамол с применением катализатора, предпочтительно палладия на угле, в большом объеме органического растворителя. Предпочтительно применять спиртовой растворитель, более предпочтительно этиловый спирт. Обычно процесс проводят под давлением водорода, предпочтительно равном 30 ф/дюйм2 (206,8 кПа). Затем предпочтительно отфильтровывают катализатор, рН фильтра доводят предпочтительно до 5,0-5,5 при 0-10°С серной кислотой, лучше концентрированной серной кислотой, при этом получают кристаллы, которые отфильтровывают и высушивают, получая Форму I сульфата левосальбутамола. Продукт (Форма I) может быть получен выделением при температуре 0-10°С.
Кристаллическая Форма II сульфата левосальбутамола характеризуется рентгеновской порошковой диффрактограммой со значительными отражениями, выраженными в виде величин 2θ при примерно 8.701, 9.636, 15.180, 15.657, 19.139, 27.199, 30.702±0.2 градуса, что видно из Таблицы 2.
Порошковая диффрактограмма Формы II сульфата левосальбутамола показана на Фиг.3. Основные пики и их интенсивности приведены в Таблице 2. Интенсивности пиков выражены в процентах от величины наиболее интенсивного отражения.
Другие предпочтительные значительные отражения для Формы II выражены в величинах 2θ, включают пики при примерно 8.701, 9.636, 15.180, 18.657, 17.44, 19.139, 21.699, 22.201, 22.837, 23.339, 23.76, 24.361, 25.022, 25.399, 26.059, 26.321, 27.199, 30.702±0.2 градуса.
Кристаллическая Форма II сульфата левосальбутамола характеризуется также ИК-спектрами с пиками при 3393, 3026, 2982, 2822, 246, 630, 1614, 1513, 1484, 1448, 1380, 1321, 1279, 1258, 1235, 1204, 1155, 1093, 1066, 1036, 1023, 919, 900, 838, 829, 818, 808, 788, 618, 596, 540, 493, 453, 440 см-1.
ИК-спектры Формы II показаны на Фиг.4.
Способ получения кристаллической Формы II сульфата левосальбутамола включает растворение любой формы сульфата левосальбутамола в воде и отгонку до получения остатка. Осадок освобождают от органического растворителя, который предпочтительно смешивается с водой и предпочтительно является ацетоном, твердый остаток затем суспендируют в растворителе, предпочтительно том же самом, и выделяют продукт, предпочтительно путем фильтрования, и высушивают под вакуумом с получением Формы II сульфата левосальбутамола.
Кристаллическая Форма III сульфата левосальбутамола характеризуется порошковой диффрактограммой (рентгенограммой) со значительными отражениями, выраженными в величинах 2θ при 5.496, 6.901, 7.340, 18.660±0,2 градуса, что видно из Таблицы 3.
Порошковая рентгеновская диффрактограмма Формы III сульфата левосальбутамола показана на Фиг.5. Основные пики и их интенсивности приведены в Таблице 3. Интенсивности этих пиков также выражены в процентах от величины наиболее интенсивного отражения.
Другие значительные отражения для Формы III, выраженные в величинах 2θ, включают пики при примерно 5.496, 6.901, 7.340, 8.18, 8.399, 10.978, 11.758, 14.298, 16.321, 17.98, 18.18, 18.660, 18.86, 19.189, 20.179, 20.72, 20.019, 22.219, 23.121, 23.64, 23.858, 24.638, 25.339, 27.62, 28.79, 29.319, 30.80, 32.341, 33.218, 33.781, 34.181±0,2 градуса.
Кристаллическая Форма III сульфата левосальбутамола также характеризуется ИК-спектрами с пиками при 3533, 3412, 3086, 2979, 2823, 2799, 1613, 1547, 1505, 1437, 1397, 1380, 1365, 1353, 1303, 1256, 1243, 1198, 1110, 1133, 1086, 1075, 1055, 1029, 990, 949, 919, 838, 792, 737, 723, 640, 618, 563, 536, 480, 442, 425 см-1.
На Фиг.6 показаны ИК-спектры Формы III.
При получении кристаллической Формы III сульфата левосальбутамола предпочтительно гидрируют R-бензилсальбутамол с применением катализатора, предпочтительно палладия на угле, в большом объеме органического растворителя. Предпочтительно применять спиртовой растворитель, более предпочтительно этиловый спирт. Обычно процесс проводят под давлением водорода, предпочтительно равном 30 ф/дюйм2 (206,8 кПа). Форма III может быть выделена путем регулирования рН серной кислотой при комнатной температуре (25-30°С) и выделения продукта при комнатной температуре (25-30°С). Предпочтительно на этих стадиях отфильтровывают катализатор и промывают, например, денатурированным спиртом. Величину рН фильтрата предпочтительно доводят до 5,0-5,5 при комнатной температуре (25-30°С) серной кислотой, лучше концентрированной серной кислотой, при этом получают кристаллы, которые отфильтровывают и высушивают, получая Форму III. Продукт (Форма III) может быть получен путем выделения при температуре от 25 до 30°С.
Другой способ получения Формы II включает струйное измельчение любой другой формы сульфата левосальбутамола, например струйное измельчение кристаллической Формы I.
Очевидно, что кристаллический сульфат левосальбутамола и его полиморфные формы, описанные в данной заявке, могут быть соединены с обычными эксципиентами, вспомогательными веществами и носителями с получением большого ряда фармацевтических композиций, включая, но без ограничения, таблетки, капсулы, пилюли, каплеты, MDI, PDI и составы Respule, оральные жидкости, такие как сиропы. При необходимости могут быть приготовлены обычные составы и составы с пролонгированным высвобождением. Специалисту известны обычные ингредиенты,которые можно применять для приготовления этих композиций. Такие составы получают в соответствии со стандартными методиками.
В частности, соединения по изобретению могут быть соединены с одними или более другими фармацевтически активными соединениями, как это очевидно для специалиста. Может быть любая подходящая комбинация активных ингредиентов, при условии, что она приемлема с фармацевтической точки зрения. Соединения по изобретению можно, например, соединять с кортикостероидами, такими как флутиказон, беклометазон или будесонид; с антихолинергическими агентами, такими как ипратропий, тиотропий или атропин; с муколитическими агентами, такими как амброксол; с ксантинами, такими как теофиллин; с антигистаминными средствами; с анальгетиками и бронходилататорами. Как очевидно, это дополнительное активное вещество (вещества) могут быть в любой подходящей форме, включая их фармацевтически приемлемые производные, в том числе их соли, эфиры, полиморфы, оптически активные формы, а также рацематы.
Следовательно, данное изобретение предусматривает фармацевтическую композицию, содержащую кристаллический сульфат левосальбутамола, в частности Форму I, Форму II или Форму III, в сочетании с одним или несколькими фармацевтически активными соединениями и, возможно, с фармацевтически приемлемым носителем.
Композиции по данному изобретению предпочтительно вводить путем ингаляции для того, чтобы обеспечить эффективную степень локального действия и избежать нежелательных побочных эффектов. Данные композиции могут также содержать фармацевтически приемлемые эксципиенты для получения нужного состава и они могут поставляться в форме, подходящей для дозирующих ингаляторов.
Аэрозольный состав по изобретению в дополнение к комбинации левосальбутамола с противовоспалительным стероидом или вдыхаемым глюкокортикоидом и по меньшей мере одним пропеллентом может включать другие фармацевтически приемлемые агенты, такие как сорастворители, антиоксиданты или поверхностно-активные вещества.
В случае аэрозольных составов в композицию добавляют пропеллент. Подходящие пропелленты включают пропеллент 11 (дихлордифторметан), пропеллент 12 (монофтортрихлорметан), пропеллент 114, 1,1,1,2-тетрафторэтан (HFA 134а) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227) или смеси двух или более таких галогензамещенных углеводородов.
Состав аэрозоля по изобретению может быть приготовлен путем диспергирования лекарства в выбранном пропелленте в подходящем контейнере, например, при помощи ультразвука. Процесс желательно проводить в безводных условиях, чтобы избежать вредного воздействия влаги на стабильность суспензии.
Составы по изобретению образуют слабо флоккулированные суспензии при стоянии, но неожиданно было установлено, что эти суспензии легко редиспергируются при умеренном перемешивании с получением суспензий, имеющих прекрасные характеристики в отношении доставки при применении в ингаляторах, работающих под давлением, даже после длительного хранения. Минимизация количества и даже возможность отсутствия в составе аэрозоля по изобретению эксципиентов, например поверхностно-активных веществ, сорастворителей и т.д., также являются преимуществом, так как составы практически не имеют вкуса и запаха, меньше раздражают и менее токсичны по сравнению с обычными составами.
По предпочтительному варианту данного изобретения состав аэрозоля может содержать терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму вместе с противовоспалительным стероидом или вводимым путем ингаляции глюкокортикоидом и или с пропеллентом 11, или с пропеллентом 114 или с их комбинацией и пропеллентом 12.
Согласно другому предпочтительному варианту данного изобретения аэрозоль может включать терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму вместе с вводимым путем ингаляции глюкокортикоидом или вводимым путем ингаляции глюкокортикоидом и или с пропеллентом 11, или с пропеллентом 114 или с их комбинацией и пропеллентом 12 и с поверхностно-активным веществом.
Во время испытания этого состава было обнаружено, что в отсутствие поверхностно-активного вещества не удается получить гомогенную дисперсию лекарства. Были испытаны различные известные поверхностно-активные вещества, такие как масла, например кукурузное масло, оливковое масло, хлопковое масло и подсолнечное масло, минеральные масла, такие как жидкий парафин, олеиновая кислота, а также фосфолипиды, такие как лецитин или эфиры жирных кислот и сорбитан, например олеат сорбитана. Лецитин привел к получению довольно хорошей стабильности суспензии, когда сульфат левосальбутамола применяли в комбинации с флутиказоном и будесонидом. Предпочтительным поверхностно-активным веществом является олеиновая кислота в случае применения сульфата левосальбутамола в комбинации с беклометазоном.
Поверхностно-активное вещество применяют в концентрации, равной 0,001-100% по весу в расчете на все активные ингредиенты. Предпочтительно вводить его в количестве, равном 1-50%, более предпочтительно в количестве, равном 5-30%. Согласно данному изобретению концентрация поверхностно-активного вещества предпочтительно составляет 10% (по весу в расчете на активные ингредиенты). Обычно активные ингредиенты представляют собой смесь двух активных веществ, например левосальбутамола и глюкокортикоида.
В составах для ингаляции очень важен размер частиц. Предпочтительный размер частиц равен 2-5 мкм. Было также обнаружено, что размер частиц оказывает заметное влияние на количество активного вещества в аэрозоле, которое доставляется при ингаляции.
Во время другого опыта лекарства смешивали с пропеллентом 11 или пропеллентом 114 или с их комбинацией, помещали в контейнеры, спрессовывали контейнеры и заряжали их пропеллентом 12. Было установлено, что это обеспечивало низкую FPD (дозу мелкодисперсных частиц). Поэтому оба лекарства и/или поверхностно-активное вещество измельчали до микросостояния с пропеллентом 11 или пропеллентом 114 или с их комбинацией с получением суспензии и затем помещали ее в контейнеры, заряжая их пропеллентом 12. Это привело к большей FPD по сравнению с CFC-аэрозолями, когда не проводили микроизмельчения. Следовательно, предпочтительно для получения большей FPD проводить микроизмельчение.
В широком аспекте данное изобретение предусматривает способ изготовления фармацевтической композиции, включающей терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму и глюкокортикоид в среде пропеллента, причем этот способ состоит в смешении указанных ингредиентов с получением указанной композиции.
Согласно дальнейшему варианту данного изобретения предусмотрен способ получения фармацевтического состава аэрозоля, содержащего терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму и глюкокортикоид, включающий (а) добавление двух лекарств, возможно вместе с поверхностно-активным веществом, пропеллентом 11 или пропеллентом 114 или с их комбинацией в контейнер, (б) опрессовку контейнера с клапаном и (в) введение пропеллента 12 через клапан. Предпочтительно применять на стадии (а) измельченные или микроизмельченные активные вещества вместе с пропеллентом.
Согласно еще одному аспекту изобретения состав аэрозоля может содержать терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму и глюкокортикоид и/или 1,1,1,2-тетрафторэтан (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтан (HFA 227) или их комбинацию.
Согласно еще одному аспекту изобретения предусмотрен способ получения вышеуказанного состава аэрозоля, который включает (а) добавление терапевтически эффективного изомера сальбутамола и глюкокортикоида в контейнер, (б) опрессовку контейнера с дозирующим клапаном и (в) загрузку в контейнер 1,1,1,2-тетрафторэтана (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтана (HFA 227) или их комбинации. На стадии (а) можно добавлять сорастворитель или наполнитель, поверхностно-активное вещество или сорастворитель и поверхностно-активное вещество.
Согласно еще одному аспекту изобретения состав аэрозоля может содержать терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму и глюкокортикоид и/или 1,1,1,2-тетрафторэтан (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтан (HFA 227) или их комбинацию и сорастворитель. В этом случае сорастворитель имеет большую полярность, чем пропеллент.
Обычно сорастворитель содержится в количестве от 0,01 до 5% по весу в расчете на композицию. Применяемый сорастворитель может быть любым подходящим, например, выбранным из группы гликолей, в частности из пропиленгликоля, полиэтиленгликоля, и глицерина или спиртов, таких как этанол. Обычно сорастворитель представляет собой этанол.
Согласно предпочтительному аспекту изобретения предусмотрен способ получения вышеуказанной композиции, который включает а) добавление обоих лекарств в контейнер, б) добавление сорастворителя к а) и обработку ультразвуком, в) опрессовку контейнера с дозирующим клапаном и (в) загрузку в контейнер 1,1,1,2-тетрафторэтана (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтана (HFA 227) или их комбинации.
Согласно другому предпочтительному варианту состав аэрозоля может содержать терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму и глюкокортикоид и/или 1,1,1,2-тетрафторэтан (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтан (HFA 227) или их комбинацию, поверхностно-активное вещество и сорастворитель.
Поверхностно-активное вещество (или сурфактант) стабилизирует состав и способствует смазке системы клапана в ингаляторе. Некоторые из обычно используемых поверхностно-активных веществ известны, и их выбирают из Polysorbate 20, Polysorbate 80, Myvacet 9-45, Myvacet 9-08, изопропилмиристата, олеиновой кислоты, Brij, эталолеата, глицерилтриолеата, глицерилмоноолеата, глицерилмоностеарата, глицерилмонорицинолеата, цетилового спирта, стеарилового спирта, цетилпиридинийхлорида, блочных сополимеров, природных масел, поливинилпирролидона, эфиров жирных кислот и сорбитана, таких как триолеат сорбитана, полиэтоксилированных эфиров жирных кислот и сорбитана (например, полиэтоксилированного триолеата сорбитана), олеата сорбимакрогола, синтетических амфотензидов (тритонов), этиленоксидных эфиров продуктов конденсации октилфенолформальдегида, фосфатидов, таких как лецитин, полиэтоксилированных жиров, полиэтоксилированных олеотриглицеридов и полиэтоксилированных алифатических спиртов.
Поверхностно-активные вещества обычно применяют в количестве 0,02-10% от веса активных веществ.
По другому аспекту изобретения предусмотрен способ получения вышеописанной композиции, который включает а) добавление лекарств в контейнер, б) добавление сорастворителя и поверхностно-активного вещества к а) и обработку ультразвуком, в) опрессовку контейнера с дозирующим клапаном, г) добавление в контейнер 1,1,1,2-тетрафторэтана (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтана (HFA 227) или их комбинации.
Согласно другому аспекту данного изобретения состав аэрозоля может содержать терапевтически эффективный изомер сальбутамола, глюкокортикоид, наполнитель и пропеллент, который предпочтительно представляет собой HFA 134а или HFA 227 или их комбинацию. Наполнитель действует как носитель для лекарства для доставки в легкие. Наполнитель может содержаться в концентрации 10-500% по весу в расчете на все количество активных веществ. Более предпочтительно он содержится в количестве 10-300% по весу в расчете на все количество активных веществ. Наполнитель может быть выбран из класса сахаридов, включая моносахариды, дисахариды, полисахариды и сахарные спирты, такие как арабиноза, глюкоза, фруктоза, рибоза, манноза, сахароза, трегалоза, лактоза, мальтоза; крахмалов, декстрана или маннита.
Согласно еще одному предпочтительному аспекту данного изобретения предусмотрен способ получения вышеуказанного состава аэрозоля, который включает а) добавление активных веществ в контейнер, б) добавление наполнителя к а), (в) опрессовку контейнера с дозирующим клапаном и г) добавление в контейнер пропеллента.
Согласно еще одному предпочтительному аспекту данного изобретения состав аэрозоля может содержать по меньшей мере один терапевтически эффективный изомер сальбутамола, его соль, сольват, эфир, производное или полиморфную форму, глюкокортикоид, поверхностно-активное вещество и/или 1,1,1,2-тетрафторэтан (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтан (HFA 227) или их комбинацию. Поверхностно-активное вещество может быть любым подходящим, например, выбранным из перечисленных выше или из класса солей стеариновой кислоты или сложных эфиров, таких как аскорбилпальмитат, изопропилмиристат, и эфиров токоферола. Предпочтительны магниевая соль стеариновой кислоты и изопропилмиристат. Поверхностно-активное вещество обычно применяют в количестве 0,01-1% по весу в расчете на общее количество активных веществ.
Согласно предпочтительному аспекту данного изобретения предусмотрен способ получения вышеуказанного состава аэрозоля, который включает а) добавление лекарств в контейнер, б) добавление к а) поверхностно-активного вещества, в) опрессовку контейнера с дозирующим клапаном, г) загрузку в контейнер или 1,1,1,2-тетрафторэтана (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтана (HFA 227) или их комбинации.
Композиции по изобретению могут содержать антиоксиданты, такие как лимонная кислота или бензалконийхлорид.
Комбинация левосальбутамола и глюкокортикоида может быть в виде сухого порошка или в виде раствора/суспензии для ингаляции. В случае сухого порошка лекарства можно применять в отдельности или вместе с мелкоизмельченным фармацевтически приемлемым носителем, который предпочтительно добавлять и который может быть выбран из материалов, применяемых в качестве носителей в порошковых композициях для ингаляции, например сахаридов, включая моносахариды, дисахариды, полисахариды и сахарные спирты, такие как арабиноза, глюкоза, фруктоза, рибоза, манноза, сахароза, трегалоза, лактоза, мальтоза; крахмалов, декстрана или маннита. Особенно предпочтительным носителем является лактоза. Сухой порошок может быть в капсулах из желатина или НРМС или в виде блистеров, или сухой порошок может содержаться в резервуаре в ингаляторе для многих доз порошка. Размер частиц активного ингредиента и носителя, если он есть в сухой порошковой композиции, может быть уменьшен до желаемой величины обычными методами, например путем размалывания в струйной мельнице, шаровой мельнице или вибраторной мельнице, путем микроосаждения, сушки распылением, лиофилизации или перекристаллизации из суперкритической среды.
Согласно данному изобретению предусмотрен также способ получения сухого порошка для ингаляции, содержащего левосальбутамол и глюкокортикоид, который включает смешение активных ингредиентов, возможно с подходящим носителем, и помещение ингредиентов в подходящий ингалятор для сухих порошков.
В случае растворов для ингаляции лекарства соединяют с подходящими эксципиентами, такими как агенты, регулирующие тоничность, регуляторы рН, хелатирующие агенты, смачивающие агенты, в подходящем носителе. Предпочтительный агент, регулирующий тоничность, представляет собой хлорид натрия. Регуляторы рН можно выбрать из фармакологически приемлемых неорганических кислот, или органических кислот, или оснований. Предпочтительные неорганические кислоты выбирают из группы, состоящей из соляной кислоты, бромистоводородной кислоты, азотной кислоты, серной кислоты, фосфорной кислоты и т.п. Предпочтительные органические кислоты и соли органических кислот включают, но без ограничения, ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты и фумараты. Предпочтительные неорганические основания выбирают из группы, состоящей из гидроокиси натрия, гидроокиси калия, гидроокиси аммония, карбоната натрия, гидроокиси кальция. Предпочтительные органические основания выбирают из группы, состоящей из метиламина, этиленимина, гидрохинона, этиленимина, этиламина, диметиламина, этаноламина, бутиламина, диэтиламина. Предпочтительное основание представляет собой гидроокись натрия. Предпочтительно, чтобы состав для ингаляции в нос согласно данному изобретению имел величину рН в пределах от 3 до 5.
В композициях по изобретению могут быть применены подходящие хелатирующие или комплексообразующие агенты, они могут быть молекулами, которые способны образовывать связи в комплексах. Предпочтительно, чтобы эти соединения могли образовывать комплексы с катионами, предпочтительно с катионами металлов. Предпочтительным агентом является этилендиаминотетрауксусная кислота (EDTA) или ее соль, такая как динатриевая соль. Подходящие смачиватели с хорошими эмульгирующими и смачивающими свойствами также могут входить в состав по изобретению. Некоторые типичные примеры включают эфиры сорбитана, ПЭГ и т.д., которые известны специалистам.
Жидкие носители, применяемые в композициях по изобретению (особенно в растворах или суспензия для ингаляции), включают, но без ограничения, полярные растворители, в том числе, но без ограничения, соединения, которые содержат гидроксильные группы или другие полярные группы. Такие растворители включают, но без ограничения, воду или спирты, такие как этанол, изопропанол, и гликоли, включая пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, гликолевый эфир, глицерин и полиоксиэтиленовые спирты.
Другие полярные растворители включают также протонные растворители, включая, но без ограничения, воду, водные физиологические растворы с одной и несколькими фармацевтическими приемлемыми солями, спирты, гликоли или их смесь. Для физиологического раствора в качестве растворителя или его компонента особенно подходящими солями являются те, которые не проявляют или проявляют только незначительную фармакологическую активность после введения.
В случае форм с многими дозами может быть добавлен антимикробный консервант.Подходящие консерванты очевидны для специалиста, особенно предпочтительны бензалконийхлорид или бензойная кислота, или бензоаты, такие как бензоат натрия, сорбиновая кислота или сорбаты, такие как сорбаты калия в концентрациях, известных из уровня техники.
Согласно данному изобретению предусмотрен также способ получения раствора для ингаляции, содержащий левосальбутамол и глюкокортикоид.
Способ предпочтительно включает следующие стадии:
1. Растворение левосальбутамола вместе с изотоническим агентом, хелатирующим агентом и смачивающим агентом в очищенной воде с последующим фильтрованием.
2. Обработка ультразвуком глюкокортикоида в части воды в другом сосуде с последующей стерилизацией.
3. Оба раствора смешивают для получения конечной суспензии для ингаляции и регулируют величину рН (если требуется). Суспензию помещают в единичную дозированную форму или во флаконы с многими дозами.
Согласно еще одному альтернативному варианту раствор для ингаляции по изобретению может быть введен при помощи небулайзера. Такие небулайзеры включают, но не без ограничения, струйный небулайзер, связанный с воздушным компрессором с адекватным потоком воздуха. Небулайзер снабжен наконечником или подходящей маской. Небулайзер (с лицевой маской или наконечником), связанный с компрессором, может применяться для доставки раствора для ингаляции по изобретению пациенту.
Данное изобретение относится также к способу лечения млекопитающего, такого как человек, от респираторных заболеваний, таких как астма, и нарушений, приводящих к бронхостенозу, который включает введение терапевтического количества фармацевтической композиции по изобретению.
Специалисту очевидно, что не выходя за рамки изобретения можно сделать различные замены и модификации. Таким образом, следует иметь в виду, что хотя данное изобретение было описано на примере предпочтительных вариантов и возможные признаки, модификация и изменение основных замыслов изобретения находятся в компетенции специалистов, и такие модификации и изменения входят в объем изобретения.
Нижеследующие примеры служат только для иллюстрации изобретения и никоим образом не ограничивают его объем.
Пример 1: Ингаляция при помощи CFC.
А)
а) Соедините сульфат левосальбутамола и лецитин с пропеллентом 11;
б) Заполните контейнер суспензией;
в) Сделайте опрессовку и
г) Введите Пропеллент 12 при помощи клапана.
В)
а) Соедините лекарства и олеиновую кислоту с пропеллентом 11;
б) Заполните контейнер суспензией;
в) Сделайте опрессовку и
г) Введите Пропеллент 12 при помощи клапана.
С)
а) Соедините лекарства и лецитин с пропеллентом 11;
б) Заполните контейнер суспензией;
в) Сделайте опрессовку и
г) Введите Пропеллент 12 через клапан.
Пример 2: Ингаляция при помощи HFA
А)
а) Введите оба лекарства в контейнер;
б) Сделайте опрессовку;
в) Введите 1,1,1,2-тетрафторэтан (HFA 134а) в контейнер.
В)
а) Введите оба лекарства и спирт и часть HFA 134a в контейнер;
б) Сделайте опрессовку контейнера; а также обработку ультразвуком;
в) Введите в контейнер 1,1,1,2-тетрафторэтан (HFA 134a).
С)
а) Введите оба лекарства в контейнер:
б) Сделайте опрессовку контейнера;
в) Введите в контейнер 1,1,1,2-тетрафторэтан (HFA 134a).
Пример 3: Ингаляция при помощи HFA
А)
а) Введите оба лекарства в контейнер:
б) Сделайте опрессовку контейнера;
в) Введите в контейнер 1,1,1,2,3,3,3-гептафторэтан (HFA 227).
В)
а) Введите оба лекарства в контейнер:
б) Сделайте опрессовку контейнера;
в) Введите в контейнер 1,1,1,2,3,3,3-гептафторэтан (HFA 227).
Пример 4: Ингаляция при помощи HFA
А)
а) Добавьте оба лекарства в контейнер;
б) Добавьте спирт и раствор поверхностно-активного вещества к (а) и обработайте ультразвуком;
в) Сделайте опрессовку контейнера;
г) Введите в контейнер 1,1,1,2-тетрафторэтан (HFA 134a).
В)
а) Добавьте оба лекарства в контейнер;
б) Добавьте спирт и раствор поверхностно-активного вещества к (а) и обработайте ультразвуком;
в) Проведите опрессовку;
г) Введите в контейнер 1,1,1,2-тетрафторэтан (HFA 134а).
С)
а) Добавьте оба лекарства в контейнер;
б) Добавьте спирт и раствор поверхностно-активного вещества к (а) и обработайте ультразвуком;
в) Проведите опрессовку;
г) Введите в контейнер 1,1,1,2-тетрафторэтан (HFA 134a).
Пример 5: Сухой порошок для ингаляции
Пример 6: Суспензия для небулайзера
1. Растворите левосальбутамол вместе с изотоническим агентом, хелатирующим агентом и смачивателем в очищенной воде и отфильтруйте;
2. В другом сосуде обработайте ультразвуком глюкокортикоид в части воды, затем проведите стерилизацию;
3. Смешайте оба раствора с получением конечной суспензии для ингаляции и отрегулируйте величину рН (если это требуется). Суспензию введите в единичную дозированную форму или флаконы с многими дозами.
Нижеследующие примеры иллюстрируют получение кристаллических полиморфных Форм I, II и III сульфата левосальбутамола.
Пример 7.
R-бензилсальбутамол (20,0 кг), метанол (61,0 л), денатурированный спирт (72 л) загружали в автоклав, добавляли палладий (5%) на угле (1,30 кг) и перемешивали при давлении водорода, равном 30 ф/дюйм2 (206,8 кПа). После завершения реакции катализатор отфильтровывали и промывали метанолом (60 л) и денатурированным спиртом (60 л). Серной кислотой доводили величину рН прозрачного фильтрата до 5,0-5,5 при температуре 0-10°С, полученный твердый продукт перемешивали при температуре 0-10°С в течение часа, отфильтровывали и промывали метанолом (20). Полученный продукт высушивали при 30°С под вакуумом и затем при 50-60°С в течение 1 ч с получением Формы I R-сальбутамола (19,0 кг).
Пример 8.
R-бензилсальбутамол (10,0 кг), метанол (30 л), денатурированный спирт (36 л) загружали в автоклав, добавляли влажный палладий (5%) на угле (0,65 кг) и перемешивали смесь под давлением водорода, равным 30 ф/дюйм2 (206,8 кПа). После завершения реакции катализатор отфильтровывали и промывали денатурированным спиртом (25 л). Серной кислотой доводили величину рН прозрачного фильтрата до 5,0-5,5 при температуре 25-30°С и полученный твердый продукт отфильтровывали и промывали метанолом (10 л) при температуре 25-30°С. Этот продукт высушивали под вакуумом при 50-60°С с получением Формы III сульфата R-сальбутамола (19,0 кг).
Пример 9.
Сульфат R-сальбутамола (14,80 кг) растворяли в воде (60,0 л) и отфильтровывали с получением прозрачного раствора. Фильтрат отгоняли под вакуумом при температуре менее 60°С с получением остатка. Остаток дважды обрабатывали ацетоном (74,0 л), затем добавляли ацетон (148,0 л) и полученную суспензию перемешивали в течение 2 ч. Суспензию отфильтровывали и высушивали под вакуумом при 60 С° в течение 10-12 ч с получением Формы II R-сальбутамола (11,1 кг).
Пример 10.
Сульфат R-сальбутамола (10,0 кг) растворяли в воде (30,0 л) и перемешивали в течение 10-15 мин. Полученный прозрачный раствор отфильтровывали. К прозрачному фильтрату медленно добавляли метанол (150 л) и перемешивали в течение 30 мин и затем охлаждали до 0-5°С. Полученный твердый продукт отфильтровывали и промывали метанолом. Продукт высушивали под вакуумом при 60°С в течение 3-4 ч с получением Формы I сульфата R-сальбутамола (8 кг).
Пример 11.
Сульфат R-сальбутамола (20 кг) растворяли в воде (60,0 л) и отфильтровывали с получением прозрачного раствора, загружали медленно при 25-30°С 300 л ацетона и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Полученную суспензию отфильтровывали и высушивали под вакуумом при 80°С в течение 10-12 ч с получением Формы III сульфата R-сальбутамола (17 кг).
Пример 12.
Сульфат R-сальбутамола (10 г) растворяли в воде (30 мл). Загружали при 25-30°С метанол (150 мл) и добавляли изопропиловый спирт (75 мл), смесь охлаждали до 5-10°С в течение 2 ч, отфильтровывали и высушивали при 80°С под вакуумом в течение 15-20 ч с получением Формы II R-сальбутамола.
Пример 13.
Сульфат R-сальбутамола растворяли в метаноле при нагревании с обратным холодильником. Реакционную массу охлаждали до комнатной температуры и затем охлаждали до 5-10°С. Полученный твердый продукт отфильтровывали и высушивали при 80°С с получением Формы II R-сальбутамола.
Пример 14.
Форму I сульфата R-сальбутамола подвергали струйному измельчению с получением Формы II сульфата R-сальбутамола, имеющей размер частиц (90%) менее 5 мк, а 100% частиц имели размер менее 12,5 мк.
В примерах 9-13 в качестве исходного материала можно применять любую форму сульфата R-сальбутамола.





Данное изобретение относится к двум новым полиморфным формам кристаллического сульфата левосальбутамола (энантиомерно чистого (R)-сальбутамола), обозначенным как Форма (I) и Форма (II). Кристаллическая Форма I сульфата левосальбутамола характеризуется рентгеновской порошковой диффрактограммой с пиками при 10,8, 11,9, 13,0, 18,3, 28,5±0,2 градуса 2-тета. Кристаллическая Форма II сульфата левосальбутамола характеризуется рентгеновской порошковой диффрактограммой с пиками при 8,7, 9,6, 15,2, 15,7, 19,1, 27,2, 30,7±0,2 градуса 2-тета. Изобретение также относится к способам получения новых полиморфных форм и фармацевтическим композициям, содержащим указанные полиморфные формы. Фармацевтическая композиция может содержать дополнительно терапевтически эффективное количество одного или более дополнительных глюкокортикоидов, выбранных из флутиказона пропионата, беклометазона дипропионата или будесонида. Предпочтительно фармацевтическая композиция может представлять собой аэрозоль, сухую порошковую композицию или раствор/суспензию для ингаляции и содержать фармацевтические приемлемые эксципиенты, пригодные для этих форм. 14. н. и 40 з.п. ф-лы, 6 ил., 3 табл.
1. Кристаллический сульфат левосальбутамола (Форма I), характеризующийся рентгеновской порошковой диффрактограммой с пиками при 10,8, 11,9, 13,0, 18,3, 28,5±0,2 градуса 2-тета.
2. Кристаллический сульфат левосальбутамола по п.1, отличающийся тем, что он дает диффрактограмму, показанную на Фиг.1.
3. Кристаллический сульфат левосальбутамола по п.1, отличающийся тем, что он характеризуется ИК-спектрами, показанными на Фиг.2.
4. Кристаллический сульфат левосальбутамола по п.1, отличающийся тем, что он характеризуется рентгеновской дифракционной решеткой со следующими характеристиками:
5. Кристаллический сульфат левосальбутамола (Форма II), характеризующийся рентгеновской порошковой диффрактограммой с пиками при 8,7, 9,6, 15,2, 15,7, 19,1, 27,2, 30,7±0,2 градуса 2-тета.
6. Кристаллический сульфат левосальбутамола по п.5, характеризующийся диффрактограммой, показанной на Фиг.3.
7. Кристаллический сульфат левосальбутамола по п.5, отличающийся тем, что он характеризуется ИК-спектрами, показанными на Фиг.4.
8. Кристаллический сульфат левосальбутамола по п.5, отличающийся тем, что он характеризуется рентгеновской порошковой диффрактограммой со следующими характеристиками:
9. Способ получения кристаллической Формы I сульфата левосальбутамола по любому из пп.1-4, который включает а) растворение левосальбутамола в спиртовом растворителе; б) установление величины рН от 5,0 до 5,5 путем добавления серной кислоты при температуре от 0 до 10°С; в) выделение полученного продукта при температуре от 0 до 10°С.
10. Способ по п.9, отличающийся тем, что растворитель включает денатурированный спирт, или метанол, или их смесь.
11. Способ получения кристаллической Формы II сульфата левосальбутамола по любому из пп.5-8, который включает а) растворение сульфата левосальбутамола в воде, б) перегонку с получением остатка, в) обработку остатка органическим растворителем, г) диспергирование твердого продукта в органическом растворителе и д) выделение полученного продукта, причем на стадии в), или стадии г), или на обеих этих стадиях в качестве растворителя используется ацетон.
12. Способ получения кристаллической Формы I сульфата левосальбутамола по любому из пп.1-4, который включает а) растворение сульфата
левосальбутамола в воде, б) соединение раствора со стадии а) со смешивающимся с водой растворителем для осаждения и в) выделение полученного продукта, при этом до проведения стадии в) раствор охлаждают до температуры от 0 до 5°С.
13. Способ по п.12, отличающийся тем, что смешивающийся с водой органический растворитель представляет собой метанол.
14. Способ получения кристаллической Формы II сульфата левосальбутамола по любому из пп.5-8, который включает струйное измельчение другой формы сульфата левосальбутамола.
15. Способ по п.14, отличающийся тем, что кристаллическую Форму I сульфата левосальбутамола подвергают струйному измельчению с получением указанной Формы II.
16. Фармацевтическая композиция для ингаляционного введения для лечения респираторных расстройств и родственных состояний, содержащая соединение по любому из пп.1-8 в эффективном количестве и фармацевтически приемлемый носитель.
17. Фармацевтическая композиция по п.16 в комбинации с эффективным количеством одного или более дополнительных фармацевтически активных соединений, выбранных из флутиказона пропионата, беклометазона дипропионата или будесонида.
18. Фармацевтическая композиция для ингаляционного введения для лечения респираторных расстройств и родственных состояний, содержащая терапевтически эффективные количества кристаллической формы левосальбутамола по пп.1-8, глюкокортикоида, выбранного из флутиказона пропионата, беклометазона дипропионата или будесонида, а также фармацевтически приемлемый носитель или эксципиент.
19. Фармацевтическая композиция по п.18, отличающаяся тем, что сульфат левосальбутамола содержится в виде смеси соединений по пп.1-8.
20. Фармацевтическая композиция по пп.18 и 19, отличающаяся тем, что она содержит подходящие фармацевтические приемлемые эксципиенты с целью получения состава аэрозоля, сухой порошковой композиции или раствора/суспензии для ингаляции.
21. Фармацевтическая композиция по п.18, отличающаяся тем, что она дополнительно содержит пропеллент, выбранный из группы, содержащей пропеллент 11, пропеллент 12, пропеллент 114, 1,1,1,2-тетрафторэтан (HFA 134а) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227) или смесь двух или более таких галогенсодержащих углеводородов.
22. Фармацевтическая композиция по п.21, отличающаяся тем, что содержит пропеллент 11, или пропеллент 114, или их комбинацию.
23. Фармацевтическая композиция по п.18, отличающаяся тем, что она дополнительно содержит поверхностно-активное вещество.
24. Фармацевтическая композиция по п.23, отличающаяся тем, что поверхностно-активное вещество представляет собой масло, такое как кукурузное масло, оливковое масло, хлопковое масло и подсолнечное масло; минеральное масло, такое как жидкий парафин; олеиновую кислоту; фосфолипид, такой как лецитин; или эфир жирных кислот и сорбитана, такой как олеат сорбитана; или смеси двух или более указанных веществ.
25. Фармацевтическая композиция по п.23, отличающаяся тем, что поверхностно-активное вещество содержится в концентрации 0,001-100% по весу в расчете на активное вещество.
26. Фармацевтическая композиция по п.25, отличающаяся тем, что поверхностно-активное вещество содержится в концентрации 1-50% по весу в расчете на активное вещество.
27. Фармацевтическая композиция по п.26, отличающаяся тем, что поверхностно-активное вещество содержится в концентрации 5-30% по весу в расчете на активное вещество.
28. Фармацевтическая композиция по п.21, отличающаяся тем, что она содержит, по меньшей мере, один сорастворитель.
29. Фармацевтическая композиция по п.28, отличающаяся тем, что сорастворитель представляет собой гликоль, такой как пропиленгликоль, глицерин или этанол или смесь двух или более указанных веществ.
30. Фармацевтическая композиция по п.28 или 29, отличающаяся тем, что сорастворитель содержится в количестве от 0,01 до 5% по весу в расчете на композицию.
31. Фармацевтическая композиция по пп.28, 29 или 30, отличающаяся тем, что она содержит поверхностно-активное вещество.
32. Фармацевтическая композиция по п.31, отличающаяся тем, что поверхностно-активное вещество выбрано из Polysorbate 20, Polysorbate 80, Myvacet 9-45, Myvacet 9-08, изопропилмиристата, олеиновой кислоты, Brij, этилолеата, глицерилтриолеата, глицерилмоноолеата, глицерилмоностеарата, глицерилмонорицинолеата, цетилового спирта, стеарилового спирта, цетилпиридинийхлорида, блочных сополимеров, природных масел, поливинилпирролидона, эфиров жирных кислот и сорбитана, таких как триолеат сорбитана, полиэтоксилированных эфиров жирных кислот и сорбитана (например полиэтоксилированного триолеата сорбитана) олеата сорбимакрогола, синтетических амфотензидов (тритонов), этиленоксидных эфиров продуктов конденсации октилфенолформальдегида, фосфатидов, таких как лецитин, полиэтоксилированных жиров, полиэтоксилированных олеотриглицеридов и полиэтоксилированных алифатических спиртов.
33. Фармацевтическая композиция по п.31 или 32, отличающаяся тем, что поверхностно-активное вещество содержится в концентрации 0,02-10% по весу в расчете на активное вещество.
34. Фармацевтическая композиция по п.28, отличающаяся тем, что она дополнительно содержит наполнитель.
35. Фармацевтическая композиция по п.34, отличающаяся тем, что наполнитель выбран из группы, включающей сахариды, в том числе моносахариды, дисахариды, полисахариды; сахарные спирты, такие как арабиноза, глюкоза, фруктоза, рибоза, манноза, сахароза, трегалоза, лактоза, мальтоза, крахмалы, декстран или манит.
36. Фармацевтическая композиция по п.34 или 35, отличающаяся тем, что наполнитель содержится в концентрации, равной 10-500% по весу в расчете на активное вещество.
37. Фармацевтическая композиция по п.36, отличающаяся тем, что наполнитель содержится в концентрации, равной 10-300% по весу в расчете на активное вещество.
38. Фармацевтическая композиция по п.28, отличающаяся тем, что она содержит поверхностно-активное вещество, выбранное из группы солей стеариновых кислот или сложных эфиров, таких как аскорбилпальмитат, изопропилмиристат и эфиры.
39. Фармацевтическая композиция по п.28, отличающаяся тем, что каждый из терапевтических агентов является измельченным.
40. Фармацевтическая композиция по п.18, отличающаяся тем, что она представляет собой сухой порошковый состав.
41. Фармацевтическая композиция по п.40, отличающаяся тем, что она содержит в дополнение к активному веществу фармацевтически приемлемые эксципиенты, подходящие для получения сухой композиции для порошкового ингалятора.
42. Фармацевтическая композиция по п.41, отличающаяся тем, что она содержит в дополнение к активному веществу мелкоизмельченный фармацевтически приемлемый носитель.
43. Ингалятор с сухим порошком, содержащий композицию по любому из пп.40-42.
44. Способ получения сухого порошка для ингалятора по п.43, включающий смешение активных ингредиентов, возможно, с подходящим носителем и помещение этой сухой композиции в ингалятор для сухого порошка.
45. Фармацевтическая композиция по п.18, отличающаяся тем, что она представляет собой суспензию для ингаляции.
46. Фармацевтическая композиция по п.45, отличающаяся тем, что она содержит фармацевтически приемлемые эксципиенты, подходящие для получения суспензии для ингаляции.
47. Фармацевтическая композиция по п.45 или 46, отличающаяся тем, что она содержит в дополнение к активному веществу полярный растворитель, агент, регулирующий тоничность, смачивающий агент.
48. Способ получения фармацевтической композиции по любому из пп.45-47, включающий суспендирование активных ингредиентов, возможно, в смеси с агентами, регулирующими тоничность, и смачивающими агентами и любыми другими эксципиентами в жидком носителе и регулирование рН.
49. Способ получения фармацевтической композиции, содержащей кристаллическую форму левосальбутамола по пп.1-8, глюкокортикоид в пропелленте, включающий смешение указанных ингредиентов с получением указанной композиции.
50. Способ по п.49, отличающийся тем, что он включает (а) добавление кристаллической формы левосальбутамола вместе с глюкокортикоидом и, возможно, сорастворителем или наполнителем; поверхностно-активным веществом или сорастворителем и поверхностно-активным веществом в контейнер, (б) опрессовку контейнера с дозирующим клапаном и (в) добавление в контейнер или
1,1,1,2-тетрафторэтана (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтана (HFA 227), или их комбинации.
51. Способ по п.50, отличающийся тем, что кристаллическую форму левосальбутамола и сорастворитель или наполнитель, поверхностно-активное вещество, или сорастворитель и поверхностно-активное вещество подвергают микроизмельчению с или 1,1,1,2-тетрафторэтаном (HFA 134а), или 1,1,1,2,3,3,3-гептафторэтаном (HFA 227), или их комбинацией.
52. Композиция по п.19 или 45, отличающаяся тем, что она предназначена для лечения бронхостеноза, астмы и COPD.
53. Способ лечения млекопитающего, такого как человек, от респираторных расстройств, таких как астма, расстройств, приводящих к бронхостенозу, который включает введение фармацевтической композиции по п.19 или 45.
54. Применение комбинации кристаллической формы левосальбутамола по пп.1-8 и глюкокортикоида, выбранного из флутиказона пропионата, беклометазона дипропионата или будесонида для лечения астмы и COPD.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| DATABASE СА [Online], XU, JING ЕТ AL: "Preparation of ultrafine medicine particles of salbutamol sulfate"XP002375560 retrieved from STN Database accession no | |||
| Топливник с глухим подом | 1918 |
|
SU141A1 |
| DATABASE CA [Online] | |||
| DATABASE CA [Online]CHEN, CHIEN-FENG ET | |||
Авторы
Даты
2012-01-27—Публикация
2005-12-19—Подача