Область техники настоящего изобретения
Настоящее изобретение относится, главным образом, к области молекулярной медицины и связано с мономерными одноцепочными наноантителами. В частности, настоящее изобретение относится к новому наноантителу, способному ингибировать действие фактора роста эндотелия сосудов (изоформа А-165) человека, и к использованию этого наноантитела для диагностических и терапевтических целей.
Предшествующий уровень техники настоящего изобретения
Фактор роста эндотелия сосудов (VEGF) является важным сигнальным белком, вовлеченным в васкулогенез (образование de novo циркуляторной системы эмбриона) и ангиогенез (рост кровеносных сосудов из существующих ранее сосудов). Исходя из названия данного белка активность VEGF наилучшим образом изучена на клетках эндотелия сосудов, хотя он оказывает действие и на некоторые другие клетки. Например, VEGF стимулирует миграцию моноцитов/макрофагов, нейронов, раковых клеток, эпителиальных клеток почки. В экспериментах in vitro было показано, что VEGF стимулирует митогенез эндотелиальных клеток и миграцию клеток. VEGF также является вазодилататором и повышает проницаемость капилляров, за что исходно был назван фактором проницаемости сосудов.
Семейство VEGF включает в себя прототипный член VEGF-A, плацентарный фактор роста (PIGF), VEGF-B, VEGF-C и VEGF-D. Убедительные доказательства свидетельствуют, что тогда как построение и созревание сосудистой стенки представляют собой весьма сложные процессы, требующие согласованных воздействий ангиопоэтинов, тромбоцитарного фактора роста В (PDGF-B) и других факторов, действие VEGF-A представляет собой лимитирующую скорость стадию нормального и патологического роста кровеносных сосудов. Важным представляется то, что VEGF-C и VEGF-D регулируют ангиогенез лимфатических сосудов, что подчеркивает уникальную роль этого семейства генов в контролировании роста и дифференцировки некоторых анатомических компонентов сосудистой системы.
VEGF характеризуется значительной гомологией с цепями А и В PDGF. Ген, кодирующий VEGF-A человека, состоит из восьми экзонов, разделенных семью интронами. Альтернативный сплайсинг экзонов приводит к образованию четырех основных изоформ - VEGF121, VEGF165, VEGF189 и VEGF206, состоящих после отщепления сигнальной последовательности соответственно из 121, 165, 189 и 206 аминокислот. Альтернативный сплайсинг регулирует биологическую доступность VEGF. К настоящему времени скопилась масса доказательств того, что VEGF165 является наиболее физиологически компетентной изоформой. Также в регуляции биологической доступности VEGF важную роль играет внеклеточный протеолиз. Плазмин способен расщеплять VEGF165 и VEGF189 и высвобождать биологически активный продукт, состоящий из первых 110 аминоконцевых аминокислот.
Основные биологические эффекты VEGF in vitro и in vivo опосредованы его взаимодействием со специфическими рецепторами. В настоящий момент описаны два основных типа рецепторных тирозинкиназ, выполняющих роль рецептора: VEGFR1 (он же FLT-1) и VEGFR2 (он же FLK-1 или KDR). Кроме того, считается, что нейропилин может выполнять функции VEGFR3. В настоящий момент центральная роль в обеспечении биологических функций VEGF отводится VEGFR2. Передача сигнала через VEGFR2 запускает процессы пролиферации, миграции, увеличивает выживаемость эндотелиальных клеток, стимулирует ангиогенез и проницаемость сосудов [Ferrara N., Hillan K.J., Gerber H.P., Novotny W. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer. Nat. Rev. Drug Discov. 2004; 3:391-400].
Ввиду фундаментальной роли роста и пролиферации клеток эндотелия в различных патологиях человека и критической роли VEGF в этом процессе желательно разработать способ контроля активности VEGF. Эта стратегия действительно является практически полезной и реализована в настоящее время несколькими различными способами, основанными на блокировании митогенного сигнала VEGF в эндотелиальных клетках. Эти способы [Ellis L.M. & Hicklin D.J. VEGF-targeted therapy: mechanisms of anti-tumour activity. Nature Reviews Cancer. 2008; 8:579-591] предусматривают использование:
- антител, нейтрализующих действие VEGF или его рецептора посредством их связывания. В частности, (1) использование гуманизированных анти-VEGF моноклональных антител [международная патентная публикация WO 98/45331] или их Fab'-фрагментов (препараты бевацизумаб (Авастин) и ранизумаб (Люцентис)), связывание которых с VEGF приводит к блокированию способности VEGF инициировать передачу сигнала через соответствующий рецептор на поверхности клеток эндотелия, или (2) использование собственных антител к VEGF, индуцируемых иммунизацией антигеном, содержащим VEGF (киноидная вакцина), принцип действия которых аналогичен принципу действия гуманизированных моноклональных антител [Rad F.H., Le Buanec H., Paturance S., Larcier P., Genne P., Ryffel В., Bensussan A., Bizzini В., Gallo R.C., Zagury D., Uzan G. VEGF kinoid vaccine, a therapeutic approach against tumor angiogenesis and metastases. Proc. Natl. Acad. Sci. USA. 2007; 104:2837-42];
- ингибиторов тирозиновых протеинкиназ с селективностью действия по отношению к рецепторам VEGF (например, сорафениб и сунитиниб). Их действие блокирует действие VEGF посредством ингибирования активации рецептора и последующей внутриклеточной передачи сигнала;
- растворимых форм рецепторов VEGF или их гибридов. Действие подобных агентов (например, VEGF-trap) основано на связывании VEGF, что приводит к истощению свободного VEGF, способного взаимодействовать с рецепторами на клетках.
В качестве ближайшего аналога технического решения, составляющего основу настоящего изобретения, можно привести гуманизированные антитела против VEGF бевацизумаб и люцентис.
Однако в основе настоящего изобретения находятся не классические бивалентные антитела, коим является бевацизумаб, а малые одноцепочечные наноантитела, которые имеют ряд преимуществ по сравнению с классическими антителами для практического применения в области диагностики и терапии заболеваний. Поскольку наноантитела (молекулярная масса около 17 кДа) на порядок меньше по размеру традиционных антител, они приобретают ряд новых положительных качеств практической значимости. Полипептидная цепь в составе наноантител образует всего один домен, не содержащий гидрофобных участков. Это позволяет избегать проблем с растворимостью и правильным сворачиванием молекул наноантител при продукции прокариотическими клетками и ведет к существенному снижению затрат на их производство по сравнению с традиционными способами получения терапевтических моноклональных антител в эукариотических системах экспрессии. В силу меньшего размера полипептидной цепи наноантитела более устойчивы к температурным воздействиям и рН, хранятся при комнатной температуре, в то время как традиционные многодоменные антитела требуют специальных условий хранения и транспортировки при 4°С. В силу меньшего размера наноантитела характеризуются лучшей способностью проникать в ткани. Наконец, наноантитела позволяют легко проводить генно-инженерные манипуляции с целью последующей продукции биспецифических наноантител или химер, в состав которых, помимо наноантитела, входит другой белок с желаемыми свойствами.
Возможность получения рекомбинантных наноантител с заданной специфичностью определяется существованием у представителей семейства Camelidae функциональных и обладающих достаточно широким спектром узнавания неканонических антител. Неканонические антитела состоят из димера только одной укороченной тяжелой цепи иммуноглобулина (без легких цепей), специфичность узнавания которых определяется лишь одним вариабельным доменом [Hamers-Casterman С., Atarhouch Т., Muyldermans S., Robinson G., Hamers С., Bajyana Songa E., Bendahman N., Hamers R. Naturally occurring antibodies devoid of light chains. Nature. 1993; 363:446-448]. Техническая реализация отбора наноантител, являющихся генно-инженерными производными антигенраспознающих доменов одноцепочечных антител верблюда, основана на высокоэффективной процедуре селекции антигенузнающих полипептидов, экспонированных на поверхности частицы нитчатого фага («фаговый дисплей»).
Метод фагового дисплея является весьма эффективной и широко используемой технологией для отбора из больших рекомбинантных библиотек пептидов и белков, экспрессирующихся в составе поверхностного белка нитчатых фагов [Brissette R. & Goldstein N.I. The use of phage display peptide libraries for basic and translational research. Methods Mol. Biol. 2007; 383:203-13; Sidhu S.S. & Koide S. Phage display for engineering and analyzing protein interaction interfaces. Curr. Opin. Struct. Biol. 2007; 17:481-7]. Одно из особо важных приложений этой технологии - генерирование специфических рекомбинантных антител для самых различных антигенов [Hoogenboom H.R. Selecting and screening recombinant antibody libraries. Nat. Biotechnol. 2005; 23:1105-16].
Обычно вместо больших целых молекул классических антител для экспонирования на поверхности фага используют гибридные рекомбинантные одноцепочечные белки, представляющие собой случайные комбинации клонированных последовательностей вариабельных районов тяжелой и легкой цепей иммуноглобулинов, соединенные короткой богатой серином и глицином линкерной последовательностью. Такая химерная молекула, в случае правильного сочетания доменов, способна сохранять специфичность исходного иммуноглобулина, несмотря на введенные по сравнению с нативной молекулой антител изменения. Одной из проблем традиционных рекомбинантных технологий является необходимость работы с очень большими библиотеками рекомбинантных антител, в которых должны быть представлены всевозможные комбинации двух случайных вариабельных районов (тяжелой и легкой цепей иммуноглобулинов), соединенных линкерной последовательностью. Помимо проблемы представленности, здесь также очевидна и проблема формирования правильной относительной конформации этих двух доменов, а также проблема растворимости индивидуальных вариабельных доменов, которые часто имеют тенденцию к агрегации. Упомянутые проблемы возможно избежать при использовании наноантител, так как практически каждый клонированный вариабельный домен одноцепочечных антител будет в этом случае обладать определенной антигенузнающей специфичностью, соответствующей одному из антител иммунизированного животного, и можно эффективно проводить селекцию из относительно небольших библиотек таких доменов.
Наноантитела с заданной специфичностью или их производные могут использоваться, как и классические антитела, в различных приложениях, включающих в себя без ограничения детекцию антигенов (как в исследовательских, так и в диагностических целях), блокирование активности белка-антигена, специфическую доставку за счет связывания с антигеном желаемых молекул, конъюгированных с антителом.
Краткое описание чертежей
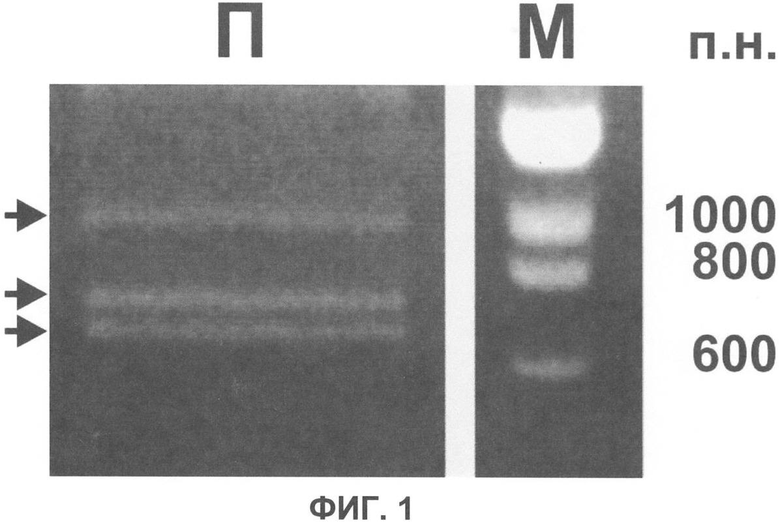
Фиг.1. Продукты амплификации фрагментов кДНК, кодирующих вариабельные домены антител (показаны стрелками), разделенные в агарозном геле, содержащем бромистый этидий (дорожка П). Справа (дорожка М) приведены маркеры молекулярной массы с указанием их длин в парах нуклеотидов (п.н.).
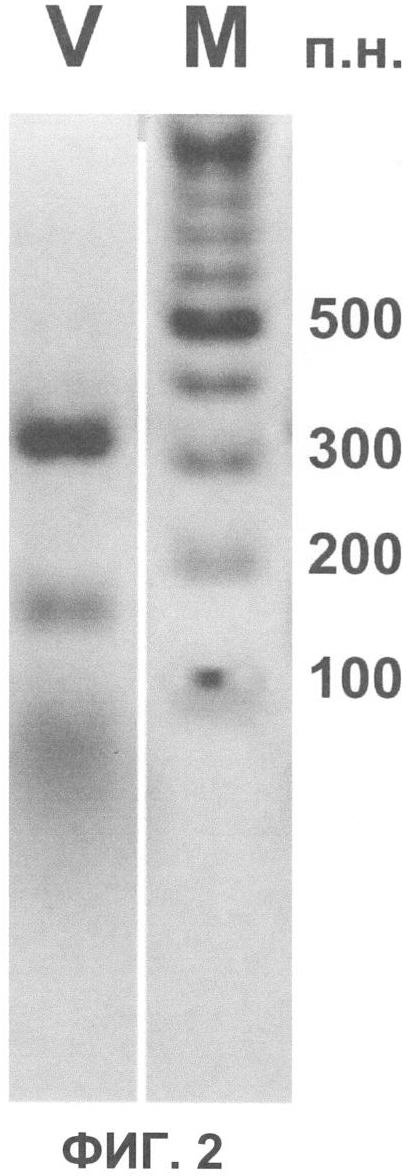
Фиг.2. Характерный паттерн расщепления плазмиды pHEN4, содержащей последовательность, кодирующую наноантитело V9, рестрикционной эндонуклеазой HinfI (дорожка V). Справа (дорожка М) приведены маркеры молекулярной массы с указанием их длин в парах нуклеотидов (п.н.).
Фиг.3. Схематичное представление рекомбинантного наноантитела V9, кодируемого плазмидой на основе модифицированного вектора pHEN6. Указаны лидерная последовательность периплазматической локализации (peIB), наноантитело (V9) и НА- и (His)6-эпитопы.
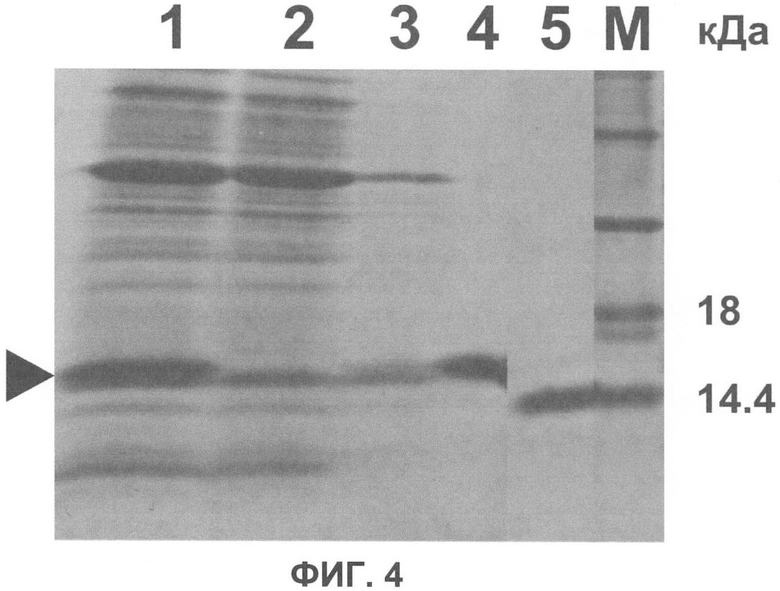
Фиг.4. Очистка наноантител V9. Показан гель-электрофорез в полиакриламидном геле с добавлением ДСН периплазматического экстракта клеток E.coli, продуцирующих наноантитело V9 с НА- и (His)6-эпитопами (1), не связавшиеся с Ni-NTA-агарозой белки экстракта (2), белки, диссоциирующие с Ni-NTA-агарозы при ее промывке (3) и элюированное с Ni-NTA-агарозы очищенное наноантитело V9 в количестве 1 мкг (4). Положение наноантитела V9 в геле показано стрелкой. Справа нанесены 1 мкг коммерческого препарата лизоцима (5) и белковые стандарты молекулярных весов (М). Гель окрашен красителем Coomassie Brilliant Blue.
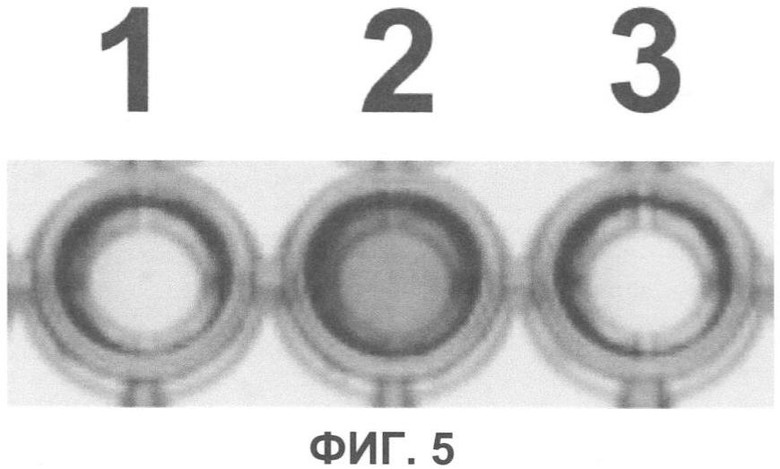
Фиг.5. Наноантитело V9 специфически связывает VEGF в иммуноферментном анализе. Показаны лунки после добавления хромогенного субстрата. 1 - лунка без иммобилизованных белков (только блокирующий раствор BSA), 2 - лунка с иммобилизованным VEGF, 3 - лунка с иммобилизованными иммуноглобулинами.
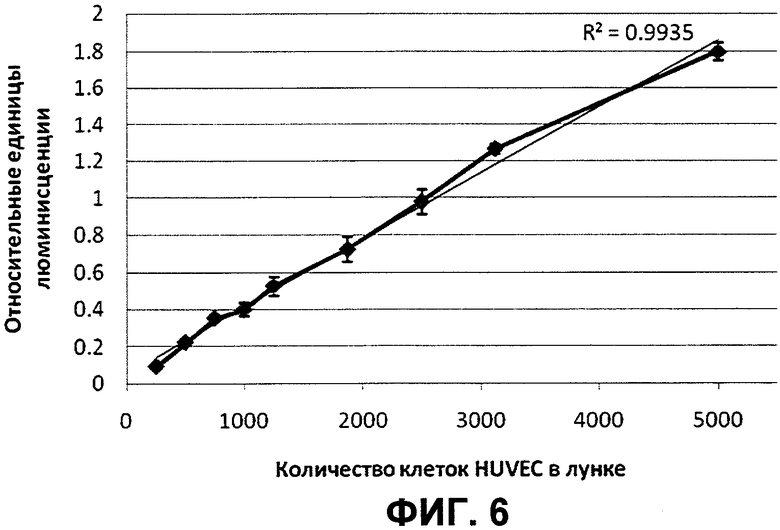
Фиг.6. Доказательство наличия строгой взаимосвязи между интенсивностью люминесценции и количеством клеток HUVEC.
Фиг.7. Наноантитело V9 блокирует VEGF-зависимую пролиферацию эндотелиальных клеток HUVEC. Клетки HUVEC рассевали в лунки 96-луночного планшета (2000 клеток на лунку) в базальной среде для роста эндотелиалных клеток ЕВМ-2 (Lonza, США), содержащей 2% фетальной бычьей сыворотки. После прикрепления клеток (через 4 часа) добавляли VEGF до указанных концентраций (А) или до концентрации 100 нг/мл (Б) и наноантитела до концентрации 12,5 мкг/мл или Авастин (Ava) до концентрации 6 мкг/мл. Пролиферацию клеток определяли через 96 часов с помощью набора CeliTiter Glo Luminescent Cell Viability Assay (Promega, США). Данные приведены в относительных единицах люминесценции как среднее значение для трех независимых лунок±стандартное отклонение.
Раскрытие настоящего изобретения
Настоящее изобретение относится к рекомбинантному наноантителу V9, которое способно специфически связываться с VEGF и нейтрализовать его митогенную активность. Термин «VEGF» относится к 165-аминокислотному фактору роста эндотелия сосудов А человека. Термин «наноантитело» означает, что белок, являющийся предметом изобретения, является рекомбинантным вариабельный доменом одноцепочечных антител верблюда.
Для получения библиотеки вариабельных доменов одноцепочечных антител двугорбого верблюда иммунизировали VEGF или смесью белков, содержащих VEGF.
После иммунизации из периферической крови иммунизированного верблюда выделяли В-лимфоциты и их использовали как источник РНК для клонирования всего репертуара вариабельных доменов особых иммуноглобулинов верблюда, состоящих из димера только одной тяжелой цепи.
Изолированную РНК использовали в качестве матрицы в полимеразной цепной реакции (ПЦР), сопряженной с обратной транскрипцией, с парами праймеров, соответствующих консервативным последовательностям РНК тяжелых цепей иммуноглобулинов между сигнальным пептидом и участком константного СН2-доменами [Hamers-Casterman et al., 1993; Nguyen V.K., Desmyter A., Muyldermans S. Functional heavy-chain antibodies in Camelidae. Adv. Immunol. 2001; 79:261-96; Saerens D., Kinne J., Bosnians E., Wernery U., Muyldermans S., Conrath K. Single domain antibodies derived from dromedary lymph node and peripheral blood lymphocytes sensing conformational variants of prostate-specific antigen. J. Biol. Chem. 2004; 279:51965-72; Rothbauer U., Zolghadr K., Tillib S., Nowak D., Schermelleh L, Gahl A., Backmann N., Conrath K., Muyldermans S., Cardoso M.C., Leonhardt H. Targeting and tracing antigens in live cells with fluorescent nanobodies. Nat. Methods. 2006; 3:887-9].
Полученные продукты амплификации разделяли в агарозном геле и выделяли из геля продукты ПЦР размером 600-800 п.н., соответствующие неканоническим антителам [Sambrook J., Fritsch E.F., Maniatis Т. Molecular Cloning. A Laboratory Manual. 2nd Edition 1989, Cold Spring Harbour: CSHL Press]. Выделенные продукты амплификации использовали в качестве матрицы в ПЦР с парами праймеров, соответствующих консервативным последовательностям в начале и в конце этого собственно вариабельного (антигенузнающего) домена [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006}. Используемые в этой реакции праймеры содержали также дополнительные последовательности, соответствующие участкам узнавания рестрикционных эндонуклеаз, соответственно Ncol и Notl.
Полученные продукты амплификации клонировали по сайтам Ncol и Notl в фагмидный вектор pHEN4 [Ghahroudi M.A., Desmyter A., Wyns L., Hamers R., Muyldermans S. Selection and identification of single-domain antibody fragments from camel heavy-chain antibodies. FEBS Lett. 1997; 414:521-526], кодирующий также белок резистентности к ампициллину, для фагового дисплея [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006].
Селекцию наноантител, специфически узнающих VEGF, проводили методом фагового дисплея с использованием иммобилизованного рекомбинантного VEGF (Peprotech), как описано [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006]. Процедуру селекции и последующей амплификации отбираемых фаговых частиц (содержащих ген наноантитела внутри, а экспрессирующееся наноантитело - в составе поверхностного фагового белка pIII) повторяли, как правило, последовательно три раза. Полученные в результате этой процедуры клоны наноантител исследовали на предмет их разнообразия и требуемой специфичности.
Последовательности клонов отобранных наноантител, находящихся в составе плазмиды pHEN4, группировали согласно схожести картин их электрофоретически разделенных продуктов гидролиза часто щепящих рестрикционных эндонуклеаз. По 2-3 представителя каждой группы использовали для переклонирования в другой экспрессионный плазмидный вектор, обеспечивающий присоединение к С-концу наноантитела (His)6-эпитопа.
Таким образом, настоящее изобретение также относится к экспрессионному вектору, содержащему нуклеотидную последовательность, кодирующую наноантитело V9, и обеспечивающему его экспрессию с дополнительным(и) эпитопом(ами) на С-конце для детекции и выделения и сигнальным пептидом на N-конце.
Благодаря наличию на N-конце экспрессируемой последовательности сигнального пептида (pelB) нарабатываемый рекомбинантный белок (наноантитело) накапливается в периплазме E.coli, что позволяет эффективно выделять его методом осмотического шока, не разрушая собственно бактериальные клетки. Рекомбинантные наноантитела выделяли из периплазматического экстракта с использованием аффинной хроматографии на колонке с Ni-NTA-агарозой.
Таким образом, настоящее изобретение также относится к способу получения наноантитела V9, предусматривающему следующие стадии:
а) трансфекция клетки-продуцента экспрессионным вектором, содержащим нуклеотидную последовательность, кодирующую наноантитело V9, и обеспечивающим его экспрессию с дополнительным(и) эпитопом(ами) на С-конце для детекции и выделения и сигнальным пептидом на N-конце;
б) экспрессия наноантитела V9 в клетке-продуценте;
в) выделение наноантитела V9 из клетки-продуцента.
Выделенные наноантитела использовали для анализа их способности узнавать VEGF предпочтительно методом иммуноферментного анализа с иммобилизованным рекомбинантным VEGF. Детекцию связавшихся с VEGF наноантител проводили с помощью анти-НА антител мыши, вторичных антител к иммуноглобулинам мыши, конъюгированных с пероксидазой хрена, и хромогенного субстрата АБТС (2,2'-азино-бис(3-этилбензтиазолин-6-сульфоновой кислоты, Sigma).
В другом предпочтительном варианте выполнения изобретения наноантитело V9 является нейтрализующим. Термин «нейтрализующее» означает, что наноантитело способно специфически связываться с VEGF и существенно ингибировать или отменять митогенную активность VEGF на клетки эндотелия. Нейтрализующее наноантитело этого изобретения особенно применимо для профилактического или терапевтического лечения нежелательной пролиферации клеток эндотелия и неоангиогенеза путем доставки наноантитела к эндотелиальным клеткам, пролиферацию которых желательно ингибировать. Фармакологически приемлемая форма, способ доставки и доза наноантитела V9, вводимого в профилактических или терапевтических целях, будет определяться совокупностью факторов, включающих в себя тип заболевания и его тяжесть, переносимость вводимого наноантитела и необходимое количество наноантитела для нейтрализации VEGF при выбранном способе введения. Подтверждением существования такой возможности является эффективность препарата Авастин, который является нейтрализующим VEGF классическим антителом.
Плазмиду, кодирующую наноантитело V9, выделяли из клеток E.coli и нуклеотидную последовательность (SEQ ID NO: 1), кодирующую наноантитело, определяли секвенированием.
На основании нуклеотидной последовательности, кодирующей наноантитело V9, определяли аминокислотную последовательность наноантитела V9 (SEQ ID NO: 2).
Таким образом, настоящее изобретение также относится к способу ингибирования пролиферации эндотелиальных клеток, предусматривающему доставку наноантитела V9 к эндотелиальным клеткам, пролиферативную активность которых желательно ингибировать. Такое ингибирование может быть необходимо для профилактического или терапевтического лечения заболеваний, при которых наблюдается избыточная пролиферация эндотелия.
Для диагностических приложений, являющихся еще одним объектом настоящего изобретения, наноантитело V9, содержащее НА-эпитоп для детекции, может быть детектировано непосредственно с помощью анти-НА антител, если антитела конъюгированы с пероксидазой хрена или другим компонентом, позволяющим проводить детекцию, включая другие ферменты (например, фосфатазу) и флуорофоры, или анти-НА антитела могут быть детектированы с помощью подходящих вторичных антител для детекции. Наноантитела V9 могут быть использованы в любом известном методе детекции, включая прямой и непрямой ИФА, конкурентное связывание, иммунофлуоресцентную детекцию, иммунопреципитацию, Вестерн-блоттинг.
Примеры
Пример 1
Получение библиотеки вариабельных доменов одноцепочечных антител
Иммунизация
Двугорбого верблюда Camelus bactrianus последовательно иммунизировали 5 раз. В качестве антигена использовали концентрированную кондиционную среду клеток линии СНО, транзиторно продуцирующих VEGF. Для этого клетки трансфицировали с помощью реагента Unifectin-56 (Transfection Group, Россия) плазмидой, содержащей кДНК VEGF под контролем CMV-промотора. Через 24 часа после трансфекции клетки промывали фосфатно-солевым буфером (PBS) и для получения кондиционной среды, содержащей VEGF, инкубировали в среде без сыворотки в течение 3 суток. Кондиционную среду собирали, фильтровали через PES-фильтр с диаметром пор 0,2 мкм (Corning-Costar, США) и концентрировали с использованием погружного картриджа Immersible СХ-10 (Millipore, США) с номинальным размером пор 10 кДа. Количество VEGF в концентрированной кондиционной среде определяли по окраске белка в ДСН-полиакриламидном геле красителем Кумасси. Для каждой инъекции брали кондиционную среду, содержащую примерно 300 мкг антигена в конечном объеме 7,5 мл, доведенном PBS. Первую инъекцию проводили антигеном, смешанным с полным адъювантом Фройнда в соотношении 1:1. Затем антиген смешивали с неполным адъювантом Фройнда (1:1) и проводили последовательно еще 4 инъекции, соответственно через 1 месяц и трижды - через 2 недели. Забор крови (150 мл) проводили через 5 дней после последней инъекции. Для предотвращения свертывания взятой крови добавляли гепарин 35 ед./мл и ЭДТА (2 мМ).
Выделение В-лимфоцитов
Кровь разводили в 2 раза стандартным солевым раствором (PBS), содержащим 1 мМ ЭДТА. На 15 мл-ступеньку специальной среды (Histopaque-1077, Sigma) с плотностью 1,077 г/мл наслаивали 35 мл разбавленного раствора крови и проводили центрифугирование в течение 20 мин при 800 g. Мононуклеарные клетки (лимфоциты и моноциты) отбирали из интерфазной зоны плазма/Histopaque, после чего промывали раствором PBS, содержащим 1 мМ ЭДТА.
Выделение РНК из В-лимфоцитов
Суммарную РНК из В-лимфоцитов выделяли с помощью реагента TRIzol (Invitrogen). Затем поли(А)-содержащую РНК выделяли на колонке с олиго(dT)-целлюлозой из тотальной РНК. Концентрацию РНК определяли с помощью биофотометра (Eppendorf) и качество выделенной РНК проверяли с помощью электрофореза в 1,5%-ном агарозном геле с формальдегидом.
Реакция обратной транскрипции: синтез кДНК на матрице поли(А)+РНК, выделенной из В-лимфоцитов
Реакцию обратной транскрипции проводили в 40 мкл по стандартному протоколу [Sambrook et al., 1989] с использованием обратной транскриптазы Н- M-MuLV, 1 мкг РНК и 1 мкг праймера олиго(dT)15 в качестве затравки.
Амплификация фрагментов кДНК, кодирующих вариабельные домены антител
Продукты обратной транскрипции (1 мкл) использовали в качестве матрицы в полимеразной цепной реакции объемом 50 мкл, содержащей два праймера CALL001 (5'-gtcctggctgctcttctacaagg-3') и CALL002 (5'-ggtacgtgctgttgaactgttcc-3') в количестве 20 пмоль в следующих условиях: 95°С, 90 с, (95°С - 30 с, 59°С - 120 с, 72°С - 90 с)×30 циклов, 72°С, 300 с. Продукты амплификации разделяли в агарозном геле, содержащем бромистый этидий (фиг.1). Продукты амплификации размером 600-800 п.н., соответствующие неканоническим антителам, выделялись из геля с помощью набора QIAEX II (QIAGEN, США) и использовались в качестве матрицы в аналогичной реакции амплификации с праймерами 5'-ccagccggccatggctgatgtgcagctggtggagtctgg-3' и 5'-ggactagtgcggccgcttgaggagacggtgacctgggt-3', содержащими дополнительные последовательности, соответствующие участкам узнавания рестрикционных эндонуклеаз, соответственно Ncol и Notl.
Создание библиотеки вариабельных доменов одноцепочечных антител
Полученные продукты амплификации клонировали по сайтам Ncol и Notl в фагмидный вектор pHEN4 и, используя в качестве фага-помощника бактериофаг M13KO7 (New England Biolabs, США), получали фаговую библиотеку с поверхностной экспрессией вариабельных доменов одноцепочечных антител, как описано [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006].
Пример 2
Селекция наноантител, специфически узнающих VEGF
Селекцию наноантител проводили методом фагового дисплея с использованием рекомбинантного VEGF (Peprotech), иммобилизованного на дне лунок 96-луночного ИФА-планшета. Использовали полистироловые иммунологические планшеты с высокой сорбцией MICROLON 600 (Greiner Bio-One). Для блокировки использовали 1%-ный BSA (Sigma-Aldrich, США) и/или 1%-ное обезжиренное молоко (Bio-Rad, США) в PBS. Процедуру селекции и последующей амплификации отбираемых фаговых частиц (содержащих ген наноантитела внутри, а экспрессирующееся наноантитело - в составе поверхностного фагового белка pill) повторяли, как правило, последовательно три раза. Все манипуляции проводили, как описано [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006].
Пример 3
Идентификация наноантитела V9
Последовательности клонов отобранных наноантител, находящихся в составе плазмиды pHEN4, группировали согласно схожести картин их электрофоретически разделенных продуктов гидролиза рестрикционной эндонуклеазы Hinfl. Одна из групп клонов характеризовалась паттерном рестрикции, приведенным на фиг.2. Последовательности кДНК наноантител были определены для трех представителей этой группы и были найдены идентичными и кодирующими одно и то же наноантитело, названное V9 (SEQ ID NO:1 и 2).
Пример 4
Продукция наноантитела V9
кДНК наноантитела V9 переклонировали в экспрессионный плазмидный вектор - модифицированный вектор pHEN6 [Conrath K.E., Lauwereys M., Galleni M., Matagne A., Frère J.M., Kinne J., Wyns L., Muyldermans S. Beta-lactamase inhibitors derived from single-domain antibody fragments elicited in the Camelidae. Antimicrob. Agents Chemother. 2001; 45:2807-12], обеспечивающий присоединение к С-концу наноантитела полигистидинового (His)6-эпитопа (сразу вслед за НА-эпитопом, кодируемым в векторе pHEN6). Благодаря наличию на N-конце экспрессируемой последовательности сигнального пептида (pelB) нарабатываемый рекомбинантный белок (наноантитело) накапливается в периплазме бактерий, что позволяет эффективно его выделять методом осмотического шока, не разрушая собственно бактериальные клетки (фиг.3). Продукцию наноантител проводили в E.coli (штамм BL21). Экспрессию индуцировали добавлением 1 мМ индолил-бета-D-галактопиранозида и клетки инкубировали при интенсивном перемешивании в течение 7 часов при 37°С или в течение ночи при 29°С. Наноантитела V9 выделяли из периплазматического экстракта с использованием аффинной хроматографии на Ni-NTA-агарозе с использованием системы для очистки QIAExpressionist (QIAGEN, США). Результаты очистки наноантитела V9 приведены на фиг.4.
Пример 5
Наноантитело V9 связывается с VEGF
Способность наноантитела V9 связывать VEGF проверяли по методу иммуноферментного анализа с иммобилизованным рекомбинантным VEGF (Peprotech) по стандартному протоколу. В качестве контроля использовали лунки без иммобилизованного VEGF и с иммобилизованными иммуноглобулинами (неспецифический белок). Детекцию связавшихся с VEGF наноантител проводили с помощью анти-НА антител мыши, вторичных антител к иммуноглобулинам мыши, конъюгированных с пероксидазой хрена, и хромогенного субстрата АБТС (2,2'-азино-бис(3-этилбензтиазолин-6-сульфоновой кислоты, Sigma).
На фиг.5 представлены результаты анализа, из которых следует, что наноантитело V9 специфически связывает VEGF, но не иммуноглобулины или BSA, использованный в качестве блокирующего агента.
Пример 6
Наноантитело V9 ингибирует VEGF-индуцированное фосфорилирование рецептора VEGFR2
Действие VEGF реализуется через его связывание с основным рецептором, VEGFR2, что приводит к его автофосфорилированию и активации [Meyer М., Clauss М., Lepple-Wienhues A., Waltenberger J., Augustin H.G., Ziche М., Lanz С., Büttner M., Rziha H.J., Dehio C. A novel vascular endothelial growth factor encoded by Orf virus, VEGF-E, mediates angiogenesis via signalling through VEGFR-2 (KDR) but not VEGFR-1 (Flt-1) receptor tyrosine kinases. EMBO J. 1999; 18:363-74]. Активация рецептора VEGFR2 является необходимой для VEGF-стимулируемой пролиферации, хемотаксиса и выживания эндотелиальных клеток in vitro и ангиогенеза in vivo [Karkkainen M.J. & Petrova T.V. Vascular endothelial growth factor receptors in the regulation of angiogenesis and lymphangiogenesis. Oncogene. 2000; 19:5598-605; Rahimi N., Dayanir V., Lashkari K. Receptor chimeras indicate that the vascular endothelial growth factor receptor-1 (VEGFR-1) modulates mitogenic activity of VEGFR-2 in endothelial cells. J. Biol. Chem. 2000; 275:16986-92; Claesson-Welsh L. Signal transduction by vascular endothelial growth factor receptors. Biochem. Soc. Trans. 2003; 31:20-4]. Поэтому автофосфорилирование VEGFR2 в ответ на обработку VEGF можно рассматривать как меру проангиогенного действия VEGF, а блокирование VEGF-зависимого автофосфорилирования наноантителом V9 как доказательство его нейтрализующей VEGF-активности. VEGFR2 человека транзиторно экспрессировали в клетках НЕК293 путем трансфекции соответствующим экспрессионным вектором, содержащим полноразмерную кДНК VEGFR2 человека под контролем CMV-промотора. Через 18 часов после трансфекции клетки промывали PBS и инкубировали в среде без сыворотки в течение 24 часов. Затем клетки обрабатывали 30 нг/мл VEGF в среде без сыворотки, 30 нг на точку) или VEGF в той же концентрации, предынкубированным в течение 60 мин с 10 мкг наноантитела V9. Через 5 мин клетки лизировали и степень активации VEGFR2 оценивали по количеству фосфорилированного по тирозину-951 VEGFR2 методом Вестерн-блоттинга с антителами, специфически узнающими фосфорилированный по тирозину-951 VEGFR2 (Cell Signaling, США). На фиг.6 видно, что предынкубация VEGF с наноантителом V9 приводит к значительной супрессии фосфорилирования VEGFR2 по тирозину-951, что свидетельствует о способности наноантитела V9 не только связывать, но и ингибировать действие VEGF.
Пример 7
Наноантитело V9 блокирует VEGF-зависимую пролиферацию эндотелиальных клеток
Эндотелиальные клетки HUVEC засевали в лунки 96-луночного планшета (2000 клеток на лунку) в базальной среде для роста эндотелиальных клеток ЕВМ-2 (Lonza). После прикрепления клеток (через 4 часа) добавляли VEGF до концентрации 1, 1,5, 3 или 100 нг/мл и наноантитело V9 до концентрации 12,5 мкг/мл или, в качестве контроля, бевацизумаб (Авастин) до концентрации 6 мкг/мл. Количество клеток определяли через 96 часов. Для определения количества клеток HUVEC использовали набор CellTiter Glo® Luminescent Cell Viability Assay производства компании Promega (Madison, Wl, USA) в соответствии с протоколом производителя набора (Promega Technical Bulletin Part# TB288). Генерируемый в результате реакции люминисцентный сигнал прямо пропорционален количеству клеток в лунке (Promega Technical Bulletin Part# TB288). Кроме того, нами было проведено исследование линейности связи количества клеток HUVEC в лунке с генерируемым люминесцентным сигналом для диапазона количества клеток HUVEC, перекрывающего количество клеток в лунке на момент анализа. Как видно на фиг.6, в диапазоне от 250 до 5000 клеток в лунке сигнал люминисценции линейно (r2=0,9935) связан с количеством клеток в лунке. Видно (фиг.7А), что при концентрациях VEGF 1-3 нг/мл наноантитело V9, как и использованный в качестве контроля препарат Авастин, способны полностью ингибировать пролиферацию клеток HUVEC. При этом эффект наноантитела V9 на пролиферацию клеток HUVEC не обусловлен их неспецифической токсичностью или токсичностью примесей, содержащихся в препарате наноантител, так как в аналогичных условиях при избытке VEGF (100 нг/мл) в присутствии наноантител не наблюдалось изменения пролиферативной активности клеток HUVEC (фиг.7Б).



Изобретение относится к иммунологии и биотехнологии. Предложено мономерное одноцепочечное наноантитело V9, способное связывать фактор роста эндотелия сосудов человека и блокировать его действие. Описаны нуклеотидная последовательность, кодирующая наноантитело V9, и вектор для его экспрессии с дополнительным(и) эпитопом(ами) на С-конце для детекции и выделения и сигнальным пептидом на N-конце. Раскрыты: способ получения наноантитела V9, способ ингибирования пролиферации эндотелиальных клеток с помощью наноантитела V9, а также применение наноантитела V9 для качественного и количественного определения VEGF в образце. Использование изобретения обеспечивает высокоаффинные нейтрализующие моновалентные одноцепочечные наноантитела, более устойчивые к внешним факторам (температура, рН) и более дешевые в производстве по сравнению с классическими антителами к VEGF, что может найти применение в медицине для лечения и диагностики заболеваний, связанных с регуляцией активности фактора роста эндотелия сосудов (VEGF). 6 н. и 1 з.п. ф-лы, 7 ил.
1. Наноантитело V9, характеризующееся аминокислотной последовательностью SEQ ID NO:2 и способное связывать фактор роста эндотелия сосудов человека и блокировать его действие.
2. Нуклеотидная последовательность, кодирующая наноантитело V9 по п.1.
3. Нуклеотидная последовательность по п.2, представляющая собой SEQ ID NO:1.
4. Экспрессионный вектор, содержащий нуклеотидную последовательность по п.2 и обеспечивающий экспрессию наноантитела V9 с дополнительным(и) эпитопом(ами) на С-конце для детекции и выделения и сигнальным пептидом на N-конце.
5. Способ получения наноантитела V9 по п.1, предусматривающий следующие стадии:
а) трансфекция клетки-продуцента вектором по п.4;
б) экспрессия наноантитела V9 в клетке-продуценте;
в) выделение наноантитела V9 из клетки-продуцента.
6. Способ ингибирования пролиферации эндотелиальных клеток,
предусматривающий доставку наноантитела V9 по п.1 к эндотелиальным клеткам.
7. Применение наноантитела V9 по п.1 в качестве диагностического реагента для качественного и количественного определения VEGF в образце.
| WO 2008101985 А2, 28.08.2008 | |||
| RU 2007109785 A, 27.08.2008. |
Авторы
Даты
2010-07-27—Публикация
2008-11-10—Подача